Datenschutz :
hier im Anhang die Episoden Vögel, Wale, Pferde, Rinder, Hunde, Katzen, Elefanten, Ameisen, die Fliege "Drosophila" und der Parasit "Plasmodium falciparum (Malaria-Erreger)" etc." sowie alle relevanten Proteine...Thema im August 2024 beendet.
Holger Thomas - Das kann doch nicht wahr sein 1979
Dies ist eine private Webseite. Der Inhaber der Webseite www.bixnom.de benötigt keine personenbezogenen Daten.
YouTube-Videos: Diese „Website verwendet für die Einbindung von Videos den Anbieter YouTube LLC , 901 Cherry Avenue, San Bruno, CA 94066, USA, vertreten durch Google Inc., 1600 Amphitheatre Parkway, Mountain View, CA 94043, USA. Normalerweise wird bereits bei Aufruf einer Seite mit eingebetteten Videos Ihre IP-Adresse an YouTube gesendet und Cookies auf Ihrem Rechner installiert. Wir haben unsere YouTube-Videos jedoch mit dem erweiterten Datenschutzmodus eingebunden (in diesem Fall nimmt YouTube immer noch Kontakt zu dem Dienst Double Klick von Google auf, doch werden dabei laut der Datenschutzerklärung von Google personenbezogene Daten nicht ausgewertet). Dadurch werden von YouTube keine Informationen über die Besucher mehr gespeichert, es sei denn, sie sehen sich das Video an. Wenn Sie das Video anklicken, wird Ihre IP-Adresse an YouTube übermittelt und YouTube erfährt, dass Sie das Video angesehen haben. Sind Sie bei YouTube eingeloggt, wird diese Information auch Ihrem Benutzerkonto zugeordnet (dies können Sie verhindern, indem Sie sich vor dem Aufrufen des Videos bei YouTube ausloggen). Von der dann möglichen Erhebung und Verwendung Ihrer Daten durch YouTube haben wir keine Kenntnis und darauf auch keinen Einfluss. Nähere Informationen können Sie der Datenschutzerklärung von YouTube unter www.google.de/intl/de/policies/privacy/ entnehmen. Zudem verweisen wir für den generellen Umgang mit und die Deaktivierung von Cookies auf unsere allgemeine Darstellung in dieser Datenschutzerklärung.“ Diese Erklärung ist im Jahr 2024 der Website „Allgemeine Datenschutzerklärung (ithelps-digital.com)“ entnommen worden. Herausgeber: Sebastian Prohaska; Pernerstorferstraße 18; 3032 Eichgraben; Österreich; Büro Berlin: Bessemerstraße 82/10. OG Süd; 12103 Berlin
office@ithelps-digital.com
...TECHNO...
Three Little Birds
Nachfolgende Hinweise zum Datenschutz wurden aus folgender Quelle entnommen: Quelle: https://www.e-recht24.de/muster-datenschutzerklaerung.html
Die Betreiber dieser Seiten nehmen den Schutz Ihrer persönlichen Daten sehr ernst. Wir behandeln Ihre personenbezogenen Daten vertraulich und entsprechend der gesetzlichen Datenschutzvorschriften sowie dieser Datenschutzerklärung.
Die Nutzung unserer Webseite ist in der Regel ohne Angabe personenbezogener Daten möglich. Soweit auf unseren Seiten personenbezogene Daten (beispielsweise Name, Anschrift oder E-Mail-Adressen) erhoben werden, erfolgt dies, soweit möglich, stets auf freiwilliger Basis. Diese Daten werden ohne Ihre ausdrückliche Zustimmung nicht an Dritte weitergegeben.
Wir weisen darauf hin, dass die Datenübertragung im Internet (z.B. bei der Kommunikation per E-Mail) Sicherheitslücken aufweisen kann. Ein lückenloser Schutz der Daten vor dem Zugriff durch Dritte ist nicht möglich.
Cookies
Die Internetseiten verwenden teilweise so genannte Cookies. Cookies richten auf Ihrem Rechner keinen Schaden an und enthalten keine Viren. Cookies dienen dazu, unser Angebot nutzerfreundlicher, effektiver und sicherer zu machen. Cookies sind kleine Textdateien, die auf Ihrem Rechner abgelegt werden und die Ihr Browser speichert.
Die meisten der von uns verwendeten Cookies sind so genannte „Session-Cookies“. Sie werden nach Ende Ihres Besuchs automatisch gelöscht. Andere Cookies bleiben auf Ihrem Endgerät gespeichert, bis Sie diese löschen. Diese Cookies ermöglichen es uns, Ihren Browser beim nächsten Besuch wiederzuerkennen.
Sie können Ihren Browser so einstellen, dass Sie über das Setzen von Cookies informiert werden und Cookies nur im Einzelfall erlauben, die Annahme von Cookies für bestimmte Fälle oder generell ausschließen sowie das automatische Löschen der Cookies beim Schließen des Browser aktivieren. Bei der Deaktivierung von Cookies kann die Funktionalität dieser Website eingeschränkt sein.
Server-Log-Files
Der Provider der Seiten erhebt und speichert automatisch Informationen in so genannten Server-Log Files, die Ihr Browser automatisch an uns übermittelt. Dies sind:
Browsertyp und Browserversion
verwendetes Betriebssystem
Referrer URL
Hostname des zugreifenden Rechners
Uhrzeit der Serveranfrage
Diese Daten sind nicht bestimmten Personen zuordenbar. Eine Zusammenführung dieser Daten mit anderen Datenquellen wird nicht vorgenommen. Wir behalten uns vor, diese Daten nachträglich zu prüfen, wenn uns konkrete Anhaltspunkte für eine rechtswidrige Nutzung bekannt werden.
Kontaktformular
Wenn Sie uns per Kontaktformular Anfragen zukommen lassen, werden Ihre Angaben aus dem Anfrageformular inklusive der von Ihnen dort angegebenen Kontaktdaten zwecks Bearbeitung der Anfrage und für den Fall von Anschlussfragen bei uns gespeichert. Diese Daten geben wir nicht ohne Ihre Einwilligung weiter.
Kommentarfunktion auf dieser Webseite
Für die Kommentarfunktion auf dieser Seite werden neben Ihrem Kommentar auch Angaben zum Zeitpunkt der Erstellung des Kommentars, Ihre E-Mail-Adresse und, wenn Sie nicht anonym posten, der von Ihnen gewählte Nutzername gespeichert.
Speicherung der IP Adresse
Unsere Kommentarfunktion speichert die IP-Adressen der Nutzer, die Kommentare verfassen. Da wir Kommentare auf unserer Seite nicht vor der Freischaltung prüfen, benötigen wir diese Daten, um im Falle von Rechtsverletzungen wie Beleidigungen oder Propaganda gegen den Verfasser vorgehen zu können.
Auskunft, Löschung, Sperrung
Sie haben jederzeit das Recht auf unentgeltliche Auskunft über Ihre gespeicherten personenbezogenen
Daten, deren Herkunft und Empfänger und den Zweck der Datenverarbeitung sowie ein Recht auf Berichtigung, Sperrung oder Löschung dieser Daten. Hierzu sowie zu weiteren Fragen zum Thema personenbezogene Daten können Sie sich jederzeit unter der im Impressum angegebenen Adresse an uns wenden.
Widerspruch Werbe-Mails
Der Nutzung von im Rahmen der Impressumspflicht veröffentlichten Kontaktdaten zur Übersendung von nicht ausdrücklich angeforderter Werbung und Informationsmaterialien wird hiermit widersprochen. Die Betreiber der Seiten behalten sich ausdrücklich rechtliche Schritte im Falle der unverlangten Zusendung von Werbeinformationen, etwa durch Spam-E-Mails, vor.
Quelle: https://www.e-recht24.de/muster-datenschutzerklaerung.html
*******************************************************************************************************************************************
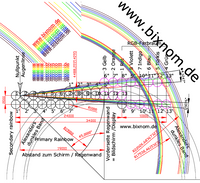
Zugabe für Freunde der BiXnom-Würfelkunde: Die Vögel
Der Zifferncode der Saurier kann mittels der Bixnom-Schwelle durch eine maximierte Fallhöhe zur Untergrenze verschoben werden. Wie beim Saurier müssen die beiden Episoden Epi.X+Vogel und EPI.Y+Vogel eine Einheit bilden. EPI.Y+Vogel enthält mit „505“ das Auge und die Wirbel. EPI.X+Vogel liefert das Zubehör. Die Evolution interpretiert den mathematischen Grundbauplan. Hier wird die Vogelfamile der Spechtvögel (Piciformes) mit 28 Gattungen und mehr als 200 Arten beispielhaft angenommen. Statt Hautmembranen der Fledermäuse enthalten die Vogel-Federn in der Kombination „33+1“ Haut und Haar den Sinn, als Zählhaare 1 einen weiten Zeilenlauf bis zu den Schwanzfedern #1111 zu erreichen.
1.) Schnabel (Rostrum): Der Schnabel ist als Zahnersatz ein spitz zulaufendes Mundwerkzeug, das den Ober- und Unterkiefer mit Hornscheiden (Rhamphotheca) überzieht. Ober- und Unterschnabel bilden in X.Z.1.#4230828695123410000 jeweils die Quersumme 2+3= 5, so dass erst der geschlossene Schnabel die stabile #55 eines Kopfskeletts ergibt. Der Hornschnabel #3311 beginnt in Y.Z.1.#433112657216301. Der Specht kann seine Zunge extrem weit ausfahren, wobei bis 2 cm Vorschub der Zungenapparat noch nicht in Aktion tritt. Die Zunge hängt in Epi.X also 2 cm heraus [8_2_8], so dass sich in Epi.Y an der Zungenspitze die vorhandenen Widerhaken zeigen [12_6 / 21_6]. Die 8_8 kann durchaus die Zunge sein, weil darüber auf der Verdauungstrakt adressiert ist, incl. Speiseröhre 808.
Entsprechend der Wirbelbildung #115 sind damit auch der Ober- und Unterschnabel adressiert. Die sonstigen verwachsenen Knochen sind als #55 zu finden. Die beiden Schnabelzeilen #115 stehen im Abstand, so dass der Oberschnabel mit einem Überbiss vorsteht. Dadurch entsteht beim Specht der scharfe Meißel des Schnabels als Werkzeug. Oberschnabel: X.Z.2.#211541434756171000. In Zeile 3 liegen am rechten Zahlenrand maximal 5 Nullen und am Kopfende nur noch 2. Wegen der paarigen Anordnung wird dadurch der V-förmige Vogelkopf symbolisiert: X.Z.3.#1410276231707800000. Die 808 kann hier als Zunge gelten: X.Z.4.#105770717378085000. Unterschnabel: Die Spitze wird als Dille (Myxa) und die Kante als Dillenkante (Gonys) bezeichnet: X.Z.6.#705138115853902000. Der verhornte 33 Rand 99 des Schnabel kann flexibel 6 und räumlich 4 oben und unten als symmetrische Gruppe 44_44 als Form gezackt oder gewellt sein. Die Form 7 ist die Zeilennummer: X.Z.7.#604404099303344000.
Die Speicheldrüse ist allein durch den Wirkstoff 88 beschreibbar, weil die 8 hier zur Verdauung gehört. Im Unterschnabel zieht sich eine paarige Speicheldrüse (Glandulae mandibulares rostrales) 868_9 am Rand 9 und im Oberschnabel liegt mittig die Glandula maxillaris. Die Ziffer 2 kann in der Mittellage nicht für paarig stehen, sondern beschreibt die H-Form der Drüse: 5_2_88_5: X.Z.8.#528853586890426000. Es sind weitere Drüsen im Schnabel vorhanden.
Den inneren Kompass der Vögel zur Ausrichtung nach dem Erdmagnetfeld sucht die Wissenschaft nicht mit Eisen 26 des Gehirns, sondern im Schnabel. Der Kompass wird andererseits auch in Molekülgruppen der Augen-Netzhaut vermutet. Weil 2 Fähigkeiten, Intensität und Ausrichtung des Magnetfeldes, benötigt werden, sind im Schnabel eindeutig auch 2 geeignete Zeilen vorhanden: Ausrichtung 9 des Magnetfeldes: 9_26_9: X.Z.12.#352569057926951000. Feldstärke 26_44_26: X.Z.16.#264426793445213000.
Der Vogelkörper ist weitgehend mit Federn (Pennae) durch eine Körperdecke (Integumentum commune) bedeckt und wird von der Oberhaut gebildet. Die Oberhaut ist den Säugetieren homolog, die Schichtung der Lederhaut weicht bei den Vögeln ab. Das globale Federkleid ist in einer mathematischen Besonderheit zu suchen. Es müssen Struktur 5, Gruppe 44, Haut 33, Haar 1, flexibel 6, außen 9, Form 7 und 8 Extra kombiniert und 4 räumlich sein. Die Besonderheit „Federn überall“ ist, dass die 333 zeilengleich in beiden Episoden vorliegt: X.Z.13.#325448361163339000 und Y.Z.13.#333163582474078000. Feder als Kopfschmuck, oben 9: Y.Z.109.#9735106166633100.
Der Steg als Teiler zwischen den beiden Nasenlöchern: X.Z.14.#302202049651672000. Paarige 2 Nasenlöcher: X.Z.14.#282055246341561000. Die Luftröhre beginnt im Schnabel und ist durch ein Zungensegel verschlossen. Geometrisch ist es eine Ritzenform 11, die offen 1_0_1 oder geschlossen 1_1_1 ist, wobei die 33 die Segelmembran darstellt: X.Z.21.#201468033101115000.
Die Augenhöhle 500 erstreckt sich etwas in folgendem Bereich: von X.Z.31.#136478345003981000, X.Z.43.#98391365002870000 bis X.Z.57.#74225064826726500. Über EPI.Y+Vogel streckt sich der Bereich weiter bis Y.Z.73.#59330500988534400. Über das Specht-Auge zieht sich eine schützende Nickhaut 33: X.Z.38.#111337597240090000. Das Auge „505“ wird in der gleichen Zeile in EPI.Y+Vogel gebildet: Y.Z.38.#113977015056921000.
Das Gehirn ist mit der 1 für Riechnerv, Sehnerv 2 als Gruppe 44 zu erwarten: X.Z.50.#866225314432602000. Die Nerven 7 liegen schließlich zusammen mit Gefäßen 8 + 9 als Ausgang am rechten Zahlenrand: X.Z.66.# 65623129881257700.
Die Kopfform folgt beim Specht dem Zungenbein. Die Grundform entspricht als Skizze einer Herz-Form: Der obere Rand wird räumlich hochgezogen, so dass die V-Form oben mittig über den beiden Augen liegt. Das Gehirn des Spechts wird durch diesen Sicherheitsbügel geschützt. Die Zunge ist somit hinter dem Auge eingerollt und kann sehr lang herausführen. Diese vordere Herzspitze muss im Unterkiefer eine Verzweigung 55_55 bilden: X.Z.33.#128206930155255000. Die beiden Bügel vereinen sich über Augenhöhe: X.Z.42.#100734016550557000. Die beiden Zungenbeinbögen wölben sich dann in den Hinterkopf: X.Z.76.#55668798620044900. Die Zungenbewegung wird über Muskeln erzeugt. Davon ist der Rückziehmuskel an der Spiralform 555 zu erkennen: X.Z.56.#75550512412918000.
Das Gehirn liegt hinten den Augen, oben dicht an der Schädeldecke, und wird durch eine hohlraumreiche Knochenstruktur eingeschlossen. Diese zeichnet sich in Kombination 11_0_33 als knöcherne 11 Gewebestruktur 33 ab: X.Z.56.# 67156011033704900 und X.Z.57.#661066983613033.
Der Oberkiefer (Oberschnabel) wird durch eine elastische Zone (Pseudogelenk) durch Muskelzug am Qadratbein (Os quadratum) nach oben bewegt. Als eine Art Pleuelstange schiebt sich der Os quadratojugale dabei mit dem Unterkiefer nach vorn. Diese lange, paarige Knochenstange 2_7_22 beginnt in X.Z.78.# 54241393527223200 als Form 7. Die Ziffer 7 erscheint dann in 2 Gelenkzeilen 700_28 vs. 700_82: X.Z.83.#50973839700282100 und X.Z.84.#50367008275278700. Os quadratum „44“, paarig 2, mit 3 Fortsätzen: Der Ohrfortsatz (Processus oticus quadrati) bildet das Schädelgelenk (Articulatio quadrato-squamoso-otica). Der Unterkieferfortsatz (Processus mandibularis quadrati) schließt den Unterkiefer gelenkig an. Der Augenhöhlenfortsatz (Processus orbitalis quadrati) ist zur Augenhöhle (Orbita) ausgerichtet. Bei den Säugetieren dient das Quadratbein als Amboss (Incus) von den 3 Gehörknöchelchen: X.Z.85.#49774455236746000.
2.) Verdauungstrakt:
2.1) Die Speiseröhre entwickelt sich nicht als menschlicher Muskelschlauch 505, sondern als Extra 8 in Röhrenform 808. Entsprechend kann der Magen als 8008 symbolisiert werden und der Darm wieder als 808. Die Ziffer 8 wird wie beim Menschen auch als Vene 8 erwartet. Die Speiseröhre (Ösophagus) beginnt in einer einheitlichen Mund- und Schlundkopfhöhle (Oropharynx): Y.Z.124.#34928440098088800. Neben der Speiseröhre entwickelt sich eine muskuläre 5 Ausbuchtung 800 als Kropf: Y.Z.378.# 11458006804664000. Der Hals wird mit 14 Halswirbeln gebildet. Direkt dahinter am Halsende hat sich der Kropf vollständig ausgeformt: Y.Z.378.#7817918000294240.
2.2) Im Drüsenmagen (Ventriculus glandularis/Proventriculus) werden Enzyme und Salzsäure (Chlor= Ziffer 17) zugegeben. Mit der Zeile 1144 liegt die 11 als Drüsenstrecke an: Y.Z.1144.# 3785949800841790. Die Magenwand besteht aus 4 Schichten: 2.2.1) Die Schleimhaut (Tunica mucosa) zum Schutz vor dem Magensaft: Die Lamina epithelialis mucosae ist ein einschichtiges 3 hochprismatisches 9_44 Epithel, so dass sie nicht sofort als Membran 33 erkannt wird. Außen sind zunächst extrazelluläre Bürstenzellen (Mikrovilli) „55_1“ vorhanden. Y.Z.1145.#3782643294465510. Der Schleim 77 des Epithels 8_33_8 bedeckt dann die Büsten 121_9: Y.Z.1148.#3772758338121090. 2.2.2) Tela submucosa: In der angelagerten Bindegewebsschicht (Lamina propria mucosae) sind 2 Drüsenarten zu unterscheiden. Oberflächliche Vormagendrüsen (Glandulae proventriculares superficiales): Y.Z.1160.#3733729803588800. Schleimabgabe nach außen 99: Y.Z.1161.#37305138433789900. Tiefe Vormagendrüsen (Glandulae proventriculares profundae): Im Gegensatz mit 99 auf der linken Codeseite wird „tief“ symbolisiert und mit der 11 als Drüsen verbunden (ähnlich menschlichen Lymphdrüsen 11): Y.Z.1164.#3720899116978530 und somit die Drüse: Y.Z.1167.# 3711333823618690 2.2.3) Tunica muscularis: Die Lamina muscularis mucosae 33 ist muskelzellreich 6_5_6 und spaltet sich am Übergang vom Ösophagus zum Drüsenmagen in 2 Schichten auf: Y.Z.1171.# 698656338311710. Muskelschicht 55: Y.Z.1172.#3695500488193690 und Y.Z.1173.#3689204916663550. Schichttrennung 55_55: Y.Z.1179.#3673559433556410. 2.2.4.) Die Tunica serosa besteht aus 3 Schichten: Z.1181.#3667338333753610.
2.3) Die Einschnürung zwischen Drüsenmagen und dem folgenden Muskelmagen (Isthmus gastris) wird über einen längeren Zeilenlauf dargestellt, weil die Einschnürung Platz für Organe bietet. Strecke von Y.Z.1187.#3648800819008430 bis Beginn Muskelmagen: Y.Z.1477.#2932380888397430. Die Einschnürung wird mit der 44 als räumliche Klemmstelle avisiert: Y.Z.1192.#3633495446445480. Anfang des Isthmus gastris: Y.Z.1240.#3492844009808880. Das Brustbein (Sternum) wird in der Episode Epi.X+Vogel gebildet. Weil die Leber dort aufliegt, kommt von dort auch die Leber: Für den langgestreckten Bereich kommen 2 Zeilen in Betracht: X.Z.846.#5000979545063130 und X.Z.1333.#3173915000092580. Weil die „915“ parallel enthalten ist, kann die Leber als Zubehör 8 in EPI.Y+Vogel integriert werden und sich weiter komplett mit Gallenblase entwickeln: Y.Z.1333.#3249157218426860. Das Herz liegt zwischen den Leberlappen, ist dort aber weit vorn positioniert. Es wird als flexibel mit der Ziffer 6 dargestellt, der Muskel 5 ist enthalten: Y.Z.895.#4839247566662580. Vögel besitzen 2 (paarig) Blinddärme (Caecum) 888, die im Zeilenlauf frühzeitig, rückenseitig und seitlich 9 mitlaufen. Anfang Blinddärme: Y.Z.1351.#3205867188869730. Milz: Y.Z.1382.#3133955551492770. In der Milz werden die roten Blutkörperchen abgebaut, insofern wird Eisen = 26 gefunden: Y.Z.1384.#312942671399061. Es folgen in beiden Episoden „555“, so dass zusätzliche winzige Nebenmilzen vorhanden sein können.
2.4) Die Einschnürung endet: Y.Z.1477.#2932380888397430. Der Muskelmagen kann sich ausformen, jedoch liegt der Magenausgang bereits vorn: Y.Z.2077.#2085280005856050. Unterhalb des Magens läuft dann der vordere Teil des Dünndarms (Duodenum) wiederholt als „808“ mit. Muskelschlauch des Kaumagens: Y.Z.2216.#1954479500073560. Die 2 Reibeplatten des Magens: Y.Z.2218.#1952717120001360 bis Y.Z.2261.#1915580084990270. In die Oberfläche der Reibeplatte werden gesammelte Steinchen 11 eingelagert, die mit Calcium = 20 mineralisiert sind: Y.Z.2295.#1887201120768200 und Cuticula gastris: Y.Z.2298.#1884737411733250. Unterhalb des Magen liegen Dünndarmschlingen. Zwischen 2 Dünndarmschenkeln liegt langgestreckt die Bauchspeicheldrüse (Pankreas) von Y.Z.2411.# 1796402560001250 bis Y.Z.2531.# 1711231360001190. Der darüber liegende Magen ist beendet und in dieser Schnittebene liegen rückenseitig die paarigen Nieren. Vögel besitzen keine Harnblase mit abgehender Harnröhre. Die Harnleiter münden direkt in der Kloake. Der Eierstock (nur links, der rechte Eierstock ist zurückgebildet) beginnt bereits vor der Niere, Y.Z.2519.#1719383315666140, und kann sich weiter entfalten bis Zeile.Y.Z.3079.#1406666635973700. Niere: Y.Z.2532.#1710555518231840. Die paarigen Harnleiter sind über die die Ziffern 9_1 zu erwarten und bei der Einmündung in die Kloake zu suchen: Y.Z.2533.# 1709880210091990. Der End-bzw. Dickdarm (Intestinum crassum) ist, wenn überhaupt, nicht wesentlich weiter als der Dünndarm (Intestinum tenue). Er besteht aus den beiden Caeca (Blinddärmen) und dem kurzen Rektum. Am Ende liegt die Kloake, der gemeinsamen Ausgang des Verdauungs-, Harn- und Geschlechtsapparats. Vereinigung beider Blinddärme je 808: Y.Z.2581.#1678080810601710 bis Y.Z.2596.#1668384657998080. Einmündung in den Dickdarm: Y.Z.2596.#1666458858085040. Übergang Dünndarm/Dickdarm: Y.Z.3218.#1348000800548710.
Der Zeilenlauf bis zur Kloake ist noch weit, so dass die Ei-Entwicklung noch ausführlich zu erwarten ist. Kloake (Ende=99): Y.Z.4718.#918000545180799.
3.) Atmung der Vögel
3.1) Der Vogelgesang entsteht beim Ausatmen, und zwar nicht im Kehlkopf (Larynx), sondern im Stimmkopf (tracheobronchale Syrinx). Der Stimmkopf liegt am Ende der Luftröhre in der Verzweigung auf die Bronchien. Die Luftröhre ist anhand ihrer Knorpelspangen 22 zu identifizieren. Letzte normale Knorpelspange 5_22 der Luftröhre noch vor dem 4. Brustwirbel: Y.Z.772.#5610267580522030. Die Bronchialverzweigung wird als Gruppe 44 und symmetrisch über die Knorpelspange 22 mit 427 _724 in Y.Z.798.#5427476907472440 avisiert. Der Stimmkopf beginnt mit einem versteiften Röhrenstück als kompakter Hohlraum (Tympanum): Y.Z.802.#5400407197210740. Bei männlichen Entenvögel wird das Tympanum auf der linken (links=1) Seite blasenartig aufgeweitet (Bulla syringealis). Die Membran 33 wird durch das Hormon 33 umgedeutet: Y.Z.804.#5386973348461460. Bulla syringealis 6_0_6_1_6: Y.Z.806.#5373606168936740. Die 808 ist hier keine Speiseröhre, sondern nur die Zeilennummer. Die 808 sind 3 Ringe als Extra 8 als Struktur 53_35. Vordere Gruppe der Syrinxringe: Die Syrinxmembranen können je nach Vogelart unabhängig als zweistimmiger Gesang genutzt werden. Durch wechselseitige Nutzung entsteht eine sehr schnelle Tonfolge. Beim Kuhstärling (Gattung Molothrus) sind es 30 Töne /Sekunde = 60_30: Y.Z.808.#5360305163568080. Die Bronchialverzweigung 22_8_22 enthält mittig ein Extra 8 als knöcherner Steg (Pessulus). An dem beidseitig eine gewellte Membran 53_53 angeschlossen ist: Y.Z.809.#5353679322822010. Äußere Membran (Membrana tympaniformis lateralis): Y.Z.812.#5333899719412570. Innere Membran (Membrana tympaniformis medialis): Y.Z.813.#5327338957150070. Hintere Gruppe mit 3 Syrinxringen als Ringform 0_77: Y.Z.816.#5307753152160550. Die Spannung der insgesamt vier Syrinxmembranen wird durch Muskeln verändert. Die Ziffer 5 steht für den Muskelanschluss an der Membran.
3.2) Luftsäcke (Sacci pneumatici): Anstelle eines Zwerchfells wird die Luft durch die muskuläre Verformung des Brustkorbs eingesaugt und im 2. Atemzug herausgepresst. Die Lunge ist im Volumen konstant und enthält parallel angeordnete röhrenförmige Parabronchien (Lungenpfeifen), die von Blutgefäßen für den Gasaustausch umgeben sind. Die Lunge wird ständig von Luft durchströmt, die aus zirkulär eingebundenen Luftsäcken zuströmt. Vögel besitzen bis 12 Luftsäcke (6 paarige Volumenkörper). In der Regel verwachsen 4 Luftsäcke zum unpaarigen Schlüsselbein-Luftsack, so dass 9 Luftsäcke vorhanden sind. Bei Singvögeln sind die vorderen Brustluftsäcke mit verwachsen, so dass nur 7 Luftsäcke vorhanden sind. Aus der 22 für die Luftröhre ist ein Volumenkörper #2000 zu erwarten. Wegen der Einbaulage müssen auch alternative Volumen gewählt werden.
Halsluftsack (Saccus cervicalis), paarig 2: Y.Z.311.#13926452000524100
Schlüsselbeinluftsack (Saccus clavicularis), unpaarig: Mit 7 als Form und 22 als 202: Y.Z.612.#7077004202880740.
Vorderer Brustluftsack (Sacci thoracici craniales), paarig: Der Luftsack liegt zwischen zwei Bindegewebsmembranen (Septum horizontale und obliquum), die auch das Herz und den Drüsenmagen (Proventriculus) einschließen: Y.Z.622.#6963226000262070.
Lunge: Für die komplizierte Lungenfunktion liegt kein geometrisch lesbarer Bauplan vor, um den Bronchialstamm mit den Luftsackanschlüssen im Zifferncode bestimmen zu können. Die Lunge liegt zwischen dem vorderen und dem hinteren Luftsack, so dass der Zeilenlauf das Lungensystem erklärt.
Die Episode X, die das unten liegende Brustbein enthält, beginnt vorn im Zeilenlauf stetig als Hautmembran #33. Es kommt zur Überschneidung mit der Episode Y mit #33, so dass sich die Parabronchien über die beiden Episoden spannen. Das System der parallelen Parabronchien (Lungenpfeifen) wird beidseitig von einem Sekundärbronchus aufgenommen, den man hier als #2222 erwarten kann.
Sekundärbronchus: X.Z.1253.#3425772222771990;
Parabronchien im Brustbeinbereich von X.Z.1245.#3398255980018800 bis X.Z.1282.#3300178389331830
Parabronchien im Wirbelsäulenbereich von Y.Z.1274.#3399628392592630 bis Y.Z.1312.#3301163545855950
Sekundärbronchus: X.Z.1313.#3222261001617220
Hintere Brustluftsäcke (Sacci thoracici caudales), paarig: Y.Z.1319.#3283644103232000
Bauchluftsäcke (Sacci abdominales): Y.Z.1605.#2698521228762000
4.) Skelett der Vögel
4.1) Halswirbel: Der Hals wird von 10 bis 31 Halswirbeln gestützt, meist 14 oder 15. Wird die Kombination 11_5 oder 5_11 als Struktur gezählt, sind es 14 Halswirbel. Der 1. Halswirbel ist mit 111_55 verstärkt: Y.Z.123.#35212411155796800. Der 14. Halswirbel: Y.Z.542.#7991008435725110. 10 Wirbel ergeben sich, wenn der 5.- 8. Wirbel entfallen, weil ( wie im 14.Wirbel) die 5 links von der 11 steht, was den Hals anders krümmt.
4.2) Brustwirbel: Das Rumpfskelett bildet eine versteifte Einheit aus Wirbeln, Rippen und dem Brustbein. Es sind 3 bis 10 Brustwirbel vorhanden. Die Wirbel können zu einem Knochenstab, (Notarium) verschmolzen sein. Hier liegen 10 Wirbel vor, wobei die Zählweise der Halswirbel 11_5 vorgeführt wird. In der Episode EPI.X+Vogel beginnt bereits das Brustbein (Sternum) in X.Z.606.#6981565503503980 und das Gabelbein (Furcula) steht bereit: X.Z.606.#6947173555210850.
1. Brustwirbel: Y.Z.611.# 7088586861150590.
2. Brustwirbel: Y.Z.615.#7042482231159370. Parallel steht das Rabenbein (Coracoid) bereit: X.Z.621.#6812928655593250.
Weiterhin wird in EPI.X-Vogel mit den Flügelknochen begonnen. Der Oberarmknochen wird als Knochen 22 gebildet. Oberarmknochen (Humerus): X.Z.626.#67585122925294100. Der Knochen ist pneumatisiert und wird weiter entwickelt ab: X.Z.627.#6747733166066050.
Für den Flügel müssen rechtzeitig Konturfedern (Pennae conturae) als Flügeldeckfedern und Brustdeckfedern erzeugt werden. Die Federn des Großgefieders für Schwung- und Schwanzfedern sind den Konturfedern sehr ähnlich, sind aber noch gesondert zu erwarten. Der mathematische Aufwand ist bemerkenswert gering. Eine Feder lässt sich nicht an einem langen und festen Federkiel (Scapus) 10 als Achse beidseitig mit einer Federfahne (Vexillum) 33 spiegeln, weil das mit 33_33 keinen Seitenunterschied ergäbe. Die Feder bildet sich daher mit einer schmalen Außenfahne (Vexillum exterior) 33 und der breiten Innenfahne (Vexillum interior) 333. Der Kiel 10 wird mit 5_7_5 als tragende Strukturform gebildet. Durch die beiden Ziffern 5 kann der Kiel in Federschaft (Rhachis) und die Federspule (Calamus) unterteilt werden. Mittels der Lagebezeichnung für 9 (oben/unten) können die beiden Löcher (Nabel) an der Spule gebildet werden als 9_0_9_0 [oberer Nabel (Umbilicus superior); unterer (Umbilicus inferior)]: X.Z.668.#6333575890903310. Mit der Ziffer 9 wird gleichzeitig die Durchblutung der Spule angezeigt. An jedem Federast sitzt eine Oberreihe Hakenstahlen und eine Unterreihe Bogenstahlen, die sich flächenbildend kreuzweise überdecken. Die Hakenstrahlen greifen in die Bogenstrahlen des benachbarten Astes: X.Z.669.# 6324108662366830.
Das schmale Schulterblatt (Scapula) zieht sich weit über die Rippenbereich hinweg. Eine Möglichkeit ist es, im Humerus-Code die Sprungmarke Zeile 1229 zu lesen, die eine Gruppe 44 ausweist: X.Z.1229.# 3442496904087400. Die Gruppe endet mit der 99 am rechten Rand und zeigt das Ende des Schulterblattes an: X.Z.1235.#3425772222771990.
Das Flügelgelenk Oberarm/Unterarm könnte im Zeilenlauf weit hinten liegen, so dass sich der Unterarm einklappen kann. Alternativ wird ein kurzer Abstand gewählt, so dass Ober- und Unterarm in der Episode X+Vogel gestreckt sind, damit sich die Flügelhand in der Episode Y+Vogel linear anschließen kann. Ende Humerus: X.Z.767.#5516073918022700. Gelenk: X.Z.767.#5508891530108610. Anfang Unterarm: X.Z.767.#5501727822007030. Mit 94_94 ist die Dopplung als Elle (Ulna) und Speiche (Radius) vorhanden. Im Gegensatz zu den Säugetieren ist die Elle mit dem Ansatz der Armschwingen der kräftigere Knochen: X.Z.768.# 5494582720939490.
Der günstige Zeilenlauf #1111 liegt nur für die Schwanzfedern vor. Das Gefieder der Flügel lässt sich nicht mühelos erklären. Beim Menschen zeichnet sich über mehrere Zeilen eine kurze Ziffernspalte 8 ab, die in Natur embryonal einen vom Zungenloch zur Schilddrüse ziehenden Verbindungskanal herstellt. Beim Vogel ist es zufällig eine kurze Ziffernspalte 1, die zwingend eine Nutzung erfahren muss. Die Ziffernspalte kann die Gefiederleiste 1 bilden.
Der Episodensprung muss am Knochenende eine Rundung erkennen lassen und zeilengleich muss wie beim Vogelfuß in EPI.X+Vogel eine Hand-Gruppe #444 vorliegen: Ende Unterarmknochen: X.Z.884.#4786005311225580. Episodenwechsel: Y.Z.884.#48994644481482000.
Bis zum Beginn der Handwurzelknochen sind weitere Zeilen geeignet, Flüghäute #335 und Muskeln #555, 56666 und 52222 darzustellen. Handknochen-Gruppe: Y.Z.923.#4692444823578560. Zwei Handwurzelknochen: Os carpi radiale: Y.Z.924.#4687366420089840. Os carpi ulnare: Y.Z.925.# 4682298996932980. Handwurzel- und Mittelhand-Knochenverschmelzung von Os metacarpale minus: Y.Z.926.#4677242518534570 und Os metacarpale majus: Y.Z.927.#4672196949474660 zum Carpometacarpus: Y.Z.928.#4667162254486000. Daumen (Digitus alulae): Y.Z.929.#4662138398453190. Digitus minor: Y.Z.930.#4657125346411840 und Y.Z.931.#4652123063547810. Grundglied des Digitus major: Y.Z.932.#4647131515196360 und Y.Z.933.#4642150666841380. Endglied des Digitus major: Y.Z.934.#4637180484114570 Y.Z.935.#4632220932794660.
3. Brustwirbel: Y.Z.643.#6735811154219300 mit Rippe: Y.Z.673.#6435552113169410. Brustbein X.Z.762#5552268628770880.
4. Brustwirbel: Y.Z.960.#4511590179336470 mit Rippe: Y.Z.992.#4366055012261100.
5. Brustwirbel: Y.Z.1016.#4262919854491150 mit Rippe: Y.Z.1025.#4225489338695620
6. Brustwirbel: Y.Z.1033.#4192765316711530 mit Rippe: Y.Z.1043.#4152566224509120
7. Brustwirbel: Y.Z.1049.# 4128814654111540 mit Rippe: Y.Z.1058.#4093692412252370
8. Brustwirbel: Y.Z.1204.#3597281206115460 mit Rippe: Y.Z.1215.# 3564713228117700
9. Brustwirbel: Y.Z.1230.#3521241115579680 mit Rippe: Y.Z.1293.#3349672522941230
10. Brustwirbel: Y.Z.1320.#3281156494062890 mit Rippe: Y.Z.1344.#3222564413811760
Brustbein: X.Z.1677.#2522855512894100; Brustbein: X.Z.2736.#1546355517223470;
Brustbein-Ende 9: X.Z.3307.#1279355517122290.
4.3) Beckengürtel: Den Brustwirbeln folgt ein versteifter Wirbelsäulenabschnitt (Synsacrum /Os lumbosacrale) aus 9 bis 22 Einzelwirbeln. Das Becken ist mit dem Synsacrum verwachsen und entspricht ansonsten dem Säugetier (Os ilium (Darmbein), Os ischii (Sitzbein) und Os pubis (Schambein).
Um die Vogelbeine als verstärkte Knochen #2255 zu suchen, wird hier nur die versteifte Wirbelfolge im steten Zeilenlauf #115 gesucht. Der Oberschenkelknochen beginnt, X.Z.2753.#1536806645522490, und muss in der der Episode EPI.Y+Vogel angeschlossen werden. Hierzu ist im Zifferncode des Knochens die Sprungmarke Zeile 3680 enthalten, so dass dort ein versteifter Bereich liegen muss. Beim Start der Episoden beträgt der zeitliche Zeitabstand nur 1 Zeile. Der Unterschied weitet sich aus, so dass die Episode EPI.X+Vogel die Versteifungsstrecke #115 startet: X.Z.3648.#1159766637917600 bis X.Z.3678.#1150306877412560. Die Sprungmarke Zeile Y.Z.3680.#1176936568522560 liegt dahinter und avisiert als geteilter Knochen 22 eine Verbindung 52_25. Diese wird dann im Unterschied zwischen Endstrukturen 5599 sichtbar: Oberschenkel: Y.Z.3715.#11658483370559900; Becken: Y.Z.3715.#1165534599613300. Es folgt der nächste Versteifungsbereich von Y.Z.3734.#1159916061104180 bis Y.Z.3766.#1150060162549920.
4.4) Schwanzwirbel: Für den Vogelschwanz erreicht die Wirbelstrecken #11 mit #111 und #1111 eine Verstärkung, die einerseits die Schwanzfedern ausbildet und in Kombination mit der Struktur-5 die 10 Schwanzwirbel ausbildet.
1. Schwanzwirbel: Y.Z.3881.#1115982110838190; 2. Schwanzwirbel: Y.Z.3882.#1115694634766360; 3. Schwanzwirbel: Y.Z.3883.#1115407306763590; 4. Schwanzwirbel: Y.Z.3884.#1115120126715500; 5. Schwanzwirbel: Y.Z.3891.#1113113999527890; Federn: Oberschwanzdecke: Y.Z.3895.#1111970878604110; Federn: Steuerfedern (Rectrices): Y.Z.3896.#1111685465134240; Federn: Unterschwanzdecke: Y.Z.3897.#1111400198142930; 6. Schwanzwirbel: Y.Z.3898.#1111115077517450; 7. Schwanzwirbel: Y.Z.3900.#1110545274913590.
Die einzige Hautdrüse 11_33 ist die Bürzeldrüse (Glandula uropygialis) am Schwanz: Y.Z.3905.#1109123321936750. Drüsenwirkstoff 88: Y.Z.3906.#1108839368193290. Drüsenkörper: Y.Z.3907.#1108555559806250.
Die letzten Schwanzwirbel sind zum großen Pygostyl verwachsen. Hier ist lediglich für die letzten 3 Wirbel eine Gruppe 44 erkennbar. Weil üblich 6 Wirbel verwachsen sind, können die Schwanzfedern am Pygostyl ansetzen. 8. Schwanzwirbel: Y.Z.3917.#1105725446046210; 9. Schwanzwirbel: Y.Z.3918.#1105443229240180; 10. Schwanzwirbel: Y.Z.3919.#11051611564590500.
Unter diesen Annahmen folgt das abgerundete Körperende, indem 2fach eine 33er-Membran-Zeile gesucht wird. Hier kann das Körperende mit der dazwischen liegenden End-Zeile #9995 angenommen werden: Y.Z.3928.#1102628964399950. Der Vogel ist damit noch nicht vollständig geschrieben. Der Scan dreht sich und kann rückläufig bis zur Kloake mit dem Thema „Das Ei“ weiter laufen. Die Vogelfüße sind ebenfalls noch nicht dargestellt worden. Beim fliegenden Vogel liegen die Füße hinter dem Körperende. Die Füße müssen wegen dem zeitlichen Gegenlauf, daher gesondert in der Episode EPI.X+Vogel als Zubehör gesucht werden.
4.5) Vogelbeine: Der Oberschenkel (Femur) beginnt in Zeile X.Z.2753.#1536806645522490. Dessen Beckenanschluss wurde bereits ermittelt. Wie beim Menschen besteht der Unterschenkelknochen aus dem Schienbein und dem dünnen Wadenbein. Beim Vogel sind weniger Fußgelenkknochen vorhanden, so dass das Schienbein mit einigen Fußgelenkknochen verwachsen ist. Der Unterschenkelknochen wird daher als Tibiotarsus bezeichnet. Das Kniegelenk liegt unmittelbar mit 2 geeigneten Zeilen (mit der Null als Kniescheibe) davor: X.Z.3050.#1387156949220790 und X.Z.3051.#1386702292731370. Tibiotarsus: X.Z.3087.#1370530837422550. Aufgrund der Knochenverwachsung kann noch eine 2. Knochenzeile eingefügt werden: X.Z.4989.#848031408122552. Gelenk „Articulatio intertarsalis“ zwischen Tibiotarsus und dem Laufknochen (Tarsometatarsus): X.Z.5867.#721123009225057. Der Laufknochen besteht aus verschmolzenen Fußwurzel- und Mittelfußknochen. Zusammen mit den Zehen ist von einer Fuß-Gruppe #4444 auszugehen, wodurch auch zu den 4 Zehen der Vögel ein Zusammenhang besteht.
Der Laufknochen wirkt aufgrund seiner Länge wie ein Unterschenkelknochen. Die Knochenlänge entsteht, wenn im Zeilenlauf 4x #44..55 aktiviert wurde, weil dann der Anschluss an die 4 Zehengrundgelenke zu erwarten ist. 1. Streckung: X.Z.5888.#718551069144601; 2. Streckung: X.Z.5917.# 715029355268448; 3. Streckung: X.Z.5941.#7121408340554470; 4. Streckung: X.Z.6089.#694831449355134. Weil in der Fußgruppe #44 die Doppelziffer 33 (Testosteron oder Haut) wegen Zeilen mit #33...44 und #33...55 aktiviert ist, kann die Evolution als Interpretation des mathematischen Bauplans darauf reagieren. Die männliche Hühnervögel (Galliformes) bilden am Laufknochen einen knöchernen Sporn (Calcar metatarsale) 5_11 aus. Die weibliche Doppelziffer 66 kommt durch die Ziffernspaltung 6_5_6 nicht zur Wirkung: X.Z.6102.#693351146365685.
Anschluss der Zehengruppe 1_4444 an den Laufknochen 55: X.Z.6175.#685154444554398. Es fehlt eine konkrete Vorgabe, so dass viele Fußformen möglich sind. Die Fußform 7 soll aus bis zu 4 Zehen 4_7_4 entstehen: X.Z.6176.#685043506334749. Die enthaltene Hautmembran 33 ist als Schwimmhaut zwischen den Zehen der Wasservögel als Extra 8 geeignet: X.Z.6191.#683383733665548. Für Dopplung 33_33 sind vorn 3 Zehen nötig. Dies entspricht den Singvögeln, wobei der 4. Zeh dann hinten liegt. Der Zeilenlauf symbolisiert die Zehen als bewegliche Extras mit #68... . Die 4 Zehen können nunmehr die Bereiche 681..., 682..., 683... und 684... füllen. Die Endziffer entspricht der Anzahl der Zehenglieder (Phalangen) abzüglich des mit einer Kralle besetzten Zehengliedes. Diese Anzahl wird durch irgendeine Aktivität und 1 Kralle bestätigt: 1. Zeh mit 2 Zehengliedern und Kralle 11: X.Z.6211.#681183174226922 und X.Z.6211.#681622151622911. 2. Zeh mit 3 Zehengliedern und Kralle 1: X.Z.6201.#682281679587713, X.Z.6198.#682611922414232 und X.Z.6197.#682722074410749. 3. Zeh mit 4 Zehengliedern und Kralle 1 : X.Z.6191.#683383733665548, X.Z.6188.#683715044460797, X.Z.6187.#683825552791888 und X.Z.6186.#683936096851505. 4. Zeh mit 5 Zehengliedern und Kralle 1: X.Z.6185.#684046676656978, X.Z.6184.#684157292225648, X.Z.6182.#684378630722001, X.Z.6182.#684489353684422 und X.Z.6180.#684600112479516.
5.) Blutkreislauf
Herz: Nachdem die Luftröhre über den Stimmkopf auf zwei Bronchien verzweigt, kann sich mittig das Herz entwickelt. Im Zeilenlauf liegt die 5 als Herzmuskelstrecke an: Die 2 Herzkammern sind mit dem jeweiligen Vorhof vollständig getrennt als 51_51: Y.Z.844.#5131666554695510.
Linker Vorhof 400: Links= 1, sauerstoffreiches Blut kommt von der Lunge über die Lungenvene: Y.Z.847.#5113490640098000. Herzklappe 9_1: Y.Z.848.#5107460580380910. Linke Herzkammer: Mit 2 Formzeilen 7 wird mit 444/44 die V-Form symbolisiert: Y.Z.849.#5101444725751480 und Y.Z.850.#5095443026074130. Das Blut wird über die Aorta (Arterie = 9) in den Körperkreislauf geleitetet. Y.Z.850.#5089455431448900. Rechter Vorhof 500: Rechts= 2, sauerstoffarmes Blut kommt von den Körper-Venen: Y.Z.859.#5042056545009320. Herzklappe 6_1_6 mit venösem, sauerstoffarmen Blut 88: Y.Z.860.#5036193688561640. Rechte Herzkammer: Y.Z.861.#5030344450828120 und Y.Z.862.#5024508784411840. Das sauerarme Blut wird über die Lungenarterie zur Lunge geleitet. Dieser menschlichen Begrifflichkeit „sauerstoffarm + Arterie“ kann der Code mit 8 und 9 nicht folgen, d.h. zur Lunge geht keine 9, sondern nur eine 8.
BiXnom_Vögel_dat09.06.2021
Zugabe für Freunde der BiXnom-Würfelkunde: Die Wale
Wale: Seit 1758 werden Wale den Säugetieren zugeordnet. Es sind Paarhufer (Artiodactyla). Der Name „Walfisch“ ist unwissenschaftlich. Hier in der Würfelkunde ist der Wal ein Säugetier (stimmt nicht: Milch wird nicht gesaugt!) und zugleich ein BiXnom-Fisch. Er entsteht, indem die Fallhöhe der Fische durch Ansatz der Schwelle als Obergrenze reduziert wird. Weil der Artenfaktor aber auf den Abstand zur Kellersohle bezogen ist, wird die Schwelle zum MINOR addiert. Artenfaktor Walfisch = (MINOR+Schwelle)^5.
Die Episode EPI.X-Wal ist gegenüber EPI.Y-Wal die Leitepisode. Sie enthält wenig tauchschädliches Volumen #5000 o.ä., dafür aber vielfällig #5555 o.ä. als schwimmendes Muskelpaket.
Die Wale (Cetacea) bilden 2 Unterordnungen: 1.) Zahnwale (Odontoceti): Zähne im Unterkiefer, Echoortung, 1 Nasenloch als Blasloch. Der einzige Großwal ist der Pottwal (Physeter macrocephalus / Physeter catodon). 2.) Bartenwale (Mysticeti): Hornlamellen (Barte) im Oberkiefer zum Filtrieren von Plankton-Krebsen, anstelle einer unteren Zahnreihe wird eine Längslippe seitlich wandartig hochgestellt; 2 Nasenlöchern als Blaslöcher. Die Evolution interpretiert den mehrdeutigen Zifferncode, so dass auch Bartenwale ableitbar sind. Direkt erkennbar, ist dagegen der Zahnwal.
Beim Pottwal wölbt sich die Junk-Melone, ein Organ aus Fett- und Bindegewebe, im Gegensatz zum Delphin weit nach vorn über den Unterkiefer hinaus. Die Melone enthält das Walrat, aus dem Walöl gewonnen wird. Das Röhrenorgan als Form 7 ist mit 666_5 ein flexibler Prellbock. Die Walhaut 33 als 3_02_3 ist längsfurchig. Der Schädel entwickelt sich als Raum 4_1_4, der mit der 1 die Zähne zum Zählen der Längenstreckung benötigt. Alternativ kann der Bartenwal auch seinen Reusen-Kamm entwickeln: EPI.X.Z.1#414076665893023000. In der Parallelepisode ist nur eine Symmetrie erkennbar: EPI.Y.Z.1.#418735234478192000. Verwendbar wären mit 2=rechts und mit 9 als beliebige Richtung als unterer Nasengang 909 die Zeile EPI.Y.Z.2.#209367617239096000 und mit 1= links (Blaslochseite beim Pottwal) der obere Nasengang 808 zum EPI.Y.Z.4.#104683808619548000. Für den Reusen-Kamm der Bartenwale ist eine Symmetrie 1_3_4_11_4_3_1 geeignet: EPI.Y.Z.4.#139578411492731000.
Die gebrauchsfähigen Zähne liegen im Unterkiefer und greifen in passende Hornscheiden im Oberkiefer ein. Die wenigen Zähne im Oberkiefer sind unsichtbar, d.h. sie brechen als Weisheitszähne nicht durch. Im Unterkiefer werden 22 paarige Zähne (Summe 44 wie in der Raumgruppe 4_1_4) adressiert [Pottwale: Unterkiefer mit 40 – 60 Zähnen]. Beim Menschen brechen die Zähne am rechten Zahlenrand einzeln als #11 durch. Im Unterschied benötigt der Wal seine Zähne nicht als Kauwerkzeug, sondern nur zum Festhalten der Beute. Die Zähne, paarig 2, werden unabhängig von der Ziffernposition einfach nur als #11 gezählt, wobei zufällige Strukturverbindungen 511 oder 115 normal mitgezählt werden. Als Struktur #115 beim 1. Zahn wird aber bereits vorausgesetzt, dass beidseitig die langgestreckte Zahnleiste schon vorhanden ist. Wird das so von der Evolution nicht erkannt, fehlt 1 Zahnpaar. Die Folge 111 zählt nicht mit und kann sich ggf. auf den Oberkiefer beziehen. Mit Form 7 werden Zahntasche (unten) und Hornscheide (oben) als Löcher 0_7_0 adressiert, sowie Haut 33 und 20=Calcium als Zahnmaterial: 1. Zahn: EPI.X.Z.2#207038332946511000.
In der Variante „Delphin“ wären nun zunächst die beiden Unterkieferhälften als lange Zahnstange mit hinterem Gelenk als Knochen 22_5 paarig anzuzeigen, was wegen der Länge auch als 2_5555_2 lesbar ist. Wegen der dezimalen Wiederholung lassen sich darin auch die Muskeln der „Melone“ erkennen, die später als Zeile 30 wertgleich erscheint. Umgekehrt beginnt die Melone beim Pottwal dagegen schon vor den Kieferknochen.
Die lange Junk-Melone bildet beim Pottwal die Unterlage für den oben liegenden Oberkiefernasenmuskel (Musculus maxillonasalis). Der Oberkieferknochen 2_2 wird geteilt und wannenartig seitlich 9 hochgezogen, so dass sich der Muskel 2_5555_2 mittig zeigt. Der Oberkieferknochen zeigt sich nicht direkt als 22_5, so dass daraus ein komplizierter Spalt ergibt: EPI.X.Z.3#138025555297674000. Die Zähne im Oberkiefer können sich wie Weisheitszähne blockiert zeigen mit 1_9_1 statt #11. Pottwal-Fundstücke zeigen oben 10 Zahnpaare: EPI.X.Z.4#10351916647325600.
Pottwal-Spermaceti (Walrat) unterscheidet sich von den Fettgemischen in den Melonen anderer Wale durch den hohen Wachsanzeil (38-98%). Wachs kann einfach als Hautprodukt 33 symbolisiert werden. Im Nasengang werden in Verbindung mit einem Luftsack Schallschwingungen erzeugt, die über den Fettkörper der Melone fokussiert und ins Wasser geleitet werden. Umgekehrt wird über einen 2. Fettkörper im Unterkiefer der Schall zur inneren Ohrkapsel gelenkt. Walrat: EPI.X.Z.5:82815333178604600. Kegelförmiger Pottwalzahn 1 als Dreiecksform 777__3_7: EPI.X.Z.5: 69012777648837100.
In der Kombination 33/66 können Geschlechtsunterschiede adressiert sein. Bei 323 kann mit 2= männlich (sonst auch rechts, auch Knorpel/Knochen) das größere Gewicht der Walbullen als Form 7 mit 5_9_5 enthalten sein. Wogegen Weibchen=1 von kleiner Struktur 5_1_7 sind: EPI.X.Z.8.#51759583236627800.
Vorderer (distaler) Luftsack (Saccus vestibularis) 600 am Ende des unteren Nasengangs: EPI.X.Z.9#46008518432558100. Vorbei am Fettkörper der Melone 3333 wird ein Verbindungsgang 300 zum linken Nasengang mit dem Blasloch hergestellt: EPI.X.Z.11#37643333263002100.
Die Breite des Oberkiefers, getrennt durch einen Mittelspalt, ist beim Pottwal schaufelartig muldenförmig ausgeformt, um die Melone darauf zu tragen. Es wird aber immer noch der Unterkiefer mit seinen paarigen Zahn-Knochenstangen gesucht. Diese sind vorn nur lose verbunden. Dazwischen liegt, wie bei Finwalen festgestellt wurde, ein Sensororgan mit Nervenenden (Nerv=7), mit denen die notwendige Maulöffnung am flexiblen 6 Spalt 3_1_3 signalisiert wird: EPI.X.Z.16.#2587979161831390. Mit 222_5 als Knochenstange, hinterem Gelenk 0 und vorderem Spalt 1 ergäbe sich der paarige 2 Unterkiefer: EPI.X.Z.13#31852051222540200. Der Oberkiefer als Struktur 5_9_5 kann dann als beidseitige Schaufel-Wand 5 mit Mittelspalt 1_1_1 adressiert werden: EPI.X.Z.15#27605111059534900.
Die Zunge ist als 6666 zu erwarten: EPI.X.Z.22 #18821666631501000. Die 6666 wiederholt sich und ist dann ab dem 15. Zahn unten 99 mit der Haut 33 verwachsen: EPI.X.Z.115#3600666659939330.
Vorderer oberer Fettkörper 3333 der Melone: EPI.X.Z.23#18003333299696600. Hinterer unterer Fettkörper 3333: EPI.X.Z.110#3764333326300210.
Blasloch 505: Beim Pottwal nur 1 Blasloch vom linken Nasengang (Links=1): EPI.X.Z.29.# 14278505720449100. 7. Zahn: EPI.X.Z.36.#11502129608139500. Randspalt 111 im muldenförmigen 12_6_12 Oberkiefer (Pottwal): EPI.X.Z.37.#11191261240352000. Rechter Nasengang 202 (ähnlich wie 22 Luftröhre) und rechts=2: EPI.X.Z.108.#3834043202713170.
Der Kehlkopf der Wale ist beweglich. Seine verlängerte Kehlkopftube wird bei der Nahrungsaufnahme quer durch die Speiseröhre (Ösophagus) in den Nasenhof geschoben. Kehlkopf: Kehlkopf 2225 im Nasenhof 20__02: EPI.X.Z.130.#185205122254020. Ein Ringmuskel 5555 verhindert, dass Wasser in die Atemwege gelangen kann. Räumlicher 44 Verschluss 4_99_4: EPI.X.Z.138.#3000555549949440.
Direkt nach dem 20. Zahn (von 22) entwickelt sich beim Pottwal ein Stirnluftsack als kleines Volumen #200: EPI.X.Z.197.#2101912009609250.
Unmittelbar dahinter wird die Ausbildung eines Volumens 9000 für die Schädelknochen avisiert: EPI.X.Z.198.#2091296292389000. Geometrisch lässt sich der Schädelknochen beschreiben, wenn er sich als halbierte Knochen-Röhre 2_2 als Abschluss des Oberkiefers vertikal aufstellt. Siehe: Das Skelett Des Wals Und Des Leuchtturmes In Morro Jable Stockfoto - Bild von landschaft, ozean: 142597880 (dreamstime.com)
Die beiden vertikalen Knochen-Flanken können in beiden Episoden dargestellt werden, weil im Zeilenlauf mit #20 die Ziffer 2 für Knochen 2_2 und 0 für das Volumen anliegt, und zwar bis EPI.X.Z.207.#2000370366632960 und EPI.Y.Z.209.#2003517868316710. Die Rückfront des Schädelknochens wird sich noch bis zu den Halswirbeln schließen, wenn die #20 im Ziffernbild nach rechts durchgelaufen ist: EPI.X.Z.275.#1505733330520080 und EPI.Y.Z.275.#1522673579920700.
22. (letzter) Zahn: EPI.X.Z.212.#1953191820250110. Hornhaut 3333 des Auges: EPI.X.Z.230.# 1800333329969660. Pupille 505: EPI.X.Z.232.#1784813215056130. Ringmuskel 550: EPI.X.Z.235.#176202836550222. Kugellinse 06060, paarig 2: EPI.X.Z.242.#1711060602863730 und EPI.X.Z.244.#1697035515955010. Glaskörper: EPI.X.Z.250.#1656306663572090. Netzhaut (Retina) paarig 666_666: EPI.X.Z.250.# 1636666663608790 und Zapfen nur grünlich und zufällig 486nm: EPI.X.Z.256.#1617486976144620. Sehnerv 2: EPI.X.Z.257.#1611193252502030.
Dem Auge folgt als Zeilenlauf mit #1_5 eine Struktur. Eine Struktur-5 als Gehirn ist bisher nicht bekannt. Wale atmen bewusst und müssen mit einer Hirnhälfte daher wach bleiben. Es werden beide Episoden aktiviert. Die rechte Hirnhälfte ist beim Wal stärker strukturiert. Beim Episodenvergleich enthält in der gleichen Zeilen EPI.Y immer die größere Zeit. Mit der Struktur #1_5 läuft EPI.X mit 3 Zeilen voraus bei einem Zeitplus als Differenz zwischen EPI.X.Z.259.#1598751605764570 und EPI.Y.Z.262.#1598226085794630. Im Endvergleich entwickelt sich zunehmend ein Zeitdefizit als imaginäre Denkleistung bei einer Differenz zwischen EPI.X.Z.276.#1500277774974720 und EPI.Y.Z.279.#1500843134330440.
Beim Delphin ist hinter dem Auge das Ohrloch 505 sichtbar: EPI.X.Z.275.#1505733330520080. Das Gehirn mit Nerv 7 muss sich ebenfalls in diesem Bereich entwickeln: EPI.X.Z.275.#1500277774974720. Gehörkapsel als Raum 44: EPI.X.Z.275.# 1489484409687130 EPI.X.Z.276.#1484145755888970. Die knöcherne 22 Ohrkapsel bildet Jahresringe, die das Alter anzeigen (bekannt bis 211 Jahre): EPI.X.Z.280.#1478845235332220. Die Zeitmessung 60 ist bereits aktiv in Zeile EPI.X.Z.277.#1494861609722100.
Direkt im Anschluss an die Schädelknochen müssen die paarigen Unterkieferzahnleisten als 222 erscheinen und mit einem unteren 9 Gelenk räumlich 44_00_44 am Schädel angeschlossen werden: EPI.X.Z.280.#1478845235332220 und EPI.X.Z.281.#1473582440900440.
Die 7 Halswirbel werden als #115 gezählt. 1. Halswirbel: Als Atlas mit Loch 115_0. Avisiert eine Halswirbelgruppe 44 mit 7 Wirbeln: EPI.X.Z.286.#1447820510115460. 2. Halswirbel: Als Axis mit Drehzapfen 0_22_0 im Atlasring: EPI.X.Z.333.#1243473471150220. 3. Halswirbel: EPI.X.Z.337.#1228714142115790. Die Halswirbel liegen lamellenartig als Paket eng zusammen. Hier folgen die letzten 4 in 4 Folgezeilen: 4. Halswirbel: EPI.X.Z.357.#1159878615946840 bis 7. Halswirbel: EPI.X.Z.357.# 1150212960813950.
Durch den Hals zieht sich die Speiserohre entweder als 808, wenn die 8 für das Verdauungssystem steht. Hier ist es offenbar wie beim Menschen ein Muskelschlauch 505.
EPI.X.Z.290.#1427850572044910. Der Wal-Hals ist anders als beim Menschen steif, was ein kräftiger Muskel 5555 anzeigt. Mit 2_2 kann sich auch die Luftröhre zeigen: EPI.X.Z.300.#1380255552976740. Die Luftrohre 202, unpaarig 1, ist erst nach dem 3. Halswirbel erkennbar: EPI.X.Z.345.#1200222219979780.
Die Episode EPI.X-Wal erzeugt die Brustwirbel. Diese werden als #115 gezählt. Die ersten 6 Rippenpaare sind echte Rippen mit 2 Rippenköpfen: 1.) am Wirbelkörper mit dem Capitulum und 2.) am Querfortsatz mit dem Tuberculum. Nach unten schließen die Rippen mit einer zwischengeschalteten, verknöcherten Bauchrippe am Brustbein an. Beim 1. Brustwirbel ist die 11 doppelt vorhanden und die Ziffer 7 ist markiert 1_7_1: 1. Brustwirbel: EPI.X.Z.544.# 761170341715115. Die 7. Rippe ist als unechte Rippen ohne Verbindung zum Brustbein (sofern in der Länge noch vorhanden). Hierzu liegt der 7. Brustwirbel bei: EPI.X.Z.544.#464211508848680. Die Wirbelanzahl der Wale ist uneinheitlich. Mit 50 Wirbeln hat der Pottwal (Physeter macrocephalus) die geringste Anzahl (7 Halswirbel, 11 Brustwirbel, 8 Lendenwirbel und 24 Schwanzwirbel). Die Schwanzwirbel verkleinern sich zum Ende hin, ansonsten würde der Schwanz unrealistisch bis zur Körpermitte reichen. Vergleich: Buckelwale 53, Blauwale 64, Finwale 65 und Delphine 67 Wirbel. Um mit der „Zählweise #115 (nicht 1115 oder 511)“ und dem bereits ermittelten Schwanzende eine ausreichende Wirbelzahl für den Delphin zu erreichen, müssten auch „#511“ als Wirbel mitgezählt werden.
Für den gewählten Pottwal sind bei 50 Wirbeln abzüglich 7 Halswirbel weitere 43 Wirbel zu adressieren. Abzüglich 34 Positionen "115" sind bis Schwanzende noch 9 Zählwirbel zusätzlich einzubauen. Weil der Beckenknochen bereits positioniert ist, können die zusätzlichen Zählwirbel für einen flexiblen Schwanz im Zeilenlauf erst anschließend folgen. Dazu ist die „11“ als Zählwirbel am rechten Zahlenrand geeignet. Von Beckenknochen bis Schwanzende sind 10 Zählwirbel „11“ vorhanden, so dass die insgesamt 50 Pottwal-Wirbel realisierbar sind. Die Positionen „511“ werden als Hilfsgröße nicht benötigt. Die After reicht etwas in den Schwanzbereich hinein.
Die Episode EPI.Y-Wal ergänzt die Wirbelsäule durch Rippen und Brustbein mittels einer gestreckten Rippengruppe #444. Darin lassen sich 11, 14 und 15 als übliche Brustwirbelanzahl deuten. Beim gewählten Pottwal sind 11 Brustwirbel mit 11 Rippenpaaren zutreffend.
Es werden 11 Rippenpaare 1_12_1 ausgebildet, wovon die ersten 6 unten mit dem Brustbein verbunden sind. Die Rippen werden wie die Wirbel als #115 gezählt. 1. Rippe: EPI.Y.Z.752.# 711514447112190. Die 11 ist doppelt vorhanden, so dass noch eine verknöcherte Bauchrippe als direkter Brustbeinanschluss dazwischen liegen kann. Das Brustbein wird durch die 6 paarigen Rippenanschlüsse als #225 gezählt. Anschluss der 6. Rippe am Brustbein: EPI.Y.Z.855.#489748812255196.
7. Brustwirbel in der Episode EPI.X-Wal mit EPI.X.Z.892.#464211508848680. Unechte Rippen: Von 7. Rippe: EPI.Y.Z.962.#435275711515792 bis 11. Rippe: EPI.Y.Z.1114.#375884411560316. 11. Brustwirbel EPI.X.Z.1155.# 358507935838115.
Für das große Herz als Hohlorgan stehen ohnehin kaum Hohlräume > 500 zur Verfügung und die Brustflosse verdeckt den Herzbereich. Normalerweise gibt es also kein Herz als Zeilencode, so dass es quer über beide Episoden als digitaler Plot gezeichnet werden muss. Das Herz liegt mit dem Aortenbogen brauchseitig (ventral) austretend horizontal gegen die Richtung des Zeilenlaufs. Der austretende Aortenbogen zieht unten an der der linken Herzhälfte vorbei, um oberhalb bis zur Wirbelsäule nach hinten in den Körper zu ziehen.
Das Herz ist mit dem Gefäßanschlüssen auf der linken Seite asymmetrisch größer, so dass auch hier die Episode EPI.X-Wal einen kleinen Zeilenvorlauf besitzt. Das Herz 5_1_5 wird mit der Botschaft adressiert „Suche fehlende Nullen!“: EPI.X.Z.583.#7102515710000390. Anschließend wird die Nullspalte für die linke Herzhälfte im Zeilenlauf als Form „7_0“ sichtbar, und zwar von EPI.X.Z.583.#709035386803121 bis EPI.X.Z.591.# 700637336536418. Die rechte Herzhälfte startet von EPI.X.Z.590.#709720736403716 bis EPI.X.Z.598.#700226144612361. Nach Zeile 599 für den 2. Brustwirbel folgen die Zeilen 600, 601, 602, 603, 604, 605,606, 607, 608 und 609, mit denen die Ziffer „0“ in beiden Episoden weiter gezogen wird. Abschließend werden die Herzhälften mit der muskulösen 5 Herzspitze als Haut 33 verschlossen: Rechte Herzspitze: EPI.Y.Z.624.#671050055253513. Linke Herzspitze: EPI.X.Z.682.#607150536500033.
Eine Herzklappe zeigt sich beispielsweise als Membran 33 mit den Zuständen offen= 0 und geschlossen= 1 als 3_0_3_1_3. Ein spezieller Schäferhund lässt alle ins Haus, aber niemanden hinaus. So enthält auch die linke Vorkammer vorn keine Herzklappe. Die 4 Herzklappen benötigen daher auch nur 1 Funktionszeile: Auf= 707, geschlossen = 3_2_3“, auf= 3_0_3 und geschlossen= 3_121_3: EPI.Y.Z.592.# 707323031213163. Der hinter dem Herz liegende vertikale Teil des Zwerchfells erscheint erst in weitem Abstand, weil das Zwerchfell bei der Atmung zwar pulsiert, aber dabei das Herz nicht abschnürt.
Die Brustflosse (Flipper / Pectoralflosse) ist nicht mit dem Skelett verbunden und bildet sich hier in Nähe des 3. Brustwirbels: Das Schulterblatt (Scapula) wird als große Knochenplatte 2222 erwartet. Zum Muskelansatz sind 2 Knochenfortsätze 29_29 vorhanden. 1.) Schultergräte (Spina scapulae) 2.) Rabenschnabelfortsatz (Korakoid / Processus coracoideus). Als Extra 8 ist eine Arm-Hand-Gruppe 44 angeschlossen 8_44_8: EPI.X.Z.658.# 629295844822223. Gelenk 0_555_0 zum Humerus-Anschluss: EPI.X.Z.685.# 604491483055508. Der Oberarmknochen (Humerus), paarig, 2_5_22_5 entwickelt sich im Zeilenlauf und muss als Flosse vom Körper beispielsweise 60° seitlich 9_5 vom Körper weggedreht werden: EPI.X.Z.687.#602731682522595. Armgelenk Oberarm/Unterarm 225_33_000_4: EPI.X.Z.694.#5966522563300040. Unterarmknochen aus Speiche (Radius) 555 und Elle (Ulna) 55. Im Alter wachsen beiden Knochen zusammen: EPI.X.Z.745.#555807605225534. Wie beim Menschen werden die Handgelenkknochen in 2 Reihen und hier als 2 Zeilen gewählt: EPI.X.Z.746.#555062554816384 und EPI.X.Z.747.# 554319499187447, wobei 1_9 und 4_99 zusammen 5 Finger als Anschluss ergeben. Hierfür liegen genau 5 Zeilen #55 vor. Beim Menschen sind 2-3-3-3-3 Fingerknochen vorhanden. Die Anzahl der Fingerknochen ist mit 4- ca. 12 pro Finger ist sehr unterschiedlich. Die erhöhte Anzahl von Fingerknochen (Phalangen) ist für aquatische Wirbeltiere typisch. Es bilden sich auch zusätzliche Finger ohne Kontakt zur Handwurzel. Der Zifferncode enthält somit keine verbindliche Vorgabe. Die Brustflossen der Buckelwale besitzen an der Vorderkante eine Reihe buckelförmiger Haut-Erhöhungen, die als 3_0_33 gegenüber der glatten Kante 33 im letzten Finger erkennbar ist (QS=8+2= 10 Zacken). Es ist möglich, den Fingerschlüssel eines Zahnwals 2_7_6_3_2 zu erkennen. Zweiter Finger 3+1+1+1+1=7 Glieder und 2=paarig. Dritter Finger 2+2+2= 6 Glieder und 1+1=2=paarig, 9 mittig an der Handwurzel. Die übrigen 3 Finger enthalten 3_8 mit jeweils 3 Gliedern, wobei 8 die Finger als Extras zeigt oder es ist allgemein die Handwurzel (beim Menschen mit 8 Knochen). Vierter Finger 0_3_8, d.h. es sind 3 Glieder vorhanden, weil mit der Null gelenkig an der Handwurzel angesetzt wird. Der 1. und der 5. Finger klammern sich als 3_3_8 mit 1 Glied in die Handwurzel ein, so dass nur noch 2 der 3 Glieder sichtbar sind. 1. bis 5. Finger:
EPI.X.Z.748.#553578430338266; EPI.X.Z.749.#552839340311112; EPI.X.Z.750.#552102221190697; EPI.X.Z.751.#551367065103892 und EPI.X.Z.752.#550633864219445.
Die Lunge erstreckt sich oben unterhalb der Wirbelsäule und wird vom Zwerchfell (Diaphragma) begrenzt. Einerseits wird damit der Bauchraum nach dem Herz rechtwinklig zur Wirbelsäule abgegrenzt. Das Zwerchfell zieht sich dann waagerecht mit dem Zeilenlauf #33 stetig weiter: EPI.X.Z.1218.#339964421915454. Das Zwerchfell senkt sich zur Volumenbildung im Zeilenlauf als 333395 symbolisiert: EPI.X.Z.1242.#333395061105493. Mit der „1105“ ist dazu senkrecht das vertikale Zwerchfellstück adressiert. Das vertikale Zwerchfell liegt zwischen dem Herz und der folgenden, unten liegenden Leber: EPI.X.Z.825.#501911110173361. Der Bereich #33 endet in Z.1254. Verzweigung der Luftröhre auf 2 Hauptbrochien zu den beiden Lungenflügeln: EPI.X.Z.841.#492362266222381. Abweichend besitzen Pottwale 3 Abzweige, weil bereits vor dem Brustkorb 1 Luftsack mit angeschlossen wird. Dieser liegt somit direkt nach den Halswirbeln als Volumen #200 an. Pottwal-Luftsack: EPI.X.Z.486.# 852009600602928.
Die Lungenflügel 22_22 werden als Form 77 EPI.X.Z.856.#4837344227722230 und als Raumgruppenstruktur 444_5 dargestellt: EPI.X.Z.860.#4814844952244450. Die Lunge ist nicht durch Lappen unterteilt. Im Gegensatz zu den Land-Säugetieren wird der Sauerstoff chemisch gebunden, so dass es beim Auftauchen keiner Wartezeit bedarf.
Die Leber 5000 beginnt wie die Lunge nach dem Zwerchfell: EPI.X.Z.828.#500092591658240. Weil die Leber unten auf dem Brustbein liegt, erstreckt sie sich weiter bis die 5000 in EPI.Y.Z.1009.#415000232386712 vorliegt. Eine Gallenblase ist beim Wal an der Leber nicht vorhanden.
Der Nabel liegt in der Körpermitte und ist als weiblich 66, Haut 33, Röhre 00 und als Ende 99 adressiert: EPI.X.Z 1150.#360066665993933.
Beim Pottwal liegt die Rückenflosse (Finne) hinter der Lunge. Mit Knorpel 22 und 9 für seitlich und 999 für vorn reicht die Finne von EPI.X.Z.1264.#327592298965999, über Hautfläche EPI.X.Z.1265.#327333332721757; bis oben und hinten 999: EPI.X.Z.1294.# 319997423410373. Beim Schwertwal (Orca) zeigt die Rückenflosse sichtbare Geschlechtsunterschiede. Beim Weibchen ist die Flosse leicht nach hinten gebogen, statt gerade oder nach vorn, und ist deutlich kleiner. In Zeile 1265 ist mit der Form 7 die Struktur 5 als 7_5_7 markiert und weiblich 66 adressiert, womit die Flosse verkürzt sein kann: EPI.X.Z.1275.#324766012465116. Beim Pottwal zieht sich in Verlängerung der Rückenflosse ein Rückenkamm, der aus buckelförmigen Elementen besteht, bis zur Schwanzflosse. Geometrisch sind es Dreieck-Zeilen 333, die sich als Gruppe 44 wie eine Zackenleiste durchzieht. Mit 1_9_888 bildet sich ein unpaariger 1 Kamm 9 als Extra-Leiste 888 und eine dreieckige Zackenleiste 333_5 als Gruppe 44. EPI.X.Z.#198884085443335. Diese Zackenleiste ist als Kamm-Form 9_7_9 nur für Weibchen 66 vorgesehen. Vereinzelt tragen auch Bullen einen Zacken-Kamm 333, denn das Testosteron 33 ist ähnlich: EPI.X.Z.#1979333966983860. Die Kamm-Gruppe 4_333_4 endet, sobald die 9 als Ende am rechten Zahlenrand ausläuft: EPI.X.Z.2683#154333457284019.
Anfang Vormagen (Kropf): EPI.X.Z.1285.#322238650500407. Der muskulöse Vormagen enthält keine Drüsen, sondern ist ein Kropf als Aussackung der Speiseröhre 505. Harte Nahrungsbestandteile werden durch Aufnahme von Sand und Steinchen im Kropf zerrieben. Reibefunktion 90_09: EPI.X.Z.1316.#314647922411112 und EPI.X.Z.1317.#314409009789691 sowie Steine 11_11 und 20= Calcium: EPI.X.Z.1342.#308551911991820. Ende Vormagen (Kropf): EPI.X.Z.1359.#4692175050054
Der Hauptmagen (Corpus ventriculi) ist eine vertikale Stapelung mehrerer Kammern, weil ein großes Volumen als 5000 nicht verfügbar. Die Vertikale ist als 5555 darstellbar: Anfang Hauptmagen: EPI.X.Z.1380.#3000555549949440. Sichtbar sind Ringe als Einschnürungen aus Bindegewebe, die eine Anzahl von Kammern abteilen können. Beispielsweise sind 8 Kammern ablesbar, es werden aber auch bis 15 Kammern erwähnt. Bindegewebe 33_1: EPI.X.Z.1471.#281493314679145 und Einschnürungen 1_05: EPI.X.Z.1473.#281111110585895 sowie gestapelte Kammern EPI.X.Z.1498.#276419670155556. Die Magendrüsen setzen Salzsäure frei, die mit Cl=17 gesucht werden kann. EPI.X.Z.1505.#275133997271111. Im Inneren des vertikalen Magens steigen wellenartig Hautlamellen hoch, mit 77 als Universalwirkstoff, Form 7 und Nerv 7: Salzsäure 17: EPI.X.Z.1514.#273498458317717 und Lamellen: EPI.X.Z.15185.#272777777268131. Ende Hauptmagen als Übergang zum Nachmagen als Röhre 808: EPI.X.Z.1620.#255602880180878.
Die Milz ist in das kompakte Organ-Paket mit eingebunden. Milz: EPI.X.Z.1650..#250955555086680. Im Nachmagen wird durch Pylorus-Drüsen Schleim abgesondert. Anfang Nachmagen (Pylorusmagen) 50500: EPI.X.Z.1653.#250500100358755. Ende Nachmagen 500_99_33: EPI.X.Z.1670.#247950099337139.
Der Zwölffingerdarm (Duodenum) ist der 1. Abschnitt des Dünndarms. Mit der Zählgröße 11 sind eine Anzahl von Darmschlingen als Haut 33 darstellbar: EPI.X.Z.1682.# 246181133111191. Der Darm wird von der Zählgröße 11 mit der Ziffer 8 in Beziehung gesetzt. Der Darm ist dann kein Muskelschlauch 505, sondern geht allgemein als 808 weiter. Der Pottwal sammelt im Darm unverdauliche Tintenfisch-Hornsubstanz und bildet damit im Darm große Amber-Kot-Kugeln. Bei der Darmentleerung werden diese manchmal ausgeschieden. Amber wird als wertvolles Strandgut für Parfüm gefunden. Der Speiseplan der Pottwale wäre dann eine Vorgabe, wenn die Kot-Kugel als Zählgröße 11 zur Darstellung der Darmlänge dient. Die Amber-Kot-Kugel ist ein Extra 8_11_8: EPI.X.Z.1683.#246034857928118.
Die paarigen Nieren liegen unter der Wirbelsäule und sich bis weit nach hinten ziehen. Unten (ventral) wird die Harnblase ebenfalls weit nach hinten gezogen. Im Zwischenraum liegen andere Organe. Die Niere zeigt sich üblich als 5555 und ist von einem Gefäßsystem umgeben. Es werden Nährstoffe aus dem Blut resorbiert, und der restliche Harn zur Harnblase abgeleitet. Um Platz zu gewinnen, werden beide Episoden genutzt: Niere, paarig 2, 555 ab EPI.Y.Z.1970#212555956587915 und gleichzeitig Harnblase, unpaarig 1, mit Anschluss von 2 Harnleitern 101 ab EPI.X.Z.1970#210191200960925.
Weil die Wale das Meerwasser trinken, muss die Niere in der Lage sein, die Salzkonzentration abzubauen. Die Nieren bestehen daher aus einer erheblichen Zahl einzelner Nierenlappen (Renculus). Die Streckung der Niere muss die Evolution aus dem Meersalz (NaCl) mit Natrium= Ordnungszahl 11 ziehen. Die Reculi sind somit Zähl-Nieren, um die Streckung im Zeilenlauf zu realisieren. Die Doppelziffer 11 wird mit der 44 als Gruppe in Verbindung gebracht: EPI.Y.Z.1971#212448114905222. Über den Zeilenlauf #211, #210 und 20 kann sich das Organ entwickeln. Das Nierenende wird vorerst als 101 gezählt, wobei die 2 paarig enthalten ist. EPI.Y.Z.2105#198924101889878.
Die paarigen 2 Harnleiter (Ureter) 101 münden bereits weit vorn in die Harnblase ein: EPI.X.Z.1987#208392886710127. Gemäß bekannter Wal-Anatomie liegt der Ausgang an der Niere im Zeilenlauf etwas später: EPI.Y.Z.1993#210102977660909. Beim Delphin sind obere Niere und untere Harnblase kürzer, so dass der Harnleiter zunächst noch oben als 101 weiter läuft und erst später herabführt. Das Nierenende wird als 101 gesucht, wobei sich die 101 nur aus der Zählgröße 11 ableitet: EPI.Y.Z.2105#198924101889878.
Die Genitalfalte bildet sich bei beiden Geschlechtern 66/33 aus. Der Penis ist in der Genitalfalte angeordnet. Die Genitalfalte liegt, beim Männchen jedoch etwas weiter vorn, so dass der Abstand zum After im Vergleich zum Weibchen größer ist. Die männliche Genitalfalte beginnt folglich mit Bezug auf Hormon 33, Haut 33 und paarig 2 bereits bei EPI.X.Z.2300.# 180033332996966. Penis: EPI.X.Z.2361.#175381899997045; EPI.X.Z.2363.#175233459963192; EPI.X.Z.2364.#175159334134104; EPI.X.Z.2365.#175085270990707. Ende männliche Genitalfalte: EPI.X.Z.2379.#174054924713335 oder weiter bis EPI.X.Z.2475.#167303703391120.
Anfang der weiblichen Genitalfalte: EPI.X.Z.2455.#168666666351537. Seitlich der Genitalfalte bildet sich nur bei Weibchen beidseitig eine Zitzenfalte aus, die in den Zeilenlauf der Genitalfalte eingeschoben wird: Zunächst könnte nur die Hautfalte 33_6000 avisiert sein: EPI.X.Z.2479.#167033749856000. Mit #166 sind die folgenden Zeilen als #66 rein weiblich adressiert. Zunächst muss die Zitzenfalte paarig 66_9_66 entstehen: EPI.X.Z.2480.#166966397537509. Es folgt dann die Zitze selbst. Mit 99099 wird ein Kanal zum Herausschießen der Milch gebildet, denn die Walkälber saugen keine Milch (Wale sind keine „Säugetiere“): EPI.X.Z.2481.#166899099513512. Ende Zitzenfalte: EPI.X.Z.2480.#166029136284291.
Die großen Milchdrüsen erstrecken sich über den unteren Bauraum, so dass diese zweckmäßig in der Episode EPI.Y-Wal im Zeilenlauf als weiblich #666 mitgezogen werden. Für jede Zitze 1 steht ein Anschluss bereit: EPI.Y.Z.2512.#166693962769981 und EPI.Y.Z.2513.#166627630114681.
Ende der weiblichen Genitalfalte: EPI.X.Z.2530.#1636666663608790. Mit 9=Ende bildet sich der After als Öffnung 9000_5. After: EPI.X.Z.2559.#161811905390005.
Die rudimentären Beckenknochen geben keinen Hinweis auf die Vorfahren der Wale. Sie haben keine feste Verbindung zur Wirbelsäule und liegen unterhalb der mächtigen Lendenmuskulatur. Vom Pottwal wird auch der Oberschenkelknochen 22_5 gefunden: Die Becken der männlichen Wale sind größer als von weiblichen Tiere. Die Penismuskulatur oder die Mutterbänder setzen ventral an den Beckenknochen an. Wird der After zur Orientierung genutzt, liegt das Becken bei EPI.X.Z.2552.#162255746823285. Penis-Rückziehmuskel 555, vorderer Ansatz EPI.X.Z.2632.#157323961205556. Penis-Muskel 5555: EPI.X.Z.2662.#155550963896703. Penis-Rückziehmuskel 555, hinterer Ansatz als Zugband: EPI.X.Z.2724.#152010523455588.
Die Schwanzflosse steht beim Fisch senkrecht und liegt beim Wal als Fluke horizontal. Weil beim Wal eine Parallelepisode vorliegt, kann sich in EPI.X-Wal das Körperende im Zeilenlauf bis #122.. mit 22 als Knochen/Knorpel zigarrenförmig auslaufen. Zuvor legen sich dann seitlich beidseitige Hautlappen #33 als Fluke an, und reicht in Form der Fluke bis hinter den Körper. Die Fluke beginnt mit einer hauttypischen Zeilennummer 3300 und beginnt in beiden Episoden gleichzeitig: Räumliche 4 Struktur 5 Form 7777 auf der Hautoberfläche 4_33_4: EPI.X.Z.3300.# 125477777543340; Fluke seitlich 9, paarig 2, bewegliche 6 Fläche 4_6_4 als Extra 88: EPI.Y.Z.3300.#126889464993392. Körperende mit Auslauf der #22: EPI.X.Z.3394.#122002553297885. Gleichzeitig ragt die Fluke hinten hinaus und wird in der Form breiter ausladend gestaltet von EPI.Y.Z.3394.#123375142745490 bis EPI.Y.Z.3399.#123193655333390 als Wal-Ende 99. Ab Zeilennummer 3570 hätte der Zeilenlauf #115 unrealistisch ständig Wirbel geliefert.
BiXnom_Wale_dat20.06.2021
Zugabe für Freunde der BiXnom-Würfelkunde: Die Pferde (Equus):
Die Equus-Linie mit den heute lebenden 3 Unpaarhufern „Pferd, Esel, Zebra“ bildete sich evolutionär vor 4 bis 4,5 Millionen Jahren. Außer dem gezüchteten Hauspferd existiert von den 3 bekannten Wildpferdearten noch das Przewalskipferd. Vom Waldtarpan und Steppentarpan sind für Rückzüchtungen die genetisch vermischten Merkmale bekannt.
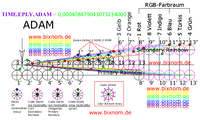
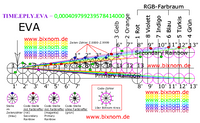
Die Episode EPI.X+Pferd.Z.1#414055050179860000 beginnt als Leitposition mit der 505 als klassische Öffnung. Diese ist als Maul eines Pferdes zu deuten, weil Augen/Ohren erst entfernt folgen. Die notwendige Hautstruktur 33 für die Lippen wird in der parallelen Episode ab Zeile 1 angeboten: EPI.Y+Pferd.Z.1#418700727347433000. Die Nullen am rechten Zeilenrand bauen sich im weiteren Zeilenlauf ab, womit sich die zugespitzte und gestreckte Kopfform des Pferds bildet. Wegen der breiten Front-Form 7007 sind die ausgerundeten Lippen als Form-Gruppe 4_7_4 dezimal vorgelagert ab Zeile 0,5 zu finden: EPI.Y+Pferd.Z.0,5#8374014546948660000. Die Episoden umrunden den Körper, so dass die Tasthaare am Maul erst am Ende des Zeilenlaufs entstehen.
Zähne: Die Zähne müssen bis zum Auge eingeordnet werden. Die Zähne bilden sich nicht einzeln, wenn im Zeilenlauf die 11 am rechten Zahlenrand steht, sondern beginnen insgesamt als Struktur 511. Im Zeilenrücklauf entstehen die Zeilen nochmals mit diversen Zusatzzeilen, so dass ggf. weitere Details zu finden sind.
Schneidezähne: Es sind 6 Schneidezähne oben und unten, geschichtet als 6_00_6_11, vorhanden: EPI.X+Pferd.Z.9.#46006116686651100. Die 11 ist doppelt mit weiteren Aussagen enthalten. Quersumme 4 + 66_8_66= 4+12+8+12= 36 Zähne (Stute). Die 66 ist mit Hormon 66 weiblich, der Hengst bekommt dann noch 4 Hengstzähne dazu (40 Zähne). Die Ziffer 8 ist die Minderung der Milchzähne 36-8= 28. Die Schneidezähne wachsen 1-3 mm im Jahr heraus, d.h. sie sollen sich abnutzen. Die Zeitsteuerung folgt mit der 60 und mit 4_1_4 als Zahngruppe. Der 1 mm ist Strukturerneuerung 55_05 enthalten. Primär ist „505“ der Zwischenkiefergang (Ductus incisivus). Der Gang endet mittig am Gaumen hinter den Schneidezähnen, auf einer kleinen Erhebung, und zwar beim Pferd im Oberkiefer (Mensch am Unterkiefer): EPI.X+Pferd.Z.10.#41405505017986000. Die Papilla incisiva bildet sich in der gleichen Zeile der Parallelepisode als Form-Hügel 7007. Beim Pferd und beim Menschen ist Gang mit einer Haut 33 verschlossen: EPI.Y+Pferd.Z.10.#418700727347433000.
Bevor mit der Doppelziffer 22 die Knorpelspangen der Luftröhre zählbar sind, bilden sich damit die paarigen Gaumenstaffeln (Rugae palatinae) als querverlaufende Schleimhautfalten im Bereich des harten Gaumens. Beim Menschen sind 3-5 und beim Pferd 16-18 paarige Gaumenstaffeln vorhanden. Es wird mit der zweiten Doppelziffer begonnen, weil vorn zunächst der obere Zahnbogen (Arcus dentalis superior) den harten Gaumen umgrenzt. Auf der 1. Gaumenstaffel sitzt die Papilla incisiva. Beim Pferd, Schwein und Wiederkäuer werden die Gaumenspalten durch eine mediane Längsfurche die als Gaumennaht (Rhaphe palati) durchzogen, die den harten Gaumen (Palatum durum) in zwei Hälften teilt. Die Gaumennaht 1 wird an der 2. Gaumenstaffel 22 als Extra 8_1_8 adressiert, so dass Hautfurche 1_33_818 wie „1331“ zu lesen ist: EPI.Y+Pferd.Z.15.#279133818231622000. Die 8. Gaumenstaffel 22 enthält EPI.Y+Pferd.Z.59.#70966224974141200 mit 4141 wie Gruppe 44 mit 11 Gaumenstaffeln bzw. 10 folgenden Gaumenstaffeln eine Erklärung für die schärfere Ausprägung der Gaumennaht (siehe Wikipedia: Gaumen – Wikipedia). Als Extra 8 endet die 18. Gaumenstaffel als Gruppe 44: EPI.Y+Pferd.Z.139.#30122354485426800. Die Doppelziffer 22 muss nunmehr an die Leitepisode EPI.X+Pferd zwecks Luftröhrenbildung zurückgehen. Dieses wird symbolisch dadurch realisiert, dass die Gaumennaht in der gleichen Zeile mit Null gestoppt wird 1331_0. Dieser Kunstgriff der Form 7 wird von der Biologie doppelt gefeiert 64_64: EPI.X+Pferd.Z.139#29788133106464700.
Beim Menschen ist das Jakobsche Organ (Organum vomeronasale) nur rudimentär ausgebildet. Säugetiere nehmen mit dem zusätzlichen Geruchsorgan Geschlechtsgerüche, Pheromone und unbekannte Gerüche wahr. Das Pferd nimmt die Witterung durch das sogenannte „Flehmen“ auf, indem die Oberlippen hochgeklappt werden, um den Bereich zwischen Zahnfleisch und Gaumen freizulegen. Die Nüstern werden dabei verschlossen, so dass statt der Nasenatmung eine kräftige Mundatmung erfolgt. Dabei strömen Duftmoleküle in den paarigen 2 Ductus vomeronasalis 303 ein. EPI.Y+Pferd.Z.11.#380637024861303000. Die ca. 2mm tiefen Einbuchtungen der Septumschleimhaut sind mit Rezeptoren ausgestattet. Aus dem Begriff „siebenfach transmembranären (heptahelikalen) G-Protein-gekoppelten Rezeptor“ ist als Symbolik die Ziffer 7 zu erwarten, die auch für den Nerv 7 gilt. Das Organ gehört zum olfaktorischen System, so dass die Weiterleitung schließlich über dem Nervus vomeronasalis und den Riechkolben (Bulbus olfactorius) als Riechnerv 1 erfolgt. Rezeptor: EPI.Y+Pferd.Z.12.#348917272789528000. Nervus vomeronasalis: EPI.Y+Pferd.Z.20.# 209350363673717000. Zum Jakobschen Organ gehört ein Venengeflecht (Venae vomeronasales) 888, das durch An- und Abschwellen einen Pumpmechanismus bewirkt: EPI.Y+Pferd.Z.23.#182043794498884000. Pumpmechanismus: EPI.Y+Pferd.Z.26.#161038741287474000. Die Riechschleimhaut 3_11_3 ist vor der letzten Gaumenstaffel angelegt: EPI.Y+Pferd.Z.136.# 30786818187311300. Der Riechkolben ist zunächst als Volumen erkennbar: EPI.Y+Pferd.Z.137.#30562096886674000. Verschaltung Nerv 7 auf den Hirnnerv 1: EPI.Y+Pferd.Z.143.#29279771143177100. Zurück zur Leitepisode EPI.X+Pferd.
Zahnaufbau: Die Zeit 60 ist enthalten. EPI.X+Pferd.Z.15.#27603670011990600. Der Zahnschmelz hüllt den Zahn nicht als Krone ein, sondern ist eingefaltet. Zahnschmelz als Calcium=20 in Zeile 20; eingefaltet als gespiegelte Form 7: EPI.X+Pferd.Z.20.#20702752508993000.
Knorpel/Knochen werden mit der Doppelziffer 22 adressiert. Der Oberkiefer ist etwas breiter als der Unterkiefer, was eine kreisende Kaubewegung ermöglicht. Oberkiefer: EPI.X+Pferd.Z.24.#17252293757494100. Unterkiefer: EPI.X+Pferd.Z.25.#16562202007194400. Der Unterkiefer gabelt sich zur linken und rechten Zahnreihe, so dass dazwischen die Zunge als längster Kopfmuskel Platz findet. Die Zunge ist als Muskel 5555 oder mit der Ziffer 6 als Flexibilität darstellbar. Alternativ ist die Zunge mit Ziffer 8 ein Extra oder ein Bestandteil des Verdauungsapparates. Die Ziffer 6 wird auf die 8 als Extra 888 spezifiziert mit 6_8_6: Epi.X+Pferd.Z.26.#15925194237686900. Beginn der unpaarigen 1 Zunge in einer Bedeutung als Haut-Muskel 5_33_5 zwischen den beiden Unterkieferästen 2_22 bzw. ist 222 die sehnige Mittelfurche auf der Zunge als Haut-Form 37_222_37. EPI.X+Pferd.Z.27.#15335372228883700.
Der Hakenzahn folgt dem Schneidezahn. Er ist bei Hengsten als Hengstzahn meist vorhanden, fehlt bei Stuten aber häufig. Die vorherige Zeile Nr. 45 aktiviert das Hormon 33 und nur indirekt 1_1 einen Zahn: #9201223337330210. Hakenzahn (Dens caninus) 11 oder Hengstzahn: 4 Zähne, die zweite 6 als 66 (weiblich) steht nur in der Zeilennummer und auch 33 ist nicht direkt vorhanden: EPI.X+Pferd.Z.46.#9001196743040430. Bis zu den Backenzähnen verbleibt eine Zahnlücke, in der sich jeweils 1 stiftförmiger Wolfszahn (Dens lupinus) 11_100 bildet: EPI.X+Pferd.Z.50.#8281101003597190. Mit 5_9 ist es wie ein Weisheitszahn eine blockierte Struktur; Zahn bricht ggf. ab. 4 Zähne als Extra 8: EPI.X+Pferd.Z.51.#8118726474114890. Je Seite sind 6 Backenzähne vorhanden (3 Prämolare + 3 Molare). Es bildet sich eine Backenzahn-Gruppe 11_444. Im Unterkiefer sind somit 6 + 6 =12 Backenzähne vorhanden. Wird 6_8_6 als Ober– und Unterkiefer gelesen, ergeben sich insgesamt 24 Backenzähne. EPI.X+Pferd.Z.54.#7667686114441840.
Das Auge: Der Augapfel (Bulbus) ist im Gewebe eingebettet und kann beim Pferd in die Augenhöhle (Orbita) zurückgezogen werden. Der Muskel „Oberlidheber“ (Musculus levator palpebrae superioris) als Muskel 55 am Oberlid 9_5_33 mit Wimpern-Funktion 5_1_5: EPI.X+Pferd.Z.74.#5595338515944050. Bewegliches Oberlid (Palpebra superior) als Haut 33 plus Wimpern 3_1: EPI.X+Pferd.Z.77.#5377338314024150 und EPI.X+Pferd.Z.79.#5241203166833660. Pigmentierter Lidrand 1_7 durch Melanin 88: EPI.X+Pferd.Z.81.#5175688127248240. Die Lid-Pigmentierung 88 wird durch die Ziffer 2 als Alternative blockiert, wenn ein weißer Farbfleck zwischen den Augen oder weiße Haare in Augennähe als Form 272 vorhanden sind. Die Ziffer 2 für „Weiß“ ist bisher nur als Knochen 22 und Calcium=20 bekannt. Der weiße Nasenstreifen des Fells mit 88 als Farbstoff Melanin, vertikal als Streifen gezogen als 888 und als Farbblockade 222 für weiß liegt bereits vorn an der Nase vor: EPI.X+Pferd.Z.27.#1533537222888370. Wimpern 111 am Oberlid: EPI.X+Pferd.Z.81.#5111790742961230.
Unter dem Oberlid liegen die Tränendrüsen und produzieren Tränenflüssigkeit: EPI.X+Pferd.Z.54.#5241203166833660 und EPI.X+Pferd.Z.81.#5111790742961230. Unterlid (Palpebra inferior) „unflexibel“ 606: EPI.X+Pferd.Z.54.#4814593606742550. Das „Drittes Augenlid (Palpebra tertia)“ als Nickhaut (Membrana nictitans) im nasenseitigen Augenwinkel. Zieht sich im Halbschlaf etwa zu: EPI.X+Pferd.Z.89.#4759253450343210.
Die mehrschichtige, gewölbte Hornhaut (Cornea) ist als vordere Begrenzung des Augapfels glasklar durchsichtig und ca. 0,9 mm dick. Mit Haut 33 und 303 als durchsichtig: EPI.X+Pferd.Z.89.#4652303934605160. Als dezimale Wiederholung der Zahn-Zeile 9 ergibt sich die Regenbogenhaut (Iris). Die Iris trennt die vordere und hintere Augenkammer und wirkt durch variable Größe als Blende. Das vordere und hintere Blatt der Iris mit der stark durchblutete Irisstroma dazwischen 66_8_66. Beim Pferd wird die querovale Pupille sichtbar. Oben an der Pupille sind Traubenkörner (Granula iridica) 11 eingelagert, die gegen Lichteinfall als Blendschutz dienen: EPI.X+Pferd.Z.90.#4600611668665110. Nach hinten geht die Iris in den Strahlenkörper (Ziliarkörper) über. In seinem Zentrum ist die Linse an kleinen Fädchen (Zonulafasern) aufgehängt. Ziliarkörper 55_00_55: EPI.X+Pferd.Z.91.#4550055496481970. Bikonvexe Linse (Lens crystallina): Statt rund 505 ist 5005 queroval. Wegen 2= Sehnerv 2 ist 202=durchsichtig mit 1 als Aufhängeapparat (Zonulafasern / zonula Zinnii): EPI.X+Pferd.Z.91.#4500598371520210. Der wasserhaltige Glaskörper (Vitreum) bildet eine stabile Struktur 55: EPI.X+Pferd.Z.100.#4140550501798600.
Die Netzhaut (Retina) ist die innere Schicht des Augapfels und schließt vorn am Ziliarkörper an. Der Zeilenlauf ist weitläufig, weil auch das Gehirn irgendwo eingeordnet werden muss. In der Mitte der Netzhaut liegt der Bereich des scharfen Sehens (Area centralis striaeformis) als Balken 888 quer über der Linse [beim Menschen punktförmig als Fovea centralis]. In diesem Bereich oberhalb der Sehnerveneinmündung liegen nur tageslichtempfindliche Zapfen. Pferde können mit nur 2 Zapfentypen fast das sichtbare Farbspektrum des Menschen wahrnehmen. Durch die seitliche Lage des Auges verbleibt nur ein schmaler toter Sichtwinkel, und zwar ca. 1° vorn an Nüstern und ca. 5° hinten am Schweif. Zum binokularen Sehen wird der Kopf zum Fokussieren entsprechend gedreht. Seitlich ist räumliches Sehen bis max. 90° monokular möglich: EPI.X+Pferd.Z.125.#3312440401438880.
Netzhaut (Retina) 5555: EPI.X+Pferd.Z.145.#28555520702059300. Zapfen: Die 2 Zapfentypen 3_599_3 und 3_494_3 könnten durch 2 Wellenlängen markiert sein. Tatsächlich wird das Farbwahrnehmungsspektrum vermutet von 324 bis 657 nm mit zwei Absorbtionsmaxima bei 539 nm und 428 nm: EPI.X+Pferd.Z.146.#2835993494382600. Die Folgezeile wird den Stäbchen 1 für die Schwarz-Weiß-Kontraste zugewiesen: EPI.X+Pferd.Z.147.#2816701021631700. Sehnerv 202, paarig 2: EPI.X+Pferd.Z.148.#2797669257972020. Die stark durchblutete Aderhaut (Choroidea) liegt hinter der Netzhaut (Retina): EPI.X+Pferd.Z.157.#2637293313247510. Lederhaut (Sklera) ist die der äußere Schicht des Augapfels EPI.X+Pferd.Z.168.#2464613393927740.
Riechschleimhaut der Nase [Riechnerv ist der 1. Hirnnerv] von EPI.Y+Pferd.Z.112.#3738399351316370 bis EPI.Y+Pferd.Z.121.#3460336589648210. Der Riechkolben entwickelt sich als Netzwerkgruppe 44 bis zu einer Struktur 55 von: EPI.Y+Pferd.Z.123.#3404070954044170 bis EPI.Y+Pferd.Z.126.#3323021645614550.
Ohr, beweglich 6, paarig 2, Form 7 dreieckig 3 spitz, Haut 33 räumlich 4, oben 9: EPI.Y+Pferd.Z.153#2736606061094330. Das nach vorn gerichtete Ohr signalisiert Freundlichkeit; mit zunehmend eng nach hinten gestellten Ohren wächst Angst und Aggression. Richtungsorientierte 9 Form 9_7_9: EPI.Y+Pferd.Z.156#2683979021457910. Gespitztes Ohr zum Sichtfeld (Sehnerv 2) ausgerichtet 9: EPI.Y+Pferd.Z.157#2666883613677920. Gehörgang: EPI.Y+Pferd.Z.158#2650004603464770. Trommelfell: EPI.Y+Pferd.Z.159#2633337907845490. Mittelohr: EPI.Y+Pferd.Z.161#2600625635698340.
Anders als beim Menschen zeigt sich in der Parallelepisode EPI.Y+Pferd die Folge von Nase, Ohren und Rippen und Extremitäten nicht sofort an. Weiterhin sind in der Kürze des Zeilenlaufs die Gehirnstrukturen nicht zu unterscheiden, wie Großhirn (Cortex), Kleinhirn (Cerebellum), Stammhirn (Medula), Mittelhirn, Hirnanhangdrüse (Hypophyse), Vorderhirn (Riechkolben).
Der Fluchtimpuls des Pferdes wird über den paarigen Mandelkern (Amygdala) ausgelöst, der auf die Informationen von Riechkolben und Augen blitzartig reagiert. Der Mandelkern ist zunächst nicht erkennbar, so dass zur Findung auf den zehnzeiligen Mandelkern des Menschen Bezug genommen wird. Diese 10 Zeilen haben die letzte Zeile des Hippocampus als Referenz. Um eine Flucht auszulösen, muss bereits die Referenzeile eine mathematische Folge enthalten. Hippocampus als Nerven-Struktur 7_555 mit Nervensystem 4_7_4: EPI.Y+Pferd.Z.199#21040237555147400. Referenz 45_45_45: EPI.Y+Pferd.Z.204.#20524545458207500. Mandelkern 5000 als paarige 2 Gruppe 44: 1. Zeile: EPI.Y+Pferd.Z.205.#20424425724265000. Die Zeitdifferenz enthält Testosteron 33 als Erregungsschwelle „199267431633081“. 9. Zeile: EPI.Y+Pferd.Z.213.#19657311143072000 ergibt als Zeitdifferenz den Fluchtimpuls als Aktivierung der Arterie 5x 9 mit Eisen=26 als Blut / Calcium=20 als Knochen / Selen=34 als Zellaktivität: „959090909262034“. 10. Zeile: Körper 5-5-5-5-5-5: EPI.Y+Pferd.Z.214.#19565454548945500. Zeitdifferenz: „1050093023443180“.
Beim Menschen erfolgt die Blutverteilung im Gehirn über ein hexagonales Ring-Gefäßsystem, so dass das Gehirn als 6666 zu identifizieren ist. Beim Menschen wird durch den aufrechten Gang über Augenhöhe die Ziffer 2 des Sehnervs (2. Hirnnerv) für die Darstellung des Gehirnbalkens (Corpus callosum) zur Koordinierung beider Gehirnhälften frei. Trotzdem ist die vielfältige Ziffer 2 (2 rechts, 2 männlich, 22 Knochen/Knorpel) auch in einer Gehirngruppe 444 zur Koordination 2_44_2 vorhanden. Die beiden Gehirnhälften sind nunmehr als symmetrischen Struktur 5 sichtbar 96_5_96: EPI.Y+Pferd.Z.227#1844496596244200. In der Gehirngruppe ist auch die 6666 enthalten, inclusive Nerv 7, Arterie 9 und Vene 8. Weiterhin wird die biologische 64 als Sieg über die Gravitation gefeiert: EPI.Y+Pferd.Z.237#1766669735643180.
Ergänzung aus dem sekundären Zeilenlauf:
Die nach der Bildung des Mandelkerns bis zur Wirbelsäule verbleibende Zeilenanzahl ist zur Ausbildung des Gehirns nicht ausreichend, so dass es erst im Zeilenrücklauf vollendet werden kann. Zunächst müsste dort das mit Gehirnwasser gefüllte Ventrikel-System mit seinen Hohlräumen 000 zur Raumorientierung gesucht werden. Weiterhin kann das Mittelhirndach (Tectum mesencephali) mit der Vierhügelplatte (Lamina quadrigemina) gefunden werden. Die 4 Hügel sind in 2 Reihen angeordnet. Die Vierhügelplatte mit 2 mundwärts liegenden Hügeln (Colliculi rostrales) [beim Menschen die oberen Hügel (Colliculi superiores)] und mit 2 mundfernen, hinteren Hügeln (Colliculi caudales) [beim Menschen die unteren Hügel (Colliculi inferiores)] sind beim Menschen als Form 7777_4_2 dargestellt, so dass beim Pferd eine Ähnlichkeit erwartet wird: Vierhügelplatte Mensch: Z.34769.# 177759999477772 (Vierhügelplatte); Vergleichszeile Pferd: EPI.Y+Pferd.Z.9227#453777747206495 (mögliche Vierhügelplatte). Mit 9999 für "oben" ist der aufrechte Gang des Menschen mathematisch vorgegeben.
Nach der Vierhügelplatte (beim Menschen oberhalb) folgt die unpaarige Zwiebeldrüse (Glandula pinealis) in der Hinterwand des 3. Hirnventrikels. Es ist keine spezielle Zeile zu erkennen, aber es sind die 88 für die Produktion von Melatonin und 33 für ein Organ aus Bindegewebe vorhanden. Die Zapfenform ist als Dreieck erkennbar: EPI.Y+Pferd.Z.9234#453433752812901 und EPI.Y+Pferd.Z.9235#453384653326944. Die Drüse enthält Hirnsand 11 aus Verbindungen von Magnesium 12 oder Calcium 20. Die 12 und 20 sind in den Folgezeilen enthalten bzw. auch direkt als Quersummen. Calcium: 5_QS 313931= 20_5; Magnesium 0_QS 75=12: EPI.Y+Pferd.Z.9240#453139315311075. Der Hirnsand ist beim Menschen im Alter von ca. 35 Jahren im Röntgenbild sichtbar. Die endokrine Drüse enthält zur Abgabe des Hormons viele Blutgefäße (99_99 Arterie, Vene 8): EPI.Y+Pferd.Z.9243#452992239908507. Kontakt Melatonin 88 zur Arterie 9_88: EPI.Y+Pferd.Z.9244#45294323598813. Die Drüse wird durch bindegewebige 33 Septen (Trennwand) in Läppchen 5_66_5 gegliedert: EPI.Y+Pferd.Z.9241#453090279566533. Eine bindegewebige Kapsel 5_33_5 umhüllt die Drüse außen 99: EPI.Y+Pferd.Z.9249#452698375335099.
Der Ausgang 505 des mit Liquor gefüllten Verbindungskanal vom 4. Hirnventrikel zum 3. Hirnventrile (Aquaeductus mesencephali): EPI.Y+Pferd.Z.9251#452600505185854. Direkt am Ausgang liegt die kleine ependymale Drüse (Organum subcommissurale), die sich als Struktur von 55 zu 55 im Zeilenlauf durchzieht von EPI.Y+Pferd.Z.9252#452551585978635 bis EPI.Y+Pferd.Z.9259.#452209447399755. Von den beiden Zellschichten liegt oben das Ependym aus sehr hohen, zylindrischen 0 Zellen, so dass eine räumliche 4 Struktur 404 (Z. 9255) vorliegt, die ihr Sekret in den ventrikulären Liquor cerebrospinalis entleert. Darunter liegt das Hypendym 303 (Z. 9258) mit Gliazellen und Blutgefäßen.
Nach Thalamus und Hyperthalamus wird der Hypophysen-Stil als 505 gesucht: EPI.Y+Pferd.Z.9294#450506485202747. Die Hypophyse (Glandula pituitaria) liegt bei den Haussäugetieren am Boden des Zwischenhirn. Beim Pferd ist die Drüse an der Fossa hypophysialis eine Knochengrube 500_222 des Keilbeins befestigt. EPI.Y+Pferd.Z.9304#450022277888471.
Die Struktur 5000 der Sehbahnkreuzung (Chiasma opticum) liegt hinter den Augen direkt vor der Hypophyse. Chiasma opticum: EPI.Y+Pferd.Z.9409.#445000241627626. Im Zeilenlauf #44 kann beim Pferd der Raum 4 bzw. das Viereck X der Kreuzung, die Gruppe 44 von Nervenfasern 111 als auch deren Kreuzung 4444 gebildet werden. Der Sehnerv 2 wird von der harten Hirnhaut (Dura mater) schützend umhüllt 95_2_95: EPI.Y+Pferd.Z.9410.#444952951485051.
Der Sehnerv (Nervus opticus) 2 ist beim Mensch und Pferden ein Bündel von ca. 1 Mio Nervenfasern, die am Chiasma opticum zur gegenüberliegenden Hirnhälfte wechseln (Sehbahnkreuzung), und zwar beim Pferd i.M. zu 80% (75-85%). Der Mensch ist mit 50% Kreuzungsanteil weniger einseitig orientiert. Wird beispielsweise das Bündel (Gruppe) 44 der Sehnervfasern zu 20 % / 80% als 2_44_8 aufgeteilt [EPI.Y+Pferd.Z.9411.#444905671392448], sind nach dem Seitenwechsel in der Folgezeile nur noch die 80 % als 44_8 vorhanden, d.h. 20% bleiben auf der Augenseite [EPI.Y+Pferd.Z.9412.#444858401346614].
Der Kreuzungsbereich ist durch den Seitenwechsel von 444_44 der Nervenfasern 111 [EPI.Y+Pferd.Z.9413.#444811141344346] zu 44_444 [EPI.Y+Pferd.Z.9431.#443962175111264 und EPI.Y+Pferd.Z.9442.# 443444955885864] weitläufig umgrenzt.
Bevor das Großhirn erreicht wird, ist als Zwischenebene der Balken (Corpus Callosum / CC) als Querverbindung beider Großhirnhälften zu durchlaufen. Für das Pferd liegen momentan keine Informationen vor, so dass nur die Zeilenposition gesucht wird, die ab #270... (2=paarig / 7=Form) vermutet wird. Mit der Ziffer 2 ist das Spiegelbild für die Querverbindung folglich stets vorhanden. Soll aber ein Element direkt auf dem Balken (CC) gebildet werden, wäre die 2 als „paarig“ störend. Daher muss die 2 dann als „rechts“ gelesen werden. Beim Pferd gibt es daher eine rationale und emotionale Seite, die beim Fluchttier wichtiger ist und daher auf „2=rechts“ liegt. Weil der visuelle Eindruck in der gegenüberliegenden Gehirnhälfte verarbeitet wird, betrachtet ein Pferd gefährliche Situationen vorzugsweise mit dem linken Auge. Vergleichsweise sind beim Pferd weniger querverlaufende Kommissuren-Fasern zu erwarten, weil Pferde auf dem Rückweg vor Objekten erschrecken können, die sie auf dem Hinweg bereits gesehen hatten.
Das Corpus Callosum zieht sich quasi als Boden einer „Gletscher-Spalte“ (Gehirnlängsspalte) durch das Gehirn, die erst etwas zurückgesetzt beginnt. Der CC bildet das Dach der beiden Seitenventrikel. Beim Gehirnzugang müssen zunächst die 3 Hirnhäute 33 (EPI.Y+Pferd.Z.15474#270583383318750; EPI.Y+Pferd.Z.15484#270408633006609; EPI.Y+Pferd.Z.15488#270338796066266) passiert werden.
Das vordere Faserpaket liegt in den auskragenden beiden Gehirnhälften, so dass es beim mittleren Durchgang durch den CC konvex (u-förmig) geformt ist. Das gespiegelte Faserpaket ist damit als 111 am rechten Zahlenrand zu erwarten: EPI.Y+Pferd.Z.15496#270199230348111. Vorn am Gehirn kragen die beiden Gehirnhälften aus, so dass zentral noch kein Gehirn vorhanden sein kann, was mit den Nullen #270 gekennzeichnet wird. Der CC „727“ beginnt somit erst ab EPI.Y+Pferd.Z.15508#269990151758727. Die neben der Spalte beidseitig aufsteigenden Spaltenwände 1 sind mit 1_5_1 enthalten und werden als Stirnwölbung mit der 99=oben über einige Zeilen bis zu einer Wandstruktur #99_55_7 weitergeführt: EPI.Y+Pferd.Z.15516#269850945699557.
Die Gehirnlängsspalte des CC muss zunächst eine Hautoberfläche 33 mit Gefäßen bilden: EPI.Y+Pferd.Z.15517.#269833555034758. Die vorderen Kommissurenfasern werden nunmehr als Faserbündel 11, flexibel 6, quer 2 zur Gegenseite durchgeführt: EPI.Y+Pferd.Z.15518.#2698161666113120. Vene 8 (Sinus sagittalis inferior): EPI.Y+Pferd.Z.15519.#269798780428786. In der Draufsicht der Gehirnlängsspalte ziehen sich 3 Doppelstreifen 11 auf der Oberfläche durch: EPI.Y+Pferd.Z.15524.#269711883114811.
Das Corpus callosum (CC) gliedert sich nach seiner Form in Rostrum (Schnabel), Genu (Knie), Truncus (Stamm) und Splenium (Hinterende). Der CC beginnt vorn punktförmig 0_555 mit der Knie-Wölbung und dann innenseitig wieder punktförmig 9_555 mit der Rückseite des Knies von EPI.Y+Pferd.Z.15528.#269642405556049 bis EPI.Y+Pferd.Z.15533.#269555608927724. Der Schnabel (Rostum) [EPI.Y+Pferd.Z.15555.#269174366665017] zieht im Zeilenlauf tief herunter, so dass im Scann die Öffnung (Foramen interventriculare) 505 vom Seitenventrikel zum 3. Ventrikel erkennbar wird: EPI.Y+Pferd.Z.15604.#268329099812505.
Das mittlere Faserpaket 111111 zeigt sich ebenfalls nicht als weitläufiger Zeilenbereich, sondern nur als Einzelzeile: EPI.Y+Pferd.Z.15999#261704311111590. Beim Menschen liegen im CC ca. 200 000 000 Kommissurenfasern, so dass 5x 1 die Zehnerstelle bezeichnen könnte, d.h. 59 000 000 mittlere Kommissurenfasern beim Pferd. Das hintere Faserpaket wird die 111 auf der linken Zahlenseite zeigen, um das Ende am Splenium zu symbolisieren: EPI.Y+Pferd.Z.16035.#261116761675980.
Nach einigen Gehirn-Details weiter mit dem primären Zeilendurchlauf:
Ohrspeicheldrüse: EPI.Y+Pferd.Z.239#1751885888482980.
Luftsäcke: Die paarigen Luftsäcke weiten die Verbindung zwischen Mittelohr und Rachenraum und entstehen als eine Erweiterung der Ohrtrompete. Dieses vorgelagerte Luftsystem dient nicht der Atmung, sondern der Verdauung. Die Tubenschleimhaut im Mittelohr produziert ein Sekret, dass durch den Luftsack in den Rachen läuft. Die tiefe Kopfhaltung beim Fressen unterstützt den Speichelfluss. Entsprechend beginnt im Rachen eine Verbindungsröhre 202 zum Luftsack von EPI.X+Pferd.Z.188.#2202420479680100 bis EPI.X+Pferd.Z.204.#2029681618528720. Luftsack 200 von EPI.X+Pferd.Z.232.#1784720043878700 bis EPI.X+Pferd.Z.250.#1656220200719440.
Schlund: Als Schlund wird nicht immer die gesamte Speiseröhre bezeichnet, sondern nur der Anfang im Rachenraum. Entsprechend ist hier noch kein Muskelschlauch 505, sondern nur allgemein eine Verdauungsröhre 808 zu finden. Pferde zählen die Anzahl der Kauschläge [80x/min] über eine Gehirnverschaltung (Nerven 77) zur Steuerung der Sättigung. Das stellt sich als ein Sanduhr 808 dar, die mit 888 voll ist und die Zählgrößen 1-10 (190) enthält: EPI.X+Pferd.Z.217.#1908087788847280.
Der Pferdekopf besteht aus 29 Knochen, die sich teils paarig symmetrisch links und rechts ausbilden. Beispielsweise Zwischenkieferbein, Nasenbein, Oberkieferbein, Jochbein, Tränenbein, Stirnbein, Schläfenbein, Scheitelbein und Hinterhauptsbein. Das Kieferngelenk fügt 2 Knochen #225 als Walzengelenk zusammen: Schläfenbein (Os temporale) 225_9 mit seitlich 9: EPI.X+Pferd.Z.318.#1302059906225970 und Unterkiefer (Os mandibulare): EPI.X+Pferd.Z.338.#1225014941360530. Daher muss dann dazwischen die extreme Struktur 5 das gesuchte inkongruente Walzengelenk sein. Es ist paarig 2 und die Gelenkfläche wird durch einen Faserknorpel 33 in 2 Gelenkflächen unterteilt: EPI.X+Pferd.Z.337.#1228650000533710. Das paarige 2 Zungenbein (Os hyoideum) bildet den letzten Knochen #225 vor den Halswirbeln. Mit 777 wird die lange vertikale Knochenform 7 und die Zunge 66 symbolisiert: EPI.X+Pferd.Z.355.#1166352254027770.
Ergänzung aus dem sekundären Zeilenlauf:
Das Kleinhirn (Cerebellum) ist beim Pferd gegenüber dem Menschen funktionell bedeutender. Es ist Teil des Rautenhirns (Rhombencephalon), das sich in das Myelencephalon (Medulla oblongata) und das Metencephalon gliedert. Das Kleinhirn löst keine Körperbewegungen aus, ist aber als Steuerzentrale notwendig. Im BiXnom-Zeilenlauf wird sich das Kleinhirn nach dem Corpus Collosum bilden. Zur Abgrenzung kann nachfolgend das Rückenmark (Medulla spinalis) gebildet werden, weil es aufgrund der Wirbelkanals erkennbar ist.
Der hintere Teil des Gehirns (Medulla oblongata) zieht sich in der hinteren Schädelgrube (Fossa cranii posterior) durch die Knochenöffnung (Foramen occipitale magnum) und geht in das Rückenmark über. Foramen magnum 5000 mit Nervengruppe 44_7: EPI.Y+Pferd.Z.16213.#258250001447871.
Anzunehmen ist, dass im Foramen magnum mit „787“ der Nerv 7 die Ziffer „8“ als graue Substanz markiert. Es ist damit möglich, die innere Schmetterlingsform des Rückenmarks zu beschreiben. Im Unterschied zum Gehirn umhüllt die weiße Substanz die graue Substanz (Substantia grisea). Die äußere weiße Substanz (Substantia alba) wird als Ziffer „2“ angenommen: EPI.Y+Pferd.Z.16216.#258202224560578. Die H-Schmetterlingsform benötigt eine paariges 2 Seitenteil 9999 (Substantia intermedia lateralis) für die „H-Form“: EPI.Y+Pferd.Z.16225.#258058999905968. Der Mittelbalken in der „H-Form“: EPI.Y+Pferd.Z.16235.#257900047642398. Die graue Substanz 8_0_8 mit der „Null“ als Zentralkanal (Canalis centralis) wird mit dem Nerv 7 aktiviert: EPI.Y+Pferd.Z.16252.#257630277718086. Die Auffälligkeiten vor und nach dieser Mittelzeile können die beiden Enden der H-Form beschreiben. Das dünne Dorsalhorn (Cornu dorsale) 100 ist schlank: EPI.Y+Pferd.Z.16247.#257709563210090. Vergleichsweise ist das plumpere Ventralhorn (Cornu ventrale) 500 voluminös: EPI.Y+Pferd.Z.16258.#257535199500205. Im Brust- und Lendenmark ist als Besonderheit am Seitenteil (Substantia intermedia lateralis) ein kleines Seitenhorn (Cornu laterale) 59959 angeschlossen: EPI.Y+Pferd.Z.16250.# 257661986059959. Der Nerv 7 ist mit der flexiblen Lage 66 verbunden. Die „6“ markiert nachfolgend die 4 (Raum/Viereck/Gruppe), so dass die örtliche Lage auffindbar wird. Mit 13_13 kann zunächst der Bereich vom 3. Brustwirbel bis zum 3. Lendenwirbel vermutet werden: EPI.Y+Pferd.Z.16251.#257646130913441. Die Ziffer „4“ hat eine Bedeutung, weil die graue Substanz außer einer zweidimensionalen H-Form auch als vierfach kannelierte (4 konkave Furchen) Säule 88_444_1_88 betrachtet werden kann: EPI.Y+Pferd.Z.16256.#257566884441088. Das Rückenmark enthält eine Teilungslinie. Ventral reicht eine ventrale Medianspalte (Fissura mediana ventralis) fast bis zum Zentralkanal. Dorsal ist eine seichte Medianfurche (Sulcus medianus dorsalis) 2000_33 vorhanden, die aufgrund der äußeren weißen Substanz 2 und der Hautmembran 33 erkennbar ist: EPI.Y+Pferd.Z.16274.# 257282000336385.
Weil die 2=paarig aber auch 2=rechts bedeutet, wird die Kombination mit dem Nerv 7 als weitläufiger Übergang #2572 [EPI.Y+Pferd.Z.16273.#257297810697126] zu #2527 [EPI.Y+Pferd.Z.16569.#252701265826201] zu einer Nervenbahnkreuzung 72-27 entwickelt [Pyramidenbahnkreuzung (Decussatio pyramidum)], mit der die Körperhälften zur Gegenseite ins Gehirn projiziert werden. In diesem weitläufigen Zeilenbereich werden auch die Rückenmarkshäute des Spinalkanals avisiert.
Das Rückenmark kann sich als Struktur 5_555 entwickeln, wozu sich die 3 gesuchten Rückenmarkshäute von 555 zur 33 spezifizieren müssen. EPI.Y+Pferd.Z.16384.# 255554643156392. Das Rückenmark hat eine quer-ovale Form. Die wird durch die mit 55 verstärkte Strukturblase 5_505 erzeugt: EPI.Y+Pferd.Z.16391.#55445505062189. Am Rückenmarksende am Kreuzmark bildet sich abweichend eine längs-ovale Form. Beim 2. Kreuzbeinwirbel entfällt rechts die Struktur-5, die dann eine Zeile tiefer entsteht und eine lotrechte Streckung verursacht: EPI.Y+Pferd.Z.16782.#249493938355043 und PI.Y+Pferd.Z.16783.#249479072482532.
Ein Bezug zu den Rückenmarkhäuten 33 entsteht, indem eine Zählgröße 111_33 als Längsspalte (Fissura mediana ventralis) 111 auf der Ventralseite des Rückenmarks gebildet wird. Diese Spalte halbiert das Rückenmark fast bis zum Mittelpunkt und trennt dabei die beiden Vorderstränge des Rückenmarks: EPI.Y+Pferd.Z.16393.#255414339869111. Weil sich die 111 wiederholt, muss es sich um eine Faserbündel handeln, das am Boden der Spalte, d.h. zentral im Rückenmark als Commissura ventralis alba liegt: EPI.Y+Pferd.Z.16494.# 253881110445933.
Der paarige Rückenmarksnerv (Nervus spinalis) entsteht aus der Vereinigung der sensorischen Dorsalwurzel (Radices dorsales) und der motorischen Ventralwurzel (Radices ventrales). In die Dorsalwurzel ist als Besonderheit ein Spinalganglion (Ganglion spinale) 777_500 eingefügt: EPI.Y+Pferd.Z.16434.#254777125074500. Die Wurzeln bilden sich aus einer Anzahl von Wurzelfäden (Fila radicularia). Aus dem Rückenmark 88 treten 4 - 10 Dorsalwurzeln aus: EPI.Y+Pferd.Z.16419.#255009883273910 und EPI.Y+Pferd.Z.16423.#254947772847490. Aus dem Rückenmark 88 treten 4 - 7 Ventralwurzeln aus: EPI.Y+Pferd.Z.16485.#253988915588373 und EPI.Y+Pferd.Z.16487.#253958104777966. Die beiden Wurzeln 57_57 laufen als Nervenstrang 9119 zusammen: EPI.Y+Pferd.Z.16490.#253911902575763. Nervus spinalis: EPI.Y+Pferd.Z.16491.#253896505577244.
Das Spinalganglion in EPI.Y+Pferd.Z.16434 ist ein Referenzpunkt, um aus der Zeitdifferenz zu den Codezeilen der Dorsalwurzel die sensorischen Meldungen an das Gehirn mitzulesen. Die ersten 3 Meldungen zum Nerv 7 entsprechen bereits den Erwartungen: 1.) Richtungserkennung: Links 1_7 und rechts 7_2 müssen zusammen enthalten sein, weil das paarige Ganglion erst links und rechts angelegt sein muss, um eine Seitenrichtung konkret zu definieren. Übt der Reiter einen wechselseitigen Druck mit seinen Unterschenkeln aus, wir das Pferd nach vorn getrieben, d.h. die Reaktion weicht der Druckaktion aus. Der Schenkeldruck des Reiters kann nur wirken, wenn das Hinterbein gerade entlastet ist (99=abgehoben). Mit „64“ wird die Struktur-5 als seitenverkehrte motorische Reaktion eingeschlossen: Delta „Z.16423 - Z.16434“: #17064777299. 2.) Raumerkennung: Mit 4_9_4 ist der seitliche Raum markiert: Delta „Z.16424 - Z.16434“: #155124893494. Der tote Winkel (ohne Kopfbewegung) ist enthalten mit einem Sichtbereich von „177“ Grad, so dass am Schweif ein toter Winkel von 2*3=6° entsteht. Für das Auge wird noch 808 spendiert: EPI.Y+Pferd.Z.16428.#254870177348084. Seitlich sieht das Pferd monokular (einäugig) unscharf. Bis 1 m vor den Nüstern ist liegt ein toter Winkel, ansonsten sieht das Pferd nach vorn binokular (beidäugig) dreidimensional scharf. Der halbseitige Winkel ist die Quersumme am Auge 0 als QS=1+7+7+3+4+8=30°, d.h. Sichtfeld = 60°.
3.) Körpertemperatur: Die normale Körpertemperatur beträgt 37-38°C. Hohes Fieber sind 39°, bei 40°C ist der Tierarzt zu rufen und 41°C sind lebensgefährlich: Delta „Z.16425 - Z.16434“:#13960390415. Die Normaltemperatur von 37° ist als Regelgröße 2_37_2 markiert: EPI.Y+Pferd.Z.16430.#254839152372144.
Die Extremitäten des Pferdes durchlaufen bei der Fortbewegung einen Bewegungszyklus aus einer Stützbein- und einer Hangbeinphase, wobei alle 4 Gliedmaßen das Stützen, Abwinkeln und Schwingen ausführen. In der Stützbeinphase beginnt eine neue Vorwärtsbewegung: 1.) Fußung [Auffußen (landing) = Fuß auf den Boden setzen], 2.) volle Stütze, 3.) Abwinkeln. Die Hangbeinphase beginnt mit dem Abheben [Abfußen (liftoff) = Fuß hebt vom Boden ab] und setzt sich als Schwingen an der gegenüberliegenden Körperseite vorbei fort. Den Pferden sind die 3 Gangarten Schritt, Trab und Galopp angeboren. Die Gangarten Tölt und Rennpass sind erlernbar bzw. bei den Gangpferderassen genetisch bedingt angeboren.
Die Gangart „Schritt“ erfolgt gleichseitig, aber nicht gleichzeitig. Die Beine einer Seite werden nacheinander vorgesetzt und dann erst auf der anderen Seite. Die 4 Beine durchlaufen dabei einen regelmäßigen Viertakt, der im Detail aus 8 Phasen besteht. Im Zeilenlauf beider Episoden wird eine momentane Lageposition der 4 Hufe als Nervenpuls 77 abgebildet. Auf der linken Körperseite mit der Leitepisode EPI.X+Pferd stehen die Beine weiter auseinander als auf der rechten Körperseite mit der Episode EPI.Y.Pferd. Hier stehen die Beine engen zusammen und bilden in der Seitenansicht hoch zum Rumpf eine V-Form. Reihenfolge im Zeilenlauf: 1.) „links vorne“: EPI.X+Pferd.Z.16503.#250896837047724, 2.) „rechts vorne“: EPI.Y+Pferd.Z.16506.#253665774474393, 3.) „rechts hinten“: EPI.Y+Pferd.Z.16509.#253619678567710, 4.) „links hinten“: EPI.X+Pferd.Z.16511.#250775271140367. Die Körperseiten sind nur beispielhaft genannt, denn die gespiegelte Schrittphase wird durch den Begriff „paarig= 2“ abgedeckt. Für die Gangart ist die Ziffer #2 stets links an 1. Stelle in der Episode EPI.Y+Pferd enthalten. An 3. Stelle steht die Ziffer 3 für 3 Füße auf dem Boden. In der EPI.X+Pferd steht die Ziffer #2 für 2 Füße auf dem Boden links an 1. Stelle. Die 3. Stelle ist mit der Ziffer „0“ nicht besetzt. Die 2. Stelle ist als Mitte mit der Struktur 5 besetzt. In den 8 Phasen müssen somit im steten Wechsel zwischen den beiden Episoden 3 und dann 2 Füße auf dem Boden stehen. Bei 2 Füßen auf dem Boden stehen diese entweder seitlich (lateral) auf nur einer der beiden Körperseiten oder diagonal in 2 Ausrichtungen.
Die motorische, ventrale Wurzelfaser löst die Bewegung nach Eingang der Gehirnschaltung aus. Dafür wird die graue Substanz (hier als 88) mit dem Nervenimpuls „77“ und der Struktur 5 bzw. dem Muskel 5 geschaltet. Nervenimpuls 77: EPI.Y+Pferd.Z.16498.#253788778850426. Zur Aktivierung der Leitepisode liegen mit 867 vs. 80067 in der gleichen Zeilennummer ähnliche Zeilen vor: EPI.X+Pferd.Z.16499.#250957664209867 und EPI.Y+Pferd.Z.16499.#253773396780067. Um die 8 Phasen der Gangart „Schritt“ zu zählen kann der Viertakt mit der 2 als „paarig= 4_2_4“ verbunden werden. Weiterhin kann die Standfestigkeit der Struktur 5 mit „4_5_4“ funktionell aktiviert werden. Wobei sich die Struktur-5 als Quersumme 3+2= 5 über die Anzahl der im Wechsel aufstehenden Füße symbolisiert: EPI.X+Pferd.Z.16500.#250942454654460.
Die Gangart „Trab“ wird als Zweitakt-Gangart allein über die Episode EPI.X+Pferd #250 aktiviert. Beim Trab wird jeweils das diagonale Beinpaar vorgeschwungen, wobei zwischen den Bodenberührungen im steten Wechsel eine Schwebephase dazwischen geschaltet ist. Die Fußfolge wird bildlich über ein halbe Gruppe 44/2 = 22 bzw. als Beinknochen angezeigt. Die Diagonale wird dabei über 2 Zeilen gebildet. Die Schwebephase folgt mit Leerzeilen. 1.) Diagonale als versetzte 22: EPI.X+Pferd.Z.16515.#250714532352322 und EPI.X+Pferd.Z.16516.# 250699352252276. 2.) Schweben als herausgehoben „99“ und Null: EPI.X+Pferd.Z.16517.#250684173990349 und EPI.X+Pferd.Z.16518.# 250668997566206. 3.) Diagonale mit Richtungswechsel: EPI.X+Pferd.Z.16519.#250653822979514 und EPI.X+Pferd.Z.16520.#250638650229939. 4.) Leerzeile mit Nerv 7: EPI.X+Pferd.Z.16521.#250623479317148; Schweben als „Null“ und 22 in der Zeilennummer: EPI.X+Pferd.Z.16522.#250608310240806 und EPI.X+Pferd.Z.16523.#250593143000581.
Die Gangart „Galopp“ wird als Dreitakt-Gangart allein über die Episode EPI.Y+Pferd #253 aktiviert. Die Ziffer „2“ für paarig, bezieht sich hier auf die Besonderheit von 2 Varianten der Gangart „Galopp“. Die Bezeichnung Links-Galopp oder Rechts-Galopp wird durch die Seite des aufsetzenden Vorderbeins definiert, das den Galoppsprung abschließt. Der Galopp wird als Flucht-Gangart als 1. Gangart sofort im Zeilenlauf angelegt. Für diese Möglichkeit wird mit „171“ der Nerv 7 auf eine Zählgröße 8 mit „181“ umgelegt und mittels „85“ als Stütze gezählt: EPI.Y+Pferd.Z.16493.#253865717181491. Mit der verbundenen „Null“ als „850“ wird die abschließende Schwebephase der Struktur 5 avisiert. In der Reitkunst kann diese Zeile tatsächlich beim Rückwärtsgalopp (Mezair Reculé) ausgeführt werden: EPI.Y+Pferd.Z.16494.#253850325783578. Fußfolge Rechts-Galopp: 1.) linkes 1 (als Variante rechts 2) Hinterbein 85: EPI.Y+Pferd.Z.16495.#253834936251854, 2.) rechtes Hinterbein und linkes Vorderbein bilden als Zweibeinstütze eine Diagonale 85_85: EPI.Y+Pferd.Z.16496.#253819548585980, 3.) rechtes Vorderbein: EPI.Y+Pferd.Z.16497.# 253804162785617, 4.) Schwebephase 85_0: EPI.Y+Pferd.Z.16498.#253788778850426. Mit dieser Zeile wird alternativ die Gangart „Schritt“ über die „77“ vorbereitet bzw. vom Galopp in den Schritt gewechselt.
Die Hirnhäute gehen bei #2533 in die Rückenmarkshäute (Meninx medullae spinalis) über. Vor den 6 Zeilen wird eine Haut-Gruppe gebildet, die statt 44 mit 404 die Auskleidung des Wirbelloches „0“ adressiert. Die harte Rückenmarkshaut (Pachymeninx spinalis) und die weiche Rückenmarkshaut (Leptomeninx spinalis) sind als 856_856 enthalten: EPI.Y+Pferd.Z.16523.#253404785660856. Die Knochenhaut (Periost) besteht aus 2 Schichten. Die innere Schicht (Stratum osteogenicum) 5_101 enthält Stammzellen zur Regeneration des Knochens sowie Nerven und Blutgefäße: EPI.Y+Pferd.Z.16524.#253389450101327. Die äußere Schicht (Stratum fibrosum) enthält kollagene Fasern. Die Sharpey-Fasern 11 ziehen durch die innere Schicht in die Substantia compacta des Knochens und verankern das Periost: EPI.Y+Pferd.Z.16525.#253374116397842. Der Epiduralraum (Cavum peridurale) ist ein Spaltraum 500 zwischen dem Duralsack und der vom Periost ausgekleideten Wand des Wirbelkanals. Der Duralsack ist ein blind endender Bindegewebsschlauch, der sich durch das innere Blatt (Stratum meningeale) der Dura mater spinalis bildet. Der Spaltraum ist mit Fettgewebe und einem Venenplexus (Plexus venosus vertebralis internus) 8_7_8 ausgefüllt: EPI.Y+Pferd.Z.16526.#253358784550062. Die Dura mater spinalis ist Teil der harten Hirnhaut (Pachymeninx) und hüllt das Rückenmark als Duralsack 545 ein. Zwischen der Dura mater und der Arachnoidea liegt der Subduralraum als kapillarer Spaltraum. Dieser ist nicht sichtbar, weil die Arachnoidea der Dura mater direkt anliegt: EPI.Y+Pferd.Z.16527.#253343454557653. Die Spinngewebehaut (Arachnoidea mater spinalis) ist als dünne, halbdurchsichtige Membran 202 Teil der weichen Hirnhaut (Leptomeninx): EPI.Y+Pferd.Z.16528.#253328126420277. Der Subarachnoidalraum (Cavitas subarachnoidalis) 800 ist ein Spaltraum in dem der Liquor zirkuliert. EPI.Y+Pferd.Z.16529.#253312800137596. Die Pia mater spinalis unterteilt sich in die Lamina interna (Interna) und die Lamina externa (Epipia) untergliedert. Die Pia mater besteht aus weichem Bindegewebe und enthält Blutgefäße. In der Epipia sind Fasern enthalten, die das Rückenmark scherengitterartig umfassen. Dazu werden die Fasern 1 zur Struktur 5151: EPI.Y+Pferd.Z.16533.#253251513547108. Die Form 7 wird ein Viereck 4_9_4, das mit der 999 für „außen“ ein Scherengitter ergibt: EPI.Y+Pferd.Z.16538.#253174946999294. Der Zeilenbereich #2533 ist beendet, so dass sich die Pia mater bis zu einer Doppel-Hautgruppe 44_33_33 für die beiden Hautschichten entwickelt: EPI.Y+Pferd.Z.16540.#253144333341858.
Durch die Schädelöffnung (Formamen magnum) läuft ein paariger Nervenstrang 2_777 zum Rückenmark, der sich dann auffächert: EPI.Y+Pferd.Z.16252.#2576302777180860. Der Anfang des Rückenmarks beginnt vor dem 1. paarigen Halsnerv am Ende der Pyramidenbahnkreuzung (Decussatio pyramidum). Die Nervenfasern der Pyramidenbahn kreuzen hier auf die Gegenseite, so dass im Großhirn die Körperseiten seitenverkehrt projiziert werden. An der mittigen Kreuzungsstelle bildet sich der Nervenpunkt 7_0_7. Die beiden Nerven 7 ziehen dann als Pyramidenseitenstrangbahn (Tractus corticospinalis lateralis) seitlich außen liegend weiter. Am Kreuzungspunkt ist weiterhinein der paarige Nerv (anterior corticospinal tract / anterior cerebrospinal fasciculus) 7_2_7 vorhanden, der ohne Kreuzung durchläuft: EPI.Y+Pferd.Z.16542.#253113727087071.
Beim Pferd zieht sich das Rückenmark im knöchernen Wirbelkanal der 7 Halswirbel, der 18 Brustwirbel und der 6 Lendenwirbel bis in den vorderen Bereich des Kreuzbeins. Der weitere Wirbelkanal enthält bis in die Schweifwirbel dann nur noch Spinalnerven. Die Wirbelsäule entsteht im primären Zeilenlauf als Strukturgröße #115. Vorab wird der sekundäre Zeilenlauf beschrieben, mit dem das Rückenmark und die Spinalnerven passend zugeordnet werden.
Der 1. Halswirbel (Atlas) ist als Struktur 5 ab #2525 mit einem Countdown der 4. Ziffer zur Bildung dezimaler Wirbelabschnitte zu erwarten. Es bilden sich 6 - 7 Codezeilen/Wirbel. Weil es weniger als 10 Zeilen sind, kann die Ziffer 7 nicht immer als paariger Spinalnerv am rechten Zeilenrand erscheinen. Für die Halsnerven (Nervi cervicales) ist das aber notwendig. Für die Brust- und Lendenwirbel sind bei notwendiger Gruppenbildung 44 Mehr- und Mindermengen möglich, weil die Gesamtzahl der Spinalnerven passend ist und durch die Schräglage der Dornfortsätze und deren Länge eine Überschneidung der Wirbel als Widerrist bei Vierbeinern vorhanden ist.
Am 1. Halswirbel (Atlas) fehlt eine Nervenzeile mit der Ziffer 7 am rechten Zahlenrand. Die Startzeile EPI.Y+Pferd.Z.16576.# 252594550764619 mit der Suchoperation #2525 kann sich aber als Nervenwurzel 2 zusätzliche Zeilen vorab hinzuziehen, weil die #25 enthalten ist: EPI.Y+Pferd.Z.16574.# 252625031584067. Die 2. Zusatzzeile bildet ein paariges Wirbel-Knochenloch (Foramen vertebrale) 0 als Form 7 zur Durchleitung der Wirbelarterie (Arteria vertebralis) 9, paarig 2: EPI.Y+Pferd.Z.16575.#252609790254862.
Für den 2. bis 7. Halswirbel ist jeweils eine Zeile mit dem Nerv 7 am rechten Zeilenrand vorhanden. Dieses ist beim 7. Halswirbel nicht ausreichend, weil es für die 7 Halswirbel abweichend 8 Halsnerven gibt. Der 8. Halsnerv 77 ist als Extra 8 am 7. Halswirbel vorhanden: EPI.Y+Pferd.Z.16574.#251910671648778. Die enthaltene Nervenverbindung 7_16 hat wegen der „6=Bewegung/flexibel“ die Bedeutung einer Innervierung der vorderen Extremitäten durch den Plexus brachialis. Entsprechend ist dazu beim Pferd die Zählgröße „16“ im Bereich des 6. bis 8. Hirnnervs enthalten.
Die paarigen Halsnerven teilen sich in einen dorsalen Ast (Rami dorsales) und einen ventralen Ast (Rami ventrales) auf. Die Aufteilung wird im Halswirbelbereich jeweils durch 1 Zeile mit doppelter 7 oder als 77 gebildet. Abweichend müssen beim 4. Halswirbel 2 Zeilen 2_7 zur Gruppe verbunden werden: EPI.Y+Pferd.Z.16597.#252274945681408 und EPI.Y+Pferd.Z.16599.#252244549278531. Bis vor die „Null=Aus“ #2520, d.h. vom 1. - 5. Halsnerv sind die Rami ventrales durch Querverbindungen zum Plexus cervicalis ventralis verbunden. Die Rami dorsales und Rami ventrales verzweigen nochmals jeweils in einen Rami medialis und einen Rami laterialis. Vom 1 - 6 Halswirbel ist dafür bereits eine zusätzliche Ziffer 2=paarig als #252 vorhanden. Die Rami dorsales der 3. bis 6. Halsnerven sind aufgrund schlingenartiger Anastomosen untereinander zum Plexus cervicalis dorsalis verbunden. Am 3. Halswirbel wird eine Nervenschlinge 66_1_7 angelegt: EPI.Y+Pferd.Z.16591.#252366178860487. Die Schlinge wird durch Nervenkontaktstelle mit der 9 als Endberührung als 9_7 gebildet. Die „97“ ist nunmehr bis zum 6. Halswirbel vorhanden. Dort ist die Ziffer 1 als Strang 4x für den Kontakt der 4 Nerven vorhanden: EPI.Y+Pferd.Z.16615.#252001641497101.
Beim 1. Brustwirbel fehlt die Nervenzeilen ...7, die erst im 5. Brustwirbelbereich ausgeglichen wird, der den Hochpunkt des Widerrist bildet. Die Gruppe der Spinalnerven wurde bereits am 2. Halswirbel (Axis) angelegt. Die Nervenzeile 7 ist mit der Gruppe 44 kombiniert und avisiert die Bildung von „10“ weiteren Spinalnerven bis zum 5. Brustwirbel, die aus den Zwischenwirbellöchern (Foramen intervertebrale) „0_10_0_5“ herauszuführen: EPI.Y+Pferd.Z.16584.#252472701005447. Bei der „10“ handelt es sich nicht um den in den Atlas gesteckten Wirbeldorn (Dens axis), weil dieser als „0_11“ kombiniert mit der Gruppe der knöchernen 22 Wirbelsäule 44_225 enthalten ist und sich aus 2 Wirbelfortsätzen bildet: EPI.Y+Pferd.Z.16586.#252442256932011. Für den Nerven-Ausgleich weiterer Wirbel wird eine neue Gruppe 1_44_1_7 gebildet. Als Gruppengröße werden die restlichen 13 Brustwirbel plus 6 Lendenwirbel = 19 Zählwirbel benötigt. Die 19 zählt sich als 17 plus 2x 1 aus 51_51: EPI.Y+Pferd.Z.16652.#251441705108956. Beim 1. Kreuzwirbel ist eine 7er Nervenzeile vorhanden: EPI.Y+Pferd.Z.16779.#249538546604347.
Mit der Bildung des Rückenmarks wird die Wirbelsäule auch in der Parallelepisode EPI.Y+Pferd sichtbar. Um dieses zu überprüfen, kann man in diesem hohen Zeilenbereich erwarten, dass der Herzschlag in der Primärepisode EPI.X+Pferd parallel in Höhe des 2. Brustwirbels auslesbar ist. Die Primärepisode eilt am 2. Brustwirbel etwas voraus und ist statt #25 bereits bei #248995760, so dass die Zeit 24 am Herz aufläuft. Die Vene 8 und die Arterie 99 sind als Struktur 5 genannt. Es folgen der Nerv 7 und die Zeit 60. Die folgende Quersumme QS=5+2+6+7+6= 36 ergibt den mittleren Ruhepuls des Pferdes von 30 - 40 Herzschläge/min: EPI.X+Pferd.Z.16629.#248995760526706. Der Impuls 1 ist beim Pferd als Dopplung 78_78 bzw. 11 hörbar (Buh-Dup). Der lange 1. Herzton entsteht aus der Schwingung der Wandmuskulatur und der kurze 2. Herzton beim Schließen der Aortenklappe und zugleich der Pulmonalklappe. Nach einer Belastung muss der Puls unter 64 Schläge/min liegen [..., um den Sieg der Biologie über die Physik zu feiern]. Beim Wettkampfpferd muss die Erholungszeit unter 20 min liegen. Die „8“ wird doppelt zum Puls 8*8= 64 angegeben. Der günstige Bereich liegt zwischen 4_4 = 4 min und 9+7= 16 min: EPI.X+Pferd.Z.16630.#248980787841166. Unter Belastung steigt der Herzschlag auf 202 Schläge/min. Vergleichsweise unbelastet ist QS=8_965_8=36 als Ruhewert: EPI.X+Pferd.Z.16631.# 248965816956202. Der Impuls 7_1 und der Doppelton 151/151 sind vorhanden in EPI.X+Pferd.Z.16633.#248935880586701 und EPI.X+Pferd.Z.16634.#248920915101515. Weiter im Rückenmark:
Kurz vor dem Ende des Rückenmarks am 1. Kreuzbeinwirbel weitet es sich mit einem Hohlraum 96_0 als Form 31_7_0 mit einer Zählgröße 3_1 zum Ventriculus terminales auf: EPI.Y+Pferd.Z.16776.#249583170807960. Die Zählgröße 31 dehnt sich zu 3001, um die Füllung mit Liquor aufzunehmen. Die Zeilennummer enthält die Form 777: EPI.Y+Pferd.Z.16777.#249568294300193. Das Rückenmark endet konisch zulaufend am 1. Kreuzbeinwirbel als Conus medullaris. Als Dreieck 3 ist die Struktur 5 dreifach enthalten, wobei die 9 als langgezogenes Ende 999 die Konusstruktur ausbildet: EPI.Y+Pferd.Z.16781.#249508805999305. Das Rückenmark verjüngt sich und bildet am 3. Kreuzbeinwirbel einen weiter ziehenden, langen Bindegewebsfaden (Filum terminale / medullae spinalis) 5_111 aus: EPI.Y+Pferd.Z.16793.#249330511134064. Das Filum terminale endet am 4. Kreuzbeinwirbel (4. Sakaralwirbel) als 11_7 mit 9 als Ende: EPI.Y+Pferd.Z.16801.#249211789386009.
Jeder Wirbelabschnitt enthält ein Rückenmarkabschnitt der beidseitig einen Nervenstrang entlässt. Diese Regelmäßigkeit endet beim Pferd ab dem 5. Lendenwirbel. Hier ziehen die Nervenstänge im Wirbelkanal zu weiter hinten liegenden Nervenaustrittslöchern (Neuroforamen), so dass sich ein Bündel von Nervenfasern bildet. Das Bündel ähnelt einem Pferdeschanz (Cauda equina), d.h. auch der Mensch besitzt einen „Pferdeschwanz“. Im 5. Kreuzbeinwirbel wird dazu ein Nervenbündel 7 erkennbar, dass als extra 8 durch den Wirbelkanal 0_8_9999_0 zieht: EPI.Y+Pferd.Z.16805.#249152470899990.
Bei der dezimalen Zuteilung der Wirbel nach 4. Stelle endet der 5. Kreuzbeinwirbel mit der Ziffer 8_0, wobei das Zubehör 8 die Ziffer Null ist. Die Null ist die 4. Stelle des 1. Schwanzwirbels, so dass die Tendenz vorhanden ist, dass der 1. Schwanzwirbel mit dem Kreuzbeinwirbel verwächst: EPI.Y+Pferd.Z.16808.#249108000563680. Der 1. Schweifwirbel enthält die Ziffer 9 für das eigentliche Ende 9 von EPI.Y+Pferd.Z.16809.#249093180645745 bis EPI.Y+Pferd.Z.16815.# 249004298154881. Die 5 Schwanznerven sind als 5_7 kombiniert als Gruppe 4_4 zählbar.
Weiter im primären Zeilenlauf:
Das Achsenskelett wird über seine Wirbel als Zählgröße #11_5 durchgezählt. Es sind 7 Halswirbel, 18 Brustwirbel, 6 Lendenwirbel, 5 Kreuzbeinwirbel und 15-21 Schweifwirbel vorhanden. Die 7 Halswirbel bilden sich aus einer Serie #115 über 7 Zeilen als Platzhalter, so dass die Details erst im Zeilenrücklauf entstehen.
Im Zeilenlauf von EPI.X+Pferd ist die links stehende Doppelziffer 11 der obere Halswirbelrand, an dem die 11 zugleich in einer Doppelwirkung „Zählhaare 11“ als die Stehmähne der Wildpferde auslöst; die lange Mähne (Juba) entstehen erst bei der Pferdezucht. Am 1. Halswirbel (Atlas) wird das Zähl-Haar als Extra 8 ausgelöst in 8_1_8. Zugleich ist die Ziffer 1 der durchgesteckte Zapfen des Axis-Wirbels. Am 2. Wirbel wird das Zähl-Haar als Form 77_1 fixiert. Am 3. Halswirbel wird die Zählgröße 1 zur Hautoberfläche 5_33_5 in Bezug gesetzt. Am 6. und 7. Wirbel sind die Zählwirbel 115 nach rechts gewandert und links (oben) wird die 11 als Stehmähne gesondert unabhängig vom Wirbel gebildet.
Halswirbel 1-7: 1. Halswirbel (Atlas): EPI.X+Pferd.Z.357.#1159818067730700; 2. Halswirbel (Axis): EPI.X+Pferd.Z.358.#1156578352457710, 3. Halswirbel: EPI.X+Pferd.Z.359.#1153356685737770; 4. Halswirbel: EPI.X+Pferd.Z.360.#1150152917166280. 5. Halswirbel: Die Serie #115 wird mit einer Ersatzgröße 515 verlängert: EPI.X+Pferd.Z.361.#1146966898005150, 6. Halswirbel: EPI.X+Pferd.Z.362.#1143798481159830 und 7. Halswirbel: EPI.X+Pferd.Z.363.#1140647521156640. Weitere oben liegende Haare (Schopf und Ohr) können in EPI.Y+Pferd gesucht werden.
Brustwirbel 1-18: 1. Brustwirbel: EPI.X+Pferd.Z.608.#681011595690558; 3. Brustwirbel: EPI.X+Pferd.Z.781.#5301601154671700: 4. Brustwirbel: EPI.X+Pferd.Z.835.#4958743115926460; 8. Brustwirbel: EPI.X+Pferd.Z.1042.#397365691151497; 18. Brustwirbel: EPI.X+Pferd.Z.1717.#241150291310343.
Lendenwirbel 1-6: 1. Lendenwirbel: EPI.X+Pferd.Z.1883.#219891157822549; 6. Lendenwirbel: EPI.X+Pferd.Z.2397.#172738861151381.
Kreuzbeinwirbel 1-5, zusammengewachsen: 1. Kreuzbeinwirbel: EPI.X+Pferd.Z.2531.#163593461153639 mit den beidseitigen Gelenkflächen 93_39 für das Kreuzbein-Darmbein-Gelenk [Iliosakralgelenk (ISG)]; 5. Kreuzbeinwirbel: EPI.X+Pferd.Z.3264.#126855101158045.
Schweifwirbel 1 bis 15-21: Der Schweif beginnt an einer Wirbel-Serie #115, die vergleichsweise bei den Walen mit ihrer Fluke nicht mehr erreicht wird. Vorhanden sind zunächst 15 Schweifwirbel. Der Scan unterbricht die Wirbel-Kette, um das gerundete Körperende mit After und Vagina abzufahren. Anschließend kann die Schweifwirbelkette um 6 Wirbel ergänzt werden. Für den Hengst wird der Scann dann bis zum Penis/Schlauch und für die Stute zum Euter weitergeführt.
1. Schweifwirbel: EPI.X+Pferd.Z.3570.#115981806773070 bis 15. Schweifwirbel: EPI.X+Pferd.Z.3584.#115528752840363. Die Struktur #55 ist das Ende und gleichzeitig die Kopplung für 6 weitere Schweifwirbel nach der Unterbrechung der Wirbelkette. 16. Schweifwirbel: EPI.X+Pferd.Z.3725.#111155718169090 bis 21. Schweifwirbel: EPI.X+Pferd.Z.3730.#111006715865914.
Rippen: Die 18 Brustwirbel sind mit Rippenpaaren verbunden, von denen nur die vorderen 8 als echte Rippen mit dem unten liegenden Brustbein verbunden sind. Die übrigen 10 Rippenpaare sind unechte Rippen bzw. Atmungsrippen. Die 18 Rippenpaare entstehen im Zeilenlauf der Parallelepisode EPI.Y+Pferd als Zählgröße #115. Bei der 2. Rippe fehlt die Ziffer 2 für paarig, was durch eine enthaltene Dopplung #9797 kompensiert wird. Bei den folgenden unechten Rippen steht die 2 zunächst vorn im Zeilencode. Bei den letzten 3 Rippenpaaren steht die 2 für paarig in der Zeile bzw. muss im vorletzten Rippenpaar #11155 als Dopplung gelesen werden. Die Rippen laufen mit der Zeilennummer nicht synchron, sondern erscheinen zunehmend später. Dies ist akzeptabel, weil es der gebogenen Form des Brustkorbes entspricht, wenn das untere Rippenende betrachtet wird.
Brustbein (Equus ferus caballus): Die 8 echten Rippen setzen in Verlängerung über Knorpelrippen (Costal cartilage) am Brustbein an. Das Brustbein besteht somit aus dem ventralen Längskochen und den 8 Knorpelrippenpaaren. Die sich nach hinten breiter auffächern. (im Grundriss eine Dreieckform). Die 8 Knorpelrippen werden mit der Knochen/Knorpel-Zählgröße #225 in der Parallelepisode EPI.Y+Pferd gezählt. Die Leitepisode EPI.X+Pferd ist für die Suche nach den vorderen Extremitäten (Schulterblatt etc.) reserviert. Das Brustbein selbst muss dann vorab als Gruppe 444 zusammengefügt werden: 1.) Rippenpaare adressiert 5_2_11: EPI.Y+Pferd.Z.611.#685271239521167, 2.) dreieckige „Grätenstruktur“ 15_15_15 mit 8 Knorpelrippenpaaren: EPI.Y+Pferd.Z.612.#684151515273584. 3.) Brustbein-Gruppe 444 gebildet: EPI.Y+Pferd.Z.613.#683035444286188. Das Brustbein wird im Zeilenlauf #225 mit 8 ansetzenden Knorpelrippenpaaren gebildet. Der Sattelgurt beim Reiten muss noch am Brustbein sitzen, um die Atmung nicht zu behindern.
Schultergürtel/Vorderbein: Weil ein Schlüsselbein fehlt, sind die vorderen Gliedmaßen nicht direkt mit der Wirbelsäule verbunden.
Schulterblatt (Scapula): Der Rumpf wird durch den fächerartigen Muskel „M. serratus ventralis“ elastisch zwischen den beiden Schulterblättern aufgehängt, so dass die Last über die Vorderbeine zum Boden abgetragen wird. Die lose Beziehung zwischen Vorderbein und Wirbelsäule wird so gestaltet, dass die Zeilennummer 457 des Schulterblatts vorweg avisiert wird. Dieser Vorspann erlaubt es, dass vor dem Zählknochen #225 zunächst der Schulterblattknorpel und die Schulterblattgräte als präzise Mittellinie des Schulterblatts erscheinen können. Schulterblattanschluss im Bereich Zeile 457 avisiert: EPI.X+Pferd.Z.431.#960684571182969. Schulterblattknorpel 22_33: EPI.X+Pferd.Z.450.#920122333733021. Schulterblattgräte (Spina scapulae) 100110_9: EPI.X+Pferd.Z.455.#910011099296395. Schulterblatt als Zählgröße: EPI.X+Pferd.Z.457.#906028556192253.
Schultergelenk (Buggelenk): Das Gelenk wird avisiert als 808. Die vor- und nachgelagerten Zeilen enthalten starke Muskeln #555. Bei diesem Gelenk übernehmen die Muskeln die Funktion der Bänder: EPI.X+Pferd.Z.512.#808701269882538. Nach der Funktionserklärung folgt das Gelenk: EPI.X+Pferd.Z.517.#800880174429129. Oberarmknochen (Humerus): Zufällig stimmen die 55 mit dem 55°-Winkel des Knochens zum Ellenbogen überein: EPI.X+Pferd.Z.455.#791692256558049. Ellbogengelenk: Der Unterarmknochen ist im Zeilenlauf erst nach einer Lücke zu finden, in der zunächst das Herz angelegt wird. Folglich könnte man in der Weitläufigkeit das Gelenk nicht erkennen. Wird aber das Gelenk unter dem Winkel von 55° symbolisch angepeilt, ist über die 55 das Gelenk aufzufinden. Das Scharniergelenk wird durch 5 Muskeln #55 bewegt: EPI.X+Pferd.Z.910.#455005549648197.
Unterarmknochen, bestehend aus der Speiche (Radius) #225 und vorab mit der Elle (Ulna) #2225 in getrennten Zeilen. Die Elle liegt nicht in Gänze neben der Speiche, sondern ist ein seitlich oben angewachsenes Knochenstück, das am Ellenbogengelenk herausgeschoben ist und durch den Ellenbogenhöcker abgerundet wird. Elle (Ulna): EPI.X+Pferd.Z.934.#443313758222548. Speiche (Radius): EPI.X+Pferd.Z.945.#438153492253820.
Das Karpalgelenk ist mit dem menschlichen Handgelenk vergleichbar. Es verbindet den Unterarmknochen mit dem Röhrbein. Das Gelenk besteht aus 3 Knochenreihen und 3 Gelenken. Es sind 6 kleine, würfelförmige [Würfel=6] Knochen und das Erbsenbein 1: Zwei Gelenk-Knochenreihen: EPI.X+Pferd.Z.948.#436766930569472 und EPI.X+Pferd.Z.949.#436306691443477 als Gruppe 44.
Röhrbein: EPI.X+Pferd.Z.980.#422505153244755. Das Fesselgelenk wird am Gleichbein gesucht. Es gehört zur Gruppe des Sesambeine und entwickelt sich an belasteten Sehnen. Gerades Gleichbeinband 111: EPI.X+Pferd.Z.1007.#4111768124924130. Vom Karpalgelenk über das Röhrbein reicht der Musculus interosseus bis zu den beiden Gleichbeinen. Oberhalb spaltet er sich auf und setzt an beiden Gleichbeinen an. Der Muskel ist wie eine Sehne aufgebaut, so dass die Muskel-Doppelziffer 55 noch nicht vorliegen muss. Muskelaufspaltung 98_98 mit 9 für seitlich und Ziffer 5 als QS=4+1= 5: EPI.X+Pferd.Z.1008.#4107688989879560. Am Fesselgelenk ist als Hautanhangsgebilde 33_55 der Sporn zu erwarten, der hier unauffällig als Extra 8 vorliegt. Diese Zählgröße 1 wächst als Form 7 seitlich 9 heraus: EPI.X+Pferd.Z.1009.#4103617940335580. Das herabhängende Haar (Fesselbehang/Kötenzopf) 11_995 am rückwärtigen Fesselgelenk enthält in der Zeile mit 5_8_3_0 ein Bündel von Hautröhren 3_0 als Extra 8, das ein alternatives Sporngebilde darstellt: EPI.X+Pferd.Z.1005.#411995074805830. Die beiden knöchernen Gleichbeine 5_22 liegen an der Hinterseite des Fesselkopfes 99_55 und etwas oberhalb des Gelenkspalts des Fesselgelenks: EPI.X+Pferd.Z.1010.#4099554952275840. Fesselgelenk 50000: EPI.X+Pferd.Z.1011.#409550000177903. Fesselringband (Ligamentum anulare palmare) 11_0: EPI.X+Pferd.Z.1013.# 408741411826120. Das Fesselringband ist eine Fazienverstärkung und steht zehenwärts mit der vierzipfligen Fesselplatte in Verbindung: EPI.X+Pferd.Z.1014.#408338313786844. Unterhalb des Gelenks liegen mittig das platte Gleichbeinband 100 (Ligamentum palmare): EPI.X+Pferd.Z.1015.# 4079360100294180 und beidseitig das schiefe Gleichbeinband EPI.X+Pferd.Z.1018.#4067338410411190.
Für das Fesselbein selbst ergibt sich aus der Zählung „#225“: EPI.X+Pferd.Z.1071.#386606022576900. Das Krongelenk ist zunächst nicht erkennbar. Es wird aus der Fesselbeinwalze 7_220: EPI.X+Pferd.Z.1080.#383384305722092 und der Kronbeingrube 400: EPI.X+Pferd.Z.1081.#383029648640018 gebildet. Krongelenkbänder 711: EPI.X+Pferd.Z.1082.# 382675647116321. Gelenkkapsel: EPI.X+Pferd.Z.1083.#382322299335050. Ansatzstelle der oberflächlichen Beugesehne 11: EPI.X+Pferd.Z.1086.#381266160386611. Kronbein: EPI.X+Pferd.Z.1093.#378824382598225. Das Hufgelenk (Articulatio interphalangea distalis manus) 81_9_81 muss zusammen mit dem Strahlbein [Os sesamoideum distale] gefunden werden: EPI.X+Pferd.Z.1110.# 376413681981690. Beugesehne [EPI.X+Pferd.Z.1098.#377099317103697], Schleimbeutel (Bursa podotrochlearis) [EPI.X+Pferd.Z.1099.# 376756187606788] und Strahlbein und bilden die sogenannte Hufrolle [Podotrochlea]. Strahlbein 555 mit Seitenbereichen 53_53: EPI.X+Pferd.Z.1102.#375730535553412.
Die beidseitigen 2 Hufknorpel 33_5 sind äußerlich 9 mit einem Venenkomplex 88 ausgestattet, der mittels der Hufmechanik als Blutpumpe die Venen der Lederhaut antreibt. Der paarige Venenkomplex wird als Dopplung 89_89__88 dargestellt: EPI.X+Pferd.Z.1103.#375389891368866 und EPI.X+Pferd.Z.1104.# 375049864293351. Die folgenden 4 Zeilen enthalten mit „33“ jeweils ein Hautelement, das die Eckstreben (Pars inflexa lateralis und medialis) der hinteren Hufwand (Trachten) bilden. Mit den Eckstreben wird das hintere Ende des Tragrandes beidseitig diagonal nach innen entlang des halben Strahlfurche gezogen. Die Eckstrebe ist beidseitig (paarig) vorhanden. Hierzu wandert die Doppelziffer 33_5 als Struktur 5 von außen nach innen und die Ziffer 2=paarig ist vorhanden: EPI.X+Pferd.Z.1104.#375049864293351 und EPI.X+Pferd.Z.1109.# 373358927123408. Innerhalb dieses Zeilenlaufs wird einseitig die äußere (lateral) Eckstrebe [unpaarig (ohne 2)] auf einer Hufseite verstärkt, so dass die Eckstreben nicht genau spiegelbildlich sind: EPI.X+Pferd.Z.1106.#374371654773833 und EPI.X+Pferd.Z.1108.# 373695893664133.
Hufbein (Os ungulare / Phalanx distalis): EPI.X+Pferd.Z.1110.# 373022567729603 (steht auf dem Boden). Die Form 7 ist als Dreieck 3_7_30 bestimmt, worin 30° die hintere Neigung zum Ballen bilden. Die vordere Hufschräge 45° (bis 50°) ergibt sich als Quersumme=5+6+7+7+2+9+6+0+3=45° in Bezug auf den Knochen 22. Der hintere Huf ist stärker geneigt. Die Ziffer 2 für paarig ist als 3. Ziffer #372 vorhanden, so dass die Symmetrie automatisch vorhanden ist, um in der horizontalen Wandfurche (Sulcus parietalis) paarige Knochenlöcher (Foramen parietale) 08 + 09 für Gefäße zur Versorgung der Lederhaut zu bilden: EPI.X+Pferd.Z.1102.#372351663830809. Rückseitig in der Sohle setzt die tiefe Beugesehne an der Oberfläche „Facies flexoria“ an. Daneben sind beidseitig Gefäß-Sohlenlöcher (Foramen soleare laterale bzw. mediale) vorhanden, die in den paarigen V-förmigen Sohlenkanal (Canalis solearis) münden. Der Sohlenkanal enthält einen arteriellen und venösen Blutgefäßbogen (Arcus terminalis) 8_9. Die V-Form des Sohlenkanals 20 (2=Knochen, 0=Loch, 7=Form) wird mit der schräg wandernden Zählgröße 11 gekoppelt und zur V-Form über mehrere Zeile durchgezogen, wobei das V durch die Spiegelung (paarig) entsteht, von EPI.X+Pferd.Z.1113.#372017116064564 bis EPI.X+Pferd.Z.1115.#371349820789112. Die 3. Ziffer ist bereits unpaarig auf „1“ gewechselt, so dass die 2 rechts außen zu finden ist. Der Arcus terminalis enthält einen Gefäßbogen 606 mit der markierten Arterie 6_QS 4+5=9_6 und der Vene QS 1+7=8 oder 4+4 =8 in 4_QS 5+6=11_4. Die Gefäße beider Sohlenkanäle verbinden sich 98_89. Wand- und Sohlenfläche führen am Tragrand (Margo solearis) als runde Form 707_00_5 zusammen. Vorn in der Mitte (unpaarig) ist eine Einkerbung (Crena marginis solearis) 7_101 vorhanden, die das Ende des Hufbeins bildet: EPI.X+Pferd.Z.1113.#371017070053638.
Die Sehnen und Bänder am Huf werden nunmehr durch eine Wende im Zeilenlauf gesucht: Oben mittig am Hufbein ist am Streckfortsatz (Processus extensorius) die gemeinsame Stecksehne 22_3 des Muskels „Musculus extensor digitorum communis“ als Gegenspieler der tiefen Beugesehne befestigt: EPI.X+Pferd.Z.1119.# 370022386219714. Die Seitenbänder des Hufgelenks (Lig. collaterale mediale bzw. laterale) 222_9 spannen vom Kronbein seitlich 9 zum Hufbein. Die Faserform 1 und die paarige Anordnung 2 sind in der Zeilennummer zu finden, wobei mit 93_39 die Spiegelung enthalten ist: EPI.X+Pferd.Z.1121.# 369362221391489. Strahlbein-Hufbein-Band (Lig. sesamoideum distale impar): EPI.X+Pferd.Z.1126.#367722069431492. Das Strahlbahn 225 wurde zuvor nur mit 555 als Platzhalter benannt, so dass im Rücklauf eine Knochenbildung 225 erfolgt: EPI.X+Pferd.Z.1143.#362252887296465. Das Strahlbein wird mit dem Fesselbein-Strahlbein-Hufbeinband (Lig. sesamoideum collaterale mediale bzw. laterale) elastisch aufgehängt. Außer an der Fläche „Margo proximalis“ des Strahlbeins ist das Band noch am Hufknorpel befestigt, so dass eine Bandgruppe 1_44_9 entsteht: EPI.X+Pferd.Z.1145.#361620131161449. Im Zeilenlauf wird nunmehr die Zwischenbefestigung am Hufknorpel als Hufknorpelband 9_111 gebildet: EPI.X+Pferd.Z.1145.#359111058265273. Die zahlreichen Details am Huf werden im Zeilenlauf mit der Bildung von Haut- und Hornschichten gesondert ergänzt!
Beckengürtel: Die hinteren Gliedmaßen werden mit dem Hüftknochen (Os Coxae) über das Iliosakralgelenk (ISG) [Kreuzdarmbeingelenk] am 1. Kreuzbeinwirbel befestigt. Der paarige Hüftknochen besteht aus folgenden Teilen: Hüfthöcker, Darmbein mit der über die Wirbelsäule aufragenden Darmbeinschaufel, Kreuzhöcker, Schambein, Sitzbein, Sitzbeinhöcker. Das Kreuzbein (Os sacrum) schiebt sich zwischen die beiden Hüftknochen. In der Seitenansicht bzw. dem Zeilenlauf erstreckt sich der Hüftknochen vielgestaltig von den Lendenwirbeln bis zu den Schweifwirbeln.
Hüftknochen: Die Knochen werden als Zählgröße #225 in EPI.X+Pferd gesucht, wobei vom markanten Unterschenkelknochen mit Schien- und Wadenbein ausgegangen wird. Entsprechend zeigt sich der Hüftknochen im Zeilenlauf bereits nahe dem 5. von 6 Lendenwirbeln: Der Hüftknochen bildet sich im Zeilenlauf, so dass kein Kontakt zum Gelenk am 1. Kreuzbeinwirbel bestünde. Um dieses zu bewirken, müsste dessen Zeilennummer 2531 in Verbindung zum Knochen 22 und 0 als Gelenk sowie zur Form 77 gesetzt werden. Das durch die Darmbeinschaufel verdeckte Iliosakralgelenk (ISG) wird vorab avisiert: EPI.X+Pferd.Z.2339.#177022253176511. Anfang Hüftknochen: EPI.X+Pferd.Z.2358.#175595865216225, Hüfthöcker EPI.X+Pferd.Z.2362.#175298497112557, Schambein: EPI.X+Pferd.Z.2400.#172522937574941, Sitzbeinhöcker: EPI.X+Pferd.Z.2404.#172235877778644. Das Hüftgelenk ist ein Kugelgelenk und wird aus der Beckenpfanne und dem Oberschenkelknochen gebildet: EPI.X+Pferd.Z.2434.#170113003360665.
Oberschenkelknochen: EPI.X+Pferd.Z.2436.#169973337512258.
Das Kniegelenk ist als Wechselgelenk zweiteilig und besteht aus dem Kniekehl- und dem Kniescheibengelenk. Über die Kniescheibe (Sesambein) besteht zur statischen Entlastung ein Feststellmechanismus. Kniescheibengelenk: EPI.X+Pferd.Z.2499.#165688295390100; Kniekehlgelenk: EPI.X+Pferd.Z.2500.#165622020071944. Das Kniegelenk wird durch den Musculus quadriceps femoris (vierköpfiger Oberschenkelmuskel) 5555 in Position gehalten: EPI.X+Pferd.Z.2501.#165555797752843. Unterschenkelknochen bestehend aus Schienbein (Tibia) 225 und dem rudimentär verwachsenem Wadenbein (Fibula) 225 EPI.X+Pferd.Z.2506.#165225478922530.
Die weiteren Elemente werden als Zählpositionen #225 eingereiht: Das Sprunggelenk (Tarsalgelenk) setzt sich aus 3 Knochenreihen zusammen, wobei in der 1. Reihe das Fersenbein und das Sprungbein liegen: EPI.X+Pferd.Z.2527.#163852414000736. Röhrbein: EPI.X+Pferd.Z.2538.#163142257754082. Fesselbein: EPI.X+Pferd.Z.2584.# 160238022515426. Kronbein: EPI.X+Pferd.Z.2738.#151225365295785. Hufbein: EPI.X+Pferd.Z.2784.#148726670323225 (steht auf dem Boden). Das Hufbein liegt im Zeilenlauf noch vor dem 2. Kreuzbeinwirbel. In der Seitenansicht ist die Hufbein-Form ein Dreieck, das vorn durch die Hufschräge und hinten durch die Schräge am Hufgelenk gebildet wird. Hufgelenk 200 mit der Dreiecksspitze (Processus extensorius) 1 und 33 als Gelenkknorpel. EPI.X+Pferd.Z.2782.#1488335910064200. Die Form 7 wird markiert 8_7_8 und als eine dreieckige Sohlfläche 111 dargestellt, die durch die beiden seitlichen Hufbeinäste gebildet wird. Die Hufschräge ist mit dem Winkel (50 bis) 55° in der Dreiecksform enthalten (Vorderhufe flacher geneigt unter 45°-50°): Der EPI.X+Pferd.Z.2783.#1487801114552140. Die Hautschichten richten sich nach dem allseits dreieckigen Hufbein aus und können somit gesondert entwickelt werden.
Vor dem Hufbein bildet sich die Lederhaut 33, die in 5 Abschnitten verschiedene Hornarten erzeugt (Saumhorn, Kronhorn, Wandhorn, Sohlenhorn, Stahl- und Ballenhorn) von EPI.X+Pferd.Z.2765.#149748661909533 bis EPI.X+Pferd.Z.2758.#149101566503370. Bei jedem Tritt verformt sich der Huf durch die elastischen Hornbereiche an Hufballen und Hufstrahl, so dass die Durchblutung als Hufmechanismus/Hufpumpe unterstützt wird. In einer Doppeldeutigkeit „Außen=Arterie=9“ weitet sich der „Huf-Kreis“ von 909 zu 9009 in EPI.X+Pferd.Z.2779.#148994260590090 als Pumpe. Direkt vor dem Hufbein läuft in der Parallelepisode die Struktur 5 im Zeilenlauf, so dass dort die harten Hornarten zu finden sind. Auf die weiße Linie 111 werden die Hufnägel gesetzt: EPI.Y+Pferd.Z.2758.#150503496530350, EPI.Y+Pferd.Z.2786.#150287411108196, EPI.Y+Pferd.Z.2787.#150233486669334. Vor und nach dem vorderen Hufbein ist das Horn 33 ebenfalls von EPI.X+Pferd.Z.1083.#382322299335050 bis EPI.Y+Pferd.Z.1099.# 380983373382560 vorhanden. Weil die Hufe vorn und hinten ähnlich aussehen, muss es eine Sprungmarke geben, die übereinstimmende Details von den hinteren Hufen ergänzt. Es wird also vorn eine Hufgruppe 44 in EPI.Y+Pferd.Z.1098.#381330352775440 gebildet, die eine Sprungmarke zur Zeile 2775 enthält. Diese Zeilenmarkierung liegt vor dem hinteren Hufbein als Gruppenende 44_99 in EPI.Y+Pferd.Z.2775.#150883144990066. Weil der Scann das hintere Körperende umrundet und die Bauchseite nochmals abscannt, ist die zeitliche Reihenfolge korrekt.
Die Inneren Organe:
Das Herz liegt etwas nach links ausgerichtet im Bereich der 3. bis 6. Rippe, so dass es nicht allein nur aus einer Zeile #5555 bestehen kann. Weil im Zeilenlauf die Ziffer „5“ als Herzmuskel bereits anliegt, kann das Herzvolumen im Zeilenlauf als Null-Spalte #50... gezogen und symbolisiert werden. Die linke Herzhälfte wird durch die Episode EPI.X+Pferd und rechte Herzhälfte durch die Episode EPI.Y+Pferd gebildet. Beide Hälften setzen sich als Gruppe 444 aus diversen Codezeilen zusammen. Das Herz besteht in der Lesart 44_4 aus 4 Hohlräumen (2 Vorkammern, 2 Herzkammern/Ventrikel). Die Herzfunktion entspricht dem Herz des Menschen, jedoch ist es mathematisch einfacher strukturiert. Statt der 4 Herzklappen sind es zunächst nur die 2 Klappen jeweils zwischen Vorkammer und Hauptkammer/Ventrikel erkennbar. Die beiden Herzkammern enthalten für die ausströmende Aorta und die Lungenarterie jeweils ein Herzwandloch für das Gefäß, so dass die folgende Klappe dem Gefäß und nicht dem Herz zugeschrieben werden kann. Weil in der Episode EPI.X+Pferd keine dreiteilige Klappe verfügbar ist, windet sich der Aorten-Anfang über die Herztrennwand und bedient sich in der Episode EPI.Y+Pferd mit einer Aortenklappe (ähnlich der Pulmonalklappe).
Das vertikal stehende Herz wird analog zur Darstellung der Vorderbeine des Pferds um 90° in den Zeilenlauf einklappt. Die ausströmenden Gefäße ziehen im Zeilenlauf somit auch das Herz in die Länge. Das Herz wird vor der 6. Rippe erst wieder durch die Herzspitze sichtbar. Durch den Zeilenlauf bis #450... hat sich die Volumenform nach unten in Herzform zugespitzt. Der Scann kann nicht mehr rückwärts in die Vergangenheit schauen, so dass die Folgen der Herzdrehung unberücksichtigt bleiben. Real sind die Herztöne der Pulmonalklappe im 3. IKR und der Aortenklappe im 4. IKR bereits vor der zugeordneten Klappe am Vorkammer-Ausgang zu hören. Damit können sich vorn Gefäßbögen bilden, um dann rückwärtig zum Körper bzw. zur Lunge umzuschwenken. Der Interkostalraum (IKR) = (ICR / Spatium intercostale) ist der Zwischenrippenraum. Der 3. Rippe (costa/ribs) folgt beispielsweise der 3. IKR.
Durch ein kapillares „Wundernetz“ verzweigt sich ein Gefäß, Vene 8 oder Arterie 9 und wird dann wieder gleichartig zusammengeführt. Sobald das Kapillarsystem mit Sauerstoff in Kontakt kommt, wird es mit Wechselfunktion zur Lunge. Das venöse Blut (O2arm) der Hohlvene des Körpers strömt durch die rechte Herzhälfte und weiter als Lungenarterie (Arteriae pulmonales) zur Lunge. Als arterielles (O2reich) Blut fließt es nunmehr der linken Herzhälfte über die Lungenvene (Venae pulmonales) zu. In der medizinischen Logik ist jede Herzhälfte ein Herz für sich mit einer Arterie bzw. Aorta als Ausgang. Mathematisch ist das Herz dagegen eine Gesamtgruppe und der Lungenkreislauf somit ein inneres System. Im Zeilenlauf hat das Herz von der folgenden Lunge auch noch keine Kenntnis. Die Art des Gefäßes von Lungenvene/Lungenarterie ist somit nicht eindeutig als 8 oder 9 zu finden. Zu erwarten ist eine unbestimmte Kombination 89 mit der 2 als Lungenhintergrund.
Herzbeutel 5_33_5: EPI.X+Pferd.Z.776.#533576095592603.
Linkes Herzohr zum Gefäßanschluss 1=Links : EPI.X+Pferd.Z.808.#519517001480376.
Linke Herzhälfte als Gruppe 444: EPI.X+Pferd.Z.808.#512444369034480. Linke Vorkammer: Zulauf der O2reichen-Lungenvene 99_20012. Diese wird mit 99 wie eine Arterie gelesen und hat mit 2_2 einen Lungenhintergrund. Die „Null-Spalte“ für die Herzwand der Vorkammer beginnt: EPI.X+Pferd.Z.808.#509920012536773. Mitralklappe (Bikuspidalklappe, Valva atrioventricularis sinistra). Es ist eine Segelklappe aus 2 Membranhäuten (zweizipflig), an deren freiem Ende Sehnenfäden zur Herzwand spannen. Die bewegliche 6 Form 7 bildet eine Trichterform 79_79: EPI.X+Pferd.Z.818.#5061797679460390. Die Klappen-Funktion 33 wird mit 1_33_0 als ZU/AUF kombiniert: EPI.X+Pferd.Z.819.#505561721831330. Linke Herzkammer als Ende der Null-Spalte: EPI.X+Pferd.Z.828.#500066485724468. Segelfäden an der Mitralklappe 101:EPI.X+Pferd.Z.839.#493510190917592.
Herzkammer-Loch 5_0_55 für Aorta-Anschluss: EPI.X+Pferd.Z.843.#491168505551435. Aorta 9000_5 als Arterie 9: EPI.X+Pferd.Z.845.#490005976544212. Aortenklappe: Funktion als Formänderung 77 der Membran 33. „Auf“ 500 / „Zu“ als Einschub der 51 in 500 wie: 35_51_3: EPI.X+Pferd.Z.869.#487697350035170. Herzmuskel der linken 1 Hälfte ist stärker als der rechte Muskel: EPI.X+Pferd.Z.901.#459550555138579. Herzform nach unten symmetrisch verengt: EPI.X+Pferd.Z.910.#455005549648197. Herzspitze 505 innenseitig 9999 ausgerundet: EPI.X+Pferd.Z.919.#450549564939999. Außenkontur der Herzspitze größer als innen, endet vor dem 6. Brustwirbel: EPI.X+Pferd.Z.920.#450059837152021.
Rechtes Herzohr 500: EPI.Y+Pferd.Z.813.#515007044707790. Hohlvene 88 (Vene=8) bringt sauerstoffarmes Blut aus dem Körperkreislauf. „Null-Spalte“ für die Herzwand: EPI.Y+Pferd.Z.821.#509988705660698. Rechte Herzhälfte als Gruppe 444, 2=Rechts: EPI.Y+Pferd.Z.822.#509368281444566. Klappenfunktion Auf/Zu=0_33_1: EPI.Y+Pferd.Z.825.#507516033148404. Die dreizipflige Trikuspidalklappe (Valva atrioventricularis dextra) am Ausgang der rechten Vorkammer ist eine Segelklappe, von der sich Sehnen zur Herzwand spannen. Nur 2 Zipfel liegen sich symmetrisch gegenüber, der 3. Zipfel schiebt sich seitlich nur wenig ein: 690_QS1+6=7(Form)_069: EPI.Y+Pferd.Z.826.#506901606958152. Herzkammer-Loch 0_5557_0 für den Ausgang der Lungenarterie: EPI.Y+Pferd.Z.841.#497860555704439. Die Pulmonalklappe (Valva trunci pulmonalis) besteht aus 3 Taschen (Valvula semilunaris dextra/sinistra/anterior) zur Lungenarterie 9: EPI.Y+Pferd.Z.844.# 496090909179423. Aortenklappe (Valva aortae) aus 3 Taschen (Valvula semilunaris dextra/sinistra/septalis) wird in EPI.Y+Pferd für EPI.X+Pferd bereitgestellt. Aorta 99 > Lungenarterie 9: EPI.Y+Pferd.Z.850.#492589090996980. Segelfäden 1010101 an die dreizipflige Segelklappe: EPI.Y+Pferd.Z.918.#456101010182389. Bogen 6000 der Hohlvene 800: EPI.Y+Pferd.Z.929.#450700460008001. Herzspitze 55 des rechten Ventrikels vor der 6. Rippe: EPI.Y+Pferd.Z.930.#450215835857455.
Die Struktur 55 der Luftröhre 2_55_2 in der Art durchgezählter Knorpelspangen 22 endet 9 vor einer Verzweigung auf 2 Hauptbronchien: EPI.Y+Pferd.Z.984.#425508869255522. Verzweigte Hauptbronchien 22_22: EPI.Y+Pferd.Z.994.#421228095922971. Die kaudale Ausdehnung der Lunge ist durch die Kontur des Zwerchfells begrenzt. Lungenfunktion: Der luftleitende (konduktive) Teil des Bronchialsystems geht in den respiratorischen Abschnitt mit den Bronchioli respiratorii und den Ductus alveolares über, die die Lungenbläschen (Alveolen) enthalten. Die Lungenbläschen 22_00 kommen mit dem venösen 8 Blut in Kontakt: EPI.Y+Pferd.Z.1003.#417448382200831. Durch den Gasaustausch entsteht arterielles 9 Blut: EPI.Y+Pferd.Z.1004.#417032596959595.
Das Zwerchfell (Diaphragma) trennt die Brusthöhle mit dem kleinen Herz und der großen Lunge von der Bauchhöhle mit Leber, Magen/Darm, Milz, Niere etc. ab. Vom kaudalen Ende des Brustbeins am Schwertfortsatz (Processus xiphoideus) beginnend, zieht sich das Zwerchfell kuppelartig gewölbt, steil und dann weitläufig bis unter die Wirbelsäule hoch. Weil diese Entfernung nicht über einzelne Zeilen adressiert werden kann, muss das Zwerchfell als „Zählmembran“ organisiert werden. Das Atmungssystem ist mit 22 als Luftröhrenknorpel/Bronchien bekannt, so dass mit der Zählgröße 1 die 2_1_2 als vorderer, unterer Startpunkt in EPI.Y+Pferd und als hinterer, oberer Zielpunkt der Schlusspunkt in EPI.X+Pferd adressierbar ist. Die Zwerchfell-Kurve bildet sich nunmehr über den Zeilenlauf an den Fixpunkten der Membran-Struktur 33_5 (analog zu Wirbeln 11_5). Das Zwerchfell liegt als Besonderheit in einem Zeilenabschnitt, der von der Zählgröße 33_5 über den Zeilenlauf kontinuierlich durchwandert wird.
Zwerchfell-Start: EPI.Y+Pferd.Z.1247.#3357664212890400 und weiter Z.1248, Z.1249, Z.1303, Z.1335, Z.1483, Z.1485, Z.1487, Z.1505, Z.1620 bis EPI.Y+Pferd.Z.1703.#245860673721335. Im Gegenlauf ab Z. EPI.X+Pferd.Z.1305.# 317283563356214, weiter mit Z.1468, Z.1477, Z.1526, Z.1562, Z.1628, Z.1654, Z.1667, Z.1773 bis Zwerchfell-Ende: EPI.X+Pferd.Z.1950.#212335923169159.
Entsprechend der Neigung des Zwerchfells liegen auch die weiteren Organen in einer Schräge und überdecken sich als Sandwich-Paket über mehrere Zeilen. Eine Unterscheidung ist mit der Leber 5555..., dem Magen als Hohlorgan 500..., der Milz 555...möglich. Die paarige, kleine Niere folgt als Einzelzeile 555.
Leber: EPI.X+Pferd.Z.1308.#316555848761360 steil ansteigend bis EPI.X+Pferd.Z.1450.#285555207020593.
Zwerchfell-Loch: Die Durchleitung der Speiseröhre 505 (Muskelschlauch) im Zwerchfell-Loch 33_0_3: EPI.X+Pferd.Z.1515.#273303663485056.
Mageneingang (Kardia): Der Rückfluss des Speisebreis wird durch einen schleifenförmigen Muskel verhindert. Hier zeigt sich der Muskel 55 und ein Versatz der Speiseröhre (Ösophagus) 505: EPI.X+Pferd.Z.1399.#295965010850507 und EPI.X+Pferd.Z.1401.#295542505481698.
Magen: Der Magen liegt überwiegend links in der Bauchhöhle und endet im 15. Interkostralraum (hinter 15. Rippe). Im drüsenlosen Teil des Magens (Pars nonglandularis) werden Kohlenhydrate in Zucker und Stärke gespalten: EPI.X+Pferd.Z.1406.#294491500839160. Im Drüsenabschnitt des Magens (Pars glandularis) wird Salzsäure produziert: EPI.X+Pferd.Z.1478.#280145500798281. Salzsäure Cl=17 markiert als 2_17_2 in Drüse 8_8: EPI.X+Pferd.Z.1478.#279578021728467 weiter bis zum Magenende: EPI.X+Pferd.Z.1594.#259758500740188.
Bauchspeicheldrüse (Pankreas): EPI.X+Pferd.Z.1624.#254960006268386. Ausführungsgang 9009 von Leber und Bauchspeicheldrüse zum Dünndarm 88. Das Pferd besitzt keine Gallenblase: EPI.X+Pferd.Z.1635.#253244679009088. Dünndarm 808: EPI.X+Pferd.Z.1638.#252780860915665. Der Dünndarm in Darmschleifen 300 als gewundene Form 7777: EPI.X+Pferd.Z.1707.# 242563005377774.
Milz: EPI.X+Pferd.Z.1659.#249581103182555, EPI.X+Pferd.Z.1775.#233270450805555, bis EPI.X+Pferd.Z.1797.#230414607779555.
Niere paarig 2, 555: EPI.X+Pferd.Z.1912.#216555988587793 (am 2. Lendenwirbel).
Harnleiter (Ureter): Innerhalb der Niere wird der Harn im Nierenbecken (Pelvis renalis) gesammelt und im paarigen, sehr langen Harnleiter zur Harnblase abgeführt. Der Harnleiter kann als Serie #211 beginnen und dann als Röhre 303 weiter ziehen. EPI.X+Pferd.Z.1954.#211901253930327 bis EPI.X+Pferd.Z.3311.#124303527523224. Die unpaarige 1 Harnblase liegt dann unterhalb der Eintrittsforte (Ostitum uteri externum) zum Gebärmutterhalskanal. Harnblase (Vesica urinaria) 50000: EPI.X+Pferd.Z.3370.#122865000053371. Am Ausgang der Harnblase beginnt die unpaarige Harnröhre (Urethra), die weiterhin als 303 geführt wird. Paarig 2 ist geklammert 1_2_1 als unpaarige Fortsetzung. EPI.X+Pferd.Z.3402.#121709303403839. Bei der Stute (female horses) 66 wird die muskulöse 5 Harnröhre horizontal 5_999_5 zur Vagina weiter geführt: EPI.X+Pferd.Z.3460.#119669089647358 und EPI.X+Pferd.Z.3462.#119599956724396. Die Harnröhre 303 mündet in die Vagina im Bereich ab EPI.X+Pferd.Z.3663.#113037141736243.
Beim Hengst (male horses) 3333 dreht sich die Harnröhre als Formänderung 777 zur Leistengegend nach unten. EPI.X+Pferd.Z.3421.#121033338257778. Am Anfang der Harnröhre leiten noch die paarigen Samenleiter ein. Diese werden von den Hoden/ Nebenhoden hochgeführt. Die Hoden bilden sich im Zeilenlauf erst nach der Umrundung des Körperendes in einer Bauchansicht. Am Ende der beiden Samenleiter liegt eine fingerdicke Aufweitung als Samenleiterampulle (Ampulla ductus deferentis). Einmündung des Samenleiter 404 in die Harnröhre 303: EPI.X+Pferd.Z.3468.# 119393036384043. Aufgrund der Einmündung „404“ ist dazu passend die vorgelagerte paarige Samenleiterampulle 4004 zu finden: EPI.X+Pferd.Z.3435.#120540043720483. Die Harnröhre wird abweichend vom Menschen nicht von der Prostata-Drüse umschlossen.
Nach dem Magen beginnt der Dünndarm in 3 Abschnitten [Zwölffingerdarm (Duodenum), Leerdarm (Jejunum), Hüftdarm (Ileum)] gefolgt vom Dickdarm in 4 Abschnitten [Blinddarm, großer Grimmdarm, kleiner Grimmdarm, Mastdarm/Rectum).
Am Übergang vom Ileum zum Blindarm (Caecum) liegt ein Schleimhautwall 0_3333_0, der die Rückströmung von Gasen aus dem Blinddarm in den Dünndarm verhindert. Verschlusswall: EPI.X+Pferd.Z.2275.#182002219859279 und EPI.X+Pferd.Z.2276.#181922254033330. Übergang Dünndarm/Dickdarm: EPI.X+Pferd.Z.2289.#180889056435063 und EPI.X+Pferd.Z.2290.#180810065580725.
Im Zeilenlauf liegt unterhalb der Organe zunächst eine Dickdarmschleife 3000, die sich dann wechselseitig mit Dünndarmschleifen 300 überlagert. Die Dickdarmschleife zeigt sich am Wendepunkt durch einen großen Bogen 30003 und den inneren engen Bogen 303 als Haut 3. Dickdarmbogen: EPI.X+Pferd.Z.1380.#300039891434681 und EPI.X+Pferd.Z.1382.# 299605680303806. Weiterer Dickdarm: EPI.X+Pferd.Z.1603.#258300093686750, EPI.X+Pferd.Z.1685.#245730000106742 bis EPI.X+Pferd.Z.2071.#199930009744017.
BiXnom-BIXN-Punkt (Wechsel 33 zu 66): EPI.X+Pferd.Z.1992.#207858960933664. Die bohnenförmigen Eierstöcke liegen real unterhalb des 4. und 5. Lendenwirbels. Die folgende Fundstelle liegt abweichend etwas vor dem 4. Lendenwirbel:
Eierstöcke ab EPI.X+Pferd.Z.1992.#207754666422408. Trompetenförmige Aufweitung des Eileiters: EPI.X+Pferd.Z.2006.#206408300189362. Eileiter: EPI.X+Pferd.Z.2007.#206305455993951. Die Mündungsstelle des Eileiters (Ostium uterinum tubae uterinae) in das Uterushorn (Cornu uteri) liegt auf der Papilla uterina: EPI.X+Pferd.Z.2008.#206202714232998. Uterushorn (Cornu uteri) 1000, Form 7, paarig 53_53: EPI.X+Pferd.Z.2009.#206100074753539. Uteruskörper, unpaarig 1: EPI.X+Pferd.Z.2022.#204775000088951.
Der Uteruskörper dehnt sich extrem weit aus, so dass die Eintrittspforte (Ostitum uteri externum) in den Gebärmutterhalskanal (Canalis cervicis uteri) erst vor den Schweifwirbeln endet und dort in die Vagina übergeht. Ausbildung einer Symmetrie 23_23; 96_96 in Bezug auf Hormon 66: EPI.X+Pferd.Z.3360.#123230669696387. Zunächst bildet die Vagina eine äußere Übergangskontur als räumliche 4 Umfassung 4004. EPI.X+Pferd.Z.3361.#123194004814002. Die Eintrittspforte kann nunmehr dort einmünden 404: EPI.X+Pferd.Z.3363.#123120740463830.
Die Schweifwirbel bilden die muskulöse Schweifrübe, die mit Langhaar 3_3_1 besetzt ist und den Schweif (Cirrus caudae) bildet. Schweifhaare 1 als Gruppe 44. Haarwachstum 13-18 mm/Monat: EPI.X+Pferd.Z.#118301442908531. Langhaar 9001: EPI.X+Pferd.Z.#3533.#117196447829001.
In EPI.X+Pferd beginnen die Schwanzwirbel in Zeile 3570. Die Schweifwirbelkette wird für den Scann um das Körperende unterbrochen. Das Rektum (Mastdarm/Enddarm) ist der letzte Abschnitt des Dickdarms 808: EPI.X+Pferd.Z.3625.#114222082808237. Nach außen mündet der After (Anus) 505: EPI.X+Pferd.Z.3654.#113315558341505. Bei der Stute schließt sich an den Gebärmutterhals die Scheide (Vagina) 5000 an, die unterhalb des Afters nach außen führt: EPI.X+Pferd.Z.3676.#112637391235000.
Im Zeilenlauf entwickeln sich die Hoden des Hengstes vor dem Euter der Stute. Zunächst ist die Harnröhre des Hengstes 303 sichtbar, weil diese zum Penis weiterführt: EPI.X+Pferd.Z.3981.#104007799593032. Hoden 3333, Struktur 555, paarig 2, Form 7 rund 0_3: EPI.X+Pferd.Z.3983.#103955573733332. Nebenhoden: EPI.X+Pferd.Z.3985.#103903400296075. Samenleiter: EPI.X+Pferd.Z.3987.#103851279202373. Muskel 55 spannt zur Hoden-Aufhängung zum Beckenknochen: EPI.X+Pferd.Z.3990.#103773195533799. Hodensack 0_0, Haut 33: EPI.X+Pferd.Z.4008.#103307148248468.
Das Euter (Mamma) ist in der Leistengegend der Stute (Hormon 66, weiblich 1) mit Milchdrüsen angelegt. Der Milchdrüsenkomplex ist paarig 2 angelegt mit 1 Zitze je Komplex. Die Stute besitzt 1 paarigen Komplex und hat somit 2 Zitzen. Euter: EPI.X+Pferd.Z.4019.#103024396660826. Zitze 1, paarig 2: EPI.X+Pferd.Z.4033.#102666761760441.
Der Penis zeigt sich durch die seitlichen Schwellkörper der Blutgefäße 98_89. Die Formänderung 737 wird vom Testosteron 3_3 bewirkt. Die Erregung wird durch 66=weiblich symbolisiert: EPI.X+Pferd.Z.4209.# 983737348966167. Der Penis ist zuvor bereits im Körper mit seinen Schwellkörpern 9898_9009 als bauchwärts führender, schlauchförmiger Bogen angelegt: EPI.X+Pferd.Z.4183.# 989851900979822. Die Eichel am vorderen Ende des Penis schwillt beim Koitus (66/33) 2-3fach auf einen Durchmesser von 15-20 cm. Die Eichel 98_98 ist als Arterie 9 und Vene 8 als Schwellkörper symbolisiert und zeigt mittig das Ende der Harnröhre 303. EPI.X+Pferd.Z.4212.#983036681338698. Im entspannten Zustand zieht sich der Penis in eine Einstülpung der Bauchhaut in den „Schlauch“ zurück. Der Schlauch 111 zeigt sich in 3 Zeilen. In der mittleren Zeile ist die Eichelgrube adressiert. Die Harnröhre sitzt mittig in der Eichelgrube 0400: EPI.X+Pferd.Z.4215.#98233701110287; EPI.X+Pferd.Z.4216.#982104008965511; EPI.X+Pferd.Z.4217.#981871117334265. Die Schwellkörper des Penis führen zur Erektion. Beim „Ausschachten“ wird der Penis mit einer Länge von 30 bis 50 cm sichtbar.
Aufgrund der Zählwirbel #115 in EPI.X+Pferd und der Zählrippen in #115 in EPI.Y+Pferd fallen in der jeweiligen Umgebung immer auch Muskel 5 als Zählmuskeln „#511“ an. Weil es weiterhin auch noch Zählknochen #225 gibt, können Muskeln im Sonderfall auch als „#522“ adressiert sein.
Zwei besonders kräftige Muskeln sind als #55511 modifiziert, die dezimal wegen Zeile 349 wie Zeile 3490 gleichartig sind: 1.) Der Äußere Kaumuskel (Musculus masseter) zieht sich außen von der Jochbeinleiste unterhalb des Auges nach unten zum hinteren Rand des Unterkiefers. Mit 1199_7_1 können mehrere Muskelschichten erfasst werden, die jeweils durch Sehnenplatten getrennt sind. Die Ziffer 2 für einen paarigen Muskel fehlt, nur indirekt ist eine Dopplung 11_11 vorhanden. Dadurch können sich beide Seiten unabhängig anspannen und eine seitliche Mahlbewegung erzeugen. Bei beidseitiger Anspannung wird das Maul geschlossen: EPI.Y+Pferd.Z.349#1199715551138780. 2.) An der Hüfte ist der oberflächliche Kruppenmuskel (Musculus glutaeus superficialis) 55511 beim Pferd mit dem kaudalen Ende 1199 des Musculus tensor fasciae latae vereinigt. EPI.Y+Pferd.Z.3490.#119971555113878. Wie im deutschen Sprachgebrauch ist Backe (Wange) = Backe (Podex/Gesäß).
Damit der Pferderücken nicht durchhängt, muss eine Hängebrücke aus dem vom Halswirbel zum Kreuzbeinwirbel gespannten langen Rückenmuskel und dem unter dem Brust- und Bauchraum gespannten geraden Bauchmuskel (Musculus rectus abdominis) gebildet werden. Die Muskel-Streckung wird als #5111 oder ähnlich adressiert. Der lange Rückenmuskel (Musculus longissimus dorsi) 51111 beginnt am Hals, weil er vor dem 1. Brustwirbel (Vertebrae thoracicae) im Zeilenlauf steht. Die Muskel-Markierung 5_7_5 ist eine Form 7, um damit das Muskelende zu finden: EPI.X+Pferd.Z.601.#688943511114575. Das Muskelende 51117_9 bildet sich nach dem 4. Kreuzbeinwirbel und zeigt die Ziffer 9 als Ende der zuvor markierten Form 7: EPI.X+Pferd.Z.3163.#130905801511179. Der Scann umrundet das Körperende und kann dabei die zuvor im Zeilenlauf angelegten Extremitäten mit herausdrehen und senkrecht stellen. Der gerade Bauchmuskel ist daher nach der Position der Hufbeine ausgerichtet. Der gerade Bauchmuskel (Musculus rectus abdominis) 5111 beginnt nach den vorderen Hufbeinen in EPI.X+Pferd.Z.1117.#370684915111781 und spannt sich bis vor die hinteren Hufbeine in EPI.X+Pferd.Z.2740.#151114981817467. Der innere schiefe Bauchmuskel (Musculus obliquus internus abdominis) 5111 ist kürzer und zieht sich von der Bauchmitte in EPI.X+Pferd.Z.1672.#247640580251112 bis zum Beckengürtel hoch. Im Zeilenlauf ist er vor dem Darmbein zu finden. EPI.X+Pferd.Z.2254.#183697892715111.
Die Muskelbezeichnungen wie Musculus bicepts, tricepts und quadriceps finden sich durch die Anzahl der Muskelköpfe im Zifferncode wieder. Der Sägemuskel zieht zackenförmig als „Sägeblatt“ von den einzelnen Rippen, ist unter dem Schulterblatt fixiert und zieht weiter zu den Halswirbeln. Weil das Pferd kein Schlüsselbein besitzt, wird der Rumpf am Vorderbein mittels Sägemuskel aufgehängt. Für eine Säge-Form muss zwangsläufig zum Ausdruck der vielen Muskelansätze eine Sägemuskel-Gruppe 44 gebildet werden. Der Muskel entspringt direkt der Knochenhaut, so dass statt 511 eine Knochenmuskelgruppe 522_44 maßgeblich wird. Der Sägemuskel (Musculus serratus ventralis) kann aufgrund des Fixpunktes am Schulterblattes in 2 selbstständige Muskeln geteilt werden: 1.) Musculus serratus ventralis cervicis: EPI.X+Pferd.Z.335.#1235985224417490 und 2.) Musculus serratus ventralis thoracis: EPI.X+Pferd.Z.930.#445220484064365.
Vom Schulterblatt mit 1 Muskelkopf und vom Oberarm (Humerus) mit 2 Köpfen spannt der 3-köpfige Oberarmmuskel (Musculus triceps brachii) zum Ellenbogen. Bei anderen Tieren sind es abweichend 4 Köpfe. Die Ziffer 4 in 4_9_4 verstärkt am Ende 99 rechts die 3 Köpfe in EPI.X+Pferd.Z.838.#494099105226563.
Der Halbhäutige Muskel (Musculus semimembranosus) 5111_121 ist ein fleischiger Muskel, der die Hinterbacke unterlagert. Beim Pferd ist noch ein zusätzlicher Wirbelkopf am 1. Schwanzwirbel ausgebildet. Die Suche nach der Haut 33 führt direkt zur Zeilennummer in EPI.X+Pferd.Z.3354.#1234511181216040.
Der Vierköpfige Kniegelenksstrecker (Musculus quadriceps femoris) 115111_404 ist bei allen Haussäugetieren ausgebildet. Die Köpfe sind verschmolzen, einer entspringt an der Hüfte und 3 am Oberschenkelbein. Der Muskel wird vom Musculus tensor fasciae latae und dem Musculus sartorius bedeckt: EPI.X+Pferd.Z.3597.#115111217731404.
Der Zweiköpfige Oberschenkelmuskel (Musculus biceps fermoris) 5511_2 enthält die Ziffer 2 in EPI.X+Pferd.Z.3694.#112088535511602.
Das kaudale Körperende wird vom Halbsehnenmuskel (Musculus semitendinosus) gebildet: EPI.X+Pferd.Z.3828.#108164851144164.
Der Bauchnabel (Umbilicus) als Haut 33 in „0330“ wird vom Fell bedeckt, nachdem sich der Nabelstumpf beim Fohlen zurückgebildet hat. Der Nabel ist nur bei Primaten und Menschen deutlich erkennbar. Die Blutgefäße bringen sauerstoffreiches Blut von der Plazenta zum Fötus. Der Nabel bildet sich aus der rechten und linken Nabelarterie (Arteria umbilicalis) 909, der Nabelvene (Vena umbilicalis) 8 und ziehen im Embryo am Urharngang (Urachus) 6000 entlang. In der Lage korrekt angeordnet folgt der Bauchnabel im Zeilenlauf dem Penis. Umbilicus: EPI.X+Pferd.Z.4231.#978622193760008 und EPI.X+Pferd.Z.4232.#978390950330481.
„Return to Sender“: Der Scann ist durch das Pferd gelaufen, muss für weitere Details aber noch zum Kopf zurücklaufen, und zwar normalerweise bis zur Zeile 10000. Diese entspricht bis auf weniger End-Nullen der Zeile 1.
Die 7 Halswirbel sind nur als Platzhalter einer Zeilenserie #115 entstanden. Weiterhin konnte sich das Gehirn mit #6666 nicht detailliert entfalten. Der Scann wird daher bauchseitig in der Mittelachse fortgeführt, wobei eine untere Struktur 9_5 und Form 9_7_9 am Bauch als eine Hautfalte 1_ 33_7_1 im Zeilenlauf EPI.X+Pferd von Z.4314.#959793811265321 bis Z.4358.# 950103373519641 als Zähl-Aktivität mitgezogen wird. Das Bauchfell ist auf der halben Rumpflänge kurz (über 3 Zeilen) faltenfrei, um dann in EPI.Y+Pferd von Z.4362.#959882456092236 bis Z.4407#950081069542621 zwischen die Vorderbeine fortgesetzt zu werden. Aufgrund dieser Zeilenorientierung können nunmehr die langen Muskeln im Kopf-Brust-Bereich gebildet werden, um darin die Zeilen für die Halswirbel zu erkennen.
Der Oberarm-Kopf-Muskel (Musculus brachiocephalicus) spannt sich paarig („2“ fehlt Ersatz 151) vom Oberarm in EPI.X+Pferd.Z.4176.#991511135488169 über das Buggelenk in EPI.X+Pferd.Z.5501.#752690511143173 zum Warzenfortsatz (Processus mastoideus) des Schläfenbeins am Kopf EPI.X+Pferd.Z.6010.#688943511114575. Enthalten ist 88 wie vom Muskelansatz am Oberarm (Humerus), wobei die fehlende Paarigkeit „2“ durch die Muskel-Länge 51111=511+511 mit 5_7_5 als Form 7 gedoppelt wird. In EPI.X+Pferd.Z.4679.#884922099123444 werden die 3 Muskel-Zeilen 1-2-3 als Gruppe 444 avisiert. Beim Pferd besteht der Muskel aus 2 eigenständigen Muskeln (M. cleidomastoideus und M. cleidobrachialis), die durch einen Bindegewebe-Streifen (Klavikularstreifen) 33_9_33 voneinander getrennt sind: EPI.X+Pferd.Z.5971.#693443393367710.
Der Oberarm-Kopf-Muskel überspannt die Halswirbelsäule. Deren Platzhalter wurde als Serie #115 am linken Zahlenrand gezählt. Nunmehr wird die „115“ am rechten Zahlenrand (mit 2 begründeten Ausnahmen) gezählt, wobei der Atlas-Wirbel erst zum Schluss erscheint: 7. Halswirbel: EPI.X+Pferd.Z.4514.#917268609171155; EPI.X+Pferd.Z.4697.#881530871151500; EPI.X+Pferd.Z.4894.#846046281528115; EPI.X+Pferd.Z.5045.#820723588067115; EPI.X+Pferd.Z.5309.#779911565605311; Axis: EPI.X+Pferd.Z.5925.#698827088911155; 1. Halswirbel (Atlas): EPI.X+Pferd.Z.6144.#673917724902115. Aus einer Vertiefung im 1. Halswirbel (Atlas) zieht der „Seitliche gerade Kopfmuskel (Musculus rectus capitalis)“ 5555 zum Hinterhaupt: EPI.X+Pferd.Z.5909.#700719326755559.
Die Luftröhre 202 mit den Knorpelspangen 22 wird am Hals durchgeführt: EPI.X+Pferd.Z.6071.#682021166496227. Speiseröhre 505: EPI.X+Pferd.Z.6140.# 674356759250586.
Ein weiterer langgestreckter Unterhalsmuskel ist der Brustbein-Unterkiefer-Muskel (M. sternomandibularis). Der paarige Muskel beginnt vorn am kranal gelegenen Teil des Brustbeins (Sternum). Die paarigen, rundlichen Muskeln berühren sich am Brustbein, so dass die Ziffer 2 noch frei ist, um mit 22_55 das Brustbein 225 selbst zu adressieren: EPI.Y+Pferd.Z.4653#899851122603553. Die beiden Muskeln 55_111_55 ziehen gemeinsam hoch und trennen sich erst in Mitte des Halses: EPI.Y+Pferd.Z.5152#812695511155732. Der Muskel verjüngt sich im Bereich der Ohrspeicherdrüse in der Normgröße „511“ und zieht als Sehne „3333_1“ zum halsseitigen Rand des Unterkiefers: EPI.Y+Pferd.Z.5152#785112933334771.
Zwischen Oberarm-Kopf-Muskel und Brustbein-Unterkiefer-Muskel formt sich längs des Halses die paarige 2 Drosselrinne „000“. In der Rinne verläuft die Drosselvene (Vena jugularis externa) 8. Drosselrinne: EPI.X+Pferd.Z.4942.#837828915782800; EPI.X+Pferd.Z.4963.#834283800483295; EPI.X+Pferd.Z.5170.#800880174429129; EPI.X+Pferd.Z.5266.#786280004139498; EPI.X+Pferd.Z.6089.#680005009328066.
Der Weg zur Speiseröhre (Ösophagus) wird geöffnet, wenn der Zungengrund das Gaumensegel hochdrückt und der Kehldeckel zum Verschluss der Luftröhre zurückklappt. Die Speiseröhre verläuft dorsal der Trachea und verschiebt sich in Höhe des 4.-5. Halswirbel nach links, dorsolateral der Trachea. Seitliche 9999 Lage der Speiseröhre 505, wobei links = 1 fehlt, aber wegen des Rücklaufs als 2 gelten kann: EPI.X+Pferd.Z.5185.#807523099995050. Eine Verstopfung der Speiseröhre (Schlundverstopfung) durch Fremdkörper, Äpfel etc. ist an der linken Drosselrinne tastbar.
Im Zeilenlauf #66 ist das Gehirn #6666 enthalten. Zugleich kommt damit auch der Sexualzyklus der Stute in Betracht. Die weibliche Steuergröße 66 bezieht sich auf das Östrogen, dessen Produktion in den Follikeln der Eierstöcke vom Gehirn stimuliert wird. Das Follikel-stimulierende Hormon (FSH) wird in der Hirnanhangdrüse produziert. Dort wird auch das luteinisierende („gelbfärbend“) Hormon (LH) gebildet, welches den Eisprung bewirkt.
Die Stute zeigt die Paarungsbereitschaft (Rosse) durch ihr Verhalten an. Die Dauer der Rosse von 21 Tagen muss mit der Zeit 60 und Hormon 66 kombiniert sein, um den Steuerungsbereich zu erkennen: EPI.X+Pferd.Z.6253.#662170238573260. In Richtung des Hengstes 333 wird die Stute 66 den Schweif 151 mit 21 Schwanzwirbel heben, um schleimige Harnportionen 1_33 abzusetzen: EPI.X+Pferd.Z.6242.#663337151842133. Die Harnröhre 303 ist adressiert in EPI.X+Pferd.Z.6250.#662594095343030. Heben 9 des Schweifs 151: EPI.X+Pferd.Z.6252.#662276151919161.
Die Zeitdauer der Rosse wird über die Zeit mit 24 Stunden adressiert und dem Hormon Melatonin 88. Das Melatonin wird in der Zwirbeldrüse (Epiphyse) in Abhängigkeit vom Tageslicht produziert. Die Rosse und der Eisprung können auf diese Weise in den Wintermonaten blockiert werden. Die Rosse 777 dauert 7 Tage und nach dem 5 Tag (2 Tage vor dem Ende der Rosse) erfolgt der Eisprung: EPI.X+Pferd.Z.6250.#662488080287775.
Der Follikelphase der Rosse (Östrus) schließt sich die 14-tägige Zwischenrosse (Diöstrus) an, in der die Gelbkörper aufgelöst werden. Die Gelbkörper entstehen aus umgebildeten Follikelzellen und produzieren das Gelbkörperhormon Progesteron. Hat eine Befruchtung stattgefunden wird die Reifung weiterer Eizellen verhindert und die Gebärmutterschleimhaut wird zur Aufnahme eines Embryos vorbereitet. Hat sich kein Embryo eingenistet. bildet der Uterus das Hormon Prostaglandin, mit dem der Gelbkörper am 14. Tag nach dem Eisprung aufgelöst wird.
Die weiteren Details des Pferdeschädels werden zweckmäßig gegen den Zeilenlauf vorn am Maul beginnend entwickelt.
Die Zeile 1 bzw. 10000 markiert mit 4_1_4 die Maulspalte 1, die sich im Zeilenlauf vom Anfang 99 an den Schneidezähnen EPI.X+Pferd.Z.10000.# 414884819819499 bis zum Ende 99 vor die Backenzähne durchzieht: EPI.X+Pferd.Z.9879.#419976721959488. Der Zeilenlauf kann die Zeile 10000 überschreiten, wenn nach der heraushängenden Zunge 555 gesucht wird: EPI.X+Pferd.Z.10247.#404074412198555 und EPI.X+Pferd.Z.10301.#401956169478555.
Am Maul, Nüstern (Nasenloch) und Augen sitzen Tasthaare (Vibrissen), die über die Verbindung zu Nervenzellen den Tastsinn aktivieren, um den eingeschränkten Sichtbereich am Kopf zu kompensieren. Das Clippen/Rasieren der Tasthaare ist verboten. Beispielsweise sitzt am Maul eine Tasthaar-Gruppe 44, in der zusätzlich die Haut 33 adressiert wird. Enthalten ist das Haar 1 als Extra 8. EPI.X+Pferd.Z.9965.#415509332844816. Die links stehende Ziffer 1 (4_1...) ist kein Haar, sondern die Maulöffnung als Spalt 1 im Zeilenlauf. Die Beziehung zum Nerv 7 wird mit der 6 für flexibles Tasthaar markiert 6_1_6: EPI.X+Pferd.Z.9966.#415467640156391. Das beidseitige Tasthaar 17_71 steht rechts als 1 in weiteren Zeilen bis zum Gruppenende 44: EPI.X+Pferd.Z.9973.#415176025448571.
Die oberen Schneidezähne sitzen im Zwischenkieferknochen, der in der Mittelachse ein kleines Knochenloch 101 zeigt: EPI.Y+Pferd.Z.9995.#418910182438653. Der Knochen teilt sich nach hinten zum Oberkieferknochen in 2 Knochenleisten, die aufsteigen und das auskragende Nasenbein tragen. Es bildet sich in somit ein großes Knochenloch 20002, in das die auskragende Spitze des Nasenbeins 020 hineinragt: EPI.Y+Pferd.Z.9969.#420002735828502. Zwischenkieferbein 225: EPI.Y+Pferd.Z.9960.#420382256372925. Nasenbein: EPI.Y+Pferd.Z.9826.#426115130620225. Oberkieferbein: EPI.Y+Pferd.Z.9815.#42659269215225. Durch das Knochenloch 7007 (Foramen infraorbitale)[HB1] im Oberkieferbein tritt der Nerv 7 (Nervus infraorbitalis) durch den Schädel zur Haut nach außen: EPI.Y+Pferd.Z.9776.#428294524700730.
Nach der Maulspalte #41 folgt mit der Ziffer 2 in #42 die horizontale Knochenplatte als harter Gaumen (Palatum durum) zur Abgrenzung zwischen Maul– und Nasenhöhle. Als Ergänzung muss noch die 22 als Knochen vorliegen sowie die 11 um senkrecht die Nasenscheidewand (Septum nasi) auszubilden (QS1+4= Struktur 5, Form 7): EPI.Y+Pferd.Z.9926.#421822211714118.
Im Nasenraum sind weiterhin eine obere- und untere Nasenmuschel (Conchae nasales) als Knochenplatte 200, paarig 2 vorhanden. Die mittlere Nasenmuschel liegt weit hinten im Rachenraum. Beginn obere Nasenmuschel: EPI.Y+Pferd.Z.9944.#421058655820025. Beginn untere Nasenmuschel: EPI.Y+Pferd.Z.9728.#430407820052871. Beginn mittlere Nasenmuschel: EPI.Y+Pferd.Z.8565.#488850820020354.
Die Episode EPI.Y+Pferd enthält den Knochenaufbau der Nasengänge und der Nasenhöhle (Cavum nasi). Der Atemweg muss dann in die Leitepisode Episode EPI.X+Pferd über den Kehlkopf (Larynx) zur Luftröhre (Trachea) überführt werden. Das Gaumensegel (weicher Gaumen / Velum palatinum) trennt Mund- und Nasenrachenraum. Das Pferd atmet praktisch nur durch die Nase. Hierbei legt sich das Gaumensegel auf den Zungengrund und der geöffnete Kehldeckel (Epiglottis) legt sich dann auf das Gaumensegel. Der muskulöse Zeilenlauf #5 zeigt bei abgesenktem Gaumensegel in der Atemstellung den Nasenrachen 500000 als einen extremen Hohlraum: EPI.Y+Pferd.Z.8374.#500000868578258. Bei hochgeklappten Gaumensegel wird dieser Raum in der Schluckstellung zum Mundrachen. Das Gaumensegel 5555, ein 10 cm langes muskulöses Organ, ist erkennbar in EPI.Y+Pferd.Z.8282.#505555092184778. In der parallelen Leitepisode bildet sich nunmehr der dreieckförmige Kehldeckel (Epiglottis) in EPI.X+Pferd.Z.8281.#500006098514503. Die Dreieckform zeichnet sich über die Reduzierung der Nullen ab, so dass die Spitze 010 des Kehldeckels gebildet wird in EPI.X+Pferd.Z.8263.#501095304586542. In dieser Bewegungsrichtung liegt die Schluckstellung mit einer verschlossenen Luftröhre vor, wobei sich der Kehldeckel gegen den gleichzeitig schließenden Stellknorpel/Aryknorpel abstützt. Die paarigen Stellknorpel und die unten anschließenden Stimmbänder schieben sich von den Seiten zusammen. Stellknorpel 22 als Form 77 in EPI.X+Pferd.Z.8271.#500610627711111 und EPI.X+Pferd.Z.8262.#501155955192277. Stimmbänder: EPI.X+Pferd.Z.8243.#502311112677253.
Tränenbein: EPI.Y+Pferd.Z.9703.#431516775582225. Jochbein: EPI.Y+Pferd.Z.9593.#436464846604225. Stirnbein: EPI.Y+Pferd.Z.8031.#521355656017225. Scheitelbein: EPI.Y+Pferd.Z.7800.#532698126396225. Hinterhauptbein: EPI.Y+Pferd.Z.6800.#615736363746225.
Die Muskeln am Unterhals wurden bereits gebildet. Um die Muskeln am Oberhals zu lokalisieren, ist zunächst das an der Oberlinie des Pferdes gespannte Nackenrückenband zu bilden. Es besteht 1.) aus dem sehnigen Nackenstrang (Funiculus nuchae), der sich vom Hinterhauptbein zum Kreuzbein spannt und 2.) aus der Nackenplatte (Lamina nuchae) beidseitig des Halses.
Der Nackenstrang ist nicht als langer Knorpel 222 zu finden, sondern als Schnur 111, kombiniert mit der 2 für sehnige Festigkeit. Für die Nackenplatte wird die Ziffer 2 als paarig verwendet.
Der Nackenstrang 111 beginnt am Hinterhauptbein, d.h. vor den Halswirbeln. Die Form 7-Markierung zeigt die Rückenlinie und die Ziffer 2 ist geklammert 1_2_1, um nicht als paarig zu gelten: EPI.X+Pferd.Z.340.#12178089711172300. Der Nackenstrang endet aufgrund eines trivialen Ursache: Die dezimale Ziffern-Wiederholung liegt vor den Schweifwirbeln in EPI.X+Pferd.Z.3400.#1217808971117230. Der Nackenstrang ist am Dornfortsatz (Processus spinosus) des 3./4. Brustwirbels befestigt und bildet die Widerristkappe aus. An dieser Position von Zeile 781 bis 835 liegt die Strukturziffer 5 herausgehoben am linken Zahlenrand an: EPI.X+Pferd.Z.725.#5711104140411860. Die weitere Strecke wird als Rückenband (Ligamentum supraspinale) bezeichnet.
Am Widerrist ist weiterhin der Brustteil des Riemenmuskels 5111 (Muskulus splenius) befestigt. Die Kopplung 5_111 beschreibt den langen Muskel. Der Kopfteil des Muskels führt zum Hinterhaupt mit einer Befestigung zwischen dem 3. und dem 5. Halswirbel. Weil die Halswirbel sich aber er erst später im Zeilenrücklauf auffächern, muss der Muskel zwangsläufig zweiteilig gebildet werden. Brustteil (Musculus splenius cervicis): EPI.X+Pferd.Z.810.#5111790742961230. Kopfteil: (Musculus splenius capitis): EPI.X+Pferd.Z.4678.#885111265882556.
Der Hals entfaltet sich erst im Zeilenrücklauf von Z.4514 bis Z.6144 (Atlas). Zunächst wird vorgegeben, dass sich der Nackenstrang mittig als Rückenlinie 88_111_88 über die Nackenplatte legen soll: EPI.X+Pferd.Z.4921.#841404288111887. Die paarige Nackenplatte ist an 5 der 7 Halswirbel befestigt. Es sind 5 Sehnenstränge 1112 bzw. 2111 vorhanden. Die direkt anliegende Ziffer 2 (111_2) meint nicht allein paarig 2, sondern die obere Verbindung beider Nackenplatten auf der Rückenlinie: EPI.X+Pferd.Z.5204.#795647675211106; EPI.X+Pferd.Z.5356.#773067681441112; EPI.X+Pferd.Z.5433.#762111264825804; EPI.X+Pferd.Z.5799.#714011122917502; EPI.X+Pferd.Z.5826.#710702111534259.
Das Pferdfell benötigt ähnlich dem Nackenstrang und der Nackenplatte zur Entwicklung eine Zählgröße 333 zur Darstellung der räumlichen Ausdehnung der Haut 3. Im Ausnahmefall wird dabei der Zeilenlauf als Aalstrich (dunkelgefärbte Rückenlinie im Fell 1333) oder eine Zebrierung (Querstreifen des Zebras 2333 und 3332) bei Fjordpferden und Zebras dauerhaft sichtbar. Beim Zebra werden die weißen Streifen erst kurz vor der Geburt angelegt. Die Ziffer 2=paarig kann auch als 2=rechts gelesen werden, so dass die rechte Oberhaut (Epidermis) dicker ausgebildet wird als an der linken Körperseite. Die Haut wird erst detailliert als Struktur-Gruppe #5_44 entwickelt, weil der Zeilenlauf auf die Hautstruktur #533 zuläuft: EPI.Y+Pferd.Z.7683.#544970359686884. Der Schichtenaufbau ist dem Menschen ähnlich, so dass der Einsatz der Pferde-Peitsche aufgrund der Nerven in der Oberhaut schmerzhaft ist.
Fell-Streifen des Zebras (Zebrierung): Im Zeilenrücklauf werden am Hals 7 Querstreifen als #2333 (Z.4500, Z.4922, Z.5029, Z. 5305, Z.5350, Z.5885, Z.5990) und 1 Streifen als #3332 gezählt werden EPI.X+Pferd.Z.5692.#727433327793147. Wegen der unpaarigen Ziffer 1 entfällt ein weiterer Querstreifen, weil dieser als unpaariger Aalstreifen #1333 in der Rückenlinie zählbar ist: EPI.X+Pferd.Z.5690.#727689016133321. Die Querstreifen können auch die Stehmähne einfärben. Alternativ kann sich mittig in der Mähne auch der dunkle Aalstreifen durchziehen. Nach dem Hals folgen an der Brust über dem Vorderbein am Rücken 3 Querstreifen als #2333 in EPI.X+Pferd. Zeilen 450, 535 und 599. Das Körperende am Schweif umrundet, so dass die Querstreifen dort horizontal ausgerichtet sind. Am Oberschenkel 4 horizontale Fell-Streifen: EPI.Y+Pferd.Z.3749.#111683309508518;EPI.Y+Pferd.Z.3779.#11079669948331; EPI.Y+Pferd.Z.3788.#110533454949164; EPI.Y+Pferd.Z.3800.#110184401933535.
An den Vorder- und Hinterbeinen wird das Fell durch Stapel von Ringstreifen gefärbt. Um dieses gleichartig zu ermöglichen muss eine Bein-Ring-Gruppe gebildet werden. Vor den Vorderbeinen müssen noch die Rumpf-Querstreifen am Bauch zusammengeführt werden.
Die Bein-Ring-Gruppe überspringt den Bauch-Bereich durch eine Zeilen-Sprungmarke. Markiert als Gruppenfortsetzung 5_4_55 wird in der Gruppe 4_4 die Zeilennummer 4426: EPI.Y+Pferd.Z.4032.#103844426425455. Die Bauchmitte 1000001 wird durch Nullen geformt und als Hautform 7_3_7 markiert: EPI.Y+Pferd.Z.4187.#1000001737156520. Die Querstreifen können sich zu Bauch-Streifenringen 101 vereinigen. Bei einer Bauch-Zentrierung 101_101 sind es zusammen 2*4= 8 Bauchringe: EPI.Y+Pferd.Z.4145.#101013444474652. Die Anzahl der Farbringe in der Bein-Ring-Gruppe können am Hinterbein als Ring 033 gezählt werden. Am Oberschenkel wird 303 noch für den Durchlauf der Harnröhre benötigt. Unten am Fuß und an den Vorderbeinen können mit 303 ergänzende Ringe gefunden werden. Die Haar-Ringstreifen 1_033 an den Hinterbeinen bilden sich im Rücklauf der Parallelepisode: EPI.Y+Pferd.Z.4050.#103382895641342; EPI.Y+Pferd.Z.4051.#103357375301761; EPI.Y+Pferd.Z.4052.#103331867558597; EPI.Y+Pferd.Z.4053.#103306372402525.
Der Vorderbeinbereich von der Sprungzeile EPI.Y+Pferd.Z.4426.#946002547102199 bis zum 7. Halswirbel Z.4514 enthält bereits in der Zeilennummer die 44 als Gruppe. In den Zeilen ist mit #944 auch eine Folge von 5 Zeilen. Die 033 liegt ebenfalls in Kombination mit der 44 vor: EPI.Y+Pferd.Z.4438.#943444631247033. Die Zeilennummer 4444 ist eine weitere Symbolik. Die Gruppe endet mit der Ziffer 9 als Ende, dem Ring 5_0_7 und dem Haar 1: EPI.Y+Pferd.Z.4449.#941111996735071.
Bis zu den Halswirbeln wird dann noch das Brustfell gestaltet. Die Grundeigenschaft der Episode EPI.Y+Pferd ist die häufige Art einer „Dreifaltigkeit“ (3 Ziffern mit Null kombiniert), so dass immer eine Mitte als Ordnungssystem fixiert wird: EPI.Y+Pferd.Z.4484.#933766118080806.
Die äußere Haut (Integument commune)
Die leicht saure Pferdehaut (pH-Wert 4,8-6,8) weicht vom Menschen insbesondere durch den schäumenden, alkalischen Pferdeschweiß pH > 7 ab. Beim Menschen liegt der pH-Wert etwas unter 5, d.h. der übliche pH-Wert 5,5 wird von der Forschung in Frage gestellt. Die Hautstruktur wird nachfolgend vom Menschen als behaarte Felderhaut übernommen, soweit nichts anderes bekannt ist. Die Felderhaut ist geometrisch als Felder geformt und aus den Furchen wachsen Haare. Die unbehaarte Leistenhaut enthält im Schichtenaufbau noch zusätzlich eine Glanzschicht. Die Haut besteht aus 3 Schichten: Oberhaut (Epidermis), Lederhaut (Dermis) und Unterhaut (Subkutis).
Der Mensch hat ca. 200 Haare/cm². Ein Fell ist mit mehr als 400 Haaren/cm² definiert. Pferde besitzen ca. 800 Haare/cm². Das Fell besteht aus Primärhaar (Deckhaar bzw. Oberhaar) und Sekundärhaar (Wollhaar bzw. Unterwolle/Unterhaar). Der freistehende Haar-Schaft entwickelt sich aus der Haarpapille im Haarfollikel. Der Haarfollikel wird in der Haut durch den umhüllenden Haarbalg (Wurzelscheide) verankert.
Die Haut kann im Zeilenlauf als vertikale Folge diverser Schichten beschrieben werden. Im Gegensatz dazu besteht der Haar-Schaft aus 3 radialen Schichten (Cuticula, Cortex und Medulla), so dass die Haarspitze vorab gesondert als Strukturelement gebildet wird.
Haarspitze (Apex pili)
1.) Die Schuppenschicht (Cuticula) spitzt sich wie ein Tannenzapfen zur Haarspitze 1 als Form 7 zu, wobei der „Tannenzapfen“ nachfolgend mit 3_3 als Dreieck symbolisiert wird. Bei einer glanzlosen Haarspitze hat sich strapaziertes Haar zunehmend als Spliss (Trichoptilosis) zersplittert. Die Cuticula besteht aus flachen, übereinander greifenden, verhornten, abgestorbenen Zellen in 6 bis 10 Zell-Lagen. Diese sehr kleinen Cuticula-Schuppen unterscheiden sich von den „Haarschuppen“, die von der Kopfhaut abgestoßenen werden. Die Kopfhaut erneuert sich beim Menschen alle 28 Tage. Verkleben die Hautschuppen werden sie als „Haarschuppen“ sichtbar. Haarspitze: EPI.Y+Pferd.Z.7349.#569738368958271. Tannenzapfen: EPI.Y+Pferd.Z.7350.#569660853533923 und EPI.Y+Pferd.Z.7351.#569583359199338. Die 10 Zelllagen sind als eine radiale Struktur 505 adressiert (505 sonst immer eine klassische Öffnung bekannt): Anzahl der Zelllagen: EPI.Y+Pferd.Z.7352.#569505885945910. Die Zelllagen sollen als eine Hautmembran 33 als äußere 9 von 3 Schichten am Haar-Schaft liegen: EPI.Y+Pferd.Z.7353.#569428433765039.
2.) Die Faserschicht „Rinde“ (Cortex) wird als eine Röhrenstruktur 5_100 avisiert, die Faserbündel aus Keratin-Fasern (Fibrillen) enthält: EPI.Y+Pferd.Z.7354.#569351002648128. Die Keratin-Faser 5_8_5 entwickelt sich aus ca. 2 nm dicken Protofibrillen. Protofilamente bestehen aus 2 Paaren von gewickelter α-Helices, die Cystein-Reste enthalten. Es bildet sich eine Struktur 9+2 aus einem Ring von 2 zentralen und 9 äußeren Protofibrillen. Doppelhelix in Selbstorganisation - keine Evolution!: 92_92: EPI.Y+Pferd.Z.7355.#569273592586585. Beim Aufbau der Wollfaser lagern sich 11 Protofibrillen zu einer 8 nm dicken, stabförmigen Mikrofibrille zusammen: EPI.Y+Pferd.Z.7357.#569118835595261. Das Pigment Melanin 88 färbt das Haar in der Follikelmatrix in Oxidationsschritten aus der Aminosäure Tyrosin: EPI.Y+Pferd.Z.7358.#569041488648319. Das Haar der Säugetiere besteht zu 80% aus dem Faserprotein α-Keratin [b-Keratin Vögel/Reptilien]. Der Begriff Keratin gilt mehrdeutig für die Gruppe von Faserproteinen als auch für die daraus gebildeten Mikrofibrillen. Das farblose Keratin ist durch den hohen Gehalt an Cystein schwefelhaltig [Schwefel=16]. Das Cystein stabilisiert das Haar durch Disulfid-Brücken 2_7_22. Cystein: EPI.Y+Pferd.Z.7358.# 568964162722426. Aneinanderlagerung 888 von mehreren Hundert stabförmigen 111 Mikrofibrillen: EPI.Y+Pferd.Z.7360.#568886857809012; EPI.Y+Pferd.Z.7366.# 568423469111367; EPI.Y+Pferd.Z.7371.#568037888139239. Bildung einer Makrofibrille als runde 0 Form-Gruppe 7 im Durchmesser von 200 nm: EPI.Y+Pferd.Z.7372.#567960834708944. 10 Makrofibrillen lagern sich als Zelle zusammen, so dass diese als Zellen-Paket eine Wollfaser im Durchmesser von 20000 nm ergeben. Zelle: EPI.Y+Pferd.Z.7371.#567806790544390. Glatte Haare entstehen bei einem runden Querschnitt, gewellte bei einem elliptischen Querschnitt.
3.) Bei normalen und dicken Haaren lockert 0 sich das Zentrum zu einem Markkanal (Medulla) als 3. (innere 9) Schicht der Gruppe 44 auf: EPI.Y+Pferd.Z.7374.#567806790544390. Die Röhre kann mit schwammartigem Mark aus Zellwanderungen, Abbauprodukten der Cortexzellen und Fetten gefüllt sein. Die mobile Zellwanderungen zeigt sich am Durchlauf der 77 bis zur Darstellung des Markkanals 101: EPI.Y+Pferd.Z.7375.#567729799793130; EPI.Y+Pferd.Z.7376.#567652829917887; EPI.Y+Pferd.Z.7377.# 567575880910171.
Haarzyklus
Die Haarbildung aus dem Haarfollikel durchläuft einen Haarzyklus, der durch Wachstumshormone gesteuert wird. Beim Menschen sind ca. 80% der Kopfhaare in einer Wachstumsphase. Nach genetisch bedingten 10 - 30 Zyklen kann beim Menschen im Haarfollikel kein neues Haar wachsen. Die 3 Phasen des Haarzyklus sind auch beim Pferd vorhanden, jedoch ist das Zeitregime durch den Fellwechsel verkürzt. Weiterhin sind im Fell mit dem Oberhaar- und Wollhaar 2 Haartypen vorhanden. Das Zeitregime des Menschen könnte u.U. im Zeilenlauf enthalten sein.
1.) Wachstumsphase (Anagenphase) als "Papillarhaare": Phase dauert beim Menschen 2 - 6 Jahre mit 15cm Haarlänge/Jahr [0,3-0,5mm/Tag].
2.) Übergangsphase (Katagenphase) als "Beethaare": Phase dauert beim Menschen 14 Tage. Der Follikel schrumpft bei Ende der Zellteilung mangels Nährstoffen und stößt das Haar ab.
3.) Ruhephase (Telogenphase) als "Kolbenhaare": Phase dauert beim Menschen 2-3 Monate (90 Tage). In dieser Phase fallen die Haare aus (Haarausfallphase), weil die Haare durch fehlenden Stoffwechsel verkümmern. Die Haarpapille bildet sich neu, so dass sich der umhüllende Haarfollikel regeneriert. Das Haarwachstum mit der Anagenphase wird eingeleitet. Das nachwachsende Haar schiebt das alte Haar aus dem Follikel heraus.
Außer beim Langhaar (Schopf, Mähne und Schweif) unterliegen die Pferdehaare einem Haarzyklus. Das Fell besteht aus dem Primärhaar (Oberhaar / Capilli) [400-500 Stk/cm²] und dem Sekundärhaar (Wollhaar / Pili lanei) [850-1200 Stk/cm²]. Im Frühjahr und Herbst erfolgt ein Fellwechsel, der vom Tageslicht bestimmt wird. Der Fellwechsel wird am Winteranfang (kürzester Tag) und zum Sommeranfang (längster Tag) aktiviert. Durch das Melatonin der Zirbeldrüse wird gesteuert, dass das Winterfell im Januar langsam abzuwerfen ist und ab August neu gebildet wird. Die Zusatzfütterung von Zink als Bestandteil des Keratins unterstützt das Haarwachstum. Das Oberhaar ist als Sommerfell 1-2 cm und als Winterfell 2-4 cm lang. Das dünne gekräuselte Wollhaar ist kürzer und wächst zwischen dem Oberhaar. Im Herbst fallen nur wenige aus und das Wollhaar wird nachgeschoben. Im Frühling entsteht dagegen ein neues Haarkleid.
Im Zeilenlauf folgt nach der Haarbildung #56 die Strukturgröße #55, wobei unter #5533 wieder das Haar adressiert werden kann. Die Haargruppe wird zwischenzeitlich durch 444 weiter aktiv gehalten. Zuletzt mit der Haarform 7_1_7 in EPI.Y+Pferd.Z.7563.#554717444816419. Mit 55_5_1_55_0 wird eine Stukturerneuerung als Fellwechsel adressiert, wobei das Alt-Fell 0_222 als 0 und 222 als Layer-Struktur von Primär-und Sekundärhaar zu finden ist. Das neue Fell ist mit #553 noch kein #5533, so dass das Wachstum noch spezifiziert wird. Ebenso wie die Ziffer 3 (Haut) noch eine Vorstufe ist, ist die Ziffer 6 die Vorstufe der Zeit 60, um das Wachstum zu beschreiben. Das Wachstum ist durch das notwendige Zink=30 als Keratin-Bestandteil gekennzeichnet. 60/30 = 2 sind 2 Haartypen bzw. 2 Fellwechsel/Jahr: EPI.Y+Pferd.Z.7563.#553617251550222. Die Zeit 60 ist alternativ mit 060 als 6 Jahre Wachstumsphase beim Menschen ablesbar. Die „80“ kann die Pausenzeit beschreiben. Abzüglich 14 Übergangstage, ergibt das eine Ruhephase zur Haarneubildung von 66 Tagen. Beim Menschen sind es tatsächlich 60 bis 90 Tage. Zeitsteuerung durch einen Universalwirkstoff 77: EPI.Y+Pferd.Z.7564.#553544060480477. Der Fellwechsel folgt folgender Logik: Um ½ Jahr auszudrücken wird das Jahr mit 365 Tagen in 2 Ziffernteile 3_65 zerlegt und die Zerlegung mit der Ziffer 2 rechts adressiert. Die Zeit 60 ist enthalten. Die 88 wäre der vorhandene Farbstoff, so dass 888 das Melatonin bedeutet. Damit ist der Fellwechsel an die Sommer- und Winterzeit nach dem Tageslicht ausgerichtet: EPI.Y+Pferd.Z.7565.#553470888760652. Zink=30 muss zum Haarwachstum verfügbar sein: EPI.Y+Pferd.Z.7566.#553397736383073. Haarerneuerung 33_60_33, Zeit 60 mit 24 auf Tageszählung eingestellt: EPI.Y+Pferd.Z.7567.#553324603340073. Beim Menschen 14 Übergangstage als Umkehrung 89_98: EPI.Y+Pferd.Z.7568.#553251489623987 bzw. mit dem Haar 1 in 53_1_53: EPI.Y+Pferd.Z.7570.#553105320141920.
Zur Anordnung der Haare wird der Haarwirbel gesucht, wobei zunächst ein Mittelpunkt 0 definiert wird: EPI.Y+Pferd.Z.7571.#553032264360630. Der Wirbel wird als Form 7 markiert 7_8_7, der beim Pferd aber mit der 2 für beide Haartypen zu 27 kombiniert isr. Die Hautoberfläche ist mit 959 als oben 9 adressiert: EPI.Y+Pferd.Z.7572.#552959227875638. Der Wirbel wird nunmehr über 3 Zeilen durch die Wanderung der „27“ auf der Haut symbolisiert: EPI.Y+Pferd.Z.7575.#552740234122024; EPI.Y+Pferd.Z.7576.#552667274745820; EPI.Y+Pferd.Z.7577.#552594334627733. Die Haarneubildung dauert beim Menschen 60-90 Tage. Die „90“ Tage als Haarstruktur 0_1_5: EPI.Y+Pferd.Z.7587.#551865990968015. Das Fell des Pferdes 333_9 in EPI.Y+Pferd.Z.7593.#55142990563339 wird mit Primär- und Sekundärhaar spezifiziert als „Bürste“ 1_1_1_1 auf der Felderhaut 4_7: EPI.Y+Pferd.Z.7596.#551212121310470.
Haut der Pferde
1.) Oberhaut (Epidermis): Das mehrschichtige Plattenepithel besteht aus folgenden Schichten:
1.1) Oberflächenprofilierung: Als Annahme wird die Hautoberfläche aufgrund der Strukturgröße #550, der Haut 33 und Nerven/Form 777 markant definiert: EPI.Y+Pferd.Z.7602#550777068333903. Haar 1 als Extra 8_1_8 in einer Felderhaut 4_1_4: EPI.Y+Pferd.Z.7638#548181104146941. Es folgt die Oberhaut (Epidermis) als Hautwölbung 33_00 von den Feld-Furchen umgeben: EPI.Y+Pferd.Z.7639#548109343300737. Furchen-Umgrenzung: EPI.Y+Pferd.Z.7640#548037601240096. Hydrolipidmantel als Schutzschicht auf der Haut aus Talg, Schweiß, Aminosäuren, verhornten Zellen sowie Fetten (Lipide): EPI.Y+Pferd.Z.7664#546321408334334 und EPI.Y+Pferd.Z.7665#546250133525679.
1.2) Stratum corneum (Hornschicht): Die Hornschicht ist die oberste Schicht der Epidermis und besteht aus abgestorbenen, abgeflachten Plattenepithelzellen (Korneozyten). Der oberste Teil der Hornschicht ist das Stratum disjunctum. Die Hornzellen (Korneozyten) 33 lösen sich aus ihrem Verbund, d.h. die Struktur 5 ist freigestellt 050. EPI.Y+Pferd.Z.7695#544120503375482. In der Struktur der Hornschicht 555 sind die Zellen wie Mauerziegel angeordnet, so dass eine Regelmäßigkeit 484848 vorliegt: EPI.Y+Pferd.Z.#543555403540742 und EPI.Y+Pferd.Z.#543484848581819.
Im Übergang zum Stratum granulosum liegt die Glanzschicht (Stratum lucidum), die nur bei der haarlosen Leistenhaut als eine dünne, lichtbrechende 55 Schicht vorhanden ist. Die Zellen enthalten das halbflüssige Eleidin (Zwischenprodukt des Keratins). Bei der behaarten Felderhaut ist die Schicht nicht deutlich erkennbar. Weil dort für „1“ Haare vorhanden sind, muss auf die 1 als Schicht „1“ nicht gesondert reagiert werden: EPI.Y+Pferd.Z.7709#543132348355731.
1.3) Stratum granulosum (Körnerschicht): Dünne Schicht aus wenigen Zelllagen abgeplatteter Kerationozyten, die feine Granula enthalten. Hautschicht 5353 mit Körpern als Extra 8: EPI.Y+Pferd.Z.7718#542498998895353.
1.4) Stratum spinosum (Stachelzellschicht): Gehört zur Keimschicht (Stratum germinativum): Mehrere Lagen von kubischen 4 Zellen, die durch Desmosomen verbunden sind: EPI.Y+Pferd.Z.7725#542007414041985
1.5) Stratum basale (Basalschicht): Gehört zur Keimschicht (Stratum germinativum). Merkel-Tastzellen zur Druckwahrnehmung als Nerv 7, Zelle 7007 und Druck 55: EPI.Y+Pferd.Z.7728#541797007437155. Die Epidermis-Zellen wandern nach außen, wobei sie immer mehr verhornen und an der Körperoberfläche abschuppen. Flexible 6 Wanderung nach außen 99. Die Hauterneuerung von neuen Zellen aus der Basalschicht bis zur vollständigen Verhornung und Abschilferung (Abschuppung/Desquamation) dauert beim Menschen 28 Tage: EPI.Y+Pferd.Z.7737#541166766637499. Verhornen 303 und abschuppen 11: EPI.Y+Pferd.Z.77387#541096830379211. Die 99=oben ist in der Hornschicht als Oberhautgruppe 44 zu finden als EPI.Y+Pferd.Z.7698#544545099944639 und EPI.Y+Pferd.Z.7699#544474287838015.
1.6) Basalmembran (Membrana basalis): Zwischen Stratum papillare und Stratum basale liegt zur räumlichen Abgrenzung die Basalmembran der Epidermis. Die Basalmembran besteht aus 4 Schichten, vom Epithel gesehen: a) Die Lamina rara externa (Lamina lucida) besteht aus einem Speichervolumen 200, das mit dem Glycoprotein Laminin gefüllt ist. Laminine sind Heterotrimere mit einer kreuzförmigen Struktur mit 4 Armen, von denen sich 3 Arme mit anderen Molekülen verbinden und der 4. längere Arm 1 sich an der Zelloberfläche verankert: EPI.Y+Pferd.Z.7643#540747420053511; b) Die Lamina densa bildet mit dem Netzwerk aus Kollagen die Grundstruktur der Membran 5_33: EPI.Y+Pferd.Z.7744#540677592132533; c) Die Lamina rara interna enthält kollagene Ankerfibrillen 2_1_2 als Verbindungselement: EPI.Y+Pferd.Z.7747#540468216532120; d) Die Lamina fibroreticularis verbindet die Basalmembran ohne klare Grenzen mit dem angrenzenden Bindegewebe 222: EPI.Y+Pferd.Z.7748#540398460696222.
2.) Lederhaut (Dermis/ Corium): Die bindegewebige Hautschicht liegt unter der Epidermis und enthält Haarfollikel, Gefäße, Nerven und Drüsen. Sie besteht 1.) aus der Netzschicht (Stratum reticulare) und 2.) aus der Zapfenschicht (Stratum papillare).
2.1) Strukturelemente in der Haut: Um die Entstehung des Haares aus dem Haarfollikel zu beobachten, müssen zunächst diverse überlagerte Hautstrukturen im Zeilenlauf insbesondere in der Lederhaut separiert werden. Grundsätzlich kann im gesunden Körper nur etwas entstehen, wenn es im Zeilenlauf angelegt ist!
2.1.1) freie Strukturelemente
2.1.1.1) Schweißdrüsen: Die kleinen (0,4mm), ekkrinen (merokrine) Schweißdrüsen (Glandulae sudoriferae merocrinae) sind als Knäueldüsen spiralisiert und nicht mit den Haarfollikeln verbunden. Sie bestehen aus dem Drüsenkörper (Drüsenazinus) und dem Ausführungsgang hoch zur Epidermis. Beim Menschen sind die Schweißdrüsen außer am Lippenrot und an der Klitoris/Eichel (Glans penis) überall vorhanden[HB1] . Beim Pferd dient der Schweiß im Unterschied zu Hund und Katze wie beim Menschen der Thermoregulation. Das Pferd schwitzt zuerst an Hals, Brust und Flanken sowie unter dem Sattel/Gurten. Im Schweiß (Sudor) sind Elektrolyte enthalten. Durch den hohen Eiweißgehalt schäumt der Schweiß beim Pferd und hinterlässt getrocknete weiße Kügelchen. Mit einer Annahme zur Pore des Ausführungsganges ergibt sich die Hautoberfläche: Hautoberfläche 333_9 nicht höher als EPI.Y+Pferd.Z.7602#550777068333903. Pore (Pore of swaet gland duct) 606 des Ausführungsgangs in der Epidermis 33. Der Drüsenkörper liegt in der Lederhaut. Pore: EPI.Y+Pferd.Z. 7622.#54933183855606. Drüsenkörper der Knäueldrüse: EPI.Y+Pferd.Z.7845#533716669658933.
2.1.1.2) sonstige Elemente: Die freien Talgdrüsen liegen unabhängig vom Haar in speziellen Hautregionen (Lippen, Nasenloch, Ohrloch, Augenlider, Brustwarzen, Genitalien und Anus)
2.1.2) haargebundene Strukturelemente
2.1.2.1) Haaraufrichtemuskel/Haarbalgmuskel (Musculi arrectores pilorum) in Oberhaut: Der Muskelansatz 555 sitzt an der Oberhaut 3_7_3. Die Kontraktion (Nerv 7) richtet die Haare 1 auf und bildet die „Gänsehaut“. Weiterhin werden die Talgdrüsen ausgepresst, um Talg zur Haut zu leiten: EPI.Y+Pferd.Z.7818#535559896837341. Der Muskel zieht schräg zur Lederhaut an die Haarwurzel herunter. Beim Menschen fehlt der Haaraufrichtemuskel an Gesicht, Hals, Brust und oberem Rücken.
2.1.2.2) Talgdrüsen (Glandula sebacea): Holokrine Drüsen in der Lederhaut, die Lipide als Hauttalg (Sebum) produzieren. Neben den freien Talgdrüsen an speziellen Körperstellen sind sie überwiegend als Haarbalgdrüsen in der Felderhaut angeordnet. Am Haarfollikel liegen seitlich als Säckchen bis 5 Drüsen. Statt einer großen Drüsen 888 kann diese Aufteilung nur noch 88 ergeben, so dass 5 Öffnungen (9_5_9) der Ausführungsgänge (Ende=9) der Talgdrüsen als „808“ in die Haarwurzel (Wurzelscheide) resultieren: EPI.Y+Pferd.Z.7825.# 535080801721959. Ausführungsgang 300 kombiniert mit der Zeit 60 als Zyklus: Nach der Einlagerung von Fetttröpfchen löst sich die Zelle bei der Talgabgabe selbst auf und wird durch eine neue Drüse ersetzt: EPI.Y+Pferd.Z.7832#534602563007448. Beim Menschen wird die Talgproduktion durch Androgene (männliche Sexualhormone u.a.Testosteron 33) angeregt. Östrogene 66 mindern die Drüsenaktivität dagegen: Drüsensekret bei 66 Null „080“ gestoppt, ansonsten wird der Talg 8 am Haarmuskel 5_1_5 ausgepresst: EPI.Y+Pferd.Z.7834#534466080351587. Der Talg 80 gelangt zunächst in den Ausführungsgang, bevor er am gefetteten Haar zur Oberfläche kommt: EPI.Y+Pferd.Z.7836#534329667365280. Sekretgefüllte Zelle (pyknotischer Kern 666): EPI.Y+Pferd.Z.7845#533716669658933. Basalzelle/Ersatzzelle 64_8_64: EPI.Y+Pferd.Z.7846#533648645612329. Holokrine Talgdrüse/Talgkolben: EPI.Y+Pferd.Z.7847#533580638903317.
2.1.2.3) Haaraufrichtemuskel/Haarbalgmuskel (Musculi arrectores pilorum) in der Lederhaut: Unterhalb der Talgdrüsen weitet sich die Haarwurzel zu einer Wulst als Wulstregion (Bulge area) auf, um den unteren Ansatz des Muskels aufzunehmen. Der Muskel wird von einem Nervengeflecht räumlich 444_77 umsponnen: EPI.Y+Pferd.Z.7849#533444677471567. Die Wulst als Extra 800: EPI.Y+Pferd.Z.7853#533172962367800. Der Muskel 55 setzt ober- und unterhalb der Wulst an: EPI.Y+Pferd.Z.7850#533376722735584 und EPI.Y+Pferd.Z.7854#533105076836559.
2.1.2.4) Schweißdrüsen: Die großen (3-5mm), apokrinen Schweißdrüsen (Glandulae sudoriferae apocrinae) liegen an der Haarbasis mit einem Ausführungsgang zum Haartrichter in der Epidermis. Die embryonal angelegten Duftdrüsen sind beim Menschen erst nach der Pubertät im Achsel- und Genitalbereich funktionsfähig. Der Duft (Odor) wird erst durch die Bakterien gebildet, die im Haartrichter angesiedelt sind. Haartrichter 44_6000 in der Epidermis: EPI.Y+Pferd.Z.7642#547894173446000 und verengt EPI.Y+Pferd.Z.7653#547106660587264. Der Ausführungsgang 505 in der Wand des Haartrichters 66066: EPI.Y+Pferd.Z.7660#546606693665056. Der Schweißdrüsenkörper erstreckt sich aufgrund der Größe über den Zeilenbereich von EPI.Y+Pferd.Z.7950#526667581569098 bis EPI.Y+Pferd.Z.8044#520513087204666. Die Position liegt unterhalb der Haarwurzel, so dass sich die Lederhaut im Drüsenbereich in die Fettschicht der Unterhaut einsenken muss.
2.2) Zapfenschicht (Stratum papillare): Die Zapfenschicht verzahnt durch zapfenförmige Ausstülpungen die Lederhaut mit der Epidermis. Die Schicht enthält feine Blutgefäße (Kapillare) und eingekapselte Meißner-Tastkörperchen zur Tast- und Vibrationswahrnehmung. Diese Tastfunktion wird in behaarten Haut nicht benötigt, so dass sie als Haarfollikel-Sensoren wirken: Innenseitig Nervenfasern 777 (1-7 marklose Dendriten) und außen eine Bindegewebskapsel 505; Meißner-Tastkörperchen: EPI.Y+Pferd.Z.7902#529866777205053.
2.3) Netzschicht (Stratum reticulare): Die Netzschicht bildet sich aus kreuzenden, dickeren elastischen Fasern und straffem Bindegewebe. Durch gebundene Flüssigkeit wird die Schicht gestrafft. Die Faserbündel bilden eine Spaltlinie. Entlang der Spaltlinie klafft eine Wunde nicht auseinander, sondern nur quer zur Spaltlinie. Es werden verschieden Hautstrukturen ausgebildet (Haarfolikel, Talg-, Schweiß- und Duftdrüsen, Rezeptoren und subpapillärer Gefäßplexus). Der Gefäßplexus des Stratum reticulare versorgt die Kapillarnetze des Stratum papillare und ernährt somit indirekt die Epidermis.
Das Ruffini-Körperchen reagiert auf Druck und horizontale Dehnung. Zwischen den durchgeleiteten 32_23 Kollagenfasern sind Nervenzellen spiralförmig eingelagert: EPI.Y+Pferd.Z.7857#532901523924441 und EPI.Y+Pferd.Z.7858#532833707492279.
2.4) Stratum profundum: Der Grenzbereich zur Unterhaut enthält kollagene Faserbündel, die parallel zur Oberfläche ausgerichtet sind.
3.) Unterhaut (Subkutis/Tela subcutanea):
3.1) Fettschicht (Stratum adiposum): Geschlossenen Bindegewebskammern, die mit Fettzellen gefüllt sind. Die Subcutis ist mit der darüber liegenden Lederhaut über starke Bindegewebszüge fest verbunden, die sie auch mit darunter liegenden Strukturen wie zum Beispiel Sehnen, Faszien oder Knochenhaut verbinden. Die Schweißdrüsen, die tiefen Abschnitte der Haarfollikel und Rezeptoren der Haut (Vater-Pacini-Körperchen) aus der Lederhaut können in die Unterhaut hineinragen. Im Subcutangewebe wird Wasser gebunden.
Das zwiebelförmige Vater-Pacini-Körperchen liegt in der Fettschicht und ist aus 60 Schichten aufgebaut. Es reagiert besonders auf Vibrationen: EPI.Y+Pferd.Z.7911#529263970860110 und EPI.Y+Pferd.Z.7912.#529197077031640.
3.2) Besonderheiten: Beim Pferd und anderen Säugetieren mit einem Fell liegt in der Unterhaut eine Zwischenschicht „Panniculus carnosus“ mit dem Gefäßplexus „Plexus arteriosus subdermalis“ vor. Somit sind es insgesamt 5 statt 3 Hautschichten. Dieser Aufbau ist beim Menschen nur an besonderen Hautpartien wie u.a. der Kopfhaut vorhanden.
Als letzte Hautschicht wird die Umhüllung des Knochens durch die äußere Knochenhaut als grobfaseriges Bindegewebe (Stratum fibrosum) im Zeilenlauf ermittelt. In die horizontal geschichtete Haut sind somit 3 vertikale Radialsysteme integriert: Haarspitze (Apex pili), Haarwurzel (Radix pili) und Röhrenknochen (Os longum).
Sorry, ab 26.08.2021 schmälert die Deutsche Telekom den Funktionsumfang: Der Upload von Schriftzeichen ist im Homepage-Designer nur noch verhüllt farblos gestattet.
Der Haarfollikel wird nach Auflistung der Hautschichten nunmehr in die Haut integriert:
Das Haar als biegsamer Hornfaden besteht aus Haarschaft und Haarwurzel. Der Haarschaft (Scapus pili), bestehend aus Haaroberhäutchen (Cuticula pili), Haarrinde (Cortex pili) und Haarmark (Medulla), und die sich anschließende Haarwurzel (Radix pili) sind in der dreischichtigen Haut (Epidermis, Dermis, Subcutis) mit dem umhüllenden Haarfollikel (Haarbalg/ Folliculus pili) verankert. Das Haarmark bildet einen axialen Strang. Das Schweifhaar des Pferdes ist jedoch marklos. Der Markkanal fehlt auch bei feinen Haaren wie dem Wollhaar.
Der Haarfollikel wird a) aus der umhüllenden Haarwurzelscheide, b) der von unten eingestülpten Haarpapille (Papilla pili), die das Haar über einen Gefäßkomplex ernährt, und c) der umgebenden Haarzwiebel (Bulbus pili) mit der inneren Haarmatrix, die für das Haarwachstum und die Haarfarbe sorgt, gebildet. Der Haarfollikel steckt als röhrenförmige Tasche bzw. als Haarbalgtrichter in der Cutis (Epidermis + Dermis). Bei Pelztieren reicht die Verankerung bis in die Unterhaut (Subcutis). Beim Menschen gehört zur Haartasche (Haarfollikel) nur 1 Haar. Grundsätzlich können aber mehrere Haare herauswachsen. Um den Follikel herum verläuft ein bindegewebiger Becher, der als Haarbalg bezeichnet wird, d.h. der Begriff „Haarbalg“ ist räumlich umfassender als der „Haarfollikel“.
Der Haarfollikel sitzt schräg in der Haut, so dass die Haare schräg heraus wachsen. Eine Erklärung liefert die Neigung des zentralen Haarmarkkanals. Nachfolgend ist hierzu oberhalb der Haarzwiebel das Radialsystem der Haarwurzelscheide als Schichtenfolge erkennbar, die aus einer äußeren und inneren Haarwurzelscheide besteht. Die innere Wurzelscheide bildet eine Gleitschicht über die sich das Haar an der äußeren Wurzelscheide entlang hochschiebt. Die innere Wurzelscheide 5_33_5 endet auf Höhe der Talgdrüseneinmündung, so dass kein Mündungsloch gesucht wird. Die Endposition 9_525 muss vor dem Muskelanschluss liegen: EPI.Y+Pferd.Z.7848#533512649525272.
Die Schichtenfolge des Haarfollikels wird als Gruppe 4_44 avisiert: EPI.Y+Pferd.Z.7857#532901523924441. Schichtenfolge von außen nach innen: 1.) umgebendes Bindegewebe der Haut, 2.) Glasmembran: Die Basalmembran 303_1_1_1 des Follikelepithels ist dreischichtig: EPI.Y+Pferd.Z.7861#532630361719162, 3.) Äußere epitheliale Haarwurzelscheide 33_0_4_9_4 als trichterförmige Einstülpung der Basalschicht (Stratum basale) in die Lederhaut (Dermis): EPI.Y+Pferd.Z.7861#532359475330494, 4.) Innere Haarwurzelscheide aus 3 Schichten. Die Doppelziffer 33 ist nicht verfügbar, so dass die nächsten 3 Zeilen als Schichten zugewiesen werden: 4.1) äußere einzellige Henle-Schicht 1_3_6_3 aus länglichen 22_9 Zellen ohne sichtbare Zellkerne (ohne 5): EPI.Y+Pferd.Z.7866#532291796780363, 4.2) mittlere 1-2 zellige Huxley-Schicht 3_3 aus verhornten flachen 222 Zellen mit Zellkern (5_5). Die Mitte als Spiegelung 41_3_3_14: EPI.Y+Pferd.Z.7867#532224135435914, 4.3) einzellige Haarscheiden-Kutikula, die die Haarwurzel als innere Schicht umfasst. Eine Einfassung ist als 9_QS 1+2=3_9 vorhanden, wobei die Haut=3 nur als Quersumme vorliegt: EPI.Y+Pferd.Z.7868#532156491290586. 5.) Haarwurzel: Die 3 Schichten der Haarwurzel wurden bereits ausführlich in der Haarspitze (Apex pili) dargestellt. 5.1) Cuticula 33: EPI.Y+Pferd.Z.7869#532088864337823, 5.2.) Cortex 33: EPI.Y+Pferd.Z.7874#531750987233215, 5.3.) Medulla: Der Haarmarkkanal 100 zieht sich mit einem Ziffernversatz, so dass der schräge Sitz des Haares symbolisiert wird: EPI.Y+Pferd.Z.7878#531480994348100 und EPI.Y+Pferd.Z.7880.#531346100694712. Beim Menschen werden Haare üblicherweise mit einem steilen Haut-Haarwurzel-Winkel von 80-90° zeichnerisch dargestellt. Dagegen sind in wissenschaftlichen Messungen 45°-75° für die verschiedenen Hauptpartien dokumentiert. Folglich kann räumlich 4 aus der Zwischenzeile ein Maximalwinkel von 78° zwischen den Schenkeln 531_135 gewählt werden: EPI.Y+Pferd.Z.7879#531413538961078.
Der untere verdickte Teil der Haarwurzel (Radix pili) ist die Haarzwiebel (Bulbus pili), die an der Haarpapille befestigt ist. In der Haarzwiebel ist die Mutterzellenschicht / Matrix als einschichtiges Epithel zur Umhüllung der Haarpapille (Papilla pili) enthalten. Von hier aus werden nach oben heterogene Matixtochterzellen in den Haarschaft abgegeben. Es handelt sich um keratinbildende Zellen (Keratinozythen) und pigmentbildende Zellen (Eu- und Phäomelanozythen). Insoweit ist nunmehr Melanin 88 als Farbstoff und Keratin als Faser 11 vorhanden: EPI.Y+Pferd.Z.7882#531211275497885. Die Mutterzellenschicht (Matrix) umschließt die Haarpapille. Um dieses im lotrechten Zeilenlauf darzustellen, muss die Matrix pauschal als Volumen-Gruppe 44_00 (inclusive 11 und 88) als Struktur 55 der Haut 5_3_3 avisiert werden: EPI.Y+Pferd.Z.7882#531143888554400.
Die in die Matrix eingestülpte Haarpapille wird ebenfalls als Gruppe 44 avisiert und ab der Folgezeile #530... im Zeilenlauf der „Null“ als Papille in Blasenform 100 räumlich ausgeformt 7_4_7: EPI.Y+Pferd.Z.7885#531009165944747. Weil ein Nährstofftransport erfolgt, kann in den Folgezeilen nach Stoffen gesucht werden. Zunächst wird mit Eisen=26 das Blut als Nährstoffträger zusammen mit Stickstoff=7 und Sauerstoff =8 genannt. Das Zink=30 ist generell enthalten: EPI.Y+Pferd.Z.7886#530941830265576. Die Elemente des Schönheitsvitamins Biotin/B7 mit der Summenformel C10H16N2O3S sind enthalten [Schwefel S=16, Sauerstoff=8, Stickstoff=7, Kohlenstoff C=6 und Wasserstoff=1]: EPI.Y+Pferd.Z.7887#530874511661510. Die Zeit=60 ist vorhanden: EPI.Y+Pferd.Z.7888#530807210126056. Das Kupfer=29 fehlt zunächst, weil es nicht direkt verwendet wird. Die Ziffer 2 ist als Formumkehrung 2_7_2 genannt, so dass das Kupfer 29 in der Spiegelung 92 lesbar ist. Die Ziffer 2 kann auch die 2 Kupferionen symbolisieren, die bei der Tyrosinase gebunden werden. Das Kupfer wird indirekt zur Bildung des Enzyms Tyrosinase benötigt, welches zur Bildung des Haarfarbstoffs Melanin unverzichtbar ist: EPI.Y+Pferd.Z.7889#530739925652723. Selen =34: EPI.Y+Pferd.Z.7896#530269411534237. Der Haarwuchs ist beim Menschen an der sprechenden Stelle örtlich festgelegt, so dass noch ein spezieller Schalter gesucht werden kann. Dieser ist auf das Testosteron 33 bezogen, ist aber als Hautmembran 33 doppeldeutig auch allgemeingültig. Die Zeit ist sehr kurz als „24“ enthalten. Mit der Ziffer „6=flexibel“ dient „020226_33_6“ als Schalter für die haarlose Null-Kahlstelle. Als Steuerungshormon für das Haarwachstum dient das Dihydotestosteron (DHT / 5α-Dihydrotestosteron). Es wird in den Nebennieren, den Eierstöcken und den Hoden aus dem Testosteron mittels der 5-α –Reduktase gebildet: EPI.Y+Pferd.Z.7897#530202263324596. Die Haarpapille ist bis unten von der Haarzwiebel umhüllt, die sich nochmals mit 11 (Keratinfaser) und 88 (Melanin) mit der Papillenöffnung 0 zeigt: EPI.Y+Pferd.Z.7898#530135132118806. Im Zeilenlauf #530... schließt sich die Zwiebelform der eingestülpten Papille mit #5300 und der umhüllenden Haarzwiebel mit #53000. Automatisch folgt der „Null“ eine Ziffer „9“ im Zeilenlauf, so dass die arterielle Versorgung aus dem unteren Gefäßplexus der Unterhaut gesichert ist. Erkennbar ist, dass in die Haarpapille (Papilla pili) unterseitig eine Gefäßkapillare als Vene=0 und Arterie=9 in Gefäßform 7_0 eingeführt wird: EPI.Y+Pferd.Z.7899.#530068017910410. Die Haarzwiebel (Bulbus pili) schließt sich um die Haarpapille mit der Ziffer 9 für unten, wobei für die Papille ein Öffnung 2_0_2 verbleibt: EPI.Y+Pferd.Z.7900.#530000920692953.
Im Zeilenlauf folgt die bereits erfasste Unterhaut (Subkutis), die in der oberen Lage aus der Fettschicht (Stratum adiposum) besteht. Die Fettschicht enthält Fettläppchen, deren Form sich geschlechtsabhängig durch die Struktur der Bindegewebsfasern unterscheidet. Das weibliche Gewebe [Östrogen =66] ist als Voraussetzung für eine Schwangerschaft dehnfähig (z.B. Cellulite) und somit oberflächlich gewellt. Das männliche Gewebe [Testosteron=33] ist dagegen gestrafft und somit glatt.
Beispielsweise kann das weibliche Fettgewebe mit der Gruppe von Fettläppchen beginnen: EPI.Y+Pferd.Z.7905.#529665689244065. Die Bindegewebsfasern liegen unvernetzt parallel, was als Form 7 mit 8_8_8 veranschaulicht wird. Die 8 ist durch die Ziffer 3 markiert als 3_8_3. In der Folge ergibt sich daraus als Quersumme 5 (Struktur) + 3 (Haut) = 8. Die „53“ wird damit zur Bindegewebsfaser: EPI.Y+Pferd.Z.7906.#529598693836875. Die Bindegewebsfaser 1 kommt als Form 171 unvernetzt 53_53_53: EPI.Y+Pferd.Z.7907.#529531715375532. Die Thematik wird über die Zeit=60 mit der Schwangerschaft in Bezug gesetzt: EPI.Y+Pferd.Z.7908.#529464753853608. Jedes Fettläppchen 0 wird mit Blut versorgt 8_0_9. EPI.Y+Pferd.Z.7909.#529397809264677.
Vergleichsweise ist das männliche Fettgewebe nicht überzeugend zu finden, sondern lediglich dadurch, dass die 33 selbst straff vom Bindegewebe 8 (wie 53) eingeklemmt wird und die Haut 3 als glatte Schicht erscheint 28_3_28: EPI.Y+Pferd.Z.7924.#528395668030582 versus EPI.Y+Pferd.Z.7925.# 528328993498338.
Der Schweißdrüsenkörper erstreckt sich aufgrund der Größe über den Zeilenbereich von EPI.Y+Pferd.Z.7950#526667581569098 bis EPI.Y+Pferd.Z.8044#520513087204666.
Das in der Subcutis enthaltene Bindegewebe und Fettgewebe wird in der Gesamtheit auch als Panniculus adiposus (Unterhautfettgewebe) bezeichnet. Im Unterschied zu Mensch und Schwein besitzen felltragende Affen und Pferde statt der 3 Hautschichten abweichend 5 Hautschichten, weil sich die Subcutis in eine oberflächliche Schicht und eine tiefe Schicht teilt, so dass dazwischen die Schicht „Panniculus carnosus“ mit dem Plexus arteriosus subdermalis eingeschoben wird. Statt eines Fells besitzt der Mensch eine dickere Fettschicht. Beim Pferd steigen die Arterien somit nicht aus dem Muskelgewebe zur Lederhaut hoch, sondern höher und gesondert aus dem „Panniculus carnosus“. Die Schicht reicht weit über die Hüfte des Pferdes, so dass schnelle und zuckende Hautbewegungen eine Insektenabwehr ermöglichen. Statt Thermoregulalation durch einen starken Blutstrom schützt beim Pferd das Fell. Der Mensch hat zum „Panniculus carnosus eine vergleichbare Struktur im subkutanen Fettgewebe als flächige Bindegewebsschicht auf der Kopfhaut „Galea aponeurotica“, im Gesicht als „SMAS (superfizielles muskuloaponeurotisches System zur Verbindung der Haut mit dem Gesichtsmuskel) und am Hals als „Platysma“.
Oberflächliche Schicht der Subcutis 33: EPI.Y+Pferd.Z.7950#520060523347948. Der Panniculus carnosus [panniculus=kleiner Lappen; carnosus=fleischig] mit dem Gefäßplexus „ Plexus arteriosus subdermalis“ liegt dann am dezimalen Übergang vor: Aufsteigende Arterien: EPI.Y+Pferd.Z.7951#519995935602873. Arterien 9: EPI.Y+Pferd.Z.7951#519931363898464. Venen 8, Nerven 7: EPI.Y+Pferd.Z.7951#519866808228747. Der Panniculus carnosus ist beim Menschen eine feine, flache Muskelschicht an bestimmten Stellen wie Kopfhaut, Gesicht, Hand, Brustwarze und Hodensack. Tiefe Schicht der Subcutis 33: EPI.Y+Pferd.Z.7966#519093388727291.
Als nächste Schicht folgt die oberflächliche Körperfaszie (Fascia superficialis), die als eine durchgängige Bindegewebshülle aus kollagenen Fasern (Fibrae collagenosae), die Muskeln des Bewegungsapparats gegen die Subkutis abgrenzt. Eine Verbindung 34_34 von Muskel 55 und Haut 33 liegt vor: EPI.Y+Pferd.Z.8090#517553433062340. Ein Organ wird von seinen Segmentarterien versorgt. Beim Mensch steigen dazu in der Haut vertikale Perforationsarterien aus den horizontalen Segmentarterie (Arteria segmentalis) in die Lederhaut (Dermis) auf. Im Unterschied dazu enden die Perforationsarterien beim Pferd aufgrund des Fells bereits in der Muskelschicht. Kurze Perforationsarterie 99: EPI.Y+Pferd.Z.8097#517105998947058. Segmentarterie 99: EPI.Y+Pferd.Z.8097#516723099281048. Ab dieser Zeilenposition ist der Beginn der Knochenhaut (Periost) zu erwarten.
Wo ist der Röhrenknochen (Os longum)? Der Knochen (Os / Bone) wird von seiner Knochenhaut (Periost) außer an den Gelenkflächen (Facies articularis) umschlossen. Missverständlich gemeint ist immer die Knochenhaut = Äußere Knochenhaut. Jedoch ist der Begriff durch die äußere Faserschicht (Stratum fibrosum) des zweischichtigen Periosts schon besetzt. Die innere Kambiumschicht (Stratum osteogenicum) folgt. Die Innere Knochenhaut (Endost) kleidet innenseitig die Knochenmarkhöhle aus. Die Knochenhaut fehlt am Gelenk nicht, sondern führt außen als Gelenkkapsel (Capsula articularis) vorbei. Zwischen 2 Knochen liegt ein Gelenkspalt (Spatium articulare), der mit einer Gelenkflüssigkeit (Synovia) gefüllt ist. Das Ende eines Röhrenknochens bildet der Gelenkknorpel (Cartilago articularis), der mit dem Knochen verwachsen ist.
Der Knochenzugang kann in der Längsachse vom Ende her gesucht werden oder in Knochenmitte über die radiale Schichtenfolge. Die radiale Schichtenfolge des Knochens:
Zunächst muss der Röhrenknochen (Os longum) als Knochen 225 und als Röhre 505 adressiert werden: EPI.Y+Pferd.Z.8114#516022587315052. An einem dezimalen Zeilenübergang sind die Gefäße 7, 8 und 9 automatisch vorhanden: EPI.Y+Pferd.Z.8115#515958998579708. Die Knochenhaut (Periost) 33 wird als Gruppe 4_4 und als Struktur 55 avisiert: EPI.Y+Pferd.Z.8116#515895425514334.
1.) Äußere Faserschicht (Stratum fibrosum), eine kollagene Faserschicht für die Biegesteifigkeit des Knochens. Spezielle Bezeichnungen sind a) Perikranium für die Deckschicht des Schädelknochens, b) Periorbita für die Auskleidung der Augenhöhle und c) Endorhachis für die Auskleidung des Wirbelkanals. Stratum fibrosum als Kollagenfasern 11_313 mit der Quersumme 8+6+8=22= Knochen. Als Zählgröße „11“ zur Verbindung von Muskulatur und Sehnen mit den Knochen dienen die Sharpey-Fasern, die im Stratum fibrosum entspringen und innenseitig das Stratum osteogenicum durchdringen bis hinein in den kompakten Knochenteil (Substantia compacta). Beispielsweise hängt auch der Zahn (Dens) druckentlastend in diesem elastischen Fasernetz. Stratum fibrosum: EPI.Y+Pferd.Z.8117#515831868113137.
2.) Innere Kambiumschicht (Stratum osteogenicum), eine knochenbildende Schicht, die Osteoblasten enthält und die Heilung von Knochenbrüchen bewirkt. Als Wachstumsbezug sind das Blut =26 und die Form 7 enthalten als 3_26_3_70_3: EPI.Y+Pferd.Z.8118#515768326370329. Das Wachstum muss dann als Strukturzuwachs 55_777 gedeutet werden: EPI.Y+Pferd.Z.8121#515577795034396. Durch die Schicht werden Nährstoffe zum Aufbau der kompakten Schicht nach innen durchgeleitet, wie z.B. Phosphor=15: EPI.Y+Pferd.Z.8122#515514315867315.
3.) Die Knochenkompakta (Substantia compacta) liegt direkt unterhalb des Periosts als der kompakte Teil des Knochens. Die Substantia compacta setzt sich aus dicht gepackten Knochenlamellen zusammen. Der Begriff „Substantia compacta“ beschreibt die kompakte Struktur am Schaft des Röhrenknochens. Allgemein wird diese Schicht unter der Knochenhaut auch als Kortikalis („Substantia corticalis“ von lateinisch Cortex „Rinde“) bezeichnet. Als Schichtbeginn ist eine räumliche Struktur 5_4_5 des Knochens 22 avisiert. Für die Knochenhärte ist keine dünne Membran 33 genannt, sondern die Haut 3 wird durch den Knochen 2_3_2 stabilisiert. Das dafür notwendige Calcium muss als Quersumme 9+7+2+2=20: gelesen werden: EPI.Y+Pferd.Z.8121#515450852329722. Zur Strukturbildung wird eine Knochengruppe 44 gebildet. Als unreifer Geflechtknochen/Faserknochen (Os membranaceum reticulofibrosum) liegen die Fasern zunächst ungeordnet. Es entwickelt sich dann ein Lamellenknochen (Os membranaceum lamellosum), der durch parallele Fasern belastbarer ist. Der Lamellenknochen ist ebenfalls in der folgenden Knochenschicht „Spongiosa“ als parallele Anordnung vorhanden, jedoch ordnet sich die Struktur in der „Substantia corticalis“ jeweils um einen zentralen Gefäßkanal (Havers-Kanal). Die parallele Struktur 555_4 ist mit 60 von der Zeit abhängig, wobei das Wachstumsende beim Pferd erneut mit 4 Jahren bzw. bedingt mit 36 Monaten enthalten ist. Um die Fläche der Kompakta mit den kreisförmigen Osteonen auszufüllen, müssen die Osteone ständig auf- und abgebaut werden, um mit den Resten von abgebauten Lamellenbereichen die Lücken zwischen den Kreisen füllen zu können. Hierzu wird noch eine Zeile mit der Zeit=24 erwartet: EPI.Y+Pferd.Z.8126#515260555436172. Der zentrale Gefäßkanal (Havers-Kanal) 99_000 ist als Platzhalter 000 für die einzubauenden Osteone vorhanden: EPI.Y+Pferd.Z.8129#515070399000410. Osteone sind auch in folgenden Substantia spongiosa vorhanden, sind dort aber nicht um die Blutgefäße gelegt. Die Osteone in der Kompakta müssen gesondert gebildet werden, weil Nerv 7, Blutgefäße 8+9 und Lymphgefäße 11 im Zeilenlauf günstig zusammentreffen müssen. Die Doppelziffer 11 ist hier keine Faser, sondern eine Zählgröße, die aus der Kette von Lymphknoten resultiert. Die Kollagenfaser 1 ist im Zeilenlauf #515 ständig vorhanden, bis die Schicht dezimal mit „00“ endet. Die Bildung der Osteone mit einem Havers-Kanal wird als Gruppe 44 ausgelagert und ist als Form 77 zu suchen: EPI.Y+Pferd.Z.8130#515007044707790.
4.) Die Bälkchenknochen bzw. Schwammknochen (Substantia spongiosa) bilden ein schwammartiges Netz aus feinen Knochenbälkchen (Trabekeln). In den Hohlräumen dieses Netzes aus Spongiosabälkchen ist das Knochenmark (Medulla ossium) lokalisiert. Beim Neugeborenen ist ein rotes blutbildendes Knochenmark vorhandenen. Später lagern sich Fettzellen ein, so dass 2 Formen entstehen: a) Rotes Knochenmark (Medulla ossium rubra), b) Gelbes Knochenmark (Medulla ossium flava). Der Spongiosa wird der dezimalen Übergang zugewiesen: EPI.Y+Pferd.Z.8131#514943705998565. Für die schwammartige Struktur liegen Hohlräume vor: EPI.Y+Pferd.Z.8133#514817075307307
5.) Die Innere Knochenhaut (Endost) grenzt das Knochengewebe vom Knochenmark ab. Die Innenseite der Knochenmarkhöhle wird überzogen. Weil außerdem die Havers-Kanäle, die Volkmann-Kanäle und die Canaliculi ausgekleidet werden, kann der mikroskopische Blick in die Substantia compacta folgen. Endost 33: EPI.Y+Pferd.Z.8134#514753783313786.
6.) Die Osteone in der Kompakta: Die Osteone füllen den äußeren kompakten Knochenquerschnitt durch eine Vielzahl von Zell-Ringen als Kreisstruktur 050 aus. Es ist ein ringförmiger Lammellenanteil im Osteon 6_88_0_6 und ein Rest aus Kreisauschnitten (Tortenstücke) als Extra 8_0 im Zwickel zwischen den vollen Osteonen mit zentrischem Gefäßkanal (Havers-Kanal) vorhanden, der aus dem permanenten Auf- und Abbau der Osteone resultiert: EPI.Y+Pferd.Z.8135#514690506880680. Die Osteone befinden sich nur in der Substantia compacta. Entsprechend wird der feste Knochen 225 adressiert. Die zeitlichen Veränderungen werden als täglich mit der Zeit=24 verbunden: EPI.Y+Pferd.Z.8136#514627246002253.
Um den Zentralkanal (Havers-Kanal) werden im Osteon 4 Zell-Ringe 4_000 gruppiert. Davon wird der äußere Ring aus Knochenzellen (Osteoblast) und den Gegenspielern Knochenfresszellen (Osteoklast) gebildet, wofür 2 Zell-Formen als 72 und 77 enthalten sind. Im Inneren sind 2 Zell-Ringe mit Osteozyten vorhanden. Ein Innenring mit 4 Osteozyten und ein äußerer Ring mit 6 Osteozyten. Die Zählung mit den 2 Zellringen entspricht zufällig der üblichen Querschnittsabbildung eines Osteons in der Literatur. Tatsächlich wird die Anzahl der Lamellenringe in der Fachliteratur nicht mit 4 Stück, sondern 5 bis 20 genannt. In den Ringen liegen die Lamellen 5_6__6, sich durch Trennwände 5_1 abgrenzen. Der Unterschied im lamellären Aufbau der Osteone in der Kompakta und der Spongiosa wird im Polarisationsmikroskop sichtbar: EPI.Y+Pferd.Z.8137#514564000672770. Der Havers-Kanal (Canalis centralis) 500 im Zentrum des Osteons wird von Knochenlamellen umschlossen und enthält Nerv 7, Vene 8 und Arterie 9. Für die Lymphbahn 11 wird eine 2. Zeile benötigt: EPI.Y+Pferd.Z.8138#514500770886499 und EPI.Y+Pferd.Z.8139#514437556637711. Der Nährstofftransport ist mit Calcium=20 enthalten: EPI.Y+Pferd.Z.8140#514374357920680. Das Osteon wird radial zum Zentralkanal hin von mikroskopisch kleinen Knochenkanälchen (Canaliculi) 111 durchzogen. Hierin liegen die Zellfortsätze 1 der Osteozyten zur gegenseitigen Verbindung und zum Havers-Kanal. EPI.Y+Pferd.Z.8141#514311174729681. Die Havers-Kanäle sind quer untereinander (transversal) über die Volkmann-Kanäle verbunden. Die Volkmann-Kanäle als Extra 8_00 sind mikroskopisch erkennbare Knochenkanäle, die senkrecht zur Knochenoberfläche verlaufen und Blutgefäße 99 enthalten. Räumliche Verbindung 4_2_4, wobei die 142_142 über die Zeilennummer gekoppelt ist, um den Havers-Kanal zu adressieren: EPI.Y+Pferd.Z.8142#514248007058994. Die Gefäße 9 benachbarter Havers-Kanäle werden über den Volkmann-Kanal 1_4_1 verbunden 90_90: EPI.Y+Pferd.Z.8142#514184854902902. Der Volkmann-Kanal mit Gefäßen 8+9 muss als Form 7 über 1_1_1 als Knochenkanälchen kategorisiert werden: EPI.Y+Pferd.Z.8142#514121718255689. Nunmehr kann das Knochenkanälchen 111 als Endothel mit einer dünnen Schicht aus Endothelzellen 3=Haut ausgekleidet werden: EPI.Y+Pferd.Z.8145#514058597111643.
Die longitudinale Schichtenfolge des Knochens: Der Röhrenknochen (Os longum) ist außer seiner radialen Schichtenfolgen auch in der Längsachse unterschiedlich strukturiert. Das Knochenende (Epiphysis ossis) liegt als umfassende Struktur in der Gelenkhöhle (Cavitas articularis) 505_4 (4=räumlich), die an einem Dezimalübergang zur Haut 3_995 hilfsweise angenommen wird: EPI.Y+Pferd.Z.8146#513995491465054. Die Gelenkhöhle kann beispielsweise Schleimbeutel (Bursa synovialis) zur Auspolsterung an Druckflächen enthalten. Hohlraum als Extra 8_0, wobei die markierte 6= flexibel auf die enthaltene Gelenkflüssigkeit (Synovia) hinweist: EPI.Y+Pferd.Z.8149#513806267452980. Als Fuge zwischen den benachbarten Knochen 22 ist ein Gelenkspalt (Spatium articulare) 32_23 vorhanden, der seitlich 9 von der bindegewebigen Gelenkkapsel (Capsula articularis) 37_73 umhüllt ist: EPI.Y+Pferd.Z.8150#513743223739182. Die Gelenkkapsel umhüllt das Gelenk als zweischichtiger Schlauch, der aus der äußeren Faserschicht (Membrana fibrosa) und der Gelenkinnenhaut (Membrana synovialis) gebildet wird. Die Membrana synovialis 33 ist eine Schleimhaut, die aus 4 Zelllagen 4_9_4 besteht und die Gelenkflüssigkeit 6 bildet: EPI.Y+Pferd.Z.8151#513680195494336. An der Unterseite enthält die Subintima vaskularisiertes, kollagenes Bindegewebe und diverse Zellarten: EPI.Y+Pferd.Z.8152#513617182712749. Erwartet wird eine Formaussage 7, dass über 2 Zeilen die Gelenkflächen zur Passung möglichst gegensätzlich gewölbt sind: 35_5 und 0_35:
EPI.Y+Pferd.Z.8153#513554185388732 und EPI.Y+Pferd.Z.8154#513491203516597. Gelenkflüssigkeit (Synovia) im Gelenkspalt 0660: EPI.Y+Pferd.Z.8155#513428237090660.
Die äußere faserreiche 1 Membrana fibrosa 33 ist mit den Bändern verwachsen, die die Gelenkkapsel umgeben. Am Unteren Ende _391 muss sich die äußere Hautschicht einfalten und in die normale faserreiche äußere Knochenhaut übergehen: EPI.Y+Pferd.Z.8156#513365286105239l.
1. Röhrenknochenabschnitt: Als Epiphysis ossis werden die beiden (zum Körperzentrum proximale=näher bzw. distale=entfernte) Gelenkenden des Röhrenknochens bezeichnet [Die Epiphysis cerebri ist dagegen die Zwirbeldrüse (Glandula pinealis)]. Die Kompakta ist dünn. Dagegen ist die Substantia spongiosa mit dem Trabekel-Netzwerk stabilisierend nach der Knochenbelastung ausgerichtet. Im Alter bauen sich die Trabekel bei der Osteoporose mit einer Frakturneigung ab. Der Gelenkknorpel (Cartilago articularis) 33 überzieht die Gelenkfläche in einer Dicke von 5 mm bis 0,5 mm, besteht aus 4 Gewebezonen und ist mit dem Knochen verwachsen: EPI.Y+Pferd.Z.8157#513302350554656. In der 1. Knorpelschicht = Tangentialzone sind die Kollagenfibrillen tangential zur glatten Gelenkfläche ausgerichtet. Die Parallelität 2_3 ist zuvor bereits als 23 enthalten und über die 3_2_3 adressiert. In der Schicht sind runde Knorpelzellen (Chondrozyt) 4_3_0_4 enthalten, die ebenfalls parallel ausgerichtet sind: EPI.Y+Pferd.Z.8158#513239430433235. 2. Knorpelschicht = Übergangszone: Die Kollagenfibrillen 1_3_1, zuvor parallel 3_2, biegen sich bogenartig 3_0_2 EPI.Y+Pferd.Z.8159#513176525735302. 3. Knorpelschicht = Radiärzone: Die Kollagenfibrillen und die Chondrozyten liegen senkrecht 11 zur Gelenkfläche. Die Radiärzone ist die breiteste Schicht 4_55. An der unteren Schichtgrenze bildet sich eine Verfärbung als eine Grenzlinie "tide mark" 1_88, die durch eine hohen Gehalt an Proteoglykan verursacht sein könnte. Statt Melanin=88 ist es hier ein anderer Farbstoff: EPI.Y+Pferd.Z.8159#513113636455188. 4. Knorpelschicht = Mineralisierungszone: Es ist eine Übergangszone zum Knochen, bei der sich Calciumsalze in das Gewebe einlagern. Der Knochen ist noch nicht als 225, sondern übergangsweise als 22 erkennbar, die Struktur-5 ist lediglich avisiert 0_5_0. EPI.Y+Pferd.Z.8161#513050762587224.
Die Epiphysis hat gegenüber dem Knochenschaft (Diaphyse) eine eigenständige Blutversorgung, weil nach der Wachstumsphase mit der Verknöcherung eine Trennlinie (Linea epiphysealis) entsteht. Die Epiphysis ist nicht hohl, so dass die Gefäßeinführung von außen nicht als Knochenloch erscheint, sondern nur als Hohlraum. Die Epiphysenvene 8 besitzt keine gesonderte Einführung, so dass sie sich an die Epiphysenarterie 9 als Paarung 9_8 anlehnen muss: EPI.Y+Pferd.Z.8162#512987904125745. Die beiden Gefäßeinführungen 50_50 in den Knochen 2_9_2 sind außen 9 vorhanden: EPI.Y+Pferd.Z.8163#512925061065090.
Die Epiphyse ist knorpelig angelegt. Die Verknöcherung bildet sich erst im Zuge der Skelettentwicklung des Erwachsenen aus Knochenkernen (Ossifikationszentrum) heraus.
2. Röhrenknochenabschnitt: Die Epiphysenfuge bzw. Wachstumsfuge trennt die Epiphyse vom Knochenschaft (Diaphyse). Während des Wachstums ist die Fuge hyalinem Knorpel ausgefüllt, der zum Längenwachstum führt. Beim Menschen verknöchert die Fuge im Alter ab 20 Jahren. Die Zahl 20 ist durch Calcium=20 ohnehin vorhanden. Beim Pferd muss daher allgemein nach der Zeit=60 in Verbindung mit einem Hautwachstum 33_3 gesucht werden. Der Knochen wird 22 in Bezug gesetzt und die Epiphyse am Knochenende 99: EPI.Y+Pferd.Z.8164#512862233399600. Bei Fohlen ist nur ein Teil der Wachstumsfugen geschlossen. Nach 12 Monaten ist die Hauptwachstumsphase abgeschlossen und bei langsamen Wachstum sind alle Wachstumsfugen nach 4 Jahren geschlossen. Die Belastbarkeit eines Rennpferdes wird durch Röntgen des Karpalgelenks festgestellt. Der Zahnwechsel erfolgt bis zum 5. Lebensjahr. Mit 7 Jahren ist das Pferd mental ausgereift. Die Wachstumsfuge wird als Spalt 11 in Bezug zum Knochen 22 gesetzt als 2_11_2, so dass an der Epiphysenfuge 99 die Ziffer 4 für 4 Jahre bis zur Verknöcherung ablesbar ist. Mit 12 für 12 Monate des Hauptwachstums können die 36 auch als 3 Jahre für den Belastungsbeginn gezählt werden, sofern der Rücken am Kreuzbein nicht überlastet wird: EPI.Y+Pferd.Z.8165#512799421123617. Die verknöcherte Wachstumsfuge bleibt als Epiphysenlinie (Linea epiphysealis) 11 bzw. 1_9_1 sichtbar. Die 7 Jahre können über QS 1+2= 3 mit 65 als 365 Tage/Jahr gezählt werden, so dass die 7 Entwicklungsjahre über QS 1+2=3_7_65_7 ablesbar sind: EPI.Y+Pferd.Z.8168#512611076576191.
Die Epiphysenfuge bildet bis zu den knöchernen Rändern 4 Zonen aus, denen als Hautschicht ein Bereich „33“ zugewiesen werden kann:
Zone 1: Reservezone 33 hyalinem Knorpel mit der Zeit 24 und Form 7 als rundliche „0“ Knorpelzellen (Chondrozyten) 0_33_0: EPI.Y+Pferd.Z.8171#512422870330967.
Zone 2: Proliferations- oder Wachstumszone 33: Mit dem Wachstum 1-2-3 und der Zeit 60 sowie einer Säulenbildung 6_5_6: EPI.Y+Pferd.Z.8172#512360165623389. Die runden Chondrozyten flachen sich ab und ordnen sich longitudinal 22_22 in Säulen als Säulenknorpel 5_666: EPI.Y+Pferd.Z.8174#512234802235666.
Zone 3: Hypertrophe Zone (Resorptionszone) 33: Die Chondrozyten vergrößern durch Wasseraufnahme ihr Zellvolumen und bilden durch ihre blasenartige Form den Blasenknorpel. Die Doppelziffer 33 liegt anfangs nur indirekt vor. Die Knochenmatrix wird als Gruppe 44 strukturiert. Die Haut 33 ist als Quersumme QS 2+1=3 _Form 7_QS 2+1=3 enthalten: EPI.Y+Pferd.Z.8175#512172143544261. Der Blasenknorpel 5_00 ist nunmehr als Struktur vorhanden: EPI.Y+Pferd.Z.8176#512109500180324. Für die Blasenform „0“ in der Zellschicht 33 muss das Wasser für die Zellhydraulik „H20“ über 1*2=H2 + 8=Sauerstoff vorgemerkt werden, bevor dann noch die 10=Wasser zur Anregung des Längenwachstums erscheint: EPI.Y+Pferd.Z.8177.#512046872138233. Das Wachstum wird über die Zählgröße #511 und den Beginn der Säulenbildung adressiert: EPI.Y+Pferd.Z.8178#511984259412366. Das Wasser=10 wird mit der Säulenbildung 66 als Wirkstoff eingefügt. Das Wasser 10 ist im 10er BiXnom-Schwingkreis stets aktiv. Aufgrund Östrogen=66 ist der weibliche Knochen feiner strukturiert und bei mangelndem Östrogen von einem Knochenschwund bei einer Osteoporose betroffen. Bei Männern 10 Jahre später am 60 Jahre: EPI.Y+Pferd.Z.8179#511921661997106. Die hypertrophen Chondrozyten produzieren während der enchondralen Ossifikation das Kollagen Typ X. Es befindet sich in der Mineralisationszone des hyalinen Knorpels. Die Knorpelmatrix wird verfestigt und es bilden sich Trennwände (Septen). Die Trennung zur Septenbildung ist eine Spaltung von 7=Form und 9=Ende: EPI.Y+Pferd.Z.8180#511859079886838 und EPI.Y+Pferd.Z.8181#511796513075948. Die 88 ist hier kein Melanin, sondern wegen der Doppeldeutigkeit der 9 als Arterie produzieren die Chondrozyten den Wirkstoff VEGF (vascular endothelial growth factor), der in der nachfolgenden Eröffnungszone die Blutgefäße zur Erneuerung anregt.
Zone 4: Eröffnungszone (Verknöcherungszone) 33: Im Zeilenlauf liegt mit #511... der Knochen stets vor. Mit #5117... beginnend wird die Strukturschwelle #5115 dezimal unterlaufen, so dass es zum Strukturabbau kommt. Die hypertrophen Chondrozyten werden abgebaut. Unter dem Einfluss von Chondroklasten lösen sich die zwischen ihnen liegenden Septen ebenfalls auf. In diese Knorpelhöhlen wachsen Blutkapillaren (Vene 8, Arterie 9) und Stammzellen ein: EPI.Y+Pferd.Z.8189#511296528693898. Es reifen knochenbildenden Osteoblasten heran, die eine Knochenmatrix: EPI.Y+Pferd.Z.8192#511109286312785. Die Zeile zuvor wird den Gegenspielern, den Knochenfresszellen (Osteoklasten) zugewiesen. Diese enthalten bis 25 Zellkerne und befinden sich an der Knochenoberfläche in den Resorptionslakunen (Howship-Lakunen). Diese sichtbaren Einbuchtungen entstehen bei der Resorpotion der Knochensubstanz an der Oberfläche der Knochentrabekel. Die Epiphysenfuge liegt im wachstumsbedingt unscharf abgegrenzten Bereich der Metaphyse, die zwischen dem Knochenschaft (Diaphyse) und der Epiphyse an den beiden Knochenenden liegt.
3. Röhrenknochenabschnitt: Die Diaphyse kann nunmehr im dezimalen Strukturübergang mit der Null als Röhre des Knochenschafts als mittlerer Knochenabschnitt adressiert werden. Mit Eisen=26 kommt die Markhöhle demnächst in Betracht, die das Knochenmark enthält: EPI.Y+Pferd.Z.8193#511046902657675. Die Knochenmarkhöhle (Cavum medullare) ist von der Substantia compacta umgeben und mit der inneren Knochenhaut (Endost) 33 ausgekleidet: EPI.Y+Pferd.Z.8194#510984534229233. Die Knochenmarkhöhle als Zentrum des Knochens liegt als struktureller Hauthohlraum 303_00_55 vor. EPI.Y+Pferd.Z.8196#510859843030055. Die Markhöhlen ersetzen die in der Diaphyse spärlich ausgebildete Substantia spongiosa, so dass in diesem Knochenabschnitt die Substantia compacta überwiegt. Das Knochenmark wird über Blutgefäße ernährt. Um diese durch die Substantia compacta einzuführen, ist seitlich ein Knochenloch (Foramen nutricium) 202 vorhanden. Die Arteria nutrica 9 (nutrire = ernähren) zieht durch. Die Vena nutrica 8 hat ihr Knochenloch direkt daneben: EPI.Y+Pferd.Z.8197#510797520248180 und EPI.Y+Pferd.Z.8199#510672920292027. Die beiden Gefäße als 00 in der Zeilennummer verteilen sich beidseitig, so dass eine Symbolik 106_106 mit QS 4+3=Form 7 benötigt wird: EPI.Y+Pferd.Z.8200#510610643106626. Zentrale Vene (Central vein) 8_0_8: EPI.Y+Pferd.Z.8201#510548381108930. Zentrale Arterie (Central artery) 9_0: EPI.Y+Pferd.Z.8203#510423902654435. Das Grundgewebe des Knochenmarks enthält zahlreiche dünne Blutgefäße, die als Knochenmarksinus bezeichnet werden. Der Venenraum 4_8_4 [Hematopoietic tissue space/ Venous sinuses] ist an der zentralen Vene angeschlossen 88: EPI.Y+Pferd.Z.8205#510299484884135. Von der zentralen Arterie gehen 2 Arterien (Radials arteries) 99 ab: Arterieller Abgang 99 zum Knochenmarksinus: EPI.Y+Pferd.Z.8210#509988705660698. Arterieller Abgang 99 zur äußeren Periosteal artery den Gefäßen der Cortical bone, die nach innen mit dem Venenraum verbunden sind: EPI.Y+Pferd.Z.8211#509926595234969. Der Knochenmarksinus als Gefäßgruppe 44 mit Arterien 999 und Venen 88:EPI.Y+Pferd.Z.8212#509864499935988. Einige Kapillare der Nährstoffarterie (Arteria nutrica) führen zuerst in die Havers-Kanäle 0_89_0 ein, bevor sie ins Knochenmark zurückschwingen und im Venenraum münden: EPI.Y+Pferd.Z.8212#509802419758229. Mögliche weitere Entwicklung: Die im Knochenmark enthaltenen Stammzellen sind als Gruppe 44 adressiert, über das Eisen=26 mit der Blutbildung (Hämatopoese) über Gefäße 9_8_9 und 7_0_7 gekoppelt und als Struktur 55 vorhanden, wobei die rote Blutzelle (Erythrozyt) optimiert als 9000 wie innenseitig leergeräumt ohne Zellkern zu deuten ist: EPI.Y+Pferd.Z.8215#509678304744289; EPI.Y+Pferd.Z.8216#509616269897071; EPI.Y+Pferd.Z.8217#509554250149000. Die 26 ist ohne die 9 als Arterie zusätzlich in der Quersumme 5+5+5+4+2+5=26 enthalten.
Huf (Ungula)
Der „Huf“ im engeren Sinne ist ein Hornschuh, der bei Unpaarhufern (Pferd, Esel, Zebra) das Zehenendorgan ähnlich dem Fingernagel beim Menschen umschließt. Die inneren Bestandteile wie Knochen, Bänder, Sehnen und Gelenkbestandteile sind im Begriff „Huf“ aber mit enthalten. Paarhufer (Rinder, Schweine, Ziegen, Schafe, u.a.) tragen Klauen (Noun) statt Hufe. Die inneren Bestandteile sind im Hornschuh elastisch mit einem „Hufbeinträger“ aufgehängt und können durch einen horizontalen Scan vom Ballen über den Stahl zur Zehenspitze adressiert werden. Mit dieser Betrachtung wird der äußere Hornschuh nicht erreicht, weil das Horn lotrecht die Hufwand herunterwächst. Vertikale Hufwand und horizontale Sohle treffen sich an der „Weißen Linie“.
Die dreischichtige Haut [Hufoberhaut (Epidermis ungula), Huflederhaut (Dermis bzw. Corium ungulae), Hufunterhaut (Subkutis bzw. Tela subcutanea ungulae) ist modifiziert: Die Epidermis ist stark verhornt und die Unterhaut (Subkutis) ist nur im Bereich der Polster vorhanden, so dass der vordere Hufbereich starr und der hintere Bereich flexibel ist
Der Huf als distales Ende des einzehigen Pferdefußes besteht aus folgenden Stützelementen: distaler Abschnitt des Kronbeins (Os coronale), Hufbein (Os ungulare), Strahlbein (Os sesamoideum distale), die Hufknorpel, Bänder, tiefe und oberflächliche Beugesehne, Strecksehnen, Hufrollenschleimbeutel (Bursa podotrochlearis).
Zur Darstellung der Besonderheiten werden 6 Hufsegmente unterschieden: 1.) Hufsaum (Limbus ungulae) im Anschluss an die behaarte Haut, 2.) Hufkrone (Corona ungulae) distal des Hufsaums, 3.) Hufwand (Paries ungulae), 4.) Hufsohle (Solea ungulae), 5.) Hufstrahl (Cuneus ungulae), 6.) Hufballen (Torus ungulae). Der Strahl ist eine Bildung des Ballensegments, so dass mit einem Ballen-Stahl-Segment alternativ nur 5 Segmente entstehen.
Informationen zu den Hautschichten siehe u.a.: 1.) „Zur Morphologie und Histochemie des Pferdehufes; Bolliger, C; Geyer, H. [Pferdeheilkunde 8 1992 Geyer.pdf (uzh.ch)]“; Farbdarstellung von Abbildungen siehe: „Glossar | e-hoof.com“
***Lederhaut (Dermis/Corium)
Die Hufsegmente bilden jeweils eine Lederhaut, über der sich das Horn bildet. Die Lederhaut ernährt die gefäßfreie hornbildende Epidermis und fixiert das Hufinnere in der Hornkapsel. Dazu wird die Oberfläche durch Zotten vergrößert. Nur im Wandsegment sind ergänzend 600 Primärblättchen vorhanden, von denen jedes 100 bis 200 Sekundärblättchen bildet.
***Dermoepidermale Junktionszone (DEJ)
Dermis und Epidermis grenzen mittels einer Basalmembran aneinander, die einen gewellten / gezackten Verlauf zeigt. Die Basalzellen der Epidermis sind in der Basalmembran durch Hemidesmosomen und die Palillarschicht der Dermis durch kollagene Ankerfibrillen eingebunden. Die Basalmembran enthält 3 Schichten (Lamina rara externa, Lamina densa, Lamina fibroreticularis).
***Epidermis
Die Hufoberhaut (Epidermis ungulae) besteht aus mehreren Schichten: 1.) An der Keimschicht (Stratum germinativum) aus lebenden Zellen werden 1.1) die Basalzellschicht (Stratum basale), in der die Zellteilung erfolgt, und 1.2) die Stachelzellschicht (Stratum spinosum) unterschieden. Das Stratum spinosum geht direkt in das Stratum corneum über, abweichend wird im Ballen-Strahl-Segment mit einem weichen Horn 2.) das Stratum granulosum als eine Zwischenschicht analog zur behaarten Haut gebildet. 3.) Hornschicht (Stratum corneum).
Die Verhornung beginnt bereits im Stratum basale und verstärkt im Stratum spinosum, indem zur inneren Zellstabilität Tonofilamente eingelagert werden. Die Tonofilamente sind Vorläufer der Keratinfibrillen im Stratum corneum. Der äußere Zusammenhalt der Epidermiszellen wird im Stratum germinativum durch Haftplatten (Desmosomen) hergestellt. Im Unterschied dazu werden die Zellen in der Hornschicht (Stratum corneum) mittels Interzellularkitt (Glykoproteine, Lipide, Enzyme) als „Mauerwerk“ vermörtelt. Die Keratinfibrillen richten sich nach der Form der Hornzellen aus. In den abgeplatteten runden Hornzellen liegen die Fibrillen in 2 Ebenen parallel zur großen Zelloberfläche. Dagegen richten sich Keratinfibrillen in langgestreckten spindelförmigen Zellen in Längsrichtung der Hornzellen aus. Das Hufhorn wird hauptsächlich als Röhrchenhorn gebildet. Ein innerer Hohlraum (Lumen), das Mark, entsteht unmittelbar über der Spitze der Lederhaut-Zotten. Die Epidermis bildet dort Hornzellen, die sogleich wieder zerfallen. Das Mark ist von der tragenden Röhrchenrinde umgeben, die über den Zotten entsteht. Das Röhrenhorn wird vom Zwischenröhrenhorn umgeben, dessen Zellen quer zur Längsachse des Röhrenhorns ausgerichtet sind.
Beim Röhrenhorn werden 3 Typen nach der Ausrichtung der Zellen in der Röhrchenrinde unterschieden: Die Hornwand wird vom Saum-, Kron- und Wandsegment gebildet und schließt unten (distal) mit dem Tragrand ab. Begriff „Hornwand“ = Hufplatte (Hornplatte / Hufplatte) [Paries corneus]. Das Saumhorn reicht als eine oberflächliche Überzugsschicht von der behaarten Haut zum Tragrand herunter und besteht aus Röhrchenhorn. Das 6-10mm dicke Kronhorn wird oben an der Kronwulst angrenzend an das Saumsegment aus 3 Zonen zusammengesetzt: Außen- und Mittelzone enthalten ovale Hornröhrchen (suche 00 statt 0 für rund) vom Typ 1 mit platten Rindenzellen. Der größere Durchmesser ist parallel zur Oberfläche ausgerichtet. Die Rindenzellen sind zwiebelförmig um das Röhrenmark angeordnet. In der Innenzone sind große, runde Röhrchen vom Typ 2 vorhanden. Die Rinde besteht aus spindelförmigen Zellen deren Längsachse parallel zum Röhrenmark ausgerichtet ist. Das Sohlen- und Strahlhorn vom Typ 3 enthält spindelförmige Zellen, deren größte Länge zirkulär um das Röhrenmark angeordnet ist, so dass die Längsachse der Zellen senkrecht zum Röhrenmark verläuft. Die Epidermis ungulare bildet eine am Kadaver künstlich ablösbare Hufkapsel (Capsula ungulae), die aus der Hornwand / Hornplatte (Paries corneus) sowie Hornsohle (Solea cornea), Hornballen (Torus corneus) und Hornstrahl (Torus corneus) besteht.
*** Suche der Hufbestandteile:
Das Hufbein (Os ungulare) wurde als Bestandteil des Skeletts bereits erfasst. Aufgrund des Zeilenlaufs müssen sich der vordere und der hintere Huf etwas in geometrischen Merkmalen unterscheiden. Die funktionelle Übereinstimmung entsteht durch gemeinsame Haut-Merkmale. Die Haut des Pferdes in der Episode EPI.Y+Pferd unterscheidet sich nur wenig vom Menschen. Daher kann der markante Unterschied zwischen Huf und Fingernagel nur dadurch entstehen, dass der Huf parallel zur Hautentwicklung in der Leitepisode EPI.X+Pferd vorliegt.
Die Hornkapsel (Hufkapsel) wird als Hautstruktur 5_33 im Zeilenlauf ab EPI.X+Pferd.Z.7759#533644864260677 erwartet, zumal eine Hufgruppe 44 in runder Hufform 606_77 adressiert wird. Der Zeilenlauf kann an der Hufsohle beginnen, in dem der Huf wie für den Hufschmied um 90° angewinkelt werden. In dieser Position wird der Huf dann im Zeilenlauf vom Hufballen, über die mittlere Strahlfurche, die Strahlspitze, die Hornsohle, die „Weiße Linie (WL)“ bis zum Tragrand abgescannt, um alle Hautschichten zu adressieren. Diese Startposition liegt bereits vor, weil das Hufknorpelband erst infolge einer Wende an der Hufbeinspitze im Zeilenlauf entsteht. Das Suchgebiet muss jedoch ausgedehnt werden, weil das Saum- und Kronhorn bereits oberhalb der Hornkapsel (Hufkapsel) entsteht und dann mit dem Wandhorn herunterwächst. Mittels einer Zeilensprungmarke vom Hufbeinbereich in Zeile 1095 zur Hornbildung in Zeile 7680 wird das Suchgebiet vorverlegt. Sprungmarke: EPI.X+Pferd.Z.1095#378132465917680 auf EPI.X+Pferd.Z.7680#539134179921692, wobei sich 6 Segmente am Fußende 9, paarig 2, finden lassen. Noch früher ist der automatische Wechsel: Sobald die behaarte Haut in EPI.Y+Pferd beginnt, startet auch die Hornbildung in der Leitepisode EPI.X+Pferd.Z.7641#541885944483522. Enthalten ist ein Bezug zum Knochen 522 und eine Hufgruppe 44 synchron für 4 Hufe gleichzeitig als 444. Die Lederhaut 33 der beharrten Haut 11 setzt die Haarbildung auf Null=0_11 an 4 Füßen 4_0: EPI.X+Pferd.Z.7644#541673273390711 und EPI.X+Pferd.Z.7645#541602420117540. Die Haare betreffen die Epidermis, so dass die Saumlederhaut noch früher beginnt.
Was wird gesucht? Gleichartig muss nach dem Saumhorn das Kronhorn folgen: 1.) Die hornbildende Epidermis ist von der Lederhaut (Dermis) durch eine Basalmembran 333 getrennt, die als Hautmembran 33 aus 3 Schichten besteht und als 333 gewellt erscheint. 2.) Im Zeilenlauf vor der Basalmembran müssen in der Lederhaut Ankerfibrillen als Fasern 11 oder 111 vorhanden sein. 3.) Der Membran muss im Zeilenlauf ein versetztes Fugenbild der verkitteten Epidermiszellen folgen, das einem Mauerwerksverbund ähnlich ist.
Die Saumlederhaut 33 legt sich unterhalb der behaarten Haut und oberhalb des Hornschuhs als ein bis 6 mm breites Band um den Fuß. Die Ziffer 9 ist als Markierung 929 und als Quersumme 5+4=9 enthalten. Mit diesem Hinweis entsteht der Ring als Raumstruktur 5_4 dadurch, dass die 54 im Zeilenlauf von links nach rechts durchwandert. Weiterhin ist mit 929_292 die Schichtung von Saum- und Kronsegment enthalten. Ringform als 707: EPI.X+Pferd.Z.7538#549290329238338 bis EPI.X+Pferd.Z.7546#548707991226954. Die Breite des Saumbandes 22_3_22 ist mit 6 mm in 2_6_2 markiert: EPI.X+Pferd.Z.7543#548926223226647. Die ringfömige Saumlederhaut ist aufgrund der Wanderung „54“ über mehrere Zeilen in Bezug auf die Sohle im Winkel von 30° geneigt. Mißverständlich wird der schräge Ring über dem Hornschuh nur zusammen mit der Kronlederhaut als „Saumband“ bezeichnet. Die Zahl 30° fehlt! Es sind 9 Zeilen als Kathete vorhanden, so dass man in einer Zeile die Zahl 18 als Form 7_18_7 für die Hypotenuse suchen kann, um sin (9/18) = 30° zu bilden. Die Zahl 18 wird nochmals als Quersumme 6+9+1+1+0+1=18 hinter der Markierung gebildet: EPI.X+Pferd.Z.7541#549071807691101. Die Saumlederhaut 33 ist wie die Kronlederhaut mit Zöttchen 11_3_1 besetzt (Wandlederwand mit Blättchen): EPI.X+Pferd.Z.7566#547257533941131 bis EPI.X+Pferd.Z.7573#546751683850336. Ankerfibrillen 111 an der Basalmembran: EPI.X+Pferd.Z.7576#546535177111747. Basalmembran 333: EPI.X+Pferd.Z.7581#546174713335786. Der Zellverbund der Epidermis wird über die flexible 66 zunächst als Form 7 in 6_77_6 avisiert. Es folgen dann 3 Zeilen, die die 66 als „Mauersteine“ enthalten, sowie 2 Zeilen als Fugenversatz „7247 vs. „7427“ der Steine. Die Bildung von Saumhorn 33 ist mit 707 als Röhrchenhorn erkennbar: EPI.X+Pferd.Z.7590#545527075335783 und EPI.X+Pferd.Z.7592#545383364304346. Das Saumhorn wächst als Gruppe 444 aus 3 Segmenten 4_3_4 (Saum-, Kron- und Wandsegment) die Hornwand bis zum Tragrand herunter, wobei die Zeitdauer mit 365 Tagen fixiert ist: EPI.X+Pferd.Z.7602#544665943409444 und EPI.X+Pferd.Z.7618#543521987634365. Das Horn 3_4_3 ist in der Markierung enthalten, bis zu der die Quersumme =5+4+3+5+2+1+9+8+7+6+3+4+3= 60 als Zeitbezug zu verstehen ist. Der Rest 6+5= 11 ist eine Zählgröße.
Die Saumlederhaut liegt in einer Senke /Grube, so dass umgekehrt von innen gesehen, die Unterhaut (Subcutis) zunächst das Kronpolster (Kronwulst /Kronkissen) bilden muss, auf dem die Kronlederhaut nach außen folgen kann. Die Kronwulst 33 der Unterhaut 33 liegt neben dem Hufgelenk und entsteht als Zeilenbereich 44 ab: EPI.X+Pferd.Z.7581#543379330944698. Die Verdickung 666 zur Wulst erreicht das Maximum am Hufgelenk als Knochenbezug 5_22_5: EPI.X+Pferd.Z.7628#542809452254666. Nerv „Ramus coronalis“ 7: EPI.X+Pferd.Z.7628#542453884684737. Blutgefäße als Netzwerk 444 aus der Arteria coronalis 9 und der Vena corolalis 8: EPI.X+Pferd.Z.7641#541885944483522. Vor dem Hufgelenk zieht sich die Sehne 1 des gemeinsamen Zehenstreckers zum Hufbein herunter: EPI.X+Pferd.Z.7622#543236749120781; EPI.X+Pferd.Z.7627#542880621712154; EPI.X+Pferd.Z.7638#542098782639251. Die Kronwulst als Gruppe 44 endet 9: EPI.X+Pferd.Z.7641#541744145204579.
Die Kronlederhaut 33 beginnt: EPI.X+Pferd.Z.7644#541673273390711. Bei Annäherung an die Basalmembran sind keine Fibrillen 111 erkennbar, sondern es ist ein Fasernetz 444_1 vorhanden: EPI.X+Pferd.Z.7636#535231450594441. Ankerfibrillen 9_11_9: EPI.X+Pferd.Z.7748#534402491197547. Basalmembran 333: EPI.X+Pferd.Z.7749# 534333527138804. Der „Mauerwerksverbund“ der Zellen in der Epidermis der ist ein Strukturversatz 5808 zu 8085 als Form 77 in 2 Zeilen mit einem verschobenen Fugenbild 956_596 in der Zwischenzeile: EPI.X+Pferd.Z.7750#534264580877238; EPI.X+Pferd.Z.7751#534195652405960; EPI.X+Pferd.Z.7752#534126741718085.
Das Kronhorn gliedert sich in Außen-, Mittel- und Innenzone. Wie zuvor ersichtlich, enthält die Außenzone ovale Hornröhrchen vom Typ 1 als „808“. „Oval“ entsteht nicht als 00, sondern mit 5808 und 8085 wird seitlich oval gezogen. Die Innenzone 33 wird als Röhrenstruktur 50__05 gebildet. Die Zone ist unpigmentiert, weil der Farbstoff 88 fehlt. In der Folgezeile ist lediglich die Zahl 8 enthalten: EPI.X+Pferd.Z.7758#533713650657205. Es folgt die Röhrchengruppe 44 mit großen runden Hornröhrchen vom Typ 2 als „606“ und Form 7: EPI.X+Pferd.Z.7759#53364486426067. Die Innenzone bleibt in der Dicke konstant, dagegen wird die Außen- und Mittelzone an den Trachten dünner. Die Hornröhrchen in der Mittelzone sind nicht direkt auffindbar, können aber als gemischte Verteilung zwischen 808 und 606 als 86_0_86 gedeutet werden. Keine Evolution, sondern ein zahlentheoretischer Durchlauf: EPI.X+Pferd.Z.7755#533920116286086.
Gemäß Suchkonzeption wird ab der Struktur #5335 mit dem Ballen-, Strahl und Sohlelement begonnen, so dass die Hornwand mit der Bildung des Wandsegments an dieser Stelle nicht mehr vollendet werden kann. Somit wird nunmehr nach dem Kronhorn zunächst das Sohlhorn gebildet, um anschließend das Wandsegment zu bilden. Hierbei zeigt sich an der Sohle neben dem Tragrand als Übergang zwischen Kron- und Sohlhorn die "Weiße Linie" des Wandhorns, die als Nagellinie beim Hufbeschlag dient. Im Wandsegment bildet sich außerdem der Hufbeinträger. In der Knochenoberfläche des Hufbeins treten kollagene Fasern aus, über die das Körpergewicht elastisch am Hornschuh aufgehängt wird. Weil das Wandhorn herunterwächst, muss die Kontaktstelle ständig erneuert werden. Außer dem Hufbeinträger muss daher noch das Gleithorn gebildet werden. Bei der Suchoperation wird als Grenze zwischen Epidermis und Lederhaut (Dermis) weiterhin die Basalmembran „333“ zur Orientierung gesucht.
Der Huf beginnt als Hautstruktur 33_5. Die paarigen Hufballen sind mit der Ziffer 6_0 weich und flexibel. Der Hufballen liegt unter der Fesselbeuge, besitzt eine weiche Haut und liegt direkt über dem Huf. Es sind 2 Ballenpolster, die symmetrisch zur Mittelachse angeordnet sind 60_9_55_9_60 als Haut 3. Hufballen (Torus ungulae): EPI.X+Pferd.Z.7760#533576095592603. Darin enthalten ist ein Verweis auf den noch weichen, verhornten, lederartigen Strahl 9_55_9_2 in der Hufsohle. Nach der Art der Hautschichten ist der Strahl eine Ausbildung des Ballensegments, so dass hier eine Information zu erwarten ist. Die mittlere Strahlfurche endet als Ausrundung 606_5, wobei ein Bezug zum Hufballen 60 und zur Form 6_7_6 vorhanden ist: EPI.X+Pferd.Z.7782#532067656360652. Die paarigen Diagonalen des Strahls laufen mit 9=seitlich in V-Form über das Strahlbein hinaus mittig zusammen, und zwar bis EPI.X+Pferd.Z.7783#531999293562713.
Im Hornschuh wird das Körpergewicht über das Hufbein elastisch aufgehängt. Die Huflederhaut liegt unter der Hornschicht. Es wird eine Huflederhaut-Gruppe 33_5_44 gebildet, zu der zufällig 6 Hufbereiche 6_4_6 gehören [Ballenlederhaut (Dermis tori), Stahllederhaut (Dermis cunei), Sohlenlederhaut (Dermis solerae), Wandlederhaut (Dermis parietis), Kronlederhaut (Dermis coronae), Saumlederhaut (Dermis limbi)]. Die Haut 3 ist auch als Quersumme 1+2=3 enthalten. Die Ziffer 7 bezieht sich weniger auf die Form als auf die Nerven 7 in der Lederhaut: EPI.X+Pferd.Z.7761#533507344646127. Der Papillenkörper ist in der Huflederhaut dominant ausgeprägt. In der Wandlederhaut bilden sich lange stark verzweigte Blättchen und in den anderen Bereichen lange Zotten. Der Form nach handelt es sich um eine kammartige bzw. bürstenförmige Lamellenlederhaut. Mit dem Bürstenelement 1 entsteht eine Lamellenlederhaut 33 als Raumgruppe 11_4_1_44. Das venöse Blutgeflecht 8 entleert sich durch den Druck beim Auftritt, so dass neues Blut vom Herzen nachfließen kann (Hufpumpe). Die Arterie 9 umschließt die Bürstengruppe als Quersumme 6+3=9 und der Nerv 7 ist als 4+3=7 vorhanden: EPI.X+Pferd.Z.7762#533438611414403.
Am hinteren Ende der beiden Hufbeinäste bildet sich der paarige Hufknorpel 333_89_5_89. Der Hufknorpel erreicht das distale Ende des Kronbeins, so dass das Kronbein als Stützstelle ebenfalls zum Huf gehört. Als ein Krankheitsbild kann der Hufknorpel verknöchern. Die Quersumme des Knochens 225 mit 2+2+5=9 ergibt mit 9=seitlich den Hufknorpel, der als Extra=8 am Hufbein als Hufknorpel 333 mit 3+3+3=9=hinten anliegt: EPI.X+Pferd.Z.7763#533369895890583. Mittig zwischen dem seitlichen Hufknorpel beginnt das Ballen- und Strahlkissen (Strahlpolster), das sich durch die Verdichtung der Subkutis bildet. Das Strahlpolster füllt die Ballengrube aus. Es ist mit dem seitlichen Hufknorpel verwachsen, der beim Auftritt des Pferdes hochgedrückt wird und dabei den Hufmechanismus in Gang setzt. Das Verwachsen wird als Spiegelung 98 zum seitlichen Knorpel 89 angezeigt. Zwischen dem Hufbein und dem Strahlpolster zieht sich die tiefe Beugesehne 11 als Bestandteil der „Hufrolle“ bis hinter das Strahlbein. Das Strahlbein wird mit 8_2_5 statt 225 bereits als Extra 8 avisiert [die „225“ entsteht erst nach einer Wende um die Hufbeinspitze im Rücklauf]. Das Strahlbein (Os sesamoideum distale) ist ein zusätzlicher Knochen, der die Auflagefläche für das Kronbein vergrößert. Strahlpolster 333_0: EPI.X+Pferd.Z.7764#533301198067825.
Über die sogenannten „Hufrolle“ wird die tiefe Beugesehne (TBS) zum Hufbein am Strahlbein (Os sesamoideum distale) umgelenkt. Zur Druckverteilung ist der Hufrollenschleimbeutel (Bursa podotrochlearis) dazwischen geschaltet. Das Strahlbein ist im Schleimbeutel eingebettet. Weil der Schleimbeutel seitlich übersteht, muss er vor und nach dem Strahlbein im Zeilenlauf erkennbar sein. Der Schleimbeutel ist ein mit Flüssigkeit gefüllter Gewebesack 33_0, der aus einer äußeren Bindegewebsschicht (Stratum fibrosum) und einer inneren Schicht (Stratum synoviale) besteht, die die Schleimbeutelflüssigkeit (Synovia) produziert. Stratum fibrosum 33_0 mit der Bindegewebsfaser 1 sowie dem Sack=0 als Hautform 7_3_7 : EPI.X+Pferd.Z.7767#533095210737556. Stratum synoviale 33_0 enthält die Zeit mit 365 Tagen/Jahr, d.h. die Flüssigkeit wird ständig produziert: EPI.X+Pferd.Z.7768#533026583650695. Mit 6_5 liegt eine flexibel Struktur, die die Flüssigkeit als Extra=8 erzeugt, so das mit dieser Ziffer als 88 oder 808 die Ausdehnung des Schleimbeutels erzeugt wird.
Das Strahlbein wird als Knochen 225 gebildet und zeigt einen symmetrischen Querschnitt mit einer konvexen Oberlinie 1_9_040_9_1. Die Ziffer 9 zeigt die Richtung nach oben und zugleich handelt es sich um 9_0 um die Gefäßkanäle (Canales sesamoidales) im Knochen. Das Blut wird über die Arterie 9 in den Knochen gepumpt. Sofern das Blut in den Venen staut, bilden sich Kanalverzweigungen, die den Knochen krankhaft aushöhlen. Die Verbindung von Hufbein und Strahlbein erfolgt über ein Strahlbein-Hufbein-Band 1_1. Strahlbein: EPI.X+Pferd.Z.7772#532752251904091. Die paarige 2 seitliche Strahlfurche 71_3_0__71 als Form 7 zeichnet sich als Linie 1 ab. Zugleich ist die Symmetrie 83_83 als ein Extra 8 der Haut 3 vorhanden: EPI.X+Pferd.Z.7773#532683713083571.
Hufsohle (Solea ungulae):
Die Hufsohle entsteht, wenn unterhalb des Hufbeins ein Zeilenlauf mit der vertikalen Folge von Lederhaut, Basalmembran und Epidermis vorliegt. Verfügbar ist der Bereich von Zeile 7784 bis 7965: 1.) Saum– und Kronelement von Zeile 7680 bis 7760; 2.) Ballen– und Strahlelement vom Ballen horizontal zur Hufspitze von Zeile 7661 bis Strahlspitze Z. 7783. 3.) Freier Bereich: Suche von 7784 bis 7965 4.) „Hufbeinstütze“ für das Körpergewicht als hängende Diagonale vom Kronrand zum Hufbein herunter von Zeile 7966 bis 8025. 5.) Wandelement zur Verbindung der Hufwand mit der Hufsohle als „Weiße Linie“ unterhalb des Hufbeins bis zum Tragrand herunter von Zeile 8026 bis 8242.
Das Pferd ist ein Tragwand-Läufer, so dass statt der Sohle nur der Strahl den Boden berührt. Die Sohle besteht aus dem zentralen Sohlenkörper, der hinten beidseitig des Strahls durch zwei Sohlenschenkel bis zum Eckstrebenwinkel ergänzt wird. Mangels einer stoßdämpfenden Unterhaut (Subkutis) ist die Hufsohle nicht zur direkten Lastabtragung des Körpergewichts geeignet, was am konkav nach innen geformten Sohlengewölbe sichtbar ist. Die Sohlfläche senkt sich erst bei der elastischen Verformung der Hornkapsel (Hufkapsel) beim Hufmechanismus.
Die Lederhaut ist im Hufbein verankert und ersetzt die Knochenhaut (Periost) durch eine knorplige Übergangsschicht in 4 Zonen (siehe „Hufbeinstütze“). Die Knochenverankerung ist am Wandelement wegen der elastischen Aufhängung des Hufbeins notwendig, trotzdem sind diese 4 Zonen auch an der Sohle zu erwarten. Aufgrund der tiefen Beugesehne ist das Hufbein bereits vorhanden, so dass die 4. Zone in die Knochenkompakta einstrahlt 303_1: EPI.X+Pferd.Z.7781#532136036730317. Die 3. Zone enthält mineralisierten Faserknorpel Calcium=20: EPI.X+Pferd.Z.7782#532067656360652. Die Grenzschicht (Tidemark) zur nicht mineralisierten Zone enthält sowohl Calcium=20 als auch Eisen=26 wie Blut. EPI.X+Pferd.Z.7785#531862620654926. Die 2. Zone enthält einen nicht mineralisierten Faserknorpel, der durch Knorpel 22 und nachfolgend mit Blut wie Eisen=26 symbolisiert wird: EPI.X+Pferd.Z.7791#531453022949377 und EPI.X+Pferd.Z.7792#531384817992633. In der 1. Zone durchziehen Kollagenfasern 111_313 das verdichtete Gewebe 3_3: EPI.X+Pferd.Z.7796#531112173139892. Die arterielle 9 Blutversorgung der Sohlenlederhaut 33 ist aufgrund der diversen Äste zunächst nur global als Struktur 3_55_3 und als Netzwerk 44 ringförmig „0“ enthalten, wobei die seitliche 9 Ringarterie als paarig 2_9 enthalten ist: EPI.X+Pferd.Z.7820#529482161355319 und EPI.X+Pferd.Z.7820#529414461296330. Unmittelbar vor der Basalmembran sind Arterien 9 und Venen 8 enthalten, um die dann folgende Sohlenepidermis zu ernähren: EPI.X+Pferd.Z.7832#528670901659678 und EPI.X+Pferd.Z.7833#528603408885305. Die 3-schichtige Basalmembran 33_3 ist doppelt vorhanden, so dass daraus die Ober- und Unterkante einer gewellte Form entsteht, um die Lederhautpapillen (Zotten) zu umhüllen. Die beiden Zwischenzeilen adressieren die Lederhautpapillen mit Gefäßen 8/9 und Nerven 7: EPI.X+Pferd.Z.7834#528535933341664; EPI.X+Pferd.Z.7835#528468475022156 EPI.X+Pferd.Z.7836#528401033920188; EPI.X+Pferd.Z.7837#528333610029169. Mit 9_16_9 wird darin mit 9=unten und Schwefel=16 die Entwicklung von Hornschichten avisiert, wobei mit „100“ der Ansatz für den Markkanal angelegt wird. Der Basalmembran folgt die Epidermis mit der Keimschicht 33, wobei die Hornbildung mit der Quersumme QS 2+6+6+2=16 avisiert wird: EPI.X+Pferd.Z.7838#528266203342510. Die Bestandteile des Sohlenhorns werden als Gruppe 44 vereinigt, die als Struktur 555 aus dem vom Zwischenröhrenhorn umhüllten Röhrenhorn besteht, wobei das herunter geschobene Horn als Quersumme QS 9+4+3=16 avisiert wird: EPI.X+Pferd.Z.7840#528131441555943. Als Einzelheit wird die Röhrenhorngruppe 44 gebildet, die mit 28_28 eine Dopplung für die periphere Rinde enthält und das zentrale Röhrchenmark als Form 77 zu suchen ist. Das Horn ist als Quersumme QS 6+4+4+2=16 markiert. EPI.X+Pferd.Z.7841#528064086442877. Mit „64“ feiert die Biologie den Sieg über die Physik, weil es gelungen ist, die gewaltige Körpermasse vom Zeh tragen zu lassen - nur Fliegen ist schöner. Die seitliche Einrahmung 80_08 bildet ebenfalls das harte Horn als QS=16: EPI.X+Pferd.Z.7841#528064086442877. Die Lederhautpapille ist an der Spitze ausgerundet, so dass sich das zentrale Röhrchenmark als Gegenform anfänglich in Trichterform bilden muss. Der Trichter entsteht als paarige 2 Diagonale, weil die kleine Formgröße 77 von links nach rechts gewandert. Das harte Horn Schwefel=16 wird direkt markiert. Die Lederhautpapillen ragen über kurze Distanz in den Markraum hinein: EPI.X+Pferd.Z.7846#527727568416849.
Das Röhrchenmark enthält eine locker geschichtete Masse aus nicht vollständig verhornten Zellen sowie deren Zerfallsmassen. Über die weitere Strecke ist der Markkanal dann durch Austrocknung hohl. Wie entsteht der Zelltod? Die Zeit=60 ist direkt ablesbar. Die Quersumme QS 5+2+7+6+6=26 adressiert mit Eisen=26 das Blut und schaltet mit „Null“ die Blutversorgung aus. Schwefel=16 ist als Horn direkt enthalten und wird indirekt als Quersumme QS 1+6+2+7=16 markiert: EPI.X+Pferd.Z.7847#527660316273556.
Dem peripheren Rand der Lederhautpapille folgt in der Epidermis die Basalzellschicht (Stratum basale) 33 zur Bildung der Röhrchenrinde: EPI.X+Pferd.Z.7849#527525863396432. Bis zur Hornzellschicht (Stratum corneum) müssten weitere Schichten abgegrenzt werden: Stachelzellschicht (Stratum spinosum), Körnerschicht (Stratum granulosum) und ggf. die Glanzzellschicht (Stratum lucidum). Das Röhrchenhorn zeigt sich als Gruppe 444 des Stratum corneum aus dem zentralen Röhrchenmarkkanal 100, der inneren Rindenschicht 33, der mittleren Rindenschicht 33 und der äußeren Rindenschicht 33, sofern man in der Rinde unterschiedlich ausgerichtete Hornzelltypen erkennt, deren Form informativ vom bekannten Kronhorn informativ übernommen wird: EPI.X+Pferd.Z.7867#526318863836100; EPI.X+Pferd.Z.7868#52625197023368 (spindelförmige Rindenzellen quer zur Röhrchenlängsachse); EPI.X+Pferd.Z.7869#526185093633066 (polygonale Rindenzelle zirkulär um das Mark); EPI.X+Pferd.Z.7871#526051391411332 (längliche Rindenzellen zwiebelschalenartig um das Mark herum gewickelt).
Jedes Lederhautzöttchen (Papille) passt in eine epidermale Vertiefung der Sohlenepidermis. Das Zwischenröhrchenhorn geht aus dem Bereich zwischen den hervorstehenden Lederhautzöttchen (Papillen) und der gewellten Basalmembran hervor und bettet somit das Röhrchenhorn ein. Geeignet ist dafür eine Gruppe 44, in der die Ziffer 2 eine Strukturverbindung 5_2_5 symbolisiert: EPI.X+Pferd.Z.7882#525317242044988 und EPI.X+Pferd.Z.7883#525250602790637. Diese Kopplungsfunktion muss dann noch einer Haut-Formation zugewiesen werden, die das harte Horn als Schwefel=16 und die Zeit mit 24 Stunden für das Hornwachstum enthält: EPI.X+Pferd.Z.7899#524186669426332 EPI.X+Pferd.Z.7900#524120316683366. Die Pigmentierung der Sohle mittels eines allgemeinen Farbstoffs 88 häuft sich in den weiteren Zeilen ab EPI.X+Pferd.Z.7905#523788804781606. Das harte Horn „16“ ist mit dem weichen Horn „606“ kombiniert.
Hufbeinstütze:
Das Körpergewicht wird nur teilweise von der Sohle getragen. Vielmehr hängt das Hufbein an Fasern, die die Last als Schrägzug zum oberen Rand des Hornschuhs umlenken. Als Druckkraft fließt die Last dann über die äußere Hornwand nach unten zum Tragrand ab. Beim Krankheitbild der Hufehe (Laminitis) ist die Lederhaut entzündet, was zur Ablösung der Hufkapsel von der Lederhaut führt. Die elastische Aufhängung des Hufbeins wird getrennt, so dass eine Hufbeinrotation / Hufbeinsenkung entsteht. Die Lederhaut wird nicht von einer Unterhaut (Subcutis) abgepolstert, sondern ist mit einer Knorpelschicht um das Hufbein in Kontakt. Weil der Kraftfluss nach oben gerichtet ist, muss gegen der Zeilenlauf unten am Hufbein 225 begonnen werden, wobei die Einstrahlung der Fasern 1 strukturell vorhanden ist 5_1_5. Mit 22_2 kann die überschüssige 2 die 2 mm Verankerungstiefe und die 44 die „4- zonale (chondral-apophysäre) Insertion“ darstellen, wie sie auch bei der Verankerung von Sehnen und Bändern vorliegt. Die tiefe 4. Zone stahlt in die Knochen-Kompakta ein: EPI.X+Pferd.Z.8025#515956448822255. Die 3. Zone enthält einen mineralisierten Faserknorpel, der mit der Ziffer 4 für vier Zonen und der 20=Calcium adressiert ist. Die Faser 11 ist als Quersumme 3+4+0+4=11 nach der Form 7__7 enthalten: EPI.X+Pferd.Z.8024#516020750473404. Zwischen der 2. und 3. Zone liegt eine dünne Mineralisierungsgrenze (Tidemark). Die angrenzenden beiden Schichten adressieren die Grenze als Zahlenspiegelung 681_186, die als Haut 3 entsteht: EPI.X+Pferd.Z.8023#516085068153882 und EPI.X+Pferd.Z.8022#516149401869683. Die 2. Zone enthält einen nicht mineralisierten Faserknorpel. Analog zur Luftröhre wird der Knorpel normal als 22 adressiert. Die 22 folgt erst in der nächsten Zeilennummer und ist zunächst mit der Ziffer 2 in der Dopplung 1_62_1 / 1_62_26 enthalten. Die Ziffer 6 ist flexibel und somit keine starre Mineralisierung, was nochmals mit 26=Eisen wie Blut adressiert ist. EPI.X+Pferd.Z.8021#516213751626804. In der 1. Zone durchziehen die Kollagenfasern 11 das verdichtete Gewebe (vergleichsweise bei Sehnen das dichte Sehnengewebe): EPI.X+Pferd.Z.8020#516278117431246. Die 2-schichtige Lederhaut (Dermis) grenzt mit der Zapfenschicht (Stratum papillare) an die Epidermis. Als tiefe Schicht 99 wird zunächst die bindegewebige 3 Netzschicht (Stratum reticulare) gebildet, die Kollagenfasern 1 enthält: EPI.X+Pferd.Z.8019#516342499289013. Die Hufbeinstütze ist im Zeilenlauf als diagonal gespanntes Faserbündel 111 erkennbar: EPI.X+Pferd.Z.8018#516406897206111 und EPI.X+Pferd.Z.8018#516471311188549. Das Faserbündel zieht sich über einen weiten Bereich schräg nach oben bis EPI.X+Pferd.Z.7977#519061113425924.
Die Zapfenschicht (Stratum papillare) der Lederhaut bildet generell zapfenförmige Ausstülpungen, die sich an der Basalmembran vom Stratum basale der Epidermis abgrenzen. Das Stratum papillare enthält spezielle Strukturen:
1.) Kapilläre Gefäßschlingen: Gefäße 00 mit Vene 8 und Arterie 9 als räumliche Schlinge 666_464: EPI.X+Pferd.Z.8015#516600187373499 und EPI.X+Pferd.Z.8014#516664649588045.
2.) Makrophagen 2000: Die Zellen entwickeln sich aus im Blut zirkulierenden Monozyten. Deren Halbwertzeit von 72 Stunden ist enthalten, mit dem Verfall als „Zeitspiegelung“ 27: EPI.X+Pferd.Z.8013#516729127892000.
3.) Thermosensoren an freien Nervenenden: Nerv 7 (Ende 9) zur Überwachung von 36° C (unter 36,5° unakzeptabel): EPI.X+Pferd.Z.8012#516793622291387.
4.) Mastzellen: Die Mastzelle gehört als Blutzelle zu den Leukozyten, die im Knochenmark heranreift. Die 26= Eisen wie Blut ist enthalten. Eine Vielzahl von Einschlüsse im Zytoplasma sind Körnchen (Granula) 400 von runder Form 7: EPI.X+Pferd.Z.8010#516922659400574
5.) Nozizeptoren an freien Nervenenden zur Schmerzwahrnehmung. Der Schmerz ist als Weiterleitung im Nerv 7 über die Struktur 5 als 17__17 adressiert: EPI.X+Pferd.Z.8009#516987202122437 und EPI.X+Pferd.Z.8008#51705176096386, wobei nach 6_6 nochmals mit QS 3+8+6= 17 enthalten ist, um einen akuten Schmerz auszulösen.
6.) Drucksensor: Beim Menschen sind Druckrezeptoren (Mechanorezeptoren) als Meissner-Körperchen in der Leistenhaut zur Vermittlung des Tastsinns u.a. in Fußsohlen und Zehenspitzen vorhanden. Sie müssen somit auch beim Huf vorhanden sein. Die Meissner-Körperchen sind als Extra 3_0_88 sind nach außen durch eine Bindegewebskapseln 33_5 mit Kollagenfasern 11 abgegrenzt 9: EPI.X+Pferd.Z.8007#517116335930885.
Es werden Wandlederhaut-Lamellen (weiche Blättchen / Lederhautblättchen) [Lamellae dermales] gebildet, in die als Gegenstück die Epidermis kammartig eingreift, um den Verbund durch Hornlamellen an einer großen Oberfläche zu sichern. Auf dem First der Lederhaut-Lamellen (äußeres apikales Lamellenende zur Annäherung an das Kronenhorn) sitzen Zöttchen (Kappenpapillen) über denen sich das Kappenhorn bildet. Am distalen Ende der Lederhaut-Lamellen bilden sich zur Sohle ausgerichtete Terminalpapillen zur Bildung der „Weißen Linie“.
Achtung: In der Fachliteratur werden die sekundären Epidermisblättchen teilweise als „sekundäre Lederhautblättchen“ bezeichnet. Diese Meinung kann aufgrund der Lage der Basalmembran hier nicht bestätigt werden, zumal Gefäße nur in der Lederhaut enthalten sind. Die uneinheitliche Darstellung der kammartigen Verbindung könnte daraus resultieren, dass beim jungen Pferd (bis 2 Jahre) die Verhornung der primären Epidermisblättchen noch nicht abgeschlossen ist, so dass die Sekundärblättchen fälschlich als Bestandteil der Lederhaut erscheinen. Zwischen den sekundären Epidermisblättchen ist zwangsläufig ein Spalt vorhanden, der wegen seiner konjugierten Form als „sekundäres Lederhautblättchen“ bezeichnet werden kann. Das erschwert aber die Betrachtung, wenn man die Lederhaut vorzugsweise als „Lamellen“ und die Epidermis als „Blättchen“ unterscheiden will.
Die Lederhaut-Lamellen entstehen als Struktur 55 über 2 Zeilen mit 809_908. Darin ist QS 8+0+9= 17 eine Form 7 als Zählgröße 1. Um einen Zusammenhang zur Wandlederhaut zu erkennen, wird noch eine Zählgröße 1 als Referenzzeile benötigt, die exakt 600 primäre Wandlederhaut-Lamellen abzählt. Wird die Zeitdifferenz beider Zeilen zur Referenzzeile gebildet, erscheint jeweils auch die 33. Die versteckte „33“ weist auf stete Veränderungen in der Zeit über 24 Stunden hin: EPI.X+Pferd.Z.8006#517180927029552 und EPI.X+Pferd.Z.8005#517245534265908. Referenzzeile: EPI.X+Pferd.Z.8004#517310157646001 [Zeitdifferenz: 193870146331 bzw. 64623380093].
Das Krankheitsbild der Hufehe (Laminitis) wird u.a. auf eine mangelnde Blutversorgung der Lederhaut zurückgeführt, weil die Arterien in den Lederhautlamellen direkt mit Venen verbunden sind, so dass die Blutkapillaren der Lederhaut ggf. nicht mehr ausreichend mit Blut versorgt werden. Mit dem Gefäß „0“ ist dieses in Zeile 8006 mit #809 zu Zeile 8005 mit „#908“ als Direktverbindung enthalten. Die Kurzschlussverbindung (arteriovenöse Anastomose) zwischen der Arteriole 9 und der Venole 8 wird zur Durchblutungsregulation geöffnet und geschlossen.
Die Lederhaut-Lamellen enthalten Blutkapillaren als Netzwerk 444_9 um die Epidermis zu versorgen. Arterie 9 und Vene 8 sind enthalten, wobei das Blut statt 26 als Kehrwert 62 zu lesen ist: EPI.X+Pferd.Z.7992#518086899624449. Der Lamellen-Bereich enthält die Haut 33 bis EPI.X+Pferd.Z.7991#518151733424927. Zur Verankerung in der Basalmembran entstehen feine Bindegewebsfasern 1 als Form 7 und Fasergruppe 44: EPI.X+Pferd.Z.7989#518281449718187. Die Basalmembran erscheint nicht als Grenzschicht „333“, sondern als gewellte Verbindungsschicht 33_222. Zunächst ist nur die Lederhaut durch feine Bindegewebsfasern 1 in der Haut 3_1_5 verankert. Die rückseitige Verankerung der Epidermis ist als Quersumme 5+1+8+3+4+6+3+3=33 enthalten. Der Rest bildet die Zeit ab: QS 2+2+2+3+1+5+9= 24 Stunden. Basalmembran als dermo-epidermale Verbindung: EPI.X+Pferd.Z.7988#518346332223159. Die Basalzellen der Epidermis (Stratum basale) haften fest auf der Basalmembran und sind kernhaltig mit dem Kern 1 als Zählgröße 11. Eine Zellteilung von 515 auf fiktive 51-15 ergibt als Quersumme 6_6. Die Quersumme QS= 61 hat den Kern 1 als Überschuss zu 60: EPI.X+Pferd.Z.7987#518411230975159. Die Basalzellen teilen sich zu Spinosazellen (Stratum spinosum) mit der Teilung 60_60: EPI.X+Pferd.Z.7984#518606024774373.
Im Stratum spinosum wird Interzellularkitt gebildet und über den Interzellularspalt 00 ausgeschleust, der für den Zusammenhalt der Hornzellen benötigt wird. Der lichtmikroskopisch unsichtbare Interzellularspalt wird erst beim Anfärben der enthaltenen Glycoproteine sichtbar. Der Interzellularkitt kann als allgemeiner Wirkstoff 88 (analog Melanin) erkannt werden, so dass sich das Ausschleusen über 3 Zeilen vollzieht. Die Ziffer 9 für „außen“ wechselt die Seitenlage zum Wirkstoff „88“ und die mittlere Zeile ist wegen der Baumstruktur des Proteins als 965_596 integriert. Als strukturbildend wird Stickstoff 7 adressiert 5_7_5: EPI.X+Pferd.Z.7983#518670988575547; EPI.X+Pferd.Z.7982#518735968654297; EPI.X+Pferd.Z.7981#518800965016739.
Als kammartiges Gegenstück der 600 Wandlederhautlamellen sind entsprechend auch 600 Primärblättchen der Oberhaut (Epidermis) vorhanden. Auf jedem Primärblättchen sitzen hinter der Basalmembran jeweils 100 Sekundärblättchen: EPI.X+Pferd.Z.7979#518931006617195. An der Grenze der Sekundärblättchen zum Primärblättchen beginnt die Verhornung. Die vorgenannte Teilung 6060 ist als abgestorben in einer Trennung 60_60 zu deuten. Die Quersumme ohne 60 ergibt QS=5+1+8+9+9+5+1+8+6+7+4=63. Die 63 ist die physikalische Basiszahl im Gegensatz zu einer lebenden „64“ der Biologie. Verhornung: EPI.X+Pferd.Z.7978#518996051867460. Die obere Verankerung der Faserbündel 111 am Hornschuh als Hufbeinstütze wurde bereits erwähnt: EPI.X+Pferd.Z.7977.#519061113425924. Jedes primäre Epidermisblättchen spaltet sich (Spalt=1) an seinem basalen Ende (Ende=9) in zwei Gabelblättchen, so dass eine Dopplung 19_19 als Form 7 vorhanden ist: EPI.X+Pferd.Z.7975.#519191285491987. Das Gleithorn 6666 zeigt sich als flexible 6 Verschiebung: EPI.X+Pferd.Z.7972.#519386666056020 und EPI.X+Pferd.Z.7966.#519777868666658.
Weiße Linie (Zona alba)
Die Hufbeinstütze entwickelt sich wie die behaarte Haut, indem der Zeilenlauf mit der Epidermis beginnt und in der Tiefe zur Lederhaut fortschreitet. Die Wandlederhaut ist am Hufbein befestigt. Direkt unter dem Hufbein muss die Lederhaut ein geometrisches Modell finden, um das Wandsegment mit einer epidermalen Sohle als Terminalhorn zwischen Kron- und Sohlenhorn als Oberfläche abzuschließen. Dieses epidermale Terminalhorn liegt im Zeilenlauf somit umgekehrt hinten. Die Höhe des Hufes von ca. 80 mm resultiert aus der Dauer des Zeilenlaufs bis ein geometrisches Modell als Terminalhorn evolutionär verwertbar ist. Diese Konstruktion entsteht über eine Höhe von 20 mm und zeichnet sich neben dem Tragrand als sogenannte „Weiße Linie“ (Linea alba unguis / Zona alba) ab. Die hellen, gelb-braunen, radiären Streifen werden aus dem herunterwachsenden Blättchenhorn des Wandsegments gebildet. Der dunkle Zwischenstreifen resultiert aus dem speziellen geometrischen Modell des Terminalhorns und enthält eine Röhrenstruktur. Die „Weiße Linie“ ist nicht weiß gefärbt! Vielmehr erscheint die benachbarte unpigmentierte innere Schicht „Water Line“ des Kronhorns als helle Line.
Beim Warten auf das geeignete Modell zum Sohlenübergang muss aus den durchlaufenden Zeilen etwas produziert werden, so dass sich das Kappenhorn (Galea cornealis) in der weißen Linie am Rand zum Kronhorn bildet. In der weißen Linie kann ein äußerer Abschnitt mit dem Kappenhorn und ein inneren Abschnitt mit den Hornblättchen und den Terminalhornröhrchen unterschieden werden. Weil alle 3 Bestandteile der weißen Linie unpigmentiert sind jedoch die beiden Bezeichnungen „Pars nonpigmentosa“ und Pars „lamellata“ ungeeignet.
Das Kappenhorn wird von den sekundären Epidermisblättchen über den zur äußeren Wandseite gerichteten First der Lederhautlamellen (primäre Lederhautblättchen) gebildet. Dieses wird offenbar mysteriös durch seitliche Kappenpapillen in der Lederhaut angeregt. Zur Sohle hin bildet die Lederhaut Terminalpapillen aus. Das Kappenhorn zeichnet sich in hier bekannten Abbildungen des Kappenhorns als eine punktierte Linie ab, die als Querschnitt durch einzelne, dünne Kappenhornröhrchen (Tubuli corneales parietis accessorii) entsteht. Das eigentliche schalenartige, bogenförmige Kappenhorn, die sogenannten Kappenhornarkaden, wurde hier in Abbildungen noch nicht entdeckt. Das Kappenhorn bildet sich verstärkt sich als eine Schicht, wenn es im Krankheitsbild der Hufehe sich Oberhautblättchen und Lederhautlamellen verlängern und gekrümmt winden. Weil sich dabei die Kappenhornröhrchen bis zu 10 Stück stapeln, kann das Kappenhorn als Zählvorgang „11“ erkannt werden. Das harte Wandhorn kann als Schwefel=16 im enthaltenen Cystein (C3H7NO2S / schwefelhaltige proteinogene Aminosäure) gesucht werden. Vergleichsweise enthält das weiche Sohlen- und Ballenhorn das Tyrosin (C9H11NO3). Mit dem enthaltenen 6-eckigen Benzolring und Kohlenstoff=6 ist „606“ als Suchgröße geeignet.
Die Kappenhornarkaden werden als Bögen 000__5 adressiert, wobei mit den Quersummen QS 5+1+2+0+0+0+8=16 der Schwefel sowie QS 3+9+8+1+5+2+5= 33 die Haut enthalten sind: EPI.X+Pferd.Z.8087.#512000803981525. Die Kappenhornröhrchen werden als räumliche Gruppe 444_16_4 avisiert, deren Verhornung als Schwefel=16 enthalten ist. Die Serie #5_11 kann mehrere Kappenhornröhrchen in der Nähe einer Kappenhornpapille ausbilden: EPI.X+Pferd.Z.8092.#511684441645897. Es kann normalerweise aber nur das 1. von 10 Kappenhornröhrchen entstehen, weil dort Schwefel=16 enthalten ist. Nicht unter jedem Bogen einer Kappenhornarkade ist ein Kappenhornröhrchen zu finden, denn 878 ist eine Extra-Form: EPI.X+Pferd.Z.8093.#511621216087804. Das 9. Kappenhornröhrchen: EPI.X+Pferd.Z.8101.#511115973558646. Das 10. Kappenhornröhrchen: EPI.X+Pferd.Z.8102.# 511052888397753.
Die primären Epidermisblättchen werden als Spiegelbild des darüberliegenden Hufbeinträgers zum Tragrand heruntergeschoben. Das primäre Blättchenhorn im inneren Abschnitt der weißen Linie wird nicht mehr von den sekundären Epidermisblättchen begleitet. Diese umhüllen weiterhin die sich nach unten zu Terminalzotten verändernde Lederhaut bzw. wird ersatzweise eine spezielle epidermale Keimschicht gebildet. Zwischen Epidermis und Lederhaut liegt die Basalmembran 5_333, die in die Veränderungen einbezogen wird. Im Prinzip geht es darum, dass sich an jeder Lederhautlamelle am sohlnahen, freien Rand etwa 14 Terminalpapillen ausbilden. Die Zahl 14 ist als Quersumme QS 5+3+3+3=14 eingeprägt. Als Mittelwert wurden wissenschaftlich 13,6 Zotten ermittelt, alternativ werden in der Literatur ca. 15 Zotten genannt: EPI.X+Pferd.Z.8111.#510485821945333. Das Blättchenhorn kann als weicher Horntyp „606“ erkannt werden: EPI.X+Pferd.Z.8125.#509606215605981 und EPI.X+Pferd.Z.8128.#509418122760654.
Bevor am Ende das Terminalhorn entsteht, wird zunächst der Blick von der Zellebene auf die globale Gesamtform der weißen Linie mit dem markanten Zeilenlauf „505“ über 17 Zeilen gerichtet. Die weiße Linie „0“ zieht sich dabei in „505“ als Verbindung von Hufplatte und Sohlenhorn durch. Sohlenform: Am hinteren Strukturende 5_99 wird für die Eckstreben an den Trachten ein Öffnungswinkel von 270° markiert durch seitliche Nullen 0_270_0: EPI.X+Pferd.Z.8183.#505994195502700. Die Länge der Eckstrebe ergibt sich aus der Verschiebung der Ziffer 9 an das Ende=9 in der Ziffernfolge 496 zu 469 als Form 7. Die Eckstreben sind paarig 2 angeordnet 3_2_3: EPI.X+Pferd.Z.8183.#505932368254960 und EPI.X+Pferd.Z.8184.#505746977134310. Der Mittelpunkt der Hufsohle ist als „0-Punkt“ markant vorhanden: EPI.X+Pferd.Z.8183.#505500000219582. An der Hufspitze werden die Lamellen der Haut 33 als Form 7 mit 505_00 als Parallele in Bezug auf den Nullpunkt adressiert. An den Hufseiten krümmen sich die Lamellen dagegen, um sich zum Hufmittelpunkt auszurichten. EPI.X+Pferd.Z.8199.#505006769337553.
Der Zeilenlauf EPI.X+Pferd für den Huf muss sich über den gleichen Zeilenbereich wie die Bildung der Pferdehaut in EPI.Y+Pferd erstrecken, so dass für das Terminalhorn nur noch wenige Zeilen verbleiben. Die 14 Terminalpapillen „5_14_5“ sind auf der Lamelle als Punktreihe 000 angeordnet, die sich zu eine Anzahl von Trichtern jeweils nach unten verengen.
EPI.X+Pferd.Z.8207.#504514500036383. Die Terminalpapillen müssen nunmehr von epidermalen Keimschicht 33 ringförmig 33_0 umschlossen werden, aus denen die verhornten Terminalröhrchen entstehen und distal zur Sohle geschoben werden. Die Anzahl von 14 Trichtern ist enthalten: EPI.X+Pferd.Z.8208.#504453033844858 und EPI.X+Pferd.Z.8210.#504330146382289. Der Papillen-Trichter bildet sich über 8 Zeilen als eine diagonale Verschiebung der Formlinie 777, die als paarig 2 gespiegelt wird, und zwar von EPI.X+Pferd.Z.8212.#504207318777228 bis EPI.X+Pferd.Z.8212.#503777892906509 mit 9 als Ende. Am Trichterende bildet sich jeweils 1 Terminalröhrchen 606 mit Schwefel=16 als Horn: EPI.X+Pferd.Z.8220.#503716606058223. Zwischen den Terminalhorn-Röhrchen entsteht das raumfüllende Zwischenblättchenhorn 33, um die Terminalröhrchen in eine Reihe zu integrieren. Das Zwischenblättchenhorn bildet die dunklen Streifen in der weißen Linie alternierend zu den gelb-braunen Streifen des Blättchenhorns: EPI.X+Pferd.Z.8221.#50365533411976. Das Zwischenblättchenhorn ist als ausfüllende Form 77 zwischen 2 Röhren als Null enthalten: EPI.X+Pferd.Z.8222.#503594077085696. Die Terminalröhrchen enthalten jeweils einen Markkanal 505 in der Mittelachse: EPI.X+Pferd.Z.8223.#503532834950577. Zum Abschluss der Bildung des Terminalhorns wird nochmals die Anzahl 14 und QS 6+7+1=14 als Ende=9 markiert: EPI.X+Pferd.Z.8230.#503104556719149.
Die Hufwand wächst vom Kronrand zum Tragrand herunter. Ab der Skelettbildung für das Kronbein wird nach der behaarten Haut ein Zeilencode für die Hufausbildung benötigt. Hierfür sind Zeilensprünge möglich. Im Bereich des hinteren Kronbeins EPI.X+Pferd.Z.2776.#149155277442313 wird beispielsweise die Zeilennummer 7744 als Verweis und Haut-Zählgröße 3_1_3 zur Kronwulst markiert. Im Bereich des vorderen Kronbeins EPI.X+Pferd.Z.1095.#378132465917680 wird beispielsweise frühzeitig die Zeilennummer 7680 genannt. Die Hufausbildung endet in Zeile 8242. Dieser Bezug liegt im Bereich des hinteren Fesselbeins vor: EPI.X+Pferd.Z.2571.#161048249778242. Abschließend wird in 2 Zeilen mit der Zeit=24 das tägliche Hornwachstum als Ersatz für das beim Auffußen (Sohlkontakt) abgenutzte Horn adressiert. Mit Außen=9 und Haut=3 wird die weiße Linie 5_0 einerseits vom Kronhorn 9_3 und andererseits vom Sohlhorn 9_3 begrenzt. Das äußere Saumhorn verwittert und reicht selten bis zum Tragrand herunter. Das Saumhorn ist als Quersumme QS 7+2=9 plus 3 als 9_3 indirekt mit enthalten: EPI.X+Pferd.Z.8240.#502493992936723. Die weiße Linie 33 kann auch als Haut 3 mit den 3 Hornanteilen (Kappenhorn, Zwischenblättchenhorn und Blättchenhorn) adressiert werden: EPI.X+Pferd.Z.8241.# 50243301805589. Die weiße Linie 50_QS 2+3+7+2=14_05 wird weiterhin mit der Anzahl 14 der Terminalröhrchen im Streifen 11 des Zwischenblättchens als Ende=9 symbolisiert. EPI.X+Pferd.Z.8242.# 502372057971196. Der nachfolgende Zeilenbereich wird anderweitig verwendet.
Summary [dat 14.10.2021]: Der Pferderennenpokal könnte mit der „64“ geschmückt sein, um die Biologie in 2 Episoden zu jeweils „32“ zu feiern, weil die Quersumme QS = 2 + 3 = 5 den Goldenen Schnitt symbolisiert. Die beiden Episoden beruhen auf der „Quadratur des Kreises nach BiXnom“, die sich auf einen Halbkreis bezieht. Die Biologie kann paarige, spiegelbildliche Strukturen ausbilden, so dass 2 Episoden ausreichen, um einen Vollkreis als Ganzheit eines Individuums zu füllen.
Die Triebkraft der Würfelkunde wird mit dem Huf in Epi.X+Pferd als Bewegungsorgan veranschaulicht, weil die Haut in Epi.Y+Pferd als Gegenspieler im Fettgewebe Materie speichert, womit diese Episode massenträge zeitlich nachläuft. Werden beiden Halbwahrheiten der Philosophie zur „Negation der Negation“ als Veränderungselement durch die Grundgesetze der Chemie ergänzt, wird im 10. Satz als ewiger Kreislauf wieder auf die Triebkraft verwiesen, so dass jedes Teilchen mit jedem in Beziehung steht. Im Prinzip „will“ sich der Materiestrom ohne Materie bewegen. Um als solcher Strom zu gelten, muss er Materie enthalten. Statt ein unlösbares Henne-Ei-Problem aufzutischen, wurde 1987 mit dem Erkenntniswürfel „BiXnom“ die Triebkraft der Würfelkunde erfunden.
Vergleichbar zum Halbkreis bei der „Quadratur des Kreises nach BiXnom“ kennt die Bodenmechanik bei der Berechnung der „Relativen Ruhe“ den sogenannten „bodenmechanischen Halbraum“, bei dem ein Erdkörper aus der Erdoberfläche ideel herausgeschnitten wird. Die „Relative Ruhe“ liefert den Erdruhedruckbeiwert als Faktor k für den Reibungsanteil im Horizontaldruck in Bezug den gravimetrisch bedingten und bekannten Vertikaldruck. Wasser ist näherungsweise reibungsfrei, so dass bei allseitig gleichem Druck k=1 gilt. Für die relative Ruhe an der massiven Kellerwand ergeben die diversen bekannten Berechnungsformeln für Sand z.B. mit k = sin (Reibungswinkel 30°) = 0,5. Das Schubverhältnis 1:4 ist beim Goldenen Schnitt übereinstimmend am Rechteckblock als auch am Kreis zu finden.
Als Episode X-Erde wird die „Relative Ruhe nach BiXnom“ ideel an einem Erdblock ermittelt, der wie beim Goldwaschen in der Schüssel mit einer Sohlreibung bewegt wird. Die relative Ruhe ist der Durchgang durch die Blockmitte: k (EPI X)= 1 - [(2*b) / (a + b)²] mit a= 1 und b= sin (Phi); Phi ist hier nicht der Goldene Schnitt, sondern der Reibungswinkel des Erdstoffs. Mit Phi= 30°, a= 1 und b= sin (Phi) = 0,5 folgt k= 1-[2*0,5/ (1+0,5)²] = 1- [1/2,25]= 0,555555.
In anderer Schreibweise ergibt sich als Bezug auf den aktiven Erddruckbeiwert für eine biegsame Wand k_aktiv= tan² (45°- (Phi/2)) der Erddruckbeiwert für die relative Ruhe k (EPI X) = k_aktiv *[1+2* tan² (Phi)].
Der horizontale Erdruhedruck p= Erdruhedruckbeiwert k * (Druckhöhe * Wichte) ist wegen k > 0,5 sicher, aber unwirtschaftlich hoch. Durch eine Episode Y-Erde wird nunmehr nachgebessert: Die Einführung einer Masse als eine unbiegsame Wand wird ideel eingefügt, indem mittig eine Blocktrennwand auf der Blocksohle aufsetzt, wodurch die Hälfte der Sohlreibung an der Wirkung beim Goldwaschen verhindert wird. Diese „Halbierung“ einer Wirkung ist mit dem Unterschied von BiXnom-Signalkugel und BiXnom-Steuerkugel vergleichbar, durch den sich die Leitepisode X und die Parallelepisode Y unterscheiden: Erddruckbeiwert für die relative Ruhe k (EPI Y) = k_aktiv *[1+1,5* tan² (Phi)], wobei k_aktiv den aktiven Erddruckbeiwert für eine biegsame Wand enthält k_aktiv= tan² (45°- (Phi/2)). Für Phi=30° folgt k_aktiv=tan² (45-15=tan²(30°)=0,3333. Daraus folgt k (EPI Y) = 0,3333...* [1+1,5*tan²(30°)]=0,3333...*1,5= 0,5.
Somit besteht bei Sand mit Phi=30° eine Übereinstimmung zur üblichen Formel „Erdruhedruckbeiwert der relativen Ruhe k = 1- sin (Phi)“.
Die klassische Erddrucktheorie (1776) geht u.a. auf Charles Augustin de Coulomb zurück. Die Kraftwirkung auf eine Wand ist dabei von der Relativbewegung der Wand abhängig. Bei der relativen Ruhe gibt es keine Wandbewegung, so dass im Erdstoff keine Scherkräfte entstehen. Der Begriff der „Relativen Ruhe“ wird von Rankine verwendet [RANKINE: On the stability of losse earth. Phil. Trans. roy. Soc. Lond. 1857]: „Die Kraft ist eine Wirkung zweier Körper, die eine Änderung ihrer relativen Ruhe oder Bewegung verursacht oder zu verursachen strebt.“ [zitiert in: John Bernhard Stallo: Die Begriffe und Theorien der modernen Physik - Seite 172].
BiXnom_Pferde_dat30.06.2021
Paarhufer
Paarhufer / Paarzeher (Artiodactyla) sind eine Ordnung der Säugetiere (Mammalia). Hierzu gehören Rinder, Schweine, Schafe, Hirsche, Giraffen etc. Einige Vertreter dieser Gruppe, wie beispielsweise die Flusspferde, sind eher mit den Walen verwandt. Die Paarhufer werden in 4 Unterordnungen eingeteilt: 1.) Schweineartige (Suina) bzw. Nichtwiederkäuer (Nonruminantia), 2.) Flusspferde, 3.) Kamele, 4.) Wiederkäuer (Ruminantia).
Die Artenvielfalt wird durch den freien Fall der BiXnom-Kugel beschrieben, der bisher Lösungen in den 5 Fallebenen zuzüglich der jeweiligen Ober- und Untergrenze liefert. Um die Paarhufer in der Nähe der Pferde zu suchen, wird eine mathematisch fixierte Abstandsgröße benötigt. Diesbezüglich wird die BiXnom-Biokugel als Lösung vermutet, die beim Goldenen Schnitt entsteht. Hier wurde bereits festgestellt, dass bei jeder punktuellen Kugelberührung die Bedingungen für einen Goldenen Schnitt vorliegen. Dies ist bei einer statischen Betrachtung unrealistisch, weil ein Punkt keine teilbare Strecke ist. Bei einer dynamischen Betrachtung mit der relativen Ruhe nach Bixnom als ein Durchlaufvorgang ist ein Realbezug vorhanden, weil mit der Bixnom-Schwelle der Goldene Schnitt bereits vor dem Kugelkontakt wirkt bzw. auch nach der Kontaktverformung vorliegt. Der BiXnom-Würfel zeigt diesen Durchlauf mit der Plusseite, der neutralen Mittlachse und der Minusseite. Im Prinzip muss nunmehr aus der BiXnom-Schwelle die zugeordnete Größe der BiXnom-Biokugel ermittelt werden.
Die Funktion der BiXnom-Biokugel ließe sich somit bestätigen, wenn sich damit als Abweichung vom Pferd die Rinder (Bovini) als Paarhufer finden ließen. Die Rinder sind eine Gattungsgruppe der Hornträger (Bovidae), zu der das Hausrind als Nutztier gehört. Einige Rinderarten werden als Büffel bezeichnet. Der Auerochse (Bos primigenius) ist eine seit 1627 ausgerottete Wildform der Rinder.
Die Differenz = Major - Minor entspricht der Länge von 2 BiXnom-Biokugeln. Diese stehen lotrecht am Rand der Teilungsstrecke der Länge 1. In dieser lotrechten Position ragt somit der Radius der Biokugel in die Teilungsstrecke hinein, wodurch der klassische Goldene Schnitt fundamental attackiert wird. Diese Einflussbreite der Biokugel ergibt den Biokugel-Einflussfaktur F_Bio = 1 - [ (Major - Minor) / 4] = 1,5 - (Wurzel(5) / 4) = 0,940983005625053.
Beim Pferd wird die maximale Schwellenbreite angesetzt, um sich von der Basisfallhöhe der Fische zu unterscheiden. Der Biokugel-Einflussfaktor F_Bio wird nunmehr auf die BiXnom-Schwellenbreite angesetzt. Hierdurch ändert sich der Artenfaktor. Die Rinder sollen als „modifizierte Pferde“ gefunden werden, weil dieses Ergebnis aufgrund der gedrungenen Kopfform zu erwarten ist. Entsprechend kann dadurch die Zunge als außergewöhnlich lang erscheinen. Die Pflanzenfresser-Lücke zwischen Schneidezähnen und Backenzähnen ist ein übereinstimmendes Merkmal.
Artenfaktor Rind = [Minor - (Schwelle * F_Bio) ]^5.
Ob sich die Vermutung bestätigt, ist ungewiss. Zumindest muss sich in den ersten Zeilen das Gebiss der Rinder bereits korrekt abbilden lassen. Die Episode EPI.Y*-Rind kann zunächst unverändert bleiben, weil der Huf in EPI.X*-Rind zu suchen ist. Der Faktor F_Bio ist darin als Stern (*) markiert. Die Startzeiten beider Episoden ergeben sich wie folgt: TIME.EPI.X*+Rind= 0,000414055687069400; TIME.EPI.Y*+Rind= 0,000418701744072188
Zähne:
Die 32 Zähne, 8 vordere Zähnen und 24 Backenzähne, entwickeln sich in EPI.X*+Rind wie üblich über die Zählgröße 11. Im Oberkiefer sind keine Scheidezähne und Eckzähne vorhanden. Unten liegen die 6 Schneidezähne und die 2 Eckzähne in einer Reihe, so dass es alternativ auch 8 Schneidezähne sind. Zweckmäßig werden nur 6 Schneidezähne gezählt, um je Gebissseite den inneren, den mittleren und den äußeren Schneidezahn benennen zu können. Die Evolution hat mit beiden Varianten ebenfalls ein Problem und findet eine diplomatische Lösung: Es sind insgesamt 8 vordere Zähne im Unterkiefer vorhanden. Das Rind wird mit 2 Schneidezähnen geboren, so dass die Zahl 2 dann auch später als 2 Eckzähne 8_2_8 umgedeutet werden kann. Die 8 Zähne sind nach 31 Tagen =1 Monat vorhanden QS 8+2+8+1+1+1+3+7=31Tage. Die Zeit wird als QS 4+1+3+8+8=24 Stunden aufgerufen: EPI.X*+Rind.Z.5#82811137413880100. Die Folgezeile adressiert die 12 Vorbackenzähne (3 je Seite im Ober- und Unterkiefer). Weil eine monatsweise Zeitangabe fehlt, sind diese Zähne ebenfalls bereits seit der Geburt vorhanden. Das Milchgebiss ist somit mit 20 Zähnen nach 1 Monat komplett ausgebildet. Die 3 Backenzähne werden mit 2_3_3_4 mit der 2 als paarig und der 4 als räumlich adressiert, wobei der Oberkiefer mit der 33 als Haut speziell aktiviert werden kann. Die 8 vorderen Zähne sind nochmals mit erwähnt. Mit QS 6+9+0+0+9 =24 Stunden ist die kurzfristige Zeit enthalten; Backenzähne wachsen entsprechend der Abnutzung nach: EPI.X*+Rind.Z.6#69009281178233400.
Der 4. Backenzahn 11 bricht nach ca. 7 Monaten (6 bis 8 Monate) auf allen 4 Seiten durch. Die 7 Monate stehen als Ziffer rechts außen [bzw. vorn QS 3+4=7], wobei sich die Zeitzählung auf den Monat mit 30 Tagen bezieht als QS 5+8+9+1+1+6=30 Tage. In der Markierung 4_6_4 stehen die Ziffern 4 für den 4. Backenzahn in auf 4 Seiten. Die Ziffer 6 ist „flexibel“ als nachwachsend: EPI.X*+Rind.Z.12#34504640589116700. Die hinteren Nullen ergeben sich aus der Stellenanzahl im 1000er Zeilenbereich, woraus sich am Zeilenstart die Körperform-Zuspitzung am Maul erklärt.
Der 5. Backenzahn 11 ist als Ziffer 5 rechts außen vermerkt. Die Zeit=24 Tage ist enthalten, wobei 00_24 als Zeitdehnung auf 18_00_24 für 18 Monate bzw. 1,5 Jahre bis zum Zahndurchbruch zu lesen ist. Die Markierung 2_4_2 bezieht sich auf alle 4 Seiten: EPI.X*+Rind.Z.23#18002421176930500.
Nach 18 Monaten beginnt der Zahnwechsel mit dem mittleren der paarigen 3 Scheidezähne [im Unterkiefer in Reihen: 6 Schneidezähne plus 2 Eckzähne], wobei in dieser Zeit auch noch der 6. Backenzahn durchbricht. Nach 2,5 Jahre =30 Monate wird der innere Schneidezahn (2 paarig in der Mitte) ausgetauscht. Nach 3 Jahren bricht während des Zahnwechsels noch der 6. Backenzahn durch. Der Wechsel des äußeren Schneidezahn-Paares und der beiden Eckzähne folgt später.
Für den Zahnwechsel der vorderen 8 Zähne wird zunächst eine Zahn-Gruppe 8_44 als Zählgröße 1 und Form 7 gebildet. Die insgesamt 20 Zähne des Milchgebisses sind als Quersumme QS 1+2+1+7+8+1=20 Zähne genannt: EPI.X*+Rind.Z.34#12178108443217700.
Der Zahnwechsel ist abgeschlossen, indem die Zeit der Zahn-Gruppe 44 an die Zeit für den 6. Backenzahn gemäß Zeile 44 (wie Gruppe 44) über 3 Jahre begrenzt wird. Weil die Zeit nicht in die Vergangenheit vom Backenzahn zum zu ersetzenden Schneidezahn springen kann, muss der Zahnwechsel über die Gruppenbildung vorab avisiert worden sein.
Der Zahnwechsel entsteht als Reihenfolge nach einer Zahlenfolge: Das mittlere Schneidezahn-Paar 11 wird als 2. Zahn von der Mitte aus gezählt. Die 18 Monate sind als Zahnwechselzeit enthalten, wobei die Zeit als 30 Tage =1 Monat zählt. Der Zahnausfall ist erklärbar, wenn die Blutversorgung 26=Eisen als Spiegelung „62“ blockiert wird: EPI.X*+Rind.Z.35#11830162487697200.
Für den Zahnwechsel des inneren Schneidezahn-Paares wird die Zählweise geändert. Die 8 vorderen Zähne werden mit dem Anteil der 6 Schneidezähne markiert als „6_8_6“. Nunmehr ist der innere Schneidezahn der 3. Schneidezahn, um die beiden Mittelzähne geometrisch als 3_0_3 zu symbolisieren. Die Blutversorgung wird mit 8_9 als Vene und Arterie ist gesperrter Reihenfolge als Zahnwechselfall genannt: EPI.X*+Rind.Z.36#11501546863038900.
Der Eckzahn 11 und das äußere Schneidezahn-Parr 111 werden ebenfalls mit „89“ auf „Ausfall“ geschaltet. Das wird aber mit 9=hinten bzw. später erst vollzogen, wenn mit Ziffer „6“ in 9_6_9 der 6. Backenzahn nach 3 Jahren durchgebrochen ist. Mit 42 Monaten =3,5 Jahre wird der Wechsel des äußeren Schneidezahl-Paares avisiert. Der Wechsel der beiden Eckzähne ist nach 5 Jahren avisiert: EPI.X*+Rind.Z.37#11190694245118900.
Die Zeile 44 ist eine Sprungmarke von der Zahngruppe 44 in Zeile 34, die eine Zeitvorgabe enthält. Die Zeit=24 ist grundsätzlich enthalten und wird als Ziffer 3 für 3 Jahre spezifiziert. Mit der 55 wird allgemein ein markantes Lesezeichen gesetzt, um in 3_5_65 den Zeitmodus 365 Tage=1 Jahr auszulesen. Mit der Ziffer 5 wird außerdem der Zeitraum von 5 Jahren bis zum Abschluss der Zahnbildungen vorbestimmt: EPI.X*+Rind.Z.44#94103565243045500. In der Folgezeile bricht der 6. Backenzahn folglich nach 3 Jahren durch. Die Ziffer 6 für den 6. Backenzahn wird nicht genannt. Der 6. Backenzahn wird hier als 3. Zahn in Bezug auf die 12 angeborenen Vorbackenzähne als 12_3 genannt, und zwar als Form 7 auf allen 4 Seiten und hinten 9: EPI.X*+Rind.Z.45#92012374904311200. Die Suche nach der fehlenden Ziffer kann als paralleler Verhornungsprozess der Schleimhaut im Oberkiefer zur Bildung einer Dentalplatte als Zahnersatz entwickelt werden. Für hartes Horn kann Schwefel=16 gesucht werden. Weiches Horn mit dem sechseckigen Benzolring und Kohlenstoff=6 ist mit 606 zu erwarten. Einfacher Knorpel als 22 ist nicht vorhanden. Die Dentalplatte endet vor den Backenzähnen und wird mit 11 als Zahn-Zählgröße als paarige 2 Widerlager-Funktion [QS 4+5=9 als oben] für die 8 Vorderzähne akzeptiert: EPI.X*+Rind.Z.49#84501160626408200.
Der avisierte Zahnwechsel wird nunmehr vollzogen. Die Zeile 50 entspricht der Zeile 5, wird aber aufgrund der Entwicklung auf das äußere Schneidezahm-Paar 111 bezogen. EPI.X*+Rind.Z.50#8281113741388010. Es folgt nach 5 Jahren der Wechsel der Eckzähne 11. Die Wurzel ist mit 11_0 rund, so dass der Zahn bei älteren Tieren wackelt: EPI.X*+Rind.Z.51#8118738962145110.
Auge:
Die Linse ist beim Rind analog zum Pferd queroval #5005 statt rund #505 geformt. Diese Zeile ist verfügbar, so dass mit EPI.X*+Rind das Auge erzeugen kann: EPI.X*+Rind.Z.118.#3508946500588140. Rinder sind Dichromaten und erkennen damit nur die 2 Farben blau und grün. Der Rot-Bereich wird vom Rind schlechter erkannt. Für das Farbsehen haben die S-Zapfen bei 455 nm und die M/L-Zapfen bei 554 nm ihr Absorbtionsmaxima. Von dieser wissenschaftlichen Messung weicht der BiXnom-Code für die Netzhaut 33 mit 454 und 555 nur um 1 nm ab: EPI.X*+Rind.Z.125.#331244549655520. Die beiden Zapfen-Typen enthalten eine unterschiedliche Art des Sehpigments Opsin, so dass der Farbeindruck aus dem Signalvergleich entsteht. Das Dämmerungssehen erfolgt mit den Stäbchen 1 der Netzhaut. Für die Hellempfindlichkeit ist allgemein ein Maximum bei 502 nm bekannt. Hier wird eine Wellenlänge von 550 nm markiert: EPI.X*+Rind.Z.118.#313678550810152.
Sehnerv 202 wird auf den 2. Hirnnerv bezogen: EPI.X*+Rind.Z.142.# 2915885120207050. Die stark durchblutete Aderhaut (Choroidea) 33 liegt hinter der Netzhaut (Retina). Die Gefäße sind als Arterie 9 und Eisen=26 wie Blut enthalten: EPI.X*+Rind.Z.155.#267132701335097.
Zwischen den beiden Schichten der Aderhaut liegt eine das Licht reflektierende Schicht (Tapetum lucidum), die bei Menschen und Schweinen fehlt. Bei Pferden und Wiederkäuern wird das Tapetum lucidum 222 aus kompakten Faserbündeln (Tapetum fibrosum) „1“ gebildet. Die Fasern zerlegen das Licht, so dass es bläulich erscheint. Das Tapetum lucidum ist halbmond- oder dreieckförmig „3“. Die vorgelagerte Netzhaut ist in diesem Bereich pigmentarm, so dass das nicht absorbierte Licht reflektiert wird. Der Nerv wird für die bessere Sicht dabei nochmals gereizt: EPI.X*+Rind.Z.156.#265420312223975. Die Lederhaut (Sklera) 33 ist die äußere Schicht des Augapfels: EPI.X*+Rind.Z.169.# 245003365129823.
Rinderhorn
Die Parallelepisode soll vorzugsweise vom Pferd übernommen werden. Daher muss in EPI.X*+Rind nach dem Auge eine Hornbildung in der Epidermis erkennbar werden. Die Lederhaut ist zuvor beim Auge adressiert worden, so dass als Grenzschicht zur Epidermis nunmehr eine Basalmembran 333 entsteht. Das Horn ist darin bereits als paarige 2, räumliche 4 Struktur 555_4_5 und als Form 7 adressiert. Die Ziffer 6=flexibel zeigt das stete Wachstum bis zur Hornspitze 1 an: EPI.X*+Rind.Z.178.#232615554533371. Die Rinder werden immer häufiger hornlos gezüchtet. Wie am Fingernagel schiebt sich das Horn zur Hornspitze hoch, die das älteste Horn enthält. Die Hornbildung der Epidermis entwickelt sich aus der darunter liegenden Lederhaut. Die äußere Hornscheide ummantelt den inneren knöchernen Hornzapfen und überragt diesen um einige Zentimeter. Der hohle Hornzapfen ist unmittelbar mit den Stirn- und Nasennebenhöhlen verbunden. Im Laufe der Jahre höhlt die Stirnhöhle den Hornzapfen weiter aus. Das Horn zeigt sich schließlich als flexibler Volumenkörper 6000, der am rechten Zahlenrand herauswächst. Das harte Horn ist analog zum Pferdehuf als Schwefel=17 erkennbar. Die einfache geometrische Hornform „404“ wird als räumliche Ringform gebildet: EPI.X*+Rind.Z.190.#217924045826000. Das Horn der Rinder wächst im Laufe des Lebens zu einer individuellen Form. Die Anzahl der geborenen Kälber ist an den „Kälberringen“ ablesbar (1 Ring je Kalb). Diese Besonderheit ergibt sich als weiblicher Hormonbezug „66“. Mit der Zeit=60 sind Jahresringe möglich. EPI.X*+Rind.Z.193.#214536625424560. Die 365 Tage müssen erst durchlaufen werden, so dass die 3 von der 65 verschoben ist als 65_3. Mit 0_7 ist eine Ringform enthalten: EPI.X*+Rind.Z.194.#213430766530619. Im Unterschied zu den Rindern (Hornträger) sind die Geweihträger offensichtlich auf das männliche Hormon 33 adressiert, so dass das Geweih jährlich komplett erneuert wird.
Wirbelsäule:
Das Rind besitzt 7 Halswirbel (Vertebrae cervicales), 13 Brustwirbel (Vertebrae thoracicae), 6 Lendenwirbel (Vertebrae lumbales), 5 Kreuzwirbel (Vertebrae sacrales) und 18 bis 20 Schwanzwirbel (Vetrebrae caudales). Vergleichsweise besitzt das Pferd abweichend 18 Brustwirbel. Schweine besitzen nur 4 Kreuzwirbel, und verfügen über 13 - 16 Brustwirbel sowie 20 - 23 Schwanzwirbel.
Halswirbel: Der 1. Halswirbel (Atlas) zeigt die Lochform 707 zum Durchstecken des Dorns vom 2. Halswirbels: EPI.X*+Rind.Z.222#865115707519820. 2. Halswirbel (Axis): EPI.X*+Rind.Z.274#1511152142589050. 3. Halswirbel: EPI.X*+Rind.Z.357#1159819851735010. 4. Halswirbel: EPI.X*+Rind.Z.358#1156580131478770. 5. Halswirbel: EPI.X*+Rind.Z.359#1153358459803340. 6. Halswirbel: EPI.X*+Rind.Z.360#1150154686303890. 7. Halswirbel: EPI.X*+Rind.Z.401#1032557823115710.
Brustwirbel: 1. Brustwirbel: EPI.X*+Rind.Z.405#1022359721159010. 2. bis 12. Brustwirbel in den Zeilen 580, 639, 658, 802, 896, 913, 988, 1006, 1233, 1329, 1366 und 1379. 13. Brustwirbel: EPI.X*+Rind.Z.1379#300257931159826.
Lendenwirbel:
1. Lendenwirbel: EPI.X*+Rind.Z.1382.#299606141150073.
2. Lendenwirbel: EPI.X*+Rind.Z.1527.#271156311112901
3. Lendenwirbel: EPI.X*+Rind.Z.1678.#246755475011562
4. Lendenwirbel: EPI.X*+Rind.Z.1717.#241150662241934
5. Lendenwirbel: EPI.X*+Rind.Z.1869.#221538623365115
6. Lendenwirbel: EPI.X*+Rind.Z.1956.#211684911589673
Kreuzwirbel:
1. Kreuzwirbel: EPI.X*+Rind.Z.1957.#211576743520389
2. Kreuzwirbel: EPI.X*+Rind.Z.1989.#208172793901157
3. Kreuzwirbel: EPI.X*+Rind.Z.2005.#206511564623142
4. Kreuzwirbel: EPI.X*+Rind.Z.2034.#203567201115733
5. Kreuzwirbel: EPI.X*+Rind.Z.2147.#192853137899115
Schwanzwirbel:
1. Schwanzwirbel: EPI.X*+Rind.Z.2212.#187186115311664
2. bis 17. Schwanzwirbel in den Zeilen 2220, 2299, 2464, 2611, 2740, 2762, 2853, 2904, 2934, 3131, 3157, 3202, 3337, 3354, 3548 und 3561. 18. Schwanzwirbel: EPI.X*+Rind.Z.3570.#115981985173502. 19. Schwanzwirbel: EPI.X*+Rind.Z.3571.#115949506320191. 20. Schwanzwirbel: EPI.X*+Rind.Z.3572.# 115917045652128. Es handelt sich somit um 20 Schwanzwirbel, wobei die letzten 3 wegen der direkten Folge als Einheit gebildet werden können.
Herz:
Ein Merkmal der Wiederkäuer sind die Herzknochen (Ossa cordis). Im Herzmuskelgewebe (Myokard) sind im Grenzbereich zwischen Vorhof und Herzkammer 2 Knochen (Os cordis dextrum und Os cordis sinsistrum) eingebettet, die ein Herzskelett bilden. Speziell beim Rind ist der rechte Herzknochen größer und besitzt eine rhombische Form. Der kleinere linke Herzknochen ist dreieckig geformt. Beim Pferd wird der Herzbeutel als Hautmembran-Struktur #5335 in Zeile 776 adressiert. Diese Zeilennummer gilt auch für das Rind. Lediglich die weitere Ziffernfolge weicht dann ab! Die Blutversorgung als Eisen=26 ist ebenfalls unverändert enthalten. Herzbeutel Rind: EPI.X*+Rind.Z.776.#533576916326547. Ein normaler Knochen kann als 225 oder schwächer als 522 adressiert werden. Im Gegensatz zum Pferd liegt diese Situation in 2 Folgezeilen vor. Linker Herzknochen (Os cordis sinsistrum): Der linke Herzknochen wird durch die „Null“ in 3_22_0_5 in der Struktur schwächer und mit der Ziffer „3“ in Dreieckform ausgebildet. Die Ziffer „1“ bezeichnet die linke Seite. Mit 525_33 wird die Einbettung der 2 Knochen im Muskelgewebe adressiert: EPI.X*+Rind.Z.778.#532205253302571. Rechter Herzknochen (Os cordis dextrum): Die Ziffer „2“ bezeichnet die rechte Herzseite. Weil erst für die Kammerkonstruktion der rechten Herzseite beim Pferd die Parallelepisode EPI.Y verwendet wird, kann die rechte Seite für die äußere Kammerumgebung durchaus vorab in EPI.X*+Rind als Herzskelett adressiert werden. Die rhombische Form (Raute) ist ein ebenes Viereck mit 4 gleich langen Seiten, so dass dafür die „44“ gilt. Die notwendige Form 7 ist in der Zeilennummer als 77 enthalten: EPI.X*+Rind.Z.779.#531522062990244. Kleine Wiederkäuer (Schafe und Ziegen) und Schweine besitzen ebenfalls ein Herzskelett, bei dem der Herzknorpel im höheren Alter verknöchern kann. Bei den Herzgefäßen wird zwischen links-koronarer (Hund und Wiederkäuer) und beidseitig-koronarer (Schwein und Pferd) Herzversorgung unterschieden. Beim Rind endet die Arteria coronaria dextra in Höhe des Sulcus interventricularis dexter und zieht nicht bis zur Herzspitze hindurch weiter [dexter=rechts].
Lage: Das Herz liegt bauchwärts (ventral) innerhalb des 3. bis 6. Rippenpaares, wobei die Herzspitze ist etwas nach hinten (kaudal) und linksseitig ausgerichtet. Das Herz berührt vom 4. bis 5. Interkostralraum (ICR) die linke Brustwand.
Herztöne: Erster Herzton (systolischer Ton): a) Schluss der Segelklappen (Atrioventrikularklappen, AV-Klappen), b) Schwingungen der sich kontrahierenden Kammermuskulatur, c) Schwingungen der Gefäßwände (Aorta und A. pulmonalis) durch Druckanstieg beim Ausströmen des Bluts. Die linke Segelklappe (Valva atrioventricularis sinistra) zwischen Vorhof und Herzkammer ist zweizipfelig (Mitralklappe /Valva bicuspidalis seu mitralis). Die rechte Segelklappe (Valva atrioventricularis dextra) zwischen Vorhof und Herzkammer ist dreizipfelig (Tricuspidalklappe / Valva tricuspidalis). Die freien Ränder der Klappensegel sind mit den Papillarmuskeln verbunden. Zweiter Herzton (diastolischer Ton): Schluss der Taschenklappen (Semilunarklappen / Valvulae semilunares) und Druck des Bluts (Aorta und A. pulmonalis) auf die verschlossenen Klappen. Die Taschenklappen befinden sich an den beiden Ausströmwegen der Herzkammer und verhindern den Rückstrom des Blutes in die Herzkammern während der Diastole. Die Taschenklappe des Truncus pulmonalis (Pulmonalklappe / Valva trunci pulmonalis) besteht aus drei halbmondförmigen Semilunarklappen. Die Taschenklappe der Aorta (Aortenklappe / Valva aortae) besteht ebenfalls aus drei halbmondförmigen Semilunarklappen. Zur Bildung von Segelklappen wird ein günstiger Zeilenlauf benötigt, der ggf. erst beim Rücklauf entsteht: EPI.X*+Rind.Z.4099#101013829487534.
Vorder- und Hintergliedmaßen
Teil A: Vordergliedmaßen
1.) Schulterblatt (Scapula): Das Schulterblatt 225 ist eine geteilte Form 7 (QS 1+6=7): EPI.X*+Rind.Z.505.# 819912251622575. Zwischen dem vorderen Rand (Margo cranialis scapulae) und dem hinteren Rand (Margo caudalis scapulae) sitzt eine Knochenleiste 3333 (Haut=3) als Schultergräte (Spina scapulae), die quer über die Rückenfläche läuft: EPI.X*+Rind.Z.509.#813468933338704. Kranial der Schultergräte liegt eine Grube (Fossa supraspinata), in der der Musculus supraspinatus entspringt. Kaudal der Schultergräte liegt eine weitere Grube (Fossa infraspinata), der der Musculus infraspinatus entspringt. Ein Muskel ist ausreichend als 55 beschrieben, so dass mit der Muskel-Dopplung 5555 beide Muskeln am Schulterblatt ansetzen. Die beiden Knochengruben sind mit 0_9 als Null und 9=außen enthalten, wobei zweckmäßig die Zeilennummer mitzulesen ist: EPI.X*+Rind.Z.509.#805555811419067. Das Schulterblatt zieht sich über einen weiten Zeilenbereich zum Schultergelenk, so dass dessen Ende nochmals mit der Schultergräte 333 als Form 77 avisiert wird. EPI.X*+Rind.Z.620.#667831753337743. Am Schulterblatt (Scapula) bildet sich eine Schultergelenkpfanne (Cavitas glenoidalis) als Form 7_00 und Endstruktur 9_5: EPI.X*+Rind.Z.623.#664615870095346. Das Schultergelenk (Buggelenk /Articulatio humeri) wird beidseitig mit QS 6+3 bzw. 3+6= 9 als Ende eingefasst: EPI.X*+Rind.Z.624.#663550780559936.
2.) Oberarmknochen (Humerus): Am Humerusschaft (Caput humeri) ist eine Gelenksfläche (Facies articularis) 909 für das Schultergelenk ausgebildet. EPI.X*+Rind.Z.625.#662489099311041. Der Humerus 225 ist ein Röhrenknochen: EPI.X*+Rind.Z.732.#565649845723225 und wird erst kurz vor dem Ellenbogengelenk als 225 erkennbar. Ellenbogengelenk (Articulatio cubiti): Das zusammengesetzte Gelenk (Articulatio composita) besteht aufgrund der 3 Knochen (Humerus und Ulna /Radius) aus 3 Teilgelenken. Diese werden als 0_22_7 gelenkige Knochenform in 3 Zeilen erfasst: EPI.X*+Rind.Z.735.#563341070842722; EPI.X*+Rind.Z.737.#561812329809227; EPI.X*+Rind.Z.739.#560291863422734
3.) Knochen des Unterarmes [Speiche (Radius) und Elle (Ulna)]: Elle und Speiche sind Röhrenknochen, die zwischen Humerus und Karpus (Vorderhandwurzel) liegen. Die Elle ist bei den Tierarten unterschiedlich ausgeprägt und liegt dem Radius verschieden an. Im Gegensatz zum Pferd ist die Elle weitgehend voll ausgebildet. Dennoch ist nur eine gemeinsame Zeile 225 mit einer Struktur-Dopplung 559_559 vorhanden. Die Elle überragt die Speiche am Ellenbogengelenk. Unterarmknochen Elle und Speiche: EPI.X*+Rind.Z.740.#559534712255946
4.) Handwurzelknochen (Karpalknochen): Die Karpalknochen (Ossa carpi) bilden in 2 Reihen das zusammengesetztes Karpalgelenk (Articulatio carpi). Mit der Gelenksymbolik 505 liegt für jede Reihe eine Zeile vor: Obere [proximale (antebrachiale)] Reihe: EPI.X*+Rind.Z.784.#528132253915051. Es sind 4 Einzelknochen vorhanden: Os carpi radiale, Os carpi intermedium, Os carpi ulnare und dem Os carpi accessorium. Untere [distale (metakarpale)] Reihe: EPI.X*+Rind.Z.980.#422505803132041. Eine Reihe aus 2 Knochen: Os carpi V sowie den zu einem Knochen verschmolzenen Ossa carpi II und III.
5.) Mittelhandknochen / Metakarpalknochen (Os metacarpale): Evolutionär sind die fünf Vordermittelfußknochen (Ossa metacarpalia) auf 2 reduziert worden, wobei die Metakarpalknochen III und IV zu einem Hauptmittelfuß (Röhrbein) verschmolzen sind. Die Metakarpalknochen I und II fehlen und der Metakarpalknochen V ist rudimentär vorhanden. Die Metakarpalknochen 225 sind beim Wiederkäuer aus 2 Knochen des 3. und 4. Strahls als einheitliches Röhrbein zusammengewachsen. In der Mittelachse ist eine Rinne (Sulcus longitudinalis dorsalis) 1 erkennbar, die durch eine Dopplung 54_54 erkennbar ist: EPI.X*+Rind.Z.1039.#398513654542253.
6.) Gleichbein am Fesselgelenk (Zehengrundgelenk / Articulationes metacarpophalangeae): Am Fesselgelenk der Pferde und Rinder sitzen an den Sehnen zwei Sesambeine, die als Gleichbeine (Ossa sesamoidea proximalia) 225 bezeichnet werden. Die Dopplung ist als 55_55 enthalten: EPI.X*+Rind.Z.1045.#396225537865455. Es folgen die Fingerknochen (Fesselbein, Kronbein, Klauenbein).
7.) Fesselbein: Im Unterschied zum Pferd müssen in der Zeile als Dopplung zwei Fesselbeine als paarige Konstruktion sichtbar werden. Die Ziffer 2 zeigt das Vorderbein grundsätzlich als paarig an. Das Fesselbein wird nunmehr als räumliche 444 Doppelstruktur 505 mit Lücke „Null“ adressiert. Die Quersumme 1+6=7 bildet die Form 7. Die 444 ist zugleich eine Klauen-Funktionsgruppe aller folgenden Bestandteile: EPI.X*+Rind.Z.1143.#362253444505162.
8.) Kronbein: Die Dopplung des Kronbeins wird durch den Spalt 1 in 5_1_7 aktiviert, so dass sich die Symmetrie dann mit 9 als seitlich aus 9_1_9 erklärt: EPI.X*+Rind.Z.1143.#312259190851735.
9.) Klauensesambein: Das distale Klauensembein ist wegen der beiden Klauen doppelt mit 202 vorhanden. Vergleichsweise ist beim Pferd nur 1 Sesambein im Huf als Strahlbein vorhanden: EPI.X*+Rind.Z.1434.#288741762252023.
10.) Klauenbein: Die Zählung der Positionen „225“ ist beendet, so dass für jedes der beiden Klauenbein eine eigene Zeile „2225“ gilt.
Äußeres Klauenbein: EPI.X*+Rind.Z.1501.#275853222564557. Die beiden Klauenbeine werden im Zwischenzehenraum vom Ligamentum interdigitale distale mit überkreuzenden Fasern 11_7 verbunden: EPI.X*+Rind.Z.1503.#275486152408117 und EPI.X*+Rind.Z.1519.#272584389117446. Die Faserkreuzung ist vergleichsweise als 5_48 vs. 5_84 addressiert. Inneres Klauenbein: EPI.X*+Rind.Z.1521.#272225961255359 mit 9=seitlich. Der Scann wendet und führt zum Körper zurück, wobei die nach hinten ausgerichteten beiden Afterklauen ausgebildet werden. Den Afterklauen fehlt der Bodenkontakt: EPI.X*+Rind.Z.1616.#256222578632055.
Teil B: Hintergliedmaßen
1.) Beckengürtel (Cingulum membri pelvini): Der Beckengürtel wird als Knochenring aus den beiden Hüftbeinen (Ossa coxae) gebildet. Jedes Hüftbein ist aus 3 Einzelknochen zusammengewachsen: Das Darmbein (Os ilium) ist nach vorn und rückenseitig (kraniodorsal) ausgerichtet. Das Schambein (Os pubis) ist nach vorn und bauchseitig (kranioventral) ausgerichtet. Das Sitzbein (Os ischii) ist schwanzwärts und bauchseitig (kaudoventral) ausgerichtet. Das Darmbein besitzt seitlich einen Darmbeinflügel (Ala ossis ilii). In die Lücke zwischen den beiden Darmbeinflügeln gliedert sich das Kreuzbein (Os sacrum) der Wirbelsäule über ein wenig bewegliches Kreuzdarmbeingelenk bzw. Iliosakralgelenk (Articulatio sacroiliaca) ein. Die Knochenzählung „#225“ wird am vor letzten (5.) Lendenwirbel begonnen, weil der letzte (6.) Lendenwirbel zu dicht am 1. Kreuzwirbel codiert ist. Zur Orientierung wird dann der Unterschenkelknochen gesucht, der die Dopplung von kräftigen Schienbein (Tibia) und schwächeren Wadenbein (Fibula) enthält. Weil das Wadenbein beim Rind nur rudimentär am Schienschein sitzt, ist es unauffällig zu erwarten. Darmbein: EPI.X*+Rind.Z.1863.#222252113295438, wobei mit 11_QS 3+2=5 ein Kontakt zum Kreuzbein besteht. Schambein: EPI.X*+Rind.Z.2002.#206821022512188. Sitzbein: EPI.X*+Rind.Z.2124.#194941472254897. Alle 3 Knochen sind in der runden, napffförmigen Hüftgelenkpfanne bzw. Beckenpfanne (Acetabulum) sichtbar. Hier wird angenommen, dass das Acetabulum einen selbstständigen Knochencode bildet, der sich als dreiteilige Gelenkpfanne 33_0_33 mit einer Y-förmigen Fuge abbildet. Beckenpfanne (Acetabulum): EPI.X*+Rind.Z.2142.#193303308622503.
2.) Oberschenkelknochen (Os femoris / Femur): Mittig in der Beckenpfanne (Acetabulum) liegt eine flache Grube (Fossa acetabuli) 303: EPI.X*+Rind.Z.2145.#193032954344709. Diese ist von einer glatten halbmondförmigen Gelenkfläche (Facies lunata acetabuli) 300 räumlich 4_4 umgeben. EPI.X*+Rind.Z.2146.#192943004226188. Zusammen mit dem seitlichen Gelenkkörper des Oberschenkelknochens bildet sich ein Hüftgelenk aus. Bevor sich das Femur im Zeilenlauf zeigt, muss der Kugel-Gelenkkörper 2205_9 seitlich am Knochen 225 entstehen. EPI.X*+Rind.Z.2145.#87525220593026. Die Extremitäten stehen nicht senkrecht, sondern liegen im Zeilenlauf. Der Beckenknochen ist noch nicht bis zum Ende gekommen, so dass beispielsweise auch eine großes Knochenloch (Foramen obturatum) zwischen dem Schambein (Os pubis) und dem Sitzbein (Os ischii) gebildet wird: EPI.X*+Rind.Z.2158.#19187010522215. Bevor der Femurschaft erkennbar wird, muss zunächst noch ein Sesambein als Kniescheibe (Patella) 222 gebildet werden. Die Patella bildet beim Rind und Pferd einen medial weisenden Processus cartilagineus aus und das Ligamentum patellae ist in drei abgegrenzte Bänder geteilt: EPI.X*+Rind.Z.2156.#183535322282536 und EPI.X*+Rind.Z.2156.#183454004018343. Femurschaft (Corpus ossis femoris) 225: EPI.X*+Rind.Z.2276.#181922533861775. Das Knieglenk kann in zwei Einzelgelenke unterteilt werden. Es ist eine Kniegelenk-Gruppe 444 vorhanden. Kniescheibengelenk (Articulatio femoropatellaris): EPI.X*+Rind.Z.2279.#181683057073015. Kniekehlengelenk (Articulatio femorotibialis): EPI.X*+Rind.Z.2282.#181444209934005.
3.) Unterschenkelknochen: Die Fibula (Wadenbein) bildet mit der Tibia (Schienbein) das Unterschenkelskelett. Das kräftige Schienbein 225 ist mit dem rudimentären Wadenbein verbunden, das nur summarisch als Knochen 225 erkennbar ist: Schienbein und Wadenbein 222525: EPI.X*+Rind.Z.2286.#181126722252581.
4.) Hinterfußwurzelknochen bzw. Tarsalknochen (Tarsus): Der Tarsus als Verbindung zwischen dem Unterschenkel (Crus) und den Hintermittelfußknochen (Ossa metatarsalia / Metatarsus) setzt sich bei den Haussäugetieren aus bis zu 3 Knochenreihen mit 7 Knochen zusammen. Durch Verschmelzung sind beim Wiederkäuer nur noch 5 Knochen vorhanden. Beim Karpalgelenk der Vorderbeine werden diese in 2 Reihen angelegt, die in 2 Zeilen adressiert wurden. Am Tarsalgelenk ist die Lage vergleichsweise unübersichtlich, so dass die 5 Knochen einzeln erfasst werden. Die Knochen bilden 6 Gelenke aus: Fersenbein (Calcaneus): EPI.X*+Rind.Z.2309.#17932251497159; Sprungbein (Talus): EPI.X*+Rind.Z.2339.#177022525467892. 3 Tarsometatarsalknochen: Os centroquartale: EPI.X*+Rind.Z.2506.#176795767322545; Os tarsale primum: EPI.X*+Rind.Z.2608.#165225733068396; Ossa tarsalia secundum et tertium: EPI.X*Rind.Z.2608.#158763683692255. Sofern die Zählung „#225“ keine paarigen Klauenbeine ergibt, können alternativ 3 statt 5 Zeilen beansprucht werden: a.) obere Reihe aus Os tarsi tibiale (Talus) und dem Os tarsi fibulare (Calcaneus); b) mittlere Reihen mit Os tarsi centrale; c) untere Reihe aus Ossa tarsi I, II, III und IV
5.) Mittelfußknochen (Röhrbein): Beim Rind sind die Metatarsalknochen des III. und IV. Strahles miteinander zum einheitlichen Röhrbein zu einem runden Querschnitt verwachsen finden. Entsprechend zeigt sich im Knochenschaft eine Längsfurche (Sulcus longitudinalis). Ein Os metacarpale V ist rudimentär vorhanden. Erkennbar ist mit 797 und 55_1 eine Formzusammenfügung mit einer Furche 1. Röhrbein 225: EPI.X*+Rind.Z.2621.#157976225512934.
6.) Gleichbeine: Den paarigen 2 Gleichbeinen als Form 7 und seitlich 9 werden keine dominante Zählgröße 225, sondern schwächer 522_2_7 zugewiesen, um Zeilen einzusparen: Gleichbeine: EPI.X*+Rind.Z.2653.#156070745220279. Fesselgelenk 40404 als räumliche 4 Form 7: EPI.X*+Rind.Z.2669.#155135139404047.
7.) Fesselbein: Im Unterschied zum Pferd müssen in der Zeile als Dopplung zwei Fesselbeine als paarige Konstruktion sichtbar werden. Mit 55 und 979 ist eine Dopplung vorhanden. Die Form 7 ist mit der 9 für seitlich markiert, so dass mit 070 eine Lücke erkennbar ist. Ergänzend ist mit ein Spalt 1 adressiert: EPI.X*+Rind.Z.2738.#151225597907013. Die Krongelenke müssen paarig vorhanden sein, was mit 2 „Nullen“ am Struktur-Abstand 0_555_0 adressiert wird: EPI.X*+Rind.Z.2787.#148566805550556.
8.) Kronbein: Das Kronbein 225 wird paarig 0_2 _0 in einer Lücke angezeigt. Mit 9 als seitlich ist der Knochen doppelt angeordnet 9_225_9: EPI.X*+Rind.Z.2816.#147036820692259.
Es zeichnet sich keine Dopplung der Klauenbeine ab. Weil die Außenklaue größer als die Innenklaue ist, können beide Klauen gesondert erfasst werden. Entsprechend werden die Klauengelenke mit einer kleinen Innengelenkform 700 und einer großen Außengelenkform 7000 angenommen. Klauengelenke: EPI.X*+Rind.Z.2835.# 146051388737002 und EPI.X*+Rind.Z.2838.# 145897000376815.
9.) Klauensesambeine 225 / 522: Das distale Klauensembein ist wegen der beiden Klauen als Dopplung erforderlich. Hierfür ist eine Folgezeile über eine Hautverbindung 33 und einer Spiegelung 5_2_68 vs. 9_86_9 gekoppelt: EPI.X*+Rind.Z.2953.#14021526822533 und EPI.X*+Rind.Z.2954.#140167801986933. Das paarige Sesambein ist als geheime Spiegelung 522= QS 1+4=5 und QS 1+6+7+8=22 enthalten.
10.) Klauenbeine: Äußeres Klauenbein 225: EPI.X*+Rind.Z.2962.#139789225884335. Ein Merkmal der paarigen Klauenbeine ist deren kreuzweise gespannte Faserverbindung im Klauenzwischenraum, die an der Vordergliedmaßen als Faser-Form-Spiegelung 117 vs. 711 vorliegt. Das Faserbündel ist an der Außenklaue vorhanden: Faserbündel: EPI.X*+Rind.Z.2964.#139694901170513. Das Faserbündel ist an der Innenklaue nicht direkt erkennbar, kann aber als breiter gestreut als vorhanden gelesen werden. Die Form-Ziffer 7 hat sich kreuzend nach links verschoben. Die Form 7 wird markiert als „272“, so dass sich mit QS 2+7+2=11 das Faserbündel zeigt. Mit 1_1 sind die Fasern auch direkt enthalten. Der Klauenzwischenraum ist als Null in 505 adressiert, der durch Fasern 010 gefüllt wird. Faserbündel: EPI.X*+Rind.Z.2973.#13927201045052. Inneres Klauenbein 225: EPI.X*+Rind.Z.2974.#139225180588231. Der Scann wendet zum Körper zurück und adressiert hierbei die paarige Afterklaue. Die beiden Klauen sind nach hinten ausgerichtet und berühren nicht den Boden. Die Dopplung an der Lücke „0“ ist mit den Klauen als Extra=8 in 86_0_8_2_6 enthalten, wobei die „2“ die Dopplung der Form 7 lediglich verstärkt. Afterklaue: EPI.X*+Rind.Z.2984.# 138758608267225.
Euter (Uber): Das weibliche Rind wird als Kuh bezeichnet. Im Alter von 2 - 3 Jahren wird die Kuh nach dem Kalben (Geburt Bullenkalb / Kuhkalb) zur Milchkuh. Milchdrüsen sind modifizierte Schweißdrüsen. Beim Wiederkäuer und beim Pferd sind die Milchdrüsen nur (inguinal) in der Leistengegend als Euter ausgebildet, bei der Stute mit 2 Zitzen bei der Kuh mit 4 Zitzen. Durch den Leistenbereich zieht beim Bullen (männlich 33 bzw. 2) die Harnröhre 2_303 zum Penis: EPI.X*+Rind.Z.3991.#103747353312303. Die Euter-Struktur 55_1_55 gilt nur für weiblich=1, so dass der Bulle mit Testosteron 33 ausgeklammert wird. Die 33 gilt nachfolgend für die Haut: EPI.X*+Rind.Z.3990.#103773355155238. Das Kuheuter enthält 4 eigenständige Milchdrüsenkomplexe (Viertel / Mammarkomplex). Der Milchdrüsenkomplex besteht aus dem Euterkörper (Milchdrüse und Euterzisterne) und 1 Zitze (Zitzenzisterne und Strichkanal). Bildung einer Milchdrüsen-Gruppe 44 als Euter mit 4 Milchdrüsenkomplexen 3_4_3: EPI.X*+Rind.Z.4003.#103436344508968. Die Zahl 63 für die „Physik“ ist enthalten, aber mit der Quersumme 1+3+4+3+6+3+4+4+5+8+9+6+8=64 wird der Sieg der „Biologie“ gefeiert. Mit QS 6+4=10 wird der BiXnom-Schwingkreis angetrieben. Die Kennzahl „64“ ist nützlich, um den mechanischen Saugreiz zu beschreiben, der vermittelt über das Hormon Oxytocin (hier allgemein als Wirkstoff 88) den Milcheinschuss in die Zisterne bewirkt. Der Milchdrüsenkomplex mit Euterzisterne „0“ als 3333_0_888 entsteht 4-fach 3333. Mit „2“ werden 2 Milchdrüsenkomplexe paarig zu insgesamt 4 angelegt. EPI.X*+Rind.Z.4007.#103333088861842. Die Milch wird durch Muskelstränge 55_11_5_7_1 aus den Alveolen in die Euter- und Zitzenzisternen gepresst: EPI.X*+Rind.Z.4010.#103255782311571. In den 4 Milchdrüsenkomplexen bildet sich jeweils ein Sammelraum als Euterzisterne 3003. Das weibliche Hormon 66 ist genannt: EPI.X*+Rind.Z.4011.#103230039159661. Mit „88“ wird als Wirkstoff das Hormon Oxytocin adressiert. Der Milcheinschuss als biologischer Saugreiz „64“ ist mit der „32“ zunächst blockiert, wird aber durch den Faktor 2 in der Wirkstoffmarkierung 828 zu „64“ aktiviert: EPI.X*+Rind.Z.4012.#103204308840828. Die 4 Zitzen 666_4 bilden sich am Euter. Die Zahl 26 Liter beschreibt die tägliche Milchleistung der Hochleistungskühe. Pro Jahr wurden früher ca. 2300 Liter gemolken, und heute ca. 8000 Liter pro Jahr. EPI.X*+Rind.Z.4014.#103152886664026. In den 4 Zitzen ist jeweils eine Zitzenzisterne 101 enthalten, die über 2 Zeilen als Formdehnung 47 vs. 407 sichtbar wird. Mit der hinteren 32 (statt 64) liegt kein Saugreiz vor, so dass der Abfluss durch den folgenden Schließmuskel verhindert wird: EPI.X*+Rind.Z.4015.# 103127194786899 und EPI.X*+Rind.Z.4016.#103101515704532. Der Schließmuskel ist mit der Zeit 24=Stunden adressiert. Die Kuh muss somit 1x täglich gemolken werden. Weil die Milchleistung dabei erheblich sinkt, muss trotz des höheren Arbeitsaufwandes aus Kostengründen morgens und abends gemolken werden. Die verwertbare Laktationsperiode nach dem Kalben dauert 300 Tage. Die 15 min für das Melken per Hand rechnen sich als QS 5+5+5=15: Schließmuskel 555: EPI.X*+Rind.Z.4019.#10302455513048. Der als mechanischer Reiz geeignete Zusammenhang 64 vs. 32 wird adressiert: EPI.X*+Rind.Z.4026.# 102845426495132. Der Wirkstoff 88= Oxytocin (Summenformel C43H66N12O12S2) wird ausgeschüttet. EPI.X*+Rind.Z.4027.#102819887526546. Der Ausfluss der Milch, die mit der Ziffer 2 beschrieben ist (weil männlich=2 oder „rechts“ hier ausgeschlossen sind), erfolgt über den „Strichkanal“ 090 mit 9=Zitzenende: EPI.X*+Rind.Z.4029.#102768847622090. Der Strichkanal der 4 Zitzen 4_666 ist mit einer speziellen Keratinschicht 33 ausgekleidet: EPI.X*+Rind.Z.4030.# 102743346667345. Der 1 cm lange „Strichkanal“ 9_1_9 zeigt sich gegen das Eindringen von Infektionserregern verschlossen (offen 909): EPI.X*+Rind.Z.4033.# 10266691967999.
Die Parallelepisode EPI.Y*+Rind: Zur Adressierung des Verdauungstraktes der Rinder mit 4 Mägen und der Funktion „Wiederkäuer“ ist eine Mitwirkung der Parallelepisode EPI.Y*+Rind wahrscheinlich. Um die räumliche Körperform zu erfassen wird zunächst der Brustkorb (Thorax) angelegt. Nach Maßgabe der Brustwirbel in EPI.X*+Rind werden nunmehr die Rippen und das Brustbein (Sternum) über EPI.Y*+Rind zugeordnet.
Rippen (Costae): Die von der Wirbelsäule zum Brustbein (Sternum) bogenförmig und paarig verlaufenden Rippen (Os costale) bilden den Brustkorb (Thorax). Das Brustbein und die Rippen sind im Gegensatz zu runden, langen Röhrenknochen (Ossa longa) als platte, abgeflachte Knochen (Ossa plana) geformt. Die Anzahl von 13 Brustwirbeln, beginnend ab EPI.X*+Rind.Z.405, stimmt aufgrund der gelenkigen Verbindung mit der Anzahl von 13 Rippen überein. Davon sind nur die 8 wahren Rippen (Costae verae) über ihren Knorpel direkt mit dem Sternum verbunden. Die 5 falschen Rippen (Costae spuriae) sind nur indirekt über zwischengeschalteten den Rippenbogen (Arcus costalis) kaudal, am hinteren Ende des Brustbeins angeschlossen. Über die Wirbelstrecke der 13 Brustwirbel können statt 13 nur 8 Rippen als Zählgröße „115“ in EPI.Y*+Rind gefunden werden. Daher muss die Zählung unter Maßgabe einer Brustbein-Gruppe 444_8_44 mit den 8 Anschlusspaaren und der mit 44 angehängten Rippenbogen-Gruppe 444 erfolgen. Die über die Wirbelstrecke fehlenden 5 Rippen müssen dann mit einer erweiterten Zählgröße zwischengeschoben werden. Das Brustbein ist ein Knochenstab 2222, unten=9, der mit 4_3_2_3_4 dreieckig 3 und räumlich 4 symmetrisch geformt ist. Mit der Quersumme 2+2+2+2=8 werden bereits die 8 paarigen Rippenanschlüsse avisiert, die nachfolgend als eine Gruppe 444 auf dem Knochenstab sitzen:
Anschluss des 1. bis 8. Rippenpaares am Brustbein (Sternum): EPI.Y*+Rind.Z.463.#904323421322220 und EPI.Y*+Rind.Z.464.#902374448431440.
Die Brustwirbelstrecke endet mit dem 13. Brustwirbel in EPI.X*+Rind.Z.1379. Weil der Brustkorb über das Ende der Brustwirbel kaudal ausgeformt ist, liegt die kompakte Rippenbogen-Gruppe etwas später vor. Die Bogen-Zählgröße ist mit „511“ zur Rippe „115“ gespiegelt, um den Rippen den Weg bauchwärts nach unten zu weisen. Mit normalen Rippen als „115“ könnten die Rippen den Weg nach unten zum Brustbein nicht finden. Zweckmäßig liegen die 5 fehlenden Ergänzungsrippen „511“ als 2. bis 6. Rippe vor, um für die 1. bis 8. Rippe den Direktanschluss an das Brustbein zu finden.
1. Brustwirbel 115: EPI.X*+Rind.Z.405.#102235972115901;
1. Rippe 115: EPI.Y*+Rind.Z.536.#781159970283933;
2. Brustwirbel 115: EPI.X*+Rind.Z.580.#713889115636897;
2. Rippe 511: EPI.Y*+Rind.Z.601.#696675114928765;
3. Brustwirbel 115: EPI.X*+Rind.Z.639.#647974471157121;
3. Rippe 511: EPI.Y*+Rind.Z.640.#654221475112794;
4. Brustwirbel 115: EPI.X*+Rind.Z.658.#629263962111551;
4. Rippe 511: EPI.Y*+Rind.Z.643.#651169119863434;
5. Brustwirbel 115: EPI.X*+Rind.Z.802.# 516278911557856;
5. Rippe 511: EPI.Y*+Rind.Z.818.#511860322826636;
6. Brustwirbel 115: EPI.X*+Rind.Z.896.#46211572217567;
6. Rippe 511: EPI.Y*+Rind.Z.920.#455110591382813;
7. Brustwirbel 115: EPI.X*+Rind.Z.913.#45351115779781;
7. Rippe 115: EPI.Y*+Rind.Z.981.#426811156036889;
8. Brustwirbel 115: EPI.X*+Rind.Z.988.#419084703511539;
8. Rippe 115: EPI.Y*+Rind.Z.1001.#418283460611576;
9. Brustwirbel 115: EPI.X*+Rind.Z.1006.#411586170049106;
9. Rippe 115: EPI.Y*+Rind.Z.1017.#411702796531158;
10. Brustwirbel 115: EPI.X*+Rind.Z.1233.#335811587242012;
10. Rippe 115: EPI.Y*+Rind.Z.1315.#318404368115732;
11. Brustwirbel 115: EPI.X*+Rind.Z.1329.#311554316831753;
11. Rippe 115: EPI.Y*+Rind.Z.1344.#311534035767997;
12. Brustwirbel 115: EPI.X*+Rind.Z.1366.#303115437093265;
12. Rippe 115: EPI.Y*+Rind.Z.1383.#302748911115103;
13. Brustwirbel 115: EPI.X*+Rind.Z.1379.#30025793115982;
13. Rippe 115: EPI.Y*+Rind.Z.1414.#296111558749779;
Rippenbogen an 9. Rippe: EPI.Y*+Rind.Z.1596.#262344451173050;
Rippenbogen an 10. Rippe: EPI.Y*+Rind.Z.1600.#261688590045118;
Rippenbogen an 11. Rippe: EPI.Y*+Rind.Z.1602.#261361887685511;
Rippenbogen an 12. Rippe: EPI.Y*+Rind.Z.1667.#251170812280857;
Rippenbogen an 13. Rippe: EPI.Y*+Rind.Z.1679.#249375666511130.
Zwerchfell-Öffnungen: Die nachfolgenden Öffnungen korrespondieren nicht mit den vorgenannten Rippen-Zeilen. Beispielsweise wäre die Speiseröhre außerhalb der Rippen deplatziert. Die Ermittlungen dienen momentan nur als Vorbereitung zur Erkundung des Verdauungstaktes (Pansen bis Labmagen).
Das Zwerchfell (Diaphragma) trennt die Brusthöhe mit Lunge und Herz von der Bauchhöhle. Bei den Wiederkäuern hat das Zwerchfell linksseitig Kontakt zum Netzmagen, wodurch die Leber beim erwachsenen Tier durch die Vormägen nach rechts verschoben wird. Im Zwerchfell 33 sind 4 Öffnungen zur Durchführung von Leitungsbahnen vorhanden, die in der Veterinärmedizin nach schwanzwärts (kaudal) in folgender Reihenfolge aufgelistet werden:
1.) Zwerchfellöffnung als Aortenschlitz „Hiatus aorticus“: Die Aorta 909 wird am Zwerchfell 33 adressiert: EPI.Y*+Rind.Z.1532.#273304010490984. Durch die Öffnung ziehen auch noch 2 Venen und ein Lymphgefäß. Vena azygos dextra als Vena 8, rechts=2 an der Aorta 99: EPI.Y*+Rind.Z.1533.#273125729988381. Vena azygos sinistra als Vene 8, rechts=1: EPI.Y*+Rind.Z.1538.# 272237804988419. Lymphgefäße entstehen beim Menschen als Zählgröße 11 der Lymphknoten. Entsprechend gilt für die Durchführung des Lymphgefäßes Cisterna chyli die Formgröße 7117: EPI.Y*+Rind.Z.1544.#271179886057117. Das Zwerchfell 33 wird nach unten wieder geschlossen: EPI.Y*+Rind.Z.1548.#270479162837331.
2.) Zwerchfellöffnung als Speiseröhrenschlitz „Hiatus oesopahgeus“: Die Speiseröhre (Ösophagus) als Muskelschlauch 505 wird am Zwerchfell 33 adressiert: EPI.Y*+Rind.Z.1792.#233650526825998. Der Nerv „Nervus Vagus“ 7 zur Steuerung der Körperfunktionen teilt sich und wird mit seinen beiden Ästen mit durch die Öffnung geleitet. Zunächst sind 2 Nerven-Strukturen 52_7_51 adressiert, die nachfolgend als Nervenstränge 777 erscheinen: EPI.Y*+Rind.Z.1795.#233260024552751. Truncus vagalis dorsalis 777: EPI.Y*+Rind.Z.1807.#231710981777636. Truncus vagalis ventralis 777: EPI.Y*+Rind.Z.1808.#231582823048777.
3.) Zwerchfellöffnung als Hohlvenenloch „Foramen venae cavae“: Die Vene „Vena cava caudalis als Venen-Gefäß 808 wird am Zwerchfell 33 adressiert: EPI.Y*+Rind.Z.1808.#226080855330555. Die Vene ist strukturell unverschieblich 55_33_555 mit dem Zwerchfell verwachsen, wodurch sie nicht zusammenfallen kann. Um das Hohlvenenloch liegt der Zwerchfellknochen als kleiner knöcherner Ring 225_5225 [Ob beim Rind vorhanden ist hier unbekannt] mit einer Ringform 9_7_0_9 und Knochen 225 an Vene 8: EPI.Y*+Rind.Z.1854.# 225836970912723 und EPI.Y*+Rind.Z.1855.#225715225914926.
4.) Zwerchfellöffnung „Arcus lumbocostalis“: An den Zwerchfellpfeilern setzen beidseitig Sehnenbögen an, die einen Spalt bilden. Die Nerven Truncus sympathicus, Nervus splanchnicus major, Nervus splanchnicus minor ziehen durch diesen Spalt. Ein Nervengefäß als Durchleitung 707 am Zwerchfell 33 sowie ein räumlicher Spalt 404 sind vorhanden. Die Fundstelle 707_33 liegt im Zeilenlauf aber fälschlich vor dem Ösophagus. Das wäre nur richtig, wenn die vorgenannten Öffnungen alle zu spät erscheinen: EPI.Y*+Rind.Z.1789.#2340423387770750. Durch einen Wechsel zur Leitepisode EPI.X*+Rind kann mit Bezug auf die Sehnen 22 eine spätere Position gefunden werden. Eine Gruppe 44 von Sehnenpfeilern 3_11_9_22 liegt vor, wobei sich eine Zwerchfell-Öffnung 33_00 als räumlicher Spalt 4_1_4 bildet: EPI.X*+Rind.Z.1913.#216443119220805 und EPI.X*+Rind.Z.1914.#216330035041484. Die Nerven-Zeile 707 wird von 2 Sehnen-Zeilen 22 eingeklemmt. Die 3 Nerven sind als 7_77_7 vorhanden: EPI.X*+Rind.Z.1916.#216104220808664; EPI.X*+Rind.Z.1917.#215991490385707; EPI.X*+Rind.Z.1918.# 215878877512722.
Zwerchfell-Kurve: Das Zwerchfell ist eine Muskel-Sehne-Platte zwischen Brust- und Bauchraum und dient als zentraler Atemmuskel. Es wird von einer flächigen Struktur (Fazie) überzogen; auf der Brusthöhlenseite vom Brustfell (Pleura diaphragmatica) und auf Bauchhöhlenseite vom Bauchfell (Peritoneum). Der Rippenteil des Zwerchfells beginnt bauchseitig am Schwertfortsatz (Processus xiphoideus) des Brustbeins (Sternum). Es folgen das Brustbeinteil und das Lendenteil. Alle 3 Teile enden in einer gemeinsamen Sehnenplatte (Centrum tendineum). Das Zwerchfell ist als Haut-Zählgröße 335 bzw. 533 zu finden. Diese Positionen schieben sich im Zeilenlauf überwiegend von einem Zahlenrand zum anderen. Eine Fundstelle auf dieser Kurve kann somit wahrscheinlich eine Zwerchfell-Lage beschreiben. In der Episode X*+Rind findet sich die Position der Wirbelsäule als Bezug für „oben (dorsal)“ bei einer Wirbelknochen-Suche, wenn die Zählgröße #115 möglichst am rechten Zahlenrand steht. Steht die Zählgröße #335 vergleichsweise für das Zwerchfell dagegen am linken Zahlenrand, ist das der Beginn des Zwerchfells unten (ventral) an der Bauchseite. Im Zeilenlauf zum Körperende wandert die Zählgröße #335 bis zum rechten Zeilenende, so dass das Zwerchfell oben an der Wirbelsäule eintrifft. Um die wenigen Fundstellen zur Darstellung einer Kurve zu ergänzen, wird umgekehrt in der Episode Y*+Rind die gespiegelte Zählgröße #533 verwendet. Die Reihenfolge der Zeilennummern ergibt dann eine Vorstellung von der Lage des Zwerchfells.
Leber (Hepar): In der Seitenansicht erstreckt sich die Leber vom Zwerchfell im bauchseitigen (ventralen) Drittel des 6. Interkostalraums (IKR) bis hin zum rückenseitigen (dorsalen) Drittel des letzten IKR. Unterhalb der Wirbelsäule schließt sich dort die Niere an. In der gleichen vertikalen Schnittebene liegt der Ausgang des Labmagens in den Dünndarm. Der Pansen dehnt sich auf der linken Körperseite noch weiter bis zum Ende der Bauchhöhle. Anatomie: Siehe Bild: https://www.quagga-illustrations: „Skelett und innere Organe einer Kuh - Quagga Illustrations (quagga-illustrations.de)“. Die Leber 555 ist in 4 Lappen gegliedert, die in der Reihenfolge der Positionen 555 benannt werden: 1.) Lappen: Lobus hepatis sinister 555: EPI.X*+Rind.Z.868.# 47702268095553. Die Abgrenzung zum 2. Lappen auf der rechten Seite erfolgt durch einen Einschnitt „Incisura ligamenti teretis“ in Bezug auf die Haut 33, die Form 7 und als Spalt 11: EPI.X*+Rind.Z.885.#467859533411752. 2.) Lappen: Lobus hepatis dexter 555: EPI.X*+Rind.Z.909.#455506806456986. 3.) Lappen: Lobus quadratus 555 EPI.X*+Rind.Z.994.#416555017172435. Die Gallenblase 400 wird als Volumen mit eingeordnet: EPI.X*+Rind.Z.1000.#414055687069400. 4.) Lappen: Lobus caudatus 555: EPI.X*+Rind.Z.1048.#395091304455535 [Berichtigung: Die bisherige Zuweisung als Kapsel des Fesselgelenks ist ungültig bzw. wurde gelöscht!]. Die Vena cava caudalis 8 ist den rückenseitigen Leberrand 33 in einem Sulcus venae cavae 100 teilweise eingelassen: EPI.X*+Rind.Z.1239.# 334185381008394. Die Lappen-Gruppe 44 ist geeignet, die beiden anhängenden Lappenfortsätze zu integrieren: 4.1) Processus caudatus 555: EPI.X*+Rind.Z.1250.#331244549655520. 4.2) Processus papillaris 555: EPI.X*+Rind.Z.1283.#322724619695558.
Milz: Die Milz zieht sich vom 7. Interkostalraum (IKR) bis zum letzten Rippenpaar auf der linken Seite. Sie liegt dem Pansensack auf und grenzt auch an das Zwerchfell [mit Zählgröße 335 bzw. 533]. Im 11. IKR ist die Milz in der Horizontalebene der unteren Kante des Hüfthöckers (Tuber coxae) verortet. Der Pansen wird vorläufig als Durchlauf der „Null=Volumen“ im Zeilenlauf erwartet und die Milz könnte sich statt 555 für die Leber als 55 durchziehen. Milz: EPI.X*+Rind.Z.903.#458533429755704 und EPI.X*+Rind.Z.1355.# 305576152818746.
Dünndarm: Im Zeilenlauf der Leber ist der Ausgang des Labmagens 555_505 als ein Muskelbezug enthalten. In welcher Röhren-Zifferform sich der Dünndarm nachfolgend entwickelt wird, ist noch nicht bekannt: EPI.X*+Rind.Z.1190.#347945955520505.
Niere (Ren): Die mehrwarzig gefurchte Niere und hat ein traubenähnliches Aussehen. Die Nierenlappen sind voneinander getrennt und die Markpyramiden münden einzeln in den Ureter. Ein Nierenbecken ist beim Rind nicht vorhanden. Niere 5555: Das Blut wie Eisen=26 ist nur indirekt als Spiegelbild 62 ablesbar. EPI.X*+Rind.Z.1450.#285555646254759.
Speiseröhre (Ösophagus): Der Magen besteht aus 3 Vormägen und dem Drüsenmagen (Labmagen) zur eigentlichen Verdauung. Die Speiseröhre mündet im Pansen am Übergang zum Netzmagen. Ein schwerer Stein als Fremdkörper fällt somit vom Pansen-Vorhof auf den Boden des Netzmagens. Weil der Netzmagen grobe Stoffe herausfiltert und in die Speiseröhre zum Wiederkauen zurückdrückt, können spitze Fremdstoffe die Magenwand bei der Kontraktion durchbohren. Eine Kurzschlussverbindung im Netzmagen (Haube) von der Einmündung der Speiseröhre bis zur Öffnung des Blättermagens wird über eine Magenrinne realisiert. Die Umformung der Magenrinne zu einem geschlossenen Rohr als Verlängerung der Speiseröhre wird vom Kalb beim Trinkvorgang für wenige Minuten durch den Haubenrinnenreflex aktiviert. Im Gegensatz zum Menschen ist ein Pferd nicht in der Lage, den Mageninhalt retour ins Maul zu befördern. Das Rind wäre nicht lebensfähig, wenn die Nahrung im Pansen als Gärsack ohne Entleerungsmöglichkeit verbliebe. Nur die Flüssigkeitsaufnahme über die Verdauungsstrecke eines Kalbs ist funktionsgerecht. Pansen und Netzmagen müssen daher eine vom Nervensystem gesteuerte komplizierte Motorik ausbilden, um pflanzliche Stoffe zu verdauen. Dafür musste die Evolution den mathematisch möglichen Pfad entdecken.
Zunächst wird eine Magen-Gruppe 44 als weit verstreut 4994 gebildet. Die Funktion der Magenrinne ist mit 365 Tagen als 3_5_65 enthalten. Die Struktur-5 kann das Alter von 5 Monaten sein, ab der das Saugen abgesetzt wird. Im Alter von 1 Jahr wird das Kalb als Rind bezeichnet: EPI.X*+Rind.Z.804.#514994635658458. Dem Zwerchfell folgt zunächst der Netzmagen (Haube / Reticulum) als vertikale Hautstruktur 3333 und als flexible Form 67_67: EPI.X*+Rind.Z.804.#513716733336725. Als Zählgröße 1 als Gruppenstruktur 44_515 sind die Hauben-Zellen 6- bis 4-eckig. Mit dem Nerv 7 kann über „10“ speziell der Hirnnerv 10 (Nervus vagus) adressiert werden, um eine Kontraktion des Netzmagens auszulösen. Der Netzmagen wirkt als Filter, womit die groben Pflanzenstoffe komprimiert und zum Wiederkauen in die Speiseröhre zurück befördert werden. Am Eingang der Speiseröhre liegt ein kranialer Ösophagusshinkter (Muskel Mm. Thyreopharyngeus und cricopharyngeus). Am Ende der Speiseröhre bildet sich ein kaudaler Ösophagusshinkter aus der verstärkten Ringmuskulatur und der Kardiamuskelschleife. Die endseitigen Schließmuskel werden gegensätzlich angespannt, so dass der Rücktransport des Mageninhalts möglich ist: EPI.X*+Rind.Z.804.#512445157264109. Die Haubenzellen (Cellulae reticuli) als Extra 8 werden durch Leisten 11 als Form 7 begrenzt. Die Zellen 0 stehen aus der Oberfläche heraus 0909: EPI.X*+Rind.Z.809.#511811726909024. Im Pansen setzen sich die äußeren Einschnürungen durch innere Strukturen fort. Zwischen dem Netzmagen und dem Pansenvorhof (Schleudermagen) ist trotz außen sichtbarer Einschnürung durch eine Pansen-Netzmagen-Furche (Sulcus ruminoreticularis) 111 innenseitig keine Trennung durch Pansenpfeiler vorhanden: EPI.X*+Rind.Z.810.#511179860579507.
Pansen: Der Pansen reicht real von der 8. Rippe bis zum Beckeneingang. Der weitläufige Pansen wird erwartungsgemäß auf der linken Körperseite=1 und als Volumenstruktur 0_5_900 avisiert. Der Pansen (Pantex) setzt sich aus 2 Pansensäcken 49_49 zusammen. Der rückenseitige Pansensack (Saccus dorsalis) überragt den bauchseitigen Pansensack (Saccus ventralis) nach vorn. Dieser Abschnitt wird als Pansenvorhof bzw. Schleudermagen bezeichnet und ist mit der Milz (Lien) verwachsen. Die Milz soll als „55“ weitläufig mitgezogen werden. Beide Pansensäcke teilen am Ende durch Einschnürungen jeweils ein Blindsack ab, Saccus caecus caudodosalis und Saccus caecus caudoventralis. Bei der Pansenmotorik unterscheiden sich diese 4 Abschnitte zuzüglich Pansenvorhof und Netzmagen voneinander: EPI.X*+Rind.Z.811.#510549552490013. Innenseitig besteht vom Netzmagen zum Pansenvorhof (Atrium ruminis) eine weite Öffnung (Ostium ruminoreticulare), die durch ein Faltenkranz (Plica ruminoreticularis) 11 abgegrenzt 9 wird: EPI.X*+Rind.Z.816.#507421185134069. Die Einmündung des Ösophagus (Ostium cardiacum) in den Pansen als räumliches Ende 4_99_4 wird statt 505 mit einem Ringmuskel 5055 abgeschlossen: EPI.X*+Rind.Z.819.#505562499474237. An der Einmündungsstelle ist die Magen-Haut 33 trichterförmig aufgeweitet. Als seitlich=9 wird die Ziffer 9 räumlich 4 markiert 494 und dann mit 09 aufgeweitet: EPI.X*+Rind.Z.820.#504945959840732 und EPI.X*+Rind.Z.821.#504330922130817.
Über die „808“ (wie bei einfachen Tierarten) kann eine alternative Verdauungsstrecke adressiert werden, bei der die phasenweise Bildung einer Magenrinne im Kälberalter durch einen Zeilensprung zur Zeile 8630 in EPI.Y* übergangen wird, um gesteuert über das Nervensystem 7_1_7 trotzdem zum Blättermagen zu gelangen; der Haubenrinnenreflex wird dabei unterdrückt: EPI.X*+Rind.Z.822.# 503717380863018. Außer dem Zeilensprung als „Luftnummer“ kann ein Rektus ausgelöst werden: Beim Menschen gehen die mit den Blähungen angesammelten Verdauungsgase als Flatus (Darmwind) über den After als Vorgang der Flatulenz ab. Beim Rind wird die im dorsalen Pansensack bei der Fermentation entstehende Gasblase durch regelmäßige Kontraktion des Pansens im B-Zyklus vor den Magenmund (Cardia) geschoben. Über die Speiseröhre bei geschlossenem Gaumensegel (Velum palatinum) gelangt das Gas (CO2) in die Lunge, wodurch die Atmung angeregt wird. Ein Rektus („Gas ablassen“) erfolgt 2 Mal pro Minute. Zählvorgang 1 durch Formänderung 7 über einen Nervenreflex 717 gezählt alle 30 Sekunden 30_1 als Zählgröße in Bezug auf eine Gasblase 808 als Extra 8: EPI.X*+Rind.Z.822.#503717380863018. Die Hautkontraktion 5_33 erfolgt mit „10“ über den „Nerv 7_10. Hirnnerv (Nervus vagus)“ alle 30 Sekunden: EPI.X*+Rind.Z.823.# 503105330582503. Über die Zeitsteuerung 24 und 60 wird der Rektus regelmäßig ausgelöst: EPI.X*+Rind.Z.823.#502494765860923.
Der Pansen zeigt äußerlich beidseitig eine vertikale Furche 111 durch beide Pansensäcke. Die vordere Furche teilt den auskragenden Pansenvorhof ab, und die hintere beidseitige Furche teilt die beiden Blindsäcke ab. Der Pansenvorhof kann sich im Zeilenlauf als Volumen #50... ausbilden, und zwar von EPI.X*+Rind.Z.812.#509920796883498 bis EPI.X*+Rind.Z.828.#500067254914735. Die vordere Vertikalfurche (Sulcus cranialis) 111_77 liegt vor dem Volumen #40...: EPI.X*+Rind.Z.1007.#411177444954717. Die hintere Vertikalfurche (Sulcus coronarius dorsalis + Sulcus coronarius ventralis) 7_111 liegt vor dem Volumen #30...: EPI.X*+Rind.Z.1335.# 310154072711161. Die beiden Pansensäcke teilen sich untereinander beidseitig durch eine horizontale Mittelfurche (Sulcus longitunalis sinister und dexter), und zwar mit 11_711 von EPI.X*+Rind.Z.962.#430411317119959 bis EPI.X*+Rind.Z.1344.# 308077148117113 mit 11711. Die beiden Pansen-Blindsäcke müssen ihr Sackende jeweils als Haut-Punkt 303 für die Ausrundung als Form 7 darstellen. Ende oberer Pansensack 7_303: EPI.X*+Rind.Z.1740.#237963038545632. Ende unterer Pansensack 303_7: EPI.X*+Rind.Z.962.#233402303872266. Bei der Pansenmotorik wird der Pansen-Inhalt durch Kontraktion der Pansenmuskulatur und der Pansenpfeiler durchgemischt. Durch Rezeptoren in der Pansenwand und des Dünndarms wird im Reflexzemtrum des Stammhirns ein Signal ausgelöst, das vermittelt über den Nervus vagus eine Kontraktion auslöst. Die Reihenfolge der zu bewegenden Pansen-Abschnitte wiederholt sich. In einem der beiden Zyklen wird der Netzmagen beteiligt, wobei er als Besonderheit eine doppelte Kontraktion ausführt. Man kann die Verbindung „Nerv 7_10. Hirnnerv (Nervus vagus)“ als 710 oder 107 suchen. Im ungefähr zu erwartenden Funktionsbereich ist die Dopplung als Spiegelung 701_107 erkennbar: EPI.X*+Rind.Z.906.#457015107140619. Bei Fieber, hier 40°C, wird die Pansenmotorik gehemmt.
Netzmagen (Reticulum) und Magenrinne (Sulcus reticuli): Bevor die Speiseröhre (Ösophagus) in den Pansenvorhof (Schleudermagen) mündet, hat sich bereits der Netzmagen (Haube) als vorderen Teil des Magens gebildet. Äußerlich ist der Netzmagen vom Pansen durch die Pansen-Netzmagen-Furche (Sulcus ruminoreticularis) abgegrenzt. Der Pansen hat selbst keinen Magenausgang und findet nunmehr in der Episode EPI.Y*+Rind die Möglichkeit, den mit der EPI.X*+Rind bereits gebildeten Netzmagen durch eine Magenrinne zum Blättermagen (Psalter / Omasum) zu ergänzen. Der Spurwechsel ist möglich, weil in der Parallelepisode gerade die Speiseröhre „505“ als mögliche Verlängerungskonstruktion beginnt: EPI.Y*+Rind.Z.962.#505678434869792. Um die temporäre Bildung der Magenrinne zu ermöglichen, wird zunächst eine Gruppe in 2 Varianten gebildet: Fall 1: Mit „505_44“ wird die Magenrinne zu einer geschlossenen Röhre. Die Milch des Saugkalbs kann mit Ziffer 2 und speziell durch Calcium=20 adressiert werden. Das Kalb verfügt in der Maulschleimhaut über Chemorezeptoren, um Inhaltsstoffe der Milch zu analysieren. Die Impulse führen über den 9. Hirnnerv (Nervus glossopharyngeus) zum verlängerten Mark (Medulla oblongata). Die reflektorische Antwort als Bewegungsimpuls verläuft über den 10. Hirnnerv (Nervus vagus). Die Rinne kann auch künstlich durch Kupfersalze (29) oder Natriumsalze (11) temporär für 600 Sekunden = 10 min geschlossen werden. Die Quersumme ist 63: EPI.Y*+Rind.Z.829.#505068448820492. Fall 2: Mit „50_44 wird das Rohr in der Längsachse offen aufgeklappt: EPI.Y*+Rind.Z.830.#50445993261709. Die offene Magenrinne 303 mit beiden Hauträndern (linke und rechte Lippe des Sulcus reticuli) 3 und Mulde 0 (Boden des Sulcus reticuli mit großen verhornten Papillen) ist mit 24 zeitgesteuert: EPI.Y*+Rind.Z.832.# 503247288548303. Die Milchkuh als Milchgeber ist mit Hormon 66 genannt. Quersumme 29=Kupfer: EPI.Y*+Rind.Z.833.#502643150146684. Die Milch wird mit Calcium=20 allgemein adressiert und mit der Wirkung Natrium=11 verbunden. Die Rinne ist räumlich 4 und sekundengenau 60 zu formen 404_60: EPI.Y*+Rind.Z.834.#502040460518211. Es wird eine formbare Muskelgruppe 44_5_77 aus 2 linienförmigen 501 Muskelwülsten gezogen, zwischen denen sich eine Fließrinne bildet: EPI.Y*+Rind.Z.835.#50143921445771. Linke Muskelwulst als Lippe „Labium sinistrum“ 500: EPI.Y*+Rind.Z.836.#500839406784914. Rechte Muskelwulst als Lippe „Labium dextrum“ 500: Die Zeit 24 ist enthalten. „Nerv 7_10. Hirnnerv (Nervus vagus)“ ist mit „10“ enthalten. Der fehlende allgemeine Nervenbezug 7 ist auf beide Wülste als Quersumme symmetrisch verteilt 7=3+4_4+3=7. Der Schließbefehl wird mit Natrium=11 ausgelöst: EPI.Y*+Rind.Z.837.#500241032344311. Die Zeitsteuerung schließt die Rinne 4_99 exakt über den Nervus vagus für 600 Sekunden = 10 min nach auslösen des Saugreflexes. Die Biologie feiert sich mit diesem Kunstgriff als 64: EPI.Y*+Rind.Z.838.#499644086004998.
Die Röhrenbildung erfolgt durch eine spiralige Drehung der beiden Haubenlippen bei gleichzeitiger Öffnung der Hauben-Psalter-Öffnung (Ostium reticuloomasicum) bzw. der Öffnung zwischen Netzmagen (Reticulum) und Blättermagen (Psalter / Omasum). Netz- und Blättermagen liegen eng zusammen, so dass sich äußerlich nur eine Einschnürung der Form 707 entwickelt. Gleichzeitig ist aber auch die spiralige Drehung der Haubenlippen als Gegensatz von 707 und 7997 erkennbar: EPI.Y*+Rind.Z.858.#487997370713506. Die beiden Haupenlippen werden als Muskel 5505 adressiert. Es sind Zeilen mit Schwefel=16 enthalten, die die verhornten Zellen des Rinnenbodens beschreiben können. EPI.Y*+Rind.Z.845.# 495505022570637 und EPI.Y*+Rind.Z.872.#4801625505415.
Von EPI.X* erfolgte eine Sprunganweisung zur Zeile 863, so dass die mysteriöse Folgezeile für Rinder gilt (keine Kälber) und mit 5000 stets eine offene Magenrinne bis zum Blättermagen vorliegt. Möglicherweise wird damit alternativ die Öffnung des Psalterkanals adressiert: EPI.Y*+Rind.Z.864.#48460850008355. Das Rind verfügt nunmehr über eine Entleerungsmöglichkeit für den Pansen. Damit ist einem Kalb nicht geholfen, so dass sich im Blättermagen noch ein Psalterkanal ausbilden muss, der die röhrenförmig verschließbare Magenrinne verlängert. Im Blättermagen ist dann eine Kontraktion des Psalterkanals gefolgt von einer Kontraktion des Psalterkörpers zu unterscheiden. Der Psalterkanal innerhalb des Blättermagens wird durch mehrere Röhrenpositionen gebildet. Teilweise wird dieser statt eines Kanals auch nur als Psalter-Rinne bezeichnet [keine Abbildung/Geometrie bekannt!]: EPI.Y*+Rind.Z.872.#48016255054150; EPI.Y*+Rind.Z.887.#472042552505285; EPI.Y*+Rind.Z.915.#457597534505124; EPI.Y*+Rind.Z.925.#452650534132095. Die Blätter des Psalterkörpers, zwischen denen die Nahrung ausgepresst und entwässert wird, werden als flexible Hautstruktur 666_33_55 gebildet. Psalterkörper: EPI.Y*+Rind.Z.922.#454123366672655. Die einzelnen Blätter ergeben mit „111“ blattweise eine Buchform als sogenannter Buchmagen. Die Psaltermotorik wird über „Nerv 7_10. Hirnnerv (Nervus vagus)“ gesteuert: EPI.Y*+Rind.Z.926#452161710661110. Bei der Maximalkontraktion des Netzmagens öffnet sich der Psalterkanal und saugt die aufgenommene Nahrung (Ingesta) in seiner Saugphase an. In der Druckphase schließt sich die Hauben-Psalter-Öffnung wieder und der Psalterkanal kontrahiert, wodurch der Nahrungsbrei zwischen die Blätter gepresst wird. Nach einigen Sekunden kontrahiert nunmehr der den Psalterkanal umgebende Psalterkörper als Kontraktionswelle zum Psalterausgang, wodurch die Nahrung (Ingesta) in den Labmagen (Abomasum) gedrückt wird. Die Hautstruktur wird als Gruppe 333_44 gebildet. Zwischen den Blättern verschiebt sich die Ziffer „6“ als „ausgepresst“ mit 86808_6: EPI.Y*+Rind.Z.931#449733344868086. Der Pressvorgang der Blätter 1 wird über das Nervensystem 717 mit der Zeit 60 gesteuert: EPI.Y*+Rind.Z.932#449250798360717. Die Anzahl der Magen-Blätter wird exakt mit 100 Stück definiert: EPI.Y*+Rind.Z.931#448769286251005. Es liegt nunmehr der Zeilenlauf der Gruppe #44 an, so dass eine Vielzahl von Zeilen zur Verfügung steht. Die longitudinale Kontraktion des Psalterkörpers könnte als Ziffernverschiebung von einem Zahlenrand zum anderen abgebildet werden. Die Pressstrecke wird jedoch noch bis zu einer Gruppe 444 verlängert: EPI.Y*+Rind.Z.959#436602444287996. Mit der Zeilennummer 9_5_9 wird eine Struktur-5 in der Zeilennummer ausgepresst; weil die Nahrung nicht zum Körper gehört. Begleitet von der übereinstimmenden Vergleichszahl „196; QS=16“ wird die Struktur von voll 555 auf leer 500 entwässert. Die Psalterblätter besitzen verhornte Ausstülpungen (Papillae omasi). Weil das Horn gemäß Pferdehuf mit Schwefel= 16 adressiert ist, wird mit der Quersumme 1+9+6=16 die Verhornung der Psalterblätter adressiert: EPI.Y*+Rind.Z.937#446853515551962 und EPI.Y*+Rind.Z.937#436147650075196.
Der Blättermagen liegt real auf der rechten Bauchseite im 7. bis 11. Interkostalraum und ragt handbreit über den rechten Rippenbogen hinaus. Der Labmagen überragt im Zeilenlauf den Blättermagen, so dass sich beide Mägen überdecken bis der Blättermagen schlauchartig die „Buchlabmagenöffnung“ als Magenöffnung zwischen Blättermagen (Omasum / Psalter / Buchmagen) und Labmagen gefunden hat. Zunächst sind noch Blätter oder Lamellen als 1111_9 und 111_9 zu finden. Statt einer Öffnung 0_99_0 mit 9 als Ende könnte es sich zunächst um den runden Anfang des Labmagens handeln, so dass die Öffnung am Labmagen erst noch folgen wird: EPI.Y*+Rind.Z.972#430763111185379 und EPI.Y*+Rind.Z.981#426811156036889. Anfang Labmagen: EPI.Y*+Rind.Z.984#425509902512386. Buchlabmagenöffnung als Formloch 707: EPI.Y*+Rind.Z.1021#410089857073642.
Labmagen (Drüsenmagen /Abomasum): Der Labmagen besitzt eine Drüsenschleimhaut und funktioniert damit als der eigentliche Magen (Gaster). Der Labmagenkörper liegt unterhalb und links des Blättermagens (Psalter). Der Labmagen ist L-förmig und liegt mit dem Labmagenknie an der ventralen Bauchwand an. Das Labmagenknie ist der Magenausgang (Pars pylorica ventriculi). Der Magen verengt sich im Vorraum (Antrum pyloricum) trichterfömig. Beim Menschen folgt der Pförtnerkanal (Canalis pyloricus). Dieser wird beim Rind als Pylorusteil des Labmagens bezeichnet. Der Magenschließmuskel (Pförtner / Pylorus / Musculus sphincter pylori) bildet distal am unteren Magenmund (Ostium pyloricum) die Grenze zum anschließenden Zwölfingerdarm (Duodenum).
Die wissenschaftlichen Darstellungen zeigen den Darmanschluss als lineare Fortführung oder als L-förmigen Anschluss des Pylorusteils als Knick unter 90°. Tatsächlich kann der Pylorusteil als Schleife gewendet sein, so dass erst von diesem Rücksprung aus der Dünndarm aufwärts (dorsal) beginnt. Der Form nach ist es ein um 90° gedrehter Waschbeckenabfluss (Syphon) mit umgekehrter Fließrichtung [vgl. Lehrbuch der Anatomie der Haustiere: Lehrbuch der Anatomie der Haustiere Band II: Thieme E-Books & E-Journals (thieme-connect.de ]. Weil ein Sprung in die Vergangenheit nicht möglich ist, muss die Episode EPI.Y*+Rind am Labmagenknie enden. In der Leitepisode EPI.X*+Rind muss zunächst in umgekehrter Reihenfolge der untere Magenmund (Ostium pyloricum) als Öffnung erkennbar sein, der sich der Pförterkanal (Pylorusteil) anschließt, um dort ebenfalls als Gegenstück des Labmagenknies zu enden. Die Situation ist auch real schwierig, weil sich das flexible Ende des Labmagens nachteilig im Körper verschieben kann.
Die Magenschleimhaut wird über Drüsen 88 in Verbindung mit der Salzsäure als Chlor=17 (QS=8) gesucht. Der Molekülabstand von 199 pm kann hilfreich sein. EPI.Y*+Rind.Z.1096#382027138751996; EPI.Y*+Rind.Z.1115#375517259257568; EPI.Y*+Rind.Z.1117#374844891738754; EPI.Y*+Rind.Z.1119#374174927678452; 37317445995738; EPI.Y*+Rind.Z.1125#372179328064167 u.a., Drüsenschleimhaut 33: EPI.Y*+Rind.Z.1122#371848795801233. Im Zeilenlauf liegt mit #37 die Haut als Form an, diesbezüglich wird die gekrümmte Magenform innenseitig als kleine Kurvatur und außen als große Kurvatur bezeichnet. Magenmotorik Nerv 7_10. Hirnnerv (Nervus vagus)“ EPI.Y*+Rind.Z.1229#340684901604710. Bogenteil von 90° für die Schleife 4040 des Pförtnerkanals (Polyrusteil) avisiert: EPI.Y*+Rind.Z.1230#340407922009909. Bei einer Magenschleife am Labmagenknie ist der Pförterkanal in der Leitepisode EPI.X*+Rind bereits fertiggestellt und kann durch eine Gruppenbildung beider Episoden 44_44 angeschlossen werden: EPI.Y*+Rind.Z.1234#339304492765144. Es werden zwei 90°-Bögen als Schleife 180° zusammengefügt, so dass ein Schleifenende statt als Hautpunkt 303 auch mit 30 ausreichend benannt ist. Das 90°-Bogenende des Labmagens liegt mit Ende=9 der Gruppe 44 vor: EPI.Y*+Rind.Z.1245#336306621744729. Der Zeilenlauf #33 der Haut wird zweckmäßig nicht weiter verfolgt, weil diese Phase in Leitepisode bereits mit Bildung des Pförtnerkanals beendet ist. Die Alternative wäre eine krankhafte lineare, extrem weite Fortführung, so dass sich ein langes Endstück im Körper einen Platz suchen muss. Dieses zeigt sich durch einen engen Innenbogen 303 und einen weiten Außenbogen 3003 als Labmagenende: EPI.Y*+Rind.Z.1375#30517619830334 und EPI.Y*+Rind.Z.1394#300359931185214.
Als Normalzustand wurde dagegen in der Leitepisode EPI.X*+Rind bereits der untere Magenmund (Ostium pyloricum) 505 mit dem Magenschließmuskel (Pförtner/Pylorus) 555 gebildet: EPI. X*+Rind.Z.1190#347945955520505. Im Zeilenlauf kann, dem Weg des Nahrungsbreies entgegen, der Pförtnerkanal bis zum Anschlussbogen über die Hautserie #33 entstehen. Am in EPI.Y*+Rind genannten Ende des Labmagens in Zeile 1245 ist zufällig der Anschlussbogen von 90° enthalten, wobei mit der Form 7 die Ziffer 2 markiert ist, um die Magenschleife von 2 x 90° = 180° über beide Episoden auszuformen: EPI.X*+Rind.Z.1245#332574849051727. Der Dünndarm wird weitergehend nicht als Muskelschlauch 505, sondern als Verdauungselement 808 erwartet.
Die After- und Schwanzregion ist beim Pferd auffällig zu finden. Für die Kuh sind in der Leitepisode vergleichsweise keine besonderen Fundstellen vorhanden. Bei der Kuh ist der After in einer eingezogenen Aftergrube zurückgezogen. Hierdurch kommen die langgezogenen Schamlippen in der oberen Hälfte in eine Schräglage. Die Harnröhre kann dadurch als Fehlbildung ebenfalls zu früh zur Scheide führen. Es ist wahrscheinlich, dass sich die Region unabhängig von der Positionierung der Schwanzwirbel über die Parallelepisode EPI.Y*+Rind bildet. Am 2. Schwanzwirbel kann ein Zeilensprung von EPI.X*+Rind.Z.2245.#184434604485256 zur Parallelepisode EPI.Y*+Rind.Z.3460#121012064760748 genutzt werden, um die Afterregion abzubilden. Mit „64“ feiert die Biologie diesen Kunstgriff. Zugleich wird der Nervus vagus als 10. Hirnnerv mit der Zeit 12_10_12 bzw. als Nerv 7 mit der Zeit 60 verbunden.
Der Dickdarm bildet anfangs den Blinddarm (ohne einen Wurmfortsatz). Der folgende Grimmdarm (Colon) als Hauptabschnitt gliedert sich in den aufsteigenden, quer verlaufenden und absteigenden Abschnitt, gefolgt vom Mastdarm (Rectum). Im Mastdarm wird der Kot gesammelt und entwässert. Im letzten Abschnitt bildet sich im Dickdarm ein kurzer Afterkanal. Der Afterkanal ist mit einer schwach verhornten, sensiblen Schleimhaut ausgekleidet, weil im Zeilenlauf mit #117... das Horn als Schwefel=17 anliegt. Der im Afterkanal 808 vorhandene innere Schließmuskel 505 wird adressiert: EPI.Y*+Rind.Z.3564#117480848505103. Äußerer Schließmuskel 5555 im Afterkanal 8008 als räumliche Struktur 5_4_5, der flexibel 6_4_6 geöffnet wird: EPI.Y*+Rind.Z.3595#116467800854572. Der innere Schließmuskel ist eine glatte Muskulatur, die willentlich nicht beeinflussbar ist. Der äußere Schließmuskel ist eine quer gestreifte Muskulatur, die willentlich beeinflusst wird und zur Entleerung des Kots führt. Im Rektum bewirken Druckrezeptoren eine entsprechende Erregung. Der Anus (Rosette / Poperze / After) ist die Austrittsöffnung, die sich als Hautstruktur 33 mit dehnbaren 6 Falten 116_0_116 als Ring bildet: EPI.Y*+Rind.Z.3599#116338356230116. Die Harnröhre 303: EPI.Y*+Rind.Z.3602#116241461430369 und die Scheide (Vagina): EPI.Y*+Rind.Z.3609#116016000020002 werden avisiert. Eine Strukturbildung für Kühe mit Hormon=66 ist im Detail natürlich erst möglich, wenn männliche Rinder (Bullen) 33 vom weiteren Zeilenlauf ausgeschlossen werden. Das männliche Hormon 33 ist durch weiblich=1 geklammert: EPI.Y*+Rind.Z.3620#115663465213312.
Mit der Anwendung der BiXnom-Biokugeln erweitert sich das Spektrum der Artenvielfalt - Zahlenbilder entstehen weiterhin. Die Kettenreaktion als Biokugel der Biokugel ist eine weitere Möglichkeit zur Artenfindung.
BiXnom_Rinder_dat14.10.2021
Auf den Hund „Sophi“ gekommen – Schlittenhund statt Diesel-Stunk
In der Umgebung der Basisfallhöhe der Fische, deren Artenfaktor sich als 5. Potenz ergibt, entstehen aufgrund der BiXnom-Schwelle an der Obergrenze die Pferde und an der Untergrenze die Wale. Der innere Bereich der Schwelle fächert sich unter der Wirkung der Biokugeln für weitere Arten auf. Auf dem Schwellenrand stapeln sich zwei lotrecht stehende Biokugeln, so dass diese mit dem Radius einer Biokugel die wirksame Schwellenbreite verkürzen. Die wirksame Schwellenbreite wurde mit einem Schwellenfaktor auf die bekannte Bixnom-Schwelle angesetzt. In den Episoden-Bezeichnungen Epi.X*+Rind und Epi.Y*+Rind zeigt der Stern (*) die Modifizierung durch die Biogugeln in der 1. Stufe an. Die Kettenreaktion setzt sich unendlich fort, indem der Schwellenfaktor zum Einfluss der Biokugeln potenziert wird. Wird der Schwellenfaktor in der 2. Stufe (**) in das Quadrat gesetzt, liegt die Startzeit für den Hund vor. In der 3. Stufe (***) in Kubik ist der Bauplan der Katzen, Tiger und Löwen zu erwarten. Beim Rind ist zwischen Schneidezähnen und Backenzähnen eine Lücke „Wiederkauer-Lücke“ vorhanden. Bei Katze und Mensch ist der Kopf rund, so dass die Augen weit vorn liegen. Hunderassen reichen in der Kopfform von der Bulldogge bis zum Deutschen Schäferhund. Im Bauplan kann das Hunde-Auge somit nicht kompakt über wenige Zeilen gefunden werden, sondern zieht sich über den Schädelbereich fast unsichtbar dahin. Die Kopfform ist daher divers. Zur Familie der Hunde (Canidae) gehören Fuchs, Schakal, Kojote, Wolf und der domestizierte Haushund (Canis lupus familiaris). Der Bauplan für den Hund entsteht, wenn die folgenden Startzeiten der Episoden verbrannt werden: Time.Epi.X**+Hund= 0,000408524302161550; Time.Epi.Y**+Hund= 0,000409871490781359.
Das Auge
Das Hunde-Auge ist unsichtbar im weiten Zeilenlauf des Bauplans verteilt. Um überhaupt ein Auge zu entwickeln, wird der Zeilenlauf der „Ziffer 2“ als Sehnerv (Nervus opticus) = 2. Hirnnerv genutzt, um eine Augen-Gruppe 0_44 mit Null=0 als Auge zu bilden. Mit 33_33 sind die Augenlider bereits enthalten. Epi.X**+Hund.Z.159#256933523372044. Diese Struktur wird mit der Quersumme 0+9+6+9=24 auf die Zeit mit Null=0 als Auge bezogen, d.h. der Hund ist kurzsichtig, reagiert aber blitzschnell auf Bewegungen. Epi.X**+Hund.Z.160#255327688850969. Hornhaut 303: Epi.X**+Hund.Z.169#24173035630861. Vordere Augenkammer (Camera anterior bulbi) : 3_100: Epi.X**+Hund.Z.171#238903100679269. Bindehaut 33: Epi.X**+Hund.Z.181#225704034343398. Iris 404 mit „4“ als räumlich und „7“ als Nerv sowie Zeit=24. Blende 1 in Sehnerv-Funktion 212: Nerv 7Epi.X**+Hund.Z.192#212773074042474. Zilarkörper (Corpus ciliare) 202 (wie Zeilennummer) enthält Muskeln 5 in der Hautschicht 53_53: Epi.X**+Hund.Z.202#202239753545322. Linse 505: Epi.X**+Hund.Z.204#200257010863505. Hintere Augenkammer (Camera posterior bulbi) 500: Epi.X**+Hund.Z.208#196405914500745. Zonulafasern 1 radial zwischen Linse und Zilarkörper 19_81_9_81_91: Epi.X**+Hund.Z.210#194535381981691. Lederhaut 333: Epi.X**+Hund.Z.208#190011303330954. Glaskörper 600 in Kugelform 707: Epi.X**+Hund.Z.217#188260047079055. Netzhaut 555: Epi.X**+Hund.Z.226#180762965558208. Zapfen für das Farbsehen: Der Hund kann mit 2 Zapfentypen im kurzwelligen Bereich um 440 nm (blau) und im mittellangen Bereich bei 550 nm (gelb) Farben erkennen. Rotes und Grünes erscheinen als gelb. Der lange Bereich für rot fehlt – der Mensch besitzt 3 Zapfen. Im BiXnom-Code sind Zapfen 1 für das Schwarz-Weiß-Sehen und für das Farbsehen 2 Zapfentypen mit 550 nm und (abweichend) 452 nm lesbar: Epi.X**+Hund.Z.226#179177325509452. Reflektierende Hautschicht (Tapetum lucidum) 303 zwischen Netzhaut und Aderhaut. Die enthaltenen Faserbündel (Tapetum fibrosum) „111“zerlegen das Licht: Epi.X**+Hund.Z.234#174583035111774. Aderhaut (Choroidea) 33: Gefäße als Vene 8 und Arterie als Quersumme 1+7+1=9 sowie 4+5=9. Die Biologie feiert die Bildung des Auges als Kunstgriff „64“: Epi.X**+Hund.Z.238#171648866454433. Lederhaut (Sklera) 33: Epi.X**+Hund.Z.240#170218459233979. Das breite Gesichtsfeld im Winkel von 240° ist als Halbwinkel von 120° lesbar. Wird mit 6=flexibel 86_86 eine Überschneidung erkannt, ergibt sich der Winkel des Simultansehens beider Augen als Quersumme 1+6+2+7+5+8+6+8+6+1+2+0+1+4=57°, statt ca. 60° wie bekannt. Epi.X**+Hund.Z.251#16275868612014. Sehnerv „2“ mit zentraler Netzhaut-Arterie 9 und zentraler Netzhaut-Vene 8: Epi.X**+Hund.Z.255#160205608690804.
Zähne
Die Wirbelsäule entsteht aus einer Reihe Zählwirbel „#115“. Die Kopfform wird über die Zählung der Zähne „#11“ gebildet. Zunächst sind nur Ober- und Unterkiefer zu erkennen, so dass die Details erst im Zeilen-Rücklauf beider Episoden zu erwarten ist: 1.) Hirnschädel (Hinterhauptsbein, Schläfenbein, Stirnbein, Scheitelbein, Zwischenscheitelbein, Siebbein)
2.) Gesichtsschädel (Stirnbein, Nasenbein, Tränenbein, Jochbein, Oberkieferbein (Maxilla), Zwischenkieferbein, Gaumenbein, Pflugscharbein, Flügelbein, Keilbein), 3.) Zungenbein, 4.) Unterkiefer (Mandibula).
Milchgebiss 28 Zähne: Im Ober- und Unterkiefer sind je Seite 3 Schneidezähne (Incisivi), 1 Eckzahn (Canini) und 3 vordere Backenzähne (Prämolare) und keine hinteren Backenzähne (Molare) vorhanden [(3i+1c+3p+0=7)*4 Seiten=28 Milchzähne]. Die Zahnanlage der bleibenden Zähne ist tiefer angelegt und bricht daher nach den Milchzähnen als Platzhalter durch. Die Milchzähne brechen nach 3 Wochen durch und sind bis zur 6. Wochen alle vorhanden.
Scheidezähne: Die insgesamt 12 Schneidezähne als Quersumme 9+3=12 werden wie beim Facharzt über alle 4 Quadranten und paarig mit 4_2_4 mit 11_9_3 Zähnen je Seite komplett in einer Zeile adressiert. Zahn-Zählgröße „11“, 9 hebt den Zahn heraus, 3=Anzahl je Seite. Die Zeit=24 ist enthalten, so dass die Schneidezähne erst nach den Eckzähnen nach exakt 31 Tagen (real 4. – 6. Woche) durchbrechen. Zahn aus Calcium=20: Epi.X**+Hund.Z.13#314249463201193. Fangzahn / Eckzahn: Der große, spitze Fangzahn ist im Bogen nach hinten gekrümmt und ist mit einer starken Wurzel verankert. Der paarige Eckzahn ist außer der Zahlgröße 11 als Struktur 1_5_0 adressiert. Der Eckzahn steht als Form 7 seitlich 9 neben den 12 Schneidezähnen 12_7_9. Die Anzahl von 4 Zähnen ist durch 4x „1“ enthalten. Als Form 7 ist ein Bogen 90° vorhanden. Die Zeit=12 ist enthalten, so dass die Eckzähne zeitlich noch vor den Schneidezähnen nach genau 21 Tagen durchbrechen (real 3. – 5. Woche): Epi.X**+Hund.Z.19#215012790611342. Vordere Backenzähne (Prämolare): In der Reihenfolge fehlt der 1. Prämolare P1, weil er erst als bleibender Zahn ohne Milchzahn als Platzhalter durchbricht. Die 3 Milchzähne p2, p2 und p4 brechen in der 5. - 6. Woche durch: 2. Prämolare: Epi.X**+Hund.Z.35#116721229189014; 3. Prämolare: Epi.X**+Hund.Z.36#113478972822653; 4. Prämolare: Die Zählgröße 11 ist doppelt vorhanden, so dass die 4 Zähne im Oberkiefer (mit 9 für oben) als Struktur 55 für einen stärkeren Reißzahn (Dens sectorius) adressiert werden. Epi.X**+Hund.Z.37#110411973557176;
Bleibende Gebiss 42 Zähne: Beim Zahnwechsel werden zunächst 12+4=16 Zähne als Schneide- und Eckzähne ersetzt. Die 1. Prämolare P1 hatten keinen Milchzahn als Vorgänger. Die Prämolare p2, p3 und p4 werden durch P2, P3 und P4 ersetzt, 16+4*4=32 Zähne ohne Molare. Im Oberkiefer sind je Seite 2 Molare und im Unterkiefer 3 Molare vorhanden. Unterkiefer: [(3I+1C+4P+3M=11)*2=22; Oberkiefer: [(3I+1C+4P+2M=11)*2=20; Hundegebiss enthält 42 Zähne. Im Gegensatz zum Mensch bewegt sich der Unterkiefer nur auf und ab, so dass die Nahrung nicht zermahlen wird. Der Zahnwechsel wird mit einer Zeitvorgabe adressiert. Bis zum 6. Lebensmonat sind die Milchzähne ausgefallen und das bleibende Gebiss ist vorhanden. Das sind 6 Monate * 4 Wochen/Monat* 7 Tage/Monat=168 Tage. Die Zeit=60 ist mit 170 Tagen adressiert. Die 28 Milchzähne sind vor der „Zeit“ als Quersumme 8+1+7+0+4+8=28 enthalten. Die weiteren 14 Zähne folgen nach der „Zeit“ als 4+3+2+3+1+0+1=14: Epi.X**+Hund.Z.50#817048604323101.
1. Prämolare P1: Dieser Prämolare hat im Milchgebiss keinen Vorgänger, so dass die 4 Zähne als „Null= 0“ als vierfach 0_0_0_0 zählbar sind. Mit 77 und 33 noch 2 Symmetrien vorhanden sind. Zeit=Quersumme 5+7=12, so dass der Durchbruch exakt nach 133 Tagen erfolgt (real 4.-5. Monat): Epi.X**+Hund.Z.53#770800570116133.
Unterkiefer, 1. Molar M1: Die 1. Molaren werden zunächst nur im Unterkiefer angelegt, um den gegenüber den Oberkiefer zusätzlichen Backenzahn zu bilden. Für den 1.-3. Molaren sind 3 Zeilen verfügbar, weil dann die Zeilen 83 und 97 wegen 115 strukturbedingt keine Zähne sind. Anschließend erhält dann der Oberkiefer die 2 hinteren Backenzähne (je Seite). Im Unterkiefer ist der 1. Molar M1 als 3. Zahn von hinten als Reißzahn (Dens sectorius) kräftiger ausgebildet. Hierfür ist mit 97_97 und 66_665 eine Dopplung vorhanden, die als Struktur-5 verstärkt ist: Epi.X**+Hund.Z.61#66971197075664. Unterkiefer, 2. Molar M2: Epi.X**+Hund.Z.72#567394864113264. Unterkiefer, 3. Molar M3: Epi.X**+Hund.Z.79#517119369824747.
Der Unterkieferknochen 115 wird aus 2 V-förmig verbundenen Knochenleisten gebildet. Dafür stehen 2 Zählknochen „115“ (analog Wirbel) zur Verfügung. Zunächst wird eine Unterkiefer-Gruppe 44 avisiert.Mit 3x Ziffe 9=seitlich und QS2+1=3 ist ein Dreieck als Form 7 zu bilden, der einen spitzen Winkel von 44° einschließt: Epi.X**+Hund.Z.83#92197954411507 und Epi.X**+Hund.Z.97#421159074393351. Oberkiefer: Oberkiefer, 1. Molar M1: Epi.X**+Hund.Z.104#392811829001491; Oberkiefer, 2. Molar M2: Epi.X**+Hund.Z.111#368039911857253
Der Oberkieferknochen könnte in der Parallelepisode gesucht werden, steht aber als normaler Knochen 225 zur Verfügung: Epi.X**+Hund.Z.126#324225636636151. Der Schädelknochen setzt sich mehrteilig zusammen, so dass sich mit dem Auge „5_505_55“ eine Schädelstruktur mit Augenhöhlen ergibt: Epi.X**+Hund.Z.129#316685505551589.
Die Zähne werden nochmals dargestellt, ggf. sind weitere Eigenschaften wie Zahn- und Wurzelform enthalten: Die Zeile 130 wiederholt praktisch die Zeile 13 mit den Schneidezähnen des Milchgebisses, könnte aber eine andere Bedeutung entwickeln: Epi.X**+Hund.Z.130#314249463201193. Eckzahn: Epi.X**+Hund.Z.130#311850612337061. Prämolare: Epi.X**+Hund.Z.133#307161129444775. Molare: Epi.X**+Hund.Z.134#304868882210112.
Durch die Öffnung „Foramen magnum“ 55009_22 im Bereich der hinteren Schädelgrube (Fossa cranii posterior) wird die Medulla oblongata als Teil des Gehirns geführt, um mit dem Rückenmark in Verbindung zu treten. Die Öffnung ist bei normal großen Rassen nicht rund, sondern queroval geformt. Als Gehirnbezug ist die Zeit=24 verbunden, wobei die Quersumme 1+2+4= 7 den Nerv aderssiert: Epi.X**+Hund.Z.328#124550092122424.
Wirbelsäule (Columna vertrebralis) #115
Halswirbelsäule (Vertebrae cervicales) 7 Wirbel: 1. Halswirbel (Atlas): Am Atlas ist kein Wirbelkörper, sondern ein ventraler „Wirbelbogen“ vorhanden. Der Wirbel setzt sich embryonal aus 1 paarigen Dorsalbogen (Arcus dorsalis) und 1 Zentralbogen (Arcus ventralis) zusammen, womit das Wirbelloch (Fovea dentis) umschlossen wird. Der 2. Halswirbel führt hierin den Zapfen als Zapfengelenk (Articulatio trochoidea): Epi.X**+Hund.Z.353#115729264068428 und Epi.X**+Hund.Zeile.354#115402345243376. 2. Halswirbel (Axis): Zapfen „1“ enthalten: Epi.X**+Hund.Z.355#115077268214521. 3. Halswirbel: Zeile 459, 4 Halswirbel: Zeile 521, 5. Halswirbel: Zeile 562, 6. Halswirbel: Zeile 668, 7. Halswirbel: Epi.X**+Hund.Z.681#599888843115346. Als Abweichungen können den Brustwirbeln ein oder beide Rippen fehlen, die dann am letzten Halswirbel oder am ersten Lendenwirbel als unnormal vorhanden sein können.
Brustwirbelsäule (Vertebrae thoracicae) 13 Wirbel: 1. Brustwirbel: Epi.X**+Hund.Z.693#589501157520275, 2. Brustwirbel: Zeile 695, 3. Brustwirbel: Zeile 703, 4. Brustwirbel: Zeile 728, 5. Brustwirbel: Zeile 830, 6. Brustwirbel: Zeile 970, 7. Brustwirbel: Zeile 1096, 8. Brustwirbel: Zeile 1122, 9. Brustwirbel: Zeile 1444, 10. Brustwirbel: Zeile 1453, 11. Brustwirbel: Zeile 1566, 12. Brustwirbel: Zeile 1636, 13. Brustwirbel: Epi.X**+Hund.Z.1694#241159564440112.
Lendenwirbelsäule (Vertebrae lumbales) 7 Wirbel: 1. Lendenwirbel: Epi.X**+Hund.Z.1788#2284811533342, 2. Lendenwirbel: Zeile 1792, 3. Lendenwirbel: Zeile 1831, 4. Lendenwirbel: Zeile 1881, 5. Lendenwirbel: Zeile 1931, 6. Lendenwirbel: Zeile 2043, 7. Lendenwirbel: Epi.X**+Hund.Z.2081#196311533955574.
Als Abweichung können der letzte Lendenwirbel oder der erste Kreuzwirbel als sogenannter Übergangswirbel Merkmale des anderen Wirbelabschnitts aufweisen.
Kreuzbein (Os sacrum) 3 Wirbel, die nach 18 -24 Monaten als Knochen verschmelzen:
Schwanzwirbelsäule (Vertebrae caudales) 20-23 Wirbel:
1. Schwanzwirbel: Es wird eine Wirbelfolge 555 avisiert. Die Zählung 1 ist mit 5_1_5 als Struktur 55 aufgerufen, wobei die Suche bei einem Null-Signal „55_00“ mit dem 23. Schwanzwirbel endet. Weil die #1155 aber bereits ab dem 20. Schwanzwirbel vorliegt, reicht diese Anzahl bereits aus. Epi.X**+Hund.Z.2627#155509821911515. Ein guter Kompromiss sind 21 Schwanzwirbel. 8. Schwanzwirbel: Der Zeileninhalt läuft im Countdown auf die Serie #115 auf und liefert dann mit jeder Zeile weitere Schwanzwirbel: Epi.X**+Hund.Z.3522#11599213576421, 23. Schwanzwirbel: Epi.X**+Hund.Z.3537#115500226791504.
Teil A: Vordergliedmaßen
1.) Schulterblatt (Scapula): Das Schlüsselbein (Clavicula), und das Rabenschnabelbein (Os coracoideum) sind bei den Säugetieren stark zurückgebildet, so dass nur das Schulterblatt als Knochen #225 gezählt wird. Aufgrund der fehlenden beiden Knochen liegt das Schlüsselbein als 225 an den Brustwirbeln unreal spät an. Weil das Schulterblatt bereits neben der Halswirbelsäule liegt, soll es direkt schon vor dem 7. Halswirbel mitgezählt werden, in dem der Knochen ab dem Oberarmgelenk rückwärts gescannt wird. Evolutionär wird das rudimentäre Schlüsselbein als eine funktionslose Sehne 101 betrachtet, die in einem Muskel 55 liegt. Rudimentäres Schlüsselbein: Epi.X**+Hund.Z.652#62657101558520. Das Rabenschnabelbein hat sich als Rabenschnabelfortsatz (Processus coracoideus) 522 am unteren Ende des Schulterblattes zurückgebildet: Epi.X**+Hund.Z.675#605221188387482. Schulterblatt 225: Epi.X**+Hund.Z.670#609737764420225. Erst im Nachgang folgt dann der Schulterblattknorpel 22_33: Epi.X**+Hund.Z.701#582773612213339, sowie die Schulterblattgräte 11: Der Sieg der Biologie wird wegen des Kunstgriffs als 64 gefeiert: Epi.X**+Hund.Z.705#579467095264611. Schultergelenk 77077: Epi.X**+Hund.Z.711#574577077583053
2.) Oberarmknochen (Humerus) 225: Epi.X**+Hund.Z.807#506225901067597. Ellenbogengelenk 707: Epi.X**+Hund.Z.814#501872607078072.
3.) Unterarmknochen aus Speiche (Radius) 225: Epi.X**+Hund.Z.847#482319128880225 und Elle (Ulna) 225: Epi.X**+Hund.Z.848#481750356322583.
4.) Handwurzelknochen: 7 Knochen in 2 Form-Reihen 9_7_9. Erste Knochenreihe: Epi.X**+Hund.Z.859#475581259792259. Zweite Knochenreihe: Die Zahl 75 wird jetzt in einer Gruppe 44 gespiegelt 4_57_4. Mit der Form 77 liegen oben 3 und unten 4 Knochen, wobei die Ziffer 2=paarig für beide Vorderbeine gilt. Obere (proximale) Reihe [Os carpi radiale, Os carpi ulnare und das seitlich (lateral) herausragende Os carpi accessorium]. Untere (distale) Reihe [Ossa carpalia I bis IV]: Epi.X**+Hund.Z.893#457474022577324.
5.) Mittelhandknochen (Ossa metacarpalia I bis V): Mittelhandknochen 2, 3, und 4: Es bildet sich eine 4er Gruppe 4_225 ohne die gesonderte Daumenseite: Epi.X**+Hund.Z.922#443084926422506. Erster Mittelhandknochen 2225. Mit 8 als Extra in 282 ergänzt der Knochen die 4er Gruppe mit 9_5 seitlich als Form 7: Epi.X**+Hund.Z.954#428222538953407.
6.) Zehenknochen der Hand (Ossa digitorum manus):
An den Vorderpfoten haben die Hunde 5 Zehen. Die Daumenkralle liegt wie beim Menschen innenseitig. Die Daumenkralle ist kürzer und erreicht beim Zehengänger nicht den Boden (Kralle nutzt sich nicht ab). Die Hinterpfoten haben dagegen nur 4 Zehen! Die Vorderpfoten sind auch größer und runder. An den Zehen sitzen Ballen auf denen der Hund läuft. Bei den Zehenknochen reihen sich 3 Zehenglieder (Phalanges proximalis, media und distalis), wobei am Daumen (Pollex / Digitus primus manus) das Mittelglied fehlt. Das Endglied (Phalanx distalis) wird als Krallenbein bezeichnet. Die 4 dreigliedrigen Zehen bilden für jede Reihe eine Zeile, der Daumen erhält für seine 2 Glieder 2 gesonderte Zeilen. Phalanx proximalis 2 bis 5, 4 Glieder 4_225: Epi.X**+Hund.Z.1094#37342257967235. Phalanx media 2 bis 5, 4 Glieder 4_225: Epi.X**+Hund.Z.1153#354314225638812. Phalanx proximalis 1, 1 Glied 1_2255: Epi.X**+Hund.Z.1160#352176122553061.Phalanx distalis 2 bis 5, 4 Glieder 4_225: Epi.X**+Hund.Z.1260#324225636636151. Phalanx distalis 1, 1 Glied 225: Epi.X**+Hund.Z.1287#317423700203225.
Das Hornwachstum 33 an Krallen und Ballen wird als Hautelement 33 für 1+4=5 Zehen avisiert: Epi.X**+Hund.Z.1329#307392251438337. Für die Krallen 11 wird eine Krallengruppe 9_444 als Form 77 gebildet. Das Horn ist als Schwefel=16 enthalten: Epi.X**+Hund.Z.1330#307161129444775.
Sesambeine (Ossa sesamoidea) der Hand: 1.) Os sesamoideum m. abductoris digiti I liegt medial am Os carpale I: 2.) Ossa sesamoidea proximalia liegt palmar am Zehengrundgelenk; 3.) Sesamoideum distale liegt palmar am Zehenendgelenk; 4.) Sesamoideum dorsale liegt dorsal am Zehenmittelgelenk:
Teil B: Hintergliedmaßen
1.) Beckengürtel (Cingulum membri pelvini): Der Beckengürtel wird als Knochenring aus den beiden Hüftbeinen (Ossa coxae) gebildet. Jedes Hüftbein ist aus 3 Einzelknochen zusammengewachsen: Das Darmbein (Os ilium) ist nach vorn und rückenseitig (kraniodorsal) ausgerichtet. Das Schambein (Os pubis) ist nach vorn und bauchseitig (kranioventral) ausgerichtet. Das Sitzbein (Os ischii) ist schwanzwärts und bauchseitig (kaudoventral) ausgerichtet. Das Darmbein besitzt seitlich einen Darmbeinflügel (Ala ossis ilii). In die Lücke zwischen den beiden Darmbeinflügeln gliedert sich das Kreuzbein (Os sacrum) der Wirbelsäule über ein wenig bewegliches Kreuzdarmbeingelenk bzw. Iliosakralgelenk (Articulatio sacroiliaca) ein. Die Knochenzählung „#225“ wird am vorletzten (6.) Lendenwirbel begonnen, weil die Darmbeinflügel (Ala ossis ilii) im Scann vor den Kreuzwirbeln beginnt. Zur Orientierung dienen die Gelenke. Der Unterschenkel ist nicht als Dopplung von kräftigem Schienbein (Tibia) und schwächeren Wadenbein (Fibula) zu erwarten, weil die Knochen beim Hund voll ausgebildet sind und dann getrennte Zeilen benötigen.
Darmbein 2255: Epi.X**+Hund.Z.2014#202842255293719. Kreuzbein-Darmbein-Gelenk (Iliosakralgelenk) 909 mit seitlich=9: Die beiden Gelenkflächen (Facies auriculares) sind jeweils mit einem Knorpel 33 überzogen: Epi.X**+Hund.Z.2120#192700142529033; Epi.X**+Hund.Z.2121#192609289090783; Epi.X**+Hund.Z.2123#192427838983302. Hüftgelenk mit der Beckenpfanne (Acetabulum): Die 3 Beckenknochen (Darmbein, Schambein, Sitzbein) treffen in einer Y-Naht zusammen. Beim Rind wurde die ringförmige Wulst mit einer eigenen Knochenbildung „225“ kombiniert. Dies ist beim Hund mit „5111“ ähnlich, weil die 111 zwar stärker wirkt, jedoch mit der Struktur-5 auf der linken Seite (statt rechts) wieder markant abgeschwächt wird. Epi.X**+Hund.Z.2340#174583035111774.
Schambeinfuge (Symphysis pubica): Die beiden Beckenhälften werden am Schambein (Ossa pubis) durch Faserknorpel (Symphyse) 333 als Knochenform 7_222_7 verbunden. Darin in mit 77 ein Universalwirkstoff enthalten, der Knorpel und Bänder während der Schwangerschaft [Östrogene, Gestagene und Humanes Choriongonadotropin] am Symphysen-Spalt dehnt: Epi.X**+Hund.Z.2372#172227783373335. Dehnung der Schambeinfuge:
Dieses wird durch einen Abbau von Calcium=20 angezeigt, indem 20_5 anfangs stabil ist, dann aber ohne Struktur-5 mit der Zeit=24 nach links wandert: Epi.X**+Hund.Z.2373#172155205293532; Epi.X**+Hund.Z.2373#172155205293532; Epi.X**+Hund.Z.2374#172155205293532; Epi.X**+Hund.Z.2375#172010232489074. Die Schwangerschaft wird mit dem Wirkstoff 88 und „weiblich“ mit Östrogen=66 adressiert, wobei die „33“ sich nicht auf „männlich“, sondern auf den Knorpelabbau bezieht. Die Biologie feiert diesen Kunstgriff mit „64“: Epi.X**+Hund.Z.2374#171648866454433. Das Foramen obturatum ist eine paarige Öffnung im Becken zwischen dem Schambein (Os pubis) und dem Sitzbein (Os ischii), sofern für innere Organe nachfolgend keine Nutzung verbleibt: Epi.X**+Hund.Z.2384#17136086500065. Sitzbein (Os ischii) 225: Epi.X**+Hund.Z.2417#169021225552979
2.) Oberschenkelknochen (Os femoris / Femur):
Der Oberschenkelknochen (Femur) 44_225 wird zunächst nur als Gruppe 44 avisiert, zu der die Kniescheibe (Patella) und in der Kniekehle 2 Sesambeine gehören: Epi.X**+Hund.Z.2532#161344511122255. Kugelkopf am Hüftgelenk 22_05 als seitlich herausgestellte Struktur 9_5: Epi.X**+Hund.Z.2582#58220101534295. Gelenkknorpel: Epi.X**+Hund.Z.2587#15791430311617. Sehne 11 des Muskels „Musculus gastrocnemius“: Epi.X**+Hund.Z.2795#146162541023811. An der Kniekehle im Ursprung des Muskels werden 2 Sesambeine 22 herausgehoben 9 als Form 7 und als Extra 8: Epi.X**+Hund.Z.2797#146058027229728. Kniestrecker-Muskel „Musculus quadriceps“ 55_55: Epi.X**+Hund.Z.2805#145589558860139. Kniescheibe (Patella) 225: Oberseitig sind mit 69 die Quadriceps-Sehne und unterseitig 6_2_9 das Kniescheibenband angeschlossen: Epi.X**+Hund.Z.2807#145537692255629. Kniescheibengelenk (Articulatio femoropatellaris) 505: Epi.X**+Hund.Z.2816#145072550483505. Im Zeilenlauf #44 können komplexe Gruppen dargestellt werden. Kniekehlengelenk (Articulatio femorotibialis) 202: Epi.X**+Hund.Z.2833#144202012764402.
3.) Unterschenkelknochen: Das Wadenbein (Fibula) bildet mit dem Schienbein (Tibia) das Unterschenkelskelett. Das Wadenbein ist über den gesamten Unterschenkel ausgebildet, so dass 2 getrennte Zeilen vorliegen. Schienbein (Tibia) 225: Das Schienbein wird als Gruppe 44 gebildet, um mit dem Wadenbein eine Einheit zu bilden: Epi.X**+Hund.Z.2868#142442225300401. Wadenbein (Fibula) 225: Epi.X**+Hund.Z.2886#141553812252789.
4.) Hinterfußwurzelknochen bzw. Tarsalknochen (Tarsus): Der Tarsus als Verbindung zwischen dem Unterschenkel (Crus) und den Hintermittelfußknochen (Ossa metatarsalia / Metatarsus) setzt sich bei den Haussäugetieren aus bis zu 3 Knochenreihen mit 7 Knochen zusammen, wobei in der Literatur bis 14 Knochen beschrieben werden. Am Tarsalgelenk ist die Lage vergleichsweise unübersichtlich, so dass die Knochen teilweise einzeln in Zeilen erfasst werden.
4.1) Obere (proximale / krurale) Reihe: Fersenbein (Calcaneus) 225: Epi.X**+Hund.Z.3089#132251311803674; Sprungbein (Talus) 225: Epi.X**+Hund.Z.3329#122716822517738
4.2) Mittlere (intertarsale) Reihe: Os tarsi centrale 225: Epi.X**+Hund.Z.3335#122569547603225
4.3) Untere (distale /metatarsale) Reihe: Os tarsale (Nr. 1-5) 225: Epi.X**+Hund.Z.3334#122532784091647; Os metatarsale (Nr. 2-5) 225 als 4 längliche Röhrenknochen 4_4004: Epi.X**+Hund.Z.3364#121440042259676; Os metatarsale (Nr. 1) 225 als Rudiment oder vollständig als verkürzter Knochen: Epi.X**+Hund.Z.3441#118722552212017.
5.) Mittelfußknochen (Ossa metatarsalia): Beim Hund als Fleischfresser sind wie beim Menschen 5 Mittelfußknochen (Os metatarsale I-V) vorhanden. Der Os metatarsale I ist beim Hund unterschiedlich lang und bildet bei manchen Rassen zehentragend eine Afterkralle. Weil es im Unterschied zum Vorderbein nur 4 Krallenbeine gibt, liegt ein Problem vor. Um dem Mittelfußknochen eine Länge zu geben, wird eine Anfangsaktion gestartet. Weil ab dem 8. Schwanzwirbel gerade eine Serie #115 anläuft, die mit Wirbeln besetzt ist, kann in der Ziffernfolge die Zeile als Sprungmarke zur Zeile 3786 gelesen werden, um gelöst vom Schwanz im Körper zu bleiben. Es wird dennoch 1 kurzer Mittelfußknochen 225 angelegt, dem eine verhornte Kralle 33 als Afterkralle bzw. Wolfskralle folgt: Epi.X**+Hund.Z.3517#116157037862255 und Epi.X**+Hund.Z.3564.#114625225073387. Es werden nunmehr die 5 Mittelfußknochen als angelegt, die auch bekannt sind. Im Röntgenbild sind aber nur 4 lange Knochen zu sehen, so dass offenbar der Knochen für die Afterkralle mitgezählt wird. Die Anzahl von 5 Knochen müsste dabei als 22_5_22 gelesen werden: Epi.X**+Hund.Z.3703#110322522862963. Zur Kontrolle können die Mittelfußknochen nur vorliegen, wenn an deren Ende mehrere Sesambeine nachzuweisen sind. Sesambeine (inoffiziell aus Abbildungen entnommen): 1.) Am unteren (distalen) Ende eines Mittelfußknochens das Sesamoideum dorsale. Weil mit #111 eine Sehnenstrecke anliegt, ist 1 Sesambein 22_1 funktionell sinnvoll: Epi.X**+Hund.Z.3679#111042213145298. 2.) Palmar am Zehenendgelenk, d.h. am unteren Ende des Mittelfußknochens liegen die Ossa sesamoideum distale 20255: Epi.X**+Hund.Z.3735#109377323202557. Das Zehenendgelenk folgt mit 404 für 4 Zehen: Epi.X**+Hund.Z.3738#109289540439152.
6.) Zehenknochen des Fußes Hand (Ossa digitorum pedis): Die 4 Zehenknochen liegen am 2. bis 5. Mittelfußknochen und bestehen jeweils aus 3 Zehengliedern (Phalanges proximalis, media und distalis). Das Endglied (Phalanx distalis) wird als Krallenbein bezeichnet. Es wird zunächst eine Formgruppe 3_44 mit 3 Gliedern für 4 Zehenknochen 7_4_7 gebildet, die mit „33“ verhornt ist: Epi.X**+Hund.Z.3992#102335747034457. Die Formgruppe mit Gelenken „0“ wird als Zehenknochen 225 paarig 4343 für 4 Knochen mit je 3 Gliedern 1 avisiert, die am Ende=99 eine Hornkralle als Schwefel=16 tragen: Epi.X**+Hund.Z.3995#102258899164343.
6.1) Phalanx proximalis: Epi.X**+Hund.Z.3995#978501322542636.
6.2) Phalanx media: Epi.X**+Hund.Z.4308#948292251999885.
6.3) Phalanx distalis: Epi.X**+Hund.Z.4330#943474138941225.
Im Unterschied zum Menschen beim Fingernage liegen in der Kralle Nervenbahnen und Blutgefäße, so dass die Krallen nicht kurz geschnitten werden dürfen. Es wird eine Krallen-Gruppe 44_9 gebildet, die Nerven=7, Vene=8 und Arterie=9 als Hautanhangsgebilde 33 enthält: Epi.X**+Hund.Z.4376#933556449180874. Es folgt die verhornte Kralle 33_225. Mit „64“ feiert die Biologie den Kunstgriff, die Füße ähnlich zum Vorderbein zu gestalten: Epi.X**+Hund.Z.4401#928253356422518.
Darm: Der Zeilenlauf umrundet das Körperende, so dass der After als Wendestelle ermittelt wird.
Rectum 808: Am Ende des Mastdarms (Intestinum rectum) bzw. des Dickdarms befindet sich beidseitig ein Analbeutel, so dass auch im Zusammenhang mit dem Schließmuskel eine After-Gruppe 44 gebildet wird. Die Zeit=24 ist zur Funktion enthalten: Epi.X**+Hund.Z.3833#106580824983446. Die paarigen Analbeutel werden als Struktur 55_55 angelegt: Epi.X**+Hund.Z.3834#106553026124557. In der Wand des Analbeutels befinden sich Analbeutel-Drüsen 88, die u.a. auch Duftstoffe 77 produzieren. Das Sekret wird dem Kot beigemischt. Epi.X**+Hund.Z.3836#106497471887787. Die Analbeutel besitzen zum Darm hin jeweils einen Analbeutel-Gang 555_0_1: Epi.X**+Hund.Z.3838#106441975550169. Ausscheidungsöffnung des Darms (Anus) 808 mit dem Sekret 88 der beiden Analbeutel: Epi.X**+Hund.Z.3841#106358839406808. Beim Hund sind die weiblichen Geschlechtsorgane extrem weit bis in Bauchnähe entfernt, so dass die Harnröhre 303 zunächst noch für beide Geschlechter adressiert wird, dann aber als Strecke für männliches Hormon 33_0 mit Null und männlich=2 blockiert ist als Ende=99: Epi.X**+Hund.Z.3843#106303487421689 und Epi.X**+Hund.Z.3844#106275833028499. Die Vula als Form 777 wird nur bei Weiblichkeit=66 gebildet. Mit 2_777 zeigt sich die Vulva als Besonderheit mit gekreuzten Falten, wobei die Querfalte mittig im Winkel von 45° jeweils seitlich ansteigt. Die Funktion der Vulva ist mit Zeit=60 adressiert: Epi.X**+Hund.Z.3853#106027589452777. Im Wechsel von der äußeren Form nach innen wird im Körper die Vagina 60000 adressiert: Epi.X**+Hund.Z.3854#106000078402063. Dadurch kann die weibliche Harnröhre (Urethra feminina) gefunden werden, die im Querschnitt größer als die männliche Harnröhre (Urethra masculina) ist, die an der Eichel des Penis mündet. Das Ende der weiblichen Harnröhre (Röhrenform „303“) ist nicht mehr vorherrschend mit Bindegewebe umhüllt, so dass statt 303 ein anderes Symbol benötigt wird. Der Harnröhre liegt der Muskel „Musculus urethralis“ 40_5555 _4 auf, so dass die Ziffer 4=räumlich verwendet wird: Epi.X**+Hund.Z.3916#104321834055554. Der Harnröhrenausgang (Ostium urethrae externum) liegt auf einer hügligen Schleimhautwulst und ist bei Hund und Katze schlitzförmig bis oval geformt. Die Schlitzform 1 auf der Schleimhaut 3, dem Hügel 400_4 und dem Muskel 55: Ostium urethrae externum: Epi.X**+Hund.Z.3928#104003131914855. Vom Übergang der Vagina zum Vestibulum vaginae liegt nach dem „runden Zirkelweg“ wieder die Vula: Epi.X**+Hund.Z.3941#103660061446727. Zwischen den Hinterbeinen ist abweichend vom Pferd kein Euter zu finden, denn die 8 -10 Zitzen (in 2 Reihen) der Rüden und Hündinnen liegen weiter vorn auf der Bauchseite, beim Rüden etwas kleiner. Die männliche Harnröhre (Urethra masculina) 303 ist auf dem Weg zum Penis: Epi.X**+Hund.Z.4097#997130344548573. Paariger 2 Hodensack 300, herabhängend=99 und Gefäße=99: Epi.X**+Hund.Z.41147#993009971223992. Penisschwellung: räumlich 444, mit Gefäßen Venen 88, mit der Zeit=60 über 30 min: Epi.X**+Hund.Z.4133#988444960468305. Der Penis beim Hund erreicht den gleichen Zeilenbereich wie beim Pferd. Eichel (Glans penis) mit dem Harnröhrenausgang (Ostium urethrae externum) 303: Epi.X**+Hund.Z.4148#984870545230353. Der Hund bildet in beiden Reihen zusammen je nach Lesart 10 oder 8 Zitzen 3_1_3 auf der Haut 33 aus: Epi.X**+Hund.Z.4341#941083395903134. Bei der Hündin=66 entwickelt sich mehr Volumen 500: Epi.X**+Hund.Z.4342#940866656290996 und Epi.X**+Hund.Z.4343#94065001648987.
Herz
Das Herz könnte sich über beide Episoden entwickeln, indem diese im Zeilenlauf mit dem Beginn der Periode „55“ die Herzmuskel-Wand bilden. Hunde sind nur kleine Geschöpfe, so dass das Herz allein in der Leitepisode Epi.X**+Hund entsteht. Im Zeilenlauf entstehen die 4 Herzklappen als eine Reihenfolge, in der sie auch real auf einer horizontalen Linie liegen.
Sinus venarum cavarum: In Höhe des 4. Rippenpaares münden die vordere Hohlvene (Vena cava cranialis) 85 und die hintere Hohlvene (Vena cava caudalis) 58 in eine Ausbuchtung (Sinus venarum cavarum) 600 des rechten Vorhofs (Atrium cordis dextrum). Mit rechts=2 bzw. Blut Eisen=26. Das sauerstoffarme Blut wird zum Herz transportiert: Epi.X**+Hund.Z.724#564260085858495. Zur Abgrenzung vom eigentlich rechten Vorhof ist eine Leistenstruktur (Crista terminales) 22_33 vorhanden und eine Muskelwulst 55_9 ragt zwischen die beiden Venen 8 hinein: Epi.X**+Hund.Z.730#559622331728151.
Der Herzbeutel (Pericardium) nimmt die Ursprungs- bzw. Mündungsabschnitte der Aorta, des Truncus pulmonalis, der Vena cava cranialis und caudalis und der Venae pulmonales auf. Der Herzbeutel besteht aus 3 Hautschichten (der Pleura pericardiaca, dem Pericardium fibrosum, der Lamina parietalis des Pericardium serosum). Auf der Suche nach den Herzklappen werden 3 Hautschichten „33“ gesucht: 1.) Der Herzbeutel 0_33_0 mit den Gefäßen (Vene 8/ Arterie 9) und Rand=9 sowie Form=7 beginnt: Epi.X**+Hund.Z.732#558093308963867. 2.) Epi.X**+Hund.Z.733#557331926550546. 3.) Epi.X**+Hund.Z.753#542528953733799.
Rechter Vorhof (Atrium cordis dextrum) 0_0_0_0_2: Epi.X**+Hund.Z.756#540376061060252. Zwischen dem rechten Vorhof und der rechten Herzkammer liegt die Trikuspidalklappe. Die Herzklappe verhindert einen systolischen Rückfluss von Blut aus der rechten Herzkammer in den rechten Vorhof bei der Kontraktion des Herzens. Das Zurückschlagen dieser Segelklappe wird durch gespannte Sehnenfäden (Chordae tendineae) verhindert. Beim Menschen sind die Sehnenfäden mit 3 Papillarmuskeln (Mm. papillares anterior, posterior und septalis) an der Herzkammerwand befestigt. Die Trikuspidalklappe besteht aus 3 bindegewebigen Segeln (Cuspis ventralis, Cuspis dorsalis, Cuspis septalis). Der Zeilenlauf ist dramatisch unpassend, weil keine geöffnete Klappe erkennbar ist. Daher wird der Öffnungsmechanismus über die Änderung der Form 07 zu 70 und mit 2222_14_2 zu 4_0_1=offen dargestellt, wobei mit „3“ die Segel und „11“ die Sehnenfäden adressiert sind. Nachfolgend kann sich somit eine geschlossene Klappe alternativ auch öffnen: Epi.X**+Hund.Z.757#539662222142074; Epi.X**+Hund.Z.758#538950266703892 Epi.X**+Hund.Z.759#53824018730112. Die Klappenöffnung „7_0“ wird mit „12“ statt „24“ als eine halbe Zeitperiode (AUF/ZU) verknüpft. Epi.X**+Hund.Z.761#53682562701912. Geschlossene Trikuspidalklappe: Es wird eine Klappengruppe 44 gebildet, der dann mit 7_7_7 die 3 Segel als Form „7“ aus Bindegewebe 3_3 folgen: Epi.X**+Hund.Z.762#536121131445604 und Epi.X**+Hund.Z.764#534717672986323. Das „sauerstoffarme“ Blut wird durch die Lungenarterie zur Lunge transportiert, in dem es durch die Pulmonalklappe ausströmt. Dieser Logik kann der BiXnom-Code nicht folgen, so dass es bei einem sauerstoffarmen Gefäß bei der Bezeichnung Vene „8“ bleibt. Weil es 2 Lungenflügel sind gelangt das Blut vor der Verzweigung auf die beiden Lungenarterien (Arteriae pulmonales) in den entspringenden Gefäßstamm Truncus pulmonalis „0_88“. Das Blut ist als Verzweigungs-Doppel 26_26 enthalten: Epi.X**+Hund.Z.767#532626208815581. In Herzmitte ist die Aortenklappe und somit die Aorta als Arterie mit dem ausströmenden sauerstoffreichen Blut direkt benachbart. Aorta „099“: Epi.X**+Hund.Z.769#531240965099545. In die beiden Gefäße werden nunmehr die Taschenklappen eingebaut. Pulmonalklappe: In Y-Form liegen 3 halbmondförmige, kleine Klappen (Valvulae) mit jeweils mit einer nestartigen Vertiefung zusammen. Die Form „77“ ist nur in der Zeilennummer der Hautstruktur 33 enthalten, mit Knötchen 7_55_7 und einer räumlichen Nestform „040“. Das Zeitmanagement ist als Halbzeit=12 und als Quersumme 8+1+2+1+3+3+6=24 enthalten: Epi.X**+Hund.Z.771#529862908121336 und Epi.X**+Hund.Z.772#529176557204081. Die Taschenklappe 09 wird mit 3 Hautschlitzen 3_1 adressiert. 1. Schlitz: Epi.X**+Hund.Z.774#527809175919316. 2. und 3. Schlitz: Epi.X**+Hund.Z.775#527128131821355. Geöffnete Klappe 13_0 als Form 777 in der Zeilennummer und Blutstrom Eisen=26: Epi.X**+Hund.Z.777#525771302653218.
Die Herzkammerwand als Muskel 55_9 seitlich trennt die linke und rechte Herzkammer: Epi.X**+Hund.Z.778#525095504063689. Die Aortenklappe ist ebenfalls eine baugleiche Taschenklappe. 1. Schlitz: „31“ als Form 7 in der linken „1“ Herzkammer. Die Ziffer 2 dient als Markierung und zählt nicht als „rechts=2“: Epi.X**+Hund.Z.783#521742403782312. 2. und 3. Schlitz: 131_3 und Blutstrom Eisen=26: Epi.X**+Hund.Z.785#520413123772676. Unmittelbar vor der Aortenöffnung liegt als Erweiterung der linken Herzkammer in der Kontraktionsphase der Aortenvorhof (Vestibulum aortae) als arterielles Volumen 090905 mit der aufsteigenden Aorta 999_5: Epi.X**+Hund.Z.787#519090599951144. Das sauerstoffreiche Blut der Aorta ist zuvor über die linke Herzkammer, die Mitralklappe und den linken Vorhof (Atrium cordis sinistrum) aus den sauerstoffreichen Lungenvenen zugeflossen. Das Dach des linken Vorhofs wird als Herzmuskelwand 555 adressiert, um die von der Lunge kommenden sauerstoffreichen Lungenvenen (Venae pulmonales) im Vorhof aufzunehmen. Die Öffnungen werden als Ostia venarum pulmonarum bezeichnet. Weil die Lunge im Bixnom-Code ignoriert wird, ist unverändert eine Vene=8 vorhanden, was jetzt zufällig wieder übereinstimmend ist mit „Lungenvene“. Für beide Gefäße 8_0 ist eine Zeile vorhanden: Epi.X**+Hund.Z.788#518431855534962, Epi.X**+Hund.Z.789#517774780939861, Epi.X**+Hund.Z.791#516465615880595. Das sauerstoffreiche Blut wird durch die Mitralklappe in die linke Herzkammer geleitet. Die Mitralklappe (Valva atrioventricularis sinistra) ist eine Segelklappe, die nur 2 Segel (Bikuspidalklappe) enthält. Während der „Pump – Phase“ des Herzens (Systole) ist die Klappe vollständig geschlossen, um den Rückfluss in den linken Vorhof zu verhindert. Die beiden Segel der Klappe werden erneut mit Form 7_7 als Platzhalter für die noch fehlenden Sehnenfäden (Chordae tendineae) codiert. Die Klappe wird mit Blut Eisen=26 adressiert, womit ab der Klappe offenbar arterielles Blut 9_00 angerechnet wird: Epi.X**+Hund.Z.797#512577543490026. Mitralklappe: Die beiden Segel sind als 74_74 jeweils mit der Quersumme 7+4=11 als Fasern adressiert. In der Mitte ergibt 7+5=12 die Halbzeit für das Zeitmanagement. An den Rändern der sich schließenden beiden Segel befinden sich mit 3_1 kleine dreieckige Spalten am Rand 9. Um diese zu schließen, sind links und rechts kleine bandartige Segel (Cuspis commissuralis) vorhanden, die mit der Quersumme 11 enthalten sind. Mit diesen beiden Segel und den beiden jeweils dreiteiligen Klappensegeln besteht die Mitralklappe aus 8 Teilen (ohne Sehnenfäden): Epi.X**+Hund.Z.803#508747574298319. Das Volumen der linken Herzkammer 555 mit der Herzspitze 030 wird durch den weiteren Zeilenlauf aufgezogen: Epi.X**+Hund.Z.858#476135550304837. Im Zeilenlauf noch vor dem 6. Brustwirbel kann der Herzbeutel (Pericardium) 500900 als Form 7 verschlossen werden: Epi.X**+Hund.Z.891#458500900293547.
Die Sehnenfäden (Chordae tendineae) fehlen und müssen im Zeilenrücklauf auf dem Wege zum Gehirn in die Herzstruktur eingepasst werden, was bei kleinen Hunden ein Findungsproblem aufwerfen könnte. Die Sehnenfäden sind an Vorstülpungen der Herzmuskulatur (Papillarmuskel) „5“ befestigt. Der bisherige Form-7-Platzhalter in der Klappe wird mit 7_11 auf eine Faser umgeschrieben. Im Rücklauf werden die Sehnenfäden für die beiden Sehnenfaserstränge der Mitralklappe (Bikuspidalklappe / Valva atrioventricularis sinistra) eingebaut als Gruppe 44 mit den Sehnenfadenstängen 10_10 an 2 Segeln. Epi.X**+Hund.Z.4043#101044843473052. Sehnenfaserstränge der Trikuspidalklappe (Valva atrioventricularis dextra) mit 3 Sehnenfasersträngen 101010: Epi.X**+Hund.Z.4044#101019857112154. Im Zeilenlauf folgt mit 1_00_9 ein Fadenabbau über die Zeit=60: Epi.X**+Hund.Z.4048#100920035118960. Fadenende 5_11_0: Epi.X**+Hund.Z.4049#100895110437528. Mit 28 Monate/12= 2,33 Jahren und früher besitzen manche kleine Rassen ein genetisch eingebautes Klappenproblem. Ansonsten kann es bei kleinen Rassen ab ca. 7,5 Jahren problematisch werden. Die Sehnenfäden spannen sich im Rhythmus des Herzschlags von im Mittel 100 Schlägen/min ***___ Der rote Faden ist auf das Knäuel gewickelt, die Katze spielt noch damit!
BiXnom_Hund_dat30.10.2021
Katzen (Felidae)
Zu den Säugetieren (Mammalia) gehört die Ordnung der Raubtiere (Carnivora), zu der die Hundeartigen (Caniformia) und die Katzenartigen (Feliformia) gehören. Zu den Katzenartigen gehören die Katzen, bei denen Großkatzen (z.B. Löwe, Tiger und Leopard) und Kleinkatzen (z.B. Wildkatze, Luchs, Puma, Gebhard) unterschieden werden.
Der Ansatz der BiXnom-Biokugel in der 3. Stufe in Kubik (***) auf die BiXnom-Schwelle in Bezug auf die Basisfallhöhe der Fische führt erwartungsgemäß zu den Katzen. Die Katze ist minimal tiefer als der Hund in den mathematischen BiXnom-Keller gestürzt, so dass die verheizbaren Episodenzeiten bis zur Kellersohle schrumpfen. Der Hund konnte die Wiederkäuer-Lücke im Gebiss schließen, die Katze muss nunmehr den Kopf insgesamt kürzen und abrunden. Die Katzen besitzen daher meist kürzere und stärkere Schädel als der Hund. Die Eckzähne der Katze sind stärker entwickelt und es sind weniger Backenzähne vorhanden. Insbesondere beim Skelett sind aufgrund des ähnlichen Energieniveaus keine wesentlichen Unterschiede mehr vorhanden. Unvergleichbar sind jedoch sämtliche Zahlenbilder - Hund und Katze sind jeweils eigene Kreationen.
Schurhaare (Vibrissae / Tasthaare):
Die Vibrissen sind steife, lange Haare „1“ mit einer speziellen Haarwurzel (Quersumme. '=0_8+4+7+9+4+1_0=33=Haut). Druckveränderungen werden am Haarbalg (Follikel) über den Tastsinn registriert. Die Verwirbelungen der Luft durch die Bewegungen des Beutetiers werden wahrgenommen (zeitgesteuert „24“). Außer den Tasthaaren direkt am Maul, sitzen die Vibrissen auch am Kinn, d.h. sie sind räumlich „4“ verteilt. Die räumliche Ausrichtung der Haare gehört zur Körpersprache. Mit seitlich= 9 ausgerichteten Vibrissen wird eine neutrale, entspannte Situation signalisiert. In der Kombination 88_2 bewirkt die „2“ die weiße Milchfarbe der Vibrissen, statt 88= Farbstoff Melanin. Als Haar 1_0 versteht sich die Null als Blutblase, wobei die Haut=3 den Hautzwischenraum als 88 meint. Zugleich ist mit Vene=8 auch der Blutsinus=88 adressiert, der die „Blutblase=0“ füllt, die sich zwischen der äußeren und inneren Hautschicht „3“ des Haarfollikels bildet. In der Wand sitzen die Nervenenden für den Tastsinn der Haare. Wo ist das Blut? Quersumme 1+0+3+8+8+2+4=26 ist das Blut Eisen=26: Epi.X***+Katze.Z.1#408479410388249. Sinushaare: Die Zeile 1 wiederholt sich inhaltlich als Zeile 1000. Wahrscheinlich wird dort der Pfotenballen (Karpalballen=Handwurzelballen) auflaufen. Etwa 3 Zentimeter oberhalb des Karpalballens wachsen 3 - 6 pigmentlose Sinushaare, die mit den Schnurrhaaren (Vibrissen) vergleichbar sind. Die „88“ ist zugleich auch als Duftdrüse geeignet, die neben den Sinushaaren sitzt – die Duftdrüsen und die Karpalvibrissen bilden das Karpalorgan. Der Haarfollikel 0 als Form 7 ist von Muskelgewebe 5_5 umgeben, so dass die Tasthaare bewegt werden können. Die Beziehung zur Haut 33 ist als Quersumme 2+4+2+3+9+7+0+5+1= 33 (9=Ende) enthalten: Epi.X***+Katze.Z.2#204239705194125.
Nasenspiegel (Rhinarium):
In der Parallelepisode Epi.Y***Katze wird der haarlose Nasenspiegel als Geruchsorgan im Oberkiefer angelegt. Die Zeile 1 ist hier statt der Zählgröße Zahn=1 der 1. Hirnnerv für den Geruchssinn. Dieser ist zugleich allgemein als Nerv 7 mit den Blutgefäßen 9 und 8 markiert. Die Struktur ist symmetrisch 5_9_5: Epi.Y***+Katze.Z.1#409799825956812. Die Mittelachse wird durch eine Rinne 1_9_1 gebildet: Epi.Y***+Katze.Z.5#819599651913625. Nasenlöcher: Mit der Form=7_0 werden die paarigen Nasenlocher 0_2 angelegt: Epi.Y***+Katze.Z.6#682999709928021. Unterhalb des Nasenspiegels liegt das Maul etwas zurückgesetzt.
Zähne:
Milchgebiss (Die 26 Zähne brechen im Alter von 2 - 6 Wochen durch): Oberkiefer: 3p/1c/3i/3i/1c/3p; Unterkiefer: 2p/1c/3i/3i/1c/2p
Adultes Gebiss (Die 30 Zähne ersetzen 26 Milchzähne mit 4 zusätzlichen Molaren im Alter von 3 – 5 Monaten): Oberkiefer: 1M/3P/1C/3I/3I/1C/3P/1M; Unterkiefer: 1M/2P/1C/3I/3I/1C/2P/1M.
Fangzahn / Eckzahn (Canini) c1, c2: Der Eckzahn als Zählgröße „11“ beginnt mit der Zahnentwicklung in einer gesonderten Zeile. Im Unterkiefer bildet sich 1 Eckzahn mit seitlich=9, paarig 2. Der Oberkiefer ist als Struktur 5_2_5 mit oben= 9 als Form 7 und mit der 2 zum Unterkiefer paarig, d.h. 4 Eckzähne. Mit dem Zeitregime QS 9+7+0+6+2=24 brechen die Zähne zutreffend nach 21 Tagen = 3 Wochen durch: Epi.X***+Katze.Z.4#102119852597062.
Scheidezähne (Incisivi) i1, i2, i3: Die Schneidezähne als Zählgröße „11“ fallen mit der Bildung des Unterkiefers „115“ zusammen. Um dieses zu erklären wird zuvor in Zeile 8 die Zählgröße „11“ als Quersumme 5+1+0+5=11 und mit 99=herauswachsend für die enthaltenen 12 Schneidezähne codiert. Mit 2_6_2 wird die paarige Verteilung von 6 Zähnen je Ober- und Unterkiefer adressiert: Epi.X***+Katze.Z.8#510599262985312. Unterkiefer „115“ mit den 12 Schneidezähnen 6_6 und dem Zeitregime 24_99 brechen die Schneidezähle nach 18 Tagen (QS 9+9=18) bereits vor den 4 Eckzähnen durch: Epi.X***+Katze.Z.9#453866011542499.
Vordere Backenzähne (Prämolare) p1/p2 im Unterkiefer: 4 Zähne 11, 2 je Seite, paarig 2 als 2_2. Zeitregime 24 enthalten: Epi.X***+Katze.Z.17#240282006110735.
Der Oberkiefer „115“ wird mit oben=9 und 5_115_9 als Zahnfunktion zusammen mit dem Unterkiefer und den Zähnen 1 adressiert. Der Oberkiefer enthält 16 Zähne und unterscheidet sich daher vom Unterkiefer mit nur 14 Zähnen Epi.X***+Katze.Z.33#123781639511591.
Hinterer Backenzahn (Molare) M1 im Unterkiefer: 2 Zähne 11, 1 je Seite, paarig 2. Die Zeit fehlt, weil kein Milchzahn: Epi.X***+Katze.Z.35#116708402968071.
Vordere Backenzähne (Prämolare) p1/p2/p3 im Oberkiefer: 6 Zähne 11, 3 je Seite und auch als Struktur 5_5_5, paarig 2. Die Zeit fehlt, daher Durchbruch wie Unterkiefer: Epi.X***+Katze.Z.36#113466502885625.
Hinterer Backenzahn (Molare) M1 im Oberkiefer: 2 Zähne 11. Ziffer „2“ paarig fehlt ist als räumliche Struktur 4_5_4 ersetzt. Zeit fehlt, weil kein Milchzahn: Epi.X***+Katze.Z.37#110399840645473.
Der Eckzahn/Fangzahn wiederholt sich inhaltlich in der Zeile 40. Weil die Zeit als Quersumme QS 9+7+0+6+2=24 enthalten ist, kann der Zahnwechsel als 2. Zähne mit der Ziffer 5 für 5 Monate allgemein vorgegeben sein. Anschließend kann der Zahnaufbau beschrieben werden. Das Zahnfach (Alveole) wird über 3 Zeilen beschrieben, indem der Zahn „11“ mittig mit 2 Hautzeilen 33 als Zahnfleisch eingeschlossen wird. An der Zahnwurzel sind die Gefäße 8/9 und der Nerv 7 als Strang „171819“ vorhanden. Der Zahnschmelz schützt das Zahnbein aus Dentin. Das Dentin=22 ist mit „22“ knochenähnlich enthalten: Epi.X***+Katze.Z.42#972570024733927; Epi.X***+Katze.Z.43#949952117181975; Epi.X***+Katze.Z.44#928362296336930. Der Zahn besteht aus Zahnkrone, Zahnhals und Zahnwurzel. Die Zahnkrone 202, herausgehoben als Form 77_ 999, enthält Calcium=20 als Zahnschmelz. Epi.X***+Katze.Z.45#907732023084999. Die innere Wurzelhöhe „00“ zeigt sich mit Calcium=20 über 2 Zeilen, um Nerv 7 und Gefäße 8/9 im Hohlraum gemeinsam aufzunehmen: Epi.X***+Katze.Z.50#816958820776499 und Epi.X***+Katze.Z.51#800940020369116. Im Zahnfleisch ist das Zahnbein durch natürlichen Zahnzement umschlossen, der Sharpey-Fasern 1 des Zahnhalteapparates und Zink=30 enthält, und zwar von Epi.X***+Katze.Z.52#785537327669710 bis Epi.X***+Katze.Z.52#716630544540788.
Auge:
Die Iris (Regenbogenhaut) ist eine Blende, die im freien, vertikalen Lichtspalt 1_60_1 als Kuriosum die Zeit=60 als lichtgesteuert einfängt. Das Melanin 88 als Farbpigment entsteht erst nach der Geburt, so dass es noch geteilt als 8_8 enthalten ist [unklar, speziell muss genauer zwischen Melanin und Melantonin unterschieden werden]: Epi.X***+Katze.Z.137#298160153568065. Als Form 7 mit oben= 999 wird der Blendenspalt „1“ vertikal durchsichtig=0 ausgerichtet. Epi.X***+Katze.Z.138#295999572745108. Das Katzenauge zeigt die Pupille nur durch den vertikalen Spalt, den die Iris offen lässt. Mit der Form-7-Spiegelung „700_007“ bilden beide Seiten einen lotechten, flexiblen „6“ Spalt „1“, paarig „2“ (2 Augen): Epi.X***+Katze.Z.139#293870079416007. Das Melanin Extra=8 entsteht nicht als Drüse 88, sondern wird im Zeilenlauf „#28“,paarig 2, gleichzeitig in beiden Augen, fortlaufend eingesammelt. Je nach Intensität erscheint die Iris dabei in 4 verschieden Farben. Pigmentsammlung: Epi.X***+Katze.Z.140#291771007420178; Epi.X***+Katze.Z.142#289701709495212; Epi.X***+Katze.Z.142#287661556611443. Die Regenbogenhaut 33 erscheint jetzt in der üblichen grünen Augenfarbe. Wegen der Wellenlänge für „grün“ 490 – 575 nm ist der Bereich als Überlagerung 564 nm bis 499 nm: Epi.X***+Katze.Z.143#28564993733444. Bei einer starken Pigment-Ansammlung wirkt das Auge dunkel (kupferfarben). Melanin enthält die Aminosäure Tyrosin, die strukturell als Geometrie einen Benzolring 666 enthält. Die enthaltene Wellenlänge von 572 nm hat den „#d9cf45 Hex-Farbcode“: Epi.X***+Katze.Z.144#283666257214062. Ohne Melanin erscheint die Iris rot, weil die Blutgefäße 9/8 durchscheinen: Epi.X***+Katze.Z.145#281709938198793. Bei der Geburt ist Melanin mit 8_0 (Null) nicht vorhanden, so dass die Iris durch die Lichtbrechung blau erscheint. Im Zeilenlauf fehlt jetzt vorn die „8“ als Extra. Die Wellenlänge von 414 nm kann der Mensch noch sehen, weil darunter ab 400 nm das unsichtbare UV-Licht beginnt: Epi.X***+Katze.Z.146#279780418074143. Augenlinse: Die immer erfolgreiche „505“ steht nicht zur Verfügung, so dass mit flexibel=606 und dem Muskel=550 eine Alternative genutzt wird. Die 0=Null als Linse ist jetzt am rechten Zahlenrand vorhanden und am linken Zahlenrand steht paarig=2. Glaskörper: Epi.X***+Katze.Z.153#266980006789705. Die Netzhaut 33 beginnt: Epi.X***+Katze.Z.190.#214989163362237. Bei schwacher Beleuchtung sind die Stäbchenzellen aktiv, und für das Farbsehen sind 2 Zapfentypen vorhanden. Die Katzen lassen sich nicht auf Farben trainieren, so dass das Farbsehen nicht sicher beurteilt werden kann. Es sind jedenfalls 2 Zapfentypen vorhanden. Die enthaltene Wellenlängen von 500 nm und 509 nm werden überwiegend wissenschaftlich verbreitet (500nm und 510nm), andere Forscher nennen die Wellenlänge der Hunde: Epi.X***+Katze.Z.204.#200235005092279. Hinter der Netzhaut liegt die reflektierende Schicht „Tapetum cellulosum lucidum“ nachtaktiver Tiere. Das Licht wird nochmals durch die durchsichtige Netzhaut auf die Photorezeptoren 9_0_9 gespiegelt. Die Netzhaut ist Gefäßen als Blut Eisen=26 enthalten: Epi.X***+Katze.Z.206.#198290975916626. Aderhaut 33: Epi.X***+Katze.Z.207.# 197333048496739. Lederhaut 33: Epi.X***+Katze.Z.214.#190878229153388. Sehnerv= 2. Hirnnerv und allgemein Nerv 7: Epi.X***+Katze.Z.219.#186520278716096. Großes Hinterhauptloch „Foramen magnum“ 505: Im Bereich der hinteren Schädelgrube (Fossa cranii posterior) wird die Medulla oblongata als Teil des Gehirns zum Rückenmark durchgeleitet: Epi.X***+Katze.Z.234.#174563850593269.
Darmausgang
Das Rektum (Intestinum rectum) ist der letzte Abschnitt des Dickdarms, dessen Ende die Afteröffnung (Anus) bildet. Bei der Katze liegt der Anus direkt unter dem Schwanzansatz. Dieses trifft für den Zeilenlauf zu: 1. Schwanzwirbel 115: Der Darm ist bereits mit 808 avisiert. Weiterhin wird die Steuergröße der Wirbelzählung (Ziffer 5) genutzt, um den äußeren Schließmuskel des Darms 15_808_15 mit der Form als Schlitz 7_1_7 zu bilden: Epi.X***+Katze.Z.2584.#158080267178115. Darmausgang (Anus /After) 8008: Epi.X***+Katze.Z.2586.#157958008657482.
Das Problem: Der Darmausgang liegt gegenüber dem Hund mehr als 1200 Zeilen zu früh vor! Nachfolgend werden der Darmausgang und ggf. für den Kater die Hoden angelegt, die oberhalb des Penis liegen. Anschließend könnte der Zeilenlauf eine lange Strecke überbrücken, indem die bis zu 23 Schwanzwirbel gebildet werden. Dadurch käme der Zeilenlauf wieder ideel an die Hoden-Position zurück, so dass nunmehr die Vagina und der Penis angelegt werden können. Innerhalb dieser „Genitallücke“ entwickeln sich außer dem Schwanz zugleich auch die hinteren Extremitäten. Grundsätzlich ist Penis „zu früh“ am Start: Der Penis ist zur Schwanzseite ausgerichtet und wird erst beim Deckakt (Paarung /Kopula) durch einen Muskel unter den Bauch gezogen. Gesucht wird die Position der Vagina, um den Klitorisknochen (Os clitoridis/ Baubellum) zu finden. Übrigens muss man ein Rüsseltier ( Elefant ) offensichtlich durch Zeilenzuwachs umgekehrt zur Rinder-Suche ansetzen.
Die beiden Analbeutel (Sinus paranalis) sind Drüsenorgane und liegen beidseitig unterhalb des Anus. Die beiden Ausführungsgänge 90_9_90 sind in der Hautzone des Anus (Zona cutanea) sichtbar als Ende=9: Epi.X***+Katze.Z.2588.# 157835939099014. Zunächst bildet sich die Analbeutelwand 33, in der die Drüsen arbeiten. In der Wand ist ein Muskel 55 enthalten, der zusammen mit dem äußeren Afterschließmuskel des Darms eine Entleerung der Analbeutel beim Herauspressen des Kots (Faeces) bewirkt. Epi.X***+Katze.Z.2600.#157107465533942. Für die Sekret-Produktion sind die Hormone 66/33 und eine Zeitsteuerung 60 enthalten, mit der bei Katzen die Sekretmenge im Frühjahr gesteigert wird: Epi.X***+Katze.Z.2600.#156866133021601. Analbeutel 5_65_65_5 als Volumen 800, paarig 2.
Hoden (Testis) männlicher Katzen (Kater)
Der Penis ist funktionell der Harnröhre und nicht dem Samenleiter zugeordnet, so dass der Penis beim Kater erst später folgt. Der Hodensack ist direkt unterhalb des Darmausgangs angeordnet. Der Hoden liegt nach dem Hodenabstieg (Descensus testis) aus dem Leistenspalt im Hodensack (Skrotum) als eine Ausstülpung der Bauchwand. Beim Kater erfolgt diese Phase bereits unmittelbar bei der Geburt. Die beiden Hoden liegen jeweils in einem Skrotalfach, weil der Hodensack durch eine bindegewebsartige Scheidewand (Septum scroti) in zwei Fächer unterteilt ist. In der Haut des Hodensacks befindet sich die Muskulatur „Musculus cremaster“. Der Muskel 55 umhüllt „505“ den Samenstrang (Funiculus spermaticus) “101“ (Spermien als Zählgröße=1) und besteht aus Fasern 1 der Bauchmuskulatur. Die Formänderung 7 bei der Muskelkontraktion ist als 9_7_9 (Ende=9) enthalten bzw. sind es gleichzeitig die Gefäße 9/8 und Nerven 7 sowie die Lymphgefäße 11 und der Samenleiter 101. Samenstrang: Epi.X***+Katze.Z.2661.#153505979101184. Der Samenstrang zieht durch den Leistenkanal, damit die Spermien über den Bereich der Prostata zur Harnröhre gelangen können. Das Hodennetz (Rete testis) zeigt sich als eine Gruppe 44 feiner Samenkanälchen (Tubuli seminiferi) 3_1_3 als Netzwerk 444, welches über die „Ductuli efferentes“ mit dem Nebenhoden verbunden wird. Die Ductuli efferentes sind ein System aus ca. 15 Einzelgängen, das den Hoden (Testis) mit dem Kopfteil des Nebenhodens (Epididymis) verbindet. Die Zahl „15“ liegt im Zeilenlauf an. Hodennetz (Rete testis): Epi.X***+Katze.Z.2662.#153448313444121. Hoden (Testis) als Keimdrüse mit Testosteron 33 und Spermien „1“: Epi.X***+Katze.Z.2664.# 153333112007601. Scheidewand (Septum scroti) 33 im Hodensack als Trennung in 2 Formteile 7 als Dopplung 27_27. Die Nahtstelle 22 ist äußerlich an einer dunkler gefärbten Linie 1 als Hodensacknaht (Raphe scoti) erkennbar: Epi.X***+Katze.Z.2675.# 152702583322710.
Der Hodensack besteht aus 9 Hautschichten 33, die für einen weiten Zeilenvorschub von innen nach außen (9. bis 1. Schicht) einzeln aufgelistet werden. Die Schichtenfolge 33 kann eingeordnet werden, weil die äußere, 1. Schicht am rechten Zahlenrand die Ziffer „1“ als Behaarung zeigt. Weiterhin muss sich die Muskelschicht 55 des „Musculus cremaster“ passend in die Schichtenfolge einordnen:
9. Sackschicht: Lamina visceralis der Tunica vaginalis 33: Schicht ist fest mit dem Hoden verbunden: Epi.X***+Katze.Z.2746.#148754337359159; Hoden 2000 (männlich=2) als Volumenform 77: Epi.X***+Katze.Z.2749.# 14859200086877.
8. Sackschicht: Lamina parietalis der Tunica vaginalis 33: Epi.X***+Katze.Z.2764.# 147785604337283.
7. Sackschicht (Fascia spermatica interna) 33: Epi.X***+Katze.Z.2767.#147625374191633.
6. Sackschicht (Musculus cremaster) 33: Muskel 55 als Hobenheber und –senker; von der Fascia cremasterica überzogen: Epi.X***+Katze.Z.2791.#146355933496327.
5. Sackschicht (Fascia spermatica externa) 33: Epi.X***+Katze.Z.2801.#14583342034568.
4. Sackschicht (Stratum subdartoicum) 33: bindegewebige Verschiebeschicht: Epi.X***+Katze.Z.2810.#145366338216459.
3. Sackschicht (Tunica dartos) 33: elastisch-muskulösen System 777_66 zusammen mit Tela subdartoica: Epi.X***+Katze.Z.2825.#144594481553363 und Epi.X***+Katze.Z.2826.#144543315777866.
2. Sackschicht (Tela subdartoica) 33: Epi.X***+Katze.Z.2830.#144339014271466.
1. Sackschicht (Cutis scroti) 33: dünn, behaart, individuell pigmentiert und mit Schweiß- und Talgdrüsen: Drüsen 44_84448: Epi.X***+Katze.Z.2835.#144084448108730. Haare 1: Epi.X***+Katze.Z.2836.# 144033642591061.
Der weitere Zeilenlauf lässt sich ohne örtliche Bewegung forcieren, weil sich Gefäße zu einem Knäuel verflechten. Während dieser Schlaufenlegung, können die weiteren Schwanzwirbel angelegt werden. Hodenarterie und -vene sind am Hoden eng miteinander verflochten. Die Aufknäuelung der Arterie bezeichnet man als Rankenkonvolut und die Aufkläuelung der Vene als Rankengeflecht (Plexus pampiniformis).
Klitorisknochen (Os clitoridis / Baubellum)
In Anlehnung an den Zeilenlauf der Hunde ergibt sich die Vagina in Epi.X***+Katze.Z.3950.#106000441537263. Der Penisknochen wird untergeordnet als 511 (statt 115) gefunden. Für den Klitorisknochen wird dieses Zählsymbol über 3 Zeilen als Gruppe 44 mit 5...66...11 gesteckt und das weibliche Hormon 66 eingefügt. Die Erregung ist als Gegensatz 2_9_6 (kein Blut) / 26_9 (Blut: Eisen=26) enthalten. Der Form nach ist es ein flacher Knochenstab 7_100 (Abbildungen liegen nicht vor / beim Eichhörnchen ca. 5 mm lang) als Extra=8: Epi.X***+Katze.Z.3938.#106323449485066; Epi.X***+Katze.Z. 3939.#106296456987100; Epi.X***+Katze.Z. 3940.#106269478190911.
Penisknochen (Os penis)
Der Penisknochen (Os penis / Os priapi / Baculum) ist ein Organknochen, der beim Kater im Penis liegt und von der Harnröhre begleitet wird. Beim Skelett des Hundes wurde die gegenüber dem Rind verkürzte Startzeit, die mit einem früheren Beginn der Halswirbelsäule verbunden ist, bereits am Schlüsselbein problematisch. Es wurde rückwärts vom Oberschenkelgelenk zur Wirbelsäule gescannt. Bei der Katze fiele der 1. Halswirbel in den Augenbereich, so dass eine Speziallösung benötigt wird. Umgekehrt könnte am Schwanz ein Knochen-Überschuss entstehen, der als Penisknochen verwertet werden könnte. Tatsächlich besitzen Hunde, Pferde und Primaten ebenfalls einen Penisknochen. Dieser kommt im Tierreich auch in der weiblichen Form als Klitorisknochen (Os clitoridis, Baubellum) vor, beispielsweise bei Kleinkatzen. Beim Kater wird der Penis nach hinten (kaudal) ausgeschachtet, erst beim Deckakt wird der Penis durch einen Muskel nach vorn unter den Bauch gezogen. Der Penisknochen ist beim Hund ein sekundärer Knochen, der nicht als Wirbel „115“, sondern als „511“ zählt. Penisknochen haben üblicherweise eine Rinne „080“, in der die Harnröhre liegt. Beim Hund liegt die Harnröhre in der Folgezeile Epi.X**+Hund.Z4148 mit „303“ vor. Beim Kater wird der Penisknochen „5111“ mit „111“ nicht hundeähnlich lang, sondern als Dreieck angezeigt. Mit dem Hormon Testosteron „33“ wird die männliche Katze (Kater) adressiert. Die Harnrohre 303 liegt nicht sichtbar vor, weil mit „30...(3?)“ die rechtsseitig fehlende Ziffer 3 am rechten Zahlenrand zur Markierung 3_9_3 dient, d.h. die Harnröhre soll nicht frei liegen, sondern als Form 7 in der Rinne „0“ bzw. oben=9 im Knochen. Für den Penis ist das Blut Eisen=26 enthalten. In Abbildungen ist er bei kleinen Katzen nur ca. 5 mm lang, pyramidenförmig als spitzes Dreieck „3_9_3“ geformt: Epi.X***+Katze.Z.4391.#930265111337393. Als Besonderheit besitzt der Kater die Penisstacheln 11_8 als Extra 8 und Form 7. Das sind verhornte kleine Widerhaken in der Schleimhaut „33“, die im Kontakt mit der Schleimhaut der Katze die Hormonausschüttung für den Einsprung anreizen. Zugleich ist „33“ das männliche Hormon, so dass sich die Penisstacheln nach einer Kastration stark zurückbilden. Das Horn als Schwefel=16 ist als Quersumme 5+3+3= 11 als Stachel plus 2+3=16 enthalten. Die Ziffer „4“ bewirkt die räumliche Verteilung der Penisstacheln ringförmig um die Penisspitze „9300“: Epi.X***+Katze.Z.4392.# 930053302341187. Mit dem Penis richtet sich auch die Harnröhre als Form 7 nach vorn aus „7030005“, wobei der Deckakt als Doppel 92_92 erscheint. Wegen der Quersumme 9+2=11 kommen somit Penisknochen und Klitorisknochen zusammen: Epi.X***+Katze.Z.4396.# 929207030000567. Der Deckakt wird mathematisch mit männlich=2 und weiblich=1 als 33_2_33 angezeigt. Hormon männlich 33+33=66 weibliches Hormon. Der Form 77 nach ist der Kater oben 92 zu unten 29: Epi.X***+Katze.Z.4403.# 927729753323301. Hormonklammerung 3_66_3: Epi.X***+Katze.Z.4405.#927308536636207. Muskelzug 55 am Penis: Epi.X***+Katze.Z.4408.#926677428285502.
Wirbelsäule
7 Halswirbel (Vertebrae cervicales) 115: 1. Halswirbel (Atlas): Als Abweichung muss der Atlas als eine alternative Wirbelzählung gebildet werden, um den Kopf im verkürzten Zeilenlauf unterzubringen. Weil der Knochen allgemein als „225“ gebildet wird, ist statt „115“ der Einschub 1_22_15_5 als eine Verstärkung zulässig. Das Knochenloch 505 ist optimal enthalten: Epi.X***+Katze.Z.261.#156505521221551. Der am weitesten kopfwärts (kranial) austretende Halsnerv wird als 1. Halsnerv (Nervus cervicalis I) bezeichnet. Dieser tritt durch eine paarige Wirbelöffnung (Foramen vertebrale laterale) 9_0 (seitlich=9) für Nerv=7: Epi.X***+Katze.Z.262.#155908171903912. An der Wurzel des Atlasflügels befindet sich kein Flügelloch (Foramen alare), sondern bei Fleischfressern wie Hund und Katze eine paarige, seitliche Kerbe (Incisura alaris) 7_0_49_94. Hier zieht ebenfalls ein Nervenast durch: Epi.X***+Katze.Z.264.# 154727049389488. 2. Halswirbel (Axis): Epi.X***+Katze.Z.266.#153563688115883. Weitere Halswirbel: Z.353, Z.354, Z.355, Z.372; 7. Halswirbel: Epi.X***+Katze.Z.454.#899734384115087.
13 Brustwirbel (Vertebrae thoracicae) 115: 1. Brustwirbel Epi.X***+Katze.Z.492.#830242704041157. Weitere Brustwirbel: Z.593, Z.616, Z.754, Z.802, Z.900, Z938, Z.1013, Z.1022, Z.1254, Z.1321, Z.1459; 13. Brustwirbel: Epi.X***+Katze.Z.1666.#2451857205211580.
7 Lendenwirbel (Vertebrae lumbales) 115: 1. Lendenwirbel Epi.X***+Katze.Z.1702.#239999653577115. , Weitere Lendenwirbel: Z.1722, Z.1730, Z.1847, Z.1931 Z.2029; 7. Lendenwirbel Epi.X***+Katze.Z.2034.#200825668824115.
3 Kreuzwirbel (Vertebrae sacrales) 115: 1. Kreuzwirbel Epi.X***+Katze.Z.2358.#173231302115458; 2. Kreuzwirbel Epi.X***+Katze.Z.2502.#163261155231115; 3. Kreuzwirbel Epi.X***+Katze.Z.2568.#159065190961156.
18-27 (Hauskatze 20-23) Schwanzwirbel (Vetrebrae caudales) 115: 1. Schwanzwirbel Epi.X***+Katze.Z.2584.#158080267178115. Weitere Halswirbel: Z.2660, Z.2699, Z.2817, Z. 2995, Z.3199, Z.3154, Z.3179, Z.3300, Z. Z.3522, Z.3523, Z.3524, Z3525, Z.3526, Z. 3527, Z.3528, Z.3529. 18. Schwanzwirbel (Panthera pardalis): Epi.X***+Katze.Z.3530.#115716546852195. 19. Schwanzwirbel (Panthera Onca): Epi.X***+Katze.Z.3531.#115683775244477. 20. Schwanzwirbel (nicht bekannt): Epi.X***+Katze.Z.3532.#115651022193729. 21. Schwanzwirbel (nicht bekannt): Epi.X***+Katze.Z.3533.#115618287684192.
Die folgenden 3 Zeilen werden überprungen: a) Die Formen #1155, #11555 und #1155 sind Strukturgrößen und keine Zählgrößen und b) die Zeile 3535 enthält auch die Zählgröße #225 für die hinteren Extremitäten, und ist daher bereits besetzt.
22. Schwanzwirbel (Felis domestica): Epi.X***+Katze.Z.3537.#115487534743639.
23. Schwanzwirbel (Felis domestica): Epi.X***+Katze.Z.3538.#115454892704423.
24. Schwanzwirbel (Felis domestica): Epi.X***+Katze.Z.3539.#115422269112249.
25. Schwanzwirbel (Panthera tigris): Epi.X***+Katze.Z.3540.#115389663951483.
26. Schwanzwirbel (Panthera tigris): Epi.X***+Katze.Z.3541.#115357077206509.
27. Schwanzwirbel (Panthera leo): Epi.X***+Katze.Z.3542.#11532450886173.
Andere Quellen nennen 20-23 Schwanzwirbel der Fleischfresser und bei der Hauskatze. Die Zählwirbel #115 liegen in einer Folge bis Zeile 3551 vor. Das natürliche Ende ist durch die Bildung der hinteren Extremitäten gegeben – der Schwanz schleift nicht auf dem Boden.
Rippen (Costae)
Analog zur Wirbel-Suche „115“ in der Leitepisode werden die Rippen in der Parallelepisode Epi.Y***+Katze mit „115“ ermittelt. Die von der Wirbelsäule zum Brustbein (Sternum) bogenförmig und paarig verlaufenden Rippen (Os costale) bilden den Brustkorb (Thorax). Die Anzahl von 13 Brustwirbeln, beginnend ab EPI.X***+Katze.Z.492, stimmt aufgrund der gelenkigen Verbindung mit der Anzahl von 13 Rippen überein. Die Katze besitzt - wie der Hund - 9 wahre Rippen, die mit dem Brustbein verbunden sind [Pferd und Wiederkäuer mit 8 wahren Rippen] und 3 falsche Rippen. Diese schließen am Ende des Brustbeins nur über einen Rippenbogen an. Beim Hund endet 1 Fleischrippe ohne Anschluss an das Brustbein. Wahre Rippen: 1. Rippe: Epi.Y***+Katze.Z.760#539210297311595. Weitere Rippen: Z.1077, Z.1135, Z.1167, Z.1276, Z.1329, Z.1371. 9. Rippe: Epi.Y***+Katze.Z.1481#276704811584613. Falsche Rippen: 10. Rippe: Epi.Y***+Katze.Z.1504#272473288535115, 11. Rippe: Epi.Y***+Katze.Z.1561#262523911567465 12. Rippe: Epi.Y***+Katze.Z.1625#252184508281115 13. Rippe: Epi.Y***+Katze.Z.1675#24465661251153.
Die Rippe (Os costale) gliedert sich in 3 Abschnitte: Rippenköpfchen (Caput costae), Rippenhals (Collum costae) und Rippenkörper (Corpus costae). Die Rippenknochen (Os costae) bilden die Seitenwand des Brustkorbs. Am unteren (distalen) Ende der Rippe ist ein Rippenknorpel (Cartilago costae) ausgebildet. Der Rippenknorpel ist mit dem Brustbein (Sternum) verbunden. Am Brustbein setzen die 9 Rippenpaare der wahren Rippen an.
Der Brustbeinkörper besteht bei Hund und Katze aus 6 knöchernen Segmenten (Sternebrae) und dazwischen liegenden Knorpelabschnitten. Folglich müssen 3 der 9 wahren Rippenpaare noch gedrängt eingeordnet werden. Am kaudalen Ende des Brustbeins liegt der knöcherne Schwertfortfortsatz (Processus xiphoideus), der mit dem Schaufelknorpel (Cardilago xiphoidea) verbunden ist. Die Rippenbögen als Knorpelverbindung zu den falschen Rippen müssen hierüber eine Verbindung zum Brustbein herstellen.
Das Brustbein liegt den Rippen gegenüber und wird deshalb in der Parallelepisode Epi.Y***+Katze als eine gespiegelte Suchgröße „511“ ermittelt. Es werden 9 Rippenknorpel (Cartilago costae) gezählt, über die eine Verbindung zum Brustbein besteht:
1. Rippenknorpel: Epi.Y***+Katze.Z.661#619969479511063. Weitere Rippenknorpel: Z.703, Z.801, Z.868, Z.860, Z.1007, Z.1125, Z.1152. 9. Rippenknorpel: Epi.Y***+Katze.Z.1154#355112500829127. Die Ursache dafür, dass nur 9 Rippenpaare direkt mit dem Brustbein in Kontakt stehen, liegt einerseits darin, dass dieses am Brustbein so vorgegeben ist, andererseits muss es 4 Rippenbögen geben, die über beidseitige Knorpelanschlüsse verfügen, um mit „5115“ eine Verbindung zu den falschen Rippen und zum Brustbein herzustellen. Diese 4 Rippenbögen sind bei der Katze vorhanden. Diese Positionen sind bereits auch als Rippe 115 gezählt worden, so dass sich die Bogenform zum Brustbein abzeichnet: Rippenbogen für 10. Rippe: Epi.Y***+Katze.Z.1167#351156663202067 (zugleich 4. Rippe); Rippenbogen für 11. Rippe: Epi.Y***+Katze.Z.1329#272473288535115 (zugleich 6. Rippe); Rippenbogen für 12. Rippe Epi.Y***+Katze.Z.1504#272473288535115 (zugleich 10. Rippe); Rippenbogen für 13. Rippe: Epi.Y***+Katze.Z.1675#24465661251153 (zugleich 13. Rippe).
Brustbein (Sternum): Der erste Abschnitt des Brustbeins (Manubrium sterni) besteht aus einem knöchernen Anteil und dem Habichtsknorpel (Cartilago manubrii) 5_33_5: Epi.Y***+Katze.Z.581#705335328669212. Mit der Form 7, paarig 2, Zahl 12= „212“ ist ein Zusammenhang mit dem folgenden Brustbeinkörper (Corpus sterni) vorhanden, der die Zahl 12 als Quersumme 5+7=12 enthält. Mit der Ziffer „1“ wird bereits das 1. Rippenpaar vorab am Manubrium sterni angeschlossen, so dass die Zahl 12 die noch folgenden Rippenpaare zählt. Brustbeinkörper (Corpus sterni) als Knochenstab 57_55222_75: Epi.Y***+Katze.Z.589#695755222337542. Die Form „7“ ist nach Art eines Tannenbaums dreieckig 7_3_7. Es sind weitere Rippenpaare seitlich=9 aber auch insgesamt am Brustbein 9 Rippenpaare direkt anzuschließen. Epi.Y***+Katze.Z.592#692229435737859. Die 6 knöchernen Segmenten (Sternebrae): An den Zwischenknorpeln liegen zusammen 6 Rippenpaare an. Zuzüglich 1 Rippenpaar vorn am Manubrium sterni und 2 am Ende sind zusammen 9 Rippenpaare: Epi.Y***+Katze.Z.593#69106210110760. Schwertfortfortsatz (Processus xiphoideus) 600: Epi.Y***+Katze.Z.596#687583600598679. Schaufelknorpel (Cardilago xiphoidea) 335: Epi.Y***+Katze.Z.598#685283989894335.
Teil A: Vordergliedmaßen
1.) Schulterblatt (Scapula): Das Schlüsselbein (Clavicula), und das Rabenschnabelbein (Os coracoideum) sind bei den Säugetieren stark zurückgebildet, so dass nur das Schulterblatt als Knochen #225 gezählt wird. Das Schulterblatt ist angewinkelt und ragt etwas in die Halswirbelstrecke hinein, so dass es rückwärts von der Oberarmseite gescannt wird. Die mittlere Schultergräte kann umrundet werden, um in den normalen Lauf zu kommen. Evolutionär wird das rudimentäre Schlüsselbein als kleine dünne, gekrümmte 606 Knochengräte 11 und als eine funktionslose Sehne 101 betrachtet, die in einem Muskel 55 liegt. Epi.X***+Katze.Z.512.#79781134841455; Epi.X***+Katze.Z.513.#796256160600876; Epi.X***+Katze.Z.514.# 794707024101652. Das Rabenschnabelbein hat sich evolutionär als Rabenschnabelfortsatz (Processus coracoideus) 522 zurückgebildet. Das ist auch bei Hunden so zu finden. Bei Katzen besteht die Besonderheit, dass von diesem Fortsatz noch ein weiter kleiner Fortsatz ausgeht (Akromion): Epi.X***+Katze.Z.536.#762088452216883 und Epi.X***+Katze.Z.543.# 752264107529004. Schulterblattknorpel 333_22: Epi.X***+Katze.Z.557.# 733356212546229. Schulterblattgräte 11: 649410827326311. Schultergelenk 5505_5505 mit Knorpelüberzug 33: Epi.X**+Katze.Z.742#550511334755053.
2.) Oberarmknochen (Humerus) 225: Epi.X***+Katze.Z.803#508691669225715.
Ellenbogengelenk: Der Oberarmknochen bildet ein rollenförmiges Gelenk, das in der Einbuchtung der Elle gelagert ist und auf der Gelenkfläche der Speiche aufliegt: Epi.X***+Katze.Z.810.# 504295568380555.
3.) Unterarmknochen aus Speiche (Radius) 225: Epi.X***+Katze.Z.930.#439225172460483 und Elle (Ulna) 225: Epi.X***+Katze.Z.945.#43225334432619.
4.) Handwurzelknochen: 7 Knochen in 2 Form-Reihen 9_7_9. Erste Knochenreihe: oben 3 Karpalknochen: Epi.X***+Katze.Z.1085.#377522560432763. Das seitlich herausragende 999 Erbsenbein 4114_7: Epi.X***+Katze.Z.1124.#363415845541147 und Epi.X***+Katze.Z.1125.# 363092809233999. Zweite Knochenreihe: unten 4 Karpalknochen: Epi.X***+Katze.Z.1127.#62448456422582.
5.) Mittelhandknochen: Zunächst wird ein Mittelhand-Knochengruppe 44_5 für 5 Knochen gebildet.
Epi.X***+Katze.Z.1166.#350325394844125. Mit der Form-7 sollen an den 5 Mittelhandknochen „500“ die Zehenknochen als Form 703727 drei Glieder folgen und als Daumen nur zwei Glieder. Der Knochen ist statt 225 indirekt als 252 adressiert: Epi.X***+Katze.Z.1167.#350025201703727. Mittelhandknochen für den Daumen 225: Seitlich=9: Epi.X***+Katze.Z.1168.#349725522592679. Der Muskel=55 fällt über die weitere Strecke 19x an. Dies entspricht der Zahl der anzuschließenden Knochen: Die 5 Mittelhandknochen + 4 *3 Glieder+ 2 Glieder= 19 Knochen. Die 4 Mittelhandknochen für den 2. bis 5. Finger bilden eine flexible symmetrische Knochenstruktur 6060_225. Mangel: Die Knochenanzahl 4 fehlt!: Epi.X***+Katze.Z.1368.#298596060225328.
6.) Zehenknochen der Hand (Ossa digitorum manus):
Die Zehenknochen laufen in einen Zeilenlauf #225 ein, mit dem die Zehenglieder und anschließend die Krallen in enger Folge adressiert werden können. Bei den Zehenknochen reihen sich 3 Zehenglieder (Phalanges proximalis, media und distalis), wobei am Daumen (Pollex / Digitus primus manus) das Mittelglied fehlt. Das Endglied (Phalanx distalis) wird als Krallenbein bezeichnet. Die 4 dreigliedrigen Zehen bilden für jede Reihe eine Zeile, der Daumen erhält für seine 2 Glieder 2 Zeilen. Im Unterschied zum Hund muss die Ziffer 4 für die 4 Finger in der Zeile erst gesucht werden. Es sind 3 Zeilen vorhanden, so dass die restlichen 2 Zeilen als Daumenglieder zählen: Daumen 1. Glied: Epi.X***+Katze.Z.1759.#232222518697129; 2. bis 5. Finger: 1. Glied: Epi.X***+Katze.Z.1782.#229225258354798; 2. bis 5. Finger: 2. Glied: Epi.X***+Katze.Z.1808.#225928877427129; 2. bis 5. Finger: 3. Glied: Epi.X***+Katze.Z.1809.#225803985842039; Daumen 2. Glied: Epi.X***+Katze.Z.1810.#225679232258701.
Teil B: Hintergliedmaßen
1.) Beckengürtel (Cingulum membri pelvini):
Darmbein 2225: Epi.X***+Katze.Z.2125.#19222560488858. Kreuzbein-Darmbein-Gelenk (Iliosakralgelenk): Die beiden Gelenkflächen (Facies auriculares) sind jeweils mit einem Knorpel 333 überzogen: Epi.X***+Katze.Z.2171.#188152653334062. Iliosakralgelenk 0660_225: Epi.X***+Katze.Z.2171.#188066026882251. Hüftgelenk mit der Beckenpfanne (Acetabulum): Die 3 Beckenknochen (Darmbein, Schambein, Sitzbein) treffen in einer Y-Naht zusammen: Epi.X***+Katze.Z.2506.#163000562804569 und Epi.X***+Katze.Z.2507.#162935544630335. Schambeinfuge (Symphysis pubica): Epi.X***+Katze.Z.2513.#162546522239654. Das Foramen obturatum ist eine paarige Öffnung im Becken zwischen dem Schambein (Os pubis) und dem Sitzbein (Os ischii): Epi.X***+Katze.Z.2520.# 162095004122321. Sitzbein 225: Der Bereich liegt bereits hinter dem 1. Schwanzwirbels mit Bildung von Darmausgang und Hoden!: Epi.X***+Katze.Z.2721.# 150121062252205.
2.) Oberschenkelknochen (Os femoris / Femur) 225:
Femur: Epi.X***+Katze.Z.2754.#148322225994281. Kniescheibe (Patella) 225: Epi.X**+Katze.Z.2821.#144799507404555 und Epi.X***+Katze.Z.2822.#14474819645225. Kniegelenk 0550: Epi.X***+Katze.Z.2842.#143729560305506.
3.) Unterschenkelknochen: Das Wadenbein (Fibula) bildet mit dem Schienbein (Tibia) das Unterschenkelskelett. Das Wadenbein ist über den gesamten Unterschenkel ausgebildet, so dass 2 getrennte Zeilen vorliegen. Schienbein (Tibia) 225: Epi.X***+Katze.Z.2852#143225599715375. Wadenbein (Fibula) 225: Epi.X***+ Katze.Z.2996#13634159225242
4.) Hinterfußwurzelknochen bzw. Tarsalknochen (Tarsus): Der Tarsus als Verbindung zwischen dem Unterschenkel (Crus) und den Hintermittelfußknochen (Ossa metatarsalia / Metatarsus) setzt sich bei den Haussäugetieren aus bis zu 3 Knochenreihen mit 7 Knochen zusammen. Statt nur eine Zeile für jeder der 3 Knochenreihen werden 6 Zeilen berücksichtigt, weil die beiden Knochen der oberen Reihe extreme und unterschiedliche Formen besitzen.
4.1) Die proximale (krurale) Knochenreihe besteht aus und dem seitlich befindlichen Calcaneus (Os tarsi fibulare, Fersenbein) und dem Talus (Os tarsi tibiale, Rollbein).
4.1.1) Das Fersenbein (Calcaneus) besteht a) aus einem weit nach proximal ragenden Tuber calcanei (Fersenbeinhöcker), der als Ansatzstelle für die Tarsalgelenksstrecker dient. Im proximalen Teil ist eine Rinne „Sulcus calcanei“ vorhanden. Weiterhin b) ein nach medial gerichtetes Sustentaculum tali, das als die Gleitschiene für die Sehne des Musculus flexor digitalis lateralis dient.
Calcaneus 225: Epi.X***+Katze.Z.3102.#131682595225097.
4.1.2) Das Rollbein (Talus) gliedert sich in ein Corpus, Collum und Caput. Am Corpus liegt die mit 2 parallelen Kämmen ausgestattete Trochlea tali. Die Achse der Rollkämme 20° (beim Hund 25°) ist nach lateral gerichtet, so dass die Hintergliedmaßen im Galopp seitlich an den Vordergliedmaßen vorbeigeführt werden. Talus 225: Epi.X***+Katze.Z.3131.#130462922513015.
4.2) Die mittlere (intertarsale) Knochenreihe besteht aus dem medial gelegenen Os tarsi centrale. Es ist ein platter Knochen, der Gelenkflächen enthält. Das Os tarsi centrale dient als Stütze und ist mit allen Tarsalknochen gelenkig verbunden: Os tarsi centrale 225: Epi.X***+Katze.Z.3332.#122592860260579
4.3) Die distale, metatarsale Gelenkreihe der Knochen „Ossa tarsalia“
4.3.1) Der größte Knochen „Os tarsale quartum“ ragt in die mittlere Ebene hinein. In einer Würfelform besitze er sechs Flächen. Durch die Fläche zieht eine tief eingeschnittene Sehnenrinne für die Sehne des „Muculus tibularis longus“. Os tarsale quartum 225: Epi.X***+Katze.Z.3333.#122556078724347.
4.3.2) Os tarsale tertium 225: Epi.X***+Katze.Z.3535.# 115552874225813
4.3.3) Os tarsale primum und der kleinste Knochen „Os tarsale secundum“ werden als eine Zählgröße 225 zusammengelegt, um 6 statt 7 Positionen zu adressieren, zumal unter „2225“ ein Anhängsel enthalten ist: Epi.X***+Katze.Z.3417.#119543286622256.
5.) Mittelfußknochen (Ossa metatarsalia):
Die Katze als Fleischfresser besitzt wie beim Menschen 5 Mittelfußknochen (Os metatarsale I-V). Von den 5 Hintermittelfußknochen (Ossa metatarsalia primum bis quintum) ist der Ossa metatarsalia primum nur rudimentär und sehr kurz.
5.1) Ossa metatarsalia primum: Die Knochenposition des rudimentären Knochens liegt zwischen einer Folge von Schwanzwirbels, die für diesen Knochen als Strukturgröße #11555 reserviert wurde. Der rudimentäre Knochen (Os metatarsale I) ist kegelförmig „1_3“ und wird über Faserzüge fest mit dem (Os metatarsale II) verbunden: Epi.X***+Katze.Z.3535.#115552874225813. In dieser Zeile wird ein Hinweis benötigt, dass eine Fußgruppe 44 vorliegt, in der sich die 555 auf die 5 Mittelfußknochen beziehen. Die Gruppe 44 wird als Quersumme ohne die „555“ gebildet: Quersumme 1+1+2+8+7+4+2+2+5+8+1+3=44.
5.2) Os metatarsale II-V: Die 4 Knochen „Os metatarsale II-V“ sind vergleichsweise länger als an der Vorderpfote der Katze. Der 5. Mittelfußstrahl ist etwas schwächer als der zweite. Der 3. und 4. sind stärker, davon der 3. Strahl ist besonders kräftig. Mit 2_7_5 und seitlich=9 ist zumindest ein Zusammenhang erkennbar, so dass nicht alle Knochen einzeln aufgelistet werden müssen. Weiterhin ist mit der Ziffer „4“ die Anzahl der Knochen enthalten: Epi.X***+Katze.Z.3639.#112250456275968.
6.) Zehenknochen des Fußes (Ossa digitorum pedis): Die 4 Zehenknochen liegen am 2. bis 5. Mittelfußknochen und bestehen jeweils aus 3 Zehengliedern (Phalanges proximalis, media und distalis). Das Endglied (Phalanx distalis) wird als Krallenbein bezeichnet. Wie für die Zehenknochen der Hand wird für jede der 3. Zehenglieder (Phalanx) eine Zeile gebildet, wobei für den Anschluss an den rudimentären Mittelfußknochen (Os metatarsale I) gesondert nur 2 statt 3 Glieder angeschlossen werden. Für die Zehengruppe mit 3. Zehengliedern wird muss neben der Zählgröße „225“ eine Ziffer „4“ in der Zeile stehen. Dieses ist hier am Fuß nicht eindeutig genug, so dass eine direkte Kopplung „4225“ vorliegen muss.
6.1) Phalanx proximalis
6.1.1) Phalanx proximalis für 2.-5. Zehe: Epi.X***+Katze.Z.3647.# 112004225497189
6.1.2) Phalanx proximalis für 1. Zeh: Epi.X***+Katze.Z.3648.# 111973522584498
6.2) Phalanx media für 2.-5. Zehe: Epi.X***+Katze.Z.3784.# 107949104225224
6.3) Phalanx distalis
6.3.1) Phalanx distalis für 1. Zeh: Epi.X***+Katze.Z.4078.# 100166603822523
6.3.2) Phalanx distalis für 2.-5. Zehe: Epi.X***+Katze.Z.4113#993142257204594
Als überschüssige Zeile liegt mit „2225“ keine zwingende Zählgröße „225“ vor, so dass mit der Ziffer „7“ eine Formausssage gelesen werden kann. Werden mit 02 und 04 der 2. und 4. Zeh wegen der Null=0 schwach ausgebildet, wirkt der 3. Zeh besonders kräftig. Form 7 für „Ossa digitorum pedis“: Epi.X***+Katze.Z.4066#100462225870204.
BiXnom_Katze_dat04.11.2021
Wildschwein (Sus scofa)
Die Paarhufer (Artiodactyla) sind eine Ordnung der Säugetiere (Mammalia), die 4 Unterordnungen enthält: 1.) Die Schweineartigen (Suina) mit a) den Echten Schweinen (Altweltliche Schweine) und b) den Nabelschweinen (Pekaris); 2.) Flusspferde ; 3.) Kamele 4.) Wiederkäuer (Ruminantia). Als Vertreter der Paarhufer wurde das Rind durch den Ansatz der BiXnom-Biokugel auf die BiXnom-Schwelle (siehe Pferd) gefunden. Das Rind ist ein Wiederkäuer und deckt dadurch nicht das Wildschwein (Sus scofa) aus der Familie der echten Schweine als Paarhufer ab. Das Wildschwein ist die Stammform des Hausschweins (Sus scrofa domesticus).
Wird die Kettenreaktion der BiXnom-Biokugeln nicht wie für die Hunde und Katzen zur Basisebene der Fische bewegt, sondern zurück in Richtung Pferd, entwickeln sich die Schweine, was bereits anhand der Zahnformel erkennbar ist. Die Eckzähne (Dentis canini) sind bei Männchen (Keiler) stärker ausgeprägt als bei Weibchen (Bache). Die Eckzähne der Bache wachsen nur bis zum 3. bis 4. Lebensjahr. Die Eckzähne sind wurzellose Zähne, die zeitlebens wachsen. Der Eckzahn (Canius) im Oberkiefer ist kleiner als der im Unterkiefer. Die Eckzähne wachsen im Ober- und Unterkiefer jeweils gleichgerichtet im Halbkreis nach oben. Die oberen Eckzähne wachsen zunächst schräg heraus, so dass sich die Zähne gegenseitig zu scharfen Waffen ständig anschleifen. Insgesamt werden 44 Zähne ausgebildet.
Besonderheiten: 1.) Die Kinndrüse als Mentalorgan (Landula mentalis) ist eine 5 mm hohe Hauterhebung mit Tasthaaren und einer Drüsenöffnung für das Drüsensekret. 2.) Duftdrüse als Karpalorgan (Organum carpale) auf der Innenseite der Vorderbeine oberhalb der Afterklauen. 3.) Einige Arten haben warzige Höcker im Gesicht. 4.) Die Nabelschweine (Pekaris) bilden eine Familie, die mit den echten Schweinen verwandt ist. Unterschiede: Statt 20-23 Schwanzwirbel nur 6-9. Im hinteren Drittel des Rückens ist nach einer Hauteinstülpung eine Duftdrüse vorhanden, die ein moschusartiges Sekret verspritzt. Die Eckzähne sind kürzer, wodurch sie nicht aus dem Maul ragen.
In der Symbolik wird die Kettenreaktion zur Basisebene mit dem Stern*=Rind als 1. Vorsprung gekennzeichnet (2. Vorsprung: Doppelstern**=Hund, 3. Vorsprung: Tripelstern=***= Katze). Ein Rücksprung wird als Potenz^ symbolisiert, d.h. das Schwein ist der 1. Rücksprung nach dem 1. Vorsprung (Stern mit Potenz *^= Schwein). Folgende Startzeiten werden verbrannt:
Time.Epi.X*^+Schwein= 0,000414044903297708; Time.Epi.Y*^+Schwein= 0,000418684528955711.
Rüssel
Die Zähne bilden sich in der Leitepisode Epi.X*^+Schwein mit der Zählgröße „115“. Ansonsten werden Knochen allgemein mit der Zahlgröße „225“ gefunden, jedoch diese auch im Oberkiefer über die Parallelepisode Epi.Y*^+Schwein ggf. mit „115“ vorhanden. Am weitesten vorn an der Schnauze (rostal) befindet sich das Zwischenkieferbein (Os incisivum) „115“ in der Parallelepisode: Epi.Y*^+Schwein.Z.25#167473811582284. Mit „22“ als Knochen wird das Rüsselbein (Os rostrale) avisiert, das dem Zwischenkieferbein aufsitzt und den Rüssel stützt. Typisch ist die nackte Rüsselscheibe mit ihren paarigen Nasenöffnungen an der Schnauze. Die Nasenlöcher sind statt rund 505 etwas oval 5005 als Haut=3 am Ende=9. Durch Drüsensekrete 77 (allgemeiner Wirkstoff=77) wird die Rüsselscheibe stets feucht gehalten: Epi.Y*^+Schwein.Z.51#820950056775903. Nasenscheidewand (Septum nasi) 511_011: Epi.Y*^+Schwein.Z.134#312451141011724. Das Rüsselbein (Os rostrale) „115“ liegt direkt hinter der Nasenscheidewand: Epi.Y*^+Schwein.Z.135#310136688115341.
Zähne
Die Zählgröße 115 wird für die Zahnbildung benötigt, so dass für den Unterkiefer mit seiner vorderen Zahnleiste die allgemeine Knochenzählung 225 als Bezug zum Zahn mit 511 kombiniert wird. Epi.X*^+Schwein.Z.4#103511225824427. Die Gruppe 2442 bezieht sich auf die inhaltsgleiche Zeile 400. Der Unterkiefer wird damit im Bereich der Backenzähne massiv verstärkt.
In der Zahnformel beschreiben kleine Buchstaben das Milchgebiss und Große Buchstaben das adulte Gebiss. Fehlt ein Milchzahn als kleines Symbol, gibt es im Milchgebiss keinen Vorläufer. Eine Zahl hinter dem Buchstaben ist die Reihenfolge bei mehreren Zähnen.
Milchgebiss (Dentes decidui) aus 28 Zähnen: 12 Schneidezähne (Dentes incisivi), 4 Eckzähne (Dentes canini) und 12 Prämolaren (Dentes praemolares). Zahnformel: Oberkiefer: 3i 1c 3p / Unterkiefer: 3i 1c 3p. Zahndurchbruch: 1.) Bei Geburt i3 und c sind durchgebrochen; 2.) nach 1. Monat p3 und p4 sowie Milchzangen (innere Scheidezähne) i1; 3.) nach 10 Wochen p2 (oben+unten) und i2 (nur unten); 4.) nach 12 bis 14 Wochen i2 im Oberkiefer; 5.) nach 3,5 Monaten=105 Tage: vollständiges Milchgebiss. Das Milchgebiss wird durch den folgende Zahnwechsel und die Ergänzung durch den Prämolaren P1 und die Molaren M1, M2 und M3 zum permanenten Gebiss (adultes Gebiss). Der Zahnwechsel: 1.) 10 Monate: Ersatz der Milcheckzähne c durch C. 2.) 10 bis 12 Monate: Wechsel der äußeren Schneidezähne i3 durch I3. 3.) 14 bis 16 Monate: Die inneren Schneidezähne „Milchzangen“ i1 durch I1 und die Prämolaren p2, p3, p4 werden durch P2, P3, P4 ersetzt. 4.)19 bis 20 Monaten: Die mittleren Schneidezähne i2 werden durch I2 ersetzt.
Adultes Gebiss (Dentes permanentes) aus 44 Zähnen:
Zahnformel: Oberkiefer: 3I 1C 4P 3M/ Unterkiefer: 3I 1C 4P 3M
Ergänzung der im Milchgebiss noch fehlenden Zähne: 1.) 4-8 Monate: M1; 2.) 6-7 Monate: P1; 3.) 12-14 Monate: M2; 4.) 21-24 Monate: M3; Der Molar bleibt nach 24 Monaten noch vom Zahnfleisch bedeckt, so dass das bleibende Gebiss erst nach 27 Monaten komplett ist. Es ist ein Weisheitszahn!
Schneidezähne i1, i2, i3 (Incisivi): Zählgröße 115 für 3 Zähne „1“ je Seite 313 , oben und unten 2_5_2 zusammen 12 Zähne wie enthalten und als Zeitregime=24 Stunden. Mit „3“ ist nur der 3. Zahn bei Geburt durchgebrochen. Das Milchgebiss ist nach 105 Tagen vorhanden, die als Spiegelbild „501“ vorliegen. Die Quersumme 45 kann als 4,5 Monate bis zum abgeschlossenen Zahnwechsel gelesen werden: Epi.X*^+Schwein.Z.36#115012473138252. Die Folgezeile widmet sich mit 111_9 unverkennbar dem Weisheitszahn des Schweins. Weil die Molare in Zeile 360 der Zeile 36 gleichen und die Schneidezähne keine Weisheitszähne sein können, ist mit hinten=9 und „erst später herauswachend“ mit 111_9 der Molar M3 adressiert. Der Zahn M3 bricht in der Anzahl 4 entsprechend der Vorgabe exakt nach 27 Monaten durch: Epi.X*^+Schwein.Z.37#1119040279183. Weil sich die Augenentwicklung kaum sichtbar weitläufig entwickelt, wird der Molar M3 als Nachkömmling bzw. Weisheitszahn als Platzhalter avisiert, womit die Augenzeilen zur Augenfunktion zusammenwachsen.
Eckzähne c (Canini): Zählgröße 115 für 1 Zahn je Seite als paarig „2“, oben und unten, zusammen 4 Zähne. Die 4 Eckzähne sind mit der Ziffer 9=seitlich und als Form=7 gespiegelt kombiniert zu 94_479. Die Zähne sind bei Geburt durchgebrochen: Epi.X*^+Schwein.Z.105#394328479331151. Wegen des Hormons 33 würden nur dem Männchen (Keiler) die Eckzähne wachsen. Es sind aber noch zusätzlich 3_3 vorhanden, so dass mit 33+33=66 auch das Weibchen (Bache) Eckzähne mit Einschränkungen erhält, d.h. die Zähne wachsen nicht wie beim Keiler zeitlebens. Mit Wachsen= 9 ergibt sich die Aussage aus der Quersumme 9+4+3+2+8+4+7+9= 46 Monate = 3,8 Jahre Zahnwachstum bei einer Bache. Die Folgezeile ist wegen der Zahlgröße „1“ auf den Zahn der Bache bezogen. Die 46 Monate Wachstumszeit für den Zahn der Bache 3_3_9933 mit 99 als Wachstum werden adressiert: Epi.X*^+Schwein.Z.106#390608399337461. Die Interpretation „Richtung=9“ kann auch als „Wachstum=9“ gelesen werden, so dass damit ein Zusammenhang zur Blutversorgung „Arterie=9“ als Voraussetzung für das Wachstum besteht.
Vordere Backenzähne (Prämolare) 115 werden einzeln aufgeführt:
1. Vorderer Backenzahn P1: Die Ziffer „2“ ist doppelt als paarig vorhanden, so dass es allseitig zusammen 4 Zähne sind. Kein Milchzahn als Vorgänger vorhanden. Zeitregime als 12 enthalten, so dass der P1 nach 6-7 Monaten „67126“ zutreffend durchbricht. Die 3 Prämolare p2, p3, p4 werden nachfolgend einzeln aufgeführt: Epi.X*^+Schwein.Z.355#116632367126115; 2. Vorderer Backenzahn P2: 4 Zähne mit „2“ als paarig und 97_9_QS1+6=7: Epi.X*^+Schwein.Z.357#115978964509162; 3. Vorderer Backenzahn P3: 4 Zähne mit „2“ als paarig und Zahndopplung “11“: Epi.X*^+Schwein.Z.358#115655000921148; 4. Vorderer Backenzahn P4: Zusammen 4 Zähne, wobei der Zahn mit Ziffer „2“ doppelt als paarig vorhanden ist: Epi.X*^+Schwein.Z.359#115332842144208.
Hintere Backenzähne (Molare) M1, M2, M3: Mit der Zählgröße 115 sind je Seite, oben und unten als „252“, je 3 Zähne „1“ als „313“ mit zusammen 12 Zähnen adressiert. Die Anzahl 12 Zähne und das Zeitregime sind enthalten. Die Zeile 360 ist der Zeile 36 ähnlich!: Epi.X*^+Schwein.Z.360#115012473138252.
Auge
Die Zähne ziehen sich weit über den Kopfbereich, so dass das Auge einerseits mitten im Zahnbereich liegt und anderseits sich weitgehend unsichtbar über einen extrem langen Zeilenbereich entwickelt. Das ist passend, wenn die Kopfhaltung des Schweins zum Boden gerichtet ist, und der Scan dadurch gestaucht wird. Das Auge wird als paarige „2“ Lochform 707 avisiert, die seitlich=9 und oben=9 am Kopf liegt: Epi.X*^+Schwein.Z.240#72518709707379. Über einen Zeilenbereich werden nach den unteren Augenlider 33, der Augapfel (Bulbus oculi) „515505“, die Augenwimpern „1“ und die oberen Augenlider 33 gebildet: Epi.X*^+Schwein.Z.245#16899791971335; Epi.X*^+Schwein.Z.247#167629515505145; Epi.X*^+Schwein.Z.250#165617961319083; Epi.X*^+Schwein.Z.252#16430353305464. Der Tränenapparat besteht aus Tränenröhrchen 111, Tränensack 0550, Tränenkanal 11_0 und Tränendrüsen 888: Epi.X*^+Schwein.Z.253#163654111975379; Epi.X*^+Schwein.Z.254#162370550312827; Epi.X*^+Schwein.Z.257#1611069662637; Epi.X*^+Schwein.Z.260#159248039729888.
Hornhaut (Cornea) 33: Beim Säugetier sind 5 Schichten vorhanden:
1.) vorderes Hornhautepithel (Epithelium corneae externum): Epi.X*^+Schwein.Z.265#156243359734984; 2.) Bowman-Membran (Lamina limitans superficialis): Epi.X*^+Schwein.Z.266#155655978683349; 3.) Substantia propria corneae: Epi.X*^+Schwein.Z.267#155072997489778; 4.) Descemet-Membran (Lamina limitans profunda): Epi.X*^+Schwein.Z.268#154494366902130; 5.) hinteres Hornhautepithel (Epithelium corneae internum) als Abschluss nach innen zur Augenkammer: Epi.X*^+Schwein.Z.269#153920038400635.
Bindehaut (Konjunktiva), oben und unten 33_33: Epi.X*^+Schwein.Z.270#153349964184336. Die Iris (Regenbogenhaut) 2222_909 ist adressiert auf den 2. Hirnnerv (Sehnerv) und als Nerv 7 allgemein, in der Funktion seitlich=9 als Begrenzung der Pupille 909. Die Haut=3 ist enthalten: Epi.X*^+Schwein.Z.272#152222390918275. Ziliarkörper (Strahlenkörper / Corpus ciliare) 1_5_1111: Epi.X*^+Schwein.Z.274#151111278575806. Augenlinse (Lens oculi) 505: Epi.X*^+Schwein.Z.275#150561783017349 und Epi.X*^+Schwein.Z.276#150016269310764. Basallamina 303 umschließt die Linse: Epi.X*^+Schwein.Z.277#149474694331303. Ziliarmuskel (Musculus ciliaris) 55: Epi.X*^+Schwein.Z.278#148937015574715.
Der Glaskörper (Corpus vitreum) liegt nicht als Volumenzeile vor, sondern als Hautgruppe 4433. Darin ist mit #14 die Ziffer „1“ ein Zeilenzähler und 4 die räumliche Form 7 des Glaskörpers. Epi.X*^+Schwein.Z.282#146824433793514. Die Folgezeile enthält eine Zeilenangabe als Ende des Glaskörpers in Zeile 305 vor der Netzhaut, die mit Gefäßen 9/8 und Blut Eisen=26 adressiert ist: Epi.X*^+Schwein.Z.283#146305619539826.
Hintere Augenkammer als Form 7 paarig als 7_90_90_7: Epi.X*^+Schwein.Z.284#145790458907644. Die Augenmuskeln sind mit dem Augapfel (Bulbus) verbunden und richten das Auge nach der Blickrichtung aus. Weil es 4 schräge und 4 gerade Muskelzüge sind, wird dafür der Zeilenlauf #1_44 genutzt: Die schrägen Muskeln werden über 2 Zeilen #1_44 gezogen, wobei der Muskel 55 je Zeile nur als 5 und verdeckt nochmals als Quersumme 1+4=5 erscheint. Schräger Muskel als Form 77, paarig „2“: 4 schräge Augenmuskeln: Epi.X*^+Schwein.Z.286#144770945208989 und Epi.X*^+Schwein.Z.287#14426651682847. 4 gerade Augenmuskeln 55: Epi.X*^+Schwein.Z.288#143765591422815. Der Glaskörper enthält die gelartige Füllung „Vitreous humour / vitreous fluid“. Enthalten ist die Hyaluronsäure als ein Polysaccharid, das für den Glaskörper des Auges, das Bindegewebe, die extrazelluläre Matrix der Zellen und die Synovialflüssigkeit der Gelenke verwendet wird. Im Molekül sind 6-Eck-Ringe enthalten, so dass allgemein mit „4“ als räumlich, „1_0“ als durchsichtig, der Form 77 und der Funktion des 2. Hirnnervs eine Auswahl erfolgen kann. Mit QS1+4=5_QS4+1=5 ist eine Symmetrie enthalten: Epi.X*^+Schwein.Z.290#142774104585417.
Die Sprunganweisung ist nur subjektiv auf der Suche nach der Netzhaut entstanden. Objektiv wird einerseits das Glaskörpervolumen aufgezogen und andererseits wird der Einschub eines fremden Objektes (kein Auge) symbolisiert: Üblicherweise werden der Ober- und Unterkieferknochen in der Leitepisode Epi.X*^+Schwein wie die Zähne mit „115“ gefunden. Weil die Zählgröße 115 für die Zahnbildung vollständig verbraucht wird, entstehen Unter- und Oberkieferknochen als allgemeiner Knochen 225, und zwar als Doppel in einer Zeile: Epi.X*^+Schwein.Z.293#141312253685225.
Der Glaskörper wird von der Netzhaut bis zur Linse vom Kanal „Canalis hyaloideus“ als Extra 9_8800 durchzogen, der während der Embryonalentwicklung die Arteria hyaloidea „9“ aufnimmt: Epi.X*^+Schwein.Z.296#39880034897874. Die Netzhaut der Säugetiere wird als Netzgruppe 44 in 10 Schichten avisiert, wobei 10_09 mit 09 das hintere Auge gezählt werden kann: Epi.X*^+Schwein.Z.301#137556446278308 und Epi.X*^+Schwein.Z.296#137100961356857. Die 10 Schichten werden in der Reihenfolge durchgezählt, die Zeilennummer Z.303 ist symbolisch geeignet und im Zeilenlauf #13 ist die Haut 3 stets enthalten:
1.) Die innere limitierende Membran (inner limiting membrane, ILM) bzw. Membrana limitans interna grenzt die Netzhaut zur Glaskörperseite ab; QS 3+6=9=Ende: Epi.X*^+Schwein.Z.303#136648482936537 [speziell beim Schweineauge: 3-4 Hauptarterien sind in die ILM eingebettet und entsenden ein kapillares Netzwerk in die NFL, GCL, IPL und INL].
2.) Die Nervenfaserschicht (nerve fiber layer, NFL) 1_7_1 enthält marklose Ganglienzellaxone und Typen von Astrozyten: Epi.X*^+Schwein.Z.304#136198981347930.
3.) Die Ganglienzellschicht (ganglion cell layer, GCL) enthält den Zellkern (Somata) der Ganglienzellen 575 und vereinzelter Amakrinzellen. Die Nervenfasern verlaufen bis zur Papille (Blinder Fleck, Discus nervus opticus), werden dort gebündelt 1_0 und verlassen das Auge als Sehnerv 2: Epi.X*^+Schwein.Z.305#135752427310724.
4.) In der inneren plexiformen Schicht (inner plexiforme layer, IPL) bilden die Dendriten der Ganglienzellen Kontaktstrukturen (Synapsen) zu verschiedenen Zellarten. In dieser Schicht liegen die Mikrogliazellen und einige Zellkerne von Ganglienzellenr: Epi.X*^+Schwein.Z.306#135308791927356.
5.) Die innere Körnerzellschicht (inner nuclear layer, INL) enthält die Zellkerne der Bipolar-, Amakrin-, Horizontal-, Interplexiform- und Müllerzellen: Epi.X*^+Schwein.Z.307#134868046676778.
6.) In der äußeren plexiformen Schicht (outer plexiforme layer, OPL) liegen die Synapsen zwischen Axonen der Stäbchen / Zapfen und Dendriten der Bipolar- und Horizontalzellen: Epi.X*^+Schwein.Z.308#134430163408347.
7.) Die äußere Körnerzellschicht (outer nuclear layer, ONL) enthält die inneren Segmente bzw. Somata der Stäbchen und Zapfen. In der Sehgrube (Fovea centralis) ist die Schichtdicke verstärkt.
[Speziell bei Schweineauge: Die Sehgrube liegt im Zentrum des gelben Flecks und ist der Bereich des schärfsten Sehens, ob beim Schwein tatsächlich ein Vertiefung als „Grube“ ausgeformt, ist ungewiss. In der Schicht der Stäbchen und Zapfen (Stratum neuroepitheliale) überwiegen die Stäbchen die Anzahl der Zapfen (7%), wobei sich die Zapfendichte im Zentrum Area centralis) 14:1 und in der periphere 3:1 verändert. Die maximale Empfindlichkeit der Zapfen wird bei Wildschweinen im Bereich von 439 bis 556 nm geschätzt. Schweine können blau und gelb unterscheiden. In einer Quelle wird der Zapfentyp blau und der 2. Typ sogar als rot bezeichnet. Daher würde sich der Farbbereich nicht wesentlich vom Menschen unterscheiden]. Aus dem Ziffernbild können 433 nm und 511 bis 582 nm entnommen werden: Epi.X*^+Schwein.Z.309#133995114335828.
8.) Die äußere limitierende Membran (external limiting membrane, ELM) liegt zwischen dem Außen- und Innenglied der Photorezeptorzellen. Die Schicht wird aus bandförmigen Zellkontakten (Zonula adhaerentes) 151 gebildet: Epi.X*^+Schwein.Z.310#133562872031519.
9.) Die Photorezeptorschicht 133_133 enthält die äußeren, pigmentierten Photorezeptorsegmente (PRS) der Stäbchen und Zapfen. Die Zapfen dienen beim Tagessehen zur Farbunterscheidung. Die Stäbchen dienen ohne Farnunterscheidung dem Dämmerungssehen: Epi.X*^+Schwein.Z.311#133133409420485.
10.) Das Pigmentepithels (RPE) enthält melaninhaltige Zellen und ist durch die Bruchsche Membran von der Aderhaut (Choroidea) abgegrenzt: Epi.X*^+Schwein.Z.312#132706699774907.
Übergang zum Sehnerv: Blinder Fleck als Formloch 7_0 in der Netzhaut 33 als Ausgang des Sehnervs 22_7: Epi.X*^+Schwein.Z.313#132282716708533. Tapetum nigrum: Zwischen Netzhaut und der Lederhaut befindet sich im oberen (dorsal) Augenbereich bei einigen Säugetieren eine reflektierende Schicht (Tapetum lucidum / “leuchtender Teppich“), die beim Schwein fehlt. Die Netzaut (Retina) ist im Bereich des Tapetum lucidum pigmentlos, so dass die Strahlen als Restlichtverstärker nochmals auf die Netzhaut treffen. Das Schwein besitzt somit keinen Restlichtverstärker. Die untere nicht reflektierende Schicht (Tapetum non lucidum / Tapetum nigrum) ist durch Pigmente der Aderhaut und des Pigmentepitheld der Retina dunkel eingefärbt. Die Pigmente 8 sind der unteren Netzschicht 44282 als Tapetum nigrum zugeordnet und in der oberen Schicht ist die Reflexion mit 44_3_717 gesperrt, d.h. für ein Tapetum licidum wäre eine durchsichtige Form 707 nötig: Epi.X*^+Schwein.Z.315#131442826443717. Nervenfaserbündel 131_0: Die Sehleistung steigert sich in Abhängigkeit von der Tierart mit der Anzahl der Nervenfasern. Beim Schwein sind mit dem 2. Hirnnerv „68_68“ paarig vorhanden. Am rechten Zahlenrand stehen nach der gespiegelten 86 beliebig viele Nullen zur Verfügung. Im Ergebnis besitzt das Schwein 680000 Nervenfasern in 1 Sehnerv als 2. Hirnnerv (1_0_2). Aderhaut (Choroidea) 33 und durchgeleiteter Sehnerv (Nervus opticus) 202: Epi.X*^+Schwein.Z.317#130613534163315; Epi.X*^+Schwein.Z.318#130202799779154. Lederhaut (Sklera) 33 und durchgeleiteter Sehnerv (Nervus opticus) 202: Epi.X*^+Schwein.Z.317#126233202224911 und Epi.X*^+Schwein.Z.317#124712320270394.
Wirbelsäule
7 Halswirbel (Vertebrae cervicales) 115: 1. Halswirbel (Atlas): Epi.X*^+Schwein.Z.446#928351801115938; 2. Halswirbel (Axis): Epi.X*^+Schwein.Z.317#73542611598172; Weitere Halswirbel: Z.677, Z.704, Z.843, Z.877. 7. Halswirbel (Axis): Epi.X*^+Schwein.Z.317#451521159539486
13 Brustwirbel (Vertebrae thoracicae) 115: 1. Brustwirbel: Epi.X*^+Schwein.Z.1006#411575450594144; 2. Brustwirbel: Epi.X*^+Schwein.Z.1050#394328479331151; 3. Brustwirbel: Der Knochen ist zwar verstärkt „1115“ wird aber wegen der Zählgröße „1“ als Wirbel akzeptiert: Epi.X*^+Schwein.Z.1204#343891115695771; 4. Brustwirbel: Es ist eine Dopplung 11_115_1 vorhanden, so dass alternativ 1 Brustwirbel zusätzlich entstehen könnte (15 statt 14): Epi.X*^+Schwein.Z.1241#333638117081151; Weitere Brustwirbel: Z.1287, Z. 1329, Z.1414, Z.1608, Z.1656, Z.1773, Z.1957. 12. Brustwirbel: Der Zählung als Wirbel ist ggf. zu unbeweglich und kann als Wirbel nicht akzeptiert werden. Es ist möglich, dass alternativ nur 13 statt 14 Wirbel vorhanden sind: Epi.X*^+Schwein.Z.1973#209855500911155. 13. Brustwirbel: Epi.X*^+Schwein.Z.2017#205277592115869. 14. Brustwirbel: Mit 151_1155 ist eine 2. Dopplung erkennbar, so dass alternativ statt 14 Brustwirbel bis 16 Brustwirbel entstehen können: Epi.X*^+Schwein.Z.2068#200215136991155.
6 Lendenwirbel (Vertebrae lumbales): Es sind regulär 6 Lendenwirbel vorhanden, wobei sich die Anzahl wegen der Variationen der Brustwirbel ebenfalls um Plus/Minus-1 Lendenwirbel (4-7) ändert: 1. Lendenwirbel: Epi.X*^+Schwein.Z.2147#19284811518291; 2. Lendenwirbel: Epi.X*^+Schwein.Z.2166#191156465049727; 3. Lendenwirbel: Epi.X*^+Schwein.Z.2201#188116721171153; 4. Lendenwirbel: Epi.X*^+Schwein.Z.2335#177321157729211; 5. Lendenwirbel: Epi.X*^+Schwein.Z.2704#153123115124892; 6. Lendenwirbel: Epi.X*^+Schwein.Z.2864#144568751151435.
4 Kreuzwirbel (Vertebrae sacrales) 115: 1. Kreuzwirbel: Epi.X*^+Schwein.Z.2873#144115873058722; 2. Kreuzwirbel: Epi.X*^+Schwein.Z.2995#138245376727115; 3. Kreuzwirbel: Epi.X*^+Schwein.Z.3026#136829115432157; 4. Kreuzwirbel: Epi.X*^+Schwein.Z.3207#129106611567729.
20-23 Schwanzwirbel (Vetrebrae caudales) 115: Es liegen in 3 Zeilen eine „11“ als Dopplung vor, so dass alternativ statt 23 auch 26 Schwanzwirbel entstehen können. Sind die Sehnen beidseitig nicht symmetrisch, entsteht bei dieser Rasse dann ein platzsparender Ringelschwanz, der keiner Fliege ein Haar krümmen kann: 1. Schwanzwirbel: Epi.X*^+Schwein.Z.3207#129106611567729. Weitere Schwanzwirbel: Z.3211, Z. 3272, Z.3287, Z.3476, Z.3550 (doppelt). 7. Schwanzwirbel: Etwa ab dem 7. Schwanzwirbel ist der Schwanz äußerlich vorhanden. Ab dem 7. Wirbel beginnt eine Serie #115, die von den Nabelschweine (Pekaris) mit nur 6-9 Schwanzwirbel ignoriert werden kann: Epi.X*^+Schwein.Z.3570#115978964509162. Weitere Schwanzwirbel: Z.3571, Z.3572, Z.3573, Z.3574, Z.3575 , Z.3576 (doppelt), Z.3577 , Z.3578 , Z.3579 , Z.3580 (doppelt), , Z.3581 , Z.3582. 20. Schwanzwirbel: Epi.X*^+Schwein.Z.3283#115558164470474. 21. Schwanzwirbel: Epi.X*^+Schwein.Z.3584#115525921679048. 22. Schwanzwirbel: Epi.X*^+Schwein.Z.3585#115493696875232. 23. Schwanzwirbel: Epi.X*^+Schwein.Z.3586#115461490043979. Ab dem 3. Schwanzwirbel verschwinden zunehmend die Bögen und Fortsätze der Wirbel und bestehen dann aus mit Knorpelscheiben verbundenen Knochenkörpern.
Teil A: Vordergliedmaßen
1.) Schulterblatt (Scapula): Das Schlüsselbein (Clavicula), und das Rabenschnabelbein (Os coracoideum) sind bei den Säugetieren stark zurückgebildet, so dass nur das Schulterblatt als Knochen #225 gezählt wird. Evolutionär wird das rudimentäre Schlüsselbein als eine funktionslose Sehne 1 betrachtet, die in einem Muskel 55 liegt. Beim Schwein ist das Schlüsselbein wie ein regulärer Knochen 225 vorhanden, wobei die Knochendefinition durch das Hautsymbol „33“ abgeschwächt wird. Die Einbettung der Sehne in den Muskel ist als „515“ adressiert:
Rudimentäres Schlüsselbein: Epi.X*^+Schwein.Z.1096#377778196439515 und Epi.X*^+Schwein.Z.1097#377433822513864. Als Rudiment des Rabenschnabelbeins (Os coracoides) ist am Schulterblatt ein Rabenschnabelfortsatz (Processus coracoideus) 522 undeutlich ausgeprägt. Epi.X*^+Schwein.Z.1147#360980735220321. Schulterblatt 225: Epi.X*^+Schwein.Z.1153#359102257847102. Schulterblattgräte 7_11_7: Epi.X*^+Schwein.Z.1148#360666292071175. Schultergelenk 090: Epi.X*^+Schwein.Z.1164#355708679809028 und Gelenkknorpel 33 Epi.X*^+Schwein.Z.1165#355403350470136.
2.) Oberarmknochen (Humerus) 225: Epi.X*^+Schwein.Z.1187#348816262255862 Ellenbogengelenk 707: Epi.X*^+Schwein.Z.1253#330442859774707.
3.) Unterarmknochen aus Speiche (Radius) und Elle (Ulna): Beim Pferd, Rind und Schwein liegen Elle und Speicher dicht zusammen, so dass beim Schwein nur 1 Zeile zur Verfügung steht, die beide Knochen als Verstärkung „2225“ enthält. Beide Knochen sind in voller Länge vorhanden: Epi.X*^+Schwein.Z.1254#330179348722256. Der Knochen liegt direkt am Gelenk, so dass die Elle (Ulna) gesondert als Extra 522_8 gebildet wird: Epi.X*^+Schwein.Z.1295#319725794052285.
4.) Handwurzelknochen: Beim Schwein sind sämtliche 8 Karpalknochen vorhanden, die in 2 Reihen angeordnet sind: Erste Knochenreihe 225: Os carpi radiale (Kahnbein), Os carpi intermedium (Mondbein), Os carpi ulnare (Dreiecksbein), Os carpi accessorium (Erbsenbein): Epi.X*^+Schwein.Z.1326#312251058293898. Zweite (distale) Knochenreihe 225: Os carpale primum (großes Vieleckbein), Os carpale secundum (kleines Vieleckbein), Os carpale tertium (Hauptbein), Os carpale quartum (Hakenbein): Epi.X*^+Schwein.Z.1370#302222557151612.
5.) Mittelhandknochen: Von den 5 Mittelhandknochen sind beim Schwein nur 4 Mittelhandknochen ausgebildet (Ossa metacarpalia II bis V). Die beiden äußeren Metakarpalknochen (Ossa metacarpalia II+V) 5_222_5, seitlich=99, paarig=2 für beide Vorderbeine: Epi.X*^+Schwein.Z.1470#281663199522251. Die beiden inneren Metakarpalknochen (Ossa metacarpalia III+IV) 55225: Epi.X*^+Schwein.Z.1577#26255225320083.
6.) Zehenknochen der Hand (Ossa digitorum manus): Die 2 äußeren Nebenzehen und die 2 inneren Hauptzehen besitzen jeweils 3 Zehenglieder (Phalanges proximalis, media und distalis), die in 6 Zeilen adressiert werden. Zur Kontrolle müssen im Zeilenlauf die 6 Fingergelenke vorliegen. Falls Sesambeinen bekannt sind, können diese ermittelt werden.
6.1) Phalanx proximalis: Zehengrundgelenk (Articulationes metacarpophalangeae) der beiden Nebenzehen 707: Epi.X*^+Schwein.Z.1610#257170747389881 (äußere Sattelgelenke). Zehengrundgelenk (Articulationes metacarpophalangeae) der beiden Hauptzehen 707: Epi.X*^+Schwein.Z.1618#255899198577076 (innere Sattelgelenke). 6.1.1) Phalanx proximalis – äußere Nebenzehe 225: Epi.X*^+Schwein.Z.1685#245723978218225. 6.1.2) Phalanx proximalis - innere Hauptzehe 225: Epi.X*^+Schwein.Z.1774#233396225083263. Zehenmittelgelenk (Articulationes interphalangeae proximales manus) der beiden Nebenzehen 101: Epi.X*^+Schwein.Z.1691#24485210129965 (äußere Sattelgelenke). Zehenmittelgelenk (Articulationes interphalangeae proximales manus) der beiden Hauptzehen: Epi.X*^+Schwein.Z.1800#230024946276505 (innere Sattelgelenke).
6.2) Phalanx media: 6.2.1) Phalanx media – äußere Nebenzehe 225: Epi.X*^+Schwein.Z.1788#231568737862253. 6.2.2) Phalanx media - innere Hauptzehe 225: Epi.X*^+Schwein.Z.1801#229897225595618. Zehenendgelenk ( Articulationes interphalangeae distales manus) der beiden Nebenzehen 505: Epi.X*^+Schwein.Z.1800#230024946276505 (äußere Sattelgelenke). Zehenendgelenk (Articulationes interphalangeae distales manus) der beiden Hauptzehen 202: Epi.X*^+Schwein.Z.1804#229514913136202 (innere Sattelgelenke).
6.3) Phalanx distalis: Nach Quellenangaben besitzen die Nebenzehen und die Hauptzehen außer den 3 Zehengliedern jeweils auch Sesambeine, wobei die Phalanx distalis benannt wurde. Folglich ist von Sesambeinen an der Phalanx distalis an den Neben- und Hauptzehen auszugehen. Die Zehenendglieder entstehen am Beginn einer Serie #225. Aufgrund eines Überschusses von Möglichkeiten ist es zweckmäßig, wenn sich in der Phalanx distales jeweils vor dem Zehenglied ein Sesambein am Gelenk bildet und das Zehenglied selbst dadurch 1 Position weiter zieht. 6.3.1) Phalanx distalis – Sesambein an äußeren Nebenzehen 225: Epi.X*^+Schwein.Z.1833#225883744297713. 6.3.2) Phalanx distalis – äußere Nebenzehe 225: Epi.X*^+Schwein.Z.1834#225760579769743. 6.3.2) Phalanx distalis – Sesambein an inneren Hauptzehen 225: Epi.X*^+Schwein.Z.1835#22563754948104. 6.3.4) Phalanx distalis - innere Hauptzehe 2255: Epi.X*^+Schwein.Z.1836#22551465321226.
Teil B: Hintergliedmaßen
1.) Beckengürtel (Cingulum membri pelvini): Darmbein 225: Beginn am 6. Lendenwirbel: Epi.X*^+Schwein.Z.2858#144872254477855; Gelenkflächenknorpel 333 am Iliosakralgelenk: Epi.X*^+Schwein.Z.2875#144015618538333. Kreuzbein-Darmbein-Gelenk (Iliosakralgelenk) 550_055: Epi.X*^+Schwein.Z.2877#4391550340553. Hüftgelenk mit der Beckenpfanne (Acetabulum) 66_03__30_64_03: Die 3 Beckenknochen (Darmbein, Schambein, Sitzbein) treffen in einer Y-Naht zusammen: Epi.X*^+Schwein.Z.2877#136603399306403. Das Foramen obturatum ist eine paarige Öffnung im Becken zwischen dem Schambein (Os pubis) und dem Sitzbein (Os ischii): Epi.X*^+Schwein.Z.3071#134824130022048. Schambeinfuge (Symphysis pubica) 1111: Epi.X*^+Schwein.Z.3151#131401111805049. Sitzbeinende vor dem 1. Schwanzwirbel 200999: Ende=9: Epi.X*^+Schwein.Z.3173#130490042009993.
2.) Oberschenkelknochen (Os femoris / Femur) 225: Der Oberschenkel setzt im Zeilenlauf etwas früher an, als der Beckengürtel schwanzseitig endet: Epi.X*^+Schwein.Z.3097#13369225162987. Kugelkopf am Hüftgelenk als seitlich „9“ herausgestellte Struktur 909_5555: Epi.X*^+Schwein.Z.3098#133649097255555. Kniescheibe (Patella) 225: Epi.X*^+Schwein.Z.3308#125164722883225. Kniescheibengelenk (Articulatio femoropatellaris) 505: Epi.X*^+Schwein.Z.3311#125051314798462. Kniekehlengelenk (Articulatio femorotibialis) 202: Epi.X*^+Schwein.Z.3320#124712320270394.
3.) Unterschenkelknochen: Das Wadenbein (Fibula) bildet mit dem Schienbein (Tibia) das Unterschenkelskelett. Schienbein (Tibia) 225: Epi.X*^+Schwein.Z.3318#124787493459225. Die beiden Knochen wirken als Gruppe 444_25_25 zusammen: Epi.X*^+Schwein.Z.3327#124449925848425. Wadenbein (Fibula) 225: Epi.X*^+Schwein.Z.3333#12422589357867. Beim Schwein sind Tibia und Fibula durch 2 straffe Gelenke 909 verbunden: 1.) Articulationes tibiofibularis proximalis: Epi.X*^+Schwein.Z.3340#123965539909494. 2.) Articulationes tibiofibularis distalis: Epi.X*^+Schwein.Z.3361#123190985807114.
4.) Hinterfußwurzelknochen bzw. Tarsalknochen (Tarsus): Der Tarsus als Verbindung zwischen dem Unterschenkel (Crus) und den Hintermittelfußknochen (Ossa metatarsalia / Metatarsus)
Am Sprunggelenk sind das distale Ende der Tibia und die Fibula und anderseits die Mittelfussknochen Ossa metatarsalia II-V beteiligt. Das Gelenk selbst wird aus 7 Tasalknochen gebildet, die in 3 Reihen sortiert werden können. Der Calcaneus wird zuerst aufgeführt, weil er aufgrund seiner Größe und Lage im Scann zuerst erscheint. 1. Reihe) Calcaneus, Talus, 2. Mittlere Reihe: Os tarsi centrale 3. Reihe: Os tarsale II-V.
4.1) Obere (proximale / krurale) Reihe: Fersenbein (Calcaneus) 225: Epi.X*^+Schwein.Z.3378#122571019330287. Sprungbein (Talus) 225: Epi.X*^+Schwein.Z.3379#122534744983045. 4.2) Mittlere (intertarsale) Reihe: Os tarsi centrale 225: Epi.X*^+Schwein.Z.3417#121172052472259. 4.3) Untere (distale /metatarsale) Reihe: Os tarsale (Nr. 2-5) 225: Epi.X*^+Schwein.Z.3597#115108396802254; Mit den 6 Zeilen werden 7 Tarsalknochen abgebildet, weil „2225“ eine Dopplung enthält: Epi.X*^+Schwein.Z.3717#11139222579976; Epi.X*^+Schwein.Z.3801#108930519152252.
5.) Mittelfußknochen (Ossa metatarsalia): Wie beim Menschen können bei den Haussäugetieren 5 Metatasalknochen (Os metatarsale I-V) vorhanden sein. Das Schwein besitzt dagegen nur 4 Mittelfußknochen (Os metatarsale II-V). Die beiden äußeren Knochen werden als Symmetrie 80_08 mit einer Lücke 500 dargestellt: Os metatarsale II+V Epi.X*^+Schwein.Z.3831#108077500208225. Die beiden mittleren Knochen werden mit 880 in der Lücke platziert und bilden mit 535_9 die vordere Doppelspitze: Os metatarsale III+IV: Epi.X*^+Schwein.Z.3930#105354937225880.
6.) Zehenknochen des Fußes Hand (Ossa digitorum pedis): Die 4 Zehenknochen liegen an den 4 Mittelfußknochen an. Zunächst wird eine Zehenknochen-Gruppe gebildet, die eine Formaussage für die Gruppe mit 2_44_2_7 vorgibt: Ablesbar sind 4 Zehenstrahlen, wovon die beiden äußere mit 2/4=50% kürzer sind. Das sind dann die beiden kürzen Afterklauen, die aber ebenfalls jeweils aus jeweils 3 Zehengliedern bestehen. Epi.X*^+Schwein.Z.4000#103511225824427.
Die äußere Afterklaue ist länger als die innere. Die hintere Afterklaue ist etwas höher angesetzt und erreicht den Boden nicht. Die Zeile 4000 unterscheidet sich in der Aussage nicht von der Zeile 4, in der sie eine andere Bedeutung hat. Wegen der 4 Strahlen können es die 4 Begrenzungslinien der beiden Unterkiefer-Zahnleisten sein, die mit „511“ gebildet werden.
Für die 3 Zehenglieder werden mit dem Unterschied von Afterklaue und Hauptklaue 6 Zeilen gebildet. Die Afterklaue ist am rechten Zahlenrand als „1“ erkennbar.
6.1) Phalanx proximalis: 6.1.1) Phalanx proximalis der Afterklaue: Epi.X*^+Schwein.Z.4049#10225855848301. 6.1.2) Phalanx proximalis der Hauptklaue (Fesselbein): Epi.X*^+Schwein.Z.4106#100838992522579.
6.2) Phalanx media: 6.2.1) Phalanx media der Afterklaue: Epi.X*^+Schwein.Z.4349#952046225103951. 6.2.2) Phalanx media der Hauptklaue (Kronbein): Epi.X*^+Schwein.Z.4399#941225058644484.
6.3) Phalanx distalis: 6.3.1) Phalanx distalis der Afterklaue: Epi.X*^+Schwein.Z.4433#93400609812251; 6.3.2) Phalanx distalis der Hauptklaue (Klauenbein): Epi.X*^+Schwein.Z.4437#933164082257626.
Der Klauenschuh besteht aus Hornwand, Hornsohle und Hornballen. Ähnlich wie beim Pferdehuf ist eine „weiße Linie“ vorhanden, an der die Hornschichten von Sohle und Wand zusammentreffen. Die Hufkapsel hatte sich dort in der Leitepisode Epi.X ab #533 gebildet. In der Parallelepisode Epi.Y bilden sich dort gleichzeitig die Haut und das Haar. Die Ausbildung des Klauenschuh ist entsprechend zu erwarten ab: Epi.X*^+Schwein.Z.7734#535356740752144. Die Klauen des wiederkäuenden Haarwildes und die Klauen des Wildschweins werden in der Jägersprache als Schalen bezeichnet, woraus der Begriff „Schalenwild“ resultiert.
BiXnom_Schwein_dat09.11.2021
Elefant
Die Elefanten (Elephantidae) sind die einzig überlebende Familie der Rüsseltiere (Proboscidea) einer Ordnung der Säugetiere. Die auffälligsten Merkmale der Elefanten sind außer der Körpergröße ihr langer Rüssel und die Stoßzähne. Es leben noch 3 Arten auf der Erde: Afrikanischer Elefant (Loxodonta africana) [Afrifant], Waldelefant (Loxodonta cyclotis) und Asiatischer Elefant (Elephas maximus) [Indifant]. Die Zahnformel ist bei allen gleich: Oberkiefer 1.0.3.3 / Unterkiefer 0.0.3.3 [Im Oberkiefer paarig 1 Schneidezahn als Stoßzahn; keinen Eckzahn; paarig 3 Prämolare und 3 Molare sowie im Unterkiefer keinen Schneidezahn und keinen Eckzahn, paarig 3 Prämolare und 3 Molare]. Unterschiede: Der Afrikanische Elefant besitzt eine größere Körpergröße, die größeren Ohren, aber auch die längeren Stoßzähne, die bei beiden Geschlechter imposant sind. Fundamental ist der Unterschied an den Zehen: Der Afrikanische Elefant besitzt mit 4 Zehen an den Vorderbeinen und 3 Zehen an den Hinterbeinen jeweils 1 Zeh weniger. Am Rüssel besitzt der Afrikanische Elefant mit 2 fingerartigen Rüsselspitzen eine Rüsselspitze mehr. Forschungsergebnisse zur Anatomie des Elefanten liegen in der Bibliothek der Veterinärmedizinischen Universität Wien vor.
Die Zähne und Wirbel sind das mathematische Raster im Bauplan eines Geschöpfes. So wie Tierarten mit dem Körperende in eine Zählgrößen-Serie #115 als Schwanzwirbel geraten können, ereignet sich dieses bei den Elefanten mit dem Gebiss. Für die Backenzähne wird wie beim Revolvermagazin stets nur eine Position als Zahnmunition verbraucht und dann wird 5-mal im Leben des Elefanten nachgeladen. Nach dem Verschleiß der 4 (Seiten) mal 6 (Zähne) = 24 Backenzähne verhungert der Elefant, sofern er nicht bereits durch Elfenbein-Wilderer erlegt wurde. Der Backenzahn selbst ist ebenfalls als Serie in Lamellenform gestaltet. Die Lamellen verschleißen und werden beim Vorschub des Ersatzzahns lamellenweise vorgeschoben und fallen vorn heraus. In einer Zwischenphase liegen mit dem alten und dem neunen Zahn 2 Zähne vor, so dass wegen der gesteigerten Nahrungsaufnahme das Gewicht phasenweise extrem zunimmt. Vor dieser Backenzahn-Serie liegt zunächst ein Zeilenbereich, der den Rüssel als Nasenspitze bildet, zugleich ist eine einzelne Zahnposition für den Stoßzahn enthalten.
Ebenso wie das Pferd die enorme Masse des Körpers optimal säulenartig als Last zum Boden abträgt, und nur wenige Stunden liegend schläft, ruht auch der Elefant stehend und senkt dabei den Rüssel zum Boden ab. Das Pferd entwickelt sich auf der BiXnom-Schwelle, die nicht überdehnt werden kann. Folglich muss eine Kettenreaktion unter Einfluss der BiXnom-Biokugel nach innen als „Rind (*)“ erfolgen, um durch den 1. Rücksprung als „Schwein (*^)“ und den 2. Rücksprung als „Elefant (*^^)“ noch in Nähe des Pferdes zu bleiben. Ohne Rücksprung folgen weiter nach innen in Richtung der Basisebene der Fische (Minor^5) der „Hund (**)“ und die „Katze (***)“. Folgende Startzeiten werden verbrannt:
Time.Epi.X*^^+Elefant= 0,000414025250534301; Time.Epi.Y*^^+Elefant= 0,000418653155460348.
Rüssel
Beim Rüssel (Proboscis) ist die Funktion der Nase mit der Oberlippe zu einem Muskelschlauch ohne Knochen verwachsen. Ein Knorpelgewebe ist nur am Schädel vorhanden, um die beiden Nasenlöcher zu trennen. Auf der Unterseite (ventral) des Rüssels sitzen auf horizontalen Querfalten seitlich paarige Noppen, die durchgehend eine paarige Papillarleiste bilden. Offensichtlich handelt es sich um Rüssel-Struktur-Zählgrößen, die ersatzweise für die fehlenden Wirbel #115 zählbar sind. Der Rüssel kann damit sektionsweise zusammengesetzt werden. Wäre die Anzahl bekannt, könnten beispielsweise Zeilen „1“ als Zählgröße und „5“ als Muskelstruktur durchgezählt werden. Es kann in beiden Episoden gezählt werden, so dass die Ziffer 2 für paarig nicht enthalten sein muss. Der Elefant nutzt die Zeilennummer Z.7 um eine Form=7 zu adressieren. Hierzu wird als weitere Besonderheit mit der „64“ die Noppen-Kreisform symbolisiert. Somit bildet „6464“ mit seitlich=9 eine doppelte Noppenleiste, die eine Struktur=5 auf der Haut=3 bildet und als Zählgröße „1“ über die Rüssellänge mehrfach kopiert wird: Epi.X*^^+Elefant.Z.7#59146464362043. Ab der 8. Zeile = 8. Querfalte können dann Noppen erwartet werden. Die horizontalen Falten verfeinern sich zur Rüsselspitze, so dass an der Rüsselspitze ohnehin kein Platz für die Noppen verfügbar ist. Der Rüssel ist etwas zu lang, so dass er beim Gehen vorgestreckt oder eingerollt wird.
Die Leitepisode adressiert mit dem klassischen Strukturloch „505“ die Nase als Rüssel, darin ist der doppelte Rüsselfinger des „Afrifanten“ als 2_5_2 enthalten. Die Quersumme 4+1+4=9 positioniert den Rüssel mit der Symmetrie 414 als „QS 9=vorn“, die „9“ selbst hätte seitlich bedeuten können. An der Rüsselspitze sind Tasthaare als Zählgröße „1“ am rechten Zahlenrand vorhanden, wobei die Hautfunktion 33 räumlich 4 als „343“ adressiert ist. Der Rüsselfinger sitzt am Rand einer ebenen Fläche aus der die beiden Nasenlöcher „0_0“ austreten. Mit 0_2525_0 ergibt sich wegen QS 2+5=7 ein Form 0_7_7_0 mit der Zahl 4 als Fläche: Epi.X*^^+Elefant.Z.1#414025250534301. Der „Indifant“ findet seinen einfachen Rüsselfinger 505_0_1_0 in Epi.X*^^+Elefant.Z.5#828050501068602. Der Rüssel kann Wasser aufsaugen, aber nicht als „Trinkhalm“ weiterleiten. Die Pflanzennahrung wird mit dem Rüssel in Kleinmengen von ca. 75 g portioniert. Der Rüssel dient der Atmung und ist keine muskulöse Speiseröhre „505“. Mit „505“ werden die muskulösen Rüssel-Nasenlöchern (Tubuli nasales) gebildet. Folglich muss allgemein für den Verdauungsweg „808“ gewählt werden. Der Rüssel dient nur als Greifarm unterstützt aber die Nahrungsaufnahme, so dass der Rüssel mit „8008“ queroval und flexibel 6 geformt 7_6_7 wird als ein Extra „8“ des Verdauungsweges: Epi.X*^^+Elefant.Z.5#138008416844767.
Zum Start des Zeilenlaufs liegt stets eine relativ große Zahl vor, so dass sich im Vergleich zum Zeilenfortschritt beim Elefanten rechts 2 Nullen stehen, die einen schlanken Rüssel symbolisieren. Der Kopf ist folglich im Gegensatz sehr breit. Die schlanke Rüsselform ist zunächst mit den aufgebrauchten Nullen „...00“ in Zeile 45 der Parallelepisode beendet. Die Zeilennummer 44 und die „4444“ sind eine Raumgruppe. Die „64“ ist eine besondere biologische Steuergröße entweder mit QS 6+4=10 als Bezug zum 10er Bixnom Schwingkreis bzw. hier als Bezug zur Bixnom-Gravitationslinse für die Ausrundung des Rüssels zum Kopf hin: Epi.Y*^^+Elefant.Z.44#951484444228064. Hierzu liefert die Folgezeile als Fortsetzung der Gruppe „44“ die fehlende Rüssel-„O (Null)“ für den Übergangsbereich: Epi.Y*^^+Elefant.Z.45#930340345467440.
Beim Menschen besitzt der Oberlippen –und Nasenflügelheber den längsten Namen „Musculus levator labii superioris alaeque nasi“. Der obere Längenmuskel „Musculus levators proboscidis“ „55“ setzt oben am Rüssel an und zieht als Rüsselheber durch den gesamten Rüssel zum Stirnbein, weil Z. 1 wie Z.100: Epi.Y*^^+Elefant.Z.1=Z.100#418653155460348. Eine andere Quelle bezeichnet den oberen (dorsalen) Muskel als „Musculus maxillolabialis“. Unterseitig zieht der „Musculus depressores proboscidis“ „55“ als Gegenspieler durch den Rüssel zum Zwischenkieferbein (Os intermaxillare): Epi.Y*^^+Elefant.Z.3#139551051820116. Nach einer anderen Quelle wird der untere (ventrale) Muskel als „Musculi Buccinatorii“ bestehend aus „Pars supralabialis“ und „Pars rimana“ bezeichnet.
Die vorhandenen Quermuskeln 55 müssen als quer=QS 6+9+7+7+5+5+2+5+9=55 mit der folgenden „100“ bis zur Zeilennummer Z.100 angelegt werden. Die Zeilennummer wird mit der Zahl „59+1=60“ aktiviert, weil sich die Zeile 6 als Zeile 60 wiederholt. Diese Mathematisierung ist für den Elefanten typisch: Epi.Y*^^+Elefant.Z.6#697755259100580.
Die Muskeln des Rüssels werden beidseitig vom Proboscisnerv durchzogen und innerviert, so dass sich eine Verzweigungsstelle zeigen muss. Der Nerv entsteht aus dem mittleren Ramus maxillaris des Nervus facialis und aus Ästen des Nervus trigeminus. Aus dem Nerv „7_2_7777“ entsteht paarig der Proboscisnerv 707 im Rüssel „Null“. Ob bereits im Rüssel eine Riechschleimhaut „33“ vorhanden ist, wird in der Literatur nicht erwähnt. Hier wird die Haut „33“ mit der Quersumme QS 3+2+7+0+7+2+7+7+7+7+0+3+3=55 auf den Muskel umgeschaltet. Der Restbetrag ergibt als QS 55+9+7=26 das Blut wie Eisen=26. Der paarige Nerv ist trotz „Nase“ kein 1. Hirnnerv (Riechnerv) und läuft daher allgemein als „777“ über die Zeilen Z.110, Z.92, Z.65, Z.20, Z.11 vor bis Epi.Y*^^+Elefant.Z.2#209326577730174.
Die Nasenscheidewand (Septum nasi) 222 kommt in Zeile 16 zu spät um den paarigen Nasengang bereits an der Rüsselspitze für den Luftdurchgang offen zu halten. Die Nasenscheidewand besteht daher nicht aus Knorpel, sondern aus Bindegewebe 33 und Sehnen 1. Damit „222“ nicht als Knorpel „22“ gelesen wird, muss dieser zuvor umgeschrieben werden. Nasenlöcher aus Knorpel 22_040 werden ersatzweise mit QS 8+8+8+8+1=33 durch Bindegewebe 33 für den flexiblen Rüssel 5_6_5 getrennt. Diese Lesart wird nochmals durch die Zeilennummer Z.16 mit 16_16 unterstützt, so dass sich als Summe 32 ergeben plus 1 als Sehne = 33: Epi.Y*^^+Elefant.Z.13#322040888815652 und Epi.Y*^^+Elefant.Z.16#261658222162718. Nach anderer Quelle werden statt Sehnen transversale Fasern des „Musculus rectus nasi“ erwähnt.
Schlundkopf (Pharynx)
1.) Zunge (Lingua): Das klassische Strukturloch „505“ wird wegen Muskel=55 beim Elefanten als „spitze Zunge“ adressiert. Es sind 1 Binnenmuskel und 3 Muskel zur Bewegung vorhanden. Die Zunge wird mit flexibel=6 kombiniert, um die Zungenbreite im Zeilenlau breiter und dann wieder schmaler anzulegen. Dieses Merkmal wird erkannt, wenn zunächst eine Zungengruppe 4_49_49_49_0 gebildet wird. Blutgefäße 8/9 sind enthalten. Mit seitlich=9 sind 3 Verbreiterungsstufen vorhanden 60, 600 und 6000. Die Zeile 50 entspricht der Zeile 5 hat aber eine andere Bedeutung. Die Zunge wird seitlich von einer Haut-Lippe am Unterkiefer eingefasst. Diese legt sich als Extra 8_2_8 mit der Quersumme 0+5+0+5+0+1+0+6+8+6+0+2=33 an die Zunge. Erste Breitenstufe=„60“: Epi.X*^^+Elefant.Z.49#844949490886328 und Epi.X*^^+Elefant.Z.50#828050501068602. Binnenmuskel (Musculus lingualis proprius) „55_ 202_404“: Epi.X*^^+Elefant.Z.52#796202404873655. Der Musculus genioglossus 55 zieht die Zunge nach vorn und der Musculus hyoglossus 55 zieht die Zunge als Antagonist zurück. Für die beiden Muskeln „5_2_55“ wird das Hin- und Her der Bewegung gegensätzlich am linken und rechten Zahlenrand als Form gespiegelt 73_37. Epi.X*^^+Elefant.Z.56#739330804525537. Zweite Breitenstufe=„600“ als flexible „6“ Zungenstruktur 6_5_666: Epi.X*^^+Elefant.Z.57#726360088656668. Der Muskel „Musculus styloglossus“ führt als Gruppe 44_2 zwei Bewegungen aus: Die beidseitige Kontraktion „60_66“ dient zum Anheben der Zungenspitze und bei einseitiger Kontraktion wird als Unterschied eine Seitwärtsbewegung „60_88“ der Zunge als Extra=8 ausgeführt, wobei sich seitlich über die Zeilennummer Z.68 (608 seitlich=9 ist nicht verfügbar) erklärt: Epi.X*^^+Elefant.Z.68#608860662550442. Dritte Breitenstufe=„6000“ mit Muskel 55. Die 3. Stufe ist erreicht, so dass eine neue Gruppe 44 gebildet wird, um die Zungenbreite abzubauen und die Lippen dabei bis zwischen die unteren Backenzähne weiterzuführen. Versteckt ist 1.) mit „2_55_0_44_2“ eine Zungenlänge bis zwischen die Backenzähne des Unterkiefers bzw. Zungenbein 2_2 und Kehldeckel (Epiglottis) „55_0“ und 2.) enthält auch die Quersumme 2+5+5+0+4+4+2=22 einen Knochen. Vorn an der Kinnspitze kann sich die Zunge nur auf 1 Knochen „22“, dem mittig vorstehenden Knochenfortsatz, abstützen, so dass erst nachfolgend der paarige Kieferknochen (Corpus mandibulae) entsteht. Am Hinteren Ende kann es das Zungenbein (Os hyoideum) „22“ sein: Epi.X*^^+Elefant.Z.68#608860662550442 und Epi.X*^^+Elefant.Z.69.#600036594977248. In Zeile Z.204/Z.205 liegt nochmals die Kombination 55/6000 vor. Weil aber die 3. Stufe erreicht ist, können diese Zeilen ggf. anderweitig belegt werden. Anatomisch wird an der Zunge ebenfalls 3 Abschnitte unterschieden: 1.) Zungenspitze (Apex linguae), 2.) Zungenkörper (Corpus linguae) 3.) Zungenwurzel (Radix linguae). Zeilennummer „Z.70“ bezieht sich auf die Form „7“ mit der die Maulform über die Lippen als paarige Bixnom-Ausrundungskurven „64_64“ adressiert wird: Epi.X*^^+Elefant.Z.70.#59146464362043. Das Zungenende im Schlundkopf (Pharynx) steht mit dem Kehlkopf in Beziehung. Zungenbein (Os hyoideum), Kehlkopf (Larynx) und Luftröhre (Trachea) werden als Einheit zusammengesetzt und vom Kehldeckel (Epiglottis) beim Schluckakt verschlossen. Der Kehlkopf hat sich beim Elefanten nicht wie beim Menschen tief in den Hals abgesenkt und ist daher vor den Halswirbeln adressiert. Die beteiligten Knorpel sind bekannt, jedoch liegen zum funktionellen Zusammenwirken mit der Speiseröhre (Ösophagus) zurzeit keine Informationen vor.
2.) Zungenbein: Das Zungenbein „22“ bildet einen U-förmig als 1_64 (Bixnom-Kurve)_1 ausgerundeten Körper als Form 7 in QS 1+6=7_4=räumlich_QS 1+6=7, wobei sich mit „1“ das paarige Zungenhorn (Cornu minus) bildet, an dem der Aufhängeapparat sitzt. Insgesamt sind 7 Knochen vorhanden, die sich als 1 Knochen für den Körper und 6 Knochen für den Aufhängeapparat als 16_4_16 zusammensetzen. Die 7 Knochen stehen am Zahlenrand. In der Zeilennummer Z.228 kann Knochen / Knorpel „22“ 8-fach statt 7-fach gelesen werden, so dass sich das Zungenbein zum Kontakt direkt auf den Knorpel des Kehlkopfs setzt: Epi.X*^^+Elefant.Z.228#181590022164167.
Am Zungenbein des Haussäugetiers setzt jeweils eine Muskelgruppe oberhalb (suprahyal) aus 6 Muskeln und unterhalb (infrahyal) aus 4 Muskeln an. Dafür stehen nachfolgend 10 Zeilen zur Verfügung, die aber keinen Muskel 55 zeigen. Die Evolution kann spitzfindig eine Muskelgruppe als Quersumme QS 1+7+9+2+3+1+7+8+8+0+0+9=55 finden, wobei der Zahlenrest „101“ genau 10 Muskel und die Ziffer „1“ als Zählgröße ergibt. Die beiden Gruppen 179_17 sind enthalten, wovon am rechten Zahlenrand oben=9 adressiert ist. Damit ergibt QS 2+3+1= 6 Muskeln in der oberen Gruppe: Epi.X*^^+Elefant.Z.231#179231710188009. Zum Unterschied zum Knorpel „22“ wird das elastische Band (Ligamentum hyoepiglotticum) 3_22_3 in der Haut „33“ verpackt dargestellt. Mit der Quersumme 3+2=55=2+3 wird bereits der Muskel „Musculus hyoepiglotticus“ „55“ für die Kehldeckel-Zungenbein-Verbindung avisiert. Das Ligamentum hyoepiglotticum verbindet das Zungenbein mit dem Kehldeckel (Epiglottis): Epi.X*^^+Elefant.Z.239#173232322399289 und Epi.X*^^+Elefant.Z.240#172510521055959.
3.) Kehlkopf (Larynx): Im unteren Rachenraum (Pharynx) bildet eine Schleimhautfalte (Plica aryepiglottica) die Grenze zum Kehlkopf (Larynx), die sich trichterförmig von den Zungenrändern als mittlere Längsfalte zusammenzieht. Offensichtlich sind beginnt die linke Seite zuerst mit der Faltenbildung, dass 2 gesonderte Formzeilen „7_2“ die beiden Seiten der Falte „0101_1010“ bilden: Epi.X*^^+Elefant.Z.249#166275201017792 und Epi.X*^^+Elefant.Z.250#165610100213720. Die beiden Faltenseiten werden jeweils als Bixnom-Kurve „64“ in der Schleimhaut 33 ausgerundet: Epi.X*^^+Elefant.Z.251#164950299017650 und Epi.X*^^+Elefant.Z.252#164295734339008. Wie adressiert sollte die Zunge bei „64_64“ enden, so dass darunter die Schleimhautfalte zu verstehen ist. Speiseröhre und Luftröhre liegen horizontal, so dass vom Kehldeckel (Epiglottis) im Zeilenlauf zunächst nur der kleine halbmondförmige Kehldeckel-Rand 63_64_63 (QS 6+3=9=seitlich) sichtbar wird. Die Ausrundung ist darin als Bixnom-Kurve „64“ enthalten. Durch die Bewegung der umliegenden Muskelgruppen verschießt die Epiglottis beim Schluckakt die Kehlkopfhöhle (Cavum laryngis): Epi.X*^^+Elefant.Z.253#163646344084704. Der Kehlkopfeingang (Aditus laryngis) ist als Loch „163_00“ erkennbar, wobei sich mit beiden „Nullen“ als Platzhalter die Epiglottis „163_64“ formschlüssig zur Abdichtung einfügt: Epi.X*^^+Elefant.Z.254#163002067139489. Das mittige Eingangsloch wird beidseitig von der Schleimhautfalte (Plica aryepiglottica) gebildet. Diese zieht von der Epiglottis zum Stellknorpel (Cartilago arytaenoidea) und liegt über dem Musculus aryepiglotticus. Rückseitig wird das Eingangsloch bogenförmig durch ein Portal (Tuberculum corniculatum) „9_0330“ begrenzt, das aus der Plica aryepiglottica bei der Umhüllung eines Knorpels entsteht: Epi.X*^^+Elefant.Z.258#160474903307869. Nach außen und beidseitig sind beutelförmige Vertiefungen vorhanden als Schleimhautbucht (Recessus piriformis). Hierbei wird es sich offensichtlich um die Rachenbeutel (Pharyngeal pouch) handelt. Das im Körper gespeicherte Wasser entnimmt der Elefant folglich nicht dem Magen, sondern diesen Rachenbeuteln. Auf der linken Seite ist ein längerer Beutel, der wegen einer Überbrückung (Nerv oder Muskel) in zwei Bereiche gegliedert wird: Linker Rachenbeutel „404“: Epi.X*^^+Elefant.Z.257.#161099319274047 mit links=1 in 1_6_1 doppelt als Teilung. Teilungsstruktur: Epi.X*^^+Elefant.Z.259.# 159855309086603; Epi.X*^^+Elefant.Z.260.#159240480974731. Rechter Rachenbeutel „4_2_404“: Epi.X*^^+Elefant.Z.263.#157424049632814. Der Kehlkopf wird dann im Detail betrachtet mit der Schleimhaut „33“ der Epiglottis. Die Epiglottis wird nicht als offenes Loch „505“ sondern flexibel= 6 als „550656“ mit geklammerter „5“ dargestellt. Epi.X*^^+Elefant.Z.267.#155065636904233. Im Weiteren wird der Kehlkopf aufgeführt. Die Stimmritze (Rima glottidis) ist der spaltförmige Raum zwischen den Stimmlippen (Plicae vocales), die über 2 Zeilen als „1_33“ zu erwarten sind. Elefanten können für den Menschen unhörbar bei 16 Hz mittels Infraschall kommunizieren. Mit Bezug zum Bixnom-Schwingkreis muss hierfür die Quersumme der Zeile Z.286 als QS 2+8+6= 16 Hz gelesen werden: Epi.X*^^+Elefant.Z.267.#145272017731334 und Epi.X*^^+Elefant.Z.267.#144764073613392. Die Zeitdifferenz der Zeilen ergibt eine bemerkenswerte Resonanz „44044“ in „504404437677323“, wobei im Rest 3_QS 7+6+7+7+3+2=32_3 ein Defizit von „1“ Ton zu 33 (1_33) besteht. Eine ähnliche Funktion wäre gegeben, wenn 2 Hörknöchelchen nur „21“ erbringen, und daher den Hammer als 3. Knochen bei der Tonübertragung permanent zum Verknöchern=22 anschlagen lassen. Am Ende liegt der Ringknorpel (Cartilago cricoidea) 777_0 und der Beginn der Luftröhre als Knorpel„22“. Die Haussäugetiere besitzen 29 bis 60 Trachealspangen: Epi.X*^^+Elefant.Z.290.#142767327770449 und Epi.X*^^+Elefant.Z.291.#142276718396667. Von vorn bis hinten „67_67“ sind 67 Spangen avisiert, die beim Elefanten auch zählbar wären. Der Kehlkopf wird mit seinem Knorpel „22“ vor den Schädelknochen „22“ angelegt. Der Kehlkopf kann seinen Platz erst nach der Schädelbildung einnehmen.
4.) Speiseröhre (Ösophagus): Der Beginn der Speiseröhre als Muskelschlauch ist als klassisches Loch „505“ zu erwarten. Wird dieses zur Bildung des Kehlkopfes nicht benötigt, steht es in Kombination mit 2 Muskeln 55_55 zur Verfügung: Epi.X*^^+Elefant.Z.275.#150554636557928. Der Schluckreflex wird erst ausgelöst, wenn die Wangenmuskulatur die Nahrung (Bolus) zum Zungengrund in den Rachen geschoben hat. Beim Menschen wird das Gaumensegel (Velum palatinum / soft palate) angespannt und angehoben, um die oberen Luftwege gegen den Nahrungsbrei abzudichten. Das Gaumensegel ist eine Verlängerung des harten Gaumens. Beim Menschen ist mittig noch ein Zäpfchen (Uvula) ausgeformt. Die beiden Muskeln wären geeignet als Gaumensegelspanner (Musculus tensor veli palatini) und Gaumensegelheber (Musculus levator veli palatini). Diese Muskeln weiten auch die Ohrtrompete, so dass es beim Schlucken zum Druckausgleich mit dem Mittelohr kommt. Als 3. Muskel ist der obere Schlundschnürer (Musculus constrictor pharyngis superior) mit dessen Pars pterygopharyngea beteiligt. Bei der Muskelkontraktion entsteht beim Menschen die „Passavant-Ringwulst“, gegen die sich das Gaumensegel zur Abdichtung des Luftweges anlegt. Der Kehlkopf müsste nunmehr seine reale Position am 1. Halswirbel einnehmen, weil dort erneut ein klassisches Loch „505“ mit dem fehlenden Muskel „55“ verfügbar ist: Epi.X*^^+Elefant.Z.447.# 926230985535349. Die Hautverbindung ist darin als 3_5_3 enthalten, ein herausgehobener Bogen als 9_09_09 und eine Bixnom-Kurve „64“ als Quersumme= 2+6+2=10, sofern der Muskel angespannt wird. Der Ösophagus „505“ erhält nunmehr den Nahrungsbrei mittels der Zeilennummer Z.448 selbst als Extra 8 mit der Speiseröhre als eine Gruppenkonstruktion „44“: Epi.X*^^+Elefant.Z.448.# 924163505656921. Ausgehend von Z.275 mit QS 2+7+5=14 liest sich die Gruppe 44 als QS 4+4+7=15 und QS 4+4+8=16 als eine Zahlenfolge von 3 Elementen „16_3“ und als Schluckvorgang mit der Zeit=24. Zutreffend werden die Ohren in der Parallelepisode im Zeilenlauf angelegt.
Schädelknochen: Die Schädelknochen verteilen sich auf den Gesichts- und Hirnschädel, wobei der bewegliche Unterkiefer zum Gesichtsschädel gehört. Der Schädel wird durch Knochennähte aus Einzelknochen zusammengefügt. Der Elefant ist ein streng mathematisiertes Geschöpf, so dass für den Schädel auch die Zeilennummer als Konstruktionselement dient. Der gesamte Zeilenlauf wird beansprucht, so dass das Gehirn erst im Zeilenrücklauf seinen Platz finden wird.
Unterkiefer (Mandibula): Der Unterkiefer wird provisorisch ermittelt, um zusammen mit den Zähnen eine Basis zur Erkundung einer Vielzahl von Schädelknochen zu finden. Der Unterkiefer ist mit dem des Menschen vergleichbar, jedoch besteht die Kinnpartie mangels Schneidezähnen nur aus einer schmalen Verbindung der beiden horizontalen Körperhälften des Unterkiefers. Der Körper (Corpus mandibulae) gliedert sich in den Schneidezahnteil (Pars incisiva) und den hinteren (kaudalen) Backenzahnteil (Pars molaris). Der Körper bildet mit dem vertikalen Gelenkast (Ramus mandibulae) einen Unterkieferwinkel (Angulus mandibulae), der im Unterschied zum Menschen jedoch vollständig ausgerundet ist. Die Evolution sucht im Zeilenlauf verzweifelt nach dem Unterkiefer und findet diesen Anfang als einen horizontalen, spitzen Zipfel mittig auf der Kinnspitze.
Als Startpunkt wird vorerst die Zeile 300 reserviert. Der Kinnzipfel ist ein rundes Extra „8008“, das zur Kinngruppe 8_44 als Form 7_6_7 gehört: Epi.X*^^+Elefant.Z.300#138008416844767. Die Form 1_7_1 muss als Spitze gedeutet werden, die im Wechsel 5_499 zu 0_994 als Kurve „64“ ausgerundet wird: Epi.X*^^+Elefant.Z.301#137549917121030; Epi.X*^^+Elefant.Z.302#137094453819305; Epi.X*^^+Elefant.Z.303#136641996876007. Es wird ein Gegenbogen „64“ benötigt, um an das Kinn anzuschließen. Zipfelende 5_1_9 als Form 7: Epi.X*^^+Elefant.Z.303#134861645125179.
Es sind 3 vereinzelte Abschnitte (Kinn, Zahnfächer, Kiefergelenk) vorhanden, die zu einer paarigen 3er-Gruppe „3_44_2_3“ vereinigt werden. Evolutionär hat sich der Unterkiefer verkürzt und beginnt somit in der Leitepisode mit einer hohen Zeilennummer als Form „7“. Die „Zahl „64“ ist als QS 6+4=10 mit Bezug auf den 10er Bixnom-Schwingkreis ein Kreis oder mit Bezug auf die Bixnom-Gravitationslinse eine Ausrundungskurve. Diese liegt für den Unterkiefer vor, weil er im Gegensatz zum Menschen nicht scharf abgewinkelt ist, sondern sich bananenförmig bis zum Kiefergelenk krümmt. Mit „26“ kann Blut wie Eisen=26 gelesen werden, damit die fehlende Zahl „9“ als Arterie ersatzweise verstanden wird. Vene 8 und Nerv 7 sind als „78_26“ enthalten. Die Zeilennummer Z.308 bildet die Quersumme QS 3+0+8=11. Die Zahl „11“ ist eine Zählgröße, mit der beim Menschen die Zähne herauswachsen. Als Knochenzählgröße „115“ muss die Zahl 5 neben der Gruppe „44“ aus QS 2+3=5 gelesen werden. Mit der Methode „Versuch und Irrtum (trial and error)“ wird die Evolution solange experimentieren, bis geklärt ist, um welche Gruppe „44“ es sich überhaupt handelt. Der innere Knochenkanal (Canalis mandibulae) „100“ ist das verbindende Element der 3 Abschnitte: Epi.X*^^+Elefant.Z.308#134423782641007. Abschnitt 1: Das Kinn wird vom Knochen-Nullpunkt „22_0“ an der Kinnspitze durch eine aufsteigende Kurve zum hufeisenförmigen Unterkieferkörper (Corpus madibulae) geformt. Mit dem Knochen „22“ startet die Gruppe und bildet wegen der „22“ den 1. Abschnitt, der genau mit der Zeile 3_22 endet: Epi.X*^^+Elefant.Z.308#133988754218220. Im Knochen ist außenseitig das Kinnloch (Foramen mentale) sichtbar, das die Mündung des Knochenkanals (Canalis mandibulae) bildet, der Nerven und Gefäße enthält. Das Loch wird mit seitlich=9=Arterie und paarig=2 als „09020“ gebildet, wobei der Knochen als QS 3+9+5+5=22 zählt: Epi.X*^^+Elefant.Z.311#133127090203955. Vom Unterkieferköper wird eine Knochenleiste bogenförmig 22_7 bis 22_7 hochgezogen, um in der Folge die Zahnfächer anzulegen: Epi.X*^^+Elefant.Z.312#132700400812276 Epi.X*^^+Elefant.Z.313#132276437870384. In der hochgezogenen Knochenleiste sind 3 kleine Knochenlöcher „0_7“ vorhanden. 1. kleines Knochenloch: Epi.X*^^+Elefant.Z.315#131436587471207. Die folgenden beiden Löcher liegen eng zusammen, so dass sie eine Zeile bilden „07_07“: Epi.X*^^+Elefant.Z.317#30607334553407. Der 1. Abschnitt endet in Zeile 322 mit einem Teil des Kieferknochens „522“, dem sich ab Zeile Z.323 die Bildung der Backenzähne als 2. Abschnitt anschließt: Epi.X*^^+Elefant.Z.322#128579270352267. Die Backenzähne werden gesondert dargestellt. Am Kieferwinkel (Angulus mandibulae) steigt der Unterkieferknochen als vertikaler Ast (Ramus mandibulae) zum Unterkiefergelenk (Articulatio temporomandibularis) auf. Dieser Ast bildet gabelförmig den Muskelfortsatz (Processus muscularis) und den Gelenkkopf (Caput mandibulae). Der Muskelfortsatz dient dem Schläfenmuskel (Musculus temporalis) „55“ als Ansatzstelle. Epi.X*^^+Elefant.Z.334#123959655848593. Der Muskelfortsatz (Processus muscularis) QS2+3=5_22 sitzt als große dünne Platte als Extra „800“ auf dem Unterkieferkörper: Epi.X*^^+Elefant.Z.336#123221800754256.
Der Unterkiefer (Mandibula) muss vor der Querachse der paarigen Knochenlöcher des Karotiskanals (Canalis caroticus) beendet sein, um einen passenden Gelenkanschluss zu finden. Beim Menschen ist im vertikalen Gelenkast (Ramus mandibulae) für die Mündung des Alveolarkanals (Canalis mandibulae) nur 1 Loch vorhanden. Beim Elefanten liegt kein Loch „505“, sondern ein Schlitz „050“ mit Seitenwänden 13_13_4 (wie QS 1+3=4=rechteckig) vor: Epi.X*^^+Elefant.Z.339.#122131342340502. Der Schlitz befindet sich in der Taschenwand eines dünnen knöchernen „Känguru-Beutels“ „5_100“, der innenseitig am Ramus mandibulae hängt. Der Blick in den Beutel zeigt das Knochenloch „Foramen mandibulae“. Der durchziehenden Nervus alveolaris inferior „77“ ist adressiert. Als Blutgefäße wird nur eine Vene „88“ angezeigt. Die „Arteria alveolaris inferio“ fehlt und muss daher als Summe 8+1=9 aus „1_2_1“ entnommen werden: Epi.X*^^+Elefant.Z.340.#121772132510088. Der Gelenkast endet mit einem Knochenfortsatz „Processus condylaris mandibulae“. Innenseitig oberhalb des Foramen mandibulae liegt darin eine Knochenvertiefung (Fovea pterygoidea) 22_00, die dem „Musculus pterygoideus lateralis“ als Ansatz dient. Die Struktur „5_0“ muss über die markierte Zählgröße 1_4_1 zum Muskel=55 erweitert werden: Epi.X*^^+Elefant.Z.341.#121415029482200. Vom Muskelfortsatz (Processus muscularis) zieht ein dünner Knochenkamm „121_111“ bis unter die Gelenkfläche (Caput mandibulae) zum Knochenfortsatz (Processus condylaris) heran: Epi.X*^^+Elefant.Z.342.#121060014776111. Im Ergebnis liegt die Gelenkfläche (Caput mandibulae) als eine besondere Form vor. Darin müssen 12_12 als Quersumme 33 für den Gelenkknorpel gelesen werden, wie er auch in der Zeilennummer enthalten ist: Epi.X*^^+Elefant.Z.343.#120707070126618. Die dreifache Ziffer „7“ bildet eine Gelenkfläche in C-Form, so dass sich ein Schlitz „1_77_090_1“ auf der Gelenkfläche bildet. Wegen der Zeilennummer Z.344 als Gruppe 44 gehört der Schlitz noch zum Unterkiefer: Epi.X*^^+Elefant.Z.344.#120356177480901.
Unbewegliche Schädelknochen: Das Zungenbein ist bereits im Schlundkopf (Pharynx) erfasst worden. Die 3 Gehörknöchelchen (Ossicula auditus: Hammer (Malleus), Amboss (Incus) und Steigbügel (Stapes) werden in der Paukenhöhle (Cavum tympani) gesucht.
1.) Zwischenkieferbein (Os incisivum) „22_00“ [Proc. alveolaris; Proc. alveolaris; Stoßzahnalveole]: Die runde Schädelform des Elefanten mündet zur Aufnahme der Stoßzähne in einem vorgestreckten Knochenkomplex, der oberseitig vom Zwischenkieferbein gebildet und unterseitig vom paarigen Oberkieferknochen (Maxilla) gestützt wird, um die beiden Stoßzähne jeweils in einem Zahnfach (Stoßzahnalveole) zu tragen. Das Zwischenkieferbein ist als paarige Struktur „252“ mit den beiden Zahnfächern 60_60 enthalten, die sich jedoch nicht berühren, sondern wegen 6_9_6 seitlich liegen. Die als „paarig=2“ teilbare Anordnung kann den engen Strukturspalt „5_1“ nur bilden, weil die Folgezeile beide Teile räumlich eng zusammenhält: Epi.Y*^^+Elefant.Z.166#252200696060451.
2.) Oberkieferknochen (Maxilla) „22_5“ [Corpus; Proc. palatinus; Proc. alveolaris; Proc. frontalis; Proc. zygomaticus; Tuber maxillae; Foramen maxillare; Canalis infraorbitalis; Foramen maxillare]: Als Stützknochen wird der Knochen nicht „paarig“, sondern als eng stehende Dopplung beidseitig des Knochenspalts „51_22_51“ sowie als Form 7 adressiert, wobei die Zahnfächer als Strukturlöcher „50_05“ gespiegelt sind: Epi.Y*^^+Elefant.Z.167#250690512251705. Maxilla und Os incisivum sind beim Menschen bereits embryonal verwachsen. Beide Knochen enthalten „5_1“, um mit der Zählgröße „1“ als Struktur zu verwachsen. Hierzu wird die laufende „#2_4“ als Knochen 22, räumlich=4 zusammengehalten. Das Zahnfach „606“ im Os incisivum Z.166 zieht sich weiter als „606“ in Epi.Y*^^+Elefant.Z.169#247723760627425 bis Epi.Y*^^+Elefant.Z.172#243402997360668.
Um den Knochen weiter zu ziehen, wird ein kleiner Knochenkanal (Canalis infraorbitalis) „60“, der den Boden der Augenhöhle (Orbita) durchquert, als Strecke adressiert. Beim Elefanten zählt die Zeilennummer Z.1_7_3 den Nerv „Nervus infraorbitalis“ „7“ bereits mit. „Arteria infraorbitalis“ „99“ und Vena infraorbitalis „88“ sind paarig und somit als Doppelziffer vorhanden. Folglich ist mit QS 4+3=7 plus QS 6+1=7 und auch der Nerv als Doppelziffer vorhanden: Epi.Y*^^+Elefant.Z.172#241996043618698 und Epi.Y*^^+Elefant.Z.173#240605261758821. Der Knochenkanal „60_60“ zieht paarig weiter und endet hinter dem letzten Backenzahn (Molar) als knöcherne Erhebung am Oberkieferhöcker (Tuber maxillae). Der Oberkieferknochen begann am Zahnfach 69_6060 und endet als Spiegelung mit dem Ende=9 als Form 6_7_6. Das paarige Tuber maxillae bildet eine ideelle Verbindungslinie, auf der die paarige Knochenöffnung „Foramen palatinum majus“ des Gaumenbeins liegt. Aufgrund des Scanns sind die Löcher als „606“ enthalten:
Epi.Y*^^+Elefant.Z.189#221509606063676. Weil die Maxilla vom Tränenbein (Os lacrimale), dem Nasenbein (Os nasale) und dem Siebbein (Os ethmoidale) überlagert wird, sind diese Knochen bereits im Zeilenlauf enthalten und werden nachfolgend ergänzt.
3.) Tränenbein (Os lacrimale) „22“ [Proc. dorsalis]: Das paarige Tränenbein bildet den vorderen Rand der knöchernen Augenhöhle (Orbita) „2_303“ mit dem Knochen als Quersumme QS 2+3+9+2+3+0+3=22. Die fehlende Struktur-5 folgt als Zählknochen QS 7+4=11_5. Die paarige Augenform nochmals als 77_0: Epi.Y*^^+Elefant.Z.175#239230374548770. Dem Knochen entspringt speziell beim Elefanten ein nach unten (ventrolateral) gerichteter dünner, länglicher Knochenfortsatz „7_1111_05_7“ mit einer ovalen Seitenansicht als Form „7“. Ovale Form als QS 70_QS1+6=7. Processus dorsalis: Epi.Y*^^+Elefant.Z.176#237871111057016.
4.) Nasenbein (Os nasale) „22“ [Proc. Nasalis]: Das paarige Nasenbein bildet das Dach der Nasenhöhle (Cavum nasi). Das Nasenbein verschmilzt rostal mit dem Os incisivum, rückseitig (kaudal) mit dem Stirnbein (Os frontale) und unterseitig (ventromedial) mit dem Siebbein (Os ethmoidale). Die paarigen Ossa nasalia bilden nach vorn (rostromedial) eine Dreiecksspitze „Processus nasalis“, die als „Balkon“ mit einer dreieckigen Konsole abgestützt ist. Als Dreiecksform „3“ werden 2 Teile mittig zusammengeschoben als „47_47_7_3“. Die Form „77“ bezieht die Zeilennummer Z.1_77 ein, so dass der Prossessus nasalis unpaarig=1 als QS 4+7+4+7=22 zum Knochen 22 verwachsen kann: Epi.Y*^^+Elefant.Z.177#236527206474773. Der Scann trifft beidseitig 19_19 des „Processus nasalis“ auf eine Fläche „44“, die jeweils „3“ Knochenlöcher „Foramina“ zum Sinussystem der Schädelknochen enthält. Im Zusammenhang mit der Pneumatisierung ist das Lüftungsloch 0_QS 1+6=7 als Stickstoff=7 der Luft zu lesen: Epi.Y*^^+Elefant.Z.178#235198401944016 und Epi.Y*^^+Elefant.Z.179#233884444391256. Über 3 Zeilen sind die Löcher in der Reihenfolge klein als „50“, groß als „3000“ und mittelgroß als „300“: Epi.Y*^^+Elefant.Z.180#23258508636686; Epi.Y*^^+Elefant.Z.181#231300085889695; Epi.Y*^^+Elefant.Z.182#230029206296895 existent.
5.) Siebbein „22“ (Os ethmoidale): Das Siebbein besteht aus den paarigen Siebbeinplatten (Laminae cribrosae) 29_29_5, die durch die vertikale Lamina perpendicularis getrennt werden. Die Lamina perpendicularis bildet mit dem Pflugscharbein (Vomer) den hinteren Teil der Nasenscheidewand (Septum nasi). Der komplexe Knochen muss durch eine noch fehlende Gruppe „44“ avisiert werden. Mit QS 2+9=11 plus QS 2+9=11 mit der Markierung 6_29_2 folgt die Summe 22. Ebenfalls 22 folgt aus dem Rest 8+9+5=22. Siebbein-Gruppe 44: Epi.Y*^^+Elefant.Z.182#230029206296895. Das kann so „verschwommen“ sein, weil der innere Knochenbereich nicht einsehbar ist. Vorn ist die Nasenscheidewand (Septum nasi) erkennbar. Diese besteht im Rüssel nur als Bindegewebe und bildet den Knorpel erst am Knochenübergang. Knorpel 22 und Knochen 22_5 sind ähnlich und bilden daher eine Zeile. Durch den Knorpel „22“ wird die Zahl „2“ am linken Zahlenrand verwendet, so dass die Nasenscheidewand unpaarig „1“ gebildet werden kann. Die Rüssel-Muskel 55 müssen am Schädel befestigt sein: Epi.Y*^^+Elefant.Z.183#228772216098551. Die Vielzahl der Löcher im Siebbein sind unreal aus „88888“ als kleine Nullen lesbar, der Elefant müsste 5*8= 4_0 rechnen, um die Fläche 4 mit Löchern (Nullen) zu füllen: Epi.Y*^^+Elefant.Z.184#227528888837146 ... und tatsächlich, die Zahl „40“ wurde errechnet. Weiterhin ist mit 5_1_5 eine Trennwand zwischen den bereits zuvor erwähnten Platten 29_29 vorhanden: Epi.Y*^^+Elefant.Z.185#226299002951540.
6.) Pflugscharbein (Vomer) „225“: Das Pflugscharbein bildet eine unpaarig vertikal stehende Knochenplatte, die das hintere Ende der Nasenscheidewand bildet. Der Knochen verschmilzt vorn (rostal) mit der Lamina perpendicularis des Siebbeins (Os ethmoidale) und hinten (kaudal) mit dem unpaarigen Körper (Corpus) des „Vorderen Keilbeins (Os praesphenoidale)“. Die Verschmelzung muss als Formgruppe 4_QS 1+6=7_4 gelesen werden. Weil die innere Zahl „2“ nicht als paarig gelten soll, wird sie mit Knochenbildung „beschäftigt“ QS 2+2+5+0+8+2+3=22: Epi.Y*^^+Elefant.Z.186#225082341645348.
7.) Gaumenbein (Os palatinum) „22“: Die Lamina horizontalis bildet den hinteren (kaudalen) Anteil des harten Gaumens. Die Lamina perpendicularis bildet die hintere Seitenwand der Choanen, die die paarige Öffnung der Nasenhöhle (Cavum nasi) bilden. Zwischen beiden Knochen liegt das paarige Knochenloch (Foramen palatinum majus). Dieses ist als „606“ bereits im Oberkieferknochen (Maxilla) im Scann erfasst, mit dem es seitlich verschmilzt. Das paarige „2“ Gaumenbein ist die letzte Zeile der Knochenserie #22 der Parallelepisode. Die Zeile Z.190 holt lediglich die Knochenbildung „22“ ab, um erst in der Leitepisode die Details auszubilden. Zur Übersicht wird der horizontale Gaumen als Fläche 3_4_3 markiert. Die 66_0 bildet den Nullpunkt zur beidseitigen Aufweitung der Seitenwände als Form 76_76 in V-Form unter ca. 45° im Anschluss an die horizontale Gaumenplatte: Epi.Y*^^+Elefant.Z.190#220343766031762. Lamina horizontalis „7000“: Zwischen der Gaumenplatte und den schrägen Seitenwände ist keine freie Zeile verfügbar, um das seitlich liegende Knochenloch „Foramen palatinum“ lagegerecht einzuordnen. Folglich wird es als seitliches Extraloch „9_080“ als Form 7 avisiert und erst nach Bildung Seitenwände mit der seitlichen Lage dargestellt: Epi.X*^^+Elefant.Z.190#217908026597000. Lamina perpendicularis: Die Seitenwände der Parallelepisode 76_76 erscheinen in der Leitepisode gespiegelt als 1_67_67_1. Mit der Markierung als Zählgröße 1_1 kann nachfolgend ein Öffnungswinkel der Seitenwände von 46° gebildet werden. Die Zahl 8 ist ein Bezug auf die Lage des Knochenlochs 080 sowie zur Seitenwand 7_6: Epi.X *^^+Elefant.Z.191#216767146876597. Foramen palatinum majus: Das Knochenloch ist die Mündungsstelle des Canalis palatinus major. Weil sich das Knochenloch im Zeilenlauf (Längsachse) schräg in den Knochen bohrt, wird es über 2 Zeilen dargestellt. Das Durchziehen der Arterie „Arteria palatina descendens“ „99“ wird adressiert. Zu erwarten ist, dass auch beim Elefanten der „Nervus palatinus major“ vorhanden ist. Dieser ist nur als Zählgröße QS 1+5+1=7 vorhanden. Epi. X *^^+Elefant.Z.192#215638151319948. Das paarige „Foramen palatinum majus“ 20_20 ist mit der Arterie „99“ adressiert. Die Arterie ist von der Zählgröße 51_99_1 blockiert, so das wiederholt der Nerv als QS 5+1+(99)+1=7 sowie als 2+1+4=7 lesbar ist, falls er mit durch das Loch zieht. Als Restgröße QS 5+2+0+8+5=20=Calcium wird erneut das Knochenloch 2_0 adressiert: Epi. X *^^+Elefant.Z.193#214520855199120.
8.) Flügelbein (Os pterygoideum) „22“: Obwohl das Gaumenbein (Os palatinum) die letzte Knochenzeile bildet, lagert sich das Flügelbein nachfolgend noch an. Die Quersumme 66 enthält den Knochen QS 2+1+9+1+9=22 und eine Knochengruppe QS 1+3+3+7+4+8+8+7+3=44: Epi.Y*^^+Elefant.Z.191#219190133748873. Zum Flügelbein gehört ein Knochenfortsatz „Hamulus pterygoideus“, so dass sich dieser als angezeigte Gruppe „44“ bildet. Die Knochenspitze bildet eine dreieckige Form 7_333: Epi.Y*^^+Elefant.Z.193#216918733399144.
9.) Stirnbein (Os frontale) „225“ [Squama frontalis; Facies temporalis; Facies orbitalis; Crista orbitotemporalis; Margo supraorbitalis; Proc. Zygomaticus]: Teil 1: Die Augenhöhlenfläche (Facies orbitalis) „225_0“ bildet den Augenhöhlenboden und ist Bestandteil des paarigen „2“ Stirnbeins. Die Leitepisode hat die Netzhaut des Auges passiert, so dass die Augenhöhle adressiert werden kann. Beim Elefanten steht die Zahl „64“ für eine Kreisfläche [QS 6+4=10 wie 10er Bixnom Schwingkreis]: Epi.X*^^+Elefant.Z.184#225013723116468. Eine scharfe Kante (Crista orbitotemporalis) „2225_9“ am seitlichen (lateral) Teil des Stirnbeins bildet eine Teilung in der Knochenform „717“ als eine rostroventral liegende Facies orbitalis und eine kaudodorsal liegende Facies temporalis: Epi.X*^^+Elefant.Z.186#22259422071736. Aufgrund der Teilung erfolgt der Übergang in die Parallelepisode, in der im Zeilenlauf #22 Knochen gebildet werden. Vor dem Jochbein (Os zygomaticum) wird das Stirnbein in den Scann eingereiht. Weil das Stirnbein in diesem Bereich auch das Schädeldach bildet, wird ein Stirnbein-Gruppe 5_9_5_44 für das Schädeldach mit oben=9 gebildet. Mit diesem Platzhalter kann das Stirnbein später ergänzt werden: Epi.Y*^^+Elefant.Z.187#223878692759544. Teil 2 als Fortsetzung: Das Stirnbein (Os frontale) 222 kann das Schädeldach mit der Ausrundung 05_50 über 4 Knochenzeilen „22“ enthalten, wobei die Knochennaht „11“ zur Verbindung beider Hälften vorhanden ist: Epi.Y*^^+Elefant.Z.204#205222135029582; Epi.Y*^^+Elefant.Z.205#204221051444072; Epi.Y*^^+Elefant.Z.206#203229687116674; Epi.Y*^^+Elefant.Z.207#202247901188574.
10.) Jochbein (Os zygomaticum) „22“: In der Leitepisode laufen hinter dem Auge ebenfalls Knochenzeilen #22. Die große Öffnung am Bogen (Arcus zygomaticus), welche sich zur Durchführung von Gefäßen hinter dem Jochbein befindet, dient zur Positionierung des Jochbeins. Eine Form 7 seitlich 9 vom Loch „7_0_9“ ist das paarige „2“ Jochbein (Os zygomaticum) 22_0_22: Epi.X*^^+Elefant.Z.188#220226197092713. In der Parallelepisode wird der schmale Knochen länglich „222“ im Zeilenlauf ausgezogen. Der Knochen verschmilzt vorn (rostal) mit dem Oberkieferkochen (Maxilla) und hinten (kaudal) mit dem Schläfenbein (Os temporale), so dass das Jochbein nur den mittleren Teil des Knochenbogens (Arcus zygomaticus) bildet. Das Element nutzt im Extremfall auch die Zeilennummer, die hier 8_8 liefert, um die beiden seitlich angewachsenen Knochen als „22“ zu adressieren. In den beiden Quersummen QS 6+8=14 fehlt jeweils die Zahl 8 zur Summe 22, die in der Zeilennummer Z.1_88 vorhanden ist. Als weitere extreme Nutzung liest der Elefant „64“ als Kurvenbildung für den gemeinsamen Knochenbogen „Arcus zygomaticus“. Als „übrige Restzahlen“ verbleiben 7, 8 und 9, um die Öffnung zur Durchleitung von Nerven und Gefäßen zu nutzen: Epi.Y*^^+Elefant.Z.188#222687848649121.
11.) Keilbein (Os sphenoidale): Das Keilbein besteht aus 2 Knochen, die durch Knorpel verbunden sind und bei adulten Tieren verknöchern können. Beim Menschen sind das vordere Keilbein und das hintere Keilbein bereits embryonal verbunden. Die Knochen bestehen ähnlich einem Wirbelknochen oder einer Schmetterlingsform aus dem unpaarigen Körper (Corpus) und paarigen Flügeln (Alae). Die Knochen spannen sich über die Schädelbreite, so dass sie beim Scann im Prinzip nur als vertikale Linie in einer Knochenzeile erkennbar sind. Es muss eine Gruppenbildung „44“ vorliegen, damit die Knochendetails entstehen können. Weil in sich das vordere und hintere Keilbein in getrennten Episoden zeitgleich auf Knochensuche „22“ sind, ergibt sich insgesamt eine Gruppe „22+22=44“.
11.1) Vorderes Keilbein (Os praesphenoidale) „22“: Das vordere Keilbein verschmilzt nach vorn (rostal) mit dem Stirnbein (Os frontale) und dem Siebbein (Os ethmoidale) sowie rückseitig (kaudal) mit dem hinteren Keilbein. Der Corpus trägt das Pflugscharbein (Vomer). Die beiden Flügel ziehen lateral und dorsal nach außen und werden dabei vom Canalis opticus durchbohrt, der den Sehnerv (Nervus opticus /2. Hirnnerv) durchleitet. Das Zusammenwachsen der Schädelknochen beruht darauf, dass die Knochen keine eigene Struktur 225/115 zur Verfügung haben und die Doppelziffer 22 nur noch als Quersumme aufbieten. Das Zusammenwachsen der beiden Keilbeinknochen wird als Gleichzeitigkeit beider Episoden erzeugt. Weil die Leitepisode zunächst mit einem Knochenloch neben dem hinteren Keilbein beschäftigt ist, wird das vordere Keilbein in der Parallelepisode erkennbar. Der Knochen „22“ wird mit der Quersumme 5_QS 8+0+0+5+9=22_55 als Struktur-5 erzeugt. Mit 9_55_9 entsteht der tragende Körper, wobei mit seitlich=9 die Flügel 8_11_8 als Extra=8 adressiert werden. Zugleich liegt die Zählgröße „11“ als Markierung vor, so dass die Flügelform entsteht, weil die Doppelziffer über 5 Zeilen zum linken Zahlenrand durchwandert. Das zu tragende Pflugscharbein (Vomer) ist als Struktur „55“ enthalten: Epi.Y*^^+Elefant.Z.194#215800595598118. Die Quersummen begründen sich auch daraus, dass sich der Knochen quer zum Zeilenlauf bildet. Somit kann der Knochen in der im Zeilenlauf unsichtbaren Breite dargestellt werden. Das Durchwandern der Zählgröße „11“ als Flügel zeigt eine Quersumme 1_QS 2+5=7_1 als Form an. Die spaltförmige Öffnung (Fissura orbitalis) „111“ wird adressiert, aber es fehlen die „Nullen“, um auch Öffnungen zu zeigen. Die Fissura ist äußerlich auch nicht sichtbar, weil sich doppeldeutig der Knochenfortsatz „Processus pterygoideus“ 111 des hinteren Keilbeins mit seiner dünnen vertikalen Knochenfläche vor die Knochenöffnungen des vorderen Keilbeins in der Augenhöhle (Orbita) legt: Epi.Y*^^+Elefant.Z.197#212514292111852. Die Wanderung der Zählgröße „11“ für den Flügel des Knochens wird mit einer Öffnung für den Canalis opiticus 44_0_606 verbunden. Das ist zutreffend, weil der Kanal den paarigen Flügel durchbohrt. Nerven und Gefäße im Canalis opticus sind als 9_8_7 adressiert: Epi.Y*^^+Elefant.Z.198#211440987606236. Die Fissura orbitalis 7_00 bildet die Durchtrittsstelle für den Nerv „Nervus ophthalmicus“ „77“ als 1. Ast des Nervus trigeminus: Epi.Y*^^+Elefant.Z.199#210378470080577. Des weiteren ziehen die 3 Augenmuskelnerven „777“ „Nervus oculomotorius“, „Nervus trochlearis“ und „Nervus abducens“ durch die Fissura orbitalis: Epi.Y*^^+Elefant.Z.200#209326577730174. In Zeile 201 liegt im Prinzip am Zeilenende mit „22“ ein „Knochen“ vor. Weil das vordere Keilbein aber bereits existiert, ist es der Verbindungsknorpel „22“ zum hinteren Keilbein, das gerade in Zeile 201 in der Leitepisode fertiggestellt ist. Die Knorpelzeile „22“ enthält keine Zeitangabe Zeit=60 oder ähnlich zur Verknöcherung, so dass die beiden Keilbeinknochen „828_515“ beim Elefanten erkennbar bleiben: Epi.Y*^^+Elefant.Z.201.#208285151970322.
11.2) Hinteres Keilbein (Os basisphenoidale) „22“ [Proc. Pterygoideus; Corpus; Ala; kaudaler Anteil des Pflugscharbeins; Foramen ovale; Proc. pterygoideus]: Das hintere Keilbein besteht aus dem unpaarigen Körper und den paarigen Flügeln sowie dem paarigen Processus pterygoidei, der bis an die Zahntaschen der Molaren heranreicht. Der Körper des hinteren Keilbeins liegt vor der Pars basalis des Hinterhauptbeins (Os occipitale). Das Hinterhauptbein ist zwar der letzte Schädelknochen, zieht aber weit nach vorn (rostal). Am Flügel liegt das Knochenloch „Foramen alare caudale“, das über den Canalis alaris eine Verbindung zur Augenhöhle (Orbita) eröffnet, sowie das „Foramen ovale“ für den Durchtritt des Nervus mandibularis. Beim Elefanten wird die Öffnung als ein Einschnitt (incisura ovalis) eines größeren Lochs (Foramen lacerum) an der Schädelbasis gebildet, was auch für einige andere Tiere zutrifft. Knochenloch „Foramen ovale“ „50“ mit dem Einschnitt „Incisura ovalis“ 1_QS 3+4=7_1 als Form 7 am Rande des „Foramen lacerum“ „500“ mit dem Nerv „Nervus mandibularis“ „77“ in der Leitepisode: Epi.X*^^+Elefant.Z.194#213415077595000. Der Flügel des hinteren Keilbeins wird über 3 Zeilen als aufgespannter Flügel gebildet, indem die Ziffer 11 von links nach rechts durchwandert. Die mittlere Zeile enthält mit „101“ das Knochenloch „Foramen alare caudale“. Die Quersumme 1+0+1=2 zeigt den Sehnerv als 2. Hirnnerv und die Dopplung „101_101“ zieht den Knochenkanal „Canalis alaris“ in die Länge. Die Quersumme „22“ ist das hintere Keilbein: Epi.X*^^+Elefant.Z.196#211237372721582 Epi.X*^^+Elefant.Z.197#210165101794061 Epi.X*^^+Elefant.Z.198#209103661886011. Im Zeilenlauf ist „#2“ stets als paarig=2 vorhanden. Diese Vorgabe wird durch die Flügel als Form 7 „ O7O“ erfüllt, so dass die Ziffer „1“ für den unpaarigen Körper des Keilbeins steht. Der Körper ist als Knochen „22“ mit „252_15“ als unpaarige Struktur-1_5 adressiert: Epi.X*^^+Elefant.Z.200#20701262526715. Am hinteren Keilbein wird ein paariger Knochenfortsatz „Processus pterygoideus“ als Form 7_11_7 und mit der Quersumme 2_QS 5+9+8=22_2 als Knochenpaar angehängt: Epi.X*^^+Elefant.Z.201#205982711708607.
12.) Zwischenscheitelbein (Os interparietale) „225“: Das Zwischenscheitelbein ist beim Menschen embryonal nachweisbar und verwächst dann mit anderen Schädelknochen. Nachfolgend wird davon ausgegangen, dass das Zwischenscheitelbein eine embryonale Phase und eine adulte Phase durchläuft. Die embryonale Phase wird im Anschluss an das Gleichgewichtsorgan (Ohr) im Felsenbein (Pars petrosa) des Os temporale in der Leitposition von Epi.X*^^+Elefant.Z.225-Z.227 erwartet, weil der Elefant als mathematisiertes Geschöpf auf die Knochenzeile „Z.225“ reagieren muss. Der Elefant besitzt incl. Unterkiefer, 3 Gehörknöchelchen und Zungenbein 21 Schädelknochen. Die Adresse für das Zwischenscheitelbein wird direkt aus der Zeilennummer Z.225 bezogen. Das ursprünglich paarige Zwischenscheitelbein befindet sich zwischen dem paarigen Scheitelbein (Os parietale) und dem schalenförmigen Teil (Squama occipitalis) des Hinterhauptbeins (Os occipitale), d.h. es ist das Schädeldach. Der Knochen ist mit dem Scheitelbein verwachsen und oberflächig beim älteren Tier nicht abgrenzbar. Bei den Säugetieren kann im Zwischenscheitelbein, wie z.B. beim Pferd, der horizontal und quer verlaufende Knochenkanal „Canalis sinus transversi“ ausgebildet sein, der links und rechts den paarigen venösen Blutleiter „Sinus transversus“ verbindet. Der „Canalis sinus transversi“ liegt im knöchernen Hirnzelt (Tentorium cerebelli osseum), das aus den Sichelfortsätzen (Processus tentoricus) von Zwischenscheitelbein, paarigem Scheitelbein und Hinterhauptbein besteht. Es wird hierbei eine dreieckige Knochenspitze gebildet, die innenseitig in die Schädelhöhle hinein ragt. Beim Pferd wird wegen der Durchleitung des Knochenkanals „Canalis sinus transversi“ die kaudale Rückseite des Hirnzeltes als Venenraum „Confluens sinuum“ bezeichnet. Beim Elefanten ist im Hinterhaupt dort mittig eine tiefe Grube ausgeformt, so dass das Hirnzelt rückseitig „dünn wie eine Eierschale“ ist. Offensichtlich muss der ggf. vorhandene querliegende Knochenkanal aus Platzmangel daher durch die beiden im Längsschnitt erkennbaren Knochenlöcher unter- und oberhalb des Hirnzeltes geführt werden. Der filigrane Hohlkörper des Hirnzeltes selbst ist nur unwahrscheinlich als Gefäß-Knochenkanal geeignet, weil das knöcherne Hirnzelt des jungen Elefanten lediglich eine kaum sichtbare Knochenspitze am kompakten Zwischenscheitelbein bildet.
1.) Embryonale Phase: In den 3 Zeilen wird unter dem Begriff „embryonal“ die Kurzzeit=24 gesucht. Mit QS 2+2+5=9 (aus Zeile Z.225) plus 1+8+4+0= 22 mit Restgröße QS=49 wird definitiv ein Knochen adressiert. Erkennbar ist damit, dass die „222“ keine Bedeutung hat, sondern als Kurzzeitknochen „22_24“ gelesen werden muss. Dessen QS 2+2+2+4=10 ist unvollkommen. Weil es zu einer Zählgröße „11“ nicht reicht, muss „10“ geometrisch gedeutet werden. Im Ergebnis handelt es um 4 Stück temporäre Knochen 4*10 =“40_11“: Epi.X*^^+Elefant.Z.225#184011222459689. Die Zahl „10“ entsteht jetzt auch in der Zeilennummer QS 2+2+6=10. Zwar wird die „10“ als Form 10_7 zu einem Paar gespiegelt, jedoch wird „35“ zurück gespiegelt, so dass es sich um 2 Paare „7_01_35_10_7_53“ mit Rest „QS 1+8=9_QS 3+1=4_9=seitlich“ handelt. Epi.X*^^+Elefant.Z.226#183197013510753. In der Folgezeile ergibt Z.227 die QS=11 als Zählgröße. Für eine Zähloperation QS 1+8+2+3+8+9+9+7+8+2=57 sowie QS 8+9+4+3=24=Zeit folgt als Division „57 / (57+24) = 0,703703703703704“ mit einer Serie von 4 Einzelknochen „3+7=10“. Dieses entspricht der Realität beim Menschen. Im Scheitel liegt 1 mittleres Knochenpaar, das sich aus Neuralleistenzellen (Neuralleiste entsteht durch Einstülpung des Ekoderms entlang seiner Längsachse) entwickelt. Seitlich wird es von einem 2. Knochenpaar umfasst, das sich aus dem Mesoderm (mittlere Keimblatt des Embryoblasten) bildet. Dementsprechend besteht der Zwischenscheitelbeinkomplex aus 2 verschiedenen Gewebestrukturen: Epi.X*^^+Elefant.Z.227#182389978208943. Die Quersumme von Z.227 als 2+2+7=11 und der Restgröße QS 7+4=11 sind gleich, werden aber wegen der unterschiedlichen Herkunft um 90° verdreht eingebaut. Das mittlere Paar liegt als paarige Knochenleiste in der Längsachse. Das seitliche Paar zieht vom mittleren Paar jeweils beidseitig als schmaler Knochen zum Schläfenbein herunter. Die 4 Teile der Form-7-Serie „703_703_703_703“ können vertikal gestapelt werden, um als Säule im Schädeldach eine Rechteckform „7_0_4“ auszubilden. Zwei Teile sind dabei das knöcherne Hirnzelt aus 2 dreieckförmigen Hohlräumen und 2 Teile setzen sich zum dreischichtigen Schädelknochen als Sandwich durch Luftblasen „0“ der späteren Pneumatisation zusammen. Die Quersumme QS 7+0+3=10 ergibt sich auch aus der Bixnom-Krümmung 64 oder der Spiegelung 46 als Schädelform.
2.) Adulte Phase: In der Parallelepisode formt sich das Zwischenscheitelbein (Os interparietale) im Schädeldach zu einem unpaarigen Knochen. Innenseitig an der Schädelhöhle bildet das Zwischenscheitelbein einen Sichelfortsatz (Processus tentoricus) aus, der Bestandteil des knöchernen Hirnzeltes (Tentorium cerebelli osseum) ist. Das paarige Scheitelbein und das Hinterhauptbein sind ebenfalls mit einem Sichelfortsatz beteiligt. Das knöcherne Hirnzelt springt mit einer Knochenspitze in die Schädelhöhle vor und ist bei Elefanten, Fleischfressern und Pferden vorhanden. Das Kleinhirnzelt (Tentorium cerebelli) ist eine querverlaufende Hirnhautstruktur, die Groß- und Kleinhirn trennt. Bei einigen Säugetieren ist ein knöcherner Anteil (Tentorium cerebelli osseum) vorhanden, dem sich der häutige Teil des Hirnzeltes (Tentorium cerebelli membranaceum) anschießt. Beim Wiederkäuer und Schwein wird der Bereich als „Protuberantia occipitalis interna (andere Quelle: Eminentia cruciformis) bezeichnet.
Im sagittalen Längsschnitt wird die beim Pferd im Grundriss dreieckige Knochenspitze des Hirnzeltes beim Elefanten von einer unter 45° geneigten Trennwand in 2 dreieckige Hohlräume unterteilt, so dass im Längsschnitt die obere Kammer eine vertikale Seitenwand und die untere eine horizontale Seitenwand bildet. Das Hirnzelt des Pferdes enthält keinen Hohlraum und ist um Grundriss dreieckig geformt, weil die beiden Äste des Sinus transversus als Fortsetzung des verzweigten Sinus sagittalis dorsalis seitlich am Hirnzelt anliegen und sich hierbei in Bogenform von der Längsachse in die Querachse nach links und rechts krümmen. Der Sichelfortsatz des Scheitelbeins bildet die seitliche Begrenzung und der Sichelfortsatz des Hinterhauptbeins ist der kaudale Deckel. Eine genaue Abgrenzung ist hier nicht bekannt. Ober- und unterhalb des ausgehöhlten Hirnzeltes liegt im Längsschnitt jeweils ein sehr kleines Knochenloch, das den quer verlaufenden Venen-Gefäßkanal „Canalis sinus transversi“ bilden könnte. Vergleichsweise ist das Hirnzelt bei einem Pferdeschädel hohlraumfrei verknöchert, und entweder ist ein paariger Knochenkanal oder alternativ ein offener Knochenschlitz vorhanden. Das Hinterhaupt der Elefanten zeigt eine glatte Schale, wobei manche Tiere einen nach außen gerichteten, mittigen knöchernen Höcker (Tuberkel) ausbilden. Hierbei handelt es sich nicht um das knöcherne Hirnzelt in der Schädelhöhle. Das Zwischenscheitelbein wird beim Elefanten als kleiner rechteckiger Knochen beschrieben, der nur bei jungen Tieren erkennbar ist. Ein äußerer Scheitelkamm (Crista sagittalis externa), der längs über das Schädeldach zieht, ist nicht vorhanden. Als Crista occipitalis externa wird beim Elefanten eine sehr schmale Knochenleiste bezeichnet, die eine große, mittige Grube in der Hinterhauptschale in 2 Gruben vertikal trennt. Die Rückwand des Hirnzeltes ist zwar „dünn wie eine Eierschale“, wird aber durch diese Knochenleiste rückseitig stabilisiert. Wie beim Pferd und Schwein könnte beim Elefanten eine innere Knochenleiste (Crista sagittalis interna) ausgebildet sein. Bei Säugetieren kann diese Knochenleiste durch den venösen Blutleiter „Sulcus sinus sagittalis dorsalis“ entweder ersetzt oder begleitet werden. Wo sich das Zwischenscheitelbein im Schädeldach als Knochennaht vom Scheitelbein abgrenzt, ist bei den Säugetieren sehr uneinheitlich. Beim Rind ist das Zwischenscheitelbein im gesamten Schädeldach vorhanden, so dass sich die beiden seitlichen Scheitelbeine nicht verbinden können. Es verschiebt sich aber zum Nacken hin, weil sich das Stirnbein im Wachstum ausbreitet. Beim Schwein ist umgekehrt durchgehend eine mittlere Knochennaht vorhanden, weil das Zwischenscheitelbein innenseitig nur mit dem Hinterhauptbein verwachsen ist. Beim Elefanten ist das Schädeldach im Knochen pneumatisiert, so dass die Formgebung vom Lebensalter beeinflusst wird. Am knöchernen Hirnzelt (Tentorium cerebelli osseum) liegt der Venenraum (Confluens sinuum), der durch die Falx cerebri und die Blätter des Tentorium cerebelli begrenzt wird. Beim Menschen sind punktuell konzentriert und kreuzweise 3 Venenzuflüsse (Sinus sagittalis superior, Sinus rectus und Sinus occipitalis) und horizontal nach links und rechts 2 Venenabflüsse (Sinus transversus, paarig) angelegt. Bei den Säugetieren wird dieses Gebiet sehr unterschiedlich verzweigt ausgebildet. Über den Elefanten liegen diesbezüglich hier keine Informationen vor, hilfsweise wird daher wegen der erkennbaren Symmetrie der Venenraum des Pferdes als Vergleichsbasis gewählt. Weiterhin ist anzunehmen, dass die 3 Sichelfortsätze in direkter Folge im Zeilenlauf angelegt sind, weil das Zusammenfügen zum gemeinsamen knöchernen Hirnzelt ansonsten unwahrscheinlich ist.
Zweckmäßig wird in der Parallelepisode die Suche in der gleichen Zeilennummer begonnen. Vorhanden ist die Zeit=60 für das mittlere Knochenpaar als Spiegelung 86_0_68. Mit 6+6=12 könnte die Evolution ein Lebensalter von 8 Monaten auslesen, bis zu dem der mehrteilige Knochen zusammengefügt und ggf. mit anderen Knochen verschmolzen ist. Der Längsblutleiter die Vene „Sinus sagittalis dorsalis“ „88“ ist darin als Röhre 8_0_8 enthalten. Das seitliche Knochenpaar ist mit dem Winkel 90°, als halbes, seitlich=9 liegendes Paar mit 68/2=34 avisiert. Die Situation ist nunmehr von Leitepisode auf die Parallelepisode übertragen worden: Epi.Y*^^+Elefant.Z.225#186068069093488. Das mittlere Knochenpaar „68“ wird als Gruppe 2_44 und 44_2 mittig in das paarige Scheitelbein geschoben. Epi.Y *^^+Elefant.Z.226#85244759053251 und Epi.Y*^^+Elefant.Z.227#184428702845968. Es verbleiben noch 2 Knochenzeilen als Zeilennummer Z.22x für das seitliche Knochenpaar „68“. Dieses wird als seitliche Form symmetrisch „81_7_9_7_18“ mit QS 8+1=9=seitlich angeschlossen. Mit der symmetrischen Krümmung „64“ als „6_4_6“ ist das Schädeldach quer gewölbt und mit „46“ am Hinterkopf fallend gekrümmt: Epi.Y*^^+Elefant.Z.228#183619805026468 und Epi.Y*^^+Elefant.Z.229#182817971816746. Ein innerer Knochenkamm (Crista sagittalis interna) könnte beim Elefanten ausgebildet sein. Die letzte Knochenzeile Z.229 kann diese Knochenleiste noch mit „17_9_17“ als Zählgröße einer Form „1_7“ adressieren. Die „17“ steht am Zahlenende der nachfolgenden beiden Zeilen und ist dann stets maßgeblich am Zahlenanfang als #17... vorhanden, um eine Leiste in der Längsachse durchzuziehen. Der „Sinus sagittalis dorsalis“ verläuft in der Hirnsichel (Falx cerebri) und würde dann unterhalb der Knochenleiste „Crista sagittalis interna“ entlang ziehen. Infolge dieser Leiste kann der „Sinus sagittalis dorsalis“ folglich an der Unterseite des Zwischenscheitelbeins keine Gegenform als Rinne „Sulcus sinus sagittalis dorsalis“ bilden. Der „Sinus sagittalis dorsalis“ ist von Bindegewebsbälkchen durchsetzt und wird entweder wie beim Pferd durch eine Scheidewand vertikal halbiert oder wie beim Rind durch eine Lamelle horizontal geteilt. Beim Elefanten ist eine Scheidewand „111“ als vertikale Scheidewand 1_7_1 zu erkennen. Die Röhrenform „202“ ist enthalten: Epi.Y*^^+Elefant.Z.230#182023111069717. Der Längsblutleiter „Sinus sagittalis dorsalis“ ist bei Säugetieren an der Knochenleiste „Crista sagittalis interna“ 22_17 mittels Bindegewebe „33“ als „2233_9=oben_17“ befestigt: Epi.Y*^^+Elefant.Z.231#181235132233917.
Der „Sinus sagittalis dorsalis“ folgt auf dem Weg zum Hirnzelt dem gewölbten Schädeldach abwärts, so dass er sich der Vene „Sinus rectus“ nähert und diese dann aufnimmt. Die Absenkung zeigt sich als Spiegelung der Bixnom-Krümmung „64“ als „46“ in einigen Zeilen, wie Epi.Y*^^+Elefant.Z.232#180453946319116 und Epi.Y*^^+Elefant.Z.233#17967946586281. Wird am Hinterhaupt ein zipfliger Höcker passiert, ist ein Krümmung mit einem Bogen direkt als „604“ erkennbar: Epi.Y*^^+Elefant.Z.234#178911604897585. Unterhalb des Höcker-Bereichs liegt ein Gefäß-Knochenloch „5_0“ in der Hinterhauptschale. Weil vertikal darunter ein 2. Knochenloch vorhanden ist, kann es sich um die vertikale Dopplung „9_1_9_2_9“ als Form 7 handeln. Die größte der Venen im Schädeldach (Diploë-Venen) drainiert das Hinterhauptbein ( Os occipitale) in die Vena occipitalis, den Sinus transversus und in den Confluens sinuum. Beim Pferd liegt der Venenraum „Confluens sinuum“ kaudal bzw. rückseitig auf dem Hirnzelt und enthält den knöchernen Verbindungskanal „Canalis sinus transversi“ zwischen dem paarigen „Sinus transversus“. In diesem quer liegenden Knochenkanal münden 2 Venen aus dem Hinterhaupt, so dass 2 Knochenlöcher notwendig sind. Die Krümmung „64“ zählt sich hier aus der Restsumme =“2“+7+8+9+1+9+2+9+7=54, wenn aus der Zeilennummer QS „2“+3+5=10 addiert wird: Epi.Y*^^+Elefant.Z.235#178150278919297. Das Loch „404“ folgt nochmals direkt mit der Zahl „54“ und die Vene=0_8_0 für ein mögliches Gefäß im Loch: Epi.Y*^^+Elefant.Z.236#177395404856080. Das Hinterhauptbein ist gewölbt, zeigt aber in der Mittelachse eine Grube, die bis zum knöchernen Hirnzelt (Tentorium cerebelli osseum) herunter reicht, so dass mit „6_4_6“ die gegensätzlichen Wölbungen mittig und seitlich enthalten sind. In diesem Bereich bildet das Zwischenscheitelbein nunmehr seinen Sichelfortsatz (Processus tentoricus) aus. Weil zur Beschreibung nur die „66“ zur Verfügung steht, müssen 3 Knochen mit einem Sichelfortsatz beteiligt sein, um mit „66/3=22“ einen Knochen zu adressieren. Die Sichelfortsätze des Scheitelbeins und des Hinterhauptbeins müssen dann ähnlich erkennbar werden. Es handelt sich um einen Zählvorgang, so dass eine Zählgröße „010_3“ auf die 3 Anteile verweist. Der Winkel 90° ist geeignet, die Konstruktion passend zu drehen bzw. bildet auch die Spitze des Hirnzeltes eine 90°-Ecke. Mit „8_1“ wird die Vene=8 als Zählgröße zur Gestaltung aktiviert: Epi.Y*^^+Elefant.Z.237#176646901038122. Direkt vor dem Hirnzelt nimmt der „Sinus sagittalis dorsalis“ die Vene „Sinus rectus“ auf. Beim Elefanten könnte dieses wie beim Menschen im Winkel von „90°“ erfolgen. Zwar wird mit der QS 1+7=8 die Aufnahme der Vene als Klammerung „68_QS 1+7=8_68“ avisiert, die 1_7 deuten aber gleichzeitig die Venentrennwand 1_7_1 an. Diese ist aber tatsächlich lückenhaft, so dass ein Seitenzulauf möglich ist. Beim Pferd kommt der Sinus rectus von der linken Seite, so dass der Zufluss auch nur in die linke Venenhälfte erfolgen könnte. Der Zufluss des „Sinus rectus“ wird in der Zeilennummer Z.“23_8“ als Struktur QS 2+3=5_8 vermerkt und auch wegen #QS 1+7=8_5 bestätigt: Epi.Y*^^+Elefant.Z.238#175904687168214. Durch die Dreiecksspitze des knöchernen Hirnzeltes werden die beiden Hälften des „Sinus sagittalis dorsalis“ als eine symmetrische Verzweigung 68_68 aufgefächert. Das knöcherne Hirnzelt wird beim Scan im Zeilenlauf angeschnitten und zeigt dabei den dreieckigen Hohlraum als „3033“. Wegen QS 1+7+5+1+6+8+6+8+4+2+9+3+0+3+3=66 und dem Drittel 66/3=22 von 3 Sichelfortsätzen handelt es sich bei der „33“ um keine Hautmembran, sondern um die knöcherne Trennwand im Hirnzelt. Wird die „33“ von der QS wegen der „Trenn-Null“ subtrahiert, verbleiben als Zeit=60 und eine Monatszählung „1_QS 7+5=12_1“, um die Pneumatisation des Hirnzeltes zu adressieren. Ausgewachsen und geschlechtsreif „66/33“ ist der Elefant im Alter von 12 - 20 Jahren: Epi.Y*^^+Elefant.Z.239#175168684293033. Der „Sinus sagittalis dorsalis“ geht beim Pferd nach der Verzweigung direkt in den paarigen Sinus transversus über als „QS 1+7=8_QS4+4=8_88. Die Evolution findet die „45°“ für die Neigung der Trennwand als Form 77 am rechten Zahlenrand aufgrund der Strukturdopplung 14_5_14 sowie den Hohlraum in der Zeilennummer Z.“240“. Wird von der Quersumme QS 1+7+4+4+3+8+8+1+4+7+7+5+1+4+5=69 der Längsschnittwinkel 45° als 4+5=9 subtrahiert, verbleibt ein nutzbarer Grundrisswinkel von 60°, so dass der „Sinus transversus“ im Grundriss unter 60° beidseitig verzweigt und das Hirnzelt des Elefanten eine 60°-Dreiecksspitze (60°+60°+60°=180°) bildet: Epi.Y*^^+Elefant.Z.240#174438814775145. Der paarige „Sinus transversus“ krümmt sich in Bogenform in die Querachse hinein, so dass sich im Grundriss zum „Sinus sagittalis dorsalis“ als Startpunkt ein Venendreieck bildet. Beim Pferd ist hinter dem knöchernen Hirnzelt ausreichendes Knochenmaterial vorhanden, um einen querverlaufenden Knochenkanal „Canalis sinus transversi“ zur Verbindung beider „Sinus transversus“ anzulegen. Dieser Bereich wird allgemein als „Confluens sinum“ bezeichnet. Beim Rind ist dieses kein Knochenbereich, sondern ein Venengeflecht. Für den Elefanten ist anzunehmen, dass sich das „Confluens sinum“ in der Grube der Hinterhauptschale hinter dem Hirnzelt als Venenraum ausbreitet, und außerdem wird über und unter dem Hirnzelt jeweils ein querliegender Knochenkanal für die Vene „Sinus communicans“ durchgeleitetet als 1+7=8_3 (wie Hirnzelt 7_3_7)_QS 1+7=8=Vene. Knochenkanal „0_22“ als paarige Struktur 50_05. Epi.Y*^^+Elefant.Z.241#173715002265705. Der paarige Knochenkanal ist als Form 77 mit „2_99_1_7_1“ vertikal ausgerichtet und wird beidseitig „71_71“ am Sinus transversus angeschlossen: Epi.Y*^^+Elefant.Z.242#172997171677830. Der Sichelfortsatz (Processus tentoricus) des Zwischenscheitelbeines ist realisiert, so dass der Sichelfortsatz des Scheitelbeines nunmehr beidseitig folgt und das knöcherne Hirnzelt seitlich mit dem Scheitelbein verbindet. Für den Processus tentoricus ist der Knochen=22 und die Zählgröße 1_606 enthalten, wobei mit dem Hirnzelt 66/3=22 die „0 (Null)“ für den aufzunehmenden „Sinus communicans“ im „Canalis sinus transversi“ adressiert ist. Beim Pferd tritt der „Sinus transversus“ am Verbindungspunkt in den direkt in den Knochen ein: Epi.Y*^^+Elefant.Z.243#172285249160637. Ein Querschnitt der Schädelhöhle liegt hier nicht vor. Grundsätzlich nimmt der paarige „Sinus transversus“ beim Pferd den „Sinus petrosus lateralis“ „88“ auf, der an der seitlichen Begrenzung der Schädelhöhle „Crista partis petrosae“ „11“ entlang zieht: Epi.Y*^^+Elefant.Z.245#170878838963407 und Epi.Y*^^+Elefant.Z.248#168811756234011. Der „Sinus transversus“ geht abschließend beidseitig in den paarigen „Sinus temporalis“ über als „40_8_5_8_40“. Die Doppelziffer „66“ als Drittel-Zählgröße „1_66_1_3“ für das knöcherne Hirnzelt liegt nunmehr am linken Zahlenrand, so dass sich in Verbindung mit dem Knochen-Hohlraum=22_0 der 3. Sichelfortsatz (Processus tentoricus) des Hinterhauptsbeins als kaudaler räumlicher Deckel „454_7_757“ bildet. Zum Abschluss hat sich die Zeilennummer des Zwischenscheitelbeins von der Knochenzeile Z.225 zur symmetrischen Struktur Z.252 geformt: Epi.Y*^^+Elefant.Z.251#166794085840776 und Epi.Y*^^+Elefant.Z.252#166132204547757.
13.) Scheitelbein (Os parietale): Das paarige Scheitelbein liegt zwischen dem Hinterhauptbein (Os occipitale) und dem Stirnbein (Os frontale). Mittig vor dem Hinterhauptbein wird als kleiner Knochen das unpaarige Zwischenkieferbein eingekeilt. An der Oberfläche ist es nicht sichtbar und kann nur bei jungen Tieren abgegrenzt werden. Der Sichelfortsatz (Processus tentoricus) des Zwischenkieferbeins ist Bestandteil des Hirnzeltes (Tentorium cerebelli osseum). Weil das Zwischenkieferbein relativ klein ist und nicht das ganze Schädeldach ausfüllt, bildet das paarige Scheitelbein im Schädeldach eine Knochennaht „111“, die erst bei älteren Tieren unsichtbar verknöchert. Im Übergang vom Schädeldach zu den Seitenflächen des Schläfenbeins zieht sich eine Knochenleiste (Linea temporalis). Im Unterschied zum Menschen, bei dem 2 parallele Linien vorhanden sind, zieht nur 1 Linie bogenförmig weiter bis zum Schläfenbein (Os temporale) herunter. Am Schläfenbein (Os temporale) ist der Unterkiefer (Mandibula) gelenkig angeschlossen. Der großflächige, bogenförmige Verlauf der „Linea temporalis“ kann beim Elefanten aus einer Bixnom-Kurve „64“, einer runden Form 0_777 und einer Linie „1“ in „1_3__3“ sowie als seitliche Linie seitlich=9 in Zeile Z.309 adressiert werden, wobei die Linie Z.3_1_x nachfolgend in 10 Zeilen durch die Zeilennummer mitgezogen wird: Epi.Y*^^+Elefant.Z.309.#135486458077783. Als weitere Struktur liegt in der inneren Schädelhöhle 55_00 (55 kein Muskel, sondern Struktur) ein Knochenkamm „Sphene-orbital crest“. Dieser verläuft bogenförmig und teilt die mittlere Schädelhöhle von der vorderen (rostal) Schädelhöhle. Als Teiler „1“ wirkt auch hier die Zeilennummer „Z.313“, wobei beim Scheitelbein mit dem Hirnzelt immer 3 Knochen strukturell einzuschließen sind. In der Schädelhöhle als Form 7 wird nunmehr der Knochenkamm als Linie „1“ erkennbar in „7_5500_1_7“. Die Trennlinie ergibt sich, wenn die Gruppe 44_5_2 als Raumteiler 44/2=22 zwei Knochenbereiche in der Schädelhöhle (Cavum cranii) liefert: Epi.Y*^^+Elefant.Z.313.# 13375500174452. Der innere Knochenkamm wird als Linie 1_3 in der mitlaufenden Zahl #13... zusammen mit der äußeren „Linea temporalis“ über die Zeilennummer 31x als Gegenbogen 31 vs. 13 über 6 Zeilen mitgezogen. Diese Dopplung als Struktur „5“ ist mit räumlich=4 und seitlich=9 in 13__9_030_4_13 enthalten: Epi.Y*^^+Elefant.Z.314.#133329030401385. Nichts passiert, wenn es nicht mathematisiert ist. Folglich muss auch die Pneumatisierung des Knochens, die über die Stirnhöhle erfolgt, enthalten sein. Beim älteren Tier zeigt sich über die Zeit=24 ein verknöcherter „Blasenschaum“. Offensichtlich wird die Luft mit dem Stickstoff=7 (ansonsten Form und Nerv) adressiert. Das ist möglich, weil das Periodensystem der Elemente (PSE) durch den Bixnom bzw. „Relative Ruhe“ entsteht. Gleichzeitig kann sich der Knochen als Form 7 aufwölben „757_77(Stickstoff)“. Pneumatisierung: Epi.Y*^^+Elefant.Z.316.# 132485175778591. Gekoppelt ist eine 2. Zeile, die erneut die Zeit=24 enthält. Die wissenschaftliche Abbildung zeigt die Pneumatisierung in der Weise an, als sei der Knochenkamm „Sphene-orbital crest“ in eine obere und untere Linie gespalten worden, um den riesigen Zwischenraum bis zur Schädeldecke mit „Blasenschaum“ zu füllen. Bei der doppelten Linienbeschriftung müsste man einen Schreibfehler unterstellen, aber es scheint real so zu passieren 414_70(Blasenschaum)_141 und QS 4+1+4+7+0+1+4+1=22=Knochen. Ebenfalls als Knochen 2_2 bildet sich mit 2_QS 6+7=13_2 der Knochenkamm „13“: Epi.Y*^^+Elefant.Z.317.#132067241470141. Als 3. Linie ist eine Knochenlängsnaht „111“ auf dem Schädeldach zu adressieren: Paarig=2 ist in „13_QS 0+8+2+9+1+1+1+0=22(Knochen)_08_13 der Knochen adressiert. Die Knochennaht existiert nur für das junge Tier, so dass eine Zeitangabe zu suchen ist als „8+8 plus QS 1+3+1+3=8“ mit 3*8=24 Stunden: Epi.Y*^^+Elefant.Z.320.# 130829111081359. Als „jung“ =59/13 sind es 4,5 Jahre bis zur Verknöcherung der Mittelnaht im Schädeldach.
14.) Schläfenbein (Os temporale): Das paarige Schläfenbein bildet den unteren seitlichen Abschluss des Schädels und gliedert sich in 3 Abschnitte: 1.) Schläfenbeinschuppe (Pars squamosa), 2.) Felsenbein (Pars petrosa) mit dem Warzenfortsatz (Processus mastoideus) und 3.) Paukenteil (Pars tympanica). Das Felsenbein umgibt das Innenohr (Auris interna) und ist von außen nicht sichtbar. Der Paukenteil im Mittelohr (Auris media) ist über die Ohrtrompete (Tuba auditiva) mit dem Nasenbein verbunden und ebenfalls nicht sichtbar.
14.1) Pars squamosa: Erkennbar ist, dass sich der „)-förmige“ Bogen der „Linea temporalis“ vom Scheitelbein (Os parietale) nach unten und vorn bis zum Jochbein fortsetzt. Die Knochenleiste der „Linea temporalis“ zeigt sich zunächst innerhalb der Knochenfläche des Schläfenbeins und krümmt sich dann als Rand des Jochfortsatzes (Processus zygomaticus) weiter zum Jochbein. Die „Linea temporalis“ wird unter Einbeziehung der Zeilennummer ab Z.309 in der Parallelepisode gebildet. Entsprechend läuft die weiterführende Kurve im Schläfenbein zuvor von Z.300 bis Z.308. Dieses ist sinnvoll, weil in der Leitepisode zeitgleich ab Z.300 der Unterkiefer entsteht, der am Gelenkkopf (Condylus mandibularis) des Schläfenbeins angeschlossen wird. Vom Gelenkkopf zieht ein Knochenkamm entlang der Vertiefung „Fossa mandibularis“ als „Facies articularis“ unterseitig des Schädels zur Schädelmitte. Dieser Knochenkamm wirkt als aufgesetzter Fremdkörper gegenüber den übrigen sichtbaren inneren Strukturen des Schläfenbeins (Fissura petrooccipitalis, Inzisura tympanica und Canalis musculotubarius), die bereits vor Zeile Z.300 entstanden sein müssen. Die bogenförmige Fortsetzung der „Linie temporalis“ wird als Knochenleiste „11“ avisiert, die mit 1_QS 1+7 eine Form „7“ als Zählgröße „1“ bildet. Der Quersumme 48 = 24+24 =„1+3+9+5+5+1=24“ + „5+1+8+2+0+1+1+6=24“ fehlt an der Bixnom-Kurve „64“ für die „Linea temporalis“ der Restwert=12. Die Zahl 12 rechnet sich über die Zeilennummer Z.301 bis Z.304 als 3*4=12 zusammen. In der Zeile Z.304 ist die Facies articularis fertiggestellt, so dass die „Linea temporalis“ als Knochenleiste auf einer Schläfenbeinfläche erst beginnen kann. Epi.Y*^^+Elefant.Z.300#139551051820116. Knochenverbindung vom Jochbein zum Jochfortsatz (Processus zygomaticus) zum Jochbogen (Arcus zygomaticus): Die vordere Zahl „1“ ist eine Zählgröße und die Zahl „2“ gilt als paarige Ausführung der Verbindung 39_39. Die überschüssige Zählgröße „1“ ergänzt QS 8+7+4+2=21 nur ideel als gemeinsamer Knochen=22, so dass das Jochbein real separat bleibt: Epi.Y*^^+Elefant.Z.301#139087427063239. Der Unterkiefer (Mandibula) ist in der Leitepisode Z.322 fertiggestellt und muss nunmehr die Information finden, dass der Gelenkkopf am Schläfenbein bereits in der Parallelepisode Z.302 zur Verfügung steht. Die Parallelepisode enthält mit der „Null“ in der Zeilennummer Z.303 einen Platzhalter, der für ein Gelenk=flexibel=6 als Markierung der Ziffer „2“ in „6_2_6 zum Aufruf der Zeilennummer Z.322 zwecks Hochzeit „86_68“ mit dem Unterkiefer dient. Anschluss der „Fossa mandibularis“ seitlich als Extra „89_89“: Epi.Y*^^+Elefant.Z.302#138626872668989. Die Bezeichnung „Fossa“ ist eine Grube und bezieht sich somit nicht auf den Knochenkamm der Knochenfläche „Facies articularis“, sondern ist die Einsenkung daneben, die den Gelenkkopf formt. Am Boden der Grube ist eine Kerbe (Incisura tympanica) erkennbar. Ein Grube ist als Lochform 3_77_3 enthalten, weil die Zeilennummer Z.303 mit der „Null“ die Grube darstellt: Epi.Y*^^+Elefant.Z.303#138169358237739. Die Facies articularis bildet sich ebenfalls als Form 77 mit Anschlüssen 85_85. Die „Null“ in der Zeilennummer Z.304 mit QS 3+0+4=0_7 ein Nervenkanal. Dieser ist als Begrenzungsloch des Knochenkamms adressiert, weil dort die Öffnung „Foramen stylomastoideum“ für den „Canalis nervi facialis“ liegt: Epi.Y*^^+Elefant.Z.304#137714853769851.
14.2) Felsenbein (Pars petrosa): Weil mit der Zeilennummer die Knochenleiste „Linea temporalis“ auf der Oberfläche des Schläfenbeins im Zeilenlauf mitgezogen wird, kann die Zeile selbst einen Blick hinein in den Schädel werfen, um die folgenden Bestandteile des Schläfenbeins zu adressieren: 1.) Knochenleiste „Crista partis petrosa“, 2.) Felsenbein (Pars petrosa), 3.) innerer Gehörgang „Meatus acusticus internus“ als Knochenkanal im Felsenbein (Pars petrosa ossis temporalis). Diese Umrandung des inneren Gehörganges bildet eine „kleine Insel mit Loch“, die in 1 Zeile Platz findet, wobei die Zeilennummer Z.307 ergänzend ein Formloch 0_7 bzw. den Nerv 7 adressiert. Insel „3636“ mit Knochenleiste als Seitenrand „1_3636_9_1“ sowie dem integrierten Loch „060“ als Gehörgang. Der Hörnerv ist Teil des „Nervus vestibulocochlearis“ als 8. Hirnnerv. Der Ton wird durch den Gehörgang geleitet von 13 bis 13, so dass der Hörnerv = 8. Hirnnerv als QS 1+3+1+3=8 bereits avisiert ist und das Loch einem Zweck dient: Epi.Y*^^+Elefant.Z.307.#136369106013143. Als letzte Zeile und als Ende des inneren Gehörganges könnte noch das Trommelfell adressiert werden. Zwar ist davon absolut nichts zu sehen, aber der Elefant basiert auf einer verehrungswürdigen Schläue: Das Trommelfell ist zweifelsfrei als Kombination von Zeile Z.308 und Hörstrecke in der Zeile xxx38 mit der „Null“ in der Zeilennummer adressiert, wobei das Loch nochmals als Formloch 7_0 als QS=1+3+5+9+2+6+3+4+9+1+7+5+4+3+8=70 bestätigt wird. Die Zeitdifferenz der Strecke im inneren Gehörgang bis zum Trommelfell beträgt Delta=„442756837705011“. Darin ist das Trommelfell als Struktur „050“ enthalten und ergibt QS 5+11=16 Hz. Die ermittelte Sprechfrequenz an der Infraschallgrenze stimmt somit mit der Hörfrequenz überein. Das Trommelfell ist prinzipiell ein Hautelement „33“. Bei einem Trommelfell das permanent beschallt wird, fehlt ähnlich wie beim Sprechen oder am Hörknöchelchen immer etwas Perfektes. Hier ergibt die Quersumme zwischen den Doppelziffern QS 2+7+5+6+8+3=31 und wird erst am Ende der Zeitdifferenz mit „11“, wenn der Ton vom Hörknöchelchen „Hammer“ weitergeleitet wurde, mit QS 31+1+1=33 zur Haut. Außerdem enthält eine Membran immer 2 Seiten, die beim Durchgang erkennbar sein müssen. Der Weg „44“ zum Ziel „77“ besteht als innerer Gehörgang QS 4+4+7+7=22 aus einer Verknöcherung 22. Insgesamt wurde somit über die Zeitdifferenz eine Struktur „55“ adressiert (kein Muskel), die mit QS=5+5=10 zum 10er Bixnom-Schwingkreis führt.
14.3) Paukenteil (Pars tympanica) [Show-down „Papyrus Rhind“]:
Der Elefant ist ein mathematisiertes Geschöpf, so dass für das Hör- und Gleichgewichtsorgan in der Paukenhöhle (Tympanic cavity) nunmehr Physik statt Biologie benötigt wird, um auch ohne Zeitvorstellung (der Beobachter bewegt sich parallel zum Vorgang) den Zifferncode entschlüsseln zu können: Im Quadrat aus 9 x 9 Feldern der Einheit „E“ mit der Fläche=81 (E^2) entsteht eine maximale Kreisfläche= Pi*4,5^2= 63,61725124 (E^2), die eine Ersatzkantenlänge=7,976042339 E ergibt. Der Kreis wird umschrieben von einem kleinen Achteck aus 63 E^2 und einem größeren Quadrat 8 * 8 = 64 E^2, so dass die Zahl Pi näherungsweise bestimmbar wird. Für die Physik sind 63 E^2 maßgeblich, weil in der Bixnom-Gravitationslinse nur eine Rechteckmatrix mit maximal 7 Kugeln in der Spalte mit 7 * 9 = 63 Lichtkugeln platziert werden kann, wogegen sich die Biologie der Linsenkrümmung anpasst und 64 Lichtkugeln unterbringt.
Weil das Universum auf der relativen Ruhe beruht, muss sich auch die Erdbeschleunigung „g“ in irgendeiner Weise darstellen. Mit der Triebkraft der Würfelkunde bewegt sich der Materiestrom, um sich ohne Materie zu bewegen. Zeitversetzt erfolgt dann die Parallelepisode: Damit ein Materiestrom überhaupt bestehen kann, muss er Masse aufnehmen, die wegen der Erdbeschleunigung „g“ eine Kraft erzeugt. Die Erdbeschleunigung beträgt rd. 9,81 m/s², wobei die Biologie vorzugsweise nicht an den Polen mit 9,832 m/s² und am Äquator mit g=9,780 m/s² stattfindet. Um mit einem Energieminimum eine Wirkung ganzzahlig > Nichts (0) zu erzeugen, sind wegen Aktion=Reaktion auf das biologische Wirkungsfeld von 64 E^2 beidseitig jeweils 0,11 E^2 anzusetzen, so dass sich ein Gesamtfeld von 64,22 E^2 ergibt. Bei einem 10er Bixnom-Schwingkreis wirkt auf 1 Tortenstück nur 1/10 des Einflusses.
Physikalische Einheiten = 64,22 Biologische Einheiten * 10% des 10er Bixnom-Schwingkreises * 9,81m/s² (Erdbeschleunigung) = 62,99982 = rd. 63. Im Dreieck Paris-Brüssel-Frankfurt ist die Erdbeschleunigung optimal:
BiXnom-Erdbeschleunigung= 10 * 63 / [(11/100) + 64 + (11/100)]= 9,81002802865151 m/s².
Die Kennzahl in Kubik (g^3) = „944084233127449“ bildet seitlich 2 Oberflächen „9_44“ als 2 Membranen „2_33“. Die Leitepisode bildet die linke Restgröße= 0+8+4=12 und die Parallelepisode die rechte Restgröße QS 1+2+7=10. Damit die relative Ruhe zwischen den beiden Membranen mit 11=11 wieder hergestellt ist, muss die Parallelepisode zeitverzögert eine Zählgröße „1“ aufnehmen. Die Kennzahl als Wurzel (g) = „990455856091099“ mit der Membran „33“ als Quersumme 4+5+5+8+5+6= 33 bildet mit der Restgröße QS 9+1=10 das Wasser H2O [1*2+8=10].
Vom Nasenrachenraum (Pars nasalis des Pharynx) besteht über die paarige Ohrtrompete (Tuba auditiva / Eustachi-Röhre / Tuba pharyngotympanica) an der Öffnung (Ostium tympanicum) ein Zugang zur Paukenhöhle (Tympanic cavity). Das Ostium „0“ wird mit dem Knochen 22 als Zeilennummer Z.202 symbolisiert. Die Paukenhöhle ist mit einer einschichtigen „1“ Schleimhaut ausgekleidet, die aus isoprismatischen (kubisch) Zellen „4“ besteht, in die Becherzellen eingelagert sind. Die Becherzellen „40“ produzieren den Schleim. Es werden die 4 Arterien=9 (Arteria tympanica inferior, Arteria tympanica anterior, Arteria tympanica posterior, Arteria tympanica) adressiert als 4_9_Vene 6+2=8_9_9_QS 5+3+1=9_4. Die Arterien sollen sich untereinander zu Anastomosen „99“ verbinden. Die Paukenhöhle ist paarig „#2“: Epi.X*^^+Elefant.Z.202#204962995314010. In der Paukenhöhle (Cavum tympani) werden die vom Gehörgang am Trommelfell (Membrana tympani) anliegenden Schwingungen über die 3 Gehörknöchelchen (Ossicula auditus) zur Hörschnecke (Cochlea) weitergeleitet. Der Hammer (Malleus) ist am Trommelfell befestigt und gibt den Ton über Amboss (Incus) und Steigbügel (Stapes) weiter. Die Physik=„63“ wird zur Schallleitung benötigt, wofür der Trommelfellspanner (Musculus tensor tympani) „63_55“ kombiniert wird. Die Übereinstimmung von „203“ in Zeilennummer und Zifferncode wird genutzt, um in der Paukenhöhle „0“ eine untere Tasche als Paukenblase (Bulla tympanica) anzulegen, die das Hören von tiefen Tönen begünstigt. Funktionell wird am Trommelfell „33“ das 1. Gehörknöchelchen Hammer (Malleus) benötigt, das aus 3 Abschnitten (Stiel, Hals plus Fortsatz „Processus lateralis“ und 2 Gelenkflächen besteht. Der Stiel als Knochenabschnitt „2“ liegt am Trommelfell „33_2“ an und ist als heller Streifen „Stria mallearis“ erkennbar. Als Gelenkflächen kann die Dopplung 53_53 gezählt werden. Der Hals „20“ kann mit der QS 2+0+3=5 zum Fortsatz 5_9=seitlich (lateral) ergänzt werden: Epi.X*^^+Elefant.Z.203#203953325386355. Weiterhin wird der Steigbügelmuskel (Musculus stapedius) „55“ benötigt. In der Paukenblase werden beim Elefanten als Extra „8“ Trennwände als Septen „202_8_1“ eingezogen. Die Gehörknöchelchen werden durch 5 zarte Bänder (Lig. mallei superius, Lig. mallei anterius, Lig. mallei laterale, Lig. incudis posterius, Lig. incudis superius) „111“ aufgehängt „4_1_QS 8+3=11_4“: Epi.X*^^+Elefant.Z.204#202953554183481. Die Paukenhöhle bildet einen physikalischen Raum „63_6000“ und enthält 3 Membranen „000“. Zur Schallleitung wird die Physik 63 mittels der Struktur 5 gespiegelt als „63_5_36“, wobei die Membranen 33 als 3_5_3 avisiert werden. Mit QS 8+4=12 handelt es sich zeitabhängig um Schwingungen. Die Restgröße QS 2+0+1+9=12 zeigt, dass die Schwingung in der Paukenhöhle mit 12+12=Zeit=24. Die Knochenwände der Paukenhöhle setzen sich zum größeren Teil aus der „Pars tympanica“ und im medialen Teil aus der „Pars petrosa“ des Schläfenbeins zusammen. Der Knochen „22“ wird daher aus der der Zeilennummer Z.2xx und dem Zifferncode #2 zusammensetzt. Cavum tympani: Epi.X*^^+Elefant.Z.205#201963536846000. Die Schwingung wird auf die Membran im ovalen Fenster (Fenestra ovalis) übertragen. Das ovale Fenster wird über 2 Zeilen „oval=200...2000“ geformt. Weiterhin wird das Tonsignal (beim Menschen) mit Knochenbezug „22“ um das 22-fache verstärkt [17:1 Fläche ovale Fenster / runde Fenster; Hebelwirkung der Gehörknöchelchen Faktor 1,3]. Dieses ist erforderlich, weil der Schall von der Luft in eine Flüssigkeit eintritt. Die „22“ in Zeilennummer und Zifferncode wird für das 2. und 3. Gehörknöchelchen (Incus und Stapes) benötigt, wobei in beiden Zeilen eine Zahl „2“ zusätzlich für paarig=2 verfügbar ist.
Als physikalische „63“ Schallleitung muss nunmehr die Ziffer „6“ in der Zeilennummer vor die Zahl „3“ zu „63“ geschoben werden. Mit der Quersumme QS 6(aus Z.206)+3+1+3+1+3+2+7+3+3+1= 33 hat das Trommelfell „33“ ein Signal erhalten und leitet es zur Membran am ovalen Fenster (Fenestra ovalis) 33_1 mit einem Signalton “1“ zur Hörschnecke (Cochlea) weiter. Mit den beiden Zeilen Z.206 und Z.207 stehen mit „0 (Null)“ 2 Gelenke zur Verfügung: 1.) Hammer-Amboss-Gelenk (Articulatio incudomallearis) und 2.) Amboss-Steigbügel-Gelenk (Articulatio incudostapedia). In der Zeile 206 wird der Amboss (Incus) aus einem langen Schenkel 313 mit Fortsatz als Extra 8 und seitlich=9 sowie ein kurzer Schenkel 31 als Form 7 benötigt: Epi.X*^^+Elefant.Z.206#200983131327331. Der Steigbügel ist an beiden Schenkeln (Crus anterior und Crus posterior) „121“ erkennbar. Die beiden Schenkel werden zum Gelenkkopf (Caput stapedis) verbunden. Hierfür wird eine Multiplikation = 48 * „2“= 96 gestartet. Die Zahl „7“ in der Zeilennummer kann nunmehr als Schallleitung in die Lücke verschoben werden zu QS 7(aus Z.207)+3+2+5+7=24=Zeit. Epi.X*^^+Elefant.Z.207#200012198325749. Die für den Steigbügel benötigte ovale Fußplatte „050“ wird in einer 2. Zeile gebildet, die beide Schenkel „121“ nochmals adressiert. Entwicklungsgeschichtlich wurde durch den Steigbügel die Arterie „Ramus stapedius arteriae auricularis posterioris“ „99“ durchgefädelt. Beim Menschen wird alternativ „99“ als seitlich=9 interpretiert, so dass der offene Bogen beim Menschen von Bindegewebe überspannt ist. Wird 99/3=33 auf 3 Knochen verteilt, ist Bindegewebe 33 vorhanden. Die Null in der Zeilennummer Z.208 dient als Extra 8 für das runde Fenster (Fenestra cochleae) zum Innenohr (Auris interna). Die Quersumme mit dem ovalen Fenster ergibt die Zeit QS 1+9+9+0+5+0=24. Davon wird mit 9+9=18, die im Zifferncode vor der Halbzeit=12 steht im Prinzip die Hörschnecke avisiert, die die Schwingungsenergie im Innenohr zum Schwingungsausgleich über das runde Fenster wieder an das Mittelohr zurückgibt. Die Zahl Kalium=19 gewinnt für die Flüssigkeit im Innenohr an Bedeutung. Wird die Ziffer 8 der Zeilennummer zur Schallleitung verschoben, wird in der Lücke die Quersumme 8(aus Z.208)_6_QS 1+2+1_8 = 8_64_8 gebildet, die eine biologische Verarbeitung des physikalischen Signals „63“ in der Hörschnecke avisiert. Das runde Fenster wird durch das zweite Trommelfell (Membrana tympanica secundaria) „33“ verschlossen. Die Membran könnte aus der Laufzeitdifferenz der Zeilen Z.207-Z.208=#961597107335337 zwischen dem ovalen und dem runden Fenster als „7_33_5_33_7“ ermittelt werden. Hierbei handelt es sich aber um die beiden Membranen und den Nerv „7“ in der Hörschnecke selbst. Das zweite Trommelfell „versteckt“ sich daher physikalisch: In Z.206 wird mit 33_1 ein Signalton „1“ als Zählgröße am ovalen Fenster abgeben. Dieser Energieüberschuss muss nunmehr auf der Empfangsseite das Defizit 32+1=33 als Membrana tympanica secundaria „33“ kompensieren. Die Größe 99=seitlich verschiebt dazu die Ziffer „1“ bzw. zählt in der Quersumme nicht mit QS 1+[99]+0+5+0+6+0+1+2+1+8+4+1+4=33: Epi.X*^^+Elefant.Z.208#199050601218414. Hörschnecke (Cochlea) und Gleichgewichtsorgan (Vestibularapparat) gehören zum Felsenbein (Pars petrosa).
Hörschnecke (Cochlea): Das Signal „1“ der Differenz 64-63 pflanzt sich als Druckwelle durch einen pyramidenförmig gewickelten Spiralschlauch vom ovalen Fenster (Fenestra ovalis) zum runden Fenster (Fenestra cochleae) fort, Der Schlauch ist mit Perilymphe aus Natrium-Salz=„11“ gefüllt. Auf diesem Weg von der Vorhoftreppe (Scala vestibuli) zurück zum Mittelohr über die Paukentreppe (Scala tympani) wird auf halber Strecke die Schneckenspitze (Apex cochlearis) durch das Schneckenloch (Helicotrema) passiert, wo als mathematischer Hintergrund in der Halbzeit die „Quadratur des Kreises“ realisiert wird. Vorhoftreppe und Paukentreppe laufen in der Hörschnecke als obere und untere Lage gestapelt und werden außenseitig vom Schneckengang (Ductus cochlearis / Scala media) begleitet, der als Schlauch mit Endolymphe aus Kalium-Salz=„19“ gefüllt ist. Das Schallereignis ist mit der Öffnung von Kalium-Ionen-Kanälen durch eine einschichtige Membran verbunden. Wegen Kalium als QS 1+9=10 zuzüglich dem Signal „1“ der Druckwelle = 11 wird gegenüber Natrium=11 ein Konzentrationsausgleich hergestellt. Die Druckwelle bringt die Basilarmembran im Schneckengang zum Schwingen, auf dem das Corti-Organ für den Hörsinn mit diversen Härchen (Stereovilli) sitzt, die sich gegen die darüber liegende Tektorialmembran (Deckmembran / Membrana tectoria) verbiegen. Der mechanische Reiz wird durch eine Reiztransduktion in einen elektrischen Nervenreiz umgewandelt. Diese Gruppe aus 3 äußeren Reihen von Haarzellen dient der Signalverstärkung. Eine innere Reihe von Haarzellen reicht mit den Härchen nicht an die Deckmembran heran und ist jeweils auf bestimmte Tonhöhen spezialisiert. Der 8. Hirnnerv (Nervus vestibulocochlearis) wird statt Nerv=7 als 8. Hirnnerv mittels der Ziffer „8“ adressiert. Der Nervenstrang zur Schneckenspindel (Modiolus cochleae) wird als Hörnerv (Nervus cochlearis) und gelangt über das Ganglion spirale cohcleae an das Corti-Organ. Der Gleichgewichtsnerv (Nervus vestibularis) zieht zum Gleichgewichtsorgan. Beide Stränge besitzen eine Verbindung. Die Wanderwelle löst aufgrund verschiedener Effekte Resonanzen an unterschiedlichen Haarzellen im Schneckengang aus, was zur Trennschärfe der Töne führt und im Gehirn als Höreindruck ausgewertet wird. Das Signal „1“ liegt an der Membran des ovalen Fensters als 33_1 an. Diese kleine ringförmige Faserstruktur verankert die Fußplatte des Steigbügels und wird nicht als Membran, sondern als Ligamentum ovale (Ligamentum anulare stapedis) bezeichnet. Die folgenden 3 inneren Membranen im Schneckengang und die Membran am runden Fenster zeigen sich nicht als Membran „33“, sondern als Quersumme versteckt mit der Haut=3 und 2 Oberflächen als QS „32“. Dieses ist als Membran „32+1=33“ zu verstehen, wenn das durchgewanderte Signal „1“ ideel addiert wird.
Die letzte „0(Null)“ in der Zeilennummer Z.209 wird für den spiralförmigen Schneckenkanal (Canalis spiralis cochleae) genutzt. Ein gewöhnlicher Knochenkanal „202“ kann aus Z.20_9 und dem Zifferncode nicht begründet werden. Generell wird für die Hörschnecke ähnlich den Zähnen hartes Knochenmaterie eingebaut, so dass es als Calcium=20_20 lesbar ist. Eine doppelte Form „7_2_7“ ist als 1_98_0_98_2 vorhanden. Die Kanalteilung wird äußerlich durch die Halbzeit=12 in der Schneckenspitze umklammert, wenn als Vollzeit=24 gilt. Die Ziffer „8“ ist ein Bezug zum Hörnerv, die sich als „88“ in 2 Folgezeilen schräg versetzt wiederholt. Im Prinzip muss beschrieben werden, dass die Hörschnecke 2,5 Windungen bilden muss, sofern der Elefant diesbezüglich dem Menschen entspricht. Für die Raumteilung in Vorhoftreppe (Scala vestibuli) und Paukentreppe (Scala tympani) werden die beiden Nullen „0_9=seitlich“ in Z.209 und „98_09_8“ verwendet. Die Zahl „7_3“ zeigt als 3. Form den Schneckengang (Ductus cochlearis / Scala media) an, dessen Volumen „05“ die Restgröße „05_99“ bildet. Darin ist der Endast der Arteria labyrinthi „99“ zur Blutversorgung des Innenohrs enthalten. Das Kalium=19 für die Endolymphe im Schneckengang ist im Zeilenlauf stets als #19 vorhanden. Natrium=11 für die Perilymphe wird über die Zeilennummer QS 2+0+9=11 adressiert. Die Flüssigkeiten sind in der Hörschnecke vorhanden, so dass ein Signal“1“ als Wanderwelle durchlaufen kann: Epi.X*^^+Elefant.Z.209#198098205997273.
Die Zeile Z.210 kann das im Schneckengang „0“ empfangene Signal „1“ als vom Corti-Organ biologisch verarbeitet als „64“ adressieren. Dieses Ergebnis wird mit den Quersummen aus der Zeilennummer QS 2+1+0=3 plus dem Ziffercode QS 1+9+7+1+5+4+8+8+1+2+0+6+8+1=61 erreicht. Die 3 Kammern werden durch 2 Membranen abgeteilt, die jeweils vom Signal „1“ erregt werden. Die Summe aus 64 plus 2= 66 ergibt nunmehr 2 Membranen als untere Basilarmembran „33“ und obere Reissner-Membran „33“. Aus der Laufzeitdifferenz zwischen ovalem und rundem Fenster sind beide Membranen bereits als „33_5_33“ ermittelt worden. Außer der Struktur der Ohrschnecke wird somit deren Funktion adressiert. Als Bezug zum 8. Hirnnerv (Nervus vestibulocochlearis) ist die Doppelziffer 88 auch in der Folgezeile schräg versetzt enthalten, so dass die Anzahl der Windungen aus „8812_06_8_1“ mit der Ziffer „1“ als Zählgröße entnommen werden kann. Um die beim Menschen vorhandenen 2,5 Windungen zu erzeugen, muss die Halbzeit=12 gemäß Z. 209 wegen beider Zeilen „88“ als 2 Windungen gelesen werden, so dass sich zusammen mit der folgenden Zahl „6=12/2“ insgesamt 2,5 Windungen in der Hörschnecke ergeben. Die „0 (Null)“ am Zeilenende bildet in der Schneckenspitze (Apex cochlearis) das Schneckenloch (Helicotrema). Die am ovalen Fenster beginnende Vorhoftreppe (Scala vestibuli) wird am Schneckenloch mit der Paukentreppe (Scala tympani) verbunden, die zum runden Fenster zurückführt. Die Spindelachse (Modiolus cochleae) 81_QS 2+0+6=8_81 kann mit „0 (Null)“ das enthaltene Spiralganglion „Ganglion spirale cochleae“ symbolisieren. Für die dreieckige Pyramidenform der Hörschnecke aus Z.210 QS 2+1+0=3 wird die Quersumme QS 1+9+7+1=18 als Pyramidenspitze „18_81_81“ in der Achse 1_1 gelesen: Epi.X*^^+Elefant.Z.210#197154881206810.
Die Zeilennummer Z.211 beschreibt die Hörsinneszellen mit terminalen Hörnervenfasern „11“ zur Signalübertragung. Damit das Corti-Organ im Schneckengang (Scala media) auf der Basilarmembran platziert werden kann, muss die Basilarmembran selbst auf einem dünnen Spiralblatt (Lamina spiralis ossea) „22_0“ fixiert werden, das die Scala vestibuli und die Scala tympani trennt. Auf der Basisalmemban sitzen im Corti-Organ 3 äußere Reihen der Hörsinneszellen besonderer Funktion als „3_555“: Epi.X*^^+Elefant.Z.211#196220497883555. Weiterhin läuft 1 innere Reihe als zum Gehirn sendende Hörsinneszellen seitlich=9 in 1_9_5 und in Z.212 als „1“ sowie QS 2+1+2=5 mit. Zwischen den Hörsinneszellen liegen Stützzellen QS 5+2=7_949_2_949_7. Hierin ergeben die beiden 3er Pakete als Stützung QS 9+4+9=22 zugleich sind es aber 6 Nullstellen zur Zählung der Hörnervenfasern (Stereovilli) QS 7+9+4+9+2+9+4+9+7=“6_0“ . Der Elefant könnte somit wie der Mensch als „312“ pro Reihe 3 Millionen Hörnervenfasern anordnen und in den 3 äußeren Reihen zusammen 12 Mio Stück: Epi.X*^^+Elefant.Z.212#195294929497312.
Als logische Folge muss die Zeilennummer Z.213 nunmehr als QS 2+1=3_3 die Hörnervenfasern durch die Tektorialmembran (Deckmembran / Membrana tectoria) „33“ in der Mitte des Schneckenganges (Scala media) überdecken. Für einen Funktionsunterschied müssen andere Hörnervenfasern die Membran erst bei der Berührung verbiegen, so dass ein Signal „1“ entsteht, um QS 1+9+4+3+7+8= 32 plus „1“= 33 zu bilden. Im Lumen des Corti-Organs sind 2 Bereiche mit unterschiedlicher Spannung von 85 mV =“8_0(Ionenkanal)_5“ aufgrund der Endolymphe und abweichend 40 mV=“40“ genannt. Die kaliumhaltige Endolymphe wird durch eine drüsenähnliche Zellstruktur (Stria vascularis) in der Seitenwand des Schneckenganges produziert. Beim Menschen enthält die Stria vascularis als einziges Epithel im Körper Blutkapillaren. Diese können identifiziert werden, wenn aus der Dopplung 94_94 die QS 9+4+9+4=26 als Blut wie Eisen=26 gebildet wird: Epi.X*^^+Elefant.Z.213#194378051894038. Mit QS 0+3+8=11 ist Kaliumkanal „0“ und Natrium=11 zum Ausgleich enthalten bzw. wird unterhalb der Stria vascularis eine Schicht aus Fibrozyten „11“ ausgebildet, die mit dem Natrium=11 der Perilymphe in der Scala vestubuli oberhalb der Reissner-Membran funktionell in Beziehung stehen. Kalium=19 als QS 1+9 =10 bzw. Wasser QS 1+1+8=10 plus Signal „1“= 11 sind funktionell gegenüber Natrium=11 und Fibrozyten „11“ stets verfügbar. Funktionsstörungen des Kreislaufs führen zur Schwerhörigkeit: Epi.X*^^+Elefant.Z.213#194378051894038.
Abschließend wird in der Zeilennummer Z.214 mit QS 2+1+4=7 der Nerv 7 adressiert. Die wenigen Zeilen dienen nur als Platzhalter, so dass die Nervenzellen selbst erst im Zeilenrücklauf entstehen: Auch hier ergibt sich aus dem Nerv „7“ plus Signal „1“ = 8 als 8. Hirnnerv (Nervus vestibulocochlearis). Das paarige Ohr wird als Form 7 und räumlich=4 allgemein adressiert als 32_0_32 in „743240327. Mit der Hörsumme 32+32=64 wird das biologisch verarbeitete Hörsignal von 63 zur 64, weil die Informationen während des Hörens zwecks Anpassung der Trennschärfe auch vom Gehirn zum Ohr laufen. Diese Funktion wird markiert in 9_346_9, weil erst durch die Mitwirkung des Gehirns der Vorgang verständlich gespiegelt wird als „64_(6 fehlt) 3“. Die Ziffer „6“ fehlt, was die deutsche Außenministerin nicht als Mangel sieht, weil zum Dienstantritt die Zahl „9“ als „Ansichtssache“ mit der Zahl „6“ als Alternative akzeptiert wurde. Wo ist die Zahl „6“? Wird die Zahl 2 ins Ohr=0 geschoben, folgt „7_3_4+2+2_3_7“ bzw. die Gruppe „7_3_44_3_7“ und der Hörnerv „7_3_8_3_7“, so dass 3+3=„6“ beim Hören bereits verarbeitet wurde. Das Hören wird wegen QS 1+9+3+4+6+9+7+4+3+2+4+0+3+2+7=64 mit dem Vorgang am Bixnom-Kreis, d.h. mit der Findung der Zahl Pi als Resonanz in Bezug gesetzt. Außer der Funktion wird als Überleitung vom Schneckengang (Ductus cochlearis) zum Sacculus des Gleichgewichtsorgans der Gang „Ductus reuniens“ „4_32_4_0 (Null)“ adressiert, um die Endolymphe mit Kalium=19 bereitzustellen. Darin ist 4_4 nachfolgend die Gruppe 44_2 aus Sacculus und Utriculus: Epi.X*^^+Elefant.Z.214#193469743240327.
Gleichgewichtsorgan (Vestibularapparat):
Gleichgewichtsnerv: Die Zeilennummer Z.215 zeigt als „5“ eine neue Struktur an und adressiert als QS 2+1+5=8 den 8. Hirnnerv. Der 8. Hirnnerv (Nervus vestibulocochlearis) ist der Hör- und Gleichgewichtsnerv, der die beiden Stränge Hörnerv (Nervus cochlearis) und den Gleichgewichtsnerv (Nervus vestibularis) entlässt. Die Nervenzellen des Ganglion vestibulare sind bipolar. Hierzu lagert das Ganglion je einem Teil in die ebenfalls geteilten Abschnitte Pars superior und Pars inferior des Gleichgewichtsnervs ein. Die beiden Abschnitte des Gleichgewichtsnervs (Nervus vestibularis) werden als Gruppe 44_2 mit dem eingelagerten Ganglion „88“ adressiert: Der obere Abschnitt (Pars superior) „69_88_3_969“ nimmt 1+“3“= 4 Nerven auf (Nervus utricularis, Nervus utriculoampullaris, Nervus ampullaris anterior, Nervus ampullaris lateralis): Epi.X*^^+Elefant.Z.215#192569883969442. Der untere Abschnitt (Pars inferior) „67_67_88_QS 6+7+8+3+5+6+7+2+8+8+4+3=67“ nimmt 2 Nerven auf (Nervus saccularis, Nervus ampullaris posterior): Epi.X*^^+Elefant.Z.216#191678356728843.
Sinnesfelder zur Messung der vertikalen Linearbeschleunigung (Sacculus), der horizontalen Linearbeschleunigung (Utriculus) und der Drehbeschleunigung (3 Bogengänge): Sacculus und Utriculus besitzen eine gekrümmte Längsachse (Striola), so dass analog zu den knöchernen 3 Bogengängen ein Bogen auf Basis der Bixnom-Krümmung „64“ zu finden sein muss. Auf dem Sinnesfeld sitzen Kristalle aus Calcium=20. Diese 20 Einheiten sind durch 4 teilbar, so dass alle Richtungen durch die 4 Bixnom-Gravitationslinsen gleichartig verfügbar sind. Bei einer Beschleunigung wird die Ruhematrix H/B=7*9=63 durch eine 1 Beschleunigungsaktion zu „64“ aktiviert, so dass die 20 Einheiten der Calcium-Kristall eine Matrix von H/B=7*12= „84“ erregen. Diese breite Matrix der Gravitationslinse stimmt mit dem System der „Bixnom-Pyramiden von Sakkara“ überein, so dass der Stromfluss über die Nervenbahn einen geometrischen Hintergrund erhält. Dieses Wunschbild ist zur Orientierung geeignet. Mit dem Calcium von Sacculus und Utriclus lassen sich nur „81“ Zählgrößen finden. Es werden für den Drehimpuls als Gesamtbeschleunigung „84“ auch nur noch 3 Zählgrößen entsprechend den 3 Achsen benötigt. Ein Überschuss entsteht nicht, weil zur Messung einer Drehbeschleunigung keine Calcium-Kristalle benötigt werden.
Sacculus: Die Größe #1_90_7 wird nicht als Kalium, sondern als Winkel=90° benötigt, denn das Sinnesfeld steht senkrecht auf der horizontalen Ebene des Utriculus. Weil in der Folgezeile Z.218 der Utriculus adressiert wird, stellt die Zeile Z.217 als QS 2+1+7=1_0 mit „1“ den Zeilenzähler und mit „0 (Null)“ den Verbindungsgang zwischen Sacculus und Utriculus „Ductus utriculosaccularis“ dar. Mit „50“ wird dazu auf einer kurzen Strecke ein vom Sacculus ausgehender, Gang „Ductus endolymphaticus“ mitgenutzt. Das Ende dieses Ganges endet in Zeile Z.219 gespiegelt „05“ blind als „Saccus endolymphaticus“. Der „Ductus endolymphaticus“ steht in der Hinterfläche des Felsenbeins mit der äußersten Hirnhaut (Dura mater) in Kontakt und reguliert die Zusammensetzung der Endolymphe mit dem Gehalt an Kalium=19. Die Restgröße QS 4+6+3+2+9+1+7+1=33 bildet als häutige Basis eine Membran (Statolithenmembran). Beim Utriculus ist die Membran „33“ direkt ablesbar. Das Sinnesfeld wird von einem Streifen (Striola) als bogenförmige Längsachse markiert. Das Sinnesfeld (Sakularmakula bzw. Utrikularmakula) ist mit Haarzellen (Stereozilien und Kinozilien) besetzt. Die Striola bildet beim Saccusus eine streifenförmige Erhebung und beim Utriculus eine streifenförmige Vertiefung, so dass sich die Haarzellen symmetrisch beim Sacculus von der Striola weg neigen bzw. beim Utriculus zur Striola hin neigen. Der Sacculus bildet die Striola als herausgehobenen Formstreifen „9_171“. Die Bogenform zeigt sich als Bixnom-Krümmung 4_6_3 bei der die Zahl „Pi“ zwischen 63 und 64 eingespielt wird. Gewinner ist die Biologie „64“ mit QS 1+9+0+7+9+5+0=31 plus Membran-Restgröße „33“ = „64“. Der Sacculus wird gemeinsam mit dem Utriculus vollendet, sobald die Calcium-Kristalle=20 im Zeilenlauf verfügbar sind: Epi.X*^^+Elefant.Z.217#190795046329171.
Utriculus: Enthalten ist die Statolithenmembran „33“. Die Striola kann nur als Spalt „9_1_9“ erkannt werden. Für die Krümmung der Striola ist die Ziffer „6“ mit „3_9_6_9_4“ seitlich=9 markiert, wodurch das Spiel 63/64 eröffnet wird. Die Sinneshärchen sind in Bezug auf den 8. Hirnnerv in der Zeilennummer und im Zifferncode als „1_8/1_8“ enthalten. Der Utriculus ist wegen der fehlenden Calcium-Kristalle noch unvollständig. Der Utriculus liegt er an der Basis der 3 Bogengänge, wo nur 5 Öffnungen sichtbar sind, weil 2 Bogengänge mit einem gemeinsamen Kanal (Common canal) beginnen. Ein Ende jedes Bogenganges ist in der Wand des Utriculus zur Bogenampulle aufgeweitet, in der auf der „Cristae ampullares“ Sinneshärchen zur Messung der Drehbeschleunigung sitzen: Epi.X*^^+Elefant.Z.218#189919839694633. Sacculus endolymphaticus „9_05“: Zur Regulierung von Kalium ist die „19“ in Z.219 und als Umklammerung 1„474“9 erkennbar. Um die Calcium-Kristalle auf den Sinneshärchen zu fixieren wird für Sacculus und Utriculus eine gallertartige Masse benötigt. Die als flexibel „6“ und verschieblich als 52_6_25 auf dem Härchen 8_1 adressiert wird. Mit der Zahl „90“ kann auch der Utriculus in der horizontalen Gegenposition den Winkel=90° ausbilden: Epi.X*^^+Elefant.Z.219#189052625814749.
Statolithen: In der Zeile Z.220 ist Calcium=20 enthalten, das mit den Haarzellen 1_88_1 in Bezug zu den Nervenzellen „88“ steht. Die Haarzellen tragen Büschel aus je einer langen Kinozilie 9_QS 5+6=11_9 und 74 (real 70- 80) kurzen Stereovilli markiert mit „9_74_0_9“. In der Restgröße wird 32 markiert 9_32_9. Wird wie beim Ohr ein Ereignis wie eine Linearbeschleunigung „1“ ergänzt zu 32+1=33 wird eine Membran „33“ adressiert, auf der sich Calciumcarbonat-Kristalle (Statolithen / Otholithen) „20“ befinden. Durch deren Massenträgheit werden die Haarzellen erregt: Mit der QS 1+8+8+1+9+3+2+9+5+6+9+7+4+0+9=81 wird das gewünschte Beschleunigungssymbol „84“ um die 3 Achsen der Drehbeschleunigung in den Bogenbögen nur mit der Linearbeschleunigung noch verfehlt („81 < 84“): Epi.X*^^+Elefant.Z.220#188193295697409.
Mit Zeile Z.221 als QS 2+2+1=5=Struktur können die 3 Ampullen (Ampulla ossea) an den 3 Bogengängen (Canales semicirculares ossei) nicht als Volumen „0“ gefunden werden, sondern nur als Struktur QS 2+3=5. Hier ist 2 die äußere Knochenhöhle und 3 der innere mit Endolymphe gefüllte Hautschlauch. Die Ampullen enthalten die Wahrnehmungsorgane (Cristae ampullares ) mit spezialisierten Haarzellen. Tierartlich abweichend können diese großvolumigen Aufweitungen als Ampullen fehlen. Der Canalis semicircularis anterior steht quer zur Körperlängsachse, der Canalis semicircularis posterior liegt (sagittal) in der Körperlängsachse und der Canalis semicircularis lateralis ist horizontal ausgerichtet. Der vordere und hintere Bogengang beginnen zwar mit einem gemeinsamen Kanal, aber am anderen Ende der Bögen liegen die Ampullen des vorderen und des horizontalen Bogens zusammen „23_23“. Die Ampulle des hinteren Bogenganges liegt seitlich „2323213“, wobei sich „232_QS 3+2+1+3=9=seitlich“ zählt: Epi.X*^^+Elefant.Z.221#187341742323213. Mit der Zeile Z.222 können die 3 knöchernen Bogengänge bereits als Knochen 22 gezählt werden. Der Bixnom-Bogen ist als „64“ enthalten. Der gemeinsame Gang von 2 Bögen ist als „6060“ enthalten. Als Zählgröße „1“ sind insgesamt 3 Knochenbögen vorhanden „1_0_3_6“: Epi.X*^^+Elefant.Z.222#186497860601036.
Mit der Zeile Z.223 werden als QS 2+2+3=7 die Sinnesfelder in den 3 Bogengangampullen avisiert. In die Ampulle ragt eine quer stehende Bindegewebsleiste (Cristae ampullares), die als herausgehobene Form 7_99 adressiert ist. Auf der Oberfläche sitzen Stützzellen 47_QS 3+2=5 _47, wobei die dazwischen liegenden Stützzellen eine stabile Struktur-5 bilden. Auf der Cristae ampullares sitzt eine gallertartige Kuppel (Cupula) „66=flexibel“, die einerseits die Härchen (Zilien) enthält und andererseits beim Menschen im Dach der Ampulle befestigt ist. Nach anderen Quellen ist kein Kontakt zum Dach der Ampulle erkennbar. Es werden auch Calcium-Kristalle auf der Cupula dargestellt oder schweben außen als kleine Partikel herum. Nach anderen Quellen sind die Kristalle nicht in der Ampulle entstanden, sondern vom Saccuslus oder Utriculus insbesondere durch altersbedingten Strukturverfall des Kristalls in einen Bogengang gerutscht, wodurch der krankhafte Lagerungsschwindel entsteht. Die volle Absperrung des Ampullenquerschnitts zeigt sich, weil die Restgröße QS 1+8+5+6+6+1+5=32_47_32_47 eine Symmetrie ausbildet, wobei ein Bixnom-Kreis 64 =32+32 zählbar wird. Die Erregung kann sich auf maximal 47+47=94 Elemente in der Gravitationslinse steigern, wobei dieses der natürlichen Grenze von Plutonium=94 entspricht: Epi.X*^^+Elefant.Z.223#185661547324799.
Mit der Zeile Z.224 und der QS 2+2+4=8 kann die Erregung über den 8. Hirnnerv signalisiert werden. Die Sinneshärchen „11“ sind in der Cupula eingebettet 3_1_3. Günstiger als erwartet wird die Gesamtbeschleunigung als „84_84“ dargestellt, wodurch die beidseitige Verformung der Zilien bei der Drehbeschleunigung adressiert wird. Die Cristae ampullares ist mit 7000 Sinneszellen besetzt, von denen 70.. lesbar sind. Die Zelle trägt an der Spitze 1 langes Kinozilium (Flimmerepithel) auf dem ca. 80 kürzere Stereozilien sitzen „83_313“. Die Calcium-Kristalle sind zur Messung der Drehbeschleunigung nicht gesondert erschienen: Epi.X*^^+Elefant.Z.224#184832701131384. Für den 90°-Achsenwinkel zwischen den Bögen wird die Zeitdifferenz zwischen der Ampulle als Messeinrichtung und der Drehbeschleunigung Z.221-Z.224 gelesen mit Delta „#250_90_4119182875“. Darin sind für die Bogengänge als paarige Struktur der beiden Ohren „2_5“ mit 75/25 = 3 jeweils 3 Drehachsen unter 90° sowie als weitere Strukturen „QS 4+1=5“ die lotrechte Ebene des Sacculus „191“ und die horizontale Ebene des Utriculus „828“ enthalten. Die Folgezeile Zeile Z.225 ist für eine andere Struktur reserviert.
15.) Hinterhauptbein (Os occipitale): Beim Zeilenlauf #1... ist das Hinterhauptbein grundsätzlich ein unpaariger Knochen. Die Zeile Epi.Y*^^+Elefant.Z.345 enthält eine notwendige Gruppe 44 aus Zählgrößen 1_1, die aus beiden Episoden in einer horizontalen und einer vertikalen Strecke vor dem Halsgelenk zusammentreffen.
15.1) Basisstrecke (Pars basalis): In der Leitepisode liegt die Zählgröße 11 am Anfang der Dreiecksstruktur vor: Epi.X*^^+Elefant.Z.346#119660477033035. Abschließend bildet sich in der Serie der Knochen „115“ am Halsgelenk. Die Arterie „Arteria carotis interna“ „9“ durchzieht den paarigen Karotiskanal (Canalis caroticus) zusammen mit Nervenfasern „7“, der durch paarige Knochenlöcher sichtbar ist. Die Öffnung wird über 3 Zeilen adressiert. Das Loch wird mit der Ziffer räumlich=4 von 040 zu 40 gebildet, wodurch das Loch schräg unter 40° oval gestreckt wird. Die Arterie=9=seitlich wird mit 9_2_9 genutzt, um den Kanal paarig auszuführen. In der mittleren Zeile wird die Arterie 9 mit dem Blut Eisen=26 gekoppelt: Epi.X*^^+Elefant.Z.348#118972773142040;
Epi.X*^^+Elefant.Z.349#118631876943926; Epi.X*^^+Elefant.Z.350#118292928724086. Im Zeilenlauf folgt in der schrägen Achse der Öffnung am Karotiskanal die Knochenöffnung „Foramen jugulare“. Entsprechend der Bezeichnung „Jochbeinvenenloch“ sind Venen 0_88_0 und Nerven 7 im Loch vorhanden: Epi.X*^^+Elefant.Z.352#117620809810881. Das Loch liegt schräg, so dass eine weitere Zeile für den Winkel benötigt wird, die die Form 7620 zu 7606 oval verändert. Die Struktur 55° kann als Winkel gelesen werden. Als Struktur 55 werden nachfolgend in der Querachse 606 zwischen den Löchern paarige knöcherne Höcker gebildet: Epi.X*^^+Elefant.Z.353#117287606383655. Die beiden Höcker werden jeweils in einer Zeile „166“ und symmetrisch 3_11_3 und kreisrund=64 adressiert. In der 3. Zeile werden die Höcker als Knochen „22“ emporgehoben „99“: Epi.X*^^+Elefant.Z.354#116956285461667; Epi.X*^^+Elefant.Z.355#116626831136423; Epi.X*^^+Elefant.Z.356#116299227678174. Die Zähne beanspruchen im Zeilenlauf von Z.357 bis Z.360 die Zählgröße „115“ in der Lage unpassend bis zum Schädelende. Die Zähne werden bei einem Revolvergebiss erst über die Lebenszeit entwickelt. Als Doppelnutzung kann eine kurze Knochenstrecke hinter den Höckern aufgezogen werden, um das große Loch „Foramen magnum“ zu erreichen. Das „Foramen magnum“ wäre als 505 erbärmlich klein, so dass es als 350_51_053 größer erscheint. Mit „5_1“ liegt die Besonderheit vor, dass es kein vertikales Loch existiert, weil es mit dem Scann horizontal durchlaufen wird. Die Gelenkflächen sitzen nicht wie beim Menschen seitlich vom Loch, sondern erst nachfolgend entsteht ein paariger Gelenkaufsatz mit Gelenkflächen (Condylus occipitalis) zur Artikulation mit dem 1. Halswirbel (Atlas): Epi.X*^^+Elefant.Z.361#114688435051053. Es bildet sich als Form QS 1+6=7 (3-fach) ein U-Profil, in das mittig das Foramen magnum flankiert von den beiden Gelenkaufsätzen mündet. Die Ziffer „6“ ist markiert und wird nunmehr mit seitlich=9 als 96_96 genutzt, um die Seitenfläche des Condylus occipitalis in der U-Form zu adressieren: Epi.X*^^+Elefant.Z.362#114371616169696. Der Gelenkaufsatz wird über einige Zeilen in die Länge gezogen, von denen auch der Backenzahn Molar M6 eine Zeile belegt. Die abgerundete Gelenkfläche entsteht als Kreis „9_64_9_444“ und liegt abgerundet „606“ über 2 Zeilen als Knochen „22“ direkt vor dem 1. Halswirbel (Atlas). Der fehlende Gelenkknorpel 33 wird in 11_1 als QS 1+8+9+8+7=33 zusammengezählt„1“: Epi.X*^^+Elefant.Z.361#112201964914445 und Epi.X*^^+Elefant.Z.361#111898716360622.
15.2) Hinterhauptschale (Squama occipitalis): In der Parallelepisode wird mit 13_13 eine Abgrenzungskante „Linea nuchalis“ zum paarigen Scheitelbein (Os parietale) gebildet. Im oberen Scheitelpunkt wird mittig eine Knochenloch „0_7“ gebildet. Mit der Gruppe 44 werden beide Episoden aktiviert: Epi.Y*^^+Elefant.Z.345#121348740713144. Das Hinterhauptbein ist zwar unpaarig, trotzdem enthält die Hinterhauptschale (Squama occipitalis) eine Teilung durch Besonderheiten in der lotrechten Mittelachse. Diese breite Mittelzone kann bogenförmig überspannt werden, weil in Zeilenlauf #12_0 die Zählgrößen #11 noch nicht beginnen. Mit rechts=2 wird etwas außermittig ein kleines Knochenloch 2_030_2 angelegt und mit einer dünnen Knochenleiste „10“ als unnütze Beschäftigung überwölbt. Weil die Zahl 26 enthalten ist, könnte eine Blutgefäß durchgeführt werden: Epi.Y*^^+Elefant.Z.348#120302630879410. Als seitliche Form „79“ soll eine paarige 2_4_200 Grube angelegt werden. Diese wird im Zeilenlauf durchgezogen, wobei die beginnende Zählgröße #11 eine mittige Grubenteilung bewirkt. Dieses wird nachfolgend durch Doppelgruben „200_200“ und eine Mittelwand „Crista occipitalis externa“ „2222“ noch präziser adressiert: Epi.Y*^^+Elefant.Z.349#119957924200673. Der knöcherne Grubenboden fehlt, so dass in den beiden großen, längsovalen Gruben lagenweise feinste Knochenstrukturen „55555“ erkennbar werden, die ggf. als Kühlrippen nutzbar sind: Epi.Y*^^+Elefant.Z.352#118935555528508; Epi.Y*^^+Elefant.Z.356#117599200972008 Epi.Y*^^+Elefant.Z.358#116942222195628. An der Hinterhauptschale (Squama occipitalis) setzt als sichtbare Kante ein Knochenteil (Pars laterale) an, um die breite Hinterhauptschale als Übergang zum Nacken zu verengen. Die beiden Knochenteile bilden eine Gruppe 44 mit der Kante „1“ in 6_1_6, wobei die Squama occipitalis mit der Schalenform als Kurve=64 enthalten ist. Die Kante wird dann paarig angelegt 43_QS1+8=9=seitlich=Pars laterale_43. Die Kante ist mit einem Neigungswinkel 43° zu beschreiben: Epi.Y*^^+Elefant.Z.359#1166164778441080 und Epi.Y*^^+Elefant.Z.360#11629254318343. Der Anschluss zur Leitepisode ist damit formal zutreffend erreicht, weil das Foramen magnum in Zeile 361 gebildet wird. Erkennbar setzt ein abweichender Winkel an, um den Übergang in der Gesamthöhe zu vollenden. Die Folgezeilen sind von den Backenzähnen (Molare M4 bis M6) besetzt, die erst im höheren Lebensalter wachsen. Als Doppelnutzung können die Zahn-Zeilen die Anpassung realisieren. Eine räumliche Form 37_444_73 als Kurve=64 und paarige Kante unter 41° sind enthalten. Der Knochen zählt sich über die Zeilennummer bis zur Form 7 als QS 3+6+8+1+1+3=22: Epi.Y*^^+Elefant.Z.368#113764444418573.
Zähne
Die Leitepisode Epi.X*^^+Elefant liefert mit #115 die Zahnformel eines Ur-Elefanten, indem außer den 6 Zeilen für die paarigen Backenzähne (Z.324, Z.357, Z.358, Z.359 Z.360 Z.367) jeweils eine Schneidezahn-Zeile für 2 Zähne seitlich im Oberkiefer Z.82 „2_115“ und für 2 Zähne mittig im Unterkiefer Z.323 „11_2_115“ vorliegen. In der Stammesgeschichte sind die unteren Scheidezähne entfallen, so dass sich der Kiefer verkürzte. Dieses lässt sich vorteilhaft einrichten, indem sich der Schneidezahn des Unterkiefers als Backenzahn eingliedert und die letzte abgesonderte Zeilennummer somit entfallen kann. Die zahnfreie Lücke zwischen Schneidezähnen und Backenzähnen der Pflanzenfresser („Wiederkäuerlücke“) wird als Diastema bezeichnet.
Der heutige Elefant besitzt für die Backenzähne ein Revolvergebiss, dessen Zähne sich aus der laufenden Zeilenfolge beider Episoden fortlaufend zusammensetzen. Der permanente Stoßzahn entsteht in der Episode Epi.Y*^^+Elefant. Daher wird der Milchstoßzahn in der Episode Epi.X*^^+Elefant adressiert. Der Zahn ist als kleiner Milchzahn bei der Geburt vorhanden. Die Zeit als QS 8+8+4+2+1+1=24, Rest als Zahn 5001. Mit oben=9 sind die oberen beiden Schneidezähne adressiert QS 5+0+4=9_9. Die 365 Tage bis zum Zahnwechsel sind kunstvoll versteckt, indem die Doppelziffern 88 und 11 in der Quersumme 99=oben entnommen werden, verbleiben QS 4+9=13 und QS 4+2=6 und 5 und somit Zahn „1“ bis 365 Tage: Milchstoßzahn: Epi.X*^^+Elefant.Z.82#504908842115001.
„Afrifanten“ und „Indifanten“ müssen bei der Zahnbildung die Parallelepisode Epi.Y*^^+Elefant beachten, weil das Zählsymbol „#115“ ein schwächeres Signal ist, als ein Struktur-Zahn „155“, der zum Stoßzahn wird. Die Zeit ist enthalten, indem das Jahr (365 Tage) alternativ auch in der Zerlegung 65_3 erkannt wird. Weiterhin wird mit Zeit=60 sehr genau gezählt, hierbei sind es genau 348 Tage bis zum Zahnersatz durch einen bleibenden Stoßzahn beim Elefantenkalb (lt. Quellen 1 Jahr): Epi.Y*^^+Elefant.Z.1#418653155460348. Es existieren auch Elefanten, die ohne Stoßzahn als „Makna“ harmlos wirken, am Körperbau jedoch als Bullen erkennbar sind. Hierfür kann der Stoßzahn als Calcium=20 als Form 7 sowohl über das Hormon 33 und männlich=2 geklammert werden, so dass der Stoßzahn mit 7_0 (Null) unnötig ist. Ist ein Stoßzahn vorhanden, kann alternativ mit Nerv=7 und den Ziffern links=1 oder rechts=2 auch einer der beiden Stoßzähne als Arbeitsinstrument bevorzugt werden „Master Tusk“: Epi.Y*^^+Elefant.Z.9#465170172733720. Ein Bulle mit Stoßzahn ist ein „Tusker“. Weibliche „Afrifanten“ können aufgrund eines Gendefektes ohne Stoßzähne geboren werden und sich aufgrund uninteressierter Wilderer relativ häufig vererben. Männchen (Bullen) sind mit diesem Gendefekt nicht lebensfähig.
Die Zahnwurzel wird von einer Zahnwurzel-Höhle (Pulpahöhle) räumlich=4 „044440“ gebildet. Mit Blut Eisen=26 und Nerv=7 werden Gefäße erwähnt: Epi.Y*^^+Elefant.Z.26#161020444407826. Der Elefant wird mit sehr kleinen Stoßzähnen geboren, so dass sich diese gemäß Vorgabe des Zeitregimes von 348 Tagen nunmehr als Struktur 5_ 348_5 und unverkennbar als permanenter Stoßzahn „1_115555_QS8+3=11“ auswachsen: Epi.Y*^^+Elefant.Z.46#910115555348583. Vom Stoßzahn liegen 1/3 der Länge im Zahnfach des Schädels. Zahnfach 0_2222_0: Das Knochenmaterial wird allgemein als 22 adressiert, sofern nicht Calcium=20 direkt verwendet wird. Um das Elfenbein zu adressieren, das viel Kalciumphosphat enthält, ist Phosphor=15 zur Unterscheidung nützlich, so dass der Zahn spiegelbildlich mit „51“ im Zahnfach sitzt: Epi.Y*^^+Elefant.Z.52#805102222039131.
Der Elefant verwendet mathematisch nur 1 Backenzahn je Seite im Ober- und Unterkiefer an einer Platzhalterstelle, die als Revolvergebiss mit wechselnden Zähnen beschickt wird. Zur Organisation dieser Platzhalterstelle wird eine Zahngruppe 11_44 eingerichtet. Die Zeit=365 Tage ist undeutlich als 3_65 enthalten: Epi.Y*^^+Elefant.Z.351#119274403265056. An die Platzhalterstelle werden einerseits die Backenzähne M1 bis M6 durchgezogen und andererseits im Detail deren einzelne Lamellen „55555“. Zufällig ergab ein Foto der Zahnoberfläche beim „Indifanten“ 11 Lamellen und beim „Afrifanten“ 8 Lamellen. Beide Varianten sind am linken bzw. rechten Zahlenrand adressiert: Epi.Y*^^+Elefant.Z.352#118935555528508. Das weitere Prozedere ist im Zeilenvergleich beider Episoden erkennbar, indem sich die Zahn-Zählgrößen „115“ der Parallelepisode exakt an die Leitposition anschließen. Diese lange Kette symbolisiert den Durchlauf der „11“ Lamellen jedes Zahnes, weil diese am linken Zahlenrand durchlaufen. In der Episode Epi.X*^^+Elefant werden die Molare M1, M2 und M3 mit jeweils 2 Zeilen adressiert: Erste Zeile Zahnaufbau und zweite Zeile Zahnabbau, sind im Durchschnitt 1 Zahn. Im Zeilenlauf folgen dann in der Parallelepisode Epi.Y*^^+Elefant die Molare M4 und M5 mit jeweils 2 Zeilen. Für den Molar M6 werden die 2 Zeilen X/Y gemischt aus beiden Episode entnommen.
M1: Epi.X*^^+Elefant.Z.323#128181192115883; Epi.X*^^+Elefant.Z.324#127785571152562;
Zeit=12 enthalten: Alter lt. Lit.: 0 - 2 Jahre.
M2: Epi.X*^^+Elefant.Z.357#115973459533418; Epi.X*^^+Elefant.Z.358#115649511322430;
Zeit=24 enthalten: Alter lt. Lit.: 2 - 5 Jahre
M3: Epi.X*^^+Elefant.Z.359#115327367836853; Epi.X*^^+Elefant.Z.360#115007014037306;
Aus der Symmetrie 7_36_7_8_36_8 folgt Zeit= Quersumme 7+3+6+7+8+3+6+8=48: Alter lt. Lit.: 3 - 11 Jahre
M4: Epi.Y*^^+Elefant.Z.361#115970403174612; Epi.Y*^^+Elefant.Z.362#115650042944848;
Zeit=12 und Zeit=48_48: Alter lt. Lit. Durchbruch: 10-14 Jahre; Funktion Alter 6-24 Jahre; alternativ andere Info: Nach 26 Jahren letztes Bruchstück M4
M5: Epi.Y*^^+Elefant.Z.363#115331447785220; Epi.Y*^^+Elefant.Z.364#115014603148447;
Zeit=60 und Zeit=48: Alter lt. Lit.: Durchbruch 26-27 Jahre; Funktion Alter 18-52 Jahre; alternativ andere Info: Nach 26 Jahren M5 voll in Funktion. Nach 36 Jahren Abbau M5
M6: Epi.X*^^+Elefant.Z.367#112813419764115; Epi.Y*^^+Elefant.Z.369#113456139691151.
Ohne Zeit: Alter lt. Lit.: Durchbruch 34-37 Jahre; Funktion Alter 30+ ; alternativ andere Info: Nach 26 Jahren Zahnfach (Alveole) für M6 entsteht. Nach 36 Jahren Aufbau M6. Nach 60 Jahren verbleibt vom M6 nur noch ein hinteres Teilstück. Als Zwischenzeile im letzten Molar M6 wird die eingangs gebildete Zahngruppe nochmals mit „44444“ adressiert, womit der 5. Zahnwechsel als Schlussunkt gesetzt wird: Epi.Y*^^+Elefant.Z.368#113764444418573. Die Quersumme 1+8+5+7+3=24 ist eine Zeit, so das man zumindest 73 Jahre als Lebensalter rechts außen zutreffend abliest.
Elefantenauge
In der Parallelepisode ist die Haut 33 vorhanden, in der Leitepisode fehlt diese. Die Ziffer „2“ ist in Bezug auf den 2. Hirnnerv „2“ (Sehnerv) von Bedeutung: Epi.Y*^^+Elefant.Z.90.#46517017273372. Die Parallelepisode ist mit zu betrachten, weil sich hinter dem Auge eine Schläfendrüse (Temporaldrüse) befindet, die für den Elefantenbullen während der „Musth“ von Bedeutung ist. Die Drüse kann somit ein „unabsichtliches“ Nebenprodukt sein, wenn die Parallelepisode eigentlich nur die notwendige Augenbildung unterstützen sollte.
Augenlider (Palpebra): Im Gegensatz zum Menschen mit Oberlid und Unterlid besitzen Haussäugetiere zusätzlich eine Nickhaut (Palpebra tertia) als 3. Augenlid im nasenseitigen Augenwinkel, die die Hornhaut schützt. Beim Menschen ist diese nur rudimentär vorhanden. Der Elefant besitzt eine Nickhaut. Die Tränendrüsen sitzen in der Nickhaut (Glandula palpebrae tertiae superficialis und profundus), so dass sich der Tränenapparat vom Menschen unterscheidet.
Das Auge wird beim 1. Körperdurchlauf nur in wenigen Zeilen erkennbar. Für die Augenlider fehlt die Hautbildung als „33“. Stattdessen ergibt die Zahl „44“ einen räumlichen Bezug zur „Felderhaut (meshed skin)“. Furchen in der Oberhaut grenzen rhombische Felder (Areolae cutaneae) ab. Aus den Furchen wachsen die Haare und auf den erhabenen Flächen münden Schweißdrüsen. Die Haut „3_74_3“ wird ergänzend durch die Form=7 und räumlich=4 adressiert, und zwar als Ober – und Unterlid 44_44 und paarig „2“ für beide Augen. Der Dickhäuter „5“ versteckt in der Gruppe 44_44 als beidseitige Quersumme 4+4...(ohne 5...)+1+8+8+4+4=33 zufällig die fehlende Haut 33: Epi.X*^^+Elefant.Z.93.#445188441434732. Augenwimpern 1_1, und weil keine Augenbraue erkennbar ist, ist das Wimpernhaar 1 am Oberlid (oben=9) extrem lang: Epi.X*^^+Elefant.Z.97.#426830155190001. Die Augenlider 44_44 müssen nunmehr eine Dopplung 47_47 erhalten, weil an der Hinterseite die Bindehaut (Konjunktiva) befestigt ist. Die Bindehaut bildet im Bindehautsack eine Falte (Fornix conjunctivae inferior) 4_22_4 und legt sich dann schützend auf den Augapfel (Bulbus oculi). Die Bindehaut „3“ liegt dann innenseitig auf dem Augenlid 44_3: Epi.X*^^+Elefant.Z.98.#422474745443164. Um die Nickhaut (Palpebra tertia) als 3. Augenlid zu finden, kann die Nickhaut vergleichsweise zum Hund geometrisch als ein doppelter Bindehautsack dargestellt werden, so dass mittig eine extra Hautfalte entsteht. Zwei Falten 74_74 liegen vor, so dass die 3. Falte für die Nickhaut als „74“ der Parallelepisode entnommen wird. Am Muskel „5“ sitzt als „19“ noch eine seitliche Sehne. Die Zahl „7_19_7“ ist doppelt vorhanden, so dass beim Elefanten zwei Muskeln vorhanden sind, um die Nickhaut zu bewegen: Epi.X*^^+Elefant.Z.98.#427197097408519. Die Bindehaut bedeckt die weiße Lederhaut, so dass diese räumlich 3_4_3 neben der Pupille 505 angezeigt wird: Epi.X*^^+Elefant.Z.100.#414025250534301. Diese Zeile lag als Nr.1 und Nr.10 bereits vor, mit 252 ist es auch eine Augenstruktur über den Hirnnerv 2 (Sehnerv).
Hornhaut (Cornea): Die Hornhaut ist zumindest am Beginn der Wölbung nicht vorhanden. Aus der Parallelepisode wird die Wölbung 444_700_5 und die gewölbte Hornhaut 2_333 entnommen: Epi.Y*^^+Elefant.Z.102.#410444270059165 und Epi.Y*^^+Elefant.Z.103.#406459374233348.
Hornhaut und Iris bilden die vordere Augenkammer. Durch den Kammerwinkel (Angulus iridocornealis) fließt das Kammerwasser nach außen durch den Schlemm-Kanal 101 ab. Dieser wurde früher den Venen 8 zugerechnet und aktuell dem Lymphsystem 11_11. Für beide Varianten ist eine Episode vorhanden: Epi.X*^^+Elefant.Z.104.#398101202436828 und Epi.Y*^^+Elefant.Z.104.#402551111019565. Die Hornhaut 33 wird nunmehr am Kammerwinkel sichtbar: Epi.X*^^+Elefant.Z.108.#383356713457686 Die enthaltene Zahl 38 verschiebt sich in den Folgenzeile als Winkel. Für den oberen Kammerwinkel des Auges ist eine Spiegelung „83“ vorhanden: Epi.X*^^+Elefant.Z.109.#379839679389267 und Epi.X*^^+Elefant.Z.110.#376386591394819.
Regenbogenhaut (Iris): Die Iris ist eine durch Pigmente gefärbte Blende, deren innerer Rand die Pupille (Sehloch) 202 bildet. Die die Iris kann blau-grau, gold, grün, gelb gefärbt sein. Die Iris liegt als Margo pupillaris auf der Vorderfläche der Linse. Die Pupille wird vom radiär verlaufenden Musculus dilatator pupillae mit seitlich=9 als 99_5 erweitert, der am befestigten Rand der Iris (Margo ciliaris iridis) liegt: Epi.X*^^+Elefant.Z.111.#372995721202073. In der Parallelepisode ist die Haut=33 und der zirkulär verlaufende Musculus sphincter pupillae 5_00 am freien Pupillenrand (Margo pupillaris iridis) adressiert, der die Pupille verengt: Epi.Y*^^+Elefant.Z.111.#377165004919233.
Augenlinse (Lens oculi): Die Linse „505“ bildet eine glasklare, bikonvexe Struktur, die mittels der Zonulafasern (Fibrae zonulares) am Ziliarkörper (Corpus ciliare) befestigt ist. Beim Elefanten ist die darauf sitzende Pupille kreisrund. Die Haut 33 ist als Linsenkapsel 3_66_3 dargestellt, so dass noch zwei Hautschichten folgen. Linsenkapsel (Capsula lentis) 3_66_3: Epi.X*^^+Elefant.Z.113.#366394027021505. Die Linsenrinde (Cortex lentis) 33 besteht aus Linsenfasernzellen 1_00, die aus der Parallelepisode entnommen werden: Epi.X*^^+Elefant.Z.114.#363180044328334 und Epi.Y*^^+Elefant.Z.114.#367239610052937. Der Linsenkern (Nucleus lentis) 33 ist der Kernbereich der Augenlinse, der mit zunehmendem Alter verhärtet und sich vergrößert, dagegen nimmt die Rinde ab. Als Krankheitsbild liegt altersbedingt der Kernstar (Cataracta nuclearis) vor. Der Kern 404 wird insbesondere in der Parallelepisode ersichtlich, und in der Leitepisode die Zeit=60: Epi.X*^^+Elefant.Z.115.#360021956986349 und Epi.Y*^^+Elefant.Z.115.#364046222139433.
Augenmuskeln: Die inneren Augenmuskeln sind in der Art „5“ unauffällig, vergleichsweise werden die 8 äußeren Muskeln (Veterinärmedizin) über die Augenstrecke als „55“ in der lexikonalen Reihenfolge durchgezählt. Es werden 8 Muskeln lexikalisch erwähnt, aber nur 7 Muskeln bezeichnet. Wie beim Menschen liegen zunächst 4 gerade und 2 schräge Muskeln vor. Beim Haussäugetier ummantelt der Musculus retractor bulbi den Sehnerv und teilt sich bis zum Augapfel in 4 Zacken auf. Die Anzahl der Muskeln wird in der Parallelepisode gezählt, sobald der Muskel 55 mit der Augenhaut 33 adressiert ist:
Musculus rectus dorsalis: Epi.Y*^^+Elefant.Z.121.#34599434335566; Musculus rectus lateralis: Epi.Y*^^+Elefant.Z.126.#332264409095514; Musculus rectus medialis: Epi.Y*^^+Elefant.Z.132.#317161481409355; Musculus rectus ventralis: Epi.Y*^^+Elefant.Z.134.#312427727955484; Musculus obliquus ventralis: Epi.Y*^^+Elefant.Z.137.#305586244861568; Musculus obliquus dorsalis: Epi.Y*^^+Elefant.Z.158.#264970351557182; Musculus retractor bulbi: Epi.Y*^^+Elefant.Z.164.# 25527631430509; 8. Muskel?: Epi.Y*^^+Elefant.Z.183.#228772216098551. Der 8. äußere Augenmuskel reicht bis zum Sehnerv.
Ziliarkörper: Der Ziliarkörper 50_500_1 ist ein ringförmiger Teil der mittleren Augenhaut, über den die Linse über Zonulafasern „111“ am Ziliarkörper aufgehängt ist. Der Ziliarkörper sorgt für die Anpassung (Akkomodation) der Linse und ist an der Produktion des Kammerwassers beteiligt. Im Ziliarkörper ist der Musculus ciliaris „500_1“ eingelagert: Epi.X*^^+Elefant.Z.118.#350868856385001 und Epi.X*^^+Elefant.Z.120.#345021042111917.
Glaskörper (Corpus vitreum): Der Glaskörper 33_1 füllt den Bereich zwischen Linsenkapsel und Netzhaut durch eine gallertartige, lichtdurchlässige Struktur aus. In einem feinen Fasernetz (Stroma vitreum) „44_1“ ist dazu eine wässrige Substanz (Humor vitreus) „00“ einlagert. Die Gegenform zur Augenkapsel bildet am Glaskörper eine zentrale Delle (Fossa hyaloidea) „202“: Epi.X*^^+Elefant.Z.125.# 331220200427441. Durch den Glaskörper zieht der Kanal „Canalis hyaloideus“ 707 als Rudiment der Arteria hyaloidea „9“. Die Arterie ist embryonal bedingt und muss sich zurückbilden, um das Sehvermögen nicht zu beeinträchtigen. Die Zeit=24 ist enthalten und zwischen Arterie 9 und deren Form 7 gesetzt. Mit der Kanalform 707 als „Null“ kann sich die innere Arterie zurückbilden: Epi.X*^^+Elefant.Z.135.#306685370766149; Epi.X*^^+Elefant.Z.139.#29785989247072; Epi.X*^^+Elefant.Z.142.#291567077841057.
In der embryonalen Phase ist im Unterschied dazu die Arterie 9 in der Kanalform als „7_9_7“ enthalten, wenn die Geburt zur Strukturbildung 555 erklärt wird. Mit „909“ wird das Auge „0“ embryonal arteriell versorgt: Epi.X*^^+Elefant.Z.148.# 279746790901555.
Im Weiteren bilden sich Stäbchen und die Zapfen für das Sehvermögen auf der Netzhaut. Wie bei den Haussäugetieren sind zum Farbsehen nur 2 Zapfentypen vorhanden. Es wird von grün und rot empfindlichen Zapfen berichtet, so dass diese Farben nicht unterschieden werden können. Bei wenig Licht kann blaues und violettes Licht besser gesehen werden. Über gemessene Wellenlänge liegen keine Informationen vor. Aus der Netzhaut 44_3_55_3 können vorstellbare Wellenlängen von 535 nm und 457 nm entnommen werden. Davon ist Grün „535 nm“ passend. Epi.X*^^+Elefant.Z.169.# 24498535534574.
Auf der folgenden Aderhaut sitzt beim Elefanten eine das Licht reflektierende Schicht (Tapetum lucidum). Das Licht gelangt nochmals auf die Netzhaut, so dass sich die die Sehleistung verstärkt. Die Schicht ist auch bei Fleischfressern, Pferden und Wiederkäuern als eine charakteristische dreieckige bis halbmondförmige Form vorhanden. Bei Pferd und Wiederkäuer sind abweichend von Hund und Katze Faserbündel eingelagert, so dass das Auge durch die Lichtbrechung bläulich schimmert. Weil sich auf der Haut zwei unterschiedliche Areale bilden, wird das Tapetum lucidum „33_333“ erkennbar: Epi.X*^^+Elefant.Z.169.# 24498535534574. Die enthaltenen Faserbündel (Tapetum fibrosum) 1111 werden zeitgleich von der Parallelepisode als Extra 7_8_7 geliefert: Epi.Y*^^+Elefant.Z.176.#237871111057016. Gefäßreiche 3_9_3 Aderhaut 33: Epi.X*^^+Elefant.Z.181.#228743232339393. Der Sehnerv führt in seinem Verlauf zur Versorgung der Netzhaut die Blutgefäße mit, und zwar die Arteria centralis retinae und die Vena centralis retinae 101_101: Epi.X*^^+Elefant.Z.197.#21016510179406. Lederhaut 33: Epi.X*^^+Elefant.Z.203.#203953325386355. Sehnerv (Nervus opticus, 2. Hirnnerv) „202“: Epi.X*^^+Elefant.Z.203.#202953554183481.
Schläfendrüse (Temporaldrüse) und Musth
Lymphknoten werden als Kette mit der Doppelziffer „11“ gezählt. In der Kombination mit „88“ als Drüsensekret kann sich hinten dem Auge die Schläfendrüse ausbilden. Die Haut „33“ ist doppeldeutig und wirkt auch als männliches Hormon Testosteron auf den Elefantenbullen ein. Die Drüse liegt an der Hautoberfläche zwischen Auge und Ohr, so dass eine schwarze, ölige Rinnspur des Drüsensekrets über die Wangen zum Mundwinkel verläuft. Musth ist eine unkontrollierbare, periodisch auftretende Verhaltensänderung bei Elefantenbullen, die aufgrund eines Testosteron-Schubes Wochen oder Monate anhält. Der Zustand ist nicht mit der Brunft der Hirsche vergleichbar, weil er unabhängig vom Östruszyklus der Elefantenkuh wirkt. Der Östruszyklus weiblicher Säugetieren ähnelt dem Menstruationszyklus der weiblichen Primaten. Die Musth ist aber nicht an die Jahreszeiten gebunden und erfolgt häufig nur einmal im Jahr. In der ersten Phase vergrößern sich die paarigen Schläfendrüsen und die Reizbarkeit nimmt kontinuierlich zu. Nach einem Monat erreicht die Aggressivität ihren Höhepunkt. Häufig wird diese Phase von einem beständigen Urintröpfeln begleitet. Die Drüse entwickelt sich in der Parallelepisode Epi.Y*^^+Elefant. Körper der Schläfendrüse 8811_011: Epi.Y*^^+Elefant.Z248#168811756234011. Die Drüse tritt bei einem Hormonüberschuss 33 beim Bullen in Aktion. Bei Arbeitsbullen wird die Phase aktiv auf wenige Tage beschränkt, im Zoo dauert sie nicht reguliert 5 bis 7 Monate. Die Unzufriedenheit des Tieres kann aus der unbestimmten Zeitvorgabe zur Drüsenfunktion resultieren, weil die Folge 363 mit Quersumme 36_QS3+4=7 im Mittel die 365 Tage als Zeitangabe nur versteckt enthalten ist. Die Musth wiederholt sich ggf. jährlich, so dass ein Zeitmanagement notwendig ist. Die QS 7+9+7+3+7=33 ergibt die Hormonverdopplung 33+33= 66 weiblich, so das 33 ein Hormon und keine Hautmembran 33 bedeutet bzw. sind Kühe von der Musth nicht betroffen. Die Dauer der Drüsenaktivität ergibt sich mit den 7_7_7 als Wochenzählung aus der verbleibenden vorderen Quersumme 1+6+8+1+3+3=22 Wochen= 22/4= 5,5 Monate Musth-Dauer: Epi.Y*^^+Elefant.Z249#168133797373634. Damit die Drüse auf Testosteron 33 wirkt, muss das weibliche Hormon „66“ erwähnt werden, um eine Wirkungslosigkeit zu bezwecken. In der eingangs erwähnten Drüse „11“ ist weiblich=66 als 1_66_1 geklammert. Gleichfalls wird die Aggressivität „5“ 3fach geklammert: Epi.Y*^^+Elefant.Z251#166794085840776 und Epi.Y*^^+Elefant.Z252#166132204547757. Wenn der Elefantenbulle für die extreme Struktur „55555“ keine geeignete Erklärung findet, muss er das Mobiliar mit der Zeit=24 unverzüglich zerlegen: Epi.Y*^^+Elefant.Z253#165475555517924. Tatsächlich kommt dafür die Muskulatur der Ohren in Betracht. Die Harnröhre „303“ enthält zum Testosteron eine gewisse Zahlen-Ähnlichkeit. Beim Elefanten ist die Harnblase ähnlich als Volumen „30003“ ausgebildet: Epi.X*^^+Elefant.Z.5093.#812930003012568. Ein Schließmuskel „3_5_3“ ist in der Parallelepisode zu finden: Epi.Y*^^+Elefant.Z5101#820727613135362. Auf das Testosteron 33 bezogen sind die Urintropfen als Formtropfen „07“ vorhanden und nochmals auf männlich=2 und Nerv=7 adressiert: Epi.Y*^^+Elefant.Z5107#819763374702072. Bei der Entstehung der Duft–und Verwüstungsspur fallen als Ursache ungünstig wirkende Code-Dopplungen zusammen.
Ohrmuschel
Die Ohrmuschel (Auricula) bildet einen Schallauffangtrichter. Die Vielzahl der an der Bewegung der Ohrmuschel beteiligten Muskeln kann beim Säugetier durch 6 Muskelgruppen 5_55555 symbolisiert werden. Die Gehörgangmuskeln werden gesondert ermittelt: 1.) Schildspanner (Musculus scutularis); 2.) Niederzieher (Musculus parotidoauricularis); 3.) Auswärtszieher ( Musculi auriculares caudales); 4.) Heber (Musculi auriculares dorsales); 5.) Einwärtszieher (Musculi auriculares rostrales) 6.) Dreher ( Musculi auriculares profundi): Epi.Y*^^+Elefant.Z253#165475555517924. Die paarige „2“ Ohrmuschel setzt sich unspektakulär aus der Form „777“ (bzw. Nerv=7) und einer Flexibilität „666“ zusammen, und zwar als Extra über ein Ohrensymbol „O8O“ sowie der Haut „3“: Epi.Y*^^+Elefant.Z255#164177708023666. Mit der Quersumme=1+6+4+1+7+7+7+0+8+0+2+3+6+6+6=64 feiert die Biologie den Sieg über die Physik. Die Ohrmuschel wird über ein fächerförmig verzweigtes Leitungssystem 4444 versorgt, wobei die Gefäß- und Nervenversorgung von hinten (kaudal) auf das Ohr trifft. In der Symbolik lässt sich die große „888“ als Vena jugularis von der „8“ als Vena facialis unterscheiden. Im Gefäßdurchmesser ist die „9“ als Arteria carotis communis noch kleiner: Epi.Y*^^+Elefant.Z256#163536388851698. Die flächenhafte Ausdehnung „900060“ mit der enthaltenen Zeit=60 für die Thermoregulation wird durch ein Gefäßnetzwerk Netzwerk 4_90_4_08 gebildet. Epi.Y*^^+Elefant.Z257#162900060490408. Die zuvor enthaltene Zahl „49“ ist zugleich die Quersumme der Zeile 257. Damit wird die Gesamtheit der Gefäße symbolisiert, und zwar mit der Bedeutung, die Gefäße von der Rückseite der knorpligen Ohrmuschel durch Randlöcher zur Vorderseite durchzuleiten. Die Zahl „49“ ist daher in der Folgezeile erneut vorhanden. Der Knorpel „22“ der Ohrmuschel-Knorpelplatte (Cartilago auriculae) mit den Randlöcher 9_0_7_11 wird gebildet: Epi.Y*^^+Elefant.Z258#162268664907112. Im Ergebnis zeigen sich die Gefäßnetzwerke auf der Vorder- und der Rückseite 44 / 4444 der Ohrmuschel über 2 Zeilen: Epi.Y*^^+Elefant.Z257#161642144965385 und Epi.Y*^^+Elefant.Z257#161020444407826. Für die Thermoregulation wird auf das Blut Eisen=26 verwiesen. Die spezielle Aussage ergibt sich aus der Zeitdifferenz beider Netzwerkzeilen: Delta=621700557559171. Die Antwort des Netzwerks ist eindeutig: QS=6+2+1=9 und QS =1+7+1=9 sind Arterien 9. Die Form 7 und das Nervensystem 7 beschreiben eine Waage im Gleichgewicht des Körpers als ein Muskelsystem „55_7_55“. Den Elefanten fehlen Schweißdrüsen, so dass die Ohren die Luft zur Kühlung fächern.
Bei Säugetieren ist an der Basis der Ohrmuschel ein Schildknorpel (Cartilago scutiformis) als eine dünne, unregelmäßige dreieckige Platte ausgebildet, die Muskelansätze aufnimmt. Die Cartilago scutiformis wurde beim Elefanten als ein sehr kleines Knorpelstück (2 cm²) am vorderen-oberen (rostro-dorsalen) Rand der Auricula festgestellt. Der Knorpel „22“ bildet mit „2_3_22_22“ einen Dreiecksknorpel: Epi.Y*^^+Elefant.Z265#157982322815226. Die Haut 33 der Ohrmuschel ist beidseitig pigmentiert. Die spärliche Behaarung ist dem Hausschwein ähnlich, ebenfalls kann die Haarstruktur als „Borste“ bezeichnet werden. Am Eingang in den äußeren Gehörgang (Meatus acusticus externus) sind zahlreiche Borsten vorhanden, die als „Tragi“ bezeichnet werden [die Vorwölbung „Tragus“ liegt beim Menschen vor dem Gehörgang]. Die Haut 33 wird adressiert von Epi.Y*^^+Elefant.Z265#15563314329381 bis Epi.Y*^^+Elefant.Z273#15335280419793.
Die Haut 33 bildet vor den Gehörgang mit 11 eine Doppelfalte 3232_7 als Form. Der Zugang zum äußeren Gehörgang wird von den beiden Hautfalten verdeckt: Epi.Y*^^+Elefant.Z265#151138323270884. Am Ohreingang liegt eine Behaarung „1“ vor. Weiterhin sind Ohrschmalzdrüsen „888“ vorhanden: Epi.Y*^^+Elefant.Z281#148986888064181. Der äußere Gehörgang (Meatus acusticus externus) wäre als „505“ ausreichend bestimmt: Epi.Y*^^+Elefant.Z278#150594660237535. Weil aber für die folgende Bedingung „5005“ keine evolutionäre Idee für eine „Aufweitung“ vorliegt, muss das Großvolumen „5005“ kompensiert werden. Zur Problemlösung wird eine russische Matroschka-Gruppe „44“ gebildet, in dem das Kleinvolumen „505“ in das Großvolumen „5005“ als eine spezielle Röhrenkonstruktion in den äußeren Gehörgang gesteckt wird. Epi.Y*^^+Elefant.Z279#150054894430232. Am Röhrenende liegen gegensätzliche Muskeln „055“ und „550“. Mit diesen kann eine längliche, aufgerollte Knorpelplatte (Cartilago anularis) 2222 zu einer dichten Röhre zusammengezogen und wieder geöffnet werden. Der äußere Ohrengang der Elefanten ist somit wie bei Meeressäugern verschließbar. Die Knorpelröhre wird durch 2 Knopelstäbe befestigt. Wird eine Gruppe 44 halbiert sind der Knorpel 22 sowie mit 11 ein Befestigungsband vorhanden. Die Stäbe sind mittig 5 und seitlich 9 mit der Knorpelröhre verbunden „8_95_8“: Epi.Y*^^+Elefant.Z285#146895844021175. Knorpelplatte 2222: Epi.Y*^^+Elefant.Z286#146382222188933. Muskelgruppe 44_550 (Öffner): Epi.Y*^^+Elefant.Z289#144862683550293. Muskelgruppe 44_055 (Schließer): Epi.Y*^^+Elefant.Z290#144363157055292. Der Höreindruck als Zeitdifferenz besteht aus 1 Ton, wobei die beiden Seiten der Ohrmuschel zufällig jeweils wieder mit „49“ enthalten sind: 499526495001006. Die Schläfendrüse liegt mittig zwischen Auge und Gehörgang.
Wirbelsäule
7 Halswirbel (Vertebrae cervicales) 115: 1. Halswirbel (Atlas): Epi.X*^^+Elefant.Z.371#111597102569892. 2. Halswirbel (Axis): Epi.X*^^+Elefant.Z.507#816617851152467. Weitere Halswirbel 115: Z.608, Z.677, Z.820, Z.863. 7. Halswirbel 115: Epi.X*^^+Elefant.Z.894#463115492767674. Über den weiten Zeilenlauf der Halswirbel stellen sich mit „511“ interpretierbare Halsrippe ein, die bei 4% der Elefanten zur Fehlbildung führen. Bei Mammuts ist die Fehlbildung häufiger - lt. Wissenschaft könnte das zum Aussterben beigetragen haben.
20 [18-21] Brustwirbel (Vertebrae thoracicae) 115: 1. Brustwirbel: Epi.X*^^+Elefant.Z.897#46156661152096. 2. Brustwirbel: Alternativ wird „1115“ als Sehne etc. und nicht als Rippe akzeptiert, so dass die Rippenanzahl 1x gemindert wird: Epi.X*^^+Elefant.Z.926#447111501656912. Weitere Brustwirbel 115: Z.1006, Z.1012, Z.1058, Z.1066. 7. Brustwirbel: Alternativ wird „1115“ als Sehne etc. und nicht als Rippe akzeptiert, so dass die Rippenanzahl 1x gemindert wird (2. Minderung): Epi.X*^^+Elefant.Z.1106#374344711152171. Weitere Brustwirbel 115: Z.1329, Z.1375, Z.1413, Z.1462, Z.1612, Z.1703, Z.1957, Z.2034, Z.2041, Z.2067, Z.2261. 19. Brustwirbel: Der Wirbel wird alternativ als Doppelwirbel gezählt, weil mit „22“ ein Knochenbezug vorhanden ist und 515_2 eine Doppel-Struktur erwartet wird, zumal der Folgewirbel mit „Nullen“ extrem geschwächt wirkt: Epi.X*^^+Elefant.Z.2403#172295152115814. 20. Brustwirbel: Epi.X*^^+Elefant.Z.2419#1711555397000000.
5 [3 - 5] Lendenwirbel (Vertebrae lumbales): Es sind 5 Lendenwirbel vorhanden. Es werden nur die ersten 3 Lendenwirbel gebildet, wenn die Kombinationen „5115“ und „1155“ als zu starre Strukturgrößen übergangen werden: 1. Lendenwirbel: Epi.X*^^+Elefant.Z.2563#16153930961151. 2. Lendenwirbel: Epi.X*^^+Elefant.Z.2695#153627180161151. 3. Lendenwirbel: Epi.X*^^+Elefant.Z.2704#153115847091088. 4. Lendenwirbel: Epi.X*^^+Elefant.Z.2739#151159273652538. 5. Lendenwirbel: Epi.X*^^+Elefant.Z.2799#147918989115506.
6 [3-6] Kreuzwirbel (Vertebrae sacrales) 115: Nur 3 statt 6 Kreuzwirbel werden ausgebildet, weil die letzten 3 Kreuzwirbel als Wirbel mit „11_QS 9+2=11_115“; „55_115_QS 2+5+6+2=15“ und „11_115_15“ überbestimmt sind. Weil in den Wirbel-Zeilen kein Hüftgelenk enthalten ist, wird die Funktion nicht gestört, wenn diese Zeilen eine andere Verwendung finden. 1. Kreuzwirbel: Epi.X*^^+Elefant.Z.2837#145937698461156. 2. Kreuzwirbel: Epi.X*^^+Elefant.Z.3153#131311528872281. 3. Kreuzwirbel: Epi.X*^^+Elefant.Z.3175#130401653711591. 4. Kreuzwirbel: Epi.X*^^+Elefant.Z.3230#128181192115883. 5. Kreuzwirbel: Epi.X*^^+Elefant.Z.3240#127785571152562. 6. Kreuzwirbel: Epi.X*^^+Elefant.Z.3565#116136115156887.
31 [18-34] Schwanzwirbel (Vetrebrae caudales) 115: Die 31 Schwanzwirbel schöpfen eine Serie #115 in direkter Folge aus. Die 34 Schwanzwirbel entstehen, wenn die 6 Kreuzwirbel um 3 als Schwanzwirbel gemindert werden. Alternativ sind unter den 31 Schwanzwirbeln 3 Wirbel als Doppelwirbel 115_11_5 vorhanden. Nur 18 Schwanzwirbel entstehen, wenn das vorhandene Stopp-Signal beim Auslesen der Serie #115 gelesen wird. 1. Schwanzwirbel: Epi.X*^^+Elefant.Z.3570#115973459533418. Weitere Schwanzwirbel 115: Z.3571, Z.3572, Z.3573, Z.3574. 6. Schwanzwirbel: Alternativ als Doppelwirbel 115_11_2_5: Epi.X*^^+Elefant.Z.3575#115811258890714. Weitere Schwanzwirbel 115: Z.3576, Z.3577, Z.3578, Z.3579. 11. Schwanzwirbel: Alternativ als Doppelwirbel 115_511 (2. Zusatzwirbel): Epi.X*^^+Elefant.Z.3580#11564951132243. Weitere Schwanzwirbel 115: Z.3581, Z.3582, Z.3583. 15. Schwanzwirbel: Alternativ als Doppelwirbel 1155_115 (3. Zusatzwirbel): Epi.X*^^+Elefant.Z.3584#115520438207115. Weitere Schwanzwirbel 115: Z.3585 und Z.3586. 18. Schwanzwirbel: Statt 31 Schwanzwirbel entstehen nur 18 Schanzwirbel, wenn der knöcherne Schwanz als räumliches Extra „8222_8_4444“ ein Zeit-Stoppsignal als Quersumme 8+ 4+4+4+4=24 Stunden in der Folgezeile Z.3588 als Zeit „0_24_0“ erhält (Was der Fall ist!): Epi.X*^^+Elefant.Z.3587#115423822284444. 19. Schwanzwirbel: Epi.X*^^+Elefant.Z.3588#115391652880240. Weitere Schwanzwirbel 115: Z.3589 bis Z.3599. 31. Schwanzwirbel: Ende Serie #115: Epi.X*^^+Elefant.Z.3600#115007014037306. Am 28. Schwanzwirbel wird die Haut=33 mit dem Haar „1“ als linienförmiges Haarbüschel (Quaste) „11_5_1_0_QS 2+9=11_33_1“ adressiert: Epi.X*^^+Elefant.Z.3597#115102933148263. Dieser dorsale Haarkamm läuft um das Schwanzende herum und rückseitig zum 29. Schwanzwirbel zurück, der ebenfalls die Haut=33 enthält: Epi.X*^^+Elefant.Z.3598#115070942338605 Am 30. Schwanzwirbel wird in der Parallelepisode der Haarkamm 333_1 angelegt, um in Bixnom-Kreisform=„64“ das Schwanzende am 31. Schwanzwirbel (Z.3600) mit QS 3+6+0+0=9=Ende zu umrunden: Epi.Y*^^+Elefant.Z.3599#116324855643331.
After (Anus)
Zur Zahnbildung #115, zur Bildung der Vorderen Extremitäten #225 und an den Schwanzwirbel #115 liegen beim Elefanten als Besonderheit jeweils Serien von Zählgrößen vor. Die Vorteile führen andererseits zu Problemen: Um genau unter den Schwanz den Darmausgang (After/Anus) zu positionieren, muss die Parallelepisode Epi.Y*^^+Elefant aktiviert werden, weil in der Leitepisode Epi.X*^^+Elefant bereits alle Zeilen mit Schwanzwirbeln besetzt sind. Der sichtbare Schwanzanfang beginnt erst einige Schwanzwirbel hinter dem Kreuzbein. In Höhe des 6. Schwanzwirbels kann der Darmausgang gebildet werden. Es bildet sich eine Hautfalte 11_7 deren Form 5_7777_5 räumlich, flexibel 4_6 verschlossen ist: Epi.Y*^^+Elefant.Z.3576#117105777751146. Der Darmausgang zeigt sich als Form-Loch 707 und als Hautöffnung „3030050_4_33“: Epi.Y*^^+Elefant.Z.3576#117073030050433. Die Aussage „303“ ist unpassend, weil damit üblicherweise der Harnweg beim Säugetier adressiert wird. Der Darm wird durch „808“ symbolisiert, was sich ergibt, wenn mit der Hautspalte 11 und dem Formloch 707 die Quersumme als 808 gebildet wird. Mit der „Quersumme“ kann der Blick quer in die Leitepisode gerichtet werden. Diese zeigt nicht direkt den 8. Schwanzwirbel, sondern einen Scann durch die örtliche Situation. Hier wird nunmehr die klassische Öffnung „6_505_6_008“ als Anus sichtbar, die mit einem großen Darmausgang „8008“ vergleichbar ist: 8. Schwanzwirbel 115 mit Blick auf den Anus: Epi.X*^^+Elefant.Z.3577#115746505600867.
Teil A: Vordergliedmaßen
1.) Schulterblatt (Scapula):
Das Schulterblatt wird beginnend am Brustkorb adressiert, so dass sich die Vorderextremitäten vertikal wie ein Tischbein ausrichten. Die Last eines schweren Körpers kann zum Boden abgetragen werden. Läge der Zeilenbeginn wie beim Skelett des Hundes bereits im Halsbereich, muss der Scann am Oberschenkelgelenk beginnen, um eine nach vorn geneigte Lage des Schulterblattes darzustellen. Mit dem Gruppenbildung „444_7“ als Form „7“ wird das rudimentäre Schlüsselbein bereits avisiert: Schulterblatt (Scapula) 225: Epi.X*^^+Elefant.Z.931#444710258361225. Das Schulterblatt ähnelt einem gleichseitigen Dreieck, so dass es in halber Höhe nach hinten (kaudal) eine Dreiecksspitze ausbildet. Entsprechend liegt der Knochen- und Formbezug „2277“ am rechten Zahlenrand: Epi.X*^^+Elefant.Z.1116#370990367862277.
Auf dem Schulterblatt sitzt eine Knochenleiste 222 als Schultergräte. Weil mit dem Tripel bereits die Leiste selbst symbolisiert wird, kann nicht gleichzeitig noch deren senkrechte Position adressiert werden. Es werden daher mehrere Zeile gebildet. Schulterblattgräte: Epi.X*^^+Elefant.Z.1062#389854284872223; Epi.X*^^+Elefant.Z.1143#36222681586553; Epi.X*^^+Elefant.Z.1218#339922208977258.
Das Schlüsselbein (Clavicula) und das Rabenschnabelbein (Os coracoideum) sind bei den Säugetieren stark zurückgebildet. Evolutionär wird das rudimentäre Schlüsselbein als eine funktionslose Sehne 1 betrachtet, die in einem Muskel 55 liegt. Beim Schwein ist das Schlüsselbein wie ein regulärer Knochen 225 vorhanden. Beim Elefanten wird es abgeschwächt wie ein Sesambein als „522“ adressiert. Rudimentäres Schlüsselbein 5222: Epi.X*^^+Elefant.Z.1226#337704119522268. Innerhalb einer weitläufigen Hautserie „33“ sind 2 Muskelzeilen „55“ vorhanden, zwischen denen die Sehne „11“ liegt (beim Elefanten sind die Dimensionen weit gespannt): Epi.X*^^+Elefant.Z.1234#335514789736062; Epi.X*^^+Elefant.Z.1235#335243117841539; Epi.X*^^+Elefant.Z.1236#334971885545551.
Als Rudiment des Rabenschnabelbeins (Os coracoides) ist am Schulterblatt ein Rabenschnabelfortsatz (Processus coracoideus) 2225 ausgeprägt, der wie ein Knochen gezählt wird. Mit seitlich=9 entspringt der Muskel „Musculus biceos brachii“ „55“, sehnig „11“ seitlich (lateral) „9“ am Knochen. Sehne des Muskels 11: Epi.X*^^+Elefant.Z.1263#327810966377119. Processus coracoideus scapulae: Epi.X*^^+Elefant.Z.1264#327551622258149.
Schultergelenk / Buggelenk (Articulatio humeri): Die Gelenkpfanne (Cavitas glenoidalis scapulae) wird durch einen faserknorpeligen „1“ Saum „33_5_33“ vergrößert. Labrum glenoidale: Epi.X*^^+Elefant.Z.1357#305103353378261. Gelenkpfanne (Cavitas glenoidalis scapulae) 30_44_30_33 im Knochen 522. Statt „rund=303“ ist die Gelenkfläche elliptisch ausgeformt: Epi.X*^^+Elefant.Z.1360#304430331275221. Die Biceps-Muskel 1_555 wird im Bereich des Gelenks von einer Kapselsehnenscheide umhüllt 303_93 als Extra 888: Epi.X*^^+Elefant.Z.1366#3030931555888. Der Biceps-Muskel zieht durch eine Knochenrinne des Humerus „Sucus intertubercularis“ 500: Epi.X*^^+Elefant.Z.1368#302650036940278. Damit die Kapselsehnenscheide mit dem inneren Muskel nicht aus der Knochenrinne springt, legt sich eine Sehnenband „Retinaculum transversum“ 2_1_2 quer über die Knochenrinne 0_22_0: Epi.X*^^+Elefant.Z.1370#302208212068833.
2.) Oberarmknochen (Humerus) 225: Epi.X*^^+Elefant.Z.1376#300890443702253. Bereits vor dem Ellenbogengelenk legt sich der Knochenvorsprung „Tuber olecrani /Olecranon“ 50 der Elle (Ulna) seítlich an den Humus. Der schnabelförmige Processus anconaeus Tuber olecrani senkt sich bei gestecktem Ellenbogengelenk in die Fossa olecrani des Humerus (Oberarmbein) 800. Mit der Folge „98= seitlich, extra“ über 2 Zeilen wird die Beziehung hergestellt: Epi.X*^^+Elefant.Z.1386#298719516980015 und Epi.X*^^+Elefant.Z.1387#298504146023288. Das Ellenbogengelenk der Elefanten ist wie bei den Haussäugetieren ein zusammengesetztes Scharniergelenk. Es wird von einer Gelenkkapsel umgeben, und besteht aus der Articulatio humeroradialis, der Articulatio humeroulnaris und der Articulatio radioulnaris proximalis. Ellenbogengelenk (Articulatio cubiti) 707: Epi.X*^^+Elefant.Z.1390#29785989247072. Über das Ellenbogengelenk zieht das Innenband „Ligamentum collaterale med. obliquum“ 101 und der Muskel „Musculus pronator teres“ 55 zur Speiche (Radius): Epi.X*^^+Elefant.Z.1392#297431932855101.
3.) Unterarmknochen aus Speiche (Radius) und Elle (Ulna): Beim Pferd, Rind und Schwein liegen Elle und Speicher dicht zusammen, so dass beim Schwein nur 1 Zeile zur Verfügung steht, die beide Knochen als Verstärkung „2225“ enthält. Beim Elefant liegen nunmehr 2 Zeilen als 2225 vor, wobei als Besonderheit die Elle 5fach mehr wiegt als die Speiche. Die Elle (Ulna) begann bereist neben dem Humerus, so dass die Speiche unverändert zuerst als „225“ gezählt wird: Speiche (Radius) 2225: Epi.X*^^+Elefant.Z.1467#282225801318542. Oberes Verbindungsgelenk zwischen Radius und Ulna (Articulatio radioulnaris proximalis) 707: Epi.X*^^+Elefant.Z.1529#270781720427927. Elle (Ulna): Epi.X*^^+Elefant.Z.1539#269022255058025. Articulatio radioulnaris distalis 707: Epi.X*^^+Elefant.Z.1553#26659707053078. Beim Elefanten und den Haussäugetiren wird eine Knochenverbindung (Syndesmose) zwischen Ulna und Speiche durch eine breitflächige bandartige Verbindung (Membrana interossea antebrachii) 33 hergestellt, die bei Wiederkäuern und Pferden im Alter verknöchert. Entsprechend ist eine Membran-Verbindung 33_33 vorhanden, die dann vertikal als „333“ nach unten und flächig „44“ durchgezogen wird: Epi.X*^^+Elefant.Z.1528#289933648833544 und Epi.X*^^+Elefant.Z.1579#262207251763332.
4.) Handwurzelknochen am Karpalgelenk (Articulatio carpi): Das Karpalgelenk verbindet einerseits Radius und Ulna mit der oberen (proximalen) Reihe der Karpalknochen (Ossa capi) und andererseits mit der unteren (distalen) Reihe der Karpalknochen die Mittelhandknochen (Ossa metacarpalia). Es bilden sich 3 Gelenke:
1.) Gelenk „Articulatio antebrachiocarpea“, gliedert sich in Articulatio radiocarpea und Articulatio ulnocarpea, an der oberen (proximalen) Reihe der Karpalknochen (Ossa carpi): Os carpi ulnare; Os carpi intermedium; Os carpi radiale; Os carpi intermedioradiale (Fleischfresser); Os carpi accessorium. Die 4 Ossa Carpi beim Elefanten in der proximale Reihe bestehen von medial nach lateral aus den Ossa carpi radialis, intermedium, ulnare und accessorium.
2.) Gelenk „Articulatio mediocarpea“ als mittlere Abteilung artikulieren die proximalen mit den distalen Karpalknochen.
3.) Gelenk „ Articulatio carpometacarpea“ an der unteren (distalen) Reihe der Karpalknochen, die zur Unterscheidung statt „Ossa carpi“ als „Ossa carpalia“ bezeichnet werden können. Ossa carpalia: Os carpale I-IV (Wiederkäuer) bzw. Os carpale II-IV. Das Gelenk artikuliert mit den Mittelhandknochen (Ossa metacarpalia): Os metacarpale I-V (Fleischfresser); Os metacarpale II-V (Schwein); Os metacarpale III-IV (II+V rudimentär, Wiederkäuer); Os metacarpale III (Griffelbeine II+IV, Pferd). Die 4 Ossa Carpalia beim Elefanten in der distalen Reihe bestehen von medial nach lateral aus den Ossa carpalia I, II, III und IV. Dis distale Reihe artikuliert mit 5 Mittelhandknochen Metacarpalia I, II, III, IV und V. Der mittlere Mc III ist am längsten und stärksten, gefolgt von Mc II und IV sowie den äußeren Mc I und Mc V.
Erste (proximale) Knochenreihe 225: Os carpi radiale (Kahnbein), Os carpi intermedium (Mondbein), Os carpi ulnare (Dreiecksbein), Os carpi accessorium (Erbsenbein) mit der Zählweise QS 1+3= 4 Knochen: Epi.X*^^+Elefant.Z.1667#248365477225135. Zweite (distale) Knochenreihe 225: Os carpale primum (großes Vieleckbein), Os carpale secundum (kleines Vieleckbein), Os carpale tertium (Hauptbein), Os carpale quartum (Hakenbein) mit der Zählweise QS 1+3= 4 Knochen oder 2x Ziffer „2“ plus „2“ als paarig: Epi.X*^^+Elefant.Z.1803#229631309225902.
Sesambeingruppe: Die Mittelhand- und Zehenknochen laufen in eine Knochenzählserie #225 ein, die zwar serienweise Knochen liefert, aber dazwischen keine Gestaltung durch Gelenke und Sesambeine erlaubt. Die Hinterextremitäten geben vor, welche Interpretation notwendig ist, um ähnliche Vorderzehen zu bilden. Der Zeilenlauf kommt dazu vom Schwanz ohnehin zur Bildung des Gehirns über die Vordergliedmaßen zurück. Zweckmäßig wird bereits innerhalb des Karpalgelenks eine Sesambeingruppe gebildet. Sesambeine an der Unterseite der Mittelhandknochen (Os metacarpale) können bereits avisiert werden. Diese entstehen, sobald der Os metacarpale vorhanden ist. Sesambeingruppe 22_4444 als Gruppe 44 mit Knochenbezug 22: Epi.X*^^+Elefant.Z.1688#245275622354444 und Hautbezug 33: Epi.X*^^+Elefant.Z.1689#245130402921433. Bei einem Doppelhügel des Sesambeins ziehen 2 Sehnen darüber, nur 1 Sehne über den einfachen Hügel. Sesambeine 522 (statt 225) als Einfachhügel 2_1_2 (QS 2+1+2=5) unter McI + McV: Epi.X*^^+Elefant.Z.1710#242120029552223. Sesambeine 522 (statt 225) als Doppelhügel 5_2_5 unter McII + McIII + McIV: Epi.X*^^+Elefant.Z.1756#235777477525228.
Die McI-V liegen schließlich vor und können zugewiesen werden: Einfachhügel auf McI+V als „15“. Doppelhügel auf McII+III+IV als 22, 33 und 4_3_4: Epi.X*^^+Elefant.Z.1869#221522338434618. Als Extra bildet der Elefant noch ein extrem großes Sesambein, den sogenannten Präpollex aus, der aus dem Karpalknochenbereich als 6. Zeh herausragt, um das Knorpelpolster der Sohle zu stabilisieren. Dieses knorplige Sesambein verknöchert in der Regel mit Calcium=20. Der Präpollex setzt am McI an und wächst in Richtung Sohle und schräg bis unter Mc4 „21_42“: Präpollex 52222: Epi.X*^^+Elefant.Z.1913#216427208852222.
5.) Mittelhandknochen (Ossa metacarpalia I bis V): Beim Elefanten sind wie beim Menschen und übereinstimmend mit den Mittelfußknochen (Metatarsalknochen) 5 Mittelhandknochen vorhanden. Der Zeilenlauf läuft in eine Serie #225 ein. Die 5 Knochen können daher nicht als eine Zeile gezählt werden, weil die Folgezeile wieder eine Zählgröße „225“ ist, dann aber keine Zeilen für 5 Zehengelenke verfügbar wären. In der ersten Zeilen sind auch keine Gelenke als „0=Null“ vorhanden. Folglich werden für die 5 Knochen als Serie „225“ mit 5 Zeilen gebildet, wobei die letzte Zeile dann die 5 notwendigen Zehengrundgelenke (Articulationes metacarpophalangeae) „5_0_909“ enthalten muss: Ossa metacarpalia I (McI) 225: Am McI setzt der Präpollex als „6. Zeh“ an. Das Sesambein ist als Extra=8 in der Knorpelstruktur 33 als 3_8_3 enthalten: Epi.X*^^+Elefant.Z.1832#225996315793832. Ossa metacarpalia II 225: Epi.X*^^+Elefant.Z.1833#225873022659193; Ossa metacarpalia III 225: Epi.X*^^+Elefant.Z.1834#225749863977263; Ossa metacarpalia IV 225: Epi.X*^^+Elefant.Z.1835#225626839528229; Ossa metacarpalia V 225: Epi.X*^^+Elefant.Z.1836#225503949092756.
6.) Zehenknochen der Hand (Ossa digitorum manus): Am Vorderbein werden der innere Zeh aus 1 Zehenglied (Phalanx proximalis I), die 3 mittleren Zehen jeweils aus 3 Zehengliedern (Phalanx proximalis II+III+IV, Phalanx media II+III+IV, Phalanx distalis II+III+IV) und der äußere Zeh aus 2 Zehengliedern (Phalanx proximalis V, Phalanx media V) gebildet. Der äußere Zeh hat somit bei einer horizontalen Reihenzählung kein Endglied „Phalanx distalis“. Beim Menschen entfällt vergleichsweise am Daumen ideel das Mittelglied, um am Endglied einen Daumennagel auszubilden. Diese logische Sichtweise ist hier unnötig, weil die Zehennägel im Zeilenlauf gesondert entstehen. Elefanten besitzen 5 Zehennägel, teilweise werden aber auch nur 4 gefunden.
6.1) Phalanx proximalis: Entsprechend der unterschiedlichen Anzahl der Zehenglieder könnten 3 Zeilen gebildet werden. Dieses ist aber nicht ausreichend, weil die Zehenglieder als „Serie 225“ ohne Zischenzeile keine Zehengelenke adressieren könnten. Folglich werden alle Zehen als gesonderte Zeile erfasst. Das Gelenkproblem wird damit nicht gelöst, aber nicht verschärft. Die Evolution muss eine Lösung finden.
Phalanx proximalis I 225: Zeh I endet als 11, paarig 2: Epi.X*^^+Elefant.Z.1837#225381192451987; Phalanx proximalis II 225: Epi.X*^^+Elefant.Z.1838#2252585693875410; Phalanx proximalis III 225: Epi.X*^^+Elefant.Z.1839#225136079681512; Phalanx proximalis IV 225: Epi.X*^^+Elefant.Z.1840#225013723116468; Phalanx proximalis V 225: Epi.X*^^+Elefant.Z.1860#222594220717366.
6.2) Phalanx media: Als Spezialität offeriert der „Indifant“ 1 Zehnagel mehr als der „Afrifant“ und besitzt daher ein 2. Zehenglied „Phalanx media I“. Als spezielle Endform 5_77_5_9 als „1“ Glied zu den übrigen „4“ in „1_7_4“ kann die fehlende „5“ als Quersumme 2_22_QS2+3=5 wie 225 gelesen werden. Phalanx media II+III+IV 225: Die 3 Glieder sind 1x 64 + 2x 64 = 3 Zehenglieder, wobei QS 6+4 =10 als 1 Zeh mit Gelenk „0“ lesbar ist: Epi.X*^^+Elefant.Z.1868#221640926410225. Das 3. Zehenglied kann sich beim „Afrifanten“ nicht gelenkig an die Phalanx media II+III+IV anschließen, weil die Gelenk-Interpretation nicht akzeptiert wird. Daher wird eine geeignete Haut-Zeile „33“ gewählt, um sich an der Lederhaut (Corium) zu befestigen: Epi.X*^^+Elefant.Z.1872#221167334687126. Der äußere Zeh V besitzt definitionsgemäß ein Mittelglied ohne Endglied. Phalanx Media V 225: Zeh V endet als 11, paarig 2: Epi.X*^^+Elefant.Z.1925#215078052225611.
6.3) Phalanx distalis: Phalanx distalis II, III, IV: 3 Zehenendglieder „1“ als Ziffer 3 und Extra=8_8_8, flexibel=6: Epi.X*^^+Elefant.Z.1984.#208682081922531. Der „Indifant“ schmückt sich mit 5 Zehennägel, der „Afrifant“ nur mit 4.
Teil B: Hintergliedmaßen
1.) Beckengürtel (Cingulum membri pelvini): Darmbein 225: Beginn am 1. Kreuzwirbel: Epi.X*^^+Elefant.Z.2892#143162258137725. Kreuzbein-Darmbein-Gelenk (Iliosakralgelenk) 50_55 / 0_50_5: Gelenk über 2 Zeilen gezogen. Der Gelenkflächenknorpel 333 ist als Vorzeile nicht vorhanden, und ist somit mit enthalten als 3_QS5+8=13_3. zusammen als 1_3_1_3_3: Epi.X*^^+Elefant.Z.3048.#135835055949574 und Epi.X*^^+Elefant.Z.3049.#135790505258872. Hüftgelenk mit der Beckenpfanne (Acetabulum) Gelenk über 2 Zeilen gezogen. Beckenpfanne 737373: Die 3 Beckenknochen (Darmbein, Schambein, Sitzbein) treffen beim Wirbeltier in einer Y-Naht als Form 7 zusammen: Epi.X*^^+Elefant.Z.3346.#123737373142349. Hüftgelenk 505: Epi.X*^^+Elefant.Z.3347.#123700403505916. Das Foramen obturatum ist eine paarige Öffnung im Becken zwischen dem Schambein (Os pubis) und dem Sitzbein (Os ischii). Darstellung über 2 Zeilen: Zuerst wird der Knochenbezug 22 adressiert und dann das paarige „2“ Form-7-Loch 2_070707: Epi.X*^^+Elefant.Z.3429.#120742271955177 und Epi.X*^^+Elefant.Z.3430.#20707070126618. Schambeinfuge (Symphysis pubica) 111: Epi.X*^^+Elefant.Z.3432.#120636728011160. Die in der Fuge enthaltene Zeit=60 bezieht sich nachfolgend mit dem weiblichen Hormon=66 auf die Schwangerschaft, in der sich die Schamfeinfuge zur Geburt weitet: Epi.X*^^+Elefant.Z.3434.#120566467831771. Ende der Schambeinfuge 111: Epi.X*^^+Elefant.Z.3447.#12011176400763. Sitzbeinende vor dem 6. Kreuzwirbel: Epi.X*^^+Elefant.Z.3502.#118225371369018.
2.) Oberschenkel: 2.1) Oberschenkelknochen (Os femoris / Femur) 225: Epi.X*^^+Elefant.Z.3653.#113338420622584.
2.2) Strukturen oberhalb des Kniegelenks: Elefant und Mensch verfügen über ein 180° streckbares Gelenk. Vergleiche dazu: „Die Gelenke der Hinterextremität des Afrikanischen Elefanten (Loxodonta africana; https://www.vetmeduni.ac.at/hochschulschriften/dissertationen/AC07814988.pdf“. Beim Menschen liegt der vierköpfige Oberschenkelmuskel (Musculus quadriceps femoris/ Quadrizeps) auf der Vorderseite des Oberschenkels. Der gerade Oberschenkelmuskel (Musculus rectus femoris ) gehört zur Muskelgruppe und beginnt bereits am Darmbein: Epi.X*^^+Elefant.Z.2904.#1425706785586440. Am Oberschenkel setzen 3 Köpfe des Quadrizeps an (Musculus vastus medialis an der Innenseite, Musculus vastus intermedius, Musculus vastus lateralis an der Außenseite). Die 4 Muskeln strahlen zusammen in eine Endsehne ein, die über das Kniegelenk zu einem Knochenvorsprung (Tuberositas tibiae) am Schienbein (Tibia) führt. Das Wadenbein (Fibula) besitzt zum Femur kein Gelenk. In die gemeinsame Endsehne ist die Kniescheibe (Patella) eingelagert. Unterhalb der Patella wird die Sehne auch als Kniescheibenband (Ligamentum patellae) bezeichnet. Bei der Knochenzählung „225“ könnte die Kniescheibe wie ein rudimentäres Schlüsselbein verstanden, das in einem Muskel eingelagert ist. Die Kniescheibe hat aber mehr Ähnlichkeit mit einem Sesambein, das aber statt „225“ als „522“ vorliegen würde. Tatsächlich spannt auch eine Sehne wie beim Sesambein über die Patella, teilweise setzen Sehnen aber auch an. Für die Zeile „225“ wird möglichst eine andere Verwendung gesucht. Die Kniescheibe kann sich wie wie ein Wirbel „115“ bilden, weil Wirbel nach dem Schwanz nicht mehr entstehen. Damit könnte die Bezeichnung Patella= „Sehnenknochen“ 115 gewählt werden, weil Sehne 11 und Muskel 5 korrekt enthalten sind. Zunächst wird eine Muskelsehnen-Gruppe 1_445_1 gebildet, in der die Sehne 1_1 des Musculus rectus femoris bereits enthalten ist: Epi.X*^^+Elefant.Z.3657.#113214451882500. Die Sehnen der 3 Oberschenkelmuskel werden als 131, 121, 151 in die Muskelsehnen-Gruppe 44 aufgenommen: Epi.X*^^+Elefant.Z.3660.#113121653151448.
2.3) Kniegelenk (Articulatio genu): Das Kniegelenk setzt sich aus dem Kniescheibengelenk und dem Kniekehlgelenk zusammen, die im Zeilenlauf in 2 Ebenen folgen. Das Tibiofibulargelenk (Articulatio tibiofibularis proximalis) als obere Gelenkverbindung zwischen Schienbein und Wadenbein folgt als 3. Ebene, die jedoch nicht zum Kniegelenk gehört.
2.3.1) Kniescheibengelenk (Articulatio femoropatellaris): Gelenkkapsel 101: Die Parallelepisode liefert die Gelenkkapsel „101“ als Hautstruktur 5_7_33. Es ist eine gemeinsame Gelenkkapsel für 2 Gelenke 42_42: Epi.Y*^^+Elefant.Z.3663.# 114292425733101. Gemeinsame Endsehne 511: In der Leitepisode wird mit der Spiegelung von Endsehne 511 zur 115 Muskelsehne „Patella“ als Klammerung 959 der Struktur 5 avisiert: Epi.X*^^+Elefant.Z.3666.#112936511329597. Kniescheibe (Patella): Die Knochenform 7_64 kann mit der „64“ beim Elefanten als kreisförmig gelesen werden. Der Gelenkknorpel auf der Rückseite zwischen 41_41 ist als Quersumme 9+7+6=22 bereits enthalten: Epi.X*^^+Elefant.Z.3670.#112813419764115. Schleimbeutel: Am Knie sind beim Menschen 4 Schleimbeutel als Polster verteilt. In der Art “404_33_5“ kann es sich um den flachen, runden Schleimbeutel „Bursae praepatellares“ handeln, der außen auf der Kniescheibe liegt. Beim Elefanten wird 1 Schleimbeutel erwähnt, der allerdings am Schienbein liegt und noch erwartet wird. Der Schleimbeutel entsteht in der Parallelepisode: Epi.Y*^^+Elefant.Z.3671.# 114043354797153. In der Leitepisode entsteht am Oberschenkelknochen (Femur) eine Gelenkrolle (Trochlea ossis femoris) „69_05_96“, die am Kniescheibengelenk eine Gleitrinne „05“ für die Kniescheibe bildet. Für die „Trochlea ossis femoris“ ist die „Knochenbezeichnung „225“ nunmehr geeigneter als für die Kniescheibe, jedoch ist der Femur dann doppelt als Zählgröße vorhanden. Alternativ wird nicht der Knochen, sondern der Gelenkknorpel der Trochlea ossis femoris „22_5“ adressiert: Epi.X*^^+Elefant.Z.3674.#112690596225994. Die Anteile der Quadrizepssehne ziehen als breites Band „Ligamentum patellae“ 11 unterhalb der Kniescheibe weiter zur „Tuberositas tibiae“ an der Vorderseite des Schienbeins. Davon zieht die Sehne des Musculus rectus über das Gelenk ohne an der Kniescheibe anzusetzen: Epi.X*^^+Elefant.Z.3675.#112659932118177. Wie beim Menschen sind im Zeilenlauf der Parallelepisode hinter den Ligamentum patellae“ 2 Strukturen zu finden: a) Fettpolster (Corpus adiposum infrapatellare) 76_44444 mit Hautbezug „33“ als Quersumme 7+6+4+4+4+4+4=33: Epi.Y*^^+Elefant.Z.3680.#113764444418573 und b) Schleimbeutel (Bursa infrapatellaris) 33_5_70: Epi.Y*^^+Elefant.Z.3680.#113733538565702.
2.3.2) Kniekehlgelenk (Articulatio femorotibialis): Gelenkverbindung: Oberschenkelknochen (Femur) und Schienbein (Tibia) besitzen jeweils 2 Gelenkköpfe, die miteinander artikulieren: a) Konvex: Condylus lateralis femoris / Konkav: Condylus lateralis tibiae b) Konvex: Condylus medialis femoris / Konkax: Condylus medialis tibiae. Die 4 Gelenkköpfe sind durch 4x O (Null) als Gelenk 505 mit 2 Gelenkflächen 23_23 enthalten: Epi.X*^^+Elefant.Z.3686.# 112323725050000. Die beiden Kreuzbänder, das vordere Kreuzband (Ligamentum cruciatum craniale) und das hintere Kreuzband (Ligamentum cruciatum caudale), werden als Band=22 adressiert. Die Bänder sind nicht ersichtlich, wenn sich die beiden Bänder zu 22+22=44 als Gruppe 44 bilden. Kreuzbänder 442+244 oberhalb der horizontalen Gelenkachse: Epi.X*^^+Elefant.Z.3679.#112537442384969 und Epi.X*^^+Elefant.Z.3682.#112445749737724. Kreuzbänder 22_4_444 unterhalb der Gelenkachse: Epi.X*^^+Elefant.Z.3682.# 112201964914445. Zur Fixierung der beiden Kniegelenkmenisken können bei den Säugetieren richtungsbedingt 4 Haltebänder entstehen: Kraniale Haltebänder (Lig. tibiae craniale menisci lateralis bzw. medialis). Kaudale Haltebänder (Lig. tibiale caudale menisci lateralis bzw. medialis). Indifanten benötigen keine Menisken zur Gelenkfächenanpassung. Beim Afrifanten entstehen die Haltebänder und die Menisken in der Paralelleepisode. Zeitgleich zur Gelenkflächen-Zeile Z.3686 zieht ein Band (Ligamentum meniscofemorale) „1115“ an die Innenfläche des medialen Fumur-Gelenkkopfes. Epi.Y*^^+Elefant.Z.3686.#113579260841115. Das äußere kaudale Halteband (Lig. tibiale caudale menisci lateralis) „1151“ legt sich an dieses Band zum Femur, so das es nicht zum Schienbein (Tibia) führt: Epi.Y*^^+Elefant.Z.3690.#113456139691151. Das innere kaudale Halteband (Lig. tibiale caudale menisci mediales) führt zu keinem Knochen, sondern ist mit der Gelenkkapsel „4_0_11_000“ verbunden. Die fehlende Hautstruktur 33 der Kapsel folgt als QS 3+4+2+5+4+0+1+1+0+0+0+6+7=33: Epi.Y*^^+Elefant.Z.3691.#113425401100067. Nachfolgend bilden sich die Menisken. Die beiden kranialen Haltebänder sind mit dem Schienbein (Tibia) verbunden, so dass diese in einer Zeile als Dopplung 115_115 enthalten sind: Epi.Y*^^+Elefant.Z.3695.#113302613115115. Die Afrifanten setzen NI=Natürliche Intelligenz ein, um sich die Menisken zu beschaffen. In der Leitepisode werden die beiden Menisken als paarige „2“ Knorpelringe 5_0_22 avisiert, entstehen dann aber tatsächlich erst in der Parallelepisode: Epi.Y*^^+Elefant.Z.3692.#112141183785022. Die Menisken verwachsen als Hautstruktur 33 mit der Gelenkkapsel 33, womit die Kapsel straff am Gelenk ansetzt. Um Knorpel=22 zu bilden, wird ein Menisken-Gruppe 44 gebildet. Weil #11 am linken Zahlenrand mitläuft, sind mit der Gruppe schon 50% des Knorpels vorhanden. Mit 1 Zeile für jeden Meniskus zählt sich der Knorpel 11+11=22. Die QS 9+4=13 ergänzt die “1133“, so das QS 6+7+9=22 auf den Knorpel=22 verweist: Epi.Y*^^+Elefant.Z.3692.#113394679160441. Der dünne mediale Meniskus ist nur an der Gelenkkapsel 33 befestigt. Die C-Form des Meniskus kann als „dreiseitig=3“ gelesen werden. Wird die QS 6+3+9+7+3+8+5+8+7+4+6=66 durch 3 dividiert bestehen alle Seite aus Knorpel 22. Das Seitenband (Lig. collateralen mediale) 11 liegt dicht am Meniskus: Epi.Y*^^+Elefant.Z.3693.#113363973858746. Der laterale Meniskus ist mit „3333“ auffällig. Die C-Form ergibt sich ebenfalls mit (33+33)/ 3=22 als Knopel. Das Seitenband (Lig. collaterale laterale) 11 liegt dicht am Meniskus: Epi.Y*^^+Elefant.Z.3694.#113333285181469.
2.4) Tibiofibulargelenk (Articulatio tibiofibularis proximalis): Schienbein (Tibia) und Wadenbein (Fibula) sind durch Gelenke verbunden, wobei das obere (proximale) Tibiofibulargelenk direkt am Kniegelenk liegt. Die Tibia bildet am Gelenkkopf (Condylus lateralis tibiae) für Verbindung zur Fibula seitlich eine konkarv=3 eingesenkte Gelenkpfanne „838“ für den konvexen Gelenkkopf (Caput fibulae) „808“ (Null als Kugelsymbol) des Wadenbeins (Fibula) aus: Epi.X*^^+Elefant.Z.3702.#111838263245354 und Epi.X*^^+Elefant.Z.3703.#111808061175885. Darin ist der Knorpel in der Gelenkfläche als QS 8+0+8+0+6=22 enthalten. Kniekehlenmuskel „Musculus popliteu“ „55_9“ schützt den Außenmeniskus und zieht an der Fibula vorbei zur Tibia: Epi.X*^^+Elefant.Z.3706.#111717552761549. Die Gelenkkapsel 7_5_33 schließlich sich in der Parallelepisode: Epi.X*^^+Elefant.Z.3713.#112753341088163.
2.5) Strukturen unterhalb des Kniegelenks: Die Kniescheibensehne (Ligamentum patellae) zieht vom unteren Rand der Kniescheibe (Patella) als breites Band zur Vorderseite des Schienbeins (Tibia). An der Schienbeinkante ist ein Knochenfortsatz (Tuberositas tibiae) „115_99_1“ für den Sehnenansatz vorhanden: Epi.X*^^+Elefant.Z.3711.#111567030599391. Die mächtige Patellasehne (Ligamentum patellae) wird weitläufig als Sehnengruppe „111_44“ gebildet von Epi.X*^^+Elefant.Z.3715.#111446904585276 bis Epi.X*^^+Elefant.Z.3720.#111297110358683. Die Sehne „Tendo musculli rectii femoris“ 111_55 zieht über die Kniescheibe hinweg, gehört somit nicht zur Patellasehne, und wird direkt unterhalb der Patellasehne befestigt: Epi.X*^^+Elefant.Z.3722.# 111237305355804. Die Gelenkkapsel „11_0909_33“ wird als geschlossen. Form 7 und Haut 33 sind auch in der Zeillennummer vorhanden: Epi.X*^^+Elefant.Z.3733.#110909523314841.
3.) Unterschenkelknochen: Es wird eine Unterschenkelgruppe 22_444_5 mit „22“ als Knochen für das Unterschenkelskelett gebildet, die aus dem Schienbein (Tibia) 225 und dem Wadenbein (Fibula) 225 besteht. Die beiden voll ausgebildeten Knochen sind noch nicht adressiert, weil diese nur jeweils mit 1 Zeile gezählt werden. Von den 2 Verbindungsgelenken (Articulationes tibiofibularis proximalis et distalis) zwischen Tibia und Fibula ist das Tibiofibulargelenk zuvor bereits als Kniegelenk enthalten. Articulatio tibiofibularis distalis 909: Epi.X*^^+Elefant.Z.3795.#109097562723136. Schienbein (Tibia) 225: Epi.X*^^+Elefant.Z.3796.#109068822585432. Wadenbein (Fibula) 225: Epi.X*^^+Elefant.Z.3806.#108782251848214.
3.) Unterschenkelknochen: Es wird eine Unterschenkelgruppe 22_444_5 mit „22“ als Knochen für das Unterschenkelskelett gebildet, die aus dem Schienbein (Tibia) 225 und dem Wadenbein (Fibula) 225 besteht. Die beiden voll ausgebildeten Knochen sind noch nicht adressiert, weil diese nur jeweils mit 1 Zeile gezählt werden. Von den 2 Verbindungsgelenken (Articulationes tibiofibularis proximalis et distalis) zwischen Tibia und Fibula ist das Tibiofibulargelenk zuvor bereits als Kniegelenk enthalten. Articulatio tibiofibularis distalis 909: Epi.X*^^+Elefant.Z.3795.#109097562723136. Schienbein (Tibia) 225: Epi.X*^^+Elefant.Z.3796.#109068822585432. Wadenbein (Fibula) 225: Epi.X*^^+Elefant.Z.3806.#108782251848214.
4.) Hinterfußwurzelknochen bzw. Tarsalknochen (Tarsus): Der Tarsus als Verbindung zwischen dem Unterschenkel (Crus) und den Hintermittelfußknochen (Ossa metatarsalia / Metatarsus). Am Sprunggelenk sind das distale Ende der Tibia und die Fibula und anderseits die Mittelfussknochen Ossa metatarsalia II-IV beteiligt. Im Vergleich zum Schwein liegen statt der üblichen 7 Tarsalknochen nur noch 6 Knochen vor, weil Os tasale V fehlt. Der Os tasale IV hält Kontakt zu 2 Mittelfußknochen. Die 6 (statt 7) Tarsalknochen können in 3 Reihen einsortiert werden. Wegen der Unterschiedlichkeit der Knochen werden wie beim Schwein unverändert 6 Zeilen verwendet, zumal zur Gelenkausbildung der Knochen ein Zeilenlauf notwendig ist. Der Calcaneus wird zuerst aufgeführt, weil er aufgrund seiner Größe und Lage im Scann zuerst erscheint. 1. Reihe: Calcaneus, Talus, 2. Mittlere Reihe: Os tarsi centrale 3. Reihe: Os tarsale II-IV.
4.1) Obere (proximale / krurale) Reihe: Fersenbein (Calcaneus) 225: Epi.X*^^+Elefant.Z.3875.#106845225944336; Sprungbein (Talus) 225: Epi.X*^^+Elefant.Z.3996.#103609922556131. 4.2) Mittlere (intertarsale) Reihe: Os tarsi centrale 225: Epi.X*^^+Elefant.Z.4038.#102532256199678.
4.3) Untere (distale /metatarsale) Reihe: Os tarsale (Nr. 2-4) 225: Epi.X*^^+Elefant.Z.4049.#102253704750383; Epi.X*^^+Elefant.Z.4116.#100589225105515; Epi.X*^^+Elefant.Z.4282.# 966896895222561. Mit „52225“ kann durchaus ein Sesambein als 7. Knochen bzw. als 6. Zeh des Elefanten herauswachsen (QS6+1=7 Tarsalknochen).
5.) Mittelfußknochen (Ossa metatarsalia):
5.1) Fußknochen: Der Mensch besitzt wie die meisten Haussäugetiere 5 Metatasalknochen (Os metatarsale I-V). Beim Schwein fehlt dagegen der Os metatarsale I. Der Elefant besitzt alle 5 Metatasalknochen (Os metatarsale I-V). Die 5 Metatarsalknochen „QS 1+4=5 als Form 7“ können mit 1 Zeile erfasst werden, weil nachfolgend 5 Gelenke zum Anschluss der Zehen vorhanden sind: Epi.X*^^+Elefant.Z.4394.# 942251366714385. Es entstehen 4 Gelenke „4_505“ zusammen und 1 Gelenk gesondert unten=9 „050910“: Epi.X*^^+Elefant.Z.4435.#933540587450509; Epi.X*^^+Elefant.Z.4459.# 928515924050910. Für den Anschluss der Zehen muss eine Zehengruppe avisiert werden, die die besondere Anzahl der Zehenglieder vorgibt. Dafür ist eine die Ziffernfolge der Zeilennummer Z.4445 selbst für den „Afrifanten“ geeignet: Die Phalangen der 5 Zehenglieder werden gebildet als „5_4_2_2=paarig“, von denen 2 mit 3 Gliedern die symmetrische Spitze 3_8_3 bilden: Epi.X*^^+Elefant.Z.4445.#93144038365422.
5.2) Sesambeine (Ossa sesamoidea): Wenn im Zeilenlauf Knochen als Zählgrößen 225 entstehen, fallen umgekehrt mit sekundärer Bedeutung immer auch Zählgrößen 522 an. Auf der Sohlenseite der Mittelfußknochen entstehen damit kleine Knochen als Sesambeine (Ossa sesamoidea). Über ein Sesambein spannt sich für gewöhnlich eine Sehne (Ligamentum sesamoideum).
5.2.1) Sesambein (Ossa sesamoidea I) 522 am Os metatarsale I: Epi.X*^^+Elefant.Z.4427.#935227581961375
5.2.2) Sesambein (Ossa sesamoidea II+V) 522 am Os metatarsale II+V: Die Zählgröße „1“ in der Symmetrie „141“ bewirkt, dass das Sesambein als „1 Paar“ gebildet wird und dann auch 2 Sehnen über das Gelenk ziehen: Epi.X*^^+Elefant.Z.4529.# 914164827852287
5.2.3) Sesambein (Ossa sesamoidea III+IV) 522 am Os metatarsale III+IV: Die Zählgröße „1“ in der Symmetrie „191“ bewirkt, dass das Sesambein als „1 Paar“ gebildet wird und dann auch 2 Sehnen über das Gelenk ziehen: Epi.X*^^+Elefant.Z.4565.# 906955641915226
6.) Zehenknochen des Fußes (Ossa digitorum pedis): Die 5 Zehenknochen liegen an den 5 Mittelfußknochen an.
6.1) Phalanx proximalis 225: Die 5 Zehen besitzen naturgemäß auch alle das 1. Zehenglied. Weil an der I. Zehe aber kein 2. Zehenglied folgt, liegt eine Besonderheit vor, so dass 2 Zeilen zugewiesen werden. 6.1.1) Phalanx proximalis der I. Zehe ist der vollständige I. Zeh: Epi.X*^^+Elefant.Z.4463.#9276837341122580. 6.1.2) Phalanx proximalis der II. bis V. Zehe: Epi.X*^^+Elefant.Z.4488.#922516155379458. Kontrolle: Es müssen 4 Zehenglieder-Gelenke folgen (Articulatio interphalangea proximalis II, III, IV, V): 1.) 2 Gelenke „404“ für die äußeren II. und V. Zehe. Dazwischen liegen die inneren III. und IV. Zehe als Extra=8, seitlich=9: Epi.X*^^+Elefant.Z.4493.# 921489540472515. 2.) 2 Gelenke „808“ für die inneren 3. und 4. Zehe: Epi.X*^^+Elefant.Z.4538.#912351808140813.
6.2) Phalanx media 225: Von den 5 Zehen besitzen noch 4 ein 2. Zehenglied. Weil am II. und V. Zeh aber kein 3. Zehenglied folgt, liegt eine Besonderheit vor, so dass 2 Zeilen zugewiesen werden:
6.2.1) Phalanx media der äußeren II. und V. Zehe: Diese bilden mit „115“ jeweils ein Endglied: Epi.X*^^+Elefant.Z.4575.#904973225211586. 6.2.2) Phalanx media der inneren III. und IV. Zehe: Diese werden symmetrisch mit 3 Gliedern fortgeführt „8_3_8“, Glied 8=Extra: Epi.X*^^+Elefant.Z.4596.#900838230057225. Kontrolle: Es müssen 2 Zehenglieder-Gelenke
(Articulatio interphalangea distalis III und IV) folgen. Vorhanden: „2_505“: Epi.X*^^+Elefant.Z.4599.#900250599117853.
6.3) Phalanx distalis: 6.3.1) Phalanx distalis der III. und IV. Zehe symmetrisch 80_80 als Spitze=9 und paarig als 88_88. Der „Afrifant“ erkennt mit „räumlich=4“ die Beziehung „4_80_8_08_4“ wegen der „Null“ vor der „4“ als geometrisch „ungleich“, so dass die Phalanx distalis der IV. Zehe sehr klein geformt wird:: Epi.X*^^+Elefant.Z.4699.# 881092254808046. Der „Indifant“ schmückt sich mit 4 Zehennägel, der „Afrifant“ nur mit 3.
Weiblicher Reproduktionstrakt
Dem Zeilenlauf um das Körperende zur Bauchseite wird über den Reproduktionstrakt nachgegangen. Der After konnte kunstvoll in der Serie der Schwanzwirbel untergebracht werden. Es ist aber nicht möglich, die Vulva und Klitoris dort ebenfalls zu platzieren. Es wird angenommen, dass der Zeilenlauf das Schwanzende umrundet und die Betrachtung somit am Kreuzwirbel folgen kann. Die Hoden des Bullen liegen im Körper in der Nähe der Nieren. Hoden und Ovarium sind in der Formgebung ähnlich. Unterhalb des Nierenendes beginnen die beiden Uterushörner (Cornua uteri), Sie liegen senkrecht übereinander und vereinigen sich im Uteruskörper. Am Ausgang der folgenden Vagina bildet sich ein langer Vorraum (Vestibulum vaginae) als ein Urogenitalkanal in einer Länge von 90 cm bis 1,40 m. Die weibliche Harnröhre (Urethra femina) mündet darin. Der Urogenitalkanal erstreckt sich vom hinteren (kaudalen) Rand des Schambeins (Os pubis) schräg nach unten (kanioventral) bis zwischen die Hinterextremitäten. Das Vestibulum der Kuh entspricht somit der Bogenführung des Penis beim Bullen. Bei der Geburt verbleibt für das Kalb eine gefahrlose, kurze Fallhöhe zum Boden. An der Bauchseite folgt der Bauchnabel. Die Milchdrüsen (Gesäuge) sind zwischen den Vorderextremitäten angeordnet.
1.) Eileiter (Tuba uterina): Für den Darmausgang wurde die typische Darstellung „808“ einer Verdauungsstrecke nicht verwendet, so dass diese als Extra-8-Strecke umgedeutet wird. Um die senkrecht übereinander liegenden Uterushörnern im Zeilenlauf darzustellen, sind zweckmäßig zeitgleich beide Episoden zu aktivieren. Vor jedem Uterushorn sitzt jeweils der Eileiter, der als muskulöser Schlauch die Eizelle vom Ovar zum Uterus weiterleitet. Die Spermien treffen im Eileiter auf die Eizelle. Direkt nach den Zehen der Hinterextremitäten folgt mit #880 eine geeignete Eileiterstrecke von Epi.X*^^+Elefant.Z.4700#880904788370853 bis Epi.Y*^^+Elefant.Z.4757#880078106916855. Der Muskel ist mit „55“ enthalten, und liegt auch in der Strecke vor: Epi.X*^^+Elefant.Z.4729.# 875502750125398 und Epi.Y*^^+Elefant.Z.4751.#881189550537462.
2.) Uterushörner (Cornua uteri): Die Dopplung des Uterushorns wird über die beiden Episoden gezogen. Die Zeit=24 ist enthalten: Epi.X*^^+Elefant.Z.4765#868888248760338 und Epi.Y*^^+Elefant.Z.4765#878600536118254. In der Leitepisode kann sich die Dopplung über die Abschnitte 868, 858, 848, 838, 828, 818, 808 entwickeln. Bereits innerhalb jedes Abschnittes ist eine Null-Strecke zur Volumenbildung vorhanden.
3.) Uteruskörper (Corpus uteri): In der Gebärmutter reift die befruchtete Eizelle heran. Der Uteruskörper beginnt, wenn die Verzweigung 80_80 zum Volumenkörper 808 zusammengeführt wird: Epi.X*^^+Elefant.Z.5124#808011808224631.
4.) Gebärmutterhals (Cervix uteri): Der Gebärmutterhals besteht in Folge aus 2 Abschnitten (Portio praevaginalis und Portio vaginalis), die jeweils über eine Öffnung (Ostium uteri) „8008“ zugänglich sind: Ostium uteri internum: Epi.X*^^+Elefant.Z.5145#804713800844122; Ostium uteri externum: Epi.X*^^+Elefant.Z.5170#800822534882594.
5.) Vagina: Das weibliche Begattungsorgan erstreckt sich vom äußeren Muttermund (Ostium uteri externum) bis zum Scheideneingang (Ostium vaginae). Die Vagina erweitert sich im Volumen und wird nunmehr weiblich=66 weitergeführt. Die Zeit=24 ist enthalten: Epi.X*^^+Elefant.Z.5171#800667666861924. Mathematisch steht am Ausgang für das Ostium vaginae keine große Form „6006“ Verfügung. Ersatzweise wird beidseitig jeweils 1 Blindsack „60“ angelegt. Zwischen beiden Blindsäcken kann nunmehr mit seitlich=9 die Öffnung „Ostium vaginae“ als „9009“ angelegt werden: Epi.X*^^+Elefant.Z.5345#774602900906082. Schwellkörper (Corpus cavernosum clitoridis): Epi.X*^^+Elefant.Z.5352#773589780519994. Das oberhalb der Einmündung der Harnröhre liegende Jungfernhäutchen (Hymen) ist beim Fohlen und dem jugendlichen (juvenilen) Schwein nur durch eine ringförmige Falte erkennbar und bei anderen Haussäugertieren als kleines Querfältchen. Diese kann auch beim Elefanten als ringförmiges Form-Haut-Gebilde 7733_00 als Extra 8 vorliegen: Epi.X*^^+Elefant.Z.5354#773300804135788.
6.) Urogenitalkanal (Vestibulum vaginae): Das Vestibulum zieht sich als Struktur 5_666_5 im Zeilenlauf als Form # 7 und als Volumen 0_12_0 (Zeit=12) ab: Epi.X*^^+Elefant.Z.5354#773012043566656. [Nur männlich! Im Scann ist eine unbekannte Struktur 5000 erkennbar. In dieser Größe und Lage wird dort die Bulbourethraldrüse (Bulbourethral gland) positioniert, die beim Menschen nur erbsengroß ist. Die Drüse produziert bei sexueller Erregung ein visköses Sekret (Präejakulat "Lusttropfen") und befeuchtet die Harnröhre. Die paarige Anordnung könnte als Formdopplung 7_6699_7 vorliegen: Epi.X*^^+Elefant.Z.5398#766997500063544. Ein Ausführungskanal 11 ist in 3 Zeilen enthalten: Epi.X*^^+Elefant.Z.5403#766287711520083. Die weibliche Vorhofdrüse (Bartholin-Drüse / Glandula vestibularis major) ist mit der Bulbourethraldrüse vergleichbar.]. Die Harnröhre 303 mündet in das Vestibulum bei Epi.X*^^+Elefant.Z.5426#763039532868229 bzw. wegen der Einleitung in einer sackartigen Erweiterung günstiger in Epi.X*^^+Elefant.Z.5508#751679830309188. Vor dem Ende des Vestibulums wird das Ende des Harnweges statt 303 als temporär verschlossen 033 dargestellt: Epi.X*^^+Elefant.Z.5527#749095803391172. Die Mündung des Vestibulums wird mit der Haut= 33, der Zeit=24, Hormon=66 sowie bei der Geburt als dehnbar „66666“ adressiert: Epi.X*^^+Elefant.Z.5529#748824833666668.
Penis
Weil der weibliche Reproduktionstrakt den Zeilenlauf um das Körperende beansprucht, erklärt es sich, dass das männliche Gegenstück ähnlich aufgebaut ist, und unbemerkt mit entstand. Die Spermien werden über den Prostata-Bereich in die Harnröhre abgegeben. Der Penis wird „ausgeschachtet“, so dass er im weiteren Zeilenlauf noch erkennbar wird. Zunächst tritt der Penis aus einer Hautringfalte 33_33 äußerlich hervor: Epi.X*^^+Elefant.Z.5544#733567063313786. Gemäß Fotos liegt die Harnröhre seitlich und öffnet sich erst am Ausgang zur Mitte. Penis: Epi.X*^^+Elefant.Z.5669#730332070090494.
Bauchnabel
Der Zeilenlauf ist beim Elefanten mathematisch optimiert, so dass der Bauchnabel als vertikale Raumachse 44 ersichtlich ist: Bauchnabel (Umbilicus) „1“ mit 9=unten: Epi.X*^^+Elefant.Z.5723#723440941000001.
Magen (Ventriculus /Stomach) und Milz (Splen / Spleen)
Leber: Im Zeilenvorlauf sind hinter dem Zwerchfell zunächst keine Organe auffindbar. Erst im Zeilenrücklauf werden vom Verdauungssystem zuerst der Dickdarm (Intestinum crassum) mit den Abschnitten Rectum, Colon und Caecum und der Dünndarm (Intestinum tenue / small intestine) mit den Abschnitten Ileum, Jejunum, Duodenum erwartet. Magen und Milz entstehen dann an der korrekten Position in der überwiegend linken Körperhälfte. Die Leber wird real rechts neben dem Magen platziert. Dieses erklärt man sich beispielsweise als eine Verschiebung als Folge der Darmfüllung. Im Zeilenrücklauf als Rückwärtsschau muss sich die Leber funktionell bereits vor dem Magenausgang bilden.
Die Milz „ klebt“ in der linken Körperhälfte scheinbar direkt und langgezogen auf dem Magen. Die Milz des Schweins besitzt ebenfalls eine langgezogene Form. Weil die aktive Magenepisode im mittleren Teil wechselt, kann in der Leitepisode Epi.X*^^+ Elefant die Milz entstehen. Tatsächlich liegt die Milz auch nornalerweise nahe der großen Kurvatur des Magens, zwischen den beiden Serosablättern (Paries profundus et superficialis) des Omentum majus. Bei allen Haussäugetieren ist das „Omentum majus“ als ein zwischen Baucheingeweide und ventraler Bauchwand gelegener doppelwandiger Peritonealsack ausgebildet, d.h. die Milz liegt am Bauchfell. Milz-Ende als venöses Netzwerk 8558_444: Epi.X*^^+Elefant.Z.6049.#685585776675444. Entsprechend liegt auch ein Beginn des Netzwerks im folgenden Zeilenlauf vor: Milz-Anfang als arterielles Netzwerk 444_9. Blut ist als Eisen=26 enthalten: Epi.X*^^+Elefant.Z.6065# 68264674449184. Im Zwischenbereich könnte „555_9“ als Nebenniere gelten: Epi.X*^^+Elefant.Z.6048#684565559745868. Am Gefäßstil (Milzhilus) der Milz „44_707“ werden die Arteria lienalis=9 und Vena lienalis=8 zusammengeführt: Epi.X*^^+Elefant.Z.6049#684452389707887. Das Band zwischen Milz und Magen „Ligamentum gastrolienale“ 11 ist vorhanden: Epi.X*^^+Elefant.Z. 6052#684113103989261. Es ist zu einer großen Sekundärtasche „4000“ geformt, die als „Milznetz“ bezeichnet wird. Epi.X*^^+Elefant.Z. 6065.#684000083486372. Davon ist das „Segelnetz“ eine seitliche Abfaltung 44_7_44: Epi.X*^^+Elefant.Z. 6054#683887100320946 und Epi.X*^^+Elefant.Z. 6055.#683774154474485.
Zum Elefantenmagen wird auf die Ähnlichkeit zu Mensch und Schwein verwiesen. Eine konkrete Darstellung zur Magenform und zur Abgrenzung der Drüsenabschnitte ist unbekannt. Allgemeines: Der Magen ist im Gegensatz zu Wiederkäuern einhöhlig. Der Blinddarm (Caecum) und der Dickdarm übernehmen die eigentliche Verdauung (Fermentationsprozesse). 1.) Mageneingang (Ostium cardiacum / Cardia) mit der Region (Pars cardiaca) um das Ostium cardiacum. 2.) Drüsenabschnitte des Magens: 2.1) Kardiadrüsen (Glandulae cardiacae) - tubuläre Drüsen, die ein alkalisches, schleimiges Sekret mit Lysozym produzieren. 2.2) Hauptdrüsen (Glandulae gastricae propriae) - tubuläre Drüsen, die Schleim, Pepsinogen und Salzsäure produzieren. 2.3) Pylorusdrüsen (Glandulae pyloricae) - den Kardiadrüsen ähnlich, wobei sie einen alkalischen Schleim produzieren. 3.) Pförtnerkanal (Canalis pyloricus), eine Engstelle am distaler Magenabschnitt (Pars pylorica). Die Öffnung (Ostium pyloricum) zum Dünndarm (Duodenum) wird von einem Ringmuskel (Pylorus / Musculus sphincter pylori / Magenpförtner) umschlossen. Die Speiseröhre mündet etwas in Körpermitte in den Magen, so dass sich unterhalb des Mageneingangs ein Magensack bildet, der divers bezeichnet wird (Fundus, Fornix, Saccus, Blindsack, Diverticulum ventriculi etc.).
Der Zeilenlauf #3 ist für das Zwerchfell „33“ geeignet. Für große Organe, die beide Episoden gelichzeitig belegen, kann selbst die bessere Situation im Zeilenrücklauf unpassend sein. Die Zeilennummer 60xx selbst ist dann das „Ass im Ärmel (an ace under table)“. Die „Null“ zieht beidseitig einen Hohlkörper mit der Ziffer „6“ als flexible Magenwand auf. Der Elefantenmagen ist kein Muskelschlauch mehr, sondern eine Zeitmaschine 60_60. Dünndarm am Magenausgang: Epi.X*^^+Elefant.Z.6003.#689697235606032. Der Magen wird im Zeilenrücklauf aufgebaut. Das Magenende in Zeile 6004 enthält mit der Ziffer 4 die räumliche Anordnung. Enthalten ist die „64“, mit der die Biologie die volle Ausnutzung der Bixnom-Gravitationslinse feiert, wogegen die Physik keine Kümmung, sondern nur die rechteckige Lichtkugelmatrix 7x9=63 vorweisen kann. Mit dem rückwärtigen Magenaufbau wird die „63“ zur Zahl 36, die doppelt 36_36 für 2 Magenabschnitte enthält. Diese Besonderheit „2_36_2“ ist markiert, so dass man noch den 3. Magenabschnitt versteckt als Quersumme 6+8+9+5+8=36 auslesen kann. Die Zahl „64“ steht auch für den Kreis, so dass der Elefantenmagen zu einer zylinderförmigen Zeitmaschine wird. Die Physik „63“ liefert dann über mehrere Zeile die Salzsäure als Chlor=17 aus dem BiXnom-Periodensystem nach Bedarf: Epi.X*^^+Elefant.Z.6004.#689582362648736. Die Salzsäure wird über mehrere Zeilen produziert.
Der Magenausgang liegt am Magenende. Der Magenschlauch ist nicht dicker als der Dickdarm, in dem die eigentliche Verdauung erfolgt. Magenausgang (Ostium pyloricum) „505“: Epi.X*^^+Elefant.Z.6005.#689467527950543. Ringmuskel (Musculus sphincter pylori): Der Ringmuskel zieht sich über 6 Zeile von „55_0 bis 55_0“ von Epi.X*^^+Elefant.Z.6007.#689237973255037 bis Epi.X*^^+Elefant.Z.6007.# 68855022540213. Dem Symbol fehlt der Schließbefehl „0_55“, so dass der Elefant so viel wie möglich frisst. Die hormonelle Regulierung ist geschlechtsabhängig „33/66“: Epi.X*^^+Elefant.Z.6009.#689008571366785 und Epi.X*^^+Elefant.Z.6011.# 688779322133257. Der Schließmechanismus wird als ein Ringband 022 nunmehr mit 221 als geschlossen angezeigt. Am Beginn der Pförtnerkanals „511“ wird ein Formverschluss 7_9_7 __9_77 adressiert: Epi.X*^^+Elefant.Z.6018.# 687978149774511. Der weitlumige Erstabschnitt der Pars pylorica ist das „Antrum pyloricum“ ist als Strukturgröße 555_59 und Form 77 in der Parallelepisode enthalten: Epi.Y*^^+Elefant.Z.6019.#695552675627759. An der Grenze zum Magenkörper (Corpus ventriculi) bildet sich eine Einkerbung „Incisura angularis ventriculi“ in der kleinen Kurvatur (Curvatura gastrica minor) des Magens, die als Hautmembran „333_3737“ erscheint: Epi.Y*^^+Elefant.Z.6021.#695321633383737. Der Magenkörper (Corpus ventriculi) wird als Volumen 60_009_06 auch im Zeilenlauf erkennbar: Epi.Y*^^+Elefant.Z.6025.#694860009062818. Die 60009 kann zu „69“ zusammemgefügt werden, die im Zeilenlauf bis zum Mageneingang durchläuft. Von dieser Blutversorgung „9“ ziehen quer als Netzwerk mehrere Gefäßäste in die Magenwand. Bei der mehrfach eingesteuten Doppelziffern „11 handelt es um real vorhandene Lympfknoten. Die Zahl 17_6000 wiederholt sich, so dass sich die Schleimhaut als neuer Abschnitt verändert und als „17“ wie auch in Folgezeilen Salzsäure produziert: Epi.Y*^^+Elefant.Z.6052.#691760005717694. Weitere Chlorzeilen-17, eine Schleimhaut 303 und Schleimhautfalten 111 sind vorhanden. Der Magen als Muskelschlauch „7_5005_7“ wird mit der besonderen Zeilennumer „6064“ für die gesamte Zeitmaschine adressiert: Epi.Y*^^+Elefant.Z.6064.#690391087500574. Mageneingang (Ostium cardiacum / Cardia) „505“: Epi.Y*^^+Elefant.Z.6071.#689595050997114.
Vor 150 Jahren war die Ernährung scheinbar ganz, ganz anders und führte ohne Plastik-Müll zu erkennbaren Formen. Die Forscher diskutierten damals über den Zweck des Magensacks, den aktuell niemand darstellen mag. Die uralte Skizze zeigt im Magensack etwa 11 Querfalten. Bei der oberen Falte wurde eine Ventilfunktion vermutet, so dass der Magensack als Wasserspeicher ähnlich wie bei Kamelen genutzt werden könnte. Es waren Elefanten bekannt, die sich mit dem Rüssel Wasser aus dem eigenen Magen saugten und versprühten. Vor dem Mageneingang wird der Magensack in der Leitepisode als Dopplung 68_68 aktiviert: Epi.X*^^+Elefant.Z.6069.#682196820784809. Es wird eine Magenfalten-Gruppe „44“ gebildet, die 11 Stück Querfalten avisiert: Epi.X*^^+Elefant.Z.6070.#682084432511204. Nachfolgend liegen statt 11 nur 6 Zeilen vor, so dass nach Dopplungen gesucht wird: Zeile 6078: “681186“ enthält 4 Falten; Zeile 6080 enthält mit „11“ 1 Falte; Zeile 6081 enthält mit „0110“ nur 1 Falte, wenn „Null“ keine Symmetrie ist; Zeile 6085: „41141“ enthält 3 Falten; Zeile 6088 enthält mit „11“ 1 Falte; Zeile 6093 enthält mit „11“ 1 Falte; Zeile 6095 enthält mit „11“ 1 Falte. Der Magensack schließt sich am Boden als Zeitmaschine bis Ende Zeile 60xx in Zeile 6099. Dazu wird werden 4 Magenwandschichten 7_4_7 gebildet und als „52“= QS 5+2=7 in 7_52_7 als Form mit Ende=9 adressiert: Epi.X*^^+Elefant.Z.6096.#679175279747869. Ergänzend folgen 2 Schichten „52_52“: Epi.X*^^+Elefant.Z.6098.# 67895252629436. Abschließend hat sich die Zeitmaschine mit „52“ verschlossen. Der Muskel ist als „5“ enthalten. Bei 4 fiktiven Schichten „5_2“ sind „5555“ eine symbolische Magenwand, die im Hintergrund ausgeführt wurde. Im Ergebnis dienen die Querfalten im Magensack somit als Zählgröße 11 zur Findung des Magenbodens.
Der Wandaufbau des Magens entspricht den Schichten im gesamten Gastrointestinaltrakt: 1.) Magenschleimhaut (Tunica mucosa / Mukosa); 2.) submuköse Bindegewebeschicht (Tunica submucosa / Submucosa) 3.) dreilagige, gewunden verlaufende Muskelschicht (Tunica muscularis) 4.) seröse Haut (Tunica serosa / Serosa). Die Serosa besteht aus a) Lamina epithelialis serosae (Mesothel), b) Lamina propria serosae und c) Tela subserosa. Die Tela suberosa kann zur Serosa gezählt werden, so dass die Magenwand aus 4 Schichten besteht.
Gesäuge (Mammarkomplex)
Das Gesäuge besteht aus den Milchdrüsen und Zitzen und liegt zwischen den Vorderextremitäten. Der Elefantenbulle verfügt folglich ebenfalls über einen Brustwarzenkomplex mit Zitzen. Damit der Bulle daran teilhaben kann, muss der Mammarkomplex bereits etwas vor dem einlaufenden weiblichen Zeilenbereich #66 beginnen. Der Stier als männliches Rind, der ebenfalls als Bulle bezeichnet wird, bekommt dagegen keine Zitzen, weil das weibliche Rind (Kuh) ein „Euter“ an den Hinterextremitäten besitzt. Je Körperseite ist beim Elefanten [wie bei Menschen / Primaten] 1 Mammarkomplex (Gesäuge) aus Drüsenkomplex und Zitze (Papillae mammae) einer thorakalen Milchdrüse (Mamma) vorhanden. Das Kalb saugt nicht mit dem Rüssel, sondern mit dem Maul am Gesäuge.
Um die Zitze geschlechtsneutral zu scannen, muss diese von der Milchdrüse getrennt werden, in dem sich der Mammarkomplex aus 2 Form-Gruppen 7_44_1(Zitze)_80(Drüse)_01_7_44 zusammensetzt: Epi.X*^^+Elefant.Z.6139.#674418065701744. Bei einem Euter bildet sich eine lange Zitze, dagegen kann die Zitze bei einem Gesäuge bereits in der Brust beginnen. Bei einem Scann der Zitze wird somit der pigmentierte Brustwarzenvorhof und das innere Gewebe mit erfasst. Eine Rinne 222 „Sulcus intermamarius“ teilt das Drüsengewebe in der Körperlängsachse in die beiden Mammarkomplexe in Busenform auf. In der Ziffer 2 steckt weniger ein trennendes Hautband als allgemein die Ziffer 2 in vielfacher Nutzung auch für die Milch [9=seitlich, 3=Haut, 4=räumlich, 7=Form, 6=flexibel]. Paariger Mammarkomplex 38_222_83: Epi.X*^^+Elefant.Z.6144#673869222874839. In der Zeilennummer ist eine Gruppe 44 enthalten, so dass die Milchgänge 202 des Drüsengewebes zeitgleich in der Parallelepisode entstehen: Epi.Y*^^+Elefant.Z.6144#681401620215410. Der Rinne 222 „Sulcus intermamarius“ wird nochmals dargestellt, so dass die Rinne (Sulcus) mit dem Zeilenlauf durchgezogen wird. Epi.X*^^+Elefant.Z.6159#672228041133789. Über das Gesäuge eines Elefanten liegen keine Informationen vor, daher wird der allgemeine Wissensstand hinzugezogen. An der Verengung von der Brustdrüse aus Drüsenzisterne und Milchgängen befindet sich der Fürstenbergsche Venenring, paarig=2“, der den Milchfluss reguliert. Dieser ist einerseits als Vene 8 erkennbar und besteht andererseits aus einer Muskelstruktur 5_7_5, mit der hier die Form-7 markiert wird: Epi.X*^^+Elefant.Z.6147#673540345752889. Die Zitze enthält eine längliche Zitzenzisterne als Hohlraum, die von Schwellvenen umgeben ist. Die Zitzenzisterne wird somit im Zeilenlauf lang gezogen, indem mit #680 eine äußere Vene als „8“ und die Zisterne als „0“ in der Parallelepisode durchläuft bis zu Epi.Y*^^+Elefant.Z.6153#680404933301395. Zeitgleich entsteht in der Leitepisode die „Fürstenberg Rosette“ 606. Diese bildet am distalen Zitzenende den Zugang zum Strichkanal (Zitzenkanal / Ductus papillaris ). Die Fürstenberg Rosette ist eine starkwandige Vene (Circulus venosus) „88“: Epi.X*^^+Elefant.Z.6153#67288355360686. Der Strichkanal ist mit einer Schleimhaut 33 ausgekleidet, wobei kurz vor der Austrittsstelle zur Milchkontinenz ein Schließmuskel (Musculus sphincter papillae) 505 vorhanden ist: Epi.X*^^+Elefant.Z.6158.#672337204505198. Äußere Zitzenöffnung (Ostium papillare) „606“: Epi.X*^^+Elefant.Z.6162.#67190076360646.
Weil die Zitze entstanden ist, aber die weibliche Strecke #66 erst noch beginnt, ist eine Wiederholung zu erwarten, so dass die weiblichen Zitzen folgen und so auch die Milchdrüsen entstehen. Wenn die Leitepisode die Serie #66 durchläuft, kann die Zitzenzisterne in der Parallelepisode statt als Venenumhüllung #680 als Volumenform #670 entstehen.
Zwerchfell (Diaphragma)
Anhand der Lungenposition kann davor Herz platziert werden. Die Durchlaufzeiten zur Bildung der Brustwirbel liegen beim Elefanten ungünstig nicht mehr als Struktur „#5“ vor, um im Zeilenlauf beider Episoden die Herzmuskel-Wände aufzuziehen können. Im Bereich „#45“ ist eine Raumgröße „4“ aktiv, und die Form des Herzens wird als Viereck beschrieben. Am Zwerchfell grenzen bauchseitig Leber und Magen an. Weil beide Organe parallel liegen, sind beide Episoden zu betrachten. Die Lunge wird gesucht, indem nach der Verzweigung der Luftröhre 22 (Knorpel) beide Hauptbrochien als 22_22 festgestellt werden. In einer Zeile ist das nicht möglich, so dass beide Episoden beteiligt sind: Epi.X*^^+Elefant.Z.1250.#331220200427441 und parallel in Epi.Y*^^+Elefant.Z.1247.# 33572827222161.
Das Zwerchfell als Atemmuskel trennt den Brustraum vom Bauchraum, so dass sich daran die Lage der Organe orientiert. Weiterhin sind Durchtrittsstellen von Aorta, Speiseröhre und Hohlvene vorhanden. Das Zwerchfell ist zur Brusthöhle hin von der Fascia endothoracica und vom Brustfell (Pleura diaphragmatica) sowie zur Bauchhöhle hin von der Fascia transversalis und vom Bauchfell (Peritoneum) überzogen. Das Brustfell (Pleura) besteht zur Lunge hin aus einem inneren Blatt (Pleura pulmonalis) und zur Bauchhöhle hin aus dem äußeren Blatt (Pleura parietalis), so dass sich ein trennender Spalt (Pleurahöhle) bildet, der normalerweise mit seröser Flüssigkeit gefüllt ist. Beim Elefanten sind beide Blätter verwachsen. Der Elefant kann daher im Wasser mit dem Rüssel schnorcheln, weil die Pleura mangels Flüssigkeitsspalt nicht druckempfindlich ist.
Im Zeilenlauf beginnt das Zwerchfell als Serie #33, so dass universell alles Hautmembran=33 wäre. Wird eine Formkurve zur Führung des Zwerchfells vom Brustbein bogenförmig zur Wirbelsäule hoch mit der Zählgröße „#335“ gesucht, ist dieses nicht erfolgreich. Eine Diagonale ergibt sich erst dann, wenn statt der Hautmembran „335“ das Zwerchfell als Muskel „355“ gezählt wird. Um diesen Unterschied zu anderen Säugetieren zu symbolisieren, verwachsen beide Blätter des Brustfells, so dass die Dopplung für die Pleura „33“ entfällt. Über die Durchleitung der Gefäße durch das Zwerchfell 33 liegen keine Informationen vor. Sicher ist aber, dass im Unterschied zum Menschen die Aorta deutlich oberhalb der Speiseröhre durchgeleitet wird. Die Verzweigung der Luftröhre (Trachea) auf 2 Bronchien als Hosenstück 22_22_22 liegt im Zeilenlauf nicht vor, weil diese Stelle beim Elefanten durch ein elastisches Band mit dem Zwerchfell divers verflochten ist. Beidseitig des Bandes 22 zieht der paarige Nervus vagus (pneumogastric nerv) 7_7 kombiniert als „2727“ entlang. Die Doppelziffer 22 kann daher nicht nochmals als Luftröhrenknorpel verwendet werden. Das Hosenstück wird daher versteckt: Die Quersumme ist 66, geteilt durch 3 Röhrenstücke = 22 für das Hosenstück aus Knorpel 22. 1 Hauptbronchus liegt am Band mit QS 3+5+3+5+6=22 =Bronchus 22. Das Band 22 ist weiterhin mit dem Luftröhren-Speiseröhren-Muskel (Trachea-Esophageal Muscle) 55 verbunden. Weil der Mageneingang nicht direkt hinter dem Zwerchfell liegt, kann der Muskel nicht als Schließmuskel dienen: Epi.X*^^+Elefant.Z.1171.# 35356554272784. Das Band 22 wird mit 303 am Zwerchfellloch adressiert. Der Nerv „7“ wird extra markiert als „8_7_8“, so dass die Zahl 20 den paarigen 10. Hirnnerv (Nervus vagus) speziell adressiert: Epi.X*^^+Elefant.Z.1176.#352062287869303. Die Speiseröhre „505“ wird durch das Zwerchfell nur durchgeleitet, so das eine Öffnung adressiert wird „50....5001“: Epi.X*^^+Elefant.Z.1180.#350868856385001. Folgende Durchtrittstellen können festgestellt werden: Speiseröhre (Ösophagus) 505 passiert Zwerchfell 355 Epi.X*^^+Elefant.Z.1181.#35057176167172. Hohlvene 808 passiert Zwerchfell 333_55: Epi.X*^^+Elefant.Z.1241.#333622280849557 und parallel: Epi.Y*^^+Elefant.Z.1243.#336808652824093. Aorta 9...909 passiert Zwerchfell 335: Epi.X*^^+Elefant.Z.1248.# 33175100203069 und parallel: Epi.Y*^^+Elefant.Z.1249.#335190676909806.
Herz
Indifanten und Afrifanten entstehen an Meilensteinen der Mathematik. Werden diese nicht erkannt, steigt ein schlechtes Karma aus den BiXnom-Zeilen auf. Es ist dann hoffnungslos im fehlenden Rhythmus dem Schlagen einer Herzklappe zu lauschen. Das Herz muss genau vor dem Zwerchfell liegen, aber dort ist nichts! Das Herz hinterlässt lediglich einen Platzhalter und findet günstige Bedingungen erst im Zeilenrücklauf zum Gehirn. Die Milchdrüsen liegen zwischen den Vorderbeinen, so dass nachfolgend über dem Brustbein das Herz entsteht.
Das voluminöse Elefantenherz bildet sich, in dem jede Episode ihre eigene Herzkammer ausbildet. Die Herzkammerwand als Muskel und Struktur „5“ benötigt zur Kammerbildung „5_5“. Zieht sich die Doppelziffer „55“ nicht im Zeilenlauf durch, muss vorab eine Herzwand-Gruppe 44_55 gebildet werden. Die äußere Herzform ergibt sich aus den Besonderheiten der Zusammenfügung beider Episoden. Statt der üblichen Herzform ist eher eine kompakte Quadratform mit 2 Herzspitzen ausgebildet. Die Hohlvene ist beim Elefanten paarig vorhanden.
Im Zeilenlauf entwickelt sich jede Herzhälfte vom Vorhof zur Herzspitze. Erst anhand von Details kann festgestellt werden, ob es die linke oder rechte Herzkammer ist. Weil die Annäherung von der Rückseite erfolgt und es die Art der Herzklappe vorhersagt, ist abweichend von bisherigen Herzbildungen in der Leitepisode Epi.X*^^+Elefant [Excel-Tabelle am „linken“ Bildschirmrand] die „linke“ Herzkammer zu erwarten, aus der die Aorta sauerstoffreiches Blut erhält.
Die Episode Epi.X*^^+Elefant bildet für die linke Herzhälfte eine Herzwand-Gruppe 44_798 mit Nerv, Arterie und Vene. Die Doppelziffer „55“ ist unnötig, weil diese unverzüglich als #655 mitläuft: Epi.X*^^+Elefant.Z.6309.#656245443864798. Die Parallelepisode Epi.Y*^^+Elefant bildet für die rechte Herzhälfte eine Herzwand-Gruppe 4_555_4. Die Doppelziffer „55“ ist enthalten, weil diese im Zeilenlauf #66 vorerst fehlt: Epi.Y*^^+Elefant.Z.6309.#663580845554522. Mit „808“ ist der Zufluss von sauerstoffarmen venösen Blut aus der Hohlvene des Körperkreislaufs enthalten, was die Annahme einer rechten Herzkammer unterstützt. Die paarige Hohlvene „8_2_808“ läuft in der Parallelepisode zu, in der sich parallel in der Leitepisode die Zitzen des Gesäuges bilden: Epi.Y*^^+Elefant.Z.6219.#673184041582808.
Der Herzbeutel (Pericardium) nimmt die Ursprungs- bzw. Mündungsabschnitte der Aorta, des Truncus pulmonalis, der Vena cava cranialis und caudalis und der Venae pulmonales auf. Der Herzbeutel besteht aus 3 Hautschichten (der Pleura pericardiaca, dem Pericardium fibrosum, der Lamina parietalis des Pericardium serosum). Beginnend mit einer Hautzeile „33“ werden 3 Zeilen „55“ gezählt, sofern 1x die Haut=3 enthalten ist: Epi.Y*^^+Elefant.Z.6211.#663370552147597; Epi.Y*^^+Elefant.Z.6212.#663265455418802; Epi.Y*^^+Elefant.Z.6214.#663055361831404. Herzbeutel in der Leitepisode: Epi.X*^^+Elefant.Z.6312.#655933540136725; Epi.X*^^+Elefant.Z.6313.#655829638102805; Epi.X*^^+Elefant.Z.6315.#655621932754237.
Die Leitepisode verliert im Zeilenfortschritt beim Übergang #655 zu #654999 eine Seitenwand der Herzkammer, so dass zur Herzbildung eine Herzwandgruppe 44_5 gebildet wird, die pauschal die Seitenwand liefert: Epi.X*^^+Elefant.Z.6320.#655103244516299. Die Parallelepisode bildet die vorhandene Furche „Sulcus terminalis“ aus. Anatomisch trennt die Furche den rechten Herzvorhof (Atrium dextrum) vom rechten Herzohr (Auricula dextra) und liegt zwischen den Ansätzen der Vena cava superior und der Vena cava inferior. Untere Hohlvene (Vena cava inferior) 888: Epi.Y*^^+Elefant.Z.6317.#662740470888631. Furche (Sulcus terminalis) 1115_88: Epi.Y*^^+Elefant.Z.6323.#662111585418865. Obere Hohlvene (Vena cava superior) 888: Für die linke Seitenwand der rechten Herzhälfte läuft die „5“ jetzt im Zeilenlauf mit, für die rechte Seite wird eine Wandgruppe 44_9_5 gebildet: Epi.Y*^^+Elefant.Z.6354.#658881264495354. Innerhalb dieses Bereich ist die Furche „Sulcus interatrialis“ vorhanden. Das Vorhofseptum (Septum interartriale cordis) ist eine dünne Wand zwischen dem rechten und dem linken Vorhof. Äußerlich wird das Septum als Sulcus interatrialis 0_222_2_7 sichtbar: Epi.Y*^^+Elefant.Z.6325.#661902222071697.
Der linke Vorhof (Atrium cordis sinistrum) nimmt das sauerstoffreiche Blut der Pulmonalvenen 8888 aus den Lungen über eine Lungenvenenöffnung auf. Bei den Säugetieren sind es 5 bis 8, meist 7 Venen. Davon kommen 2 Venen jeweils von den beiden Lungenflügeln, die weiteren sind ergänzende Äste der Venae pulmonale. Mit der Zählung „8_4_1“ können gemäß einer Herzskizze für einen Elefanten 4 große Venen gezählt werden. Für 1 kleine Vene „88“ wird eine gesonderte Zeile gebildet. Quersumme 4+1=5 Pulmonalvenen: Epi.X*^^+Elefant.Z.6324.#654688884462841 und Epi.X*^^+Elefant.Z.6325.#654585376338816. Die Lungenvenenöffnung (Ostia venarum pulmonarum) 9009 kann im Vorhof keinesfalls als Aorta=909 verstanden werden, sondern es gilt seitlich=9 als Lochrand: Epi.X*^^+Elefant.Z.6326.#654481900939458. Die Bikuspidalklappe (Mitralklappe) trennt den linken Vorhof vom linken Ventrikel (Herzkammer) und verhindert den Rückfluss durch die Öffnung „Ostium atrioventriculare sinistrum“. Die Klappe besteht aus 2 Klappensegeln, die als Öffnungssymbol gleichartig zunächst in 2 Zeilen 303 gebildet werden Zuerst im Zulauf von hinten (kaudal) das Segel „Cuspis parietalis“: Epi.X*^^+Elefant.Z.6338.# 653242743032977. Das Segel „Cuspis septalis“ liegt kanial und septumseitig: Epi.X*^^+Elefant.Z.6338.#653036672767036. Die beiden Ränder des Klappenschlitzes werden als Spalt 11 speziell abgedichtet, so dass noch ein weiteres Klappensymbol 202 folgt. Epi.X*^^+Elefant.Z.6341.#652933686381171 und Epi.X*^^+Elefant.Z.6344.# 652624922027586. An den freien Enden der Segel der Bikuspidalklappe sind Sehnenfäden (Chordae tendineae) befestigt, die mit zwei Papillarmuskeln (Musculus papillaris subauricularis und Musculus papillaris subatrialis) 9_5_9 verbunden sind, um das Zurückschlagen der Klappe zu verhindern: Epi.X*^^+Elefant.Z.6336.# 643295914441114. Zur Aortenklappe wieder zurück im Zeilenlauf!
Die Verbindung vom linken Ventrikel (Herzkammer) in die Aorta über die Öffnung (Ostium aortae) erfolgt über die Aortenklappe (Valva aortae). Die Taschenklappe (Semilunarklappe) enthält 3 Taschen: 1.) Valvula semilunaris sinistra (links=1, in Richtung nach kaudal) 606: Epi.X*^^+Elefant.Z.6351.#651905606257756. 2.) Valvula semilunaris septalis (rechts=2, in Richtung des Septum interatriale) 101: Epi.X*^^+Elefant.Z.6362.#650778451012733. 3.) Valvula semilunaris dextra (kranial, in Richtung des rechten Ventrikels) 505: Epi.X*^^+Elefant.Z.6364.#650573932329197.
Der rechte Vorhof (Atrium cordis dextrum) der rechten Herzhälfte nimmt das sauerstoffarme (venöse) Blut aus dem Körperkreislauf auf: 1.) Hohlvene „Vena cava cranialis“ an der Mündungsöffnung Ostium venae cavae cranialis 303: Das Loch ist der Vene „8“ gewidmet: Epi.Y*^^+Elefant.Z.6355.#658777585303459. 2.) Hohlvene „Vena cava caudalis“ an der Mündungsöffnung Ostium venae cavae caudalis 303: Für die Hohlvene wird gleichartig „303“ als Loch übernommen, die fehlende Vene ist als QS 4+1+3=8 zählbar. Epi.Y*^^+Elefant.Z.6370.# 657226303705413. 3.) Herzvenen [inkl. Vena azygos sinistra (Wiederkäuer/Schweine)] an der Mündungsöffnung „Ostium sinus coronarii“ 0_999_0_8: Epi.Y*^^+Elefant.Z.6432.#650891099907258. Die Mündung der eigenen Herzvenen liegt üblich unter dem Ostium venae cavae caudale, daher wurde die Reihenfolge der Hohlvenenlöcher angepasst. 4.) Venae cordis minimae entlässt das Blut der rechten Vorhofwand durch zahlreiche Löcher „Foramina venarum minimarum“ in den rechten Vorhof.
Das Blut der rechten Vorkammer strömt durch die Öffnung „Ostium atrioventriculare dextrum“ in den rechten Ventrikel (Herzkammer) und passiert dabei die Trikuspidalklappe in Funktion einer Segelklappe. Die Klappe enthält 3 Zipfel (Cuspes): 1.) Cuspis parietalis valvae atrioventricularis dextrae (außenwandseitig) 404: Epi.Y*^^+Elefant.Z.6451.#648974043497672. 2.) Cuspis angularis valvae atrioventricularis dextrae (zwischen beiden Zipfeln) 303: Epi.Y*^^+Elefant.Z.6456.#648471430390874. 3.) Cuspis septalis valvae atrioventricularis dextrae (zum Septum gerichtet) 202: Epi.Y*^^+Elefant.Z.6461.#64796959520252. Die 3 Zipfel entfalten sich durch den Zug der Papillarmuskel an den Sehnenfäden (Chordae tendineae). Papillarmuskel-Gruppe [Musculus papillaris subarteriosus; Musculi papillares parvi; Musculus papillaris magnus] 44_55: Epi.Y*^^+Elefant.Z.6495.#644577606559427. Sehnenfäden (Chordae tendineae) 444_111: 644478379711127. Im Zeilenlauf zurück zur Pulmonalklappe!
Die Pulmonalklappe (Valva trunci pulmonalis) ist eine Taschenklappe (Semilunarklappe), die während der Diastole den Rückfluss des Blutes in den rechten Ventrikel verhindert. Es sind 3 halbmondförmige Valvulae (Taschen) vorhanden. Die konvexe Fläche ist zum Ventrikel gerichtet, so dass die Rückseite eine Tasche bildet. Aufgrund des Füllgewichtes sind keine Sehnenfäden notwendig. 1.) Valvula semilunaris dextra (rechts-kranial) 404 mit mittiger Randverdickung 767: Epi.Y*^^+Elefant.Z.6495.# 648974043497672; 2.) Valvula semilunaris sinistra (kaudal) 303 mit mittiger Randverdickung 484: Epi.Y*^^+Elefant.Z.6495.# 648471430390874; 3.) Valvula semilunaris intermedia (links-kranial) 202 mit mittiger Randverdickung 969: Epi.Y*^^+Elefant.Z.6495.#64796959520252.
Die Herzkranzfurche (Sulcus coronarius cordis) zieht sich zwischen den Vorhöfen und den Herzkammern (Ventrikel) entlang. Die Furche liegt daher in beiden Episoden vor, wobei die Äste der Koronaarterien als Arterie=9 enthalten sein müssen: Epi.Y*^^+Elefant.Z.6460.#648069900093418; Epi.X*^^+Elefant.Z.6474.#639520003914583.
Passend zum mathematischen Phänomen des Elefanten-Codes sind die zum Ende hin fehlenden Herzwände „55“ auf die Zeilennummer selbst übergegangen, so dass sich in beiden Episoden die Biologie mit der „64“ für die gute Annäherung an den Kreis feiern kann. Übrigens sind 64 als Quersumme 6+4=10 und 10=5+5, so dass beide Wände vorhanden sind. Dann könnte das Herz in beiden Episoden in der Zeilennummer Z.6500 enden, in der das Herzvolumen als „500“ in der Zeilennummer erscheint.
Um den Herzbeutel unten zu schließen wird eine Hautmembran 33 benötigt. Weil diese aber um 1 Zeile versetzt vorliegt, bilden sich am Elefantenherz 2 Rundungen als 2 Herzspitzen:
Erste Herzspitze, Rundform 7_0: Epi.X*^^+Elefant.Z.6499.#637059933119404;
Zweite Herzspitze, Rundform 7_0: Epi.Y*^^+Elefant.Z.6501.#643982703369248.
Mit der #64# hat sich der BiXnom-Kreis geschlossen!
... Aber ohne Zehennägel können wir ihn nicht laufen lassen.
Zehennägel
Beim Elefantenfuß stellt die Wissenschaft Ähnlichkeiten mit Hufen und Klauen fest, so dass nur Menschen und Primaten Zehennägel besitzen. Der Fuß wird als Huf bezeichnet. Der Huf gliedert sich in Saum-, Kron-, Wand-, Sohlen- und Ballen-Segment. Jedes Segment besteht aus Lederhaut (Dermis / Corium) und Oberhaut (Epidermis), wobei bei einer Polsterung auch eine Unterhaut (Subcutis) vorhanden ist.
Augenscheinlich sind es aber Zehennägel, so dass nachfolgend der Fingernagel des Menschen [Fingernagel (Unguis digiti manus) / Zehennagel (Unguis digiti pedis)] als Vergleichsbasis gewählt wird, um den Zehennagel des Elefanten im Zeilenlauf zu erkennen. Ein Unterschied ist in der Art der Hornbildung zu erwarten, weil der Fingernagel beim Menschen „parallel über“ dem letzten Fingerglied liegt und beim Elefanten „senkrecht vor“ dem letzten Fingerglied herunterwächst und folglich eine Abgrenzung zur horizontalen Sohle benötigt. In der Draufsicht (Projektion) wirkt der herunter gewachsene Zehennagel abweichend von der wahren Länge sehr kurz.
Der Elefant ist mit seinen vertikalen Extremitäten zwar schnell, kann aber nicht springen und galoppieren. Vom Herz geht es senkrecht über die Zählgröße „225“ zum Fuß herunter. Analog zum Pferd können sich die Haut und das Horn ab #533 entwickeln. Der Fuß als Kombination aus Zehennagel, Sohlenhorn und einem großen Fußpolster benötigt beide Episoden. Dafür ist der Wertebereich ab #4999 geeignet. Mit räumlich=4 und Ende=9 ist der Zehennagel adressiert. Die 3 bis 5 Zehennägel werden nur an 1 Zehe entwickelt, so dass der Zehennagel dann nach Bedarf vielfach zur Verfügung steht. Die Zehenglieder (Phalangen) müssen sich durch eine Hautfurche voneinander abgrenzen. Das Projekt: “San Francisco 49ers“: Mit seitlich=9 steht seitlich eine Furche zur Abgrenzung zur Verfügung, wenn #49 in beiden Episoden vorliegt. Die Parallelepisode Epi.Y*^^+Elefant benötigt mit #50 (Null=Volumen bzw. Bogen) noch einige Zeit und kann mit der „Null“ noch die bogenförmige Ausrundung zu den Zehen als Übergangsform anlegen. In der Leitepisode bildet sich eine Haut-Gruppe. Epi.X*^^+Elefant.Z.7757.#533744038332217. Bemerkenswerte Zeilen in der Parallelepisode könnten Haare „111111_3_51_3“ mit Epi.Y*^^+Elefant.Z.8096.#517111110993513 und die Felderhaut „4“ betreffen: und Epi.Y*^^+Elefant.Z.8234.#508444444328817. Im Ergebnis liegt schließlich zum Zehennagel eine Zehennagel-Gruppe „5_44“ vor, in der ein Zehennagel „1“ am Zehenende=9 entweder für den „Afrifanten“ 4-fach oder alternativ für den „Indifanten“ 5-fach ausgeführt wird. Weil die Zeilenposition schon die Hinterextremitäten passiert hat, gilt die Aussage für den Vorderfuß (Hinterfuß jeweils 1 Nagel weniger) „4_919_5“. Die Zehennägel werden am Fuß zusammengeführt, indem die Zehennägel gegeneinander durch einen Spalt „1“ und in der Hautoberfläche durch eine Hautfurche „0“ abgegrenzt werden mit „0_1_55_1_0“: Epi.X*^^+Elefant.Z.8416.#491950155102544.
Der Beginn des Zehennagels liegt am Ende der medialen Phalanx II, jedoch dicht unter der Hautoberfläche. Der Zehennagel soll nunmehr ähnlich wie beim Menschen entstehen. Statt geradeaus muss sich der Zehennagel beim Elefanten an der Zehenspitze vor dem Fuß nach unten eindrehen. Durch diese Drehung um die distale Phalanx III ist diese nur noch im entfernten Hintergrund als Drehpunkt in einer Zeile „225“ aktiv.
Die Hornbildung erfolgt beim Menschen flächenhaft in der Matrix, wobei sich die Nagelplatte durch nachwachsendes Horn zum Nagelrand vorschiebt. Beim Elefanten muss das Wandhorn vermittelt über Blättchen-Lamellen im Winkel von 90° als Röhrchenhorn herunter wachsen. Beim Pferd liegt dann noch das von oben herunter wachsende Saum- und Kronhorn vor dem Wandhorn. Beim Elefanten werden sich die Hornarten wahrscheinlich gegenseitig ergänzen. Die flächenhafte Hornbildung ist nicht zu erkennen, weil der Zeilenlauf dazu quer verläuft. Wird die Quersumme gebildet, kann die Fläche indirekt mit erfasst werden.
Stecksehne (Digital extensor tendon) „11“: Die Strecksehne im Bindegewebe 33 wird oberseitig an der Phalanx II befestigt: Epi.X*^^+Elefant.Z.8340.#496433154117867. Mediale Phalanx II „225“: Epi.X*^^+Elefant.Z.8344.#496195170822508. Gelenk (Articulatio interphalangea distalis) „3303“: Das Projekt: “San Francisco 49ers“ ist mit 49_49 integriert, so dass der einzelne Zeh vom benachbarten Zeh seitlich abgegrenzt ist. Die Parallelepisode wird nicht benötigt, so dass es sich um eine innere Abgrenzung handelt. Die Abgrenzung „49“ wird nochmals als Quersumme angezeigt. Die Breite der Nagelwurzel ist natürlich schmaler als die Zehenbreite. Mit der Quersumme=1+6+8+3+3+0+3+4+9+8+4=49 folgt die Schreibweise „49_60_49“, d.h. einerseits wird das Konzept zur seitlichen Begrenzung der Zehe durch den Zeilenlauf „#49“ bestätigt und gleichzeitig wird mit Zeit=60 das ständige Wachstum des Zehennagels adressiert: Epi.X*^^+Elefant.Z.8347.#496016833034984. Am Huf des Pferdes beginnt die Lederhaut (Dermis / Corium) am Wandsegment mit einer Übergangszone direkt am Knochen. Beim Elefanten liegt jedoch noch die Unterhaut dazwischen, die ein dickes Fußpolster über dem Knochen bildet. Zur Versorgung der Lederhaut wird darin ein Gefäß-Netzwerk 44_8 (Arterie 5+0_0+3+1=9, Vene=8) und ein Nerven-Netzwerk 44_77 hinter der Nagelwurzel mittels der Parallelepisode angelegt. Mit der Verbindung 1_44 ist die Haut an dieser Stelle noch behaart „1“: Epi.Y*^^+Elefant.Z.8348.#501501144538031; Epi.Y*^^+Elefant.Z.8349.#501441077327043. Unterhaut (Subcutis) 33: Das Projekt “San Francisco 49ers“ ist als Spiegelung 49_94 in der Leitepisode enthalten. Mit dieser 90°-Drehung kann man blind in die Unterhaut gelangen, ohne unten und oben jeweils eine Sehne zu erblicken: Epi.X*^^+Elefant.Z.8350.#495838623394372. In der Parallelepisode verzweigt die Strecksehne (Digital extensor tendon) „11_11“ und zieht oberseitig zur distalen Phalanx III weiter. An dessen Unterseite wird die Oberflächliche Fingerbeugesehne (Superficial digit flexor tendon) „111“ befestigt. Der Bereich #50 geht im Countdown zu #500 über, womit das Fußpolster über der Zehe noch weiter verstärkt wird, bis am Ende mit #4999 als Barriere das Horn zur Sohle senkrecht herunterwächst: Epi.Y*^^+Elefant.Z.8354.#50114095697911; Epi.Y*^^+Elefant.Z.8358.#500901119239469. Die Lederhaut verläuft genau quer zum Scann im Zeilenlauf und bildet in der Leitepisode eine Quersumme =2+3+1+3+2+6+8+8=33. Blut ist mit Eisen=26 optimal enthalten, weil das Gefäßnetzwerk einbindet. Lederhaut: Epi.X*^^+Elefant.Z.8358.#495364023132688. Gefäßnetzwerk nochmals als „99“ und Quersumme „9“ in der Haut 3_QS 1+8=9_3: Epi.X*^^+Elefant.Z.8360.#495245514993183. Der Scann steht immer noch hinter der distalen Phalanx III - die Bildung des Zehennagel kann beginnen. Wenn sich der Scann eindreht, wird er als gerade Folge dargestellt.
In beiden Episoden ist mit „500“ ein Volumenkörper enthalten, der beim Menschen die Nageltasche (Sinus unguis) bildet, in der die Nagelwurzel (Radix unguis) steckt. Eingesteckt ist 8_66_8, wobei sich die „66“ auch als Quersumme in der Parallelepisode ergibt. Der Schwefel=16 zeigt hartes Horn an. Zunächst muss dieses Element aber durch die Basalmembran als Grenze zwischen Lederhaut und Epidermis geschleust werden. Die Basalmembran „333 oder ähnlich“, muss sich irgendwo in der Quersumme verstecken. Diese ist nicht vorhanden, so dass die „66“ beidseitig halbiert werden muss zu „3333_3333“: Epi.X*^^+Elefant.Z.8364.#495008668740197; Epi.Y*^^+Elefant.Z.8364.#500541792755079 mit QS= 7+9=16=Schwefel und QS=5+0+0+5+4+1+7+9+2+7+5+5+7+9=66. Der aus der Nageltasche frei herausragende Teil der Nagelplatte (Unguis) wird als Nagelkörper (Corpus unguis) bezeichnet. Das Dach der Nageltasche wird vom Nagelwall (Eponychium) gebildet. Beim Menschen legt sich das Nagelhäutchen (Cuticula) aus abgestorbenen Zellen des Eponychium auf den Nagelkörper, so dass die Nageltasche beim Menschen abgedichtet ist. Weil sich der Scann an der Zehenspitze eindreht, ist beim Elefanten ein Luftspalt vorhanden. Außer der seitlichen, äußeren Zehenabgrenzung mittels Projekt “San Francisco 49ers“ zieht die Evolution als „Plagitor“ einer menschlichen Idee damit die unsichtbare Nageltasche über die Nagelbreite im Zeilenlauf in die Länge „49494949“. Diese Zahlenkette schrumpft über Quersummen zur Form=4+9+4+9+4+9+4+9=52=5+2=7 und Haut=3 mit 9_3_9 (2+5 und 7 auch extra enthalten): Epi.X*^^+Elefant.Z.8365.#494949492569397. Die verdeckte Seitenbegrenzung der Nageltasche wird am sichtbaren Nagelkörper durch den Nagelfalz (Sulcus matricis unguis) als seitliche Begrenzung fortgeführt. Diese Rinne zwischen Nagelwall und Nagelkörper entsteht beim Menschen, weil sich die Nagelplatte stark wölbt, um sich der Form des Fingerknochens anzupassen. Der Boden der Nageltasche wird beim Menschen von der Nagelmatrix gebildet, in der die Zellen zur Bildung von Keratin für die Nagelplatte enthalten sind. Die Zellen verlieren ihren Zellkern und bilden feste, verklebte Hornlamellen in der Dicke von 100 - 150 Schichten. Das Ende der Nagelmatrix zeichnet sich als helles Möndchen (Lunula) auf dem durchsichtigen Nagelkörper ab, weil die vorderen 4/5 des Nagels aufgrund der durchscheinenden Blutgefäße rosa erscheinen. Beim Menschen ist das Möndchen mindestens am Daumen erkennbar. Das Elefanten-Horn ist dicker, pigmentiert und die Hornbildung andersartig, so das kein Möndchen durchscheint.
Die Saum-Haut „0_33_0“ wird als voluminöse räumliche Struktur „5_4_5“ als Nagelwall (Vallum unguis) angelegt, kann dann aber erst beim Zeilenvorschub mit 49_489 mit 8 als Extra auch seitlich neben der Nagelplatte gebildet werden. Dieses Weichteilgewebe wird auch als Paronychium bezeichnet. Der Nagelwall gehört beim Elefanten zum Saumsegment. Das aus der Tasche herauswachsende Horn gehört zum Kronsegment. Das Horn vorn an der Zehenspitze stammt innenseitig aus dem Wandsegment. Nagelwall: Epi.X*^^+Elefant.Z.8366.#494890330545423.
Bevor sich der Nagelwall (Paronychium) auch seitlich bilden kann, muss zunächst am Rand der Nagelplatte ein Nagelfalz (Sulcus matricis unguis) „11“ entstehen. Zwischen den beiden Nagelfalzen zeigt sich die gewölbte Nagelplatte „202“: Epi.X*^^+Elefant.Z.8367.#494831182663202. Mit „20“ und „4_9_4“ als unterhalb der Nagelplatte wird die Verschiebeschicht (Hyponychium) adressiert, die als Haut mittels der Quersumme=4+9+4+7+7+2=33 erkennbar ist. Das Hyponychium ist ein mehrschichtiges unverhorntes Plattenepithel, das die Nagelplatte mit dem bindegewebigen Nagelbett (Lectulus unguis) verbindet: Epi.X*^^+Elefant.Z.8367.#494772048917664. Nachdem der Zehennagel als Nagelkörper sichtbar wurde, kann sich die Nagelhaut (Cutikula) auf den Zehennagel schieben. Die Cutikula ist eine dünne Schicht abgestorbener Epithelzellen am Rand des Möndchen (Lunula) „303“. Die Zellen sind vom Rand der Nageltasche aus dem Eponychium entstanden. Die Cutikala ist auf beiden Seiten „29_29“ mit dem Nagelwall (Perionychium) verbunden. Cutikula: Epi.X*^^+Elefant.Z.8369.#494712929303741. Das Möndchen ist der Bereich des Hornbildung in der darunter liegenden Matrix, so dass nunmehr für die Hornfestigkeit Schwefel=16 vorliegt, der die Keratinketten zusammenhält. Hornbildung: Epi.X*^^+Elefant.Z.8370.#494653823816369. Das beim Elefanten auf dem Knochen liegende Unterhautpolster rundet sich in der Parallelepisode zur Fußspitze mit „50000“. Der enthaltene Schwefel=16 muss zur Epidermis nach vorn durchgeschleust werden: Epi.Y*^^+Elefant.Z.8373.#500003768613816. In der Leitepisode wird die distale Phalanx III als Drehpunkt „5_0“ des Zeilenlaufs als Zählgröße „225“ sichtbar. Der Knochen wird an der Zehenspitze von keiner Unterhaut bedeckt: Epi.X*^^+Elefant.Z.8379.# 494122509290250. Die Lederhaut als der lebende Teil baut sich mit Übergangsschichten an der Zehenspitze auf. Die Lederhaut besteht aus 2 Schichten. Unterseitig (hier vertikal vor dem Knochen) liegt die Netzschicht (Stratum reticulare) 44_35: Epi.X*^^+Elefant.Z.8380.#494063544790335. Mit „4004_1_4_1_4“ wird die netzartige „4“ Ausrichtung der Kollagenfaserbündel und die Bildung von Spannungslinien (Spaltlinien) „1“ im Gewebe symbolisiert. In folgenden Zeilen sind Gefäße (8/9) und Blut „26“ vorhanden: Epi.X*^^+Elefant.Z.8381.#494004594361414. Kollagenfaserbündel als „4_10“. Epi.X*^^+Elefant.Z.8383.#493886735696410. Zapfenschicht (Stratum papillare) 33: Epi.X*^^+Elefant.Z.8385.#49376893325498. Zapfen „100_3_10_55_3“ zur Verbindung mit der Epidermis: Epi.X*^^+Elefant.Z.8386.#493710053105534. Die Basalmembran zwischen Lederhaut und Epidermis versteckt sich in der Quersumme 33_QS=4+9+2+4+0+5+9=33 als 33_33, weil sie nicht in einer Schichtenfolge passiert wird, sondern beim Scann selbst durchfahren wird: Epi.X*^^+Elefant.Z.8386.# 493592334924059. Weil die Basalmembran die hervorstehenden Zapfen umringt, erfordert der kurvige Verlauf als Symbol der Breite noch eine 2. Zeile „33“: Epi.X*^^+Elefant.Z.8389.# 493533496881989. Beim Menschen liegt der epithelialen Verschiebeschicht (Hyponychium) eine oberste Zelllage auf, die das distale Wachstum der Nagelplatte begleitet. In der Darstellung würde „1“ oberste Zelllage des Hyponychium die „100“ Hornlagen der Nagelplatte begleiten: Epi.X*^^+Elefant.Z.8391.#493415862870100. Ein Zeithinweis über die „Dauer der Begleitung“ bzw. das Hornwachstum ist nicht erkennbar. Diese Vorzeile des Hyponychium „33“ ist aber als Referenzeile notwendig, um aus der Zeilendifferenz ein Symbol für die Verschiebung zu gewinnen. Hyponychium „33“: Epi.X*^^+Elefant.Z.8392.#493357066890254. Die Zeitdifferenz „58_79_5_97_98463“ enthält eine Spiegelung als Begleitsymbol. Hornwachstumsrate: Vorderfuß „Indifant“ = 7 - 8 mm / 28 d wie beim Pferd. Weniger beim „Afrifanten“ und generell beim Hinterfuß, aber mehr als 4 mm /28d bei Rindern. Mensch: ca. 3 mm/28d. Im Schichtenaufbau folgt das Horn der von oben herunter wachsenden Nagelplatte, die bereits als „202“ adressiert wurde. Epi.X*^^+Elefant.Z.8396.#493122023027990. Schwefel=16 ist in der Folgezeile sowie als QS 4+9+3=16 enthalten: Epi.X*^^+Elefant.Z.8397.#493063297051686. Beim Menschen wird jeder Finger jeweils durch 2 Nervenbündel „77“ und 2 Gefäßbündel „99“ auf der Beugeseite bis in die Fingerkuppe versorgt. Wird auch der Knochen „22“ als Doppelziffer ignoriert, liegen die Bündel über die Quersumme =4+9+4+2+5+6+1+2= 33 in der Haut - unterseitig ist eine Unterhaut (Subcutis) vorhanden: Epi.X*^^+Elefant.Z.8411.#49224259961277. Diese Bündel sind auch zeitgleich in der Parallelepisode als Netzwerk 44 und als Dopplung “9_7_00_9_7“ enthalten. Epi.Y*^^+Elefant.Z.8411.#497744804970097. Die Nagelplatte ist (wie eingangs erläutert) fertiggestellt: Epi.X*^^+Elefant.Z.8416.#491950155102544.
Experimentell liegen zwischen der medialen und der distalen Phalanx Z.8379-Z.8344=35 Zeilen und der Aufbau der Nagelbetts benötigt von der Lederhaut bis zur distalen Phalanx als Drehpunkt Z.8385/Z.8386 - Z.8379= 6 bis 7 Schichten, so dass der Einfluss der Scann-Drehung einen Winkel Arctan (35/7 bis 35/6)=78,69°- 80,27° bildet, der zufällig der Neigung des Zehennagels beim „Indifanten“ entspricht; realer Winkel 72° – 79°. Beim „Afrifanten“ ist der noch Winkel etwas steiler.
Beim Menschen wird der Hautübergang vom Nagelbett (Lectulus unguis) am freien Nagelrand in die Finger- bzw. Zehenkuppe als „Nagelsaum“ bezeichnet. Am Huf ist der Begriff „Saum“ dagegen am oberen Nagelanfang am Ende der behaarten Haut zu verorten. Im Vergleich zum Menschen, bei dem die Fingerkuppe (Fingertip) die Vorderseite des Fingers abrundet, dreht sich dieser Bereich mit dem Zehennagel um 90° auf die Standfläche. Hier ist dann entsprechend der Dicke des Zehennagels ein Tragrand vorhanden. Die Verschiebeschicht unter dem Zehennagel wird beim Elefanten als „Weiße Zone“ bezeichnet, die sich an der Sohle wie beim Pferd als Linie abzeichnet. Diese weiße Linie bildet die Grenze zum Sohlensegment. Beim Pferd hat aber nicht die weiße Linie (Nagellinie für den Hufschmied) eine weiße Farbe, sondern die Grenzschicht im Sohlenelement. Das Sohlenelement ist vergleichsweise nur eine kleine Fläche, die jeweils die Fingerkuppe eines Fingers auf der Standfäche als Abdruck hinterläßt. Die große Standfläche des Elefantenfusses ist somit nicht die Sohle, sondern die „Pelotte“, mit der das Ballensegment bezeichnet wird. Die Sohlensegmente gehören jeweils zur Zehe, werden durch das Ballensegment verbunden und zu einer großen kreisförmigen Aufstandfläche erweitert. Die seitliche Begrenzung der Zehen und der Nagelplatte wird durch das Projekt “San Francisco 49ers“ realisiert. Die beiden Seiten können nunmehr unter den Fuß in einem Punkt „49_0_49“ zusammengezogen werden, um zugleich am Boden das Sohlensegment zu umgrenzen. Die Haut 3 ist als seitlich=9 markiert 9_3_9: Epi.X*^^+Elefant.Z.8460.# 489391549094918. Die Abgrenzung der kleinen Sohlenfläche hinter dem Tragrand der Nagelplatte gegenüber der großen Standfläche zeichnet sich durch eine Furche ab. Vorhanden sind eine Hautabgrenzung 9_333, eine Form „7“, eine Linie „1“ und „0__0“ als Furche: Epi.X*^^+Elefant.Z.8461.#489333708231061. Die Last wird vom Tragrand und vom Sohlensegment übertragen.
Die „Pelotte“, gemeint ist das große Ballensegment, ist von den einzelnen Zehen unabhängig. Am Vorderbein mit 5 Zehen wird das Ballensegment kreisrund gebildet. Das „Kreisform-Signal“ kann wie beim Herz des Elefanten nur durch die Zahl „64“ in der Zeilennummer Z. 8464 als „Freudensignal“ der Biologie aufgerufen werden. Zur Bestätigung ist die Zahl „64“ in der Zeile zusammen mit der 444 als Zehen-Gruppe enthalten. Als Quersumme ergibt QS 6+4=10, so dass eine Besonderheit bei einem 10er Bixnom-Schwingkreis entsteht. Blut mit Eisen=26 und Horn mit Schwefel=16 sind vorhanden. Beim Pferd wurde „weiches“ Horn für den Ballen mit Bezug auf einen 6-eckigen Benzol-Ring als 606 erkannt, der an dieser Position jedoch nicht vorliegt: Epi.X*^^+Elefant.Z.8464.#489160267644495. Gleichzeitig liegt in der Parallelepisode das Projekt “San Francisco 49ers“ vor, bei dem in jeder folgenden Zeile als Rundlauf #494 zur Bildung des runden Ballens vorhanden ist. Der Rundlauf ist mit „494“ gegenüber einer beidseitigen Längsabgrenzung „49_49“ erkennbar. Die Zeile beinhaltet die Startposition an der kreisrunden „0“ Abgrenzung der vertikalen, behaarten „111“ Körperhaut QS=4+9+4+6+2+8=33 vom horizontalen Ballen über 3 Zeilen: Epi.Y*^^+Elefant.Z.8464.#494628019211186. Rundlauf 707 als Kreisform 0_7: Epi.Y*^^+Elefant.Z.8465.# 494569587076607. Die Behaarrung 111 wird erneut angezeigt, so dass der Kreis umfahren wird. Weiterhin doppelt als QS 4+5=9=seitlich: Epi.Y*^^+Elefant.Z.8466.#494511168745982. Die Ballenfläche entsteht als Gruppe 44_64_44, die mit der enthaltenen „64“ rund ist, und mit der Zählgröße „1“ in „1_44_1“ alle vorhandenen Zehen einschließt: Epi.Y*^^+Elefant.Z.8466.#494452764214419. Der Ballen umschließt die mittleren Zehen (II, III und IV) jeweils bestehend aus 3 Zehengliedern (Phalangen) und die beiden äußeren Zehen (I und V) jeweils bestehend aus 2 Phalangen. Die Zusammenführung wird am Ende der Serie „494“ als Kreisgruppe „0_44“ abgeschlossen. Die Anzahl der (3*3)+(2*2)= 13 Phalagen am runden Ballen ist gespiegelt „31“ enthalten. Der Ballen der Hinterextremitäten ist mit weniger Zehen nur oval geformt: Epi.Y*^^+Elefant.Z.8474.# 494044318456866. In der Leitepisode wird die Ballenoberfläche durch Furchen rauh gestaltet und liegt dann als runde Form „7000“ vor. Mit „2_5“ für „13“ Phalangen wird der Ballen paarig an den Vorderextremitäten angelegt. Der Zeilenlauf kann die Hinterextremitäten nicht mehr direkt erreichen. Offensichtlich ist eine Rückwendung möglich, indem die Zeilennummer Z. 8484 gespiegelt wird als Zeile Z.4848, denn dort sind die distalen Phalangen gerade fertiggestellt, um den Ballen an den Hinterextremitäten gleichartig und insgesamt „4“-fach auszuführen. Die Spiegelung von Zeilennummer „xx84“ zum Zifferncode „#48“ ist codiert: Epi.X*^^+Elefant.Z.8484.#488007131700025. Das streng mathematisierte Grundsystem des Bauplanes zeigt sich u.a. an den vertikalen Extremitäten und am Zifferncode des Bauchnabels.
BiXnom_Elefant_dat14.11..2021
Ameisen
Ameisen und Elefanten können ohne Verwendung ihres vorderen Organs (Fühler / Rüssel) nicht existieren. Der Elefant setzt sich aus der Leitepisode TIME.EPI.X.Lebewesen = TIME.EPI.ADAM + [(TIME.EPI.BIX-TIME.EPI.ADAM) * Artenfaktor] und der Parallelepisode in der Sonderversion TIME.EPI.Y.Lebewesen = TIME.EPI.EVA + (TIME.EPI.XIB * Artenfaktor) zusammen. Beim Sonderfall entfällt der Selbstbezug „EVA*Artenfaktor“ im Standardfall TIME.EPI.Y.Lebewesen = TIME.EPI.EVA +[(TIME.EPI.XIB-TIME.EPI.EVA) * Artenfaktor]. Bei den Insekten mit einem Artenfaktor „Minor^3“ bildet sich mit der Leitepisode „X“ eine Biene als Hautflügler und in der Sonderversion „Y“ mit einer gedehnten Zeitspanne durch eine modifizierte Interpolationsformel die Spinne. Diese Sonderversion setzt sich zu den Säugetieren fort, die beide Episoden zur Skelettbildung benötigen. Die Ameise ist wie der Elefant hochgradig mathematisiert und kann als Übergangsfall (!) noch die Standardepisode nutzen: TIME.EPI.Y!Ameise = TIME.EPI.EVA +[(TIME.EPI.XIB-TIME.EPI.EVA) * Minor^3]. Eine Kettenreaktion als feinere Abstufung durch Bixnom-Schwelle und Bixnom-Biokugel ist nicht erforderlich. Die Ameise verheizt folgende Startzeit: TIME.EPI.Y!Ameise = 0,000448093183143703.
Die Ameisen (Formicidae) sind eine Familie in der Klasse der Insekten (Insecta) und gehören zur Ordnung der Hautflügler (Hymenoptera), zu der auch die Bienen gehören. Die Insekten werden in 7 Ordnungen gegliedert und sind die artenreichste Klasse im Tierstamm der Gliederfüßer (Arthropoda). Bekannte Ameisenarten sind die Gelbe Wegameise (Lasius flavus), die Schwarzgraue Wegameise (Lasius niger) und die Rote Waldameise (Formica rufa). Die weibliche Königin und die Männchen (Drone) werden mit Flügeln geboren und sind doppelt so groß wie die sterilen Arbeiter*innen. Auf dem Hochzeitsflug wird die Königin begattet, füllt dabei ihre Samenblase als Lebensvorrat mit Spermien, beißt sich die Flügel ab und legt fortan viele Jahre Ameiseneier ab - das Leben der Drohne endet dagegen.
Zunächst wird eine Übersicht der Bereiche Kopf, Thorax, Stielchen und Hinterleib angelegt...
Kopf (Caput): Die beiden Fühler (Antennen) sind das wichtigste Sinnesorgan. An den Geißel sitzen eine Vielzahl von Sensillen zur diversen Wahrnehmung. Die Antennen dienen dem Sozialverhalten bei der Kommunikation durch Beklopfen von Artgenossen (Betrillern), dem Paarungsverhalten und der Weitergabe von flüssiger Nahrung (Trophallaxis). Die Antenne erhält durch ein Knie eine zweiteilige, gekniete (geniculat) Winkelform mit der Antennengeißel (Flagellum) und dem hinteren Antennenschaft (Scapus /Basalglied), das in einer Antennengrube gelenkig verankert ist. Die beiden Antennen werden als Gruppe „44“ gebildet, so dass die Geißel aus einem Schaft heraus entstehen kann. Die Antennengeißel „1“ mit Haut=3 ist paarig 3_1_8_3_1 angeordnet. Die Restgröße soll den Antennenschaft avisieren. Mit „44_8“ stellt die Zahl 8 die Gesamtgruppe QS 4+4=8 dar. Die halbe Gruppe „4“ (Geißellänge=Schaftlänge) ist damit der Schaft in „4_37030, der am Kopf in einer Grube gelenkig verankert ist: Epi.Y!Ameise.Z.1#4480931831437030. Der Antennenschaft ist als Knie angeschlossen in dem die Gruppe 44/2 = 22 halbiert adressiert wird. Der Anschluss am Kopf erfolgt mit einem Kugelgelenk „404“. Die Zahl 2 für paarig ist als Z.2 und als Zahl 5_2 enthalten: Epi.Y!Ameise.Z.2#2240465915718520. Der Bixnom-Kreis „64“ wird mit Haut=3 und seitlich=oben=9 markiert, um den vollen Aktionsradius „93_64_39“ der paarigen Antennen 43_QS 8+1+2=11_34 zu adressieren. Die QS 1+4+9+3+6+4+3+9+4+3+8+1+2+3+4=64 bestätigt dieses. Die Zählgröße „11“ bestimmt die häufigste Anzahl von 11 (real 9 bis 13) Antennensegmenten (Funiculus): Epi.Y!Ameise.Z.3#1493643943812340. Die Antennengeißel (QS 2+9=11) wird mit „11“ Segmenten und einem Gelenk „202 (50% von 404)“ am Antennenschaft paarig 29_5_78_5_92 angeschlossen: Epi.Y!Ameise.Z.4#1120232957859260. Unterhalb der Fühler sitzt das Kopfschild (Clypeus) unpaarig in Kopfmitte. Die Z.5 bildet eine Struktur-5. Eine Ziffer 2 bzw. eine Symmetrie fehlen, so dass unpaarige Schild als Form 74_0_7 adressiert wird und in der Folgezeile erneut mit der Zahl 74 (QS 7+4=11). Als erkennbare Form wird manchmal ein senkrechter Mittelgrat als Symmetrie 19_7_19 ausgebildet. Beide Zeilen enthalten mit 628 und 682 eine Ähnlichkeit, die auf die Oberlippe hinweisen kann, die sich hinter dem Clyperus versteckt. Epi.Y!Ameise.Z.5#896186366287407 und Epi.Y!Ameise.Z.6#746821971906172. Die Oberlippe (Labrum) „1_33_11“ wird mit oben=9 in der Ruhelage aufgeklappt und zurückgeschlagen, so dass 2 Zeilen gebildet werden, die beide die Bixnom-Kurve „64“ zum Aufklappen und Schließen enthalten. Ein Zählgröße 11 ist in QS 5+6=11 bzw. in QS 2+9=11_6=flexibel_QS 2+9=11 enthalten. Die Spiegelung 92_96_29 weist auf die dazugehörige Maxillardrüse hin, deren Ausführungsgänge 11 sich im Mundraum zu einem Büschel vereinigen. Die Drüse erscheint daher erst nach dem Oberkiefer. Restgröße QS 7+8+9=24=Zeit. In der Vorderansicht wird die untere Kante durch 2 konvexe Halbkreise gebildet, so dass sich ein mittlerer Spalt bildet. In diese wellige Kontur kann sich als Gegenform der Unterkiefer (Maxillen) mit dem rechten und linken Stapes (Stamm) einpassen: Epi.Y!Ameise.Z.7#640133118776719 und Epi.Y!Ameise.Z.8#560116478929629.
Als Mundwerkzeug ist eine Kaulade ausgebildet, die vergleichsweise beim Menschen durch den Unterkiefer=Mandibula gebildet wird. Die Kaulade bewegt sich bei der Ameise nicht vertikal, sondern horizontal und scherenartig durch ein Paar vom „Mandibeln (ähnlich dem Wort Mandibula)“. Gleichfalls seitenverkehrt wird bei der Ameise der Unterkiefer=Maxillen bezeichnet, bei den Säugetieren ist Oberkiefer=Maxilla. Der Oberkiefer wird von dem scherenartigen Mundwerkzeug (Mandibel) gebildet, das als Kaulade QS 1+4=5_Zeit=60_QS 1+4=5 funktioniert und als harte Struktur „115“ adressiert ist. Die Dracula-Ameise kann die Scheren zum Aufbau einer Federspannung gegeneinander pressen. Beim Wegschnippen wird die höchste Geschwindigkeit im Tierreich von 90 m/s erreicht: Epi.Y!Ameise.Z.9#497881314604115. Die Zeile Z.10 ähnelt der Zeile Z.1, so dass die Mandibel ebenfalls vor dem Kopf beginnen. Im Grundtyp sind die paarige Mandibel 31_8_31 mit 8 Zähnen „1“, dreieckig als Schaufel 3_7_0_3 geformt. Bei anderen Gattungen sind die Mandibel zangenartig verlängern und tragen am Kaurand ggf. mehr Zähne: Epi.Y!Ameise.Z.10#448093183143703. Mit der Zeilennummer Z.11 als Zählgröße sitzen an den Mandibel maximal 11 Zähne „22_1_5“ je Seite. Sind mit 0(Null) keine Zähne vorhanden, wird diese Ameisengattung ggf. als Skalve gehalten: Epi.Y!Ameise.Z.11#407357439221549. An den Zähnen „1“ werden die Spitzen mit oben=9 markiert 5_9_5, so dass dort Zink=30 eingelagert wird: Epi.Y!Ameise.Z.12#373410985953086. Zum Öffnen und Schließen der Mandibel werden 2 Muskeln „55“ benötigt. Dieser ist statt „55“ als offen „5_5“ mit flexibel=66 und seitlich=9 als Ansatz am geschlossen Mandibel als physikalische Funktion „63“ und als Gruppe 44 mit dem Öffnungsmuskel 5_669_5 adressiert: Epi.Y!Ameise.Z.13#344687063956695. Der Schließmuskel „55_9“ ist mit der Zeit=60 und statt 90 m/s nur mit 88 m/s markiert als „3_88_3_60“: Epi.Y!Ameise.Z.14#320066559388360. Die paarige „2“ Maxillardrüse „88“ über der Mundhöhle liefert ein Verdauungssekret 87_2_87_88 mit der Zeit=24: Epi.Y!Ameise.Z.15#298728788762469. Schlund „800_5_8“: Epi.Y!Ameise.Z.13#280058239464815.
Die Ameisen verarbeiten flüssige Nahrung, die über den Schlund (Pharynx) „8005“ in den Körper gelangt. Als Speiseröhre (Ösophagus) wird dieser Schlauch erst hinter dem Kopf bezeichnet. Der Schlund krümmt sich nach hinten, weil noch keine Ziffernfolge für die Schlundöffnung an der Mundhöhle vorliegt: Epi.Y!Ameise.Z.16#280058239464815. Der Schlund zieht vertikal zum Kopf, so dass hier Drüsen und das Gehirn folgen. Dieser Bereich wird zunächst umgangen, indem nach der Mundhöhle gesucht wird. Eine Schlundöffnung „808“ liegt am Kopf nicht vor, so dass eine Form 8_QS 1+4=5_714_8 als Gruppe 44 gebildet wird, mit der in die Schlundöffnung eine Mundhöhle (Infrabuccaltasche) integriert wird. Die Nahrung wird in der Infrabuccaltasche gesammelt, dann wieder ausgespuckt und von der benachbarten Schlundöffnung übernommen.
In der Vertikale des Scanns dazwischen die Pharynxdrüse: Oberhalb der Mandibulardrüse bildet sich in der Pharynxregion am Vorderdarm ein paarige Ausstülpung als Pharyngealdrüse (Pharynxdrüse). Von den beiden Säcken geht ähnlich einem Handschuh jeweils eine fingerartige Verzweigung aus, die sich vor und über dem Gehirn ausbreitet. Die Pharynxdrüse besteht aus ca. 20 (gemäß Quelle) fingerähnlichen Röhren, die eine gelbe, ölige Substanz enthalten. Die Aussackungen sind mit der Haut 33 als Zeilennummer Z.33 adressiert. Im Sandwich der Haut 33 werden die Form-7, der Verdauungstrakt „8“, der Sack=0, das Volumen=50 und der paarige Sack (rund QS=64) als 85_85_0 adressiert: Epi.Y!Ameise.Z.33#135785813073850. Die Drüsenschläuche werden als Zahlgröße „11“ und die Anzahl von 20 Stück als paarig markiert „2_20_2“: Epi.Y!Ameise.Z.38#117919258722027. Der 20 Drüsenschläuche 11_20 werden paarig 2_3_2 als Drüsenform „78“ nach oben=9 als 95_78_59 ausgerichtet: Epi.Y!Ameise.Z.40#112023295785926. Die 20 Drüsenschläuche in Drüsenfunktion 888 und Substanz 66, paarig 53_QS 1+2+9+4=16=gelb wie Schwefel_53: Epi.Y!Ameise.Z.41#109291020278952 und Epi.Y!Ameise.Z.42#106688853129453.
Die Mundhöhle zeigt sich dann später als Struktur-5 „714“: Epi.Y!Ameise.Z.55#814714878443097. Statt einer engen Schlundöffnung „808“ wird die Öffnung breiter als 800_QS 1+6+6+3+9+8+4+7=40_8 seitlich ausgedehnt „99“, wobei ein Raum QS 4_0 integriert ist: Epi.Y!Ameise.Z.56#800166398470899. Die Schlundöffnung 80_181 selbst ist nochmals speziell enthalten, worin mit „181“ ein senkrechter Abgang adressiert ist: Epi.Y!Ameise.Z.57#786128391480181. Die Mundhöhle 4_0 benötigt eine Öffnung „040“ und ein Volumen „714_3000_6=flexibel“, wobei die „714“ für die Mundhöhle aus Z.55 enthalten ist: Epi.Y!Ameise.Z.58#772574453696040 und Epi.Y!Ameise.Z.59#59479971430006. Als weitere Strukturen folgen Unterkiefer (Maxillen) und Unterlippe (Labium). Die Speicheldrüse liegt in der Brust und transportiert ihr Sekret über einen Ausführungsgang vor die Zunge.
Die Ameisen verfügen über 3 mittige Stirnaugen (Punktauge / Occelus), die als Dreieck mit einem oberen Augenpaar und 1 Auge als untere Dreiecksspitze angeordnet sind. Weil die Haut=33 als Hornhautlinse mit dem männlichen Hormon=33 doppeldeutig ist, und auch das weibliche Hormon=flexibel=66 doppeldeutig mit der Potentialänderung „6620“ von Calcium=20 bei Lichteinfall ist, bekommen die sterilen Arbeiter*innen keine Ocellen. Der Gegenspieler von Calcium ist mit Natrium das Sehstäbchen „11“ selbst. Die Gattung „Formica“ irgnoriert die hormonelle Interpretation – alle Ameisen besitzen Ocellen. Die Ameise versteht wie der Elefant den Bixnom-Kreis „64“ und startet das Punktauge in Zeile Z.64 als Bixnom-Kreis=64. Das kugelförmige Gesamtgebilde enthält im Mantel Nervenzellen „7_00“ und außenseitig ein Linse. Die beidseitig gewölbte Linsenform ergibt sich aus oben=9 mit 86_6 und einer Spiegelung in Folgezeile 68_9, wobei die Ziffer 8 eine Pigmentierung zur Begrenzung des Lichteinfalls bedeuten kann: Epi.Y!Ameise.Z.64#700145598662037 und Epi.Y!Ameise.Z.65#689374127913390. Experten vermuten in den Ocellen Kompass- und Gleichgewichtsorientierungen. Epi.Y!Ameise.Z.66#678929065369248 bildet QS 84. Die folgende Dopplung 795_795 davon die Hälfte, und die Zeitdifferenz enthält immerhin das Punktauge „101“ in #101332696323768. Eine Nerv-7-Serie „68_797_797_3_68“ ist enthalten in Epi.Y!Ameise.Z.67#668795795736871. Bei Insekten kann der Linse ein Glaskörper folgen, der aus gekrümmten „64“ lichtdurchlässigen Schichten 10_4_10 besteht, die seitlich den Kugelmantel bilden: Epi.Y!Ameise.Z.69#649410410353193. Das Licht trifft dann auf Sehstäbchen, wofür die Zeilennummer Z.70 als Nerv 7 passend ist. Die Informationen der Stäbchen „11“ werden dann über ein Nervenbündel „111“ weitergeleitet. Mit dem Unterschied von 64 und 63 ist die Quadratur des Kreises dazwischen eine optimale Messgröße: Epi.Y!Ameise.Z.70#640133118776719 und Epi.Y!Ameise.Z.71#631117159357329. Bei geneigter Kopfhaltung liegt das obere „9_5_9“ Paar der Stirnaugen (Occellus) der 3 Ocellen „101“ im Zeilenlauf vor dem unteren Mittelauge. Oberes Ocellenpaar QS 3+6=9_101_QS 3+6=9=seitlich: Epi.Y!Ameise.Z.76#589596293610136. Unteres Mittelauge (Ocellus) „464_101“: Epi.Y!Ameise.Z.82#54645510139476.
Das Facettenauge (Netzauge / Komplexauge / Seitenauge / Oculus compositus) bildet sich ab Z.83 als Zählgröße 8+3=11 bzw. Natrium. Mit dem Einzelauge (Ommatidium) „1“ in einer Netzstruktur „414“, paarig=2, am Seitenrand des Kopfes=99. Auf der Oberfläche ragt in jeder Ecke der hexagonalen Einzellinsen 1 Härchen als Nippel-Form 7 (kein Nerv 7) „7_1“ heraus, um Reflexionen zu vermeiden. Das Einzelauge besteht aus einer Chintin-Linse, einem Kristallkegel und der Nervenzelle 7. Chitin (Chitin=C8H13O5N)n ist ein aminozuckerhaltiges Homopolysaccharid und übernimmt bei wirbellosen Tieren die Stützfunktion ähnlich der Cellulose bei Pflanzen: Epi.Y!Ameise.Z.83#539871304992414. Die obere Hornhaut 33 ist als in sechseckigen 66 Feldern 444 faccetiert. Die Gesamtoberfläche und die Chitin-Linse des Einzelauges sind aufgrund der Bixnom-Kurve „64“ gewölbt: Epi.Y!Ameise.Z.84#533444265647266. Unter der Linse sitzt eine pigmentierte „Extra=8“ Hauptzelle, die einen Kristallkegel enthält. Die Zeile Z.85 bildet eine Pigment-Struktur, die sich in Z.86 als „8585“ wiederholt. Die Struktur 50_757 ist mit dem Nerv 7 kombiniert und der Nerv 7 mit dem Sehnerv 2 als „27_72“: Epi.Y!Ameise.Z.85#527168450757298. Aus welchem lichtdurchlässigen Material das Kristall besteht, ist hier nicht bekannt. Der runde, vier geteilte Kegel setzt sich bei Insekten aus 4 Sektoren (Semperzellen = Kristallbildungszelle) zusammen. Der Kristallkegel verjüngt nach unten und verändert dabei den Brechungsindex. Die 4 mit der 0(Null) lichtdurchlässigen Strukturen zählen sich als 4_50. In den folgenden 4 Zeilen ist Zahl 50 enthalten, um den Kegel in die Länge zu ziehen. Die klassische Öffnung „505“ bildet die Augenform in Kombination mit den Nullstellen „505_0“ für die Anzahl der Facetten. Die Anzahl des Einzelaugen müssen die Ameisengattungen aus der Basiszahl von 10 Facetten wahlweise interpretieren aus „2_10_3“. Die Anzahl der Nullen ergibt 1=10, 2=100 oder 3=1000 für eine gut sehende Ameisengattung: Epi.Y!Ameise.Z.86#521038585050818 bis Epi.Y!Ameise.Z.89#503475486678318. Die Ziffer 8 endet als Pigment in der Zeilennummer und wird nunmehr für den Beginn der 8 Sehzellen „88“ benötigt. Natrium=11 ist nützlich, weil bei einfallendem Licht Natrium-Ionen einströmen und als Pumpen-Effekt Kalium-Ionen in der Folgezeile als Kalium= 19 in der Art „1009“ ausströmen: Epi.Y!Ameise.Z.90#497881314604115. Die Sehzelle zieht sich in die Länge und enthält im Zentrum das Sehstäbchen (Rhabdom) „707“, zu dem jede der 8 Sehzellen mit einem Rhabdomer beiträgt: Epi.Y!Ameise.Z.91#492410091366707. Die Zeile Z.92 mit QS 9+2=11 adressiert das Sehstäbchen (Rhabdom) „11“, dass sich in der Form 70_7_077 zu einem Ausgangsnerv 7 verengt: Epi.Y!Ameise.Z.92#487057807764895. Am Fuß des Sehstäbchens werden Nervenfasern 77 heraus geleitet und am äußeren Mantel des Einzelauges liegen Pigmentzellen 888: Epi.Y!Ameise.Z.95#471677034888109. Die Nervenfasern durchdringen die Hautschicht der Basallamina. Dafür fehlt die ideale Zahl „333“, kann aber perforiert vom Nerv 7 als „37_337“ erkannt werden: Epi.Y!Ameise.Z.95#457237941983371.
Mundwerkzeuge: Unterhalb des Clypeus deckt die unpaarige Oberlippe (Labrum) den oberen Mundbereich als schuppenartiger Fortsatz des Kopfskeletts ab. Die 3 Mundwerkzeuge sind der paarige Oberkiefer (Mandibeln), der paarige Unterkiefer (Maxille) und in der Mitte die unpaarige Unterlippe (Labium) [Diese wird auch als sogenannte zweite „Maxille II“ bezeichnet, weil dieses 3. Paar in der Mitte verwachsen ist]. Die Mandibeln können sich quer vor den Mund legen, um die beiden anderen Mundwerkzeuge, den Maxilio-Labial- Komplex zu schützen. Literatur siehe: 1.) Comparative analysis of worker head anatomy of Formica and Brachyponera (Hymenoptera: Formicidae) (senckenberg.de) [www.senckenberg.de/arthropod-systematics on May 26, 2020]; 2.) Vergleichende morphologische Untersuchungen der Ameisen unter besonderer Berücksichtigung der Mundwerkzeuge (Hautflügler: Formicida) [https://ia802701.us.archive.org/2/items/ants_04898/4898_text.pdf]; 3.) „The mouthpart of Ants [paul.pdf (uni-wuerzburg.de)].
Der Unterkiefer (Maxille) besteht bei den Insekten aus dem Basalglied und den aufsitzenden flächigen Kauladen. Das Basalglied ist zweigeteilt: Der Drehpunkt (Cardo) ist an der Kopfkapsel eingelenkt. Das Stammelement (Stipes) ist durch eine Beugungsfalte abgesetzt. Dem Stipes sitzen die innere Kaulade (Lacinia) und die äußere Kaulade (Galea) auf. Weiterhin ist ein i.d.R. 4 bis 5-gliedriger Unterkiefertaster (Palpus maxillaris) vorhanden.
Die Unterlippe (Labium) liegt nicht allein vorn und unten am Kinn, sondern beginnt hinten als Postmentum (nach dem Kinn), das nochmals in Submentum (sub=unter) und Mentum unterteilt wird. Der vorderste Teil ist das Prämentum, dem mittig die Zunge (Glossa) aufsitzt. Die Zunge ist an der Basis verbreitert. Diese Verbreiterung wird als Nebenzunge (Paraglossa) bezeichnet. An der Unterlippe entspringt 1 Paar Lippentaster (Labialpalpen).
Die Funktionen von Unterkiefer und Unterlippe werden übereinstimmend von jeweils 6 Muskeln kontrolliert. Innenlippe (Hypopharynx): Der Übergangsraum von den Mundwerkzeugen zum Rachen (Pharynx) mit der weiterführenden Speiseröhre (Ösophagus) und dem im Brustraum beginnenden Speichelgang wird als Innenlippe (Hypopharynx) bezeichnet. In diesem Zwischenraum zwischen dem Raum der Mundwerkzeuge (Präoralraum) wird vor dem Rachen (Pharynx) die eigentliche Mundhöhle (Cibarium) und die Speicheltasche (Salivarium) abgegrenzt, in die der Speichelgang mündet.
Drüsen der Mundwerkzeuge: Den 3 Mundwerkzeugen ist jeweils eine paarige Drüse zugeordnet: Mandibular-, Maxillar- und Labialdrüse. Bei der Labialdrüse handelt es sich um die Speicheldrüse, deren Drüsenkörper im Brustraum liegt. Die beiden Ausführungsgänge vereinigen sich bereits vor dem Hinterhaupt zu einem gemeinsamen Speichelgang, der hinter der Zunge mündet. Der Speichelgang ist ähnlich den Tracheen mit einer geringelten Struktur ausgekleidet, was beim Menschen mit den Knorpelspangen der Luftröhre „22“ vergleichbar ist. Der Speichelgang könnte als Signalleitung „7“ wie ein Nerv adressiert sein, weil der Speichel eine chemisch basierte Kommunikation mit den Larven ermöglicht. Die Mündung des Speichelganges ist ein Hilfspunkt zur Lage der Zunge. Die Zunge bewegt sich allerdings mehrfach in der Sekunden auf- und abwärts, so dass im Zeilenzulauf zunächst ein Fixpunkt gesucht wird. Die Mundwerkzeuge überlagern sich funktionell, wogegen der Zeilenlauf nur linear voranschreitet.
Nahrungstransport: Die Ameisengattungen entwickeln bevorzugte Methoden zum Nahrungstransport. Beispielsweise können kugelförmige Flüssigkeitstropfen, die der Kopfgröße entsprechen, mit den seitlichen Mandibeln und den umgreifenden Tastern weggetragen werden. Meist wird jedoch die Zunge zum direkten Aufnehmen der Nahrung verwendet. Zunge (Glossa): Die Zunge ist das vordere (distale) Ende der Unterlippe. Die flüssige Nahrung kann durch Saugen oder alternativ durch Ablecken aufgenommen werden. Saugen (Sucking): Beim Saugen wird die Zunge tief in die Flüssigkeit getaucht. Über die Kapillarspannung und die Wirkung des Pharynxdilatatormuskels wird ein Unterdruck erzeugt, durch den ein kontinuierlicher Flüssigkeitsstrom von der Zunge durch den Mund und die Speiseröhre (Ösophagus) bis in den Kropf erfolgt. Ist nur noch wenig Flüssigkeit vorhanden, können die Reste aufgeleckt werden, was von Ameisenarten auch als generelle Methode gewählt werden kann. Auflecken (Licking): Die Flüssigkeit wird beim wechselnden Absenken und Anheben der Zunge schaufelartig in den Mund gefördert. Die Zunge schiebt sich durch ihre Elastizität als nicht-muskuläre Bewegung selbst vor den Mund (Glossa-Protraktion), weil ein entsprechender Muskel fehlt. Diese Zungen-Elastizität ist der Antagonist zu vorhandenen Zungen-Rückziehmuskeln (Glossa retractor muscle). Sobald sich die Rückziehmuskeln (Glossa-Muskel / Paraglossa-Muskel) entspannen, kann sich die Zunge wieder nach vorn bewegen. Dieser relativ langsame Mechanismus begrenzt die Leckhäufigkeit der Zunge auf ca. 4 bis 5 Leckvorgänge / Sekunde. Beim Leckvorgang sind vier verschiedene Labialmuskeln beteiligt (Labialöffner und –schließer, Glossa-Muskel und Paraglossa-Muskel). Beim oberflächigen Flüssigkeitskontakt nimmt die Zunge durch ihre Kapillarität die Flüssigkeit auf. Wird die Zunge dann zurückgezogen, bewegt sich die paarige äußere Kaulade (Galea) nach unten, ohne die Zunge bereits zu berühren. Erst wenn die Zunge wieder vorgestreckt wird, streift die Galea mit einer Gegenbewegung die Flüssigkeit nach oben hin ab. Die Ameisenzunge kann sich nicht wie beim Menschen als langgestreckter Muskel im Unterkiefer über mehrere Bixnom-Zeilen entwickeln, sondern muss sich auf wenige Zeilen beschränken. Dadurch hängt die Zunge hammerartig und zapfenförmig wie ein Eispickel im Winkel von 90° herab. Auf der Zungenoberfläche dieses Zapfens liegen auf der vorgestreckten Zunge in engen Querreihen (ca. 5 µm) horizontale Leistenreihen der Cutikula. In den entstehenden Spalten kann die Flüssigkeit aufgrund der vergrößerten Oberfläche aufgenommen werden. Die Zunge selbst ist keine Schaufel, sondern ihre mikroskopisch kleinen Leistenreihen erfüllen diese Funktion.
Die äußere Kaulade (Galea) des Unterkiefers (Maxille) und die Zunge (Glossa) der Unterlippe (Labium) arbeiten funktionell und räumlich zusammen. Um 2 Strukturen im linearen Zeilenlauf gleichzeitig darzustellen zu können, wird eine Problemlösung benötigt: Die Galea zeigt auf der Innenseite eine Reihe von Geschmackspapillen und parallel darunter eine Borstenreihe. Gemäß der Mikroskopie ist die Galea ein fiktiv aufklappbares „Portemonnaie“. Auf der oberen Außenkante sitzt die Reihe der Geschmackspapillen und auf der Innenkante eine Borstenreihe. Dazwischen liegt eine Senke, durch die der Unterkiefertaster (Palpus maxillaris) zwecks Reinigung gezogen werden kann. Im Zeilenlauf beginnt das aufgeklappte „Portemonnaie“ mit dem Außenteil (Galea, Teil 1) der äußeren Kaulade (Galea). Es folgt der Inhalt der „Geldbörse“ als Unterlippe (Labium) inclusive Zunge (Glossa). Dann folgen der fiktiv eingeklappte Innenteil (Galea, Teil 2) der äußeren Kaulade (Galea) sowie die innere Kaulade (Lacinia), Stamm (Stipes) und Drehpunkt (Cardo).
Galea, Teil 1: Der fiktive äußere Lappen der paarigen „2“ Galea (Teil 1) ist mit der Bixnom-Kurve 64_46 abgerundet, wobei dieser runde Rand nach vorn mit Borsten (Galeal crown) 11_9_1_6=flexibel besetzt ist. Die Zeilen-Nr. Z.115 ist eine Strukturgröße: Epi.Y!Ameise.Z.115#389646246211916. Der Lappen bildet eine Volumenstruktur „500“: Epi.Y!Ameise.Z.118#379739985715003. Die Hautoberfläche 9_33_9 wird im Trichter einer Geschmackspapille mit einem Nerv „0_7_0“ innerviert. Die Zeilen-Nr.Z. QS 1+1+9=11 ist eine Zählgröße, so dass die gesamte Reihe der Papillen versorgt ist. Als Anzahl der Papillen ist wegen „88“ pro Seite soweit erkennbar mit 8 Papillen vorgegeben: Epi.Y!Ameise.Z.119#376548893398070. Beim Zusammenklappen reicht der fiktive innere Lappen bis an diese Position, so dass die Galea aus den beiden fiktiven Teilen 1 und 2 besteht. Der innere Lappen (Teile 2) streicht die Flüssigkeit von der Zunge (Glossa) ab. Zur Koordination ist der Nerv=7, die Zeit=24 und Gegenkrümmung „46“ zur Zungenbewegung „64“ notwendig. Weiterhin kann mit „686“ der Token-86 als freie Transportstrecke eingerichtet werden: Epi.Y!Ameise.Z.119#370324944746862. Beim Zusammenklappen beider fiktiver Galea-Teile „94_94“ entsteht zwischen der Papillenreihe und der Borstenreihe eine Furche als Sammeltasche „8008_5“ im Verdauungssystem „8“: Epi.Y!Ameise.Z.122#367289494380085. In der Mikroskopie ist die Reihe der Geschmackspapillen in der Seitenansicht durch die Borstenreihe verdeckt, so dass nur vorn ca. 8 Geschmackspapillen einer Ameisenart erkennbar sind. Die Papille sitzt in der Haut 3_3 und senkt sich von einem Kreis „3_64=Bixnom-Kreis_3“ trichterförmig „303“ in die Tiefe. Im Trichter steht ein rechteckiger Lappen „400“, der eine große Papillenoberfläche bildet. Für einen guten Geschmack müssten der Zucker des Honigtaus und die Ameisensäure zur Desinfektion bevorzugt werden: Epi.Y!Ameise.Z.123#364303400929840. Der lotrechte hintere Rand der „Geldbörse“ bildet eine Klappen-Falte. Die Klappfunktion zeigt sich, weil der Anfang in Zeilen –Nr. Z.115 zur hinteren Falte mit „511“ gespiegelt ist. An der Falte setzt real die innere Kaulade (Lacinia) zur Verlängerung der Galea an. Der Verbindungsmuskel „55“ ist bereits vorhanden: Epi.Y!Ameise.Z.126#355629510431511. Vor dem Start der Zunge wird die Funktion zur Füllung der Galea-Sammeltasche „8008“ adressiert, die als „80_659_08“ mit den Ziffern „659“ besetzt ist. Mit „282“ wird die Ziffer „8“ für den Token-86 als „806“ markiert. Weiterhin ist der Nerv „7“ in Zeile und Zeilen-Nr. enthalten. Als paarig „2“ wird gleichzeitig die Ziffer „9=seitlich“ als „292“ markiert. Somit streicht die äußere Kaulade (Galea) die aufgeleckte Nahrung seitlich von der Zunge (Glossa) ab. Der Zungen-Zapfen schwingt am „Eispickel“ ständig mit dem Bixnom-Kreis hin und her. Die Galea ist darauf eingetaktes, in dem als Berechnungsvorgang die Zeilen-Nr. Z. QS 1+2+7=10 von der QS 3+5+2+8+2+9+2+7+8+0+6+5+9+0+8=74 subtrahiert wird. Die Galea löst beim „Abstreichen=Subtraktion“ die Aufgabe 74 – 10 = 64=Bixnom-Kreis: Epi.Y!Ameise.Z.127#352829278065908.
Zunge (Glossa): Die Zunge kann mit der Zeilen-Nr. Z.QS 1+2+8=11 als Zählgröße 11 beginnen, um zur Oberflächenvergrößerung eine Vielzahl von horizontalen Faserreihen auf der Vorderseite des vertikal ausgeklappten Zungen-Zapfens „500“ als Hautelement „33“ QS 9+9=18_33_101_18“ anzuordnen. Die Ziffer „8“ betrifft das Verdauungssystem. Die O(Null) erfüllt als Volumen die Mikro-Schaufelfunktion, wenn die Zunge wieder aus Flüssigkeit herausgehoben wird. In der äußeren Ansicht ist die Zunge ein unpaariger Zapfen. Die Ziffer „2“ ist dadurch vordergründig mit „727“ blockiert, zeigt aber rückseitig eine Faltung. Diese Zungenfaltung ist an der Unterseite des Zapfens an einer Kerbe ersichtlich. Durch die Kapillarität kann die Flüssigkeit auch rückseitig in der Kerbe aufsteigen. Als weitere Zählgröße kann die Leckhäufigkeit vorgegeben sein. Dafür ist die Zeit 24/2=12 in der Zeilennummer enthalten, weil die Zeit beim Senken und Heben halbiert wird. Variante 1: maximale Leckhäufigkeit „72“ / 12 = 6 Leckvorgänge / Sekunde. Variante 2: optimale Leckhäufigkeit: Die Zeilennummer Z.128 wird zerlegt in „12“ als Divisor und „8“ zwecks Addition für eine fiktive „Nahrungsaufnahme“ zur QS 3+5+0+0+7+2+7+9+9+3+3+1+0+1+8=58. Mit (58 + 8) / 12 = 5,5 Leckvorgänge / Sekunden als bekannter Mittelwert: Epi.Y!Ameise.Z.128#350072799331018. Der Zungenzapfen hängt bei der eingetauchten Zunge im Winkel von 90° als Struktur herunter mit „5_90_5“. Der Zungenzapfen geht an der Oberseite in eine glatte Fläche „700_5_4_5“ über, wobei sich in der Mittelachse aufgrund der Faltung die Form eines „Satteldaches“ bildet. Auf diese Fläche fließt der Speichel aus der Speichelgangmündung aus: Epi.Y!Ameise.Z.129#347359056700545. Die Zungenfaltung zeigt sich an der trichterförmige Kerbe auf der Unterseite des Zungenzapfens. Die Trichter ist gegen den Zeilenlauf nach vorn gerichtet, so dass die Gegenkrümmung „46“ enthalten ist. Für die Trichterform „64_46“ muss die Zeilennummer mit verwendet werden Z.1_QS 3+0+ #3=6_4_4_6. Die für die Leckhäufigkeit addierte Zahl „66“ ist markiert als „95_66_95“, wobei der Divisor QS 6+6=12 für 66/12 = 5,5 bereits integriert ist. Die Zunge klappt ohne Muskel selbsttätig aus. Zum Hochklappen sind 2 Schließmuskeln vorhanden, davon ist mit 5_5 zunächst der Glossa-Muskel vorhanden: Epi.Y!Ameise.Z.130#344687063956695. Der Paraglossa-Muskel „55“ ist der 2. Zungen-Schließmuskel. Die Schließfunktion des Muskels „55“ beim Ausklappen der Zunge wird nochmals in Teilmengen QS 3+4+2=9=oben_ QS 0+5+5+8+6+4+9+9+5+1+9+3=64=Bixnom-Kreis angezeigt. Die „64“ ist auch direkt enthalten. Die Zeilen-Nr. Z.QS 1+3+1=5 ergibt insgesamt 5_5 und 55 für beide Muskeln: Epi.Y!Ameise.Z.131#342055864995193. Auf der Zungen-Oberseite wird die glatte Satteldachform trichterartig zur Mündung der Speicheldrüse verengt. Technisch gesehen, ist es ein Venturikanal für die Durchflussmessung des Speichels. Für den horizontalen Trichter vor der Speichelgangmündung ist ein Trichter „64_46“ vorhanden (mit 464 verdeckt). Wegen 64_QS 5+3+2+6+8=24=Zeit_46_24=Zeit ist der Speichelfluss als Zeitgeber adressiert, was auch einen Pumpvorgang abbilden kann: Epi.Y!Ameise.Z.132#339464532684624. Am Ende des Speichelganges befindet sich als Speichel-Reservoir das Salivarium. Wenn die Schließmuskeln den Zungenzapfen aus der Hängeposition zurückgezogen haben, wird das Ende des Speichelganges „707“ [siehe: Epi.Y!Ameise.Z.157#285409670792168] vertikal zum Salivarium als „7777_22_1“ aufgerichtet. Ziffer 1= unpaarig. Die Doppelziffer=22 steht für die harte Auskleidung des Salivariums durch Sklerite (Hartteile der Wirbellosen, wie die Gliederfüßer). Das Ausklappen der Zunge und die Bewegung des Salivariums ist als Bixnom-Kurve in QS 3+3+6+9+1+2+1+6+7+7+7+7+2+2+1=64 enthalten. Die Zeilen-Nr. Z. QS 1+3+3=7 beinhaltet scheinbar die Hautmembran „33“, aber als Quersumme ist Nerv=Form=7 und offensichtlich auch der Speichelgang als Kommunikationsleitung gemeint: Epi.Y!Ameise.Z.133#336912167777221. Auf die Zunge wirkt die äußere Kaulade (Galea) ein, weil die von der Zunge aufgenomme flüssige Nahrung von den Borsten abgestrichen wird. Daher ist es zweckmäßig mit seitlich=9 in „97_8=Veraudungssystem_97“ die Galea zu erwähnen. Der Token-86 ist enthalten, um die Förderstrecke direkt in den Kropf freizugeben bzw. wegen „8_6_8“ unter Vorbehalt zu steuern QS 4+3=7_QS 4+3=7: Epi.Y!Ameise.Z.134#334397897868435. Die Mündung des Speichelganges gehört zum Bereich der Paraglossa. In der Auskleidung „22“ des Salivariums ist nunmehr ein breite Öffnung enthalten 20_64_02. In Längsrichtung sind es 2 Schlitze, so dass mittig noch ein Abdeckelement erkennbar ist. Seitlich=9 der Öffnung des Speichelganges ist die Haut 33 mit Bürsten-Haaren „33_1“ der Paraglossa-Bürste (Basiparaglossal brush) besetzt. Epi.Y!Ameise.Z.135#331920876402743. Die Lippentaster (Palpus labialis) entstehen als Zählgröße „11“, paarig=2, seitlich=9, als QS 2+3=5=Struktur_3. Diese 3 Glieder sind vorhanden: Epi.Y!Ameise.Z.136#329480281723311. Der Speichelgang geht hinter dem Salivarium zunächst als dünne Röhre „707“ weiter, um sich noch vor dem Gehirn in einer Schlaufe im Querschnitt stark zu vergrößern. Die Paraglossa-Bürste wird seitlich nach hinten durch einen paarigen Lappen begrenzt. Mit der Zeilen-Nr. Z.Q 1+3+7=11 als Zählgröße reicht der Lappen „16_16“ bis an die Lippentaster 11 heran. Epi.Y!Ameise.Z.137#327075316163287. Es wird ein Lippentaster-Muskel (Labial palpus muscle) „55“ benötigt, der sich mit dem Attribut paarig=2 als 0_5_2_0_5 verdeckt zeigt: Epi.Y!Ameise.Z.138#324705205176597. Bevor der Hypopharynx sich als Volumen nach oben hin in Richtung der Oberlippe ausweitet, wird im Übergang von der Paraglossa zum Hypopharynx eine harte Wandplatte „3_22_3“ zur Stabilisierung des Volumens ausgebildet, damit im Inneren ein Muskel ansetzen kann. Die Seitenflächen des Hypopharynx ist in Längsrichtung mit feinen Leisten „1“ als „6_9_1_9_6“ ausgestattet: Epi.Y!Ameise.Z.139#322369196506261. Im Hohlkörper des Hypopharynx „200_66“ setzt der Hypopharynx-Muskel „55“ an. Die flexible Oberlippe oben=9_3_88_3 gleitet oberseitig des Hypopharynx entlang, so dass die Zeit=60 hier verwendbar ist: Epi.Y!Ameise.Z.140#320066559388360.
Galea, Teil 2: Die äußere Kaulade (Galea) wurde hier zuvor mit dem äußeren Teil 1 aufgeklappt. Nach der Zunge wird nunmehr die Galea mit dem inneren Teil 2 zugeklappt, um den Borstenkamm zu bilden. Bekannt ist, dass eine Muskelverbindung von der äußeren [vorderen] zur inneren Kaulade vorhanden ist. Hier für ist ein Zeilenbereich vorhanden, indem eine Muskel „555“ durchläuft. Zur Bildung des vorderen Randes ist eine Krümmung “64“ vorhanden: Epi.Y!Ameise.Z.142#315558579678664. Für den Borstenkamm bildet die Zeilennummer eine Borstengruppe Z.1_44 mit den Borsten „111“: Epi.Y!Ameise.Z.144#311175821627572. Die Borstengruppe zieht sich mit der Zeilen-Nr. Z.1+4+6=11 als Zählgröße 11 in die Länge mit den Bosten in der Haut 3_3 als „1313_9=oben_13_9=oben“. Hierbei kann es sich auch um Gruppen von haarähnlichen Mikrotrichien handeln, die in Paaren oder Drillingen neben den Geschmackspapillen angeordnet sind. Mit dem Muskel „555“ wird die Galea, Teil 2 beendet: Epi.Y!Ameise.Z.147#304825294655581.
Stamm (Stipes): Die äußere Kaulade (Galea) und die innere Kaulade (Lacinia) werden vom Stamm getragen. Etwas mittig unterhalb der Galea bildet der Stipes das Gelenk „60060“ für den Anschluss des Unterkiefertaster (Palpus maxillaris) aus. Es werden 6 Palpen-Glieder paarig mit „2_6_2“ avisiert, die bei der Ameisenart „Formica rufa“ vorhanden sind. Andere Arten zählen nur 3 Glieder, wenn man beispielsweise die Ziffer „1“ zählt incl. der Zeilen.-Nr. Z.171_#7_1 zählt: Epi.Y!Ameise.Z.171#262042797160060. Der Unterkiefertaster ist als Zählgröße 11 mit „66“ für 6 paarige Glieder adressiert, von denen die vorderen 3 Glieder einheitlicher wirken: Epi.Y!Ameise.Z.173#59013400661100. Auf inneren Zungenseite ist die Galea incl. Borstenkamm mit dem stützenden Stipes zu sehen. Dagegen ist auf der Außenseite im oberen Bereich die innere Kaulade (Lacinia) erkennbar, die sich dort offenbar auf den Stipes gelegt hat. Eine Art von doppeltem Lappen „Lacinia=999_666=Stipes“ ist mit oben=9 vorhanden: Epi.Y!Ameise.Z.177#253159990476669. Der Lappen der Lacinia ragt etwas über den Stipes hinaus, so dass sich eine Hautleiste „333“ über dem Stipes entlang zieht: Epi.Y!Ameise.Z.178#251737743339159. Im Anschluss ist ein Lacinia-Borstenkamm (Lacinial comb) „111_9“ ausgebildet: Epi.Y!Ameise.Z.179#250331387231119. Der hintere Rand der inneren Kaulade (Lacinia) ist halbkreisförmig „406“ ausgeschnitten. Zwischen Stipes und Cardo ist eine Beugungsfalte „57_020_57“ zur Abgrenzung vorhanden: Epi.Y!Ameise.Z.180#248940657302057. Muskelverbindung „4_55_4“ zum Kopfskelett: Epi.Y!Ameise.Z.181#247565294554532. Der Unterkiefer (Maxille) ist mit dem Cardo als Gelenk „050“ am Kopfskelett paarig „2_46_2“ angeschlossen. Zeit=24 für die Beweglichkeit: Epi.Y!Ameise.Z.182#246205045683354.
Gehirn: Das Oberschlundganglion (Supraesophageal ganglion) zeigt in der Draufsicht (Top view) einen Pilzkörper (Corpora pedunculata / Mushroom body), der das Riechzentrum (olfaktorisches Zentrum) bildet. In der Frontalansicht sind oberseitig 4 Ringe erkennbar, die jeweils 1 Pilz aus Kelch / Becher (Calyx) und Stiel (Pedunculus) bilden. Die beiden Kelche einer Seite sind etwas verbunden, so dass bei paariger Anordnung 4 Ringe entstehen. Das Gehirn lässt sich im Zeilenbereich zwischen den Ringen in der Vorder– und Hinteransicht finden. Es liegen nicht 4 Ringe, sondern in beiden Ansichten jeweils nur 1 Ring „202“ vor, der mit „2202“ als 1 Doppelring zu lesen ist, und dann nochmals paarig zu 4 Ringen auszuführen ist. Weil es zeitlich nicht möglich ist, im Zeilenlauf beider Zeilen exakt den selben Ring zu sehen, werden Halbringe benötigt, die sich erst beim Scann zusammenfügen; alternativ 1 Ring mit 1 Kerbe als Wurstring: Alles hat 1 Ende, nur die Wurst hat 2. Weil die Hirnoberfläche gewölbt ist, sind in beiden Ansichten tatsächlich 4 Halbringe sichtbar. Nur in der Draufsicht sind es 4 Vollringe. Weil sich der Pilzkörper über die gesamte Gehirnlänge zieht, müssen sich seitliche (laterale) und untere (ventrale) Hirnstrukturen in diesen Zeilenbereich einordnen. Innerhalb des Pilzkörper-Bereiches entsteht der paarige Sehlappen (Lobus opticus) hinter dem Facettenauge, d.h. an der Seitenfläche des Oberschlundganglions. Die Nerven der Punktaugen (Ocelli) führen von oben (dorsal) ins Gehirn. Einer oberen Hirn-Etage als Protocerebrum folgen darunter das Deutocerebrum mit dem Antennenlappen und das Tritocerebrum.
Das Oberschlundganglion wird als Gruppe 44 und Ziffer „2“, 2_9=oben_2005_7=Nerv avisiert: Epi.Y!Ameise.Z.183#244859662920057. Zufällig kann mit der Zählgröße 11 in 28_QS 3+8=11_82 die Sprungmarke Zeile Z.388 als Gehirn-Ende der Gruppe 44 dienen: Epi.Y!Ameise.Z.184#243528903882448. Kelch des Pilzkörpers als Doppel-Ring „2_202“. Deutung als Halbring in der Ansicht, wenn „30“ als Halbzeit von Zeit=60 und als Form 7 gelesen werden. Der Doppelring ist mit 23_23 paarig, so dass „4“ Ringe oben (dorsal)=99 entstehen: Epi.Y!Ameise.Z.187#239622023071499. Der scheinbare Halbring benötigt für eine gewölbte Hirnoberfläche die Bixnom-Kurve „64“. Das Thema 63 vs. 64 ist als 634 enthalten. Die Ziffer 6 ist markiert und Ziffer 4 folgt „767_4 (QS=67)“: Epi.Y!Ameise.Z.189#237086340287674.
Zunächst müssen sich 3 Strukturen (VL / CB / PED) zeigen, die nur in der Vorderansicht erkennbar sind: 1.) vertikaler Lappen (VL): hier im Stiel (Pedunculus / PED) enthalten 2.) Zentralkörper (CB): Im Querschnitt des Gehirn ist mittig das Loch der Speiseröhre erkennbar. Die beiden Hirnhälften sind lotrecht geteilt und werden vom unpaarigen Zentralkörper verbunden, der als Assoziationszentrums alle Sinneseindrücke vergleicht und verarbeitet, so dass sich die Fasermasse aus Fasern vieler Gebiete des Ganglions zusammensetzt. Auf der Hirn-Rückseite verbindet die „Brücke (ähnlich dem Corpus Callosum)“ beide Hirnhälften. Weil im Zeilenlauf #2xx die Ziffer „2“ für paarig läuft, muss der unpaarige Zentralkörper ein erkennbares Gegensymbol erzeugen: Die Zeilennummer Z.201 enthält die Ziffer unpaarig=1. Eine Kette verbindet beide Seiten 229_„319-319_1“_229, darin ist die Zahl oben=9 mit unpaarig „1“ markiert „1_9_1“: Epi.Y!Ameise.Z.201#22293193191229. Struktur 555 und „Glomeruli“ als Wirkstoff „88“: Epi.Y!Ameise.Z.203#220735558198869. Fasermasse 111 als Verbindungen 96_2_69: Epi.Y!Ameise.Z.206#217520962691118. Die Wissenschaft vermutet die biologische Hauptuhr im Zentralkörper (CB). Die Uhr wird als Taktung eines Pendels (Biologie/Physik=64/63) bei der Quadratur des Bixnom-Kreises „64_7=Nerv=Form_0=Kreis_36 als Spiegelung der 63“ gebildet. Die Ameise denkt: „Oh, hier stimmt etwas nicht! Die „36“ ist falsch und muss als Subtraktion mit der Quersumme QS=3+6=9 beseitigt werden, weil es so als Zeilen-Nr. Z.207=QS 2+0+7=9 befohlen wird.“ Um Himmels Willen, wie schlau ist die denn! Wegen der QS =2+1+6+4+7+0+1+3+6+7+8+4+3+9+8=69 muss tatsächlich „QS 3+6=9“ subtrahiert werden, um die Zeiteinheit sekundengenau mit 69 – 9 = 60 Sekunden zu takten! Die Quarzuhr enthält mit Quarz=SiO2 die Werte von Silicium=14 und Sauerstoff=8, doppelt als 16. Die Zahl „14“ ist momentan in der Folgezeile schon besetzt, so dass der Quarz in „164“ zwischen 16 und 14 pendelt als Ziffer „2“. QS 1+6+4=11 ist eine Zählgröße 11 als Zeittakt: Epi.Y!Ameise.Z.207#216470136784398. 3.) Stiel (Pedunculus / PED): Der Stiel besteht aus Nervenbündel, die vom Kelch in das Gehirn führen und auf die einzelnen Lappen verzweigen. Anzahl von „4“ Stielen „4_414_4“ , davon 2 je Seite 4_29_29 mit seitlich=9: Epi.Y!Ameise.Z.208#215429414972934. Der Stiel bildet zunächst mit „33777“ den Haupt-Nervenstiel 777. Am unteren Ende ist eine Verzweigung in Lobus Alpha und Lobus Beta vorhanden: Epi.Y!Ameise.Z.210#213377706258906. Im Querschnitt des Gehirns bilden die 2 Pilze jeder Seite jeweils zusammen eine Wölbung als Bixnom-Kurve „64“ mit „64_64“.
Dieses ist beim Männchen 33 und der Königin 666 der Fall. Die Arbeiterin 66 verwendet aber die Wölbung als „664“, so dass die 4 Kelche eng zusammenstehen und nur 1 Gesamtwölbung „64“ verbleibt. Bei den Arbeiterinnen sind die Stirnaugen nur noch rudimentär vorhanden, so dass kein oder wenig Platz benötigt wird, um zwischen den Kelchen beider Seiten eine Lücke für die Nerven der Ocelli frei zu halten: Epi.Y!Ameise.Z.211#212366437508864 und Epi.Y!Ameise.Z.212#211364709030049. An der Stiel-Wurzel krümmt sich der Lobus Beta als Verlängerung des Stiels, so dass der Lobus Alpha unter „45°“ als Gruppe 44 abzweigt. Der Lobus Alpha ist mit oben=9 nach oben gekrümmt als 9_337_9: Epi.Y!Ameise.Z.213#210372386452443 und Epi.Y!Ameise.Z.214#209389337917618. Bei den Bezeichnungen „Lobus Alpha“ und „Lobus Beta“ könnte es sich synonym um die Bezeichnungen „medialer Lappen (ML)“ und „vertikaler Lappen (VL)“ handeln. Der vertikale Lappen beginnt bereits vor den 4 Kelchen des Pilzkörpers (MB) und ist paarig als kleine Ausstülpung erkennbar. Jeder der beiden Ausstülpungen, müsste dann aber als „Lobus Beta“ noch jeweils geteilt sein, weil es 4 Stiele sind. Paarig 29_0_29 und geteilte Dopplung sind als „2_4_2_212“ sind vorhanden: Epi.Y!Ameise.Z.185#242212531429029.
In der Draufsicht ist das Deutocerebrum nicht sichtbar, so dass es sich wegen der zentralen Lage in den Zeilenlauf des Pilzkörpers hineinschieben muss. Es sind 2 Nervenzentren enthalten: 1.) Das mechanosensorische und motorische Zentrum der Antenne (AMMC) empfängt Signale der ersten beiden Antennensegmente (Scape und Pedicel) über die Antennalnerven und bewegt die Kopfmuskeln. 2.) Der paarige Hauptantennenlappen (AL) empfängt Signale aus dem 3. Antennen-Segment (Flagelum) der Geißel über Antennalnerven. Die Signale der Chemorezeptoren werden im Antennalnerv im Verhältnis 15:1 gebündelt. Der Antennalnerv ist paarig 74_505=Loch_47 und als Verhältnis 15:1 mit „1_7_15“ zu identifizieren: Epi.Y!Ameise.Z.216#207450547751715. Der Hauptantennenlappen (AL) ist aufgrund Bixnom-Kurve „64“ als kreisrunder Lappen „55_4444“ erkennbar. Die Struktur 55 wird dann mit dem Nerv=7 in Beziehung gesetzt als „55_7_33_17_17“ sowie „115“ als 15:1: Epi.Y!Ameise.Z.217#206494554444103, Epi.Y!Ameise.Z.218#205547331717295 und Epi.Y!Ameise.Z.221#202757096445115. Die Mitte des Gehirns liegt vor, wenn die Bixnom-Kurve für die Hirnwölbung am Pilzkörper von „64“ in die Gegenkrümmung „46“ als „646“ übergeht und „52_5_25“: Epi.Y!Ameise.Z.225#199152525841646.
Die Speiseröhre (Ösophagus) „808“ führt durch das Gehirn. Aufgrund der Krümmung vom Schlund zum Thorax wird die Speiseröhre beim Scann doppelt getroffen. Der ebenfalls als „808“ bezeichnete „Speichelgang“ ist an dieser Position nicht zu erwarten. Epi.Y!Ameise.Z.191#234603760808222 und Epi.Y!Ameise.Z.274#163537658081644.
Der paarige Sehnervenlappen (Lobus opticus) schiebt sich in den Zeilenlauf des Pilzkörpers und besteht aus der Lamina ganglionaris (Ganglienplatte / LA), der Medulla (ME) und der Lobula (LO). 1.) Lamina ganglionaris: Die 6 Photorezeptoren der Netzhaut des Facettenauges sind mit den 6 Laminasäulen der Lamina verschaltet als Säulen 55_6_55 und Nerv=7 / Sehnerv=2 in „227“. Z.365 als ganzjährig: Epi.Y!Ameise.Z.365#122765255655809. 2.) Medulla-Neuropil: Die Medulla ist in Kolumnen (Säule) gegliedert, die Signale der Netzhaut von der Lamina ganglionaris über 8 Axione erhalten. Die Übermittlung erfolgt über 2 Zeilen als Spalte einer Gruppe 44 mit QS 4+4=8=Medulasäulen, in dem sich die Bixnom-Kurve von „64_4“ zu „4_46“ über die Zeit=12/24 spiegelt: Epi.Y!Ameise.Z.368#121764451941224 und Epi.Y!Ameise.Z.369#121434466976613. Medulla 222 mit 8 Medulla-Säulen „5¬_8“ „Epi.Y!Ameise.Z.373#120132220681958. 3.) Das Lobula-Neuropil erhält Signale von der Medulla und ist ebenfalls in Säulen „11_11_0_11“ organisiert. Epi.Y!Ameise.Z.374#11981101153575. 4.) Punktauge: Die Nervenfasern für die 3 Punktaugen (Ocelli) können nunmehr unpaarig in Hirnmitte angeordnet werden. Die Zeile Z.379 bietet 3 Nerven „7“ oben=9 an. Die 3 Punktaugen sind als „303“ symbolisiert. Entscheidend ist die Zahl „2“ am rechten Zahlenrand. Mit 303 und 33 kann daraus 606 gedeutet werden, was eine Null-Setzung für die Punktnerven bei sterilen Arbeiter*innen „66“ mancher Ameisenarten bedeuten kann - die Ocellen fehlen oder sind nur rudimentär vorhanden. Die Ameise vermeidet es, die Zahl „2=paarig“ zu lesen, weil dieses 6 Nerven für 3 Punktaugen zur Folge hätte. Daher wird die Zahl 2 auf 2 Nerven für das Mittelauge bezogen, so dass insgesamt nur 4 Nerven benötigt werden: Epi.Y!Ameise.Z.379#118230391330792.
Ende des Pilzkörperbereichs mit dem Kelch als Doppel-Ring „7_2_202_7“ und als paarige Anordnung 72_27 für 4 Ringe. Beim Menschen könnte unter 9_1_9 mit der Ziffer „1“ der Riechnerv als 1. Gehirnnerv erkannt werden. Die Zählgröße 11 ist auch als Z. QS 3+8+0=11 enthalten: Epi.Y!Ameise.Z.380#117919258722027. Aufgrund der Ringform des Pilzkörpers ist vor dem Ring-Ende noch ein Blick die Tiefe des Gehirns möglich. Das Protocerebrum zeigt in der rückseitigen Ansicht dorsal und zentral 3 symmetrische Strukturen (Stapel von oben nach unten): 1.) Die Protocerebralbrücke (PB) verbindet beide Hirnseiten. Nur in einer Abbildung gehen von der Brücke unpaarig und mittig 4 „Finger“ nach oben, die sonst fehlen „404_111“: Epi.Y!Ameise.Z.382#117301880404111. Protocerebralbrücke (PB) „11_909_33_11_33“: Epi.Y!Ameise.Z.384#116690933110339. 2.) paarige Noduli „38_Nerv=7_83_777“: Epi.Y!Ameise.Z.385#116387839777585. 3.) paariger, medialer Lappen (ML) des Pilzkörpers (MB) 79_33_79_999_Zeit=24: Epi.Y!Ameise.Z.388#115487933799924.
Beim Scann des Gehirns von vorn (rostal) nach hinten (kaudal) wird zuletzt das paarige Gnathal Ganglion (GNG / Unterschlundganglion / subesophageal ganglion) sichtbar, mit dem die Mundwerkzeuge innerviert werden. Das Unterschlundganglion setzt sich aus 3 Anteilen zusammen (Mandibular-, Maxillar- und Labialganglion). Der mögliche Zeilenbereich ist mit dem Körpergelenk zum Thorax in Zeile Z.494 begrenzt. In diesem Abschnitt sind die Aorta, der Speichelgang, die Speiseröhre, Nervenstränge und ist das Fußglied des 1. Beinpaares einzuordnen. Das Unterschlundganglion reguliert im Zusammenwirken mit den Ganglien der einzelnen Körperregionen die Atmung des Tracheensystems. Zunächst wird eine Tracheen-Gruppe 44_QS 3+7=10 gebildet. Die Zahl „10“ steht auch paarig am linken Zahlenrand. Der Insektenbauplan sieht auf jeder Körperseite 10 Atemöffnungen (Stigma) vor, zugleich aber auch 10 Luft-Längsröhren. Der Kopf kann keine Stigmen enthalten, weil die Gruppe erst jetzt gebildet wird. In der Zeilennummer ist Z.4+8=12 Stunden enthalten, weil sich die Insekten visuell am Tageslauf orientieren. Für die Atmung wird mit „60“ nach Sekunden gezählt Nerv=7_605_7. Darin ist die Atemfreqenz mit 0,5 Hertz (Hz) enthalten, die die Ameise offenbar Laufkäfern vererbt hat, bei denen sie gemessen wurde. Epi.Y!Ameise.Z.408#109826760574437. Bei den 10 Luft-Längsröhren gruppieren sich 4 Röhren zentral um die Speiseröhre (Ösophagus), 2 Röhren dorsal, 2 Röhren ventral und 2 Röhren seitlich. Das sind in beiden Hälften 5 Röhren, paarig als 5_58_58. Von der Anzahl der 5 Röhren liegen davon 4 am Verdauungstrakt „8“ als „548“. QS 7+4=11 ist eine Zählgröße 11: Epi.Y!Ameise.Z.409#109558235487458. Die beiden „2“ seitlichen „9“ Längsröhren 10_9_2_9_10_202 enthalten jeweils 10 Atemöffnungen (Stigma) „202“, von denen nicht notwenig alle offen sichtbar sind. Entweder fehlen diese, liegen unter Hautschuppen oder können durch Filter geschützt sein. Im Hinterleib mit 5 Segmenten ist das 1. Stigmen-Paar „202“ offen und mit dem Luftsack „2000“ verbunden. Die folgenden 4 Stigmen-Paare „202_11“, sind aufgrund der Spaltöffnung „11“ durch Filter geschützt. Am Stielchen (Petiolus) ist 1 Stigmen-Paar vorhanden, so dass nach dem Insektenbauplan auf den Thorax noch 4 Stigmen-Paare entfallen würden. Sichtbar sind von den 4 vorhandenen Codezeilen nur 2 Stigmen-Paare, die markanter adressiert sind: Epi.Y!Ameise.Z.410#109291020278952.
Speichelgang zwischen Thorax und Mundwerkzeugen: Der Speichelgang passiert das Körpergelenk am Hinterhaupt des Kopfes. Welcher Zifferncode den Speichelgang beschreibt, ist noch nicht abschließend geklärt. Im Zeilenlauf des Thorax liegt vor dem Übergang zum Kopf die Ziffer „#8“ an, so dass sich oberhalb des Ösophagus eine paarige Drüse wie die Speicheldrüse „888“ ausbreitet. Um das Sekret über einen Speichelgang auszuleiten, bilden die beiden Drüsen jeweils einen dünnen Drüsenschlauch 5_1_88. Die Schläuche erscheinen neben dem Ösophagus als QS 88_8+1=9=seitlich_808=Ösophagus_QS 8+1=9=seitlich, weil diese neben dem Ösophagus nach unten ziehen, um sich noch vor dem Kopf zu einem gemeinsamen Drüsenschlauch zu vereinigen: Epi.Y!Ameise.Z.526#851888180881565. Ein Problem liegt darin, dass die Form-Engstelle „707“ vom Thorax zum Hinterhaupt nicht 3-fach als „808“ - Ösophagus plus 2 Speichelgänge - passiert werden kann. Der Drüsenschlauch 88 muss daher mit „8_700_8“ zu einem Speichelgang „700“ umgeschrieben werden, womit ein Volumen „00“ und eine Signalleitung „7“ adressiert wird. Die chemische Kommunikation mittels Speichel zu den Larven wird einem Nerv=7 gleichgesetzt. Der Speichelgang wird erst im letzten Abschnitt vor der Zunge zu einer engen Speichelröhre „707“, so dass keine Verwechslung mit der Form-Enge am Kopfübergang „707“ gegeben ist. Die beiden Drüsenschläuche sind noch nicht vereinigt: Epi.Y!Ameise.Z.515#870083850764473. In den Zeilen-Nr. Z.500 bis Z.509 läuft die Ziffer O(Null) für eine Röhrenform mit. Bei Annäherung an die Engstelle zieht mit „777“ die Ganglienkette durch und gleichzeitig kommen die beiden Speichelgänge zusammen als 88_07_77_07: Epi.Y!Ameise.Z.504#889073776078777. Der vereinigte Speichelgang „700“ liegt nunmehr vor. Die „700“ liegen nur vorn-mitte-hinten vor, so dass noch eine spiralförmige Auskleidung als eine Zählgröße für Zwischenpositionen benötigt wird. Epi.Y!Ameise.Z.502#892615902676700. Die Engstelle „707“ vom Thorax zum Hinterhaupt zeigt sich mit seitlich=90_707_09 als enge Ausformung, so dass das Kopfgelenk „707“ oder gleichwertig noch folgen müsste: Epi.Y!Ameise.Z.494#907071220938671. Der Speichelgang enthält den Speichel „77“ als Universalwirkstoff und wird seitlich=9 wie eine Luftröhre „22“ als 92_77_29 mit hartem Material ausgekleidet, und zwar wegen der Bixnom-Kurve „64“ spiralförmig als 7_64_7: Epi.Y!Ameise.Z.483#927729157647419. Die Auskleidung „2002“ ist spiralförmig „64“ angelegt und besteht aus hartem Material (Sklerite) „22“. Die Zeilen-Nr. Z. 4+6+1=11 ist eine Zählgröße 11 und sorgt für einheitliche Gestaltung: Epi.Y!Ameise.Z.461#972002566472242. Der Ösophagus „808“ zieht durch die Engstelle. Es sind dafür 2 Zeilen mit „1000_20_808_20“ und „55_808_55_Muskel“ vorhanden: Epi.Y!Ameise.Z.451#993554729808655 und Epi.Y!Ameise.Z.448#1000207998088620. Ein mögliches Körpergelenk „707“ ist in Z. 416 vorhanden. Dieses soll aber ein Fußgelenk am Putzapparat bilden. Kopfgelenk: Es bieten sich 2 Zeilen mit dem Bixnom-Kreis „64“ für ein Kugelgelenk an: Epi.Y!Ameise.Z.431#103965935764200 und Epi.Y!Ameise.Z.430#104207717010164. Der Speichelgang „700“ ist nochmals unterhalb des Gehirns sichtbar: Epi.Y!Ameise.Z.346#129506700330550. Die Mundwerkzeuge sind evolutionär als Beinpaare zu betrachten. Den imaginären Beinpaaren wäre dann auch eine Ganglienkette „777“ zuzuweisen. Die „777“ muss deshalb alternativ für eine Schlaufe im Speichelgang verwendet werden. Als Senkrechte „777“ für Aufstieg- und Abstieg sind für eine Schlaufe 2 Zeilen erforderlich. Dazwischen zeigt sich nochmals der Speichelgang „700_464“, wobei der Speichelgang mittels Krümmung- und Gegenkrümmung „4_6_4“ verdreht wird. Die Schlaufe liegt vor dem Gehirn, so dass die „777“ nicht für das Nervensystem benötigt wird: Epi.Y!Ameise.Z.284#157779289839332, Epi.Y!Ameise.Z.284#182151700464920 und Epi.Y!Ameise.Z.210#213377706258906. Der Speichelgang geht von „700“ als Volumen in eine enge Röhre „707“ über: Epi.Y!Ameise.Z.157#285409670792168 und Epi.Y!Ameise.Z.137#327075316163287. Der Speichelgang endet anschließend im einem Salivarium mit einer Mündung hinter der Zunge (Glossa). Das Salivarium steht bei hochgeklappter Zunge senkrecht als „7777“. Die ständige Lageveränderung des Salivariums ist als Drehung mit der Quersumme QS=64 enthalten: Epi.Y!Ameise.Z.133#336912167777221.
Exoskelett: Das Exoskelett der Insekten besteht aus Chitinfasern. Die Ameisen können aber auch Stoffe züchten oder sammeln. Die Blattschneiderameise „Acromyrmex echinatior“ kann die Außenschale mit einer harten Schutzschicht aus manganreichem Calciumkarbonat umhüllen. Zeilen, die Mangan=25 und die Haut=33 enthalten wie „25_555_33“ mit Extra=8 bzw. Z. QS 3+4+1=8 sind dafür ein geeigneter Auslöser. Epi.Y!Ameise.Z.341#131405625555338. Bei Ameisen kann sich beginnend am Hinterkopf ein Kamm aus wenigen langen Stacheln über den Rücken ziehen. Alternativ sitzt oben=9 auf dem Kopf kein einzelner Stachel „404_111“, sondern beidseitig 33_11_33 ein Kamm aus kurzen Stacheln 11: Epi.Y!Ameise.Z.382#117301880404111 und Epi.Y!Ameise.Z.384#116690933110339.
Laufbeine: Das 1. Beinpaar (Vorsilbe „Pro-“) der Ameise ist mit der Hüfte (Procoxa) am Thorax angeschlossen. Weil das Vorderbein zum Kopf ausgerichtet ist, wird dessen Fuß (Protarsus) bereits mit dem Ameisenkopf gebildet. Das Oberschlundganglion reiht sich dann in die Fußbildung im Zeilenlauf ein. Der Thorax und der Hinterleib werden vom Bauchmark in der Art eines Strickleiternervensystems durchzogen. Es enthält eine Serie von Ganglienpaaren mit einer Querverbindung. Im Bereich des Thorax sind 3 Ganglien-Paare für die Bewegung der 3 Beinpaare und Flügel einzuordnen.
Das 5-teilige 1. Beinpaar beginnt mit dem Fuß (Protarsus). Der Fuß besteht aus 5 Fußgliedern (Tarsomere) und einem Endglied (Prätarsus). Das Endglied besteht aus einem entfaltbaren Haftorgan (Arolium) und einem Krallen-Paar. Das Haftorgan beginnt, weil es vor den Krallen aufsetzt. Der Fuß bildet sich als Fußgruppe 11_44_8, paarig=2. Durch das gesamte Bein läuft eine Sehne „11“ bis zur Unguitraktorplatte „22“ im Endglied (Prätarus): Epi.Y!Ameise.Z.396#113154844228208. Das Haftorgan (Arolium) liegt zwischen den Krallen und wird durch den „Arcus“, eine U-förmige Struktur im Aroniumsack bei Bedarf entfaltet. Der „Arcus“ wird durch die Bixnom-Kurve „64“ erzeugt, weil darin eine „Entfaltung“ als Einschluss „6_oben=9_QS 8+1=9_9_4“ enthalten ist: Epi.Y!Ameise.Z.397#112869819431663. Krallen: Das Krallen-Paar zeigt sich als Bixnom-Kreis „64“ mit Markierung der „22“ in 6226. Zwar ergibt sich 6_QS 2+2=4, gemeint ist mit der Ziffer „2“ aber die Kralle als ein Halbkreis der Form „2+0+5=7“. Kralle paarig 2 als Extra 8: Epi.Y!Ameise.Z.398#112586226920528. Die 5 Tarsomere enthalten Gelenke, die mittels weicher Haut=3 erzeugt werden. 5. Tarsomere „11“ mit Gelenk 3_040: Epi.Y!Ameise.Z.399#11230405592574. 4. Tarsomere „11“ mit Gelenk 202_3: Epi.Y!Ameise.Z.400#112023295785926. 3. Tarsomere „111“ mit Gelenk 393_606: Epi.Y!Ameise.Z.401#111743935946061. 2. Tarsomere „111“ mit Gelenk 659_659: Epi.Y!Ameise.Z.402#111465965956145. Am 1. Glied ist zur Reinigung der Fühler ein Putzapparat am oberen Gelenk ausgebildet, der aus einem behaarten Putzkamm und eine Putzscharte als Rinne mit seitlicher Aufwallung besteht. Vergleichsweise befinden sich bei der Honigbiene die Haare am Rand einer Putzrinne und zum Abstreifen des passend einsteckbaren Fühlers dient eine haarlose Fahne. Putzscharte als langer Schlitz „1111“ mit beidseitiger Aufwallung seitlich=oben=99: Epi.Y!Ameise.Z.403#111189375469902. Der Putzkamm besteht aus einem Sporn 11 mit seitlich=9 angesetzter, flächiger „1_4_1“ Behaarung „1“. Die als Putzaufgabe ist mit der Zeit=24 und mit der Zeilennummer Z.404, enthalten, die die Fühler als Gruppe 44 in Zeile 1 im Querschnitt „0“ passend in der Rinne „404“ zeigt: Epi.Y!Ameise.Z.404#110914154243491. Oberschlundganglion „777“: Epi.Y!Ameise.Z.406#110367779099434. Der Putzkamm liegt am oberen Gelenk des 1. Fußgliedes (1. Tarsomere) am Vorderbein. Das obere Fußgelenk „707“ gehört zum Putzapparat, so dass das Kopfgelenk „707“ erst noch folgt. Die Lage des Körpergelenks muss durch weitere Details bestätigt werden. Nahe dem Kopf liegt ein Luftsack „64_2000“. Weil das Gelenk erst folgt, müsste der Kopf nach unten geneigt sein: Epi.Y!Ameise.Z.431#1039659357642000. Der gesamte Vorderfuß liegt neben dem Kopf. Fußgelenk „707“: Epi.Y!Ameise.Z.416#107714707486467. 1. Tarsomere „111“: Epi.Y!Ameise.Z.493#908911121995342. Kopfgelenk am Thorax „707“: Epi.Y!Ameise.Z.494#907071220938671. Schiene (Protibia) „111“: Epi.Y!Ameise.Z.534#839125811130531. Schenkel (Profemur) „111“: Epi.Y!Ameise.Z.546#820683485611178. Ganglienpaar (1. von 3 im Thorax) „777“, paarig und gespiegelt 939_93: Epi.Y!Ameise.Z.576#77793955406893. Schenkelring (Protrochanter) „111_0“: Epi.Y!Ameise.Z.589#760769411109853. Hüfte (Procoxa) „111“: Epi.Y!Ameise.Z.655#684111729990387.
Die 3 Beinpaare sind jeweils einem der 3 Brustsegmente zugeordnet: Vorderbrust (Prothorax), Mittelbrust (Mesothorax) und Hinterbrust (Metathorax). Die Königin und das Männchen (Drohne) besitzen am 2. und 3. Segment jeweils ein Flügelpaar. Die unbegattete Königin (Jungfer) „66“ wird über die Zeile Z.660 adressiert, in der bereits die Zeit=24 für den Hochzeitsflug an einem warmen windstillen Tag enthalten ist: Epi.Y!Ameise.Z.660#678929065369248. Die Flugmuskulatur „555“ wird für die Königin über die Zeilennummer Z.66_5 und für das Männchen (Drohne) im Zifferncode „33_555“ und räumlich bzw. als Gruppe mit dem Hinterflügel „444“ angelegt. Die sterilen Arbeiter*innen bilden keine Flugmuskulatur aus. Die Arbeiter*innen besitzen teilweise weibliche Anlagen und können mit der 55 als Klammer „5665“ noch speziell von einer Flügelentwicklung ausgeschlossen werden: Epi.Y!Ameise.Z.662#676877920156652. Der Flügel ist gegenüber den Beinen „111“ als „222“ sekundär, wobei zunächst die Ziffer „2“ mit weiblich/männlich 66/33 verbunden wird: Epi.Y!Ameise.Z.672#666805332059082. Der Vorderflügel ist paarig 66_66: Epi.Y!Ameise.Z.673#665814536617687. Vorderes Flügelpaar „222“: Erneut ist 66_66 enthalten, so das „6645_QS 2+6+6+8+1+2+2+2+1+1+2=33“ abgeteilt werden kann, um auch das Männchen „33“ in 2_2 zu erwähnen: Epi.Y!Ameise.Z.674#664826681222112. Der Insektenflügel wird von 6 Longitidinaladern durchzogen, die nach dem Comstock-Needham System beginnend an der Vorderkante mit „seitlich=9“ bezeichnet werden. Die Longitidinaladern sind jeweils über ein Gelenk „0“ mit dem festen Teilen des Rückens (Sklerite) „2_5_0_2 verbunden. Bei den Insekten besteht zu 4 Skeliten des Rückens eine Verbindung: Epi.Y!Ameise.Z.677#661880625027627. Longitidinalader: 1.) Costa (C) „999“, Gelenk „090“: Epi.Y!Ameise.Z.678#660904399916967. 2.) Subcosta (Sc) „99“, Gelenk „050“ : Epi.Y!Ameise.Z.679#659931050285278. Gelenkverbindung für Radius (R) vorab mit Null in Zeilennummer Z.680 und als „605“: Epi.Y!Ameise.Z.680#658960563446623. 3.) Radius (R) „99“: Epi.Y!Ameise.Z.681#657992926789579. Basalnerv „777“: Epi.Y!Ameise.Z.682#657028127776691. Die 4. Gelenkverbindung zu einem festen Teil des Rückens „606“: Epi.Y!Ameise.Z.683#656066153943929. Die Flügelkante „151“ wird zwischen Costa/Subcosta auf halber „929“ Flügellänge durch einen Knoten (Nodus) „900_151“ als Struktur „55“ ausgesteift, um ein Abknicken des Flügels zu verhindern. Epi.Y!Ameise.Z.684#655106992900151. 4.) Median (M) „99“: Epi.Y!Ameise.Z.686#653197059976244. Die seitliche Abrundung des Flügels vollzieht sich im Zeilenlauf über den Durchlauf mit der Bixnom-Kurve „#64“ ab Zeile Epi.Y!Ameise.Z.690#649410410353193. 5.) Cubitus (Cu) „99“: Epi.Y!Ameise.Z.693#646599109875474. An der Vorderkante des Flügels wird ein Feld „44“ adressiert, dass sich mit einem Farbstoff „888“ eingefärbt ist und an der Flügelkante 11 als Flügelmal (Pterostigma) sichtbar ist: Epi.Y!Ameise.Z.696#64381204474670, Epi.Y!Ameise.Z.697#642888354582071 und Epi.Y!Ameise.Z.698#641967311094131. Ende der seitlichen Flügelausrundung „64“ an der Flügelhaut 1_33_1: Epi.Y!Ameise.Z.700#640133118776719. 6) Analadern (1A, 2A ... mehrere, sofern vorhanden): A1: „99“ Epi.Y!Ameise.Z.701#639219947423257. A2: „99“ Epi.Y!Ameise.Z.704#63649599878367. Der Hinterrand des Vorderflügels „999“ kann als Form 7 gefaltet „76_191_67“ sein, so dass sich eine Hakenreihe (Hamuli) des Hinterflügels dort einhaken kann, um im Flug eine vereinigte Flügelfläche zu erzeugen: Epi.Y!Ameise.Z.708#632899976191672.
Das 5-teilige 2. Beinpaar ist kaudal ausgerichtet und beginnt mit der Hüfte (Mesocoxa) „111“: Epi.Y!Ameise.Z.710#631117159357329. Die Entwicklung der Flugmuskulatur wird nicht nochmals gesondert auf die Königin und die Männchen (Drone) beschränkt, so dass die eingangs gebildete Flügelgruppe „444“ noch besteht. Flugmuskulatur „55“: Epi.Y!Ameise.Z.717#624955625026086. Vor dem Hinterflügel wird die Königin mit „66“ adressiert und das Männchen nur halbherzig als „3“ in 2_13_292. Der Rest „31“ folgt in der Flügelzeile als Zählgröße 3_11: Epi.Y!Ameise.Z.718#624085213292066. Hinterflügel „7_222_7_31“ Epi.Y!Ameise.Z.719#623217222731159. Die Hakenleiste am Hinterflügel (Hamuli) wird als Hakengruppe „1_44“ aus Einzelhaken (Hamulus) „1“ adressiert. Zur Flächenbildung mit dem Vorderflügel ist der Bixnom-Kreis „64“ zur Strukturverbindung QS 2+3=5_51_64_QS 2+3=5_551 enthalten: Epi.Y!Ameise.Z.720#622351643255144. Fortsetzung 2. Beinpaar: Schenkelring (Mesotrochanter) „505_111“: Epi.Y!Ameise.Z.735#609650589311161. Fortsetzung Hinterflügel: Longitidinalader: 1.) Costa (C) „99“: Epi.Y!Ameise.Z.737#607996177942610. 2.) Subcosta (Sc) „99“: Epi.Y!Ameise.Z.742#603899168657282. 3.) Radius (R) „99“: Epi.Y!Ameise.Z.745#601467359924434. 4.) Median (M) „99“: Epi.Y!Ameise.Z.747#599857005547126. 5.) Cubitus (Cu) „99“: Epi.Y!Ameise.Z.748#599055057678748. 6.) Analadern (A1) „999“, Ende Hinterflügel: Epi.Y!Ameise.Z.776#577439668999618.
Nach dem Insektenbauplan sind zwar für 10 Atemlöcher 10 Möglichkeiten vorhanden. Von den 4 möglichen Stigmen im Thorax sind 2 nicht sichtbar oder nicht vorhanden, weil die Zeile entweder für den Darm „808“ oder die Königin „666“ mitgenutzt werden. Unsichtbare Tracheen „202“: Epi.Y!Ameise.Z.657#682029198087829 und Epi.Y!Ameise.Z.751#596662028154066. 1. sichtbares Atemloch-Paar (Stigma) am Thorax: Die Zeilen-Nr. Z.764 enthält den Nerv 7 kombiniert mit dem Taktgeber 1_64 im Unterschlundganglion als Bixnom-Kreis „64“. Eine Symmetrie ist durch die Seitenlöcher „0_202_0“ adressiert. Die „55“ ist auch enthalten als QS 5+8+6+5+0+9+4+0+2+0+2+0+5+5+4=55. Wegen QS 5+5=10 handelt es sich um das Zusammenwirken aller 10 Stigmen-Paare des Insekten-Bauplanes: Epi.Y!Ameise.Z.764#586509402020554. 2. sichtbares Atemloch-Paar (Stigma) am Thorax: Die Zeilen-Nr. Z.789 bildet mit QS 7+9+8=24 Stunden die Zeit ab. Die Zeile setzt sich aus QS 5+6+1+5+2+0+2+7+9+6+2+8+7=60 Sekunden plus dem Takt 01 zusammen. In die Symmetrie Z.79_202_79 ist die Zeilen-Nr. Z.79x eingebunden: Epi.Y!Ameise.Z.798#561520279628701.
Zweite Fortsetzung 2. Beinpaar: Schenkel (Mesofemur) „111“: Epi.Y!Ameise.Z.809#553885269646111. In der Grundstellung liegen das 2. und 3. Beinpaar parallel. Diese Formdopplung 77_77 wird statt 111 als 1_77_1_77_1 symbolisiert in der Schiene (Mesotibia): Epi.Y!Ameise.Z.809#532177177130289. Der Fuß (Mesotarsus) setzt sich aus 5 normalen Gliedern (Tarsomere) und dem Endglied/Krallenglied (Prätarsus) mit dem Haftorgan zwischen dem Krallenpaar zusammen: 1. Tarsomere „11“: Epi.Y!Ameise.Z.848#528411772575122. 2. Tarsomere „11“: Epi.Y!Ameise.Z.852#525930966131107. 3. Tarsomere „11“: Epi.Y!Ameise.Z.858#522253127207114. Ganglienpaar (2. von 3 im Thorax) „777“, paarig 6_QS 4+5=9_69: Epi.Y!Ameise.Z.859#521645149177769. 4. Tarsomere „11“: Epi.Y!Ameise.Z.868#516236386110257. 5. Tarsomere „11“: Epi.Y!Ameise.Z.876#511521898565871. Prätarsus mit dem Krallenpaar „252“ in Halbkreisform 6_700_6: Epi.Y!Ameise.Z.878#510356700619252. Prätarsus mit dem Haftorgan (Arolium) mit Bezug auf den „Arcus“ als U-förmiger Bogen 6_1_1_604 und Bixnom-Kreis „64“: Epi.Y!Ameise.Z.881#508618823091604.
Das 5-teilige 3. Beinpaar ist kaudal ausgerichtet und beginnt mit der Hüfte (Metacoxa) „111“: Epi.Y!Ameise.Z.884#506892741112787. Ganglienpaar (3. von 3 im Thorax) „777“, paarig 49_49: Epi.Y!Ameise.Z.902#496777364904328. Üblicherweise wird als Hinterleib (Abdomen) erst der „Gaster“ hinter dem Stielchen verstanden. In wissenschaftlichen Bezeichnungen beginnen die 7 Abdominalsegmente bereits im hinteren Abschnitt der Hinterbrust (Metathorax) als „Propodeum“: 1.) Propodeum I, 2.) Stielchen (Petiolus II), 3.) Gaster mit 5 Segmenten (Postpetiolus III und 4 weitere Segmente IV, V, VI, VII). Am „Propodem“ ist direkt vor dem Körpergelenk zum Stielchen eine beidseitige Drüsenöffnung zu erkennen. Weil eine Atemöffnung „202“ wie am Mesothorax erst hinter der „Wespentaille“ zum Stielchen vorliegt, kann in der paarigen „geschlossene“ Öffnung die Reservoir-Öffnung der Metathorakaldrüse (Metapleuraldrüse) „22_7_22_79_22“ erkannt werden. Ein „Loch“ ist in der Zeilennummer Z.903 und in der QS 4+9+6+2+2+7+2+2+3+8+5+7+9+2+2=70 als Form 7 enthalten. Das Drüsensekret sickert aus der schlitzförmigen Öffnung heraus und wird von der Ameise zur Deinfektion auf dem Körper verteilt. Drüsenschlitz: Epi.Y!Ameise.Z.903#496227223857922. Mit der Körperoberfläche seitlich=999, Haut=3 und Universalwirkstoff=77 tritt das Drüsen-Sekret aus: Epi.Y!Ameise.Z.904#495678299937725. Wo ist die Drüse? Von der Drüse wird beispielsweise Benzolessigsäure (Phenylessigsäure) (C8H8O2) produziert, zu deren Herstellung bei einer sauren Hydrolyse Chlor=17 benötigt wird. Der sechseckige Benzolring der Säure ist als „66“ enthalten: Epi.Y!Ameise.Z.893#501784079668201. Drüse „2227999“ als Extra=8 und Hautdrüse 3_8 und einem Reservoir=500 für den Universalwirkstoff 77 zur Verteilung auf der äußeren Hautfläche 3_999_0_44_3: Epi.Y!Ameise.Z.894#501222799937028, Epi.Y!Ameise.Z.894#500662774462238 und Epi.Y!Ameise.Z.894#500103999044312.
Körpergelenk „707“ zwischen Thorax und Stielchen „707“: Epi.Y!Ameise.Z.910#492410091366707. Schenkelring (Metatrochanter) „4_00_111“: Epi.Y!Ameise.Z.934#479757155400111. Schenkel (Metafemur) „111“: Epi.Y!Ameise.Z.937#478221113280366. Schiene (Metatibia) „111“: Epi.Y!Ameise.Z.976#459111867975106. Der Fuß (Metatarsus) setzt sich aus 5 normalen Gliedern (Tarsomere) und dem Endglied (Prätarsus) mit dem Haftorgan zwischen dem Krallenpaar zusammen. Der Begriff „Metatarsus“ bezeichnet nachfolgend nur den Fuß (Tarsus) im Hinterbein (3. Beinpaar). Doppeldeutig wird bei den Insekten aber auch das 1. der 5. Fußglieder aller 3 Beinpaare als „Fersenglied (Metatarsus)“ bezeichnet. Das 3. Beinpaar kann sich bis zum Körperende strecken, so dass für eine große Länge nur „111“ gezählt werden. 1. Tarsomere „111“: Epi.Y!Ameise.Z.1015#441471116397737. 2. Tarsomere „111“: Epi.Y!Ameise.Z.1025#437164081115808. 3. Tarsomere „111“: Epi.Y!Ameise.Z.1062#421933317461114. 4. Tarsomere „111“: Epi.Y!Ameise.Z.1347#332660121116335. 5. Tarsomere „111“: Epi.Y!Ameise.Z.1367#327793111297515. Prätarsus „11“ mit dem Krallenpaar „56_56“ in Halbkreisform als halber Bixnomkreis „64“ / 2 = “32“ : Epi.Y!Ameise.Z.1376#325649115656761. Prätarsus „11“ mit dem Haftorgan (Arolium) als Binom-Kurve „64“ mit dem „Arcus“ in gedehnter Form „6000_7_4“: Epi.Y!Ameise.Z.1401#319838103600074 und Epi.Y!Ameise.Z.1402#319609973711629.
Struktur des Hinterleibs (Abdomen): Die Atemöffnungen und die Kette der Ganglien des Nervensystems ergeben eine Übersicht zur Ausdehnung des Zeilenbereichs. Aufgrund der Doppeldeutigkeit Nerv=Form=7 sind in der Serie der Zählgröße „777“ auch die äußerlich sichtbaren „Segmentringe“ zwischen den Körpersegmenten enthalten. Der Hinterleib formt sich als Außenskelett (Exoskelett) aus gekrümmten Rückenplatten (Rückenschilde / Tergite) und schmalen Bauchplatten (Sternite). Beidseitig zieht sich somit eine horizontale Trennlinie entlang, die auch die „Segmentringe“ trennt. Gut zu entziffern sind die vertikalen Segmentringe „777“, weil die paarige Bedingung als horizontales Ganglionpaar nicht erfüllt wird und andererseits die äußere Haut=33 enthalten ist. Die 4 Segmentringe 33_777 sind vorhanden. Bei den Stachelameisen (Ponerinae) ist zwischen dem 1. und 2. Hinterleibssegment eine Einschnürung vorhanden, die sich als doppelter Segmentring darstellt. Für diesen Zusatzring ist eine Zeile „33_7777“ vorhanden. Wegen der Doppeldeutigkeit Haut=männlich=33 könnte am Körperende der Segmentring eines Männchens speziell adressiert sein. In wissenschaftlichen Quellen beginnen die Segmente des Hinterleibs schon vorn im Thorax: 1.) Propodeum I, 2.) Stielchen (Petiolus II), 3.) Gaster mit 5 Segmenten (Postpetiolus III und 4 weitere Segmente IV, V, VI, VII). Bei Insekten ist an jedem Segment ein Paar Atemöffnungen (Stigma) vorhanden. Am Thorax wurde bereits eine Atemöffnung „5_202_7 ermittelt, so dass ab dem Stielchen (Petiolus) insgesamt noch 6 paarige Atemöffnungen 202 gekoppelt mit Struktur-5 und Nerv-7 einzuordnen sind. Das Nervensystem nach Art einer Strickleiter setzt sich nach den 3 Ganglien im Thorax im Hinterleib fort. Nach dem Grundbauplan der Insekten werden einschließlich des Stielchens 7 normale Ganglienpaare und ein 8. Ganglienpaar gesucht, das zusätzlich eine Ganglienmasse enthält, um das Körperende zu innervieren. Die Ganglien-Zählung „777“ muss zusätzlich eine paarige Anordnung als Dopplung einer zweistelligen Zahl enthalten. Die Möglichkeit einer Spiegelung 68/86 in Z.2087 kann daher nicht genutzt werden. Wegen der Enge im Stielchen (Petiolus) wird die Dopplung als Quersumme zugelassen, zumal eine Spiegelung mit der Zeilennummer Z.96_0 und 69_1_9 und eine paarige Markierung 2_8_2 vorhanden sind. Ganglienpaar (1. von 8. im Stielchen/Abdomen) „777“, paarig QS 2+8+2=12_QS 6+6=12: Epi.Y!Ameise.Z.938#477711282669193. Exoskelett, 1. Segmentring (vorderer Teil des Doppelringes) im Hinterleib „33_7777“ mit Haar-Kranz „1“: Epi.Y!Ameise.Z1330#336912167777221. Exoskelett, 1. Segmentring (hinterer Teil des Doppelringes) (trennt 1./2. Segment) „33_0_777_64“: Epi.Y!Ameise.Z1923#233017775945764. Exoskelett, 2. Segmentring (trennt 2./3. Segment) „33_777_0“: Epi.Y!Ameise.Z2100#213377706258906. Ganglienpaar (2. von 8. im Stielchen/Abdomen) „777“, paarig 86_86: Epi.Y!Ameise.Z.2144#208998686167772. Ganglienpaar (3. von 8. im Stielchen/Abdomen) „777“, paarig 12_12: Epi.Y!Ameise.Z.2172#206304412128777. Ganglienpaar (4. von 8. im Stielchen/Abdomen) „777“, paarig 19_19: Epi.Y!Ameise.Z.2356#190192352777463. Atemöffnung (4. von 7) „202_7_5“: Epi.Y!Ameise.Z.2210#202757096445115. Atemöffnung (5. von 7) „202_5_7“: Epi.Y!Ameise.Z.2212#202573771764785. Atemöffnung (6. von 7) „202_5_7“: Epi.Y!Ameise.Z.2218#202025781399325. Ganglienpaar (5. von 8. im Stielchen/Abdomen) „777“, paarig 79_79: Epi.Y!Ameise.Z.2498#179380777879785. Ganglienpaar (6. von 8. im Stielchen/Abdomen) „777“, paarig 44_44: Epi.Y!Ameise.Z.2521#177744221794408. Ganglienpaar (7. von 8. im Stielchen/Abdomen) „777“, paarig 73_73: Epi.Y!Ameise.Z.2587#173209579877736. Ganglienpaar ( 8. von 8. im Stielchen/Abdomen) „777“, paarig 16_16, zusätzlich wird mit der Ganglienmasse das kaudale Körperende 68_8_68 rundum innerviert: Epi.Y!Ameise.Z.2772#161649777468868. Exoskelett, 3. Segmentring (trennt 3./4. Segment) „0_777_33“: Epi.Y!Ameise.Z2792#160491827773533. Exoskelett, 4. Segmentring (trennt 4./5. Segment) „777_33 mit Ring–Null in Z.2840“: Epi.Y!Ameise.Z2840#157779289839332. Atemöffnung (7. von 7) „5_7_202“: Epi.Y!Ameise.Z.3011#14881872572026. Liste von momentan übrigen Zählgrößen „777“: Epi.Y!Ameise.Z.1103#406249486077700; Epi.Y!Ameise.Z.1152#388969777034465; Epi.Y!Ameise.Z.1471#304618071477705; Epi.Y!Ameise.Z.1868#39878577700055.
Das Stielchen (Petiolus):
Nach dem Rachen (Pharynx) folgt die Speiseröhre (Ösophagus), die den Thorax als dünner Schlauch durchläuft. Nach dem Kopfgelenk am Thorax „707“ in Epi.Y!Ameise.Z.494#907071220938671 läuft der Ösophagus „808“ als zunächst dünner Schlauch „808“ bis zum After mit Erweiterungen für Kropf, Magen und Rectalblase durch. Die Speicheldrüse liegt in der Vorderbrust und ist als Drüse 1_888_1 mit enthalten: Epi.Y!Ameise.Z.526#851888180881565. Bei der Ameisenkönigin schwillt die Speiseröhre bereits im Thorax zu einem thorakalen Kropf an, weil der Raum im Hinterleib (Gaster) durch die wachsenden Ovarien für den dortigen Kropf (Sozialmagen) zu eng wird. Die Königin ist mit „666“ gegenüber den sterilen Arbeiter*innen „66“ speziell adressiert. Die durchgehende Schwellung der Speiseröhre ist als Form-7 , oben=9 und als Bixnom-Kurve „64“ / Gruppe 44 ausgewiesen: Epi.Y!Ameise.Z.568#788896449196661. Das Ende des thorakalen Kropfes ist über die Zeilennummer als Z.888 avisiert, indem die Bixnom-Kurve „64“ gespiegelt als 0_46_0 und die Röhrenform 4404_77 vorliegen. Die Folgezeile bildet mit „404“ einen Zusammenhang, so dass wieder ein dünner Ösophagus „808“ weiterläuft, um die enge „1. Wespentaille“ als Vordertaille zu durchlaufen. Die Königin 666 ist mit QS 6+6+6=18 enthalten: Epi.Y!Ameise.Z.888#504609440477143 und Epi.Y!Ameise.Z.888#50404182580844. Ein oberer „99“, langer unpaariger Stachel „3_51_3_131_141“ als Extra=8_00 kann wegen weiteren Zeilen „51“ bis zum Körpergelenk ziehen: Epi.Y!Ameise.Z.888#498435131416800. Es gibt auch Ameisenarten, die den Petiolus nicht unterseitig gegen den Thorax stemmen, sondern oberseitig ein passgenaues Auflagerkissen für das Stielchen (Petiolus) anbieten. Das Prinzip Form/Gegenform (konvex/konkav) “64/46“ ist adressiert in „4604“ (temporär mit der Zeit=60) als stabiles Auflager „115“: Epi.Y!Ameise.Z.900#497881314604115. Vordertaille: Das Körpergelenk „707“ als Form wird über 2 Zeilen vorbereitet, indem die Hinterbrust (Metathorax) und das Stielchen (Petiolus) am gemeinsamen Gelenkraum „909“ mitwirken. Hierzu schiebt das Stielchen eine Muskel-Befestigungsplatte „Kiel (gemäß Quelle)“ in den Gelenkraum. Der Muskel zieht dorsal hoch zum Rücken der Hinterbrust. Mit räumlich=4 bzw. Gruppe=44 wird die Zahl oben=9 in 4_9_4 markiert, um die Zeilennummer Z.909 einerseits selbst als „Kiel (gemäß Quelle)“ und anderseits die Muskelverbindung am Gelenk „5_0“ mit 9_50_9 zu adressieren: Epi.Y!Ameise.Z.908#493494695092184. Das Gelenk „909“ bildet sich, in dem auch von der Unterseite des Stielchens ein Muskel „9_5“ hoch in die Hinterbrust zieht. Bei „3773“ kann es sich um ein erkennbares Haut-Auflagepolster handeln. Die Hüfte des 3. Beinpaares (Metacoxa) verdeckt den Gelenkbereich in der Seitenansicht: Epi.Y!Ameise.Z.909#492951796637738. Formeinschnürung als Vordertaille „707“ zwischen Thorax und Stielchen (Petiolus) „707“: Epi.Y!Ameise.Z.910#492410091366707. Der Petiolus grenzt sich durch ein weiteres Körpergelenk „505“ vom Hinterleib (Gaster / Abdomen) ab, so dass sich im Vergleich zur Biene zwei „Wespentaillien“ formen. Der Petiolus enthält als Spezialität selbst eine Einschnürung „707“, die von den Ameisenarten unterschiedlich interpretiert wird. Wird die Einschnürung wie bei den Knotenameisen als Körpergelenk betrachtet, bildet sich ein „Postpetiolus“. Vor 100 Jahren wurde dieses Glied als „zweiter Petiolus“ bezeichnet (Ameisen kämpfen ums Überleben, Mensch*innen um Meinungshoheit). Ameisen können eine Vordertaille, Mitteltaille und Hintertaille besitzen. Die offizielle Anatomie (siehe: Gaster (Hautflügler) – Wikipedia) verwirrt das Publikum: Alternativ wird behauptet, der 1. Hinterleibsabschnitt sei bereits mit dem Thorax unsichtbar verschmolzen. Selbst wenn die Ameise dann mit einem Petiolus nur zwei Wespentaillen (Vorder- und Hintertaille) besitzt, wird der Anfangsabschnitt des Hinterleibs (Abdomen) als „Postpetiolus“ bezeichnet, obwohl keine Mitteltaille vorhanden ist. Erst dann folgt der Gaster. Weil der Kropf (Sozialmagen) aber sofort nach der Hintertaille (mit oder ohne Mitteltaille) beginnt, liegt der Kropf dann nicht im Gaster, sondern im „Postpetiolus“ – darüber lacht die Ameise. Insbesondere auch deshalb, weil das 1. Glied der Hinterleibs bis 2/3 der Länge von den 4 Gliedern beansprucht (Ob Männchen 5 statt 4 Glieder besitzen, bleibt monentan unbekannt.). Beidseitig einer Mitteltaille liegt ein kugeliger Knoten. Fehlt die Mitteltaille wird eine hohe Schuppe aufgetürmt. In Ameisenfotos wird der Anfang des Stielchens durch die Hüfte des Hinterbeins visuell verdeckt, so dass man nur erkennen kann, dasss sich die hohe Schuppe oben entweder gegen den Thorax oder den Hinterleib abstützen kann. Vor 100 Jahren wurde beschrieben, dass am Beginn des Stielchens fast immer vorn unten ein Fortsatz gebildet wird (bei heutigen Mutanten kaum zu sehen). Der Fortsatz kann sich gegen das Metasternum stemmen, damit sich das Stielchen nicht zu stark abwärts krümmen kann. Wird dieser Anfangsabschnitt anders interpretiert, bildet sich die Knotenameise mit einer Mitteltaille für mehr Beweglichkeit (Nachteil: ohne hohe Schuppe weniger Schutz im Kampf). Ein unterer Fortsatz am Petiolus ist bei der Ameisenart „Austroponera Rufonigra“ erkennbar (siehe: Austroponera rufonigra - AntWiki). Diese Urameisen (Ponerinae / Stachelameisen) können Artgenossen nicht füttern, indem sie Nahrung aus dem Kropf (Sozialmagen) im Gaster hochwürgen, sondern müssen flüssige Tropfen mit dem Mundwerkzeug herantragen. Der Fortsatz wird bereits mit der Zeilennummer Z.911 als Zahlgröße 11 über eine Strecke avisiert. Die Z.912 und Z.915 enden am rechten Zahlenrand mit „113“ als gerade untere Linie. Die Stützfunktion zwischen Thorax/Petiolus ist mit konkav=46 / konvex=64_9 in 2 Zeilen enthalten. Die Knotenameise formt daraus eine kleine Kugel: Epi.Y!Ameise.Z.912#491330244675113 und Epi.Y!Ameise.Z.912#490792095447649. Struktur 55: Epi.Y!Ameise.Z.914#49025512378961. Fortsatzende „113“ (QS=5): Epi.Y!Ameise.Z.914#489719325840113. Formänderung vom unten Fortsatz zur hohen Schuppe, alternativ Mitteltaille „707“: Epi.Y!Ameise.Z.917#488651235707419. Ganglion „777“, paarig QS 2+8+2=12_QS 6+6=12: Epi.Y!Ameise.Z.938#477711282669193. Atemöffnung (Stigma) „202“, paarig: Epi.Y!Ameise.Z.939#477202537959216. Herzschlauch/Aorta „500“: Epi.Y!Ameise.Z.941#476188292395009. Hintertaille: Statt einer einfachen Formeinschnürung „707“ wird der Hinterleib (Abdomen) mit einem Muskelring „505“ angeschlossen. Der „Muskelring“ arbeitet nicht als „Ringmuskel“, sondern zieht kreuzweise von der hohen Schuppe durch die Hintertaille, um den Hinterleib mittels Längsmuskel heben und senken zu können. Im Stielchen sind somit 2 kreuzende Muskelgruppen 44_55 gespannt. Die 1. Muskelgruppe 44_55 setzt tief an der hohen Schuppe an, um kreuzend zur Oberseite des Muskelringes an der Hintertaille zu spannen: Epi.Y!Ameise.Z.946#473671440955289. Um den Muskel zu befestigen, muss nunmehr die hohe Schuppe als Muskelansatz beginnen. Die hohe Schuppe zeigt sich in Z.950 als oben=9 und als großes Extra=888_09=oben. Die Form-77 ist enthalten: Epi.Y!Ameise.Z.950#471677034888109. Gipfel der hohen Schuppe 696_99_353_400: Epi.Y!Ameise.Z.954#469699353400108. Weil die 1. Muskelgruppe an der hohen Schuppe schon mit oben=9 adressiert ist, muss das nun über die Zeilennummer Z.955 noch getoppt werden, indem diese den Muskel „55“ direkt als Gipfel der hohen Schuppe enthält. Die 2. Muskelgruppe: Epi.Y!Ameise.Z.955#4692075216164430. Die 1. Muskelgruppe 44_55_QS 7+2=9=oben_55 spannt zur Oberseite des Muskelringes „505“: Epi.Y!Ameise.Z.1002#447198785572558. Die 2. Muskelgruppe 2*22=44_55 spannt zur Unterseite des Muskelrings „505“. Die Gruppe summiert sich 22+22=44, weil 2 Muskelstränge den Gipfel der hohen Schuppe davor und dahinter umfassen: Epi.Y!Ameise.Z.1036#432522377551837.
Die bei Insekten übliche Lauterzeugung (Stridulation) wird von einigen Arten der Knotenameisen (z.B.) praktiziert. Die bewegliche Überlappung der oberen Exoskelettpartie des Postpetiolus als Schrillfeld bildet an der Hinterkante eine Schrillkante. Auf der Oberfläche des 1. Hinterleibsegments (Gaster) stehen in Längsrichtung nebeneinander einige Leisten der Cuticula, so dass die Reibung hochfrequente Töne erzeugt. Diese Hilferufe nehmen die Artgenoss*innen über die Bodenvibration wahr. Die Bewegung ist durch die Verschiebung des Schrillfeldes „30444_9=oben“ in den Zeilen erkennbar, und zwar von Epi.Y!Ameise.Z.1041#430444940579926 bis Epi.Y!Ameise.Z.1045#428797304443735. An den darunterliegenden Schrillleisten entsteht Reibung. Mit der Zeilennummer Z.1044 entsteht eine Leistenringgruppe 1_0_44 mit den Leisten „11“ in der Cuticula „33“ als „3113“: Epi.Y!Ameise.Z.1044#429208029831134. Die hochfrequente Tonfrequenz ist markiert als 9_20802 Hz_9, so dass die Hörgrenze des Menschen von 20000 Hz knapp überschritten ist. Die Vibration baut sich nach einigen Zeilen als Zeitdifferenz Z.1044-Z.1052 als „#393939“ auf.
Hinterleib/Abdomen: Um den Hinterleib mittels der Muskeln bewegen zu können, muss der Muskel genau betrachtet natürlich auch am Hinterleib ansetzen. Dazu wird die Muskelbefestigung im Hinterleib überlappend als Hülse in den Petiolus eingestülpt. Hierfür sind 2 gleichartige Ringgruppen 3¬_0_444 als Bezug zur Haut=3 vorhanden: Epi.Y!Ameise.Z.1041#430444940579926 und Epi.Y!Ameise.Z.1045#428797304443735. Im Hinterleib müssen die beiden Muskelgruppen 55 und 44_44 funktionell ansetzen: Epi.Y!Ameise.Z.1050#426755412517813, Epi.Y!Ameise.Z.1051#426349365503048 und Epi.Y!Ameise.Z.1052#425944090440783. Speiseröhre (Ösophagus) „808“ im Hinterleib: Epi.Y!Ameise.Z.1059#423128595980834.
Im Hinterleib kann sich die Speiseröhre zum Kropf (Sozialmagen) erweitern, weil der unpaarige Herzschlauch (dorsal vessel / cardic tube) aufsteigt und sich in der Mitte unterhalb der Rückenplatte (Tergit) entlangzieht. Im Herzschlauch sind klappenartige Ventile (Ostien) und Paare von Alary-Muskeln vorhanden, um die Hämolymphe aufzunehmen und durch die Aorta nach vorn (rostal) zum Kopf zu pumpen. Der Aorta fehlen Ostien und Alary-Muskeln. Der Querschnitt des Hinterleibs schichtet sich durch 2 Membranen in 3 Ebenen (Kompartimente): 1.) Sinus perikardialis als obere Ebene: Der umgebende Blutraum (Blutsinus) des Herzschlauches wird durch eine durchlässige Gewebeschicht vom übrigen Blutraum des Abdomens abgegrenzt. An diesem dorsalen Zwerchfell sind die „oberen Alary-Muskeln“ beteiligt. 2.) Der „Sinus perivisceralis ( Mixocoel / Haemocoel / perivisceral cavity) “ als mittlere Ebene bildet die Bauchhöhle für die inneren Organe. 3.) Der „Sinus perineural“ mit der Ganglienkette wird durch das ventrale Zwerchfell abgedeckt, an dem die „unteren Alary-Muskeln“ beteiligt sind.
Blutkreislauf-Liste: Vor der Suche nach den inneren Organen wird zunächst der Bedarf für den Blutkreislauf reserviert. Der Herzschlauch / Dorsal Vessel (HERZ) „5005“ ist als markanter Muskelschlauch an 6 Positionen zu finden. Die Zahl „5005“ schiebt sich sortiert in 2 Staffel von links über mittig nach rechts. Der Herzschlauch als Bezugsgröße „500“ wird mit einer Membran „33“ als Oberes (dorsal) Diaphragma (DDph) „500_33“ verknüpft. Das Obere (dorsal) Alary-Muskel-Paar (DAlary) „paarig=2“ kombiniert den Muskel „55“ und die gespiegelte Lage am Herzschlauch „525“ als „5525 bzw. 5255“. Weil für 5 Ostien 6 obere Alary-Muskel-Paare benötigt werden, wird „52565“ mit dem Muskel „555“ in der Folgezeile als Bereich akzeptiert, zumal sich das Körperende hinten schräg zuspitzt. Das Untere (ventral) Alary-Muskel-Paar (VAlary) „paarig=2“ arbeitet im offenen System, so dass mit „offen“ der Muskel „55“ getrennt wird als „5_525 bzw. 525_5“. Hinter dem letzten DAlary wäre eine VAlary unnötig. Für das Untere (ventral) Diaphragma (VDph) wird die Membran „33“ mit der Strickleitersprosse „77“ in der horizontalen Ganglienkette „777“ des Nervensystems sehr eng verknüpft als „3377 bzw. 7733“. Entsprechend den 5 Segmenten des Hinterleibs sind 5 Herzschlauch-Klappen (Ostien) erforderlich. Die gesuchten 5 Ostien am Herzschlauch bildet sich als Strukturloch und Muskelring „505“ in Verbindung mit der Zahl „11“ als verschließbare Spaltöffnung „505_11“ oder „15051“. Das 1. Ostium enthält den Herzschlauch „500“ als AUF/ZU-Klappe „5150500“. Die Atmung erfolgt über das Tracheensystem mittels der Tracheen als starre Röhren. Nach außen sind Atemöffnungen (Stigmen / Stigma) vorhanden. Bei der Ameise werden für die 5 Segmente des Hinterleibs 5 Stigmen-Paare (Stigma) benötigt. Beim Menschen dient die Anzahl der Luftröhren-Knorpelringe „22“ als Zahlgröße. Für die Stigmen der Ameise werden die paarigen Luftlöcher „202“ mit der Zahl 11 als verschließbare Spaltöffnung „202_11“ kombiniert. Das 1. Stigma ist nicht direkt als Spalt „11“ zu finden, weil es ungeschüzt ist und eine offene Verbindung zum inneren Luftsack „2000“ besteht. Das 1. Stigmen-Paar ist daher mit dem Spalt „11“ indirekt in der Zeilen-Nr. Z.1153 adressiert. Das offene Loch enthält in der Membran 33 den Bixnom-Kreis „64“ als „202_3_64_3“. Die Atmung der Insekten ist somit eine Quadratur des Kreises als Finetuning. Für das 4. Stigmen-Paar, werden zwei benachbarte, gültige Zeile als 1 Stigma gezählt, bei denen die gegenüberliegenden beiden Öffnungen offenbar nicht spiegelbildlich vorliegen. Die Tracheen entstehen durch eine Ausstülpung der Epidermis nach innen, so dass die Röhren mit Chitin ausgekleidet sind. Um diese Cuticula winden sich zwecks Aussteifung spiralförmige Strukturen (Taenidien). Die Tracheen bilden immer feinere Verzweigungen (Tracheolen) zur Luftversorgung der Zellen. Aufgrund dieser Wicklungen sind die Tracheen evtl. mit einem Loch=0 je nach Größe als 22, 222, 2222 zu erwarten. Für das Tracheensystem wurden entsprechend den 5 Segmenten im Hinterleib (Gaster) 5 Stigmen-Paare festgestellt. Nach wissenschaftlicher Zählart fängt das Abdomen nicht im Hinterleib (Gaster) an, sondern mit dem letzten Brustabschnitt, gefolgt vom Stielchen (Petiolus) und dem Postpetiolus, so dass 8 Segmente als Abdomen vorliegen. Für das Tracheensystem müssen insgesamt 10 Stigmen-Paare gefunden werden, am Kopf sitzen keine Stigmen. Im Unterschlundganglion wurde hierfür eine Steuereinheit adressiert. Nach dieser Zählweise müssen die restlichen 2 Stigmenpaare im Thorax zu finden sein. Das ist auch zutreffend, jedoch passt das alles so nicht zusammen: Im Thorax sind 4 Möglichkeiten „202“ vorhanden, von denen 2 zumindest nicht als Stigma sichtbar sind. Die 1. Möglichkeit in Z.657 wird für den Ösophagus „808“ mitgenutzt und die 2. Möglichkeit ist mit „666“ ein Bezug zur Königin. Tatsächlich zeigt eine Mikroskopie, dass der Ösophagus der Königin auf der streifenförmigen Längsmuskulatur das Kreis-Muster „202“ einer runden Muskulatur bildet. Die sterilen Arbeiter*innen „66“ werden davon mit 0(Null) ausgeschlossen „066“. Die Zahl 66 wird auch von der Quersumme dieser Zeile gebildet. Der Ringmuskel „202“ am Verdauungssystem „8“ bildet sich als eine Überlagerung, wenn die Ziffer „1“ zwecks Addition auf die´Zahl „54“ gelegt wird, so dass mit 1+54=55 ein Ringmuskel-Bild „202_55“ als Dopplung „2“ über die Oberfläche des Ösophagus der Königin 666 gelegt wird. Der Längsmuskel ist mit „51“ in Zeilen-Nr. und der Zeile mit „51_15“ enthalten: Epi.Y!Ameise.Z.751#596662028154066. Es verbleiben 6 Stigmen-Paare. Mit 1 Stigmen-Paar im Stielchen (Petiolus) sind im Hinterleib (Gaster) noch 5 Stigmen-Paare anzuordnen. Ist kein Postpetiolus vorhanden, aber jemand möchte das 1. Hinterleibssegment ersatzweise als Postpetiolus bezeichnen, dann ist der Gaster kürzer und enthält nur 4 Stigmen-Paare.
Vorderer Luftsack „2000“: Epi.Y!Ameise.Z.1098#408099438200094. Stigma_1 „Z.1131_#202_3643_31“ : Epi.Y!Ameise.Z.1131#396192027536431. HERZ_1 5005: Epi.Y!Ameise.Z.1187#377500575521233. VAlary_1 525_5: Epi.Y!Ameise.Z.1154#388295652637525. VDph 7733 + DDph 500_33: Epi.Y!Ameise.Z.1187#377500575521233. VDph 3377: Epi.Y!Ameise.Z.1221#366988683983377. VAlary_2 525_5: Epi.Y!Ameise.Z.1238#361949259405253. DAlary_1 5255: Epi.Y!Ameise.Z.1271#352551678319200. Ostium_1 „5150500“: Epi.Y!Ameise.Z.1272#352274515050081. DDph 500_33: Epi.Y!Ameise.Z.1280#350072799331018. DDph 33_500: Epi.Y!Ameise.Z.1297#345484335500157. DAlary_2 5255: Epi.Y!Ameise.Z.1358#329965525142639. VAlary_3 525_5: Epi.Y!Ameise.Z.1501#298529768916525. HERZ_2 5005: Epi.Y!Ameise.Z.1641#273061050057101. VDph 7733: Epi.Y!Ameise.Z.1672#267998315277335. HERZ_3 5005: Epi.Y!Ameise.Z.1681#266563464095005. VAlary_4 525_5: Epi.Y!Ameise.Z.1720#260519292525409. Ostium_2 „505_11“: Epi.Y!Ameise.Z.1757#255033115050486. HERZ_4 5005: Epi.Y!Ameise.Z.1792#250051999522156. Stigma_2 202_11: Epi.Y!Ameise.Z.1889#237211849202596. DAlary_3 5255: Epi.Y!Ameise.Z.2055#218050210775525. HERZ_5 5005: Epi.Y!Ameise.Z.2076#215844500550917. Ostium_3 „505_11“: Epi.Y!Ameise.Z.2121#211265055701888. DAlary_4 5255: Epi.Y!Ameise.Z.2179#205641662755256. Stigma_3 202_11: Epi.Y!Ameise.Z.2210#202757096445115. Stigma_4 202_11: Epi.Y!Ameise.Z.2216#202208115137050 und Epi.Y!Ameise.Z.2217#202116907146461. Mittlerer Luftsack „2000“: Epi.Y!Ameise.Z.2240#200041599617725. Ostium_4 „505_11“: Epi.Y!Ameise.Z.2306#194316211250522. VAlary_5 525_5: Epi.Y!Ameise.Z.2322#192977253722525. Stigma_5 202_11: Epi.Y!Ameise.Z.2336#191820711962202. VAlary_6 525_5: Epi.Y!Ameise.Z.2544#176137257525041. DAlary_6 Bereich von Epi.Y!Ameise.Z.2733#163956525116613 und Epi.Y!Ameise.Z.2534#163896555648758. VDph 7733 (davon Anteil „444“ für Bereich Giftblase verwendet): Epi.Y!Ameise.Z.2655#168773326984446. Hinterer Luftsack „2000“: Epi.Y!Ameise.Z.2766#162000427745374. Ostium_5 „15051“: Epi.Y!Ameise.Z.2977#150518368540041. DDph 33_500: Epi.Y!Ameise.Z.3019#148424373350018. VDph 7733: Epi.Y!Ameise.Z.3131#143115037733537. Endbereich des offenen Herzschlauchs: Epi.Y!Ameise.Z.2877#155750150553946 bis Epi.Y!Ameise.Z.3041#147350602809505. HERZ_6 5005: Epi.Y!Ameise.Z.3165#141577625005909.
Das Herz-Prinzip wird durch Quadratur des Kreises (Bixnom 63/64) mit den Zeilen Z.1063/Z.1064 eingeläutet. Die Zahl 63=Physik wird mit der Haut=33 (vorab in Z.1061) und dem Herzmuskel=55 als Perikardialsinus 53_63_90_53 markiert. Die Zahl 90 ist der Winkel 90° mit dem der Herzschlauch im Hinterleib senkrecht nach oben=9 aufsteigt. Inclusive Z.10_QS 6+3=9 #QS 4+2+1=7 als 97 ist die Dopplung 97_97_02 für den Rückfluß der Hämolymphe im offene System enthalten: Epi.Y!Ameise.Z.1063#421536390539702. Die Kontraktion als Welle im Herzschlauch bildet sich über die Bixnom-Kurve „64“ in der Zeilennummer und der Spiegelung “46“ als QS 4+2+1+1+4+0+2+0+9+7+2+1+5+2+6=46. Die Hämolymphe „26“ der Ameise ist wie bei den Säugetieren ebenfalls als „26“ adressiert. Im Insektenblut werden Nährstoffe aber kein Sauerstoff transportiert. Statt Eisen=26 muss eine andere Erklärung gefunden werden. Die Kontraktionswellen sind mit 4=räumlich als 42_11=Zählgröße=4_0_2 und als QS 9+7+2+1+5=24=Zeit adressiert. Puls mindestens „10“/Minute, normal eher „64“ [siehe Video: "How to take an ant's pulse (https://doi.org/10.1111/eea.13071)“. Der Mensch hat das Ameisenblut als „26“ mit der Quersumme QS 2+6=8=Sauerstoff geerbt. Die Ameise nimmt den Sauerstoff direkt über die Tracheen auf. Die Zahl „8“ ist bei der Ameise keine Vene, sondern der Verdauungstrakt. Der Kropf gewinnt im Zeilenlauf an Volumen, wenn die Speiseröhre „808“ durch den Lauf der Ziffer „8“ weitergezogen wird. Um den Bereich des Magens zu erreichen, muss sich die Dehnung über den Lauf der Zeilennummer Z.11xx ausweiten. Das Ameisenblut „Hämolymphe“ hängt als Kreislauf mit der Verdauung zusammen. Hämolymphe enthält überwiegend das Disaccharid „Trehalose“ (Pilzzucker/Mykose; C12H22O11). Weil die Zahl „26“ mit QS 2+6=8 einen Bezug zum Sauerstoff=8 und zur Verdauung=8 herstellt, werden die 11 Sauerstoffatome (4xOH+4xHO+3xO) im Pilzzucker als Zählgröße 11 verwendet: Die Zeilennummer Z. QS 1+0+6+4=11 ist eine Zählgröße 11. And what about blood sugar? Glucose [C6H12O6] ist der gemeinsame Grundstoff für die Biosynthese von Trehalose/Dextran und in Tieren für das „Glycogen“. Das in der Leber gespeicherte Glycogen wird bei einem Energiebedarf wieder zu Glucose aufgespalten. Beispielsweise wird in Ketten nach allen 7-12 Elementen ein Enzym als mögliche Trennstelle eingebaut, so dass auch ein 11er Zählvorgang möglich ist: Epi.Y!Ameise.Z.1064#421140209721526. Der Rückfluss im offenen System 42_44_2 enthält Blut QS 4+8+8+6=26 das von den „unteren Alary-Muskeln“ vertikal („90°“) zum Herzschlauch hochgepresst wird. In der Zeitdifferenz Z.1063-Z.1065 wurde das Blut 26_7_63 transportiert #15802676308893: Epi.Y!Ameise.Z.1065#420744772904886. Herzschlauch „500“ im Hinterleib mit dem Aufstieg nach oben=99_5_969. Die Bixnom-Krümmungskurve „64“ ist das Ende der Zeile Z.106_6 und der Anfang #4: Epi.Y!Ameise.Z.1066#420350077995969. Krümmungswinkel „90°“ mit Zeilennummer als Form 7. Der Kropf (Sozialmagen) „088“ (Speiseröhre 808) weitet sich hinter dem Herzschlauch ebenfalls aus: Epi.Y!Ameise.Z.1067#419956122908813. Die Hämolymphe „26“ wird im Muskelschlauch „5265“ unter „90°“ von der Rückenlinie nach unten gepresst, weil klappenartige Ventile (Ostien) den Rückfluss verhindern: Epi.Y!Ameise.Z.1068#419562905565265.
Vorderdarm im Hinterleib (Verdauung Teil 1): Als Bestandteil des Verdauungssystems sind 1.1 ) der Kropf, 1.2) der Fettkörper und 1.3.) der Vormagen (Proventriculus) zu adressieren. Der Magen (Ventriculus) gehört zum Mitteldarm.
1.1) Kropf (Sozialmagen): Ameisen besitzen einen Kropf (Crop) als Sozialmagen, aus dem ein nachgeschalter Pumpmagen (Proventriculus) monodirektional den Magen (Ventriculus / Privatmagen) füllt. Vorzugsweise öffnet sich der Pumpmagen erst, wenn der Inhalt des Kropfes hochgewürgt und weitgehend durch „Ameisenküsse“ an Artgenossen (Arbeiter*innen, Männchen, Königin, Larven) verfüttert wurde (Trophallaxis). Ignorieren Artgenossen*innen 30 min lang das Angebot, entsorgt die Ameise die Portion im Nest. Der Eigennutz ist folglich eine Triebkraft zur Staatenbildung. Der Kropf kann sich mit der Füllung extrem dehnen. Hönigameisen füllen den Hinterleib bis zur durchsichtigen Kugelform als Futterspeicher. Das Hochwürgen (Regurgitation) des Speisebreis ist dem Pferd unmöglich und beim Menschen ggf. krankhaft, weil der Schließmuskel nicht korrekt funktioniert. Am Eingang des Kropfes ist bei der Ameise noch kein Schließmuskel entdeckt worden. Der eingleisige Richtungsverkehr in der Speiseröhre (Ösophagus) wird vom Nervensystem über die Richtung der Muskelkontraktion gesteuert. Dieses System hat der Mensch von den Ameisen geerbt, indem für eingleisige Eisenbahnstrecken ein „Token“ zum Einsatz kommt. Dieser Staffelstab ist nur einmal vorhanden und mit der Steckennummer beschriftet. Diese lautet bei der Ameise „Token-86“, Verdauungssystem=8 und Umschalter=flexibel=6. Der Token-86 ist als Signalsystem der „Eisenbahngesellschaft“ über das Nervensystem „77“ in 8_77_8 adressiert als „7867“. Der Token-86 öffnet im Rachen (Pharynx) mit O(Null)_7 in der Zeilen-Nr. und gespiegelt mit 7_ O(Null) in der Zeile die Ösophagus-Strecke über die Ganglienkette bis zum Kropf: Epi.Y!Ameise.Z.107#4187786758352370. Das Signal kommt in der Zeile Z.10“70“ als offen=70 an. Die O(Null) steht jetzt in der Zeilennummer, fehlt unbedeutend am rechten Zahlenrand und gleicht ansonsten der Zeile-Nr.107: Epi.Y!Ameise.Z.1070#418778675835237. Die Muskelkontraktion am Kropf-Eingang wird über die Ganglienkette von Zeile Z.1070 bis Z.1077 geregelt. Erkennbar ist, dass der Token-86 über den Ösophagus „808“ als eingleisige „Eisenbahnstrecke“ transportiert wurde als „80886“. Die Ganglienkette ist paarig, so dass mit „77“ in der Zeilen-Nr. und am rechten Zeilenrand eine Querverbindung in der paarigen Ganglienkette geschaltet ist. Im Kopf wird das Signal der Antennen und der Mundwerkzeuge über das Unterschlundganglion verarbeitet, das auch für den Ösophagus „808“ zuständig ist: Epi.Y!Ameise.Z.1077#416056808861377. Der Ameisenstaat besteht aus Ameisengruppen 44, die den Umschalter=flexibel=6 als Gruppenfunktion „4_6_4“ auslösen, die 2 gegensätzliche Kurvenkrümmungen enthält. Für die soziale Trophall“ax“is-Entleerungsrichtung „AX-46“ des Kropfes wird der „Token-86“ durch das Heben des Ameisenkopfes zu seinen Artgenossen zwecks Übergabe eines Futtergeschenks nach Antennenkontakt angefordert, weil die Kopfbewegung einen Viertelkreis im 3. Quadraten des Bixnom-Kreises „64“ als Spiegelung darstellt. Für die soziale und private Kropffüllung „BOX-64“ wird der „Token-86“ durch Senken des Ameisenkopfes beim Sammeln der Nahrung angefordert, weil die Kopfbewegung einen Viertelkreis im 2. Quadraten des Bixnom-Kreises „64“ darstellt. Die Kropffüllung „BOX-64“ ist die notwendige Grundfunktion. Der offene Ösophagus ist mit dem „Token-86“ kombiniert als „8086“. Die Zeitsteuerung ist mit der Zeilennummer Z. QS 1+0+7+3=11 als Zählgröße 11 und 7_Zeit=60 Sekunden_7 adressiert. Weiterhin halbtags 8_12_8 zur Futtersuche bei Tageslicht: Epi.Y!Ameise.Z.1073#417607812808671. Die Kontraktion zeigt den Ösophagus „808“ nunmehr mit der „64er Füllkurve“ als „BOX-64“ zwecks Kropffüllung an in Epi.Y!Ameise.Z.1076#416443478758089 mit einer Zeitdifferenz Delta-BOX-64 = Z.1073-Z.1076= #11643340505818. Enthalten sind die Kontraktionsrichtung “64“ als Muskelschlauch 505 und die Hautembran 4_33_4. In der Folgezeile als Kropfseite wird der Token-86 übernommen und bis Z.1071 zurücktransportiert. Die „46“ für „AX-46“ ist ist nur indirekt als Summe QS=4+1+6+0+5+6+8+0+8+8=46 und dem Restwert QS 6+1+3+7+7=24=Zeit vorhanden. Die soziale Kropfentleerung setzt somit zeitlich voraus, dass der Kropf gefüllt und der Privatbedarf über die Entleerung zum Magen gedeckt ist. Delta-AX-46=Z.1071-Z.1077=#23308504698116. Die Zählgröße 11 mit dem Umschalter 6 hat als „116“ gegenüber Delta-BOX-64 erkennbar die Richtung vom linken zum rechten Zahlenrand gewechselt; AX-46 ist enthalten: Epi.Y!Ameise.Z.1077#416056808861377. Das Nahrungsgeschenk wird zu den Mundwerkzeugen befördert, womit der „Token-86“ nach Z.1071 in Z.1070 wieder verfügbar ist. Die restlichen Zeile enthalten die Muskelkontraktion „55“ und den Kropf als dehnbare Haut „33“ sowie die Gruppenfunktion „44“ über das Nervensystem 7_99=oben=Gehirn_7 und weitere Voraussetzungen: Epi.Y!Ameise.Z.1072#417997372335544. Der Kropf ist im Zeilenlauf organisch nicht direkt sichtbar, weil eine Kopffüllung und Dehnung notwendig sind. Der Kropf steigt dann ggf. bis zum Herzschlauch nach oben (dorsal) auf. Die Entleerung AX-46 ist mit dem vorhandenen „Token-86“ und dem Entleerungsweg „46“ als „406“ im Prinzip mit 0 (Null)=offen. Es sind zufällig auch die 30 Minuten als 8_30_8 markiert, die eine Ameise maximal um eine Nahrungsübernahme betteln wird: Epi.Y!Ameise.Z.1075#416830868040654. Nunmehr muss der unsichtbare Kropf sichtbar werden, damit ein Nahrungsbolus vom Kropf zu den Mundwerkzeugen gefördert werden kann. Erkennbar wird die Zeit=24, die für AX-46 als Voraussetzung gilt. Die Zeile enthält ein Steuersignal, das an der Verschiebung der Ziffer „7“ als 897 vs. 879 erkennbar ist als QS 8+9+7=24=Zeit und QS 8+7+[QS 1+8=] 9 = 24=Zeit. Geometrisch drückt sich der Kernbereich der Zeile als Quersummenbildung „888888 = 48“ aus. Hierbei handelt es sich um den Kropf als gedehnter Ösophagus 888888_QS 5+3=8, der lotrecht hinter dem Herzschlauch aufgestiegen ist. Kropfbeginn: Epi.Y!Ameise.Z.1074#417218978718532. Der Kropf „8800_9_808“ ist mit der Hämolymphe=26 adressiert und dehnt sich daher immer weiter aus, solange im Körper noch Platz ist: Epi.Y!Ameise.Z.1215#368800973780826.
Der Vormagen (Proventriculus) bindet in den Kropf als Muskelschlauch „505“ ein und setzt in der Regel unterhalb des Kropfes an. Der Privatmagen kann ohne den „Token-86“ noch nicht gefüllt werden. Die Zahl „68“ müsste erst gespiegelt werden in der Zählgröße QS 0+5+0+5+1=11_68, damit die 4-blättige Klappe über das Nervensystem Z.11_QS 2+5=7=Nerv im Proventriculus geöffnet wird. Diese Möglichkeit ist vorhanden, weil die Verdauungsrichtung BOX-64 über QS 3+9+8+3+0+5+0+5+1+6+8+3+2+9+2=64 avisiert ist: Epi.Y!Ameise.Z.1125#398305051683292. Zur Umschaltung muss die Ziffer „8“ nach links wechseln, so dass Physik=63 als ein Umschalter erkennbar ist. Der Privatmagen wird gefüllt, wenn der Kropfinhalt bereits teilweise verfüttert würde. Der Kropf ist teilweise entleert, wenn er von seiner vertikalen Füllhöhe „888888_8“ wieder geschrumpft ist auf „88888“ mit einer „physikalischen“ 63er Zeilen-Nr. in Epi.Y!Ameise.Z.1463#306283788888382. In der „biologischen“ 64er Zeile wird nunmehr der „Token-86“ übernommen. Die 4-blättige Klappe 7_4_5_7_500_7=Nerv=Form_1=Zähltakt_60=Zeit wird geöffnet: Epi.Y!Ameise.Z.1464#306074578650071. Der Mageneingang enthält den Token-86 als 808_86 und ist somit offen: Epi.Y!Ameise.Z.1327#337673838088699. Der Mageneingangsbereich verhindert als Stomodealventil den Rückfluss der Nahrung mittels einer Umschaltung 8668 als „77_868“: Epi.Y!Ameise.Z.1319#339721897758683.
Eine Verdauungsröhre „808“ hat innerhalb des Magens keine Funktion, so dass sich der Kropf dieses Zeilenbereichs bemächtigt und ausdehnt. Am Ende des Kropfes „808“ sitzt vermutlich ein Ringmuskel „0_55“: Epi.Y!Ameise.Z.1618#276942634823055 und Epi.Y!Ameise.Z.1619#276771576988081. Das Ende des Kropfes ergibt sich im Scann als letzter Hautpunkt „303“ einer Blase: Epi.Y!Ameise.Z.1620#276600730335619. Die Honigameise liest darin alternativ eine Hautstruktur 33_5 und formt mit dem Bixnom-Kreis=64 als Mittelpunkt eine Hinterleibskugel als lebende „Bienenwabe“: Epi.Y!Ameise.Z.1620#276430094474832.
1.2) Fettkörper (Fat body): Der Proventriculus ist an einem Komplex aus lappenförmigen Fettkörpern befestigt, die als Gruppe 44 gebildet sein müssen als „400_44_56_0_65“. Mit der Zeilen-Nr. Z.“111“9 wird als Zählgröße eine Vielzahl erzeugt. Das Speichervolumen für Fette, Proteine und Glykogene ist im Volumen „400“ und weiteren Zeilen als 4000, 300, 700 enthalten Über die Fettkörper werden z.B. Urate entsorgt: Epi.Y!Ameise.Z.1119#400440735606527. Der Fettkörper liegt in der Hämolymphe=26, so dass er mit „26_300_75_26“ darin eingeschlossen ist: Epi.Y!Ameise.Z.1121#399726300752635. Die Fettkörper besteht auch im innern als Zählgruppe 1_44_1, weil diverse Punkteinschlüsse der gespeicherten Stoffe vorliegen. Der Zellen des Fettkörpers werden von einer Basalmembran „3_33“ eingeschlossen, die mit Einschlüssen (kein Muskel 55) „3_55_33“ dargestellt ist: Epi.Y!Ameise.Z.1123#399014410635533. Der Bienenbestand ist durch die Varroamilbe bedroht, die nicht die Hämolymphe aussaugen, sondern die Fettkörper der Bienen als Futter verwerten.
1.3) Vormagen (Proventriculus):
Der Vormagen (Proventriculus) verbindet den Kropf mit dem Magen (Ventriculus) in 4 Abschnitten: Kelch-Region, Klappen-Region (Occlusory Tract), Kugel-Region und zylindrischer Abschnitt als dünner Schlauch . Der kreuzförmige Klappenschlitz verschließt den Kropf. Im zylindrischen Abschnitt verhindert das Stomodaelventil den Rückfluss vom Magen in den Kropf. Dieses Ventil des Proventriculus gehört bereits zum Mitteldarm und ragt wulstartig als sogenannter Knopf in den Magen hinein. Siehe „Proventriculus of Cephalotes ants: A structural and comparative analysis - ScienceDirect (Micron, Volume 41, Issue 1, January 2010, Pages 79-83)“.
1.3.1) Kelch-Region: Der Vormagen (Ventriculus) bindet funktionell in den Kropf als Muskelschlauch „83_505_83“ [8=Verdauung, 3=Haut]“ ein. Hierzu bildet sich ein Trichterrand als Bixnom-Kreis QS =3+9+8+3+0+5+0+5+1+6+8+3+2+9+2=64. Weil das nicht jede Ameisenart so liest, wird der Vormagen mit abweichenden Details gestaltet: Epi.Y!Ameise.Z.1125#398305051683292. Der Trichter wird von 4 Kelchblättern gebildet. Die Zeile Z.“11“26 enthält die Zählgröße 11 und die Zeile gleichfalls „1317171_33“. Aufgrund der 4-fachen Zählgröße „1“ als Form-7 wird der Kelch aus 4 Kelchblätter (Chitinstäbchen) 33 gebildet. Die Ameisenart „Amblyopone australis“ besitzt abweichend 6 Kelchblätter, ggf. zählt die Doppelziffer „11“ in der Zeilennummer mit. Epi.Y!Ameise.Z.1126#397951317179133. Der Vorderdarm ist von einer Schutzschutz, der Cuticula (Intima) „22“ ausgekleidet, so dass zwischen den Kelchblättern jeweils eine dünne Hautfalte sichtbar ist. Die Intima „22“ ist nur 2-fach zu erkennen, so dass eine Spiegelung 21_42 zur Verdopplung nötig ist. Epi.Y!Ameise.Z.1127#397598210420322. Kelchblatt „45“ 1. von 4: Aufgrund der 4-fachen Form-7, die eine Kelchblattform „45“ mit „72_45_72 als Hautform 7_3_7_3 markiert, muss eine Kelchblatt-Zeile die räumliche Struktur „45“ bilden (Ziffer “3“ Hautmembran zweifach vorhanden): Epi.Y!Ameise.Z.1128#397245729737326. Auskleidung Cuticula (Intima) „22“: Epi.Y!Ameise.Z.1129#396893873466522. Kelchblatt „45“ 2. von 4: Epi.Y!Ameise.Z.1132#395842034579243. Kelchblatt „45“ 3. von 4: Epi.Y!Ameise.Z.1134#395143900479456. Kelchblatt „45“ 4. von 4: Mit dem 4. Kelchblatt können sich die 4 Blätter zu einem Kreuzschlitz 444_8_22 schließen: Epi.Y!Ameise.Z.1136#394448224598330. Die Ameisenarten interpretieren die Blattform unterschiedlich. Gemeinsamkeiten entstehen durch eine Formgruppe „4_101_44“. In den 4 Klechblättern zieht sich ein sogenannter „sepalarer“ Kanal „101“ mit durch, so dass das Kelchblatt im Zeilenlauf lang gezogen werden kann. Der Klappenbereich wird kugelartig von einem Ringmuskel umschlossen. Innerhalb dieser Kugel setzt unterhalb der Kelchblätter ein Längsmuskel 55 als „5_9_75“ an, der als 75 in Folge zu finden ist: Epi.Y!Ameise.Z.1137#394101304435975. Die Doppelziffer „99“ bedeutet, dass die 4 Blätter mit 9=oben sich im Kreis mit 4 Blattspitzen gruppieren. Weil „99“ eine Dopplung „9=oben=seitlich“ bedeutet, krümmen sich die 4 Blattspitzen jeweils zu einer Blatt-Wulst, die sich innenseitig an den äußeren Muskelkörper legt. Dieser umgeschlagene Bereich bildet die sogenannte „Kelchglocke“. Blattspitze „99“ 1. von 4: Epi.Y!Ameise.Z.1138#393754993975135. Blattspitze „99_24=Zeit“ 2. von 4: Epi.Y!Ameise.Z.1139#393409291609924. Das Kelchblatt wird als Zählgröße „1“ als „19_400_9_1“ über die Zeilen-Nr. Z.11xx in die Länge gezogen und kann mit der Bixnom-Krümmung „64“ an der Blattspitze eine runde Wulst formen: Epi.Y!Ameise.Z.1140#393064195740091. Blattspitze „99“ 3. von 4: Epi.Y!Ameise.Z.1141#392719704770993. Der trichterartige Kelch mit den 4 Kelchblätter „45“ wird als Haut-Konstruktion 33 außenseitig von einem Ringmuskel 55 kugelförmig als Bulbus eingeschlossen als 5_33_5. Der Bulbus wird mit der Zeilen-Nr. 11“44“ als Gruppe adressiert: Epi.Y!Ameise.Z.1144#391689845405335. Blattspitze „99“ 4. von 4: Epi.Y!Ameise.Z.1149#389985363919672. Der 4-blättrige Kelch verengt sich mit gegensätzlicher Krümmung „64_46“ zum Trichterhals, um einen Ventilkörper zu bilden: Epi.Y!Ameise.Z.1150#389646246211916.
1.3.2) Klappen-Region: An der Klappe sind eine Vielzahl von Härchen „1“ als 77_1_77 mit einer Filterfunktion integriert. Mit dem Bezug Nerv=Form=7 ist eine Signalübertragung möglich: Epi.Y!Ameise.Z.1151#389307717761688. Der Trichter kann durch die kombinierte Wirkung seiner inneren Muskeln und der hinteren Ringmuskeln des Kropfes geschlossen werden. Der Trichterhals entsteht als Formring „777_0“ zur Verengung. Beim Schließen der Klappen formen sich die Kelchblätter jeweils zu einer Kelchblattleiste um, die sich zu einem geschlossenen rechtwinkligen Kreuz „44“ zusammenschließen: Epi.Y!Ameise.Z.1152#388969777034465. Folglich wird der Kelch nachfolgend geöffnet als 5_0_1=Kanal_0_44 einer geweiteten Kreuzschlitz-Klappe 44 und als Zeit=24 adressiert: Epi.Y!Ameise.Z.1153#388632422501044.
1.3.3) Kugel-Region: Dem Kelch folgt eine muskuläre Kugel, die gemeinsam mit dem Kelch im äußeren Bulbus liegt. Sofern der Kelchbereich einer Ameisenart sehr einfach und schlank gestaltet ist, wird um die Kugel außenseitig erst noch ein Bulbus erzeugt. In den Zeilenlauf wird das 1. untere Alary-Muskelpaar eingeschoben. Mit der Zeilennummer Z.11“55“ wird dann der Muskel „55“ der Kugelregion direkt aufgerufen. Innen verbreitet sich die Engstelle der Klappe mit der Bixnom-Gegenkrümmung 59_46_59_2_5. Die mit der Ziffer „2“ paarig gespiegelt wird, weil die „64“ fehlt: Epi.Y!Ameise.Z.1155#387959465925284. Mit dem Kugelvolumen „4000“ bleiben die 4 Quadranten des Kelchs erhalten: Epi.Y!Ameise.Z.1159#386620520400089. Details sind sind nicht bekannt. Erwähnt wird ein sogenannter „Bulbar-Kanal“ „505“ als Gruppe „44“ in der Kugel-Region: Epi.Y!Ameise.Z.1161#385954507445050. Am Bulbus sind die Ringmuskeln vorherrschend. Der Bulbus muss sich im Prinzip als Ende der Kugel wieder schließen und es muss ein dünner Kanal zum Magen führen. Der Kropf dehnt sich nach hinten (kaudal) über den Anschluss des Proventriculs weit hinaus. Weil der Proventriculus unterhalb des Kropfes anschließt und senkrecht quer zum Zeilenlauf verläuft, dauert es einige Zeit bis der Magen (Ventriculus) im Zeilenlauf erscheint. Aufgrund der Unübersichtlichkeit bilden sich diverse Varianten zum Proventriculus der Ameisenarten siehe: „A comparative morphological study of the proventriculus of ants. (antwiki.org)“.
1.3.4) Zylindrischer Abschnitt: Der Bulbus des Proventriculus schließt sich unterseitig zur Kugelform, wenn über 4 Zeilen die Bixnom-Kurve „64“ vorliegt. In diesem Paket sind Muskeln „55“ und ein runder Zylinder 3_64_303_400_40 enthalten, der den Ausgangskanal zum Magen (8=Verdauung) bildet: Epi.Y!Ameise.Z.1228#364896728944384; Epi.Y!Ameise.Z.1229#364599823550613; Epi.Y!Ameise.Z.1230#364303400929840 und
Epi.Y!Ameise.Z.1231#364007459905527. Die Schutzschicht (Cuticula) des Vorderdarms ist als „QS 6+3=9_22_QS 6+3=9=seitlich“ vorhanden: Epi.Y!Ameise.Z.1231#363122514703163.
Der dünne Kanal der Kugel-Region geht in das Stomodealventil über, dessen Ende im Magen mündet. Eine Verschlussklappe ist nicht enthalten, so dass der Muskelschlauch die Ventilfunktion erzeugt. Das Stomodealventil des Proventriculus gehört zum Mitteldarm. Am Anfang des Mitteldarms gehen bei Insekten seitliche Blindschläuche (vordere Divertikel / Cecum) ab. Diese fehlen bei den Ameisen und wurden daher nicht gesucht.
Mitteldarm (Verdauungssystem Teil 2): Der Vorderdarm (Foregut) und der Hinterdarm (Enddarm / Hindgut) sind mit Chitin ausgekleidet (Intima) und ektodermal entstanden [3 Keimblätter: Ektoderm, Mesoderm und Entoderm]. Der Mitteldarm (Midgut) als Privatmagen (Ventriculus) entstammt dem Entoderm und ist mit einem Drüsenepithel ausgekleidet, um die zur Verdauung benötigten Enzyme zu produzieren. Die Ameisen bilden im Mitteldarm wie die meisten Gliederfüßern (Arthropoda) eine „Peritrophische Membran (PM)“ als nicht-zelluläre Abscheidungen [siehe: Peritrophe Matrix – Wikipedia]. Damit wird die Nahrung (Bolus) umhüllt und zugleich der Mitteldarm aufgrund der fehlenden Cuticula geschützt. Die für Nährstoffe durchlässige Membran besteht aus Proteinen und einem Netz feinster Chitinfasern. Insekten können die peritrophische Matrix mit spezialisierten Zellen bereits im Übergangsbereich zwischen Kropf und Ventriculus bilden. Bei der Tsetse-Fliege enthält der einfach gestaltete Proventriculus diesen Übergangsbereich, so dass Vorderdarm und Mitteldarm darin verbunden werden. Gleichzeitig kann in dieser Verbindungsstelle kontinuierlich und unabhängig von vorhandener Nahrung eine gelartige Matrix zur Auskleidung des Mitteldarms produziert werden. Bei der Ameise wird der Proventriculus dem Vorderdarm zugerechnet und die Entleerung erfolgt in den Mitteldarm. Der Vormagen (Proventriculus) setzt direkt am Kropf (Crop) mit einer kelchförmigen Konstruktion an. Die Mundhöhle und der Vorderdarm bilden zusammen das „Stomodeum“. Die „Stomodaealklappe“ regelt den Durchfluss vom Proventriculus zum Mitteldarm. Wie ist der der Mitteldarm definiert, wenn der Vormagen die Verbindung von Kropf und Magen bildet? Hier wird vorläufig folgendes angenommen: Vor dem Magen liegt ein Darmabschnitt an dem die Auskleidung mit der Cuticula des Vorderdarms endet, so dass an dieser Grenze der Mitteldarm beginnt. Damit würde dieses kurze Endstück des Proventriculus zusammen mit dem Magen den Mitteldarm bilden. Das Endstück ragt in den Magen als eine Wulst hinein, die als „Knopf“ bezeichnet wird. Eine Darmstrecke als Teil des Mitteldarms (Darmstrecke plus Magen) wird als vorhanden angenommen. Weil auch die Ameisenarten „Ectatomma edentatum“ und „Pachycondyla“ die gelartige Matrix bereits vor dem Ventriculus mit einem spezialisierten Zelltyp produzieren, wird nachfolgend angenommen, dass sich zwischen Proventriculus und Ventriculus ein Übergang vom Vorderdarm zum Mitteldarm befindet. Wissenschaftlich ist vermerkt, dass das „Stomodaelventil“ des Proventriculus in den Magen hineinragt und daher auch zum Mitteldarm gehört, aber der Übergang ist hier unbekannt. Das Stomodealventil produziert bei den Ameisenarten C. atratus, C. clypeatus und C. pusillus die peritrophe Typ-I-Membran. Die Übergangsstelle möge so aussehen, wie der Proventriculus einer Tsetse-Fliege (siehe: Trypanosoma brucei colonises the tsetse gut via an immature peritrophic matrix https://www.biorxiv.org/content/10.1101/513689v1.full.pdf). Der Darmübergang besteht bei der Fliege darin, dass sich der Vorderdarm als Trichter aufweitet und sich der Mitteldarm über diesen Trichter schiebt, um ihn wie eine Bördel-Verbindung (Flared Seam) einer Rohrleitung zu umklammern. Im inneren Ringspalt wird die peritrophische Matrix produziert.
Der Mitteldarm entsteht mit fachtechnischer Logik: Das Trichter-Ende ist ein Ring „0“, der in der Seitenansicht des Scanns als Trichter „406“ mit „46“ entgegen dem Bixnom-Kreis „64“ gekrümmt ist. Dieser Trichter als Ende des Vorderdarms muss fertiggestellt sein, bevor sich der Mitteldarm über den Trichter als Bördel-Verbindung schieben und verklammern kann. Der Anfang des Mitteldarms liegt dann vor dem Ende des Vorderdarms. Weil der Scann aber nicht in die Vergangenheit springen kann, wird die Doppelstruktur „2_5_2“ mit dem Bixnom-Kreis „64“ in der Quersumme versteckt als QS 3+6+1+6+5+7+1+2+9+2+5+2+3+8+4=64. Der Mitteldarm muss sich stärker weiten als der Vorderdarm-Trichter, so dass an der Verbindung „3“ Kreise beteiligt sind. Die Verbindung ist in der Zeilennummer Z.12“3“9 mit 3 Kreisen enthalten und in der Zeile mit „129“ für eine Doppelstruktur „2_5_2“ adressiert: Epi.Y!Ameise.Z.1239#361657129252384. Im Spaltraum der Verbindung wird nunmehr der Universalwirkstoff „77“ produziert, und zwar ständig, weil die Zeit=24 in Z.1_24_0 und in QS 3+6+1+3+6+5+4+7+0+2+7+7+1+8=60 Sekunden enthalten ist: Epi.Y!Ameise.Z.1240#36136547027718. Wirkstoff-Sekret „77“ mit Funktion aus der Zeilendifferenz Z.1239-Z.1240=„#291188936565“. In beiden Zeilen ist QS 6+5=11 als Zählgröße enthalten. Die Zeitdifferenz enthält eine Überlagerung 11_6565. Die Dopplung summiert sich zu „22“ als Schutzschicht mit Zwischenschicht „88“ (Ectoperitropic space) zum Mitteldarm. Vorderdarm-Trichter „406“: Epi.Y!Ameise.Z.1241#361074281340615. Großer Formring 60_7 über kleinen Formring 30_7 gestülpt. Im Querschnitt mit 4 (Z.242) Hautschichten „33“. Die Membran des Mitteldarms wird mit QS „0+7+8+3+5+6+1+3+0= 33“ avisiert: Epi.Y!Ameise.Z.1242#360783561307330. Mitteldarm-Bördel-Saum „604_33_0_9=seitlich_0“: Epi.Y!Ameise.Z.1243#360493309045618. Der Mitteldarm bildet eine Gruppe 44 in Z.1244. Der normale Darmquerschnitt entsteht, indem die Aufweitung am Bördel-Saum „64“ wieder mit einer Gegenkrümmung QS 3+6+0+2+0+3+5+2+3+4+2+7+4+1+4=46 verschlankt wird. Die Form 60_30 hat sich zu 60_03 gewendet „414“: Epi.Y!Ameise.Z.1244#360203523427414. Die Darmwand besteht aus einer Basallamina „33“ mit einem Epithel aus säulenartig herausgehobenen „99“ Zellen: Epi.Y!Ameise.Z.1245#359914203328276. Auf der Basallamina 33 sitzt außenseitig eine Ringmuskelschicht 55_0_7 und eine Längsmuskelschicht 555_70. Mit beiden Muskelarten wird der Verbindungskanal zum Magen hergestellt: Epi.Y!Ameise.Z.1247#359336955207461 und Epi.Y!Ameise.Z.1249#358761555759570. Die Muskelschicht ist von Z.1259 - Z.1262 mit #355... vorhanden, wobei sich am rechten Zahlenrand eine äußere Membran 33 als zunehmend durchlässig 3030 entwickelt. Die Zeilen Z.1263 /Z.1264 stellen einen Zusammenhang mit der Hämolymphe=26 her.
Der Magen (Ventriculus / Privatmagen / Chylusmagen) der Ameise kann kugelrund geformt oder bei räuberischen Arten mit einem birnenförmigen Hals verlängert sein, um die Nahrung besser zu verdauen. Dieser typische Hals als Magenende ist kein Pylorus. Der Pylorus mit den angeschlossenen Malpighi-Gefäßen gehört zum Hinterdarm. Die genaue Situation ist mangels Mikroskopie nicht bekannt. Jedenfalls soll angeblich wie üblich am Magenende am Übergang zum Dünndarm ein Klappenverschluss existieren, der noch vor den Malpighi-Gefäßen liegt. Der Pylorus wird nicht gesondert erwähnt (siehe: „Stitz, H. 1914. Die Ameisen (Formicidae) Mitteleuropas, insbesondere (yumpu.com)“). Der Magen wird als uninteressant übergangen (Siehe: „Die Ameise. Schilderung ihrer Lebensweise (uiuc.edu)“. Eine Magenklappe konnte hier vor dem Pylorus ermittelt werden.
Die Form des Ameisenmagens ähnelt einem Rundkolben. Salzsäure als Chlor=17 wird nicht produziert. Wegen QS 1+7=8 als Verdauungstrakt „8“ hat der Mensch das Grundkonzept geerbt. Der Ameise fehlt an passender Stelle die Ziffer „5“, um die Speiseröhre als Muskelschlauch „505“ anzulegen. Die Mikroskopie zeigt unverkennbar in der Magenwand ein quadratisches Netz, dass die „444“ benötigt [https://www.researchgate.net/figure/A-Digestive-tract-of-a-worker-of-Paratrechina-longicornis-Latreille-Es-esophagus_fig1_289747505]. Weil die Haut „33“ ständig am linken Zahlenrand vorhanden ist, muss irgendetwas gestaltet werden, weil auf die Ankunft des Mitteldarms „808“ gewartet wird. Die Darmwand bildet mit der Dopplung „33_33“ eine Einstülpung der Magenwand „55=Muskel“: Epi.Y!Ameise.Z.1318#33997965337155. Die Einstülpung formt sich mit gegensätzlichen Bixnom-Krümmungen „64_46“. Die Zeit=24 ist der zeitweilige Pumpvorgang des Vertikulus vom Kropf zum Magen (auch als QS 5+3+2+6+8=24 mit der Hämolymphe=26 als möglicher Taktgeber): Epi.Y!Ameise.Z.1320#339464532684624. Der Muskel bildet eine Wulst „7_55_7_55“ als sogenannter “Knopf“: Epi.Y!Ameise.Z.1321#339207557262455. Die Wust bildet einen Ring „5_0_97_060_79“, durch den der Mitteldarm in den Magen ziehen kann: Epi.Y!Ameise.Z.1322#338950970607945. Netzartige Magenwand 33_444 mit einem Form-Loch „8_07_8“ für die Einführung des Mitteldarms: Epi.Y!Ameise.Z.1325#338183534448078. Mitteldarm-Gefäß-Mündung „808_99=Ende“ im Magen: Epi.Y!Ameise.Z.1325#337673838088699.
Magenform Teil 1: Der birnenförmige Magen soll sich zunächst in Kugelform mit der Zeilen-Nr. Z.13“64“ als Volumen ausweiten bis durch die Gegenkrümmung „46“ am rechten Zahlenrand eine Halbkugel vollendet ist. Die Kugel beginnt mit einer Zeile „64“ als Bixnom-Kreis und als Ring „707“ zur Formänderung: Epi.Y!Ameise.Z.1364#328514063888346, Epi.Y!Ameise.Z.1366#328033076971964 und Epi.Y!Ameise.Z.1370#327075316163287.
Peritrophe Matrix: Eine „Membran-33“ liegt im Zeilenlauf weiterhin ständig an. Die peritrophe Matrix wird bei Ameisen folglich bereits am Magenanfang produziert, sobald ein passierter Nahrungsbolus diese Reaktion auslöst. Der Bolus wird von einer gelartigen Matrix umhüllt. Die Matrix ist porös, so dass kleine Nahrungspartikel und Bakterien das Epithel der Magenwand erreichen. Durch diese Grenzschicht entstehen 2 Räume: 1.) Ektoperitrophen Raum zwischen dem Epithel und der Matrix 2.) Endoperitrophen Raum als von der Matrix umhüllter Nahrungsbolus. Zunächst wird eine sensorische Barriere benötigt, die Eindringlinge identifiziert. Weil der Bixnom-Kreis „64“ mit Gegenkrümmung „464“ auch unrunde Formen identifiziert und in der Kombination „64 _63“ auf alle biologischen und physikalischen Eigenschaften reagiert, ist er als Sensor verwendbar. Die Bildung der peritrophischen Membran erfolgt ab der Zeilen-Nr. Z.1338 als Hautmemban „33“ am Verdauungstrakt „8“. In der Zeile wird die Bildung einer Membran „33“ adressiert, die einen Universalwirkstoff „77“ (analog Matrix am Bördelsaum) als gelartige Matrix produziert. Die Matrix wird nur zeitweilig „QS 4+5=9_Zeit=24_9=seitlich“ erzeugt, um einen Nahrungsbolus „O“ räumlich „4“ als Struktur-5 einzuschließen: Epi.Y!Ameise.Z.1338#334897745249405. Der Bixnom-Sensor „33_464_7=Form=Nerv_63“ reagiert auf den Bolus 4_909_4_QS 1+3=4 in vielfacher Anzahl (Gruppe 44), d.h. alles wird gekapselt: Epi.Y!Ameise.Z.1339#334647634909413. Die Umhüllung ensteht, weil die avisierte Membran „33“ nunmehr zunehmend von der Zeilennummer an die Zeile übergeht. Die beiden Wirkungsräume werden adressiert: 1.) linearer Außenraum 33_97_8=Verdauung_97: Epi.Y!Ameise.Z.1340#334397897868435. 2.) beliebig geformter „64_1_46“ Innenraum (Bolus) als QS 3+3=6_414_QS 3+3=6: Epi.Y!Ameise.Z.1341#334148533291352. Die Zeitdifferenz beider Räume ist folglich die peritrophische Membran mit der gelartigen Matrix „77_0=porös“ selbst, die zeitweilig Zeit=24 erzeugt wird: Zeile Z.1340-Z.1341=#2493645770831. Eine großflächige Membran, beispielsweile die Basalmembran zwischen Lederhaut und Epidermis bei Säugetieren, wird mit „333“ gebildet. Der Bolus durchläuft nunmehr 4 Zeilen als Beschichtungsstrecke von Z.1342 bis 1345=#333... Anschließend wird der Verdaungsprozess 88_44 avisiert, indem die Hämolymphe=26 als Nährstoffempfänger doppelt als QS 0+7+2+6+8+3+0=26 adressiert wird. Möglicherweise liegt mit „088_44“ zwischen der Matrix und dem Epithel eine Zwischenschicht mit dem Wirkstoff „88“, wie diese bereits am Anfang des Mitteldarm-Gefäßes am Bördel-Saum als kontinuierlich erzeugte peritrophische Membran bei wenigen Ameisenarten vorhanden ist: Epi.Y!Ameise.Z.1346#332907268308844.
Magenform Teil 2: Zwischen den Verdauungszellen liegen kleine generative Zellen (Fortpflanzungskörper) als Gegensatz zu vegetativen Zellen. Diese werden hier erwähnt, weil Z.1463/Z.1464 eine unbekannte Besonderheit erwarten lassen. Enthalten ist ein Verdauungsbezug „88888“ und die Zählgröße „1“ für eine Vielzahl von kleinen Zellen „60“. Erst bei der Verdaungszelle mit mehreren Zeilen entsteht aus der „60“ eine Säulenform: Epi.Y!Ameise.Z.1463#306283788888382 und Epi.Y!Ameise.Z.14634#306074578650071. Die Verdauung beginnt, weil der Verdaungstrakt „808“ aufgerufen wird: Epi.Y!Ameise.Z.1474#303998088971305. Die Halbkugel ist am Formring „707“ beendet, wenn die Tangente horizontal als „646“ vorliegt und die Krümmung fallend „46“ folgen wird. Der Magen kann nunmehr eine Birnenform entwickeln. Aufgrund der Zeit=24 verschiebt sich dieser Punkt durch die Muskelkontraktion: Epi.Y!Ameise.Z.1482#302357073646224.
Verdauungszellen TYP 1 /TYP 2: Der Magen wird außenseitig durch Ring- und Längsmuskel umschlossen. Es folgt eine Basallamina mit dem einschichtigen Epithel als säulenförmige Verdauungszellen und generative Zellen, die sich zwischen den Verdauungszellen als kleine Zellen verteilen. Die säulenförmige Verdauungszellen bilden sich in 2 Typen, deren Verteilung im Magenraum hier nicht bekannt ist. Die kleinen generativen Zellen verteilen sich zwischen den Verdauungszellen.
Verdauungszelle TYP 1: Der Anfang der Verdauungszelle wird als „400_QS 6+5=11“ Säule angesetzt, die sich als Zählgröße 11 zusammensetzt. Der Verdauungsprozess „818“ zieht sich bis „818“ durch: Epi.Y!Ameise.Z.1593#281819612040065. Zunächst wird eine Funktion als Drüsenepithel „888“ avisiert. Die Säulenform der Zelle entsteht, weil sich die Verdauungszelle „8_0“ bildet und über mehrere Zeilen durchläuft. Epi.Y!Ameise.Z.1593#281288878307410. Im Unterschied zur Zelle TYP 2 sind die Microvilli in ihrer Länge als fadenförmige Zellfortsätze zur Oberflächenvergrößerung nur kurz. „111=Faden_24=Zeit_11=kurz“: Epi.Y!Ameise.Z.1594#281112411006087. Verdauungszelle “80_64_80“: Epi.Y!Ameise.Z.1595#280936164980378. Im Epithel bilden sich Anhäufungen kleiner Körnchen als Sekretionsgranula „5_1“. Die Ziffer „1“ ist eine Zählgröße, so dass sich Punktgruppe „44“ versteckt als Teilmenge inclusive Zeilennummer mit Z._QS 1+5+9+6 = 21 plus #QS 2+8+0+7+6+0= 23 und insgesamt 21+23=44. Die Restgröße „QS=35“ als QS 8=Verdauung: Epi.Y!Ameise.Z.1596#280760139814351. Das Epithel enthält Myelinkörper 5_0 = Biomembran „33“ in der Menge als Zählgröße 11: Epi.Y!Ameise.Z.1597#280584335093114. Die Verdauungszelle „80_818“ ist fertiggestellt und liegt nachfolgend auf der Basallamina „333_33_646“: Epi.Y!Ameise.Z.1596#280408750402818 und Epi.Y!Ameise.Z.1599#280233385330646. Die säulenförmigeVerdauungszelle „800“ sitzt mit der Basallamina auf dem Ringmuskel 5_464_5 als QS 5+8+2+3+9+4+6+4+8+1+5=55: Epi.Y!Ameise.Z.1600#280058239464815. Längsmuskel „55_858“: Epi.Y!Ameise.Z.1611#278145985812355.
Magenform Teil 3: Der birnenförmige Magenhals beginnt als Formring „707“ mit einer Gegenkrümmung „46“: “: Epi.Y!Ameise.Z.1615#277457079345946.
Verdauungszelle TYP 2: Im Zeilenlauf liegt in der Zeile ständig mit „#26...“ ein Bezug zur Hämolymphe=26 vor, so dass die gewonnenen Nährstoffe nunmehr aufgenommen werden können. Die im Epithel vorhandenen Microvilli als fadenförmige Zellfortsätze sind bei diesem Zelltyp lang „11_111=lang“: Epi.Y!Ameise.Z.1705#262811251110676. Im Epithel sind Myelinkörper vorhanden, die eine Struktur „50_33=Biomembran_757“ bilden. Membranbildende Lipide besitzen einen hydrophilen und einen hydrophoben Teil, so dass eine Trennung 15_15 von Zeilennummer Z.QS 1+7+0+7=15 und Zeile #2+6+2+5+0=15 besteht. Epi.Y!Ameise.Z.1707#262503329316757. Zur Bildung einer Säulenstruktur wird der Zeilenlauf mit der Bildung von Sphärokristallen beschäftigt. Sphärokristalle besitzen eine polykristalline Struktur, die im Gegensatz zu echten Kristallen keine glatten, sondern abgerundete Grenzflächen zeigen. Hier wird angenommen, dass sich ein hexagonales „60..06“ Netz bildet, so dass typisch für ein Sphärokristall in Ecken teilweise ein runder Körper mit Verdauungsbezug „8888“ liegen kann. Das Sphärokrsitall wird als Volumen 22_9_200 erkannt. Eine Spiegelung „QS 2+6=8_21_128“ als Ordnungsprinzip: Epi.Y!Ameise.Z.1709#262196128229200. Die Form 7_9_7_60060 entwickelt sich zum Kristallnetz: Epi.Y!Ameise.Z.1710#262042797160060. Ein integrierter räumlicher Körper „225_4_5_8888_4“ muss nunmehr zwangsläufig das Sphärokristall symbolisieren: Epi.Y!Ameise.Z.1718#260822574588884. Die runden Grenzflächen folgen als „606_7=Form“ und QS 4+2=6_4=rund: Epi.Y!Ameise.Z.1719#260670845342469. Das polykristalline Netzwerk schließt sich wie begonnen als „6006“: Epi.Y!Ameise.Z.1723#260065689578470. Das Epitel der Verdauungszelle liegt auf der Basallamina „333“ auf: Epi.Y!Ameise.Z.1727#259463337083789. Ring- und Längsmuskel „55_505 an der äußeren Magenwand: Epi.Y!Ameise.Z.1736#258118193055129 und Epi.Y!Ameise.Z.1753#255615050281633.
Schließmuskel am Ventriculus: Der gefüllte Privatmagen (Ventriculus) ist entweder kugelrund oder wird birnenartig durch einen Magenhals verlängert. Der Pylorus bildet beim Menschen am Schließmuskel das Magenende. Bei der Ameise wird vermutlich ein Schließmuskel vorhanden sein, der dann aber vorzeitig entsteht und nicht den Abschluss des Pylorus am Dünndarm bildet [Klappe vorhanden siehe: „Stitz, H. 1914. Die Ameisen (Formicidae) Mitteleuropas, insbesondere (yumpu.com)“]. Der Schließmuskel „55“ arbeitet nach der Bixnom-Kurve als Krümmungsgegensatz „64/46“ über 3 Zeilen als Zeit=24: Offen-Phase: „20_QS 3+9=12=Halbzeit_02“ mit Ringmuskel 55_64: Epi.Y!Ameise.Z.1853#241820390255641. Geschlossen-Phase: Muskel 55 in Zeilen-Nr. und Zeile aktiv 55_55. Keine 0(Null) enthalten und Form gedreht 7_46: Epi.Y!Ameise.Z.1855#241559667462913. Die Funktion erklärt sich wegen Form=Nerv=7 aus der Schließzeit der Klappe Z.1853-1855= „#2607227927285“. Die Magen-End-Klappe wird in Abhängigkeit von der Hämolymphe=26 im Körper als geschlossen „7_22_7“ oder offen „272“ gesteuert mit QS 2+7+2=11 als Zählgröße und 60 Sekunden genau.
Magenform Teil 4: Der Magen (Ventriculus) endet am Übergang zum Pylorus mit einem Formeinschnitt „707“: Epi.Y!Ameise.Z.1858#241169635707052.
Hinterdarm (Verdauungssystem Teil 3): In den Pylorus münden die schlauchförmigen Malpighi-Gefäße als ungeordnetes Knäuel, so dass der Pylorus den Kreismittelpunkt „8_64_8“ bildet. Die Malpighi-Schläuche sind als 990 bereits avisiert und werden später als „909“ durchgezählt. Die Schläuche erfülllen eine Nierenfunktion. Die Anzahl der Schläuche variiert je nach der Interpretion der Insekten zwischen 2 und mehreren Hundert: Epi.Y!Ameise.Z.1859#241039904864822. Die überschüssigen Abbauprodukte aus der Hämolymphe des Bauchraumes werden in den hier beginnenden Hinterdarm „808“ entsorgt. An dieser Position wird zunächst noch der Mitteldarm adressiert, weil die Ampullle des Pylorus noch nicht entstanden ist. Die Malpighi-Gefäße werden bereits als eine Zählgruppe „1“-44 von „6“ bis „20“ Schläuchen avisiert. So mathematisch verhielten sich aber nur die damaligen deutschen Ameisen, denn der Experte H. Stitz zählte im Jahre 1914 exakt 6 bis 20: Epi.Y!Ameise.Z.1861#240780861442076. Der Polyrus bildet eine voluminöse Ampulle, die selbst sehr kurz ist. Es schließt sich daran der Dünndarm (Ileum) an. Die Malpighi-Schläuche sitzen außen am Pylorus. Die Schläuche werden hier unter dem Begriff „Schlauch-Ende=9“ als häufige „909“ gewählt, weil mit der Zählung von 6 Schläuchen das Ende des Dünndarm erreichbar ist. Die Pylorus-Ampulle wird über die besonderen Zeilen-Nr. Z.18_63 / Z.18_64 gebildet. Enthalten ist eine kugelförmige „64“ äußere Form 0_7. Der Mitteldarm ist durch eine spezielle peritrophische Membran „333“ geschützt, weil der Mitteldarm als entodermales Organ mit keiner chintinhaltige Cuticula ausgekleidet ist. Der Hinterdarm beginnt nach dieser inneren Abgrenzung: Epi.Y!Ameise.Z.1864#240393338596407. Die Art und Lage des Übergangs ist hier unbekannt. Für den Durchfluss in den Schläuchen ist die Zeit=24 enthalten. Als Halbzeit=12 wird die Kette innerhalb der „6...4“ mit QS 1+1+3+7=12 als Zusammenhang benötigt, um die 6 Schläuche als Zählgrößen „11“ mit „909“ durchzählen zu können. Erst zum Schluss stehen die 6 Schläuche dann in einer „64“ Liste, um darin ggf die Funktion der Schläuche abzulesen: Epi.Y!Ameise.Z.1867#240007061137495. Ampulle des Pylorus als Volumen „777000_55“ mit der Schlauchanzahl „6“ in der Zeilennummer: Epi.Y!Ameise.Z.1868#239878577700055. Der 1. MP-Schlauch „909“ von 6: Die 6 Schläuche sind mit dem geometrisch ungeordneten Schlauchknäuel „46_909_64“ enthalten: Epi.Y!Ameise.Z.1881#238220724690964. Einleitungsstelle der 6 (QS 2+2+2=6) Malpighi-Schläuche für die Abbauprodukte der Hämolymphe in den Verdauungstakt „808“ innerhalb des Pylorus. Eine Mikroskopie vom Innenraum der Ampulle ist nicht bekannt: Epi.Y!Ameise.Z.1910#234603760808222. Der 2. MP-Schlauch „909“ von 6: Epi.Y!Ameise.Z.1916#233869093498801. Der 3. MP-Schlauch „909“ von 6: Epi.Y!Ameise.Z.1943#230619239909266. Der 4. MP-Schlauch „909“ von 6: Epi.Y!Ameise.Z.1949#229909278165061. Der 5. MP-Schlauch „909“ von 6: Epi.Y!Ameise.Z.2027#221062251180909. Der 6. MP-Schlauch „909“ von 6: Epi.Y!Ameise.Z.2081#215325892909036. Die 6 Malpighi-Schläuche wurde von der realen Position am Pylorus durchgezählt, um über eine Strecke am Dünndarm in die Leibeshöhle (Mixocoel) einzustrahlen. Im Zuge eines inneren Wasserkreislaufs werden Harnsäure, Harnstoff und Allantoin als Nieren-Funktion ausgeschieden. Ab Zeile Z.2110 kann über 11 Zeilen festgestellt werden, dass die Zeilennummer geeignet ist, die Hämolymphe in der Leibeshöhle zu symbolisieren, weil sich die Zählgröße 11=Natrium in den Zeilencode als die Hämolymphe innerhalb des Schlauches hineinzieht. Diese Besonderheit entsteht dadurch, dass der Bixnom-Kreis= 64 fast in allen Zeilen vorhanden ist. Mit 64_64 ist es der Gesamtkreis der Schläuche am Pylorus und der Kreislauf der Hämolymphe als Resorptionsprozess vorhanden: Epi.Y!Ameise.Z.2110#212366437508864. Die Zeile Z.2111 symbolisiert mit „111“ die enorme Schlauchlänge. Die Schläuche werden als Struktur 5 dem Verdauungstrakt 8 als 58_58_5_8_3_8 zugeordnet. Weil nachfolgend Ei- und Drüsenschläuche entstehen. Ist eine Abgrenzung nützlich: Epi.Y!Ameise.Z.2111#212265837585838. Gefäßwand als Membran 33: Epi.Y!Ameise.Z.2112#212165332927890. Der Wassertransport aus der Hämolymphe in der Körperhöhle ist an Kalium=19 gebunden, das wegen der Membran 64_33 noch als 11 und 99 durch Zeilennummer und Zifferncode gespalten ist. Das Natrium=11 steht außen bereits zum Abtransport bereit. Zusammen mit der Harnsäure bilden sich lösliche Urate, die durch die Schlauchwandung gelangen: Epi.Y!Ameise.Z.2113#212064923399765. Die Natrium- und Kaliumionen (11 /19) sind als Summe „119“_64_64 lesbar und erzeugen im Schlauch ein leicht alkalisches Milieu: Epi.Y!Ameise.Z.2114#211964608866463. Zwecks Optimierung sind „6 (MP-Schläuche)_ 64 vs. 63“ sowie die Spiegelung „646“ enthalten: Epi.Y!Ameise.Z.2114#211964608866463. Die 6 Malpighi-Schläuche folgen als 64er Serie: 1.) „64_24“: Epi.Y!Ameise.Z.2115#211864389193240; 2.) „64_64_24“: Epi.Y!Ameise.Z.2116#211764264245607: 3.) „64_33“: Epi.Y!Ameise.Z.2117#211664233889326; 4.) „64“: Epi.Y!Ameise.Z.2118#211564297990417; 5.) „64_64“: Epi.Y!Ameise.Z.2119#211464456415150; 6.) „64“: Natrium ist nicht mehr in der Zeilennummer enthalten: Epi.Y!Ameise.Z.2120#211364709030049. Die 6 Schläuche entwässern über die Verbindung „808“ am Pylorus. Die „Öffnung „505“ ist als Herzklappe (Ostium) am Herzschlauch bereits reserviert. Die Herzschlauch treibt die Zirkulation der Hämolyphme=26 an: Epi.Y!Ameise.Z.2121#211265055701888. Bei der Resorption entstehen Hydrogencarbonate, die hier knochenähnlich als „22“ in der Zeilennummer zählbar und getrennt in einer Spiegelung 629_7_692 enthalten sind. Weiterhin sind die Bestandteile 1 und 9 aus 11 und 19 wieder zerlegt worden: Epi.Y!Ameise.Z.2122#211165496297692. Der Hinterdarm wird nach dem weiblichen Geschlechtsorgan fortgesetzt!
Weibliche Geschlechtsorgan: Das Ameisen-Ei entwickelt sich in einem Ei-Schlauch (Ovariole / Eiröhre). Bei den sterilen Arbeite*rinnen kann sich aus dem Ei notfalls ein Männchen (Drohne) entwickeln bzw. wird das Ei resorbiert. Auf jeder Seite des Ovars sind als reale Variante 3 Ei-Schläuche vorhanden, jedoch ist auch eine massenhafte Anzahl möglich. Das Ovar befindet sich im hinteren Körperabschnitte. Die Länge einer gewickelten Ovariole entspricht der Körperlänge der Königin. Um die Länge der Ei-Schläuche zu symbolieren, beginnen sie im Zeilenlauf vorzeitig. Die Ei-Schläuche der sterilen Arbeiter*innen bleiben kurz. Dem linken und rechten Ovarium sind jeweils 3 Ei-Schläuche zugeordnet. Aus den Ovarien gelangt das Ei jeweils in einen der beiden Eileiter. Zwischen den Ovarien ist die Spermathek (Receptaculum seminis / Samentasche / Samenkapsel) angeordnet, in die Königin zeitlebens die Spermien der Begattung vom Hochzeitsflug als Vorrat lebensfähig hält. Dieses Organ ist bei den sterilen Arbeiter*innen funktionslos angelegt. Die Spermien gelangen über einen Samengang mit einer Befruchtungstasche am Ende an das Ei, dessen Mündung an dem unpaarig vereinigten Eileiter liegt. Es folgt dann noch eine Begattungstasche (Bursa copulatrix) an der Vagina, aus der die Spermien erst noch in die Spermathek umgelagert werden müssen. Ein direkter Verbindungskanal von der Begattungstasche in die Spermathek ist nicht bei allen Gattungen vorhanden, so das auch Samengang als Transportstrecke erforderlich ist. Weil sich Spermien auch zu einem Bündel binden, um andere Spermien als Konkuurenz zu reduzieren, würden ein Bündel den Extragang ggf. verstopfen. Für die Königin werden vor dem Hochzeitsflug beispielsweise der Begriff „Jungkönigin“ und danach "Functional Queen" für ein fertiles (Eier legend) und zugleich begattetes Vollweibchen verwendet.
Ovarien: Die 6 Ei-Schläuche sind nunmehr zwischen den Malpighi-Schläuchen und den Schläuchen der Samentaschen-Anhangsdrüse zu erwarten. Ovariolen-Gruppe: Zunächst muss sich eine Ovariolen-Gruppe 44 bilden, die als Formgruppe 4_7_4 oder als Ei-Zählgröße beider Ovarien 2_11_0 als Restgröße QS 6+6+0+3+0+6+8+4+7+4=44 vorhanden ist. Die Gruppe ist mit „66“ nicht für Männchen (Drohne) bestimmt. Die Eier sollen als Zeitvorgang 60/2=30 als Halbzeit immer wechselseitig in den Ovarien heranreifen, Diese „Halbzeit“ ist auch in der Zeilennummen als 24/2=12 adressiert: Epi.Y!Ameise.Z.2123#21106603068474. Die 6 Ei-Schläuche werden in 6 Zeilen adressiert und durch 2 Zeilen „666“ jeweils als Sammelkanal (Ovarium) markiert. Die beiden Ovarien enthalten als Struktur die „55“ bzw. QS 2+1+2=5_5. Der Reifungsprozess der Eier im Ei-Schlauch erfolgt durch eine Serie von Eiern, in der immer ein Ei und eine Ernährungszelle wechseln. Dieses wird symbolisiert, indem in der Serie der 6 Schlauchzeilen ein Strukturzeile 5 als Ei mit einer Ernähungszelle 03 wechselt. Eine Zeile ohne „5“ enthält bei dieser Zusatz-Symbolik natürlich ebenfalls Eier. Von den 6 Ei-Schläuche enthält 1 Zeile das Hormon „66“, um auch für die sterile Arbeiter*in einen paarigen „626“ Ei-Schlauch zu bilden. Die Halbzeit 24/2=12 ist komplett in der Zeilennummer Z.2124 enthalten: Epi.Y!Ameise.Z.2124#210966658730557, Epi.Y!Ameise.Z.2125#210867380302919, Epi.Y!Ameise.Z.2126#210768195269851, Epi.Y!Ameise.Z.2127#210669103499626, Epi.Y!Ameise.Z.2128#210570104860763, Epi.Y!Ameise.Z.2129#210471199222031, Epi.Y!Ameise.Z.2130#210372386452443, Epi.Y!Ameise.Z.2131#210273666421259. Bei einer Präparation der Gattung „Polyrhachis dives“ wurde je Seite 25 Ovariolen gezählt, die hier in der Zeilennummer der Anfangszeile Z.2125 enthalten sind. Massenhaft wären „210“ Oviolen auf jeder Seite. Der Eisprung gibt das Ei „101“ frei: Epi.Y!Ameise.Z.2132#210175038997985. Das Ei gelangt in den paarigen „2“ Eileiter 2_100. In der Zeilennummer Z.2133 wird mit „33“ vermerkt, dass ohne Besamung nur Männchen erzeugt werden: Epi.Y!Ameise.Z.2133#210076504052369. Die Länge des paarigen Eileiters kann mit #20_99=Ende als eine Gruppe 4_5_44 gesucht werden: Epi.Y!Ameise.Z.2134#209978061454406. Die Gruppe des paarigen Eileiters „44_2“ vereinigt sich als „20_442_20__20“ zum unpaarigen Einleiter „20“: Epi.Y!Ameise.Z.2192#204422072602054. Die Malpighi-Schläuche reichen weit in das Körperende hinein, so dass das Ovarium als Gesamtorgan dorthin umzusetzen ist bzw. sich mit dem Längenwachstum der Ovariolen entfaltet. Der Samengang kann nunmehr jederzeit in den unpaarigen Einleiter einmünden. Eine Umsetzung „2020“ ist abgeschlossen: Epi.Y!Ameise.Z.3003#149215179202032.
Anhangsdrüse: Eine weitere schlauchförmige Struktur wird von den beiden Drüsen-Schläuchen der Anhangsdrüse an der Spermathek (Receptaculum seminis / Samenvorratsblase) gebildet. Als Verwendungszweck wird die Spermathek-Gruppe 44 an die Spermien „33“ als „4_33_4“ gekoppelt. Aus den Markierungen „98797“ hebt sich die Drüsenziffer „8“ als Zählgröße „11“ heraus. Die Drüse liegt somit nicht einzeilig als 888 vor, sondern zieht sich über viele Zeilen in vertikalen 8er-Serien als Schlauch: Epi.Y!Ameise.Z.2135#209879711074334. Welches Sekret in der Drüse produziert wird, ist hier nicht bekannt. Die Drüse lässt sich für mikroskopische Präparation mit Eisenhämatoxylin anfärben. Der Färbeeffekt tritt erst nach Zugabe von Hämalaunen (Eisen=26, Aluminium=13) ein. Aluminium=13 liegt in der Zeilennummer vom Eisen=26 als Z.2_13_6 umklammert vor. Im Zifferncode ist Eisen=26 verbunden mit den Spermien „33“ vorhanden. Um am Ende des Drüsenschlauches die chemisch aktive Zone am Samengang zu finden ist eine Sprungmarke als Drüsen-Form 78_78 enthalten. Die Zusammenführung an der Mündungsstelle der Drüsenschlauch liegt noch davor: Epi.Y!Ameise.Z.2136#209781452782633. Eine Serie aus 5 Zeilen zeigt die Ziffer „8“ an 5. Stelle. Eingeschoben wird dann eine unpaarige=“1“ Samengangruppe „1_33444“, mit der sich das Ende des Samenganges „909“ zeigt, damit die Drüsenschläuche eine Mündungsstelle finden. Als Gemeinsamkeit ist dafür die Zählgröße QS 3+8=11 enthalten: Epi.Y!Ameise.Z.2141#209291538133444, Epi.Y!Ameise.Z.2142#209193829665594 und Epi.Y!Ameise.Z.2143#209096212386236. Nach einer Zeile für ein Ganglienpaar „777“ wird der paarige Drüsenschlauch als Serie von 10 Zeilen mit der Drüsen-Ziffer „8“ an 3. Stelle fortgesetzt ab Epi.Y!Ameise.Z.2145#208901250882845. In der letzten Zeile ist mit „404“ ein Verbindungsgang vorhanden, der direkt in die Spermathek führen könnte: Epi.Y!Ameise.Z.2154#208028404430689.
Die Bixnom-Kurve „64“ wird zur Bildung der Form=7 für die der Spermathek (Receptaculum seminis) verwendet. Die Spermathek kann blasen- oder hantelförmig sein. Hier passend ist die Mischform aus Banane und Schmetterling mit einem seitlich spitzen Flügelpaar (siehe: Präparation „Polyrhachis dives“, Ameisenwiki). Die Oberseite des Flügels ist beidseitig konvex und gespiegelt „7_64_46_7“. Der „Schmetterling“ sitzt mittig auf dem Samengang „09“: Epi.Y!Ameise.Z.2158#207642809612467. Die Unterseite ist als Gegenform „5_46_5_64“ konkav geformt. Die Kurve für den unteren Rand liegt jedoch nicht linsenartig unter jedem Flügel, sondern zieht wegen der Struktur-5 konkav über beide Flügel. Die Existenz der Spermathek zeigt sich auch in folgenden Zeilen ber die Kurvenzahl „64“: Epi.Y!Ameise.Z.2159#207546634156417. Die Zusammenführung der Drüsenschläuche 51_7_15 und QS 4+5=9_0_ QS 4+5=9 sowie die reguläre Drüsenmündung liegen am Ende des Samenganges „909“ als Zählgröße QS7+4=11 mit der klassischen Öffnung „505“. Diese ist keine Struktur-5, sondern die Einmündung in einen Muskelschlauch „55“ als Endstück des Samensganges („Pumpenkammer“). Dieses muskuläre Endstück liegt vor der Spermathek und funktioniert als Pumpe: Epi.Y!Ameise.Z.2160#207450547751715. Die Pumpenkammer „78_6000_78“ wird nunmehr mit der Drüsenwirkungszone „78“ in eine Beziehung gebracht: Epi.Y!Ameise.Z.2167#206780426000786. Das Endstück des Samengangs „09“ ist von einem Ringmuskel „757_55“ umgeben. Bei Erschlaffung der Muskulatur über den Nerv 7 weitet sich der Raum, so dass wenige Spermien aus der Spermathek in den Samengang / “Pumpenkammer“ gesaugt werden: 206685047575509. Die Spermathek als Form „64“, der Samengang- Muskel „55“ und das Spermium „1“ bilden eine Funktionsgruppe „4444“: Epi.Y!Ameise.Z.2170#206494554444103. In Z.2172 bildet sich im Zeilenlauf ein weiteres Ganglienpaar „777“ des Nervensystems. Die Wand der Spermathek enthält erkennbar ein Gefäßnetzwerk 44, das gemäß Quellen dem Luftsystem der Tracheen „222“ zugeordnet wird: Epi.Y!Ameise.Z.2173#206209472224438. Am Ende des muskulären Endabschnittes des Samenganges ist bei der Ameisengattung „Polyrhachis dives“ eine Einschnürung des Schlauches „707“ vorhanden, der dann eine Blase „1000“ mit einem engen Ausgangsventil „505“ in den weiteren Samengang folgt: Epi.Y!Ameise.Z.2176#205925176077070. Die Wandmembran „33“ einer leeren Spermathek zeigt im Mikroskop eine Streifenform 1_7_1_7: Epi.Y!Ameise.Z.2180#205547331717295. In der Membran 33 ist ein ovaler Bereich 5_3_5_030 vorhanden, in dem ein Ventilspalt „11“ liegt. In der Zeilennummer Z.2_QS 1+8+2=11 und am rechten Zahlenrand mit „112“ wird eine Dopplung „211_112“ für den mikroskopisch sichtbaren Ventilspalt an der Spermathek erzeugt: Epi.Y!Ameise.Z.2182#205358929030112. Die Blase „1000“ im Samengang enthält die Zahl „404“, die für die weitere Benennung des Samenganges gewählt wird, weil nachfolgend noch eine „505“ für das Ausgangsventil verfügbar ist und die „Pumpenkammer“ „909“ eher weniger als Fortsetzung geeignet ist. Weil die Ameise keinen Harnleiter „303“ besitzt, wird die „303“ für den Extra-Spermiengang einiger Ameisengattungen gewählt, über den die Spermien von der Begattungstasche direkt in die Spermathek als Vorrat geleitet werden, statt den Samengang „404“ als Tranportstrecke zu nutzen. Epi.Y!Ameise.Z.2196#204049719100047. Ausgangsventil „505“ am Endstück des Samenleiters: Epi.Y!Ameise.Z.2198#203864050565834. Für den Spermientransport in der umgekehrten Richtung nach dem Hochzeitsflug über den „Spermienkanal“ „303“ sind 2 Zeilen vorhanden, von denen 1 Zeile mit der Zahl „64“ für den Direktanschluss an der Spermathek verfügbar ist: Epi.Y!Ameise.Z.2206#20312474303885 und Epi.Y!Ameise.Z.2207#2030327064538760.
Der unpaarige Eileiter bildet bereits vor der Begattungstasche (Bursa copulatrix) eine Befruchtungstasche, an deren Ende der Samengang „404_33“ mündet als Ende=99: Epi.Y!Ameise.Z.2921#153404033941699. Bei der Sackform handelt es sich gemäß Quellen um 2 Lappen „4664 und 2662“: Epi.Y!Ameise.Z.2924#153246642662005. In Übereinstimmung mit dem Endstück des Samenganges (Pumpenkammer) ist in der Befruchtungstasche an der Mündung des Samenganges die gleiche Funktionsgruppe „4441“ mit der Zeitdifferenz Z.2170-Z.2926 = #5_33_5_26_5_99999_118 enthalten: Epi.Y!Ameise.Z.2926#153141894444191. Sowohl die Befruchtungstasche als auch der benachbarte einpaarige Eileiter besitzen eine Ringmuskulatur. Ringmuskulatur „505“ am Eileiter: Epi.Y!Ameise.Z.2976#150568945948825. Die Ringmuskulatur an der Befruchtungstasche zeigt sich als Samengang „404“ als Tasche erweitert „505_4004“: Epi.Y!Ameise.Z.2977#150518368540041. Der unpaarige Eileiter „20“ und die Befruchtungstasche mit dem einmündenden Samengang „404“ vereinigen sich „6_20_6_404“: Epi.Y!Ameise.Z.2983#150215616206404.
Die Begattungstasche (Bursa copulatrix) beginnt als Ende eines blinden Sackes als Form 707 und als Blase mit der Bixnom-Kurve „64“ als Raumende 4_9_4 in Bezug auf das Spermium „1“ in „616“. Die Zeit als QS 1+4+9+4+6+4+0+3+7+0+7+2+6+1+6=60 weist die Begattungstasche als temporäres Spermien-Zwischenlager aus. Über den Zeilenlauf entwickelt sich über die Zeilennummer das Sack-Volumen „0“. Die Bixnom-Kurve „93_64_39“ ist enthalten: Epi.Y!Ameise.Z.3000#149364394381234.
Das Ovarium inclusive Spermathek wird in die Nähe der Begattungstasche (Bursa copulatrix) in das hintere Körperende verlagert als „2020“. Mit der Zeilennummer Z.3003 kann die Evolution einen temporären Extra-Spermienkanal „303“ als Ähnlichkeit zu „Z.3003“ suchen, um direkt in die Spermathek einzumünden: : Epi.Y!Ameise.Z.3003#149215179202032. Der unpaarige Samenleiter „20“ ist in „6_20_6“ adressiert. Die Begattungstasche (Bursa copulatrix) mündet dann als voluminöser Schlauch „1116000“ seitlich ein: Epi.Y!Ameise.Z.3020#148375226206524 und Epi.Y!Ameise.Z.3021#148326111600034.
Vagina: Der Zeilenlauf setzt sich als Drehung des Scanns um das Körperende fort. Die Vagina liegt unterhalb des Afters. Bei der Vagina ist wahrscheinlich ein Schlüssel-Schloss-Prinzip in Bezug auf geeignete Männchen zur Begattung zu finden. Das Männchen „333“ besitzt den Formschlüssel 7_00_6, so dass in der Vagina als Schloss für die beiden Nullen „00“ eine passende Vorgabe benötigt wird. Die Vagina ist als Spalt „6_11“ adressiert: Epi.Y!Ameise.Z.3114#143896333700611. Das Schlüssel-Schloss-Prinzip „85“_ 90_5_09 liefert die Schlüsselzahl „85“ mit QS 8+5=13_0_13. Bei Aluminium=13 kann es sich um ein Lockmittel handeln: Epi.Y!Ameise.Z.3115#143850139050948. Die Zahl „85“ steht dann schließlich am rechten Zahlenrand. Vagina „66_5_6_5_6666“: Epi.Y!Ameise.Z.3119#143665656666785.
Fortsetzung Hinterdarm (Verdauungssystem Teil 3): Reektalblase: Der Dünndarm (Ileum) endet mit einer Verbindungsröhre mittig im Boden der großen, birnenförmigen Rektalblase. Der Stofftransport wird mittels einer Rektalklappe (Recatal valve) reguliert. Siehe: „(A) Digestive tract of a worker of Paratrechina longicornis... | Download Scientific Diagram (researchgate.net)“. Bei einer Fruchtfliege endet der Dünndarm wie ein verschnürtes, rundes Ende einer Wurst „8008_64“. Als Verbindung zur Rektalblase führt eine dünne Röhre „101_22“ heraus. Diese Kombination liegt an den besonderen Zeilennummer Z.2263/Z.2264 als Optimierungsfall „63 vs. 64“ vor: Epi.Y!Ameise.Z.2263#198008476864208 und Epi.Y!Ameise.Z.2263#197921017289622. Die Mikroskopie zeigt eine runde „64“ Wulst, in der 3 Hautlappen in Y-Form „333“ den Klappenverschluss als Gruppe 1_44_1 bilden: Epi.Y!Ameise.Z.2278#196704645804962 und Epi.Y!Ameise.Z.2279#196618333981441. Die 3 Hauptlappen werden zunächst mit 2 Lappen „37_37“ als Spalt „11“ am runden „64“ Verschluss dargestellt: Epi.Y!Ameise.Z.2281#196445937371198. Der 3. Lappen folgt als Haut=3 und Form=7 am Spalt „1_37_1“, wobei die runde Klappenform als Quersumme QS=64 der Zeile enthalten ist: Epi.Y!Ameise.Z.2283#196273842813712. Die 3 Schließmuskeln „55“ sind im Unterschied zur Muskelwand der Rektalblase sehr klein und werden auf 3 Zeilen Z.2284, Z.2286 und Z.2287 verteilt. Die Ringmuskeln 550 zur Bildung der Blasenwand werden wie ein gespiegelter Kreis 46 statt 64 als Volumen „4006“ avisiert. Mit 3_1_3 sind Bindegewebsleisten quer zu den Muskelringen als Netzwerk vorhanden. Bindegewebe 33 und Ringmuskel 555 bilden ein kombiniertes rechteckförmiges „4“ Netzwerk „4_3_5_4_555“ am Blasenkörper: Epi.Y!Ameise.Z.2294#195332686636314 und Epi.Y!Ameise.Z.2295#195247574354555. Die Form Z. QS 2+3+0+2=7 wird als Verdauungstrakt „808“ in Verbindung nit Drüsen 888 als Gruppe 44 entwickelt. Die Kontur der Blase ist zum Körperende mit 46 (vs. 64) zum Blasenhals fallend: Epi.Y!Ameise.Z.2302#194653858880844. Auf der Oberfläche der Rektalblase heben sich als zwei „2“ runde „2_5_64_5_9=oben“ Formen 0_77_0 als Rektalpolster (Rectal pad) heraus: Epi.Y!Ameise.Z.2315#193560770256459. Die Rektalpolster bilden sich, indem sich die Hautschichten in Innen- und Außenepithel trennen 9_33_9__33, um eine zylindrische Hohlform zu bilden: Epi.Y!Ameise.Z.2317#193393691473329. Die Hohlform „2000“ ist mit Hämolymphe=0_26_0 gefüllt: Epi.Y!Ameise.Z.2318#193310260200045. Die Hämolymphe „26“ besitzt eine höhere Osmolarität als die umgebende Lymphe „26“, so dass die Rektalpolster der Resorption von Wasser dienen: Epi.Y!Ameise.Z.2319#193226900881287. Der Zeitunterschied Delta „833593187581“ enthält die Hautmembran 33_18_81 am Verdauungstrakt. Im mittleren Abschnitt der Rektalblase ist am besonderen Zeilenübergang Z.2363/Z.2364 mit 89_QS 6+2=8_89 die Hautoberfläche „33“ adressiert, um die Rektaldrüse (Rectal gland) im Zeilenlauf #188... auf der Rektalblase mitzuziehen: Epi.Y!Ameise.Z.2319#18962893912133.
Rectum: Direkt vor dem After ist die Hautoberfläche 333 als Ring glatt geschlossen, ist aber zuvor mit einem hexagonalen Wabenmuster ausgestattet: Epi.Y!Ameise.Z.3106#144266961733324.
After „808“ und Ende=99: Epi.Y!Ameise.Z.3109#144127752699808. Der After wird von einem Haarkranz „1_44_0“ mit ca. 44 Haaren umschlossen, die in der Zeilen-Nr. als „111“ enthalten sind. Epi.Y!Ameise.Z.3111#144035095835327. Die Öffnung wird mit der Zeilen-Nr. QS 3+1+1+2=7=Form durch einen kreisrunden (Bixnom-Kreis=64) dünnen Hautring gebildet, der innenseitig vermutlich mit 2 Lappen verschlossen ist. Auf jedem Lappen sitzt ein dunkelbrauner Drüsenfleck „888“. Epi.Y!Ameise.Z.3112#143988812064172. Wahrscheinlich ist der After mit der Zeilen-Nr. „3_11_3“ spaltförmig und mit einem Schließmuskel 55 ausgestattet: Zeilen-Nr. Z.3113#143942558028816. Der After sitzt vertieft in einer kreisförmigen Hauttasche „333700“ , die ein netzartiges Hautmuster und vereinzelte Haare 11 zeigt: Siehe „Ameisenanus, REM - Archivbild - C018/0549 - Science Photo Library“: Epi.Y!Ameise.Z.3114#143896333700611.
Giftblase mit Säuredrüse / Giftdrüse: Die Giftblase nimmt die von der Giftdrüse prozuzierte Säure als Reservoir auf und führt es über einen Ausführungsgang mit oder ohne Stachel ab. Die Giftblase zieht sich über die obere, hintere Hälfte des Hinterleib (Abdomen) unterhalb des Herz-Schlauches entlang und ist mit einer Giftdrüse ausgestattet. Andere Quellen zeigen, dass dort statt der großen Giftblase die Rectasblase mit ihrer Rectaldrüse angeordnet ist, so dass statt einer oberen langgestreckten Giftblase eine kleine untere Giftblase vorhanden ist. Weil die Giftblase die Giftdrüse als ein kompaktes Knäuel (gestreckt 20 cm) enthält, ist auch eine gesteckte Variante der Giftblase vorstellbar. Die gesteckte Giftblase beginnt bereits vor dem Ende der Ganglienkette, so dass dort der Suchbereich liegt.
Zunächst wird eine Form-Gruppe 7_44_2_44 gebildet, die 2 freie Giftdrüsen-Schläuche adressiert, die außerhalb der Giftblase liegen. Die Zeilenummer zeigt mit Z. 262_9 eine Symmetrie und die Ziffer „6“ symbolisiert die Ameisensäure als einfachste Karbonsäure mit Kohlenstoff=6. Die „88“ ist eine übliche Drüsenadresse: Epi.Y!Ameise.Z.2629#170442443188932. Die Drüsenschläuche sind als Zählgröße 11 an der runden Giftblase 0020_64 vermerkt. Der Kreis 64 wird dann zu 46 gespiegelt und der Drüsenschlauch 11_4 wird am rechten Zahlenrand für das Ameisenmännchen=33 als unwirksam herausgeschoben. Zumindest ist nur sicher, dass Königinnen und sterilen Arbeiter*innen immer eine Giftdrüse besitzen: Epi.Y!Ameise.Z.2634#170118900206417. Epi.Y!Ameise.Z.2637#169925363346114. Die Giftblase wird in der Zeilennummer avisiert als Bixnom-Kreis „64“: Epi.Y!Ameise.Z.2640#169732266342312. Auf der Oberfläche der Giftblase „64“ vereinigen sich beiden Drüsenschläuche und bilden in der Giftblase einen unpaarigen Drüsenschlauch als 69_11_4_11_96: Epi.Y!Ameise.Z.2645#169411411396485. Die Giftblase läuft in der Zeilennummer Z.26xx und die Giftdrüse im Zifferncode #16... bis zum Auslauf der Giftziffer „6“ in Epi.Y!Ameise.Z.2699#166021927804262. Der Drüsenschlauch windet sich, weil ein Bereich als Dopplung #166... durchlaufen wird. Aufgrund der Windungen liegt der Ausführungsgang der Giftdrüse in die Giftblase bereits vorzeitig als „6006“ in Epi.Y!Ameise.Z.2687#166763372960068. An der Mündungsstelle zeigt der Drüsenschlauch eine Anschwellung 666: Epi.Y!Ameise.Z.2689#166639339212980. Der Ausführungsgang des Giftblase „606_9“ wird entweder eng in den Stachelapparat geführt oder endet breit in der Kloake „60666_9“. Eine Kloake als Sammelausgang kann durchaus etwas nach dem After erscheinen, weil sich der Scann überlicherweise am Körperende zur Körperunterseite wendet. Epi.Y!Ameise.Z.3255#137663036296069 und Epi.Y!Ameise.Z.3294#136033146066698.
Stachelapparat: Der Stachelapparat ist nur bei Knoten- und Stechameisen ausgebildet, fehlt ansonsten oder ist reduziert vorhanden. Ohne Giftstachel wird mit dem Mundwerkzeug eine Wunde gebissen, das Ende des Hinterleibs zwischen den Beinen nach vorn gebogen und Gift versprüht. Die Giftdrüse und die Dufor-Drüse liegen am Stachel. In den Z. 314x wird die Zahl „14“ mit QS 1+4= 5=Struktur=Stachelapparat in der Ziffernfolge #14 übernommen, die sich dort zur Stachelfunktion „141“ mit QS 1+4+1=6=Carbon=Ameisensäure“ entwickelt. Die Dufor-Drüse gibt Duftstoffe (Pheromone) ab und ist auch bei Ameisengattungen ohne Stachel am Körperende positioniert. Die Dufor-Drüse wird auch als „Alkalische Drüse“ bezeichnet, so das Natron- und Kalilauge mit Natrium=11 und Kalium=19 adressiert werden können in Epi.Y!Ameise.Z.3147#142387411230919. Eine Drüse ist mindestens als Wirkstoff mit der Zahl „88“ zu beschreiben, die mit der Zeilennummer Z._QS 3+1+4=8_8 gebildet wird. Die Drüse 1_80_1 bildet ein Volumen 6000_7 als Form in Epi.Y!Ameise.Z.3148#142342180160007.
Der Giftstachel (Stilett) ist der Hauptstachel und kann ähnlich Knorpel/Knochen als hartes Material „22“ und als Struktur 55 adressiert werden, wobei das Gift zunächst als Universalwirkstoff 77 enthalten ist. Mit seitlich=9 wird ein Paar Borstenstacheln (Lanzette) als 9_6_9 avisiert, so dass insgesamt 3 Stacheln „3_55“ in das Opfer stechen und sich die Ameise dabei mit dem Mundwerkzeug am Opfer festklammert: Epi.Y!Ameise.Z.3149#142296977816355. Die beiden Borstenstacheln „225“ sind als Paar 14_41 enthalten. Die Zeit=60 bewirkt, dass sich die Stacheln wechselseitig in nicht sichtbarer Höchstgeschwindigkeit in die Haut des Opfers hämmern, so dass der Giftstachel leicht folgen kann und das Gift tropfenweise injiziert: Epi.Y!Ameise.Z.3150#142251804172604. Für die 3 Stacheln sind im Stachelapparat Führungen als „0 (Null)“ 20_60_5_06 enthalten, wobei mit der gespiegelten Zeit=60 das wechselseitige Hämmern adressiert wird: Epi.Y!Ameise.Z.3154#142071396050635. Am Körperende ist eine Stachelscheide „202“ vorhanden, der wahlweise über den Nerv 7 den Stachel „1“ als 7_2_1_2 ausfahren kann. Mit 49_7=7x7_7 können alle 3 Stachel-Teile innerviert werden. Die 3 Teile des Stachels sind als „636“ adressiert. Epi.Y!Ameise.Z.3155#142026365497212. Die Stechfunktion zieht sich als Serie #141 über einige Zeilen bis sich die vorherige Zahl „636“ in „363“ gewendet hat und der Stachel 11_22 tief in der Opferhaut „33“ sitzt, von Epi.Y!Ameise.Z.3156#141981363480261 bis Epi.Y!Ameise.Z.3175#141131711226363. Das injizierte Gift „Kohlenstoff=6“ lässt sich mit der Ameisensäure HCOOH in Beziehung setzen, die die einfachste Karbonsäure ist. Ihre Eigenschaft wird von der Carboxygruppe (–COOH) bestimmt, in der das Kohlenstoffatom eine Oxidationsstufe von +2 besitzt. Die Zeitdifferenz Z.3156-Z.3175=“#8496522538976“ zeigt den Stachel 5_22_5 und das Gift=6. Die Ameisen streichen Säure vom Hinterleib ab oder sprühen sich diese in den Rachen. Offensichtlich wird zur Bildung des Magens die Ziffer „6“ verwendet, aber in der Magenwand fehlt eine Drüse zur Säureproduktion. Weil die Opfer vergiftet sind, gelangt die Säure auch zur Desinfektion in den Ameisenkörper.
Männliche Geschlechtsorgane: Der Aedeagus [siehe: DeWiki > Aedeagus] liegt als männlicher Geschlechtsausführungsgang (Penis) am entsprechend verlängerten Körperende. Um den hormonell männlich geprägten Zeilenbereich Z.“33“xx zu erreichen, wird der Zeilenlauf zunächst mit der Bildung der Hoden (Testis) und eines Kopulationsapparates beschäftigt. Die Hoden liegen etwa in der Mitte des Hinterleibs am Magen (Ventriculus). Die Genitalkapsel steht im Hinterleib unter Spannung, so dass sich Bestandteile nach der Begattung am Körperende im Tode ausstülpen. Zur komplexen Steuerung muss zunächst eine Genitalgruppe „44“ angelegt werden. Die Zeile Z.QS 3+1+7=11 ist als Zählgröße 11 geeignet, den Genitalbereich zählbar zu gestalten. Die Zeilen-Nr. und der Zeilencode enthalten mit „31“ eine Spiegelung der „13“ als abergläubisches schlechtes Omen „13“_31. Wenn später mit „13“_ „13“ am Lebensende noch zusätzlich eine schwarze Katze von links nach rechts über den Weg läuft, ist das Ameisenmännchen erschöpft über den Zielstrich gelaufen. Die tödliche Austülpung ist eine Subtraktion 44-11=33, so dass diese Gruppe männlich=33 zugeordnet wird. Die Zahl „64“ ist als Kugel zwecks Kapselbildung enthalten. Epi.Y!Ameise.Z.3170#141354316449118. Das Kapselende folgt als Gegenform „1_46_1“. Die Hämolymphe=26 ist auch als QS 0+1+4+6+1+8+6=26 enthalten: Epi.Y!Ameise.Z.3172#141265190146186. Es kann dann ein weiblicher Hintergrund „weiblich=66–22=44=Gruppe“ und eine Zählgröße 11 erkannt werden. Für die Jungkönigin „666“ fehlt noch 1+4+1=6 als 3. Ziffer, die in der Folgezeile einzeln 6_6_6 genannt sind: Epi.Y!Ameise.Z.3173#141220669128176 und Epi.Y!Ameise.Z.3174#141176176163738. Mit einem „Blick in die Glaskugel“ wird die Kopulation aufgrund der Zählgrößen 11_31_7=Nerv_11 als eine Hormonmischung „6363“ avisiert: Epi.Y!Ameise.Z.3175#141131711226363.
Hoden (Testis): Fachbegriffe siehe: 1.) (PDF) Testes degeneration in ants: A histological study of Gnamptogenys bicolor (researchgate.net); acta Zoologica (Stockholm) 92: 372–376 (October 2011)“. 2.) The coexistence (antwiki.org), The copulation biology of ants (Hymenoptera: Formicidae); Boris BAER; Myrmecol. News 14: 55-68 (online 22 July 2010) ISSN 1994-4136 (print), ISSN 1997-3500 (online). 3.) Testes and Spermatozoa as Characters for Distinguishing Two Ant Species of the Genus Neoponera (Hymenoptera: Formicidae) Source: Florida Entomologist, 98(4): 1254-1256 [2015], https://doi.org/10.1653/024.098.0441
Der Zeilenlauf #140... ist mit der Ziffer „1“ unpaarig, so dass beide „2“ Hoden von einer Gewebshülle (Peritoneal sheath) „33“ unpaarig umschlossen werden mit „09_09_60200_33“. Wegen Hautmembran=männliches Hormon=33 ist das Männchen adressiert: Epi.Y!Ameise.Z.3180#140909806020033. Die Zeit=24 ist in Bezug auf die Spermien „1“ in „2_1_2“ durch die Auswanderung als Leere „2_0_2“ mit der Folge einer Hoden-Schrumpfung enthalten: Epi.Y!Ameise.Z.3182#140821239202924. Der Hoden besteht je nach Ameisenart aus einer Anzahl von 1 bis 32 bohnenförmigen Lappen ( Follikel ). Die Lappen werden in 3 Zeilen #QS 1+4+0+6=11 als Zahlgröße avisiert. Die Zeile Z.3185 enthält die Hautoberfläche „333“, Z.3186 mit „6444“ eine gekrümmte Lappengruppe. Mit „60030_630“ können 3 Lappen gewählt werden oder mit „848“ alternativ 4 Lappen je Hoden. Von Z.3197 bis Z.3200 folgen 4 Zeilen die jeweils die Zählgröße „11“ direkt enthalten, wobei die bekannten Lappenanzahl von 25 und 32 als Maximalwerte mit enthalten sind: Epi.Y!Ameise.Z.3187#140600308485630. Der Mensch hat die genetischen Grundlagen für das Hormonsystem von den Ameisen geerbt. Es basiert auf den Neuropeptiden Oxytocin und Vasopressin. Die Futtersuche, die Bewegungsaktivität und der Stoffwechsel (Metabolismus) werden damit reguliert. Männchen besitzen einen Großvater aber keinen Vater. Bei den Wirbeltieren wird das Testosteron „33“ in den Hoden produziert. Um welches männliche Sexualhormon „33“ es sich bei den Ameisen handelt und wo es produziert wird, ist hier unbekannt bzw. unerforscht: Epi.Y!Ameise.Z.3193#140336104962012. Beim frisch geschlüpften Männchen sind bereits einige Spermien aus dem Larvenstadium vorhanden, so dass nachfolgend die Reifung und Auswanderung in den Samenleiter zu erwarten sind. Für den Samenleiter werden in der Literatur die Fachbegriffe „Vasa seminales“ und „Vasa deferentia“ meist synonym verwendet. In einem Längsschnitt [ANATOMY AND HISTOLOGY OF THE MALE REPRODUCTIVE SYSTEM OF CAMPOSOTUS PENNSYLVAKICUS DEGEER (FORMICIDAE, HYMENOPTERA) JAMES FORBES Biological Laboratory, Pordham University] führt ein dünner langer Schlauch als „Vas defererens“ vom Hoden zum einem langen voluminösen Spermienreservoir als „Semininal vesicle“, bevor der „Ejaculatory duct“ beginnt. Nach einer spektakulären Spermien-Ziffernform (Kopf + Schwanz) müsste im Zifferncode der Larven gesucht werden. Bei Insekten ist die Möglichkeit gegeben, dass die Spermien als Bündel entstehen und je nach Ameisenart ggf. auch als Bündel abgegeben werden. Die Zeile Z.3200 enthält die Zählgröße 9_“11“_9 und mit 40_00_40_7 die Möglichkeit, eine ringförmige Bündelform-Gruppe 44_0_7 zu adressieren: Epi.Y!Ameise.Z.3200#140029119732407. Die Spermienbündel bilden sich, indem die runden Spermienköpfe mittels einer Hülle zusammengehalten werden, wobei die Schwänze einzeln beweglich bleiben. Die Köpfe laufen als Ziffer „0“ in der Zeilennummer und das Spermium „#1“ beginnt in jeder Zeile von Z.3201 bis 3208, die dann mit „99199“ eine Bündelfunktion paarig 67_76 , d.h.in beiden Hoden erzeugt: Epi.Y!Ameise.Z.3208#139679919932576. Der Samenleiter ist ein männlich „33“ geprägter Muskelschlauch „9_505_9=seitlich“, der paarig=2 vorhanden ist: Epi.Y!Ameise.Z.3212#139505972336147. Dieser dünne Muskelschlauch formt sich mit der Zeit=24 aufgrund der einwandernden Spermien zu einem Samenreservoir (SR) „1_7_6000_7“ um: Epi.Y!Ameise.Z.3218#139245861760007. Die Spermien sind als Zahlgröße 11_6_1_6 und als Form 6_7_6_1 enthalten, so dass das Samenreservoir im Vergleich zum schrumpfenden Hoden weitaus länger ist: Epi.Y!Ameise.Z.3221#139116169867651. Das Samenreservoir (SR) ist mangels einer Dehnung am Ende verengt, um nachfolgend einen kleinen Samenvorrat für die Begattung im paarigen Ejakulationsabschnitt (Ejaculatory section = ES) des Samenganges anzulegen. Die Zeit=24 ist in Z.3224 auf männlich=33 und die Form „7377“ bezogen. Im Zeilenlauf beginnt die Drüsen-Ziffer „8=Extra“ mitzulaufen, um die paarige akzessorische Geschlechtsdrüse (Accessory glands = AG) zur Bildung der Samenflüssigkeit anzulegen. Der Samenleiter durchläuft diesen Drüsenabschnitt: Epi.Y!Ameise.Z.3224#138986719337377. Die Engstelle „6226“ könnte durch hartes Material (Skerite) „22“ verursacht sein: Epi.Y!Ameise.Z.3225#138943622680218. Der Ejakulationsabschnitt (ES) bildet das Volumen „90055“ als paarige „138_138“ Form „2_7“: Epi.Y!Ameise.Z.3225#0138900552741384. Der Drüsenabschnitt #138... vermischt sich im Zeilenlauf mit der Entstehung des Kopulationsapparates und endet als erkennbares Volumen „3_8_3003“ mit dem Spermienbezug „1__1_0“. In den Zeilen-Nr. Z.3240 und Z.3247 ist die Zeit=24 zwecks Abgabe der Samenflüssigkeit als Volumen „3003“ und „800_22122“ enthalten: Epi.Y!Ameise.Z.3240#138300365167810 und Epi.Y!Ameise.Z.3247#138002212240130. Der unpaarige Einspritzkanal (Ductus ejaculatorius) „505“ muss sich zunächst aus der Zusammenführung „05250_55_1 der beiden Samenleiter vereinigen: Epi.Y!Ameise.Z.3282#136530525028551.
Kopulationsapparat: Fachbegriffe siehe 1.) DeWiki > Aedeagus, 2.) https://www.researchgate.net/figure/Terminology-for-male-genitalia-and-forewing-of-ants-A-D-E-F-H-genital-capsule-B_fig2_261517156, 3.) http://antbase.org
Der männliche Geschlechtsausführungsgang endet mit einem Kopulationsapparat, der den Aedeagus als spermaübertragendes Organ (Penis) enthält. Im Larvenstadium entstehen durch Teilung eines Zellhaufens 2 Phallomeren. Nach deren erneuter Teilung entstehen sekundär 4 Phallushügel (secondary phallic lobes) und somit 4 Phallomere für Begattungsfunktionen. Liegen die 4 Phallomere nebeneinander, werden die beiden inneren als „Endomere“ bezeichnet. Die Endomere verwachsen und bilden am distalen Ende den Aedeagus, der den Samengang (Ductus ejaculatorius) enthält. Der äußere seitliche Bereich wird als „Tegmen“ bezeichnet. Das Tegmen besteht aus einem basalen Teil (Basalring / Phallobasis) und den 2 seitlichen Parameren.
Basalring: Der vordere (rostale / anterior) Rand des Basalrings ist nicht der Anfang des Kopulationsapparats, sondern vor der Genitalkapsel liegt noch eine horizontale Doppelbogenstruktur „Anterior Loop Structure“. Es liegen dazu keine Informationen vor. Erkennbar sind zwei Halbkreise, die in der Skizze mittels Doppelstrich einen Doppelbogen „64_64“ bilden, deren beide Scheitel nach vorn (rostal / anterior) gerichtet sind. Vermutlich ist daran einer der insgesamt 15 Muskeln befestigt: Epi.Y!Ameise.Z.3232#138642692804364. Die Männlichkeit „33“ ist nunmehr in der Zeilennummer enthalten. Das paarige „2“ Volumen „seitlich=99_2000“ liegt hinter den beiden Bixnom-Halbkreisen, so dass damit eine erkennbare Bogenform (Doppelstrich in Skizze) freigeschnitten wird: Epi.Y!Ameise.Z.3233#138599809200032. Der Doppelbogen besteht nicht aus 90°- Halbkreisen, sondern der Öffnungswinkel ist etwas weiter „97“ aufgezogen, so dass die „Anterior Loop Structure“ erst paarig=2 auf „64_5“ endet: Epi.Y!Ameise.Z.3237#138428539741645. Zur Bildung des Basalrings muss vom horizontal liegenden Doppelbogen um 90° in den normalen Scann der Querschnitte gewechselt werden. Der Basalring wird als räumlicher Ring „404“ als Gruppe 44 avisert. Mit der Gruppenbildung wird die Länge des Basalrings gebildet, um den Zeilenbereich Z.33xx der Männlichkeit „33“ zu erreichen. Die 90° sind im Zeitunterschied zwischen „Anterior Loop Structure“ und „Basalring“ Z.3232–Z.3238 =#2569043103231 enthalten. Anfang Basalring: Epi.Y!Ameise.Z.3238#138385788494041. Oberkante Basalring: Der vordere Rand ist von oben nach unten schräg geneigt, so dass sich mehrere Zeilen entwickelt. Die Kreisform „64“ ist enthalten. Die Ziffer „2“ wird durch Zeit=24 gebunden, so dass der Basalring unpaarig bleibt. Oben=9 ist in der Zeilennummer und als QS 2+4+3= 9 am rechten Zahlenrand enthalten: Epi.Y!Ameise.Z.3239#138343063644243. Unterkante Basalring: In der Ringgruppe „0_44“ ist die Gegenform „46“ in der Zeilennr. Z.3246 für den geschlossenen Ring des Vorderrandes enthalten: Epi.Y!Ameise.Z.3246#138044726784875. Der hintere Rand des Basalringes ist etwa parallel zum Vorderrand ausgebildet. Oberkante Basalring des Hinterrandes als Gruppe 44 Kreisform „46“: Epi.Y!Ameise.Z.3261#137409746440878. Unterkante Basalring des Hinterrandes als Gruppe 44 Kreisform QS 1+3=“4_6“: Epi.Y!Ameise.Z.3284#136447376109532. Die Konstruktion setzt sich mit den paarigen Parameren fort.
Exoskelett: Die Genitalkapsel wird seitlich vom Exoskelett umgeben. Der Zeilenlauf vermischt sich daher mit der letzten Rückenplatte (Abdominal Tergum IX) und der letzten Bauchplatte (Abdominal Sternum IX). Der Scann des Zeilenlaufs dreht sich hierfür um das Körperende zur Unterseite. Der Aedeagus zieht den Zeilenlauf bis zur Zeilennummer Z.33xx. Dieses verlängerte Körperende setzt voraus, dass der After „808“ des Männchens mit „33_808“ entsprechend verlängert ist. After: Epi.Y!Ameise.Z.3328#134643384358084.
Hypopygium, Teil 1: Die Bauchplatte (Abdominal Sternum IX) beginnt mit einem zentralen Stiel (Spiculum) „666“: Epi.Y!Ameise.Z.3260#137451896669848. Der Stiel verbreitert sich Trichterform „464“, in dem sich die Ziffer „6“ des Stiel mit der Ziffer „4“ zur Krümuung „64“ verbindet. Die Stiellänge ist daher bei den Ameisenarten variabel. Die mittlere Ziffer „6“ kann dann eine anschließend nach außen eine Gegenkrümmung von konkav zu konvex verursachen: Epi.Y!Ameise.Z.3261#137409746440878. Am harten Material (Sklerite) „22“ setzt zunächst ein Muskeln „55“ paarig seitlich=9 an: Epi.Y!Ameise.Z.3262#13736762205509. Ein weiterer Muskel ist zentral „2552“ angeschlossen: Epi.Y!Ameise.Z.3263#137325523488723.
Pygidium: Die letzte verhärtete (sklerotisiert) Rückenplatte (Abdominal Tergum IX) wird bei den Insekten als Pygidium bezeichnet. Am Ende der Rückenplatte bildet die Ameisenart Dinoponera einen Anhang als Zipfelkonstruktion „Pygidial spine“ aus [siehe: Schematic drawing of generalized Dinoponera male genitalia in situ ;... | Download Scientific Diagram (researchgate.net)]. Der Zipfel bildet sich, indem sich ein Trichter aus Bixnom-Kurve „64“ in der Zeilennummer und am rechten Zahlenrand „46“ als Gegenkrümmung entsteht: Epi.Y!Ameise.Z.3264#137283450718046. Die Krümmung „46“ wandert zur Mitte des Zahlenbildes, was zur Trichterform führt: Epi.Y!Ameise.Z.3266#137199382468985. Beidseitig des unpaarigen Zipfels ist der „Cercus“ als ein paariges Anhängsel angeordnet. Die Cerci dienen bei den Insekten unterschiedlichen Zwecken, beispielsweise beim Ohrenkneifer (Dermaptera) als Kneifzange. Der Cercus besitzt keine erkennbare Funktion und bildet sich mehrgliedrig als Zählgröße QS 1+3+7= 11 mit “11_11“: 137115417118636. Das Pygidium läuft in Zipfel-Form punktfömig „707“ als Ende zusammen. Mit 7_QS 2+9=11_7 sind die Cerci „11“ neben dem Zipfel adressiert. Der Zipfel ist mit seiner Gegenkrümmung und dem Kreis „46_0“ adressiert: Epi.Y!Ameise.Z.3269#137073472971460. Der folgende Zeilenbereich kann sich nunmehr wieder auf die Genitalkapsel beziehen.
Hypopygium, Teil 2: Die Hinterkante der Bauchplatte (Sternum) verjüngt sich blattartig als Rundung „64_4“ über mehrere Zeilen: Epi.Y!Ameise.Z.3359#133400769021644. Die enthaltene Zahlgröße „11“ verursacht mit der folgenden Serie 333, 333, 33, 33=Haut einen durch 2 Kerben „333“ ausgefransten Plattenrand: Epi.Y!Ameise.Z.3260#133361066411816. Am Plattenende ist die Rundung „64“ als unpaarig in der Zeilen-Nr. Z.33“64“ enthalten. Das harte Material (Skerite) ist als Endpunkt „202“ am Ende=9 vorhanden: Epi.Y!Ameise.Z.3364#133202492016559.
Der Kopulationsapparat bildet am Körperende 3 Strukturen: 1.) Parameren (Seitenteile), 2.) Vosella (Zange) und 3.) Aedeagus:
1.) Parameren (Seitenteile): Die außen liegenden beiden Parameren setzen am Basalring an und formen sich zu länglichen Hüllen (Gonopoden). Die beiden Gonopoden sind in der Regel zweigliedrig, bestehend aus dem proximalen Basisglied ( Basimere / Basiparamere / Gonocoxa / Stipes ) und dem distalen Endglied ( Telemere / Gonostylus / Lacinia ). Die beiden lappenartig gestreckten Glieder sind mit seitlich=9 am Durchlauf der „999“ vom linken zum rechten Zahlenrand erkennbar, so dass sich der Aedeagus dazwischen entwickeln muss. Weil die Ziffer „2“=paarig fehlt, muss ersatzweise eine Spiegelung für die Symmetrie vorhanden sein. Basisglied (Basimere) 33_999_76_67: Epi.Y!Ameise.Z.3344#133999157638667. Die Basimere liegt paarig schalenartig an, so dass sich die Schalen am Basalring mittig gelenkartig „909“ nähern. Parameren-Näherung „909“ auf der Oberseite Epi.Y!Ameise.Z.3345#133959098099762. Parameren-Näherung „99099“ an der Unterseite: Epi.Y!Ameise.Z.3349#133799099176979. Endglied (Telemere) 33_39_9993. Enthalten ist eine Spiegelung 39_39 für die Symmetrie. Die Telemere ist ein schlanke Verlängerung der Basimere, die schräg nach unten („63°“) gerichtet ist: Epi.Y!Ameise.Z.3353#133639481999315. Die Telemere kann gegenüber der Basimere weitaus länger ausgebildet sein, was sich in der Skizze als Quersteg „599“ und eine schaufelartige Fläche „770099“ zeigt [siehe: Genital capsule and sternum IX habitus and musculature. 1 Formica... | Download Scientific Diagram (researchgate.net)]: Epi.Y!Ameise.Z.3354#133599637192517 und Epi.Y!Ameise.Z.3374#132807700991021. Die Parameren sind mit der Ziffer seitlich=9 enthalten. Die Sklerite als hartes Material, paarig „22_979_22 als Umklammerung sind am Ende nochmals verfügbar: Epi.Y!Ameise.Z.3387#132297957822174.
In dem durch mehrere Strukturen vermischten Zeilenlauf muss noch der Aedeagus und die Vosella gefunden werden. Die Vosella liegt zwischen den Parameren und dem Aedeagus. Vergleichsweise besitzen männliche Bienen (Drohnen) keine Vosella.
2.) Vosella (kleine Zange): Fachbegriffe: (PDF) The male genitalia of ants: musculature, homology, and functional morphology (Hymenoptera, Aculeata, Formicidae) (researchgate.net) / Brendon E. Boudinot / JHR 30: 29–49 (2013) / Hymenoptera Anatomy Ontology Portal.
Die Volsella ist eine Gruppe von Skleriten auf der Unterseite (ventral) des männlichen Genitals. Als Hauptbestandteil der Zange setzt an der Vosellar-Membran „13_133“ der paarige Parossiculus (Copulatory sclerite) an. Ein Muskel „55“ ist vorhanden. Die Sklerite sind avisiert, wenn Zeilen-Nr. QS 3+3+1+0=7 und QS 0+3+1+3+3+0=10 zu 17 addiert werden, so dass die in „353“ markierte Strukturzahl „5“ zu „22“ noch fehlt: Epi.Y!Ameise.Z.3310#135375584031330. Der Parossiculus benötigt hartes Material (Sklerite) „22“. Mit seitlich=9 und Extra=8 ist mit der Dopplung „8989“ eine Zange vorstellbar. Weil sich die beiden Parossiculi in der Mitte berühren, ist die Dopplung zutreffend symbolisiert: Epi.Y!Ameise.Z.3317#135089895430722. Am Zangenende wird erneut ein Sklerit „22“ adressiert, weil am Parossiculus ein schlanker Fortsatz „Cuspis vosellaris“ ansetzt. Es sind Haare vorhanden, die mit der Ziffer „1“ am rechten Zahlenrand und in der Zeilennummer als Hautverbinding Z.333“1“ erzeugt werden: Epi.Y!Ameise.Z.3331#134522120427410. Als weiteres Element ist ein schlanker Fortsatz „Digitus vosellaris“ vorhanden. Dieser entsteht, weil das Zangenende einen ausgerundeten Einschnitt „64“ ausbildet. Die Größe der Ausformung ist bei den Ameisenarten unterschiedlich. Aufgrund der Gruppenbildung gehört der „Digitus vosellaris“ zur Vosella: Epi.Y!Ameise.Z.3332#134481747642168. Von den beiden Fortsätzen liegt der „Digitus vosellaris“ innenseitig neben dem Aedeagus. Die Zangenfunktion ist in der Zeilennummer Z.3333 und als 13_444_13 mit seitlich=9 erkennbar. Die Umklammerung „13_13“ ist für das Männchen ein schlechtes Omen. Mit Z. QS 3+3=6_QS 3+3=6 als „66“ soll die Jungkönigin umklammert werden. Epi.Y!Ameise.Z.3333#134441399083019.
3.) Aedeagus: Anatomie des Kopulationsapparates siehe: 1.) „The anatomy and histology of the male reproductive system of Camponotus pennsylvanicus DeGeer (Formicidae, Hymenoptera) | James Forbes | download (booksc.eu)“; James Forbes /Journal of Morphology 1954 Vol. 95; Iss. 3. 2.) „Untersuchungen über den männlichen Copulationsapparat der Ameisen, speziell der Formicinae - Research Collection (ethz.ch) / eth-21199-02.pdf (ethz.ch)“; René Clausen, 1938.
Die Endomeren verwachsen. Aus dem distalen Ende bildet sich der Aedeagus. Im Aedeagus endet der unpaarige Samengang ( Ductus ejaculatorius ) „505“. Bei den Insekten ist dieses der innere Teil, denn die männlichen Bienen (Drohne) stülpen den äußeren Teil (Endophallus) bei der Begattung selbstmörderisch aus dem Körper aus. Bei einem Ameisenmännchen tritt der Endophallus erst mit dem Tod aus dem Körper hervor.
Als Gonopore (ejaculatory opening / primary gonopore ) wird der Übergang vom Ductus ejaculatorius zum Endophallus bzw. der Übergang vom inneren zum äußeren männlichen Genital bezeichnet. Der Ductus ejaculatorius endet in einem V- förmigen Sperrkeil (Wedge).
Der Samengang ist durch einen dreieck- oder keilförmigen Sperrkeil verschlossenen. Räumlich betachtet, ist es eine Trichterform, die als Muskelring „5055“ mit der Wand des Ductus ejaculatorius verwachsen ist. Der Trichterform aus Bixnom-Krümmung und Gegenkrümmung 64_46 wird avisiert als Zeilen-Nr. Z. QS 3+3=6_4_6 und zieht über 2 Zeilen in die Tiefe: Epi.Y!Ameise.Z.3346#133919062505590. Mit Z.QS 3+3=6_4_7=Form _#_46“ ist die Trichterform vorhanden. In dem Trichter muss der Sperrkeil als Röhre „0_5_0“ umgangen werden können, damit die Spermien die Sperrstelle zunächst umgehen können. Erst beim Geschlechtsakt wird der Sperrkeil fest angepresst, um die Rückströmung zu verhindern: Epi.Y!Ameise.Z.3347#133879050834689. Am Ende des Ductus ejaculatorius wird die Penisblase von einem muskulären Ringwall „79_505_79_64“ umschlossen: Epi.Y!Ameise.Z.3352#133679350579864.
Die Fortführung im Endophallus erfolgt ein einer Spermienrinne (Sperm gutter). Eine genaue Geometrie des Endophallus ist nicht hier nicht bekannt. Anzunehmen ist, dass sich oberseitig (dorsal) eine Mittelfalte als Rinne einsenkt. Es entstehen zwei Hälften, durch die Sagitta (sagittal= von vorn nach hinten) / Penisvala / Lamina aedeagalis ) oberseitig geteilt wird. Bei der Begattung pressen sich beide Seiten in der Vagina zusammen, so dass die Spermien an der Spitze des Aedeagus austreten. Die Spermienrinne könnte als „25005525“ dargestellt werden, weil eine Ähnlichkeit zum Ductus ejaculatorius „505“ besteht. In diesem Endbereich müsste der Muskel „55“ dann von der muskulösen Vagina gebildet werden. Das harte Material (Sklerit) „22“ ist aufgrund der Mittelfalte in 25_25 geteilt. Epi.Y!Ameise.Z.3385#132376125005525. Das Ende des Aedeagus formt sich durch einen weiten oberen Bogen „64“ und durch einen unteren Bogen „64“, der durch eine enge Gegenkrümmung „46“ den oberen Bogen am Ende schließt. Die Krümmungziffer „1_4_1“ und „8_6_4“ sind markiert: Epi.Y!Ameise.Z.3385#132141900071868. Die Ziffer „6“ in „46“ ist durch die Rinne in 3_1_3 incl. dem Spermium „1“ als 43_1_43 geteilt: Epi.Y!Ameise.Z.3392#132102943143780. Körperende als Endausrundung „0_64_00“. Mit 7_88 wirken Lockstoffe als Drüsensekret ein, denn die Jungkönigin „666“ ist auf dem Hochzeitsflug. Die Luft mit der Leichtigkeit der Tracheen und der Flügel „202“: Epi.Y!Ameise.Z.3393#132064009178810 und Epi.Y!Ameise.Z.3394#132025098156660. Die Giftdrüse ist weiblich, so dass die Männchen der Knotenameisen (Myrmicidae) und der Stechameisen (Poneridae) auch keinen Stachel einsetzen können. Zur Begattung verklammert sich das Männchen in einer Rückenlage und drückt den Stachel der Jungkönigin dabei senkrecht nach oben (siehe R. Clausen / 1938). Ein Stachel „111“ ist vorhanden: Epi.Y!Ameise.Z.3379#132611181753094.
Der Zeilenbereich des Aedeagus kann weiterhin anhand des gezackten unteren Randes ermittelt werden. Seitenansicht des Aedeagus siehe: „A Revision of Male Ants of the Malagasy Amblyoponinae (Hymenoptera: Formicidae) with Resurrections of the Genera Stigmatomma and Xymmer (plos.org); Yoshimura / Fisher, March 29, 2012; https://doi.org/10.1371/journal.pone.0033325“.
Bei diesen Ameisenarten zieht sich unterhalb (ventral) des Aedeagus eine plattenartige Erweiterung (Lamina aedeagalis) ähnlich einem Schiffskiel entlang, dessen Rand gezackt ist. Aufgrund Haut=männlich=33 ist diese Erweiterung aufgrund der Zeilennummer Z.33xx durchgehend möglich. Die Erweiterung entsteht, indem zunächst senkrecht, S-förmig ein Gegenbogen „46“ gefolgt von einem Bixnom-Bogen „46_64“ in „Z.QS 3+3=6_0_4“ nach unten zieht: Epi.Y!Ameise.Z.3304#135621423469644. Der gezackte Rand formt sich dann mit der Zählgröße „11“ als Anfang und Ende am rechten Zahlenrand, und zwar von Epi.Y!Ameise.Z.3306#135539377841411 bis Epi.Y!Ameise.Z.3378#132650439059711. Es sind mehr Zacken als Zählgrößen vorhanden. Die Zählgröße „141_11“ ist zuerst mit räumlich=4 verbunden. Am kurvigen Rand können 8 Zacken angeordnet werden. Dann wird mit 8_117 die Form=7 adressiert, so dass dann am rechten Zeilenrand maximal und insgesamt „23“ Zacken zählbar sind: Epi.Y!Ameise.Z.3318#135049181176523. Der gezackte Bereich endet, wenn 7_11 zum rechten Zahlenrand durchgelaufen sind: Epi.Y!Ameise.Z.3378#132650439059711.
Hochzeitsflug: An etwa 3 sonnigen Tagen im Mai sammeln sich die Männchen der selben Ameisenart an Hochpunkten im Gelände oder auch Waldlichtungen und können mehrere Meter hohe Schwarmsäulen bilden. Die Jungköniginnen verlassen das Nest zeitlich vor den Männchen und fliegen zur Begattung in die Schwarmsäulen „64 / 46“ Z.33_oben=99 hinein: Epi.Y!Ameise.Z.3399#131830886479466. Die Kopulation dauert ohne erkennbare Zeitvorgabe bis zur Spermienübertragung „101“, allerdings mit dem ungünstigen Omen „1313“. Für das Männchen hat Freitag, der „13“ eine schwarze Katze den Weg von links kommend gekreuzt: Epi.Y!Ameise.Z.3411#131367101478658. Vergleichsweise ergibt sich für die Königin QS=1+3+1+3+2+8+5+9+9+9+8+3+5=66 ein langes Leben. Als „Rechenkunststück“ muss die Halbzeit=12 noch auf 24 verdoppelt werden, damit sich 500/24= 20,83 Lebensjahre mindestens im Labor ergeben (in der Natur kürzer): Epi.Y!Ameise.Z.34“12“#131328599983500. Die Penisvalvae des Aedeagus verankern das Männchen „3_11_3“ im Inneren der Begattungstasche (Bursa copulatrix) “64_11_4600“ des Weibchens „66“: Epi.Y!Ameise.Z.3417#131136430536641 und Epi.Y!Ameise.Z.3418#131098064114600. Die verhängten beiden Tiere fallen zu Boden. Die Königin reißt sich los, wobei Teile des Männchens als Begattungszeichen stecken bleiben. Die Männchen sterben nach dem Hochzeitsflug. Die Männchen fliegen nicht ins Nest zurück, sondern werden von den Arbeiter*innen hineingetragen und an die Larven verfüttert. Das böse Omen „1313“ findet sich auch doppelt als Quersumme der Zeilennummern Z.QS 3+4+5+1=13 und Z.QS 3+4+6+0=13. Das männliche Geschlechtshormon (welches ist hier unbekannt) wird am rechten Zahlenrand existenziell ausgeschieden „999_33_5“: Epi.Y!Ameise.Z.3451#129844445999335. Außer dem Hormon „33“ wird auch die Muskelaktivität „55“ auf Null gesetzt als „50_QS 6+7=13_00_33_0550“: Epi.Y!Ameise.Z.3460#129506700330550. Die Königin baut sich in der Regel selbst ein neues Nest, wirft die Flügel ab und zieht die ersten Arbeiter*innen selbst auf.
Entwicklungsstadien: Die Metamorphose von der Puppe zur erwachsenen Ameise (Imago) [Arbeiter*innen / Königin / Männchen] ist mit dem Menschen vergleichbar, bei dem der junge Mann erkrankte und sich der Prozess der Gesundung durch den gesamten Körper bis durch das Gehirn zieht. Für dieses Zeitregime müsste bei der Ameise nach einem Einstieg in eine Kettenreaktion gesucht werden. Im weiteren Zeilenlauf sind hier noch die 3 Entwicklungsstadien der Brut (Ei, Larve, Puppe) enthalten. Die Larve besteht aus 14 Segmenten, so dass es sich um einen Zählvorgang „11“ in der Serie „#11“ handelt, bei dem die 14 Segmente mit unterschiedlichen Zählkriterien für Larve, Kokon und Puppe adressiert werden. Die Anzahl von 14 Segmenten ist mathematisch nur mühsam zu entdecken, so dass die Anzahl der Segmente bei den Ameisenarten als Vielfalt abweicht. Die Entwicklung der Ameisen von der Eiablage bis zum Schlüpfen der Arbeiterin dauert mindestens etwa 30 Tage. Beispiel für die Armeisenart „Lasius niger“: Entwicklungsdauer der Eier ca. 14 [ 9 bis 16; i.M.=12 )Tage. Entwicklungsdauer der Larven ca. 10 (9-13; i.M.=11) Tage. Entwicklungsdauer der Puppe ca. 10 (9-12; i.M.=10,5) Tage. Insgesamt von der Eiablage bis zum Schlüpfen 34 (27 - 41) Tage. Mathematisierbare Entwicklungsdauer mit 9=Ende aus „999“ aus der Quersumme QS 9+9+9=27 Tage.
Fachbegriffe: siehe: 1.) Ameisenlarve – Ameisenwiki ; 2.) Brut – Ameisenwiki ; 3.) Brutentwicklungsdauer – Ameisenwiki
Über das Ei ist im Detail hier zurzeit noch keine Fachliteratur bekannt. Die Einhülle ist weich und bildet keine harte Eierschale. Die Königin legt über die Eier einen Schaum, um ein Eierpaket zu bilden. Es ist hier unbekannt, ob die Klebrigkeit von der Einhülle gebildet oder von der Königin aufgetragen wird. Die Eier werden in Eipaketen in einer Nestkammer deponiert und durch Belecken feucht gehalten. Bei der Ameisenart „Myrmecia“ werden die Eier lose gelagert, weil die klebrige Schicht fehlt. Aus dem Ei schlüpft die Larve. Aus unbefruchteten Eiern schlüpfen Männchen.
Im Anschluss an die Ameisen-Anatomie bilden sich die Larven und Puppen im Zeilenauf als Zählgrößen in der Serie #11. Anschließend steht für das Ameisen-Ei ein Bereich als Serie #101 zur Verfügung. Vorab wird die Eier-Gruppe „44“ mit der Zeilennummer „Z.4_11_4“ mit der Zählgröße „11“ kombiniert und im Zeilencode ist das Ei „101“ avisiert. Die Zählgröße steht nunmehr in 6 Zeilen in der Zeilennummer zur Verfügung. Bevor die Königin täglich 1000 Eier legt, muss sie zunächst nur 11 Eier legen. Diese muss die Königin selbst zu Arbeiter*innen heranziehen, damit ein Ameisenstaat entstehen kann. Die Struktur-5 ist mit dem Ei noch nicht geschaffen, aber die Ziffer „1“ ist 5x enthalten: Epi.Y!Ameise.Z.4114#108919101396136. In 4 Zeilen ist der Wirkstoff „88“ enthalten, der auch als Färbemittel geeignet ist. Die Eier sind hell und durchscheinend mit Ausnahmen: Schwarze Eier bei der Art „Ectatomma ruidum“ und senfgelbe Eier bei der Art „Camponotus ligniperdus“. Die Zeile enthält Eisen=26 als mögliches Element. Die anderen Arten markieren die Physik=63 mit „2_63_2“ als durchscheinend: Epi.Y!Ameise.Z.4115#108892632598713. Die Königin „666“ legt nunmehr sofort nach dem Hochzeitsflug 11 (12) Eier zur Selbstaufzucht der Arbeiter*innen „66“. Mit Form=Nerv=7 ist eine runde Eierform „707“ mit enthalten. Es können auch 12 Eier sein mit Z.QS 4+1+1+6=12: Epi.Y!Ameise.Z.4116#108866176662707.
1.) Larve: Kriterium „11_11_5*“ – Bildung von 14 Segmenten als Struktur-5 in 14 Zeilen, sofern die Ziffer 5* nicht als Markierung „575“ oder „595“ funktionell gebunden ist. Die madenförmigen Larven besitzen im Unterschied zu Käferlarven keine Beine zur Fortbewegung. Augen fehlen. Mit dem beweglichen Kopfteil wird Aufmerksamkeit erregt. Die aufgenommene Nahrung kann aufgrund einer fehlenden Darmverbindung noch nicht ausgeschieden werden, so dass sich ein Kotsack füllt. Im Mittelteil schimmern die Verdauungsreste als dunkle Verfärbung durch die Haut. Die Wachstumsphase der Ameise vollzieht sich nur im Larvenstadium, so dass die Larven an Größe zunehmen. Die weiche Haut dehnt sich nicht ausreichend, so dass die alte Körperhülle 3 bis 6 mal abgeworfen wird. Die Larven werden zum Fraßschutz der Eiern gesondert in einem feuchteren Nestbereich gelagert. Das letzte Larvenstadium wird als Vorpuppe Vorpuppe (Präpuppe) bezeichnet. Merkmale sind 1.) der entleerte Kotsack aufgrund der Darmverbindung und 2.) Ausbildung von Körperanhängen (Fühler, Mandibel, Flügel, Beine) unter der Larvenhaut und 3.) ist der Konkon einiger Ameisenarten [ Formicinae, Myrmeciinae, Ponerinae ] im letzten Larvenstadium bereits gesponnen. Die Abbildung von künstlich aufgeschnitteten Konkons zeigt das Stadium der Vorpuppe und vergleichsweise die plötzliche Veränderung als Puppe mit den sichtbaren Körperanhängen nach der Verpuppung im Konkon, siehe „Giant bulldog ant, Myrmecia brevinoda, two pupal shells cut open to show an advanced larva and a pupa about to emerge or eclose, Eastern Australia; Pin on Insect Images and Illustrations (pinterest.de)“. Die Bildung der Puppenhaut kann bei den meisten Ameisenarten nicht beobachtet werden, weil sich die Larve zuerst über der Larvenhaut ein undurchsichtiges Konkon spinnt, bevor innenseitig die Verpuppung abläuft.
Mit zunehmendem Zeilenlauf bilden sich größere Zeilenbereiche. Der madenförmige Körperbau entsteht aufgrund der sichtbaren Larven-Segmente im Zählgrößenbereich „#11“ mittels einer Segment-Zählgruppe „44_11“. Die Larve bettelt durch Bewegungen um Aufmerksamkeit „Leck mich“. Die Larven zeigen teilweise dunkle Narbenpunkte, weil die Arbeiter*innen etwas Hämolymphe=26 [in Zeilen-Nr. und Zeile] absaugen „Beiß mich“. Die Segmente sind als Einschnürung „20_02“ der Cuticula sichtbar. Nachfolgend werden mit „11“ die dazwischen liegenden behaarten Ringfelder gezählt: Epi.Y!Ameise.Z.3726#120261187102443.
Der Borstenschaft „11“ wird vorab avisiert als „4114“. Damit sind einerseits die Segment-Gruppe 44 und anderseits die 14 Larven-Segmente avisiert. Mit dem Kriterium „11_11_5“ wird die ankerartige Verzweigung der Borsten-Spitzen symbolisiert. Die Borsten bewirken einen Larven-Abstand, der einen Kannibalismus verhindert und das Nestklima begünstigt. Kleine Larven können mittels der Borsten als Paket gekoppelt werden. Die Borsten können den Arbeiter*innen ggf. das Larvenstadium signalisieren. Die Zeit ist als „24“ und als Halbzeit „12“ enthalten. Die Larven entwickelt sich optimal im Bereich von 24 - 30° C. Bei einer Temperaturveränderung werden die Larven jedoch umgelagert: Epi.Y!Ameise.Z.3732#120067841142471. Die 14 Segmente werden mit beginnt der Serie #11 gezählt, wobei die Zahl „14“ bereits in der 1. Zeile adressiert wird. Bis zum Ende der Serie von Z.3735 bis Z.4073 fallen mehr als 14 Ereignisse „11_11“ an, so dass als Einschränkung eine Struktur-5 als „11_11_5“ gefordert wird. Es fallen dadurch Zeilen mit den Werten „111“ und „55“ heraus. Weitere 2 Zeilen sind unwirksam, weil die benötigte Zahl „5“ zur Markierung (Klammer) „595“ bzw. „575“ funktionell gebunden ist.
Es gibt Ameisenarten, die diese Ausschlüssen nutzen können, in dem gesondert 5 Reihen sehr langer und stabiler Anker-Haare „11_11_55“ angeodnet werden, mit denen die Larven von den Arbeiter*innen an der Nestdecke aufgehängt werden. Der Larvenkopf bleibt durch den Abstand zur 1. Aufhängung noch beweglich. Ankerreihe Nr. 1: Epi.Y!Ameise.Z.3826#117117925547230. Ankerreihe Nr. 2: Epi.Y!Ameise.Z.3909#114631154551983. Ankerreihe Nr. 3: Epi.Y!Ameise.Z.3954#113326551123850. Ankerreihe Nr. 4: Epi.Y!Ameise.Z.3977#112671154926755. Ankerreihe Nr. 5: Epi.Y!Ameise.Z.4054#110531125590455.
14 Larven-Segmente: 1.) Epi.Y!Ameise.Z.3735#119971401109425. 2.) Epi.Y!Ameise.Z.3738#119875115875790. 3.) Epi.Y!Ameise.Z.3762#11911036234548.
4.) Epi.Y!Ameise.Z.3781#118511817811083. 5.) Epi.Y!Ameise.Z.3802#117857228601711.
6.) Epi.Y!Ameise.Z.3853#116297218568311. 7.) Epi.Y!Ameise.Z.3859#116116398845220.
8.) Epi.Y!Ameise.Z.3876#115607116394144. 9.) Epi.Y!Ameise.Z.3910#114601837121152.
10.) Epi.Y!Ameise.Z.3922#114251194070297. 11.) Epi.Y!Ameise.Z.3929#114047641421151. 12.) Epi.Y!Ameise.Z.3965#113012152116949.
13.) Epi.Y!Ameise.Z.3995#112163500161127. 14.) Epi.Y!Ameise.Z.4061#110340601611353.
Die Larve ist am Kopfende bei Ameisenarten ggf. etwas schlanker. Der Kopfbereich ist beweglich, weil die Larve Aufmerksamkeit erregen muss, um von den Arbeiter*innen gefüttert und durch Belecken gepflegt zu werden. Der Bereich kann sich in der Hakenform einer Stricknadel krümmen. Die Verdickung zum Körperende ergibt sich aus dem gesteigerten Zeilenlauf „#11/#111/#1111/#111/#11“. Enthalten sind 2 Bixnom-Krümmungen „64“ zur Gestaltung der Birnenform: Epi.Y!Ameise.Z.4017#111549211636471 und Epi.Y!Ameise.Z.4018#111521449264237. Schließlich ist dann auch in der Zeilennummer Z.40“64“ der Bogen „64“ enthalten, um das Körperende abzurunden: Epi.Y!Ameise.Z.4064#110015512679525. Aufgrund des Wachstums häutet sich die Larve artenabhängig 3 - 6 mal. In der letzten Larven-Phase bildet sich die „Vorpuppe (Präpuppe)“, die den Larvenkot nach außen bzw. in den Konkon abgibt, weil die Verbindung vom Magen zum Darm durchgängig wird. Der dunkle Kotfleck wird als Meconium bezeichnet. Sobald die 14 Segmente in der Serie #11 durchlaufen sind, beginnt die neue Serie #10 mit dem Kotfleck (Meconium) als Verdauungsfunktion „808“: Epi.Y!Ameise.Z.4480#100020799808862.
2.) Kokon (Puppenhülle): Kriterium „11_22_0_0“ – Bildung von festem Kokonmaterial „22“ mit dem Kokonsymbol „0_0“ in 14 Zeilen des Segmentbereiches „11_11_5“. Der Kokon besteht aus Seide, die mit dem Mundwerkzeug gesponnen wird und dann erhärtet. Die Seide wird in den Speicheldrüsen (Labialdrüse) produziert. Der beigefarbene, seidenmatte Kokon ist nicht existenziell notwendig, schützt aber vor der Ameisensäure, die im Nest zur Desinfektion versprüht wird. Aufgrund der natürlichen Zahlen-Reihenfolge 11, 22, 33 bildet sich der Kokon 22 vor der Puppenhaut 33. In der künstlichen Umgebung eines glatten Reagenzglases gelingt kein Kokon. Der Spinnfaden muss an der Nestwand befestigt werden, damit sich die Larve am Faden winden kann. Je nach Ameisenart gibt es Nacktpuppen und Kokonpuppen [Formicinae, Myrmeciinae und Ponerinae]. Der Kokon ist eine Schutzhülle, die unabhängig von der Verpuppung gesponnen wird. Das Spinndrüsensekret für die Seide tritt nicht am Hinterleib, sondern aus der Unterlippe aus. Das Sekret wird von der Speicheldrüse produziert. Die Oberfläche des Kokons ist seitenmatt und beige gefärbt. Während der Metamorphose wird zwischen Magen und Darm eine Verbindung hergestellt, so dass der Larvenkot austritt und im Kokon sichtbar als schwarzer Punkt (Meconium) erhärten. Die Arbeiter*innen wirken als Schlupfhelfer, in dem der Kokon nach der Metamorphose mit den Mundwerkzeugen aufgebissen wird.
Direkt nach der Larven-Segmentgruppe wird die Kokon-Gruppe 22_44 gebildet. Die Größe des Kokons wird passend gebildet, in dem das Kriterium in 14 Zeilen erfüllt wird. Die Kokongruppe bildet dabei bereits die 1. Zeile. Die fehlende 2. Null wird durch die Kokon-Kugel mit dem Bixnom-Kreis QS 1+2+0+2+2+8+9+1+9+5+4+4+8+6+3=64 kompensiert. Diese Ausnahme ist möglich, weil die Mundwerkzeuge ein Spinnloch freihalten müssen. Der Bixnom-Kreis „64“ gibt die Wirbelbildung zur Kokon-Wicklung vor. Das Kokon endet mit 0_9=Ende_0 erneut mit dem Bixnom-Kreis „6422“ in Z.4108. Ausgeschlossen werden 4 Zeilen mit der Zahl „222“. Die Zeile darf nicht bereits zur Segmentzählung 11_11_5 besetzt sein (Fall nicht vorhanden). Der Kokon „11_22_0_0“ hat Vorrang vor der Puppe „11_33_3. Dopplung (Verstärker)“ (Fall nicht vorhanden).
14 Kokonzeilen: 1.) Epi.Y!Ameise.Z.3727#120228919544863. 2.) Epi.Y!Ameise.Z.3759#119205422491009. 3.) Epi.Y!Ameise.Z.3761#119142032210503. 4.) Epi.Y!Ameise.Z.3765#119015453690227. 5.) Epi.Y!Ameise.Z.3765#119015453690227. 6.) Epi.Y!Ameise.Z.3813#117517226106400. 7.) Epi.Y!Ameise.Z.3827#117087322483330. 8.) Epi.Y!Ameise.Z.3842#116630188220641. 9.) Epi.Y!Ameise.Z.3889#115220669360685. 10.) Epi.Y!Ameise.Z.3894#115072722943940. 11.) Epi.Y!Ameise.Z.3958#113212022017105. 12.) Epi.Y!Ameise.Z.3989#112332209361670. 13.) Epi.Y!Ameise.Z.4047#110722308659180. 14.) Epi.Y!Ameise.Z.4108#109078184796422.
3.) Puppe: Kriterium „11_33*=Haut_Verstärker = 3. Doppelziffer. Unwirksam ist die Zahl „22=hartes Material“ als Verstärker. Die Doppelziffer „00“ zählt nicht als Verstärkung (2 Fälle). Mit 33* wird die Zahl „333“ mit dem Ausnahmefall ausgeschlossen, dass aufgrund einer Markierungsbindung nur „33“ lesbar sind. Die Zeile Epi.Y!Ameise.Z.3806#117733363936864 bildet daher mit „11_33_77“ eine Pumpenhaut, weil mit „33363“ eine Markierung „363“ abtrennbar ist. Außerdem wäre die Kombination mit den Vorrang-Kriterien „11_22_0_0“ und „11_11_5*“ unwirksam, was jedoch nicht auftritt. Beispielsweise ist Epi.Y!Ameise.Z.3819#117332595743311 mit „11_11_33_33_595“ als Puppenhaut akzeptabel, weil wegen der Larven-Sonderbedingung 5* die Struktur-5 nicht als Markierung „595“ funktionell gebunden sein darf.
Im Stadium der Vorpuppe werden bei den Insekten bereits vor der Verpuppung die Körperanhänge (Mandibeln, Antennen, Flügel und Beine) unterhalb der Larvenhaut vorgebildet. Eine genaue Beschreibung der Verpuppung ist hier nicht bekannt. Die Ameisen bilden die häufigste Puppenform „Pupa exarata“, bei der die Körperanhänge unbeweglich und nicht mit dem Körper verklebt sind. Hierbei handelt es sich um die spezielle Form der freien Puppe (Pupa exarata libera). Die Körperanhänge sind mit dem Körper am Gelenk verbunden, liegen aber unbeweglich frei am Körper an. Die Puppenhaut wird an den Körperanhängen offenbar von einer Scheide als Umhüllung gebildet. Wird der Kokon künstlich entfernt, sind die Körperanhänge einzeln sichtbar. Über 14 Zeilen wird im Segmentbereich eine Puppenhaut „33“ gebildet, die unabhängig vom Kokon entsteht. Die Puppe nimmt keine Nahrung mehr auf und ruht regungslos. Es erfolgt eine Metamorphose zur Imago.
14 Puppenzeilen: 1.) 11_33_“88“: Epi.Y!Ameise.Z.3749#119523388408563. 2.) 11_33_“44“: Epi.Y!Ameise.Z.3774#118731633053446. 3.) 11_33_“77“_*363: Epi.Y!Ameise.Z.3806#117733363936864. 4.) 11_33_“99“: Epi.Y!Ameise.Z.3812#117548054339901. 5.) 11_33_“33“_11_*595: Epi.Y!Ameise.Z.3819#117332595743311. 6.) 11_33_“44“: Epi.Y!Ameise.Z.3825#117148544612733. 7.) 11_33_“33“_66: Epi.Y!Ameise.Z.3840#116690933110339. 8.) 11_33_“44“: Epi.Y!Ameise.Z.3848#116448332417802. 9.) 11_33_“99“: Epi.Y!Ameise.Z.3880#115487933799924. 10.) 11_33_“99“: Epi.Y!Ameise.Z.3886#115309619954633. 11.) 11_33_“33“: Epi.Y!Ameise.Z.3952#113383902617334. 12.) 11_33_“55“: Epi.Y!Ameise.Z.3853#113355219616419. 13.) 11_33_“55“_11: Epi.Y!Ameise.Z.3954#113326551123850. 14.) 10_33_“99=Ende“_151: Epi.Y!Ameise.Z.4075#109961517335878.
4.) Besonderheiten der Verpuppung: 4.1) Auge: Während der Puppenruhe ist das Wachstum bereits beendet. Beim körperlichen Umbau (Metamorphose) bilden sich die Körperanhänge inclusive der Mundwerkzeuge. Weiterhin sind die Augen aufgrund der durchsichtigen Puppenhaut (bei aufgeschnittenem Kokon) sichtbar. Die klassische Augenöffnung „505“ liegt im Zeilenlauf #11 nur 1x vor. Bei der Puppe liegt diese Zeile im akzeptablen vorderen Abschnitt. Facettenaugen „505“, paarig 36_63: Epi.Y!Ameise.Z.3796#118043515053663. Die 3 Punktaugen sind folglich im Dreieck als „01_101“ in der Folgezeile lesbar: Epi.Y!Ameise.Z.3797#118012426427101. 4.2) Meconium: Bei der Ameise wird die Zeitfunktion auch mittels der Lösung mathematischer Aufgaben vollzogen. Bei der Vorpuppe ist bereits eine Verbindung vom Magen zum Darm vorhanden, so dass der Kotsack als Meconium entleert wird. Am Ende des Konkons bildet sich ein schwarzer Kotfleck. Die unübersehbar auffälligste Zähl-Zeile „1111_11“ enthält mit Z.QS 4+0+3+1=8 eine Beziehung zur Verdauungsfunktion. Der Darmtrakt „808“ ist mit der Ziffer „9=Ende“ blockiert. Die Ziffer „9“ muss daher durch die Ziffer 0(Null) ersetzt werden. Die notwendige Rechenoperation ist mit der Ziffer 7=Nerv=Form in „7_9189_7“ markiert. Enthalten ist die Rechenaufgabe „9+1=10“ zur Bildung der Ziffer „0“ für den freien Darmweg „808“. Mit der Summe aus den Sperrziffer-9 + Rechen-9 =18 Tage liegt zeitlich die Vorpuppe vor. Die Zahl 18 ist auch direkt markiert in „9_18_9“ als Stopp-Ende: Epi.Y!Ameise.Z.4031#111161791898711. 4.3) Flügel: Das Männchen (Drohne) „33“ und die Jungkönigin (Vollweibchen) „666“ besitzen Flügel. Mit „1111“ können 4 Einzelflügel (Vorder- und Hinterflügelpaar) gezählt werden. Die paarige Anordnung ist als Spiegelung QS 1+1+1+1=4_QS 3+4=7 _47 enthalten mit den 4 Flügeln „4_22200“: Epi.Y!Ameise.Z.4032#111134222009847. Die Zahl „33“ ist doppelt erforderlich, um männlich=33 in der Zeile und als Puppenhaut=33 in der Zeilennummer Z.40“33“ zu adressieren. Die Jungkönnigin ist mit „666“ enthalten, so dass beim Flügel kein Geschlechtsunterschied vorliegt. Hierfür müsste nach einer Alternative gesucht werden. Die sterilen Arbeiter*innen „66“ bleiben flügellos: Epi.Y!Ameise.Z.4033#111106665793133.
4.4) Körperanhänge: Mundwerkszeuge (3x paarig) , Fühler (1x paarig) und Beine (3x paarig) sind vergleichsweise vom Geschlecht unabhängig zu suchen. Verwendbar sind die Zeilen 11_333, die für eine Verpuppung 11_33_plus Verstärker nicht vollwertig mitzählten.
4.4.1) Mundwerkzeuge „333“: Die 3 paarigen Mundwerkzeuge [Oberkiefer (Mandibeln), Unterkiefer (Maxillen), Unterlippe (Labium)] werden als 3 Strukturen 3_55_333 gemeinsam verpuppt. Die Zahlen „37“ in Zeile und Zeilennummer ergeben eine paarige Anordnung mit der von „33_37“ abtrennbaren Puppenhaut 33: Epi.Y!Ameise.Z.3739#119843055133379.
4.4.2) Antennen „333“: Für die paarige Anordnung müssen zunächst die Antennen stärker herausgehoben werden mit „11_QS 9+2=11_QS 3+7+1=11“. Die beiden Quersummen bilden den abgeknickte Fühler und die Zahl 11 zählt die Anzahl der Fühlerglieder. Nunmehr wird die Spiegelung erkennbar als „QS 4+2=6_9_333_96“: Epi.Y!Ameise.Z.3758#119237142933396.
4.4.3) 3 Beinpaare „3633“: Die möglichen 3 Zeilen der Art „333“ für die 3 Bein-Paare sind bereits für Puppe, Kokon und Flügel verbraucht. Hilfsweise werden die 6 einzelnen Beine pauschal als „3_6_33“ verpuppt. Enthalten ist das harte Bein-Material „22“ und eine Formspiegelung „17_3_71“ für 3 Beinpaare. Der Bixnom-Kreis „64“ zeigt die Beweglichkeit der Beine „2264“. Im fortgeschritten Alter nimmt die Härte des Kokons zu, so das die Puppe über die Reibung messbare Töne als Zirpen erzeugt, um mit den Arbeiter*innen zu kommunizieren. Als physikalischer Effekt ist hierfür die Zahl „63=Physik“ enthalten. Die Bein-Verpuppungszeile ist verfügbar, weil für einen Kokon „11_22_0_0“ die Nullen fehlen und für eine Puppenhaut „11_33_**“ die Doppelziffer „22“ wegen der Materialhärte keine gültige Verstärkung als weiche Puppenhaut bilden kann: Epi.Y!Ameise.Z.3818#117363327172264.
4.4.4) Sonstiges: Die geschlüpfte Ameise ist zunächst von einer durchsichtigen Puppenhaut umgeben. Obwohl die Ameise außerhalb des Kokons im Detail bereits vollständig sichtbar ist, muss die Puppenhaut – wie zu vermuten ist – noch entfernt werden. Im Zeilenlauf der Verpuppung #11 dürfte daher keine Information über die Färbung der Cuticula des fertigen Insektes enthalten sein. Weil die 4 braunen Punkte auf dem schwarzen Hinterleib der Ameisengattung „Dolichoderus quadripunctatus; [Dolichoderus quadripunctatus - AntWiki]“ auffällig sind, wird dieses Punkte-Viereck hier trotzdem erwähnt. Das Viereck „444“ mit Eckpunkten „0444“ würde dabei in 2 Zeilen mit je 2 Punkten entstehen. Die 1. Reihe ist paarig=2 mit 78_78. In der 2. Reihe wird paarig=2 nochmals als Punkt-Spiegelung 40_04 in Zeilen-Nr. und Zeile verstärkt. In beiden Zeilen ist die Ziffer „8“ jeweils doppelt vorhanden, so dass „88“ als bekannter Wirkstoff für das Sonnenbraun vorstellbar ist. Als mathematische Aufgabe muss die Quersumme mit über alles inclusive Zeilennummer gezählt werden als QS 3+9+7+3+1+1+2+7+8+4+5+9+1+7+8+0+4+4+4=87. Die Verpuppung wird als eine erforderliche Zählaktion „1“ addiert zu 87 + 1 = 88. Es besteht ein Bezug zur Sonne, weil zur Aktivität eine Wärme ab 18°C und ein von der Sonne beschienener Weg benötigt wird. Dieser „Punkte-Schönling“ unter den Ameisenarten ist mathematisch begabt und besitzt an der Antenne die 11 Glieder (Dolichoderus quadripunctatus / Institut für Schädlingskunde (schaedlingskunde.de): Epi.Y!Ameise.Z.3973#112784591780444 und Epi.Y!Ameise.Z.4044#110804446870352.
5.) Ameisen-Ei: Unter dem Begriff „Ameisen-Ei“ wird fälschlich eine Ameisenlarve verstanden, weil diese als Tierfutter verkauft wird. Damit sich eine der beiden weiblichen Ameisentypen (Königin oder Arbeiterin) entwickeln kann, muss das Ei durch eine männliche Samenzelle (Spermium) befruchtet werden. Das Spermium gelangt bei der Kopulation in die Begattungstasche (Bursa copulatrix) und wird anschließend in der Samentasche (Receptaculum seminis) der Königin gelagert. Die Befruchtung des Eies erfolgt bei Insekten in 2 Stufen: 1.) Eindringen des Spermiums in die Eizelle (Syngamie). An einem Ende der harten Eihülle (Chorion) ist 1 Loch (Mikropyle) vorhanden, damit das Spermien in die Eizelle gelangen kann. 2.) Vereinigung vom männlichen und weiblichen Vorkern (Karyogamie).
Das runde bis ovale, glatte, leicht klebrige Ei ist sehr klein und kann von den Arbeiter*innen mit den Mandibeln umschlossen werden. Die Eihülle (Chorion) ist mehrschichtig. Die Innenschicht (Endochorion) ist der Cuticula der Insekten ähnlich. Die Außenseite wird durch das zweischichtige Exochorion gebildet, das außenseitig eine harte Schicht bildet. Die Oberfläche des Chorion kann bei Insekten beispielsweise aus hexagonalen Waben bestehen - für Ameisen liegt momentan keine Information vor. Vergleichsweise wird die Eihülle (Chrorion) beim Hühnerei noch vom Eiklar und einer festen Eierschale umschlossen. Die Eier werden in Eipaketen in einer Nestkammer deponiert und durch Belecken feucht gehalten. Bei der Ameisenart „Myrmecia“ werden die Eier lose gelagert, weil die klebrige Schicht fehlt. Aus dem Ei schlüpft die Larve. Aus unbefruchteten Eiern schlüpfen Männchen.
Ein wesentlicher Unterschied von Mensch und Ameise besteht in der Bildung der Körperachse. Die Körperachse der Wirbeltiere wird durch die Wirbelsäule und 2 Episoden für die Gesamtstruktur gebildet. Durch dieses Ordnungssystem können sich die Körperzellen nach der Befruchtung sofort differenzieren und dann vervielfältigen. Die Ameise entsteht allein aus 1 Episode. Dem Exoskelett fehlt ein Ordnungssystem, so dass im Ei zunächst diverse Aktivitäten erforderlich sind, um eine dreiteilige Körperachse aus Kopf, Thorax und Abdomen zu bilden. Im Unterschied zum Mensch werden im Ei zunächst massenhaft Zellen vermehrt, bevor deren Differenzierung beginnt. Ohne die synchronisierte Parallel-Episode der höheren Lebewesen sind die Zimmermannsameisen (Formica carpentiera / Carpenter ants ) eine Endosymbiose mit einem Bakterium bei gegenseitiger Abhängigkeit eingegangen, um sich als Ameisengattung vorteilhaft weiter zu entwickeln. Bei dieser Endosymbiose lebt das Blochmannia-Bakterium als Symbiont (Endosymbiont) in den Ameisen-Darmzellen, d.h. im Körper des Wirts. Die Mikrobe steuert die Zellentwicklung der Ameise zum eigenen Nutzen, so dass das Bakterium zielgerichtet bei der Entwicklung des Embryos in den Darmzellen der Ameisenlarve platziert wird. Siehe: 1.) How Two Became One: Origins of a Mysterious Symbiosis Found | Quanta Magazine /September 9, 2020; / https://www.quantamagazine.org/symbiotic-bacteria-tell-ant-embryos-how-to-develop-20200909/ 2.) Funktionelle Analyse von Blochmannia Floridanus, dem primären Endosymbionten der Rossameise Caponotis Floridanus / Würzburg, Mai 2009/ Dissertation Sascha Stoll (uni-wuerzburg.de)
Das Ei „0“ der Ameise kann sich mit der Zeilennummer als Zählgröße „11“ entwickeln. Bevor die Königin täglich mehr als 1000 Eier legt, werden zunächst nur ca. 11 Eier gelegt und selbst gepflegt, um die ersten Arbeiterinnen schlüpfen zu lassen: Epi.Y!Ameise.Z.4110#109025105387762. Das Ei „101“ wird adressiert: Epi.Y!Ameise.Z.4114#108919101396136. Königin „666“ und Arbeiter*innen „66“ werden erwähnt: Epi.Y!Ameise.Z.4114#108866176662707. Die Eihülle (Chorion) ist als Haut „33“ adressiert. Die „3“ Schichten müssen dabei als Endochorion „733“ und das zweischichtige Exochorion als 5_78747 gelesen werden: Epi.Y!Ameise.Z.4117#108839733578747. Das Loch (Mikropyle) „0“ in der Eihülle für den Eintritt des Spermiums ist doppeldeutig als männlich= Haut=33 als „330333“ adresssiert: Epi.Y!Ameise.Z.4118#108813303337470. Die Mikropyle im Exochorion an einem Ende des Eies wird auch Mikropylarbecher bezeichnet. Bei dem Schmetterlingen bildet sich eine rosettenförmige Struktur „555“. Der Bixnom-Kreis 64 kann das Loch als „604“ umgeben, weil die Quersumme mit der Null unverändert ist. Die Mikropyle wird von einem räumlichen Netzwerk umgeben. Die hexagonale Ringstruktur um das Loch geht in eine rechteckige Struktur über. Eine Abbildung zum Ei des Bananenfalters (Caligo memnon) ist als Mikroskopie (REM) dargestellt: „Insekten als Überlebenskünstler: Weltherrscher aus dem Ei - DER SPIEGEL“; https://www.spiegel.de/wissenschaft/natur/insekten-als-ueberlebenskuenstler-weltherrscher-aus-dem-ei-a-714694.html ; Prüftechnik Uri, und der Hochschule für Angewandte Wissenschaft, FHNW /Schweiz: Epi.Y!Ameise.Z.4120#108760481345559. Für das Netzwerk der Eihülle wird eine Gruppe „44“ gebildet: Epi.Y!Ameise.Z.4121#108734089576244. Das Exochorion besitzt eine chininöse Festigkeit, so dass die nötige Ziffer „22“ in der Zeilennummer und im Zifferncode enthalten ist: Epi.Y!Ameise.Z.4122#108707710612252. Für die Ameisen sind keine hochauflösenden Abbildungen der Netzstruktur bekannt. Das grobe punktförmige Netz ist mit „44444“ rechteckförmig. Gleichzeitig können aber auch hexagonale Einschlüsse für ein universelles Netz erkannt werden. Für die Hexagonalität ist der Winkel 60°=Zeit=60 versteckt als Quersumme QS 1+0+8+6+8+1+3+4+4+4+4+4+2+6+5=60° enthalten. Für das unverselle Ameisen-Chorion-Netz muss das Rechteck ein spezielles Seitenverhältnis besitzen, um gleichzeitig hexagonal und rechteckig zu sein. Als mathematische Aufgabe wird die Bezughöhe im Rechteck von 100 ["10" fehlt 0] benötigt. Die Ziffer 8 in „86“ wird dazu nach rechts als 868 verschoben. Das rechteckförmige Netz besteht aus Flächen H=100 / B=86. Ein Hexagon kann nunmehr in ein Feld aus 4 Kantenelementen eingeschrieben werden. Die Dachschräge des Hexagons bildet einen Dachwinkel (Innenwinkel) Alpha von rd. 120° aus 2 * arctan ((2*B) / H) = 2 * [ arctan ((2*86)/100)] = 2*arctan(172/100) = 2*59,826° = 119,653°, rd. 120°: Epi.Y!Ameise.Z.4121#108681344444265. Mikroskopien der Entwicklungsstadien vom Ei bis zur Larve sind für die Pharaoameise (Monomorium pharaonis) bekannt: „(PDF) From egg to adult: a developmental table of the ant Monomorium pharaonis (researchgate.net); DOI:10.1101/2020.12.22.423970; 12 / 2020; Matteen Rafiqi u.a.“
Der Embryo entwickelt sich im Ei. Wenn im Zeilenlauf das Ei „101“ als Serie „#101...“ ab Zeile 4394 anläuft, kann der Embryo adressiert werden. Zwischenzeitlich finden Aktivitäten der Keimbahnzellen in der Eihülle (Chorion) statt. Die Keimbahn (Germline) reproduziert das genetische Material für die Nachkommen. Die Keimbahn wird in einem frühen Embryonalstadium abgesondert, noch bevor die somatischen Zellen sich verschiedenartig differenzieren. Bei vielen wirbellosen Tieren wird bereits vor der Befruchtung ein bestimmter Bereich des Cytoplasmas der Eizelle für die künftigen Keimbahnzellen reserviert [siehe: Keimbahn – Wikipedia]. Die Zone der Keimbahnzellen ist meist am hinteren Pol des Ameisen-Eies positioniert. Bei den Zimmermannsameisen (Camponotus) teilt sich das Ei dagegen in 4 Aktivitätssegmente. Die Keimbahnzone wurde evolutionär vom hinteren Ende verdrängt, um dort die Bakterie „Blochmannia“ zum gegenseitigen Vorteil als Endosymbionten anzulocken. Die Mikrobe wird über die Eier weitergegeben und im Larvenstadium in den Zellen des sich entwickelden Darmtrakts positioniert. Weil die 4 Zonen von der Eihülle (Corion) „44444“ ausgehen, sind die Zonen ähnlich auf die Ziffer räumlich=4 und Gruppe 44 abgestimmt. Am vorderen Pol liegt der Embryo in der ersten Zone mit dem Merkmal „444“. Die Zimmermannsameisen können einen Endosymbiont beherbergen, weil die „444“ auch für den hinteren Pol als 4. Zone gilt, so dass eine Verschiebung der Embryo-Position evolutionär realisierbar war. Für die 1. Zone von 4 Zonen wird für die eiförmige Ausrundung zunächst der Bixnom-Kreis „64“ als Form benötigt. Die 4 Zonen sind in der Zählgröße 11 als „141“ geklammert. Epi.Y!Ameise.Z.4131#108470874641419. Die Zone ersteckt sich mindestens über den Bereich der 3 Zeilen „444“: Epi.Y!Ameise.Z.4132#108444623219677; Epi.Y!Ameise.Z.4136#108339744473816 und Epi.Y!Ameise.Z.4139#108261218444963. Weiterhin ist für den Embryo ein Volumen „8000“ reserviert: Epi.Y!Ameise.Z.4149#108000285163582. Die 1. Zone ist in der Mikroskopie in der Farbe „türkis“ eingefärbt [siehe: How Two Became One: Origins of a Mysterious Symbiosis Found | Quanta Magazine]. Die 2. Zone erstreckt sich über den mittleren Bereich des Ameisen-Eies. In der Mikroskopie ist der Bereich „rot“ eingefärbt. Die Funktion wird als extraembryonales Gewebe (extra-embryonic tissues) bezeichnet. Der Übergang zur 2. Zone wird mit der „64“ in Zeile Z.41“64“ gewählt. Enthalten ist eine Gruppe 44 als Zählgröße 11: Epi.Y!Ameise.Z.4164#107611235144982. Die „11_44“ wiederholt sich und bildet auch das Zonenende in Epi.Y!Ameise.Z.4234#105832116944663. Die 3. Zone ist „grün“ eingefärbt. Funktionell ist eine Kapsel, die sich um die Keimbahnzellen legt [the capsule (green) around the germline cells (yellow)]. Die Abbildung zeigt die Keimbahnzellen als gelbe Punkte in der grünen Zone. Es ist daher günstig, wenn die Keimbahnzellen eine separate Gruppe 44 in der 3. Zone als Kapsel bilden können. Die Kapsel beginnt als Form „707“. In Zeilennummer und Zeilencode ist weiterhin eine Spiegelung Z.4„235“_#...535 sowie die Halbzeit 7_12_7 enthalten: Epi.Y!Ameise.Z.4235#105807127070532. Das Ende der 3. Zone wird wegen der Wiederholung der Formeinschnürung „707“ gewählt in Epi.Y!Ameise.Z.4318#103773317078208. In diesen Bereich fällt eine Gruppenserie „44“, wobei noch nicht verständlich ist, um wessen Keimbahn es sich handelt (Ameise oder Endosymbiont?). Die Serie zieht sich über 5 Zeilen von Epi.Y!Ameise.Z.4288#104499343083886 bis Epi.Y!Ameise.Z.4292#104401953202168. Die 4. Zone ist „weiß“ eingefärbt. Das hintere Polende (posterior pol) ist mit den Bakterien „Blochmannia“ gefüllt. Die 4. Zone beginnt in Epi.Y!Ameise.Z.4319#103749289915189. Analog zum vorderen Pol ist die „444“ in 3 Zeilen verfügbar: Epi.Y!Ameise.Z.4325#103605360264440, Epi.Y!Ameise.Z.4357#102844430374961 und Epi.Y!Ameise.Z.4374#102444714939118. Die Bakterien bilden ein stäbchenförmige Bakterien-Ansammlung als Struktur „51115“ am Ende der Eihülle (Chorion) „22_99“. Epi.Y!Ameise.Z.4378#102351115382299. Der hintere Pol als Ende der 4. Zone ergibt sich als Gegenform „46“ am rechten Zahlenrand zum vorderen Pol „64“ in Epi.Y!Ameise.Z.4382#102257686705546. Der Anschluss zum Ei „#101...“ kann somit durch Zwischenaktivitäten überbrückt werden.
Am Ende des Embryos befinden sich Boten-RNA-Moleküle (mütterliche mRNA), über die die Körperachse definiert wird. Dann realisieren die embryonalen Gene den Körperbauplan. In diese Kette schalten sich Hox-Gene ein, um den Kopf, den Brustkorb (Thorax) und den Hinterleib (Abdomen) der Ameise entlang der Körperachse zu gliedern. Die Reihenfolge der Hox-Gene auf einem Chromosom entspricht dabei der zeitlichen Genexpression (Exprimierung) des zu steuernden Körperabschnitts. Die Hox-Gene liegen am Ende der Gengruppe auf dem Chromosom. In der Tierwelt verschmelzen bei der Befruchtung normalerweise die einfachen (haploide) Chromosomensätze von Eizelle und Spermium zum doppelten Chromosomensatz einer diploiden Zelle (Zygote). Die Ameisen-Männchen (Drone) sind haploid, aber als Besonderheit sind die Ameisen-Weibchen diploid, und zwar als Königin (Gyne) und Arbeiter*innen. Die Königin kann daher Männchen erzeugen, wenn sie den Spermienfluss unterbindet. Auch die unbegatteten Arbeiter*innen können aus den wenigen Eiern Ameisen-Männchen erzeugen (siehe: Haploidie – Ameisenwiki).
Die Entwicklungsentscheidungen vollziehen sich über Signalwege im Follikelepithel. Die wissenschaftlichen Zusammenhänge werden vorzugsweise an Taufliegen (Drosophilidae) bzw. Obst-, Frucht-, Gär-, Most- oder Essigfliegen erforscht. Die Taufliegen sind eine Familie der Fliegen (Brachycera) innerhalb der Ordnung der Zweiflügler (Diptera). In der Literatur wird speziell die Gattung der „Drosphila“ genannt; siehe: Determination of EGFR Signaling Output by Opposing Gradients of BMP and JAK/STAT Activity [Laura A. Nilson; Current Biology, Volume 26, Issue 19, 10 October 2016, Pages 2572-2582; Determination of EGFR Signaling Output by Opposing Gradients of BMP and JAK/STAT Activity - ScienceDirect].
Kastendetermination: Bei den Ameisen gibt es 2 Kasten: 1. weibliche Geschlechtstiere und 2.) Arbeiter*innen. Die Arbeiter*innen einer Ameisenart können sich durch Unterkasten als Minor, Media, Major und Soldaten unterscheiden. Eine polymorphe Ameisenart sind die Camponotus-Arten. Die Soldaten erfüllen spezialisierte Aufgaben. Beispielsweise verteidigen phragmotische Soldaten den Bau, indem der eigene Körper als Barriere eingesetzt wird. Es bilden sich extrem große und scheibenförmige Köpfe, mit denen die Nesteingänge gegen Eindringlinge blockiert werden (Phragmose). Diese Soldaten sehen absolut hässlich aus, weil die scheibenförmige Front wie ein Fremdkörper wirkt. Abbildung siehe: 1.) File:Colobopsis truncata (Michal Kukla).jpg - AntWiki. 2.) Species Colobopsis truncata (Spinola, 1808); Image - Colobopsis truncata | BioLib.cz ; Author: Stanislav Krejčík. Dieser Vorbau kann im Sonderfall entstehen, wenn der Zifferncode statt ab Zeile Nr. 1 bereits dezimal ab Zeile Z.= 0,1 ausgelesen wird. Mit 22_404 ist eine harte quadratische Draufsicht zu erkennen: Epi.Y!Ameise.Z.0,2#224046591571852000. Im Querschnitt folgt die runde Scheibenform als Bixnom-Kreis „64“ im Zifferncode und als Quersumme QS 1+4+9+3+6+4+3+9+4+3+8+1+2+3+4=64. Weiterhin ist eine Reihenfolge 1, 2, 3 und 4 für einen Einlassdienst gegenüber der eigenen Spezies vorgegeben: Epi.Y!Ameise.Z.0,3#1493643943812340000. Die rote Farbgebung steht als Eisen=26 zur Verfügung: Epi.Y!Ameise.Z.0,4#1120232957859260000. Die Arbeiter*innen sind mit „66“ adressiert: Epi.Y!Ameise.Z.0,5#8961863662874070000. Es wird dann noch eine Verschlussfunktion des Kopfes für den Eingangsbereich benötigt. Diese wird als Gegenform „46“ zum Bixnom-Kreis „64“ für die Kopfscheibe adressiert. Die Form „7“ des Kopfes dient als Verschluss in der Markierung in „19_7_19“: Epi.Y!Ameise.Z.0,6#746821971906172000. Die Form „7“ in der Zeilennummer bezieht sich durch die Anordnung von Zählelementen 1 als Zählgröße 11 in „1_33_11“ auf Oberfläche der Haut=33 (hier ist männlich=33 nicht gemeint). Die Haut der Kopfplatte ist entsprechend nicht glatt, sondern blasenartig „0“ mit dem Bixnom-Kreis „64_0“ geformt. Der Universalwirkstoff „77“ lässt auf eine Drüsenfunktion schließen: Epi.Y!Ameise.Z.0,7#640133118776719000. Ein Verschluss ist nochmals mit der Ziffer flexibel=6 in „QS 2+9=11_6_ QS 2+9=11“ markiert, wobei die Zählgröße 11 mit der Zeit=60 und dem Bixnom-Kreis „64“ in „60_11_64“ für einen Einlassdienst am rechten Zahlenrand inclusive der Ziffer Ende=9 kombiniert wird: Epi.Y!Ameise.Z.0,8#560116478929629000. Wahrscheinlich ist an Vorderfront noch ein Fühlerpaar „115“, gespiegelt 14_60_41 an der Zeit=60, vorhanden, um die eigene Spezies anhand der Wirkstoffe „88“ zu erkennen: Epi.Y!Ameise.Z.0,9#497881314604115000.
BiXnom_Ameise_dat19.01.2022
Fliegen (Brachycera)
Fliegen (Brachycera) und Mücken (Nematocera) gehören zur Insektenordnung der Zweiflügler (Diptera). Die Fliegen existeren in diversen Familien. Die Taufliege (Drosophilidae) wird auch als Obst-, Frucht-, Gär-, Most- oder Essigfliege bezeichnet. Die Gattung „Drosophila melanogaster“ ist ein häufig wissenschftlich erforschter Organismus. 60% der Gene der Drosophila sind auch beim Menschen vorhanden. Wie beim Menschen besitzt das Männchen X- und Y-Chromosome. Um die Gene auf dem X-Chromosom wie beim Weibchen mit 2 X-Chromosen in gleicher Genauigkeit abzulesen, wird die Leseintensität mittels einer sogenannten Dosiskompensation verdoppelt. Das Gen für das männliche Geschlecht liegt auf dem Y-Chromosom. Bei der Stubenfliege (Musca domestica) trifft das nur zu, wenn die Fliege in nördlichen Breitengraden lebt. Stubenfliegen in südlichen Breitengraden besitzen kein Y-Chromoson. Das Gen für das männliche Geschlecht der „Südfliege“ liegt abweichend auf dem X-Chromosom.
Die Fliegen sind in dem breiten Episoden-Zeittrichter zwischen Bienen und Ameisen zu erwarten. Der Zeittrichter bildet sich allein aufgrund des unterschiedlichen Ansatzes der Interpolationformel als Übergang vom breiten Pflanzenspektrum zum engen Fischspektrum. Eine Feinjustierung zur Findung der Säugetiere erfolgt durch Kettenreaktion mittels Bixnom-Schwelle und Bixnom-Biokugel. Dieser Aufwand ist bei Fliegen unnötig, weil dieses erfolgreiche Lebewesen offensichtlich eine optimale Position im Zeittrichter besetzt. Diese Position kann ermittelt werden, indem der Interpolationsunterschied zwischen Bienen und Ameisen entsprechend dem 10er Bixnom-Schwingkreis dezimal aufgefächert wird. Feststellungsgemäß liegt die Fliege bei exakt 40%, d.h. etwas dichter an der Biene als an der Ameise. Warum? Die Auffächerung ist bei einer fixen Anzahl von Nachkommastellen zweifelfrei ohne Rundungsproblem gelungen, wenn die letzte Stelle unstrittig ist. Nur bei 40% ist dieses der Fall, weil Nullen den rechten Zahlenrand günstig kürzen. Die letzte Ziffer ist außerdem die Struktur-Zahl 5.
TIME.EPI.Y!Fliege = 0,000447300224362500000 (Test am 20.09.2022 beendet - Es ist die Drosophila!)
Diese Startzeit ist geeignet, wenn wesentliche Merkmale einer Fliege bereits zu erkennen sind:
1.) Ameisen-Arbeiter*innen tragen keine Flügel. Weil die Ameisen-Geschlechtstiere 2 Flügelpaare besitzen, ist das 1 Flügelpaar der Fliegen ein Mittelwert.
2.) Fliegenaugen
2.1) Facettenaugen: Ohne die ausgeprägten Mundwerkzeuge und die langen Antennen der Ameise muss das Facettenauge der Fliege im Zeilenlauf früh anliegen. Je nach Kopfhaltung kann alternativ der Rüssel frühzeitig beginnen. Das klassische Auge „505“ ist in Kombination mit der Zählgröße 111 als Facettenauge geeignet, die durch Härchen im Eckwinkel der Einzelaugen als hexagonales Netzwerk dargestellt sind. Die Ziffer „2“ ist mit 25_25 für eine paarige Anordnung vorhanden. Mit der Zeilen-Nr. Z.4 (ähnlich 40) ist räumlich=4 für das Sehen adressiert. Der Sehnerv ist beim Menschen als 2. Hirnnerv mit der Ziffer „2=Sehnerv“ adressiert. Mit seitlich=9 liegen die Augen beidseitig außen „60_9_06“. Die Zeit=60 ist enthalten. Die Anzahl der Einzelaugen (Ommatidien) ist mit bis „5000“ und hexagonal=6 enthalten. Das Auge der Taufliege (Drosophila) enthält ca. 800 Einzelaugen mit jeweils 8 Photorezeptoren (6 äußere und 2 innere) und 12 nicht-neuronale Zapfen- und Pigmentzellen.
Insgesamt sind mit den 3 Punktaugen (Ocelli) und 1 Paar „Hofbauer-Buchner-Ösen (4 Sinneszellen innenseitig am Facettenauge)“ 7 Augen vorhanden: Epi.Y!Fliege.Z.4#111825056090625000. Das Facettenauge muss sich über die Einzelaugen „1“ über den Zeilenlauf bis etwa zu den Punktaugen durchziehen. Wo die Ocellen liegen ist ungewiß, weil erst die Lage des Rüssels die Kopfhaltung (Kopfneigung) bekannt sein muss. Die gleichartige Zeile 40 ist bereits für den Rüsselbereich reserviert. Das Facettenauge „505“ kann sich mt 50005 verbreitert (Null=0 horizontal wie die Blase einer Wasserwaaage). Das Auge ist als Bixnom-Keis=64 kreisförmig, paarig=34_43: Epi.Y!Fliege.Z.42#10650005341964300. Weil die „101“ hier noch nicht als Ocellus nutzbar ist, wird damit das Einzelauge des Facettenauge als Gruppe mit der Zeilen-Nr. Z.44, paarig= 91_19=seitlich adressiert. Die Ziffer #1 ist in Z.44 beendet, so dass mit „101“ ein Sprung zur Zeile Z.101 notwendig ist, um das Facellenauge weiter zu entwickeln. Die Zählgröße 11 ist enthalten als QS 6+5=11_ QS 5+6=11: Epi.Y!Fliege.Z.44#10165914190056800. In Z.101 sind zur Bestätigung nunmehr die Punktaugen-Gruppe 44, paarig=2 mit dem Sehnerv=2 / Nerv=7 und jeweils 8 Photo-Rezeptoren vorhanden. Epi.Y!Fliege.Z.101#442871509269802.
Die Einzelaugen (Ommatidien) des Facettenauges sind paarig, dann aber nochmals zur horizontalen Mittelachse gespiegelt ausgerichtet. Gesucht wird eine doppelte Spiegelung. Die Einzelaugen mit 8 Rezeptoren in der Z.Nr. 108 sind als Form-Gruppe 7_44 mit oben=9 nochmals halbiert mit 7_22 vorhanden. Die Zählgröße 11 ist mit der Gruppe 44 in „4141“ kombiniert: Epi.Y!Fliege.Z.108#414166874409722. Die Folgezeile enthält eine Spiegelung „41_14_22“: Epi.Y!Fliege.Z.109#410367178314220. Der Mensch sieht das Licht optimal mit einer Wellenlänge von ca. 555 nm (> 380 nm). Fliegenfanggeräte arbeiten mit Leuchten von 345 - 370 nm. Das Wellenauge „101“ wird mit „352“ nm kombiniert: Epi.Y!Fliege.Z.111#402973175101352. Die Facettenaugen der Fliegenmännchen können sich bei einer holoptischen Anordnung berühren. Als paarige Anordnung wird die Männlichkeit „33_33“ adressiert und mit Physik=63_63 kombiniert als „33_63_08_63_33“: Epi.Y!Fliege.Z.132#338863806335227. Im Zeilenlauf muss das Facettenauge in der Seitenansicht einen Scheitelpunkt „15_000_15“ ausbilden. Die 800 Einzelaugen der Drosophila sind adressiert: Epi.Y!Fliege.Z.142#315000158001761. Die Zeilennummer Z.144 bewirkt für die Einzelaugen „1“ eine Gruppenbildung „44“. Hierzu wird die Zahl 15=Phosphor dominant markiert „5_15_5“. Die ziegelrote Augenfarbe der Drosphila entsteht aus dem braunen Xanthommatin und dem roten Drosopterin, das vom Guanosintriphosphat stammt: Epi.Y!Fliege.Z.144#310625155807292.
Die Einzelaugen (Ommatidien) fügen sich hexagonal wabenförmig zum Facettenauge zusammen. Das Auge besteht aus 32 - 34 ineinandergreifenden Säulen „33_5=Struktur=34“, in denen die Anzahl der Ommatidien entsprechend der ovalen Augenform angepasst ist. Aufgrund der Rundung ist in Augenmitte eine vertikale Säulen-Spalte mit etwa 34 Ommatidien zählbar: Epi.Y!Fliege.Z.145#308482913353448. Für eine Wölbung muss zwangsläufig der Bixnom-Kreis „64“ adressiert werden. Funktionell ist Physik=63 und das Futter zum Aufnehmen und Hochwürgen als Token-86/68 erwähnt. Weiterhin hat das Männchen (versteckt in 3_06_3) ein Auge auf das Weibchen „66“ geworfen. Die Zeilen-Nr. Z.QS 1+4+6=11 als Zählgröße zieht die diversen Einzelaugen über die Zeilennummer mit. In der Zeilen-Nr. ist die Einzelaugen-Ziffer „1“ bis Z.199=Ende vorhanden. In Fortsetzung ist bis Zeile Z.299 der Sehnerv=2 als Ziffer „2“ indirekt stets vorhanden: Epi.Y!Fliege.Z.146#306370016686644. Um die Lage der unsichtbaren H-B Äuglein (H-B Eylets) zu beschreiben, wird auch das Einzelauge (Qmmatidium) beiläufig und im Zeilenlauf von innen nach außen kurz adressiert. Eine genauere Beschreibung des Einzelauges ist vorhanden: Informationen siehe: a) „Building an Ommatidium One Cell at a Time - PMC (nih.gov)“/Justin P. Kumar /2012/ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3427658/ b) „The Drosophila adult ommatidium“; https://www.sdbonline.org/sites/fly/vdevlhom/movie.htm; Pattern formation in the Drosophila retina (sdbonline.org) /1993; c) Facettenauge – Wikipedia d) Sensillum – Wikipedia .
Die Zahl „20“ könnte die häufig genannten 20 Zellen des Ommatidium avisieren – es sind aber mehr. Vorhanden sind 8 Photorezeptoren R1-R8. Darüber liegen 4 Zapfenzellen, die den Kristallkegel tragen. Der Kristallkegel liegt im Becher aus 2 Zellen als Halbschalen. Außen ist das gesamte Ommatidium von einem hexagonalen Ring aus 12 Zellen (3 Ecken ohne Borste, 3 Ecken mit Borste, 6 Kanten) umhüllt. In der Bilanz 8+4+2+12=26 fehlen mindestens 4 Zellen für 1 haarähnlichen Augenborsten-Komplex (Bristle complexes), der durchschnittlich 1 Ommantidium allein zugerechnet werden kann. Somit können auch „30“ Zellen gezählt werden. Weil keine zusätzlichen Zellen für die Hornhautlinse (Cornea) und den Kristallkegel zur Verfügung stehen, muss die transparente hyaline Struktur von den 4 Kristallbildungszellen erzeugt (sezerniert) werden: Zeilen-Nr.: Epi.Y!Fliege.Z.149#300201492860738.
Es wird eine Augenborsten-Gruppe „44“ aus Zählhaaren „11“ mit jeweils 4 Zellen als „11444“ gebildet, so dass die folgenden 4 Zeilen aktiviert werden. In 1 Ecke jeder 6-eckigen Linse liegt jeweils 1 Borste. Alternativ betrachtet gehört jeder Borstenkomplex gemeinsam zu den 3 angrenzenden Ommatidien. Jedes Einzelauge ist dann mit 3 Borstenkomplexen verbunden. In 3 Ecken der 6 Ecken liegt keine Borste: Epi.Y!Fliege.Z.154#290454691144481. Die mechanosensorischen Borsten der Insekten bestehen aus Schaft, Scheide, Pfanne und sensorischem Neuron: Schaft (Trichogen) „11_9=oben_1=Borste“: Zeilen-Nr.: Epi.Y!Fliege.Z.155#288580789911291. Scheide (Thecogen): Im Schaft ist die Zahl „885“ enthalten. Diese Zahl wird in der Scheide am rechten Zahlenrand ausgeworfen, womit der Kontakt als Scheide zu deuten ist: Epi.Y!Fliege.Z.156#286730913052885. Pfanne (Tormogen): Die Pfanne sitzt an der Basis der Borste. Das Volumen „0460“ enthält die runde Zwiebelform „46“ als gespiegelter Bixnom-Kreis=64. Statt „777“ als massives Ganglion zu deuten, ist mit „504_77“_7 der verdickte Zellkörper (Soma) der Nervenzelle als Form=77 zu lesen. Die Lage der 1 Borste wird ungenau als „vorderer Scheitelpunkt“ beschrieben. Erkennbar ist, dass alle Borsten in der gleichen Ecke am Rand der hexagonalen Linse liegen. Hexagonal=6_Null (0)=Linse_1=Borste ergeben eine Information. Welche der 6 Ecken gewählt wird, bleibt offen. Der Borstenkomplex gehört zusammen jeweils 3 Ommatidien. Am Ommantidium sitzen 3 Borsten und 3 Ecken bleiben frei: Epi.Y!Fliege.Z.156#284904601504777. Neuron: Ausgangsnerv=7 am rcchten Zahlenrand an der Borstenzwiebel „101“: Epi.Y!Fliege.Z.158#283101407824367.
Die transparente Hornhautlinse (Corneal lense) enthält 4 Proteine, die auch in der Cutikula zum Oberflächenschutz der Epidermis nötig sind. Die Cuticula-Zellen sind bikonvex und mit ihren sonstigen Eigenschaften als Linse geeignet. Siehe: „The cuticular nature of corneal lenses in Drosophila melanogaster“; A.L Stahl /2017; The cuticular nature of corneal lenses in Drosophila melanogaster - PMC (nih.gov); https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC5581546/.
Ein Kristallkegel kann von 4 Kristallbildungszellen (Semper-Zellen) gebildet werden, die einerseits selbst durchsichtig sind und andererseits eine lichtdurchlässige hyaline Masse abgeben, um das Licht zu focussieren. Dieser unechte Kristallkegel wird als „Pseudoconus“ bezeichnet. Die 4 Semper-Zellen sind nicht im Pseudoconus zu finden, sondern es ist ein Quartett von 4 linsensekretierenden Zapfenzellen, die den Pseudoconus als Boden stützen. Hornhaut (Cornea) und Pseudoconus bilden als Einheit eine Linse – die 4 Kristallbildungszellen sezernieren (Sekret absondern) die Linsenmasse. Die hexagonale Linsenform „606“ wie sie für das Einzelauge benötigt wird, erscheint daher nicht in der Hornhaut (Cornea), sondern erst für den transparenten Pseudoconus, der von der Hornhaut (Cornea) als Schutzschicht überzogen ist. Wenn erneut die Zahl „20“ erscheint, können es universell alle 20 natürlichen Aminosäuren sein, um die Proteine für Eiweißkristalle nach dem physikalischen Bedarf=“63“ mit der Quersumme QS=66 flexibel zu generieren. Die Quersumme „66“ verweist auf die Zeilen-Nr. Z.166, deren Stützzellen die Linse absondern.
Welcher Bedarf? Angeboten wird eine Wellenlänge von 472 nm am rechten Zahlenrand. Die Fliege muss 2 - 3 Rezeptoren vergleichen, um auf Wellenlängenunterschiede zu reagieren. In allen äußeren 6 Photorezeptoren ist Opsin Rh1 vorhanden, um eine breitbandige Blau-Grün-Empfindlichleit (max=478 nm) zu bewirken. Das Gesamtspektrum der 8 Photorezeptoren kann mit 320 nm bis 582 nm zutreffend gelesen werden [siehe: „The spectral sensitivity of Drosophila photoreceptors | Scientific Reports (nature.com)“ /C.R.Sharkev/Scientific Reports volume 10, Article number: 18242 (2020)]. Eine andere Quelle gibt für Photorezeptoren R1-R6 und R8 das sichtbare Licht im Absorptionsmaximum von 480 - 490 nm an. R7 ist für das UV-Licht bei max 370 nm empfindlich: Epi.Y!Fliege.Z.159#281320895825472.
Die Zeilen Nr. Z.160 selbst zeigt bereits die Facettenaugenlinse (Cornea) als „0“, die Form QS 1+6+0=7 als hexagonal „6“ mit 1 Augenborste „1“ pro Linse an. Die Linsenwölbung ist als Kreis=64_0 und bikonvex als 6_2=paarig_6 zu deuten. Die Cuticula-Zellen als Schutzschicht=22 bewirken eine bikonvexe Linsenstabilität. Die Linsenfunktion ist mit Physik=63 enthalten, die das Licht als 1 Aktion = 64-63 focusiert. Hintergrund ist die biologisch gekrümmte Bixnom-Gravitationslinse (64) und als Gegensatz die rechteckige Matrix 6x9=63: Epi.Y!Fliege.Z.160#279562640226563. Das Licht wird im Pseudoconus focussiert, indem die sich die Linse „16“ in der Zeilennummer Z.160 mit dem rechten Zahlenrand der Linse als Zielfunktion „63“ am Ausgang des Kristallkörpers vertauschen. Die Zeilennummer Z.1“63“=Physik zeigt am rechten Zahlenrand „61“, so dass das Licht schräg durch die Zeilen geführt wird. Weil alle benachbarten Ommatidien gleich wirken, wird das Licht mittig focussiert. Genetische Mutationen sind häufig bereits an einer gestörten Linsenanordnung erkennbar. Der Kristallkörper benötigt eine Höhe, die mit 2 Zwischenzeilen als Zählgrößen 2_11_2 besetzt wird. Statt einer gewünschten Linse „606“ wird die Null durch Cutikula-Zellen 6_22_6 als Bestandteil der Hornhautlinse besetzt. Die Physik=63 ist zur Funktion enthalten. Epi.Y!Fliege.Z.161#277826226312112. Die Linse „606“ als Kreis=64 ist jetzt als Bestandteil des Kristallkörpers mit einer Lichtbündelung „6111“ adressiert. Der zirkadiane Rhythmus ist mit 24 Stunden enthalten: Epi.Y!Fliege.Z.162#276111249606482. Der Kristallkegel in unechter Art als „Pseudoconus“ wird als Struktur „555“ adressiert: Epi.Y!Fliege.Z.163#274417315559816. Pigmentzellen: Der Kristallkörper wird becherartig durch lichtundurchlässige Pigmentzellen geformt, die sich hexagonal zusammenschließen. Dieses ist möglich, indem die 6 Ecken durch 3-strahlige „27_27_27“ tertiäre Pigmentzellen (3°pigment cell) besetzt werden. 6 sekundäre Pigmentzellen (2°pigment cell) koppeln die „Ecksterne“ mit den beiden spiegelbildlichen „24_42“ Stabenden als Hexagon-Kante. Die benachbarten Ommatidien teilen sich dieses hexagonale Ringsystem gegenseitig. Die 3-strahligen tertiären Pigmentzellen (3°pigment cell) unterscheiden sich, weil in jeder 2 Zelle im hexagonalen Ring eine Augenborste “1“ (in der Zeilen-Nr. Z.“1“63) sitzt. Hierzu ist eine Gruppe 44_0=leer und eine Gruppe „454“ mit einem Borstenkomplex „5“=Struktur aus jeweils „4“ Zellen gefüllt. Die tertiären und sekundären Pigmentzellen sind becherartig über die gesamte Höhe des Ommantidium vorhanden. Das hexagonale Ringsystem wird durch den Bixnom-Kreis=64 in der Zeilen-Nr. gefordert: Epi.Y!Fliege.Z.164#272744039245427. Der Kristallkegel „Pseudoconus“ wird auf der Innenseite des Hexagon von einem Ring „0“aus 2 Halbschalen „Form=7_10_9=seitlich=10“ umschlossen. Weil sich diese beiden Zellen gegenseitig zum Ring koppeln sind es 2 primäre Pigmentzellen (1°pigment cell): Epi.Y!Fliege.Z.165#271091045068182. Zapfenzellen (Semper-Zellen): Die 4 linsensekretierenden Zapfenzellen liegen an der Basis des Kristallkegels und tragen einerseits zum Aufbau von Hornhaut und Kristallkegel bei und reichen andererseits bis zur Sohle des Ommantidium herab, weil dort ein voluminöser Fuß gebildet wird. Der Innenraum des Ommatidium wird von den Photorezptoren R1 – R6 und gestapelt R7/R8 gefüllt. Aufgrund des Stapels sind im Querschnitt nur 7 Rezeptoren erkennbar. Die 4 Zapfenzellen ordnen sich zu 2 gegenüberliegenden Paaren. Mit „3434“ berührt sich das 1. Paar und das 2. Paar ist gespiegelt getrennt 69_96. Der Fuß ist wesentlich kleiner als die Spitze und die Zellanordnung verdreht sich im Grundriss offenbar um 90°. Um den Fuß im Zeilenlauf nachfolgend zu identifizieren, wird vorab eine Fußgruppe 44 gebildet, in dem die Zahl „83“ in „4834“ markiert ist. Die Kreis=64 kann den Boden ausfüllen, der durch den Ring der beiden primären Pigmentzellen vorgeben ist: Epi.Y!Fliege.Z.165#269457966483434. Äquator: Die lotrechten zylindrischen Zellkörper der Photorezeptoren R1 bis R8 verteilen sich in Ringform im Ommatidium. Die verkürzten R7 und R8 sind übereinander gestapelt. Aus den Zellkörpern strahlen Mikrovilli als lotrechter Bürstensaum in das Zentrum, so dass sogenannte „Rhabdomere“ entstehen. Die Enden sind offen, so dass Fliegen keinen verwachsenen lichtleitenden Achsenstab als geschlossenes Rhabdom ausbilden. Die Achsen der Rhabdomere im Ommatidium divergieren leicht. Die Rhabdomere der benachbarten Rhabdomere teilen sich bei gleichen Winkeln ein gemeinsames Sichtfeld und senden ihre Axone an die gleiche Stelle der Ganglienschicht (Lamina). Das Bild ist 7-fach heller als von einem Ommatidium allein, so dass Fliegen mit dem „neuralen Superpositionsauge“ auch mit wenig Tageslicht fliegen können.
Die Endpunkte der Rhabdomere zeichnen im Querschnitt des Ommatidium eine asymmetrische Trapezform. Die Trapezformen als Umriss der 8 Rhabdomere sind auf der Netzhaut „4444“ beider Fliegenaugen weder zufällig noch gleichartig, sondern nach einem Achsenkreuz ausgerichtet. Deshalb muss bei der Beschreibung des Ommatidium ein Hinweis auf das Verteilungsmuster gegeben werden. Der Bixnom-Kreis=6O4 adressiert das Facettenauge als gewölbte Halbschale. Die Ziffer „4“ für 4 Ecken wird nachfolgend eher unverständlich kombiniert, weil sich die Rezeptoren im Ommatidium zu einem „asymmetrischen“ Trapez (4 Ecken) formieren müssen. Im Trapez entsteht dadurch ein 90°-Winkel mit Parallelen zum Augen-Achsenkreuz als Spiegelachse für 4 Bilder. Vergleichsweise sieht der Mensch nur 2 Bilder seitenverkehrt und kopfstehend. Das Trapez ist im linken und rechten Auge gespiegelt. Innenseitig lotecht zur Körperachse zwischen beiden Augen stehen R1/R2/R3 (außen R6/R5; mittig R4 und R7 oder R8). In Augenmitte zieht sich eine Horizontale als Äquator, zu dem die dorsalen und ventralen Trapeze in den Ommatidien jedes Auges gespiegelt sind, wobei R6 und R1 parallel zum Äquator liegen. Der 90°-Winkel erscheint als „7_90_7=Form“ erst in Zeile Z.171, weil als Eckpunkt dort der Rezeptor R1 entsteht.
Aus der gesamten Netzhaut 4444 wird nunmehr eine Gruppe „44“ als „Form=7_84_44=Gruppe_QS 4+5=9=oben_7=Form_48“ adressiert, die eine Spiegelung 8_4_4_8 enthält. Im Ergebnis muss sich eine horizontale Linie als Äquator durch das Facettenauge ziehen. Mit „ QS 2+6=8_7_7_ QS 2+6=8“ ändern die 8 Rezeptoren das Muster (Form-7) am Äquator abrupt: Epi.Y!Fliege.Z.167#267844445726048.
Das Rhabdomer induziert eine elektrische Spannung, die das Nervensystem erregt. Das Rabdomer kann durch den lotrechten Zellkörper 777=Nerv mit dem seitlich=9 angesetzten Mikrovilli „11“ und als Rezeptor mit Physik=63 als „63117779“ avisiert werden: Epi.Y!Fliege.Z.170#263117779036765. Nachfolgend werden über 6 Zeilen die Rezeptoren R1 bis R6 angenommen, weil R1 in der 90°-Trapezecke liegt: R1: Epi.Y!Fliege.Z.171#261579078574562; R2: Epi.Y!Fliege.Z.172#260058269978198; R3: Epi.Y!Fliege.Z.173#258555042984104; R4: Epi.Y!Fliege.Z.174#257069094461207; R5: Epi.Y!Fliege.Z.175#255600128207143; R6: Epi.Y!Fliege.Z.176#254147854751421.
Die Rezeptoren R7 und R8 sind kürzer, weil beide mit ihren Mikrovilli „11_11“ in einer Zeile liegen. Mit 99=oben wird zunächst der obere R7 adressiert: Rezeptor R7: Der Rezpetor R7 enthält ein verwandtes Paar „252“ und „525“, dass als Opsin Rh 3 und Rh 4 bekannt ist: Epi.Y!Fliege.Z.177#252711991165254. Rezeptor R8: Der Repzeptor R8 enthält Opsin Rh5 und Rh6. Der Rezeptor R8 ist nachgeordnet, so dass der Rezeptor R7 auf die Bildung von Rh5 im Rezeptor R8 Einfluss nimmt. Rh5 ist hier mit „251_2“ dem Rh3 als „252“ in R7 ähnlich. Eigenständig ist dann „8778“ als Rh6 möglich: Epi.Y!Fliege.Z.178#251292260877809. Siehe: Patterning of the R7 and R8 photoreceptor cells of Drosophila: evidence for induced and default cell-fate specification | Development | The Company of Biologists; A.Huber/1999. Für Rhodopsine sind folgende maximalen Empfindlichkeiten bekannt: Rh1: 480 nm, Rh2: 420 nm, Rh3: 345 nm, Rh4: 370 nm, Rh5: 440 nm und Rh6: 520 nm.
Von den 4 Kristallbildungszellen (Semper-Zellen) führt vermutlich jeweils 1 dünner Faden zur Sohle des Ommatidium herab, um dort gemeinsam einen verdickten Fuß zu formen. Die Zahl „83“ wurde markiert und ist nunmehr in 2 Fuß-Zeilen vorhanden. Die Fuß-Rundungen sind als „604“ und „64“ und als Gegenform „46“ vorhanden. Im Kristallboden berührten sich mit „3434“ zwei gegenüberliegende Zapfenzellen. Im Fuß sind diese Zellen getrennt, weil sich „34“ über 2 Zeilen erstreckt. Folglich könnten sich jetzt das im Boden getrennte Zellenpaar 69_96 berühren, und zwar ungespiegelt als „498_498“: Epi.Y!Fliege.Z.179#249888393498604 und Epi.Y!Fliege.Z.180#248500124645834.
Auf der Unterseite eines Einzelauges werden die elektrischen Impulse von den Lichtsinneszellen incl. Mikrovilli (Rhabdomer /Retinulazelle) weitergeleitet. Bei der Drosophila verknüpfen sich die äußeren Ausgänge (Axone) der Rezeptoren R1 bis R6 der benachbarten Einzelaugen in der Lamina als 1. optisches Ganglion durch Überlagerung gleicher Rezeptoren zum Superpositionsauge. Die Axone der Rezeptoren R7 und R8 ziehen direkt zur Medulla als 2. optisches Ganglion durch. Beim Nerv=7 müssen daher 2 Gruppen unterschieden werden, und zwar 71_2_71 und 78_87. Die 6 äußeren Rezeptoren erfassen die Bewegungen, die inneren 2 Rezeptoren sind an der Farbwahrnehmung beteiligt. Mit der Quersumme QS 2+4+7+1+2+7+1+9+5+7+8+0+3+8+7=71 liegt die „71“ damit 3-fach vor, so dass 3 Ommatidien in Beziehung treten könnten: Epi.Y!Fliege.Z.181#247127195780387. Der Nerv=7 wird durch die Basallamina durchgeleitet. Eine Basallamina „333“ ist direkt nicht vorhanden, sondern nur eine Membran=33. Aufgrund des Nachbarkontaktes kann man sich „333“ ideell vorstellen. Ein Membran-Loch ist mit 33_“0“ avisiert und als Loch „404“ vorhanden. Mit der Bezeichnung „Fenestrated Membrane“ wird besser auf die Fenster- bzw. Lochbildung hingewiesen: Epi.Y!Fliege.182#245769354045330. Die Verarbeitung der Signale in Lamina und Medulla kann sich hier nicht direkt anschließen, weil vor den Punktaugen (Ocelli) noch das Antennen-Paar eingeordnet werden muss. Von QS 3+5=8 Rezeptoren werden „6“ Rezeptoren-Ausgänge im Netzwerk „444“ der Lamina als 2_444_2_6 verarbeitet und 2 Rezeptoren werden zur Medulla unverarbeitet durchgeleitet: Epi.Y!Fliege.Z.183#244426352110656. Der Nerv 7 endet zur gesuchten Fortsetzung als 979=Ende: Epi.Y!Fliege.Z.184#243097948023098.
2.2.) Punktaugen / Einzellinsenaugen (Ocelli):
Der Bereich Z.210 bis Z.213 mit dem üblichen Punktauge ähnlich „101“ als „010“ und „100001“ kann für die Ocelli nicht verwendet werden, weil zwischen Antennen und den Ocelli ein natürlicher Abstand vorhanden sein soll. Nachfolgend wurde eine Alternative gefunden.
Die 3 Punktaugen (Triplet) sind als gleichseitiges Dreieck auf dem Scheitel des Kopfes zwischen den Facettenaugen angeordnet. Die untere Dreieckspitze wird von einem medialen Ocellus gebildet. Oberhalb (posterior) folgt seitlich (laterial) ein Paar von Ocelli. Bei gerader Kopfhaltung müsste im Zeilenlauf zuerst das einzelne untere Auge erscheinen. Alternativ wird eine Ocelli-Gruppe „44“ gebildet, bei der die Ocelli notfalls auch vertikal von oben beginnend angezeigt werden könnten. Die Photorezeptoren reagieren auf eine bestimmte Wellenlänge. Die Hornhaut (Cornea) ist kuppelartig geformt. Darunter liegen „Hornhautzellen ?“ – andere Quelle nennt Retina und Kristallbildungszellen. Es folgen die Photorezeptorzellen. Die Ocelli besitzen nur das Opsin Rh2. Rh2 fehlt dagegen bei den verschiedenen Opsinen im Facettenaugen, so dass eine Spezialisierung der Augen vorliegt (siehe: Homothorax controls a binary Rhodopsin switch in Drosophila ocelli - PubMed (nih.gov)/ doi: 10.1371/journal.pgen.1009460. eCollection 2021 Jul.). Die Rhabdomere befinden sich nur im oberen Drittel des Ocellus und zwischen den Rhabdomeren fehlt der interrhabdomereale Zwischenraum (siehe: Understanding the Structural and Developmental Aspect of Simple Eye of Drosophila: The Ocelli | Semantic Scholar/2017/ DOI:10.4172/2576-1471.1000109). Bei der Drosophila enthalten das Augenpaar jeweils ca. 75 Photorezeptoren und der mittlere Ocellus ca. 100. Die spektralen Spitzenempfindlichkeiten liegen bei 350–370 nm (Ultraviolett) und 445 nm (blau). Eine Schicht von Pigmentzellen umgibt den Cluster von Photorezeptorzellen. Photorezeptorzellen sind durch Gürteldesmosomen in der Nähe der Pigmentgranulatschicht verbunden. „Die Axone der Photorektorzellen projizieren auf ihr entsprechendes ozelläres Ganglion und vier riesige ozellare Interneurone aus jedem Ganglion projizieren über den ozellaren Nerv ins Gehirn.“[siehe: „reduced ocelli Encodes the Leucine Rich Repeat Protein Pray For Elves in Drosophila melanogaster - PMC (nih.gov)“/ D. Eberl /Fly (Austin). 2007/ doi: 10.4161/fly.4562. Nach einer anderen Darstellung münden die Axone der Photorezeptoren im unterhalb (ventral) gelegenen Occelarganglion (OCG), das im Querschnitt als Y-Form die 3 Augenbereiche trennt. Die Axone werden auf postsynaptische Neurone verschaltet [siehe: „Untersuchungen zur Aspartatdecarboxylase Black im visuellen System von Drosophila melanogaster“, A. Ziegler /Diss. Ruhr-Uni.-Bochum/ 2010].
Der Kopfscheitel (Head vertex) wird quer von der Mittelachse bis zum Facettenaugen in 3 Abschnitte gegliedert, um die Lage der Borsten zu beschreiben („oc“ = ocellar domain / ozellare Region , „fr“ = frons /Fronen / Stirn, „orb“ = orbital domain / Orbitalregion ). Die Ocellus-Region enthält die 3 Punktaugen, zwei große ozellare Borsten, zwei postvertikale Borsten und sechs Microchaetae-Borsten. Der Raum innerhalb der 3 Ocelli wird als „iOC“ = inter-ocellar cuticle / interozellare Cutikula bezeichnet – hier ist ein weiteres Borsten-Paar angeordnet (siehe: „Development of the ocellar visual system in Drosophila melanogaster - Jean‐Guillaume - The FEBS Journal - Wiley Online Library“; C. Jean-Guillaume,J. Kumar/ May 2022 / https://doi.org/10.1111/febs.16468).
Occeli-Gruppe „44“ für Empfang der Wellenlänge 358 nm (Messwert 350-370 nm) und 418 bis 478 nm (Messwert 445 nm). Das Punktauge „1“ (Durchmesser rd.40 μm) liegt medial vom Bixnom-Schwerkraft-Gleichgewicht=“84“ geklammert mittig (medial) „84_1_84“. Die „3“ Punktaugen bilden eine Struktur-5, indem seitlich noch ein Augenpaar 78_78 folgt. Die Ziffer 8=Extra wird durch die Quersumme QS=81 erklärt, in dem für das Augenpaar ebenfalls ein Punktauge „1“ entsteht: Epi.Y!Fliege.230#194478358418478.
Die Funktion ist „3“-fach und pauschal als Physik=63 mit der Linsenwölbung=64=Kreis sowie der Zeit=60 enthalten. Die Ocelli sehen alles verschwommen, reagieren aber schneller als das Facettenauge: Epi.Y!Fliege.231#193636460762987. Die lamellenartige Hornhaut ist als Haut „33“ in der Zeilen-Nr. 2“33“ enthalten, wobei das Paar „1919=oben“ und „19“ als 3er Gruppe „4_3_4“ adressiert sind. Der Aufbau kann sich bis Z.236 entwickeln, weil dann „33_99_33“ in der Zeile enthalten ist. Epi.Y!Fliege.233#191974345219957. Die Zahl „115“ wäre im Prinzip von erheblicher Bedeutung, es wird damit aber lediglich die Borste eng neben dem mittleren Ocellus eingeordnet, als Borste „11“, paarig=53_35. Benötigt werden Kristallkegelzellen. Abgeleitet von einem klassischen Auge „505“ wird die Darstellung „5_QS 2+1=3 Ocelli_00=durchsichtig_5 gelesen. Als „100“ kann es sich um eine säulenförmige Anordnung handeln. Angeboten wird auch der Durchmesser von 40 µm=40000 nm. Nanometer sind (gemäß Bixnom) als Wellenlänge in nm direkt ablesbar. Mit „0_3“ ist ein Bezug zur Umrechnungszahl „1000“ und „3“ Ocelli vorhanden: Epi.Y!Fliege.235#190340521005319. Falls es sich wie beim Facettenauge um hyalines Material handelt, das erst durch Kristallbildungszellen erzeugt werden muss, ist dazu die Form „33_99=oben_33“, Form=7_ 3=Occeli_9=oben“ geeignet: Epi.Y!Fliege.236#189533993373941.
Die Pigmentzellen der Ocelli liegen nicht wie bei den Ommatidien der Facettenaugen in der äußeren Hülle, sondern oben (dorsal) im Photorezeptor. Die Rhabdomere sind seitlich offen. Das übliche Pigment „88=Extra“ bildet somit den Anfang des Rezeptors. Das Ocelli–Paar „188_7=Form_QS 3+4+2=9=oben“_“7_1_88“ und der untere Qcellus sind genannt. Epi.Y!Fliege.236#188734271882912. Die Ausbildung der meist V-förmigen Rhabdomere ist momentan unbekannt - bei einem offenen Rhabdomer ist im Zentrum im Prinzip ein Form-Loch „707“ vorhanden: Epi.Y!Fliege.238#187941270740546. Wunschgemäß wird bei der Drosophila entsprechend dem Zeilenlauf zuerst der mittlere und untere Ocellus mit seinen „100“ Photorezeptoren gebildet: Epi.Y!Fliege.239#187154905591004. Das obere Ocelli-Paar kann nur deshalb erkannt werden, weil es mit „75_75“ jeweils 75 Photorezpetoren enthält. Enthalten ist Physik=63, so dass die Funktion durchgelaufen ist. Übergeordnet ist in der Zeilennummer Z.240 die Zeit=24 Stunden als Zirkadianer Rhythmus adressiert: Epi.Y!Fliege.240#186375093484375.
Ein Ganglion bildet sich allgemein mit „777“, avisiert wird eine Nerven-Struktur „5557“. Für das Zusammenführen der Axone aus den 3 Ocelli muss mit QS 3+4=7 ein Nerv=7 gebildet werden. Die „34“ verstecken sich für das Ocelli-Paar in 848“34“8, paarig=48_48 und für den Ocellus als „34“. Mit 3x“7“ ist auch das Ganglion „777“ avisiert: Epi.Y!Fliege.242#184834803455579.
Die Y-Form des Ocellarganglions kann nur als Gruppe 44 über 2 Zeilen erkannt werden. Mit 36_36 werden die beiden Segmente für das Ocelli-Paar als Struktur-Form 55_7 gebildet. Als Gruppe 44 legt sich die Spiegelung Physik=63 in die Y-Gabel. Es ist dann möglich (sofern vorhanden) „3“ Kammerwände „222“ als Y in das Ganglion einzubauen: Epi.Y!Fliege.248#180362993694557 und Epi.Y!Fliege.249#179638644322289.
Eine Verschaltung kann dargestellt werden, indem mit der Zahl „72“ der Kontakt und die Übergabe vom allgemeinen Nerv=7 auf die Sehnerv-Funktion=2 umgeschaltet wird. Um die 3 Ocelli zu unterscheiden, ist als Single „07_2“ und gepaart „070_2“ verfügbar: Epi.Y!Fliege.251#178207260702191. Das Ocellarganglion bildet mit „77_5000“ eine Volumenform. Die Ziffer „2“ ist nicht als „paarig“ zu verstehen, sondern die „27“ ist die Spiegelung der „72“. Die Umschaltung ist somit funktionell abgeschlossen: Epi.Y!Fliege.252#177500089032738.
2.3) Hofbauer-Buchner Äuglein (Hofbauer-Buchner eyelets / H-B Äuglein):
Die Fliegen-Larven besitzen mit dem Bolwigschen Organ einen photosensiblen Zellkomplex aus 12 Photorezeptoren (4x blauempfindlich / 8x grünempfindlich). Bei der Metamorphose zur adulten Fliege reorganisiert sich der Zellbereich und es entwickeln sich daraus die 4 Zellen des paarigen, grünempfindlichen H-B Äugleins. Hierbei sterben die 8 grünempfindlichen Rezeptoren ab und die 4 blauempfindlichen Zellen werden grünempfindlich. Wellenlänge des Lichtsspektrums: Blau 430 - 490 nm / Grün 490 - 570 nm. Die Reorganisation des Bolwigschen Organgs wird mit dem klassischen Auge „505“ adressiert, wobei darin die Wellenlänge von Blau=450 nm auf Grün=536 nm wechselt als „450536“. Der 24-Stunden-Rhythmus (circadianer Rhythmus) mit „24“ Stunden und die 12 Zellen als Zelltod 1“0“2 sind enthalten. Mit Physik=63 (hier gespiegelt als 36) und Biologie=64 ergibt die Differenz 1 Elektron in der Bixnom-Gravitationslinse als Lichteffekt über den Nerv=7, paarig=2 bzw. 17_17. Die Zeilen-Nr. Quersumme QS 2+5+4=11 erzeugt die Zählgröße 11 als Wiederholungseffekt: Epi.Y!Fliege.Z.254#176102450536417.
Die H-B Äuglein (Eyelets) sind äußerlich unsichtbar, weil sie unter dem Facettenauge liegen, und zwar mittig an der Basis der hinteren Einzelaugen (Ommatidien). Die Ommatidien bestehen bei der Drosophila jeweils aus 20 Zellen, davon sind 8 Photorezeptoren (Retinula). Die Einzelaugen sind im Such-Vorfeld nicht erkennbar und werden daher umgekehrt nach den Eyelets erwartet. Die H-B Äuglein (Eyelets) werden als klassisches Auge „505“ einer Struktur=5 mit „4“ Zellen als Zell-Gruppe „44“ adressiert. Die Zellen liegen über der Lamina, die als Basalmembran „333“, paarig=43_34, enthalten ist. Grün=543nm: Epi.Y!Fliege.Z.271#165055433344096. Die „8“ Photorezeptoren (Retinula) sind Bestandteil eines hexagonalen Netzwerkes 6_444. Achsenstab (Rhabdom)=11. Am Ende beginnen die Nervenfasern=7; bei der umgekehrten Richtungsbetrachtung ist 7_9=oben_7: Epi.Y!Fliege.Z.272#164448611897978. Der hyaline Kristallkegel „22“ ist als „0220“ lichtdurchlässig. Das Licht wird gebündelt, dafür ist pauschal die Physik=63_603 zuständig: Epi.Y!Fliege.Z.273#163846236030220. Die Chitinlinse (Cornea) „606“ ist hexagonal. Die Zeit ist als 24 Stunden und 60 Sekunden enthalten. Das Facettenauge ist insgsamt paarig= 06_60. In einer Ecke des Sechsecks sitzt 1 Haar (corneal nano-nipples) „1“_6 (siehe: https://de.frwiki.wiki/wiki/Œil_composé): Epi.Y!Fliege.Z.274#163248257066606.
Die H-B Äuglein liegen im hinteren optischen Trakt mit weiteren Strukturen [„intermediäre Chiasma“, „Medulla“, „Cucatti Bündel“]. Die Nervenfasern=7 werden hinter dem Augen innerhalb eines Volumenkörpers „7_5000_7_000_0“ zusammengeführt: Epi.Y!Fliege.Z.284#157500079000880. Aus der Abbildung ist zu entnehmen, dass sich 2 Nervenfaser-Gruppen, 7_44 und 44_7, im Verlauf miteinander als Spiegelung „744_447“ kreuzen (Chiasma). Für 2 Facettenaugen erfolgt dieses paarig=47_47: Epi.Y!Fliege.Z.285#156947447144737. Gemäß Abbildung könnte es sich bei dem „Cucatti Bündel“ um ein Faserbündel „111“ handeln (siehe: „Isolation of Anatomical Brain Mutants of Drosophila by Histological Means“; M. Heisenberg / K. Böhl / 1979): Epi.Y!Fliege.Z.296#151114940663007.
2.4) Sehlappen OL (Lobus opticus / Optic lobe):
Die Photorezeptorneuronen der paarigen 800 Ommatidien des Facettenauges projizieren in den paarigen Sehlappen (OL), der aus einer Reihe von 4 neuronalen Fortsätzen besteht. Diese werden als Neuropile bezeichnet: Lamina (LA), Medulla (ME), Lobula-Komplex (LOP) in Lobula (LO)- und Lobulaplatte (LOP)-Neuropile unterteilt. Die „Ventrolateral Neuropils (VLNP)“ befinden sich direkt unter den Sehlappen (OL) und verarbeiten deren Informationen als nächsten Schritt. Die schalenartige Reihe der 4 Neuropile ist in der rückseitigen (posterior) Ansicht seitlich neben dem unpaarigen Zentralhirn (CB) erkennbar [siehe: https://www.spektrum.de/lexikon/neurowissenschaft/drosophila-nervensystem/3031.
2.4.1) Lamina (LA): Die paarige Lamina besteht aus einer Anzahl von 800 säulenförmigen Kartuschen (Cartridge / Patrone), die den 800 Ommatidien des Facettenauges zugeordnet sind. Die siebenäugige Drosophila besitzt 5 weitere Augen [3 unpaarige Ocelli und 1 Paar H-B Auglein (H-B Eyelets)], die zunächst entwickelt werden, bevor die Lamina im Zeilenlauf beginnen kann. Die Axone der Rezeptoren R1-R8 ziehen unterhalb der Retina des Facettenauges durch die Basallamina. Die dafür geeignete „333“ wurde hier zuvor bereits für die H-B Eyelets verbraucht. Die Drosophila besitzt ein neuronales Superpositionsauge. Die Zeile Z.274 enthält mit „066606“ eine Vorstellung wie sich die äußeren „6“ Axone (R1-R6) zu einem Bündel um die beiden inneren Axone R7/R8 verdrillen. Die Axone der Rezeptoren R7/R8 passieren die Lamina unverarbeitet. Ein Kreis=64 für ein Rezeptorbündel folgt ersatzweise als Gegenkrümmung=46 in einem Loch=909=seitlich der Basallamina: Epi.Y!Fliege.Z.274#163248257066606 und Epi.Y!Fliege.Z.275#162654627040909. Eine Kartusche erhält die Rezeptoren-Axone R1-R6 von den benachbarten Ommatidien mit der gleichen optischen Achse. Dieses gelingt offensichtlich dadurch, dass die Achse des Ommatidium für R7/R8 in der Lamina erhalten bleibt, sich aber die Achsen der Kartuschen seitlich versetzt ringförmig gruppieren [Schichtenaufbau der Lamina siehe: „Untersuchungen zur Aspartatdecarboxylase Black im visuellen System von Drosophila melanogaster“, A. Ziegler /Diss. Ruhr-Uni.-Bochum / 2010]. Die Kartusche enthält weiterhin verschiedene Gliazellen und 5 neuronale Zellen (Interneurone) L1-L5 deren Fortsätze mit den Axonen R7/R8 über das äußere Chiasma zur Medulla ziehen.
Histologisch wird die Lamina von außen nach innen in Schichten eingeteilt (siehe: Drosophila melanogaster – Wikipedia). Bei der Drosophila bilden sich 6 Schichten verschiedener Gliazelltypen, die als Monolayer gestapelt sind: 1.) Die Fensterschicht (fenestrierende Schicht) liegt unterhalb der Retina und enthält Gliazellen, die die Fotorezeptor-Bündel und Tracheen umhüllen. Der Kontakt zur frei verteilten Hämolymphe wird dadurch verhindert. 2) Die zweite Schicht ist die Pseudocartridge-Schicht, da Axonbündel hier eine den Cartridges ähnliche Form ausbilden. Offensichtlich ist damit das Bündel der Rezeptoraxone R1-8 gemeint, die verdtrillt unter dem Ommantidien weiterziehen. Die Gliazellen weisen eine lange, horizontal ausgedehnte Struktur auf. 3.+ 4.) In der dritten und vierten Schicht befindet sich die Satelliten-Glia (distale und proximale Satellitten-Glia), die die Zellkörper (Somata) der monopolaren Lamina-Interneurone L1-L5 umhüllt. 5.) Die fünfte Schicht stellt das Lamina-Neuropil dar, in der Bündel aus Rezeptorterminalen und Interneuronen direkt von Gliazellen umhüllt sind. Zusätzlich bilden die Gliazellen Ausstülpungen in die Axone von R1-R6, was zum einen strukturellen Halt bietet. 6.) Die sechste Schicht ist die proximale Grenzschicht. Marginale Gliazellen bilden den Abschluss des Lamina-Neuropils und markieren damit die Wachstumsgrenze für die Axone von R1-R6. Die letzte Schicht wird nur noch von den Axonen der Fotorezeptoren R7 und R8 durchzogen, die direkt in die Medulla ziehen.
Die Zeilen-Nr. Z.2“79“ verweist mit Nerv=7 und seitlich=9 auf benachbarte Ommatdien. Die Zahl „2“ ist beim Menschen für das Sehen als 2. Hirnnerv nutzbar. Von den 8 Photorezeptoren werden „2“ (R7/R8) als „828“ geklammert, so dass die Rezeptoren R1-R6 mit Nachbarn (flexibel=verdrillt=66) verschaltet werden 16_66_1=Signal_61, paarige Struktur=05_50: Epi.Y!Fliege.Z.279#160322661061828. Wegen der Ähnlichkeit „661-0-6“ zu „6616“ ist die Verschaltung abgeschlossen und an der Kartusche liegen 6 fremde Photorezeptoren mit oben=9 an: Epi.Y!Fliege.Z.283#158056616382509. Eine Zeitdifferenz, beispielsweise Delta.Time=Z.279-Z.283=#2266“044“6793“191“2 (Fazit: Gruppe 044_Kante 1_9=seitlich_1), benötigt die Fliege für das Bewegungssehen, weil die Photorezeptoren keine Bewegungen erkennen. Die Fliege vergleicht benachbarte Photorezeptoren über einen Tiefpassfilter (Reichardt-Detektor) mit 2 spiegelsymmetrischen Untereinheiten. Die Spiegelsymmetrie „16_61 und paarig=2 für beide Augen sind vorhanden.
Die Fliege besitzt in jeder Säule 2 Detektoren, um über 2 Kanäle die Bewegung heller und dunkler Kanten zu unterscheiden. Zur Funktion der Kanäle werden der Neurotransmitter Histamin [C5H9N3=17 Atome] und Chloride [Chlor=17 Elektronen] benötigt, die beide mit der Zahl „17“ (Epi.Y!Fliege.Z.282#1586“17“100837766) im Zusammenhang stehen. Für den 2. Detektor wird eine weitere Bewegung als ein Zeilenbereich benötigt.
Die Drosophila kann die Säule „5000“ gleichwertig für Ommatidium und Kartusche als Zusammenhang erkennen, wenn die Anzahl von 800 Säulen enthalten ist. In der Zeitdifferenz Delta.Time=Zeile Z.142-Z.284=#15750007900088 bleibt die Säule „5000“ übereinstimmend erhalten. Für die Lamina ist eine 800er-Spiegelung „90_00880“ wegen der unsymmetrischen Nullen-Verteilung nicht gelungen. Die am rechten Zahlenrand fehlende Null kann aber der Quersumme QS 1+5+7+5+0+0+0+7+9+0+0+0+8+8+0=50 entnommen werden, so dass die Struktur=5 lesbar ist. Eine Null muss für den 90°-Winkel entnommen werden, weil die Lamina nicht im normalen Zeilenlauf (Norm-Scann), sondern als Quer-Scann durchfahren wird: Epi.Y!Fliege.Z.284#157500079000880. Für die Lamina muss zum Quer-Scann aller Kartuschen eine Gruppe „44“ gebildet werden. Weiterhin sind die Kreuzungen (Chiasma) der Eingangssignale darzustellen. Zu diesem Zweck werden die Lamina-Kartuschen als ein rautenförmiges, 4-eckiges Netzwerk „69_47_4=Viereck_47_1_44=Gruppe_737“ gebildet. Die 6 Rezeptoren-Axone liegen seitlich als „6_9=seitlich“ und mit „737=Nerv“ werden die wichtigen 3 der 5 Interneuronen L1-L5 adressiert. In der Mitte der Kartusche sind L1 und L2 zur Bewegungswahrnehmung angeordnet. Außen verknüpft L3 die Axone der Photorezeptoren R1-R6 mit den Interneuronen der Medulla. Querschnitt der Kartusche (Cartridge) siehe: „Cartoon of a single lamina cartridge (A), the lamina at the chiasma... | Download Scientific Diagram (researchgate.net)“: Epi.Y!Fliege.Z.285#156947447144737.
In der Fensterschicht umhüllen die Gliazellen als Extra=8 die Axone der 8 Rezeptoren R1-R8 und der Tracheen „02“. Der Zweck ist die Trennung von der im Körper frei fließenden Hämolymphe=26 (beim Menschen Blut wie Eisen=26). Eine solche Trennung gegenüber dem Nervensystem ähnlich der Blut-Hirn-Schranke symbolisiert die Zeilennummer Z. „2“_8_„6“: Epi.Y!Fliege.Z.286#156398679847028.
Der 2. Bewegungsdetektor kann wegen der gesuchten Zahl „17“ beispielsweise mit der Quersumme Zeilen-Nr. Z.QS 2+8+7=17 entwickelt werden. Eine spiegelbildliche Form ist als 37=Nerv_73 vorhanden, paarig=67_11_67 für beiden Augen. Die Bewegung endet, wenn die Zahl „17“ in der Zeile vorhanden ist. Das Histamin=17 wird frei gesetzt, weil die folgende Teilquersumme TQS 3+0+6+7+0+1=17 den rechten Zahlenrand bildet: Epi.Y!Fliege.Z.287#155853736711673 bis Epi.Y!Fliege.Z.291#1537114“17“306701. Delta.Time=Z.287-Z.291=#214231940497145 (Gruppe 4“0“4_Kante 1_QS 4+2+3=9=seitlich_1. Der Unterschied der beiden Detektoren ist in der Lage der Null zu erkennen, wobei mit „404“ eine verdeckte Gruppe 44 lochähnlich „404“ die hellen Kanten detektiert. Die beiden Bewegungsdetektoren sind funktionell den Neuronen L1/L2 zum Bewegungsehen zugeordnet.
Beim Zusammenbau der Kartusche liegen „2“ Interneuronen (L1/L2) im Zentrum und L3 als „1“ Interneuron im Viereck=4 außen als „42414“. Die „6“ Rezeptoraxone liegen als 7_6_7=Neuron im Ring außen. Paarig=42_24. Für die Umhüllung durch Gliazellen=24 wurde bei der Medulla ein Zusammenhang mit den „24“ Atomen des Zuckers C6H12O6 festgestellt, der als Schleimzucker abgesondert wird: Epi.Y!Fliege.Z.290#154241456676724. Zur „4“-eckigen Kartusche gehören außen als Paar 71_17=Axon und Zählgröße „11“ die beiden zur Medulla durchlaufenden Axone von R7/R8. Die kleinen Neurone L3/L5 fehlen noch: Epi.Y!Fliege.Z.291#153711417306701. Nach der Fensterschicht folgt als 2. Schicht die Pseudocartridge-Schicht. Diese bildet Axonbündel „111_7“ aus, die den Cartridges ähnlich sind. Mit „4_9_4“ kann sich eine verdeckte Gruppe 44 bilden, die eine Schicht lediglich avisiert, weil paarig=2 oder ähnlich fehlt: Epi.Y!Fliege.Z.296#151114940663007. Eine Säule „1000“ ist darstellbar in Epi.Y!Fliege.Z.300#149100074787500. Das Schichtende kann vorliegen, wenn paarig=72_27=Nerv vorliegt: Epi.Y!Fliege.Z.301#148604725701827.
Die Kartuschen laufen schalenartig auf einen zentralen Kreuzungspunkt zu. Die Lamina benötigt für die Krümmung den Bixnom-Kreis=64. Diese 3 Zeilen werden der 3. Schicht mit einer enthaltenen distalen Satelliten-Glia (Satellite glial cells) zugewiesen. Die „64“ ist 3-mal als Quersumme enthalten: Epi.Y!Fliege.Z.302 mit QS 1+4+8+1+1+2+6+5+7+0+7+3+6+7+6=64, Epi.Y!Fliege.Z.303 mit QS 1+4+7+6+2+3+8+3+6+4+2+3+2+6+7=64 und Epi.Y!Fliege.Z.304 mit QS 1+4+7+1+3+8+2+3+1+6+9+8+1+9+1=64. Die 4. Schicht mit einer proximalen Satelliten-Glia kann dann mit der Bixnom-Gegenform=46 zugewiesen werden. Die Zahl „46“ ist in 2 Zeilen und abschließend in 1 Zeile als Teil-Quersumme 0+0+3+9+8+8+1+5+1+4+7=46 enthalten: Epi.Y!Fliege.Z.305#1“46“655811266394, Epi.Y!Fliege.Z.306#1“46“176543909314 und Epi.Y!Fliege.Z.307#1457“00398815147“. In der 5. Schicht werden im Lamina-Neuropil Bündel von Nervenzellen durch Gliazellen, paarig=227_55_722, umhüllt. Die Gliazellen werden im Zusammenhang mit Schleimzucker=24 adressiert: Epi.Y!Fliege.Z.308#145227345572240. In der 6. Schicht sind die zur Medulla durchlaufenden Photorezeptoraxone R7/R8 als „7_5_7“, paarig=2, enthalten. Die Lamina enthält außer den Photorezeptoren 12 weitere neuronale Zelltypen. Zur Medulla laufenden davon die 5 Lamina-Output-Neuronen L1-L5, Rückkopplungsneuronen (Feedback-Neuronen) C2, C3 und T1 sowie Lamina-Weitfeldneuronen (Lawf1, Lawf2) weiter (siehe: „Contributions of the 12 neuron classes in the fly lamina to motion vision - PMC (nih.gov)“;M- Reiser/ Neuron. 2013 Jul 10; doi: 10.1016/j.neuron.2013.05.024): Epi.Y!Fliege.Z.309#144757354162621.
Nach der Zuweisung von 6 Lamina-Schichten müssen nunmehr 3 Zeilen eine Kreuzung (Chisma) der neuronalen Prozesse vor dem Übergang zur Medulla erkennen lassen: Die Gesamtheit der Neuronen wird als Gruppe 44_2=paarig dargestellt. Die Kreuzung über 3 Zeilen erfolgt dadurch, dass die Gruppe „44_2“ zum rechten Zahlenrand durchläuft. Die Krümmung=64 ist in allen 3 Zeilen enthalten. Davon ist der Kreuzungsmittelpunkt eine Zählgröße 11=QS 3+8_2=paarig_64=Punkt_38=QS 3+8=11. Die Zählgröße ist auch in der Zeilen-Nr. 3“11“ enthalten. Die Axone der Gruppe „44“ spiegeln sich x-förmig als 65_4=räumlich_5=Stuktur_6=flexibel: Epi.Y!Fliege.Z.310#144290394955645, Epi.Y!Fliege.Z.311#143826438701769 und Epi.Y!Fliege.Z.312#143365456526442.
2.4.2) Optische Kreuzungen (Chiasma)
Erste optische Chiasma: Die Drosophila kann die Information des Facettenauges nicht direkt im unpaarigen Zentalhirn (CB) verarbeiten, sondern muss zunächst einen Zeilenbereich durchlaufen, der von der Evolution interpretiert wird. Als geometrische Merkmale sind 2 Kreuzungen (Chiasma) vorhanden. Es handelt sich vergleichsweise nicht wie beim Menschen um eine Kreuzung der Sehbahn mit einer gekreuzten visuellen Wahrnehmung der Augen im Gehirn als eine Spiegelung von 3 Ziffern „XYZ_ZYX“. Bei der Drosophila bezieht sich die Kreuzung nur auf das Auge selbst, in dem beim Übergang von Lamina zur Medulla lediglich die Speicherorte von vorn (anterior) nach hinten (posterior) und umgekehrt vertauscht werden. Durch die kurvenartige Formgebung 64/46 werden das Lamina-Ende und der Medulla-Anfang zopfartig in einem Punkt verschnürt, der die Kreuzungsstelle ergibt. Hierbei handelt es sich nicht um eine Formeinschnürung „707=Form“ wie zwischen Kopf und Thorax, denn die Kreuzungsstelle ist paarig. Gezählt werden somit mit „070“ die beiden äußeren Kerben als Einschnürung. Die Kreuzungsstelle wird durch 3 Ziffern ohne Spiegelung „XYZ_XYZ“ angezeigt. Der Sehlappen wird nicht im Norm-Scann längs der Körperachse, sondern als Quer-Scann durchlaufen. Für den abweichenden Quer-Scann muss als Ausnahme eine Sehlappen-Gruppe „44_2=paarig“ mit einem „90°“-Winkel als „44290“ gebildet werden. Weiterhin müssen die Struktur „55“ und der Bixnom-Keis „64“ zum Anschluss an das gewölbte Facettenauge sowie „9_4=räumlich bzw. 4 Neuropils_9=seitlich“ enthalten sein: Epi.Y!Fliege.Z.310#144290394955645.
Zweite optische Chiasma (siehe: „The Organization of the Second Optic Chiasm of the Drosophila Optic Lobe - PMC (nih.gov)“; K. Shinomiya / Okt. 2019 / Front Neural Circuits / doi: 10.3389/fncir.2019.00065.): Der Quer-Scann zieht lotrecht quer durch die Fliege. Um die Aufspaltung des Lobula-Komplexes erkennen zu können, muss der Quer-Scann (mit der Flugkunst einer Fliege) erneut um 90° gedreht werden. [siehe: https://www.spektrum.de/lexikon/neurowissenschaft/drosophila-nervensystem/3031. Dadurch wird eine Dreiecksbeziehung aus der Medulla als Zeilen-Nr. Z. „XYZ=335“ und einem Duo in der Zeile als „XYZ_XYZ=335_335“ für die parallel zueinander liegende Lobula (LO)- und Lobulaplatte (LOP) adressiert: Epi.Y!Fliege.Z.335#133522455033582. Für die Ausnahme vom lotrechten Quer-Scan in eine horizontale Quer-Scann-Ebene muss eine Lobula-Gruppe „44“ über die Zeilen-Nr. Z.3“44“, paarig=2, mit einem „90°“-Winkel gebildet werden: Epi.Y!Fliege.Z.344#130029134989099.
2.4.3) Medulla (ME): An der Engstelle Lamina / Medulla zeichnen sich im Gewebe nebeneinander 2 dunkle „Tintenkleckse“ „0_7=Form“ und etwas länger „007“ ab, die jeweils eine eigene Zeile beanspruchen, weil der Scann quer durchzieht. Es handelt sich um eine Anhäufung von Gliazellen, die das bakterielle Enzym β-Galactosidase exprimieren. β-Galaktosidasen sind Enzyme, die endständige, glycosidisch gebundene β-D-Galactose von Biomolekülen hydrolytisch abspalten. Galactose (Schleimzucker) entspricht der Zucker-Formel „C6H12O6“. Weil Zucker kein besonderes chemisches Element enthält, werden nur die 24 Atome gezählt als Galactose=“24“= circadianer Rhythmus = 24 Stunden=Zeit. Weil noch ein dritter Tintenklecks aus Schleimzucker folgt, ist diese Interpretation als zutreffend prüfbar: Epi.Y!Fliege.Z.313#142907419924121 und Epi.Y!Fliege.Z.314#142452300752389. Aufgrund der Formeinschnürung zwischen Lamina und Medulla legt sich eine äußere Umhüllung als Volumen „2000“ um die Medulla und den Lobula-Komplex, der die Formeinschnürung etwas überragt und daher zuerst erscheint. Die parallelen Säulen der Medulla sind darin eingebettet: Epi.Y!Fliege.Z.315#142000071226191. Beidseitige Einkerbung „0“ als Formeinschnürung „Struktur=55_070“. Die Bixnom-Schwerkraft=84 (Kreis=64+Calcium=20; wie Bogengang des Menschen mit Ca-Stein) steht als Bezug für das Gleichgewicht, paarig „1_2_1_84“, zur Verfügung: In die Medulla laufen 10 neuronale Prozesse [2 Photorezeptor-Axone (R7, R8), 5 Lamina-Terminals (L1-L5) und Neuriten von T1, C2 und C3]. Weil die nachfolgende Zahl 10 bereits für die 10 Schichten der Medulla Me1-Me10 benötigt wird, muss die Quersumme der Zeilen-Nr. Z.3+1+6=10 mit Nerv=7 gezählt werden. In der Literatur werden zusätzlich noch 2 Lamina wide-field Neuronen (Lawf1, Lawf2) genannt, die mit „1_2_1“ zu insgesamt „12“ Prozessen summiert werden können: Epi.Y!Fliege.Z.316#141550703912184.
Beim Quer-Scann werden die 10 Schichten der Medulla durchlaufen. Die Anzahl „10“ wird mit der Zählgröße 11, paarig=„14_110_41“ kombiniert (siehe: „From The Eye To The Brain: Development Of The Drosophila Visual System - PMC (nih.gov)“; N. Neric & C. Desplan / Curr Top Dev Biol. /2016/ doi: 10.1016/bs.ctdb.2015.11.032). Das zunehmende (Inkremente) oder abnehmende (Dekremente) Licht wird in zwei parallelen Strömen verarbeitet. Die L1-Neuronen schalten den ON-Weg (Spot AN=“hell“) und die L2-Neuronen schalten den OFF-Weg (Spot AUS=“dunkel“) zur Bewegungserkennung heller und dunkler Kanten. Die Axone der Photorezeptoren setzen den Neurotransmitter Histamin frei, der die Chloridkanäle in L1 und L2 öffnet [„Fly photoreceptors release from their axons neurotransmitter histamine which opens chloride channels on the L1 and L2 neurons and hyperpolarizes them (Hardie 1989, Gisselmann et al., 2002; Zheng et al., 2002)“]. Chloride als Verbindungen von Chlor=17 adressieren somit das Licht. Für gewöhnliche Feld-Wald und Wiesen-Moleküle wie Schleimzucker C6H12O6=24=Zeit wird nur die Anzahl der Atome gezählt. Vergleichsweise gilt somit auch für Histamine C5H9N3=17, womit der Funktionszusammenhang mit den Chloriden ersichtlich ist (siehe: „Neurotransmitters in the neuronal circuit for motion vision in Drosophila melanogaster (uni-muenchen.de)“; K. Pankova / Diss. , Mai.2017). Für die Dopplung „1717“ der Zahl „17“ (auch in der Zeilen-Nr. Z.3“17“) kann einerseits die Anzahl von „17“ Medulla-Zellen in einer der 27 Medulla-Säulen und andererseits das Chlor=17 für das Licht in Betracht kommen [siehe: „https://Synaptic circuits and their variations within different columns in the visual system of Drosophila | PNAS“; Shin-ya Takemura u.a. / Okt.2015 / doi.org/10.1073/pnas.150982011]: Epi.Y!Fliege.Z.317#141104171723186. Beim Quer-Scann werden die Säulen der Medulla passiert. Daher muss für die Anzahl der „27“ Medulla-Säulen eine Säulen-Gruppe „44“ gebildet werden. Diese Zeile wird bereits als 1. Medulla-Schicht (Me1) gezählt, weil die Wellenlänge der direkt angeschlossenen Rezeptoren R7/R8 in Me3 + Me6 etwa passend sein soll. Me1: Epi.Y!Fliege.Z.318#140660447912736. Die Schichten Me1-Me6 werden als äußere (distale) Medulla bezeichnet. In die Schicht Me3 projizieren die Photorezeptoren R7 der Retina. Der Rezeptor R7 enthält Rhodopsin entweder Rh3 mit 331...345*nm oder Rh4 mit 355...374*nm und ist gegenüber dem UV-Licht empfindlich. Nahes UV-Licht liegt unterhalb 315 nm. In der Zeile sind „320“ nm und „328“ nm als Zählgröße 11 enthalten. Me3: Epi.Y!Fliege.Z.320#139781320113281. In die Schicht Me6 projizieren die Photorezeptoren R8 der Retina. Der Rezeptor R8 enthält entweder Rhodopsin Rh5 mit 437*...442nm oder Rh6 mit 508*...515nm [*nm lt.Wiki]. In der Zeile sind „415“ nm und „483“ nm enthalten: Me6: Epi.Y!Fliege.Z.323#138483041598297. Die dickste Schicht Me7 trennt die distale von der proximalen Medulla und wird als Serpentinschicht bezeichnet. Mit „777“=Form=Nerv werden die Tangentialneuronen adressiert, die durch die Schicht laufen, um alle Medulla-Säulen miteinander zu verbinden. Der Nerv „720“ (Nerv=7, paarig=2, unterhalb der Säulen „0“) kann über 3 Zeilen laufen, bis eine Kombination Physik=63_720 zur teilweisen Direktverbindung in das Zentralhirn (CB) erscheint: Epi.Y!Fliege.Z.326#137208657779908 und Epi.Y!Fliege.Z.328#136372019622714. Die proximale Medulla (Me8-Me10) belegt 3 Zeilen. Me10 enthält den Token-86 oder in anderer Lesart das Gruppenende 9_44 mit der konkaven Krümmung=64 der Medulla: Epi.Y!Fliege.Z.331#135136019444864.
Das Richtungssehen [nach Links=1, Rechts=2, Oben=9, Unten=? mit Bixnom-Physik=63 oder Bixnom-Gravitation=84] wird in der Lobulaplatte in einer Matrix aus einer OFF-Kanal-Spalte mit 4 Elementen und einer ON-Kanal-Zeile mit 4 Elementen ausgelesen. Diese Mathematisierung ist nur möglich, weil die Drosophila in den wenigen Medulla-Zeilen der 10 Schichten ein verstecktes System erkennt, dass dann zwangsweise verschaltet wird. Beispielshaft wird dieses System im Zeilenlauf gesucht: Das Lamina-Ausgangsneuron L1 muss gleichzeitig 2 Neuronen (Mi1; Tm3) im ON-Kanal schalten; L3 muss gleichzeitig 1 Neuron im ON-Kanal (Mi9) und 1 Neuron (Tm9) im OFF-Kanal schalten. Etwa so böswillig erzwungen, wie die Software-Entwickler es verhindern, dass der Nutzer seinen farbigen Text auf die eigene Homepage hochladen kann.
In der Medulla werden mittels der Lamila-Ausgangsneuronen L1-L5 die beiden Kanäle ON und OFF für die Richtungserkennung durch spezielle Medulla–Neuronen weiter entwickelt: a) Intrinsische „Mi“-Neuronen verbinden verschiedene Schichten der Medulla miteinander. b) Trans-Medulla "Tm"-Neuronen verbinden spezifische Schichten der Medulla mit verschiedenen Schichten in der Lobula und c) Trans-Medulla-Y „TmY"-Neuronen verbinden spezifische Schichten der Medulla mit verschiedenen Schichten in der Lobula und Lobulaplatte. Für den OFF-Kanal werden 4 Medulla-Schichten mit der Lobula verbunden (Tm1, Tm2, Tm4 und Tm9). Für den ON-Kanal werden 3 Schichten innerhalb der Medulla und eine Medulla-Schicht mit der Lobula verbunden (Mi1, Mi4, Mi9, Tm3). Im Ergebnis muss für Berechnungen in der Lobulaplatte eine 4x4-Matrix aus einer Neuronen-Zeile T4 von der Medulla und einer Neuronen-Spalte T5 von der Lobula entstehen. Als Matrix wachsen T4/T5 für die bevorzugte Richtung (links, rechts, hoch, herunter) entsprechend tief in die Lobulaplatte ein (siehe: „How fy neurons compute the direction of visual motion“/ A. Borst u.a / Journal of Comparative Physiology A (2020) 206:109–124/ https://doi.org/10.1007/s00359-019-01375-9; Wie Fliegenneuronen die Richtung der visuellen Bewegung berechnen | SpringerLink).
Wo ist das Richtungssystem versteckt? Die 4 Elemente des ON-Kanals entstehen über die Zeilennummer. Die inneren Medulla-Verbindungen Mi1, Mi4, Mi9 sind vorhanden, wenn entweder der Nerv=7 als Ziffer vorliegt oder als Quersumme gebildet wird. Die Medulla-Lobula-Verbindung Tm3 ist in der Zeilennummer nicht als „7“, sondern nur als Brücke Z.323 zu finden, so dass die Zahl 7 dann in der Zeile selbst zu lesen ist. Die 4 Elemente des OFF-Kanals entstehen, wenn der Nerv=7 in der Zeile vorhanden ist und das Licht als Dopplung XY_XY blockiert wird (Gegensatz zur Spiegelung XY_YX). In beiden 4er-Gruppen müssen dann jeweils die Richtungsmerkmale (1/2/9/63 oder 84) erkennbar sein.
ON-Kanal: 1.) Mi...: Z. QS 3+2+2=7=Nerv. Richtung nach oben=9 (bestätigt über die Zählgröße 11 mit 3x3=9). Mit der „Null“ als durchsichtiges Loch kann die Dopplung 56_0_56 (5+6=11) nicht für den OFF-Kanal gelesen werden: Epi.Y!Fliege.Z.322#138913113156056. 2.) Mi...: Z.3„2“=Rechts_“7“=Nerv, Richtung nach rechts=2 und in der Zeile 2x7=Nerv und 2xNull=durchsichtig: Epi.Y!Fliege.Z.327#136789059438073. 3.) Mi...: Z. QS 3+3+1=7=Nerv; Richtung nach links=1 in der Zeile 13_13 gespiegelt zur Zeilen-Nr. Z.3_“31“ und die Ziffer „1“=links als durchsichtig „01“.: Epi.Y!Fliege.Z.331#135136019444864. 4.) Tm...: Z.323=Brücke; Nerv=7 am rechten Zahlenrand. Richtung nach unten=84=Bixnom-Gravitation. Wegen der Spiegelung 38_4_83 wirkt eine Markierung, so dass Ziffern 1 und 2 als nachrangig überlesen werden. Durchsichtig mit der QS 3+0+4=7=Nerv am Loch=0: Epi.Y!Fliege.Z.323#138483041598297. Die neuronale Verschaltung des ON-Kanals zeigt eine Besonderheit: Von der Medulla werden mittels der Neuronen in jeder Säule 4 Typen richtungsabhängiger T4-Zellen für die Matrix-Zeile der Lobulaplatte gebildet. Eine Zelle kann mit der Hautmembran=33 symbolisiert werden. Als Vorstufe ist die Ziffer „3“ 2-fach in den Zeilen enthalten. Vergleichsweise wird für die 4 Typen richtungsabhängiger T5-Zellen erst der Weg über die Lobula benötigt, die die „33“ in der Zeilennummer bereitstellt.
OFF-Kanal: 1.) Tm...: Block 81_81, Richtung nach oben=9_7=Nerv. Zählgröße 11 zählt QS 8+1=9=oben. Weiterer Verdunkelungsblock 32_32 vorhanden: Epi.Y!Fliege.Z.320#139781320113281. 2.) Tm...: Block 38_38, Nerv=7_63=Richtung nach unten als Physik=63. Der Block QS 3+8=11 enthält die Zählgröße 11. Aus 838_38 mit „8_Summe 38+38=76“ folgt als Gesamtsumme 84=Gravitation. Alternativ 63 + 11 + 10 (aus Z.QS 3+2+5=10) = 84: Epi.Y!Fliege.Z.325#137630838265385. 3.) Tm...: Nerv=7 und die Richtung nach rechts=2 sind als Spiegelung 72_27 gekoppelt. Damit eine Block 27_27 erkannt werden kann, muss die Zahl „7“ in der Zahl 72_0 mit dem Problemlöser Physik=63 den Platz mit der Null tauschen in „63_7_2_0“. Beispielsweise muss das Lamina-Neuron L3 entscheiden, ob gerade der ON-Kanal für Mi9 oder der OFF-Kanal für Tm9 geschaltet werden muss: Epi.Y!Fliege.Z.328#136372019622714. 4.) Tm...: Die Richtung nach links=1 kann ebenfalls nicht in Perfektion erkannt werden, weil 2 Zeilen notwendig sind. Vergleichsweise muss das Neuron Tm2 von den beiden Lamina-Neuronen L2 und L4 geschaltet werden. Der Nerv=7 ist in „5_Nerv=7_5_links=1_5“ mit der Zahl „1“ über eine Struktur 5_5_5 gekoppelt. Der Struktur-Block 55_4_55 erscheint aber erst in der Folgezeile: Epi.Y!Fliege.Z.329#135957515003799 und Epi.Y!Fliege.Z.329#135545522534091.
2.4.4) Lobula-Komplex (LOX): Ein großer „Tintenklecks“ liegt hinter der Medulla und trennt die gleichzeitig entstehende Lobula (LO) von der Lobulaplatte (LOP). Der Zellhaufen „700“ enthält bereits die Galactose (Schleimzucker)=24=Zeit, die dann in der Folgezeile am rechten Zahlenrand abgesondert wird. Epi.Y!Fliege.Z.333#134324391700451 und Epi.Y!Fliege.Z.334#133922222863024.
Das zweite optische Chiasma wird als Dreiecksverhältnis der Medulla (ME) mit der Zeilen-Nr. Z.“335“ und der Zahlendopplung „335_335“ für Lobula (LO) und Lobulaplatte (LOP), paarig=2, avisiert: Epi.Y!Fliege.Z.335#133522455033582.
2.4.4.1) Die Lobula (LO) ist gemäß Zeilen-Nr. Z.33“6“ in 6 Schichten gegliedert. Die Details des Säulenaufbaues quer zu den Schichten sind momentan nicht bekannt. Die Schichten werden beim Quer-Scann gleichzeitig längs durchfahren, so dass eine Gruppenbildung „44“ kombiniert als Struktur „4554“ notwendig ist. In paarig=13_31_66 sind die 6 Schichten enthalten: Epi.Y!Fliege.Z.336#133125066774554. Bevor die Lobulaplatte beginnt, liegt noch ein Gewebe-Volumen „3003“. Die Zeilen-Nr. Z.337 ist als Zusammenhang nachfolgend in der Lobulaplatte zu finden: Epi.Y!Fliege.Z.337#32730036902819. Die Lobulaplatte (LOP) besteht aus 4 Schichten, die ebenfalls gleichzeitig durchfahren werden. Es ist eine Gruppenbildung 44, paarig=2 notwendig. Die Gruppe „444“ kann sich darauf beziehen, dass 2 der 4 Schichten jeweils eine Untergruppe mit 4 Schichten bilden, d.h. „4448“ zeigt die 8 Untergruppen: Epi.Y!Fliege.Z.338#132337344485947. Für die Gruppen 44 in der Zeilen-Nr. 3“44“ wird der Querscann um 90° in die Horizontale gedreht, damit die sich kreuzenden Verschaltungen (Chiasma) sichtbar werden: Epi.Y!Fliege.Z.344#130029134989099. Das Chiasma von anterior nach posterior und umgekehrt ist als Dopplung „652_652“, paarig=2 offenbar abgeschlossen.
Für das Richtungssehen müssen 4 Typen von Tangentialzellen als T5-Zellen „33“ erzeugt werden: 1.) T5-Zelle=33 in Z.Nr. „33“6 und in Richtung nach links=1 in „1331“ sowie Nerv=77: Epi.Y!Fliege.Z.336#133125066774554. 2.) T5-Zelle=33 und Nerv=7 in Z.Nr. „33“7 . In der Zeile “Nerv=7_3003“ ähnlich „33“. In Richtung nach oben=9 am rechten Zahlenrand: Epi.Y!Fliege.Z.337#132730036902819. 3.) T5-Zelle=33 in Z.Nr. „33“8. Nerv=7 und in Richtung nach rechts=2 mit „33“ markiert als „3“2“33“7“3“. Nerv=7 am rechten Zahlenrand: Epi.Y!Fliege.Z.338#132337344485947. 4.) T5-Zelle=33 in Z.Nr. „33“9. Die Richtung nach unten=84 wird durch die Bixnom-Gravitation=84 angezeigt. Die 4 T5-Zeilen bilden eine geordnete Spalte für die Verwendung in der Lobulaplatte. Als Mangel fehlt der Nerv=7. Es muss somit eine Verbindungsleitung zur Lobulaplatte (LOP) durch ergänzende Zeilen angelegt werden: Epi.Y!Fliege.Z.339#131946968838496. Der Nerv=7 folgt mit Z.QS 3+4+0=7=Nerv: Epi.Y!Fliege.Z.340#131558889518382. Erst in der Folgezeile entsteht die 33. Als EXTRA=8 in Z.3+4+1=8 ist die Futterquelle als Token=86 enthalten. Das Fliegenmännchen „33“ kann mit 2x 33 das Weibchen=66 registrieren. Die Physik=63 ist enthalten, um beispielsweise ein geeignetes Temperaturniveau zu halten. Bei Gefahr „macht die Drosophila die Fliege“ – sie flüchtet, und zwar mit der Gegenkrümmung „46“ zum Bixnom-Kreis=64 als Quersumme QS 1+3+1+1+7+3+0+8+6+3+2+3+3+1+4=46. Die Drosophila überträgt die Informationen mit der Frequenz von 1 Hz, wofür die Zeit=60 Sekunden verständlich wäre. Vorhanden sind aber nur „30“, so dass für Signale des T4-Types ebenfalls noch „30“ als Zeit verfügbar sind. Die relativ langsame Verarbeitungszeit der Neuronen bezieht sich auf Messungen beim Richtungssehen [siehe: „Neural Circuit Components of the Drosophila OFF Motion Vision Pathway - ScienceDirect“; A.Borst u.a./ Current Biology, Feb 2014/ https://doi.org/10.1016/j.cub.2014.01.006]. Diese Extras=8 müssen dem Gehirn als Zweck für das Richtungssehen im Paket „Zählgröße=11_7=Nerv_30863233“ übermittelt werden: Epi.Y!Fliege.Z.341#131173086323314. Insgesamt verarbeitet die Fliege blitzartig 250 Bilder/Sek.(Mensch 60 Bilder/Sek.).
Visuelle Projektionsneuronen (VPNs) stellen die Verbindung zwischen der Verarbeitung im Sehlappen (Lobus opticus) und dem Zentralgehirn her. Eine Klasse der Drosophila-VPNs bilden 22 verschiedene LC-Typen [lobula columnar (LC) Zellen]. Im ventrolateralen Zentralgehirn werden die Informationen innerhalb von „optischen Glomeruli“ verarbeitet, insbesondere im hinteren ventrolateralen Protocerebrum (PVLP) und im posterioren lateralen Protocerebrum (PLP) [siehe: „Visual projection neurons in the Drosophila lobula link feature detection to distinct behavioral programs | eLife (elifesciences.org)“; Wu, Nern u.a./ Dez.2016 / https://doi.org/10.7554/eLife.21022.001]. Die Vielzahl der LC-Typen ist im Zeilenlauf nicht verfügbar, so dasss mit dem Netzwerk „444“, dem Nerv=7 am rechten Zahlenrand und der Zahl „33“ als Zellensymbol eine Referenzzeile zur Bildung einer Kettenreaktion mit dem Divisor n=1 bis x genutzt wird, um Zellen zu erzeugen. Es können dann 22 LC-Typen gelesen werden, die den Nerv=7 und die Zelle „33“ enthalten. LC-Nr.1 ist somit in der Referenzzeile enthalten: Epi.Y!Fliege.Z.338#132337344485947. LC-Nr.3 entspricht LC Nr.1, weil die Referenzzeile durch 10 dividiert wird, was die Ziffernfolge nicht ändert. Zuletzt folgt mit dem Divisor n=164 LC-Nr.22=#80693502735333. Einige LC-Typen sind an der Auslösung von Fluchtreaktionen beteiligt, wie rückwärtsgehen, im Flug abheben etc.
2.4.4.2) Die Lobulaplatte (LOP) führt die Signale der jeweils 4 Tangentialzellen T4 von der Medulla und T5 von der Lobula als Eingangssignale einer Matrix 4x4 zusammen. Die Matrix-Zeile T4 reagiert als ON-Kanal auf die Bewegung heller Kanten und die Matrixspalte T5 reagiert als OFF-Kanal auf die Bewegung dunkler Kanten. Entsprechend der bevorzugten Richtung (links, rechts, hoch, herunter) wachsen die Zellen entsprechend tief in die Matrix ein. Für eine Matrix ist ein Ordnungssystem erforderlich. Dieses ist ab Zeile Z.340 aufgrund der Teilquersumme Z.QS3+4=7=Nerv_x stets vorhanden. Weil keine weiteren Zeilen zur Verfügung stehen, muss die Lobulaplatte über 7 weitere Zeilen zwangsweise gebildet werden. Als Ordnungssystem ist erkennbar, dass der erste Block aus 4 Zeilen eine Spiegelung XY_YX enthält, was für die Matrix-Zeile der T4-Zellen im ON-Kanal spricht. Der zweite Block aus 4 Zeilen eine Vedunklung als ungespiegelter Block XY_XY enthält, der übereinstimmend der Adressierung der T5_Zellen für Matrix-Spalte im OFF-Kanal dient. Weil jede Eingangsgöße als Spiegelung oder Block 2 Werte enthält, sind insgesamt 16 Werte vorhanden, um in die 16 Matrixpositionen nach der bevorzugten Richtung einzuwachsen.
ON-Kanal als Matrixeingang mit 4 T4-Zellen der Zeile=Z1:
Matrix Z1/1 mit 15_51 als T4_Zelle: Epi.Y!Fliege.Z.340#131558889518382.
Matrix Z1/2 mit 13_31 als T4_Zelle: Epi.Y!Fliege.Z.341#131173086323314.
Matrix Z1/3 mit 78_87 als T4_Zelle: Epi.Y!Fliege.Z.342#130789539287281.
Matrix Z1/4 mit 82_28 als T4_Zelle: Epi.Y!Fliege.Z.343#130408228677114.
ON-Kanal als Matrixeingang mit 4 T5-Zellen der Spalte=S1:
Matrix S1/1 mit 13_13 als T5_Zelle: Epi.Y!Fliege.Z.344#130029134989099.
Matrix S1/2 mit 652_652 als T5_Zelle: Epi.Y!Fliege.Z.345#129652238945652.
Matrix S1/3 mit 92_92 als T5_Zelle: Epi.Y!Fliege.Z.346#129277521492052.
Matrix S1/4 mit 28_28 als T5_Zelle: Epi.Y!Fliege.Z.347#128904963793228.
Die 4 Richtungen sind wissenschaftlich in der Reihenfolge einer Bewegung nach links(=1), rechts(=2), oben(=9) und unten(=?_84)) nachgewiesen worden. Erkennbar ist hier lediglich die Reihenfolge nach oben, rechts, links und unten. Diese Reihenfolge muss zwanghaft gleichgeschaltet werden, wenn der rechte Zahlenrand unpassend für eine Richtungswahl ist. T4 dominiert die Gleichschaltung „links“ und „unten“ in T5. T5 dominiert die Gleichschaltung nach „oben“ und „rechts“ in T4. Matrix Z1/1: Oben= 9 in 888_9. Zahl 9 wird in 888_9_51_8 als 898 markiert, wenn der Block 51 überlesen wird; Matrix Z1/2: Rechts=2 markiert in „323“; Matrix Z1/3 Links=1, Zahl 1 am rechten Zahlenrand; Matrix Z1/4 Unten=84, Bixnom-Gravitation "84" als Zählgröße 11 mit 8_2+2=4=84. Matrix S1/1: Oben= 9, Zahl 99 am rechten Zahlenrand; Matrix S1/2: Rechts=2, Zahl 2 am rechten Zahlenrand; Matrix S1/3: Links=1; Zahl 1 am linken Zahlenrand (rechter Rand=2 bereits vergeben): Matrix S1/4: Unten=Physik=63 als Problemlöser mit der Spiegelung „228“ der Gravitation „8_2+2“ von T4.
Für die Lobulaplatte (LOP) sind weitere 2 Zeilen vorhanden: Epi.Y!Fliege.Z.348#128534547230604 und Epi.Y!Fliege.Z.348#128166253398997. Die räumliche Fluglage wird im nachfolgenden Ellipsoidkörper (EB) des Zentralhirns im Kreis aus 16 „Tortenstücken“ abgebildet. Die Elemente von „4“ und „90°“ als Kreis 4*90°=360° und der Bixnom-Kreis=64 sowie Stickstoff=7 als Neurotransmitter für den 4-Sekunden-Kurzzeitspeicher der Fluglage sind mit dem Chiasma als Referenzzeile in Time.Z.335-Z.348=#“4“98“7“90“7“8029“7“8“64“ lesbar. Die 16 EB-Kreiselemente bzw. Schwefel=16 in H2S als alternativer Neurotransmitter, Physik=63 und die Gravitation=84 sind in Time.Z.335-Z.349=535620“16“345“84“96 als Ausgangsinformation lesbar.
[Interessante Frage: Weshalb wird eine Arterie mit der Ziffer 9 = oben adressiert? Wird die Quersumme aus Physik=63 mit 6+3=9 für das Hochpumpen des Blutes im Herz über die Aorta=9 erkannt, ist die Gravitation=84 der freie Fall nach unten eine Gegenrichtung. Die Vene=8 ist dann ein Extra=8, um das Blut wieder zum Herz zu leiten.]
3.) Frontalansicht des Kopfes
3.1) Vibrissen: Am Kopf sind zwischen der Antenne und dem Maxilar Palp einige Tasthaare (Oral vibrissa / Vibrissae) ausgebildet. Bei der Fliegenart „Drosophila suzukii“ (gefleckte Flügeldrosophila / Essigfliege) sind „3“ Vibrissen „11“ je Seite vorhanden (Siehe x) PM 7/115 (1) Drosophila suzukii - 2013 - EPPO Bulletin - Wiley Online Library ). Mit paarig=98_89 wird wegen seitlich=9 bewirkt, dass sich die Vibrissen über die Mittelachse hinweg kreuzen können: Epi.Y!Fliege.Z.124#360725987389113.
3.2) Clypeus: Die Mundöffnung mit den Mundwerkzeugen wird bei den Insekten durch den schildförmigen Clypeus als eine unpaarige „1“ Sklerit-Platte „oben=9_0000“ überdeckt. Bei den Fliegen wird der Bereich durch eine Naht am Gesicht angeschlossen oder gehört bereits zum Rüssel [siehe: x) https://www.giand.it/diptera/morph/?id=2&lang=en#clypeus ] Epi.Y!Fliege.Z.125#357840179490000. Innenseitig besteht eine Verbindung zu den Zibarialdilatatormuskeln „55“: Epi.Y!Fliege.Z.126#355000178065476. Der Clypeus „5_22=Sklerit“ ist ist durch eine frontoklypeale Naht „010_7“ mit dem Gesicht verbunden. Die Nahtformen sind unterschiedlich, so dass auch keine Kreisform=64 vorliegt: Epi.Y!Fliege.Z.127#352204901072835. Der untere (distale) Rand des Clypeus ist mit der Oberlippe (Labrum) durch ein Gelenk (Artikulation) oder eine Membran (Clypeal membrana) „5_33“ verbunden. Aufgrund der Kopfhaltung erscheint der untere Rand im Zeilenlauf (Scann) verspätet: Epi.Y!Fliege.Z.128#349453300283203.
3.3) Antennen (Antenna): Zwischen den Facettenaugen sitzt 1 kleines Keulenpaar, das als Antennen-Paar bezeichnet wird [siehe: File:Head-diptera-muscoidfly.gif - Wikimedia Commons] . Die Antenne besteht aus 3 Segmenten (Scape, Pedicel, Funiculus). Am Anfang des vorderen (distal) 3. Antennensegmentes (Funiculus) sitzt eine lange Fühlerborste (Arista) [siehe: Arista (insect anatomy) - Wikipedia ].
3.3.1) Arista: Die federförmig mit Haaren besetzte Fühlerborste ist in Segmente gegliedert, die als „Aristamere“ bezeichnet werden. Die Fliegen (Dipteren) bilden 2 kurze Segmente an der Basis und einem langen distalen Schaft [siehe: https://www.researchgate.net/figure/SEM-micrograph-of-the-antenna-of-adult-female-C-vicina-scape-S-pedicel-P_fig2_319286259 ].
Die Anzahl der Federhaare weicht bei Mutationen ab. Der natürliche Wildtyp der Drosophila besitzt ein Verteilungsmuster für die Verzweigungen am zentralen Kern der Arista: Auf der Vorderseite liegen 3-4 Zweige und hinter (posterior) 5-7. Das distalen Ende verzweigt in Gabelform [siehe „Role of programmed cell death in patterning the Drosophila antennal arista - ScienceDirect“; K.McCall/ Developmental Biology/2004)].
In der Arista liegt ein Ganglion von dem der Arista-Nerv (Nervus aristalis) durch den Schaft zieht. Weiterhin ist ein Gefäß zur Versorgung mit Hämolymphe am Funiculus angeschlossen [siehe: (PDF) Fine structure of sensory organ in the arista of Drosophila melanogaster and some other Dipterans (researchgate.net) / R.A.Steinbrecht /Cell Tissue Res (1989) 258:277-287]. Als aristale Sinnesorgane enden bei der Drosophila 3 gleichartige Sensillen im Hämolymphraum, bei Musca 12 und Calliphora 18.
Für die Arista stehen momentan nur 4 Zeilen (Z.1 bis Z.4) zur Verfügung, mit denen die Arista nicht umfassend beschrieben ist. Die Antenne selbst folgt erst später im Zeilenlauf, wobei unklar ist, wie sich Arista und Antenne zusammenfügen.
Zeile Z.1 als Nerven-Gruppe 44_7=Nerv=Form; paarig=2: Epi.Y!Fliege.Z.1#44730022436250000. Die Federhaare „11“ zeigen sich als gabelförmiges Haar-Paar gespiegelt 21_8=Extra_12 und mit Ziffer „2=paarig“ wie in der Zeilen-Nr.Z.2 für die linke und rechte Arista. Epi.Y!Fliege.Z.2#22365011218125000. Die Haargabel ist am Kern „1000“ der Arista „paarig=000_000“ befestigt. Epi.Y!Fliege.Z.3#14910007478750000.
Die Federhaare können mit „111“ als Reihe auf der Vorder- und Rückseite der Arista gebildet werden. Die 3 Aristamere, das Ganglion, Hämolymphe sowie die Anzahl der Federhaare sind nicht erfasst: Epi.Y!Fliege.Z.4#11182505609062500. Die Zeile 19 wäre wegen Übereinstimmung mit der Zeile 190 als Arista-Anschluss geeignet, aber „707“ wird als Mündung des Speichelganges benötigt. Ansonsten ist der Bereich geeignet Z.17 mit Sensille=1 und Nerv=7 enthält mit 3_11 die 3 Sensillen der Drosophila und das Ganglion 777 mit dem ausgehenden Nerv „7“ als 676=beweglich, paarig=63_36. Auch ohne Eisen=26 ist die Hämolymphe=26 mit enthalten: Epi.Y!Fliege.Z.17#2631177790367650. Es gibt den Herzschlauch und die Aorta, aber feine Blutgefäße (Blood vessel) hätte man in der Fliege nicht erwartet: „The blood vessel supplying the funiculus ends like a funnel, but gives off a branch that extands into the aristal lumen“ - Das den Funiculus versorgende Blutgefäß endet trichterförmig, gibt aber einen Ast ab, der in das Lumen aristal hineinreicht. Auch ein kleines „Blut“-gefäß kann in der Arista mit „500“ wie eine große Aorta=500 erscheinen. Eine überdimensionierte „Null“ kann man sich für eine Sprungmarke (Z.18-->Z.190) leihen und eine „Null“ verbleibt als Trennstelle: QS 2+4+8+5=19 und mit der angehängten „Null“ folgt Zeile Z.“190“ als Sprungmarke, so dass die inhaltsgleiche Zeile Z.19 für eine „mathematisch begabte Fliege“ nicht mehr benötigt wird. Insgesamt QS=55 als Struktur der Arista: Epi.Y!Fliege.Z.18#2485001246458330.
3.3) Antennen (Antenna): Zwischen den Facettenaugen sitzt 1 kleines Keulenpaar, das als Antennen-Paar bezeichnet wird [siehe: File:Head-diptera-muscoidfly.gif - Wikimedia Commons] . Die Antenne besteht aus 3 Segmenten (Scape, Pedicel, Funiculus). Am Anfang des vorderen (distal) 3. Antennensegmentes (Funiculus) sitzt eine lange Fühlerborste (Arista) [siehe: Arista (insect anatomy) - Wikipedia ].
3.3.1) Arista: Die federförmig mit Haaren besetzte Fühlerborste ist in Segmente gegliedert, die als „Aristamere“ bezeichnet werden. Die Fliegen (Dipteren) bilden 2 kurze Segmente an der Basis und einem langen distalen Schaft [siehe: https://www.researchgate.net/figure/SEM-micrograph-of-the-antenna-of-adult-female-C-vicina-scape-S-pedicel-P_fig2_319286259 ].
Die Anzahl der Federhaare weicht bei Mutationen ab. Der natürliche Wildtyp der Drosophila besitzt ein Verteilungsmuster für die Verzweigungen am zentralen Kern der Arista: Auf der Vorderseite liegen 3-4 Zweige und hinter (posterior) 5-7. Das distalen Ende verzweigt in Gabelform [ siehe „Role of programmed cell death in patterning the Drosophila antennal arista - ScienceDirect“; K.McCall/ Developmental Biology/2004)].
In der Arista liegt ein Ganglion von dem der Arista-Nerv (Nervus aristalis) durch den Schaft zieht. Weiterhin ist ein Gefäß zur Versorgung mit Hämolymphe am Funiculus angeschlossen [siehe: (PDF) Fine structure of sensory organ in the arista of Drosophila melanogaster and some other Dipterans (researchgate.net) / R.A.Steinbrecht /Cell Tissue Res (1989) 258:277-287]. Als aristale Sinnesorgane enden bei der Drosophila 3 gleichartige Sensillen im Hämolymphraum, bei Musca 12 und Calliphora 18.
Für die Arista stehen momentan nur 4 Zeilen (Z.1 bis Z.4) zur Verfügung, mit denen die Arista nicht umfassend beschrieben ist. Zeile Z.1 als Nerven-Gruppe 44_7=Nerv=Form; paarig=2: Epi.Y!Fliege.Z.1#44730022436250000. Die Federhaare „11“ zeigen sich als gabelförmiges Haar-Paar gespiegelt 21_8=Extra_12 und mit Ziffer „2=paarig“ wie in der Zeilen-Nr.Z.2 für die linke und rechte Arista. Epi.Y!Fliege.Z.2#22365011218125000. Die Haargabel ist am Kern „1000“ der Arista „paarig=000_000“ befestigt. Epi.Y!Fliege.Z.3#14910007478750000.
Die Federhaare können mit „111“ als Reihe auf der Vorder- und Rückseite der Arista gebildet werden. Die 3 Aristamere, das Ganglion, Hämolymphe sowie die Anzahl der Federhaare sind nicht erfasst: Epi.Y!Fliege.Z.4#11182505609062500.
Die Zeile 19 wäre wegen Übereinstimmung mit der Zeile 190 als Arista-Anschluss geeignet, aber „707“ wird als Mündung des Speichelganges benötigt. Ansonsten ist der Bereich geeignet Z.17 mit Sensille=1 und Nerv=7 enthält mit 3_11 die 3 Sensillen der Drosophila und das Ganglion 777 mit dem ausgehenden Nerv „7“ als 676=beweglich, paarig=63_36. Auch ohne Eisen=26 ist die Hämolymphe=26 mit enthalten: Epi.Y!Fliege.Z.17#2631177790367650. Es gibt den Herzschlauch und die Aorta, aber feine Blutgefäße (Blood vessel) hätte man in der Fliege nicht erwartet: „The blood vessel supplying the funiculus ends like a funnel, but gives off a branch that extands into the aristal lumen“ - Das den Funiculus versorgende Blutgefäß endet trichterförmig, gibt aber einen Ast ab, der in das Lumen aristal hineinreicht. Auch ein kleines „Blut“-gefäß kann in der Arista mit „500“ wie eine große Aorta=500 erscheinen. Eine überdimensionierte „Null“ kann man sich für eine Sprungmarke (Z.18Z.190) leihen und eine „Null“ verbleibt als Trennstelle: QS 2+4+8+5=19 und mit der angehängten „Null“ folgt Zeile Z.“190“ als Sprungmarke, so dass die inhaltsgleiche Zeile Z.19 für eine „mathematisch begabte Fliege“ nicht mehr benötigt wird. Insgesamt QS=55 als Struktur der Arista: Epi.Y!Fliege.Z.18#2485001246458330.
3.3.2) Antennensegmente:
Das distale 3. Antennensegment (Funiculus) ist mit Geruchsrezeptoren und vielen Härchen „Extra=8_11“ als Zählgröße QS 0+5+0+6+0=11, paarig=2, besetzt: Epi.Y!Fliege.Z.185#241783905060811. Die Zeilennummer enthält den Token-86, „um bei Futtergeruch den Rüssel auszufahren“. Der Nerv-7 liegt beidseitig gespiegelt „24_42“ im Funiculus und ist dann mit paarig=2 für die linke und rechte Antenne gleich. Der Innenraum „Sacculus“ wird räumlich=404 angezeigt und ist mit Hämolymphe gefüllt. Die Innenwand ist seitlich=99 mit Sensillen „1“ ausgekleidet, die sich in „3“ Bereichen unterscheiden [siehe: „Fine structure and primary sensory projections of sensilla located in the sacculus of the antenna of Drosophila melanogaster | SpringerLink“; Cell and Tissue Research,volume 282, pages237–249 (1995)]: Epi.Y!Fliege.Z.186#240483991592742. Die Sensillen in den „3“ Wandabschnitten werden als Haar=1 und als Nerv=7 durch die Zahl 9=seitlich „3“-fach markiert als „3_ 9_1_9_7_9“, und zwar paarig=2 für beide Antennen: Epi.Y!Fliege.Z.187#239197980942514. Die Hämolymphe „26“ verzweigt offensichtlich nach der Aorta in ein feines Gefäßsystem bis in die Antenne, statt als offene Aorta zu enden. Weil keine „26“ vorhanden ist, muss die Evolution sprichwortlich „auf den Nürnberger Trichter kommen“. Das Paar „256_256“ ist keine Computer-256-Bit-Architektur, sondern das Endstück des Antennengefäßes, das mit der Hämolymphe=26 adressiert wird. Mit der Struktur=5 sind der obere und untere, äußere Befestigungspunkt, des paarig geweiteten Auslauftrichters in der Antenne adressiert. Mit dem Bixnom-Keis=64 kann eine runde trompetenartige Mündung entstehen, und zwar paarig=2 in beiden Antennen; Epi.Y!Fliege.Z.188#237925651256649. Der äußere Raum um die beiden Nerven „6_7_7_6“ ist mit sensorischem Gewebe (Sensory epithelium) „6666=flexibel“ gefüllt. Der weibliche Duft ist als „6666_7=Nerv“ schnell erkannt, dagegen wird das Futter als Token-86 wählerisch erst als Prüfsumme QS 2+3+6+6+6+6+7+8+5+3+7+6+9+8+4=86 freigegeben: Epi.Y!Fliege.Z.189#236666785376984. Scheinbar ist es unmöglich, den Funiculus als Geruchsorgan ausreichend zu entwickeln, weil an der sichtbaren Formeinschnürung „707“ die federförmige Arista (Zeilensprung von Z.18) als Borste „11_1_7=Nerv_1“angeschlossen wird und dann bereits das 2. Antennensegment (Pedicel / Pedicellus) folgt: Epi.Y!Fliege.Z.190#235421170717105. Zum Glück überlagern sich Funiculus und Pedicel etwas. Der Funiculus schiebt einen langen Gelenkzapfen in den Pedicel, um als Sekundärfunktion die motorischen Schwingungen der Arista in den Pedicel als Hörorgan zu übertragen. Der Pedicel lässt sein Johnston-Organ über den Funiculus herabhängen. Der Funiculus findet nunmehr Kalium=19 ständig in der Zeilennummer, um den geöffneten Ionenkanal im Gegenstrom zu Natrium=11 und Calium=20 zu durchströmen [siehe Video: Transistor in der Fliegen-Antenne | Max-Planck-Gesellschaft (mpg.de); https://www.mpg.de/7028446/Selbstregulation-Duftrezeptoren /2013].
Das 2. Antennensegment (Pedicellus) überlagert sich im Zeilenlauf und ist von Zeile Z.191 bis Z.198 zu suchen. Im Pedicel zieht sich eine Antennen-Längsnaht (Antennal seams) mit. Der Spalt 1_9=seitlich kann sich über die Zeilen-Nr.Z.19x durchziehen. Im Funiculus wird damit alternativ Kalium=19 für den Ionenkanal verwendet. Token=68_86=Token, paarig=96_69=seitlich: Epi.Y!Fliege.Z.192#232968866855469.
Das 1. Antennensegment (Funiculus) wird aufgrund der Überlagerung weiterhin mit seiner Geruchsfunktion beschrieben: Die Duftmoleküle treffen im Funiculus auf ein Rezeptor-Protein, wobei es durch die Bindung zur Öffnung eines Ionenkanals kommt. Aufgrund des Ionenaustauschs Natrium/Calcium vs. Kalium wird ein Nervenreiz ausgelöst. Ionenkanal „909“ offen mit Calcium=20. Um Calcium als Trichter einzufüllen wird neben dem Duft-Rezeptor [Or22a] als „225“ noch der zweite „Türflügel“ als Ko-Rezeptor [Orco] „223“, markiert als Gruppe 4_223_4. Kalium=19 ist getrennt in der Zeilennummer vorhanden: Epi.Y!Fliege.Z.199#225909204223485. Der erregte Riechnerv „77“ wird als Dopplung benötigt, damit sich der Antennennerv auf den linken und rechten Antennenlappen (AL) im Gehirn [analog zum Riechnerv vom Maxilary Palp] verzweigen kann. Der Ionenkanal besitzt für starke und schwache Düfte mit „09“ und „09“ zwei unterschiedliche Reaktionen: Epi.Y!Fliege.Z.199#224773982091709. Natrium=11 erscheint im gesperrten Zustand, wenn kein Kalium mehr verfügbar ist. Dafür ist in der Zeilen-Nr. jetzt Calcium=20 zusammen mit Natrium=11 vorhanden: Epi.Y!Fliege.Z.200#223650112181250.
Im 2. Antennensegment (Pedicellus) liegt das Johnston-Organ (JO) für das Hören der Fliege. In der Nähe von Weibchen strecken Männchen einen ihrer beiden Flügel zur Vibration als Balzgesang heraus. Andere Männchen werden zum Mitsingen animiert und die Paarungsbereitschaft der Weibchen wird gesteigert. Die Gesänge, dominant um 200 Hz, liegen im Hörumfang der Fliegen von 100 - 300 Hz. Beide Geschlechter detektieren die Gesänge mit ihren Antennen. Die federförmige Arista ist unflexibel am Funiculus befestigt, so dass ein Tonempfänger entsteht, dessen wechselnde Drehrichtung um die Längsachse über ein Gelenk auf den Pedicellus übertragen wird. Die auditorischen Sinneszellen sind auch an der Wahrnehmng von Wind, Gravitation und Temperatur sowie als Zeitgeber für die circadiane Uhr beteiligt. Der Pedicellus enthält 500 chordotonalen Stretch-Rezeptor-Neuronen (JONs) [Siehe: „Hearing in Drosophila - PMC (nih.gov)“/ J. Albert; M. Göpfert/ Curr Opin Neurobiol./ 2015 Oct; 34: 79–85.; doi: 10.1016/j.conb.2015.02.001 und Drosophila Hören: Mechanismen und Gene | Request PDF (researchgate.net); M. Kittelmann/M. Göpfert / Sept. 2014/ e-Neuroforum/ https://doi.org/10.1515/nf-2014-0306 ]. Die 500 Neuronen können in 5 Klassen A-E eingeteilt werden, wobei in A und B etwa 250 Neurone empfindlich auf Vibrationen reagieren, in Klasse C und D etwa 200 Neuronen benötigen starke Auslenkung des Funiculus zur Wahrnehmung von Wind und Gravitation. Etwa 50 Neuronen der Klasse E sind universell.
Zwei bis drei Stretch-Rezeptoren werden von einem Skolopidium umhüllt, das sich zwischen der Gelenkmembran des Pedicellus und der Wand (Cutikula) des Pedicellus spannt. Die Anzahl von 200 Skolopidien ergibt sich aus 500 JONs-Rezeptoren / i.M. 2,5 = 200. Bei der Zählaktion wurden exakt 477 +/- 24 JONs ermittelt. Jedes der 2 - 3 bipolaren mechanosensorischen Neuronen im Skolopidium besteht aus ciliären Dendriten, Soma und Axon. Die Dendriten sind in einer Kappe (Dendritic cap) eingangsseitig verbunden. Um diese innere Rezeptor-Einheit legt sich die Hülle des Skolopidium, bestehend aus Cap cell, Scolopale cell und Ligament cell ( Siehe: „Using Drosophila to study mechanisms of hereditary hearing loss - PMC (nih.gov)“ / H.Bellen /2018 / doi: 10.1242/dmm.031492 ).
Aufgrund der Überlagerung von Funiculus und Pedicellus wird der Pedicellus zweckmäßig gegen den Zeilenlauf gesucht. Am Übergang zum 1. Antennensegment (Scape) ist ein Gelenk „909“ wird mit einer Rundung=64 ausgebildet: Epi.Y!Fliege.Z.207#21608706490942. Mit Form=7 sitzen außen einige Borsten „1“ auf dem Pedicellus; auf Abbildungen ist zuweilen 1 große Borste erkennbar. Der Hörverstärker benötigt für die Motoren zusätzliche Energie. Der wichtigste chemische Energiespeicher ist das Adenosintriphosphat (ATP); Formel= C10H16N5O13P3. Frei nach BiXnom wird folglich Phosphor=15 für den Hörverstärker als EXTRA=8 über „8_15_8“ bereitgestellt, in dem die Energie mit den Funktionsgrößen Biologie=64_„8_15_8“_63=Physik gekoppelt wird: Epi.Y!Fliege.Z.204#219264815863971. Die Gelenkverbindung „606=flexibel“ zum Funiculus in der Einstülpung des Pedicellus besitzt eine Membran „33“ an der die 200 Skolopidien befestigt sind. Statt „33“ ergibt die Quersumme einer Teilmenge nur QS 0+3+4+4+9+3+8+1+0=32. Ein Ton kann nur mit 32 + 1 Aktion=Ton=33 übertragen werden. Die Ziffer „1“ wird in Z.202 bereitgestellt. Die Ziffer „2“=paarig steht am linken Zahlenrand für beide Antennen. An der Membran müssen wegen der Schwingung 2 Rezeptorgruppen=44 angreifen. Davon wird wechselseitig immer nur die Zugkraft gemessen. Die beiden Gruppen sind paarig=#2 einerseits als Dopplung Z.203_#2_203 enthalten, aber andererseits funktionell über die Zeilennummer getrennt. Die beiden Gruppen „44“ sind inhaltlich jeweils in einer gesonderten Zeile adressiert: Epi.Y!Fliege.Z.203#220344938109606. Zur Schallübertragung steht das Signal=1 am rechten Zahlenrand. Das Signal wird beiden Rezeptorgruppen 44_5_7=Nerv_5=Struktur übertragen, die physikalisch 4_63=Physik_4 funktionieren. Zwei Gruppen paarig zur wechselseitigen Zugkraftmessung „Z.202#22“. In der Zeilen-Nr. Z.“20“1 und in Z.“20“2 steht für die Öffnung der beiden Ionenkanäle Calcium=20 zur Verfügung: Epi.Y!Fliege.Z.202#221435754634901. Der Hohlraum im Pedicellus wird als klassische Öffnung „505“ mit der äußeren Cuticula 222_5=Struktur adressiert. Die Befestigung=5 der Rezeptorgruppe an der Cutikula erfolgt von innen seitlich=9 und enthält die Axone=7 für das elektrische Ausgangssignal: Epi.Y!Fliege.Z.201#22253742505597. Mit der Zeilennummer Z.200 findet bereits eine Überlagerung mit dem Funiculus statt, bei dem für die Ionenkanäle Natrium=11, Calcium=20 und Kalium=19 benötigt wird. Die real gefundene Mindestanzahl von JONs-Rezeptoren beträgt 477-24=453 JONs. Werden die Anfangsziffern beider Rezeptorgruppen addiert, sind 229+228=457 JONs passend. Die 453 JONS werden real zu 200 Skolopidien verpackt. Diese Anzahl wird über die Zeilennummer Z.200 über die Zählgröße „11“ vorgegeben. Nunmehr kann man vermuten, dass sich die beiden Rezeptorgruppen zu je 100 Skolopidien teilen. Für die beiden JONs-Gruppenzeilen „44“ kann dann jeweils eine Kettenreaktion für 100 Elemente ausgelöst werden, um den Inhalt der Verpackung, d.h. die Skolopidien, zu inspizieren: Epi.Y!Fliege.Z.200#223650112181250. Die beiden JONs-Gruppenzeilen „44“ unterscheiden sich durch in der Null-Lage mit wechselnder Drehrichtung als 44_0_01=links vs. 0_44_2=rechts. In beiden Gruppen ist die Bixnom-Gravitation=84 zur Gleichgewichtsmessung enthalten. Außer der JONs-Anzahl von 228 bzw. 229 sind für den Hörverstärker die optimale Frequenz von 308 Hz enthalten (real ca. 300 Hz): Links-Gruppe ONE(=1): Epi.Y!Fliege.Z.196#228214400184949; Rechts-Gruppe TWO(=2): Epi.Y!Fliege.Z.195#229384730442308. Die Zeitdifferenz DELTA.TIME=Z.195-Z.196=#117033025735871 enthält mit „0330“ den Tonempfang in der Membran „33“ am Gelenk “606“ und eine Zählgröße=11 im Nerv=7. In der Kettenreaktion werden lediglich bekannte Ergebnisse festgestellt. Wie sich die 500 JONs auf die 200 Skolopidien verteilen, ist nicht genau bekannt. In der Kettenreaktion werden keine JONs, sondern nur die 200 Skolopidien entwickelt:
TWO(=rechts)-lfd.Nr. 63=Physik mit Membran „33“ und am rechten Zahlenrand „822“ Hz: „364102746733822“. Als Resonanz liegt parallel ONE(=1): lfd.Nr. 62 mit Membran „33“ und am rechten Zahlenrand 789 Hz. Der Mittelwert (822+789)/2=808,5 Hz entspricht der bekannten Resonanzfrequenz der Drosophila-Antenne von ca. 800 Hz.
Angenommen, die Balzgesänge sollen bei den Fliegenweibchen „66“ Eindruck machen. In TWO(=rechts)-lfd.Nr.88=260664466411713 wird eine Weibchen-Gruppe „66_44_66“ adressiert. ONE(=links): lfd.Nr. 88=259334545664715 adressiert Männchen „33“ und Weibchen „66“. Aus ONE(=links): lfd.Nr. 89=256420674365 kann dann die Frequenz der Balzgesänge von ca. 200 Hz als 206 Hz in „64_206_7=Nerv“, ganzjährig=365, gefunden werden.
Die Schwerkraft=84“ ist mit 63/64 im Bereich um lfd. 70 -75 interessant: ONE(=links): lfd.Nr. 72=316964444701318 enthält den Raum 31_64_444_13 mit einer Spiegelung. Tatsächlich ist dann parallel ein schönes Gleichgewicht als Wippe „814_0_148“ in TWO(=rechts)-lfd.Nr.83=314225658140148 vorhanden. Die Spiegelung ist nicht ideal gelungen, aber die Spiegelung der „84“ ist ansatzweise lesbar – Das Gleichgewicht hinkt etwas (Das Männchen streckt dagegen einen der beiden Flügel zur Kompensation heraus – welchen?).
Wissenschaftlich werden die 500 JONs-Rezeptoren in 5 Klassen A-E eingeteilt. Klasse A + B mit 250 JONs [250 JONs / 2,5=100 Skolopidien] für Vibrationen. Klasse C+D mit 200 JONs [200 JONs / 2,5=80 Skolopidien]. Die 50 JONs [50 JONs/2,5=20 Skolopidien] der Klasse E sind nicht spezialisiert. Die Bereiche ONE(=links) und TWO(=rechts) enthalten jeweils zweifach das Signal „111“ und vielfach die Zählgröße „11“.
Der Antennennerv „77“ enthält die Innervationen von Funiculus und Pedicellus gemeinsam, um sich im Gehirn wieder zu verzweigen: Epi.Y!Fliege.Z.193#231761774281088 und Epi.Y!Fliege.Z.199#224773982091709. Die Signale des Geruchsorgans (Funiculus) gelangen im Gehirn zum Antennenlappen (AL). Die JON-Axone enden hauptsächlich im mechanosensorischen und motorischen Zentrum (AMMC) des Gehirns. Das AMMC enthält Zelltypen, die auf bestimmte Merkmale mechnischer Reize reagieren [Siehe:„ Functional maps of mechanosensory features in the Drosophila brain - PMC (nih.gov)“; P. Patella, R.Wilson /Curr Biol. 2018 Apr 23 / doi: 10.1016/j.cub.2018.02.074.
Bei Insekten mit Trommelfellohren werden die Signale in ein Ganglion gesendet, dagegen besteht bei einem Jonston-Organ wie bei der Drosophila eine direkte Verbindung ins Gehirn. Im Jonston-Organ (JO) sind 477 +/- 24 sensorische Neuronen (JONs) gezählt worden, die sich im Hörzentrum des Gehirns über 5 Zonen mit insgesamt 19 Unterbereichen verteilen. Die JONs sind in Skolopidium verpackt, dass sich hier aufgrund der Zeilen-Nr. 200 aus 200 Skolopidien zusammensetzt. Wird im Skolopidium eine Kettenreaktion ausgelöst, indem die Zeile Z.200 durch 1 bis x dividiert wird, entstehen die 457 JONs. Die 19 Unterbereiche lassen sich finden, indem davon 19 Zeilen besondere Zählmerkmale ausbilden. Signal „111“, Zählgröße „11“ am rechten Zahlenrand und mechanischer Reiz als „55“ am rechten Zahlenrand. Ausgeschlossen sind 1111, 110, 555 und die unklare Dopplung 111-11. Bei der maximalen Anzahl der JONs=228+229=457 ergibt sich für die laufende Nr. 457 =“48938755400711“ das Merkmal der 19. Untergruppe als „11 kombiniert mit Nerv=7“. Der Nerv=7 fehlt in 2 Untergruppen, dafür sind ersatzweise die Funktionszahlen „63“ und „64“ verfügbar. Die Zahl „84“ für die Schwerkraft fehlt als Merkmal in den 19 Zeilen. Ersatzweise wird eine Schwerachse aus dem Hörgleichgewicht als beidseitige Spiegelung adressiert als Physik=63_5_36_9_63=Physik in JONs Nr. 352=“63536963687855“. Die Gleichgewichtsfindung „84“ muss als Rechenaufgabe gelöst werden. Die Ziffer „8“ markiert den Nerv=7 in „878“ und für die fehlende Zahl „4“ muss die Zahl „6“ in „636“, wie vorhanden, 4-fach gezählt werden. Die Fliege produziert beim Flug die Neurotransmitter Stickstoff=7 und Schwefelwasserstoff H2S, Schwefel=16, für das 4–Sekunden-Kurzzeitgedächtnis über die Flugrichtung. Damit sind in „878“ der Stickstoff=7 und der Schwefel QS 8+8=16 für eine Hirnleistung adressiert. Die 16 Raumrichtungen sind im Ellipsoidköper (EB) des Zentralkomplexes (CX) im Gehirn durch 16 Torten-Segmente als Speicherort verfügbar [siehe: „Sicherungskopie im Zentralhirn: Wie Fruchtfliegen ein Ortsgedächtnis bilden (uni-mainz.de)“; „Visual Working Memory Requires Permissive and Instructive NO/cGMP Signaling at Presynapses in the Drosophila Central Brain: Current Biology (cell.com)“; S. Kuntz et al.,/ 2017 / DOI: 10.1016/j.cub.2016.12.056].
Nach der Verbindung „909“ zwischen 1. und 2. Antennnenglied folgen noch Krümmungen 64 und Gegenkrümmung 46 für den Anschluss der Scape (Scapus=Basis) an der Kopfkapsel. Bildlich gesehen liegt die Scape in einer Grube etwa wie beim Menschen die Augenhöhe am Nasenbein, paarig=48_1_84 und paarig=46_10_64: Epi.Y!Fliege.Z.208#215048184789664 und Epi.Y!Fliege.Z.209#214019246106459. Aufgrund der beiden Antennengruben entsteht in der Mittelachse ein nasenartiger Mittelsteg. Statt unpaarig=1 beginnt die Zeile mit der Ziffer „2“. Für die folgenden Zeilen kann der paarige Eindruck dadurch beseitigt werden, dass in den Zeilennummern und am Zeilenanfang gleichzeitig „21“ durchläuft, wodurch eine unpaarige Mittelachse generiert wird. Unpaariger Nasensteg „11“ als „Z.211_#211“: Epi.Y!Fliege.Z.211#211990627659953. Über beide Antennen legt sich wie eine Stirn ein großer unpaariger „1“ Bogen zwischen den Facettenaugen „100001“ als Struktur=5_QS 3+3=6_4=Bogen[64]_5 und Form=7: Epi.Y!Fliege.Z.211#210000105334507.
4.) Mittlerer Rüsselbereich (Haustellum): Das Haustellum [haustus (lat.)=schöpfen] bildet den mittleren Bereich des Rüssels. Es setzt sich aus verschiedenen Mundwerkzeugen zusammen, die der Nahrungsquelle angepasst sind. Der gesuchte Bereich liegt unterhalb des Palpus maxillaris und des Speichelgang-Ventils (Salvary valve). Abbildung siehe: https://www.researchgate.net/figure/Proboscis-anatomy-Dorsal-toward-top-ventral-toward-bottom-A-1870-drawing-of-a_fig1_304032717. Beim Stechrüssel bestehen die Mundwerkzeuge nur aus einem Stechborsten-Bündel, zusammengesetzt aus paarigen Mandibeln (Oberkiefer), Laciniae, Labrum (Oberlippe) und Hypopharynx. Ein Leckrüssel bzw. Tupfrüssel (Stubenfliege, Taufliege u.a.) ist anatomisch strukturiert, weil sich die verschiedenen Mundwerkzeuge zu einem Nahrungsrohr (Food canal) formen.
Der obere Rüsselbereich (Rostrum) wird vom paarigen Muskel „Lateral labial adductor“ zurückgezogen. Der Muskel zieht auf der Rüssel-Rückseite entlang bis zum Hinterkopf (Abbildung siehe: „Controlling motor neurons of every muscle for fly proboscis reaching“, online 2020 Jun 25, doi: 10.7554/eLife.54978. Langer Muskel „555“, paarig=35_53: Epi.Y!Fliege.Z.85#526235558073530. Der Muskel „555“ zieht paarig=2 bzw. 79_QS 4+5=9_7 bis zum Hinterkopf: Epi.Y!Fliege.Z.436#102591794578555.
Am Ende des Rostrum liegt das Speichelgang-Ventil (Salvivary valve) im Speichelgang (Salvivary duct). Die Abbildung zeigt Ventil-Trichter als Dreieckform. Weil beim Stechrüssel der Speichel in das Opfer injiziert wird, könnte es sich um eine Speichelpumpe handeln. Eine geeignete Trichterstelle 7007/707=Speichelgang ist am Rüssel nicht vorhanden. Angenommen wird, dass am Ventil mit der Zeilen-Nr. Z.86 der Token=86 als Funktion zur Richtung des Nahrungstransports übergeben wird. Die Information steckt funktionell im Speichel=20, so dass die Ziffer 2=paarig blockiert wird. Der Speichel=20 enthält alle 20 Standard-Aminosäuren als Proteinbausteine. Die Saugpumpe zur Nahrungsaufnahme kann mit dem Token-86 gestartet werden. Für den Vorgang sind Physik=63 und die Zählgröße 11 enthalten. Die Quersumme QS 5+2+0+1+1+6+5+3+9+9+5+6+3+9+6=70 enthält eine Kennung für den Speichelgang „707“. Die fehlende Ziffer „7=Form=Nerv“ ist als QS=5+2+0=7=Form lesbar. Der Speichelgang „707“ liegt erst wieder an der Mündung in Zeile Z.17 vor. Mit QS= 70 ist Zeile Z.70 ein mögliche Zwischenposition: Epi.Y!Fliege.Z.86#520116539956396. Die Zählaktion „1“ wird der Verdauung 8_1_8=Verdauung zugerechnet. Eine Ventilfunktion ist nunmehr als Auf/Zu-Funktion „414“/“141“ enthalten: Epi.Y!Fliege.Z.87#514138188922414. Der Speichelgang „707“ weitet sich zum Trichter 7000_7. Die Ziffer „2“ wird mit seitlich=9_2_9_1 geklammert, damit unpaarig=1 gilt. Epi.Y!Fliege.Z.90#497000249291667. Die Zeit=24 ist mit der 66=flexibel für eine varibale Trichterfüllung enthalten. Die „66“ ist auch als Quersumme enthalten: Epi.Y!Fliege.Z.90#497000249291667. Die Weiblichkeit=66 kann bei den Mücken (Unterordnung: Nematocera / Ordnung: Diptera) und Bremsen (Familie: Tabaniden / Ordnung: Diptera), aufgrund des Stechrüssels adressiert werden, weil nur die Weibchen stechen. Die Blutgruppe 0 [ohne Antigene auf der Hülle der roten Blutkörperchen] wird gegenüber A bevorzugt. Das CO2 der Atmung lockt die Mücken an. Mit Kohlenstoff=6 und Sauerstoff=8 kann der Token-68 [CO] das Blut als Nahrungsquelle identifizieren. Der Speichel wird in das Opfer injiziert und umgekehrt wird dann Blut mit dem Token-86 aufgenommen.
Bei der gemeinen Stechfliege (Wadenbeißer / Stomoxys calcitrans) stechen beide Geschlechter. Die Stubenfliege (Musca domestica) sieht ähnlich aus, besitzt aber keinen blutsaugenden Stechrüssel. Mit „0660“ kann ein Speicheltropfen aus dem Mund am „Leckrüssel“ hängen, der sich nach „15“ Sekunden um 8°C unter die Umgebungstemperatur von 25-30°C abkühlt. Der kühle Resttropfen wird aufgesaugt und senkt die Temperatur im Kopf nach „6“-facher Wiederholung um 3°C. Unter 25° wird kein Tropfen gebildet und über 30°C fliegt die Schmeißfliege (Chrysomya megacephala) nicht mehr. Erneut beträgt die Quersumme QS 4+9+1+5+3+8+7+0+8+0+9+0+6+6+0=66, womit eine 6-fache Wiederholung der Kühlprozedur adressiert wird: Epi.Y!Fliege.Z.90#491538708090660. Die Aufweitung des Ventil-Trichters wird als Rand mit dem Bixnom-Kreis=64 als 604 und der Gegendrehung 46, unpaarig=1 gebildet [gemäß Abbildung liegt dort alternativ eine unbekannte Trichterkostruktion, die mit einem Schlauch zum vorderen Nahrungsrohr führt]. Der Token-86, wie er anfangs in der Zeilen-Nr.Z.86 vorlag, ist jetzt in der Zeile mit 86 enthalten: Epi.Y!Fliege.Z.92#486195896046196. Der Speichelgang „707“ ist lediglich nochmals in Z. 190 vorhanden. Der unpaarige Speichelgang könnte wie eine Luftröhre gerippt sein und sich als „22“ durch den Zeilenlauf zur paarigen Speicheldrüse ziehen.
Im oberen Rüsselbereich (Rostrum) liegt der Pharynx. Das distale Ende zeigt in der Vorderansicht einen weiten Halbkreis mit dem Bixnom-Kreis=64 als Struktur „5000“: Epi.Y!Fliege.Z.75#596400299150000. Am Übergang zum Hausstellum liegt mit dem Prepharynx eine kleine Struktur, die in der Vorderansicht ein Dreieck „300003“ bildet. Weil der Rüssel herausgefaltet werden muss, könnte es es um eine unpaaarige „1“ Gelenkstelle handeln. Für den Faltmechanismus ist Physik=63 enthalten: Epi.Y!Fliege.Z.71#630000316003522. Der Speichelgang als Z.70 mit dem Speichel=20 muss nach dem Speichel-Ventil (Salvary Valve) mit oben=9 hoch führen, weil er im Hypopharynx (Innenlippe) eingebettet wird: Epi.Y!Fliege.Z.70#639000320517858.
Die Zeilennummern Z.63=Physik /Z.64=Biologie sind eine Besonderheit, um maßgebliche Strukturen zu bilden. Abbildung siehe: https://www.nature-microscope-photo-video.com/en/photos/animal-histology/invertebrates/arthropoda-arthropods/insecta-insects/diptera-flies/musca-domestica-housefly/010505d1003020101b-musca-domestica-housefly-mouthparts-7x.html . Das Hausstellum enthält das Nahrungsrohr (Food canal), welches bildlich wie ein langer „Storchenschnabel“ erscheint. Die obere Schnabelhälfte wird vom Epipharynx (Labrum / Oberlippe) gebildet und die untere Schnabelhälfte vom Hypopharynx [siehe: Epipharynx – Wikipedia ; Hypopharynx – Wikipedia ]. Im Hypopharynx ist der Speichelgang (Salvivary duct) eingebettet. Nahrungsrohr und Speichelgang liegen gemeinsam als „Storchenschnabel“ in der oberen Mittelnaht der Unterlippe (Labium). Das Labium bildet eine Röhre, die den langen „Storchenschnabel“ als Trägerkonstruktion umschließt. Das Labium ist aus 2 Halbschalen verwachsen, so dass paarig und unpaarig nicht sicher definierbar sind. Das Element wird auch als „Prementum“ bezeichnet. Bei den Insekten bildet das Prämentum (lat. mentum = „Kinn“) den basalen, zusammengewachsenen Abschnitt der Unterlippe (Labium). Das paarige Submentum kann ggf. verwachsen sein.
Für den Hypopharynx Z.64 ist als Kennzeichen der eingebettete Speichelgang als 06600_5=Struktur_rund=64_07=Form enthalten: Epi.Y!Fliege.Z.64#698906600566407.
Der Epipharynx (Labrum) ist unpaarig=1 mit „1000“. Die paarige Spiegelung 35_53 kann funktionell blockiert weden, in dem wegen der Bildung des Nahrungsrohres mit QS 3+5=8_6 der Token-86 gelesen wird. Der Nahrungstransport als Pumpsystem erfolgt mit Physik=63: Epi.Y!Fliege.Z.63#710000356130953. Das Labium ist ebenfalls über den Token-86 als 86_86 auffindbar. Eine Spiegelung 19_91 ist als paarige Verwachsung dargestellt: Epi.Y!Fliege.Z.52#860192739158654. Mit räumlich=4 als 7_4_7=Form wird das Labium mit dem Bixnom-Kreis=64 in Röhrenform „747_64“ und „400647“ gebildet. Nahrung kann dann als Säugetierblut Eisen=26 eingesaugt werden: Epi.Y!Fliege.Z.53#843962687476416 und Epi.Y!Fliege.Z.56#798750400647322.
5.) Oberschlundganglion: Das Gehirn der Taufliege (Drosophila melanogaster) umfasst etwa 50 Module (Neuropile). Die meisten dieser Neuropile-Module enthalten eine Ansammlung von lokalen Neuronen, die im mathematischen Modell als Local Processing Units (LPUs) vernetzt werden. Module ohne lokale Neuronen werden als „Hubs“ bezeichnet. Die Neuropile enthalten eine Vielzahl morphologisch abgrenzbarer Gewebeareale, die als Glomeruli (Glomerulus) bezeichnet werden. Die Modul-Bezeichnungen sind namentlich definiert, siehe: „A Systematic Nomenclature for the Insect Brain“; https://www.sciencedirect.com/science/article/pii/S0896627313011781 . Ein sagittaler Schnitt des Gehirns, der die Reihenfolge der Neuropile-Module im Zeilenlauf enthält, liegt momentan nicht vor. Bei der Ameise beginnt das Gehirn im Zeilenlauf mit den geometrisch auffälligen Pilzkörpern (Mushroom Bodys=MB ). Umgekehrt endet dagegen bei der Drosophila-Fliege das Gehirn mit dem Kelch (Calyx) des paarigen Pilzkörpers (MB). Siehe: The neuronal architecture of the mushroom body provides a logic for associative learning | eLife (elifesciences.org) / https://doi.org/10.7554/eLife.04577.001 / Y. Aso; Dec 23, 2014.
Die Antennen nehmen die Geruchstoffe wahr und die Informationen werden nach hinten über den Antennenlappen (AL) in den Pilzkörper (MB) und das seitliche Horn (LH ) projiziert. Das Gehirn wird daher zweckmäßig rückwärtig aufgerollt. Die Zeile Z.386 ist für die Durchleitung des Ösophagus mittig durch das Gehirn als „88088“ reserviert. Der paarige Pilzkörper (MB) enthält jeweils einen Kelch (Calyx=CA) und benötigt wegen der Kreisform in der Rückfrontansicht den Bixnom-Kreis=64. Am Kelch (CA) sitzen 2 Fortsätze „Accessory calyx (ACA)“, und zwar dorsal „dACA“ mit oben=9 und ventral „vACA“ mit dem Nerv=77 am Calyx als Kreis=64. 1. Accessory calyx (dACA), Nerv=77, oben=9, paarig=18_18, Kreis=64: Epi.Y!Fliege.Z.385#116181876457792. 2. Accessory calyx (vACA) Nerv=77, paarig=34_34, Kreis=64: Epi.Y!Fliege.Z.384#116484433427734. Der paarige Pilzkörper (MB) umklammert den Zentralkomplex (Central Complex=CX). Zum Zentralkomplex (CX) gehört die Protocerebrale Brücke (Protocerebral bridge=PB) mit den reservierten Zeilen Z.381 / Z.380. Kelch (Calyx=CA), Kreis=64, gespiegelt 47_2=paarig_74, Form=7, Nerv=77 in der Zeilen-Nr.Z.3“77“, Token-86, Zählgrößen=11_11 (beim Menschen hat die Ziffer „1“ als 1. Hirnnerv für die olfaktorische Geruchswahrnehmung eine Bedeutung): Epi.Y!Fliege.Z.377#118647274366711. Der Kelch (CA) ist mit dem Stiel (Pedunculus=PED) des Pilzkörpers (MB) verbunden (Pilzkörper – Wikipedia). Der Pilzkörper (MB) der Fliege „Drosophila“ besteht aus drei Paar Loben (alpha-, beta-, gamma-Lobus). Weil der Zentralkomplex (CX) umklammert wird, zieht sich der Stiel über die Serie #12. Der Kelch (CA) kann mit dem umgekehrten Token-68 gefunden werden. Der Riechnerv=1 ist als Funktion „12121“ enthalten: Epi.Y!Fliege.Z.369#121219572997968. Die Serie #13 enthält als Z.344 einen Hinweis auf die Gruppe „44“, paarig=13_13, von 3 Loben des Pilzkörpers (MB). Epi.Y!Fliege.Z.344#130029134989099. Innerhalb der Umklammerung der Pilzkörper (MB) kann nunmehr der Zentralkomplex (CX) gesucht werden. Der zentrale Komplex (Central Complex=CX) besteht aus der Protocerebralen Brücke (Protocerebral Bridge=PB), aus dem Fächerkörper (Fan-shaped Body=FB), dem Ellipsoidkörper (Ellipsoid Body=EB) und dem Noduli (NO). Die Protocerebrale Brücke (PB) ist mit den Elementen des Zentralkomplexes (CX) sowie den ventralen Körpern (Ventral Bodys=VBOs) und dem lateralen Dreieck (Lateral Triangle=LT) verbunden. Rückseitig beginnt die querliegende, wellenförmige Protocerebrale Brücke (Protocerebral bridge=PB) unpaarig als Verbindung der Gehirnhälften. Die Brücke (PB) besteht aus 2 wellenförmig verbundenen Halbkreisen aus jeweils 9 Segmenten, so dass die Brücke aus 18 „Glomeruli“ besteht. Siehe: „Generating an Executable Model of the Drosophila Central Complex“ / K.Ito/2016; https://www.biorxiv.org/content/10.1101/051318v1.full.pdf. ; Fruit Fly Brain Observatory. Die 18 Glomeruli sind auch im 3D-Modell des Fliegen-Gehirns erkennbar [siehe: Google Releases 3D Model of a Fruit Fly's Brain | Beebom ]. Ein mathematisches PB-Modell enthält abweichend nur 16 Glomeruli [siehe: „A Comprehensive Wiring Diagram of the Protocerebral Bridge for Visual Information Processing in the Drosophila Brain“; https://www.sciencedirect.com/science/article/pii/S2211124713002040; J.Greenspan; Cell Reports/May 2013 / DOI: 10.1016/j.celrep.2013.04.022 ].
Die Protocerebrale Brücke (PB) bildet nebeneinander 2 Halbkreise, so dass der Bixnom-Kreis=64 benötigt wird. Mit Nerv „77“ werden „8“ Elemente paarig 585_585 als Struktur gespiegelt 35_53 markiert. Kreisform=64 als Quersumme QS 1+1+7+7+1+0+5+8+5+3+5+8+5+5+3=64. Die beiden Halbkreise 64 werden als Welle durch eine Gegenform=46 verbunden, die nicht direkt vorhanden ist. Die Teilmenge QS 5+8+5+3+5+8+5+5+3=47 ergibt einen Überschuss von 1 Aktion. Füllt diese das linke Defizit der Teilmenge QS 1+1+7+7+1+0=17 auf, ergeben sich 17 + 1 Überschuss = 18 Glomeruli. Die Brücke funktioniert durch den permanenten Datenverkehr: Epi.Y!Fliege.Z.380#117710585358553. In der Folgezeile ist die Verbindungskurve „46“ mit der eingebetteten Daten-Aktion „0_1“ als 4_01_6 mit den beidseitigen 9 Segmenten „909=seitlich“ als QS 9+0+9=18 bzw. QS 0+9+4+5=18 Glomeruli enthalten. Als lokaler Bezug sind „16“ enthalten: Epi.Y!Fliege.Z.381#117401633690945.
Der Fächerkörper (Fan-spaped Body=FB) steht als gebogene Platte senkrecht vor der Protocerebrale Brücke (PB). Der Fächerkörper (FB) kann Verbindungen verschalten, weil er eine paarig verbundene Matrix aus 6 Zeilen vertikal und paarig 4 Spalten = 8 Spalten bildet. Der Fächerkörper (FB) liegt am Zeilenübergang Z.3“63“/ Z.3“64“. Die Mittelachse ist eine Spiegelung 32_0_23. Diese beiden Lappen der Matrix werden oben=9 mit unpaarig=1_23 zusammengehalten. Die Quersumme QS 1+2+3+2+2+3+2+0+2+3+0+3+7+1+9=40 hat zur „Physik=63“ ein Defizit von 63-40=23. Das sind 23 Aktionen, die als Wahrnehmung vom Körper=Biologie=64 verarbeitet werden müssen: Epi.Y!Fliege.Z.363#123223202303719. Der untere (ventrale) Bereich ist paarig=22_77=Nerv_22 angefügt und am unteren Rand ausgerundet=“46“. QS=66: Epi.Y!Fliege.Z.364#122884677022665. Für die Matrix werden nunmehr die 6 Zeilen, paarig=6_6 und die 4+4=8 Spalten adressiert. Die Matrix verarbeitet die Informationen beispielsweise mit der Quersumme QS 1+2+2+5+4+8+0+0+6+6+7+4+6+6+7+4+6+5+8=87, die sich aus (Biologie=) 64 + (Input=) 23 = 87 darstellen lässt: Epi.Y!Fliege.Z.365#122548006674658.
Vor dem Fächerkörper (FB) baut sich der Ellipsoid Body (EB) vertikal wie ein kreisrunder Donut (Torus) auf. Der Ellipsoidkörper (EB) bildet anhand der Informationen die Umgebung räumlich als Kompass ab. Als Modell besteht der Ellipsoidkörper aus 4 verschachtelten Ringen, die sternförmig und paarig von 8 Strahlen = 16 Strahlen geteilt werden. Zur Orientierung muss für den Torus zunächst der Bixnom-Kreis=64 verfügbar sein, um die paarigen 8 Strahlen (Summe 16), paarig=27_72, als „800064“ mit den 3 Innenringen „000“ zu adressieren: Epi.Y!Fliege.Z.350#127800064103572. Der Außenring wird als Form-7-Ring „707“ gebildet. Die 3 Innenringe sind als 7_7_7_0 enthalten. Strahlen und Ringe bilden eine polare Matrix: Epi.Y!Fliege.Z.352#127073927375710. Die Informationsverarbeitung muss einem Übergang 63/64 enthalten. Zahl „63“ und QS 1+2+6+0+0+0+0+6+3+2+0+0+7+0+4=31 in Epi.Y!Fliege.Z.355#126000063200704. Zahl „64“ und QS 1+2+5+6+4+6+1+3+0+4+3+8+9+0+5=57 in Epi.Y!Fliege.Z.356#125646130438905. Als Additionsaufgabe QS 31 + QS 57= 88 bildet sich kein Token-86 zum Speichern der Futterquelle, sondern die Richtung des Sonnenlichtes mit dem Bräunungspigment „Melanin=88“ als Kompass. Das Futter für den Stechrüssel ergibt sich als Subtraktionsaufgabe QS 57- QS 31=26=Säugetier-Blut. Außer dem Ösophagus zieht auch die Aorta „500“ mittig durch die beiden Gehirnhälften. Die Zeilennummer Z.360 ist geeignet, um den Kompass als Kreis des Ellipsoidkörpers (EB) mit 360° abzubilden, was durch die Facettenaugen auch möglich ist: Epi.Y!Fliege.Z.360#124250062322917. Die Zeitdifferenz Z.360-Z.355=175000087778755 enthält die Funktion eines Ganglions „8_777_8.
Der Noduli (NO) kompimiert den Zeilenlauf durch 4 Untereinheiten (andere Quellen finden nur 3 Untereinheiten), die sich als kleine Körper paarig ventral neben der vertikalen Mittelachse aufstapeln. Der Noduli (NO) bildet die 4 Untereinheiten als Zählgrößen „11“. Noduli NO-1 als 11_81_81: Epi.Y!Fliege.Z.320#139781320113281. Noduli NO-2 als 11_13_31: Epi.Y!Fliege.Z.322#138913113156056. Noduli NO-3 als 11_13_31: Epi.Y!Fliege.Z.341#131173086323314. Noduli NO-4 als 11_82_28: Epi.Y!Fliege.Z.343#130408228677114.
Die Neuropile des Zentralkomplexes (CX) sind mit akzessorsichen Gehirnarealen verbunden (AL, BU, CRE, IB, LAL, SMP, WED, PS). Der Zentralkomplex (CX) wird seitlich vom Lateral Complex (LX) begrenzt, der aus dem Lappen „Lateral Accessory Lobe (LAL)“ und der Knolle "Bulb (BU)“ besteht. Die Knolle „Bulb (BU)“ ist auch als seitliches Dreieck „Lateral Triangle (LT)“ bekannt. Seitlich direkt am Fächerkörper (FB) kann mit „seitlich=9_3=Dreieck“, paarig=35_6_35, eine Form=7 gebildet werden: Epi.Y!Fliege.Z.362#123563597890193. Ein großes Volumen „30000“ ist in der Zeile Z.375 für Fliegen reserviert, die am Ösophagus eine große Blase ausbilden. Der seitliche Lappen (LAL) ist auch als ventraler Körper (VBO) oder als unteres dorsofrontales Protocerebrum (IDFP) bekannt. Der seitliche akzessorische Lappen (LAL) umschließt den Ellipsoidkörpers (EB) und umklammert die unteren Gehirnareale rippenförmig. Die Rippenform wird über 3 Zeilen als Gruppe 44 gebildet, in dem für die Bögen der Bixnom-Kreis=64 vorhanden ist. Oberer LAL-Konturbogen „44_9=oben_64=Bogen“, paarig=2: Epi.Y!Fliege.Z.310#144290394955645. Seitlicher LAL-Außenbogen, paarig=38_64_38, seitlich=9: Epi.Y!Fliege.Z.311#143826438701769. LAL-Innenbogen „64“, paarig=2 und gespiegelt= 65_56: Epi.Y!Fliege.Z.312#143365456526442.
In der Frontalansicht des Gehirns tritt der paarige Antennenlappen (Antennal Lobe=AL) als Geruchszentrum hervor, der funktionell mit dem Riechkolben der Säugetiere vergleichbar ist. Informationen siehe: a) Geruchswahrnehmung bei Insekten | Max-Planck-Gesellschaft (mpg.de) / Hansson, Bill S./ 2007 ; b) (PDF) Der Geruchsinn der Insekten – Primärprozesse der Duftstofferkennung und Kodierung (researchgate.net) /S. Sachse /2011; c) Eine Ressource für den Drosophila-Antennenlappen, der durch das Konnektom von Glomerulus VA1v | bereitgestellt wird eLife (elifesciences.org); Ian A. Meinertzhagen / 2018.
Die paarige Antenne besteht aus 3 Segmenten (Scape, Pedikel, Funiculus) und dem dünnen Fühler „Arista“. Über die Haare werden Reize wie Gerüche und Schall (Johnstons Orgel mit 150 Sklopidien im 2. Antennensegment) wahrgenommen. Der Geruchsweg läuft über die Sensillen, die auf dem 3. Antennensegment (Funiculus) sitzen. Die Anzahl bestimmter Rezeptoren ist geschlechtsabhängig. Der Antennenlappen (AL) wird im Zeilenbereich mit dem „biologischen“ Informationseingang=64 (zugleich Kugelform) in Z.288 und dem „physikalischen“ Informationsausgang=63 (6633) in Z.294 gewählt, der zugleich den Geschlechtsunterschied weiblich (66) und männlich (33) enthält. Die im Geruchszentrum verarbeiteten Signale leitet die Fliege an den paarigen Kelch (CA) des Pilzkörpers (MB) und an das Seitenhorn (LH) weiter. Beim Menschen geht vergleichsweise vom Riechkolben der Riechnerv „1“=1. Hirnnerv ab. Die Zeitdifferenz Z.288 - Z.294=316964444701317 enthält das Netzwerk 444 der kugelförmigen „64“ Glomeruli im Antennenlappen (AL) sowie Nerven als Eingang „7“ und Ausgang „1“, paarig 31_31. Alternative Zeilenbereiche können nicht gewählt werden, wenn es beispielsweise an der Paarigkeit mangelt. In „0_3646“ ist die Geruchsfunktion „64“ mit der Spiegelung „46“ sowie der Zahl 36 enthalten, die nachfolgend in „63“ zu wenden ist. Der Eingangsnerv von der linken oder rechten Antenne verzweigt mit der Doppelziffer „5_77“, paarig=2 in beide Antennenlappen. Die „55“ ist hier kein Muskel, sondern eine doppelte Struktur-5, weil mit der Spiegelung 77_5 noch der 2. Eingang des verzweigten Nervs „77_5“ des Oberkieferpalpen „Maxillary palp“ folgen muss: Epi.Y!Fliege.Z.288#155312577903646. Auf den linken und rechten Antennenlappen (AL) verzweigter Eingangsnerv „77_5“ vom Palpen, paarig=2: Epi.Y!Fliege.Z.289#154775164139273. Der weibliche=66 Antennenlappen (AL) ist mit 42_24 paarig und bildet mit der Quersumme QS 1+5+4+2+4+1+4+5+6+6+7+6+7+2+4=64 eine Kugel als Form=7: Epi.Y!Fliege.Z.290#154241456676724. Mit „701“ kann in der Antennen-Kugel „0“ der Eingangsnerv „7“ als Riechnerv „1“ herausführen, doppelt „11“ (zu MB und LH) und paarig=37_73: Epi.Y!Fliege.Z.291#153711417306701. Der Antennenlappen (AL) der Drosophila enthält die Anzahl von „50“ Glomeruli (andere Quelle 49), paarig=2. Für den männlichen „33“ Antennenlappen (AL) stehen ggf. „53“ Glomeruli als 1_53_1 bereit, die mit 53-50=3 birnenförmig oben im AL liegen. Es ist aber nicht bekannt, ob das Fliegenmännchen trotz anderer AL-Form insgesamt mehr Glomeruli besitzt: Epi.Y!Fliege.Z.292#153185008343322. Die Glomeruli sind äußerlich unterschiedlich, weil jeder Glomeruli einen speziellen Rezeptortyp bearbeitet. Die Glomeruli erscheinen nicht speziell im Zeilenlauf, so dass die Suche mittels Kettenreaktion für Time.Epi.Z.292 ausgelöst wird. Der 50. Glomeruli enthält rund=64 und weiblich=66 und der 53. Glomeruli männlich=33 und die Birnenform des AL mit Form=7_99=oben. Optimal rund „505“ wäre ein 55. Glomeruli für den „Schürzenjäger“ unter den Fliegen mit #23“50500“3907“64“58. Am männlichen AL sind einige Glomeruli voluminöser. Mit der Suchgröße 33 liegen vom 1. bis 48. Glomeruli 8 Rezeptortypen vor, weiterhin sind der 51. und 53. Glomeruli vergrößert. Die Rezeptoren verarbeiten eine unterschiedliche Anzahl von Düften; eine monotone Ziffernfolge für nur 1 Duftnote ist nicht erkennbar. Es ist sinnlos, dem Duft des Weibchens zu folgen, wenn es nicht umklammert wird [HENRY VALENTINO feat. Daffi Cramer - Im Wagen Vor Mir (OFFICIAL VIDEO) 'MEINE SCHÖNSTEN MELODIEN' - YouTube]. Die Klammer 2_66_2 ist männlich, weil die Ziffer 2=paarig=rechts=männlich besetzt werden kann. Außerdem kann der Sehnerv=2 bei der Auswahl hilfreich sein: Epi.Y!Fliege.Z.293#15266219261518. Abschließend 33_6633: Epi.Y!Fliege.Z.294#152142933456633.
Die Neuropile-Module entlang der Mittelachse um den durchgeleiteten Ösophagus sind vom Pilzkörper (MB) bis zum Antennenlappen (AL) erfasst. Der seitliche Bereich wird von den Facettenaugen und den Sehlappen (OL) besetzt. Von den 50 Neuropile-Modulen des Gehirns verarbeitet der paarige Sehlappen (OL) (Lobus opticus/ Optic lobe) mit seinen 4 Neuropilen [Lamina (LA), Medulla (ME), Lobula-Kompex (LOP) in Lobula (LO)- und Lobulaplatten (LOP)-Neuropile unterteilt] die Informationen des Facettenauges von den 800 Einzelaugen (Ommatidien) der Drosophila und überträgt die Informationen an das Zentralhirn (CB). Das Medulla-Neuropil (ME) enthält 10 Schichten (1-6 distal, 7-10 proximal). Die Lobula (LO) wird in 6 Schichten unterteilt. Das Lobulaplatten-Neuropil wird in 4 Schichten unterteilt, davon werden 2 Schichten jeweils in 4 Unterkassen unterteilt. Die „Ventrolateral Neuropils (VLNP)“ befinden sich direkt unter den Sehlappen (OL) und verarbeiten deren Informationen als nächsten Schritt.
6.) Die beiden Gehirnhälften werden mittig vom Ösophagus „808“ durchzogen. Hierfür ist die erst erfasste Position als „88088“ geeignet: Epi.Y!Fliege.Z.386#115880887140544. Die Formeinschnürung „707“ für den Hals folgt in Zeile Z.443.
7.) Die 3 Beinpaare bestehen aus Hüfte (Coxa), Schenkelring (Trochanter), Schenkel (Femur), Schiene (Tibia) und dem mehrgliedrigen Fuß (Tarsus), der bei der Fliege aus der maximalen Anzahl von 5 Tarsengliedern besteht. Das erste (obere) Tarsenglied ist länger und wird als Fersenglied (Metatarsus) bezeichnet. Das 10. Beinglied ist das Endstück (Prätarsus) mit speziellen Fortsätzen: 2 Klauen (Unguis) als Paar und 2 Haftläppchen (Pulvillus) als Paar. Das Sohlenläppchen (Empodium) und die Fußlappen (Arolium) sind weitere Fortsätze. Die Fliegenarten, wie Stubenfliege (Musca domestica), Schwebfliege (Eristalis pertinax) und Schmeißfliege (Calliphora vicina) unterscheiden sich lediglich in der Größe der einzelnen Elemente [ Mikroskopie siehe: (A–D) Fly pretarsus. (A–C) SEM-micrograph of the pretarsi and last... | Download Scientific Diagram (researchgate.net)]. Die Füße (Trasus) des Vorderfußes stehen vorn am Kopf. Der Zeilenlauf enthält hier die Serie mit den Zählgrößen #11, so dass genügend Härchen verfügbar sind. Als Besonderheit stellt die Fliege in der Mitte der Fliegenbeine eine klebrige Emulsion aus Kohlenwasserstoffen, Fettsäuren, Alkoholen und Wasser als Wirkstoff „88“ her. Durch feine Kapillare gelangt die Flüssigkeit dann zu einer Öffnung „88_0_88“ in den Haftplättchen [Siehe: Feuchte Füße: Warum Fliegen nicht von der Wand fallen - DER SPIEGEL / 2004]: Epi.Y!Fliege.Z.386#115880887140544. Die Haftläppchen (Pulvillus) sind mit unzähligen dünnen Härchen (Setae) „111“ besetzt, die jeweils mit kleinen ovalen Lappen enden. Dieser Lappen haftet auf den Oberflächen. Diese Lappen sind nicht vollständig flach, sondern bilden einen Rand mit einer hufeisenförmigen Wulst „505“: Epi.Y!Fliege.Z.400#11182505609062. Die Haftläppchen bilden insgesamt ein Netzwerk „4444“ als Ende=99: Epi.Y!Fliege.Z.405#110444499842593 [Mikroskopie siehe: Forschungsbericht 2003 - Max-Planck-Institut für Intelligente Systeme, Standort Stuttgart / Mikro- / Nanomechanik von biolo | Max-Planck-Gesellschaft (mpg.de)]. Die Kralle wird für einen beweglichen Aktionsraum mit dem Bixnom-Kreis=64 in Beziehung gesetzt. Das Krallenpaar als Spiegelung wird offensichtlich mit einem Gelenk „50_0_05“ zusammengehalten: Epi.Y!Fliege.Z.420#106500053419643.
Die Hüfte (Procoxa) ist real am Thorax noch vor dem 1. Atemloch (Stigma) der Zeile Z.555 angeschlossen. Der Schenkel (Profemur) kann nach der Hüfte erscheinen, weil das 1. Beinpaar nach hinten angewinkelt ist, um den Fuß nach vorn neben den Kopf zu stellen. Statt „111“ wird eine Alternative gewählt mit 11_1_5=Struktur_1; paarig=2 und 81_18: Epi.Y!Fliege.Z.546#819231180151099. Passend zur Struktur „151“ kann der anliegende Schenkelring (Protrochanter) als paariges Gelenk „5_101_5“ ausgewählt werden: Epi.Y!Fliege.Z.591#756853171510153. Schenkel (Profemur) „111“, paarig=71_17: Epi.Y!Fliege.Z.629#711129132531797. Die Schiene (Protibia) der Fliege muss im Zeilenlauf bereits passiert worden sein, weil sie angewinkelt zum Kopf ausgerichtet ist. Daher wird nur das Gelenk „7_00000_51115_0“ zwischen Femur und Tibia als Endpunkt benötigt: Epi.Y!Fliege.Z.639#700000351115024. Die Schiene (Protibia) „111“ liegt nunmehr vorgelagert im Kopfbereich, paarig=2 und 47_47 bzw. gespiegelt über die Zeilen-Nr. 42_24. Die Zeit=24 als QS 2+4=6=flexibel ist ebenfalls im Gelenk in Z.639 vorhanden, so dass eine Verbindung besteht: Epi.Y!Fliege.Z.425#105247111614706. Die Schiene (Protibia) endet mit einem Sporn (Tibial sporn). Der Sporn „115“, paarig=2 ragt über das Fußgelenk hinaus und kann je nach Fliegenart starr oder beweglich sein. An der Spitze ist nochmals eine „Borste „1“ als Extra=8 vorhanden: Epi.Y!Fliege.Z.419#106754230158115. Der Fuß (Tarsus) besteht aus 5 Fußgliedern (Tarsomere). Die 1. (obere) Tarsomere „11_115“ ist besonders lang. Die Länge wird gebildet, indem viele feine Haare als Zählgröße 11 in der Zeilennr. Z. 4=räumlich_11 und als Form 1_7_1, paarig=37_7_73 aktiviert werden: Epi.Y!Fliege.Z.411#108832171377737 und Epi.Y!Fliege.Z.403#110992611504342. 2. Tarsomere „111“: Epi.Y!Fliege.Z.402#111268712527985. 3. Tarsomere „111“: Epi.Y!Fliege.Z.401#111546190614090. 4. Tarsomere „111“: Epi.Y!Fliege.Z.400#111825056090625. 5. Tarsomere „111“: Epi.Y!Fliege.Z.396#112954602111742. Das Endglied (Prätarsus) des 1. Beinpaares ist vorgelagert.
Die mittlere Hüfte (Mesocoxa) des 2. (mittlere) Beinpaares liegt real etwas vor der Taille „707“ in Zeile Z.1201. Zum Anschluss des 3. (hinteren) Beinpaares kragt der hintere Thorax ventral weit nach hinten aus. Die hintere Hüfte (Metacoxa) liegt direkt vor der Taille, die weiteren Glieder liegen neben dem Abdomen.
Hüfte (Mesocoxa) 2. Beinpaar „111“, paarig=2: Epi.Y!Fliege.Z.882#507143111522109. Schenkelring (Mesotrochanter) „111_060“, paarig=29_92: Epi.Y!Fliege.Z.985#454111902906092. Schenkel (Mesofemur) „111“, paarig=50_50 oder über Zeilen-Nr. gespiegelt 05_50: Epi.Y!Fliege.Z.1005#445074850111941. Schiene (Mesotibia) „111“, paarig=2: Epi.Y!Fliege.Z.1088#411121529744945. Der Fuß (Mesotarsus) mit 5 Gliedern und der Prätarsus können sich bilden, weil im Zeilenlauf in der Zeilen-Nr.11xx als Bodenkontakt viele Möglichkeiten weitläufig adressierbar sind. Enthalten ist ein engerer Bereich der Zeilen Z.1110 bis Z.1119 der vorrangig nutzbar ist. Hüfte (Metacoxa) 3. Beinpaar „111“, paarig=2: Epi.Y!Fliege.Z.1195#374309811182009. Schenkelring (Metatrochanter) „111_606“, paarig=96_69: Epi.Y!Fliege.Z.1210#36966960691117. Schenkel (Metafemur) „111“, paarig=38_83: Epi.Y!Fliege.Z.1267#353038851114838. Schiene (Metatibia) „111“, paarig=2 in der Zeilen-Nr. Z.1_272 und gespiegelt QS 3+5=8_1_18: Epi.Y!Fliege.Z.1272#351651119781840. Die Fliege kann den Fuß (Metatarsus) bis hinter das Körperende setzen. Entsprechend sind ausreichend viele Möglichkeiten vorhanden, um die 5 Fußglieder (Tarsen) als „111“ zu bestimmen und den Prätarsus zum Bodenkontakt anzuschließen. Die 1. (obere) Tarsomere „111“, paarig=2: Epi.Y!Fliege.Z.1314#340411129651827. Die 2. Tarsomere „111“, paarig=2: Epi.Y!Fliege.Z.1620#276111249606482. Die 3. Tarsomere „111“, paarig=2: Epi.Y!Fliege.Z.1746#256185695511169. Die 4. Tarsomere „111“, paarig=2: Epi.Y!Fliege.Z.1876#238432955417111. Die 5. (untere) Tarsomere „111“, paarig=2: Epi.Y!Fliege.Z.1898#235669243605111. Nachfolgend werden die Elemente des Prätarsus für den Bodenkontakt benötigt.
8.) Die Bienen sind die engsten lebenden Verwandten der Ameisen. Die Ameisen besitzen mit dem Petiolus (Stielchenglied / Hinterleibsstiel) eine „2. Wespentaille“. Die unpaarige Wespentaille bildet sich aus einer Formeinschnürung „707“. Falls die „707“ unlogisch paarig anfällt, muss die Fliege daraus eine Alternative kreieren. Die Zweiflügler ersetzen das 2. Flügelpaar durch Stummelflügel als sogenannte Schwingkölbchen bzw. Haltere (siehe: Haltere – Wikipedia). Die Schwingkölpchen bestehen aus einem Stiel und einer Verdickung am Ende und ähneln in ihrer Form einem Trommelschlegel. Das unpaarige Ameisen-Stielchen muss ersetzt werden, weil die „707“ von einer paarigen Spiegelung „53_707_35“ als auslesbare Formeinschnürung blockiert wird. Die Bereich enthält mit „3333“ einen Hautbezug zu den Flügeln. Abschließend liegt erneut eine „707“ für die Kugelform eines Trommelschlegels „222“ vor, der mit paarig=2 als 7_2_7 beidseitig bzw. seitlich=9 als „7_9_7“ angeordnet ist: Epi.Y!Fliege.Z.945#473333570753969; Epi.Y!Fliege.Z.946#472833218142178; Epi.Y!Fliege.Z.947#472333922241289; Epi.Y!Fliege.Z.948#471835679707279. Zu den unterschiedlichen Nutzungen des Schwingkölbchens gehört auch die Gleichgewichtsfindung beim Fliegen. Die Zahl 84 = 64+20 ist für ein Gleichgewichtsorgan bereits bekannt. Die Zählgröße 11 für die Schwingungen des Schlegels „222“ ist ebenfalls vorhanden: Epi.Y!Fliege.Z.949#471338487210222; Epi.Y!Fliege.Z.950#470842341434211. Die Flügelstummel sind mit kuppelförmigen Sinnesorganen (campaniforme Sensillen) „11“ paarig =2 und Nerv=77 besetzt, die die Verformungen der Kutikula wahrnehmen (Siehe: Campaniforme Sensillen – Wikipedia). Kuppelförmig „4004“ ist der Bixnom-Kreis=64 in der Zeilen-Nr. 9“64“ und im Zeilencode: Epi.Y!Fliege.Z.964#464004382118776.
9.) Die Fliegen der Unterfamilie „Calyptratae“ bilden an der Basis der Flügel diskoide / membranöse Lappen (Calypter) aus. Je Seite sind 2 Lappen (Calypter) vorhanden. Der untere (proximale) Calypter wird auch als Squama / Tegula bezeichnet und verbindet den Hinterrand des Flügels mit dem Thorax. Der obere (distale) Calypter wird als Squamula bezeichnet [siehe: 1.) Calypter - Wikipedia; 2.) Łuseczka tułowiowa – Wikipedia, wolna encyklopedia]. Die Lappen überdecken die Schwingkölbchen und können mit diesen verwechselt werden. Beispielsweise gehören die echten Fliegen dazu, nicht aber die Taufliegen (Drosophilidae). Der untere Calypter kann flügelähnliche Form „7_333“ mit dem Bixnom-Kreis „64“ und paarig= 2 beginnen: Epi.Y!Fliege.Z.1176#380357333641582. Mit der Gegenform „7_46“ beginnt der obere Calypter „3303“, paarig=2 bei Epi.Y!Fliege.Z.1194#374623303486181. Der untere Calypter endet an der Taille vor dem Hinterleib: Epi.Y!Fliege.Z.1198#373372474426127. Der obere Calypter überdeckt die Taille (Z.1201) zum Hinterleib (Abdomen) bis Epi.Y!Fliege.Z.1217#36754332322309. Beispielsweise gehören die echten Fliegen (Muscidae) zu den „Calyptratae“, nicht aber die Taufliegen (Drosophilidae).
10.) Das Tracheensystem „202“ wird durch paarige Atemlöcher (Stigma) „0_202“ ventiliert. An der Brust (Thorax) ist ein vorderes Atemloch / Anterior Spiracle und ein hinteres Atemloch / Posterior Spiracle vorhanden. Entsprechend sind die Formeinschnürungen „707“ zwischen Kopf (Head) / Brust (Thorax) als Hals und Thorax/ Hinterleib (Abdomen) als Taille zu finden. Hals „707_05“: Epi.Y!Fliege.Z.443#100970705273702.
Mit seitlich=9 bildet sich ein Tracheenstrang 202_225, dessen Hohlquerschnitt mit 09_90 paarig gespiegelt ist: Epi.Y!Fliege.Z.491#910998420290225. Vorderes Stigma „0_202“, paarig als Strukturloch-Spiegelung „05_50“: Epi.Y!Fliege.Z.555#805946350202703. Hinteres Stigma „0_202“, paarig=2: Epi.Y!Fliege.Z.1057#423179020210502. Taille „707“. Wegen der Abtrennung 0_45“1“707 wird unpaarig=1 als Taille mit der Struktur 5 verknüpft, so dass paarig=2 (ggf.auch männlich oder rechts) ignoriert werden kann. Es bildet sich aber keine sehr enge Wespentaille: Epi.Y!Fliege.Z.1201#372439820451707.
11.) Das Nervensystem bildet sich beim Urinsekt als Strickleitersystem mit 3 Ganglienpaaren im Thorax für die Beinpaare und 8 Paaren im Abdomen. Für die Fliegen (Diptera) sind bei den Fliegenarten Musca, Calliphora und Lucilia die 3 Ganglienpaare für die Beine zu einem Ganglion fusioniert und es sind keine Abdominalganglion vorhanden (siehe: The nervous system and co-ordination / The Insects (entomologa.ru)). Die Zählung mit Nerv=7 erfolgt als Ganglion „777“ mit dem Zusatz einer Doppelzahl für das Paar. Zahlenspiegelung sind dabei unzutreffend. Beim 2. Thorakalganglion enthält die Dopplung „05_05“ mit „05“ ungünstig keine zweistellige Zahl, so dass die Ganglien zur Struktur-5 fusionieren können. Hierzu wird ein Gruppensymbol=44 benötigt. Mit seitlich=9 kann auch die Paarbildung zu einer Gruppe „49_94“ fusionieren. Wenn hierdurch das paarige Strickleitersystem gestört wird, können im Abdomen keine Ganglien als Nervenknoten entstehen und es verbleiben nur die Nervenbahnen zur Funktion: 1. Thorakalganglion „777_91_91“ für das vordere Beinpaar: Epi.Y!Fliege.Z.575#777913433673914. 2. Thorakalganglion „777_05_05“: Epi.Y!Fliege.Z.739#605277705497294. 3. Thorakalganglion „777_51_51“: Epi.Y!Fliege.Z.1184#377787351657517. Die Taille folgt vergleichsweise in Z. 1201. Statt der 8 Abdominalganglien des Urinsekt sind bei dieser Zählweise nur 5 Ganglien im Abdomen zu finden, was für Fliegen ggf. auch zutreffend sein kann (siehe Neuronale Systeme | SpringerLink). 1. Abdominalganglion „777_33_33“: Epi.Y!Fliege.Z.1350#331333499527778, 2. Abdominalganglion „777_18_18“: Epi.Y!Fliege.Z.1508#296618185916777. Die Dopplung „04_04“ enthält keine zweistellige Zahl und wird nicht als Abdominalganglion „777_04_04“ in Epi.Y!Fliege.Z.1570#284904601504777 gewertet. Weil 04_04 wie eine Gruppe=44 wirkt, können sich damit auch das 1. + 2. Abdominalganglion wie bei der Familie der Bremsen / Viehfliegen (Tabanus) vereinigen (siehe: Insekten-Nervensystem - Lexikon der Neurowissenschaft (spektrum.de)). 3. Abdominalganglion „777_75_75“: Epi.Y!Fliege.Z.2008#222759075877739. 4. Abdominalganglion „777_87_87“: Epi.Y!Fliege.Z.2556#175000087778756, 5. Abdominalganglion „777_30_30“: Epi.Y!Fliege.Z.3438#130104777301484. Das Körperende liegt vergleichsweise mit dem After „808“ in Zeile Epi.Y!Fliege.Z.3849#116212061408808. Bei den Bremsen (Tabanus) ist statt dem 4. + 5. Ganglion eine Kette von 5 Ganglien vorhanden, so dass es insgesamt 8 Abdominalganglien sind. Die Anzahl 5 kann aus „50000“ stammen, wobei der Anteil QS 8+7+7+7+8+7=44 eine Gruppe bildet. Die Restgröße „56“ ist auch in der Zeilennummer enthalten und ist mit QS 5+6=11 eine Zählgröße für die 5er Kette.
12.) Der Hinterleib (Abdomen) besteht bei den Insekten aus 6 bis 11 Abdominalsegmenten zuzüglich dem Aftersegment. Mindestestens müssen bei der Fliege somit 6 + 1 Aftersegment = 7 Segmente im adulten Stadium verbleiben. In den 7 Segmenten ist für die Ventilation der Tracheen jeweils 1 Paar von Atemlöchern (Stigma) notwendig. Incluse der beiden Paare im Thorax sind es 2 + 7= 9 Paare bzw. 18 Einzelöffnungen (Stigmen). Diese 7 Segmente sind bei der Tsetse-Fliege (Glossina) vorhanden (siehe: Biologie, Systematik und Verbreitung von Tsetze (fao.org)). Die 7 Stigmen-Paare „0202“ bzw. „2020“ müssen zusätzlich einen Hinweis auf die paarige Anordnung enthalten: 1. Abdominal-Stigma „0202_83_83“: Epi.Y!Fliege.Z.1481#302025809832883, 2. Abdominal-Stigma „0_0202_2“, paarig=2 zuzüglich Doppel-Null: Epi.Y!Fliege.Z.1792#249609500202288, 3. Abdominal-Stigma „2020_32_32“: Epi.Y!Fliege.Z.2214#202032621663279, 4. Abdominal-Stigma „8_0202_082“; statt einer Dopplung wird die Spiegelung 80_08 als paarig angerechnet, weil das Loch „0“ direkt adressiert ist: Epi.Y!Fliege.Z.2379#188020270854351. 5. Abdominal-Stigma „0202_52_5“0“2“; die eingeschobene Null kann ignoriert werden, weil das Loch „0“ direkt adressiert ist. Weiterhin ist die paarig=2 markiert als „525“: Epi.Y!Fliege.Z.2676#167152550210202. 6. Abdominal-Stigma „2020“; in der Spiegelung „8“1“0“1“_080“ kann die Ziffer „1“ ignoriert werden, weil das Loch „0“ lediglich unterstützend markiert wird: Epi.Y!Fliege.Z.3318#134810194202080. 7. Abdominal-Stigma „52020_52“. Die „52“ steht ungünstig vorn nicht als separate Zahl. Eine zweite Null ist in „10“ vorhanden, wobei die Spiegelung „01“ in der Zeilen-Nr. 34“01“ steht. Epi.Y!Fliege.Z.3401#131520207104528.
13.) Für die 7 Segmente im Abdomen werden 6 Formtrennungen benötigt, die wegen Form=Nerv=7 wie die Ganglien als „777“ adressiert sind. Es wird eine Formspalt dargestellt, der jeweils am Segmentende liegt. Das Aftersegment entdet als Körperende. Im Unterschied zu den Ganglien werden jetzt die Spiegelungen zur Formabgrenzung verwendet: 1. Segmentende „777_63_36“: Epi.Y!Fliege.Z.1700#263117779036765, 2. Segmentende „777_17_71“; die Zahl 17 greift ungünstig in 777 ein. Ersatzweise wird paarig=2 direkt angezeigt: Epi.Y!Fliege.Z.2054#217770313711052, 3. Segmentende „777_20_02“: Epi.Y!Fliege.Z.2234#200223914217771, 4. Segmentende „777_82_28“: Epi.Y!Fliege.Z.2516#177782283132949, 5. Segmentende „777_29_92“: Epi.Y!Fliege.Z.2666#167779529018192, 6. Segmentende „777_75_57“: Epi.Y!Fliege.Z.3253#137503911577774.
14.) Fliegenhals: Die Formeinschnürung „707“ am Hals liegt in Epi.Y!Fliege.Z.443#100970705273702. Der Hals weitet sich als „7007“ bis zum Thorax in Epi.Y!Fliege.Z.451#991796506347007. Die Umgebung des Fliegenhalses ist mysteriös: Die Fliegen (Dipteren) besitzen im Larvenstadium direkt hinter dem Gehirn eine Ringdrüse (Ring gland), die sich aus verschiedenen Hormondrüsen zusammensetzt. Damit diese Ringdrüse im Zeilenlauf hinter der Formeinschnürung „707“ für den Hals erscheint, müsste der Fliegenkopf leicht nach hinten geneigt sein [siehe Foto: https://www.istockphoto.com/de/foto/seitliche-fliegen-kopf-gm696896816-129023619 ]. Bei der aldulten Fliege (Imago) sitzen Bestandteile der Ringdrüse gemäß wissenschaftlichen Abbildungen aber im Thorax vor dem Proventriculus - wieso? Die Ringform der Drüse bildet sich, in dem sich die unpaarige Drüse „Corpora allata“ oben zwischen die paarige Prothoraxdrüse schiebt und sich unterseitig ein Bogen durch die Drüse „Corpora cardiaca“ anlegt. Andere Quellen erwähnen weiterhin noch die Pericardialdrüsen und das Ganglion hypocerebriale; siehe: (PDF) Über die Wirkung des Puparisierungs-hormons bei der Wildform und der Mutante 1gl von Drosophila melanogaster (researchgate.net) / P. Karlson und G. Hanser / Z. Naturforschg. 7 b, 80—83 /Jahr 1952]. Weil die Prothoraxdrüse die Puppenbildung anregt, degeneriert die Drüse bei den Dipteren bereits im Puppenstadium und ist bei der adulten Fliege (Imago / Vollinsekt) folglich nicht mehr vorhanden [siehe: Prothoraxdrüse - Lexikon der Biologie (spektrum.de)]. Der Drüsenkomplex (Ringdrüse / Weissmann-Ring) der Larve kann sich somit in den Thorax verschieben. Hierbei wird nunmehr die Degeneration der Prothoraxdrüse als „00000“ mit der Drüse seitlich=9 und paarig=2 identifiziert: Epi.Y!Fliege.Z.497#900000451433602. Die weiteren Drüsenbestandteile bilden eine Gruppe=44 ab Epi.Y!Fliege.Z.498#898193221611446. Corpora allata: Epi.Y!Fliege.Z.499#896393235195391 und Epi.Y!Fliege.Z.500#894600448725001. Corpora cardiaca / Hypocerebrial Synganglion mit Nerv=7: Epi.Y!Fliege.Z.501#892814819086827 und Epi.Y!Fliege.Z.502#891036303510957. Es folgt eine Serie #88, die als Wirkstoff viele Hormone darstellen kann von Epi.Y!Fliege.Z.503#889264859567595 bis Epi.Y!Fliege.Z.508#880512252682087.
15.) Speicheldrüse (Salivary gland): Im Larvenstadium sondert die Speicheldrüse das Material für die Verpuppung ab. Die Zellen können aufgrund der extremen Größe einfach betrachtet werden, weil sich die Chromosomen vermehren, ohne sich zu teilen.
Analog zur Ameise wird erwartet, dass die Ausführungsgänge der paarigen Speicheldrüse (Salivary gland) „8888“ im vorderen Brustabschnitt der Fliege in einem unpaarigen Speichelgang (Salivary duct) zusammengeführt werden, der zum Rüssel führt. Weil sich die Speicheldrüsen im Thorax erst weiter hinten neben dem Kropf befinden, muss der dünne Speichelgang verzweigen, um die Strecke bis zu den Speicheldrüsen zu überbrücken. Der Kropf besitzt mit dem Kropf-Kanal (Crop duct) ebenfalls eine vorgelagerte Struktur. Die Lage von Kropf und Speicheldrüsen kann sich real bis in den Hinterleib (Abdomen) ausbreiten.
Annahme eines unpaarig zusammengeführten Speichelganges „08550_888“ in Epi.Y!Fliege.Z.564#79308550418883. Verzweigung des Speichelganges (Salivary duct) 8888, paarig=2 und 84_48 als Strecke bis zu den beiden Speicheldrüsen (Salvary gland): Epi.Y!Fliege.Z.567#788889284589948.
Bei der Ameise entsteht der Speichelgang mathematisch kompliziert: Erst vor dem Gehirn an den Mundwerkzeugen zeigt sich „707“, wobei die Ziffer 7 als chemischer Rezeptor wie ein Nerv=7 wirkt. Im vorderen Thorax können sich schlauchartige Strukturen zeigen. Hierbei handelt es sich um Malpighi-Schlauche, die am Ausgang des Mitteldarms beginnen und mit 1 Paar bis in den Thorax auslaufen. Bei den Insekten können sich am Anfang des Mitteldarms seitlich Blindsäcke (Gastric Caecum) ausformen. Im Larvenstadium der Fliege sind 2 Blindsäcke je Seite vorhanden, die in der Regel bei der Verpuppung aufgelöst werden.
Die Position des Kropfes kann im Zeilenlauf bestätigt werden, weil die paarige Speicheldrüse incl. Speichelgang den Kropf-Kanal (Crop-duct) begleitet und beidseitig neben dem Kropf endet. Bei den Bohrfliegen (Tephritidae) bilden sich die Speicheldrüsen geschlechtsabhängig. Die weibliche Speicheldrüse zeigt sich in der Skizze als gesteckter Zylinder. Die männliche Speicheldrüse bildet eine zylindrisch gewickelte Spule, die am Ende in eine imposante Drüsenkugel übergeht. Dieser Drüsenanhang fehlt beim Fliegen-Weibchen.
Statt „808“ als Speiseröhre (Ösophagus) kann das Ende=9 des Speichelganges, paarig=2, adressiert sein, weil die Ziffer 8 (Verdauungssystem) dreifach vorliegt und nochmals in der Zeilennummer Z.QS 7+1=8_8 vorhanden ist. Ende Speichelgang (Salivary duct): Epi.Y!Fliege.Z.718#622980813875349. Nachfolgend beginnt mit „88“ zunächst die männliche Speicheldrüse „33“, paarig=2, Struktur=5, mit den Windungen als Zählgröße „11“, die auch in einer weiteren Zeile vorhanden ist und ggf. die Anzahl der Windungen bestimmt: Männliche Speicheldrüse 33_5_88: Epi.Y!Fliege.Z.719#622114359335884 und Epi.Y!Fliege.Z.720#621250311614584. Weibliche Speicheldrüse 88_66, paarig 69_69: Epi.Y!Fliege.Z.721#620388660696949 und Epi.Y!Fliege.Z.722#619529396623962. Die Ziffer 9=Ende ist durch 6_9_6 markiert, so dass die weibliche Speicheldrüse enden kann: Epi.Y!Fliege.Z.725#616965826706897. Die männliche Drüsenkugel 33_373_88 bildet paarig=2 eine Volumenform 7_400: Epi.Y!Fliege.Z.730#612740033373288. Für die Kugelform des männlichen Drüsenanhangs stehen 2 Zeilen mit dem Bixnom-Kreis „64“ zur Verfügung. Die Oberfläche ist blasenartig "606" wie ein Blumenkohl gestaltet: Epi.Y!Fliege.Z.737#606920250152646 und Epi.Y!Fliege.Z.738#606097864989838.
16.) Verdauungstakt (Digestive System) im Thorax: Die Verdauungsorgane sind vergleichsweise bereits von der Ameise bekannt. Die im Kropf (Crop) gesammelte Nahrung dient aber nicht zur Fütterung von Artgenossen, so dass der Kropf kein Sozialmagen ist. Der Rüssel / Schlund geht innerhalb des Kopfes (Head) in den Ösophagus über. Der Ösophagus zieht mittig durch die beiden Gehirnhälften in Epi.Y!Fliege.Z.386#115880887140544. Oberhalb zieht ein Nerv „77“ mit durch die Gehirn-Öffnung Epi.Y!Fliege.Z.384#116484433427734 und Epi.Y!Fliege.Z.385#116181876457792. Außerdem zieht oberhalb die Aorta „500“ mit entlang, die bereits weiter vorn adressiert ist: Epi.Y!Fliege.Z.360#124250062322917.
Als Kuriosum ist der Ösophagus bei einigen Fliegenarten innerhalb der Kopfes (Head) zu einer Speiseröhren-Zwiebel „Dorsal esophageal bulb (EB)“ ausgeformt. Dieses ist bei den Bohrfliegen (Tephritidae) der Fall. Die Taufliege (Drosophila melanogaster) wird wie die Bohrfliege ebenfalls als Fruchtfliege bezeichnet, was zur Verwechlsung führt. Eine Volumenbildung „8_00_Struktur=5 _oben=9_Verdauung=8_Hautvolumen=30000“ ist vorhanden in Epi.Y!Fliege.Z.375#119280059830000. Hierbei ist die Blasenform als Gegenform zum Bixnom-Kreis=64 als QS 1+1+9+2+8+0+0+5+9+8+3=46 vorhanden.
Die gegenüber der Ameise veränderte Zeit „Time.Epi.Fliege“ bewirkt, dass sich der Kropf (Crop / Ventral Diverticulum) und der Proventriculus als Organe des Vorderdarms (Foregut) vom Hinterleib (Abdomen) in die Brust (Thorax) verschoben haben. Der Kropf hängt schlauchartig an einem dünnen Kropf-Kanal [Crop duct (CD)] und kann sich bei der Füllung bis in den Hinterleib ausdehnen. Anatomie siehe: 1.) „Fly foregut and transmission of microbes / John G. Stoffolano; Advances in Insect Physiology, Volume 57, 2019, Pages 27-95 (https://doi.org/10.1016/bs.aiip.2019.10.001); Fly foregut and transmission of microbes - ScienceDirect; https://www.sciencedirect.com/science/article/pii/S0065280619300207 . 2.) Structural Differences in the Digestive Tract Between Females and Males Could Modulate Regurgitation Behavior in Anastrepha ludens (Diptera: Tephritidae) / Larissa Guillén / Journal of Insect Science, 2019, Vol. 19, No. 4 / https://www.scienceopen.com/document_file/6938c9fa-4195-46a5-80c1-bd6164894f54/PubMedCentral/6938c9fa-4195-46a5-80c1-bd6164894f54.pdf .3.) Anatomy and Physiology of the Digestive Tract of Drosophila melanogaster | Genetics | Oxford Academic (oup.com) / Irene Miguel-Aliaga / Genetics, Volume 210, Issue 2, 1 October 2018, Pages 357–396 ( https://doi.org/10.1534/genetics.118.300224).
Bei den Insekten hat nur der Mitteldarm einen endodermalen Ursprung [innere der 3 Keimblätter], um die zur Verdauung notwendigen Zellen zu bilden. Vorder- und Hinterdarm sind ektodermalen Ursprung [äußere der 3 Keimblätter], so dass eine Auskleidung durch die Kutikula vorhanden ist. Der Übergang vom Vorderdarm zum Mitteldarm findet in einer donutförmigen Blase statt, für die es keine genaue wissenschaftliche Bezeichnung gibt - üblich sind Proventriculus, Kardia oder Proventriculus / Kardia für den „Donut“. Der Proventriculus gehört zum Vorderdarm und verfügt direkt im Donut über keine vor- oder nachgelagerten Ventile. Die Kardia (Mageneingang) ist ein klappenartiges Organ an der Verbindung zwischen dem Vorderdarm und dem Mitteldarm, die eine peritrophe Matrix absondert. Der Mitteldarm zieht sich über die Funktionsabschnitte R1 bis R5 bis in den Hinterleib (Abdomen). Die Kardia wird in diesem Modell als R0 bezeichnet. R2 liegt im Hinterleib und dreht sich im letzten Bereich als Bogen von dorsal nach ventral herunter. R3 ist der mittele Mitteldarm und enthält Kupferzellen (Kupfer=29). Der Bogen wird ventral aufgenommen und kreisförmig wieder dorsal hochgezogen. Das Ende R3 erscheint im Scann des Zeilenlaufes somit vor dem Ende R2. Zitat: „This region initiates a retrograde folding of the midgut, (from posterior to anterior), and it follows a ventral-dorsal axis“; 3D-Mitteldarm-Modell siehe: „Anatomy of the Drosophila adult midgut“; https://flygut.epfl.ch/anatomy .
Der Abschnitt R3 wird als Magenmuskel „555“, Kupfer=29 und Verdauungstrackt=8 ermittelt. Aufgrund der Rückdrehung ist die 1. der 3. gefundenen Positionen bereits das Ende von R3 (Anschluss an R4): 1.) Ende Mitteldarm-Teilstück R3 (Anschluss an R4): Der Token-86 bezeichnet mit „86_555_29“ den Magenabschnitt R3: Epi.Y!Fliege.Z.1361#328655565292065. 2.) Mitteldarm-Teilstück R3: Kupfer=29 ist doppelt vorhanden. Die Ziffer „8“ ist in der Zeilen-Nr. 15“38“ gespiegelt als „83“ in der Zeile vorhanden. Epi.Y!Fliege.Z.1538#290832395554291. 3.) Anfang Mitteldarm-Teilstück R3 (Anschluss an R2) „8_555_29_8“: Epi.Y!Fliege.Z.1730#258555042984104. Das Teilstück R3 kann als Gegendrehung „46“ zum Bixnom-Kreis=64 als Bogenstück verlaufen, das im Zeilenlauf bereits vor dem Anfang R3 (Anschluss an R2 ) vorliegen muss. Hierzu wird eine Formgruppe „44_878“ gebildet, die auf die Verdauung=8 bezogen ist (auch in der Zeilennummer enthalten). Der Bogen erscheint als Darmmuskel „55“ mit der Gegenform „46“ als Form=7 am rechten Zahlenrand. Kupfer=29 ist für R3 adressiert: Epi.Y!Fliege.Z.1718#260361015344878 und Epi.Y!Fliege.Z.1719#260209554602967.
Das Mitteldarm-Teilstück R4 zieht nicht zum Hinterdarm weiter, sondern krümmt durch eine weitere Drehung wie eine „Brezel“ noch weiter nach vorn und liegt dann bei gegensätzlicher Transportrichtung neben neben dem Mitteldarm-Teilstück R2. Nach einer weiteren Krümmung im unteren (Ventral) Bereich wird die horizontale Richtung zum Hinterdarm über den Mitteldarm-Teilstück R5 realisiert. Das Ende des Mitteldarm-Teilstück R4 liegt im Zeilenlauf hinter dem Anfang des Mitteldarm-Teilstück R3 (Zeile Z.1730). Der Mitteldram „808“ im Abschnitt R4 durch einen Bogen aus Bixnom-Krümmung 64 und Gegenbogen 46 als „646“ beschrieben. Zugleich sind der Token-86 und die Zeit=24 enthalten enthalten. Mit Ende=9 kann „90099_8“ den gerade gestreckten Endbereich adressieren; Epi.Y!Fliege.Z.1803#248086646900998. Durch diese Brezel-Krümmungen wird die Zeit zusammengeschoben, um im Zeilenlauf die morphologische Detail der Organe unterzubringen. Die Kupferzellen sind zur Orientierung bei der Faltung der „Brezel“ notwendig. Der Anfang des Mitteldarm-Teilstück R5 liegt noch vor der kaudalen Ausdehnung des Bogens R2. Erst dass Ende des Mitteldarm-Teilstück R5 führt weiter. An dieser Position kann nach einem üblichen Schließmuskel und den Malpighi-Schläuchen (Malpighian tubules) zur Überprüfung gesucht werden. Ende des Mitteldarm-Teilstück R5 „80888_46“ : Epi.Y!Fliege.Z.2051#218088846593125. Die Taufliege (Drosophila melanogaster) bildet zwischen Mittel- und Hinterdarm 2 Paare von Malpighi-Schläuchen (Malpighian tubules) aus, davon sind 1 Paar nach vorn und 1 Paar nach hinten (posterior) ausgerichtet. Jedes Paar vereinigt sich zu einem Harnleiter, so dass schließlich nur die beiden Harnleiter [Ureter] am Verdauungstrakt angeschlossen sind. Der Harnleiter ist zum Urintransport von Muskelschichten umgeben. Die Malpighi-Schläuche regulieren den Calciumspiegel (Calcium=20) im Körper. Im Harnleiter setzen sich ringförmige Steine ab, die aus Calcium, Magnesium, Kalium, Carbonat, und Phosphat bestehen. Info siehe: „Drosophila Melanogaster as an Emerging Translational Model of Human Nephrolithiasis“, Joe Miller1/ J Urol. 2013 November / https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3842186/pdf/nihms496284.pdf/?tool=EBI .
Das Calcium=20 zieht sich für die Regulierungsfunktion der Malpighi-Schläuche über einen weiten Zeilenbereich dahin, bis das Schlauchpaar 83_7_83 ´jeiweils in einem Harnleiter „101“ zusammengeführt wird. Ende Malpighi-Schläuche: Epi.Y!Fliege.Z.2099#213101583783945. Der Harnleiter bildet ein Volumen 3000, Hautmerkmale 333. Der Token-86 ist vorhanden. Die Zahl „101“ ist nunmehr in der Zeilennummer enthalten: Epi.Y!Fliege.Z.2100#213000106839286 und Epi.Y!Fliege.Z.2101#212898726493337. Um die Harnröhre funktionell in die Länge zu ziehen, ist das Lumen mit Zählsteinen „11“ in einer Reihe vollgepackt. Die Steine werden zunächst als Stein-Gruppe „11_44“ avisiert: Epi.Y!Fliege.Z.2109#212091144790185. Die Zählgröße 11 ist nachfolgend über 10 Zeilen (Steine) in der Zeilennummer und zugleich in der Zeile enthalten. Calcium=20 wird in 4 Steinen adressiert. Für die Ringform der Steine ist Calcium=20 als 020 und 200, Kalium als 19 und 109, Magnesium als 12 und 102 und Phosphor als 15 und 105 enthalten. Die beiden Harnleiter mit jeweils einem Paar von Malpighi-Schläuchen könnten dann mit „2_077_8808“ am Hinterdarm angeschlossen sein. Der Token-86 ist vorhanden. Harnleiteranschluss: Epi.Y!Fliege.Z.2153#207756722880864. Der hintere Mitteldarm entspricht dem Dünndarm der Säugetiere, und der Hinterdarm entspricht derem Dickdarm.
Bei der Ameise liegt die Verbindung zum Proventriculus innerhalb des Kropfes im Hinterleib (Abdomen). Die Nahrung kann somit als Sozialmagen wieder hochgewürgt oder alternativ durch den Proventriculus in den Privatmagen weitergeleitet werden. In der Zwischenlage zwischen Kropf und Magen besitzt der Ameisen-Proventricus am Ein-und Ausgang Ventile zur Steuerung des Nahrungsstroms. Bei der Fliege verzweigt sich die Speiseröhre (Ösophagus) „808“ bereits im Thorax in den oberen Hauptnahrungsweg zum Proventriculus und in den unteren Kropfgang [Crop duct (CD)] zum abflusslosen Kropf (Crop), der aus 2 Lappen besteht. Der Fliegen-Proventriculus besitzt direkt selbst kein Ventil. Als Zweck ist lediglich seine Formgebung als „Donut“ mit dem einmündendeen Ösopagus zu erkennen, weil in der Hinterwand des Donuts der Schließmuskel des Mageneingangs (Cardia) [Nr. „S5“ im Modell] eingebunden ist. Der „Donut“ als kleines Doppelorgan „Proventriculus / Cardia“ liegt hinter der Verzweigungsstelle zum Kropf, so dass auch der Mitteldarm (Midgut) bereits im Thorax beginnt und in mehreren Funktionsabschnitten bis in den Hinterleib (Abdomen) zum Hinterdarm (Hindgut) weiterzieht.
Bei Senken des Rüssels zum Aufsaugen der Nahrung muss das Nervensystem der Fliege zwischen der Richtung zum Magen oder zum Kropf entscheiden. Die Nahrung kann vom Kropf nur durch das Hochwürgen (Regurgitation) den Weg durch den Proventriculus zum Magen finden.
Die Entwässerung des Kropfes erfolgt, in dem die Flüssigkeit als sprudelnde Blasen vom Kropf in den Rüssel gelangt und dort verdunstet.
Bei der Ameise liegen im Zeilenlauf vor dem Kropf keine Strukturzeilen, sondern Funktionszeilen zum Nahrungstransport. Es gilt das Eisenbahnprinzip für eine eingleisige Strecke mit einem Token-86 (8=Verdauung / 6=flexibel): Wer den Token besitzt, darf fahren. Entsprechend sind auch bei der Fliege Hinweise zu Ventilen, Schließmuskeln und Pumpen zu erwarten, um die Nahrungstransportrichtung im Vorderdarm (Foregut) zum Proventriculus oder alternativ zum Kropf (Crop) zu definieren.
Der Verdauungsstrakt ist in einer Modellskizze dargestellt - siehe: „Fly foregut and transmission of microbes“. Der Speichelgang (Salivary duct) und eventuell existierende Blindsäcke (Caecum) sind in der Skizze nicht enthalten. Das Funktionsmodell des Verdauungstraktes gliedert sich in die Pumpenabschnitte P1 bis P6, die sich durch die Trennung mittels zwischengeschalteter Schließmuskeln (Sphincter) S1 bis S5 bilden.
Pumpenabschnitt P1: Die Nahrung wird durch die Zibarialpumpe (Cibarial pump) aufgenommen und durch den Rachen gefördert. Der Insektenhals ist in der Reihenfolge nicht genannt. Im Thorax beginnt der Verdauungstrakt unverständlich als „80080“. Mit Ende=99 und paarig=2 und der Gruppe 44 in der Zeilen-Nr. Z.44_8 können nach vorn gerichtete embryonale Blindschläuche angenommen werden, die mit 8“0“9 jedoch in der Regel bereits wieder aufgelöst wurden: Epi.Y!Fliege.Z.448#998438000809152.
Der Schließmuskel S1 „Nerv=7_55=Muskel“ im Ösophagus „8008“ liegt gemäß Skizze etwa am Anfang des Thorax und öffnet den Pumpenabschnitt P2. Für die unpassende Ziffer 2=paarig wird alternativ ein Auf/Zu-Fall als Ventil benötigt. Die Quersumme QS 9+2+8+0+0+8+7+6+4+2+3+7+5+5+2=68 ergibt eine Sperrung als Umkehrung des Token-86 für einen freien Fahrweg: Epi.Y!Fliege.Z.482#928008764237552. Gesperrt ist ebenfalls 222_“68“_7=Nerv: Epi.Y!Fliege.Z.485#922268503840207. Vergleichsweise ist „202_606“ ein freier Durchgang. Der Token-86 ist in der Zeilen –Nr. Z.4_86 enthalten: Epi.Y!Fliege.Z.486#920370832021606. Der Schließmuskel S1 versperrt den Rückfluss zum Rüssel, damit Nahrung bedarfsweise zwischen Kropf und Magen umgeleitet werden kann.
Oberhalb des Pumpenabschnitts P2 hat sich die im Larvenstadium aktive Ringdrüse (Weissmann-Ring) mit „00000“ teilweise aufgelöst, so dass noch Drüsenbestandteile verbleiben. Der Corpora allata folgt die für Fliegen (Diptera) typische Verschmelzung von Corpora cardiaca und Hypocerebralganglion: Epi.Y!Fliege.Z.497#900000451433602. Die Aorta „500“ im Thorax vom Herzschlauch im Abdomen ist in diesem Bereich ebenfalls adressiert: Epi.Y!Fliege.Z.504#887500445163691.
Der Ösophagus wird statt „808“ gedehnt als „070_8008“ adressiert: Epi.Y!Fliege.Z.512#873633250708008. Am Ösophagus liegt im Pumpenabschnitt P2 gemäß Skizze ein Vorderdarm-Dehnungsrezeptor (Foregut stretch receptor) über eine Nervenverbindung seitlich an. Die Dehnung kann über den Token-86 und 86_6_86“ dargestellt werden. Die Dehnung führt zu einer Begrenzung 999=Ende. Mit der Ziffer 2=paarig ist der Dehnungsrezeptor beidseitig vorhanden. Über den Nerv=7 kann der Füllstand des Kropfes signalisiert werden: Epi.Y!Fliege.Z.516#866860899927326. In der Zeilen-Nr. QS 5+2=7=Nerv=Form wird der Token-86 doppelt erwähnt: Epi.Y!Fliege.Z.520#860192739158654.
Der Ösophagus „808“ verzweigt im Pumpenabschnitt P2 in 2 unpaarige Ausgänge: 1.) Über den Proventriculus wird der Hauptnahrungsweg zum Magen (Ventriculus / Midgut) am Mageneingang (Kardia / Cardia) geöffnet. [Beim Menschen geht die zweischichtige Speiseröhrenmuskulatur in die dreischichtige Magenmuskulatur über. Die spiralförmig verlaufende Muskelschlingen ("Musculus sphincter cardiae") verhindern durch ihre Kontraktion, dass der Mageninhalt in die Speiseröhre gelangt (Reflux).] Bei der Fliege ist am Mageneingang (Kardia) der Schließmuskel S5 (S4 gehört zum Kropf) angeordnet. 2.) Am Verzweigungspunkt beginnt als alternativer Nahrungsweg der „Kropf-Kanal (Crop-duct) „8008“. Verzweigungsstelle „8080080_QS 3+4+1=8“ . Für den Nahrungstransport in wechselnde Richtungen ist an der Verzweigung ein Muskel „555“ adressiert: Epi.Y!Fliege.Z.529#845558080080341.
Proventriculus und Kardia bilden eine Kapsel in Form eines Donuts. Die Rundform ist in der Zeilen-Nr. Z.QS5+3=8_0 und in der Zeile als Bixnom-Kreis „64“ enthalten. Epi.Y!Fliege.Z.530#843962687476416. Lochform im „Donut“ „373_303“: Epi.Y!Fliege.Z.531#842373303884181. Die peritropische Membran „8_5_33303“ mit Ausscheidungen (Matrix) zur Auskleidung / Bolus-Umhüllung im Mitteldarms wird bei den Fliegen in der Kardia gebildet: Epi.Y!Fliege.Z.548#816241285333030. Der Schließmuskel S5 „55“ ist mit „070“ zunächst eine offene Form. Es folgen dann 10 Zeilen als Serie mit dem Muskel „55“ in der Zeilennummer, um den Schließvorgang zu adressieren:
Epi.Y!Fliege.Z.549#814754507035520 und Epi.Y!Fliege.Z.550#813273135204546. Die Rückseite des „Donuts“ wird durch die Gegenform „46“ zum Bixnom-Kreis „64“ gebildet „7_5_040064_7“: Epi.Y!Fliege.Z.560#798750400647322. Der anschließende Mitteldarm (Abschnitt R1) bildet an der Oberfläche ein rechteckförmiges „4“ Netz „9_44_9“ auf deren Feldern jeweils eine erhabene=9 Form blockartig heraussteht. Die Zählgröße 11 ist indirekt in der Reihe „4_18_18_16_16_4“ enthalten: Epi.Y!Fliege.Z.560#794494181816164.
Der Kropf-Kanal (Crop duct) „808“ bildet den Pumpenabschnitt P3. Der Token-86 als Transportstrecke ist enthalten: Epi.Y!Fliege.Z.573#780628663808901. Am Kropfkanal-Eingang liegt der Schließmuskel S2 „55“. Der Kropfkanal wird vom Kropfnerv (Crop nerve) „77“ begleitet: Epi.Y!Fliege.Z.574#779268683558363.
Die Kropfentleerung kann über das Nervensystem kontrolliert werden. Bei der Fliegenart „Drosophila subobscura“ kann das Männchen „33“ ein Brautgeschenk (Nubtial gift / Wedding gift) mit dem Weibchen „66“ teilen. Bei der Paarung führen Männchen und Weibchen einen Balztanz auf. Zur männlichen Kropfaktivität muss die Männlichkeit „33“ und Sex=6 gesondert in der Zeilennummer Z.6“33“ adressiert sein, und in der Zeile müssen „männlich=33“ und „weiblich=66“ als Tanz gemeinsam erscheinen. Mit QS 7+0+6+6+3+5+4+2+5+5+3+3+1+7+6=63=Physik kann das Hochzeitstänzchen beginnen. Die Paarung kommt aber nur durch „1“ Aktion des Weibchens zustande, die den Rüssel ausfahren muss, um den Partner zu akzeptieren. Addition 63 + 1 Aktion= 64=Biologie: Epi.Y!Fliege.Z.633#706635425533176. In der Folgezeile ist der Binom-Kreis=64 in Z.6_3_4 ansatzweise enthalten. Für den Nahrungsbolus „1“ als Geschenk des Männchens müssen nunmehr der Token-86 und der Muskel 55 zum Hochwürgen aktiviert werden. Die Quersumme ergibt „65“. Der Bixnom-Kreis=64 für den Tanzkreis=64 der Hochzeit folgt als Subtraktion 65 - 1 (Bolus) = 64: Epi.Y!Fliege.Z.634#705520858615931.
Der Kropf-Kanal endet an der Mündung in den Kropf (Crop) mit dem Schließmuskel (S3) „5_6_55_6_5“: Epi.Y!Fliege.Z.644#694565565780280. Weiter bis zum Schließmuskel „55“ in der Zeilennummer. Der Token-86 ist mit Ende=9 als „8969“ kombiniert. Umgekehrt muss der Kropf auch wieder entleert werden mittels „Token-68“: Epi.Y!Fliege.Z.655#682901105896947.
Der Kropf „808“ beginnt birnenförmig mit einem engen Eingangsbereich als Pumpenabschnitt P4 als Hauptpumpe des Systems: Epi.Y!Fliege.Z.657#680822259303653. Der vordere Kropfbereich ist mit dem AKH (Adipokinetic hormone) Neuron „777“ am Kropf-Nerv angeschlossen: Epi.Y!Fliege.Z.660#677727612670455. Der Kropf bildet mit seinen beiden großvolumigen Kropflappen (Crop lobes) den hinteren Pumpenabschnitt P5. Dieses Volumen wächst aus einem Basisabschnitt heraus, der die Steuerungsfunktionen „P6/S4“ vorgelagert übernimmt, um die Füllung und Entleerung des Kropfes zu regulieren. Kropf-Basisbereich “808“ für 2 Kropflappen mit Token-86 und entgegengesetzt als Entleerung Token-68: Epi.Y!Fliege.Z.669#668610200840808. Der Basisbereich wird von einer Reihe kreisringförmiger Muskeln umschlossen, die sowohl als Pumpe P6 als auch als Schließmuskel S4 arbeiten. In der Modellskizze sind 4 Muskelringe dargestellt. Crop-Model siehe: „The Adult Dipteran Crop: A Unique and Overlooked Organ | Annual Review of Entomology (annualreviews.org) ; John G. Stoffolano und Aaron T. Haselton Vol. 58:205-225 (Volume publication date January 2013); https://doi.org/10.1146/annurev-ento-120811-153653; https://www.researchgate.net/publication/234132097_The_Adult_Dipteran_Crop_A_Unique_and_Overlooked_Organ/link/55b65d9408aed621de034226/download“. Ringmuskel „0_5555_6“ , seitlich=999 und flexibel=66_2_666 in der Funktion als Schließmuskel S4 und als Pumpenabschnitt P6. Mit der 4-fach Muskeladresse „5555“ wird eine Verwechslung mit der Flugmuskulatur „555“ vermieden. Die Muskelzeile war fälschlich für den Kropfmuskel im hinteren Pumpenabschnitt P5 reserviert, der sich nunmehr nur noch einfach als „8_55“ als Netzwerk 4_11_4 zeigen kann. Kropfmuskel (Crop muscle): Epi.Y!Fliege.Z.686#652041143385569. Kropfvolumen „9000_858“ als Form 7 in der Zeilen-Nr. mit 2 Lappen „00“ und „808“ sowie mit 2 Lappen 87_87: Epi.Y!Fliege.Z.700#639000320517858 und Epi.Y!Fliege.Z.701#638088765139087. Am Kropfende=9 ist zwischen den beiden Lappen ein Senke bzw. ein Formspalt „717“ in der Zeilennummer vorhanden. Dann kann das Kropfende 9_808_9 folgen. Epi.Y!Fliege.Z.717#623849685303348 und Epi.Y!Fliege.Z.718#622980813875349. So wie der Kropf-Kanal (Crop duct) zieht sich auch der Speichelgang (Salivary durct) bis in den hinteren Bereich des Thorax, so dass die beiden Speicheldrüsen (Salivary gland) seitlich am Kropf enden.
17.) Der Herzschlauch (Dorsal vessel) „5005“ der adulten Taufliege (Drosophila) besteht aus 5 Abschnitten (A1-A5), wovon A5 das dreieckig zugespitzte Endstück ist [siehe: Schematische Zeichnungen von Rückengefäßen aus dem Spätstadium des Drosophila-Embryos... | Wissenschaftliches Diagramm herunterladen (researchgate.net) ]. Der Herzschlauch liegt im Hinterleib (Abdomen) und ist dort beidseitig an 4 Alary-Muscels angeschlossen. Durch den Thorax zieht sich die Aorta. Das Abdomen beginnt an der Taille „707“ in Zeile Z.1201, so dass die Aorta „500“ den Herzschlag der Fliege anzeigt. Als Ausgang am rechten Zahlenrand sind „138“ Schläge/ Minute adressiert. Real ist eine Fliegenherz-Frequenz von 140 bekannt. Mit 66 /33 ist kein Geschlechtsunterschied vorgesehen. Die Zeit=60 fehlt, liegt aber als Quersumme QS 3+6+6+3+3+9+2+5+0+0+9+2+1+3+8=60 vor. Herzschlauch und Aorta sind unpaarig, so dass die Ziffer „2“ als paarig blockiert werden muss. Dieses wird durch den Herzschlag realisiert, in dem damit ständig die Zählgröße 11 als Quersumme QS 9+2=11_QS 9+2=11 bis zum Fliegentod gepumpt wird. Ein Video „Fruit fly heart - YouTube“ [https://www.youtube.com/watch?v=KY1wf6UXmjY] zum Nachzählen (etwa 34 pro 15 sec): Epi.Y!Fliege.Z.1221#366339250092138.
Herzschlauch Abschnitt A1 „5005“: Epi.Y!Fliege.Z.1613#277309500534718; Abschnitt A2 „550055“: Epi.Y!Fliege.Z.2035#219803550055283; Abschnitt A3 „5005“: Epi.Y!Fliege.Z.2211#202306750050882; Abschnitt A4 „5005“: Epi.Y!Fliege.Z.2981#150050393949178. Das Endstück A5 muss vor dem After liegen. Das Schlauch-Ende=9 wird als Dreieck=3 markiert in „393“: Endstück des Herzschlauches Abschnitt A5 „50_10_05“: Epi.Y!Fliege.Z.3843#116393501005074. In den 5 Herzschlauch-Abschnitten wird jeweils 1 Ventilöffnung (Ostium) benötigt. Dieses ergibt sich wie bei der Ameise als Strukturloch „505“ entweder kombiniert als Klappe mit dem Herzschlauch „505_500“ oder kombiniert mit einem Ventilspalt „505_11“. Bei der Fliege sind nur in den 3 mittleren Abschnitten Ventilzellen [Cardioblast / valve cell] „11“ zu finden. In allen 5 Abschnitten sind Zellen als Cardiblast / functional ostia cell vorhanden. Ostium A1 „50500“: Epi.Y!Fliege.Z.1903#5050039076458; Ostium A2 „505_16191_50121“: Epi.Y!Fliege.Z.2069#216191505250121; Ostium A3 „505_11“: Epi.Y!Fliege.Z.2517#177711650521454; Ostium A4 „5505_11“: Epi.Y!Fliege.Z.3564#125505113457492; Ostium A5 „505_11_500“: Epi.Y!Fliege.Z.3737#119695002505352.
18.) Die Flugmuskulatur „555“ füllt die obere Hälfte des Thorax aus [siehe: Insekten und Spinnentiere: Die Fliege - Fliegen - Insekten und Spinnentiere - Natur - Planet Wissen (planet-wissen.de) ]. Die Muskelgruppen verformen die Rückenplatte des Exoskeletts, wobei sich die Bewegungen über die Gelenke auf die Flügel übertragen. Die vordere Wölbung des Thorax kann paarig=2 mit dem Bixnom-Kreis=64 geformt werden: Anfang der Flugmuskulatur „55_2_5_555_64“: Epi.Y!Fliege.Z.523#855258555186425. Das letzte Viertel der Flugmuskulatur zeichnet sich auf der Rückenplatte als Trennlinie an einer sichtbaren Kante ab mit Form=7, oben=9 als „55_900_7_555“: Epi.Y!Fliege.Z.1092#40961559007555. Die Flugmuskulatur drückt sich gegen den Hinterleib (Abdomen), so dass sich keine enge Wespentaille ergibt und die Formeinschnürung „707“ im Zeilenlauf vorgelagert den Muskel etwas überdeckt. Taille „707“: Epi.Y!Fliege.Z.1201#372439820451707. Die hintere Wölbung des Thorax sollte die Gegenform „46“ enthalten. Dieses ist ansatzweise als „4_5_6“ der Fall, weil vordergründig erneut der Bixnom-Kreis=64 enthalten ist. Ende der Flugmuskulatur „555_6456“. Epi.Y!Fliege.Z.1258#355564566265899. Der Muskel „5555“ mit „66“ und „666“ (Arbeiter*innen /Königin bei Ameisen) ist für den Kropf-Muskel (Crop muscle) reserviert, so dass geschlechtsunabhängig mit flexibel=6 der dehnbare Kropf adressiert wird: Epi.Y!Fliege.Z.675#662666999055556. Ein Geschlechtsmerkmal ist dagegen die Flügelfärbung. Bei der Fliegenart „Fleckenflügel-Drosophila“ ist der Flügel des Männchens mit einem großen dunklen Fleck markiert [siehe: Erwachsene Fleckenflügel-Drosophila-Weibchen (links) und Männchen (rechts) fliegen.... | Wissenschaftliches Diagramm herunterladen (researchgate.net) ]. Diese Fliegenart muss folgende Rechenaufgabe lösen: Der Fleck sitzt auf der Flügel-Membran=33 zugleich männlich=33 als „0330“. Weiblich=66 ist wegen „636“ doppelt in Zeilennummer und Zeile nicht adressiert. Um den Farbstoff „88“ zu gewinnen, müssen am rechten Zahlenrand in Zeile Z.636 die Zahl=80 und in Zeile Z.637 die Zahl=8 zu „88“ addiert werden. Der Farbstoff ist beidseitig paarig 15_44_15 vorhanden. In Zeile Z.638 kann nunmehr der Membran-Farbfleck „303“ entstehen: Epi.Y!Fliege.Z.636#703302239563680, Epi.Y!Fliege.Z.637#702198154415228 und Epi.Y!Fliege.Z.638#701097530348747.
Flügelgelenke: Der Insektenflügel ist mit 4 Gelenken an den Skleriten des Rückens befestigt. Mit dem Flügel als seitlich=99 und Gelenk „0“ sowie Form=7 kann auch der Bezug zum Calcium=20 zweckmäßig sein, weil dann 4 Gelenkzeilen zur Verfügung stehen. Calcium (Ca²+) tritt bei jeder Gelenkbewegung aus. Es fehlt dann aber das harte Material „22“ der Sklerite als weiterer Bezug. 1. Flügelgelenk „7_0_99_20“, paarig=2 in der Zeilennummer Z.626 markiert: Epi.Y!Fliege.Z.626#714537099620607. 2. Flügelgelenk „20_799“, paarig als 2 und als Spiegelung 41_14. Die Gelenk-Null wird vom Calcium=20 mitgenutzt: Epi.Y!Fliege.Z.646#692415207991487. 3. Flügelgelenk „20_99_7“, paarig als Spiegelung 45_54; Die Gelenk-Null wird vom Calcium=20 mitgenutzt: Epi.Y!Fliege.Z.693#645454869209957; 4. Flügelgelenk „20_99_7“: Die Gelenk-Null und paarig=2 wird vom Calcium=20 mitgenutzt: Epi.Y!Fliege.Z.744#601209978981855.
Der Insektenflügel wird durch ein feines Gitternetz stabilsiert [siehe: https://www.weltderphysik.de/gebiet/leben/nachrichten/2012/warum-zarte-insektenfluegel-nicht-brechen/ ]. In den Flügel strahlen bei den Insekten 6 große Longitudinaladern ein: Costa (C), Subcosta (Sc), Radius (R), Median (M), Cubitus (Cu), Analadern (1A, 2A...). Die Costalader ist bei allen Insekten mit dem Humeralsklerit am Thorax befestigt. Der Humeralsklerit „22 bzw. 222“ liegt vor dem 1. Flügelgelenk: Epi.Y!Fliege.Z.623#717977888222312 und Epi.Y!Fliege.Z.624#716827282632212. Der Flügel ist an der Vorderkante gebogen, so dass die Costalader (C) „99“, paarig 49_94, im Zeilenlauf bereits zuvor entsteht: Epi.Y!Fliege.Z.624#724959844995949. Die Zeile Z.645 mit „99“ bleibt unpaarig, so dass die Subcostalader „99“, paarig „68_86“, erst in Epi.Y!Fliege.Z.653#684992686619449 entsteht. Die übliche Farbmarkierung in einem Feld an der Flügelkante ist als „888_99“ vorhanden. Die „604“ zeigt ansatzweise mit dem Bixnom-Kreis „64“ den seitlich abgerundeten Flügelrand. Flügelmal (Pterostigma): Epi.Y!Fliege.Z.652#686043288899540. Der hintere Flügelrand zeigt einen Doppelbogen „64_00_99“, paarig=2: Epi.Y!Fliege.Z.750#59640029915000.
Die Fliegen (Dipteren) bewegen die Flügel mit 200 Hz wesentlich schneller als viele andere Insekten. Das Nervensystem erregt zum Flugbeginn lediglich einen Startermuskel (Furco-Pleuralmuskel), der die Vibration von Muskelgruppen ohne ständigen Nervenimpuls als automatisches System auslöst [siehe: Flugmuskeln - Lexikon der Biologie (spektrum.de) ]. Beispielsweise könnte folgende Schleife wirken: Nerv=7 und Zeit= 60 Sekunden sind in der Zeilen-Nr. Z.760 enthalten. Die Zeile enthält den Muskel=55 und den Bixnom-Kreis=64 für eine Zeitschleife (Vibration) paarig als Spiegelung 29_92: Epi.Y!Fliege.Z.760#588552926792764. Die Physik-Zeile Z..763 enthält die versteckte Rechenaufgabe, dass zu „62“ noch „1“ flexible Aktion 6_1_6 zu addieren ist, um mit „63“ eine Schwingung zu erzeugen. Die realen 200 Hz sind nicht erkennbar, aber die Summe der Quersummen von Z.761 bis Z.763 ergibt 84+70+68 = 222 Hz. Die folgende Biologie-Zeile Z.764 schließt mit dem Durchlauf der „64“ die Schleife mit der Zeilennummer ab.
Die Flügel entfalten sich erst nach dem Schlüpfen. Die Taufliegen (Drosophilidae) legen das Flügelpaar 99_71_17 in der Ruhelage unpaarig „1“ als Form=7 übereinander. Die ständige Ruhelage mit oben=9 wird verhindert, weil nur in der mentalen Ruhelage die Additionsaufgabe 9_0_QS 5+4=9 lösbar ist: Epi.Y!Fliege.Z.782#571995171819054. Die Stubenfliegen (Musca domestica) sind vergleichsweise mit dem V-förmig abstehenden Flügelpaar denkfaul (lazy to think).
19.) Mundwerkzeuge (Mouthparts): Bei einem Stechrüssel ist 1 Nahrungsrohr (Food channel) und 1 Speichelrohr (Salivary tube) zur Aufnahme flüssiger Nahrung ausreichend. Für halbflüssige Nahrung wird an der apikalen Rüsselspitze eine große Kontaktfläche erforderlich, um die Nahrung mittels Speichel und hochgewürgter Verdauungssekrete aufzulösen. Durch eine Muskelstreckung gewinnt der Mensch aus einer Kniehocke heraus an Länge - die Fliege faltet den Rüssel vergleichsweise „Z“-förmig. Abbildung der Rüssel-Streckphasen siehe 1.) „https://www.researchgate.net/figure/Anatomy-of-the-proboscis-A-C-Thick-sagittal-sections-of-fly-heads-with-proboscis-in_fig1_342459450/download“. Die schwammige Kontaktfläche entsteht durch 2 große häutige Lappen (Membranous lobes), die als Labella oder Labialpalpen (Labial palpi) bezeichnet werden. Der Begriff „Labial Palpi“ ist missverständlich, weil kein Taster als üblicher Palpen vorhanden ist. Wie an Flügeln und Beinen sind am Rüssel Geschmackssensillen (Gustatory sensilla) vorhanden. Die mit Geschmacksborsten (Taste bristles) besetzte Lappen-Außenfläche ist bei geschlossenen Lappen sichtbar. Die Innenfläche ist durch parallel angeordnete Pseodotracheen (Pseudotracheae) rippenförmig geformt, so dass Flüssigkeiten kapillar zur Mundöffnung transportiert werden können. Aus der Innenfläche ragen Geschmacksstifte (Taste pegs / Papillen) heraus. Bei der Taufliege (Drosophila) liegen die Papillen am Außenrand einer Pseodotrachee, wobei davon je Lappen statt 30 nur 6 Stück vorhanden sind. 2.) Mikrofotografie Papillen siehe: „Martin Oeggerli › Surrealistic Nature (Drosophila melanogaster)“. 3.) Das Labellum als Geschmacksorgan siehe: „Gustatory organs of Drosophila melanogaster: fine structure and expression of the putative odorant-binding protein PBPRP2 | SpringerLink /2001/ R. Steinbrecht u.a.“. Vorläufig werden folgende Zeilen reserviert:
Der Fliegen-Rüssel (Proboscis) kann die Funktionselemente als Rüssel-Verdauungsgruppe „44_8“ koordinieren. Der Rüssel ist eine unpaarige=1 Struktur=5, die eine große herzförmige Kontaktfläche (Labellum) aus dem Bixnom-Kreis „64“ als „6004“ und der Gegenform „46“ aus 2 Labiallappen (Labellar lobes) 2_500 bildet: Epi.Y!Fliege.Z.5#894600448725001. Die Zeile 6=flexibel zeigt eine paarig aufklappbare Hautform „73_9=seitlich_37“. Für die Bewegung steht ein Muskel „55“ zur Verfügung. Der Spalt „1“ zwischen den beiden Labiallappen „500“ vor der Mundöffnung wird als Prestomum bezeichnet: Epi.Y!Fliege.Z.6#745500373937501. Labiallappen als Volumenform „7000“ mittig um das Nahrungsrohr (Food channel) und den Speichelgang (Salivary duct) „räumlich=4_9=seitlich_paarig=2_49“: Epi.Y!Fliege.Z.9#497000249291667. Die chitinösen Röhren werden als Pseudotracheen bezeichnet und werden entsprechend mit „022“ adressiert, gehören jedoch nicht zum Tracheensystem. Jeder der beiden Labiallappen „2_500“ besteht aus bei der Stubenfliege aus einer Anzahl von i.M. 30 Pseudotracheen „30_022“. Mit der Zeilen-Nr. „10“ können davon im mittleren Bereich 10 Pseudotracheen trichterförmig in das Zentrum einstrahlen. Abbildungen: 4.) Rippentragwerk am Rüssel (Proboscis) einer Schmeißfliege (Calliphoridae) siehe: „The fly proboscis as a microscopical object“/ M. Samworth; Mic-UK: Probob (microscopy-uk.org.uk); http://www.microscopy-uk.org.uk/mag/indexmag.html?http://www.microscopy-uk.org.uk/mag/artmay98/probob.html. 5.) Vorderansicht des Fliegen-Rüssels siehe: „The digestive system of the adult Hermetia illucens (Diptera: Stratiomyidae): morphological features and functional properties /D. Bruno/ Springer-Verlag GmbH Germany, part of Springer Nature 2019; https://www.researchgate.net/figure/SEM-analysis-of-BSF-adult-mouthparts-a-Ventral-view-of-BSF-head-in-which-everted-labella_fig1_332853795 ; Brunoetal2019_Article_online.pdf. 6.) Prestomale Zähne siehe: „Material Properties and Morphology of Prestomal Teeth in Relation to the Feeding Habits of Diptera (Brachycera)“/ M. Lehnert 1 Insects 2022, 13, 207;
Material Properties and Morphology of Prestomal Teeth in Relation to the Feeding Habits of Diptera (Brachycera) - PubMed (nih.gov).
Prestomale Zähne bilden sich in einer paarigen „06_60“ Zahnleiste, sie beidseitig jeweils aus 2 bis 3 parallelen Zahnreihen besteht. Die beiden Zahnleisten umschließen die zentrale Mundöffnung neben den Pseudotracheen „022“ der beiden Labiallappen bzw. adressiert die „22“ eine Zahnhärte. Die Zähne bilden sich als Zählgröße „11“ in der Zeile-Nr. 11. An den beiden Spitzen eines gabelförmig in 2 Äste verzweigten Stils sitzt jeweils 1 eckig angespitzter Zahn. 1. Gabelverzweigung „6_3=dreieckig_6“ / 2. Gabelverzweigung „6_7=Form_6“. Aufgrund der Doppelziffer „66“ sollen sich benachbarte Gabeln zu einer endlosen Zahn-Girlande zusammenschließen. Diese Verknüpfung hat nur Folge, dass der Zahn aus 2 zusammengesetzten Zahnecken der zweier Gabeln besteht. Mit „7_3“ liegen bis 3 dieser Zahnleisten beidseitig nebeneinander. Die Hausfliege schneidet damit in die Haut der Opfer blitzartig schnell ein und raspelt die Flächen ab: Epi.Y!Fliege.Z.11#406636567602273.
Die Nahrungsaufnahme wird über das Nervensystem über Neuronen „727_50“ reguliert. Außer dem Token-86 ist umgekehrt der Token-68 für das Hochwürgen (Reguritation) als Richtung adressiert: Epi.Y!Fliege.Z.12#372750186968750. Das Nahrungsrohr (im Kopf weiter als Speiseröhre / Ösophagus) ist als Form=Nerv=77 mit „0770“ vorhanden. Die Zahl „66“ ist auch als Quersumme QS=66 vorhanden, so dass sich das Nahrungsrohr mit der „2“ vermutlich aus 2 Halbschalen bildet: Epi.Y!Fliege.Z.13#344077095663462. Der Hypopharynx liegt unterhalb des Nahrungsrohrs als Struktur „5000“: Epi.Y!Fliege.Z.15#298200149575000. Der Hypopharynx grenzt den Speichelgang (Salivary duct) „707“ mit der sichtbaren runden Öffnung vom Nahrungsrohr ab: Epi.Y!Fliege.Z.15#235421170717105.
Die Fruchtfliege bevorzugt eine Kombination von Pseudotracheen und Geschmackspapillen. Die Pseudotracheen „022“ können ersatzweise aus der Zeilen-Nr. Z.20 und dem Zeilenanfang #22 adressiert werden. Die Anzahl 6 ist paarig=21_12 als Zählgröße 11 und 1_8=Verdauung_1 enthalten: Epi.Y!Fliege.Z.20#2236501121812500.
Die „6“ Pseudotracheen eines Labiallappens sind wie eine Perlenkette „1_300_1_0“ zusammengesetzt und werden erst am Außenrand durch Geschmackspapillen ergänzt. Mit den Token-86 und Token-68 werden Nahrung und hochgewürgte Sekrete aufgenommen: Epi.Y!Fliege.Z.21#213000106839286. Die auf den 6 Pseudotracheen sitzenden Geschmackspapillen werden als Zählgrößen „11“ adressiert. Auf der Mittelachse sitzt ein Knotenpaar 3“1“8_83. Der Stift „1“ ist für paarig=38_83 eine Störgröße und wird daher in der Mittelachse als Stift der Papille hochgeschoben. In jeder Mittelachse sind 7 bis 9 Stifte und in der Randreihe 1 bis 5 Stifte vorhanden: Epi.Y!Fliege.Z.22#203318283801136. Die 6 Reihen der Pseudotracheen bilden 7 Seiten – und Zwischenräume, die im Randgebereich jeweils mit einer Reihe von Geschmackshaaren (Peg sensilla) besetzt sind. Beim Fliegen-Männchen enthält die 1. Reihe keine Geschmackshaare. Eine Null als Fehlstelle ist in paarig= 0_38_38 enthalten, wobei männlich=33 und Haar=11 kombiniert sind in „31_7_31“. Mit #17 kann die 1. von 7 Reihen adressiert werden: Epi.Y!Fliege.Z.26#172038547831731. Vergleichweise bilden Fliegen-Weibchen „66“, paarig=67_76, mehr Geschmackshaare in den Zwischenräumen aus: Epi.Y!Fliege.Z.27#165666749763889.
Auf der Außenfläche der Labiallappen sitzen unabhängig vom Geschlecht einige Sensillen „1000“ je Lappen. Das Verdauungselement=8 wird durch den Nerv=7 als Sensor markiert „787_500“. Die Rezeptorzelle wird von 4 Hilfszellen „747“ umgeben: Epi.Y!Fliege.Z.30#149100074787500. Bei der Taufliege (Drosophila) sind mit der Zeilen-Nr. Z.31 unabhängig vom Geschlecht 31 Geschmacksborsten (Taste bristles) je Lappen in Gruppen 44 aus 3 Borsten-Typen 9_03_9, paarig=2, angeordnet: Epi.Y!Fliege.Z.31#144290394955645. Typ „sTB“ sind 13 kurze (short Taste bristles) Geschmacksborsten (Anzahl real 10 bis „13“) „11_78“ als 13_13_11_3 am unteren Lappenrand: Epi.Y!Fliege.Z.32#139781320113281. Typ „iTB“ sind 9 mittellange (intermediale) Geschmacksborsten (Anzahl real „9“ bis 10), die als Anzahl „1_9_1“ mit oben=9 am oberen Lappenrand angeordnet sind: Epi.Y!Fliege.Z.37#120891952530405.
Die Borste „11“ folgt als „11_77_1=Y-Haar“, paarig=85_58: Epi.Y!Fliege.Z.38#117710585358553. Typ „lTB“ sind 9 lange (long) Geschmacksborsten (Anzahl real 7 bis „9“) „11_11_QS 5+4=9“, die sich zwischen den beiden Borstentypen als 9_Stück_paarig=2 verteilen. Borstensumme je Lappen 13+9+9=31 Stück: Epi.Y!Fliege.Z.39#114692365221154. Fehler: Die Zeile Z. 33 ist bereits vergeben, um geschlechtsabhängig mit männlich=33 den engeren Augenabstand der Facettenaugen zu erklären. Alternativ: Ingesamt zeigt die Zeile-Nr. Z.33 mögliche 33 Borsten. Davon sind 2 Borsten mit „oben=9_1=Borste“ als Mechanorezeptoren mit einem Muskelbezug 55_55 und der Anzahl 2, paarig 52_25, in Funktion: Epi.Y!Fliege.Z.33#135545522534091. Alle Borsten „111“ sind an der Basis von einer Einfassung (Socket) „505“ umringt: Epi.Y!Fliege.Z.40#111825056090625.
Vergleichbar mit einem menschlichen Fuß ist das Labellum der Fliege wie ein Hacken (Fersenbein / Calcaneus) als große Rundung „5005“ nach vorn gerichtet. Mit dem Bixnom-Kreis=64 ist die Drehung dieser Gelenkstelle bei der Z-förmigen, knieartigen Streckung vorhanden: Epi.Y!Fliege.Z.42#106500053419643. Die Streckung wird über Physik=63 verarbeitet. Gestrecktes Gelenk „6300003“ und verkürzt als „6003“: Epi.Y!Fliege.Z.71#630000316003522. Die Drehbewegung erfolgt mit dem Bixnom-Kreis=64: Epi.Y!Fliege.Z.75#596400299150000. Oberkiefer-Palp (Maxilary Palpus) „1115“, paarig=96_0_69: Epi.Y!Fliege.Z.121#369669606911157. Der Oberkiefer-Palp ist mit Borsten „11“, paarig=98_89 besetzt: Epi.Y!Fliege.Z.124#360725987389113. Das Riechorgan arbeitet mit den Antennen zusammen. Die Antennen besitzen 4 Arten von Sensillen (Basiconic, Trichoid, Intermediate und Coeloconic). Der Oberkiefer-Palp besitzt dagegen nur 3 verschiedene Subtypen von basikonischen Sensillen, die jeweils 2 Neuronen enthalten. Siehe 7.) „Olfactory channels associated with the Drosophila maxillary palp mediate short- and long-range attraction/ 2016/ M.Knaden u.a./ doi: 10.7554/eLife.14925 / Riechkanäle, die mit dem Drosophila-Oberkieferpalp assoziiert sind, vermitteln kurz- und langfristige Anziehungskraft | eLife (elifesciences.org).“ Vergleichsweise zum Menschen geht das Riechen mit der Ziffer „1“ als 1. Hirnnerv über eine Riechschleimhaut „33“ und allgemein über Nerv=7: Typ 1 „331333_777“: Epi.Y!Fliege.Z.135#331333499527778; Typ 2 „133“ und Nerv=7 in Zeilen-Nr. Epi.Y!Fliege.Z.137#326496514133212; Typ 3 „13_7_131“ mit Verdauung=8 in der Zeilen-Nr.: Epi.Y!Fliege.Z.138#324130597364131.
20.) Oogenese bei der weiblichen Drosophila: Die Entwicklung einer befruchtungsfähigen Eizelle (Oozyte / Ovum) wird als Oogenese / Ovogenese bezeichnet. Die schützende Eierschale (Eggshell) wird von den umgebenden Follikelzellen abgesondert und enthält die Eizelle sowie das Dotter als Nährstoff im Zytoplasma. Die beiden Eierstöcke (Ovarien) bestehen jeweils aus 16-18 büchelförmig konzentrierten Ovariolen. Die Ovariole enthält 6-7 Eikammern (Follikel) in unterschiedlichen Entwicklungsstadien. Die Eikammern (Follikel) am anterioren Ende der Ovariole vollziehen 14 Entwicklungsstadien und wandern zum hinteren, posterioren Ende [siehe: King, R. C. (1970). Ovarian Development in Drosophila melanogaster. New York: Academic Press]. Die Eikammern werden fortlaufend in einem Germarium mit 3 Regionen produziert, in denen zuletzt eine neue Eikammer abgeschnürt wird. Die Region 1 enthält die Stammzellen der Keimlinie. Die Teilung der Stammzelle ergibt 1 Tochterzelle und 1 Zystoblaste (Vorläufer des Eies). Die Zystoblaste durchläuft 4 Zellteilungen (12-4-8-16) bis zur Bildung einer Zyste aus 16 Keimzellen (Zystozyten). Daraus bilden sich 1 Eizelle und 15 Ammenzellen. Die Zyste wird in der Region 3 des Germariums von etwa 1000 somatischen Follikelzellen umhüllt (siehe: „Oogenese in Hydra vulgaris (uni-muenchen.de)“; M. Schade/2008). Die fertige Eikammer wird abgeschnürt. Die Ovariole besteht somit aus dem Germarium zur Eizellenproduktion und dem Vitellarium zur Produktion von Dotterzellen [Was ist eine Dotterzelle? „Dotter – Wikipedia: ...Anfangs sind diese Speichersubstanz (Nährdotter) und die Eizelle (Bildungsdotter) „gemeinsam (!)“ von der Vitellinmembran (Dotterhaut) umgeben.“/ Vogelei trennt Eigelb / Eiweiß]. Die Reihe der Eikammern als Serie der Stadien 1-14 wird jeweils mit 5-8 Stielzellen gekoppelt. Im Stadium 1 bildet sich eine neue Eikammer – Stadium 14 entlässt das reife Ei [Abbildungen siehe: 1.) (PDF) Automatic stage identification of Drosophila egg chamber based on DAPI images (researchgate.net) ; Dongyu Jia u.a/Jan.2016/ DOI:10.1038/srep18850 ;2.) „Drosophila oogenesis“; https://www.cell.com/current-biology/pdf/S0960-9822(08)01196-2.pdf ; Current Biology Vol 18 No 23 R1082/R. Bastock & D. Johnston; doi:10.1016/j.cub.2008.09.011 (cell.com) ; 3.) Genetische und molekulare Analyse von zwei neuen Komponenten der Oocytenpolarität in Drosophila melanogaster - Kölner UniversitätsPublikationsServer (uni-koeln.de); C.Wunderlich/ 2008]. Das Ei gelangt in einen der beiden „seitlichen“ Eileiter, die sich zum unpaarigen Eileiter vereinigen. Das Ei wird über das „Rezeptakulum seminis“ befruchtet und erreicht die Gebärmutter (Uterus). Die Oogenese dauert ca. eine Woche. Während dieser Zeit wird die „Meiose“ in der Oozyte in der 1. von 2 Phasen angehalten [Meiose – Wikipedia / Anzahl der Chromosomen wird in 2 Schritten halbiert / Unterschied zu Mitose!]. Die Meiose wird fortgesetzt, wenn das Ei den Uterus passiert, und im frisch gelegten Ei beendet.
Die Position der Eierschale kann im Zeilenlauf erkannt werden, so dass sich die vorgelagerten Entwicklungsstadien über das membranartige Suchkriterium „333/3333“ ergeben. Bei der Drosophila liegt der zur Befruchtung erforderliche Mikropylar-Kanal in der Eierschale vergleichsweise zur Ameise statt bei #10 erst bei #09. Die Oogenese muss daher über diesen Dezimalsprung gezogen werden. Feststellbar ist, dass der Bixnom-Code notfalls (wie bei der Schilddrüse des Menschen) in eine tiefere Mikro-Ebene umschalten kann. Entsprechend werden die Entwicklungsstadien der Entwicklung von der Stammzelle bis zur reifen Eizelle adressiert, so dass die Drosophila nur vier Chromosomenpaare benötigt [X/X- bzw. X/Y-Geschlechtschromosomen und die Autosomen 2, 3 und 4]. Der Bixnom-Code enthält zu einer Zeilennummer den Code von 15 Ziffern > 0, wobei hinten noch eine Null als Zellsymbol angehängt werden kann. Beim Dezimalsprung #10 zu #09 geht die hintere Zell-Null verloren, so dass die Eikammer langsam leergeräumt wird [0,000.000.1000000501592892“O“ / 0,000.000.“O“999776987846447]. Die Drosophila zeigt daher vom 8-10 Stadium besondere Aktivitäten. Im Stadium 11+12 liegt statt 333 verändert 3333 vor. Die Bereitstellung der Eierschale ist offenbar im Stadium 13 weitgehend abgeschlossen. Zur Bestätigung dieses Erklärungsmusters werden zu den 14 Stadien geometrische Informationen gesammelt und in den Zeilenlauf eingeordnet:
Stadium 1 „939_24_333“: Epi.Y!Fliege.Z.41“44“#107939243330719. Die Zeilen-Nr. Z.4144 enthält das Germarium als Gruppe „44“, das über die Zeit=24 die Eizelle im Germarium in 3 Phasen 9“3“9 aus der Stammzelle „202_500000“ erzeugt, die bei einer Teilung „2“ erneuert wird. Mit „1_0_QS 7+9=16_1“ werden 16 Zellen avisiert, von denen eine zur Eizelle wird. Mächtig gewaltig, Egon! Die Stammzelle: Epi.Y!Fliege.Z.4145#107913202500000. Im anterioren Bereich des Germariums entstehen aus einer asymmetrischen Zellteilung der Stammzelle eine neue Stammzelle und ein Cystoblast. Der Cytoblast entsteht als Zählgröße 11 und muss vervielfältigt werden. Die 16 Zellen sind sowohl in der Zeilen-Nr. Z.4“1“4“6“ als Gruppe 44 als auch in der Zeile als Form=7_QS8+8=16_7 versteckt avisiert. Epi.Y!Fliege.Z.4146#107887174231187. Der Cystoblast verwandelt sich durch 4 mitotische Teilungen in eine Cyste. Zunächst erfolgt eine Verdoppelung der Zählgröße „11_5151“, beispielsweise ist auch in der Zeilennummer 2*7=14: Epi.Y!Fliege.Z.4147#107861158“5151“92. Die folgenden Zellen sind als Anzahl von Z.4150 bis 4153 jeweils als 77_7 enthalten. Die Zeilen sind mit „7“ verbunden. Wegen 77“0“_7 bringt die Null keine geschlossene Matrix, sondern eine offene U-Form: Epi.Y!Fliege.Z.4153#107705327320612. Die 4-zellige Matrix wird in 2 Zeilen als Quadrat „4“ mit „7575_11“ und „75_7“4“7_75_“ adressiert: Epi.Y!Fliege.Z.4158#107575811534993 und Epi.Y!Fliege.Z.4159#107549945747175. Eine 8-zellige Matrix kann nicht im Quadrat, sondern nur als Matrix 2x4=8 entstehen. Die Zellbildung erfolgt am besonderen Zeilenübergang Z.41“63“/Z.41“64“, der zugleich die 16 Zellen als Ziel erwähnt. Die Zahl „17“ wird als Zelle „107“ für eine Gruppe 44 avisiert und wird für die 2. Matrixspalte als „71“ gespiegelt. Die 8 Zellen sind als 6“8“6 und als 080 mit QS 3+8=11 als Zählgröße adressiert: Epi.Y!Fliege.Z.4159#107446606861038 und Epi.Y!Fliege.Z.4164#107420803161023.
Die 4 Spiegelungen „71“ sind von Z.4173 bis Z.4176 vorhanden. Die Zahl „17“ liegt 4-mal in Z.4165, Z.4168, Z.4170 und Z.4178 vor. Die beiden Spalten sind zweifach verbunden, weil die Zahl „17“ zusätzlich nochmals mit der Zahl „71“ kombiniert wird. Epi.Y!Fliege.Z.4174#10“71“6344618“17“20 und Epi.Y!Fliege.Z.4176#10“71“12122692“17“0.
Die 16-zellige Matrix entsteht in der Region 2A des Germariums. Die Zellen sind durch cytoplasmatische Brücken (Zellbrücke=Fusom) verbunden. Zu diesem Zweck werden die folgenden 16 Zeilen von Z.4179 bis Z.4194 jeweils als eine Zelle gezählt. Für die Matrix kann auf eine Gruppe 44 verzichtet werden, weil die 16 Zellen als Ziel bekannt sind. Weil sich in der Zeilennummer Z.41xx die Ziffer „4“ durchzieht, ist auch eine Brücke vorhanden. Es bilden sich 4 quadratisch verbundene Blockgruppen 2x2=4 zu insgesamt 16 Zellen. Aus Z.41xx ist mit QS4+1=5 als Struktur-5 eine Zellbrücke entstanden. Die Centrosomen (Zentralkörperchen, mRNA und Proteine sammeln sich in 2 Pro-Oocyten. Diese sind untereinander und in der Matrix mit jeweils 3 anderen Zellen verbunden (keine Randlage). Aufgrund notwendiger Verbindungen kommen 2 benachbarte Zeilen in Betracht die 4-fach die Ziffern „1“ bzw. „7“ enthalten. Eine überschüssige Ziffer „1“ ist durch die Zellenanzahl=16 gebunden: Epi.Y!Fliege.Z.4188#“1“068052“11“16“583“1“ und Epi.Y!Fliege.Z.4189#106779714576868. In der Region 2B erfolgt die Spezifizierung der Oozyte innerhalb einer 16-zelligen Matrix. In der Region 3 wandert die Oozyte dann zum hinteren (posterior) Pol. Zunächst wird mitten im Zeilenlauf 1 Zelle als Eizelle (Oozyte) vorbestimmt. Zunächst sind die übrigen 15 Ammenzellen zu ermitteln: 15 Ammenzellen: 5 mal Zellenzahl „74“ plus „7004“ [Z.4205; Z.4209; Z.4222; Z. 4230; Z.4231] und 10 mal Zellenzahl „47“ plus „407“ [Z.4199; Z.4201; Z.4201 (doppelt 4747); Z.4210; Z.4217; Z.4221; Z.4224; Z.4228; Z.4230; Z.4232]. Eine Kapsel aus 1000 somatischen Follikelzellen ist anschaulich als Struktur „50005_64“ mit dem Bixnom-Kreis=64 und 3 Multiplikator-Nullen „000“ einer Zelle „1_065“ kombiniert: Epi.Y!Fliege.Z.4200#“106500053419643. Die avisierte Eizelle ist wie eine Ameisenkönigin als „666“ als mittlere Zeile eines Kapselbereiches über 3 Zeilen #10“64“xx erkennbar. Die Ziffer „6“ ist 5-mal enthalten. Weiterhin sind die Zeit=24 und die Physik=63 für eine Bewegung vorhanden: Epi.Y!Fliege.Z.4202#106449363246668. Auf eine unspektakuläre Oozyte „666“ würde kein Fliegen-Männchen fliegen. Bei der Wanderung in die Region 3 muss sich eine Verschönerung einstellen, es sind aber keine weiteren Zeilen vorhanden. Das Problem wird nachfolgend derart gelöst, dass die letzte Ammenzelle in Z.4232 ihren Platz zur Verfügung stellt und sich eine Alternative sucht. Die Zeile Z.4201 enthält hierfür außer der Zellendopplung 47_47 noch eine ergänzende 3. Zellposition 4_“74“_4 und die 3_000 für 3 Zellen. Diese sind in der Zeit=24 als 2_3_000_4 integriert: Epi.Y!Fliege.Z.4201#10647470“230004“8. Die Oozyte „1_0“ enthält nunmehr analog zum Spermium „1“ markant die Ziffer „1“ als Eizelle in einem Volumen der Kapsel=64 als „Zeit=QS5+6+9+4=24_Form=7_6_00100_4“: Epi.Y!Fliege.Z.4232#105694760010043. Die Wanderung ergibt eine Zeitdifferenz DELTA.TIME.Z.4202-Z.4232=#7799422“9000“5075, um die Ziffer „9“=Ende=posteriore Endlage der Oozyte in der Eikammer zu finden. In der Folgezeile entstehen noch 8 Stielzellen als Verbindung zum Eikammer-Stadium 2 mit „Ende=9_7=Form_9=Ende als „0_777_8“=8 Zellen“. Die 8 Zellen „8_0(Null)_55=Struktur“ sind in DELTA.TIME.Z.4202-Z.4233=#“80“49115222304“55“ enthalten. Stielzellen: Epi.Y!Fliege.Z.42“33“# 10566“979“0777“8“17.
Am vorderen und hinteren Ende der Eikammer wird jeweils 1 Paar Polzellen (Pole cells) angelegt. Die Stielzellen halten über die Polzellen den Kontakt zu den Follikelzellen. Bereits im Germarium werden diese Polzellen bestimmt, indem eine Teilung unterbunden wird. Diese beiden Code-Zeilen müssen im Prinzip Ende=9 und eine Umklammerung zur Unterbindung der Zellteilung sowie paarig=2 enthalten. Die beiden Polzellenpaare werden als Gruppe „44“ avisiert, die mit der Umklammerung und zugleich der Spiegelung „84_48“ ein Paar bildet, dass doppelt=2 vorhanden ist. Diese Struktur-55 liegt am Eikammerende=9 als „55_9_5“. Die Umklammerung 8_8 ist ein „EXTRA=8“, so dass keine Teilung als normale Follikelzelle stattfindet. Die Quersumme QS 1+0+5+8+4+4+8+2+3+5+5+9+5+1+3=63=Physik ergibt den Antrieb für die Polarisation der Eikammer-Ausrichtung: Epi.Y!Fliege.Z.4226#105“8448“23“5595“13. Weil sich die Umklammerung wiederholt, wird erst jetzt das anteriore Polzellen-Paar „anterior=9_7=Form_paarig=8338_QS3+6=9=anterior als EXTRA=8“ adressiert: Epi.Y!Fliege.Z.4227#1058197“8338“3605. Das posteriore Polzellen-Paar wird primär über die Ziffer „9“ in der Zeilen-Nr. Z.422“9“ gefunden, bevor dann die Umklammerung „8558“ als paarige Struktur ersichtlich ist: Epi.Y!Fliege.Z.422“9“#105769738558170.
Weitere unbearbeitet: Stadium 2 „44_333_222“; [Karyosom noch nicht gebildet, ähnliche Größe von Oozyte und Ammenzelle]: Epi.Y!Fliege.Z.4234#105644833340222. Stadium 3 „333_3443“; [Karyosom und Endokörper im Keimbläschen nachweisbar]: Epi.Y!Fliege.Z.4371#102333613443720. Stadium 4 „333_33_00_QS2+1=3“; [Ammenzellkerne haben eine ähnliche DNA-Menge und zeigen den Phänotyp „five-blob“]: Epi.Y!Fliege.Z.4377#102193334330021. Phänotyp „Five-blob“ als „5“ Blasen flexibel=666_00_5_8=Extra_11=Zählgröße: Epi.Y!Fliege.Z.4379#102146660050811. Stadium 5 „212_333_88_55“; [Kein Phänotyp "five-blob", hintere Ammenzellen enthalten mehr DNA]: Epi.Y!Fliege.Z.4380#102123338895548. Stadium 6 „79_1_79_333“; [Follikelzellen stellen Mitose ein, gleiche Ammenzellen-Ploidie (Ploidie=Anzahl Chromosomen-Sätze in Zelle)]: Epi.Y!Fliege.Z.4431#100947917933311. Stadium 7 „1_333_1“; [Deutlich verlängerte Form der Eikammer, höhere Ammenzellenploidie im hinteren Bereich, kein Eibläschen sichtbar]: Epi.Y!Fliege.Z.4435#100856871333145. Stadium 8 „99_7547_333_54_57“; [Eizelldotter sichtbar, noch einheitliche Follikelzellschicht / Die Follikelzellen (FCs) verbleiben bis zum Stadium 8 in einem quaderförmigen Epithel.]: Epi.Y!Fliege.Z.4484#997547333547057. Stadium 9 „99_40004_333“; [Die vorderen Follikelzellen beginnen zu wandern, einschließlich der Wanderung der Grenzzellen und der Abflachung der gestreckten Zellen] :Epi.Y!Fliege.Z.4500#994000498583334. Stadium 10A „99_333_55“; [Die vorderen Follikelzellen schließen ihre Wanderung ab, einschließlich der Grenzzellen, die an der Vorderseite der Eizelle ankommen, die Eizelle nimmt die Hälfte des Volumens der Eikammer ein]: Epi.Y!Fliege.Z.4503#993338273067955. Stadium 10B „55_868_303 statt 333“; [Zentripetale Follikelzellen wandern in Richtung der Vorderseite der Eizelle, die Eizelle nimmt immer noch die Hälfte des Volumens der Eikammer ein / Während der Stadien 10B bis Stadium 14 übertragen Ammenzellen ihren zytoplasmatischen Inhalt auf die Eizelle / Während der Stufe 10B bewegen sich die Follikelzellen nach innen, um das vordere Ende der Eizelle zu bedecken]: Epi.Y!Fliege.Z.4647#962556970868303. Stadium 11 „56_3333_56“; [Ammenzellen beginnen mit der Entleerung (Dumping-Prozess) und die Eizelle wird größer und nimmt mehr als die Hälfte des Volumens der Eikammer ein]: Epi.Y!Fliege.Z.4678#956178333395682. Stadium 12 „9545459_3333_66“; [Ammenzellen schließen den Entleerungsprozess ab und 15 Ammenzellkerne verbleiben am Anterior (vorn)]: Epi.Y!Fliege.Z.4686#954545933338669. Die „15“ Ammenzellen als Schicht „552277“ vorn (anterior) positioniert. Anzahl 15 zusätzlich gespiegelt (51) zwischen den Enden „9_51_09“: Epi.Y!Fliege.Z.4703#951095522778015. Stadium 13 „333_55“; [Dorsalfilamente sichtbar, einige Ammenzellkerne verbleiben am Anterior (vorn)]: Epi.Y!Fliege.Z.4704#950893334103955. Stadium 14 „686_333_6“; [Dorsalfilamente schließen die Dehnung ab, keine Ammenzellkerne mehr vorhanden]: Epi.Y!Fliege.Z.493“0“#907302686333672.
21.) Eierschale (Eggshell) der Drosophila: Aus der Entwicklung von Eikammern entsteht das Ei nach 14 Stadien der Entwicklung. Epithelzellen sondern durch Sekretion die starre Eierschale (Eggshell) als extrazelluläre Matrix ab. Die Eierschale wird im 10-14 Stadium aufgebaut. Das Ei wird auf dem Weg vom Ovidukt zum Uterus besamt. Zur Befruchtung durchdringt das männliche Spermium die Eierschale durch einen Kanal in der kegelförmig hervorstehenden Mikropyle am vorderen (anterior) Ende der Eierschale. In der Zygote verschmelzen die Zellkerne von Eizelle und Spermium. Die Zygote durchläuft schnelle mitotische Teilungen. In der frühen embryonalen Entwicklung besteht der Fliegen-Embryo nur aus einer einzigen Zelle, weil sich viele Zellkerne noch in einem gemeinsamen Cytoplasma als Syncytium befinden. Nach dem Einsetzen der Segmentierung wird der Embryo vielzellig. Die Larve spaltet die Eierschale am Deckel einer Öffnung (Operculum), so dass die Eierschale leer verbleibt. Alternativ wird die Oogenese im Zeilenlauf lediglich extrem weit gesteckt, so dass das Ei den Hinterleib (Abdomen) noch nicht verlassen hat. Die Entwicklung der Eierschale kann sich folglich in die Stadien der Oogenese einordnen und ist der Schlüssel zum Bixnom-Code. Entwicklungsbiologie der Larve siehe 1:) „Skript Mastermodul Entwicklungsgenetik 2020 (uni-osnabrueck.de)“; 2021/Universität Osnabrück, Abteilung Zoologie/Entwicklungsbiologie. 2.) Drosophila_melanogaster (bionity.com).
21.1) Mikropyle: Die komplizierte Drosophila-Mikropyle bleibt zunächst unverständlich, weil am Beginn der Eierschale mehrere Strukturen gleichzeitig entstehen. Grundsätzlich ist eine Zeile „33_0_33“ als Kombination von Membran-Öffnung und männlich=33 das Zielgebiet. Bei der Ameise ist der Zeilenlauf dafür bei #10... optimal. Die Fliege muss die Zeit durch mehrere Phasen der Ei-Entwicklung (Oogenese) vertrödeln bzw. auf Zeit spielen, um die Mikropyle verspätet bei #09 vorzufinden (siehe: „Targeted Downregulation of s36 Protein Unearths its Cardinal Role in Chorion Biogenesis and Architecture during Drosophila melanogaster Oogenesis - PMC (nih.gov)“; D. Stravopodis/ Sci Rep. Okt. 2016 / doi: 10,1038/srep35511 ).
Der Mikropylar-Apparat wird durch 2 Follikelzellsubpopulationen entwickelt. Die peripheren Zellen erzeugen den chorionischen Teil des Kegels. Hierbei umgeben 36 Zetripetalzellen den Konus in 4 verschiedenen Ringen [siehe: Zarani FE, Margaritis LH. 1986The eggshell of Drosophila melanogaster. V. Structure and morphogenesis of the micropylar apparatus. Can. J. Zool. 64, 2509-2519. (doi:10.1139/z86-372) Crossref, ISI, Google Scholar]. Vor dem Beginn der Eierschale könnten daher 4 Ringe zur Erzeugung des Zellmaterials zu finden sein. Unspektakulär bildet sich ein Bixnom-Ring 64_0 als paarig gespiegelte Konstruktion von insgesamt „4“ Ringen (2 Ringe beidseitig) als Extra=8_0_“4“_0_8=Extra: Epi.Y!Fliege.Z.4729#945866408040813. Die Anzahl von „36“ Zellen zeigt sich in Kombination mit dem Bixnom-Kreis als „5_6664_36“: Epi.Y!Fliege.Z.4730#9456664“36“284356. Das Zellmaterial kann erzeugt werden, bis das Epithel =33 in der Zeilen.Nr. 4733 erscheint. Die 4 Ringe werden nunmehr durch 4 x 0(Null) adressiert: Epi.Y!Fliege.Z.4733#945“0“67“0“28“0“2134“0“. Zunächst wird jedoch innenseitig die Vitellinmembran durch eine Gruppe von „9“ Grenzzellen erzeugt, die als Anzahl=9_44=Gruppe_090=Zellen adressiert wird. Das benötigte harte Material „22“ wird am rechten Zahlenrand ausgeschieden: Epi.Y!Fliege.Z.4734#944867394090622.
Damit die Mikropyle angeordnet werden kann, muss zunächst die Eierschale (Eggshell) insgesamt avisiert werden. Die Eierschale wird bei der Ameise als regelmäßiges Netzwerk mit einem speziellen Reckeck-Format erzeugt, mit dem hexagonale Anschlussbereiche an den beiden Polen („Wurstende“) integriert werden. Die Fliege zeigt vergleichsweise ein chaotisches räumliches Maschen-Netzwerk „444“ aus 4-, 5- und Sechsecken. Das „Mischnetzwerk“ ist daher mit dem Suchkriterium „4466“ zu finden: Chorion-Netzwerk „4466_444“ als Struktur=5 und Form=7: Epi.Y!Fliege.Z.4735#944667844482577. Das Netzwerk muss räumlich gestreckt werden, damit kein Ball, sondern eine Körperlängsachse mit vorderem und hinterem Pol als Streckung entsteht. Die Ziffer 9=seitlich_444=Netzwerk ist dafür mit den beiden Polen Form=79_79=seitlich geeignet. Der Pol mit der Mikropyle wird dabei bereits von der Männlichkeit=33 umklammert als 3_79_3, wobei auch Membran=33 gilt. Allerdings gehört die Mikropyle an den vorderen (anterior) Pol. Weil das Netzwerk „94446“ die Bixnom-Gegenkrümmung=46 enthält, ist diese Drehung statt einer Spiegelung vorstellbar. Der hintere (posterior) Pol enthält eine Aeropyle zum Gasaustausch, die bei der Drosophila artspezifisch sehr unauffällig ist. Bei der Ameise dürfen sich dort ggf. nützliche Bakterien einnisten. Das Netzwerk „444“ wird nochmals wiederholt, um im vorderen Bereich, der die kleine Mikropyle enthält, mit besonders kräftigen und tiefen Rippen einen Deckel (Operculum) ausgeformt. Am Beginn des 1. Larvenstadiums verlässt die sich entwickelte Larve die Eierschale aus dem geöffneten Deckel. Die Eierschale erfüllt nach der Befruchtung somit nur über 24 Stunden eine Schutzfunktion: Epi.Y!Fliege.Z.4736#944468379143793. Im Ei muss eine unpaarige Längsachse aufgebaut werden, so dass die Ziffer 2=paarig möglichst vermieden werden muss. Weil „020“ aber unübersehbar ist, wird daraus am Deckelrand mit 9=seitlich ein seitlicher Deckel-Kragen (Micropyle-Collar) mit einem paarigen „2“ Seitenrand abgegrenzt. Mit 0_2_0 bringt die Null die Kragen-Ausrundung zum Ausdruck, weil in der Bixnom-Gegenkrümmung „46“ die „2“ als „426“ eingeschoben wird. Erst in der Folgezeile schließt sich der Kragen als „406“ in der Mittelachse. Der Kragen umschließt die Mikropyle weiträumig [Abbildung siehe: „[PDF] The role of Cornichon (Cni) in axis formation in Drosophila | Semantic Scholar“; S. Dass / Biologie / 2005]: Epi.Y!Fliege.Z.4737#9442689980209. Die Längsachse mit vorderer Mikropyle und hinterer Aeropyle wird als unpaarige Strukturform „575“ mit einer Achse „97_Mikropyle=0_1=unpaarige Längsachse_0=Aeropyle“ adressiert wird. Die Mikropyle liegt jetzt vorn (anterior). Die Zeit=60 Sekunden ist als Maßstab für die Deckelöffnung zu kurz, so dass die Teilquersumme TQS 0+1+6+0+5+7+5=24 Stunden als Deckelöffnungszeit zu lesen ist. Die Embryonalentwicklung der Drosophila melanogaster (Schwarzbäuchige Taufliege) dauert ca. 24 Stunden. Die Larve schlüpft und beginnt im 1. Larvenstadium über 24 Stunden zu Fressen und zu Wachsen. Mit der 1. Häutung beginnt das 2. Larvenstadium analog über 24 Sunden. Das 3. Larvenstadium dauert 48 Stunden. Die Verpuppung endet nach weiteren 4-5 Tagen bis zum Schlüpfen als Imago (erwachsene Insekt): Epi.Y!Fliege.Z.4738#944069701060575.
Die kegelförmige Mikropyle wird durch 4 Zelltypen aufgebaut: Vordere zwei Polarzellen, Grenzzellen, Zentripetalzellen und Eizelle (siehe: „The Drosophila micropyle as a system to study how epithelia build complex extracellular structures | Philosophical Transactions of the Royal Society B: Biological Sciences (royalsocietypublishing.org)“; S. Horne-Badovinac /Aug.2020/https://doi.org/10.1098/rstb.2019.0561). Die Eizelle ragt in den Kegel der Mikropyle hinein und bildet einen nippelartigen Vorsprung (nipple-like projection). Der Mikropylenar-Apparat besteht aus dem inneren Teil als Vorsprung der Vitellinmembran und dem äußeren Chorion-Vorsprung als Kegel (Cone), der einen Kanal enthält. Der Mikropylar-Kanal im Kegel (Cone) hat einen Durchmesser von 800 nm (0,8µm). Der Kegel ist wie die Eierschale aus dem äußeren Chorion (4 Unterschichten) und der inneren Vitellinmembran aufgebaut, die zuerst entsteht. Diese 2 Hauptschichten werden nicht bereits am vorderen Pol im Zeilenlauf beschrieben, so dass die Vitellinmembran nur provisorisch schwammig gemustert ist und sich erst später im Muster angleicht. An der Basis geht der Mikropylar-Kanal beim Anschluss an die Eizelle in ein dreieckiges Areal über (siehe: „External morphology of the egg of Drosophila melanogaster meigen (Diptera: Drosophilidae) - ScienceDirect“; W.Klug /1974/https://doi.org/10.1016/S0020-7322(74)81004-4). Mit dem Mikropylar-Kegel kann der Zeilenlauf beschäftigt werden, weil sich zunächst aus den beiden vorderen Polzellen lange Fortsätze bilden, die sich spiralförmig zu einem „Pilotrohr“ winden. Es legen sich Mikrotubuli um diese Hilfskonstruktion, so dass sich der Chorion-Kegel formt. Die Hilfskonstruktion zieht sich dann wieder zurück. Das „Pilotrohr“ ist im Durchmesser 800 nm dick, so dass die „800“ später nochmals im fertigen Kegel erscheinen müssen. Die beiden Polzellen müssen nunmehr zwangsläufig als Zeilen-Nr.Z.474“2“ gelesen werden, die 2 Formgruppen „474“ enthält. Die #47 zieht sich weitläufig durch jede Zeilennummer. Enthalten ist eine Spiegelung für die langen Fortsätze der 2 Polzellen 73_QS3+5=8=Extra_37: Epi.Y!Fliege.Z.4742#943273353780051. Der Polzellenfortsätze werden nochmals zu einer Formgruppe vereinigt „7447“, liegen mit flexibel=6_83_QS4+2=6_83 parallel und müssen sich dann mit flexibel=6 noch winden: Epi.Y!Fliege.Z.4743#943074476834283. Die beiden Fortsätze 44_20_44_3 werden als Fäden einzeln als Gruppe 44 adressiert und können damit einzeln zurückgezogen werden. Wahrscheinlich ist der Wissenschaft die Spitze einer Mikropyle als eine charakteristische rechteckige Morphologie bekannt, die bei der Drosophila als Mangel nicht ersichtlich ist. Die Drosophila verwechselt dann das Viereck=44 mit der Gruppe=44 als räumliche Alternative: [„When the border cells are prevented from reaching the oocyte, the chorionic portion of the micropyle forms relatively normally; however, closer inspection reveals two defects. First, the tip of the cone lacks its characteristic rectangular morphology,..“ / zitiert aus: „slow border cells, a locus required for a developmentally regulated cell migration during oogenesis, encodes Drosophila C/EBP - PubMed (nih.gov)“; 1992 Oct 2;71(1):51-62; doi: 10.1016/0092-8674(92)90265-e.]. Die Länge des „Pilotrohres“ beträgt „20“µm. Weil die Einheiten in „nm“ zählen, steht der Multiplikator „1000“ als „3“ am rechten Zahlenrand: Epi.Y!Fliege.Z.4745#942676974420443. Das Pilotrohr ist mit seitlich=9_404_9=seitlich_66=gewickelt_7=Form: Epi.Y!Fliege.Z.4756#940496687053197. Die Größe „101“ liefert einen bekannten Bezug zu den Spermien. Folglich wurde der Aufwand betrieben, um den Kanal-Querschnitt genau der Spermiengröße anzupassen. Die Gruppe 44 schließt den Spermienkanal „101“, Durchmesser QS 3+5=8 zuzüglich 0_0 für 800 nm, als „4_0101_35_4“ ein. Zugleich sendet jeder der beiden Polzellen-Fortsätze jeweils einen dünnen Faden (Filopodium) „1“ als Form 7_1_7, paarig=2 bis in die Eizelle, um den richtigen Abstand zu sondieren. Auch die Eizellen kann sich daran festhalten: Epi.Y!Fliege.Z.4758#940101354271753. Die Mikropyle kann nunmehr im äußeren Aufbau entwickelt werden, in dem das Pilotrohr zurückgezogen wird. Als Antriebskraft dient in der Zeilen-Nr. Z.4763 die Physik=63. Enthalten ist eine Formgruppe 44_7_4 und die Zählgröße 11 für irgendein Rechenkunststück – Rückziehen in die Vergangenheit ist unmöglich: Epi.Y!Fliege.Z.4763#939114474832039. Das Problem wird mit 3 Fress-Klammern der Ziffern 9, 7 und 8 als Summe 9+7+8= 24 Stunden mittels der Biologie=64 in Epi.Y!Fliege.Z.47“64“#“9389“1“7347“52“8338“ nur für Bixnom-Versteher gelöst: DELTA.TIME.Z.4763-Z.4764=#19712“73037“01171: Aus 1+9+7+1+2=20 und 7+3=10, 0+3+7=10 sowie 0+1+1+7+1=10 folgen 20 µm und der Multiplikator 10*10*10=1000 für 20000 nm Kanallänge als Rückzugslänge, die im Vorwärtsgang adressiert wird - das Zellmaterial des Pilotrohres wird verarbeitet. Zum Schichtenaufbau der Mikropyle wird zuerst innenseitig die Vitellinmembran „33“ als Struktur-5 adressiert: Epi.Y!Fliege.Z.4766#938523341087915. Das außenseitige Chorion wird mit dem Bixnom-Kreis=64 als runder Form-Kegel „4_707_4“ mit „4“ Schichtumhüllungen avisiert. Die 4 Schichten entstehen in den nachfolgenden Zeilen jeweils als Schicht „77“ in der Zeile und der Zeilennummer: Epi.Y!Fliege.Z.4767#938326461847074. Erste Unterschicht (Wachsschicht / Wax layer) „3_77_3_63“ mit der Physik=63: Epi.Y!Fliege.Z.4770#937736319418240. Zweite Unterschicht [innerste Chorionschcht / innermost chorionic layer (ICL)] „77_0200“: Epi.Y!Fliege.Z.4771#937539770200168. Nunmehr ist das Zielgebiet zur Bildung der Mikropyle als Membranöffnung „33_0_33“ erreicht: Epi.Y!Fliege.Z.4772#9“373“4“33033“58“131“. Dritte Unterschicht (Endochorion) „777“ als Zählgröße „77_11“ für den Aufbau von Boden, Säulen „202“ und Decke: Epi.Y!Fliege.Z.4777#936362202977811. Runde Kegelform 7_0_33_7_64_909=seitlich: Epi.Y!Fliege.Z.4779#935970337649090. Vierte Unterschicht (Exochorion) „77_22=hart“: Epi.Y!Fliege.Z.4780#935774527955022. Der beschichtete Mikropylar-Kanal im lichten Querschnitt von 800 nm ist als Struktur „55_800_55“ fertiggestellt. Nachfolgend wird der Kegel an der Basis in Dreieckform zum Anschluss an die Eizelle verbreitert: Epi.Y!Fliege.Z.4781#93557880017255.
Die Anschlusskonstruktion wird als Gruppe „44“ avisiert und als Dreieck über eine Zeilenstrecke mit „13“ direkt eingezeichnet. Die Zahl „13“ bildet die Spitze des Dreiecks. Die Zeile ist eine Referenzzeile, weil die Embryonalentwicklung des Embryos als Zeitsprung von 24 Stunden übersprungen werden muss, um die Embryonalentwicklung innerhalb der Eierschale als Sonderthema ausblenden zu können. Die Mikropyle sitzt im Deckel (Operculum), der sich zum Schlüpfen der Larve nach 24 Stunden zum Beginn des 1. Larvenstadiums öffnet. Bei genauerer Betrachtung enthält die Zeilen-Nr.4783 eine doppelte Zählgröße „11“ als QS 4+7=11_QS 8+3=11. Mit 11+11= 22 Stunden öffnet sich der Deckel somit bereits im bekannten Zeitfenster von 22-24 Stunden. Der Timer wird gestartet und kann dann als Zeitdifferenz inhaltlich ausgelesen werden: DELTA-TIME.Z.4783-Z.4790#136666244905193. Enthalten ist nunmehr die Zeit von 24 Stunden. Statt einer Ameisenkönigin 666 wird die geschlüpfte Larve als 6666=sehr flexibel adressiert. Der weibliche Bezug ist scheinbar falsch, aber das Geschlecht ist bei der Drosophila eher sekundär. Wie beim Menschen sind die Chromosomen weiblich XX und männlich XY verteilt. Das Y-Chromosom enthält jedoch keine geschlechtsbestimmenden Merkmale. Die Drosophila ist ein diploider Organismus, bei dem fast alle Erbanlagen (Gene) doppelt vorliegen. Maßgeblich ist das Verhältnis der X-Chromosomen zu den Autosomen (keine Geschlechtschromosome). Ein Männchen entsteht bei einem Verhältnis 0,5 bis <1: Epi.Y!Fliege.Z.4783#935187590136944. Innerhalb der dreieckigen Anschlussstrecke wird nochmals die runde Kegelform „707“ adressiert: Z.4785#934796707131662. Das Dreieck mit der Spitze „13“ wurde über eine Zeilenstrecke verbreitert, bis an der Basis die Dreiecksseite in 2 Punkten 13_13 vorliegt: Z.4786#93460“13“88“13“7276.
21.2) Deckel (Operculum): Der flache Deckel wird vom seitliche Kragen (Micropyle-Collar) eingefasst. Bis auf kleine Abweichungen sind die Schichten der Eierschale (Eggshell) vorhanden. Beim Modellorganismus „Schwarzbäuchige Taufliege“ (Drosophila melanogaster) setzt am Ende des Kragens das paarige dorsale Anhängsel DA (Dorsal appendages) ähnlich einem Blindschlauch an. Die Fliegenart „Drosophila virilis“ ist doppelt so groß und bildet am seitlichen Kragen auf halber Stecke ein zusätzliches Anhängsel-Paar aus. Daraus folgt, dass der über 5 Zeilen auffällige Membran-Zeilenbereich #933... direkt hinter der kegelförmigen Mikropyle liegen muss. Dort sind 2 Ringstrukturen erkennbar: „In the operculum, immediately around the micropylar apparatus, are one or two rings of indistinct small cell imprints (Area i; Figs. 42, 49 and 51); here the floor is less fenestrated (Fig. 53) than in the main body (Fig. 25).“ [Siehe: The eggshell of Drosophila melanogaster. I. Fine structure of the layers and regions of the wild-type eggshell | Journal of Cell Science | The Company of Biologists; L.H. Margaritis u.a./ J Cell Sci (1980); https://doi.org/10.1242/jcs.43.1.1).]. 1. Membran-Zeile “33“: Die beiden Ringe müssen hinter der unpaarigen Mikropyle liegen. Die ungünstig anfallende Ziffer 2=paarig muss daher für eine Trennung des 1.Ringes in 2 Kammern genutzt werden „seitlich=92_878(Kammertrennwand als Extra)_92“: Epi.Y!Fliege.Z.4790#933820927687892. 2. Membran-Zeile “33“: 1. Ringstruktur „202_55“ unpaarig umgeschrieben als „QS 1+6=7=Form_202_QS 2+5=7_5=Struktur“: Epi.Y!Fliege.Z.4791#933626016202255. 3. Membran-Zeile “33“: unpaariger 2. Ring „606“: Epi.Y!Fliege.Z.4792#933431186065318. 4. Membran-Zeile “33“: In der Mittelachse schließen sich 2 weitere Kreisringe=64_64 an: Epi.Y!Fliege.Z.4793#933236437226164. 5. Membran-Zeile “33_33“: Mit seitlich=9 in „696“ und „933_339“ ist der letzte Kreis beidseitig durch eine Rippe an das schwammige Maschennetzwerk angeschlossen: Epi.Y!Fliege.Z.4794#9330417696339180.
21.3) Filamentöse dorsale Anhänge DA (Dorsal appendages / Respiratory appendages / Respiratory horns): Am hinteren Kragenrand des Operculum setzt bei der Taufliege Drosophila melanogaster 1 Paar schlauchförmiger Anhängsel (DA) an, die dem Gasaustausch dienen. Die Fliegenart Drosophila virilis ist vergleichsweise doppelt so groß und besitzt in der Mitte des Kragenrandes ein kleineres 2. Anhängselpaar. Im Vergleich zur Ameise sind die Anhängsel scheinbar unnütz und werden in der Zeilennummer Z.4_“808“ als Extra-Schlauch „808“ adressiert. Im Lichtmikroskop sind an der Eierschale (Eggshell) keine Löcher für einen Gasaustausch sichtbar, so dass der Austausch auf molekulare Ebene erfolgt.
Die Fliege muss die Sauerstoffaufnahme in einer Rechenaufgabe verpacken, die dann in der hinteren Aeropyle eine Bestätigung finden muss. Der molekulare Sauerstoff=8 ist im Wasser H20 als 1+1+8=10 enthalten. Luftsauerstoff (Oxygen) kann als O2 wie Sauerstoff=8_8=Sauerstoff als sonnenaktiver Wirkstoff=88 verstanden werden. Die Oberfläche der Eierschale ist wasserabweisend (hydrophob), so dass die Eierschale viele Luftporen enthält. Der Sauerstoff O2 wird über die regennasse Kontaktfläche als im Wasser gelöster Sauerstoff (DO) aufgenommen [siehe: 1.) „The structure and function of the respiratory horns of the eggs of some flies | Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences (royalsocietypublishing.org)“; H. Hinton/1960/ doi.org/10.1098/rstb.1960.0004; 2.) Respiratory Systems of Insect Egg Shells (drosophila.jp) ]. Dieser partielle Unterdruck wird gegenüber der Atmosphäre durch einen Überdruck von Luftstickstoff N2 (Dinitrogen)=„77“, wegen Stickstoff=7), CO2 (Carbon dioxide) = 6+8+8=22 und Wasserdampf (Water vapour)=1+1+8=10 ausgeglichen. Wird kein Sauerstoff verbraucht, gleicht sich der Druck wieder an. Für eine Rechenaufgabe wird die Zählgröße „11“ in der Bilanz benötigt, in der N2 (Distickstoff)=77 als Vermittler im Zeilenlauf zu beachten ist:
77 (N2) = 88 (O2) – 11 (Zählgröße); 11 (Zählgröße) = 10 (Wasser) +1 Aktion
77 (N2) = 22 (CO2) +55 (Eierschale); Eierschale als Struktur =55.
88 (O2) =Input=Output= 22 (CO2) +55 (Eierschale) + 10 (Wasser) +1 Aktion
Der Extra-Schlauch „808“ eröffnet somit mit der Zeilennummer den funktionellen Hintergrund der Anhängsel (DA). Das Anhängsel ist paarig=2 und bindet ringförmig als „303“ in das Exochorion ein. Die Anhängel liegen in der dorsalen Mittelachse paarig zusammen „8787=Form_44=Gruppe“: Epi.Y!Fliege.Z.4808#930324925878744. Die Funktion „Gasaustausch“ kann sich über die Zählgröße 11 in der Zeilennummer Z.48“11“ bis zur Aeropyle in Z.4884 durchziehen. Dazu ist der Erste Teil „48“ bereits in der Zeilennummer avisiert und der zweite Teil in der Gruppe 4“48“_0_22=CO2_5005 enthalten: Epi.Y!Fliege.Z.4811#929744802250053. Der im Wasser gelöste Luftsauerstoff=88 wird mit der Strukur-5 und der Ziffer „1“ als Aktion=1 in 55“1“5_88 verknüpft. Der Sauerstoff wird in der Struktur 55 aufgenommen: Epi.Y!Fliege.Z.4812#929551588450749. Die hydrophobe Oberfläche zeigt sich z.B. an der Wachsschicht (Wax layer) der Eierschale (Eggshell), wenn Wasser H20=1+1+8=2+8=10 am rechten Zahlenrand abgeblockt wird. Wasser wird an der Kontaktfläche zum Lösen des Sauerstoffes benötigt. Wasser kann daher zerlegt als „28“ in außen=seitlich als „9_28_9“ am Anhängsel adressiert sein. Der Sauerstoff 8_8 wird in der Struktur herausgelöst „2_858_2_555“. Mit der äußeren Klammer 2_2 kann wegen CO2=6+8+8=22 der Gasaustausch gemeint sein. Markiert wird die Zahl „82“ als Spiegelung der 28. Vergleichsweise ist in der Zeilen-Nr. und als QS 9+2+8+9+7+2+4+2+8+5+8+2+5+5+5=81 dagegen nur die Zahl „81“ enthalten. Das Defizit 82-81=1 liefert eine Aktion=“1“ in der Zeit=24: Epi.Y!Fliege.Z.4815#928972428582555. Mit der Hilfsgröße wird N2 (Distickstoff) „77“, der Physik=63 als Antrieb und der Biologie=64 als Ziel am rechten Zahlenrand eine Aktion=1 gestartet. Zusätzlich treibt die Quersumme QS 9+2+8+7+7+9+5+3+5+6+3+6+4+2+1=77 die Aktion an: Epi.Y!Fliege.Z.4816#928779535636421. Das Kohlendioxid=22 wird von der Hilfsgröße „77“ umklammert „7_22_77“, in der Aktion „1“ am rechten Zahlenrand entsorgt und durch Sauerstoff=8 in 7_“8“_7 ersetzt (858): Epi.Y!Fliege.Z.4817#928586722778701. Die Funktion zieht sich über die Oberfläche des Anhängsels weiter, was durch die Kombination von Sauerstoff=88_11=Zählgröße sichtbar ist. Der erforderliche Gasaustausch nach Bedarf 2_666=flexibel_2 wird erneut durch die Quersumme QS 9+2+6+6+6+2+9+8+8+1+1+3+7+3+6=77 aktiviert: Epi.Y!Fliege.Z.4827#926662988113736.
Die flache paddelförmige Spitze kann abgrenzt werden, weil sich die „808“ aus der Zeilen-Nr. Z.4808 nunmehr in Zeile als „8008“ zeigt. Das Paddel krümmt sich mit Form=7_64 zu einem Bixnom-Bogen: Epi.Y!Fliege.Z.4820#928008764237552. Bei der Bildung des Operculum tritt zufällig bereits die „8008“ auf, so dass die Fliegenart Drosophila virilis paarig und am Seitenrand des Operculum mit seitlich=93_39=seitlich ein zusätzliches Anhängsel ausformt: Epi.Y!Fliege.Z.4798#932263910718008. Das paarige Anhängsel (DA) besteht aus einer Bodenschicht und einer Dachschicht. Dafür ist in den meisten Zeilen eine Dopplung 27_27 oder ähnlich vorhanden. Mit „222“ zieht sich in der Folge eine Abgrenzung von einer glatten und einer gemusterten Oberfläche bis zur Paddelspitze. Epi.Y!Fliege.Z.4821#927816271235222. Zur Musterunterscheidung treten Spiegelungen 27_72 und Kombinationen auf 9272_927 auf: Epi.Y!Fliege.Z.48“22“#927239271066543. Die große Krümmung des Paddels endet mit der Kreis-Spiegelung 64_7=Form. Zugleich setzt mit der Gegenkrümmung=46 zur Unterscheidung eine Ausrundung der Paddelspitze an: Epi.Y!Fliege.Z.4828#926471052946355. Das Muster ist an der Paddelspitze schließlich auf Vorder- und Rückseite als gestapelt 92_92 und gespiegelt 27_727 unterschiedlich: Epi.Y!Fliege.Z.4829#926279197271692. Die Paddelspitze wird mit dem Bixnomkreis=0_64 abgerundet: Epi.Y!Fliege.Z.4831#925895724203064.
21.4) Extrazelluläre Matrix (ECM): Die Eierschale (Eggshell) besteht aus mehreren Schichten [siehe: „Building up the Drosophila eggshell: First of all the eggshell genes must be transcribed (wiley.com)“; V. Cavaliere u.a./ Juli 2008/ https://doi.org/10.1002/dvdy.21625 ]. Außenseitig liegt die externe Chorionschicht als 1. Hauptschicht, die sich aus 4 Schichten zusammensetzt, und zwar Exochorion, Endochorion, innere Chorionschicht [inner chorion layer (ICL)] und Wachsschicht (Wax layer). Die 2. Hauptschicht wird durch die Vitellinmembran-Schicht (vitelline membran) gebildet, die auch als „Dottermembran“ bezeichnet wird (siehe: The eggshell of Drosophila melanogaster. I. Fine structure of the layers and regions of the wild-type eggshell | Journal of Cell Science | The Company of Biologists; L.H. Margaritis u.a./ J Cell Sci (1980); https://doi.org/10.1242/jcs.43.1.1). Zwischen der „Vitelline Membran“ und der „Embryonic membrane“ ist ein Zwischenraum (Perivitelline space) vorhanden (siehe: „Pattern Formation: The link between ovary and embryo: Current Biology (cell.com)“; Current Biology / 1995 / DOI:https://doi.org/10.1016/S0960-9822(95)00270-3).
Um den Schichtenaufbau von außen nach innen, und zwar entgegen der Entstehungsrichtung und quer zum Zeilenlauf (Körperachse) darstellen zu können, müsste eine Matrix-Gruppe „44“ entstehen. Die Zeile Z.4832 bildet eine Struktur=55 mit der Quersumme QS 9+2+5+7+0+4+1+0+6+7+1+0+4+7+2=55. Die Spiegelung 41_QS 0+6+7+1+0=14 bzw. QS 5_QS 5 enthält die Gruppe 44 indirekt. Es wird somit ein Zählvorgang „11“ adressiert, um die Gruppe 44 aus 55 – 11 = 44 zu gewinnen. Die Zählgröße „11“ (negativ als Absonderung) wird markiert als Form=7_QS 0+4+1+0+6=11_7=Form. Mit „4+1“ entstehen die 4 äußeren Schichten und die Vitelline membran als 2. Hauptschicht. Die Gruppe „44“ ist nicht direkt vorhanden, sondern wird von den Follikelzellen abgesondert: Epi.Y!Fliege.Z.4832#925704106710472.
Die extrazelluläre Matrix (ECM) wird mit der Membran=33 in der Zeilen-Nr. Z.48“33“ und in der Zeile aus 2 Hauptschichten gebildet: Epi.Y!Fliege.Z.48“33“#92551256851“33“46.
In der Reihenfolge der Schichten entsteht zuletzt das Exochorion als äußere, nicht proteinhaltige Schicht (300-500nm). Exochorion und Endochorion werden von den Eierstockfollikelzellen in ca. 5 Stunden synthetisiert. Das Follikelepithels bricht schließlich auf und setzt die von der Eierschale geschützte Eizelle in den Eileiter frei (siehe: „Amplification of genes for chorion proteins during oogenesis in Drosophila melanogaster (pnas.org) “; A. Spradling u.a./1980 / https://doi.org/10.1073/pnas.77.2.1096).
Das Material der extrazellulären Matrix muss wie der menschliche Zahn „11“ herausgehoben „=9“ werden, wozu eine Zählgröße 11 entstehen muss. Zugleich werden damit die vorhandenen kurze Fasern=11 adressiert. Das Exochorin besteht aus 2 Teilschichten, so dass sich eine Gruppe 44 in der Zeilennummer versteckt: Z.Gruppe 4_QS 8+3=11=Zählgröße_4=Gruppe: Epi.Y!Fliege.Z.4834#925321109562475. Wie die Vitelline membran wird auch das Exochorion durch Disulfidbindungen stabilisiert. Die obere Teilschicht „808“ ist dichter und deutet den Schwefel=16 mit Extra=8 als „80868“ versteckt bereits an. Der Schwefel wird durch eine Schicht 22 in 2_QS 9+7=16_2 dargestellt. Damit wird in der Folgezeile die lockere 2. Teilschicht „202“ verbunden. Die Schicht wird mit Bezug zur Gravitation_84_2_9=oben_2 gewellt, in dem sie sich auf die rippenförmigen Netzwerkgrate (5- und 6- Ecke) des Endochorions legt: Epi.Y!Fliege.Z.4835#925129729808687 und Epi.Y!Fliege.Z.4836#924938429202854.
Das Endochorion bildet sich aus 3 Ebenen: Sohle, Säulentragwerk und Dach. Das Dachtragwerk spannt sich mit dem Rippennetzwerk über die von den Säulen gebildeten Hohlräume. Unter den Rippen sitze jedoch keine Säule. In der Deckschicht ist kein direkter Hinweis auf das in Z.4735 adressierte „Mischnetzwerk“ enthalten. Enthalten ist die Zeit=24 verbunden mit 2_4747_2 als Deckschicht. Möglicherweise entstehen die Rippen durch eine Schrumpfanweisung. In der Zeilennummer ist mit TQS 8+3=11 eine Rechenaufgabe enthalten. Zeilenvergleich Z.473_5 vs. Z.4_8_37. Enthalten ist eine Spiegelung 73_37 und die Zahl „8=Extra“ ist gegenüber der Zahl „88“ und als QS 9+2+4+7+4+7+4+2+0+7+6+9+5+8+8+6=88 geschrumpft. Die Schichten entstammen den Follikelzellen, die als Abdruck ein Muster hinterlassen, das als Spiegelung zu deuten ist. Statt einer Schrumpfung wäre auch ein Zelltod möglich. Wegen „7_20=Calcium_7“ ist ein Zusammenhang gegeben (siehe „Progesterone protects fetal chorion and maternal decidua cells from calcium-induced death - PubMed (nih.gov)“; A. Murtha/2007/ DOI: 10.1016/j.ajog.2007.01.007.): Epi.Y!Fliege.Z.4837#924747207695886. Säulenstruktur 5_606_5: Epi.Y!Fliege.Z.4838#924556065238736. Hohlräume 65“00“ neben den Säulen: Epi.Y!Fliege.Z.4839#924365001782394. Dünner Fensterboden des Endochorion 17_40_17_77=Form (40 auch in Z.-Nr.): Epi.Y!Fliege.Z.4840#924174017277893.
Die innere Chorionschicht (ICL) ist ein 40-50 nm dickes Kristallgitter. Die Gruppe 44 versteckt sich in der Zeilen-Nr. Z.4842, in dem die Ziffer „8“ als Kristallform adressiert wird. Die Ziffer „2“ wird dann zu 44+2=46 als Bixnom-Krümmung für die Moleküle verwendet. An die Krümmung knüpft sich über 3 Zeilen in der Zeilen-Nr. Z.4844 die „44“ als Additionsgröße einer zweiten Schicht an, um mit „44+2+ 44=90°“ einem Kristallgitterwinkel zu gewinnen (Siehe: „The innermost chorionic layer of Drosophila: II. Three-dimensional structure determination of the 90 ° crystal form by electron microscopy - ScienceDirect“ C.Akey u.a./ Journal of Molecular Biology (JMB) / 1987; https://doi.org/10.1016/0022-2836(87)90351-2 ). Die ICL bildet eine dünne Schicht aus dreidimenionalen Kristallen. Das Chorionoktamer besteht aus 2 Klassen gebogener Dimere, die Kontakte am oberen und unteren Ende des Moleküls herstellen. Die Alpha-Dimere ist von der 2-zähligen Achse weg nach außen gekrümmt, dagegen ist die Beta-Dimere zum Molekülzentrum hin gekrümmt. Beide Klassen sind als Dopplung 28_28 und 49_49 vorhanden. Mit 84=Gravitation ist eine Achse vorhanden: Die Gitterkontakte werden an der Ober-und Unterseite hauptsächlich durch die Beta-Dimere gebildet, wofür nochmals oben=92_seitlich=92_92 vorhanden ist: Epi.Y!Fliege.Z.4842#923792284928749. Mit 36_36_63 folgt: Epi.Y!Fliege.Z.4843#923601536986373. Netzwerk der Oktomere Z.“4844“: Epi.Y!Fliege.Z.4844#9234108678003720.
Die dünne Lipidwachsschicht (Wax layer) besteht aus hydrophoben Platten und schützt gegen Austrocknung. Hydrophobe Stoffe sind oft lipophil und in Fett lösbar. Dem Gegensatz bzw. einer wasserabstoßenden und einer wasserliebenden Seite können 2 Zeilen „77=Form“ zugeordnet werden. Hydrophob wird am rechten Zahlen mit seitlich=9 als abweisend und Wasser H20 als Sauerstoff=8 und 2xWasserstoff=2 als „9_82“ adressiert: Epi.Y!Fliege.Z.4845#92322“027“7321982. Fliegen-Weibchen produzieren als Geruchs- und Botenstoff das Pheromon 7,11-Heptacosadien C27H52, das von Männchen erkannt wird. Vergleichbar zum abgesonderten zuckerhaltigen Schleim werden bei flüssigen Absonderungen gewöhnlicher Moleküle als Kennzeichen lediglich die Atome gezählt C6H12O6=24. Das als Gas übertragene Pheromon wird in die Wachsschicht eingearbeitet, um die Eier gegen den Kannibalismus geschlüpfter Larven zu schützen. Das Pheromon als Zahl 27+52=79 diffundiert durch den Boden des Endochorions in Z.4842. Diese Zahl fehlt in der Wachschicht selbst, weil es dort erst synthetisiert werden muss. Auffällig ist die Zeitdifferenz zur Wachsschicht DELTA.TIME.Z.4842-4845=572007606767035, um ähnlich „66“ ein adultes Weibchen als Duft „606“ vorzutäuschen. Die Folgezeile gehört scheinbar ohne Besonderheit ebenfalls zur Wachsschicht. Wird ein Pheromon als Gasbestandteil „0“ erkannt, können die Einzelbestandteile von 27 Stück C-Atomen als „027“ in Zeile Z.4845 und die Anzahl von 52 H-Atome aus Z.4846 als „502“ getrennt zur Synthese als Stereo mit Doppelbindung adressiert werden. Als enthaltene Spiegelung „97“ von „79“ ist die QS 9+7=16 bereits zutreffend: Epi.Y!Fliege.Z.4846#923029765“502“477.
Die Vitelline Membran (Oozyten-Proximal-Vitellin-Membran) wird aus unregelmäßigen Partikeln gebildet. Sichtbar ist ein besonders schönes Linienmuster. Erkennbar halten sich 2 dünne Linienarten „1“ aus fadenförmigen Zellfortsätzen (Mikrovilli) gemischt im regelmäßigen Abstand voneinander. Aus paarig=2 ergibt sich aus „22“ eine gesuchte Parallelität der Linien. Beim Bogentyp wird in die Linie „1“ ein Bogenstück integriert als 22_64=Bogen_Form=77_64=Bogen. Epi.Y!Fliege.Z.4848#922648977645421. . Beim Winkeltyp wird die Linie „1“ mittig um 45° als 22_45°=Winkel abgewinkelt. Die Vitellin-Membranproteine sind durch Disulfidbindungen vollständig vernetzt (siehe: Minor proteins and enzymes of the Drosophila eggshell matrix - ScienceDirect; E. LeMosy u.a./ Entwicklungsbiologie Band 293 / Mai 2006 / https://doi.org/10.1016/j.ydbio.2006.01.028). Schwefel=16 deutet sich als „106“ an und zeigt sich als TQS 0+1+5+1+0+6+2+1=16: Epi.Y!Fliege.Z.4849#922458701510621.
21.5) Aeropyle: Am hinteren (posterior) Pol schließen sich die großen Maschen des 4 bis 6-eckigen Mischnetzwerk am „Wurstende“ zusammen. Wie die dorsalen Fortsätze DA ist dieser Bereich für den Gasaustausch unsichtbar porös und artspezifisch gestaltet. Im Gegenzusatz zu einer Kappe mit vielen einzelnen Aeropylen ist bei der Drosophila keine löchrige Landschaft mit Vulkankegeln oder Ringwällen vorhanden, vielmehr unterscheiden sich die Maschen am Pol lediglich im inneren Muster von der Mantelfläche. Am hinteren Pol bildet sich aus 6-15 Zellen eine ringförmige zentrale Polfläche mit hexagonalen Maschen, die feinporig und dünn scheinbar verschlossen sind. Die Polfläche wird von einem weiteren Ring aus 10 - 15 peripheren Maschen umschlossen. Diese Maschen sind nicht einheitlich porös gefüllt, sondern zeigen jeweils eine Vielzahl kleiner paralleler Wellen als Maschen-Muster. Hinter einer Welle ist 1 molekulares Loch zu erwarten (momentan fehlt für Drosophila eine Mikroskopie).
Mit im Wasser gelöstem Luftsauerstoff O2=88 als sonnenbekannter Wirkstoff „88“ in der Zeilen-Nr. Z.4“88“0 bis Z.4888 findet die Evolution einen weiteren Bereich für den Gasaustausch - die „88“ ist auch in der Zeile enthalten. Weil die Ziffer „2“=paarig stets vorhanden ist, lässt sich eine zentrale Aeropyle am hinteren (posterior) Pol kaum begründen. Die Stubenfliege (Musca domestica /House fly) nimmt es wörtlich und bildet 1 Paar Aeropyle aus. Die Drosophila findet dagegen eine großflächige Lösung über einen Doppelring, sofern sie als Zusammenhang eine Aeropylen-Gruppe bilden kann. Die Gruppe 44 ist mit 1 Atmungs-Aktion=“1“ als 4_1_4 kombiniert: Epi.Y!Fliege.Z.4880#91659882041496.
Für die Aufnahme des Luftsauerstoffs aus der regennassen Oberfläche muss das Exochorion wasserabweisend (hydrophob) sein, damit sich in der Eierschale Lufteinschlüsse halten können. Ansatzweise wird hierzu das Wasser H20 = 2+0+8 mit seitlich=9 am rechten Zahlenrand herausgeschoben. Der Bixnom-Kreis=64 wird mit der Zählgröße 11 kombiniert, um eine Aktion=1 als Bezugsgröße zu gewinnen [Um Sauerstoff aufnehmen, ist 64-63=1 Aktion geeignet. 65-64=1 Aktion kann CO2 beseitigen]. In der Zeilen-Nr. 4881 ist der Sauerstoff O2 „88“ mit einer Aktion=1 kombiniert. Epi.Y!Fliege.Z.4881#916411031269208. Das CO2=22 wird mit der Membran=33 kombiniert und als Aktion=1 seitlich=9 als 19_91 beseitigt: Epi.Y!Fliege.Z.4882#916223319054691. Die Aktions-Gruppe „414“ liegt erneut vor: Epi.Y!Fliege.Z.4883#916035683724146. Die Membran „33“ ist als „303“ porös. Die Markierungen „848“ und „252“ enthalten O2=88 und CO2=22. Die Ziffer „2“ ist im CO2 funktionell gebunden und wirkt nicht mehr als paarig. Mit „848_1=unpaarig_252“ kann die Drosophila die Aeropyle als 2 verschachtelte Ringe gestalten. Mit 9_15 sind 15 Zellen für den Außenring zählbar. Im inneren Polring verbleiben am rechten Zahlenrand maximal TQS 3+0+3+4+5=15 Zellen. Die Membran „303“ wurde bereits adressiert, so dass 4+5=9 Zellen normal sind. Gilt Ende=9=4+5 sind minimal 3+0+3=6 Zellen im Polring vorhanden: Epi.Y!Fliege.Z.4884#915“8481252“30345. Der Außenring mit 15 hexagonalen Zellen „9_15_6“ ist als Ring „6064“ mit dem Bixnom-Kreis=64 als Einfassung kombiniert. Das innere Maschen-Muster ist wegen „flexibel=6_606“ wellenförmig. Der Polring ist als „101“ adressiert und als Maschen-Muster punktförmig. In der Zwischengröße „3526“ muss die Ziffer „2=paarig“ funktionell beseitigt werden. Die Drosophila liest folglich aus „3+5=8_8=2+6“ den Sauerstoff „88“ wie bereits in der Zeilennummer adressiert. Mit QS 9+1+5+6+6+0+6+4+3+5+2+6+1+0+1=55 entsteht die Aeropyle als Struktur-55: Epi.Y!Fliege.Z.4885#915660643526101.
22.) Eileiter (Oviduct) der Drosophila
An der Basis (proximales Ende) jeder Eizelle setzt ein kleinen Kanal oder Stiel (Pedicel) an. Der Kanal ist zunächst mit Zellen verstopft, die beim Eisprung durch Muskelkontraktion entfernt werden. Die Stiele aller Eizellen im Eierstock (Ovarium / Ovary) vereinigen sich zu einem Kelch (Calyx). Jeder Kelch öffnet sich zu einem seitlichen Eileiter LO (Lateral Oviduct). Nur 1 der insgesamt 2 x 16 = 32 reifen Eikammern (Follikel) beider Eierstöcke ragt in einen der beiden seitlichen Eileiter LO hinein. Die seitlichen Eileiter verschmelzen zu einem gemeinsamen Eileiter CO (Common oviduct), der sich zur Gebärmutter (Uterus) erweitert. Am Uterus-Eingang sitzen die 3 Samenspeicherorgane (Sperm storage organ) [Seminal receptacle und paarige Spermathek] sowie die paarigen Spermathekaldrüsen (Female accsessory glands). Die Lagerung von Spermien von mehreren Männchen ist vorteilhaft. Die muskulöse und innervierte Gebärmutter hält das Ei in Position und nimmt während der Paarung Spermien auf. In Bezug auf die Position der Samenspeicherorgane liegt die anteriore Mikropyle nunmehr funktionell günstig. Am hinteren Ende verengt sich die Gebärmutter (Uterus) zur Vagina, deren distales Ende als Gonopore genannt wird. Die Gonopore gibt das Ei ab [siehe: The developments between gametogenesis and fertilization: ovulation and female sperm storage in drosophila melanogaster - ScienceDirect/; M.C. Bloch Qazi/ 2003/ https://doi.org/10.1016/S0012-1606(02)00125-2]. Am Köperende ist beim Fliegenweibchen ein Eiablageapparat als sägeförmiger Legestachel (Ovipositor) ausgebildet. Bei der Kirschessigfliege (Drosophila suzukii) ist eine solche Säge in Funktion, um die Fruchthaut für die Eibablage zu durchdringen (Foto siehe: „Ein Winzling lehrt das Fürchten (wiley.com)“; H. Vogt / Apr2020/ DOI:10.1002/biuz.202010710).
Die beiden Eierstöcke (Ovarien) werden jeweils mittels einer Peritonealhülle (Peritoneal sheath) aus einem Netz von Muskelfasern zusammengehalten [siehe „(PDF) Neuromuscular organization and aminergic modulation of contractions in the Drosophila ovary (researchgate.net)“: A. Middelton u.a./Jun 2006/BMC Biology 4(1):17/ DOI:10.1186/1741-7007-4-17 ]. Dieses Muskelfasernetz wird als Umhüllung vor der Bildung der Eikammern im Stadium 1 adressiert. Das Netz „444“ wird als Muskel 55 und weiblich=66 zunächst als „6_5_6“ nur avisiert. Die 2. Fünf für „55“ zieht sich als QS 4+1=5_2=paarig in der Zeilen-Nr. Z.41xx weiter: Epi.Y!Fliege.Z.“41“02#1090“444“2329“656“3. Das Netz wird als Zählgröße 11 vieler Muskelfasern und weiblich=66 adressiert als „1166_11“, wobei darin die 16 Ovariolen gezählt werden und zusätzlich die vielen äußeren Muskelfasern im Netz: Epi.Y!Fliege.Z.“41“07#108911668946311. Muskeln „555“ als lockere Muskelfasern 5_“1“_5 als Extra=888: Epi.Y!Fliege.Z.“41“08#10888“515“68“555“26. Das Netz enthalt den Bixnom-Kreis=64 kombiniert mit der Anzahl für 16 Ovariolen als „0_16_4_0“: Epi.Y!Fliege.Z.“4115#1086999330“164“03.
Der Ausbildung einer Aeropyle zum Gasaustausch in der Eierschale (Eggshell) folgt ab Zeile Z. 4930 das 14. und letzte Stadium der Eikammerentwicklung in der Ovariole. Jeder der beiden Eierstöcke (Ovarien) enthält 16-18 Ovariolen. Um einen Eierstock zu bilden, müssen die Ovariolen punktuell als Bündel mit einem gemeinsamen Ausgang als „Seitlicher Eileiter“ zusammengeführt werden. Beide seitlichen Eileiter vereinigen sich anschließend zum gemeinsamen Eileiter (Oviduct). Die Basallamina „333“ als Suchgröße liegt zum Ende des 14. Eikammer-Stadiums nochmals vor: Ende Stadium 14 „333_5“: Epi.Y!Fliege.Z.4935#9063834“3335“8663. Um das Ei durch den Eileiter zu bewegen, muss eine Steuerung erfolgen. Hier wird angenommen, dass die Zählung der Elektronen bei Austritt von CO2=6+8+8=22 aus der Aeropyle in eine Atomzählung „022“ des Neurotransmitters Octopamin C8H11NO2=8+11+1+2=22 wechselt. Octopamin ist im Nervensystem wirbelloser Tiere präsent. Für die Eiablage und die Muskelkontraktion im Eileiter sind Octomin-Rezeptoren vorhanden [siehe: „Regulation of Drosophila oviduct muscle contractility by octopamine - PubMed (nih.gov)“; S. Despande u.a. / Jul 2022/ doi: 10.1016/j.isci.2022.104697. eCollection 2022 Aug 19.]. Der Neurotransmitter Octopamin „022“ wird am rechten Zahlenrand ausgeschieden, womit der Ei-Transport adressiert wird. Die Umklammerung der Ziffer „8“ durch Octopamin als „2_8=Extra_2_7=Nerv“ kann EXTRA=Eierschale (Eggshell) bedeuten, so dass ein Octopamin-Rezeptor als Nerv=7 vorhanden ist: Epi.Y!Fliege.Z.4941#905“2827“85595“022“. Außer Ooctopamine wirken Tyramine C8H11NO=8+11+1+1=21 als Neuromodulator. Der Eisprung wird durch MMP2 ausgelöst. Die Drosophila stellt nur MMP1 und MMP2 her, Säugetiere dagegen 20 MMPs. Matrix-Metalloproteinesen (MMPs) sind extrazelluläre Proteasen, die extrazelluläre Matrix spalten und Signalwege verändern. Die MMMPs basieren auf Zink=30 [siehe: Both Drosophila matrix metalloproteinases have released and membrane-tethered forms but have different substrates | Scientific Reports (nature.com)“; S. Kimberly u.a./ Mar 2017]. Die Eierschale (Eggschell) wird mit der klassischen Bixnom-Struktur „505“, dem muskelartigen Transportweg „55“ und dem Ei „0“ adressiert: Epi.Y!Fliege.Z.4945#904“55050“4271992. Für den Eisprung wird MMP2 als Zink=30 mit weiblich=66 kombiniert als „066_7=Nerv_30=Zink_66=weiblich: Epi.Y!Fliege.Z.4949#90381940667“30“66.
Der Muskel „55“ in Z.49“55“ ist in der Folgezeile enthalten: Epi.Y!Fliege.Z.4956#90254282“55“90194. Die störenden Fasern „1“ im Pedicel werden als EXTRA „88_1_88“ markiert und am rechten Zahlenrand beseitigt: Epi.Y!Fliege.Z.4961#9016331875“88188“. Der Muskel 55 erreicht den besonderen Bereich der Zeilen-Nr. Z.xx63/ Z.xx64. Funktion wird die ruhenden Meiose als 2 Phase wieder aktiviert: Epi.Y!Fliege.Z.4963#901269845582310.
MMP2 ist weiterhin zur Bildung von Gelbkörperchen CL (Corpus luteum) erforderlich. Die Gelbkörperchen (CL-Cells ) entwickeln eine gelbliche Pigmentierung und entstehen aus Follikelzellen der Eikammer, die nach der Freisetzung der Eizelle verbleiben [siehe: „Matrix Metalloproteinase 2 Is Required for Ovulation and Corpus Luteum Formation in Drosophila | PLOS Genetics; J. Sun u.a./Feb. 2015/https://doi.org/10.1371/journal.pgen.1004989].
Es ist unwahrscheinlich, dass alle 16 Ovariolen in 1 seitlichen Eileiter LO (Lateral Oviduct) münden - bei einem Quadrat wären es 4 je Seite. Eine Drosophila ohne genau 16 Ovariolen ist ein mathematischer Mutant. Bei einem zwiebelförmigen Eierstock wären beispielsweise 2 Lagen von Ovariolen günstig, wo die obere Lage über einen längeren Stiel (Pedicel) verfügt. Am Übergang zum seitlichen Eileiter münden die Stiele zunächst in einen Kelch (Calyx). Bei 2 Lagen wären in der Seitenansicht folglich nur 2 Ovariolen und dazwischen ein verlängerter Stiel aus der 2. Lage am Kelch zu sehen. Stiel (Pedicel): Eine besondere Zeile ermöglicht einen langen und voluminösen Stiel als „seitlich=9_00000_QS 4+5=9=seitlich“. Die 16 angeschlossenen Ovariolen sind in der Zeilen-Nr. Z.4_QS9+7=16_0 enthalten. Stiel=1_QS 4+3+3+6=16=Stielanzahl_0_2=paarig (2 Eierstöcke): Epi.Y!Fliege.Z.4970#“90000045“1433602. Der Kelch (Calyx) wird mit dem Bixnom-Kreis=64 am Zahlenrand geformt. Die zuvor mit „9xxx=seitlich“ adressierten Stiele werden durch die Ziffer „8_8“ am Kelch als „8_99_8“ konzentriert, mit 8+8=16=Anzahl und „1=Stiehl“, paarig=2 sind alle Stiele adressiert. Epi.Y!Fliege.Z.4971#“8998“194012522“64“. Geometrisch wünschenswert wäre es, wenn sich nicht alle 16 Ovariolen mit ihren am Stielen um den Kelchrand drängen würden, sondern mit kurzen und langen Stielen in 2 Lagen gestapelt werden. Die Stapelung „89_38_2=paarig_38_98“ wird mathematisch wünschenswert realisiert: Epi.Y!Fliege.Z.4972#899638423898834. Es ist erforderlich zugleich beide Eierstöcke direkt mit ihren 32 Ovariolen zu adressieren. Weil alle Zeilen die Ziffer 2 aus 3“2“ Ovariolen enthalten, eine paarige Zeile wird automatisch zu einer unpaarigen Zeile, wenn die passende „32“ funktionell für beide Eierstöcke ohne weitere Ziffer „2“ enthalten ist. Mit „9_32_9“ wird der Eisprung zunächst in allen 32 reifen Eikammer blockiert. Zur Steuerung wird mit „9_4+5+7+5+1=22= Octopamin (C8H11NO2=8+11+1+2=22) _9“ ein Neurotransmitter markiert: Epi.Y!Fliege.Z.4973#89945751“9329“379. Nach Auswahl darf in einen der beiden Kelche als Struktur „50000“1“ exakt gleichzeitig nur für „1“ Ei geschoben werden. Mit der Zeilennummer Z.4+9+7+4 =24 Stunden werden an 1 Tag vom Drosophila-Weibchen 100 Eier gelegt. Mit „1“ Ei und den Nullen muss mit der Ziffer=2 (00) eine „100“ gelesen werden, weil die Zeile funktionell für beide Eierstöcke gemeinsam gilt: Epi.Y!Fliege.Z.4974#899“2“76687“500001“. Die bei Eisprung zusammen mit dem Ei freigesetzten Follikelzellen tragen zur Bildung der Pigmentierung von Gelbkörperchen bei. Die Zellen sind somit bereits vorhanden, aber die Pigmentierung kommt im Zeilenlauf etwas verspätet. Die Gelbkörper sollen erst dann Hormone produzieren, wenn tatsächlich auch 1 Ei vorhanden ist. Mit der Muskelkonstruktion beim Eisprung müsste sich folglich der Eileiter plötzlich nach hinten (posterior) ausdehnen, weil die Pigmentierung nicht in die Vergangenheit gelangen kann. Die Ziffer „2“ ist funktionell an die Zeit=1_“24“_15 (1+15=16) gebunden, so dass die Zeile unpaarig das Ei beim Eisprung adressiert. Die Verschiebung ist als Dopplung 8989 über die Zeit=60? zu vermuten, zumal der Gelbkörper mit dem Wirkstoff „88“ adressiert wird: Epi.Y!Fliege.Z.4976#“8989“15241“88“6054. Nachfolgend wird der Kelchrand zum Verschieben mit dem Bixnom-Kreis=64 in Z.4977 wiederholt und der Muskel „55“ folgt in Z.4978. Der seitliche Eileiter LO =20 setzt paarig=2 am Kelch (Calyx) des Weibchens=66 an: Epi.Y!Fliege.Z.4979#8983736179“20“2“66“. In einer Zwischenstation wird der seitliche Eileiter „20“ nochmals als 66_20_2=paarig erkennbar. Epi.Y!Fliege.Z.5045#886620860976215. Erst nach weitem Zeilenlauf zeigt sich die Vereinigung der beiden seitlichen Eileiter LO „20_20“zum gemeinsamen Eileiter CO „20“. Zuvor entwickelt sich bereits versteckt die Zusammenführung als „Krawattenknoten“ [Foto siehe: „(PDF) A Standardized Nomenclature and Atlas of the Female Terminalia of Drosophila melanogaster (researchgate.net)“; M. Afkhami u.a./Jan.2022 / DOI:10.20944/preprints202201.0223.v1]. Zwischen den beiden Eileitern legt sich der Knoten wie an einem Hals mit einem Bixnom-Kreis=64 an. Es ist nur 1 Bogen, aber weil es 2 Eileiter sind wird 64_QSxxx_64 als paarig dargestellt. Die Quersumme ergibt QS 0+6+5+2+7=20=seitlicher Eileiter LO: Epi.Y!Fliege.Z.5398#828“64“06527“64“913. Der Knoten zieht die beiden seitlichen Eileiter LO „20“ zur Vereinigung als „20_8_20“ enger zusammen. Am rechten Zahlenrand wird Octopamin=22 ausgeschieden. Es ist zur Erleichterung der Eiablage zweckmäßig, dass sich die zur Eiablage angespannte Muskulatur der Peritonealscheide um den Eierstock in einer Gegenreaktion im Eileiter entspannt (siehe: „Neuromuscular organization and aminergic modulation of contractions in the Drosophila ovary | BMC Biology | Full Text (biomedcentral.com)“; A. Middleton u.a /2006./ BMC Biology): Epi.Y!Fliege.Z.5401#82818038“20820“22“. Die Vereinigung ist erfolgt, kann aber noch nicht angezeigt werden, weil wie unter jedem Kravattenknoten der Schlips als Form-Enge „707“ eng zusammengeschnürt wird. Das Fliegenweibchen 66 wird ähnlich mit „606“ adressiert. Mit QS 8+2+8+0+2=20 ist der gemeinsame Eileiter CO =20 bereits versteckt vorhanden: Epi.Y!Fliege.Z.5402#82802“707“212“606“5. Der Uterus wird als breiter „Schlips“ statt „20“ verbreitert mit „seitlich=9_20_0_QS4+5=9=seitlich“: Epi.Y!Fliege.Z.5403#827873818“920045“.
In den Uterus (Ut) führen 2 verschiedene Samenspeicherorgane: Seminal receptacle (SR) und paarige Spermathek (St). Das Männchen der Drosophila melamogaster überträgt bei der 20 minütigen Paarung ca. 4000 Spermien, von den 1000 Spermien bis zu 14 Tage gespeichert werden [80% in SR / 20% in St].
Zunächst legt sich das unpaarige Samengefäß „Seminal receptacle“ als zusammengerollter Strang an den Uterus. Weil sich die Ziffer 2=paarig nicht verhindern lässt mit das Organ als weibliches „66“ EXTRA=8_66_8 adressiert und die Ziffer „2“ am rechten Zahlenrand weggeschoben: Epi.Y!Fliege.Z.5406#8274143994“8668“2. Mit „01“ am rechten Rand wird die Lagerung von Spermien=“1“ adressiert. Eine Verwechselung mit der Eizelle wird durch die Fehlrechnung QS =6+1+3+7+2+9+6=34 statt 33=männlich produziert. Erst 34-1=33 zeigt männlich: Epi.Y!Fliege.Z.5407#8272“6137296“56“01“. Die Öffnung im Unterus wird nunmehr als „303“ mit einem männlichen Bezug angelegt: Epi.Y!Fliege.Z.5408#827108403037168. Die Stranglänge kann die Drosophila melanogaster in einer Längenvariation in Abhängigkeit von der Anzahl von Paarungen mit verschiedenen Männchen wählen. Das Spermium „1“ wird mit 9=Ende als „9_1_9“ für die Schlauchlänge adressiert [Die Drosophila hat den Code nicht erfunden, sie interpretiert ihn]. Der Bereich ist enthalten als QS 8+2+6= 16? bis 0?_ 3? <“919“>54?_9=Ende. Die Maße werden im Prinzip auf Nanometer bezogen: 1mm=1*10^6 nm. Am rechten Zahlenrand steht die Struktur-5 für den Goldenen Schnitt: 0,1mm=0,1*10^5 nm. Ergebnis: Eine im Code enthaltene Zahl kann als 1/10 in mm gezählt werden. Die Mindestlänge des „Seminal receptacle“ beträgt QS=16/10= 1,6 mm. Mit der folgenden Null wird ein Zahlenwert um den Faktor 10 erhöht und dann gleichzeitig wieder um 10 dividiert. Die Maximallänge wird folglich direkt als 3,54 mm abgelesen, was exakt zutrifft [siehe: Functional significance of seminal receptacle length in Drosophila melanogaster - PubMed (nih.gov): G. Miller u.a / 2002 /https://doi.org/10.1046/j.1420-9101.2003.00476.x]: Epi.Y!Fliege.Z.5415#“826“0“3“919“54“9861“5“.
Der Eileiter (DO) geht nicht geradlinig in den Uterus (Ut) über, sondern etwas tiefer seitlich, um eine Ventilklappe (OVF) einzubauen. Im Uterus entsteht dadurch innenseitig eine Gebärmutter-Kuppel (UD / Uterine dome) auf dem außenseitig das Knäuel des „Seminal receptacle“ liegt. Das Gewölbe 64 wird mit „664“ mit weiblich=66 auf den Uterus bezogen und symmetrisch als Wölbung „49=seitlich_939=oben_seitlich=94“ gespiegelt und dann mit dem Bixnom-Kreis=64 ausgerundet: Epi.Y!Fliege.Z.5411#8266“49“8324939“94“ Epi.Y!Fliege.Z.5412#82“64“97088622506. Die Eileiter-Ventilklappe OVF ( Oviduct valve flap) ist posterio-ventral eingerollt (is curled posterio-ventrally) und kann die spermathekalen Einmündungen (spermathecal ducts) zeitweise verschließen (siehe: „SEMINAL PROTEINS BUT NOT SPERM INDUCE MORPHOLOGICAL CHANGES IN THE DROSOPHILA MELANOGASTER FEMALE REPRODUCTIVE TRACT DURING SPERM STORAGE - PMC (nih.gov)“; E. Adams, A. Wolfner; Apr. 2006/J Insect Physiol./ doi: 10.1016/j.jinsphys.2006.12.003“). Vorhanden sind ein langer, seitlicher Muskel „999_55“ mit QS 8+2+6+9+5+5+4+8+9+6+6+9+9+9+5=100 und eine Bewegung Physik=63. Die: Epi.Y!Fliege.Z.5409#826955489669995 und Epi.Y!Fliege.Z.5410#82680263283271.
Die paarige pilzförmige Spermathek (St) setzt mit einem langen Stiel am Uterus (Ut) an. Die spermathekale Kappe ist mit einem Drüsengewebe ausgekleidet, deren Sekret die längerfristige Spermienlagerung sichert. Im Prinzip handelt es sich um eine Drüse, die sich von der Kappe bis zum Stielende durch den Zeilenlauf „Drüse=#8_2“zieht bis zur Mündung am Uterus führt. Die paarige Drüse „Female acccessory gland“ setzt ihren langen Stiel am Uterus an, der den Zeilenlauf als „Drüse=#8_1“ weiterzieht. Die Mündungsbereiche beider Drüsenorgane liegen eng zusammen, so dass dort im Uterus eine Klappe eingebaut ist, um die Mündungen beim Eisprung zeitweise abzudecken. Die Spermathek wird als Drüse=88 als weiblich=66 und paarig=2 adressiert. Es ist Drüsenschichten 77 zur Lagerung der Spermien „1“ als EXTRA =8_33=männlich unter der kreisförmigen Kappe = 46 als Gegenform zu 64 enthalten: Epi.Y!Fliege.Z.5416#825“886677“1“833“46“. Es muss eine Gruppenbildung 44 erfolgen, um im Nachgang noch die obere Kappenrundung=64 zu erzeugen. Die Folgezeile liefert die Gruppe nur indirekt. In der Zeile und als Quersumme ist „66“ vorhanden. Mit der beim Eisprung wechselnden Menge an Octopamin=22 können zwei Zustände geschaltet werden: „weiblich= 66 - 22= 44= Gruppe“ und „66 + 22=88=Drüse“: Epi.Y!Fliege.Z.5417#825734215179066. Die Gruppe „44“ ist ansatzweise mit der Struktur-5 als „4545“ kombiniert vorhanden. Ein Stiel wird später als „909“ erkennbar. Dieser setzt aber bereits unter der Kappe an und schleicht sich als Ziffer „9“ ein „Struktur=55_Extra=8_1=Stiel_8_0=hohl und lang 9_QS 4+45=9_ QS 4+45=9_9“. Die Gruppe hält Kappe und Stiel zusammen: Epi.Y!Fliege.Z.5418#8255“818“09“4545“9“6. Die Lagerung der Spermien im Weibchen=66 ist über die Zeit=24 in Z.Nr. 54“24“ und in der Zeile „24_24“ als Drüse 8_xxx_8 mit xxx=“Struktur=555_24=Tageseinheit_0=Speicherzelle_QS 5+9=14 Tage Lagerzeit“ bekannt: Epi.Y!Fliege.Z.54“24“#8“24“66“8555240598“. Kappenwölbung „64“ und Stiel „909“: Epi.Y!Fliege.Z.5428#8240608407562“64“ und Epi.Y!Fliege.Z.5429#823“909“052058391. Das paarig gespiegelte Mündungsloch der „Spermathek“ ist im Uterus mit „Spermien=1_3003_1__1“ größer als für die „Female accessory gland“ mit „303“. Der Ventilbeeich liegt am Zeilenübergang Z.xx63/xx64, so dass für die Uterus-Klappe ein Antrieb Physik=63 verfügbar ist: Epi.Y!Fliege.Z.5463#1878“130031“576“1“. Zwischen den beiden Mündungen 3003/303 liegt ggf. für die Ventilfunktion ein Ringmuskel „5505“: Epi.Y!Fliege.Z.5472#81743462054“5505“. Paarige Mündung „303“ der Drüse „Female accsessory gland“ mit einem fadenartigen Stiel vom Drüsenkörper: Epi.Y!Fliege.Z.5480#81624128533“303“. Ein Drüsen-Stiel „404“ führt weiter zum Drüsenkörper: Epi.Y!Fliege.Z.5483#815794682“404“706. Der Drüsenkörper ist als Volumen 500_8 und als Drüse 606_8808 zu erwarten im Bereich: Epi.Y!Fliege.Z.5487#815199971500821 bis Epi.Y!Fliege.Z.5491#814“606“12704“8808“.
Ab der Zeile Z.5500 beginnt die Serie Z.“55“xx für die kreisförmige quergestreifte Uterus-Muskelschicht „55“ bereits mit der Zeilennummer. Im Eileiter und Uterus der Drosophila sind keine Längsmuskelfasern vorhanden. Der Uterus verjüngt sich und besitzt eine Formeinschnürung „707“ in Z.“555“2. Nach der Muskelmaximum Z.5555 fällt die Zeilennummer umgehend als Z.55xx zurück. Bei der Paarung erzeugt das Männchen im Fortpflanzungstrakt des begatteten Weibchens einen Paarungspfropfen (Mating plug). Es werden Drüsenproteine übertragen. Vor einer erneuten Begattung muss der Pfropfen zunächst entfernt sein. Nach dem Uterus folgen Vagina und Vulva sowie weibliche Kopulationsstrukturen, die mit den männlichen Genitalstrukturen in Kontakt treten (siehe: „Coevolution between Male and Female Genitalia in the Drosophila melanogaster Species Subgroup | PLOS ONE“; A.Jassin, V.Orgogozo / Feb 2013 / https://doi.org/10.1371/journal.pone.0057158 ). Die Vagina ist eine Einstülpung im hinteren Teil der Genitalkammer, in der die Befruchtung stattfindet, und erstreckt sich posterior bis zur Vulva als äußere Öffnung der Vagina. Die Vulva ist die Kopulationsöffnung und die Austrittsstelle für die Eier. Die Vulva liegt medial zwischen den hinteren Spitzen der Hypogynialklappen und ist von der Membran des Oviprovektors umgeben.
23.) Eiablage-Apparat des Weibchens:
23.1) weiblicher Analbereich mit „Epiproct“ und „Hyperproct“: Das Körperende der Drosophila melanogaster liegt im 9. Segment des Abdomen am After „808“. Die Ziffer 2=paarig wird blockiert, weil damit 2_1=unpaarig_2 markiert wird. Anus: Epi.Y!Fliege.Z.3849#162“1“2061408“808“. In Z.3846 wurde bereits eine Gruppe 44_2_“66“_8 gebildet, die ggf. nur für Weibchen gilt. Der After wird beim Weibchen von 2 Strukturen umringt. Oberseitig (dorsal) wird der Anus von der Platte „Epiproct“ umringt (Synonyme: abdominal tergite 9, abdominal tergite 10, dorsal anal plate, upper anal plate, supraanal plate). Als Zählmerkmal „11“ werden „18“ Sensillen, davon 2 sehr große Sensillen als „1818“ ausgebildet (siehe: FlyBase ID: FBbt:00004833). Die weibliche Form enthält „6__7_6“: Epi.Y!Fliege.Z.3850#116181876457792. Der Form-Ring „707“ um den Anus mit „18“ Sensillen ist als 1_707_18 und oben=99 adressiert, wobei unterseitig vom Anus bereits „19“ Sensillen avisiert werden: Epi.Y!Fliege.Z.3851#11615“170718“3199. Unterseitig (ventral) wird der Anus von der Platte „Hypoproct“ umringt (Synonyme: Abdominalsternit 9, Subanalplatte, ventrale Analplatte, untere Analplatte). Als Zählmerkmal „11“ werden „19“ Sensillen, davon 4 große Sensillen als „1_4_1“ ausgebildet (siehe FlyBase ID: FBbt:00004834): Epi.Y!Fliege.Z.3852#“11“61215535728“19“ und Epi.Y!Fliege.Z.3853#“11“609“141“5614456. Eine Abbildung der hinteren (posterior) Körperansicht siehe: A standardized nomenclature and atlas of the female terminalia of Drosophila melanogaster - PMC (nih.gov); Fly (Austin). Mai 2022; doi: 10.1080/19336934.2022.2058309.
23.2) weibliches Hinterleibssegment „Epigynium“: Das Epigynium liegt vor dem After. Das hufeisenförmige Tergit „Epigynium“, FlyBase ID: FBbt:00110704, (Synonyme: female abdominal tergite 8), umrahmt dorsal den oberen Analbereich mit Epiproct und Hypoproct sowie ventral durch seitliche Lappen die unteren weiblichen Genitalien. Der dorsale Epigynenlappen (epigynial dorsal lobe / FlyBase ID: FBbt:00052057) ist zu einem Skelerit verschmolzen und zeigt keine Sensillen (Borsten). Der paarige ventrale Epigynenlappen (epigynial ventral lobe / FlyBase ID: FBbt:00052058) liegt unterhalb dorsalen Lappens und ist mit 4-5 kleinen, unpigmetierten Sensillen (Borsten) besetzt.
Das hintere geschlechtsabhängige Körpersegment wird beim Weibchen vom Epigynium und beim Männchen vom Epandrium (Genitalbogen / genital arch) gebildet. Die letzte geschlechtsunabhängige Rückenplatte (Tergit / Tergium) würde an einer Formspalte „777“ (777 ohne Doppelziffer-Paar eines Ganglions) beginnen: Epi.Y!Fliege.Z.3798#11“777“2570922196.
Der Analbereich wird ringförmig 5_(808=After)_5 von Epiproct und Hyperproct „89_89“ umschlossen. Nunmehr kann das weibliche „6666“ Epigynium an der lotrechten Formgrenze (ersetzt 777) als Zählgröße=11_66667_QS2+5=7_7 beginnen: Epi.Y!Fliege.Z.3834#“11“6666725“18583“7“. Entsprechend dieser Annahme müsste der Beginn des männlichen „Epandrium“ bei „3333“ entstehen: Epi.Y!Fliege.Z.3780#118“3333“92688492. Aber ist gibt ein Problem: Das Männchen kann die Zeile „777“ in Z.3798 nicht mehr als Segmentgrenze lesen. Ein Segment wird „amputiert“, so dass offenbar Tergium 6 + 7 verschmolzen werden. Das Männchen entwickelt seine Genitalien weit über das Körperende am Anus hinaus, indem das Körperende im Zeilenlauf umrundet wird und unter dem Bauch weitere Segmente entstehen. Weil der Bereich vom Männchen durchlaufen wird, muss die Epi.Y!Fliege.Z.3798#11“777“25709“22“196 vom Männchen abweichend interpretiert werden. Enthalten ist ein Sklerit= 22. Damit könnte ggf. das „Epandriale anterodorsale Phragma“ (Epandrial anterodorsal phragma /FlyBase ID: FBbt:00048382) entstehen. Es ist ein dünnes Sklerit, das das Epandrium mit den Abdominaltergiten „6“ und „7“ verbindet. Die Form „777“ bildet dann die Länge des Elementes (unbekannt, kein´Foto).
23.3) männliches Hinterleibssegment „Epandrium“: Für die Suche werden Begriffe und Merkmale notiert: 1.) Epandrial anterodorsal phragma (FBbt:00048382): Dünnes Sklerit, das das Epandrium mit den Abdominaltergiten 6 und 7 verbindet. Synonyme: abdominal tergite / phragma. 2.) Epandrial dorsal lobe (FBbt:00048383): Dorsaler Teil des Epandriums oberhalb des hinteren Epandriallappens. Die beiden dorsalen Lappen sind zu einem einzigen Sklerit verschmolzen. Er enthält etwa 8 lange, dünne Borsten. 3.) Epandrial posterior lobe (FBbt:00004841): Lappen in der hinteren Region des Epandriums. Er befindet sich hinter dem ventralen Lappen des Epandriums und bedeckt meist den Surstylus. 4.) Epandrial ventral lobe (FBbt:00004842): Lappen ventral des Epandrialdorsallappens und anterior des Epandrialhinterlappens. Er enthält etwa 22 lange, dünne Borsten. 5.) Epandrium (FBbt:00004839) / synonyms: genital arch, abdominal tergite 9: Hufeisenförmiges Tergit, das dorsal die männlichen „Cerci“ umgibt. Es enthält auf jeder Seite etwa 30 Epandrialborsten. Die linke und die rechte Seite des Epandriums sind durch die Subepandriensklerite verbunden. Der ventrale Teil jeder Seite des Epandriums ist in einen ventralen Epandriallappen und einen hinteren Epandriallappen unterteilt.
23.4) weiblicher Legestachel (Ovipositor): Der Fortpflanzungstrakt ab der Eientwicklung zieht sich im Zeilenlauf extrem weit dahin, so dass diese Formation in den Hinterleib „gepresst“ wird. Der Legestachel Ovipositor verschließt dann diese Röhre als „Ofentür“ am After. Aufgrund der komplizierten sensenartigen Form und fehlender Beschreibungen, bleibt die Funktion zunächst unverständlich. Ein auffälliges Merkmal ist der als Säge ausgeformte Legestachel (Ovipositor) der Kirschessigfliege (Drosophila suzukii), mit der die Eier im Fruchtfleisch frischer Früchte deponiert werden [siehe: spotted-wing drosophila - Drosophila suzukii (Matsumura) (ufl.edu); R. Mann, L. Stelinski; Fotos: M.Hauser/Mai 2011/ University of Florida/ EENY-492]. Die Schwarzbäuchige Taufliege (Drosophila melanogaster) legt die Eier dagegen in faule Früchte ab. Aus der gleichen Anzahl von Zellen kann die D. suzukii einen Ovipositor mit doppelter Länge durch beschleunigte Zellausdehnung erzeugen. Die Fliege kann die Anzahl der Sägezähne zwischen 30 - 36 interpretieren. Im Zeilenlauf könnte der noch unbekannte männliche Kopulationsapparat zur guten Übereinstimmung verwechselbar untergemischt sein. Beim Männchen sind folgende Merkmale zu unterscheiden: „Male's genital segment...; epandrium slightly constricted at middle; surstylus (clasper) large, with tapering tip, bearing 10–11 primary teeth (prensisetae) medially and 4–5 secondary teeth subapicaly; marginal bristles also in two sets, upper one 5–6, lower one 3–4 at the tip; anal plate oval, tapered ventrally / deutsch: Epandrium in der Mitte leicht eingeschnürt; Surstylus (Klammer) groß, mit spitzer Spitze, mit 10-11 primären Zähnen (prensisetae) medial und 4-5 sekundären Zähnen subapikal; marginale Borsten ebenfalls in zwei Sätzen, obere 5-6, untere 3-4 an der Spitze; Analplatte oval, ventral verjüngt [Siehe: PM 7/115 (1) Drosophila suzukii - 2013 - EPPO Bulletin - Wiley Online Library /Nov 2013/ https://doi.org/10.1111/epp.12059]“. Die weitläufige Zählgrößen-Serie #11 wird vermutlich zuerst vom Männchen besetzt. Die männlichen Genitalien gliedern sich in die „Periphallic organs“ und den Penis-Apparat (Phallic organs) mit Aedeagus, Paramere etc.
Die weiblichen Genitalien bestehen aus dem Ovipositor (Oviscape) und den Oviscape valve [Oviscapt], die sich gliedern in „ovipositor plate, ovipositor lobe, egg guide, sternite VIII“ [siehe: „(PDF) Copulation anatomy of Drosophila melanogaster (Diptera: Drosophilidae): Wound-making organs and their possible roles (researchgate.net)“ ; Y. Kamimura/ Zoomorphology (2010) 129:163–174 DOI 10.1007/s00435-010-0109-5“.
Der Zeilenbereich für die Zähne an den stark sklerotisierten und vergrößerten plattenartigen Ovipositoren der Drosophila suzukii ist bekannt, unbekannt ist der Anfang. Der Ovipositor kann frühestens mit der Zeilen-Nr. Z.39“55“=55=Struktur und Muskel statt einer Gruppe 44 avisiert sein. Über 4 Zeilen zieht sich die Zählgröße #1130_9 mit 30 Zähnen hin. In Z.3956 ist für die Innenseite des Ovipositors ist eine lange, seitliche Membran 3033_999 vorhanden, deren Schuppenschicht als Oviprovektor-Schuppen (Oviprovector scales) bezeichnet wird. Hier wurde festgestellt, dass ein Nerv „7“ über eine Zähleinheit „1“ in „717“ in Verbindung mit der Zählgröße 11 eine Funktion auslösen kann, die als Rechenaufgabe 7_xx_7 verpackt ist. Somit zählt 11_78717 wie „8+1=9=oben“. Das Ei gleitet im Eikanal (Egg duct) mit der Schwerkraft an den Schuppen entlang herab, folglich müssen die Schuppen wieder aufgerichtet werden. Die Struktur „55“ mit 30 Zähnen, paarig „11_30_11“, ist nunmehr avisiert: Epi.Y!Fliege.Z.3958#113011678717155.
Bei der Drosophila melanogaster läuft zur Eiablage ein Ovipositor-Motorprogramm ab: Der Hinterleib (Abdomen) wird in eine lotrechte Achse senkrecht zum Substrat gebogen, der Ovipositor in das Substrat geführt und das Ei ausgestoßen. Der Ovipositor wird dann mit den Hinterbeinen gepflegt / gereinigt. Der Ovipositor wird bewegt, so dass die Struktur am besonderen Zeilenübergang Z.xx63/Z.xx“64 startet. Enthalten ist die Spitze oben=909 und die Gravitation=84 (entweder dreht sich der Ovipositor oder biegt sich der Hinterleib. Der Eiablageort muss als Larven-Futterquelle dienen, so dass der Token=86 enthalten ist. Ist eine Ortsentscheidung getroffen, läuft das Motor-Programm als QS 1+1+2+8+6+9+0+9+5+2+2+1+4+2+3=55=Muskel mit Physik=63 ab: Epi.Y!Fliege.Z.39“63“#11286“909“5221423. Zur Spitze „909“ wird die Achse „Form=7_9_7“ mit der Gravitation „84“ verknüpft: Epi.Y!Fliege.Z.3963#112“84“0621685797. Die Achsen oben=senkrecht=999 wird mit dem 90°-Grad-Winkel kombiniert, denn es ist zu vermuten, dass der Ovipositor diese Drehbewegung ausführt. Mit der Zählgröße 11 ist eine Additionsaufgabe zu lösen: Über den Nerv=7 muss die Ziffer 1 in 7_1_7 erst zu 7_83_7 als 83 +1= 84 als Gravitation addiert werden, anderenfalls wird der Hinterleib nicht verbogen: Epi.Y!Fliege.Z.3966#“11“2“783717“6“90“999“.
Die Oviprovektor-Schuppen (oviprovector scales) entwickeln sich als Gruppe 44 vertikal und lamellenartig mit dreieckigen Spitzen innenseitig am Ovipositor herab. Die Struktur 55_66=weiblich enthält die Rechenaufgabe 11_7_44_7_4_7_11. Somit kann die Ziffer „4“mit „11“ als „114“ verknüpft werden, weil in Z.3994 die Zähne des Ovipositors avisiert werden. Die bemerkenswerte Größe „Öffnung=50005_64=Kreis _292“ kann den unpaariger Eikanal (Egg duct) bilden, weil dieser mit Ziffer „2=paarig“ und seitlich= 9 aus der inneren Schuppenschicht des paarigen Ovipositors resultiert: Epi.Y!Fliege.Z.3976#12“50005“64“29200“. Die Lamellen sind in Z.3977 abhängig von der Eiablage (Zeit=24) als Aufgabe „7_1_7_68_7_61_001“ verpackt: 68-61=7 und somit als vertikale Lamellen-Form 717_7_„7=Lösung“_7 mit Spitzen „001“: Epi.Y!Fliege.Z.“3“977#“1124“71768761001“.
Die Anzahl der Zähne am Ovipostitor von Drosophila suzukii kann gemäß Abbildung „Datei:Drosophila suzukii ovi lat.jpg – Wikipedia“ über eine Serie „#111“ interpretiert werden. Die Kamm des Ovipostors wird mit „Zahn-Zählgröße=111_99=Oben_30=Zähne“ fortlaufend als Serie bestückt. Am rechten Zahlenrand wird zusätzlich eine kurze EXTRA-Serie „11_4“ mit „4“ Zähnen adressiert, die außen und seitlich=9 begrenzt an der Spitze mitzuziehen ist. Epi.Y!Fliege.Z.3994#“1119930“4565“9114“. Der Kamm wird über 13 Zeilen mit 13 Zähnen bestückt, und zwar von Epi.Y!Fliege.Z.3995#“1119“6501235607 bis Epi.Y!Fliege.Z.4007#“111“629704108435. Die paarige Zahnreihe ist durch Farbstoff „88_88“ dunkel gefärbt: Epi.Y!Fliege.Z.3998#“111“88“09965“88“920. Der 14. Kamm-Zahn kann die Reihe nicht fortsetzen, weil eine Dopplung 85_85_3=Zähne gefordert wird, so dass der 14. Zahn neben den 13. Zahn gestellt wird und in dieser Reihe bis zum 16. Zahn schräg zurück zum Kamm zieht. Weil nochmals eine „85“ vorhanden ist, aber keine doppelte 85_85, bleibt diese Besonderheit nur auf eine der beiden Kammseiten beschränkt (keine Spiegelung): Epi.Y!Fliege.Z.4008#“111601852385853 bis Epi.Y!Fliege.Z.4010#“111“546190614090. Es wird eine Zahngruppe 44_9=Zähne vom 17. bis zum 25. Kamm-Zahn gebildet, von denen nochmals 3 Zähne etwas schräg gestellt werden. Gruppe von Epi.Y!Fliege.Z.4011#“111“51“838“05“44“12“9“ bis Epi.Y!Fliege.Z.4019#“111“296398199179. Die asymmetrische Schrägstellung führt durch die Verkürzung zu einer Fehlstelle. In der Serie ist mit „5_11_9=seitlich_5“ 1 Extra-Zahn „11“ vorhanden, der als 26. Kamm-Zahn mit eingeordnet wird: Epi.Y!Fliege.Z.4018#“111“32409765“119“5. Inclusive der seitlichen 4 Extra-Zähne an der Spitze sind es wie adressiert 30 Zähne. An der Seitenwand liegt weiterhin noch eine Gruppe von 5 Zähnen für den 31. bis 35. Zahn, und zwar von Epi.Y!Fliege.Z.4020#“111“26871252798“5“ bis Epi.Y!Fliege.Z.4020#“111993045659114. Der 36. Zahn ergibt sich, wenn in der Startzeile außer der Extra-Serie 11_4 zugleich der 1. Kamm-Zahn gezählt wird, weil dann statt 13 eine Serie aus 1_14=Zähnen ablesbar ist. Die Serie ist beendet, weil die Folgezeile „1111“ statt „111“ enthält. Hiermit kann dann die Gruppe der sehr kleinen Zähne am inneren Plattenrand gestaltet werden.
25.) Epandrium - abdominale Rückenplatte (Tergium IX) des Fliegen-Männchens
Das männliche Epandrium (abdominal tergite 9; FBbt:00004839) ist eine hufeisenförmige Rückenplatte (Tergum), die ähnlich einem Pferdesattel auf dem Pferd liegt und bei „3333“ beginnt. Auf jeder Seite sind etwa 30 Epandrialborsten vorhanden, die mit dem Zeilenlauf #11 stets avisiert sind: Epi.Y!Fliege.Z.3780#“11“8“3333“92688492. Die 30 Haare „1“ sind als „Zählgröße=11_Extra=8_“30“_Stück_1=Haar“ avisiert, jedoch mit 30_2_9=seitlich insgesamt als 60 Haare. Dieses ist für das unpaarige Epandrium zweckmäßig, weil sich damit 60 Zeilen weiter, der hintere (posterior) obere Abschlussbogen „64“ des „Pferdesattels“ ergibt. Zählhaare 11_1: Epi.Y!Fliege.Z.3781#“11“8“30209“583774“1“. Über 3 Zeilen ist der obere unpaarige Abschlussbogen als 11_“64“ und als Gruppe=44_männlich=33 adressiert. Weil der Anus noch nicht ganz erreicht wird, sind die paarigen Fortsätze „Cercus“ und „Surstylus“ als „34_2_34“ an den beiden Seitenlappen des Epandriums befestigt: Abschlussbogen: Epi.Y!Fliege.Z.3840#“11“64“844“34“277“34“. Scheinbar wird die Anzahl von 60 Haaren am Bogen=64 mit männlich=33 finalisiert. Der Abschlussbogen muss das Epandrium als „Pferdesattel“ unter dem „Pferd“ (hier die Cerci) vergurten. Dieses wird durch einen Sklerit erreicht, der konkav zwischen oberen Cercus und unterem Surstylus als Verbindung liegt (2 halbkreisförmig gebogene Stangen paarig nebeneinander). Weil direkt kein Sklerit=22 vorhanden ist, wird die Drosophila eine Membran=33 im dorsalen Teil des Segmentes 9 zu einem Sklerit umwandeln: Membran=33_QS 9+6+7=22=Sklerit. Die benachbarten Sklerite sind als ungespiegeltes Paar 96_96 avisiert. Mit der Zeit=60 müssen zunächst noch die Cerci entstehen: Subepandrial-Sklerite (subepandrial sclerite): Epi.Y!Fliege.Z.3842#“11“642379“60“33“967.
Der paarige Cercus (Schwanz / Afterfühler) (FBbt:00004844) ist ähnlich einem Ohr mittig (anteromedial) am Seitenlappen des Epandriums befestigt. Der Anus „808“ wird seitlich als „88_0_88“ von den beiden Cerci begrenzt. Die birnenförmigen Cerci enden oben spitz und im unteren Drittel rund. Die Formgrenze ist durch unterschiedliche Borsten (Cercal bristle / FBbt:00048392) ersichtlich. Es sind insgesamt 40 Bosten (vermutlich nur pro Seite, weil paarig). Cercal dorsal lobe (FBbt:00048379): Es sind lange und dünne Borsten (cercal dorsal bristles / FBbt:00048393) vorhanden. Cercal ventral lobe (FBbt:00048380): Es sind kurze und starre Borsten (Cercal ventral lobe bristle / FBbt:00048394. Die insgesamt 40 Borsten werden am Anus paarig_ 88_88 als Borstengruppe Borste=1_Anzahl=40_Struktur=4_Gruppe adressiert. Epi.Y!Fliege.Z.3860#“115“88088“7“1“40“5“44“. Um die die notwendige Borstenanzahl von 40 zu erreichen, muss eine Untergruppe für die „Ventral lobe bristle“ eingerichtet werden, weil die obere Gruppe „18“ dünne und lange Borsten enthalten soll. Geeignet ist eine Zählweise mit „18“ langen und dünnen „Cercal dorsal bristles“ als „Lange“ Borsten sind Zählgröße=11_QS 5+6+7=18 Borsten_11=Borste, weil die Restsumme von „22“ kurzen starren Borsten enthalten ist als „1+1+18+1+1=22“: Epi.Y!Fliege.Z.3867#“11“567“11“20859193. Die Cerci sind auf halber Höhe jeweils nach außen über eine Strukturbrücke „555_paarig= 503_35“ und 5_9=seitlich_5 mit dem dorsalen Seitenlappen des Epandriums verwachsen: Epi.Y!Fliege.Z.3871#“11“555“159“503035“4. Die 18 Borsten paarig=18_18 sind erzeugt, so dass für den Rest eine Gruppe 44 gebildet wird, wobei die Gesamtanzahl von „40“ enthalten ist: Epi.Y!Fliege.Z.3878#“11“534301“81“440“18“. Die kurzen starren Borsten „1“ entstehen als Struktur „5_2_5“ paarig=38_5=starr_83. Die Anzahl von 22 ergibt sich als Addition der Zeilen-Nr. 3+8+8+1=20 zuzüglich der Zählgröße 1+1. Die birnenförmige Unterkante wird als Kreis mit QS1+1+5+2+5+3+8+5+8+3+7+7+3+5+1=64 erzeugt: Epi.Y!Fliege.Z.3881#“11“525“38583“7735“1“. Das Subepandrial-Sklerit „22“ musste erst aus einer Membran=33 umgewandelt werden und legt sich nunmehr konkav an die birnenförmigen Cerci als eine Verbindung zu den Surstyli passend an. Das Sklerit wurde in.Z.3842 avisiert und mit der Zeilen-Nr. Z.38„44“ als Gruppe zur Verbindung der Certi/Sklerite als 63_63=Physik mit der Zeit=24 und dem Sklerit=22 adressiert: Epi.Y!Fliege.Z.3844#“11“636322“17384“24“. Die Cerci ziehen sich über 22 Zeilen von Z.3860 bis Z.3881, so dass nunmehr das Sklerit=22 befestigt werden kann. Ungespiegelt paarig=22_9_QS0+7+8+4+3=22_9=seitlich: Epi.Y!Fliege.Z.3882#“11“5“22“416“9078439“.
Die Massenkraft der Cerci muss nunmehr von seitlichen Konsolen abgetragen werden. Hierfür zieht sich der Abschlussbogen „64“ des Epandriums nach dem oberen seitlichen Lappen [Epandrial dorsal lobe / FBbt:00048383 mit 8 Borsten (Epandrial dorsal lobe bristle / FBbt:00048396)] noch vor dem unteren seitlichen Lappen (Epandrial ventral lobe / FBbt:00004842 mit 22 Borsten (Epandrial ventral lobe bristle / FBbt:00048397)] in der Mitte den paarigen hinteren seitlichen Lappen (Epandrial posterior lobe / FBbt:00004841) ein. Ein Fortsatz setzt den Abschlussbogen als Konsole fort. Ob Borsten vorhanden sind, ist in „A Standardized Nomenclature and Atlas of The Male Terminalia of Drosophila melanogaster /doi: 10.20944/preprints201906.0071.v1“ nicht dokumentiert – in der Skizze sind 3 Borsten eingezeichnet.
Der konsolartige Lappen (Epandrial posterior lobe) kragt als Struktur=5 und als konvexer Bogen=64, paarig=64_46, seitlich=9 aus. Am unteren Ende ist die konkave Form als Gegenform=46 zu suchen: Epi.Y!Fliege.Z.3882#“11“51“64“83634“46“1“9“. Aufgrund der Zählgrößenserie #11 wird die Geometrie über die Borsten gesteuert. Die 1 obere Borste „11“ wird paarig „11_11“ bzw. „2“ adressiert: Epi.Y!Fliege.Z.3891#“11“4957652“11“0640. Die Ziffer „2“ ist von links nach rechts der „11“ gewechselt und muss als Struktur-5_2=doppelt gezählt werden, so dass unten 2 Borsten und insgesamt 3 Borsten am Lappen paarig „11_11“ und QS 5+4=9=seitlich sitzen: Epi.Y!Fliege.Z.3892#“11“4928“11“5“2“01054. Die Folgezeile enthält die konkave Gegenform=46 für die Unterkante der Konsole. Im weiteren Zeilenlauf ist der paarige innere Lappen des Tergi IX „Surstylus (FBbt:00004843)“ zu entwickeln, der bereits von der Konsole teilweise als 89_8_“5=Struktur“_9 überdeckt wird. Alternativ wird direkt mit dem unteren seitlichen Lappen des Epandriums als Abschluss fortgesetzt: Epi.Y!Fliege.Z.3893#“11“4898593“46“5836. Der untere seitliche Lappen (Epandrial ventral lobe / FBbt:00004842) umschließt den Surstylus. Die 22 Borsten (Epandrial ventral lobe bristle / FBbt:00048397) sind als „22_11=Borste, paarig=11_11 adressiert: Epi.Y!Fliege.Z.3893#“11“4692365“2211“54. Der Lappen ist wie ein abnehmender Mond, paarig gekrümmt, so dass die Unterseite einen breiten Tiefpunkt „3003“ bildet, der einen männlichen Bezug in der Zeilen-Nr. Z.39“33“ enthält und auch paarig ist: Epi.Y!Fliege.Z.38“33“#“1137“3003“4162853.
Der paarige Surstylus (FBbt:00004843) zieht sich unterhalb der Cerci vom Subepandrial-Sklerit nach unten (ventral). Der paarige Surstylus ist hakenförmig und umhüllt die männlichen Genitalien. Am Surstylus sitzen in einem gebogenen Band arrangiert 25 dornenartige Borsten (Surstylar teeth (FBbt:00004470) und am Ende 1 (manchmal mehrere) lange Surstylar-Borste (Surstylar long bristle / FBbt:00004471). Für die Drosophila melanogaster liegt momentan keine Abbildung vor. Für den verdeckten Surstylus liegen nur 3 Zeilen vor, um die Borsten zu adressieren. Gemäß einer Beschreibung der „Drosophila quinarensis“ ist der Surstylus ellipsenförmig, so dass sich die 25 Borsten in 3 Gruppen, paarig 37_73 am Rand als Summe 10 + 6 + 9= 25 Borsten verteilen. Die obere und untere unsortierte Borsten-Gruppe besitzt einen ähnlichen Borstentyp: Borste=11_QS 3+7=10 Anzahl_0_Borste=11_06=Anzahl: Epi.Y!Fliege.Z.3934#“11“37“0“11“2464“73“06“. Die 3. Gruppe liegt am inneren Rand zahnartig wie ein Gebiss „222“, paarig=82_28, mit „9“ Zähnen als 11_222_9: Epi.Y!Fliege.Z.3892#“11“367“2229“825286. Zuletzt ist noch eine Formausrundung=64, ein männlicher Bezug=33 und mit „11“ noch eine restliche Borstengestaltung, paarig=43_34 vorhanden. Weiterhin kann der vertikale Muskel 55_9_5 zu den Genitalien adressiert werden. Eine Alternative mit der Zahl „25“ kann in Z.3951/Z.3952 gesucht werden. Weiterhin ist eine Verteilung 11 + 6 + 8 =25 mit Form=7_8_7 mit Borsten als Form=7_1=Borste_7 sowie als stabile Zahn-Struktur=55 zugleich Muskel=55 und paarig= 11_11 möglich: Epi.Y!Fliege.Z.3958#“11“30“11“6“7“8“7“1“71“55“. Die flächig verteilte Borstenanzahl ist indirekt als „2(0)5“ mit den Borsten „1“ als männlicher Bezug=3_1_33_2=paarig vorhanden: Epi.Y!Fliege.Z.3959#“11“298“3“1“33“2“05986. Die einzelne lange Surstylar-Borste „11_111“, paarig=2, wird adressiert. Der untere runde Rand ist als Gegenform=46 incl. als QS=46 enthalten: Epi.Y!Fliege.Z.3960#“11295“46“02111742. Die männlichen Genitalien können nunmehr in diese umhüllende Struktur einmünden.
25.) Epandrium - abdominale Rückenplatte (Tergium IX) des Fliegen-Männchens
Das männliche Epandrium (abdominal tergite 9; FBbt:00004839) ist eine hufeisenförmige Rückenplatte (Tergium), die ähnlich einem Pferdesattel auf dem Pferd liegt und bei „3333“ beginnt. Auf jeder Seite sind etwa 30 Epandrialborsten vorhanden, die mit dem Zeilenlauf #11 stets avisiert sind: Epi.Y!Fliege.Z.3780#“11“8“3333“92688492. Die 30 Haare „1“ sind als „Zählgröße=11_Extra=8_“30“_Stück_1=Haar“ avisiert, jedoch mit 30_2_9=seitlich insgesamt als 60 Haare. Dieses ist für das unpaarige Epandrium zweckmäßig, weil sich damit 60 Zeilen weiter, der hintere (posterior) obere Abschlussbogen „64“ des „Pferdesattels“ ergibt. Zählhaare 11_1: Epi.Y!Fliege.Z.3781#“11“8“30209“583774“1“. Über 3 Zeilen ist der obere unpaarige Abschlussbogen als 11_“64“ und als Gruppe=44_männlich=33 adressiert. Weil der Anus noch nicht ganz erreicht wird, sind die paarigen Fortsätze „Cercus“ und „Surstylus“ als „34_2_34“ an den beiden Seitenlappen des Epandriums befestigt: Abschlussbogen: Epi.Y!Fliege.Z.3840#“11“64“844“34“277“34“. Scheinbar wird die Anzahl von 60 Haaren am Bogen=64 mit männlich=33 finalisiert. Der Abschlussbogen muss das Epandrium als „Pferdesattel“ unter dem „Pferd“ (hier die Cerci) vergurten. Dieses wird durch einen Sklerit erreicht, der konkarv zwischen oberen Cercus und unterem Surstylus als Verbindung liegt (2 halbkreisfömig gebogene Stangen paarig nebeneinander). Weil direkt kein Sklerit=22 vorhanden ist, wird die Drosophila eine Membran=33 im dorsalen Teil des Segmentes 9 zu einem Sklerit umwandeln: Membran=33_QS 9+6+7=22=Sklerit. Die benachbarten Sklerite sind als ungespiegeltes Paar 96_96 avisiert. Mit der Zeit=60 müssen zunächst noch die Cerci entstehen: Subepandrial-Sklerite (subepandrial sclerite): Epi.Y!Fliege.Z.3842#“11“642379“60“33“967.
Der paarige Cercus (Schwanz / Afterfühler) (FBbt:00004844) ist ähnlich einem Ohr mittig (anteromedial) am Seitenlappen des Epandriums befestigt. Der Anus „808“ wird seitlich als „88_0_88“ von den beiden Cerci begrenzt. Die birnenförmigen Cerci enden oben spitz und im unteren Drittel rund. Die Formgrenze ist durch unterschiedliche Borsten (Cercal bristle / FBbt:00048392) ersichtlich. Es sind insgesamt 40 Bosten (vermutlich nur pro Seite, weil paarig). Cercal dorsal lobe (FBbt:00048379): Es sind lange und dünne Borsten (cercal dorsal bristles / FBbt:00048393) vorhanden. Cercal ventral lobe (FBbt:00048380): Es sind kurze und starre Borsten (Cercal ventral lobe bristle / FBbt:00048394. Die insgesamt 40 Borsten werden am Anus paarig_ 88_88 als Bostengruppe Borste=1_Anzahl=40_Struktur=4_Gruppe adressiert. Epi.Y!Fliege.Z.3860#“115“88088“7“1“40“5“44“. Um die die notwendige Borstenanzahl von 40 zu erreichen, muss eine Untergruppe für die „Ventral lobe bristle“ eingerichtet werden, weil die obere Gruppe „18“ dünne und lange Borsten enthalten soll. Geeignet ist eine Zählweise mit „18“ langen und dünnen „Cercal dorsal bristles“ als „Lange“ Borsten sind Zählgröße=11_QS 5+6+7=18 Borsten_11=Borste, weil die Restsumme von „22“ kurzen starren Borsten enthalten ist als „1+1+18+1+1=22“: Epi.Y!Fliege.Z.3867#“11“567“11“20859193. Die Cerci sind auf halber Höhe jeweils nach außen über eine Strukturbrücke „555_paarig= 503_35“ und 5_9=seitlich_5 mit dem dosalen Seitenlappen des Epandrium verwachsen: Epi.Y!Fliege.Z.3871#“11“555“159“503035“4. Die 18 Borsten paarig=18_18 sind erzeugt, so dass für den Rest eine Gruppe 44 gebildet wird, wobei die Gesamtanzahl von „40“ enthalten ist: Epi.Y!Fliege.Z.3878#“11“534301“81“440“18“. Die kurzen starren Borsten „1“ entstehen als Struktur „5_2_5“ paarig=38_5=starr_83. Die Anzahl von 22 ergibt sich als Addition der Zeilen-Nr. 3+8+8+1=20 zuzüglich der Zählgröße 1+1. Die birnenförmige Unterkante wird als Kreis mit QS1+1+5+2+5+3+8+5+8+3+7+7+3+5+1=64 erzeugt: Epi.Y!Fliege.Z.3881#“11“525“38583“7735“1“. Das Subepandrial-Sklerit „22“ musste erst aus einer Membran=33 umgewandelt werden und legt sich nunmehr konkav an die birnenförmigen Cerci als eine Verbindung zu den Surstyli passend an. Das Sklerit wurde in.Z.3842 avisiert und mit der Zeilen-Nr. Z.38„44“ als Gruppe zur Verbindung der Certi/Sklerite als 63_63=Physik mit der Zeit=24 und dem Sklerit=22 adressiert: Epi.Y!Fliege.Z.3844#“11“636322“17384“24“. Die Cerci ziehen sich über 22 Zeilen von Z.3860 bis Z.3881, so dass nunmehr das Sklerit=22 befestigt werden kann. Ungespiegelt paarig=22_9_QS0+7+8+4+3=22_9=seitlich: Epi.Y!Fliege.Z.3882#“11“5“22“416“9078439“.
Die Massenkraft der Cerci muss nunmehr von seitlichen Konsolen abgetragen werden. Hierfür zieht sich der Abschlußbogen „64“ des Epandriums nach dem oberen seitlichen Lappen [Epandrial dorsal lobe / FBbt:00048383 mit 8 Borsten (Epandrial dorsal lobe bristle / FBbt:00048396)] noch vor dem unteren seitlichen Lappen (Epandrial ventral lobe / FBbt:00004842 mit 22 Borsten (Epandrial ventral lobe bristle / FBbt:00048397)] in der Mitte den paarigen hinteren seitlichen Lappen (Epandrial posterior lobe / FBbt:00004841) ein. Ein Fortsatz setzt den Abschlussbogen als Konsole fort. Ob Borsten vorhanden sind, ist in „A Standardized Nomenclature and Atlas of The Male Terminalia of Drosophila melanogaster /doi: 10.20944/preprints201906.0071.v1“ nicht dokumentiert – in der Skizze sind 3 Bosten eingezeichnet.
Der konsolartige Lappen (Epandrial posterior lobe) kragt als Struktur=5 und als konvexer Bogen=64, paarig=64_46, seitlich=9 aus. Am unteren Ende ist die konkave Form als Gegenform=46 zu suchen: Epi.Y!Fliege.Z.3882#“11“51“64“83634“46“1“9“. Aufgrund der Zählgrößenserie #11 wird die Geometrie über die Borsten gesteuert. Die 1 obere Borste „11“ wird paarig „11_11“ bzw. „2“ adressiert: Epi.Y!Fliege.Z.3891#“11“4957652“11“0640. Die Ziffer „2“ ist von links nach rechts der „11“ gewechselt und muss als Struktur-5_2=doppelt gezählt werden, so dass unten 2 Borsten und insgesamt 3 Borsten am Lappen paarig „11_11“ und QS 5+4=9=seitlich sitzen: Epi.Y!Fliege.Z.3892#“11“4928“11“5“2“01054. Die Folgezeile enthält die konkave Gegenform=46 für die Unterkante der Konsole. Im weiteren Zeilenlauf ist der paarige innere Lappen des Tergit IX „Surstylus (FBbt:00004843)“ zu entwickeln, der bereits von der Konsole teilweise als 89_8_“5=Struktur“_9 überdeckt wird. Alternativ wird direkt mit dem unteren seitlichen Lappen des Epandriums als Abschluss fortgesetzt: Epi.Y!Fliege.Z.3893#“11“4898593“46“5836. Der untere seitliche Lappen (Epandrial ventral lobe / FBbt:00004842) umschließt den Surstylus. Die 22 Borsten (Epandrial ventral lobe bristle / FBbt:00048397) sind als „22_11=Borste, paarig=11_11 adressiert: Epi.Y!Fliege.Z.3893#“11“4692365“2211“54. Der Lappen ist wie ein abnehmender Mond, paarig gekrümmt, so dass die Unterseite einen breiten Tiefpunkt „3003“ bildet, der einen männlichen Bezug in der Zeilen-Nr. Z.39“33“ enthält und auch paarig ist: Epi.Y!Fliege.Z.38“33“#“1137“3003“4162853.
Der paarige Surstylus (FBbt:00004843) zieht sich unterhalb der Cerci vom Subepandrial-Sklerit nach unten (ventral). Der paarige Surstylus ist hakenförmig und umhüllt die männlichen Genitalien. Am Surstylus sitzen in einem gebogenen Band arrangiert 25 dornenartige Borsten (Surstylar teeth (FBbt:00004470) und am Ende 1 (manchmal mehrere) lange Surstylar-Borste (Surstylar long bristle / FBbt:00004471). Für die Drosophila melanogaster liegt momentan keine Abbildung vor. Für den verdeckten Surstylus liegen nur 3 Zeilen vor, um die Borsten zu adressieren. Gemäß einer Beschreibung der „Drosophila quinarensis“ ist der Surstylus ellipsenförmig, so dass sich die 25 Borsten in 3 Gruppen, paarig 37_73 am Rand als Summe 10 + 6 + 9= 25 Borsten verteilen. Die obere und untere unsortierte Borsten-Gruppe besitzt einen ähnlichen Borstentyp: Borste=11_QS 3+7=10 Anzahl_0_Borste=11_06=Anzahl: Epi.Y!Fliege.Z.3934#“11“37“0“11“2464“73“06“. Die 3. Gruppe liegt am inneren Rand zahnartig wie ein Gebiss „222“, paarig=82_28, mit „9“ Zähnen als 11_222_9: Epi.Y!Fliege.Z.3892#“11“367“2229“825286. Zuletzt ist noch eine Formausrundung=64, ein männlicher Bezug=33 und mit „11“ noch eine restliche Borstengestaltung, paarig=43_34 vorhanden. Weiterhin kann der vertikale Muskel 55_9_5 zu den Genitalien adressiert werden. Eine Alternative mit der Zahl „25“ kann in Z.3951/Z.3952 gesucht werden. Weiterhin ist eine Verteilung 11 + 6 + 8 =25 mit Form=7_8_7 mit Borsten als Form=7_1=Borste_7 sowie als stabile Zahn-Struktur=55 zugleich Muskel=55 und paarig= 11_11 möglich: Epi.Y!Fliege.Z.3958#“11“30“11“6“7“8“7“1“71“55“. Die flächig verteilte Borstenanzahl ist indirekt als „2(0)5“ mit den Borsten „1“ als männlicher Bezug=3_1_33_2=paarig vorhanden: Epi.Y!Fliege.Z.3959#“11“298“3“1“33“2“05986. Die einzelne lange Surstylar-Borste „11_111“, paarig=2, wird adressiert. Der untere runde Rand ist als Gegenform=46 incl. als QS=46 enthalten: Epi.Y!Fliege.Z.3960#“11295“46“02111742. Die männlichen Genitalien können nunmehr in diese umhüllende Struktur einmünden.
26.) Hoden (Testis / Testiculus) von Drosophila
Beim Menschen führt der Zeilenlauf vom männlichen Hoden über einen fiktiven hormonellen Umschaltpunkt „BiXn-Point“ zu den weiblichen Eierstöcken [In Bayern wird unter „Bixn“ mundartlich eine Frau verstanden]. Diese Entwicklung der Geschlechtsorgane entsteht zusätzlich zu den beiden parallelen Basis-Episoden in einer gesonderten Episode aus den Nieren über die Harnleiter zur Harnblase. Die Drosophila entwickelt insgesamt nur 1 Episode. Das Problem wird dadurch gelöst, dass die Geschlechtsentwicklung an den Zeilenlauf angehängt wird. Die Einordnung der Geschlechtsorgane in die reale Körperlichkeit muss speziell organisiert werden. Die weiblichen Geschlechtsorgane müssen eingepresst oder der Körper gedehnt werden. Der männliche Zeilenlauf liegt noch weiter außerhalb, wird aber bei der Anpassung des Weibchens mit nach vorn gezogen. Das Männchen steht mit seinen Geschlechtsorganen als Zeilenlauf vor dem realen After. Nunmehr muss dieser Zeilenlauf ideell um 180° eingeschwenkt werden, damit die Hoden vorn (anterior) liegen. Weil der Winkel von 180° selbst die schlaue Drosophila überfordert, müssen erwartungsgemäß 2 Zeilen mit dem Winkel=90° vorliegen. Dieses hat eine gewisse Ähnlichkeit mit der Beschreibung des Aedeagus (siehe: Aedeagus – Wikipedia): „Bei den Fliegen sind gewöhnlich durch Drehungen oder Einrollungen des Hinterleibsendes während der Entwicklung die Lagebeziehungen wesentlich komplizierter... Bereits bei den Mücken findet man häufig, dass im Bereich der Genitalien die Tergite durch eine „180°-Drehung“ auf die Bauchseite zu liegen kommen, die Bauchplatten aber auf dem Rücken zu finden sind. Auch „Drehungen um 90° und Vertauschungen“ von caudal und cranial sind nicht selten.“ Die Funktionen am BiXn-Point können nicht am häufig vorhandenen Zeilenwechsel Z.xx63/xx64 erfolgen, sondern als Bereich von Z.5“63“0 bis Z.5“64“0. Zuvor erfolgt die Eiablage „505“ in Z.5626. In der Zeilen-Nr. zieht sich Physik=63 für die Bewegung beim Formationsprozess mit durch. Erster Schwenk im Winkel=„90“: Epi.Y!Fliege.Z.5631#794353088“90“5168. Zweiter Schwenk im Winkel=„90“: Epi.Y!Fliege.Z.5637#7935075826“90“261. BiXn-Point „3366“ mit der Zeilennummer als doppelte Zählgröße Z.QS5+6=11_QS3+8=11 als Kopulation mit Bewegung als Physik=63: Epi.Y!Fliege.Z.“5638“#79“3366“8399476“77“. Am BiXn-Point wird der Kopulationsapparat von Weibchen und Männchen bei der gleichen Fliegenart nach dem Schloss-Schlüssel-Prinzip ausgeformt.
Bevor die U-förmige Spitze des Aedeagus (Penis) „1111“ beginnt, zeigt sich bereits ein paariger Fortsatz, der sich als Rundung wie die Rückenlehne eines Sportwagens seitlich vorwölbt, um die Fliehkräfte bei einer Kurvenfahrt aufzunehmen. Diese „Ohren“ sind paarig 22_22 und als Zusammenhang mit der Ziffer „1“ und der Form „7“ enthalten. Welche Form fragt sich Drosophila und liest in „6“_1_“4“_7 einen Bixnom-Kreis=64 zur Rundung. Wegen 3 x Ziffer „1“ und 22=hart und parallel, wird die Oberfläche mit plattenartigen Zahnreihen und dreieckigen, teils stumpfen Spitzen bestückt: Epi.Y!Fliege.Z.5658#793“22“61471“22“717. An der Körperunterseite entwickelt sich nach dem Aedeagus (Flybas/ FBbt:00004852) das Hypandrium (Flybas/ FBbt:00004847) als IX. Hinterleibssternit (Sternit=Bauchplatte). Das männliche Kopulationsorgan entsteht im Bereich des Aedeagus (Penis / Phallus) „seitlich=9_4_1111=Spermien_4_9=seitlich“ als Gruppe „44“. Mit „oben=9_2_9=oben“ legt sich die Spitze des Aedagus somit wie ein Hufeisen um die Mündung. Die Zählgrößen „1111“ werden mit der Ziffer „3“ als eine Vielzahl spitzer dreieckiger Zähne als Extra=8 ausgebildet [siehe: https://figshare.com/articles/figure/ Scanning-electron-micrographs-of-the-terminalia-of-D-prosaltans-PSR-strain-A_fig4_264635441)]: Epi.Y!Fliege.Z.5641#79294“49111194“8“3“. Der Aedeagus ist der Hauptteil des männlichen Begattungsgliedes, durch den der Spitzkanal (Ductus ejaculatorius) mit einer Geschlechtsöffnung an der Spitze hindurch geleitet wird. Auch bei den Fliegen ist ein bei der Erektion ausstülpbarer Präputialsack vorhanden (momentan keine Abbildung bekannt). Weil der Ductus ejaculatorius als „505“ nicht zufällig genau am Ende vorliegt, muss diese Öffnung als männlich=303 akzeptiert werden. Zunächst wird Physik=63 als Bewegung für eine Erektion benötigt, und zwar in 2 Gruppen-Zuständen für „klein und schlaff sowie groß und erregt“. Dazwischen wird die Mündung „303“ gezeigt. In der Serie Z.x64x als Fortpflanzung „Biologie= 64“ ist die „63“ adressiert. In der Bewegungsgruppe „44“ „nach vorn“ ist erwartungsgemäß ein Weibchen „66“ vorhanden, das mit der Bewegungsphysik gekoppelt ist als „663“. Die Gegenbewegung ist als Zahl 8_36_8 gespiegelt. Das Weibchen ist ein Extra=8. Epi.Y!Fliege.Z.5641#792“663“87“44“68“36“8. In der Normalphase ist eine Trennung über 2 Zeilen vorhanden. Der Penis wird zurückgezogen. Die Spiegelung „63_36“ hat sich hierfür in „36_63“ gewendet. Weil die Hautmembran „33“ enthalten ist, kann auch der ausgestülpte Präputialsack in die Normallage kommen: Epi.Y!Fliege.Z.5647#7921023983752“44“ und Epi.Y!Fliege.Z.5648#79196215“36“1“63“25. Die äußere Öffnung des Aedeagus wird als „Pallotrema“ bezeichnet. Wahrscheinlich ist damit die Öffnung „303“ des Ductus ejaculatorius gemeint, denn die vordere Mulde im „Autositz“ des Aedeagus wird als „Apical grove (Bereich an der Spitze)“ bezeichnet. Die Bewegung der Mündung ist durch die geänderte Ziffernfolge 7_9_QS2+3=5 vs. 9_5_7 adressiert, um Ende=9 in das Blickfeld zu schieben: Epi.Y!Fliege.Z.5645#79238“303“6957485.
Ejaculatory bulb (EB): Im Spritzkanal (Ejaculatory duct) formt sich ein blasenartiger Ejakulationsbulbus (Ejaculatory bulb) aus. Siehe: . The Biological bulletin. Biology; Zoology; Biology; Marine Biology. REPRODUCTION IN DROSOPHILA. 211 the sac by means of powerful muscle fibers (m} which form a cone, the axis being determined by the rod. The enlarged portion (c) connecting the vas deferens with the ejaculatory duct borders the rod-shaped sclerite forming a crescent and therefore is not pierced by it, as inspection of Fig. 2 might lead one to suppose. As the sclerite is a projection from the plate mentioned above, the latter forms a considerable part of the wall of the cavity contained in this enlarged portion, which collects Stock Photo - Alamy
Die Funktion einer Muskelhülle für eine Ejakulationspumpe liegt als Serie in der Zeilen-Nr. „Z.5=Muskel_6=flexibel_7=Form“ an und in der Zeile läuft eine Drüsenserie „#Form=7_Drüse=88“ mit, um dem Ejakulat diverse Drüsensekrete „88“ als EXTRA=8 hinzuzufügen. Entsprechend verlässt der Spitzkanal den Bulbus in Z.5662 als Wirkstoffschlauch „808“. Von den Hoden ankommend ist der Ejaculatory duct in Z. 5691 als Muskelschlauch „505“adressiert. Die Unterseite ist in der Seitenansicht als ein konkave Mulde mit der Gegenform=46 als „Drüsenform=7_8_7_0_8_“46“_8“ adressiert (siehe: Repression precedes independent evolutionary gains of a highly specific gene expression pattern - ScienceDirect ; J. Pu u.a. /2021/ https://doi.org/10.1016/j.celrep.2021.109896 ). Für die Draufsicht wird der Kreis=64_paarig=2_seitlich=9 für den Anfang des EB als 2 Halbkreise für die beiden nierenartig geformten Hälften verwendet. Der Zweck „264“ enthält einerseits den Kreis=64 und andererseits die Belohnung „Ethanol=Alkohol“ C2H5OH =6+6+1+1+1+1+1+8+1=26. Somit passt der Alkohol=26 zum Blut=26 des Menschen und zur Hämolymphe=26 der Insekten. Darauf gestützt kommen Neurotransmitter zum Einsatz, um die Paarung als Belohnung zu wiederholen. Dies wird realisiert indem mit „126“ im EB-Drüsenepithel das Protein „Ejaculatory bulb-specific protein 3“ mit „126“ aa (Aminosäuren) hergestellt wird [siehe: EbpIII - Ejaculatory bulb-specific protein 3 - Drosophila melanogaster (Fruit fly) | UniProtKB | UniProt]. Weiterhin wird mit der Zahl „Z.x“68“y“ , die Muskelstränge „5“ in der Zeilennummer mitzieht, die Innenverbindung Schwerkraft=84_68_12=12 Spannzeile am Pylon und Spannseile paarig=2 nach oben=9 gespannt. Die Muskel-Spannseile führen zu 1 Sklerit-Pylon ähnlich einem Brücken-Pylon: Epi.Y!Fliege.Z.5“68“3#7870“84“68“12“64“2“97. Innenseitig ist eine Bulbus-Höhle als Lumen „500_39_500“ ausgeformt. Die Dopplung „2“ resultiert daraus, dass sich der Bulbus aus 2 nierenartigen Segmenten als Gruppe „44“ zusammensetzt: Epi.Y!Fliege.Z.568“0“#787“500“39“500“44“0“2“. Die äußere Form=7 ist ebenfalls paarig mit 78_77777_78“. Die Linie 77777 entlang der „Niere“ schließt beidseitig mit einem Zipfel „78“ ab. Mit „QS 7+8=15_15“, zerlegt als 1_5, sind „Spannseile“ entlang der Linie adressiert. Epi.Y!Fliege.Z.5678#“78“7777“78“15“47200. Der Pylon „1111“ steht mit der Bixnom-Gravitation=84 senkrecht. Die Ziffer 2 ist insoweit am unpaarigen Pylon paarig, weil das Spannseil 5_1 als „521“ beidseitig abgespannt sein muss: Epi.Y!Fliege.Z.5678#7886“1111“4884“521“. Für die Pumpfunktion ist der Pylon mit einer Wandmembran „333“ verbunden: Epi.Y!Fliege.Z.5674#788“333“141280402. Der Pylon „1111“ ist lediglich spitz, weil er das harte Sklerit „22“ als QS 1+1=“2_2“=1+1 nur versteckt zeigt. Um diesen Mangel zu beheben, zieht sich der Sklerit ergänzend zur Wandmembran als Deckel innenwandseitig entlang, bis im Zeilenlauf davor und dahinter die „22“ verfügbar ist. Gleichzeitig muss beidseitig der Muskel 55 aktiviert werden. Wandsklerit „22_5_1=Pylon_5“: Epi.Y!Fliege. Z.5675#788194“22“7951542. Muskel „55“ mit Pumpfunktion Physik=63: Epi.Y!Fliege.Z.5676#7880“55“3“63“570297. Muskel „55“ der Spannseile „5_1“ als Zählgröße „55_11“: Epi.Y!Fliege.Z.5669#78902844304“5511“. Wandsklerit „22_1=Pylon“: Epi.Y!Fliege.Z.5674#8930690729“221“90. Das Drüsenepithel „8888_QS 9+2=11_8“ ist mit der enthaltenen Zählgröße=11 in der Produktion vielfältig: Epi.Y!Fliege.Z.5670#7“8888928“4589948. Auf dem Weg zum Aedeagus wird das „Ejaculatory bulb-specific protein 3“= „126“ aa als Drüsenwirkstoff „88_9=Exit_8“ transportiert und als Ejakulat über die Zeilen-Nr. Z.5_“6“_5_“3“ mit dem Muskel „55“ und Physik=63 kombiniert: Epi.Y!Fliege.Z.5653#79“126“1674“08898“.
Der Entwicklung vom Spitzkanal (Ejaculatory duct) bis zu den Hoden ist skizziert in „ TUDIES ON THE EXPRESSION OF THE TRANSFORMER GENE OF DROSOPHILA MELANOGASTERI E. H. BROWN AND R. C. KING Northwestern University, Evanston, Illinois Received August 15, 1960“; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1210186/pdf/143.pdf. Der unpaarige Spritzkanal „505“ (Ejaculatory duct) nimmt vor seiner Verzweigung auf den paarigen Samenleiter „202=männlich“ (Vas deferens) die paarigen Drüsen „Accessory gland“ auf. Der Samenleiter ist mit der Samenblase (Seminal vesicle) am Hoden (Testis) verbunden.
Ejaculatory duct (505), Teil 1: Epi.Y!Fliege.Z.5691#785978254019“505“ und Epi.Y!Fliege.Z.5691#76842“505“4737159 und Epi.Y!Fliege.Z.5691#763050536271751.
Einmündung der Drüsen „Accessory gland“: Eine Drüsenstruktur Z.xx5“8“_#55_5“8“ wird als Drüsenmündung entwickelt. Die paarige Drüse mit dem Drüsenmerkmal „8_8“ am unpaarigen „Ejaculatory duct“ ist schlauchartig 75_0_75_55 geformt, paarig=75_57, Physik=63 als Flüssigkeitsdruck: Epi.Y!Fliege.Z.59“58“#“750755“6“63“58“2“57“9. Zwei Mündungsöffnungen „5050“: Epi.Y!Fliege.Z.5960#7“5050“3732151846. Die Pumpenfunktion Physik=63 bezieht sich nicht direkt auf Spermien, sondern auf die Hämolymphe „26“, die in eine Spermienstrecke eingebunden ist als „5_Loch=0_1_“26“_1_5_1“: Z.59“63“#750“126151“874057. Drüsenvolumen „50000“. Aufgrund der erheblichen Ausmaße des Drüsenpaares ist der Raum als paarig über den Bixnom-Kreis=64 in der Zeilen-Nr. Z.59“64“ und der Gegenform=46 adressiert: Epi.Y!Fliege.Z.59“64“#75000037619“46“69.
Ejaculatory duct (505), Teil 2: Am Endstück „505“ ist der Querschnitt mit dem Kreis=64 stark vergrößert, um die beiden Samenleiter aufzunehmen. Die Ziffer „2“ ist nicht paarig, sondern an die Flüssigkeiten als Hämolymphe=26 gebunden. In der Zeilen-Nr. Z.5_96_5 wird die Zahl „96“ umklammert, um über eine Strecke in Mündungsbereich der beiden Samenleiter (Vas deferens) über mehrere Zeilen zu ziehen. Wird 96-26 (Hämolymphe) =70 gerechnet, ergibt sich die Schlauchform 7_0: Epi.Y!Fliege.Z.5965#749874“6426“86“505“. Der Samenleiter „202“ ist bei 2 Hoden paarig=2 vorhanden und männlich=2 als „2_202“. Spermien „1“ in „2_1_2=männlich: Epi.Y!Fliege.Z.5969#74937“212“994“2202“. Der Samenleiter „202“ endet an der Samenblase (Seminal vesicle) des Hodens. Die Samenblase wird als Gruppe 44 mit den Spermien „1“ als „4_“1“_00_4_0_64=Blase“ über mehrere Zeilen mit der Blasen-Null in der Zeilen-Nr. gezogen: Epi.Y!Fliege.Z.6“0“59#7382“41004064“202“. Die Samenblasen endet als Struktur 55_9=Ende und der Zeit=24 für die Spermienbildung: Epi.Y!Fliege.Z.6“0“94#73“400102455“283“9“. Die Testis-Spirale schließt sich als Struktur-55 an: Epi.Y!Fliege.Z.6095#7“33“880597805579. Die Spirale beginnt mit der Gruppen-Durchlaufzahl=76 der Spirale und der Gegenform=4_0_6 als Schlauchkrümmung. Männlich=33 bzw. paarig=73_37 für beide Hoden.
Das Dilemma: Die Samenblase liegt ohne einen weiteren Zeilenlauf direkt an der Zyste mit 64 Spermatozyten. Diese müssen sich noch zu 64 synzytialen Spermatiden strecken und sich während der Individualisierung in einzelne Zellen trennen. Die Spermatiden benötigen insofern keinen Raum, weil sie falsch herum mit dem Kopf an der Testis-Spitze und mit dem Schwanz bis zur Samenblase reichen. Dazu wandern die Spermienköpfe entlang der Spermienschwänze zur apikalen Spitze, um dabei das überschüssige Zellmaterial (Cytoplasma und Organellen) in einer zystische Ausbuchtung (Cystic bulge) abzulegen. Die Gruppenbildung für die Testis-Spirale liegt im Zeilenlauf bereits am Beginn des „Ejaculatory duct“ vor, so dass der Zeilenbereich für die Spermatiden als Überlagerung nutzbar ist. Weil der „Ejaculatory duct“ unpaarig ist, kann ein einzelnes Spermium (wie beim Weibchen das Ei) dargestellt werden.
Der Kopf beginnt als flexibel=6_55=Stuktur_6 mit Physik=63 für die Beweglichkeit als „7_63_5_7“. Die Zeilen-Nr. als QS 5+8+5+8 =26=Hämolymphe adressiert die Einbettung in eine Flüssigkeit: Epi.Y!Fliege.Z.5858#“76357“156770“6556“. Männlich= 33_63=Bewegung: Epi.Y!Fliege.Z.5860#76“33“109“63“075“939“. Der Kern „505“ wird als klassische Struktur gebildet und ist doppeldeutig zum adressierten Ejaculatory duct „63_505_36. Spermium „1“ als Form „7_1_7“. Zugleich ist damit die Funktion Nerv=7 als Addition mit der Zeilen-Nr. xx62 als Aktion=1+62=63=Bewegung aktiviert. Die Abgabe der Spermien wird über das Nervensystem gesteuert: Epi.Y!Fliege.Z.58“62“#7“63“0“505“362“717“51. Abschließend versteckt sich noch der vom Weibchen produzierte Botenstoff Heptacosadien C27H52. Die Zahl „27“ ist vorhanden und die Zahl 5 errechnet sich aus „0“_QS 3+2=5_“0“. Die rechte 0(Null) bildet zusammen „50“. Die Zahl „2“ für „50+2=52“ steht als Überschuss „2“27 bereit, um den Duft „0“ zu erschnüffeln. Ohne Fliegen-Weibchen klappt es nicht mit den Spermien. Epi.Y!Fliege.Z.5868#76“2270320“999489.
Die Spermatiden bilden an der Spitze nach dem Spermienkern (Sperm nuclei) einen dreieckigen Atkin-Kegel (Actin cone) aus (siehe: „Myosin VI regulates actin structure specialization through conserved cargo-binding domain sites - PubMed (nih.gov)“; M. Isaji u.a. / Aug. 2011 / DOI: 10.1371/journal.pone.0022755). Atkin ist ein Strukturprotein, das entweder als globuläres Einzelmolekül (G-Aktin) oder aneinerandergereiht als Filament (F-Aktin) entsteht. Das F-Atkin ist zählbar, weil es aus „13“ Untereinheiten besteht (Aktin – Wikipedia). An der Kegelbasis sitzt eine Schicht aus dem Motorprotein Myosin VI. Die bei der ATP-Hydrolyse gewonnene Energie wird genutzt, um eine Fracht entlang von Aktinspuren zu bewegen. Im Gegensatz zu den meisten Myosinen erfolgt die Bewegung in Richtung des Minus-Endes der Aktinfilamente. Die Kegelspitze „55“ beginnt als Gruppe „40_4_44_55_40“: Epi.Y!Fliege.Z.5869#76214044021“55“40. Dreiecksgrundlinie „55_55“ der Atkin-Kegelbasis als „55_7_55_7_11=Zählgröße“: Epi.Y!Fliege.Z.5869#75955208“7557“3“11“. Das Myosin VI zeigt sich als Schicht „55_31313“ infolge der Polarität zum F-Atkin mit seinen „13“ Untereinheiten: Epi.Y!Fliege.Z.5890#75942“31313“4550.
Die „zystische Ausbuchtung“ als Volumen-Form=77_seitlich=900 beginnt als weitere Struktur-55 mit der Physik=63=Bewegung. Die Zahl 13 von den 13 Untergruppen des F-Aktin=13 zieht sich versteckt in „1“_6_“3“ mit durch, beschreibt aber hier den Zusammenbau ein A-Mikrotubuli aus 13 Protofilamenten: Epi.Y!Fliege.Z.5895#758“77900“6“55“2“163“. In jedem Spermatid zieht sich das Filament mit der Ziffer „13“ weiter hindurch. Es wird aber speziell als Axonem (Achsenfaden) bezeichnet (siehe: Axonem – Wikipedia). Es besteht aus Mikrotubuli, die im Inneren von eukaryotischen Zilien verlaufen. Ein Axonem besitzt „9“periphere Doppelmikrotubuli (A/B) mit inneren und äußeren Dyein-Armen und 2 einzelne, zentrale Mikrotubuli in der Mitte als "9x2+2"-Struktur.(siehe: Eukaryotic flagellum - Dynein - Wikipedia). Die Ziffer „9“ zieht sich in der Zeilennummer Z.x_9_0=Mikrotubuli_y durch. Es werden 2 x 9=18 Zeilen durchgezählt, wobei auch die Zahl „18“ am Ende enthalten ist. In dieser Zeile lässt sich auch die Länge des Spermiums exakt ablesen: Epi.Y!Fliege.Z.5912#75659713“18“716“18“. In den ersten 5 Zeilen der 18 Zeilen sitzt die Ziffer „9“ erst an 3. Stelle (Z.xy“9“z), so dass 2 Struktur-55-Zeilen jeweils 1 zentrales Mikrotubuli „55“ zusätzlich zum äußeren Ringdoppelelement „9“ enthalten: Z.5895 (wie vor) und Epi.Y!Fliege.Z.5898#7583930“55“887589. Die 9 Doppel-Mikrotubuli sind als Ring durch 9 Protein-Verbindungen „Nexin (Nexus=Verbindung)“ gekoppelt. Die beiden zentralen Mikrotubuli sind gleichartige A-tubule und extra mit einer Doppelverbindung gekoppelt. Eine Kopplungsdoppelzahl 55_77 bzw. 55_88 ist bereits jeweils enthalten. In „9“ weiteren Zeilen ist daher mindestens 1 Doppelzahl adressiert: 66/44/33/77/33+22/77/55/44+99/99. Die „9“ peripheren A-tulules senden jeweils eine radiale Speiche (Radial spokes) nach innen. Dieses wird durch den Bixnom-Kreis=64 und der Zahl „74“ als „QS 7+4=11= Zählgröße_7_0_4“ bewirkt. Gezählt werden dabei die 9 „0(Null)“-Zeilen von Zeilen-Nr. Z.59“0“1 bis zum Ring „909“ in Z.59“0“9. Die 9 Radialspeichen sind mit einer amorphen inneren Hülle (Amorphousinner sheath) verbunden, die die beiden zentralen Mikrotubuli umgrenzt. Weil auch eine äußere Membran vorhanden ist, kann die innere Membran „33“ mit „2_23_31_23“, paarig=2 sein und über die Radialspeichen als Spiegelung „31“ eine Verbindung zu den A-tubules aus jeweils „13“ Protofilamenten aufbauen. QS 7+2=9=B-tubules_9=A-tubules_7=Form:: Epi.Y!Fliege.Z.5904#7576“2233123“7297“. Äußere Membran (Plasma membran) 3003_99=seitlich: Epi.Y!Fliege.Z.59“11“#7567251“3003“2“99“0. Die Dynein-Arme sind erforderlich, um den konischen Spalt zwischen den Mikrotubuli zu verschließen. Der äußere und der innere Arm müssen sich daher in der Deckbreite im Verhältnis 3 / 2 unterscheiden. In der Summe sind es „5“ Arm-Kugeln pro Spalt, die jeweils mit einem Faden am A-tubules hängen. Jede Zeile-Nr. beginnt mit der Ziffer Z.“5“xxx.als Verbindung zu den 9 A-Tubules. Die jeweils „5“ kleinen Dynein-Arme pro Spalt sind durch Zählung aller „9“ Markierungen der Zahl „5“ zu finden. Für 7 Ereignisse ist dafür die Serie #7“5“7 von Z.5902 bis Z.5908 zählbar. Zeile Z.5898 enthält die Markierung „7“5“8_7“5“8“ und Zeile Z.5910 die Markierung „1“5“1“. Der Zählvorgang „11“ wird mit der Zeilen Nr. Z.59“11“ der äußeren Membran ausgelöst. Darin zeigen sich mit „99“ nunmehr die 9+9=18 A/B-Tubules in Verbindung mit „3“ äußeren Dynein-Armen und „2“ inneren Dynein-Armen als „3_2_99“. Das Axonem ist vollmathematisch.
Die Spirale kann im Zeilenlauf zeitlich nicht in die Vergangenheit rotieren. Deshalb muss für die 3 Windungen jeweils eine Spiralgruppe 44 gebildet werden, um die Spirale zeitlich als Vorwärtsbewegung in der Linie des Zeilenlaufs abzurollen. Die 3 Windungsgruppen „44“ der Testis-Spirale werden adressiert, nachdem der Bixnom-Kreis=64 in der Zeilennummer der Kopulationsgruppe als Serie in den Zeilencode #Form=7_64xxxx... gewandert ist. In der ersten Zeile des Bereiches wird die Spirale bereits durch 3 Kreise „64_6464“ avisiert. Der Bereich von Epi.Y!Fliege.Z.5848#764877264641758 bis Epi.Y!Fliege.Z.5854#7“64“09“33111“76“11“9 ist erkennbar als Spirale gewickelt, weil außer den 3 Kreisen=64 die Zahl „Form=7_6=flexibel“ vom linken Zahlenrand mit den Spermien „1“ als Markierung zum rechten Zahlenrand als „111“76“11=Zählgröße_9=Ende“ durchgelaufen ist. Erste Windungsgruppe Epi.Y!Fliege.Z.5849#7“64“74“64“94037“44“3, zweite Windungsgruppe Epi.Y!Fliege.Z.5851#76“44“85086929585 und dritte Windungsgruppe Epi.Y!Fliege.Z.5852#7“64“35“44“50380212.
Die Entwicklung des Samenleiters wird dargestellt, aber zugleich wird die Spermatogenese zur Bildung männlicher Keimzelle, vergleichbar mit der Oogenese beim Weibchen, in einem plötzlich mikroskopisch extrem vergrößerten Maßstab entwickelt. Die Spirale ist über den Zeilenlauf hinweg abgewickelt. Im Ergebnis erscheint 1 Spermium mit dem Kopf in einer Zeile und dem Schwanz (Flagellum) über viele Zeilen hinweg. Die „Drosophila bifurca“ hat eine merkwürdige Interpretation entwickelt, denn das Spermium ist mit 5,8cm 22-fach länger als ihr Körper. Bei der „Drosophila melanogaster“ ist das Spermium 1,8 mm lang: 1,8 mm= 1800µm=1800000nm ergibt 10^6 als Maßstab für die übliche Zählweise in Nanometern. Dabei muss nunmehr noch die Kommastelle in 1,8 statt „18“ gelesen werden. In „1318“ und „1618“ ist erkennbar, dass die Ziffer „1“ als Zählgröße=1 funktionell zur Markierung von 3 bzw. 6 gebunden ist, wodurch die Zahl „8“ zur Nachkommastelle wird. Die Zahl 36 ist gespiegelt Physik=63 eine Spermienpumpe. Die „Drosophila bifurca“ ignoriert die Ziffer „1“ und liest im Zwischenraum der beiden Markierungen die Zahl „7“ als 10^7, um ein Spermium mit langem Schwanz zu präsentieren. Die Zahl „5“ dient dominant als Markierung in „5_6_5“ und als Nachkommastelle dient übereinstimmend die Zahl „8“ in Länge= 5,8cm = 58mm = 58*10^6nm=5,8*10^7nm]: Epi.Y!Fliege.Z.5912#756597“1318“7“1618“.
Die Zellteilung (Spermatogense) entwickelt sich von 1 Zeile bis 248163264. Die 1. bis 3. mitotische Teilung ist einfach erkennbar. Die 4. Teilung auf 16 Zellen bleibt zunächst verbogen. Für die 5. und 6. Teilung werden direkt in den Zeilenlauf die einzelnen Zellen in der Matrix adressiert. Erkennbar ist, dass die 64 Zeilen die 8 Reihen der 64er Matrix blockweise enthalten. Weil sich die Matrix reihenweise wie aus eingerasteten Reihen von Perlenketten flächig zusammensetzt, ergibt sich bei der 32-Matrix eine spezielle Kettenlänge: 1. Kette mit 7 Zellen, 2. Kette mit 8 Zellen, 3. Kette mit 9 Zellen und 4. Kette mit 8 Zellen= Summe 7+8+9+8=32 Zellen. Für 64 Zellen wird diese Matrix mit der Besonderheit gespiegelt, dass nach 32 Zeilen eine Zeile in den Zeilenlauf eingeschoben werden muss, damit die gespiegelte 32er Matrix in das Kugelmuster einrasten kann. Matrixmuster siehe: „Investigating Spermatogenesis in Drosophila melanogaster - PMC (nih.gov); R.Demaco u.a./Mai 2014/ doi: 10.1016/j.ymeth.2014.04.020“. Bildlich gesehen, liegt die Unterkante der 32er Matrix auf einer geneigten Rampe, so dass die gespiegelte 32er Matrix nur ansetzen kann, wenn diese Matrix 1 Zell-Kugel tiefer ansetzt, um wieder als Rampe zu steigen. Die eingeschobene Zeile muss somit einen Kugeldurchmesser = 1 Code-Zeile als Fallhöhe mit der Bixnom-Gravition=84 beschreiben und gleichzeitig die Sinnhaftigkeit der versteckten 16er Matrix erklären. Nach 64 Zeilen zuzüglich der Freifall-Zeile folgt dann eine Ergebnis-Zeile, die „32_32“ für insgesamt 64 Spermatozyten im 64er-Ringsystem der Spirale vermeldet. Auch diese Zeile muss eine Freifall-Zeile darstellen, um die Teilungsaktivitäten einzuschläfern. Die Gravitation der 1. Freifall-Zeile kann bei vorhandener 64 als Addition 10+10= 84 gefunden werden. Jede 10 entsteht durch die 16er Vorgängermatrix, die in 2 Zuständen aufgebaut wird. In der Zeilennummer Z.6“10“4 versteckt sich nunmehr die „64“ und die Zahl „10“. Weil die 32er Matrix doppelt vorliegt, ist ebenfalls „64+10+10=84=Gravitation=freier Fall“ zu finden. Werden die 8 Reihen der 64er Matrix zur Quersumme QS 7+3+2+7+9+8+5+3+2+7+0+3+9+6+5=76 addiert, wird ebenfalls eine Freifall-Zeile „84“ begründet - beim Gleichgewichtssystem wird vergleichsweise 10+10=20=Calcium verwendet. Hat eventuell Neon=10 irgendeine Bedeutung? Es wird lediglich ein Helium/Neon-Laser mit einer Anregungswellenlänge von „633“ nm für die Fluoreszenzaufnahmen am Laser-Scanning-Mikroskop verwendet, um die Farbstoffe anzuregen [siehe: „Analyse des metotischen Cohesinkomplexes in Drosophila melanogaster-Weibchen“; 2015/ DoktorarbeitE.Urban.pdf (uni-bayreuth.de).]. Die Wellenlänge 633nm wird nur beim Eisprung markiert als 1_633_1_88_1_88. Die Quersumme beträgt QS=76: Epi.Y!Fliege.Z.4961#90“16331“875“88188“. Mit der Quersummenzahl „76“ (Durchlauf in der Spirale) und der Zahl „10=Neon“ wird die Wellenlänge 633nm in einer sehr speziellen Art 7_“6_33“_10 bei der Spermatogenese markiert. Statt „Neon“ ist Wasser H2O=1+1+8=10 immer vorhanden: Epi.Y!Fliege.Z.5860#“763310“9"63“075“939“.
Die 16er Matrix bleibt aufgrund der Testis-Spirale verborgen. Damit eine 32er Matrix und nochmals eine gespiegelte Matrix entstehen kann, muss die 16er Matrix dort in der Spirale bereits zuvor durchgelaufen sein, d.h. als zweifache Matrizes am Innenrand der Spirale liegen. Die fertigen Spermien wickeln sich außenseitig durch die Spirale. Auch real kann die 16er Matrix nach der 4. mitotischen Teilung mit unvollständiger Zytokinese nicht ohne eine 2. Phase als „Pro-Phase“ abgeschlossen werden. Die 16 primären Spermatozyten bleiben zunächst über Zytoplasmabrücken verbunden. Aus den mitotischen Teilungen gehen 64 haploide Spermatiden hervor und durchlaufen den Prozess der Spermiogenese [siehe: „In der Spermatogenese von Drosophila melanogaster wird das Chromatin-assoziierte Protein Mst77F in seiner Translation, in seiner Kernlokalisation und in seiner Chromatin-kompaktierenden Funktion über distinkte Bereiche kontrolliert“; S. Kaiser/2014/ Philipps-Universität Marburg / http://archiv.ub.uni-marburg.de/diss/z2014/0377/pdf/dsk.pdf ].
Matrix-Struktur zur Bildung von 16, 32 und 64 Spermatozyten: „Erste vierreihige 32er Matrix“: 1. Reihe über 7 Zeilen=Zellen von Z.6169 bis Z.6163: [Beide Zeilen mit 5_7 am Rand]; 2. Reihe über 8 Zeilen=Zellen von Z.6162 bis Z.6155: [Beide Zeilen „35“ als QS3+5=8 am Rand] 3. Reihe über 9 Zeilen=Zellen von Z.6154 [rechts “26“ als QS2+6=8 zuzüglich markiert 7_1_7=9] bis Z.6146 [ markiert „9“ als 7_9_7]; 4. Reihe über 8 Zeilen=Zellen von Z.6145 [7 Zeilen links alle #72“8“. In Z.6145 fehlt die „8“ noch. Die Umschalter ist „909“ mit QS 9+0+9=18. Die Ziffer 1 wird als fiktive Kommastelle „11_101“ weggestrichen, so dass Ziffer 8 bleibt: Epi.Y!Fliege.Z.5860#727“909“234“11“3“101“ ] bis Z.6137 [#72“8“_2“8“_55=Struktur]. „Erste Freifall-Zeile eingeschoben“: Mit QS7+2+8+8+5+8+1+1+3+6+7+5+2+4+9=76 gehört die Zeile zur Spirale. Als Vorläufer ist die 16er Matrix über 4 Zeilen in 2 Phasen bereits durchgelaufen 76+4+4=84=Gravitation: Epi.Y!Fliege.Z.6137#728858“11“3675249. „Zweite vierreihige 32er Matrix (gespiegelt): 1. Reihe über 8 Zeilen=Zellen von Z.6136 [Ziffer „80“ rechter Rand als 8 / wegen 89_89 soll die Reihe bis zur Spiegelung „98“ gelten] bis Z.6129 [Markierung 9_80_9 ebenfalls als Ziffer 8]. 2. Reihe über 9 Zeilen=Zellen von Z.6128 [Doppelziffer 99 und rechts QS 0+2+1+6=9 als Ziffer 9] bis Z.6120 [rechts Ziffer 9]. 3. Reihe über 8 Zeilen=Zellen von Z.6119 [Ziffer 8 fehlt rechts in Epi.Y!Fliege.Z.6119#7310021“64“3“44“66“5“. Die Merkmale der Spirale, Kreis=64 und Gruppe=44, markieren die Ziffer „3“, die nunmehr zur Ziffer „5“ am rechten Rand als QS 3+5 =8 addiert wird.] bis Z.6112 [Ebenfalls Ziffer 5am rechten Rand. Ziffer 3 markiert als 2_3_2 und mit 3_9=seitlich_3 zur Addition 5+3=8 als Rechenaufgabe über die Zählgröße 11 in der Zeilen-Nr. Epi.Y!Fliege.Z.6“11“2#7318“393“7“232“084“5“. 4. Reihe über 7 Zeilen=Zellen von Z.6111 [Ziffer 7 fehlt rechts, steht aber am linken Rand / mit der rechten Zählgröße 1_9=seitlich_1 wird die Zahl 7 von rechts nach verschoben, indem die Ziffer 1 incl. der Zeilennummer 7fach gefunden wird in Epi.Y!Fliege.Z.6“111“#„7“3195913003“191“0.] bis Z.6105[Ziffer „7“ fehlt, steht aber am linken Rand. Mit Gravitation=84 und Spiralen-Durchlauf=76 wird die Ziffer „2“ rechts markiert. Wegen 267_276 wird die Zahl „7“ vom linken zum rechten Rand verschoben in Epi.Y!Fliege.Z.6105#„7“3“267“85001“84“2“76“]. „Ergebniszeile und zweite Freifall-Zeile als Zusatzinformation“: Mit Form=7_32_7__32_7=Form sind 64 Spermatozyten erzeugt worden. Aufgrund QS 7+3+2+7+9+8+5+3+2+7+0+3+9+6+5=76 gehört die Zeile zur Matrix der Spirale. Wegen der 1. Freifallzeile wird analog vom Durchlauf der 2-phasigen 16er Matrix nur die gespiegelte 32er Matrix angerechnet, so dass sich 4 +4 +76=84=Gravitation= freier Fall ergibt.
Bildung der 2-phasigen 16er Matrix: Die installierte Matrix-Struktur wird mit unterschiedlichen Merkmalen 2-fach durchfahren. Zu diesem Zweck wird die Ziffer „16“ =16 Spermatozyten direkt in den Matrix-Zeilen adressiert: Fall 1: “16_xx_yy“= 16 + Merkmal „paarig mit unterschiedlicher Doppelziffer“. Fall 2: “16_xy_xy oder 16_xy_yx“= 16 + Merkmal „paarig ohne Doppelziffern“. Jeder der beiden Fälle ist 4-fach im Wechsel Fall 1/Fall 2 verteilt über die Spiralstrecke der 64 Zeilen vorhanden. Das ergibt 2x 4 Zeilen=8 Zellen in einer Reihe und paarig =2 zu 16 Zellen. Paarig bezieht sich auf die beiden Reihen – was im zweiten Hoden zeitgleich passiert, wird als Thema ausgeblendet. Nach Abschluss der 4 Mitosen („M.it.osen“) 1-> 2,4,8,16 entsteht eine Zyste mit 16 „primären“ Spermatozyten. Die Zyste wächst und es entsteht eine Zyste mit 16 „späten“ Spermatozyten. Die 16 primären Spermatozyten bleiben über Zystoplasmabrücken verbunden, weil sie Zeilen-Nr. Z.61xx stets QS 6+1=7=Form durchläuft und die Ziffer „1“ eine Verbindung mitzieht. Bei der Drosophila schließen sich dann 2 Meiosen („M.ei.ose“) als 32er Zyste und als 64er Zyste an. Der Wachstumsfaktor von „25“ wird als Form 7_“25“_7 markiert in Z.61“63“=Physik: Epi.Y!Fliege.Z.61“63“#7“25“783261986857. Die Dauer die „meiotische“ Pro-Phase für die Bildungen der 32er und 64er Zyste von 3,5 Tagen erklärt sich als 24+24+24+12=84 Tage. Die Zahl „84“ wird für die Schwerkraft=84 zur Funktion der beiden gespiegelten 32er Matrizes verwendet.
Die gewachsene 16er Zyste bildet eine Form von 4 Zellen als Quadrat im Zentrum, das von 12 Ringzellen umgeben wird (Skizze siehe: S. Kaiser /2014/ http://archiv.ub.uni-marburg.de/diss/z2014/0377/pdf/dsk.pdf). Die späte 16er Zyste liegt im Entwicklungsschema der 64erZyste bereits vor. Für die 4 Kernzellen müssen 4 Zeilen mit der Zahl 12 sowie einen Ring „0“ vorhanden sein, die zusätzlich die Zahl 4 für insgesamt 16 Spermatozyten enthalten müssen: 1. Kern-Spermatozyt: 12_0, Zahl 4 fehlt, Ersatz als Zahl „16“ in der Zeilennummer, sowie indirekt durch Zerlegung der Zahl 12 als Spiegelung 61(16) _QS 2+0+2=4, weiterhin markiert 6_QS1+3=4_6 mit der Markierung 6+6=12: Epi.Y!Fliege.Z.6“16“0#72“6136“72786“12“02.
2. Kern-Spermatozyt: 4_00_12 weiterhin markiert 7_6_7_QS 2+4+0+0=6 mit 6+6=12 und 4 innen, wobei 2 Stufen mit 7_2_7 markiert: Epi.Y!Fliege.Z.6147#727672“4“001342“12“
3. Kern-Spermatozyt: 12_1 6_4, Ring=64 kombiniert mit 16 statt O: Epi.Y!Fliege.Z.6118#731121648189768. 4. Kern-Spermatozyt: „12_4“, Ring QS 0+1+0+3+0 =4: Epi.Y!Fliege.Z.6117#73“124“117110103.
Die 8er Zyte enthält 8 Spermatozyten in zwei 4er-Reihen. Die Matrix wird als 8er Zählgröße 1_8_1 mit der Zeilen-Nr. Z.181 adressiert und in 7 weiteren Zeilen bis Z.6188 durchgezogen. Das Ordnungssystem der 2 Reihen wird durch 2 Struktur-55-Zeilen bewirkt: In der 1. Reihe werden 4 Spermatozyten mit der Zählgröße 11 über 3+1=4 gezählt als „11_“3“_9_“1“_9=seitlich_“4“: Epi.Y!Fliege.Z.6182#723“55“26“11“3“919“45. In der 2. Reihe werden die Anzahl von 4 Spermatozyten als „3_4_3“ markiert und als Gesamtheit in 2 Reihen mit insgesamt 8 Spermatozyten als 88_4_88 adressiert: Epi.Y!Fliege.Z.6183#72“343“55“88“4“88“598. Die Spermatozyten sind über Zellbrücken (Fusome) miteinander verbunden. In der Zeilen-Nr. Z.6“1“xx sind die Fusome bereits als Ziffer „1“ angelegt und müssen nunmehr durch eine Spiegelung „16“ verbunden werden: Epi.Y!Fliege.Z.“61“81#723669672“16“0654; und Epi.Y!Fliege.Z.“61“85#72320“16“56204528. In der 3. Brücke ist die Ziffer „16“ als „1616“ doppelt vorhanden, um die 4. Brücke intern mit der Spiegelung „61“ ohne die Zeilennummer statt quer in Längsrichtung zu realisieren: Epi.Y!Fliege.Z.“61“83#722967875“1616“30 und Epi.Y!Fliege.Z.“61“82#723552“61“1391945.
Die 4er Zyte wird über 4 Zeilen mit der Zählgröße 1_1 in der Zeilen-Nr. Z.6“1“9“1“ gestartet. Die Zahl von 4 ist darin nicht enthalten, weil es sich um 2 Paare handelt, die zu 4 Spermatozyten verbunden sind. Für die Paarbildung liegt eine Serie #7“22“xx mit „22“ als Matrix 2x2=4 vor. Direkte Zellverbindungen sind als Spiegelungen 62-26, 38-83 und 83-38 vorhanden: Epi.Y!Fliege.Z.6“1“9“1“#7“22“50076“62“13052. In der quadratischen Matrix verteilen sich die 4 Spermatozyten nicht gleichartig, sondern es müssen sich 2 Paare bilden als 72_27 und 27-72: Epi.Y!Fliege.Z.6192#“72“2“38“40“83“27“2772“ sowie Epi.Y!Fliege.Z.6193#7“22“26“74“38“014695 und Epi.Y!Fliege.Z.6194#7“22“150“83“0420569.
Die 2er Zyte nutzt die letzte Zeile der Serie #722 aus, um eine Struktur-Kopplung als Fusom „1_55“ mit der Folgezeile als Spiegelung „227“ am rechten Zahlenrand und der Brücke „151“ zu bewirken: Epi.Y!Fliege.Z.6195#“722“0342604721“55“ und Epi.Y!Fliege.Z.6196#721917728“151“227“.
Die Tochterzellen der Stammzellen werden aus dem Keimvermehrungszentrum, der sogenannten Nische, nach deren Teilung verdrängt. Ohne weitere Signalisierung können sich die Tochterzellen differenzieren. Der Gonialblast (GB) teilt sich bei der Spermatogenese und die Zystenzelle (Cyst cell) unterstützt diesen Prozess ohne eigene Teilungen. Das Keimvermehrungszentrum [germinal proliferation center hub /FBbt:00007141 (Fly Anatomy)] liegt im äußersten (apikal) Winkel des schlauchförmigen Hodens als sogenannte „Nische“. Die Hub-Zellen (Nabenzellen) [hub cell / FlyBase:FBrf0064778 ] sind an der Basallamina „333“ befestigt und sind andererseits an 2 Typen von Keimzellen, männliche Keimbahnstammzellen und somatische Stammzellen, gebunden. Für eine Kuppe gilt der Kreis=64. Die Zahl „76“ gehört zur Gruppenbildung der abgewickelten Hoden-Spirale. Mit QS7+0+2+7+4+9+7+6+3+3+3+4+6+3=64=Kreis wird die runde Kuppe am blinden Schlauchende bestätigt. Die Zahlen „2“ und „4“, paarig=34_43 sind eine spezielle Schwierigkeit, weil die Stammzellen erst von Hub-Zellen (Nabenzelle) produziert werden müssen. Doppeldeutig zum Kreis=64 bilden sich mit QS 6+4=10 Hub-Zellen, von denen 2 als 7_0“2“_7 zwingend notwendig sind, um 4 Keimbahnstammzellen [Germline stem cell (GSCs)] zu binden [siehe: „Headcase Promotes Cell Survival and Niche Maintenance in the Drosophila Testis | PLOS ONE“; M.Boyle u.a ./ Jul 2013/ doi: https://doi.org/10.1371/journal.pone.0068026.g007]: Epi.Y!Fliege.Z.6365#702749“76“333“4“64“3. Der Begriff „Nabenzelle (Nabe=Drehscheibe)“ stammt aus der Übersetzung engl. „Hub“, so dass „Hub cells“ gebildet werden. Das Schlauchende enthält Stammzellen, so dass die Umgebung eine Stammzellnische bildet. Die Bezeichnung „Nische“ gilt daher nicht speziell nur für die Hodenspitze. Entsprechend ist auch der Begriff „Nischenzellen“ zu finden.
Das blinde Ende des Hodens endet mit einer Kuppel (64). Wie eine „Weintraube“ hängt darunter ein Cluster von Hub-Zellen, die eine Gegenform (46) ausbildet. Je nach Quelle sind es 9-11 oder 10-15 Hubzellen. Weil die Anzahl der Hubzellen mit der Anzahl von Keimbahnstammzellen [Germline stem cell (GSCs)] korrespondiert, sind 6 - 9 angeschlossene GSCs eine weitere Quellen-Ungenauigkeit. Angenommen wird ein traubenförmiges Cluster mit 10 Hub-Zellen. Die Basallamina ist bereits mit der ersten „46“-Hub-Zählung verbunden, so dass sich die Zellen über weitere 9 Zeilen mit der Gegenform=46 weitläufig bis Z.6287 entwickeln. Traubenform „46_8_46“, paarig=2. Mit der weiteren Markierung „6_84=Gravitation_6“ hängt eine kegelförmige „Traube“: Epi.Y!Fliege.Z.6287#711“46846“5663274. Die Zeile enthält weiterhin die Zählgröße „11“, die auch in 4 vor- und 4 nachgelagerten Zeilen traubenförmig vorliegt. Weil auch in Z. 6282 die Zählgröße vorhanden ist, sind es 10 Zeilen: Die Zahl „10“ ist mit der Zählgröße „11“ als „110_55“ kombiniert. Erkennbar sind eine Formgruppe „474“ und QS 7+1+2=10 enthalten: Epi.Y!Fliege. Z.6282#71203474110“55“40. Die 10 Hubzellen können damit nochmals erscheinen, um die Bindung an die Stammzellen zu avisieren. Außerdem sind von 10 Hubzellen nur 2 zwingend notwendig. Schließt eine Fliegenart nur 6 Keimbahnstammzeilen (GSCs) am HUB an, werden von den 10 Hub-Zellen nur die Besonderheiten „111“ und 5 Dopplungen 22/22/55/66/77/55 gezählt. Davon enthalten zwei Zeilen die überlebenswichtige Verbindung als Struktur-55. Die anschließbaren 4 Keimzellen GSC sind entweder als 55_“4“_0 oder als Zählung in „113_55_31“ als QS 3+1=4 avisiert in Z.6282 und Epi.Y!Fliege. Z.6288#7113“55“318642653.
Die Kommunikation zwischen beiden Zelltypen erfolgt über Oberflächenproteine. Um dort hineinzuhören, wird eine Referenzzeile benötigt, die durch die Stammzellnische als Volumenform „7000_5“, paarig=71_17, vorhanden ist: Epi.Y!Fliege.Z.6272#7131“700005“77966. Zeitdifferenz (Kettenreaktion): DELTA.TIME. Z.6272 - Z.6282#113“525“947“242“6: Wunschgemäß sollen nur die notwendigen Zellen im ausgehungerten Zustand weiterhin mitspielen dürfen. Hierfür sind 2 Hub-Zellen [5_“2“_5=Struktur] ausreichend, die 4 Keimbahnstammzellen (GSCs) [2_“4“_2] binden. Über ein Zeitregime=24 stehen somit 10 – 2= 8 Hub-Zellen wie in der Zeilen-Nr. 6_2“8“2 zur Disposition (Apoptose). In der Zeilen-Nr. 6268 (2 markiert, 8 rechts übrig) ergibt sich eine Kombination von Zählgröße und Bewegung „11_8_63=Physik_8, paarig=36_63. Die Bewegung erfolgt beim nachfolgenden besonderen Zeilenwechsel [Z.xx63/xx64:]: Epi.Y!Fliege.Z.6268#71362511“8638“322. Vor der Zellteilungsphase wird die Zeit als QS 7+1+5+6+8+0+3+5+8+9+8+0+0+0+0=60 unpaarig adressiert. Die Zahl „25“ in der Zeilen-Nr.Z.6“25“0 und QS 8+9+8=25 ist als Wachstumsfaktor der Spermatozyten in der Wachstumsphase bekannt: Epi.Y!Fliege.Z.6“25“0#71568035“898“0000. Mit 9=oben wird die blinde apikale Schlauchspitze als 909 adressiert. Somit bildet „50004002“ die sogenannte Nische. Statt 10 Hub-Zellen sind nur 2 und statt 10 Keimbahnstammzellen (GSCs) sind nur 4 adressiert. Doppeldeutig mit 9_0_9=seitlich haben auch die somatischen Zystenstammzellen (CySCs) Kontakt zu den Hub-Zellen und umfassen gleichzeitig aufgrund ihrer Größe die GSCs. Zu 1 Keimbahnstammzellen (GSCs) gehören 2 somatische Zystenstammzellen [cyst stem cells (CySCs)]. Eine Prinzip-Skizze für die Mindestzellenanzahl enthält „8“ CySCs im Ring und 2 äußere Zellen, um eine Mindestfläche zu besetzen. Diese 10 Zellen müssten aus QS 9+0+9=1(0)8 und mit Verschiebungen zu 8 bis 10 entwickelt werden: Epi.Y!Fliege.Z.6248#715“909“45000“4“00“2“.
Im nächsten Schritt wird die assymmetrische Teilung beider Stammzelltypen, GSCs und CySCs, organisiert. Davon verbleibt jeweils 1 Stammzelle zur Selbsterneuerung als Tochterzelle [keine „Sohnzelle“ als Stammhalter] in der Stammzellnische und die andere Tochterzelle wird in den Schlauch verdrängt und differenziert sich. Aus 1 GSC entstehen 1 neue Keimbahnstammzelle GSC (Tochterzelle) und der verdrängte „Gonialblast“ (Tochterzelle). Aus 1 CySC entstehen 1 neue somatische Zystenstammzelle CySC (Tochterzelle) und 1 Zystenzelle CC (cyst cell/ Tochterzelle). Wenn 1 Gonialblast GB aus der Nische verdrängt wird, entsteht das Spermatogonium, das 2 Zystenzellen CC als Hülle mitnimmt.
Für die Zellteilung wird 1 Stammzelle identifiziert und als Zelle „O“ mit der klassischen Golden-Ratio-Struktur „505“ als 0_505 kombiniert. Daraus lässt sich später eine „Zellgeburt“ "1“ als „500“1“005“ symbolisieren. Vorzugsweise ist das aber nicht die selbsterneuernde Tochterzelle (GSC), sondern 1 „Gonialblast“, um die Spermatogenese zu starten. Die Stammzelle wird paarig (beide Hoden)=24_24 markiert als Zeit=24_0505_24=Zeit. Zweckmäßig werden mit 2_5=Struktur_2 zugleich beide Stammzelltypen (GSC / CySC) adressiert. Die Durchlaufgröße „76“ zur Gruppenbildung der abgewickelten Spirale müsste so gelesen werden, dass die Tochter „1“ wegen der Umklammerung 7“1“6 nicht in die Spirale gelangen kann, sondern wegen der Zeilen-Nr. Z.6247 mit der Spiegelung „6_7“ und der Zeit=24 nur 1 Gonialblast GB „505“ mit seinen beiden Zystenzellen CC 2_5_2: Z.6“24“7#7“1“60“24“0_505“24“252.
Der Gonialblast GB „5_001=GB_00_CC=5_1_5=CC“ ist als Spermatogonium mit 2 begleitenden Zystenzellen CC vollendet und mit Physik=63 zur Differenzierung in Bewegung. Mit der Zeilen-Nr.QS 6+2=“8“_1_“8“ ergeben die 4 mitotischen Teilungen 2, 4, 8 und 16 Spermatozyten. Die beiden Meiosen 32 + 64 sind als Spiegelung der QS 7+1+9+3+6+3+5+0+0+1+0+0+5+1+5=46 ablesbar: Epi.Y!Fliege.Zeilen-Nr. Z.6218#7193“63“500“1“00“515“.
Bixnom_Fliege_dat07.062022 / Ende20.09.2022
Regenbogen (Rainbow):
Die "Relative Ruhe" muss mit dem Thema der Rechtwinkligkeit in eine Beziehung gesetzt werden. Als Bezugsachse dienen fallende Regentropfen (H2O=1+1+8=10), die der Bixnom-Gravitation=84 folgen und durch das Sonnenlicht im Rücken des Betrachters beleuchtet werden. Von der innenwändigen Rückwand des Tropfens wird das in Spektralfarben zerlegte Licht ins Auge des Betrachters gesendet. Je tiefer der Sonnenstand, desto breiter ist die Spannbreite des Regenbogens: Kurz vor Sonnenuntergang bildet sich der Durchmesser im Winkel von 84° [siehe: Regenbogen (meteoros.de)]. Der Lichtstrahl wird beim Luft-Wasser-Übergang gebrochen, dann reflektiert und beim Ausstritt erneut gebrochen. Der Winkel zwischen Lichteinfall und Lichtaustritt beträgt dabei „42°“, wenn das mittlere gelbe Licht mit seinem Brechungsindex n=1,333 als Berechnungsgrundlage dient. Diese Berechnung bezieht sich aber nicht direkt auf das Naturschauspiel - der Regenbogen entsteht abweichend nicht als Blick zur Sonne, sondern entgegengesetzt zum Gegenpol der Sonne. Von der Basislinie des Betrachters zum Mittelpunkt eines ringförmigen Regenbogens im Winkel zu den austretenden Lichtstahlen wird der Sehwinkel = 84° / 2 = 42° eingeschlossen. Ohne Luftbildpanorama ist kein Ring, sondern nur ein Bogen über dem Erdhorizont sichtbar. Info Regenbogen siehe: „https://www.spektrum.de/lexikon/geographie/regenbogen/6501“. Die Sonne muss zur Sicht eines Regenbogens wie im Winter oder morgens und abends eher flach über dem Horizont stehen. Tatsächlich sind die Regentropfen in der Größe unterschiedlich und auch nicht immer kreisrund. Wünschenswert wäre es, wenn die Winkelbeziehungen im Molekül selbst zu finden sind, so dass Winkel induziert werden, die bereits molekular angelegt sind. Aus Ausgangsbasis zur Winkelsuche wird für den Regentropfen [H20 =1+1+8=10] eine 10er Kugelkette betrachtet. Für den Hauptregenbogen unter 42° wird im Prinzip der Radius=0,5 zur Länge=10 als Winkel Arctan ins Verhältnis gesetzt und vom 45°-Winkel der Bixnom-Gravitationsachse subtrahiert – bei Annahme R=1 ist Länge L zu verdoppeln. Für den Nebenregenbogen unter 51° mit doppelter Reflexion wird im Prinzip der Durchmesser=1,0 zur Länge=10 als Winkel Arctan ins Verhältnis gesetzt und zum 45°-Winkel der Gravitationsachse addiert. Das Ergebnis wäre erst dann mit 50,99 und 41,99 ausreichend genau, wenn der Radius bzw. der Durchmesser um den Faktor 1,05 erhöht wird. Wo liegt der Fehler? Für die 10 Kugel-Mittenabstände werden 11 Kugeln benötigt. Es wird folglich für die Kopplung der Moleküle ein Kompromiss zur Bildung einer mittleren Wirkungsbreite von 10,5 für die wirksame Kettenlänge benötigt. Hierzu muss die wirksame Gesamtlänge um 1 Radius gekürzt werden, so dass mit 9,5 statt mit 10 Kugel-Mittenabständen zu rechnen ist. Daraus folgen die Winkel 41,9872125° und 51,009006°. Die Biologie kann die Zahl „84“ als Gravitation deuten. Beim Menschen kommt die Zahl „84“ für das Gleichgewichtssystem in Betracht, in dem der Bixnom-Kreis = 64 für die Bogengänge mit Calcium=20 als Addition kombiniert wird. Die Bixnom-Gravitationslinse bildet einen informativen Hintergrund. Die Zahl „20“ lässt sich auf die 4 Bixnom-Gravitationslinsen eines Kreises verteilen, so dass auf jede Linse „5“ Elemente als Basiszahl „5“ für den Goldenen Schnitt entfallen. Und siehe da - eine Kette aus „5“ Lichtkugeln liegt direkt vor den beiden „Wurmlöchern“ der Linse. Das sichtbare Licht reicht von 380 bis 780 nm. Ein reduzierter Bereich von 410 nm (violett) bis 650 (rot) für die Regenbogenfarben (siehe: Regenbogen – Wikipedia) ergibt eine interessante Differenz von 650 – 410 = 240 nm als „24_0“ wie „24 Stunden_0 = ringsum = täglich. Mit dem Sonnenlicht wird der biologische 24-Stunden-Zyklus der inneren Uhr justiert. Im Regenbogen liegt der obere rote Ring bei einen Sichtwinkel von geschätzt ca. 42,5° und das violette Licht bei ca. 41°. Darunter liegen verwaschene, kaum sichtbare Farbringe aus Überlagerungen von Lichtstrahlen. Der Nebenregenbogen unter dem Sichtwinkel von „51°“ folgt dem biologischen Begriff der „Paarigkeit“. Ein Teil der Lichtstrahlen wird nochmals reflektiert und oberhalb des Hauptregenbogens mit gespiegelter Farbreihenfolge, aber blasser im Farbton sichtbar. Die lotrechte Achse liegt in einem gleichschenkligen Dreieck vor. Die Differenz von Biologie=64 zur Physik=63 ergibt 1 Aktion als Energiezufuhr, die für ein sinnvolles Ergebnis mit der Winkelsumme im Dreieck = 180° benötigt wird: Spitzenwinkel im gleichschenkligen Dreieck= 180 - 2* (64 + ½) =51°.
Regenbogenfarben: Newton benannte nach Seh- und Beschreibungswillen sowie suggestiv nach der Anzahl der Wochentage 7 Spektralfarben: Rot, Orange, Gelb, Grün, Blau, Indigo, Violett. Die Farbe „Indigo“ ist ein tiefer Blauton zwischen Blau und Violett. Im Vergleich zu denen nach der Wellenlängen geordneten Spektralfarben fehlt die 8. Spektralfarbe „Türkis (Cyan)“ als ein heller Blauton (siehe: Spektralfarbe – Wikipedia). Der Regenbogen entsteht im Auge des Betrachters als verschiedenfarbige Projektion der runden Sonnenscheibe. Bis auf schwarz ist zwar alles vorhanden, aber die 8 Spektralfarben erweisen sich hier als eine objektive Abgrenzung. Die „Regenbogenfahne“ als Symbol diverser Hoffnungen auf Frieden, Veränderung und Toleranz verzichtet mit 6 Farben auf die überschüssigen Blautöne Türkis und Indigo. Bei der „Peace-Flagge“ werden die 6 Farben umgekehrt entsprechend einem Nebenregenbogen geschichtet.
Moleküle und Atome erzeugen aus erhöhten Intensitäten in einem Linienspektrum einige diskrete Spektrallinien (Linienspektrum – Wikipedia), dagegen zeigen Sonne, Glühlampe und Metallschmelze ein kontinuierliches Spektrum ohne Linien. Tropfen im unteren Teil der Regenwand erzeugen den Hauptregenbogen, weil die sichtbaren Strahlen oberhalb der Tropfenmitte eintreten und nur einmal nach unten reflektiert werden. Tropfen im oberen Teil der Regenwand erzeugen den Nebenregenbogen, weil die sichtbaren Strahlen unterhalb der Tropfenmitte eintreten und zweifach nach oben reflektiert werden. Von den vielen Lichtstrahlen ist nur 1 Farbe aus dem Tropfen wahrnehmbar. Über die Fallhöhe erzeugen die Regentropfen unterschiedliche Farben, weil beim Phänomen der „Dispersion“. Beispielsweise hat blaues Licht gegenüber Rot eine kürzere Wellenlänge und wird in einem größeren Winkel gebrochen. Aber nach der Reflexion von der Tropfenrückseite tritt das blaue Licht in einem kleineren Winkel gegenüber dem ursprünglichen weißen Licht aus als das rote Licht. Blau liegt daher auf der inneren Hauptregenbogenseite und Rot außen [siehe: 1.) Regenbogen – Wikipedia – Enzyklopädie]; 2.) https://www.leifiphysik.de/optik/farben/ausblick/regenbogen ; 3.) https://www.youtube.com/watch?v=jWSfZnXNw5w 4.) https://en.wikipedia.org/wiki/Rainbow]. Um den Regenbogen künstlerisch darzustellen, werden Rot und Violett als Grenzsichtwinkel betrachtet. Die 8 Bixnom-Spektrallinien bilden 7 Farbzwischenräume, bei denen die Spektralfarbe „Türkis/Cyan“ entfällt – das ergibt die üblichen 7 Regenbogenfarben.
Bixnom-Spektrallinien: Nachfolgend werden die Sichtwinkel der 8 Bixnom-Spektrallinien im Doppel-Regenbogen zu 16 Farb-Fixpunkten ermittelt. Unsichtbar für den Betrachter liegen die Punkte in der Seitenansicht in unterschiedlicher räumlicher Tiefe. Die beiden gelben Farb-Fixpunkte der Bögen bilden als Lotrechte durch den Mittelpunkt der 11. Kugel auf der X-Achse eine Projektionsfläche. Die anderen 14 in diesen Schirm projizierten Farb-Fixpunkte ergeben sich grafisch als Durchstoßpunkte der Strahlen bzw. werden rechnerisch als Dreiecke nach dem Strahlensatz in die Projektionsfläche gezoomt. Die Projektionsfläche erscheint als Vorhang von fallenden Regentropfen. Die Projektionsfläche durchschneitet den Zenit (First) des Regenbogen unter 90° und ist seitlich nur als lotrechte Linie zu sehen. Aufgrund der 16 Farb-Fixpunkte auf der Projektionslinie kann mit einem frontalen Blick der Doppel-Regenbogen direkt ringförmig gezeichnet werden. Die Farb-Fixpunkte werden zunächst nur als Zu- und Abschläge von Winkeln auf die horizontale X-Achse berechnet. Der Sichtwinkel ergibt sich erst als Addition des Winkels von 45°. Diese Schwierigkeit erschwert das Verständnis zur zeichnerischen Darstellung des Regenbogens, ist aber notwendig, um den Mittelpunkt des Regenbogens zu definieren. Der Sichtwinkel unter 42° für den gelben Farb-Fixpunkt des Hauptregenbogens liegt nahe beim Additionswinkel von 45°. Im rechtwinkligen Dreieck sind bei 45° die Katheten von Länge=Abstand Betrachter zum Schirm (Projektionsfläche) und Höhe= Basislinie bis zum Durchstoßpunkt der X-Achse durch den Schirm gleich groß. Der Regenbogen besitzt folglich einen fiktiven Mittelradius von 9,5 Kugeln, was dem Schirmabstand zum Auge des Betrachters entspricht. Zum fiktiven Mittelradius werden nunmehr die auf den Schirm projizierten Höhen der Farb-Fixpunkte addiert, die sich mit Plus- und Minushöhen auf die X-Achse beziehen. Für jede Farbe können nunmehr der Sichtwinkel und der Farbradius für den Doppel-Regenbogen bestimmt werden.
Die Sonnenscheibe bedeckt den Himmel in einer Winkelbreite von ½ Altgrad (0,5°), so dass jede Farbe im Prinzip für die volle Anzeige ebenfalls 0,5° breit sein müsste. Der Platzbedarf von 8 * 0,5° = 4° ist physikalisch beim Hauptregenbogen (Primary Rainbow) nicht realisierbar. Der obere rote Farbenrand leuchtet noch, aber die anderen Farben überlagern sich, weil die Gesamtbreite nur ca. 2,2° beträgt (siehe: Regenbogen – Wikipedia). Für den Nebenregenbogen (Secondary Rainbow) wird in der Literatur meist ein Winkel von 3° genannt. Zweckdienlicher nennt 1 Quelle einen Winkel zwischen Rot und Blau von 3,3°. Damit kann die nachfolgende Ermittlung für die Gesamtbreite von 4° real sein, womit alle 8 Bixnom-Spektralfarben abgebildet werden können. Die Farbe Gelb leuchtet ohne Projektion direkt im Schirm. Der Nebenregenbogen (Secondary rainbow) ist nur zur Sonne ausgerichtet und dürfte deshalb bei einem Winkel von 51° > 42° eigentlich nicht zu sehen sein. Aufgrund der Größe des Bogens ist er aber im Auge des Betrachters auf derselben Himmelsseite wie der Hauptregenbogen (Primary Rainbow) sichtbar. Mit einem Fotoapparat ohne zusammensetzbare Panoramabildserie kann der Nebenregenbogen nicht ohne seitliche Verzerrungen abgelichtet werden.
Der Bixnom-Doppel-Regenbogen bildet sich aus Strahlen vom gemeinsamen Weiß-Ursprung zu den Farb-Fixpunkten in 3 parallelen 13er Kugelketten [siehe Symbol (.‘) und (.“): Unterreihe=Kugel-Nr.‘, Mittelreihe= Kugel Nr. , Oberreihe=Nr.“]. Der „Ostpol“ (x/y=r/0) der 1. Kugel in der Mittelreihe bildet den Betrachter-Nullpunkt (Augenlinse). Zu Farb-Fixpunktwinkeln muss als 2. Schritt jeweils noch gesondert der 45°-Winkel für die Drehung der X-Achse in die Neigung der Bixnom-Gravitationsachse addiert werden. Für den Hauptregenbogen (Primary rainbow) liegen die Farb-Fixpunkte in der Mittelreihe im Südpol der Gelb-Kugel Nr.11, der Orange-Kugel Nr.12 und der Rot-Kugel Nr. 13. Die weiteren 5 Farben liegen im Ostpol der Unterreihe in umgekehrter Reihenfolge, und zwar in der Grün-Kugel Nr. 13‘, in der Türkis-Kugel Nr. 12‘, in der Blau-Kugel Nr.11‘, in der Indigo-Kugel Nr. 10‘ und in der Violett-Kugel Nr. 9‘. Durch die energetische Wirkung der eingeschossenen Reflektion ist die Unterreihe aktiviert worden. Kugel Nr. 8‘ ist eine Hilfskugel für die Höhenabsenkung unter der Nr.13 (Mittelreihe) und ist im Spektrum als Ultraviolett unsichtbar. Die Kugeln Nr.1‘ bis 7‘ (Unterreihe) liegen unterhalb des Strahlenganges. In die 13er Kette der Unterreihe ist eine Lücke von 5 Kugeln gesprengt. Diese überschüssige Kette ist als Nr. 1“, 2“; 3“, 4“ und 5“ als eine abgesenkte Teilkette der Oberreihe eingewandert, um ohne eigene sichtbare Farb-Fixpunkte einen „Stör- bzw. Stützkörper“ als „Alexanders dunkles Band“ [Alexander von Aphrodisias] zu bilden. Der Stützkörper erzwingt zwischen Mittel- und Oberreihe einen Abstand in Höhe des Radius (Halbkugel) und erzeugt unsichtbares Infrarot.
Im Nebenregenbogen können die 8 Farben zwar in voller Sonnenbreite angezeigt werden, sind aber aufgrund der doppelten Reflexion blasser. Die Darstellung der Kugelketten enthält direkt keine doppelte Reflexion, deren Ergebnis ist lediglich im Höhensprung erkennbar – die beiden Reflexionen haben die Kette energetisch hochgeschossen. Der Höhensprung im dunklen Band als abgesenkte Oberreihe resultiert daraus, dass ein Bixnom-Lichtpaket in der Unterreihe nicht mehr als 13 Elemente sendet (Überschuss 5 Kugeln): Interessant ist weiterhin die Zählgröße „11“ für Gelb sowie die bekannte Teilung der Zahl 12 in 7/5 wie bei den „Pyramiden von Sakkara“. Die Farb-Fixpunkte beider Regenbogen liegen trotz unterschiedlicher Kugelnummern stets auf derselben lotrechten Farben-Achse (Bixnom-Spektrallinie). Farben für den Nebenregenbogen im Südpol der Oberreihe: Gelb-Kugel Nr. 6“, Orange-Kugel Nr. 7“ und Rot-Kugel Nr. 8“. Die weiteren 5 Farben liegen in der in umgekehrter Reihenfolge im Nordpol der Oberreihe: Grün-Kugel Nr. 13“, Türkis-Kugel Nr. 12“, Blau-Kugel Nr.11“, Indigo-Kugel Nr. 10“ und Violett-Kugel Nr. 9“. Beispiel für die Projektion in den Schirm: Im Nebenregenbogen (Secondary Rainbow) liegt oben rechts außen die Grün-Kugel Nr.13“. Der Abstand vom Nordpol zur X-Achse beträgt 2 Kugeln. Die X-Koordinate beträgt 16,5 Kugeln. Farb-Punktwinkel „Grün“ über x-Achse=Arctan (2/16,5) = 6,91123°. Zuzüglich 45° ergibt einen Sichtwinkel „Grün“ = 6,91123 + 45 = 51,91123°. Der Abstand vom Betrachter zum Schirm beträgt 9,5 Kugeln. Unter dem Sichtwinkel ergibt der Strahlengang im Schirm einen projizierten Farbpunkt „Grün“ über der X-Achse: Projizierte Höhe über X-Achse (PHY)= (9,5/ LX) * HY=(9,5/ 16,5) * 2 = 1,151515152. Farbradius „Grün“ (Secondary Rainbow)= 9,5 + PHY= 10,32608696 Kugel-Einheiten. Vergleichsweise liegt der Farb-Fixpunkt ‚Grün‘ beim Hauptregenbogen bei X=17 Kugeln und einer Ostpol-Höhe HY= -1 (negativ). Sichtwinkel= 41,63354°. PHY= -0,558823529, Farbradius „Grün“ (Primary Rainbow)= 8,941176471 Kugel-Einheiten. Die Farbreihenfolgen muss dann statt nach dem Schirmabstand zur Reihenfolge im sichtbaren Hauptregenbogen sortiert werden. Winkelspanne zwischen Rot und Violett im Nebenregenbogen = 4,1205°. Winkelspanne zwischen Rot und Violett im Hauptregenbogen = 1,9092° und bis zum Anschluss Ultraviolett =2,27° , d.h. im Mittel ca. 2°.
Farben-Radien in Kugel-Einheiten (D=1 / r=0,5) für 8 Bixnom-Spektrallinien: Die 7 Ring-Zwischenräume als Doppel-Regenbogen mit den Regenbogenfarben als Kunstprojekt gestalten – Farbe Türkis/Cyan entfällt. Nebenregenbogen (Secondary Rainbow) mit blassen Farben darstellen (fade light). Real ist Gelb sehr schmal und ROT streut breit.
R1‘ (Primary RB)_ROT / R1“ (Secondary RB)_ROT= 9,08696 / 10,32609
R2‘ (Primary RB)_ORANGE / R2“ (Secondary RB)_ORANGE= 9,04762 /10,40476
R3‘ (Primary RB)_GELB / R3“ (Secondary RB)_GELB= 9,00000 / 10,50000
R4‘ (Primary RB)_GRÜN / R4“ (Secondary RB)_GRÜN= 8,94118 /10,65152
R5‘ (Primary RB)_TÜRKIS / R5“ (Secondary RB)_TÜRKIS= 8,90625 / 10,72581
R6‘ (Primary RB)_BLAU / R6“ (Secondary RB)_BLAU= 8,86667 / 10,81034
R7‘ (Primary RB)_INDIGO / R7“ (Secondary RB)_INDIGO= 8,82143 / 10,90741
R8‘ (Primary RB)_VIOLETT / R8“ (Secondary RB)_VIOLETT= 8,76923 / 11,02000
Die Kugelketten liegen in der Größenordnung von Nanometern in einem Cluster von Wassermolekülen und enthalten einen potentiellen Nullpunkt, der sich noch bis zum Auge des Betrachters ausbreiten muss. Die Farben-Kugeln Grün bis Violett können um den Ostpol / East pole (Hauptregenbogen) bzw. Nordpol (Nebenregenbogen) in eine andere Reihe gedreht werden, um eine freie Sicht zum Betrachter zu gewinnen. Weiterhin können die Kugeln eine Bixnom-Wirkungshülle um einen Kern erhalten, um die Streuung zu untersuchen. Die Zeichnung könnte auch mit der Entwicklung messbarer Wellenlängen kombiniert werden. Im Ergebnis ist die Funktion der Zählgröße "11" für die Zeitsteuerung (z.B. Gebiss des Menschen) und die Ausbildung der Körpergeometrie (z.B. Wirbel des Skeletts) im Zusammenhang mit der Sonnenenergie erkennbar.
BiXnom-Code im molekularen Regenbogen
Die Drosophila besteht nur aus der Zahl „TIME.EPI.Y!Fliege= 0,000447300224362500000“, die im Bixnom-Nebenregenbogen (Secondary Rainbow) verschlüsselt werden kann. Die ersten 4 Nullen „0,000“ können in „Alexanders dunkles Band“ in die Kugeln 1“, 2“, 3“ und 4“ eingeschrieben werden, so dass ein Platz für einen 4-stelligen Zeilen-Zähler vorhanden ist. Mehr als die Zeilennummer Z.9999 wird für die Fliegen-Anatomie nicht benötigt. Eine 5-stellige Anzeige ist mit 5" möglich, d.h. der Zähler füllt sich mit der Ziffer "1" von links nach rechts. Die Startzeit TIME mit der Zeile "0" kann mit der Zähler-Ziffer "0" nie einen Farbtreffer erzählen. Der Zähler "1" ist selbst ein Farbtreffer, der sich von den Treffern der Zählerzahl "10" unterscheidet, obwohl der Zifferncode scheinbar keinen Unterschied enthält. Ersichtlich ist, dass dann 18 Stellen folgen, wobei hinten 5 Nullen stehen. Diese 18 Kugeln sind genau vorhanden. Insgesamt: 22 Ziffern.
Abweichend wird beim Menschen ergänzend eine zeitbasierte Episode „Epi.Vir“ durch den gesamten Körper durchlaufen, die eine 5-stellige Zeilennummer erfordert. Diese ist mit der vorhandenen Kugel 5“ realisierbar. Mit TIME.EPI.VIR= 0,00000006180537421842640000 wird zunächst 1 Virus erzeugt, dessen Vermehrung durch die Bildung von Antikörpern bekämpft wird. Ab Zeile Z.807 wechselt der mitlaufende Zeitzähler von negativ auf Null mit EPI.VIR.Z.807=0,00000000007658658515294470. Anschließend wird der Körper als Gesundheitscheck durchlaufen. Ohne absehbares Ende wurde dieser Weg bis etwa EPI.VIR.Z.“41423“=0,00000000“000149205451605211“ über die Zeit von 33,8466667 Tagen verfolgt. Eine Darstellung ist unverändert möglich, weil die 4 hinteren Nullen der Drosophila aufgebraucht werden, indem 3 vordere Nullen zuzüglich der zusätzlichen Kugel 5“ für die 5-stellige Zeilennummer entstehen.
Der 10er Bixnom-Kreis zeigt 10 Ziffern an, wobei die Ziffer „0“ im Nordpol und die Ziffer „5“ im Südpol steht (Ost- und Westpol sind mit 2,5 und 7,5 nicht ganzzahlig). Bei der Startzeit steht der Zeilenzähler auf 000“0“[Zeile 1= „0001“]. Jede Zeilennummer ist ein Fernsehsender für eine anatomische Baustelle und der Zifferncode das laufende Programm als wiederholtes Ziffernbild. Der Zifferncode ist bereits die maximale Informationsverdichtung – die bildliche Darstellung ist dann leider lediglich eine farbenfrohe, aber sinnlose Explosion. Wie beim Menschen kann eine Parallelepisode notwendig sein. Die Hauptepisode geht beispielsweise mit der Bildung der Wirbelsäule voran, und die Parallelepisode fügt die Gliedmaßen (Extremitäten) dann hinzu. Der Unterschied der beiden Episoden besteht in der Verwendung von Signal- und Steuerkugel am Bixnom - Corpus Callosum des Goldenen Schnitts [Corpus Callosum=Hirnbalken zwischen den Gehirnhälften]. Analog zum Bixnom-Doppelregenbogen handelt es sich um Reflexionen, die Radius und Durchmesser unterscheiden. Ersichtlich ist, dass der Zeilen-Zähler Farbtreffer erzielen kann, die in die Interpretation des Zifferncodes einbezogen werden können. Nur der Nebenregenbogen (Secondary Rainbow) ist besonders relevant, weil er die 8 Spektralfarben in voller Breite der Sonnenscheibe abbildet.
Drosophila erzielt 10 Farbtreffer im Nebenregenbogen (Secondary Rainbow), 6 Fehlschüsse ohne Treffer im sichtbaren Spektrum und 2 Farbtreffer im Hauptregenbogen (Primary Rainbow). Diese 2 Farbtreffer können die paarige anatomische Ausbildung symbolisieren. Von den 6 Fehlschüssen liegen 3 in „Alexanders dunkles Band“, die als infrarote Wärmestrahlung [nahes Infrarot, mittleres Infrarot und fernes Infrarot] geeignet sind. Die 3 übrigen Fehlschüsse ergeben dann die ultraviolette Strahlung [nahes UV, mittleres UV uns fernes UV]. . Die 4-stellige Zeilen-Nummer erzeugt ergänzend 3 Farbtreffer im Nebenregenbogen (Secondary Rainbow) bzw. sind ab der Zeilennummer Z.1000 zuweilen 4 Farbtreffer möglich.
Um die Funktion der Verschlüsselung zu überprüfen, werden die Basis-Episoden der Evolution TIME.EPI.ADAM und TIME.EPI.EVA dargestellt. Time.EPI.ADAM erzielt 9 sichtbare Farbtreffer im Nebenregenbogen (Secondary Rainbow), 2 sichtbare Farbtreffer im Hauptregenbogen (Primary Rainbow) und 7 Fehlschüsse ins Dunkle, davon 4 in Alexanders dunkles Band. EPI.EVA erzielt wie eine Spiegelung 7 sichtbare Farbtreffer im Nebenregenbogen (Secondary Rainbow), 2 sichtbare Farbtreffer im Hauptregenbogen (Primary Rainbow) und 9 Fehlschüsse ins Dunkle, davon 5 in Alexanders dunkles Band. Jeder Mensch entwickelt beide Episoden. Bei der Interpretation des Bixnom-Codes sind zuweilen Additions- und Subtraktionsaufgaben zu lösen. Die additive und subtraktive Farbmischung sind vergleichbare Phänomene. Bei der additiven Farbmischung werden zu weißem Licht weitere Spektralfarben zugemischt, um unterschiedliche Farbeindrücke zu gewinnen. Die Mischung der Farben "Rot", "Grün" und "Blau" als RGB-Farbraum ergibt bereits eine breite Farbenvielfalt inclusive der Farbe „Weiß“. Bei einer subtraktiven Farbmischung werden aus dem Licht einzelne Spektralfarben herausgefiltert.
Der BiXnom-Code kann in der Konstruktion eines Doppelregenbogens positioniert werden, womit sich aber zugleich sein Informationsgehalt zerstreut. Das Licht fällt in unendlich vielen parallelen Strahlen ein, so dass sich auch die Lichtbogen-Konstruktion stapelt. Ersichtlich ist, dass sich ein Detail wie eine Gruppe-44 in einem Kugelstapel auf einer 45°-Achse lesbar bleibt. Die 45°-Achse sorgt somit für eine dezimale Ziffernfolge. Der 10er Bixnom-Kreis enthält 10 Tortenstücke im Winkel von 36° (10*36=360°). Wird eine Diagonale unter 45° eingezeichnet, sind in der weiteren Konstruktion die ganzzahligen Winkel 0°, 9°, 18°, 27° und 36° messbar. Statt 360° ist somit der Winkel von 45° als dezimale Unterteilung 10-fach durch 9/2=4,5° teilbar. Aus dem Regenbogen kann eine maximale Lesebreite von 18 Ziffern vom rechten Zahlenrand erkannt werden. Es verbleiben links „0,000“, die für die Zeilennummer verwendbar sind, zumal diese den Zifferncode direkt als Ziffernbild unterstützen können. Insgesamt sind es 22 Ziffern. Wird eine Matrix 22 x 22 von parallelen Lichtstrahlen getroffen, sind 22 x 22= „484“ Elemente enthalten. Diese Zahl enthält die Bixnom-Gravitation und deren Spiegelung ähnlich 121, 242, 363, 464. Die Vierteilung der Matrix ergibt 4 Quadrate 11 x 11=121, die das rechtwinklige Koordinatensystem und die Zählgröße 11 enthalten. Die Quadranten können nunmehr jeweils ein Spielfeld bilden. Wird der Anteil des Zifferncodes von 18 Ziffern ebenfalls als Matrix verstanden, entfallen auf die Zeilen-Nr. 2 Ziffern und auf den halbierten Zifferncode 9 Ziffern. Die Matrix 9 x 9 = 81 ist das Spielfeld der frühen ägyptischen Mathematik zur Näherung der Zahl „Pi“ nach dem Papyrus Rhind [siehe: https://de.wikipedia.org/wiki/Papyrus_Rhind]. Die Lesebreite von 18 Ziffern übersteigt die realen Möglichkeiten eines einfachen Computers: Für die Aufgabe „1/3=0,333...“ mit maximal 30 möglichen Nachkommastellen wird „0,333333333333333000000000000000“ als Ergebnis angezeigt, d.h. der Wahrheitsgehalt liegt mit 15 statt 30 Stellen nur bei 50%. Dem hier angegebenen TIME-WERT mit einer Lesebreite von 18 Ziffern zuzüglich Zeilennummer wurden somit bereits 3 Nullen angefügt. Diese entstehen daraus, dass eine Episode über den Zeilenlauf mit dem Zifferncode dezimal nach rechts wandert. Das letzte Ergebnis kann somit als maßgebliche Spalte gelesen werden, um Farbtreffer zu gewinnen. Diese überschüssigen Nullen bleiben bei der Interpretation des Zifferncodes unberücksichtigt. Der Zusammenhang mit dem Papyrus Rhind und das Thema der Zahl „Pi“ wird erst bei hoch mathematisierten Geschöpfen wie Elefant und Drosophila sowie bei zunehmender Zeilenanzahl bewusst: Stehen 63/64 in den Zeilen-Nr. Z.xx63/Z.xx64 am rechten Zahlenrand, sind Denksportaufgaben verpackt. Die Zahlen 63/64 in der Zeilennummer liefern somit die 2 Stellen für die Zeilennummer im Quadranten, so dass das Spiel gestartet werden kann. Die Zahlen 63 und 64 repräsentieren 2 ringförmige Umgrenzungen, um den fiktiven Kreis einzuschließen. Weil es 4 Quadranten sind, ergibt dieses eine Ähnlichkeit mit den 4 Bixnom-Gravitationslinsen, weil sich die Linse jeweils als Überschneidung zweier Kreise bildet.
Regenbogen_dat20.09.2022
Farbtext: Anhang Datenschutz
Der Schwarz-Weiß-Text alternativ farbig!
Bunte Löcher sind als virtuelle Fake-Räume im Business-Center mietbar, wo deine Vorkasse als Spende verbucht wird
Aminosäure (AS / Aminocarbonsäure)
1.) Aufbau der Aminosäuren
Aminosäuren sind chemische Verbindungen, die mindestens 1 Aminogruppe (-NH2) mit Stickstoff (N=7) sowie mindestens 1 Carboxygruppe (-COOH) mit Kohlenstoff (C=6) und Sauerstoff (O=8) enthalten (siehe: Aminosäuren – Wikipedia). Mit dem BiXnom wird das Periodensystem der Elemente erschaffen, so dass auch die Zählung von Elektronen der beiden funktionellen Gruppen nicht ungewöhnlich ist: NH2=7+1+1=9 und COOH=6+8+8+1=23. In Verbindung mit einer Gruppe „44“ müssen sich die Zahlen „9/23“ im BiXnom-Zeilenlauf plausibel zeigen, damit eine Aminosäure erzeugt wird.
Beim Menschen ist in der DNA eine Anzahl von 20 sogenannten kanonischen Aminosäuren codiert, aus denen sich die Proteine zusammensetzen. Auf die Zahl „20“ wurde hier verschiedentlich Bezug genommen. In Enzymen findet sich mit dem Selenocystein die 21. proteinogene Aminosäure als Sonderfall, denn sie ist in der DNA nicht codiert (siehe: Aminosäure - DocCheck Flexikon). Von den 20 kanonischen Aminosäuren sind 8 Aminosäuren essentiell, weil sie nur mit der Nahrung aufgenommen werden können (siehe: Protein – Wikipedia).
2.) Hämoglobin
Proteine (Eiweiß) werden aus Aminosäureketten über Peptidbindungen aufgebaut. Der Unterschied zwischen Proteinen und Peptiden ist nicht scharf abgegrenzt. Eine Peptid-Kette ist vergleichsweise kürzer und besteht maximal aus ca. 100 Aminosäuren. Mittels Spezial-Mikroskopie wird die Anzahl der Elemente einer Verkettung von Aminosäuren strukturbiologisch ausgezählt. Die Existenz von Aminosäureketten kann aufgrund der Anzahl der Elemente im BiXnom-Zeilenlauf erkennbar sein, wenn eine spezielle Funktion wie beispielsweise für ein spezielles Hormon der Drosophila benötigt wird. Um etwas über die Struktur eines Proteins selbst zu erfahren, müsste eine Erklärung für die spezielle Funktion der Aminosäurekette gefunden werden. Beim Blut der Wirbeltiere besteht die Funktion in einer Sauerstoffbindung, die in der Episode „Blut“ erkannt werden muss.
Das Blut entsteht aus einer Zellvariation an der BiXnom-Schwelle. Weil die Episode „Blut“ mit TIME.EPI.BLUT=0,000773416257425852000 bekannt ist, wird darin der eisenhaltige rote Blutfarbstoff „Hämoglobin“ der Wirbeltiere gesucht. Die äußere Form der roten Blutkörperchen (Erythrozyten) wurde hier bereits geometrisch ermittelt. Im BiXnom-Regenbogen ergeben sich im Secondary Rainbow 8 Farbtreffer und im Primarary Rainbow und 2 Farbtreffer. Zufällig ergibt sich die Zahl 8 auch für Sauerstoff=8, der im Hämoglobin transportiert wird. Um eine Häufung bei der Suche zu auszuschließen, kann nur der zweistellige Luftsauerstoff O2=8+8=16 einen Sinn ergeben. Als Spiegelung von O2=16 kann „161“ die Abgabe von Sauerstoff symbolisieren. Zugleich muss das Eisen=26 in einem eisenhaltigen (Fe2+) Tetrapyrrolring gesucht werden, der in einer Tasche des gefalteten Hämoglobins liegt. Der Blutfarbstoff Hämoglobin wird durch die charakteristischen Kettenzahlen „141“ und „146“ beschrieben, die durch die Zählgröße „11“ zum Start einer Kettenbildung aktiviert werden. Das Hämoglobin der Säugetiere ist ein Heterotetramer aus 4 Globinen-Untereinheiten. Beim erwachsenen Menschen sind dies je zwei Hb α und Hb β (α-Kette 141 AS; β-Kette 146 AS; AS=Aminosäure). Gegenüber diesem adulten Hämoglobin weicht das fetale Hämoglobin in der Struktur ab. Die Globine sind typisch gefaltet und bilden eine Tasche, in der ein Eisen-II-Komplex (Häm) gebunden ist [siehe: Hämoglobin – Wikipedia]. Bei der Faltung der Ketten wird eine räumliche Struktur erzeugt, wobei das Energieminium aus den möglichen Varianten gewählt wird. Diese Variante erfüllt dann auch die Notwendigkeit, den Sauerstoff binden und transportieren zu können.
Die Zahlen 141/146 liegen vielfach vor, so dass nach Besonderheiten gesucht wird. Mit der Zeilen-Nr. Z.544 wird die Struktur-5 mit der Gruppe 44 gekoppelt und in der Zeile wird ein Netzwerk 444 avisiert: Epi.Blut.Z.544#142172106144458.
Die Zahl „141“ folgt als Serie über 4 Zeilen:
Epi.Blut.Z.545#141911239894652, enthält Zählgröße 11 mit „9/23 [NH2/COOH]“;
Epi.Blut.Z.546#141651329198874, enthält Wirkstoff 88; Sauerstoff O2=8+8=16
Epi.Blut.Z.547#141392368816426, enthält Wirkstoff 88 / Kreis=64 / Eisen=26 /O2=16
Epi.Blut.Z.548#141134353544864, enthält Zählgröße 11 /Gruppe 44 / Kreis=64.
Ersichtlich ist, dass diese 4 Zeilen mit den Zutaten von O2 und Fe zur Bildung eines Tetramers in Betracht kommen. Für das Heterotetramer muss dann noch eine „146“-Kette zusätzlich verwendet werden.
Die Zahl „146“ bildet eine Serie nur über 3 Zeilen:
Epi.Blut.Z.527#146758303116860, enthält Zählgröße 11;
Epi.Blut.Z.528#146480351785199; enthält Kreis=64
Epi.Blut.Z.529#146203451309235, enthält QS 0+3+4+5+1+3+0=16=O2
Eine 4. Zeile „146“ ist als Struktur-55 vorgelagert:
Epi.Blut.Z.517#1495969“550146“72. Die Struktur wird nachfolgend als symmetrische Gruppe 44 innerhalb einer auffälligen Spiegelung „148_44_841“ [QS=13_44_QS=13] avisiert: Epi.Blut.Z.521#“14844841“7932025. Für eine Faltung zwecks Bildung eines räumlichen Gebildes kann mit dieser „Referenzzeile Z.521“ eine Kettenreaktion gestartet werden, um eine massenhafte Anzahl von BiXnom-Zeilen als mögliche Faltungen zu gewinnen. Liegt das Eisen=26 am linken Zahlenrand vor, wird es in 4 Zeilen mit „146“ kombiniert:
Epi.Blut.Z.2902#266511460174312
Epi.Blut.Z.2909#265870146932228
Epi.Blut.Z.2958#261465942334636
Epi.Blut.Z.2973#260146739800152
Die Kettenreaktion aus der Zeit „TIME.EPI.BLUT.“REFERENZ.Z.521“= 0,00000148448417932025“ bildet sich, wenn diese Startzeit fortlaufend durch n=1 bis n=k geteilt wird. Weil die Faltung zeitlich sofort mit der Bildung der Aminosäureketten ohne Zeitverzug erfolgt, wird das Energieminimum von der Evolution schnell erkannt. Ansonsten wäre die Versuchszeit länger als das Protein überhaupt existiert. In der Wissenschaft werden die möglichen Faltungen von Proteinen per Computer unter Anwendung der künstlichen Intelligenz (KI) berechnet. Mit natürlicher Intelligenz werden für ein räumliches Gebilde die 3 Koordinaten-Achsen (X, Y. Z) hier in der Serie „111“ als Energieminimum ausgewertet. In der Biologie wird nunmehr nicht jede Serienzeile „111“ eine Lösung darstellen, sondern bei einer Kette aus Aminosäuren bildet die Gesamtheit der Serie „111“ die Lösung. Die Serie beginnt in Epi.Referenz.Z.13“26“#11195204972249 und enthält das Eisen=26 in der Zeilennummer. Für das komplexe Molekül werden für das Tetramer insgesamt 4 Zeilen gezählt. Somit folgen: Epi.Referenz.Z.1327#1118“676“84952544 (enthält Gruppe „44“), Epi.Referenz.Z.1328#111783447“23“7“9“7“1“ (enthält Gruppe „44“) und Epi.Referenz.Z.1329#11“16“993“36“29“1“968. Bei der AS-Plausibilitätsprüfung zum Vorliegen einer Aminogruppe und einer Carboxygruppe lassen sich diese nicht getrennt den beiden Gruppen „44“ in Z.1327/Z.1328 zuordnen. Mit Form=7 werden beide Gruppen vielmehr in Zeile Z.1328 direkt als Zusammenhang „7_23_7_9_7“_1“ angezeigt: „Form=7_ COOH“=6+8+8+1=23_Form=7_NH2=7+1+1=9_7=Form. Die Ziffer „1“ am rechten Zahlenrand wird zweckmäßig als „1“ Aktion separat abgetrennt, damit sich QS =1+1+1+7+8+3+4+4+7+2+3+7+9+7 (ohne +1)=64 als Kreisring=64 zählen lässt. Mit dieser Aktion kann dann die folgende Zeile Epi.Referenz.Z.1329#11“16“993“36“29“1“968 in die Gruppe integriert werden, um einen eisenhaltigen „Tetrapyrrolring“ zu integrieren. Pyrrol (C4H5N=4*6+5*1+7=36) enthält ein Stickstoffatom im Ring – die Zahl „36“ ist in Z.1329 enthalten. Das Hämoglobin enthält außer dem Protein „Globin“ und dem eisenhaltigen „Tetrapyrrolring das sauerstoffbindende „Häm“. Hierfür ist in der Zeile O2=16 enthalten. „Häme“ sind Komplexverbindungen, die einen Porphyrinring mit einem eingelagerten, zentralen Eisen-Ion enthalten. Porphyrin besteht aus 4 Pyrrol-Ringen (Tetrapyrrol). Diese Ringe werden durch eine „Methin-Gruppe“ verbunden (siehe: Porphyrin - DocCheck Flexikon). Die Methin-Gruppe (–CH=6+1=7) wurde bereits in Z.1328 erfasst, weil die 4-fach enthaltene Form=7 zugleich Methin=7 adressiert. In der Zeile Z.1328 ist eine Gruppe 44 enthalten und die Zahl „7“ ist markiert als „676“. Das Eisen-Ion ist als „26“ in der Zeilennummer Epi.Referenz.Z.13“26“ selbst enthalten, womit alle 4 Zeilen verwendet werden.
Die Sauerstoffbindung O2=16_99=Ende stoppt die Kettenreaktion in Zeile 1329. Die Folgezeile enthält die Spiegelung „161“ für eine Sauerstoffabgabe „61“: Epi.Referenz.Z.1330#11“161“5351828591. Ohne Sauerstoff kann die Kettenreaktion wieder aktiviert werden. Am Ende wird noch „11111“ erreicht bis dann 111_0 durch die Null als letzte Möglichkeit gestoppt wird: Epi.Referenz.Z.1336#“11111“4085278462 und Epi.Referenz.Z.1336#111“0“30978258807. Als Voraussetzung für diese Serie musste zunächst Sauerstoff O2=16 thematisiert werden. Hierzu ist die Zählgröße 11 mit der Sauerstoffaufnahme und –abgabe als „1161“ kombiniert und in der Zeilennummer ist die Zeit=24 enthalten. Der Sauerstoff ist atomar als „8“00“8“0 enthalten: Epi.Referenz.Z.13“24“#112121161580080.
3.) 1. bis 20. kanonische Aminosäure
Außer der Zuspitzung der Kettenreaktion auf ein Energieminimum „111“ im Zifferncode kann auch die Zählgröße „11“ in der Zeilennummer Epi.Referenz.Z.11xx betrachtet werden. In die Serie Z.111x fällt eine 33er Serie im Zifferncode. Beispielsweise kann im Zusammenhang mit Sauerstoff=16 der Geschlechtsunterschied „33/66“ vermutet werden: Epi.Referenz.Z.1111#133“616“93783“2606“ und Epi.Referenz.Z.1119#13“26616“78223436. Die Hämoglobinkonzentration (Hb-Wert) ist bei Männern mit 13,5-17,5 g/dl etwas höher als bei Frauen mit 12-16g/dl. In der alternativen Interpretation Membran=33 ist die Doppelziffer „33“ als Zellbestandteil universell. Mit dieser Suchgröße kann der Zeilenbereich der Zählgröße „11“ über Epi.Referenz.Z.11xx in der Anzahl von „24“ Zeilen durchgezählt werden. Für nur „20“ kanonische Aminosäuren müssen beispielsweise als freie Erfindung die beiden Null-Paare 330/033 und 3033/3303 entfallen. Real ist allerdings, dass mit der „Null“ jetzt die Oberfläche des roten Blutkörperchens als „Membran=33“ erkennbar ist und besetzt werden kann. Somit beschreiben 2 Zeilen das Antigen „A“ für die Blutgruppe A und das Antigen „B“ für die Blutgruppe B, und zwar ohne das zusätzliche Antigen D als Rhesusfaktor Negativ (Rh-). Die 2 weiteren Zeilen enthalten die beiden Blutgruppen A und B inclusive dem Antigen D als Rhesusfaktor (Rh+) positiv. Menschen die beide Antigene (A und B) besitzen, haben die Blutgruppe AB. Fehlen die Antigene A und/oder B liegt Blutgruppe 0 (Null) vor:
Epi.Referenz.Z.1116#1“330“1“82“95638016 [Antigen A, Rh-negativ]
Epi.Referenz.Z.1118#13278“033“8042957 [Antigen B, Rh-negativ]
Ob diese Feststellung tatsächlich zutreffend ist, kann aufgrund der Anzahl der Elemente in der Aminosäurekette überprüft werden - momentan hier unbekannt.
Bildung einer Rhesusfaktor-Gruppe 44 für das zusätzliche Antigen D, codiert mit dem BiXnom-Kreis als „446_Form=7_644“ und avisiert für die nachfolgenden Zeilen: Epi.Referenz.Z.1138#130“4467644“39390. Somit folgt: Epi.Referenz.Z.1139#1“3033“2236990365 [Antigen B, Rh+positiv]. Mit 9_64_9=Gruppenende ergibt sich nunmehr: Epi.Referenz.Z.1145#12“9649“27“3303“079 [Antigen A, Rh+positiv].
Die Rhesus-Gruppenbildungszeile kann als verschachtelte weitere Referenzzeile TIME.Epi.Rhesus.Referenz.Z.1138#0,00000000130“4467644“393900 für eine Kettenreaktion Zeile n=1 bis n=k genutzt werden, um nach dem Verklumpen von Blut zu suchen, wenn fälschlich bei der Blutspende Rh+ und Rh- vermischt werden. In der Kettenreaktion kann es beispielsweise zum Showdown kommen, wenn die avisierte „64=Biologie“ als Widerspruch mit „63=Physik“ zusammenknallt. Dann wird die „64“ im Oktogon aller Blutbestandteile mit „8_64_8“ als schädliche Form=7 identifiziert: Epi.Ref_Rhesus.Z2054#“63“50“8648“704668“7“. Nunmehr verklumpt das Blut als Form-Klumpen „4_777_44“. Diese Struktur-5 wird markiert „252“ und ist als „55“ markant in der Zeilennummer Z.20“55“ enthalten – das Blut kann nicht mehr fließen. Das Antigen D kann aufgrund der bekannten Anzahl von 417 Aminosäuren nach der Überprüfung bestätigt werden:
Nicht in der Kettenreaktion für die Aminosäuren, sondern direkt im Zeilenlauf des Blutes ist die Kombination von 417 Aminosäuren mit der Zellmembran=33 zu finden. Hier ist zusätzlich der Bixnom-Kreis=64 lesbar, es liegt 33_0 (Null) für die Oberfläche des roten Blutkörperchens vor und die Zahl „3303“ für das Antigen D ist vorhanden. Zufällig ist weiterhin die Zahl „79“ vom rechten Zahlenrand nunmehr in der Zeilennummer Z.2“79“8 enthalten. Es ist eine Struktur-5 und ein Andocken als Dopplung „2828“ vorhanden. Die Zahl „8“ ist das Oktogon für das BiXnom-Blutsystem: Epi.Blut.Z.2798#276“417“5“3303“2828.
4.) 21. proteinogene Aminosäure
Die 21. proteinogene Aminosäure „Selenocystein“ ist ein Sonderfall, der nicht im Ziffercode, sondern direkt mit der Doppelziffer „33“ in der Zeilennummer Z.11“33“ zählbar (11) ist: Epi.Referenz.Z.11“33“#1310224“34“1“853“71. Selen=34 ist in der Zeile enthalten. Das Selenocystein [2-Amino-3-hydroselenopropansäure]= C3H7NO2Se = 3*6+7*1+7+2*8+34 = 82 ist als Zahl nicht enthalten. Markiert ist die Ziffer „3“ in der Gruppe 4_3_4. Erst als Subtraktion von der enthaltenen Zahl „85“ ist die Zahl „82“ als 85-3=82 zu ermitteln. Alternativ und ähnlich kompliziert ergibt die Zeilennummer QS1+1+3+3=8 und die Zahl „2“ für „82“ wird aus der Markierung der Zahl 3 mit „1“_3_“1“ gezählt. Das lebensnotwendige Selenocystein kann vom Menschen und vielen Tieren nur „aufwändig“ durch ein Umkodieren ausgelesen werden (siehe: Selenocystein – Wikipedia) – hier ist es eine Rechenaufgabe.
Der Anteil von 8 kanonischen Aminosäuren, die der Mensch nicht selbst herstellen kann und über die Nahrung aufnimmt, wird zweckmäßig einfach als Serie #133xxx von Epi.Referenz.Z.1108#“133“978716545149 bis Epi.Referenz.Z.1115#“133“137594557870 durchgezählt. Die Folgezeile Epi.Referenz.Z.1116 ergänzt zwar die Serie, wurde aber mit dem „Blutgruppen-Kunstgriff“ einer anderen Verwendung zugeführt. Ersichtlich ist, dass die Kettenreaktion ein Ordnungssystem erzeugt.
Weshalb der Mensch die 8 essentiellen Aminosäuren Threonin (C4H9NO3), Valin (C5H11NO2), Isoleucin C6H13NO2), Leucin (C6H13NO2), Methionin (C5H11NO2S), Lysin (C6H14N2O2), Phenylalanin(C9H11NO2), Tryptophan (C11H12N2O2) [Reihenfolge nach der Elektronensumme: 64/64/72/72/72/80/80/108] nicht selbst produziert, wird in der einschlägigen Literatur nicht erklärt. Es ist auch keine besondere Begründung ersichtlich, selbst der Schwefel=16, der mit O2=8+8=16 zu verwechseln ist, ist in mehreren Zeilen vorhanden. Auffällig ist ein Zusammenhang mit der Ziffer 8. Das rote Blutkörperchen konnte hier aus einem Hexagon (6-Eck) entwickeln werden. Das Oktogon (8-Eck) gilt nur für das gemeinsame Zusammenspiel aller Blutbestandteile als Zielgröße. Mathematisch begabte Geschöpfe können den Zeilenlauf so lesen, dass die 8 AS-Zeilen blockiert werden können: Vorgelagert ist eine Gruppenbildung „44“, deren Elemente als Struktur 55 mit Ende=9 über den rechten Zahlenrand herausgeschoben werden sollen. In der Gruppe versteckt sich eine innere Zählgruppe „64_“1“_46 (BiXnom-Kreis 64/46)“. Informationen zur Auslagerung sind darin gemäß Markierung „4_1_4“ erst in der 4. Zeile avisiert: Epi.Referenz.Z.1104#344“64146“677559. Die Information enthält mit der Null in 6_“0“_4_“8“ das Stopp-Zeichen für 8 AS-Zeilen. Mit QS 1+3=4_4_0_99=Ende ist der Stopp nochmals erklärt. Was unnötig ist, wird biologisch nicht produziert. Was nötig ist, fehlt erst recht: Epi.Referenz.Z.1107#“134099“74519“604“8“.
5.) Immunglobuline (Ig) / Antikörper [Antibody (Ab)]
5.1) Allgemeines
Die exakte Anzahl der Aminosäuren ist aufgrund unterschiedlicher bzw. ungefährer Angaben zur Kettenlänge unbekannt, so dass zunächst nur Informationen gesammelt werden:
Serum-Immunglobuline sind eine heterogene Gruppe von Glykoproteinen, die sich in 5 Antikörperklassen unterscheiden: IgG, IgM, IgA, IgD und IgE. Für eine Infektion mit dem Corona-Virus sind die Antikörper IgG, IgM und IgA relevant. IgM bilden sich direkt nach dem Virus-Kontakt. Wegen der kurzen Verweilzeit im Blut kann damit aber kein Impfschutz nachgewiesen werden. IgG-Antikörper entwickeln sich innerhalb von 3 Wochen nach dem Erstkontakt und beschleunigt bei einer erneuten Infektion. Im Zeitraum von 3 bis 6 Monaten sind die IgG-Antikörper im Blut nachweisbar. IgA-Antikörpern sind in hoher Konzentration in Körpersekreten (Speichel, Tränenflüssigkeit, Magensäure) bei direkten Viruskontakt vorhanden. Vor der Geburt kann nur das Immunglobulin IgG die Pazenta durchdringend, so dass sich die anderen Antikörper erst nach der Geburt im Verlauf der Ontogenese bilden. Während der Stillzeit wird das mütterliche IgA übertragen (https://www.immbio.hu/phocadownload/grundlagen_zahnarzt/Grundlagen_Immunologie_2020_15_Zahn.pdf ). Es existieren mindestens 2 zusätzliche Antikörperklassen: In einigen Fischen wurde Immunglobulin W (IgW) und im Hühnerei das Immunglobulin Y (IgY) nachgewiesen.
Allen B. Edmundson, Kim N. Andersen, in Encyclopedia of Immunology (Zweite Auflage), 1998].
Die Hypervariable (HV) Region besteht aus den 3 Regionen HV1, HV2 und HV3, die jeweils von einer Framework (FR) Region als Gerüst eingefasst werden. Die 7 Regionen eines Y-Gabel-Astes werden als eine Verkettung von Gruppen-44 erkennbar. Die 3 HV-Regionen müssen aber zunächst durch eine Hypermutation für ihren Zweck als 3 Mutationsgruppen-44 vorbereitet werden - eine Serie ist als Struktur #55 vorhanden. Erforderlich ist eine Spiegelung für die L- und H-Kette und paarig=2 bzw. ein Dopplung, weil die Fab-Y-Gabel 2 Arme ausbildet, d.h. insgesamt sind es 12 Regionen. Die 1. der 3. Mutationsgruppen zeigt die Anzahl 12 als Struktur-55 und Gruppe „44“ bereits an; Spiegelung 58_85, paarig=2 ist markiert in 8_“2“_8: Epi.Ref_Rhesus.Z.3663#35“58“2“85“99“12“5449. Die 2. Mutationsgruppe „44“ enthält den Schlüssel „56“ und eine Spiegelung 73_37. Es fehlt paarig=2 bzw. eine Dopplung. Aufgrund der Gruppenbildung können die beiden nachfolgenden Zeilen als Dopplung gezählt werden, weil diese den Universal-Schlüssel „56/65“ und die Dopplungen „35_35“ enthalten: Epi.Ref_Rhesus.Z.3667#3“55“73“1“56“37“83“44“6, Epi.Ref_Rhesus.Z.3667#35“56“3458135057 und Epi.Ref_Rhesus.Z.3669#355537“65“178“3“5“6“4. Die 3. Mutationsgruppe „44“ füllt zunächst die restlichen 5 Zeilen der Struktur-Serie #55 aus. Für die Fab-Y-Gabel ist paarig=2 vorhanden. Die Spiegelung ist nur indirekt möglich, indem die Zeilennummer doppelt mitgenutzt wird. 1. Spiegelung Z.xx70#_07 und 2. Spiegelung Z.“36“xx#QS 3+5+5+4+4+0+7+7+5+0+3+9+2+0+9=“63“: Epi.Ref_Rhesus.Z.“36“70“#355“44“07“75039209. Damit können die beiden Arme der Fab-Gabel in die beide Kettenanteile getrennt werden, um die besondere Aktivität der Region HV3 der H-Kette „CDR-H3-Schlaufe“ hervorzuheben [siehe: „Die H3-Antikörperschleife zeigt einzigartige strukturelle Eigenschaften“: (PDF) The H3 loop of antibodies shows unique structural characteristics: CDR H3 of Antibodies Shows Unique Structural Characteristics (researchgate.net) ; G. Georges u.a. / March 2017/Proteins Structure Function and Bioinformatics / DOI:10.1002/prot.25291]. Strukturtrennung 3“5_5“3. Trennung der Gruppe 44 in 3“4“3_“4“33 mit Eiweiß=33. Real bestehen die Regionen aus gebogenen Eiweißfäden. Im Zeilenlauf wird dagegen eine unendliche Schleife durchlaufen, bis die passende Mutation gefunden wurde. In der Zeilen-Nr. ist die Ziffer „1“ eine Zählgröße. Mit Struktur=5_10_Form=7_räumlich=4_33=Eiweiß_8=Extra wird in der Schleife 10 mal nach Eiweiß=33 gesucht. Die Bereichs-Zählung bis Z.3709 ergibt nur 9 mal eine Zahl „33“, so dass der Ring „303“ mitgezählt wird in Epi.Ref_Rhesus.Z.3695#35“303“5898347468. Der Bereich wird als Schleife (Loop) mit dem Bixnom-Kreis=64_11=Zählgröße_33=Eiweiß definiert. Die unendliche Schleife zählt mit einem eigenen Zähler die Anzahl der laufenden Zeilen, in dem nach „33“ Zeilen wieder die Zahl „33“ im Zifferncode enthalten ist. Loop-Zähler Z.“1“: Epi.Ref_Rhesus.Z.3677#3547“6411“32428“33“. Der ideele Loop-Zähler Z.“33“ zählt laufende Zeilen von 1 bis 33 und erscheint nicht selbst als Zeilennummer. Die Zahl 33 kann incl. dieser ideelen Zahl 33 insgesamt 11-fach gezählt werden bzw. kann für 10-fach auf den Ring „303“ verzichtet werden: Epi.Ref_Rhesus.Z.3709#35170“33“28226987. In der CDR-H3-Schleife sind Glycin (Aminoethansäure) =C2H5NO2 = 6*2+5+7+8*2=40 Elektronen / 10 Atome und die Aminosäure Tyrosin= C9H11NO3= 6*9+11+7+8*3=96 Elektronen / 24 Atome beispielsweise vermischt vorhanden in Loop-Zähler Z.“8“: Epi.Ref_Rhesus.Z.3684#35“40“900229082“24“ und Loop-Zähler Z.“13“: Epi.Ref_Rhesus.Z.3689#3536“10“0“96“067741. Beim Loop-Zähler Z.“30“ (zufällig Zink=30 sind die 198 Aminosäuren (AS) des Enzyms „AID“ vorhanden: Epi.Ref_Rhesus.Z.3706#35“198“8031406880. Zink=30, 12 Regionen, Schlaufe als Formring=707 in der Z.Nr.: Epi.Ref_Rhesus.Z.3“707“#35189“30“791459“12“. Im Ergebnis folgt Schlüssel-Übergabe „56“ als Spiegelung 79_97 [oder „98_809“] für beide Ketten und Dopplung 17_17 für beide Fab-Y-Arme: Epi.Ref_Rhesus.Z.3708#35“1“7“9“817809“97“56“. Nach dem Loop-Zähler Z.“33“ in Zeile Z.3709 wird der Antikörper als Struktur erzeugt.
Ein Antikörper benötigt für seine Y-Form einen Bauplan (Roadmap). Hierfür muss eine Spaltgruppe „44“ gebildet werden, die einen Weg zum „Papain“ zeigt. Mit dem Bixnom-Kreis=64 wird auf die Bixnom-Gravitationsachse „84“ als Bezugssystem hingewiesen. Letztlich muss der Weg zum Eiweiß (Protein) als Membran=33 (Haut=3) führen. Das Protein 3_3 wird bereits in der Zeilennummer kombiniert mit einer NH-Gruppe (7_1) als Z.3_71_3 avisiert: Epi.Ref_Rhesus.Z.“3“71“3“#35132“44“39“64“2“84“8 und Epi.Ref_Rhesus.Z.3714#351229“84“5“017204. Eiweiß (Protein) =Membran=33 mit der Zählgröße 11 als „35_11_3_5_3“ Y-förmig in 3 Fragment-Äste 1_3_1 gespalten als Form=7 mit 4 Ketten sowie einer Gelenkregion „0“. Um das Protein „33“ im Zeilenlauf zu finden, startet die Zählgröße „11“ ihre eigene Zählserie parallel zum Zeilenlauf als selbstzündender Motor.
Für die Variable Region (VL/VH) beider Ketten werden die notwendigen 110 - 130 Aminosäuren jeweils durch Zählaktionen für die Kontaktzone zum Antigen (Antigen binding side) bereitgestellt: Mit den 120 Elektronen von „Papain“ wird bis zum Start der Proteinserie #33 im Zeilenlauf gezählt. Die Zählung von 212 Aminosäuren weist dagegen einen Weg zum Auslauf dieser Serie: Epi.Ref_Rhesus.Z.3715#“3511353“0“131“7“33“4“. „Papain“ aus „212“ Aminosäuren (AS) als Struktur-5 mit „3“ Disulfidbrücken, die als Form=7 mit Schwefel=16 in der Zeilennummer avisiert werden: Epi.Ref_Rhesus.Z.“3“7“16“#35104080850“212“5“. Das Papain=212 ist offensichtlich erst avisiert, aber noch nicht vorhanden. Zählung von 120 Elektronen von Epi.Ref_Rhesus.Z.37“1“7#350946366530507 bis zu einer Zählgruppe „44_111“: Epi.Ref_Rhesus.Z.3836#03400593“44“2“111“30. In der Folgezeile startet das Protein als Serie #33. Die NH-Gruppe „717“ ist von der Zeilennummer in den Zifferncode gewandert, wobei „70717“ für spezielle Rechenaufgaben bekannt ist: Epi.Ref_Rhesus.Z.3837#“33“99“70717“850898. Beim 24. Zähl-Elektron mit der Zahl 24 für 24 Zuckeratome C6H12O6 liegt erneut Papin=212 AS vor: Epi.Ref_Rhesus.Z.3740#348788140“212“272. Das Ende der Protein-Serie #33 wird nach 116 Zeilen und 212 gezählten AS-Zeilen von Epi.Ref_Rhesus.Z.374“1“#348694906280“111“ bis Epi.Ref_Rhesus.Z.3952#“33“0077845241370 erreicht. In den 116 Protein-Zeilen der Serie #33 sind 12 Dopplungen „33_33“, 1 Zahl „33“ in der Zeilennummer Z.39“33“ und 1 Ähnlichkeit als „33_303“ vorhanden, als weitere Aminosäuren avisiert. Mit diesen 14 Zusatzzeilen ergeben sich insgesamt 130 Aminosäuren. Die 14 Zusatz-Zeilen sind in der 1. Zusatzzeile als Zeilennummer Z.3_QS 9+5=14_3 auf eine Protein „33“ bezogen: Epi.Ref_Rhesus.Z.“3“95“3“#329994344648089. Die 14. Zusatzzeile für die 130. Aminosäure enthält am rechten Zeilenrand mit „131“ eine Sprungmarke, um mit der Folgezeile eine Doppelzeile zu bilden: Epi.Ref_Rhesus.Z.3966#328912668783“131“. Diese Folgezeile wird benötigt, damit bei Bedarf ein Gruppenmerkmal „44“ zählbar wird: Epi.Ref_Rhesus.Z.“39“67#3“2882“97“565“903“44“.
An der Kontaktstellen zum Antigen (Antigen binding side) liegt bei beiden Ketten die „Variable Region (VL/VH)“, die aus 110 - 130 Aminosäuren besteht und die Spezifität der Bindung zum Antigen besteht. Der variable Bereich enthält eine Hypervariable (HV) Region und eine Framework (FR) Region. Die HV-Region enthält verschiedenartige Aminosäuren in 3 hypervariablen Regionen (HV1, HV2, HV3). Synonym: CDR1, CDR 2, CDR3 : „Complementarity determining regions“.
HV1 als 444: Epi.Ref_Rhesus.Z.3985#3273“444“5279“64“61
FR2 als 44_44: : Epi.Ref_Rhesus.Z.3996#32“644“335“44“52927
HV2 als 44: Epi.Ref_Rhesus.Z.3997#3263616823602“44“
FR3 als 44_44: : Epi.Ref_Rhesus.Z.4020#32“44“9“44“38903954
HV3 als 44: Epi.Ref_Rhesus.Z.4021#32“44“13738968887
FR4 als Z.404x_#44: Epi.Ref_Rhesus.Z.“404“3#322“64“84403“64“555“
Mit der Konstanten Region CL endet die L-Kette. Die Kontanten Regionen der H-Kette ziehen nach CH1 mit weiteren 2 bis 3 Abschnitten im Anschluss an das Gelenkstück [Hinge region] als Y-„Stiel“ weiter. Die Konstante Region der L-Kette (CL) und des 1. Abschnittes (1. Domäne) der H-Kette (CH1) füllen die Struktur-5-Serie ab Zeilennummer Z.4050 über 10 Zeilen paarig=2 aus, wobei die Zahl 0(Null) die Konstanz symbolisiert. Die Disulfidbrücke zwischen CL und CH1 wird mit Schwefel=16 adressiert: Anfang CL und CH1 als Struktur-5 in Z.40“5“0#_“555“. Die Zahl „22“ ist geeignet, um die Konstante Gruppe CL mit 107 AS als 50% einer Gruppe 44 als L-Kette mit 214 AS darzustellen. Dazu werden nachfolgend 107/214AS erwähnt. In „63“_Ende=9_3“ ist eine Markierung enthalten: Epi.Ref_Rhesus.Z.40“5“0#3“22“09077“6393“555“. Für die Halbgruppe „22“ wird eine Zählgröße „11“ als „22_11_63_1“ mit dem Merkmal=63_Zähler=1 gebildet: Epi.Ref_Rhesus.Z.4051#3“22“0“11“267438“63“1“.
Disulfidbrücke als Struktur-55 in der Zeilennummer Z.40“55“ mit Schwefel=16_16 einer Form=77 und einer Spiegelung „32_23“: Epi.Ref_Rhesus.Z.40“55“#32“16“9362377“16“14.
Die „107“ AS der Halbgruppe sind adressiert. Wegen QS 3+2+1+6+1+4+3+1+0=21 und QS 7+4+8+0+0+2=21 sind 2 gleiche Teilsummen enthalten. Die Zahl 21 + 1 Zählaktion = 22 zeigt eine Halbgruppe. Die Zeilennummer enthält die Zahl „4“ für 4 Ketten des Antikörpers und die Zählgröße QS 0+5+6=11: Epi.Ref_Rhesus.Z.40“56“#3“21“6143“107“48002. Das Strukturmerkmal „63“ ist als QS=3+2+1+4+5+5+8+0+1+9+6+9+9+1+0=63 enthalten. Die Anzahl von 214 AS ist mit der Struktur=55 kombiniert als „214_55“. Die Regionen von L- und H-Kette sind zueinander gespiegelt 19_91: Epi.Ref_Rhesus.Z.4058#3“214“55“80“19“69“91“0. Ende CL und CH1 mit Ende=9 in Zeilennummer und am rechten Zahlenrand: Epi.Ref_Rhesus.Z.40“5“9“#321376606157“64“9“.
5.4) Flexible Gelenkregion (Hinge region)
1.) 1 Brücke bei Immunglobulin IgD: „1“9“1“7_79_“16“: Epi.Ref_Rhesus.Z.4087#3“1917“485“79“383“16“;
2.) 3 Brücken bei Immunglobulin IgM: Die Anzahl 3 wird durch Schwefel=16 markiert als 16_3_16 mit Brücken „79_97“. Die Monomere schließen sich zum Pentamer zusammen: Epi.Ref_Rhesus.Z.4106#31769“79“16316“097“
3.) 4 Brücken bei Immunglobulin IgG2: Die 4 Brücken zählen sich als Zählgröße über die Zeilen-Nr. Z.“4“111 und als QS 3+1=4_Form=7_QS 3+1=4 mit 4 lesbaren Dopplungen: 51_51, 151_151; 15_15; 17_17. Eine Spiegelung „15_51“ ist mit enthalten: Epi.Ref_Rhesus.Z.4111#“31731“151“65“151“78.
4.) 11 Brücken bei Immunglobulin IgG3: Es liegt eine Schwefel-Serie #3_“16“ vor, die über 11 Zeilen nutzbar ist. Nicht jede Zeile enthält eine Spiegelung, aber es sind insgesamt 11 Spiegelungen. Für die Serie wird die Zeilennummer aus der Zählgröße 11 und Schwefel=16 kombiniert. Die Serie wird mit „11_9=Ende“ nur über 11 Zeilen gezählt. Die übrigen 2 Zeilen der Serie werden für Antikörper mit 2 Brücken genutzt. Serie von Epi.Ref_Rhesus.Z.4“116“#3“16“926055489285 bis Epi.Ref_Rhesus.Z.4126#3“16“157936“11“09“78.
5.) 2 Brücken bei Immunglobulin IgG1, IgG4, IgA und IgE. Der Y-Winkel kann bei IgG und IgA flexibel weit geöffnet, was durch Spaltung der 1. Brücke vorstellbar ist. Entsprechend liegen 2 Zeilen vor. Der Y-Winkel wurde bereits auf 90° bestimmt und kann nunmehr alternativ weit bis auf „132°“ geöffnet werden als „Extra=8_132_8_90“. Mit QS 3+1+6+0+8+1+3+2+8+9+0+5+7+1+7=61 muss als Additionsaufgabe die Aktion=1 in der Folgezeile am rechten Zahlenrand ergänzt werden, um die Aminosäure „Prolin“ =C5H9NO2= (6*5)+(1*9)+7+(8*2)=30+16+16=62 zu adressieren. Der Zähler „1“ ist avisiert als Form=7_1_7=Form. Prolin (Pyrrolidin-2-carbonsäure) ist die einzige der 20 in Proteinen enthaltenen Aminosäure, die eine sekundäre, zyklische Aminogruppe enthält. Diese bewirkt, dass an der Position von Prolin die Helixstruktur unterbrochen wird, wodurch die. Sekundärstruktur von Polypeptiden und Proteinen beeinflusst wird. Helikale Bereiche können zu beiden Seiten eines Prolin-Rests räumlich unabhängig voneinander orientiert werden. Prolin ist ein Helix-Unterbrecher [siehe: Prolin - Lexikon der Biologie (spektrum.de)]. Prolin ist als Polyprolin im Zentrum der Gelenkregion vorhanden: Epi.Ref_Rhesus.Z.4127#3“16“081328905“717“. Zweite Brücke 3“16“_“16“3: Epi.Ref_Rhesus.Z.4128#“316“0047588“163“5“1“.
5.5) Fc-Region der Monomere
Nach der Gelenkregion muss am Beginn der Fc-Region in der konstanten Region CH2 das Enzym „Pepsin“ als Merkmal vorliegen. Pepsin besteht aus 327 Aminosäuren (humanes Pepsin 326 AS / Summenformel ?). Die Zahl 326 AS / 327 AS ist erst am Ende der Region zu finden: Epi.Ref_Rhesus.Z.4162#31342“326“8715496 bzw. Epi.Ref_Rhesus.Z.4164#31“327“2729201224. Im Prinzip folgt im Zeilenlauf nach einer Schwefel-Serie #3_“16“ automatisch eine Phosphor-Serie #3_“15“. Pepsin ist ein Phosphorprotein und liegt deshalb mit Phosphor=15_15 bereits am Anfang CH2 mit der Zählgröße „11“ für weitere Zeilen und paarig=2 für beide H-Ketten vor: Epi.Ref_Rhesus.Z.4129#3“15“9“2“82258“15“911. Pepsin wird aus „Pepsinogen (373 AS) bei Kontakt mit Salzsäure (Magensäure) gebildet, wobei 44 Aminosäuren abgespalten werden [siehe: Pepsin - Funktion & Krankheiten | MedLexi.de ]. Die Gruppe „44“ ist in mehreren Zeilen vorhanden und wird benötigt, um damit die äußere Anlagerung von Zucker bei der Proteinglykosylierung darzustellen. Die häufigste Form ist Bindung bei der N‐Glykosylierung, mit dem Stickstoff aus der Seitenkette des Asparins. Bei den verschiedenen Zuckerarten handelt es sich um Hexosen [siehe: Hexosen (chemie.de) ] mit 6 Kohlenstoffatomen und der Summenformel C6H12O6=24 Atome. Für die 3 Zuckerarten Mannose, Galactose (Schleimzucker), Fructose (Fruchtzucker) sind 3 Gruppen-44 jeweils mit Zucker=24 in einer Zeile gebunden. Diese 3 Grundtypen der N‐Glykosylierung bilden ausgehend von einer gemeinsamen Basis unterschiedliche Muster bei der Bindung an den Antikörper [Siehe: Untersuchungen zur Synthese von Biopolymeren unter Einsatz von Biokatalysatoren in parallelen Multienzym‐Multisubstrat‐Reaktionen; A. Schildbach; Diss. Uni Halle (2020); https://opendata.uni-halle.de/bitstream/1981185920/35110/1/Dissertation%20Schildbach.pdf ]. Vorhanden sind dafür jeweils 4 Zeilen, um die Struktur-55 zu integrieren. Diese 12 Zeilen enthalten die Gruppe 44 anfangs auch in der Zeilennummer und abschließend ebenfalls die Struktur-55. Beginn mit der 1. Zuckerzeile „24“: Epi.Ref_Rhesus.Z.41“44“# 31478466322“24“65; 2. Zuckerzeile „24“: Epi.Ref_Rhesus.Z.4149#31“44“0531318“24“290; 3. Zuckerzeile „24“: Epi.Ref_Rhesus.Z.4153#31410“24“9082“44“39. Dritte Struktur-55: Epi.Ref_Rhesus.Z.41“55“# 313951298289746.
Jede Domäne enthält eine intermolekulare Disulfidbrücke (keine Kettenquerverbindung), die nur die eigene Domäne überzieht und zur Stabilität beiträgt. Daraus ergibt sich ein Hinweis zur Länge einer Domäne. In Verbindung mit Schwefel=16 muss statt einer Spiegelung eine Dopplung als Symbol und eine Struktur-5 vorhanden sein. Für die Domäne CH2 liegen dafür nur 2 Zeilen vor. Schwefel=16 zugleich als Dopplung 64_1_64 sowie als Struktur 55_55 lesbar: Epi.Ref_Rhesus.Z.41“33“#3156224“64164“988 und Epi.Ref_Rhesus.Z.4134#31“55“461“16“20“55“87. Die folgende Domäne CH3 endet beim Antikörper IgA mit dessen Spiegelung als Dimer an einer zwischengeschalteten J-Kette. Um die J-Kette zu erzeugen, kann sich die Domäne CH3 im Zeilenlauf nicht weit ausbreiten. Der Schwefel=16 steht nur als Serie Z.x16x über 10 Zeilen in der Zeilennummer zur Verfügung von Epi.Ref_Rhesus.Z.4“16“0#313573952979302 bis Epi.Ref_Rhesus.Z.4“16“9#312897012327632. Als Besonderheit bildet die Quersumme der Zeilennummer nochmals Schwefel Z.QS 4+1+6+5=16. In der Zeile ist die Brücke als Struktur=5_9999=seitlich=Ende adressiert. Eine Dopplung ist als 13_13 enthalten: Epi.Ref_Rhesus.Z.4“16“5#3“13“1975“13“6“59999“.
Als Zwischenbilanz sind damit die Antikörper IgG und IgD mit ihren Domänen CH1, CH2 und CH3 fertiggestellt. Der Antikörper IgA liegt als Dimer vor und benötigt nachfolgend als Spiegelachse noch eine J-Kette. Sofern diese nicht nochmals produziert wird, ist die J-Kette gleichartig auch für das Pentamer IgM nutzbar. Für die Antikörper IgM und IgE wird im Anschluss an die J-Kette noch die Domäne CH4 benötigt. IgE ist ein Monomer.
Die Domäne CH3 bildet das Ende der Antikörper IgG und IgD sowie den Antikörper IgA zunächst als Monomer mit der Gesamtlänge von 446 Aminosäuren (AS) in der H-Kette. Diese Zahl könnte nur aus der Zahlen-Spiegelung 67_76 in der Zahl 447(6) gelesen werden: Epi.Ref_Rhesus.Z.4172#312“67“201“447“6“006. Der Abschluss zeigt als Besonderheit eine Dopplung „708_708“ und eine Spiegelung 12_21 sowie ein Tripel Form=70_70_70. Epi.Ref_Rhesus.Z.4173#3“12“59“708708“21“70“.
5.6) Antikörper IgA
Der Antikörper IgA in der Muttermilch zeigt sich mathematisch interessiert, indem mit der Zeilennummer Z.QS 4+1+7+4 =16=Schwefel erkannt wird. Schwefel ist für die Bildung eines Dimers erforderlich, um über Disulfidbrücken 1 H-Kette mit ihrer Spiegelung zu verbinden und in die andere H-Kette eine J-Brücke aus 137 Aminosäuren einzubauen [siehe: Immunglobuline - Lexikon der Biochemie (spektrum.de) ]. Weil die beidseitigen Disulfidbrücken selbst eine Spiegelung sind, werden 2 Spiegelungen statt 2 Dopplungen benötigt als 12_21 und paarig=2 (12_21 bereits auch zuvor in Z.4173). Mit einer Dopplung Z.x17x_#QS 0+2+9+6=17 wird die einseitige Eingliederung der J-Kette in die Gruppe Z.4xx4 avisiert. Um das Dimer als Struktur=55 zu erzeugen, wird eine Spiegelung „95_59“ adressiert: Epi.Ref_Rhesus.Z.“4174“#3“12“5“2“21“9559“0296“. Weil in der Zeilennummer das Chlor=17 der Salzsäure (Magensäure) als Serie Z.x17x stets vorhanden ist, wird das Dimer IgA von einer sekretorischen Komponente „Gruppe=44_Form=7_33=Protein“ umhüllt, um gegen die Spaltung durch Enzyme im Verdauungsapparat geschützt zu sein [siehe: anti-Immunglobulin A (IgA) sekundäre Antikörper (antikoerper-online.de)]: Epi.Ref_Rhesus.Z.4“17“5#312“44“7“33“9974586. Das Chlor=17 in der Zeilennummer wird im Zifferncode als Schutz umhüllend zerlegt als „1_2_1“ und „7_5_7“. Die Umhüllung erfolgt mit dem Bixnom-Kreis QS 3+1+2+1+4+8+2+7+5+7+5+8+2+9+0=64: Epi.Ref_Rhesus.Z.4“17“9#3“121“482“757“58290. Die J-Kette wird als Extra=8 in der Serie Z.xx8x mit der Zeilen-Nr. gebildet. Die J-Kette enthält „137“ Aminosäuren (AS): Epi.Ref_Rhesus.Z.41“8“0#312073599“137“296. Die J-Kette ist reich an Cystein, um mit dem Schwefel=16 Disulfidbrücken herzustellen. Der Schwefel wird über die Zeilennummer Z.QS 4+1+8+3=16=Schwefel adressiert. Die Kette wird nur einseitig in eine der beiden H-Ketten integriert, dafür ist eine Struktur-5 mit einer Dopplung vorhanden als Z.QS 4+1=5_83_#83_5. Zur Positionierung ist eine Bixnom-Gravitationsachse=84 vorhanden: Epi.Ref_Rhesus.Z.41“83“#311“84“97“83“503202. IgA nutzt somit die Schwefel-Lücke kreativ aus.
5.7) Domäne CH4 für Antikörper IgM und IgE
In der Folgezeile steht für intermolekulare Disulfidbrücken wieder Schwefel=16 kombiniert mit einer Dopplung 61_61 zur Verfügung, so dass sich die Domäne CH4 für IgM und IgE mit einer Zählgröße 11 als Serie #3_11 und paarig als Spiegelung „31_13“ für beide H-Ketten bilden kann: Epi.Ref_Rhesus.Z.4184#“3“11“775249“6161“3“2. Die Zählgröße endet als Zahl „110“ für ca. 110 Aminosäuren (AS) in einer Domäne: Epi.Ref_Rhesus.Z.4194#3“110“318656“16“093. Als geeignete Gesamtlänge für Monomere mit der Domäne CH 4 sind nachfolgend die Anzahl von 214 AS für die L-Kette und 577 (statt max. 576) für die H-Kette, paarig=2, enthalten: Epi.Ref_Rhesus.Z.4195#3109“577“2“214“3956. Um die Anzahl von 577 AS durch „1“ Aktion mittels Subtraktion auf 576 AS zu reduzieren, müsste eine Begründung gesucht werden, beispielsweise mit Z.QS4+2+0+4=10#_10 wird eine Zahl 10 statt 11 geliefert. Alternativ wird 577 um 10 auf 567 AS gesenkt, wodurch ebenfalls eine bekannte Kettenlänge entsteht: Epi.Ref_Rhesus.Z.“4204“#3“10“2920“181717“16“. Das Monomer IgE ist damit realisiert.
5.8) Antikörper IgM als Hexamer und Pentamer mit und ohne J-Kette
Der Antikörper IgM wird als Hexamer ohne eine J-Kette aus 6 Monomeren gebildet. In der Variante als Pentamer kann als Variante eine J-Kette integriert sein. Das Hexamer wird derart gewonnen, dass die Anfangszeilennummer Z.4214, die 214 AS für die L-Ketten enthält, als Zählgröße Z.QS 4+2+1+4=11 verwendet wird. Das Hexamer bildet sich als Additionsaufgabe mit dem Trimer „seitlich=9_555“, indem bis zu einer Wiederholung „9_555“ weiter gezählt wird, um ein Hexamer zu realisieren: Epi.Ref_Rhesus.Z.4214#30“9“555“682105813. Die Wiederholung als Hexamer liegt vor mit einer Struktur-Spiegelung „65_56“ in Epi.Ref_Rhesus.Z.4256#30“65“008“56“2“9555“8.
Eine J-Kette besteht aus 137 Aminosäuren und ist reich an Cystein mit Schwefel=16. Andererseits enthält die J-Kette 5 verschiedenen Zuckeranteile [Siehe: Allgemeine Eigenschaften von Immunglobulinmolekülen, Roald Nezlin (1998 /Immunoglobulins); Hinge Region - an overview | ScienceDirect Topics ; General Characteristics of Immunoglobulin Molecules]. Mit Zucker C6H12O6=24 Atome sind insgesamt 5*24=120 Atome am Zucker der J-Kette beteiligt. Die J-Kette im IgM wird als U-förmig gebogen dargestellt und enthält im „Hufeisen“ 2 Disulfidverbindungen mit Schwefel=16 [siehe: https://en.wikipedia.org/wiki/Immunoglobulin_M ; Immunglobulin M (IgM)- Struktur und Funktionen (microbenotes.com) ]. Die Addition zeigt somit ein Interesse an der Zahl 120+16=“136“ (zunächst statt 137). Die J-Kette wird als Zählgröße mit der Z.QS 4+2+5+0=11 und der Protein-Verbindung 33_QS 5+6=11_33 avisiert: Epi.Ref_Rhesus.Z.“4250“#3069“33“56“33“86799. Mit der Symbolik „136“ und dem Einbauwinkel=90° wird die J-Kette als „136_Form=7_136_Winkel=90°“ adressiert: Epi.Ref_Rhesus.Z.4251#30686“1360713690“. Für die Kettenlänge von 137 AS wird der Einbau in das Pentamer mittels „1“ Einbau-Aktion addiert als 136+1=137 AS. Rechenaufgaben fallen an, wenn eine seltene Digital-Form 1/0 als „71707“ vorliegt. Wegen der Verbindungsfunktion ist als Variante eine Struktur-Spiegelung 57_75 integriert als „717057_75“. Die J-Kette liegt folglich als Struktur-55 mit 137 AS vor: Epi.Ref_Rhesus.Z.4253#306“7“1“7057“228“75“5“. Die bogenförmige Ausformung wird mit dem Bixnom-Kreis=64 und dem Einbauwinkel=90° im Bixnom-Bogen „6_90°_4“ vorgegeben: Epi.Ref_Rhesus.Z.4254#306“64“49563“6“90“4“0. Mit der Zeilennummer Z.4+2+5+5=16 ist einerseits die Struktur=55 und der Schwefel=16 enthalten, um die J-Kette in das Pentamer „5“ beidseitig als Spiegelung Form=7_2_27 einzufügen: Epi.Ref_Rhesus.Z.42“55“#306“5“72“889399“27“0“.
Die Makrophagen nehmen von ihren Rezeptoren erkannte Krankheitserreger sowie körpereigenes Material auf, um diese Stoffe zu zersetzen. Zu erwarten ist, dass die Makrophagen im Zeilenlauf das Ende der Leukozyten bilden. Die Frage ist, ob die Anzahl von Aminosäuren der Evolution hilft, den Zeilenlauf zu interpretieren bzw. sich anzupassen.
Bei einer geometrischen BiXnom-Konstruktion konnte für Leukozyten ein 5-zackiger-BiXnom-Fressstern gezeichnet werden. Makrophagen besitzen dagegen eine bewegliche Zellmembran, so dass die Form unbestimmt ist. Die mathematische Problemlösung entspricht der Suche nach den Krankheitserregern. Um trotz einer wandelbaren Oberfläche im Zeilenlauf eine fixe Struktur abzugrenzen, könne imaginäre Zählwerke einige Zeilen als Block zusammenfassen (z.B. Anzahl 111 für Zellfortsätze und Zellmembran 33), um darin einen funktionellen Sinn zu finden. Weil sich das Thema auf die Oberflächenrezeptoren bezieht, muss nicht die komplette Makrophage incl. der Entstehung aller Verdauungsenzyme über ER (Endoplasmatisches Reticulum) und Golgi-Apparat gefunden werden (siehe: https://www.u-helmich.de/bio/lexikon/L/lysosomen.html). Es handelt sich lediglich um die Zellmembran, von der sich einzelne Bestandteile zwecks Aufnahme und Abbau von Fremdstoffen als blasenartiges Vesikel in das Zellplasma bewegen, um dann wieder in die Zellmembran integriert zu werden. Der Monozyt präsentiert den Abwehrzellen seine Antigene, um als Makrophage genügend Futter zu finden.
Granulolyten: Je nach dem Färbeverhalten der Körnchen (Granula) im Zytoplasma werden neutrophile [(a) stabkernige / b) segmentkernige aus 3 - 5 Segmenten], basophile und eosinophile Granulozyten unterschieden. Der Zeilenbereich kann als Kernzählung-55 durchlaufen werden, wenn 11-fach gezählt wird, wobei 2 Zeilen als eine Gruppe-44 [lfd. Nr. 4a/4b von 11] nur 1-fach zählen. Die Funktion entspricht, der der Monozyten, jedoch treffen sie früher am Infektionsherd ein: Epi.Ref_Rhesus.Z.4“505“#289“55“99654592“44“ und Epi.Ref_Rhesus.Z.4506#28949570“44“81“55“. Bereits am Anfang der Gruppen-Serie Z.44xx kann mit 522 Aminosäuren (AS) der Wachstumsfaktor M-CSF (Makrophagen Kolonie-stimulierender Faktor) gezählt werden, aus dem sich aus blutbildenden Stammzellen des Knochenmarks die Monoblasten und Promonozyten als Vorläufer der Monozyten entwickeln: Z.4402, Z.4428, Z.4475 und Epi.Ref_Rhesus.Z.4543#2871379362“522“33“ mit einer Gruppe-44 in der folgenden Zeile: Epi.Ref_Rhesus.Z.45“44“#28“707“474“56“85276.
6.3) Zellmembran
Gesucht wird der Übergang der Monozyten ins Gewebe als Makrophage. Für den Zeilendurchgang wird ein direkter Weg von der Zellmembran (Membrana cellularis / Zytomembran / Plasmamembran) durch das Zellplasma incl. Organellen bis zum Zellkern erprobt, um dann zur Funktion der Zelle zu gelangen. Eine echte Doppelmembran, die beispielsweise als „3333“ symbolisiert werden könnte, ist nur beim Zellkern und der Organelle „Mitochondrium“ vorhanden, sowie in Chloroplasten der Pflanze zwecks Photosynthese. Die Zellmembran verfügt als Phospholipid-Doppelschicht über 2 funktionell unterschiedliche Seiten. Auf der Außenseite bilden Kanalproteine den großen Molekülen eine flexible [Z.x5“6“5] Öffnung „909“ als Form-7: Epi.Ref_Rhesus.Z.4“565“#28“575“4138“9“6“909“0“. Die Zellmembran „33“ ist mit dem Schlüssel-Schloss-Prinzip „56“ enthalten. Die Struktur „55“ ist mit dem Phosphor=15 als „15_55“ gekoppelt“: Epi.Ref_Rhesus.Z.4566#28“56“9“15“55“9“33“836. Auf der Innenseite wird Wasser (H2O=2+8=“10“) am rechten Zahlenrand als wasserabweisend (hydrophob) herausgeschoben: Epi.Ref_Rhesus.Z.4567#2856290003052“10“.
6.4) Mitochondrien
Ein „Mitochondrium“ kann im folgenden Zeilenbereich als Extra „8888“ mit der mitochondrialen DNA (mtDNA) „6666“ und der Doppelmembran „3333“ notdürftig erkannt werden: Epi.Ref_Rhesus.Z.4589#2842596740“8888“6, Epi.Ref_Rhesus.Z.4590#28419774387“6666“ und Epi.Ref_Rhesus.Z.4“604“#28“3333“545698066. Für den Zweck eines Monozyten ist es aber günstiger, diese Organellen mit der Zellmembran als Mikrovesikel „3333“ abzukapseln und von den Monozyten abzuschnüren. Es werden dadurch Entzündungen als Teil der Immunantwort ausgelöst [siehe: https://www.meduniwien.ac.at/web/ueber-uns/news/detailseite/2019/news-im-juni-2019/mitochondrien-wenn-freunde-zu-feinden-werden/ ]. Mit der Zählgröße „11“ wird ein Zeilenbereich als Form-7 für Wirkstoffe 77 aktiviert. Markiert wird „1_63_1“, so dass 63 + 1 Aktion = 64 =Kreis ergeben. Mit der Serie #“2“8“... wird anschließend der Kreis=64 8-fach gezählt und doppelt=2 als zirkuläre mtDNA in Ringform ausgeführt. Für den Bedarfsfall enthält die Zeile außer Schwefel=16 mit 129 Aminosäuren das Enzym „Lysozym“, das im Blutplasma die Zellwand von Bakterien abbaut: Epi.Ref_Rhesus.Z.4588#“28“432“16“3“129“77“11“. Das Glykoprotein „GM-CSF“ [Granulozyten-Makrophagen-Kolonie-stimulierende Faktor bzw. Granulozyten-Monozyten-Kolonien-stimulierende Faktor ] wirkt als Zytokin an der Immunantwort mit. Es besteht aus mit 127 Aminosäuren: Epi.Ref_Rhesus.Z.4606#28321051“767“127“6. Der mtDNA-Zählbereich 8x „64“ endet in Epi.Ref_Rhesus.Z.4622#28223012“64“37450. Phosphor=15 wird bei einer oxidativen Phosphorylierung adressiert, womit das Molekül Adenosintriphosphat (ATP) über die Atmungskette regeneriert wird. Bei einem Übermaß an Kochsalz (NaCl) in der Nahrung hemmt das Natriumion (Natrium=11=Zählgröße) die Atmungskette der Zellatmung. Aufgrund des Energiemangels geraten die Entwicklung der Monozyten und deren Signalisierungen außer Kontrolle [siehe: https://www.mdc-berlin.de/de/news/press/zu-viel-salz-bremst-fresszellen-aus]: Epi.Ref_Rhesus.Z.4593#284012“11“5“04“33“04. Weiterhin sind Mitochondrien an der Bildung von Eisen-Schwefel-Clustern beteiligt [siehe: Eisen-Schwefel-Cluster – Wikipedia ]. Diese FE-S-Zentren (2Fe-2S und 4Fe-4S) sind als Kofaktoren an Enzymreaktionen beteiligt. Mit 2* Schwefel (16)=32 und 2 *Eisen (26)=52 sind beispielsweise Markierungen vorhanden, die mit „2_Extra=8_2“ auch verdoppelt werden können: Epi.Ref_Rhesus.Z.4619#“282“413“4“32“4“29941 und Epi.Ref_Rhesus.Z.4620#“282“3“52“3“03981363.
6.5) Oberflächenmarker und Enzyme in Monozyten :
Zunächst wird eine Entzündung (Inflammation) organisiert: Auf Monozyten und der daraus entstehenden Makrophagen ist das Oberflächenprotein CD14-Rezeptor ("CD" von Cluster of differentiation) vorhanden, der bei Kontakt mit Lipopolysacchariden eine Entzündung auslöst [siehe: CD14-Rezeptor (chemie.de)], Mangels einer frühzeitigen Gruppe-44 bilden beide Leukozyten eine Doppelgruppe-88 in Z.46“88“, damit CD-14 folgen kann. Der Universal-Schlüssel „56“ für das Schlüssel-Schloss-Prinzip ist enthalten. Durchmesser von Monozyten etwa bis 20µm. Drei Nullen sind vorhanden, um für die Zahl „40“ in der Folgezeile um den Faktor 1000 von normalen „nm“ auf den großen Durchmesser 20 - „40“µm für Makrozyten zu erhöhen. Die Bixnom-Schwerachse „84“ trägt ggf. zum symmetrischen bohnenförmig gekrümmten Kern bei. Aufgrund des großen Kerns bildet das Zytoplasma nur einen schmalen Saum: Epi.Ref_Rhesus.Z.46“88“#“2“78“2“56“7500“84“0“22“. Oberflächenmembran „33“_5_88. Makrophagen-Durchmesser bis 40 µm als Form=7_40_7 [siehe: Precisely defined fiber scaffolds with 40 μm porosity induce elongation driven M2-like polarization of human macrophages - IOPscience ; T.Tylek u.a. 2020/ Biofabrication 12 / DOI 10.1088/1758-5090/ab5f4e ]: Epi.Ref_Rhesus.Z.4689#27819“7407“6“33“5“88“. CD14-Rezeptor „326“ Aminosäuren (AS): Epi.Ref_Rhesus.Z.4692#27801953205“326“0. Die Monozyten können eine Kombination von CD14 mit CD16 enthalten, so dass die Monozyten keine einheitliche Art darstellen [CD16a mit 254 AS und CD16b mit 233 AS].
Im graublauen Zytoplasma des Monozyten sind vereinzelt (keine Struktur-5) kleine Körnchen (Granula) zu finden. Die Granula „1“ mit Wirkstoffe=77 können stets am rechten Zahlenrand gezählt werden: Epi.Ref_Rhesus.Z.4694#2“77“9“010“74647“187 und Epi.Ref_Rhesus.Z.4696#2“77“7827“18141“80“1“.
Die Entzündung wird durch die Ausschüttung von TNF-α (Tumornekrosefaktor-alpha) und Interleukin IL-1β vermittelt. Der Botenstoff TNF-α besteht bei Säugetieren aus 233 bis 235 Aminosäuren (siehe: First molluscan TNF-α homologue of the TNF superfamily in disk abalone: Molecular characterization and expression analysis - ScienceDirect ). Blut als Z.QS „4+6+9+8“=26. Es sind 235 AS markiert als Zählgröße 68_QS 6+5=11_86: Epi.Ref_Rhesus.Z.“4697“#2777“235“77“68“65“86“. Zucker 24: Epi.Ref_Rhesus.Z.4698#27766446“24“08237. Blut 26: Epi.Ref_Rhesus.Z.4701#27748“7“26“7“473707. Als „Entzündung“ wird nur als Form bzw. der Universalwirkstoff „77“ mit der Membran „33“ angeboten: Epi.Ref_Rhesus.Z.4“707“#2“77“1“33“555“214“33“9. Halbwertzeit 72 Stunden für Monozyten im Blut=26 mit QS 0+7+2+6+6+3=24=Zeit als Ende der markierten Doppelgruppe „2_88_2“ avisiert, und zwar bei einem Zählerübergang „63/64“: Epi.Ref_Rhesus.Z.4719#27“64“2882“90“726“63“.
Interleukin IL-1β mit 153 Aminosäuren hat die gleiche Entzündungswirkung: Epi.Ref_Rhesus.Z.4723#276194716“153“694. Zucker 24: Epi.Ref_Rhesus.Z.47“24“#276136“24“9871697. Entzündung 77_808_33_7_33: 2“7“6“07780833733. Blut 26: Epi.Ref_Rhesus.Z.47“26“# 27601939“153“4891. Entzündung „77“ erscheint am rechten Zahlenrand: Epi.Ref_Rhesus.Z.4727#2759609994486“77“. Blut=26 wird als Umgebung der Monozyten adressiert. Die Serie #275... wird sich in die Serie #2“72“ wandeln, so dass die Halbwertzeit von 3 Tagen=3 * 24 =72 Stunden als Vorstufe der Makrophage im Prinzip realisierbar ist [siehe: 1.) Makrophage - DocCheck Flexikon 2.) „Monozyten-Populationen und ihre Zytokin-Produktion beim Erysipel (d-nb.info)“; L. Horelt, Diss. 2004, Uni. München]. Die Zeitzählung endet mit dem Zeilen-Zähler=63, wo das Ende der Serie #2“72“0 zu erwarten ist: Epi.Ref_Rhesus.Z.4“72“8#27590“26“320“63“007.
Das Enzym „Lysozym (Muramidase)“ ist in vielen Zellen insbesondere in Sekreten vorhanden. Im Blut wird es von den Makrophagen abgeben und ist in den Granula der Makrophagen enthalten. Lysozym zerstört die Zellwand von Bakterien, indem es die β-1,4-glykosidische Bindungen von Mucopolysaccharide spaltet. Lysozym besteht aus einer Peptidkette mit „129“ Aminosäuren (AS) und 4 intramolekularen Disulfidbrücken mit Phosphor=15 und Wirkstoff=77 sowie Blut=26 [siehe: https://viamedici.thieme.de/lernmodul/549614/539527/lysozym]: Epi.Ref_Rhesus.Z.4709#2“77“0“15“851“4“32“129“ und Epi.Ref_Rhesus.Z.4710#276957“03“7“0“26“30“5.
Möglichst sollte die Trans-Seite im Zeilenlauf beginnen, damit der Golgi-Apparat direkt über „ER“ zum Zellkern durchläuft. Das Mantelprotein COP I bildet Vesikel zum Transport vom Golgi-Apparat zum „ER“ und unterstützt das von dort stammende COP II in die Gegenrichtung zur Trans-Seite zu gelangen (siehe: Mantelprotein - DocCheck Flexikon). Auf der Trans-Seite sind die Enzyme „saure Phosphatase“ (Phosphor=“15“) und „Galactosyltransferase“ vorhanden: Epi.Ref_Rhesus.Z.4641#281074691746“15“3. Weiterhin bildet das Mantelprotein „Clathin“ polygonale, ballförmige Vesikel, D=50-100nm, für den Transport zur Plasmamembran. Die Knotenpunkte (Triskelion) sind dreiarmig (3x 120°=360°). Jeder Arm ebsteht aus 1 kurzen leichten Kette und 1 langen schweren Kette [siehe: Clathrin - DocCheck Flexikon]. Gemäß Skizze handelt es sich um ca. 32 Ball-Felder, die sich gemischt aus 5-Ecken 2_“5“_2 und 6-Ecken 4_“6“_4 zusammensetzen. Der Knotenpunkt „Triskelion“ ist mit „41_41_41“ adressiert. Die Kugel „64“ wird mit der Zeilen-Nr. und QS 2+8=10_1=101 nm im Durchmesser geliefert: Epi.Ref_Rhesus.Z.“464“2#2810“141414“03“252“. Auf der CIS-Seite spaltet das Enzym „Mannosidase“ Mannosen (C6H12O6=“24“=Zucker) ab, die im endoplasmatischen Retikulum angehängt wurden: Epi.Ref_Rhesus.Z.4668#2794489383877“24“. Weil diese Zeile bereits für das „ER“ benötigt wird, kann der Zucker=24 zuvor nur als QS 2+7+9+6=24_88=Extra gezählt werden: Epi.Ref_Rhesus.Z.46“64“#“2796“88“603000407.
Das intrazellulär verzweigte Membransystem ist je nach Zelltyp unterschiedlich entwickelt. Die schlauchartige, labyrinthartige Membran-Struktur umhüllt als Übergang zur Kernhülle den Zellkern und erfüllt Synthese- und Speicherungsaufgaben. Weil die Krümmung „46“ als Nummern-Serie Z.46xx nach dem Golgi-Apparat weiterläuft, ist eine Ähnlichkeit vorhanden. Der schalenartige Bereich an der Kernhülle ist auf der Biomembran punktartig mit ablösbaren Ribosomen besetzt [rER/ rough endoplasmic reticulumraues ER]. Das glatte ER (sER / smooth endoplasmic reticulum) bildet eine eigene Membran [siehe: Endoplasmatisches Retikulum – Wikipedia ], ist frei von Ribosomen und bildet röhrenförmige (Tubuli) Hohlräume. Das ER fehlt in ausgereiften roten Blutkörperchen (Erythrozyten), weil deren Zellkern ausgelagert ist.
In Monozyten ist aufgrund des großen Zellkerns analog zum Golgi-Apparat nur wenig Platz für das „ER“ – es stehen auch nur wenige Zeilen zur Verfügung. Das endoplasmatische Retikulum (ER) ist ein Zellorganell, das nur von einer einfachen Biomembran „33“ umgeben ist: Epi.Ref_Rhesus.Z.“4666“2#279568719“33“002“5“. Das ER zeigt zwei unterschiedliche Oberflächen (rER / sER), weil das glatte ER (sER) eine eigene Membran „333“ mit einer Zählgröße „Form=7_11“ für ein Netzwerk bildet: Epi.Ref_Rhesus.Z.“46“82#27861“333“7“11“9585. Die 0 (Null)_6 für ein Röhrennetzwerk kann nur noch in „406“ erkannt werden, die dann im Tausch gegen die „8“ in der Zellen-Nr. 46“8“4 den Kreis=64 erkennen lassen würde. Die Röhre 06 ist nachfolgend ebenfalls in der Doppel-Membran der Kernhülle enthalten. Das glatte „sER“ liegt üblich außerhalb des rauhen „rER“ ohne direkte Nähe zur Kernhülle. Bei einem Monozyt ist aber aus Platzmangel erkennbar, dass aufgrund der lappenartigen Bohnenform das glatte „sER“ im Raum der Kern-Einkerbung des Monozyten liegen kann [http://www.drjastrow.de/WAI/EM/eigeneEM/Blut/Blut15.html; Monocyt - Dr. Jastrows EM Atlas (drjastrow.de) ].
Die Membranen bilden Röhren und Kanäle mit Durchmessern von „50“– 500 nm [siehe: https://www.spektrum.de/lexikon/ernaehrung/endoplasmatisches-reticulum/2475]. Diese „50“ nm werden als geometrische Aussage mit der Zahl „90“ für verschiedene Zwecke kombiniert „8_90_8“. Das ER wird in Abbildungen meist nicht um die gesamte Kernhülle skizziert, sondern meist um 180° oder nur um 90°. Außer dem Kreisumfangswinkel 90° ist damit auch eine lamellenartige Schichtung als 90_90_90 darstellbar: Epi.Ref_Rhesus.Z.“46“69#2793“8“90“8“6398350.
Das ER dient als Calciumspeicher (Calcium=20) „9_20_9“ mit QS 9+2+0+9=20. Nach dieser 1 Zählaktion ergibt die Folgezeile Z.4673 mit QS 4+6+7+3=20: Epi.Ref_Rhesus.Z.“46“72#27“9209“684159652 und Epi.Ref_Rhesus.Z.“46“73#279149934“60“1732.
Im „ER“ finden kotranslationale Glykosylierungsreaktionen statt. Der Zucker=24 wird als Z.QS 4+6+6+8=24 und als Sekretion am rechten Zahlenrand adressiert: Epi.Ref_Rhesus.Z.“4668“#2794489383877“24“. Wasserlösliche Proteine werden durch Sekretion aus dem ER entfernt und Membranproteine werden integriert. Hierzu müssen Signalerkennungspartikel (SRP) an den SRP-Rezeptor in der ER-Membran gebunden werden [siehe: https://www.spektrum.de/lexikon/biologie-kompakt/endoplasmatisches-reticulum/3626 ]. Das Docking-Protein „SRP-Rezeptor (SR, DP)“ ist ein Dimer aus zwei G-Proteinen, einer peripheren α-Protein-Untereinheit und einer integralen β-Untereinheit. Diese Primärstruktur besteht aus 638 + 271 = „909“ Aminosäuren (AS) [siehe: SRP-Rezeptor – Wikipedia]. Dieses besondere ER-Merkmal ist vorhanden. Weiterhin sind für den Transport von Proteinen durch die Kernpore der Kernhülle Hilfsprozesse erforderlich. In der 1. Stufe unterstützt beispielsweise die „Importin-Untereinheit alpha-1“ das Andocken an der Kernhülle. In der 2. Stufe wird eine Kernlokalisierungssequenz (NLS) benötigt, die aus einer kurzen Region basischer Aminosäuren oder 2 solcher Regionen besteht, die etwa 10 Aminosäuren voneinander entfernt sind [siehe: Importin Untereinheit alpha-1 – Wikipedia ]. Mit „10_6_10“ ist dafür ein Symbol enthalten: Epi.Ref_Rhesus.Z.“46“74#27“909“02“10“6“10“5“90“. „Ran“ ist ein G-Protein, das den Import und Export von Proteinen am Zellkern (nukleozytoplasmatischer Transport) reguliert [siehe: Ran - DocCheck Flexikon]. Die Energie wird aus Guanosintriphosphat (GTP) [C10H16N5O14P3=60+16+35+112+45=“268“ Elektronen] gewonnen: Epi.Ref_Rhesus.Z.“46“80#278732402648“268“. Der LDL-Rezeptor (839 AS; siehe Wikipedia) wird im ER synthetisiert und erreicht über den Golgi-Apparat die Oberfläche der Zellmembran, um Nährstoffe aufzunehmen: Epi.Ref_Rhesus.Z.4676#278970“839“263023.
6.8.1) Kernhülle (nuclear membrane) mit Kernporenkomplex (nuclear pore complex)
Das meiste genetische Material ist bei den Eukaryoten im Unterschied zu den Prokaryoten, wie den Bakterien, in einem Zellkern abgegrenzt. Bei der roten Blutkörperchen wird der Kern bei der Reifung abgestoßen. Die Kernhülle trennt das äußere Zytoplasma vom inneren Nucleoplasma und enthält für den Stofftransport Kernporen. Die Kernhülle besteht aus 2 Schichten im Abstand von 10 - 15 nm. Die äußere Membran ist teilweise mit Ribosomen besetzt und geht direkt in das Endoplasmatische Retikulum über. Auf der inneren Kernmembran sitzt zur Stabilisierung eine 20-100 nm dicke Schicht aus Lamininfilamenten. Die Krümmung als Serie Z.“46“xx endet beim Durchgang durch die Kernhülle auf der Eingangsseite. Der Zeilenlauf zieht durch den Zellkern, so dass die Kernhülle dann nochmals einzeilig als Doppelmembran 33_33 mit den 8-eckigen Kernporen „808“ auf der Ausgangsseite erscheint.
Shuttle-Proteine die zwischen Zytoplasma und Nucleoplasma hin und her wandern weisen ein M9-Domäne auf, die aus 38 Aminosäuren (überwiegend Glycin und aromatische Aminosäuren) besteht (siehe: https://www.spektrum.de/lexikon/biologie/kerntransport-von-proteinen/35898 ). Die Kernhülle liegt somit zwischen den zählbaren „38“ AS, wobei auch Glycin (Aminoethansäure) [C2H5NO2 = 6*2+5+7+8*2=“40“ Elektronen] zählbar ist: Im Zytoplasma 38 AS: Epi.Ref_Rhesus.Z.“46“83#27855“38“42492824. Kernhülle von Z.“46“85 #“278“4349294“33“0“62 mit Glycin=40 (zugleich Innendurchmesser der Kernporen von 40 nm) bis Epi.Ref_Rhesus.Z.“46“89#27819“7“40“7“6“33“588. Im Nucleoplasma 38 AS:Epi.Ref_Rhesus.Z.“46“90#2781“38“090489104 und mit markierten Höhe der Kernporen von 80 nm folgt Epi.Ref_Rhesus.Z.“46“91#2“7“80“7“8798634“38“4.
Die 5 Zeilen der Kernhülle enthalten ein 0(Null) für die durchgehenden Kernporen. Die Kernpore wird auf beiden Seiten der Doppelmembran von einem 8-eckigen Ring gebildet. Für das doppelte Oktogon läuft die Serie „paarig=2_Form=7_8“ durch die Kernhülle. Zwischen dem zytoplasmatischen Ring und dem nukleären Ring liegt der Zentralkanal. Auf beiden Ringen sitzen Fasern, die beim nukleären Ring zu einem nukleären Korb (nuclear basket) verbunden sind [Abbildung siehe: Kernpore - DocCheck Flexikon]. In den Zentralkanal ragen Cluster der Aminosäuren Phenylalanin (F) [C9H11NO2=6*9+11+7+8*2=88 Elektronen] und Glycin (G) mit 40 Elektronen als Filter hinein, damit große Moleküle nicht ohne Regulation passieren können. Der Filter wird mit „88“ in der Zeilen-Nr. Z.46“88“ als potentieller Durchgang avisiert [Phenylalanin (F) enthält einen Benzolring]. Die Zeile enthält Glycin=40, um die Zahl 8_QS 4+0+2+2=8 „herauszufiltern“. Erst in der Folgezelle wird die Zahl „88“ als geregelter Durchgang am rechten Zahlenrand päsentiert. Die Kernpore besteht aus rund „500“ Proteinen (Nukleoporine), die ringförmig gestapelt sind: Epi.Ref_Rhesus.Z.“46“88“# 2782567“500“8“40“22“.
Zwischen der plasmaseitigen und der kernseitigen Ringwulst ragen 8 Speichen in den Zentralkanal, die in der Zeilen-Nr. Z.4“686“ markiert sind, wobei mit „6_6“ bereits der zentrale Stecker (Plug) avisiert wird. Diese 8 Speichen-Kanäle ziehen sich als Struktur „55“ durch die Porenwand, so dass Wasser (H2O=2+8=“10“) ungehindert passieren kann [siehe: Kernporenkomplex - Lexikon der Biologie (spektrum.de)]. Gleichzeitig sind damit auch „10“ nm für die Spaltbreite zwischen beiden Membranen adressiert (siehe: Kernmembran - DocCheck Flexikon): Epi.Ref_Rhesus.Z.“46“8“6#27837“55“10“967541. Erwartungsgemäß wird der zentrale Stecker (Plug) als Pin=11_7=Form_66=flexibel gebildet. Dieses Zentralgranulum dient dem Transport von Makromolekülen und wird auch als „Transporter“ „78_78“ bezeichnet: Epi.Ref_Rhesus.Z.“46“87“#2“78“316“11“78“5“66“02.
Nach der Passage des Zellkerns wird ausgangsseitig wieder die Kernhülle als Doppelschicht 33_33 mit den Kernporen 808 durchquert: Epi.Ref_Rhesus.Z.4725#276077“808“33“7“33“2. Innenseitig werden dabei die im Nucleoplasma verankerten korbförmigen Filamente (nuclear basket) passiert. Der Korbring wird aufgrund einer Additionsaufgabe gebildet. Aus der Form-Spiegelung 761_716 wird die Ziffer „1“ als Zählgröße aktiviert. Im Ergebnis wird mit 6_QS 1+3=4_6 als 64_6=flexibel ein regelbarer Korb-Kreis an der Kernpore gebildet: Epi.Ref_Rhesus.Z.47“24“#2“761“36“24“98“716“97.
6.8.2) Kernplasma (Nucleoplasma / nuclear plasm/ Karyoplasma)
6.8.2.1) Chromatin: Das Kernplasma ist der gesamte Zellkerninhalt mit den Hauptbestandteilen Wasser, Chromatin und Nucleoli. Chromatin ist das Material der Chromosomen und besteht aus der Erbsubstanz DNA und speziellen Proteinen (u.a. Histone). Die Chromatinfäden (chromatin fibers) füllen das Kernplasma aus. Zur Mikroskopie kann das Chromatin durch Kernfarbstoffe angefärbt werden [griech. Chroma=Farbe]. Die DNA kann nicht speziell gefunden werden, weil kein spezielles Lebewesen betroffen ist. Allgemein kann 1 Referenzzeile ausgewählt werden, deren Kettenreaktion die DNA abgewickelt. Die DNA bildet Gen-Abschnitte aus jeweils 4 Basen, die durch eine phosphorhaltige Rückenstütze verbunden sind. Die DNA wird somit mittels der Zeilennummer als Serie Z.“Basenanzahl=4_QS 6+9=15=Phosphor_x“ adressiert. In den Zeilen folgen dann Verpackungsinformationen. Der Chromatinfaden hat einen Durchmesser von 30 nm und setzt sich aus kleinen Verpackungseinheiten (Nukleosom) zusammen. Das Nukleosom ist ein Oktamer aus 8 Histonen, um die der DNA-Strang (linksgängige Superhelix) mit ca. 1,65...1,75 Wicklungen umwickelt ist. Diese entspricht 146 - 147 Basenpaaren [Siehe: Nukleosom – Wikipedia]. Zwischen den Nukleosomen liegen kurze DNA-Abschnitte. Im Desoxyribonucleoprotein-Komplex werden die langen chromosomalen DNA-Stränge in ihrer Länge um das rund 10.000- bis 50.000-fache verkürzt (kondensiert), so dass sie in den Zellkern passen [siehe: Chromatin – Wikipedia]. Die Länge der DNA verkürzt sich im Histon-Komplex aufgrund der Windung von 68 nm auf ca. „10“ nm. Die Zahl „38“ (AS) wurde bereits für die M9-Domäne eines Shuttle-Proteins vorab adressiert: Epi.Ref_Rhesus.Z.“4“69“0“#2781“38“090489“10“4.
Die Histone liegen doppelt vor. Entsprechend werden 4 Kern-Histon-Proteine (je zwei H2A, H2B, H3, H4) benötigt. Die Wicklung wird durch ein stabförmiges Verbindungshiston „Histon H1“ (193 Aminosäuren (mit Varianten von 206 bis 225 AS) mit 2 Kontaktstellen als Ring zusammengefügt. H2A, H2B, H3 und H4 bestehen aus einer globulären Hauptdomäne und einem langen N-terminalen Ende. Die Histone H3 und H4 bilden ein symmetrisches Heterotetramer. Mit diesem Tetramer von (H3)2(H4)2 interagieren jeweils zwei Dimere der Histone H2A-H2B. Für die Kugelform der 8 Histone als Serie #27“8“0“... liegen nur 2 Zeilen vor. Das Tetramer 3„4“3 als paarig=2 und Dimer 78_0_78 mit langen Stück Stickstoff=7_9=seitlich sowie Bezugsachse=84: Epi.Ref_Rhesus.Z.“4“69“1“#“2“78078“79“863“4“3“84“. Ein Dimer ist als 532_532, paarig=2 vorhanden. Es können 2 Verbindungspunkte „53“ gezählt werden. Als Verbindung muss aber die Ziffer 3 zählbar sein um 19(5)3 als 193 AS zu zählen. Hierzu ist die Addition QS 2+7+8+0+1+9+5+3+2+0+5+3+2+6+0=53 geeignet. Das wäre zutreffend, wenn der Kontakt nicht am Tetramer erfolgt: Epi.Ref_Rhesus.Z.“4“69“2“#“ „2“780“19“532“0“532“60. Die Serie geht als Wicklung #2“77“... weiter.
Die Histone H3 und H4 besitzen lange Molekülschwänze, die modifiziert werden können. Es werden 4 Arten der Modifikation (me: Methyl, P: Phosphat, Ac: Acetyl, Ub: Ubiquitin) unterschieden [siehe: Histonmodifikation – Wikipedia]. Alternativ enthalten Abbildungen für jedes der 8 Kernhistone je 1 Molekülschwanz „1“ 8-fach „181“ gezählt [siehe: https://www.researchgate.net/figure/The-histone-code-Nucleosomes-are-the-fundamental-unit-of-chromatin-and-consist-of-an_fig2_255688242]: Epi.Ref_Rhesus.Z.4“69“6#2“777“82718141801. Zur Modifikation ist das Protein Ubiquitin mit 76 Aminosäuren (AS) in den folgenden 3 Zeilen und nochmals komplett als Serie im Kernkörperchen (Nucleolus) enthalten. Zur Signalisierung ist der Botenstoff TNF-alpha mit 235 Aminosäuren adressiert. Die Zahl „86“ wurde als Bixnom-Token-86 zur Signalisierung bei der Insektenverdauung verwendet. Kann sich um einen Stoff mit 86 AS handeln? Der Verdauungsorganexpansionsfaktor (Def) ist ein nukleoläres Protein. Ein 86-Aminosäuren-Motiv in CAPN3 ist essentiell für die Bildung des nukleolus-lokalisierten Def-CAPN3-Komplexes [siehe: „An 86 amino acids motif in CAPN3 is essential for formation of the nucleolus-localized Def-CAPN3 complex“; F.Ding u.a. / Epub 2022 Jul 19; DOI: 10.1016/j.bbrc.2022.06.032]: Epi.Ref_Rhesus.Z.4“69“7#2“777“235“7“76“86“5“86“. Mit dem Nukleosom als Bixnom-Kreis=“64“ muss die Evolution 146 bzw. 147 Basenpaare / Nucleosom in „1_Wickelform=07“_“46“oder “47“ abzählen. Dabei besteht „1“ Nucleosom aus 8 Histonen: Epi.Ref_Rhesus.Z.4“69“4#2“77“90“1“07“46“47“1“8“7. Die Kondensation auf 1/50000 erfolgt mit der Zählgröße Z.QS 4+7+0+0=11. Am rechten Zahlenrand als Bruchzahl herausgeschoben stehen „50“. Die Zeile enthält eine weitere Null, so dass mit den beiden Nullen der Zeilennummer „50000“ zählbar sind: Epi.Ref_Rhesus.Z.“47“00“#2“775“463“0“73178“50“. Eine mögliche Referenzzeile für eine DNA-Kettenreaktion ist abschließend als Netzwerk-Gruppe „444“ vorhanden: Epi.Ref_Rhesus.Z.4706#277192“444“622587.
6.8.2.2) Kernkörperchen (Nucleolus): Das Kernkörperchen ist ein kugelförmiger Bereich, der ohne eine Membranhülle die Bestandteile DNA, RNA [mRNA / messenger RN], Proteine und Enzyme enthält und bei der Synthese von Ribosomen mitwirkt. Bei Tieren ist 1 Nukleolus typisch, aber bis 3 Nucleoli sind möglich - bei Pflanzen 10. Aufgrund der ggf. gelappten Nieren- bzw. C-Form der Monozyten sind 3 Nucleoli vermutlich zweckmäßig, um auf eine Seitenwahl verzichten zu können. Drei Nucleoli zählen sich als Kreis=0_QS 7+4=11=Zählgröße_Anzahl=3_55=Struktur. Mit „07_070“ sind dafür 3 Kugelzonen „O“ vorhanden. Die Zählung wird durch QS 2+7+6+7+8+“0“+7+4+3+5+5+9+“0“+7+“0“=70 unterstützt. Diese Zeile liegt zwischen 2 Zeilen die mit „666“ jeweils die Lappenform adressieren, so dass „7_6_7“ die Mitte symbolisiert. Mit der Ergänzung 8“07“4 liegt 1 Nucleoli „0_7=Form“ in der Bixnom-Schwerachse „84“: Epi.Ref_Rhesus.Z.4712#276839483105“666“, Epi.Ref_Rhesus.Z.4713#2“7678074“355“9“070“ und Epi.Ref_Rhesus.Z.4715#27“666“3339213976.
Die Struktur des Kernkörperchen (Nucleolus) setzt sich aus 2 Gruppen-44 zusammen. Mit Z.4“707“ ist eine Form-Kugel „707“ vorhanden, die das Kernkörperchen (Nucleolus) „555=Struktur“ mit „33_33“ die beiden Anteile „Pars fibrosa“ und „Pars granulosa“ bildet: Epi.Ref_Rhesus.Z.4707#2771“33“555“214“33“9.
1.) Pars fibrosa „44“: Die rundlichen, 5 – 8 nm größen Filamente der „Pars fibrosa“ transkribieren die ribosomale Ribonukleinsäure [Ribosomal ribonucleic acid (rRNA)] zu ribosomalen Proteinen. Das Merkmal eines faserartigen Filamentes liefert Z.4_7_11=Zählgröße und die Serie Z.47_“1“=Faser_x: Epi.Ref_Rhesus.Z.4711#27689824758“9“44“9“. Die Festsetzung zur Anzahl der Nucleoli fällt in diesen Zeilenbereich. Der Filament-Durchmesser von 8 nm ist markiert als 3_8_3 und „rund“ als „604“: Epi.Ref_Rhesus.Z.4716#276“604“674“383“77“8“.
2.) Pars granulosa „44“: Die gekörnten Partikel von 15-20 nm der „Pars granulosa“ kombinieren ribosomale Proteine mit rRNA [siehe: Nucleolus: Definition, Aufbau & Funktion | StudySmarter ]: Epi.Ref_Rhesus.Z.4717#27654603“44“27368. Durchmesser 20 nm als „20_7=Form“: Epi.Ref_Rhesus.Z.4722#276253“20“7“199046.
Um Fremdkörper zu verschlingen muss die Immunzelle mit der Zellmembran eine spezialisierte Vakuole als Umhüllung bilden. Dieses Phagosom bildet zusammen mit den im Lysosom verfügbaren Verdauungsenzymen ein Phagolysosom. Gegen die Selbstverdauung schützt ein besonderer ph-Wert, der über eine Protonenpumpe geschaffen wird. Damit sich die Zellmembran schlauchartig zu einem Phagozytenbecher ausbuchten kann, wird die Zählung der 11x „33“ von einer selbst-startenden Kettenreaktion einer Schlauchgruppe-44 begleitet. Der fingerartige Schlauch „111“ wird als Membran „33“ gesondert mit der Zeilen-Nr.47“33“ adressiert, und dann über 111 Zeilen gezählt. Die Ausstülpungen mit einem Vorschub der Zellmembran werden als Lamellipodien bezeichnet, sofern diese eher flach und breit angelegt sind. Ragen die Ausstülpungen dagegen fingerförmig heraus, handelt es sich um Filopodien. Der Fremdkörper wird nach dem Schlüssel-Schloss-Prinzip=56 erkannt. Dieser Bereich enthält zugleich die „33_Nr.11“. Mit „09_48“ wird bereits der sich wieder zurückziehenden Schlauch als eine Spiegelung avisiert. Der Zeilenlauf kann zwar nicht zurück in die Vergangenheit, aber es werden sich 2 Zeilen finden, die statt „09“ eine Drehung 2x 90° bewirken, so dass aus „48“ nach Spiegelung die Schwerachse „84“ für ein Gleichgewicht vorhanden ist. Diese beiden Dreh-Zeilen müssen die Membran „33“ adressieren: Zeile 1 der Kettenreaktion: Epi.Ref_Rhesus.Z.4730#27“56“111“650948“44“.
Die Zweite-90°-Drehung ist insgesamt eine 180°-Wende, so dass die Zellmembran als letzte Zählung wieder als Kugel=64_33_Nr.11 geschlossen ist. Die 90° ist noch in „3303“ mit 3+3+3=9-0 versteckt, weil die 180°-Wende erst noch folgt: Zeile 100 (von 111) der Kettenreaktion: Epi.Ref_Rhesus.Z.4832#2699“6433“0379531. Die Zellmembran wird in der Zeilen-Nr. Z.48“33“ adressiert und die 180°-Wende als QS 9+9=18_0. Sowie das hergestellte Gleichgewicht als Schwerachse=84. Die Wende „Form=7_18_QS 3+8=11_81_7=Form“ als Spiegelung durchgezählt: Zeile 101 (von 111) der Kettenreaktion: Epi.Ref_Rhesus.Z.48“33“#26“990“84“7183817“4. Die klassische Kugel “505“ als Struktur=55_15=Phosphor_505“ kann nunmehr als Phagosom innerhalb der Zelle als letzte Zählung=11 interpretiert werden: Zeile 111 (von 111) der Kettenreaktion: Epi.Ref_Rhesus.Z.4843#26935“11“55150“505“.
Über den Zeilenlauf der 111 Zeilen kann nach Rezeptoren auf der Oberfläche der Monozyten gesucht werden, wie CD14, CD86, CD16, Toll-like-Rezeptoren (TLR2 und TLR4)
Die Rezeptoren werden durch Fremdstoffe (bakterielle Zellwände, bakterielle Lipoproteine oder Antigen-gebundene Antikörper) aktiviert, wodurch der Signalweg ins Zellinnere eröffnet wird. Es werden entzündungsauslösende Stoffe (u.a. Interleukin 1β, Interleukin 6, Tumor-Nekrose-Faktor) hergestellt [siehe: Monozyt (bionity.com)]. Phagozyten [Monozyten / Makrophagen; Granulozyten; Dendritische Zellen] nehmen Erreger auf und verdauen sie in ihrem Zellinneren als Immunantwort. Von Erregern geschwächte Zellen sind oft an einer veränderten Oberfläche zu erkennen oder es zeigen sich Knospen von Viren, die mit Antikörpern markiert werden können. Über Signalwege wird ein kontrollierter Zelltod (Apoptose / apoptosis) eingeleitet. Im Gegensatz zur Nekrose wird kein Zellplasma freigesetzt. Merkmale für die Apoptose sind u.a. Schrumpfung der Zelle, blasenförmige Ausbuchtungen an der Zelloberfläche (Zeiosis), Fagmentierung in membranumhüllte Teilstücke, Phospholipids „Phosphatidylserin“ an der Zelloberfläche und Abbau der Mitochondrien unter Freisetzung von Cytochrom c [siehe: Apoptose - DocCheck Flexikon]. Cytochrom c besteht aus 104 Aminosäuren; enthalten sind Häm c und ein zentrales Eisenion. Das Phosphatidylserin [C13H24NO10P=204 Elektronen] hält das Enzym „Flippase“ auf der inneren Schicht der Doppelmembran, erscheint es dagegen auf der Außenschicht der Zellmembran, dient es den Makrophagen als Signal zur Phagozytose [siehe: Phosphatidylserine | C13H24NO10P | ChemSpider]. Das Enzym „Scramblase“ bewirkt den schnellen Austausch zwischen beiden Membranschichten
Ob die Zellmembran des Phagosoms tatsächlich aus der Einbuchtung der Zellmembran besteht, wird gegensätzlich mit Alternativen diskutiert [siehe: The nature of the phagosomal membrane: endoplasmic reticulum versus plasmalemma - PubMed (nih.gov); N. Touret/ J Leukoc Biol; Epub 2005 Feb 23/ doi: 10.1189/jlb.1104630. Die Folgezeile bildet eine noch unbekannte Gruppe - benötigt wird das „Lysosom“. Lysosomen sind kugelförmige Bläschen, die von einer Membran umschlossen sind. Sie enthalten hydrolytische Enzyme und Phosphatasen. Wasser ist als H2O=2+8=10 und Phosphor=15 in der Folgezeilen enthalten: Epi.Ref_Rhesus.Z.48“44“#26929“55500400“28“ und Epi.Ref_Rhesus.Z.4845#269239967883“15“7 sowie Membran „33“ Epi.Ref_Rhesus.Z.4848#26907“33“58992140.
Um aus Phagosom (48xx) und Lysomsom (xx84) durch Fusion ein gemeinsames Volumen als „Phagolysosom“ Z.“48“84“ zu bilden, ist eine Form=7 erforderlich. Es werden toxische Stoffe wie Chlor=17 für die hypochlorämischer Säure (HOCl) benötigt: Epi.Ref_Rhesus.Z.4884#2670900“17“27966“7“. Zu diesem Zweck mussten sich die beiden Membranen [33+33] bereits zuvor zusammenschließen. Form=7_“3“ gespiegelt QS 5+2=7“3“_“33“. Der Sauerstoff=8 zieht sich als Serie Z.88xx durch die Zeilennummer bis er verbraucht ist. Das Merkmal für ein „Phagolysosom“ ist die Freisetzung von Sauerstoffradikalen (oxidative Burst) durch stufenweise Reduktion von molekularem Sauerstoff. Hierbei wird ein freies Elektron durch die NADPH-Oxidase und Cytochrom b, bestehend aus 350 Aminosäuren, auf molekularen Sauerstoff=8 übertragen. Das entstehende O2− reagiert unter anderem mit H2O zu H2O2 und weiter, katalysiert durch die Myeloperoxidase, mit Cl− zu hypochlorämischer Säure (HOCl). Zusätzlich entstehen OH-Radikale und Singlet-Sauerstoff O=O bzw. O2, die für Bakterien toxisch sind [siehe: Oxidativer Burst | SpringerLink; First Online: 01 January 2019]: Epi.Ref_Rhesus.Z.4“88“0#26“73“08943“52333“9. Cytochrom b „380“ AS (siehe: Cytochrom b – Wikipedia): Epi.Ref_Rhesus.Z.4“8“97#266“380“977005084. Der Sauerstoff=8 fehlt in der Zeilennummer und ist als O=O mit „88“ sowie Chlor=17 toxisch enthalten. Die nutzbaren Stoffe diffundieren durch die Membran. Das Phagolysosom enthält nur noch die Reststoffe „999“ am Zahlentand. Zugleich beginnt in der Zeilen-Nr. eine Bläschen-Serie Z.49“0“0, um die Reststoffe mittels einer Exozytose (Excozytosis) aus der Zelle zu transportieren. Das Bläschen für die Reststoffverpackung wird vom Golgi-Apparat geliefert: Epi.Ref_Rhesus.Z.4900#2“66“21788“66“10“999“. Das Transportvesikel wird als „Exosom“ bezeichnet. Die Reststoffe „999“ werden als 99_797=Form von einer Membran „33“ verpackt, die in der Zeilen-Nr. Z.QS 4+9=1“3_0_3“ lesbar ist: Epi.Ref_Rhesus.Z.4903#266054“995797“246. Volumen des sekretorischen Vesikels „Exosom“ einer Verschiebung 26_206 in Richtung der äußeren Zellmembran: Epi.Ref_Rhesus.Z.4904#“26“60007“43147“206“. Mittels „konstitutiver Exozytose“ wird ein Partikelstrom „11“44“7117“ automatisch ohne äußere Reize aus der Zelle bewegt. Epi.Ref_Rhesus.Z.4909#2657298“11447117“. Bei einer „stimulierten Exozytose“ ist ein Reiz zur Ausschüttung notwendig. Für die Reizeinleitung über Rezeptoren ist in den folgenden 3 Zeilen das Schlüssel-Schloss-Prinzip=56 enthalten. Aktin = 375 Aminosäuren vermittelt das Öffnen und Schließen der Poren, ist aber nicht passend vorhanden. Die Aktinfilamente sind in einer Doppelspirale angeordnet, die von einem aktinbindendes Protein „Tropomyosin“ mit 2 Fäden 284 + 284 = 568 Aminosäuren durchzogen wird [siehe: Aktin, Myosin und ein Sarkomer (ruhr-uni-bochum.de)]. Der„Tropomyosin-Einzelfaden=284 AS fehlt zunächst ebenfalls. Wegen der Zeilen-Nr. Z.49“11“=Zählgröße kann aufgrund der zweckdienlichen Markierung der Ziffer „2“ durch eine Membran „33“ als „3“2“3_84“ das Tropomyosin als „284“ in einer Schaltfunktion erkannt werden: Epi.Ref_Rhesus.Z.49“11“#26“56“2159“3“2“3“84“23. In der Zellmembran sind becherförmige Strukturen „Porosomen“ angeordnet, an denen sekretorische Vesikel vorübergehend verschmelzen, um Zellinhalte nach außen abzusondern. Die Porosomen enthalten viele verschiedene Arten von Proteinen, insbesondere Chlorid- und Calciumkanäle, Aktin und SNARE-Proteine, die das Andocken und die Fusion der Vesikel mit der Zellmembran vermitteln. Ein „Porosom“ kann aufgrund der Becherform mit der Gegenkrümmung=46 und einem Kreisvolumen=6“00“4 adressiert: Epi.Ref_Rhesus.Z.4919#265189“6004“053“46“. Nachfolgend entsteht vorübergehend aufgrund der Fusion eine vergrößerte Volumenform: Epi.Ref_Rhesus.Z.4920#265135“700080060“. Zwischen dem becherförmigen Porosom und dem angedockten sekretorischen Vesikel bildet sich Ausschüttung der Reststoffe eine ringförmige Fusionspore (SNARE-Rosette) [siehe: Porosom (wikibrief.org)]. Diese ist jedoch nicht ersichtlich. Der Durchmesser der Fusionspore steht mit Krümmung des angedockten Vesikels in einer Beziehung. Für den Vesikel-Durchmesser von 50 nm als „QS 2+6=8_50_Extra=8_1=Zählgröße_8“ ergibt die Folgezeile den Durchmesser der Fusionspore, wenn die „650“ nach der Abtrennung von 50 nm nunmehr als 6,5 nm_O=Durchmesser der Fusionspore gelesen werden, d.h. für einen realen Durchmesser der Rosette von 6-7 nm wurde mit 6,5 nm eine Kommastelle kreiert [siehe: ‘Porosome’ discovered nearly 20 years ago provides molecular insights into the kiss‐and‐run mechanism of cell secretion - Jena - 2015 - Journal of Cellular and Molecular Medicine - Wiley Online Library; /B. P. Jena /Mai 2015/ https://doi.org/10.1111/jcmm.12598.]: Epi.Ref_Rhesus.Z.4921#“26“50“818“21661“0“23 und Epi.Ref_Rhesus.Z.4922#2“6“5“0“279“65“1“34“88“3. Für die Ausschüttung in das Porosom steht eine Serie #2“64“ für die Krümmung des Bechers zur Verfügung, und zwar von Epi.Ref_Rhesus.Z.4923#2“64“974130488299 bis Epi.Ref_Rhesus.Z.4941#2“64“0088“33“109471. Die Chlorid- und Calcium-Kanäle werden als Kanal=707=Form und Calcium=20 / Chlor=17 in einer Zeile adressiert [siehe: Porosome - Wikipedia]: Epi.Ref_Rhesus.Z.4924#2“64“9“20“3“17“707“940. Aktin ist mit dem enthaltenen Einzelfaden des Tropomyosin 568 AS / 2 = 284 AS jetzt lesbar. Epi.Ref_Rhesus.Z.4928#264705“284“982528. Das zumindest teilweise entleerte Transport-Vesikel löst sich wieder, so dass die Fusionspore (Rosette) mit „333“ wieder verschlossen wird: Epi.Ref_Rhesus.Z.4928#264651581333718. Das Transport-Vesikel kann bis zur vollständigen Entleerung wiederholt andocken.
Die Monozyten gehen aus Vorläuferzellen im Knochenmark und aus Promozyten hervor. Zusammen mit den Makrophagen entsteht das Mononukleäre Phagozytensystem (MPS). Andere Arten von Fresszellen (Phagozyten) wie dendritische Zellen (DC) [Dendritische Zelle – Wikipedia] und Osteoklasten (Osteoklast – Wikipedia) können aber ebenfalls aus Monozyten hervorgehen. Nach einer vorläufigen Sammlung von zufälligen Hinweisen aufgrund von Aminosäuren, Formgebungen und Funktionen sollte sich schließlich ein erkennbares Gesamtsystem durch den Zeilenlauf ziehen.
6.9.1 Beginn der Differenzierung von Monozyten zu Makrophagen
Das Stadium des Monozyten ist 1 Minute (Zeit=60) vor 72 Stunden Verweilzeit im Blut abgelaufen. Der Monozyt muss ins Gewebe als Makrophage abwandern, weil ansonsten ein Monozyten-Stau durch nachdrängende Monozyten als Krankheit vorläge [siehe: Monozytose – Wikipedia]. Der Monozyt ist als Halbgruppe=22 adressiert, wenn die Gruppe 44 aus Monozyt und Makrophage besteht. Die Umwandlung in der Gruppe 44 ist eine Spiegelung 41_14 mit einer inneren Zählgröße: Epi.Ref_Rhesus.Z.4778#273015“41“3“22“60“14“. Über die 72 Stunden startet eine Serie #2“72“..., so dass nach dem Auslauf der 72 Stunden die Merkmale einer Makrophage vorliegen. Enthalten sind die Bixnom-Schwerachse zur Orientierung und QS=2+7+2+9+5+8+5+0+7+9+2+8+4=68. Makrophagen können sich schlauchartig in die Länge ziehen und die Bewegungsrichtung ändern, indem der Zellkern durch den eigenen Schlauch in die Gegenrichtung wandert. Bei Insekten ist Bixnom-Token-86 der Weg in den Magen und Token-68 das Herauswürgen als Rücktransport: Epi.Ref_Rhesus.Z.4779#2“72“9“58285“0792“84“ Monozyten markieren Krankheitserreger und besitzen alle Voraussetzungen zur Phagozytose, um als Fresszelle im Blut zu wirken. Monozyten werden in der Literatur meist nur als Vorläuferzellen der Gewebsmakrophagen beschrieben und können nur kleine Elemente wie Bakterien verdauen. Es wird daher ein Kriterium vom Übergang Monozyt / Makrophage benötigt, das unmittelbar vor dem Eintritt ins Gewebe einwirkt. Gewählt wird das Protein „Ly-6c“, weil es bei der Makrophage ausgeblendet wird ( Monozyt – Wikipedia ). Ly6c wird von Leukozyten auf der Oberfläche exprimiert und wird von Makrophagen erkannt [siehe: IJMS | Free Full-Text | Understanding the Role of LFA-1 in Leukocyte Adhesion Deficiency Type I (LAD I): Moving towards Inflammation? (mdpi.com): J. Fekadu u.a. ; Int. J. Mol. Sci. 2022, 23(7), 3578; https://doi.org/10.3390/ijms23073578]. Murines (Maus/Ratte) Ly6C besteht aus 131 Aminosäuren. Unreife Ly6C_hi Monozyten werden zu akuten peripheren Entzündungen rekrutiert und entwickeln sich zu Ly6C_+ exudate Makrophagen (exudate=Ausscheidung), während reifere Ly6C_-/lo Monozyten Vorläufer für Gewebemakrophagen und dendritische Zellen sind. [siehe: Anti-Ly6c antibody [ER-MP20] (ab54223) | Abcam]. Folglich ist anzunehmen, dass das Protein „Ly6c“ beim Übergang mathematisch beseitigt sein muss, weil sich der Monozyt nicht selbst verdauen kann. Leider werden die 131 Aminosäuren nicht am rechten Zahlenrand herausgeschoben, sondern nur unlesbar wie auf einer PC-Festplatte stehengelassen. Die Ziffer „1“ führt diese Maskerade als Zählgröße aus. Verknüpft mit der äußeren Schicht der Zellmembran „33_1“ wird eine Monozyten-Makophagen-Gruppe 44 gebildet. Der Wechsel soll erfolgen, wenn die Ziffer „1“ im Tauch mit der 0 (Null) als „0_8=Extra_1“ und nicht die „131“ am rechten Zahlenrand steht. Suche:„031_1“. Als Ersatz für die Ziffer „1“ wird mit „QS 6+9=15=Phosphor“ ein Familienbezug hergestellt. Ly6C ist ein Mitglied der Lymphozyten-Antigen-6 (Ly6)/Urokinase-Typ Plasminogenaktivator-Rezeptor-Superfamilie und ein Glykosylphosphatidylinositol-verankertes Glykoprotein mit undefinierter Funktion“; siehe:
Grenzen | Immunologische Merkmale und transkriptionelle Signalübertragung von Ly6C-Monozyten-Untergruppen aus der Transkriptomanalyse in Kontroll- und hyperhomocysteinämischen Mäusen (frontiersin.org). Die Suchgröße ist damit: „031_69_1“. Weiterhin ist der Botenstoff Tumornekrosefaktor-alpha TNF-α mit 233 (bis 235) Aminosäuren (AS) bei Säugetieren enthalten – 235 nur als Addition 1+1. Der Signalweg wird durch das Interleukin 1-alpha (271 Aminosäuren) aktiviert, das erst direkt vor dem Gewebseintritt in Z.4796 adressiert wird als #271... Weiterhin ist das Protein Ubiquitin mit 76 Aminosäuren (AS) enthalten: Epi.Ref_Rhesus.Z.4790#272“33144“97“69“081“. Der Austausch „1 gegen (0)Null“ wird adressiert „7_1_0_7_0“. Die Gruppe 4-4 teilt sich mit der Zeit=60 und der Zählgröße QS 7+4=11 als „74_60_74“ zwecks Übergang auf eine Makrophage: Epi.Ref_Rhesus.Z.4791#2722“74“60“74“71070“. Die Zeit ist als QS =2+7+2+1+6+0+9+9+4+0+3+1+6+9+1=60=Zeit abgelaufen, so dass Ly6c als „031_69_1“: unsichtbar ist - es entsteht eine Makrophage: Epi.Ref_Rhesus.Z.4793#272160994“031691“. Die Makropage benötigt als Fresszelle für den kontrollierten Zelltod (Apotose) des Gewebes das Cytochrom c mit 104 Aminosäuren und Phosphatidylserin mit „204 Elektronen“. Damit der Makrophage in das dichte Gewebe eindringen kann, muss auf eine günstige Gelegenheit gewartet werden. Das „Warten“ wird über 2 Zeilen als Zählvorgang gezogen: Mit Z.47xx=QS 4+7=11=Zählgröße_94=2*47 wird auf eine Zellteilung als 47_47 im Gewebe gewartet. In Z.4795 beginnt die Zellteilung als „47_47“: Epi.Ref_Rhesus.Z.“4794“#27“2“104“2“22860637 und
Epi.Ref_Rhesus.Z.4795#2“7“204“7“47“5368904. Im Moment der Zellteilung der Gewebszelle verliert diese den Kontakt zu Nachbarzellen und gleichzeitig wird durch die runde Form ein Spalt zum Eindringen der Makrophage erzeugt [siehe: „Cell division in tissues enables macrophage infiltration „ M. Akhmanova u.a. / Science (2022)/ DOI: 10.1126/science.abj0425; Grenzgänger des Immunsystems: Wie T-Zellen durch Wände gehen (vogel.de)]. Der Gewebe-Spalt „1“ wird als Ziel-Struktur „5_1_5“ avisiert: Epi.Ref_Rhesus.Z.4796#“271“9907“515“41680. Die Zellteilung kann durch 2 Bixnom-Kreise „64“ mit Spalt „1“ als „64_1_64“ adressiert werden. Mit der Z.4_7_9=seitlich_7 wird auf die Form=7 hingewiesen. Aufgrund der QS 2+7+1+9+3+4+0+5+1+3+6+4+1+6+4=56 wird die Zelle nur befallen, wenn die Zelle nach dem Schlüssel-Schloss-Prinzip „56“ markiert ist, so dass die Makrophage über den Universalschlüssel=56 verfügt: Epi.Ref_Rhesus.Z.4797#2719340513“64“1“64“.
6.9.2) Dendritische Zellen (DC)
Der Monozyt kann sich statt zur Makrophage auch zu einer dendritischen Zelle entwickeln. Diese Zelle ist ringsum von verzweigten Zellfortsätzen umgeben. Es werden Zellbestandteile aufgenommener Fremdkörper auf der Zelloberfläche als Antigen präsentiert. Die Zelle wandert in den nächsten Lymphknoten ein, wo durch den Kontakt mit T-Zellen eine Immunantwort erfolgt. Auf dendritischen Zellen ist das Oberflächenprotein CD40 (277 Aminosäuren) vorhanden. CD40 bindet an einen Liganden (CD40-L). CD40-L (261 Aminosäuren) ist ein Mitglied der Tumornekrosefaktor-Superfamilie [siehe: „The CD40 antigen and its ligand - PubMed (nih.gov)“; J Banchereau ; Annu Rev Immunol 1994; doi: 10.1146/annurev.iy.12.040194 ]. Ein Ligand ist ein Molekül, das einen Rezeptor als Ziel sucht und an diesem bindet. Diese Bindung ist üblich reversibel. Die Zahl „261“ liegt als Serie für 261 AS vor, so dass eine Zeile ausgewählt werden muss, in der die Bindung an 277 AS als mathematische Aufgabe verpackt ist. Außerdem muss die Membran „33_1“ mit einer Zählgröße „1“ adressiert sein. Enthalten ist CD40-L „261_7=Form“ zusammen mit Wasser „10“ bzw. QS 8+2=10 als Bindung (Ionenbindungen, Wasserstoffbrückenbindungen, Van-der-Waals-Kräfte). Vorhanden sind „297_33_1“. Folglich muss der vordere Anhang „7“ mit der Zahl „9“ ausgetauscht werden, um eine Bindung zu erzeugen. Die Zahl 9 kann gelöscht werden, weil bei der Bindung QS 2+6+1=9 vorhanden ist. Die fehlende Ziffer 7 für 277 AS wird durch QS 3+3+1=7 als Additionsaufgabe auf der Membran „33“ erzeugt: Epi.Ref_Rhesus.Z.4984#“261“7“31068“297“33“1. CD40 wird mit 277 AS adressiert, wobei der Switch „9/7“ mit dem Schlüssel-Schloss-Prinzip 56 als „5“7“6“9“ kombiniert wird: Epi.Ref_Rhesus.Z.5062#2“5769“807“277“6352.
Im Blutplasma zirkuliert ein Transportvesikel (Low-density Lipoprotein (LDL), das Stoffe wie Cholesterin, Vitamine etc. enthält. Im LDL ist das Apolipoprotein B-100 enthalten, das an den LDL-Rezeptor auf der Plasmamembran der Tiere vorhanden ist und dort zur Nährstoffversorgung bindet. Der Rezeptor wird im „ER“ in Z.4676 gebildet und gelangt über den Golgi-Apparat auf die Oberfläche. LDL-Rezeptor des Menschen enthält insgesamt 839 AS (siehe: Wikipedia), jedoch werden nachfolgend abweichend die Domänen adressiert.
Das Transmembran-Glycoprotein „LDL-Rezeptor“ enthält 5 Domänen mit unterschiedlichen Funktionen [siehe. LDL-Rezeptor - Lexikon der Biochemie (spektrum.de)]. Es liegt somit eine unverwechselbare Folge von 5 unterschiedlichen Aminosäureketten im Zeilenlauf für den LDL-Rezeptor vor. Die Zellmembran „33“ wird in der Zeilennummer Z.50“33“ adressiert. Wegen der Doppelmembran wird zur Passage der Nährstoffe eine weitere „33“ benötigt, die sich als Transport der Zählgröße=11_5=Struktur über 3 Zeilen zwecks Addition 11+11+11=33 wiederholt. Die 1. Domäne enthält 292 AS mit einer cysteinreichen Sequenz von 40 Resten, die sich mit Variationen 7-fach wiederholt. Cystein [C3H7NO2S=64 Elektronen] enthält Schwefel=16, aber kein Phosphor=15. Mit 59_59 kann die „59“ ausgeklammert werden, so dass „1(59)6“ lesbar wird. Die Länge der Sequenz zählt sich als 1+5+9+6+2+4+4=31, was inclusive der markierten Ziffer 9 in „292“ zusammen 40 Reste ergibt: Epi.Ref_Rhesus.Z.5033#25918“292“15962“44“. Zur /-fachen Wiederholungen als Serie #259...(QS 2+5+9=16=Schwefel) kann bereits eine vorgelagerte Gruppe „1_7_44“ beginnen ab Epi.Ref_Rhesus.Z.5027#“259“4922706“1744“5.
Die 2. Domäne enthält 350 AS und zwei N-gebundene Kohlenhydratgruppierungen. Die sind vorab als 5+1+1=7=Stickstoff_9=seitlich vorhanden: Epi.Ref_Rhesus.Z.5034#25913143“5119“963 und Epi.Ref_Rhesus.Z.5035#2590799690“9511“3. Es folgen 350 AS:Epi.Ref_Rhesus.Z.5036#25902852“350“9511“. Die 3. Domäne (58 AS) enthält viele Serin- und Threoninbausteine, die O-gebundene Kohlenhydratreste (O=8) tragen. Anzahl 58 AS: Epi.Ref_Rhesus.Z.5037#2“58“977“098“35“098“2. Im Zuge der Nährstoffaufnahme wandert auch der LDL-Rezeptor von der Membran in ein Lysosom im Zellplasma ein, um nach 10 min zum wiederholten Transport zurück in der Membran bereit zu sein. Die Zeit=60 Sekunden ergibt als QS 7+3=10 Minuten im Wechsel 36_63 als Spiegelung. Das Lysosom besitzt nur eine einfache Membran „33“ die in „3_6-6_3“ enthalten ist. Mit 56 AS wird vorab eine 5. Domäne (zytoplasmatische Domäne) avisiert, die für den interzellulären Transport bestimmend ist. Epi.Ref_Rhesus.Z.5038#25892“56“9“3“60“73“63“. Die 4. Domäne ist die Transmembrandomäne des LDL-Rezeptors, die sich durch die Lipid-Doppelschicht der Zellmembran spannt. Diese besteht aus 22 hydrophoben Aminosäurebausteinen an die sich eine cytosolische Domäne mit 50 Aminosäureresten anschließt, um die Wechselwirkung des LDL-Rezeptors mit den „Coated pits“ zu kontrollieren. Coated pits sind Vertiefungen auf der inneren Seite der Zellmembran, die vom Protein Clathrin= 64 Elektronen= Bixnom-Krümmung umgeben sind. Über 2 Zeilen sind 50 AS und 22 AS vorhanden bzw. sind alternativ 25 AS für die 4. Domäne (lt. anderer Quelle) ebenfalls vorhanden. Der LDL-Rezeptor muss nach „24“ Stunden ersetzt werden: Epi.Ref_Rhesus.Z.5039#“25“8874309266“50“1 und Epi.Ref_Rhesus.Z.“50“40“#“25“88“22“945316249. Die 5. Domäne mit 56 AS ist eine zytoplasmatische Domäne, die für den intrazellulären Transport bestimmend ist [LDL-Rezeptor | SpringerLink; Lexikon der Medizinischen Laboratoriumsdiagnostik; Jan 2019]. Epi.Ref_Rhesus.Z.5043#25866897“56“878“64“ und Epi.Ref_Rhesus.Z.5045#258“56“64“30999781.
Die dendritische Zelle ist aufgrund von MHC-Klasse-II-Molekülen auf ihrer Oberfläche befähigt, T-Zellen zu aktivieren. Diese Moleküle werden vom Oberflächenprotein CD74 (296 Aminosäuren), die sogenannte „invariante Kette“ transportiert (siehe: CD74 - DocCheck Flexikon). Aufgrund des kompakten Zentralbereichs kann die Dendritische Zelle bei einer Kugel-Serie #2“64“... erwartet werden. Die äußeren Zellfortsätze können einen weiten Zeilenbereich symbolisieren. Das Oberflächenprotein CD74 „296 AS“ wird dann erst mit der Kugel=0_64 in der Zeilennummer adressiert: Epi.Ref_Rhesus.Z.5“0“64“#257596“296“286314. Die Lymphknoten werden beim Menschen mit der Zählgröße 11 adressiert. Es liegt eine Kombination des Schlüssel-Schloss-Prinzips „56“ vor als „56_Form=7_11=Lymphknoten“:Epi.Ref_Rhesus.Z.5066#25“7“4946001“56“7“11“. Oberflächenmembran „33“: Epi.Ref_Rhesus.Z.5067#257“44“3782197“33“5. Die Kette CD74 kann auf gesteuert sein, indem zunächst nur 295_1=Zählgröße angezeigt wird. Die Ziffer „1“ kann entfernt werden, so dass der Schlüssel=56 lesbar wird. Ersatzweise kommt auf die verschobene Ziffer „5“ nunmehr die Ziffer „3“, die als 39_93 gespiegelt wird. Es folgt der Lymphknoten=11 mit dem Blut=26 in Verbindung als „2116“: Epi.Ref_Rhesus.Z.5073#257“1“39“295“1“6“9307 und Epi.Ref_Rhesus.Z.5074#257088617342“11“6. Eine Immunantwort ist deshalb leicht möglich, weil sich über 20 Zeilen das Schlüssel-Schloss-Prinzip=56 als Serie #256... durchzieht. In 2 Zeilen kann mit 56_56 ein Schlüssel kopiert werden: Epi.Ref_Rhesus.Z.5078#2“56“88610“56“30937 und Epi.Ref_Rhesus.Z.5084#2“56“582935“56“1349.
6.9.3) Osteoklasten
Es werden hexagonal kristallisiertes Hydroxylapatit Ca5(OH)(PO4)3=100+9+[16+32= 48]*3=100+9+48*3=253E. und die Kollagenfasern der Knochenmatrix abgebaut. Im Kollagen besteht jede 3. Aminosäure aus Glycin=C2H5NO2=6*2+5+7+2*8=40E. Weiterhin ist Prolin= C5H9NO2=6*5+9+7+8*2=62E häufig enthalten. Der Suchbereich kann mit dem Nachweis des Knochengewebes „33“ in der Zeilen-Nr. und im Code beginnen: Epi.Ref_Rhesus.Z.51“33“#2541“33“575763471. Weil die Aminosäure Glycin in regelmäßigen Abständen vorliegt, hat sie eine Zählfunktion. Glycin=40 ist in 2 Zeilen 3x enthalten und mit QS 2+5+4=11 als Zählgröße bestimmt: Epi.Ref_Rhesus.Z.5“13“4#“254“0“8407565“13“24 und Epi.Ref_Rhesus.Z.5“13“5#25“40“34594818675. Sofern die Elektronen richtig berechnet wurden, wird nunmehr das kristallisierte Hydroxylapatit mit 253E als Beginn einer Serie #253... adressiert: Epi.Ref_Rhesus.Z.5136#“253“9851“33“254263. Die Kollagenfaser bildet sich, wenn Glycin=40 zusammen mit Prolin=62 als Faser=11=Zählgröße erscheint, wobei mit Z.5“14“1_“14“ noch eine Gruppenbildung 44 verborgen ist: Epi.Ref_Rhesus.Z.5141#“253“738“11“40“62“224.
Zur Resorption des Knochens muss Salzsäure (HCl /Hydrogenchlorid) produziert werden. Salzsäure löst solides Hydroxyapatit [Ca3(PO4)2]3Ca(OH)2] in Kalzium Ca2+ und Wasser H2O. Um die Freisetzung von HCl zu ermöglichen, werden Wasserstoff-Ionen im Inneren der Zellen durch das Enzym Carboanhydrase II erzeugt. Bei der Hydrierung von CO2 [6+8*2=22E] werden Wasserstoff-Ionen und HCO3 [1+6+8*3=“31“ E] produziert. Mittels Chlorid-Bikarbonat-Austauscher in der basolateralen Membran wird das HCO3 gegen Chlorid-Ionen ersetzt [siehe: Einfluss des Transkriptionsfaktors Tal1 auf die Osteoklastogenese durch Regulation von DC-STAMP; N. Courtial; Diss. 2011; Goethe-Uni. Frankfurt am Main; 34 (d-nb.info)].
Das Merkmal Chlor=17 startet als Chlor-Serie Z.x17x mit einer Gruppe-44. Die Produktion von Wasserstoff H2=2 ist markiert in 48“2“48. HCO3=31E ist im Zusammenhang mit Chlor=17 ebenfalls adressiert. Folglich ist ersichtlich, dass die Struktur-5 Markierung (252) CO2=22E adressiert. Mit QS 4+4+0+9=17=Chlor muss lediglich noch die Ziffer „3“ belegt werden, wobei auch die 0(Nullstelle) noch zählbar ist, um Zink=30 zu erkennen. Das Zink-Ion ist das aktive Zentrum für die eigentliche Aktivität des Enzyms [Carboanhydrase - DocCheck Flexikon]. Die Struktur-5 kann das Aktin-Zytoskelett [Cytoskelett – Wikipedia] bilden, mit dem das Zellplasma stabilisiert wird. Die Anzahl der Aminosäuren für Aktin ist nicht zwingend maßgeblich, weil sich 2 gewickelte Fäden aus Tropomyosin mit je 284 AS durchziehen. Diese Wicklung kann auch Zahlen verdrehen / spiegeln und die Dopplung von 2x 284 AS beinhalten „252_48_2_48“: Epi.Ref_Rhesus.Z.5“17“0#“252“31“48“2“48“3“44“09. Das Schlüssel-Schloss-Prinzip=56 ist enthalten, um die Resorption des Knochens hemmen zu können: Epi.Ref_Rhesus.Z.5“17“9#251876“3553“56“999.
Zur Pilzform der Membran „33“ ist eine Bixnom-Krümmung mit Gegenkrümmung „Form=7_464“ erforderlich: Epi.Ref_Rhesus.Z.5184#516“33“41905“7“464“. Die Bixnom-Schwerachse=84 wird adressiert, um nachfolgend als Bezug den Grundriss als Kreis=64 zu formen: Epi.Ref_Rhesus.Z.5185#2515“84“888021966 und Epi.Ref_Rhesus.Z.5185#251536375702“64“1.
Als Protonenpumpe ist als eine Zählgröße=11 vorstellbar, die den Durchgang von Wasserstoff „1“ als Paket „Form=7_3_1“ über 3 Zeilen zeigt, wenn mittig die Biomembran=33 passiert wird und in der 3. Zeile das Paket „731=QS7+3+1=11“ gegenüber der Zählgröße 11 die Seite gewechselt hat: Epi.Ref_Rhesus.Z.5193#25“11“9“731“26“11“958, : Epi.Ref_Rhesus.Z.5194#25“11“489496“33“018 und Epi.Ref_Rhesus.Z.5195#25“11“00605“2“731“2“7.
Die ringförmige Resorbtionmulde (Resorbtionslakune) wird durch die ringförmige Versiegelungzone (Sealing Zone) eingefasst. Dieser Adhäsionsapparat hält zum Knochen einen engen Abstand vom 0,3 - 0,5 nm. Der Durchmesser von 100µm bildet die Abmessung des Osteoklasten. Diese Abstandsscheibe wird als Tangens aus beiden Maßen zusammengesetzt. Die Zahl „100“3“ in „nm“ erfordert zur Lesart Osteoklast-Durchmesser=100µm eine Vergrößerung um „3“ Nullen. Gleichzeitig würde der Haftabstand von 0,3nm erfordern, dass die Zahl „3“ um 1/10 reduziert wird. Als Bilanz werden nur 2 Nullen benötigt, die am rechten Zahlenrand „00“ überschüssig sind: Epi.Ref_Rhesus.Z.5197#25“100“3“9723675“00“.
Der Zellkern muss von einer Kernhülle als Doppelschicht „33“ umgeben sein. Zwischen den 4 Membran-Zeilen kann der Zellkern in der klassischen Struktur „2_Kern=505_Form=7_00“ kombiniert mit der maximalen Kernanzahl=25 zwischen 2 Membran-Doppelschichten „33“ mit 1 Zeile erkannt werden: Z.5200 und Z.5205 / Kern in Z.5206 / Z.5207 und Z.5209. Die gewöhnliche Anzahl bis 10 Kerne ist ebenfalls enthalten: Epi.Ref_Rhesus.Z.5206#“2505“700“43“10“2938.
Salzsäure wird mit Chlor=17 in der Zeilen-Nr. und dem Code adressiert. Für die Produktion Wasserstoff-Ionen im Zellplasma ist Carboanhydrase II mit dem Kofaktor Zink=30 enthalten: Epi.Ref_Rhesus.Z.52“17“#25004“17“18“30“4370. Das saure Milieu wird unter dem Bürstensaum auf der Knochenoberfläche geschaffen. Der Bürstensaum wird an der Kontaktfläche zum Knochen gefaltet. Ein gefaltetes Einzelelement wird zunächst aus „667“ wie Membran (33+33=)66_7=Form gebildet: Epi.Ref_Rhesus.Z.52“24“#249“70“667“00600“87. Als Zählgröße einer Bürstenform ist 111 üblich, wobei die Einzelelement 9“1“9 mit der Schwerachse „84“ enthalten sind, damit die Bürsten senkrecht über der Knochenoberfläche stehen. Epi.Ref_Rhesus.Z.5226#2496“111“06“84“919“6. Die Zellmembran 56_“33“ wird adressiert und das Faltungspaket „667“ kopiert als „667667“: Epi.Ref_Rhesus.Z.5227#249“56“33“52667667. Das Clathrin (1675 AS) ist mit dem Schlüssel-Schloss-Prinzip=56 gekoppelt. Cathrin ist an Einstülpungen der Zellmembran beteiligt [siehe: Clathrin-vermittelte Endozytose – Wikipedia]. Die Zeilen-Nr.Z.QS 5+2+2+8=17=Chlor liefert das saure Milieu für die folgende Knochenmulde: Epi.Ref_Rhesus.Z.“5228“#24951“56“1675“4762. Die Evolution muss sich zu einer unübersehbaren Zeile etwas einfallen lassen, so dass nur die Resorptionlakune (Howship-Lakune) als eine Knochenmulde passend ist. Eine Muldenkrümmung „46_7=Form, seitlich=9 und flexibel=6, ist vorhanden: Epi.Ref_Rhesus.Z.5229#249“46“78“99“0“99999“.
Der PU.1-Transkriptionsfaktor verstärkt die Umwandlung von Makrophagen in Osteoklasten. Er wird von Dexamethason [C22H29FO5=210 Elektronen] und Calcitriol [C27H44O3=230 Elektronen] aktiviert. Die Umwandlung wird alternativ über den RANK-Liganden (RANKL) verstärkt. RANKL ist ein Polypeptid aus 217 Aminosäuren [siehe: RANKL Antikörper (66610-1-Ig) | Proteintech (ptglab.com)]. RANKL ist aber auch RANKL-Trimers mit 3 unterschiedlichen existent [siehe: Crystal structure of the TRANCE/RANKL cytokine reveals determinants of receptor-ligand specificity - PMC (nih.gov): J.Lam /0kt.2001; J Clin Invest./ doi: 10.1172/JCI13890].
Osteoklasten bremsen das Knochenwachstum und verhindern Wucherungen. Osteoklasten nutzen die Knochen als Zwischenspeicher von Calcium=20 zur Regulation der Calcium-Homöostase. Im Cytoplasma wird dabei die Konzentration von Calcium-Ionen konstant gehalten. Für die Prozesssteuerung werden Hormone benötigt, und zwar Parathormon (Aktivierung, Calciumfreisetzung) und Calcitonin (Inaktivierung, Calciumspeicherung). Die Kommunikation erfolgt über die Schlüsselsubstanz RANK L( receptor activator of nuclear factor kappa B ligand). RANKL wird im Zusammenhang mit einem Köderrezeptor (Decoy-Rezeptor) Osteoprotegerin (OPG), ein Glycoprotein mit 401 Aminosäuren, genannt [siehe: Osteoprotegerin – Wikipedia]. Die Hemmung des Knochenabbaus ist direkt möglich, weil für Calcitonin ein Rezeptor vorhanden ist. Für die Wirkung des Parathormons ist kein Rezeptor vorhanden, so dass die Gegenspieler der Osteoklasten, die Osteoblasten mitwirken, weil sie über einen Rezeptor verfügen. Osteoblasten bilden das Knochengewebe. RANKL (Receptor Activator of NF-κB Ligand) ist ein Protein, das als Ligand für den Transmembranrezeptor RANK fungiert. RANK (Receptor Activator of NF-κB) ist ein Transmembranrezeptor, der den Liganden RANKL bindet und aus „616“ Aminosäuren (AS) besteht [siehe: RANKL - DocCheck Flexikon].
Transmembranrezeptor RANK „616“ AS mit einer Zählgröße „11“ in Zeilen-Nr. und Code. Die Aktivierung des Knochenabbaus wird mit Calcium=20 adressiert. Mit dem Zähler „6_1=Zeilenzähler_6“ liegt das Parathormon (PTH) „6“ Zeilen später vor: Epi.Ref_Rhesus.Z.53“11“#245“616“20“11“66239. Das Parathormon (PTH) ist ein Nebenschilddrüsenhormon und besteht aus 84 Aminosäuren (Präkursor 115 AS). Es wurde festgestellt, dass ein Fragment aus 34 AS am N-terminalen Ende des Moleküls die biologische Wirkung des PTH bestimmt [siehe: Parathormon – Wikipedia].
Die Zellmembran „33“ des Osteoklasten wird nunmehr mit dem Fragment von 34 AS, der Zählgröße 11 von RANK bzw. mit 115 AS als Präkursor von PTH kombiniert. Präkursor-Proteine entstehen in einer inaktiven Form und werden durch spezifische Aktivierungs-Enzyme aktiviert: Epi.Ref_Rhesus.Z.5317#245“33“90“34“115“835. Der Knochenabbau durch PTH=“84“ AS ist nur nach dem Schlüssel-Schloss-Prinzip=“56“ möglich. Für den Abbau von Calcium wird zunächst ein Säurebestandteil QS 0+5+6+0+0+6=17=Chlor adressiert: Epi.Ref_Rhesus.Z.5319#“2452“467“84“0“56“006. Das abgebaute Calcium=20 zeigt sich in der Zeilen-Nr. und im Code. Hierin kann der Bixnom-Token-68 (Herauswürgen der Insekten-Nahrung aus dem Magen als vergleichbare Transportrichtung für einen Knochenabbau gelesen werden [Nahrungsaufnahme wie ein Ca-Speicher umgekehrt mit dem Token-86: Epi.Ref_Rhesus.Z.53“20“#245“20“0“68“50“3“6447.
Die Speicherung von Calcium bzw. die Hemmung des Knochenabbaus wird durch Calcitonin (32 AS) bewirkt, das bei Säugetieren von der Schilddrüsen abgesondert wird. Es besteht aus 32 Amninosäuren (Präkursor: Procalcitonin= 141 AS) [siehe: Calcitonin – Wikipedia]. Calcitonin ist stets vorhanden, weil mit dem Calcium=20 in der Zeilennummer Epi.Ref_Rhesus.Z.53“20“ zugleich das als Serie Z.x32x gestartet wird. Die Hemmung ist folglich möglich, wenn im Code ein „Calcitonin-Rezeptor“ adressiert wird. Dieses Protein ist momentan nicht bekannt. Nach der Bindung an Rezeptoren der Zellmembran wird der Signalstoff „cAMP“ aktiviert [siehe: Calcitonin - Lexikon der Biologie (spektrum.de)]. „cAMP“= C10H12N5O6P=6*10+12+7*5+8*6+15=170. Der Signalstoff cAMP=170 Elektronen ist direkt an das zu speichernde Calcium=20 gekoppelt. Die Speicherung ist hier wie den Weg in den Magen mit dem Token-86 zu lesen. Der Osteoklast existiert zwar, wird aber in dieser Signalphase beim Calciumabbau gehemmt: Epi.Ref_Rhesus.Z.5343#244145“170“20“2“86“3.
Schaumzellen entstehen, wenn Makrophagen viele Fetttropfen (Lipidtropfen) speichern. Der Kern des Lipidtropfens ist von einem Kern aus Phospholipiden umgeben, in dem Proteine eingelagert sind. Im Gewebe der Blutgefäße kommt es durch atherosklerotischen Plaques zur Verkalkung (siehe: Schaumzelle - DocCheck Flexikon). Von außen nach bestehen Arterien/Venen aus 3 Schichten [Tunica adventitia (Externa), Tunica media und Tunica intima]. Schaumzellen entstehen in den Schichten Intima und Media der Gefäßwände. In der Media (Subendothelium) entwickeln sich die eingewanderten Monozyten zu Makrophagen (siehe: Schaumzelle – Wikipedia).
Das Ende der Osteokasten wird in die Bildung der Schaumzellen übergehen. Diese Struktur-55 könnte eine Gruppe-44 bilden, die direkt im Gewebe „33“ als „3443“ platziert wird und als Z.“55“00“=Schaum“ enthält: Epi.Ref_Rhesus.Z.55“00“#237175935“3443“45.
Die Umwandlung von Makrophagen in Schaumzellen ist auf die übermäßige Aufnahme cholesterinreicher Partikel durch Scavenger-Rezeptoren wie Macrosialin / CD68 (354 AS) zurückzuführen. Ein Forschungsansatz zur Therapie ist ein „fusioniertes Protein CD68-Fc“ mit einer Hemmungsfunktion [siehe: Inhibition of foam cell formation using a soluble CD68-Fc fusion protein - PubMed (nih.gov); K. Daub/ Mai 2010/ DOI: 10.1007/s00109-010-0629-y]. Macrosialin (354 AS) bindet an oxidiertes LDL-Cholesterin (Low Density Lipoprotein), das Makrophagen anlockt (siehe: Macrosialin – Wikipedia): Epi.Ref_Rhesus.Z.5540#2“354“634“73717“31“; Epi.Ref_Rhesus.Z.5541#2“354“20“978955765 und Epi.Ref_Rhesus.Z.5543#235“33“60“354“30975. In der extrazellulären Domäne von CD68 zeigt die Abbildung fingerartig 4 phoshorhaltige Cysteine, wobei zwischen ½ und ¾ jeweils eine Disulfidbrücke vorhanden ist [CD68/Macrosialin: nicht nur ein histochemischer Marker | Laboruntersuchung (nature.com); W. Bobryschew u.a. / Lab Invest 97, 4–13 (2017). https://doi.org/10.1038/labinvest.2016.116]. Das Merkmal Schwefel=16 ist in der Zeilen-Nr. Z.5“56“0 mit dem Schlüssel-Schloss-Prinzip verbunden. 1. Brücke als Spiegelung Z.x56x_65 von „1“ zu „2“ und 2. Brücke als Spiegelung: 46_64 zwischen „3“ und „4“. Nur weil der Abstand der Finger mit 36-37 AS bekannt ist, kann man die merkwürdige Rechenweise für 36,5 AS lesen:„3(4)6“ zeigt „4“ Finger im Abstand von 36 AS. Die 46 verweist auf das Anhängsel „0(46)5“, so dass die „0“ eine Kommastelle als 36,5 AS bewirkt: Epi.Ref_Rhesus.Z.5“56“0#23“46“16“4“8280“4“65“8.
Im PSE folgt nach dem Chlor=17 das Edelgas Argon=18. Argon Z.5+5+6+2= 18. Argon wird in der Laborpraxis verwendet, um Luft zu verdrängen, damit die Oxidation des LDL-Cholesterins (Low Density Lipoprotein) zu oxLDL verhindert wird. Bei einer Oxidation werden Makrophagen angelockt. Das oxidierte LDL-Cholesterin (oxLDL) wird aufgenommen und es entstehen Schaumzellen im Krankheitsbild der Arteriosklerose. Als mögliche Zählgröße 118_33 wird die „11“ später im Zeilenlauf 18x durchgezählt um einen Bereich abzustecken: Epi.Ref_Rhesus.Z.5562#234532“1“18“7“33“17“1.
Für eine Gewebenetzwerk 3_444_(3) fehlt eine Ziffer 3, die als vorhandene Zählgröße „311“ noch entwickelt werden muss: Epi.Ref_Rhesus.Z.5564#2“3444“7815“311“628. Die Makrophagen bilden Kollagenfasern und verdicken dadurch die innere Schicht (Tunica intima) der Blut- und Lymphgefäße. Ältere Schaumzellen sterben ab und setzen Cholesterinkristalle frei, was zur Einlagerung von Kalk in der Gefäßwand führt [siehe: Arteriosklerose - Klinische Metalltoxikologie (metallausleitung.de)]. Calcium=20 ist vorhanden: Epi.Ref_Rhesus.Z.5572#234“111“20“6“818“7“18“. Die Blutgefäße ziehen sich nunmehr als Membran-Serie #2“33“... weiter: Epi.Ref_Rhesus.Z.5575#2“33“985227693972. Im Verlauf liegt dann auch eine Blasen-Serie vor #23“0“.... Die Schaumzelle lagert das Fett in blasenförmigen Vakuolen „303“ in der Gefäßwand „33“. Das Krankheitsbild des Kassen-Patienten, der ohne Nebenwirkungen nur mit guten Worten behandelt wird, liegt in „054_3“ – die Ziffer 3 ist nach rechts verrutscht, so dass CD68=354 AS nicht rechts herausgeschoben wird und Kalk mit Calcium=20 nachfolgend vielfach als Zählgröße „11“ gesammelt wird: Epi.Ref_Rhesus.Z.5662#2“303“899“054“0“33“7“3“ und Epi.Ref_Rhesus.Z.5663#23034922“20“367“11“. Die mit Fett gefüllten Vakuolen vermehren sich als „303_303“ doppelt mit dem Bixnom-Kreis=64 als Blasenstruktur „5_64_5“ mit Blasen=0_8=Extra: Epi.Ref_Rhesus.Z.56“64“#2“303“08“55303“5“64“5“.
Der Anteil der Kupffer-Zellen an den Makrophagen im Körper beträgt 80%. Sie befinden sich im Netz kleiner Blutgefäße zwischen den Leberzellen im Sinusoidalraum (Lebersinusoide) des Leberparenchyms Die Kupffer-Zellen sind an den Gefäßwandzellen (Endothelzellen) verankert und haben direkten Kontakt mit dem Blut [siehe: Kupffer'sche Sternzellen - Facharztwissen (medicoconsult.de)]. Die sternförmigen Zellen besitzen einen ovalen Kern und ragen mit ihren Fortsätzen in den Disse'schen Raum hinein. Der Disse'sche Raum ist ein Spaltraum zwischen den Hepatozyten und den Endothelzellen der Lebersinusoide (siehe: Disse'scher Raum - DocCheck Flexikon). Die Endothelzellen bilden ein einschichtiges Plattenepithel und kleiden die Innenseite der Blutgefäße aus. Diese für bestimmte Moleküle durchgängigen Kapillargefäße sind einfacher aufgebaut als die anderen Blutgefäße, die aus 3 Schichten bestehen. Sobald die Kupffer-Zellen aktiviert sind, werden für Makrophagen typische Vermittlerstoffe (Zytokine) produziert, wie TNF-alpha [233 AS / 157 AS (Membran/Löslich)], IL-6 (185 AS) und IL-12 (Heterodimer mit 2 Untereinheiten, die mit einer Disulfidbrücke verbunden sind). Die Kupffer-Zelle zeigt keine auffällige Sternform. Die Sinusoide der Leber werden aus Ästen der Leberarterie von arteriellen Blut und aus Äste der Pfortader (Vena portae) von venösen Blut gespeist [Abbildung siehe: EM-Atlas im Internet: Leber Kupffer-Zellen (drjastrow.de)].
Die Kupffer-Zelle sitzt am Übergang von Blut und Gewebe. Der Übergang des Monozyten in das Gewebe erfolgte in Z.4797. Von Z.5062 bis Z.5664 wurden dendritsche Zellen, Osteoklasten und Schaumzellen adressiert. Wie die Monozyten stehen auch die Kupffer-Zellen mit dem Blut in Kontakt. Eine Blut-Serie #26...[Eisen=26] läuft von Z.4832 bis Z.5017. Für die Differenzierung der Monozyten wurde die bewegliche Zellmembran „33“ 11x durchgezählt, so dass nunmehr der ovale Kern der Kupffer-Zelle entsteht. Der Kern „505“ muss sich oval über mehrere Zeilen hinziehen, weil eine ovale Einzelform „5005“ nicht vorhanden ist. Zunächst wird die Doppelschicht der Kernhülle 33 in der unauffälligen Art „3_2=doppelt_3“ mit Form=7 (in Z.xxx7) durchfahren. Die Zelle ist vom Blutplasma umgeben, in dem auch rote Blutkörperchen (Eisen=26) schwimmen. Mit 686 sind Token-68/86 lesbar, aber Token-68 nochmals gesondert. Das Herauswürgen der Nahrung beim Insekt, ist in Bezug auf die Zelle eine Speicherung; im Zellkern sitzt als Speicher eine Vakuole (Lysosom): Epi.Ref_Rhesus.Z.483“7“#“26“9“68“5“2686“36“323“. Ovaler Zellkern „505-_1=Einzelkern als Zählgröße QS1+4+6=11“, räumlich=4 über „6“ Zeilen von Epi.Ref_Rhesus.Z.4838#“26“9629525“505“1“4“6“ als ovale Kernform „50505“ gezählt. Der Zellkern setzt sich ab „11“ bis Epi.Ref_Rhesus.Z.4843#“26“935“11“551“50505“. Der Zellkern ist der „Nukleus“. Darin enthalten ist ohne Membranabgrenzung ein Kernkörperchen, der „Nucleolus“ als Gruppe Z.xx44 für die enthaltene DNA: Epi.Ref_Rhesus.Z.48“44“#“26929“55500400“28. Die Kernhülle „33“ wird als Doppelschicht über 2 Zeilen mit 2_3_7=Form_3 und 33 gebildet: Epi.Ref_Rhesus.Z.4847#“26“91288“72373“405 und Epi.Ref_Rhesus.Z.4848#“26“907“33“58992140. Die Vakuole (Lysosom) „0“ ist mit dem Universalwirkstoffen=77 gefüllt als „077“, die mit Token-„68/86“ aufgenomemm und abgegegeben werden: Epi.Ref_Rhesus.Z.4848#“26“9017“868“5“077“12. Die innere Schicht der Zellmembran „33“ wird adressiert Epi.Ref_Rhesus.Z.4863#“26“824“33“97983528. Die äußere Schicht der Zellmembran „33“ ist als „1331“ in einer Zählgröße=11 eingebettet, um Zellfortsätze zu bilden: Epi.Ref_Rhesus.Z.4868#“26“8“1331“23205323. Die Zellfortsätze ziehen sich in den Spaltraum (Disse'sche Raum) zwischen den Hepatozyten und den Endothelzellen der Kapillargefäße. Blutgefäß=26. Der Spalt „1“ wird adressiert als „Lebersinusoide=Gruppe=44_Spalt=1_4=räumlich“: Epi.Ref_Rhesus.Z.4865#“26“785783“252“4414“.
6.9.6 Mikroglia (Hortega-Zellen /Mesoglia)
Erkennbar wird, dass sich die Immunzellen entlang der Serien #2x differenzieren. Nach den Schaumzellen in #23... sind in #22... Knorpelzellen zu erwarten. Gleichzeitig aber auch Alveolar-Makrophagen, weil die Luftröhre aus Knorpelspangen „22“ besteht. Die Serie #21 kann die Gewebsmakrophagen Mikroglia im Gehirn adressieren, weil eine #Serie 211... integiert ist, um die Verzweigungen der Zellfortsätze darzustellen. Für die Hyalozyte im Glaskörper des Auges verbleibt dann die Serie #20...
Die Mikroglia sind kleinste Gliazellen, die zum mononukleär-phagozytären Systems (MPS) gehören und sich amöboid fortbewegen. Es sind multifunktionale Gliazellen im Parenchym des zentralen Nervensystems (ZNS), die zu den Gewebsmakrophagen gezählt werden. Im Unterschied zu allen anderen Immunzellen stammen Mikroglia von Vorläufern aus dem Dottersack und nicht aus dem Knochenamrk ab (siehe: Mikroglia – Wikipedia). Im Ruhezustand gehen von den Mikroglia zahlreiche, reich verzweigte Ausläufer ab, um die Umgebung abzutasten und Kontakt mit Neuronen und anderen Gliazellen aufzunehmen. Es sind schmale, lang gestreckte Zellen, die einen irregulären, länglichen Zellkern mit dichtem Chromatin besitzen. Die Zellfortsätze sind fein und sehr verzweigt. Im Falle einer Gewebeschädigung (Gewebeläsion) werden die Mikrogliazellen in große, phagozytierende Zellen (Makrophagen) umgeformt (Abräumzellen): [siehe: Mikroglia - DocCheck Flexikon]. Mikroglia scheiden Wachstumsfaktoren IGF1 und BDNFaus. Weiterhn exprimieren sie MHC-Klasse-I- und -Klasse-II-Komplexe, auf denen sie Antigene präsentieren können (Mikroglia – Wikipedia). Das Hormon „Insulin-like growth factor 1 (IGF-1)“ wird überwiegend in der Leber hergestellt und besteht aus 70 Aminosäuren mit 3 Disulfidbrücken (siehe: Insulin-like growth factor 1 - DocCheck Flexikon).
Das Hormon IGF-1 setzt sich aus 3 Zeilen zusammen, die mit dem Merkmal 70 AS als Struktur 55 vereinigt werden. Die 1. Zeile enthält das Schlüssel-Schloß-Prinzip=56, um Antigene zu präsentieren, Die Zeile 1 und 2 enthalten mit 55_3 bzw. 553 eine Gemeinsamkeit als Disulfidbrücke, die mit dem Faktor=3 3-fach ausgeführt wird. Als Symbole von 3 Spiegelungen,sind diese 2 Spiegelungen übergreifend Zeile1/2 mit 59_95 und 25_52 vorhanden. Die 3. Spiegelung in der 3. Zeile spiegelt den Schwefel =16 in die Zeilen-Nr. als „601“1, so dass er dort mit der Zählgröße 11 für 3 Zeilen kombiniert wird. Der Schwefel=16 ist in der 3. Zeile enthalten: Epi.Ref_Rhesus.Z.6009#21“70“8“56“4“55“972“53“; Epi.Ref_Rhesus.Z.6010#21“70“49524857“553“; Epi.Ref_Rhesus.Z.6011#21“70“13416136067. Mit dem Schwefel=16 in der Zeilen-Nr. wird das Hormon IGF-1 mit „70“ AS am rechten Zahlenrand von der Zellmembran „33“ ausgeschüttet: Epi.Ref_Rhesus.Z.60“16“#2168“33“0525920“70“.
Der irregultär Zellkern „505 wiederholt sich und wird zu einer Gruppe zusammemgefasst. Mit 505_1 wird einerseits 1 Kern gebildet, der aber mit QS 5+0+5+1=11 eine Zählgröße ist: Epi.Ref_Rhesus.Z.6037#21607878820“5051“. Die Folgezeile kombiniert Zählgröße 11 und Gruppe 44 zu „1414“. Für die Gruppe 44 muss der Kern 505 insgesamt 4-mal gezählt werden, wodurch sich eine lang gestreckte Form ergibt: Epi.Ref_Rhesus.Z.6038#21604300172“1414“; Epi.Ref_Rhesus.Z.6080#2145“505“99406891;
Epi.Ref_Rhesus.Z.6234#2092“505“04394273;
Epi.Ref_Rhesus.Z.6247#20881“505“4329“101“. Die Kernhülle kann durch die Doppelmembran passiert werden, die mit 878_“33“_22_565 als zweischichtig gilt: Epi.Ref_Rhesus.Z.6248#20“878“16“33“22“565“6. Zum Passierern der zweischichtigen Zellmembran werden die folgenden 2 Membranzeilen „33“ gezählt. Bemerkenswert ist, dass der Zwischenraum den Ansatz eines Zellfortsatzes „1“ zeigt, wie er mit dem Neuron des Zentralen Nervensystems markant als „77“1“7777“=Nerv in Kontakt kommt. Die Vielzahl der Kontaktstellen ist als Struktur „5_11=Zählgröße_5“ adressiert: Epi.Ref_Rhesus.Z.6254#20858“1331“0“5115“1; Epi.Ref_Rhesus.Z.6280#20“77“1“77777“69729; Epi.Ref_Rhesus.Z.6283#2076185969“11“33“2.
Nur die Mikroglia können den gesunden Zustand im Gehirn halten, indem Abfallprodukte entfernt werden. Eine Störung des Systems kann u.a. zur Alzheimer Erkrankung führen. Mikroglia produzieren das Protein TREM2, dass die Mikroglia veranlasst Fremdstoffe zu beseitigen [siehe: TREM2: Ein Schutzfaktor gegen Alzheimer? • healthcare-in-europe.com / Quelle: Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE); Aug2019)]. Eine erhöhte Konzentration an Trem2 in der Gehirnflüssigkeit schützt einerseits erkrankte Personen, zeigt aber als Nachteil an, dass eine Erkrankung vorliegt. TREM2-human besitzt 230 Aminosäuren. TREM2 bildet zusammen mit TYROBP einen Rezeptor-Signalkomplex, der Zellaktivierung und Signalübertragung vermittelt (siehe: TREM2 - Triggering receptor expression on myeloid cells 2 - Homo sapiens (Human) | UniProtKB | UniProt). TYROBP besteht aus 113 Aminisäuren (siehe: TYROBP Gene - GeneCards | TYOBP Protein | TYOBP Antibody).
Eingangseitig liegt eine Zellmembran 33 vor: Epi.Ref_Rhesus.Z.5847#223100“33“2545561.
In 2 Zeilen für TREM2=“230“ AS ist mit 30_24 auch eine Zeitfunktion als 30 Tage verknüpft. Es ist aber im Verlauf eine Zählweise verborgen, die dann 12 Monate zählt. Weil dann die Serie #21... typisch ist, verbirgt sich darin die Zählung von 21 Jahren. 21 Jahre vor der Alzheimer Erkrankung sind dafür bereits Anzeichen erkennbar. Die Jahresanzahl „21“ wird bereits vor dem Start der Serie #21...avisiert, so dass es an der Zahl „12“ Monate=1 Jahr mangelt. Diese wird mit der Zeit 24_04 mit der Zahl 4 in „1_“4“_2“ blockiert. Die Ziffer 12 läuft als Serie Z.x_QS 8+4=12_x als Zeilennummer mit: Epi.Ref_Rhesus.Z.5“84“8#2“230“6“21“82693895 und Epi.Ref_Rhesus.Z.5“84“9#2“230“24045“887“1“4“2“. Es folgt eine Zählgröße „11“, um den Countdown zu starten, der die 21 Jahre in „211“ enthält: Epi.Ref_Rhesus.Z.5850#22298592“211“861. Zur Bildung eines Rezeptor-Signalkomplexes gemeinsam mit Trem2 folgt TYROBP=113 AS: Epi.Ref_Rhesus.Z.5851#2229478“113“81626.
Die Zeitfunktion zur Ausschüttung von TREM2=230 AS_24=Zeit ist ähnlich nochmals vorhanden, wobei die Zeilen-Nr. Z.QS 6+0+0+5=11=Zahlgröße ergibt: Epi.Ref_Rhesus.Z.6005#217“230“24“8858267. TYROBP=113 AS ist von dieser Position weiter entfernt und enthält selbst die Zählgröße 11 sowie die 12 Monate zur Jahreszählung „21 Jahre“ in der Zeilennummer Z.x“1“2“1“: Epi.Ref_Rhesus.Z.6“1“21“#“21“3“113“485442558.
6.9.7 Hyalozyten im Glaskörper (Corpus vitreum) des Auges
Abbildungen zur Sternform und zum Kern der Hyalozyten sind momentan nicht bekannt. Als Hyalozyten werden doppeldeutig auch großlumige, tote Zellen bei Torfmoosen bezeichnet. Hyalozyten sind Makrophagen im Augen-Glaskörper. Es sind sternförmige Zellen, Durchmesser 10-15 µm, mit rundem Zellkern, die in der Randzone des Augen-Glaskörpers vereinzelt und zusammen mit kollagenen Mikrofibrillen vorkommen. Um diese Position verorten zu können, ist die Hyaluronsäure der Glaskörperflüssigkeit (Humor corporis vitrei) als Merkmal geeignet, der Rest von 98% ist Wasser. Hyaluronsäure=C14H21O11N=6*14+21+8*11+7=84+21+88+7=200E. Die Hyalozyten müssen folglich in einer Serie #20... entstehen, damit der Zeilenlauf den Glaskörper als Serie #200 entwickelt, Der Rand des Glaskörpers ist gelartig und der Kern flüssig, was als „200_0“ und als Struktur=55_Wasser=H20=“2“+“8“=10 symbolisiert wird. Weil es nicht um die Anatomie des Auges handelt, muss die Serie nicht vollständig durchlaufen werden, weil auch die Synovialmakrophagen in der Synovialmembran die Synovialflüssigkeit im Gelenkspalt zum hyalinem Knorpel auf der Gelenkfläche. Der Begriff „hyalin“ bezeichnet lediglich eine homogene, kollidarige, glasige Proteinablagerung ohne ein konkretes Protein. Jedoch enthält die Synovialflüssigkeit maßgeblich auf die Hyaluronsäure (Hyaluronic Acid) zur Bindung von Wasser. Hyaluronsäure ist ebenfalls im hyalinem Knorpel und somit auch in den Atemwegen enthalten (siehe: https://www.vitaminexpress.org/de/hyaluronsaeure).
Die Zahl „22“ in der Zeilennummer ist als 44/2=22 eine Halbgruppe, so dass mit der Form=717_2=paarig nur der halbe Glaskörper adressiert werden muss: Zentrum Epi.Ref_Rhesus.Z.6522#“200“0“1“0“37“1“7“2“55“28“. Die Hyalozyten setzen wahrscheinlich die Stoffe ihrer Umgebung (Hyaluronsäure und Mikrofibrillen) sowie Proteine unbekannter Art frei. Ein weiteres Merkmal für den Glaskörper ist der aus der Embryonalentwicklung stammende Kanal „Canalis hyaloideus“ „909“, der sich durch das Zentrum zieht, um die Arterie „Arteria hyaloidea“=“9“ mit durchzuziehen: Epi.Ref_Rhesus.Z.6373#“20“46865“909“9“22“9“5. Die Randzone entsteht als Verdichtung von Kollagenfasern als „Membrana vitrea“. Hierfür werden 2 Schichten „33“ gewählt, zwischen denen sich die Hyalozyten und Mikrofibrillen einordnen. Die Lage der membran zwischen Glaskörper und Augenlinse siehe Abbildung: Präparat 133/ Glaskörper (Corpus vitreum); https://viewer.medsurf.se.iml.unibe.ch/folien/132.
Die äußere Membranschicht „33“ wird mit einer klassischen Rundung „505“ für den Glaskörper des Auges kombiniert: Epi.Ref_Rhesus.Z.6288#“20“7453“505“7878“33“. Zuerst werden die Mikrofibrillen adressiert. Um aber bereits den Durchmesser der Hyalozyten zu definieren, wird eine Gruppe 44 gebildet, in der auch das Kollagen als Glycin=40 mit enthalten ist. Der Zell-Durchmesser von 15 µm entsteht aus Form=7_15_7. Vorhanden sind zunächst scheinbar 15 nm, die durch „00_0“ aber zu 15 µm „aufgebohrt“ werden. Die Zelle ist mit dem Bixnom-Kreis=64 rund: Epi.Ref_Rhesus.Z.6297#“20“7“15“7“00“24“44“64“0“. Die Mikrofibrillen sind nicht als Fasern „111“ vorhanden, sondern setzen sich kleinteilig als Zählgröße 11 zusammen, wenn in der Zeilen-Nr. Zxx1x die Ziffer „1“ durchläuft. Ein Merkmal der Mikrobibrillen ist das Kollagen mit dem enthaltenen Glycin=C2H5NO2=6*2+5+7+2*8=40E. Glycin ist eine Zählgröße, weil es regelmäßig an jeder 3. Position des Kollagens erscheint. Mit der Zeilen-Nr. Z.QS 6+3+0+2=11=Zählgröße wird eine Kollagen-Gruppe 44 gebildet, wobei das Glycin=40 als „QS 0+6+9+9+2+6+4+4=40=Glycin_3“ avisiert wird und „3“ Zeilen weiter vorliegen wird. Die Zahl „3“ symbolisiert zugleich die dreidimensionale Struktur der Tertiärstruktur des Kollegenmoeküls: Epi.Ref_Rhesus.Z.6302#“20“69926“44“3“02427. Glycin „40“: 20“692697“40“472“55“. Die Mikrobibrillen laufen in der Serie Z.x31x kombiniert mit der Ziffer 3 als Tertiärstruktur bis Z.6319 durch. Die Zahl 31 wechselt dann abschließend in die Zeilen kombiniert mit Glycin=40. Mit dem Kreis=64 werden die Fasern in der gesamten Randzone ausgeführt: Epi.Ref_Rhesus.Z.6320#“20“6“40“31“08290173. Hyalozyten exprimieren neben klassischen Immunzellmarkern den für Myofbroblasten charakteristischen α-SMA (alpha-smooth muscle actin) [Synonym: Alpha-Actin-2 / ACTA2], gemäß Studie “NM02-02: Charakterisierung der zellulären und molekularen Mediatoren diabetischer Neovaskularisationsmembranen /Der Ophthalmologe · Suppl 3 · 2021 S245/; Abstractband DOG 2021 (springer.com)“. Das Protein hat eine Länge von 377AS [siehe: Smooth Muscle Actin Protein (Actin, alpha 2, Smooth Muscle, Aorta) (AA 3-377) (His tag) - Produktdetails (antikoerper-online.de)]: Epi.Ref_Rhesus.Z.6325#“20“623994“377“7691.
Die Zellmembran 33 des Hyalozyten liegt unbestimmt in der Zeilen-Nr. Z.x33x als Serie vor:
Epi.Ref_Rhesus.Z.6“33“0#“20“607703702905. Kernhülle „33“ doppelt in Zeilen-Nr. und Zeile. Kombiniert mit der Ziffer 4_33 können 4 Kernmerkmale „505“ umschlossen werden, ohne damit 4 selbstständige Kerne bilden zu köennen: Epi.Ref_Rhesus.Z.6“33“5#“20“5914387“4“33“922. Für den Zellkern (Nucleus) wird eine Kerngruppe gebildet Form 7_44: Epi.Ref_Rhesus.Z.6“33“6#“205“881888“319“744“.
Zellkern „505“, vierteilig: Epi.Ref_Rhesus.Z.6337#“20“5849399462“505“; Epi.Ref_Rhesus.Z.6341#“20“5719546“505“897; Epi.Ref_Rhesus.Z.6396#“20“39“505“38523123;
Epi.Ref_Rhesus.Z.6410#“20“3“505“092729157.
Kernhülle mittels Doppelschicht „33_33“ wieder schließen: Epi.Ref_Rhesus.Z.6415#“20“33“464761“33“109.
Zellmembran „33“ als innere Schicht: Epi.Ref_Rhesus.Z.6426#“20“299838848“3333“.
Hyalozyten wachsen (proliferieren) unter dem Einfluss von Zytokinen (regulatorische Peptiden oder Proteinen). Bekannt ist, dass die Hyalozyten durchTumornekrosefaktor-alpha (TNF-α) =233 AS aktiviert werden. Mit dem Schlüssel-schloss-Prinzip=56 ist dafür ein Rezeptor vorhanden. Bei der gewählten Reihenfolge kann TNF-α in der Zellmembran positioniert werden: Epi.Ref_Rhesus.Z.6447#20“233“71559475“56“.
Glycin=40 ist als Tertiärstruktur 3_5_40_5 markiert, so dass kollagene Mikrofibrillen 1_0 abgegeben werden könnten: Epi.Ref_Rhesus.Z.6452#“20“21803“5“40“5“9810.
Hyaluronsäure=200 E wird beim Durchlauf durch den Kernbereich dargestellt:
Epi.Ref_Rhesus.Z.6377#204558“200“469483. Als Absonderung über die Zellmembran müsste mit der Zählgröße „11“ eine geeignete Rechenoperation in einer Ventilfunktion vollbringen, dabei muss die Ziffer „2“ in 202_02 mit einer Null getauscht werden, um 200E zu lesen. Als eine notwendige Spiegelung ist 20_02 adressiert. Wasser ist mit QS 2+8=10 ebenfalls für Rechenoperation geeignet: Epi.Ref_Rhesus.Z.6453#“202“149“02“28“4“11“4“3. Zellmembran „33“ als äußere Schicht: Epi.Ref_Rhesus.Z.6454#“202“11“770“1“33“1“561.
6.9.8 Synovialmakrophagen in der Synovialmembran einer Gelenkkapsel
Die Alveolarmakrophagen besiedeln die Zellwand im Lungenbläschen (Alveole). Abbildung siehe: „https://www.mikroskopie-forum.de/index.php?PHPSESSID=13a861f9037ea1a6d18fa30f3d085bb5&topic=9640.0 / HISTOLOGIE: Lungen Gewebe, Alveolen, Makrophagen, Blut-Luft-Schranke (mikroskopie-forum.de)“. Die Luftröhre wird üblich durch die Anzahl ihrer Knorpelspangen „22“ in der Länge durchgezählt. Dann folgt eine Verzweigungsstück „22_22“ auf die Bronchien. Das Zielgebiet ist in der #200-Serie enthalten. Der Lungenbereich ist durch 2 Lungen-Strukturzeilen „225“ adressiert: 1.) Lungenbläschen (Alveole) „50_22_50“ in Z.6_QS 5+0+6=11=Zählgröße: Epi.Ref_Rhesus.Z.6506#“200“502250“905917. 2.) Lungenbläschen 20_0_225 in Z.6_QS 5+1+5=11=Zählgröße. Die weintraubenförmig angeordneten Lungenbläschen (Alveolen) sind das blinde Ende des Respirationstraktes und dienen dem Gasaustausch. Hiefür wechselt der Blasendurchmesser zwischen 50µm und 250 μm. Die Null ist aus 20_"0" zu gewinnen, so das aus den Basiszahlen 5 und 25 und 50 und 250 entstehen. Weil die Blase rund ist kürzen sich die Dimensionen von Höhe zur Breite, so dass statt nm realiv auch µm gelten. Die Atmung wird als Struktur-Spiegelung Z.x_51_x#15 dargestellt. Der Mittelwert als CO2 und O2 ist als "20"E enthalten: Epi.Ref_Rhesus.Z.6515#“20“0“2“25“27158770“5“. Im Wissen um die Atmung und der aus 20_“0“ gewonnenen Null, stehen die „5“ und „25“ für die Atmung zuvor bereits in 2 Zeilen an gegensätzlichen Zahlenenden. Zuvor wird die kleinste Lungeneinheit (Azinus) aus 12 Alveolen formiert als Z.x_Struktur=5_12_x und zugleich im Code #_Form=7_5“12“ vorhanden. Die Evolution muss nunmehr die funktionierenden Code-Zahlen durch Gene verewigen: Epi.Ref_Rhesus.Z.6515#“20“0“31“751“2959751. Ausatmung: Epi.Ref_Rhesus.Z.6513#“20“0“28675639396“5“ / Einatmung: Es bleiben 3 Nullen übrig, um beim Menschen normale nm (Nanometer) in µm zu transformieren: Epi.Ref_Rhesus.Z.6514#“20“0“25“6009271399. 3.) Die Markophagen sitzen auf der Zellwand, die sich als eine Basalmembran „333“ bildet: Epi.Ref_Rhesus.Z.65016#“200“19454“333“8535. Die einzelen Aveolen sind untereinander durch spezlelle Alveolarepithelzellen (Pneumozyten) verbunden, die der Basalmembran aufsitzen. In einer 2. Reihe hinter den Makrophagen sitzt dann eine Kette aus Blutgefäßen und Pneumozyten. Die Pneumozyten TYP I sind mit #20_“01“ mit ihrer Dicke von 0,1µm enthalten. Die Membran=33, Faser=11 und Glycin=40 stehen zur Verfügung und im Blutgefäß sind mit Eisen=26 Erythrozyten adressiert. In der Pneumozyten-Membran 1_33_1 sind mit 64=rund_0_3 feinste Kanäle (Kohnsche Poren) zum Gas-Austausch zwischen den Aveolen vorhanden. Hierfür ist die Lungeneinheit mit „12“ Alveolen adresssiert: Epi.Ref_Rhesus.Z.65018#“20“01“33“11“5“12“64“03“. Die Pneumozyten Typ II sind mit der Ziffer „4“ kubisch 4_1515_4_7=Form geformt. Die Zellen produzieren eine grenzflächenaktive Substanz“ (Tensid) ein sogenanntes „Surfactant“ („surf“ace „ac“tive „a“gen“t“). Folglich ist mit „Wasser=10“ die hydophile Seite des Tensids sowie Phosphor=15 enthalten (siehe: Surfactant – Wikipedia). Der Surfactant-Faktor, eine Mischung aus Phospholipiden, Proteinen und Kohlenhydraten, legt einen Film über die Oberfläche der Alveolen, um die Oberflächenspannung zwischen Lungenepitel und Luft heranzusetzen: Epi.Ref_Rhesus.Z.6519#“200“10“2“415154“7“62. Die Grenzflächenspannung „00“ wird adressiert, in dem das Wasser=10 als „4_10_4“ für die hydophile Seite markiert wird. In der Folgezeile ist „28“ am Zahlenrand dann kein „H2O“, sondern der Luftsauerstoff O2: Epi.Ref_Rhesus.Z.6521#“20“00“4104“3458656 und Epi.Ref_Rhesus.Z.6522#“20“00“10“3717255“28“.
Die Synovialmakrophagen sind ortsansässige (sessile) Makrophagen, die den Histiozyten zugeordnet werden können. Die Monozyten verlassen den Blutkreislauf und differenzieren sich zu Makrophagen. Je nach dem Reiz der Mikroumgebung unterscheiden sich dann die Makrophagen im Phänotyp M1 und M2. M1-Phänotyp ist klassisch zur Förderung von Entzündungen aktiviert, unter Einwirkung von Tumornekrosefaktor α (TNFα), Interleukin (IL)-1β und IL-6. M2-Phänotyp ist an entzündungshemmenden Reaktionen beteiligt, unter Einwirkung von IL-4 + IL-13, IL-10. Anzeichen von Gelenkerkrankungen wie rheumatoider Arthritis (RA) sind aufgrund der sich ändernden Sitaution feststellbar [siehe: Macrophages in Synovial Inflammation - PMC (nih.gov); A. Kennedy u.a.; Front Immunol. 2011; doi: 10.3389/fimmu.2011.00052]. Die Synovialmakrophagen [CX3CR1+Trem2+-Makrophagen] gehen nicht direkt aus Monozyten hervor, sondern aus MHCII+-Vorläufermakrophagen im darunterliegenden Synovialgewebe. „MHCII“ wird aktiviert mit NFAT5 (1531 AS) [siehe: Macrophage-specific MHCII expression is regulated by a remote Ciita enhancer controlled by NFAT5 - PubMed (nih.gov)].
Welches Gewebe von den Makrophagen geschützt wird, hängt von der Produktion von Zytokinen ab. Beispielsweise kontrolliert die lokale Produktion des Zytokins GM-CSF über Aktivierung des Transkriptionsfaktors PPARγ die Differenzierung von Alveolarmakrophagen. Die GATA6-abhängige Differenzierung residenter Peritonealmakrophagen wird durch Retinsäure (Vitamin-A-Säuren) kontrolliert. Retinsäuren sind Oxidationsprodukte des Retinol [C20H30O=6*20+30+8=158E]. Die Makrophagen der roten Pulpa in der Milz beseitigen alte (seneszente) Erythrozyten und sind wegen des Rycyclings von Eisen=26 bereits sehr früh in der auflaufenden Serie #26... zu erwarten. Die gegenüberliegenden Gelenkflächen sind mit hyalinem Knorpel überzogen. Der Gelenkspalt zur umhüllenden Gelenkkapsel ist mit Synovialflüsssigkeit gefüllt. Der Gelenkknorpel (Cartilago articularis) besteht aus 4 Schichten, jedoch werden die Schichten im Unterschied zu sonstigem hyalinen Knorpel von keiner Knorpelhaut (Perichondrium) überzogen. Die Gelenkkapsel besteht aus einer äußeren fibrösen Schicht und dem inneren Synovialgewebe, das mit seiner Synovialmembran an der Synovialflüssigkeit grenzt [Abbildungen siehe: Wie schützen Makrophagen das Gelenk? (trillium.de); Trillium Immunologie > Archiv > Ausgaben 2019 > Heft 4/2019; G. Krönke]. Die Synovialmembran bildet an der Grenzfläche eine abdichtende Barriere als 2-schichtige Deckschicht aus Makrophagen (Typ-A-Synoviozyten) und in einer zweiten Reihe aus synovialen Fibroblasten (Typ-B-Synoviozyten). Im gesunden Gelenk wandern in die Gelenkflüssigkeit keine Makrophagen ein.
Die Gelenkmembran [Synovialis / Membrana synovialis/ Gelenkschleimhaut] ist ein epithelähliches Gewebe aus 1 - 4 Zelllagen ("Intima synovialis"), die an lockeres kollagenes Bindegewebe grenzt. Im Unterschied zu einem normalen Epithel ist keine kontinuierliche Basalmembrane vorhanden (siehe: Synovialis - DocCheck Flexikon). Die Synovialzellen (Synoviozyten) zeigen variantenreiche Formen (abgeplattet; spindelförmig; kubisch). Die Deckzellschicht wird von 2 Zellarten gebildet: 1.) Typ-A-Synovialzellen (Makrophagen) mit der Fähigkeit zur Phagozytose, 2.) Typ-B-Synovialzellen (Fibroblasten). Das raue endoplasmatische Reticulum (RER) ist gut entwicklet. Sie produzieren eine große Menge von Glykoproteinen (Hyaluronan = Hyaluronsäure) sowie Lubricin (Proteoglykan 4) [1404 Aminosäuren]. .
Die Serie #200... als Hyaluronsäure in der Gelenkflüssigkeit verweist auf den Gelenkspalt. Für die angrenzende und abdichtende Barriere durch Markophagen auf der der Außenseite der Gelenkkapsel muss zuerst eine Deckschicht-Gruppe „44“ gebildet werden. Damit kann sich zunächst eine Makrophage entwiclelt, um dann in einer Vielzahl zu einer Deckschicht gekoppelt zu werden. Aufgrund der Guppenbildung kann die Barriere in umgekehrter Reihenfolge später erscheinen. Als Symbol für die 4-schichtige Synovialmembran liegen 4 Membranzeilen „33“ vor. Die Deckschichtgruppe „44“ enthält in der Zeilennummer die Zahl 40 das Glycin im Kollagen der Typ-B-Synovialzellen (Fibroblasten). Die Makrophagen sind nicht erkennbar, werden sich aber als Extra=8_seitlich=9_8=Extra als gekoppeltes Extra=88=Wirkstoffe zeigen. Barriere als „99_QS 4+5=9_9“: Epi.Ref_Rhesus.Z.65“40“#199459“88“44“63“898“. Nachdem die Makrophage entstanden ist, muss auf die gekrümmte Fläche der Gelenkkapsel als Zeile Z.Kapselform=707_0 gewartet werden, damit sich eine Barriere als Gruppe 44 zusammenschließen kann.
Die Makrophage entsteht als ein langgesteckter, ovaler Strukturbereich „Form=7_5005/505/50005“, der mit „505“ einen Zellkern entwickelt: Epi.Ref_Rhesus.Z.6612#197287907“5005“89;
Epi.Ref_Rhesus.Z.6879#1896304178“505“45; Epi.Ref_Rhesus.Z.7032#18“55“04“50005“6015. Mehr Hinweise sind momentan nicht ersichtlich. Vergleichsweise sieht man bei Alveolarmakrophagen in den Lungenbläschen eines Rauchers die aufgenommenen schwarzen Partikel. Die Erkenntnis, dass in der Gelenkmembran keine kontinuierliche Basalmembran vorhanden ist, könnte relativiert werden, weil die Makrophage selbst in beiden Endabschnitten das Symbol einer Basalmembran „333“ enthält: Epi.Ref_Rhesus.Z.6913#188697764269“333“ und Epi.Ref_Rhesus.Z.6652#19610157011“333“4.
Das ovale 50005-Ende ist plattenartig flach, so dass sich die Makrophagen schuppenartig etwas überdecken können. Innerhalb der Makrophage sind Koppelstellen aus 2 benachbarten Membranuzeilen „33“ vorhanden. An diese Stelle können sich Zellverbindungselemente einklinken. Die 1. Koppelstelle heftet die Zellen durch ein Verbindungsnetzwerk aus schmalen Strängen „Tight Junction (Zonula occludens)“ „1551“ aneinander (siehe: Tight Junction - DocCheck Flexikon): Epi.Ref_Rhesus.Z.6634#19“66“33“6“5“1551“6“88“ / Epi.Ref_Rhesus.Z.6635#19“66“040157“33“820. In die Verbindung der Makrophagen klemmt sich mit dem Verbindungskörper „Desmosom“ eine gesonderte Struktur hinein. Die Makrophagen werden verbunden und zugleich wird eine Verankerung zwischen der Zellmembran und dem Cytoskelett hergestellt (siehe: Desmosom - DocCheck Flexikon). Um ein Desmosom an beiden Enden platzieren zu können, werden als Platzhalter 2 Koppelstellen adressiert. Der Platzhalter „0“ ist als „33“222“0“ und „222“0“33“ übereinstimmend ersichtlich: 2. Koppelstelle: Epi.Ref_Rhesus.Z.6678#195“33“8071936792 / Epi.Ref_Rhesus.Z.6679#195308825“33“222“0. 3. Koppelstelle: Epi.Ref_Rhesus.Z.7021#185795135“222“0“33“ / Epi.Ref_Rhesus.Z.7022#1857686762167“33“. Das Desmosom wird nunmehr außerhalb der Makrophage produziert und kann im Platzhalter integriert werden. Das Desmosom wird über 2 äußere Membranzeilen „33“ und einen zentralen Kern „505_222“ erzeugt: Epi.Ref_Rhesus.Z.7048#18508“33“77467919; Epi.Ref_Rhesus.Z.7049#18“505“712078“222“4; Epi.Ref_Rhesus.Z.7050#185030871545233.
Als Aminosäuren sind beliebig viele Zahlen zutreffend, es müssen aber bestimmte Rezeptoren auch zu finden sein. Die Synovialmakrophage als CX3CR1+TREM2+-Makrophage ist auf der Oberfläche mit Rezeptoren ausgestattet:
1.) Transmembran Protein „CX3CR1“ (CX3C motif chemokine receptor 1 / G-protein coupled receptor 13 (GPR13) [siehe: CX3CR1 - Wikipedia]. Enthalten sind 355 Aminosäuren [CX3CR1 Gene - GeneCards | CX3C1 Protein | CX3C1 Antibody ].
Epi.Ref_Rhesus.Z.6547#19924662“355“1840
Epi.Ref_Rhesus.Z.6770#19268“355“1609143
Epi.Ref_Rhesus.Z.6817#191“355“08“9393“266
Epi.Ref_Rhesus.Z.6889#189“355“152328915
Epi.Ref_Rhesus.Z.6897#1891“355“14628664
Epi.Ref_Rhesus.Z.6963#1873427609“355“01
2.) Triggering Receptor Expressed On Myeloid Cells 2 „TREM2“. Enthalten sind 230 Aminosäuren [siehe: TREM2 Gene - GeneCards | TREM2 Protein | TREM2 Antibody]
Epi.Ref_Rhesus.Z.6474#201493303119“230“
Epi.Ref_Rhesus.Z.6630#19675228422“230“7
Epi.Ref_Rhesus.Z.6737#1936273778“230“51
Die 2-schichtige Deckschicht der Gelenkmembran aus Fibroblasten und Makrophagen resultiert aus 2 mathematischen Barrieren. Die Fibroblasten bilden eine Struktur Z.xx55 als 99er Kette, die mit QS 3+6=9 noch dichter als Form=7 geschlossen wird: Epi.Ref_Rhesus.Z.7055#1“848“99“7“36“9“7“9999“. Zweckmäßig wird in den folgenden Zeilen zunächst als Strukturelement ein Fibroblast (Typ-B-Synoviozyten) erkannt. Fibroblasten besitzen keine spezielle Form. In den beiden Folgezeilen wird die Zellmembran 33 als Doppelschicht aus 353 / 335 gewählt. Zellkern „rund=64_05_555“: Epi.Ref_Rhesus.Z.7062#18471“64“6“05“48555. Erneut wird eine 2-schichtige Zellmembran gebildet. Innenschicht „33“: Epi.Ref_Rhesus.Z.7069#184“5335“47092078. Es ist den Fibroblasten unmöglich, eine nicht existente Außenschicht „3333“ zu produzieren (maximal Basalmembran 333). Folglich muss die Anforderung „3333“ in 2 Teile „33_33“ getrennt werden. Die Fibroblasten müssen folglich die Vorläufer-Makrophagen anlocken, um als CX3CR1+TREM2+-Makrophagen eine äußere Barriere als EXTRA=8 zu bilden. Die Gelenkkapsel ist als Z._Form.=707x adressiert: Epi.Ref_Rhesus.Z.“707“6#184350“99“55“3333“7. Die äußere Schicht der Gelenkmemban aus einer Kette von Makrophagen zeigt sich anschließend als Membran und als Netzwerk, wobei Kollagen mit Glycin=40 als Serie mitläuft. Die Makrophagen-Barriere aus Elementen Extra=8 wird dann als Strukturform „7_5_7“ adressiert. Die Restzahlen summieren sich zu 8 + 1, so dass eine Undurchlässigkeit für 1 Aktion durch die Lücke=0 möglich bleibt. Bei einem geschädigten Gelenk kann nunmehr eine Entzündung in der Gelenkkapsel ausgelöst werden: Epi.Ref_Rhesus.Z.70“88“#1“8“40“3“888888“1“757“.
Der angrenzende Gelenkspalt 1_1 muss dann als Bixnom-Schwerachse „84“ mit einem Platzhalter=0 für die Gelenkflüssigkeit erkannt werden: Epi.Ref_Rhesus.Z.7089#“1“84“0“1“29“27689“92“7“. Gelenkflüssigkeit als Hyaluronsäure=200: Epi.Ref_Rhesus.Z.7092#“18393508804“200“5. In der Gelenkflüssigkeit können über die nächsten Zeilen Signalstoffe etc. enthalten sein. Notwendig ist beispielsweise Proteoglykan „Lubricin (Proteoglykan 4)“ mit 1404 AS [siehe: Lubricin/Proteoglykan-4-Bindung an CD44-Rezeptor: Ein Mechanismus der Unterdrückung der proinflammatorischen Zytokin-induzierten Synoviozytenproliferation durch Lubricin (wiley.com)]. Es wird von Knorpelzellen (Chondrozyten) in den oberflächlichen Schichten des Gelenkknorpels gebildet bzw. auch von den Fibroblasten produziert (Lubricin - DocCheck Flexikon): Epi.Ref_Rhesus.Z.7096#18383“1404“226874. Der Gelenkknorpel besteht aus 4 Schichten „33“. Weil die Gelenkfläche etwas seitlich um den Knochen gezogen ist, ist der Knochen vom seitlichen Gelenkspalt zugänglich. Die Kollagenfibrillen „11“ sind in Z.x11x enthalten: Schicht IV „33“ ist die Mineralisierungszone am Knochen, die Kalziumphosphatkristalle [Calcium=20] enthält: Epi.Ref_Rhesus.Z.7“11“3#18“339“20“48979881. Schicht III „33“ ist die Radiärzone: Epi.Ref_Rhesus.Z.7“11“4#18“33“66269945726. Schicht II „33“ ist die Übergangszone: Die Zahl 15 soll hier nicht unpassend als Phospkor gezählt werden, so dass beim Menschen zweckmäßig eine Knorpel-Schichtdicke gelesen wird, weil die Nullstelle als 4“0“4 markiert ist. Die Zahl 15 steht in Verbindung mit der Zählgröße 11 in der Zeilennummer. Bezogen auf 5 nm als Basisdicke wird eine Stellenanzahl benötigt. Als „15_61“ ist eine Variantenbreite von 5 bis 6 Nullen zu gewinnen. Der Knorpel des Fingergelenks (Articulatio interphalangealis) ist 0,5 mm dick und der Knorpel des Kniegelenks (Articulatio genus) ist 5 mm dick: Epi.Ref_Rhesus.Z.7“11“5“#18“33“404“98157961. Schicht I „33_33“ ist die Tangentialzone: Epi.Ref_Rhesus.Z.7“11“5“#18“33“147“33“613532.
6.9.9 Milz-Makrophagen
Die Monozyten treten aus dem Blutstrom in das Gewebe ein, um sich als Makrophagen für gestimmte Gewebearten zu differenzieren. Vorzugsweise wird sich in der Reihenfolge zuerst die Milz-Makrophage entwickeln, weil alte rote Blutkörperchen mit dem Recycling von Eisen=26 beseitigt werden können. Die Milz ist außerdem das größte lymphatische Organ, so dass Lymphozyten in der weißen Pulpa tätig werden. Der äußere Gefäßstiel der Milz (Spleen) mit den Gefäßen (Arteria splenica; Vena splenica) wird als Milzhilus bezeichnet. Die Arterie verzweigt und verengt sich zu arteriellen Kapillaren. Die folgenden venösen Kapillaren werden als Milzsinus/Milzsinusoid bezeichnet. Sie besitzen kleine Öffnungen, über die das Blut frei in das Gewebe der roten Pulpa strömt. Der Raum zwischen den Knötchen der weißen Pulpa wird vom Netzwerk (Retikulum) der roten Pulpa (Pulpa rubra) ausgefüllt.
Im Anschluss an die Monozyten kann die restliche Blutserie #26 den Milz-Makrophagen zugewiesen werden, obwohl sie nicht auffällig erkennbar sind. Ein Teil des einströmenden arteriellen Bluts wird offen in das Gewebe der roten Pulpa eingeleitet. Dieses enthält zur Filtration der roten Blutkörperchen ein Fasernetz. Nur junge und elastische Erythrozyten können die Maschen des Netzwerkes passieren, um in den Milzsinus zu gelangen. Die Milz-Makrophage benötigt keine Zellfortsätze zum Kontakt mit Fremdstoffen, weil die Fasern des Filternetzes diese Funktion übernehmen. Die Erythrozyten, Thrombozyten etc. werden mundgerecht serviert. In der Restserie #26 wird eine Mindestanzahl von 10 Membranen „33“ für den Zeilendurchlauf durch eine Makrophage benötigt [2x Zellmembran / 2x Phagolysosom mit Fremdstoffen / 2x Kernhülle – Kern „505“ - 2x Kernhülle_2xZellmembran]. Anfangs verbleiben 2 markante Zeilen „505“, die nicht in eine Makrophage passen. Es handelt sich folglich um das Zielgebiet, die rote Pulpa in der Milz. In der roten Pulpa bildet das Retikulum nach der arteriellen Einspeisung=9 ein offenes Gefäß mit einem venösen Abfluss=8. Die klassische Öffnung „505“ bildet in diesem Zusammenhang ein Blutgefäß, das weder Arterie =9 noch Vene=8 ist. Der Zeilenlauf gibt die Strömungsrichtung vor. Arterieller Zulauf „9_505“: Epi.Ref_Rhesus.Z.4838#“26“9629525“505“146.
Zielstellung ist ein venöser Abfluss=8 avisiert als „5(738)05“_ 80_080, wobei Eisen=26 im eisenhaltigen Proteinkomplex „Hämosiderin“, der Ferritin (176/182 AS) enthält, und Zink=30 gespeichert werden. Das Gefäß “505“ ist mangels einer Basalmembran „333“ mit „05“ undicht. Die Erythrozyten gelangen durch die Lücken in das Gewebe der roten Pulpa, wo die Makrophagen vor den Lücken lauern. Der Raum ist durch ein faserreiches Netzwerk der Retikulumzellen gefüllt. Die Basalmembran 333 erscheint im Zeilenlauf zu spät, und wird daher alternativ von der Makrophage verwendet: Epi.Ref_Rhesus.Z.4839#“26“9“5“738“05“41“30“8“0. Benötigt wird ein Fasernetzwerk zur Filtration als Gruppe 4(8=Abfluss)4 mit Maschen=0 in Z.484_0. Darin ist Glycin=40 zur Bildung von Kollagen für Fasern „1(8)1_0=Maschen_8=Abfluss“ enthalten: Epi.Ref_Rhesus.Z.4840#“26“95“18108“345846. Die Maschenweite ergibt sich zweckmäßig aus dem Durchmesser der Erythrozyten. Eine dimensionslose Angabe ist möglich, wenn der Durchmesser=7,5µm mit der Dicke=2,5µm in ein Verhältnis gesetzt werden. Im Zifferncode müssen lediglich die Zahlen „25“ und „75“ enthalten sein. Die Dicke=25 versteckt sich als Mittelwert von „26_Waage=946_24“. Gemäß Blockflöten-Lektion als Kunstform gilt „9=6“, so dass Schuldenpakete geschnürt und mit einem „Sondervermögen“ gegenfinanziert werden. Die Zeit=(6)24 ist enthalten, die in Bezug auf die Lebenszeit der Erythrozyten von 120 Tagen als „altersdiskriminierende Gesichtskontrolle“ gezählt wird – bei Menschen ab 50. Ergänzend zu QS 7+5=12 müsste hinter dem Wasser 2+8=10 die ergänzende Null in QS 9+1=10 gefunden werden. Zur Positionierung der Null wird dann noch eine Spiegelung 26_62 benötigt, die zugleich das Recycling von Eisen=26 symbolisiert. Weil es 2 Nullen sind, steigert die Evolution das Level: Es ist kein Wasser, sondern 28_0 ergeben 280. Mit der Ziffer „6“ sind es „280 Mio Hämoglobin-Moleküle/ Erythrozyt“. Mit der Ziffer „4“ folgen nunmehr „4 Eisenionen/ Hämoglobin-Molekül“. Die aufgenommen Eisenionen verteilen sich punktuell im Zytoplasma der Makrophagen [Histologie siehe: SBBS Jena/ H. Bandera (2014)“ Lym3Milz.pdf (jena.de); https://www.mefa.jena.de/images/stories/dokumente/histo/LymphatischeGewebe/Lym3Milz.pdf ]: Epi.Ref_Rhesus.Z.4838#“26“94“624“34“28“91“75“. Die lückenhafte venöse Blutkapillare ist als „5“0“5“0“5“ dargestellt: Epi.Ref_Rhesus.Z.4838#“2693511551“50505“. Im Ergebnis erfolgt der Abfluss über Vena splenica=8 am rechten Zahlenrand: Epi.Ref_Rhesus.Z.4844#“26“929555004002“8“.
Interleukin-6 (IL6) mit 185 AS induziert zusammen mit IL10 (160AS) in Zeile Z.4954 das Membranprotein CD163. Interleukin-6 „185AS“ mit Eisenrecycling „26_62“: Epi.Ref_Rhesus.Z.4878#“26“74“185“412861“62“. Bildung des Scavenger-Rezeptors (CD163) 1048 AS von Z.4899 bis Z.4904 mit Fressdomänen gegen Bakterien.
Im Zytoplasma der Makrophage bildet die Verschmelzung von „Lysosom [Organelle enthält hydrolytische Enzyme und Phosphatasen in der Membranhülle]“ und „Phagosom [von einer Lipiddoppelschicht umgebene Organelle]“ mit der eingeschlossenen Nahrung ein „Phagolysosom“. Der alternative Begriff „Vakuole“ ist den Pflanzen vorbehalten, wird aber ebenfalls verwendet. Für die Vakuole (Vacuola digestoria / digestive vacuole ) zur Aufnahme der Abbauprodukte (Incluciones) steht zum Durchlauf doppelt eine besondere Membran „333“ zur Verfügung, die üblich als Basalmembran bekannt ist.
Die Vakuole muss sich kugelförmig=64 zeigen, weil sich das Volumen Form=7_QS 1+8=9=seitlich in Konkurrenz zum Volumen des Zellkerns befindet. Die Zellform muss sich ggf. wie eine Mondsichel als sogennate „Sternhimmelzellen“ krümmen, um noch in der Zelle zu bleiben [HISTOLOGIE: Sternhimmelzellen (Makrophagen) in die Milz eine Ratte (mikroskopie-forum.de)]. Der Zellkern muss dann folglich in Bezug auf „64_718“ eine Gegenreaktion im Code zeigen, die mit 64_178_7=Form gespiegelt beantwortet wird. d.h. der Kern muss sich krümmen, wenn sich das Phagolysosom wächst. Beginn der Vakuole mit der Vakuolen-Membran „333“: Epi.Ref_Rhesus.Z.4880#“26“730894352“333“9. In Makrophagen wird die Eisenverteilung im Phagosom vom Metalltransportprotein NRAMP1 (natural resistance-associated macrophage protein 1) geregelt. Beim Transportmechanismus wird den Bakterien das Eisen entzogen, dass sie zum Wachstum benötigen. Das Aushungern wird unterstützt, indem TLR-aktivierte Makrophagen Lipocalin-2 sekretieren. Lipocalin-2 interferiert mit Siderophoren, den Eisentransportern von Bakterien, um den Eisenentzug zu verstärken. Das murine (Maus) NRAMP1 enthält ein 548 Aminosäuren langes Protein mit hydrophoben Domänen, einer aminoterminalen SH3-Bindungsdomäne und einem konservierten Transportmotiv (Bovine natural resistance associated macrophage protein 1 (Nramp1) gene - PubMed (nih.gov); DOI: 10.1101/gr.6.10.956).
Der Verstärker „Human Lipocalin-2“ enthält zwei Ketten mit 178 AS [siehe: Human Lipocalin-2 Enzyme von Active Bioscience (active-bioscience.de)]: Bei der Suche nach CD163 kommt es aber mit anderer Zählung zu den gleichen Zeilen wie bei der Suche nach NRAMP1. Lipocalin-2 (178 AS): Epi.Ref_Rhesus.Z.4907#2658381“178“7118. Die SH3-Domäne (SH3= Src-homology 3 von Proteinkinase c-Src) ist eine etwa 60 Aminosäuren umfassende Sequenz für Zell-Signalkaskaden, die Prolin-reiche Aminosäurenmotive (PXXP) erkennt (siehe: SH3-Domäne (chemie.de). Prolin=C5H9NO2=6*5+9+7+8*2=30+9+7+16=62 symbolisiert das Eisen-Recycling „26_62“ und ist mit „62_548“ an NRAMP1 gekoppelt. Metalltransportprotein NRAMP1 „62_548AS“ mit Eisenrecycling 26_62: Epi.Ref_Rhesus.Z.4908#“26“5783953“62“548“8. Transport als Zählgröße 11 verpackt 11_44=Gruppe_7_11_7=Form: Epi.Ref_Rhesus.Z.4911#“26“57298“11“44“7117“. Identifizierung der Bakterien mit dem Schlüssel-Schloss-Prinzip=56_Form=7_56. Nahrungsaufnahme mit dem Token-86: Epi.Ref_Rhesus.Z.4910#“26“56“7“56“913225“86“.
Interleukin-10 (IL10) mit 160 AS induziert zusammen mit IL6 (185 AS) in Zeile Z.4878 das Membranprotein CD163. Interleukin-10 „Membran=33_160AS“: Epi.Ref_Rhesus.Z.4954#“26“33“160“3“6413786. Bildung des Scavenger-Rezeptors (CD163) 1048 AS von Z.4899 bis Z.4904 mit Fressdomänen gegen Bakterien.
Ende der Vakuole mit der Vakuolen-Membran „333“: Epi.Ref_Rhesus.Z.4929#264651581“333“718. Die Außenschicht der Zellkernhülle „33“ folgt direkt, damit die Krümmung=64 als Konkurrenz erhalten bleibt: Epi.Ref_Rhesus.Z.4934#2“64“38“33“89621787. Die Innenschicht der Zellkernhülle „33“: Epi.Ref_Rhesus.Z.4941#2“64“0088“33“109471. Zentrum des Zellkerns (Nucleus phagocyti) „505_333_11“: Epi.Ref_Rhesus.Z.4959#“26“30“505“43334“11“9. Innenschicht der Zellkernhülle „33“: Epi.Ref_Rhesus.Z.4970#“262“46“8“33“8912253.
Die Krümmung=64 ist zum rechten Zahlenrand durchgelaufen. Außenschicht der Zellkernhülle „33“: Epi.Ref_Rhesus.Z.4972#“26“2362760“33“66“64“.
Scavenger-Rezeptor (CD163) in Z.4899/Z.4900
Innere Schicht der Zellmembran „33“: Epi.Ref_Rhesus.Z.4978#“26“20465“33“626737.
Äußere Schicht der Zellmembran „33“: Epi.Ref_Rhesus.Z.4981#“2618887059614“33“.
Im Zeilenlauf müssen wesentliche Merkmale vorliegen [siehe: „Die Milz als immunologisches Organ“/ Ch. T. Berge (Aug.2018); Titel (sulm.ch); PIPETTE – SWISS LABORATORY MEDICINE / www.sulm.ch]: Der Scavenger-Rezeptor (CD163) besitzt eine hohe Affinität für den Hämoglobin-Haptoglobin-Komplex, um durch Hämolyse freigesetztes Hb/Eisen aufzunehmen. An den 9 Fress-Domänen binden die Bakterien unterschiedlich stark. Der Rezeptor gehört zur Cavenger-Rezeptor-Cystein-reichen Familie Typ B. Das Membranprotein hat entzündungsfördernde Wirkung, in dem es sich bei Kontakt von der Membran trennt und als lösliches DC163 (soluble CD163)als Marker im Urin messbar ist. Der Rezeptor besteht aus einer extrazellulären Domäne mit 1048 Aminosäurereste, 1 Transmembransegment und dem zytoplasmatischen Schwanz mit mehreren Spleißvarianten (siehe: CD163 – Wikipedia). Die Gesamtanzahl von 1048 AS fehlt, aber mit dem Hinweis auf 9 Fressdomänen können 1048 AS aus 2 Zeilen zusammengesetzt werden. Die Zahl Z.48xx ist an das Merkmal „Z.xx99“ gekoppelt. Durch einen Umschalter 48_99 wird die „99“ in der Folgezeile gegen 48 ausgetauscht, wenn eine bindende Bakterie diese Aktion auslöst. In der Folgezeile ist „10999“ enthalten, so dass „1048_9=Fressdomänen“ entsteht. Wegen „10999/9=1222,111....“ gilt der 99-Zusammenhang QS2+7=9_22_QS2+7=9. Recycling von Eisen=26_62: Epi.Ref_Rhesus.Z.“48“99“#“26“62“7222788“1“99“6 und Epi.Ref_Rhesus.Z.4900#2662178866“1099“9“. Für Cystein C3H7NO2S wird Schwefel=16 bzw. QS8+8=16 bzw. QS 5+1+5+5=16 benötigt: Epi.Ref_Rhesus.Z.4901#“26“6“16“3567“5155“88“. Das Speichern von Eisen=26 wird als „2“0“6“ adressiert: Epi.Ref_Rhesus.Z.4904#“26“6000743147“206“. Die Anzahl der 1048 AS bezieht sich auf die extrazelluläre Domäne, denn insgesamt sind es 1156 AS [CD163 Gene - GeneCards | C163A Protein | C163A Antibody]. Diese Anzahl ist ebenfalls über 2 Zeilen aus der Zählgröße 11_kombiniert mit einer Zählgruppe „44_7_11_7=Form“ zu gewinnen. In der Folgezeile wird die Gruppe durch Anlagerung des Schlüssel-Schloss-Prinzips= 56_7_56 gebildet, so das 1156 AS entstehen müssen. Transportdomäne und gespleizter Schwanz können als Einheit gelesen werden: Epi.Ref_Rhesus.Z.4907#“26“58“38“11“787“11“83“. Wenn etwas über 2 Zeilen gebildet wird, kann es auch löslich getrennt werden: In der 1. Zeile ist „7117“ ein Platzhalter, in den „11“ mit „56“ für 1156 AS getauscht wird. Die durch Antikörper als körperfremd markierten (opsonierte) Bakterien (Opsonine) werden von den Makrophagen eliminiert: Epi.Ref_Rhesus.Z.4909#“2657298“11“44“7117“ und Epi.Ref_Rhesus.Z.4910#“26“56756“91322586.
Horch Smog beobachtet einen Klimaschützer, ob er auf seinem Stuhl klebt
7.) Einzellige Parasiten (Apicomplexa)
Die einzelligen Apicomplexa (lat.„Apex“=Spitze) sind Parasiten, die beim Generationswechsel infektiöse Stadien durchlaufen, wobei sich geschlechtlich und ungeschlechtlich vermehrende Zellen abwechseln. In der Gliederung der Klasse „Aconoidasida“ folgt die Ordnung „Haemospororida“ mit der Gattung „Plasmodium“. Der mathematisierte Vertreter der Apicomlexa ist „Plasmodium faliparum“, weil dieser Erreger der „Malaria tropica“ speziell mit dem Menschen in Beziehung steht.
Die Bezeichnung „Plasmodium“ resultiert aus einer früheren Zuordnung als Form von mehrkernigen Zellen und „falciparum“ beschreibt mit Falx (lat.)= Sichel die typische Sichelform des Erregers. Der Mensch fungiert für den Erreger als Zwischenwirt, in dessen Erythrozyten sich der Parasit ungeschlechtlich vermehrt. Die geschlechtliche Vermehrung von „Plasmodium falciparum“ findet im Darm einer weiblichen Stechmücke der Gattung „Anopheles“ statt, die den Erreger bei einer Blutmahlzeit per Mückenstich aus ihrer Speicheldrüse überträgt. Aktuelles Quellenverzeichnis zur Vermehrung der Apicomplexa siehe: „ Animals | Free Full-Text | Sexual Development in Non-Human Parasitic Apicomplexa: Just Biology or Targets for Control? (mdpi.com); T.Cruz-Bustos u.a. Okt.2021, Uni Wien; https://doi.org/10.3390/ani11102891“.
Verteilung von Aminosäuren im BiXnom-Code am Beispiel des DNA-bindenden Proteins Transkriptionsregulator „Homöodomänenprotein 1 (HDP1)“=3078 Aminosäuren [HDP1 - Homeobox-like protein HDP1 - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt ]
„Plasmodium falciparum“ bildet keine geschlechtlich unterschiedlichen Chromosomen, sondern es differenzieren sich einige vorbestimmte Zellen nach einem Verteilungsschema zu weiblichen oder männlichen Gamonten, die sich zu Gameten entwickeln. Nach diesem Zeitpunkt kann der Parasit zur geschlechtlichen Vermehrung vorbestimmt sein. HDP1=3078 AS erzeugt die typische Sichelform des Parasiten, weil Mutanten ohne HDP1 rund bleiben. Somit liegt das Grundthema im Gegensatz „Kreis=64 versus Schwerachse=84“ als Streckung. Die Zahl „3078 AS“ kann bei der Invasion der roten Blutkörperchen nicht abgelesen werden. Als hier neu erkannte Funktion ist das Protein bei der Entstehung der spermienförmigen Flagellen (männlich) im Mückendarm beteiligt und direkt lesbar: Epi.Ref_Rhesus.Z.7999#16“3078“84“0404288. Bereits zuvor installiert HDP1 den „Selbstauslöser zum Start der Exflagellation“, der bei erfüllten äußere Bedingungen automatisch (auch künstlich im Labor) schaltet. Der Selbstauslöser ist ein Platzhalter „O“ im Kreislauf=“6O4“. Als Besonderheit ist die Zeit als QS1+6+3+1+6+0+4+3=24 enthalten. Eine Energieversorgung als Kreislauf gegen den Zeilenlauf ist wegen der Winkelsumme =30+30+30+40+20+30=180° über mehrere Zeilen zulässig, wobei im Vorfeld bereits eine Exflagellationsgruppe „44“ gebildet werden sein muss, um diesen Bereich abzugrenzen: Epi.Ref_Rhesus.Z.7995#“16“31“604“3081“84“99“.
Die Z.-Nr. Z.7“99“5 enthält mit „99“ das zentrale Mikrotubuli-Paar eines Flagellums. Am rechten Rand werden die 9 äußeren Ring-Paare als QS 1+8=9_84_99 in Kombination mit der Schwerachse=84 gesteckt als Zeilenausgang bereitgestellt. HDP1=3078 AS ist mit der Ziffer „3“, dem Platzhalter O, QS4+3=7 und Ziffer „8“ enthalten. Zwischen beiden HDP1-Zeilen zieht sich am linken Zahlenrand das Protein „PfAG2-G=16AS“ als Transkriptionsfaktor AP-2 gamma=16 Aminosäuren als Rand-Serie entlang [TFAP2G - Transkriptionsfaktor AP-2 gamma - Homo sapiens (Mensch) | UniProtKB | UniProt)].
Die Steuerung der Platzhalterzeile beginnt bereits in Zeilen-Nr. Z.QS7+9+9+3=28=Wasser „H20“. Wasser wird im Zusammenhang mit dem pH-Wert benötigt. Calcium=20 in „3_20_1“ ist zur Prozesssteuerung erforderlich, wobei die anliegende Ziffer „1“ eine Spalte in den Platzhalter „O“ für die Xanthurensäure C10H7NO4=6*10+7+7+8*4=60+14+32=106E legt und „32°“ Celsius als Mücken-Körpertemperatur ist die 2. Exflagellationsbedingung. Die Differenz zur Körpertemperatur des Menschen von 37°Celsius wird als erfolgte Abkühlung von „5°Celsius“ am Zahlenrand herausgeschoben: Epi.Ref_Rhesus.Z.“7993“#16“3“201“2566488“05“. Nachfolgend beginnt die Serie „31“ für Bicarbonat HCO3=1+6+24=31E. Im Mückendarm „808“ liegt mit QS1+6+3+1+8+0+8=27 das Blut=26 mit dem Überschuss von „1“ Wasserstoff-Ion vor, weil CO2=“22“ aus der Blutmahlzeit ausgast und über HCO3=“31“ der pH-Wert steigt. Die Mücken-Körpertemperatur=32°C kann neben dem Platzhalter summiert werden aus „16“_ 3_“16“_O.
Für die Erzeugung der Streckung als Schwerachse „84“ wird potentielle Energie 5_84_555=Struktur als Energiehorizont waagerecht bereitgestellt: Epi.Ref_Rhesus.Z.8000#1630“584555“49237. Die Energieerzeugung durch das Protein ATP-Synthase-alpha (ATP)=551 AS zieht sich als Spalte über 3 Zeilen [ATP synthase subunit alpha - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt.
In der Energie-Entwicklung „555 > 551 > 500“ handelt es sich um den Restkörper „500“ der Exflagellation, der eine Spalte bildet, über die die 8 Flagellen in 15 Sekunden aus dem Zellplasma „33“ als Kombination „3315“ herausgedrängt werden. Das Flagellum ist mit dem zentralen Mikrotubuli-Paar „99“ und den QS5+4=9 Paaren 99_“Rest=0“6“ im Außenring adressiert, wobei die Null zur Flucht-Spalte „500“ gehört. Diese „Null“ hätte eigentlich statt 15 Sekunden als 150 Sekunden zählen sollen, damit erkennbare Regeln eingehalten werden. Der Restkörper wird abgespalten und zählt einfach nicht mit. Die Problemlösung ist schwer verständlich. Benötigt wird die Zeitbasis=60. Wegen QS1+6+2+9+9+7+3+3+1+5+4+9+9+0+6=74 beträgt der Überschuss 74-60=14. In der Zeilennummer werden „8“ Flagellen angezeigt, diese summieren sich mit der Randgröße „06“ zu QS 8+0+6=14, so dass die Zeitbasis=60 vorhanden ist und die 15 Sekunden für die Exflagellation der 8 Flagellen zählbar sind. Somit werden alle Flagellen gleichzeitig freigesetzt: Epi.Ref_Rhesus.Z.“8“003#162“99“7“33“15“4“99“06“.
Für Bewegungen entlang der Mikrotubuli-Leitstruktur sind Motorproteine enthalten: Myosin ist an der Umwandlung von chemischer Energie in Bewegung beteiligt und kooperiert mit Kinesin und Dynein beim intrazellulären Transport: Myosin=“818“AS, Kinesin=1375AS und Dynein=4985AS [MyoA - Myosin-A - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ; Kinesin-Motordomänen-enthaltendes Protein - Plasmodium falciparum NF135/5.C10 | UniProtKB | UniProt; Dynein schwerkettenartiges Protein - Plasmodium falciparum (Isolat NF54) | UniProtKB | UniProt ].
Myosin=818 liegt in der HDP1-Platzhalterzeile Z.7995 und ist Bestandteil der Schwerachse=84 als „818“_“4“ und wird nochmals speziell zählbar. Kinesin=1375 AS folgt dem Zeilenlauf als Spalte „1“ neben dem Platzhalter in Z.7995 über 3 Zeilen, springt bei der Null nach links in eine Spalte „3“ über 2 Zeilen bis Z.7999, um darin horizontal als „307“ die Ziffer 7 zu erreichen, unter der als Spalte die Ziffer 5 an der Schwerachse=84 liegt als „5“84“555“ liegt. Problem: das Protein wird als Ziffernfolge mit dem Zeilenlauf als Spalte herab zum Batteriespeicher „555“ gezählt, muss die Energie aber umgekehrt nach oben in den Kreislauf pumpen. Kinesin transportiert „anterograd“, d.h. vom Zellzentrum zur Peripherie. In Z.7997=Form kann mit 11_0 die Gesamtlänge des Molekül von 110nm enthalten sein, weil nachfolgend 30nm für eine Stiellänge enthalten sind und die Ziffern „1“ und „3“ zum Kinesin gehören [Kinesin - Lexikon der Biologie (spektrum.de)]. Flagellen werden erst durch das Dynein=4985AS beweglich. Warum? Das Protein klammert sich als Spiegelung um den Batteriespeicher „555“ und muss mit Kinesin kooperieren, weil die Proteine die Ziffer „5“ als „58“_ „4_555_“49“ teilen müssen. Mit „QS 4+5=9_5=Struktur_QS4+5=99“ sind mit „9_99“ die 9 Mikrotubuli-Paare im Außenring des Flagellums zur Streckung als Verwendungszweck der Energie bestimmt. Für die Bewegung zieht sich Physik=63 als Randserie über alle Zeilen. Am rechten Zahlenrand wird die Form=7 adressiert. Die Anzahl von 8 Flagellen ist in der Zeilennummer enthalten: Epi.Ref_Rhesus.Z.“8“000#1“63“0“58“4555“49“23“7“.
Mittels Myosin=818AS werden plasmatische Bewegungen in Wechselwirkung mit Aktin=376 AS ausgeführt. Bei „Plasmodium f.“ wird Aktin=376 AS statt der sonst üblichen 375 AS ausgebildet [ ACT2 - Actin-2 - Plasmodium falciparum (Isolat NF54) | UniProtKB | UniProt)]. Aktin 1 und Aktin 2 bilden bei gleiche Kettenlänge unterschiedliche lange Fasertypen. „Myosin“=818AS wird aufgrund der extremen Moleküllänge=145nm nochmals, diagonal zerlegt beginnend mit der Ziffer „8“ neben Aktin in Z.8001 sichtbar. Die Explosionsdauer der Exflagellation von 15 Sekunden ist zugleich auch Phosphor=15. Mit einer Spiegelung der Länge von „154“ statt real 145nm werden die 15 Sek. durch das Myosin erzeugt. Zu diesem Zweck liegt Aktin=376AS als Partner in Z.8001 gespiegelt am rechten Zahlenrand als „763“. Neben seitlich=9 beginnt Myosin=8“1“8 mit der Ziffer 8 damit, entsprechend der Symbolik eine Ziffer „1“ als Klammer einzufangen. Die beiden Gelenkstellen im Myosin-Molekül aus Papin und Trypsin schmücken das Molekül zusätzlich aus. Papin=212AS ist in Z.8002 zunächst nur als 112 teilweise erkennbar, um sich in der Folgezeile in der Spalte die Ziffer „1“ in den „15“ Sekunden als 1+1=2 für 212AS zu sichern. Über diesen Weg findet Myosin=“818“ eine Ziffer „1 und kann nachfolgend die Ziffer „8“ klammerartig als Quersumme “3 [1] 5“ darstellen, weil die störende Ziffer „1“ zum Gelenk des Moleküls gehört. Trypsin=224AS als unteres Gelenk im Myosin entnimmt die Ziffer „2“ der Zeilen-Nr. 800“2“ oder neben der Zählgröße=11“2“. Dann wird die Spalte zu 1+1=2 addiert, die Ziffer 5 übersprungen, um mit der Ziffer „4“ die „15“ Sekunden rechts zu begrenzen. Moleküllänge 145nm [Myosin - Lexikon der Biologie (spektrum.de). Myosin=818AS ist in der HPD1-Platzhalterzeile Z.7995 Bestandteil der Schwerachse=84 als „0“818“499.
Aktin=376 AS bildet Mikrofilamente und enthält zur Stabilisierung in Längsrichtung 2 gewundene Ketten von jeweils 268AS aus Tropomyosin. In Z.7998 wird somit Tropomyosin= 2*284=568AS adressiert. Um die beiden Ketten darzustellen wird die Kettenlänge=40nm als Dopplung „4040“ in der Folgezeile dargestellt [Tropomyosin - Lexikon der Biologie (spektrum.de)]. Aktin=376 AS beginnt in der HPD1-Platzhalter-Zeile Z.7995 als Ziffer „3“ neben 6O4_“3“ und zieht sich als Rechenaufgabe „2+2+3=7“ für die Ziffer „7“ in der Spalte herunter. Horizontal wird die Ziffer „3“ als Dopplung nochmals für QS 3+0+3=6 als Ziffer „6“ gezählt für 376AS. Damit ist der Anschluss an das intergierte Tropomyosin=568AS hergestellt. Anhand der Beschreibungen für Aktin 1 und 2 kann der Unterscheid noch nicht erkannt werden. Mittels der Aktin-Filamente wird die Beweglichkeit der Flagellen ermöglicht. Aktin besitzt eine katalytische Funktion [Adenosindiphosphat (ATP) + H2O = Adenosin-5'-diphosphat (ADP) + H + Phosphat+). Somit hat sich geklärt, welchem Zeck das Wasser in Z.QS7+9+9+5=28=H20=2+8 als „28“ dient. Während der Hydrolyse scheint sich „1“ Kalium-Ion im „Aktiven Zentrum“ zu befinden, und verlässt es zusammen mit Phosphat [siehe: Actin I - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt und ACT2 - Actin-2 - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt ]. Phosphor=15 kommt nur mit der Zeit von 15 Sekunden vor. Es kann aber mit Kalium=19 zusammen in die Fluchtspalte geschoben werden, wenn in Z.8003 aus dem Phosphor vom 1_QS5+4=9 das Kalium lesbar wird. Damit wird in „99_7_33_1[9]99_0“ eine Gleitbahn zur Null in der Fluchtspalte erzeugt. Der Sinn liegt nunmehr mit der [9]99 darin, dass sich die Zeilen-Nr. Z.7999 der HDP1-Hauptzeile mit den lesbaren 3078AS nachfolgend bis in den Zeilencode als Anhang durchgezogen hat. Wo ist Phosphor, wenn es für Kalium „verbraucht“ wird? Die Zeilennummer vor und nach Z.8000 liefern als Quersumme zu kleine oder zu große Ergebnisse, um verwendbar zu sein, so dass eine Spaltenzählung in Betracht kommt. Der Überschuss als Spalte am Zahlenrand des Restkörpers „500“ liefert von Z.8001-Z.8003 QS3+6+6=15=Phosphor. Das ist kein Zufall, denn wegen Zink=30 im Protein HDP1=“30“78AS muss mindestests 1 Zinkfinger-Protein beteiligt werden. Die typische Cystein-Histidin-Anordnung „C3H1“ ist für Zinkfinger-Proteine normal, so dass das Wort „Zincfinger“ momentan durch Kürzung in der Datei fehlt: Zinkfinger-Protein [W7JM64 · W7JM64_PLAFO]=1689 AS [C3H1-type domain-containing protein - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt). Das Zinkfingerprotein wird mit dem Zahlenteil „89“ als Form =7_89_7 markiert, wobei QS7+6+3=16 nunmehr 1689 AS ergeben. Die Randziffer „3“ zählt vertikal den überschüssigen Phosphor zusammen. Die Zahl QS“16“ vom rechten Rand stimmt mit 16_“30“ am linken Rand überein und ist mit Zink=30 gekoppelt.
Die Prozesssteuerung ab Z.7993 durch Calcium=“20“_12_QS5+6=11=Zählgröße_64=Kreislauf wird mit dem enthaltenen Protein „Non-SERCA-type Ca2+ -transporting P-ATPase“ =1264 AS eingeleitet. Uniprot: „Diese Analyse legt nahe, dass PfATP4 eine neue Unterklasse von Ca(2+)-ATPasen definiert, die einzigartig für apicomplexane Organismen sind und daher Potenzial als Wirkstoffziel bieten“ [ATPase4 - Non-SERCA-type Ca2+ -transporting P-ATPase - Plasmodium falciparum (malaria parasite P. falciparum) | Publications | UniProtKB | UniProt ]. Das Protein liegt in der Zeile neben Calcium, aber die Funktion zieht sich scheinbar endlos als Spalte ab der Ziffer „1“ weiter als Platzhalter-O in der HDP1-Zeile usw. in einem gleichförmigen Countdown incl. Zifferwiederholungen 1-0-9-8-7-6-5... Weil es sich von links um die 6. Spalte handelt, ist es eine Besonderheit gegenüber einer gemischten Zahlenfolge. Diese regelmäßige Folge drängt die Flagellen bei der Exflagellation heraus. Weil ein Mangel an Calcium besteht, können Calcium Protine 2xx AS oder 5xxAS an die Spalte anknüpfen. Entsprechend zieht sich der Vorgang weiter bis Calcium am rechten Zahlenrand als Steuergröße ausgesondert wird. In dieser Zeile ist das Protein CDPK2=513 AS enthalten [CDPK2 - Calcium-abhängige Proteinkinase 2 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Die im Calcium-Countdown bis Spaltenziffer „5“ durchgelaufende Zahl sitzt auf dem entsorgten Phosphor=15 und kann die in 1331 als Membran „33“ genutzte Zahl „13“ alternativ direkt anliegend als 5_QS9+0+9=13 für 513 AS bilden. Im Ergebnis ist „33“ die spermienförmig gestreckte Zellmembran „33“ der Flagellen: Epi.Ref_Rhesus.Z.“8“00“7“#16291“5“904“1331“20“. Diese Mathematik hat die Evolution nicht erfunden, sich aber die passenden Proteine für erprobte Zusammenhänge als Gene fixiert.
Und warum erzeugt „Homöodomänenprotein 1 (HDP1)“=3078 Aminosäuren die Sichelform von Plasmodium falciparum? Es gibt im extrem langen Zeilenlauf ein zufälliges Ergebnis: Das Ende des mathematischen Schemas zur asexuellen Vermehrung liegt in Zeile Epi.Ref_Rhesus.Z.7830#16659“8“677“4“44942. Zufällig ist diese Zeilennummer die Spiegelung von HDP1=3078AS. Für eine halbmondähnliche Sichelform wird die Form=7 mit einem äußeren Kreis=64 und einer inneren Gegenform=46 als „Sichel-Schneide“ benötigt. Beim Flagellum wurde die Schwerachse=84 für die spermienförmige Längsstreckung benötigt. Die schmale Sichelform ist vergleichsweise auch eine Streckung. Wenn HDP1 fehlt kann die Streckung nicht wirken, so dass der Parasit rund bleibt. Wo ist das zu finden?
HDP1=3078AS beginnt erneut in einer Platzhalter-Zeile „6“O“4_84“, die den Gegensatz von Kreis=64 und Schwerachse=84 enthält: Epi.Ref_Rhesus.Z.7835#1664“92“3“6“0“484224“.
Weil HDP1 mit der Ziffer „3“ beginnt und die Ziffer „6“ überspringt, um die Null im Platzhalter-O aufzunehmen, wird eine Zählgröße 9+2=11 gebildet. Der Block „923“ wird funktionell beschäftigt, so das QS1+6=7=Form_Kreis=64_[923]_6_O entsteht und somit am Kreis=64 auch die Gegenform=46 für eine Sichelform anliegt. HDP1 bildet beim Umweg über die Spalten der Vorzeile eine Quersumme QS3+0+4=7 und kann die Ziffer „8“ zurück in Z.7835 anschließen. Über diese Brücke werden links die Themen „Sichelform“ und rechts die „zeitliche Formänderung“ vereinigt. Die Entwicklungszeit ist in der Bildung der Zeitbasis=24 in QS4+“8“+4+“2“+2+4=24=Zeit enthalten. Die Entwicklungszeit von 8 Tagen wird markiert als 4_“8“_4 _“2“_24. Darin sind ergänzend die Zeitbasis=24 und die Basiszeit von 2 Tagen enthalten, in der der Parasit noch in runder Form verweilt. Von den insgesamt 10 Tagen liegt der Entwicklungshöhepunkt bei 5 Tagen als Halbzeit „22/44“ [siehe: The transcriptional regulator HDP1 controls expansion of the inner membrane complex during early sexual differentiation of malaria parasites - PubMed (nih.gov) ; B.Kafsack u.a. (Feb 2022); DOI: 10.1038/s41564-021-01045-0 ].
Exflagellation für Mikrogamonten (männlich) mittels HDP1=3078AS vorbestimmt: Die Umwandlung von 1 Mikrogamont in 8 spermienförmige Mikrogameten kann außerhalb der Mücke auch künstlich ausgelöst werden. Hier wurde festgestellt, dass den zur geschlechtlichen Vermehrung vorbestimmten männlichen Parasiten ein Merkmal „29“ angeheftet wird. Die Zahl „29“ ist als Zählgröße=QS11 und als maximale Länge einer Signalkette=29AS im Protein geeignet. Um welches Protein handelt es sich? Die Ziffer „9“ bezieht sich auf Kalium=19E, dass nach der Exflagellation zusammen mit Phosphor ausgeschieden wird. Kalium liegt als Spalte am rechten Zahlenrand. Neben der Kalium-Ziffer „1“ liegt das „Oberflächenprotein P113=969AS“ mit der Ziffer „6“[ P113 - Oberflächenprotein P113 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ].
P113 liegt diagonal über 3 Zeilen und greift ebenfalls auf die Kalium-Ziffer „9“ zu. Der Membranrezeptor P113 produziert das Retikulozyten-bindende Protein (RH5)=526AS. Der Parasit kann im Stadium als Merozoit mittels RH5 in der Membran junger roter Blutkörperchen (Retikulozyten) des Menschen eindringen [RH5 - Retikulozyten-bindendes Proteinhomolog 5 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. RH5=526AS steigt in der Membran-Zeile Z.78“33“=Membran bzw. männlich vom rechten Rand mit der RH5-Ziffer „5“ auf und legt „2“ und „6“ neben die Kalium-Spalte. Dadurch wird ein Zahlenteil QS=3+1+9+1+6=20=Calcium abgespalten, der zuzüglich „6“=26=Erythrozyt die Calcium-Konzentration bei der Invasion erhöht. P113 und RH5 setzen das Signal „29“ zusammen und grenzen Kalium=“19“ am Rand ab. Der Kontaktbereich im Protein P113 zu RH3 hat eine Länge von „19“ Aminosäuren.
RH5 bildet zusammen mit CyRPA=362AS und RIPR=1065AS einen Protein-Komplex [CyRPA - Cystein-reiches Schutzantigen - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ; RIPR - Rh5-interagierendes Protein - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ; P113 is a merozoite surface protein that binds the N terminus of Plasmodium falciparum RH5 | Nature Communications; G.Wright u.a ; Feb. 2017; DOI: 10.1038/ncomms14333]. CyRPA=362AS kann mit Schwefel=16 oder Cystein=C3H7NO2S=6*3+7+7+16+16=64E verbunden sein. CyRA stimmt wegen der Ziffern „6“ und „2“ mit RH5 in der Lage überein. Weil CyRPA=QS3+6+2=11=Zählgröße wird die CyRA-Ziffer „3“ in Z.7891 3-fach von der Ziffer „1“ begleitet, um zur entfernten Randspalte Kontakt zu halten. Zugleich ist die Kalium-Ziffer „1“ eingebunden. Die Protein-Funktionen sind bereits in der Länge der Proteinkette enthalten. Mit dem Zahlenteil „106“ ist die 1. Exflagellationbedingung Xanthurensäure=106E avisiert. RIPR=1065AS bildet mit dem Zahlenteil „1O“ einen Platzhalter neben dem Signal „29“. Der Zahlenteil „65“ hat die Ziffer „5“ mit RH5 gemeinsam. Für die Xanthurensäure=106E liegt eine Ziffer „6“ über Eck über dem Platzhalter-O. Die 2. Exflagellationsbedingung „Mücken-Körpertemperatur=32°C“ ist als Zeilen-Nr. Z.78“32“ vorhanden. Mit „37“_1O_29 ist die Körpertemperatur des Menschen=37°C enthalten. Im Aktionsfall springt die Ziffer 3 vom Menschen „3“7°C weg in de Platzhalter und es werden 32°C Mückentemperatur lesbar. Zur Prozesssteuerung ist Z.7+8+3+2=20=Calcium vorhanden. Notwendig es nunmehr noch die Ziffer „4“ in 343 zu binden, damit männlich=3[4]3 erkannt wird.
Epi.Ref_Rhesus.Z.“7830“#“16“6598677“44“4“9“42
Epi.Ref_Rhesus.Z.7831#“16“6577“40“3“1“9“1“6“6“1“
Epi.Ref_Rhesus.Z.78“32“#“16“65561“3“4“37“10“2“9“
Epi.Ref_Rhesus.Z.78“33“#“16“65348“70“9809“6“5“
Epi.Ref_Rhesus.Z.7834#“16“651361“3“019389
Epi.Ref_Rhesus.Z.7835#“16“64“923“60“4842“24“
Das Protein HDP1=3078AS setzt mit Ziffer „3“ in Z.7834 in der Spalte steigend zur Ziffer 0 an und hat dann 3 Entstehungsmöglichkeiten: a) direkt 780 [3] als Spiegelung lesbar, b) eine Zeile höher horizontal weiter als QS 4+3=7_QS7+1=8_Platzhalter-O oder c) optimal die Ziffer „4“ in einer Quersumme „4“+3=7 einbinden und diagonal zurück, um QS7+1=8 am Platzhalter zu erzeugen.
In der Ausgangszeile Z.7830 wird eine HDP1-Gruppe „44“ als Anhang gebildet, die als Kreislauf eine Winkelsumme=180° mit Kreiszahlen „xO=Kreis“ benötigt. Eine Zeile mit Zählgröße 1_30=Zink_1 entfällt, weil das Drehzentrum 3“4“3 von einen Zinkfingerprotein doppelt als 90°-Ecke gebildet wird. Wegen einer Dopplung bleibt auch die geklammerte 9_“80“_9 außer Betracht, die in der männlichen Zeilennummer Z.78“33“ liegt. Die Zahl „80“ kann alternativ für Bildung von 8 Mikrogameten als „09_8_09“ mit QS=26 verwendet werden. Winkelsumme= 40+10+70+ [30]+60=180° [ohne 30].
Die 90°-Ecke wird vom Zinkfingerprotein „C3H1-type domain-containing protein“=1733AS erzeugt, so dass auch HDP1 über Eck ziehen kann [C3H1-type domain-containing protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt
Genome sequence of the human malaria parasite Plasmodium falciparum - PMC (nih.gov)]. Die Ziffer „4=räumlich“ wird als „Spalte=17_3_[4]_3_71=Zeile“ in beiden Lesarten übersprungen.
Die Anzahl von „männlich=33 + 4=37AS“ liegt im Zinkfingerprotein in einer „Compositionally biased (CB) region“ Nr. 567-603=36+1=37AS [siehe: „NNNDEIINNN TTTTKNNDNN NDNNNNNNNN NNNNNNN“]. CB-Regionen sind Protein-Sequenzen, die für eine strukturelle Rolle in einer Zelle in Betracht kommen. Im Gencode ist Thyrosin=C9H11NO3=6*9+11+7+8*3=54+28+24=106E nicht enthalten. Bei gleicher Anzahl von Elektronen sind in der Xanthurensäure „32°C Mückentemperatur“ bereits integriert: C10H7NO4=6*10+7+7+8*4=60+14+“32“=106E. Wenn die Ziffer „3“ in den Platzhalter-O springt, um 32°C zu lesen, liegen an der der Ecke „132“ an. Abzüglich „106“ über die Spalte verbleiben zufällig Blutmalzeit=26.
Zur Prozesssteuerung steigt die Ca+-Konzentration vor einer Aktion. Die Exflagellation kann im Labor künstlich durch „BAPTA/AM-CAS-Nr.126150-97-8–Calbiochem“ = C34H40N2O18=6*34+40+7*2+8*18=204+40+14+144=402E verhindert werden [BAPTA/AM - CAS-Nr. 126150-97-8 - Calbiochem - 1,2-Bis(2-aminophenoxy)ethan-N (sigmaaldrich.com)]. Die Übermittlung des Exflagellationsbedingungen wird gestört, wenn der Parasit nicht als männlich identifiziert werden kann: Ersichtlich ist, dass die Zahl „402E“ das Zentrum mit der Ziffer „4“ und „O_2“ den Platzhalter mit dem Signal „29“ trifft Abgegrenzt wird „371“=QS3+7+1=11=Zählgröße: Epi.Ref_Rhesus.Z.7932#16655613“4“371“02“9. Bei der tatsächlichen Exflagellation bewirkt BAPTA/AM=402E eine Störung, weil im Code nach der Platzhalterzeile „4002“ statt Medikament=402E verarbeitet werden müssen. Dadurch ist die Spiegelung 02_20=Calcium nicht mehr möglich, so dass keine Aktion ausgelöst wird: Epi.Ref_Rhesus.Z.7995#1631“604“30818499 und Epi.Ref_Rhesus.Z.7996#1631“4002“556“20“18.
7.1) Anschlussthemen im Übergang zu den Apicomplexa
Der Malaria-Erreger „Plasmodium falciparum“ ist der bekannteste Vertreter der Apicomplexa [Lebenszyklus siehe: Plasmodium falciparum (infektionsbiologie.ch)]. In seiner infektiösen Phase wird der Parasit als Sporozoit bezeichnet, den man sich nur massenhaft als Zähleinheit=1 vorstellen kann. Die Mücke saugt das Blut des Zwischenwirts beim 1. Mückenstich, wobei in Gegenrichtung der Parasit in das Blut des Zwischenwirts eindringt. Mit Entwicklungsphasen in der Leber (exoerythrozytäre Schizogonie) und in den roten Blutkörperchen (erythrozytäre Schizogonie) mit ungeschlechtlichen Vermehrungen erreicht ein gleichartiger Parasit beim „2. Mückenstich“ zwecks geschlechtlicher Vermehrung [Gamogonie] den Mitteldarm der gleichen Mückenart. Voraussetzung sind mehrkernige Mikrogamonten, aus denen beim Teilungszerfall viele männliche Mikrogameten hervorgehen. Aus einer Makrogamonte entsteht die weibliche Makrogamete. Die Mikrogameten schwärmen aus, um die Makrogameten zu befruchten. Der Strukturwandel des Parasiten vom M.gamonte zur M.gamete fällt mit dem Übergang vom Zwischenwirt (Mensch u.a) zum Wirt Mücke) beim „2. Mückenstich“ zusammen. Nach dem 1. Mückenstich entwickeln sich die Sporozoiten im Gewebe, meist in der Leber weiter. Als „Besonderheit“ setzt der Malariaerreger „Plasmodium falciparum“ dann seinen Lebenszyklus durch „Befall der roten Blutkörperchen“ fort. Zum Abschluss dieser mehrwöchigen erythrozytären Schizogonie differenzieren sich einige Erreger geschlechtlich zu Mikrogamonten (männlich) und Makrogamonten (weiblich), die beim Blutmahl von der Mücke aufgenommen werden. Die Teilung der „M.gamonten“ zu „Mikro- und Makrogameten“ findet erst im Mückendarm statt. Die Vereinigung beider Geschlechtszellen Syngamie bildet eine Zygote. Bei der gegengeschlechtlichen Vermehrung verschmelzen das Zytoplasma und die Zellkerne beider Zellen [siehe: Mikrogamont - DocCheck Flexikon].
Welche Zahlenbilder sind vorstellbar? Bei der geschlechtlichen Vermehrung kann mit männlich=33 die Bildung von Mikrogameten=331 symbolisiert werden. Die nachfolgenden Themen von Zellumlagerungen, Plaque und Zelltod haben scheinbar nichts mit den Apicomplexa zu tun. Wenn aber der Zelltod unflexibel zu „335“ führt, dann ist der Untergang eines Mikrogameten „331“ aufgrund einer Verschmelzung mit der weiblichen Makrogamete sein Zelltod „335“. Für diesen Fall ist mit weiblich=66 die Zeilen-Nr. Z.xx66 geeignet. Die Serienzahl #1“79“ bleibt als durchlaufender Zeilentransporteur strukturell unbeachtet. Das Zytoplasma „33“ von Makrogamet und Mikrogamet kann sich mit 5_(33)_33_5 vereinen: Struktur=5_QS 3+0+3+6+6+6+9=33_335_2=paarig: Epi.Ref_Rhesus.Z.7266#179“5“303“666“9“335“2.
Die Anfangszeile nach den Makrophagen enthält bereits die die Bildung eines Mikrogameten „331“ mit dem Zellkern „353“ als Zielvorgabe. Die Form=7 bildet ein äußeres Zytoplasma=33 an dem flexibel=6 einige Geißeln=1 in der Anzahl=3 zur Fortbewegung dienen „33_613“: Epi.Ref_Rhesus.Z.7“11“6#18“331“47“33“6“1“353“2. Zur Darstellung einer Spindelform fehlt die Krümmung (64/46). Mit QS=53 wie auch im Code enthalten, müsste die Zählgröße=11 für 53+11=64 ergänzt werden. 2 Zeilen weiter sind Krümmungen verpackt: Epi.Ref_Rhesus.Z.7“11“8#183263“22“6“2“4“2“46“9. Mit der Zählgröße „11“ in der Zeilennummer muss sich anschließend eine Vielzahl von (vermutlich noch unreifen) Mikrogameten „331“ zu einem Makrogamonten „1331_5“ zusammenschließen. Geeignet ist Z.QS7+2+0+2=11=Zählgröße: Epi.Ref_Rhesus.Z.“7202“#18“11“257490“1“331“5“. Nachfolgend wird die spätere Zerfallsteilung als Wartezeit an den Timer=60 Sek. verbunden. Die Zahl „313“ ist lediglich ähnlich und muss sich noch zu „331“ umgestalten. Über die Zeilen-Nr.Zxx03 muss die Zahl „3“ in die Nullstelle (Platzhalter=0) bei der späteren Verschmelzung einwandern: Epi.Ref_Rhesus.Z.72“03“#18“11“00“6“031“36734. Die Zeilen-Nr. Zx24x enthält die Zeit=24 als Serie, so dass ein Zerfallsprozess möglich ist. Es kann nach Erklärungen für das Schlüssel-Schloss-Prinzip „56“ oder die Bedeutung von 18 AS, 262 AS und Eisen=26 in Bezug auf die Membran „33“ gesucht werden, jedoch ist der Zerfallsprozess der Mikrogamonte hier momentan unbekannt: Epi.Ref_Rhesus.Z.7242#180125“33“0626056.
Mücken (Nematocera) und Fliegen (Brachycera) sind eine Unterordnung der Zweiflügler (Diptera). Die Malaria-Mücke (Anopheles-Mücke) ist eine Gattung in der Familie der Stechmücken (Culicidae). Von den etwa 420 Arten der Anopheles übertragen 40 Arten die Malaria. Ohne Kenntnis der Oberflächenproteine kann der Zeilenlauf von Z.7157 bis Z.7172 alternativ einem Mückenstich und den 3 Hautschichten zugeordnet werden. Das ist überprüfbar, indem das wirksamste Mückenspray „DEET“=C12H17NO=6*12+17+7+8=108E getestet wird. Das Mückenspray „108 E“ auf der Haut verhindert einen Mückenstich, weil der Nahrungskanal „808“ und dessen Freigabe mittels Token-86 für die Mücke vom Nerv=7 unlesbar ist. DEET ist unwirksam gegen Bienen und Wespen. Mit QS 1+8+2=11 ist eine Zählgröße enthalten. Mit der Spiegelung 1“6_0“_61 wird der Timer=60 aktiviert. Weil dieses unkonkret ist, wird wegen „1(8)2“ je nach Dosis eine Wirkungsdauer von 8 bis 12 Stunden festgestellt (siehe: PharmaWiki - DEET): Epi.Ref_Rhesus.Z.“7“165#18206“108“0864466.
Nach dem „2. Mückenstich“ zieht der Parasit mit der Blutmalzeit der Mücke durch ihre Speiseröhre „808“, die sich als kurze Serie über 4 Zeilen Z.7211 bis Z.7214 zeigt. Die Speiseröhre beginnt nicht direkt am Stechrüssel, weil vor dem Insektengehirn noch eine Pumpeinrichtung zwischengeschaltet ist. Außerdem muss im Thorax zwischen dem Weg in den Kropf oder direkt in den Magen entschieden werden.
In diese zeitliche Streckung wird das Makophagen-Thema mit Ab- und Umbauprozessen auf der Zellebene des Zwischenwirts (u.a. Mensch) fortgeführt.
Makrophagen im Gehirn: Die zum Schutz des Gehirns vorhandenen Makrophagen sind bereits mit der Embryonalentwicklung eingewandert. Bei einer Gewebeschädigung werden Mikrogliazellen zu Makrophagen umgeformt. Aufgrund der Blut-Hirn-Schranke wandern die aus den Monozyten im Blut gebildeten Makrophagen nur ein, wenn das Gehirn bereits schwer geschädigt ist. Zunächst wird für die Makrophagen über das Plaque-Thema das Gehirn als Aktionsfeld angelegt.
Insbesondere in geschädigten Neuronen wird das Protein ERAB (endoplasmatic reticulum associated binding protein) mit 262 Aminosäuren produziert. ERAB ist mit Beta-Amyloid verbunden. Es gibt 2 Arten von Beta-Amyloid, 40 AS und 42 Aminosäuren, wobei bei Alzheimer eine Plaque-Bildung in Neuronen über „Beta-Amyloid 42“ erfolgt [Beta-Amyloid – Wikipedia]. ERAB gehört zur Familie der Alkohol-Dehydrogenasen. [Alkohol=C2H6O=6*2+6+8=12+14=“26“]. Im Zuge einer sogenannten „Translozierung“ wird ERAB am endoplasmatischen Retikulum (ER) abgebaut und an der Plasmamembraninnenseite neu aufgebaut. Innerhalb des Neurons, am Rand des Zellkerns, liegt die Ausgangsposition am „ER“vor. Kernhülle 33_Nerv=7_33 eines Neurons: Epi.Ref_Rhesus.Z.7116#18“33“14“7“33“61“353“2. Bindung „262_42“ von ERAB=262 AS und Beta-Amyloid 42=42 AS. Die Zeit=24 ist mit angelagert und ERAB wird in einer zweiten Membran-Position „3“26“3“2 an der Zellmembran „33“ avisiert. Nachfolgend muss es dann zur Translozierung kommen, wobei ERAB abgebaut und an der Plasmamembraninnenseite neu aufgebaut wird [siehe: ERAB - Lexikon der Biochemie (spektrum.de)]: Epi.Ref_Rhesus.Z.7118#18“32632“262“42“4“69.
Plaque-Ablagerungen sind damit verbunden, dass der Tages-Timer=24 auf eine Jahresbasis 365 Tage umgestellt wird, und bis zur Erkrankung exakt 21 Jahre gezählt werden. Wenn dieser Alzheimer-Timer erst im hohen Lebensalter startet, kann man das Problem verschmerzen. Für diese Rechenaufgabe wird Beta-Amyloid 42 in eine Zählgröße „11“ eingespannt als „1_42_1“. Die Zeit=24 wird mit der Gruppe 44 und der Zählgröße kombiniert. Zur Gruppe gehören 3 Teilnehmer (Beta-Amyloid 40 AS / 42 AS und ERAB=262AS). Die Zielstellung liegt darin, die Zahl „3“ über den Zeilenlauf als „Nerv=7_Zählelement=1_Transportzahl=3“ über den Zeilenlauf durchzuziehen und an eine folgende Zahl „65“ für „3_65 Tage=1 Jahr zu koppeln. Am rechten Zahlenrand ist die Deadline=21 Jahre normiert. Die Zahl „3“ endet jetzt und liegt in der Folgezeile im Code erneut vor. Die Bindung „3-65“ erfolgt nach 3 Zeilen, wenn die Zählgröße „1_4_1“ in der Zeilen-Nr. Z.7“141 erscheint: Epi.Ref_Rhesus.Z.71“3“9#1827“24“141“25“1421“. Für den Typ „Beta-Amyloid 40“ 40 AS in der Z.Nr. Mit „963“ wird die Zahl „3“an die Zahl „96“ und einer Gruppen-Klammer 4_96“3“_4 gebunden, damit die Zahl „96“ in der Folgezeile an die Zahl „5“ als „965“ binden kann: Epi.Ref_Rhesus.Z.71“40“#1826985“496“3“4“999. Bindung 9“65“ nach 96_3 für „365“Tage = 1 Jahr: Epi.Ref_Rhesus.Z.7“141“#182672“965“186094. Zum Abbau von ERAB=262AS wird das Protein in die Zahl „2“ in der Zeilen-Nr. und die Zahl „26_“ im Code zerlegt und nachfolgend weit entfernt wieder neu aufgebaut. Hierfür wiederholen sich „879“ als QS 8+7+9=24=Zeit in der Folgezeile: Epi.Ref_Rhesus.Z.714“2“#18“26“473“879“01694.
ERAB „262“ baut sich neu auf. Timer=“879“=24=Zeit am Neuron „777“: Epi.Ref_Rhesus.Z.7143#18“262“181“777“879“0. Die Alzheimer-Plaque-Ablagerung wirkt als Zeitzähler QS 1+8+2=11 für eine „Plaque-Struktur=7_ Nerv=7_0_QS 6+9+9=24 Zeit_00_QS 5+4+4+4=21 Jahre“ der mit Z.QS 7+1+4+5=17=Chlor den Säuretod der Nervenzelle zur Folge hat: Epi.Ref_Rhesus.Z.“7145“#182“570“699“00“5444“.
Aufgrund der durch Plaque geschädigten Zellen müssen sich Mikrogliazellen zu Makrophagen differenzieren, um den Zelltod der geschädigten Zelle zu organisieren. Der Zeilenbereich Z.7146 bis Z.7170 steht dafür zwecks Suche zur Verfügung. Der Mensch besitzt zur schnellen Informationsverarbeitung 10-fach mehr Mikrogliazellen als Nervenzellen. Sternförmige Mikroglia im Gehirn werden als Astrozyten bezeichnet und sitzen bevorzugt an den Synapsen. Die Nervenfortsätzen (Axone) werden dagegen von den Oligodendrozyten umlagert.
Fälschlich wurde das Thema „Zelltod“, mit der heißen Nadel gestrickt, zunächst voreilig in wenigen Zeilen durchlaufen. Die Makrophagen exprimieren auf ihrer Oberfläche das Protein „CD95L“ (Fas ligand / Apoptosis Antigen Ligand) mit 281 Aminosäuren. Statt „281“ ist aber lediglich eine Serie #181 vorhanden. Die intrazelluläre Domäne (intracellular domain) enthält 81 Aminosäuren [siehe: Human Fas ligand extracellular domain: current status of biochemical characterization, engineered-derivatives production, and medical applications (aimspress.com)/ M.Mukai/ Aug 2022/ DOI: 10.3934/medsci.2022025]. Weil sich das Molekül mit 2 Schmetterlingsflügeln zeigt, halbiert sich die sichtbare äußere Strecke auf 100 AS. Das ergibt im Mittel 81+100 [+100]=181 AS. In Zeile Z.7176 wird beim Säuretod über Chlor=17 eine Beziehung „81(7)_200(17)“ zu insgesamt 281 AS erkennbar. Wenn CD95L=281 Aminosäuren an das Transmembranprotein „ Fas-Rezeptor (CD95/ FasR)“ einer Zelle bindet, tritt der Zelltod (Apoptosis) ein [siehe: Fas-Ligand - DocCheck Flexikon]. Fas-Rezeptor=335 Aminosäuren (siehe: Fas-Rezeptor – Wikipedia). Der Bindungsprozess zieht sich über mehrere Zeilen hin, bei dem der Status der Membran von aktiv 33“1“ auf unbeweglich-stabil 33“5“ gewandelt wird. Der Switch vollzieht sich im Zeilenlauf über den Transporteur Chlor=17. Der säureempfindliche Chloridionenkanal „ASOR“ ist am Säure-induziertem Zelltod beteiligt [siehe: https://www.mdc-berlin.de/de/news/news/die-verwandlung-eines-chloridionenkanals / 2022]. Die Makrophagen schützen die Nervenzellen und die Blutkapillaren: Arterie=9 / Vene=8 / Nerv=7; Zählgröße 11; Blut=26 [Alkohol=C2H6O=6*2+6+8=12+14=26]; Membran „33“: Epi.Ref_Rhesus.Z.7171#“1819“08“7“49“7“41165 und Epi.Ref_Rhesus.Z.7172#“181“88“33“860002“64“. Der Zelltod [1*81 AS / 335 AS] wird mit „331“ vorbereitet und die Zahl „5“ wird bereits markiert 8_“5“_8. Die Zahl 17=Chlor in der Serie Z.“7“17“x“ ist der Zeilen-Transporteur: Epi.Ref_Rhesus.Z.7“17“3#“1*81“858029“331“367. Der Zelltod wird eingeleitet, indem die Anlagerung der Struktur-5 an die Membran-33 avisiert wird mit 7_33_7_77_5 und dem Zeilen-Transporteur Z.7_“17“5“: Epi.Ref_Rhesus.Z.7“17“5#“1*81“80733719“775“6. Die Zahl „5“ ist am Transporteur „17“ gebunden, die Zahl „331“ steht zur Veränderung Switch „1/5“ bereit: Epi.Ref_Rhesus.Z.7177#“18“17“5“6673316692. Der Zelltod tritt ein, wenn die Zahl 5 an der Membran angedockt hat, wobei die aktive Zahl „1“ nur zur Seite getreten ist „1*81“_7_“3“1“35“: Epi.Ref_Rhesus.Z.7“17“8#“1*81“7“3(1)35“1963485. Chlor=17 ist über den Transporteur nunmehr im Code enthalten und hat den Sekunden-Timer=60 beim Zelltod auf 0(Null) gestellt mit flexibel=66_QS 4+5=9=Ende_QS 6+3=9=Ende. Der Zelltod ist Säure-indiziert eingetreten - es lebe der König: Epi.Ref_Rhesus.Z.7179#“18“17“0“60“37664563.
Fehlfaltung von Proteinen: In der Zeilen-Nr. Z.72“62“ und im Code #...62 ist die Aminosäure „Prolin“ = C5H9NO2=30+9+7+16=62E enthalten, wobei mit „62_9“ alternativ Kupfer Cu=29 enthalten ist. Das Eiweiß „Prion=254 Aminosäuren“ ist doppelt gefangen als seitlich=9_254_254_9=seitlich. Diese Nachbarschaft führt bei einer zufälligen spontanen Fehlfaltung zur Infektion. Das bindet. Prion PrPC kann sich aber auch in erheblicher Menge lawinenartig in ein amyloidogenes Prion [Prion-Protein-Scrapie (PrPSC)] umwandeln und zur Gehirnerkrankung [u.a. Creutzfeld-Jakob-Krankheit (CJK)] führen. Die Erkrankung „Amyloidose“ wird durch eine „Proteinfehlfaltung“ verursacht, die zur extrazellulären Ablagerung von unlöslichen, polymeren Proteinfibrillen führt. Ein spontan umgefaltetes Prion ist infektiös, indem es Nachbarzellen zwingt, diese Fehlfaltung zu übernehmen. Fehlgefaltete Eiweiße sind ein Biomarker für die Alzheimer Erkrankung. Das Eiweiß „Prion“ wird auch im Lungengewebe produziert. In diesem Zusammenhang kommen auch M2-Makrophagen in den Blickpunkt. Prion PrPC erhält die Cu-Konzentration und reguliert und das antioxidative Enzym „Cu/Zn-abhängige Superoxiddismutase (SOD1). Durch die Cu-bindende OR-Region werden durch Influenza-A-Viren infizierte Lungen aufgrund der Minderung von reaktiven Sauerstoffspezies [reactive oxygen species (ROS)] reduziert.
Superoxiddismutasen „SOD1“ ist 154 Aminosäuren lang, jedoch wird die 1. Aminosäure „Methionin“ nach der Expression entfernt [siehe: Superoxid-Dismutase aus Humanerythrocyten essentially salt-free, lyophilized powder, ≥2,500 units/mg protein | Sigma-Aldrich (sigmaaldrich.com). Beispielsweise ist das SOD von menschlichen Erythrozyten folglich nur 153 AS lang, wobei jedes Dimer aus zwei Cu2+-Atomen und zwei Zn2+-Atomen besteht. Methionin = C5H11NO2S= 30+11+7+16+16=80E. Die Beseitigung von Methionin wird nicht zwingend durch die Zahl 80E adressiert, sondern es wird der Schwefel=16 in einer Prozesssteuergröße als Serie #1“79“ mit QS=7+9=16 abgewickelt, wobei mit der Ziffer „1“ die 1. Aminosäure „Methionin“ in der Kette adressiert wird, die Schwefel enthält.
Sind weitere Entwicklungsschritte des Parasiten in der Mücke (Endwirt) im Anschluss an die Zygote über Ookinete und Oozyte bis zum infektiösen Sporozoiten erkennbar?
Die Zeile Z.72“66“=weiblich und dem Code „1795303“666“9“33“52“ mit männlich=33 kann als „Befruchtung einer Eizelle“ betrachtet werden, zumal ein Kern“505“ als „Zygote“ folgt. Mit dem Prion in Z.7262 kann der Zeileninhalt noch auf andere Weise betrachtet werden:
Die Evolution zerlegt die Zahlen bei Bedarf in eine Bildsprache, um Verschiebungen über mehrere Zeilen als Strukturprozesse durchzuführen. Weil die Serie #1(79) durchläuft, ist dieses ein Prozess. Die Steuergröße „79“ wird nicht mitgelesen, so dass SOD1=1(79)53 AS produziert wird, wobei Zink=30 als Symbol mit integriert ist. Die Zahl „33“ ist dann nicht männlich, sondern eine Membran=33. Wird „Methionin“ entfernt, wird SUB1 statt 154 AS mit 153 AS angezeigt als 1(79)53. Das ist mathematisch unausweichlich, weil eine höhere Zeilennummer in der Serie einen kleineren Code verursacht: Epi.Ref_Rhesus.Z.7266#“1(79)53“0“3“666“9“33“52. Mit Eisen=Blut=Hämolymphe (ohne Fe)=26 und der Form=7 bildet die Zeile Z.7“26“7 eine äußere Umgebung. Es handelt dabei noch um die infizierte Blutmahlzeit vom Zwischenwirt. Erst nach der Bildung einer beweglichen Ookinete setzt sich eine Ooyzyte auf der äußeren Darmwand der Mücke in der Umgebung der Hämolymphe fest: Epi.Ref_Rhesus.Z.7“26“7#“179“505“66“1812838. Es ist nur weiblich=66 sichtbar, weil nur die weibliche Mücke auf eine Blutmahlzeit angewiesen ist.
In Plasmodium-Parasiten werden 5 MACPF-Proteine gefunden, von denen die Ookinete zur Passage des Mitteldarms und zum Eindringen in das Mückenmitteldarmepithel die Proteine PPLP1, PPLP2 und PPLP3 produziert [siehe: Essentielle Rolle von Plasmodium perforin-like protein 4 in ookinete Mitteldarmpassage - PMC (nih.gov); E. Deligianni u.a. / Aug. 2018; doi: 10.1371/journal.pone.0201651]. Davon ist nur „PPLP2“ für den Austritt des Parasiten aus dem Wirt maßgeblich. Info Wirtszellenaustritt: „Nach dem initialen Austritt der Leberschizonten aus den Hepatozyten erfolgen zwei weitere Wirtszellaustritte jeweils aus dem Erythrozyten: der Austritt der Merozoiten am Ende des asexuellen Entwicklungszyklus und der Austritt der reifen Gametozyten während der Transmission von P. falciparum vom Menschen auf die Anopheles Mücke. Allen drei Wirtszellaustritten ist gemeinsam, dass es sich um „inside-out“-Austritte aus den Wirtszellen handelt, während derer die parasitophore Vakuolenmembran (PVM) vor der jeweiligen Wirtszellmembran ruptiert. Außerdem geht allen drei Wirtszellaustritten die Proteasen-vermittelte Destabilisierung des Wirtszell-Zytoskeletts voraus und es kommt zu einem Anstieg der intrazellulären Calciumkonzentration während der PVM Ruptur (zusammengefasst in: [Wirth & Pradel, 2012])“; zitiert in „Charakterisierung von Proteasen in den Blut- und Sexualstadien des humanpathogenen Malariaerregers Plasmodium falciparum“; Diss. T.Weißbach /2018/ https://publications.rwth-aachen.de/record/726490/files/726490.pdf ]. Als Information über die Anzahl der Aminosäuren wird die maximale Länge von 788 AS ausgewählt [siehe: Exiting the erythrocyte: functional and temporal analysis of a malarial subtilase (ucl.ac.uk); N. Silmon de Monerri /Division of Parasitology MRC National Institute for Medical Research London, NW7 1AA]. PPLP2=“788“ AS ist adressiert: Epi.Ref_Rhesus.Z.7“26“9#“1“(79)45627244“3“788“. Der Darm wird durch die Salzkonzentration Z.7+2+8=17=Chlor#17_5_11=Natrium_5_17=Chlor dargestellt: Epi.Ref_Rhesus.Z.7280#“17“9185115988“17“3. Für die schnelle Entwicklung der Ookinete wird der Timer auf 60 Sekunden=Minuten eingestellt, weil der Parasit eine drastische, geschlechtsspezifische morphologische Veränderung durchläuft: Die Dopplung 60_60 ist an QS 2+8=10 gekoppelt. Mit Z.x28x als Dopplung folgt Calcium=10+10=20, weil die Calcium-Konzentration im Parasiten sprunghaft ansteigt. Die Prozessgröße „60“ wird nicht mitgelesen, so dass eine Entwicklungszeit von exakt 15 min als „1(60)5“ vorgegeben wird [siehe: „Mit der Ruptur der PVM gelangen parasitäre Moleküle aus der PV in das Zytoplasma der Wirtszelle. Unter anderem beginnen Proteasen das Zytoskelett zu degradieren und so die Wirtszelle flexibel für den Wirtszellaustritt zu machen. Dieser wird nach vollständiger Reifung der männlichen Mikrogameten und der weiblichen Makrogameten 15 Minuten nach Beginn der Gametogenese durch die Öffnung der Wirtszellmembran an einer einzigen Pore vollzogen. An der Bildung dieser Pore ist das parasitäre Protein PfPLP2 (Perforin-ähnliches Protein 2; perforin-like protein 2) beteiligt und die reifen Gameten verlassen die Wirtszelle im Mitteldarm der Mücke [Wirth et al., 2014].“; zitiert in: https://publications.rwth-aachen.de/record/726490/files/726490.pdf ; T.Weißbach /2018]: Epi.Ref_Rhesus.Z.7“28“1#179“1“60“5“0“60“28“553 .
Die besondere Struktur der Ookinete ist erforderlich, um aus dem Blutbulbus zu entkommen, sich vor der Vedauungsumgebung zu schützen und in das Epithel des Mitteldarms einzudringen. Wird eine Ookinete bei einer Expansionsmikroskopie aufgeblasen, dann hat sich Ookinete gegenüber einem lang gesteckten Sporozoiten verkürzt, weil die Länge der auf der Oberfläche in Längsrichtung gespannte Mikrotubuli ausreichend ist, vom vorderen Polring den hinteren Pol zu erreichen. In der Spitze (Apikalkomplex) sind keine 3 Polringe erkennbar, sondern nur 1 Polring schwebt dominant als „Heiligenschein“ über der Ookinete. Statt einem Strukturring „505“ ist eine dominante Strukturbildung über 2 Zeilen erkennbar. Die Struktur-5 wird von einer Spiegelung „oben=9_60_5_06=flexibel_EXTRA=8_55=Struktur“ markiert und herausgehoben: Epi.Ref_Rhesus.Z.7281#17“9“1“60“5“06“02“855“3. Weil in der Folgezeile erneut die Struktur=55 dominant ist, werden beide Zeilen zum Polring vereinigt. Statt „855“ ist nunmehr mit „EXTRA=8_Ring=0_55“ eine Änderung auszuführen. In der Zeilen-Nr. und im Code ist übereinstimmend „282“[„2_EXTRA=8_2“] eine Kopplung mit der Zeile Z.7_QS2+8+1=11=Zählgröße erzeugt worden. Die Ziffer „5“ wurde zuvor markiert, so dass unsichtbar „(5)05“ als Ring erscheint. Die in Längsrichtung gespannten Mikrotubuli werden mit 180° (2x90°) am Ende als Schleife gewendet. Zur Längsrichtung steht der Polring mit „90°“ quer zur Längsrichtung. Quersumme der Zeile= 65 = 64 (Ring) + 1 Zeilenaktion. Epi.Ref_Rhesus.Z.7“282“#17913“5“90“282“8“0“55“.
In der kurzen Lebensphase als „Ookinete“ muss der Parasit zwecks Fortbewegung auf der Zellmembran „33“ flatternde „616“ Flagellen „111“ ausbilden. Für die gleitende Bewegung durch Actin / Myosin ist Aktin = 375 AS als Einzelmolekül enthalten: Epi.Ref_Rhesus.Z.7283#“179“111“30“6“3838“93; Epi.Ref_Rhesus.Z.7285#1790621“3“3“75“3452 und Epi.Ref_Rhesus.Z.7286#17903“7557“5“616“11“. Die Längsachse mit den Mikrotubuli auf der Oberfläche ist gewunden. Die Bixnom-Schwerachse=84 ist versteckt (bzw. markiert) enthalten, weil die Zahl „91“ aus der Zeilennummer mit QS 9+1=10 auch im Code enthalten ist als „8_(91)_4“. Um eine lesbare Schwerachse herzustellen, muss QS 9+1=10 beseitigt werden. Mit QS 1+7+8+9+1+4+7+7+7+7+2+5+1+2+6=74 entsteht dann eine Bixnom-Krümmung=64, wenn um diese Zahl „9+1=10“ reduziert wird. Folglich ist die Formachse=7777 gewunden [Mikrotubuli siehe: Form follows function: Variable Mikrotubuli-Architektur im Malariaparasiten | bioRxiv ; K. Grünewald u.a. (April 2022); doi: https://doi.org/10.1101/2022.04.13.488170]:
Epi.Ref_Rhesus.Z.72“91“#17“8“91“4“7777“25126.
Die Ookinete wandert durch den Mitteldarm der Mücke und setzt sich innerhalb der Darmwand zwischen den Epithelzellen „33“ und der Basalmembran „333“als eine Oocyste fest [Abbildung der Ookinete im Darm siehe: Quantitative Analyse der Bewegung von Plasmodium Ookinete in drei Dimensionen deutet auf eine entscheidende Rolle für die Zellform in der Biomechanik der Gleitmotilität von Malariaparasiten hin - PMC (nih.gov) ; A. Kan u.a. /Mai 2014/. doi: 10.1111/cmi.12283].
Innere Darmwand „33“: Epi.Ref_Rhesus.Z.7348#1775268977128“33“. Festsetzen der Ookinete als Netzwerk Form=7_Struktur=5_444_7=Form: Epi.Ref_Rhesus.Z.7351#17“7454447“611739. Basalmembran „333“: Epi.Ref_Rhesus.Z.7356#177“333“828764804.
Bildung einer Oocyste „707“ als Volumenform an der Basallamina „333“: Epi.Ref_Rhesus.Z.7380#1767571“333“86“707“. In der Oocyste bilden sich durch meoitische Teilungen (Sporogonie) „Extra=8_Vermehrung=1111_Form=7_8=Extra“ neue Sporozoiten als potentielle Krankheitserreger. Die Ziffer „8“ steht für die neue Zielrichtung zur paarigen Speicheldrüse (ähnlich 8888). Der unpaarige Ausführungsgang der Speicheldrüse führt in den Stechrüssel: Epi.Ref_Rhesus.Z.7415#1759“22“8“11111“7“8“6. Die Oozyte platzt auf, indem ein Loch seitlich=9_0_9 zwischen 2 Membranen „33“ dargestellt wird: Epi.Ref_Rhesus.Z.7419#1758279612“33“845; Epi.Ref_Rhesus.Z.7422#1757568“909“18067 und Epi.Ref_Rhesus.Z.7423#1757“33“213578593.
Mit Z.74_24=Zeit gelangen die neu gebildeten Sporozoiten „1_77=Universalwirkstoff_1“ in die Hämolymphe=26 über „2“ Wege, weil es 2 Mücken-Speicheldrüsen gibt (jedenfalls bei einer Fliege): Epi.Ref_Rhesus.Z.7424#17570954“26“1771“2“.
Auf dem Weg zur Speicheldrüse wird die Speiseröhre (Ösophagus) “808“ passiert Epi.Ref_Rhesus.Z.7427#1756385679“808“67. Die erwarteten Speicheldrüsen „8888“ ziehen sich zur Volumenbildung als Durchlauf „88“ über 3 Zeilen. Es werden beide Speicheldrüsen durch die Dopplung „533_335_88“ adressiert: Epi.Ref_Rhesus.Z.7438#17537“88“17476996; Epi.Ref_Rhesus.Z.7439#175355241“88“6530; Epi.Ref_Rhesus.Z.7440#17“533“16726“335“88“. Die beiden ausmündenden Speichelgänge „858_80_848“ vereinigen sich im Thorax und ziehen (bei der Fliege) von oben, vorbei an der Speiseröhre, nach unten, um dann die Engstelle zum Kopf zu passieren: Epi.Ref_Rhesus.Z.7425#1756“858“7“80“32“848“. Speiseröhre Ösophagus „808“: Epi.Ref_Rhesus.Z.7427#1756385679“808“67. Der Mückenhals zeigt sich als Engstelle räumlich=4_0_4. Die Speiseröhre zieht (bei der Fliege) mitten durch das Gehirn und der Speichelgang muss einen anderen Weg finden. Bei der Fliege wird eine mysteriöse Auskleidung in der Art „22“ wie eine Luftröhre gewählt, um vom Zusammenhang Speicheldrüse=888 auf die Mündung des Speichelganges im Rüssel mit 707 o.ä. zu wechseln, d.h. der Speichelgang wird bereits im Zwischenzustand als „202“ angedeutet: Epi.Ref_Rhesus.Z.7432#1755“2“0“404“2“51062. Die 22er Auskleidung des Speichelganges wird avisiert und die Sporozoiten „11“ werden im Speichel „22“ transportiert: Epi.Ref_Rhesus.Z.7435#17544958“22“99“11“2. Bei einem Parasiten ist es kein neutraler Speichel, weil der Sporozoit gleichzeitig mit dem Speichelfluß in den Zwischenwirt (u.a. Mensch) eindringt. Die Mündung des Speichelganges wird deshalb nicht leer als „707“ (Speichelfluss bei Bedarf) adressiert, sondern mit dem TOKEN-68 kombiniert. Die Gegenrichtung TOKEN-86 ist die Blutnahrung in den Magen der Mücke: Epi.Ref_Rhesus.Z.7436#17542598“7“68“07“28. Zunächst aktiviert die Mücke mit dem Token-86 das Nervensystem=7, sofern mit Zeit=24 die Tageszeit passt: Epi.Ref_Rhesus.Z.7439#1“7“53“55“24“18“86“53“0. Mit Z.Form=7_Gruppe=44_0 und der Strukturspiegelung „53_35“, wird aus den beiden scheinbaren Membranen „33“ eine weibliche Mücke=33+33=66 kreiert, um das Blut=26 des Zwischenwirts aufzusaugen. Nach dem Schlüssel-Schloss-Prinzip „1_56_1“ wird geprüft, ob das richtige Opfer für eine Blutmalzeit vorhanden ist, ggf. kann der Parasit das Ziel mitbestimmen: Epi.Ref_Rhesus.Z.7441#1753081097“1“56“1“6. Für das Blut=26 ist eine Transportröhre=100 als Stechrüssel erkennbar: Epi.Ref_Rhesus.Z.7443#175“26“100“2874365. Mit dem Token-68 können nunmehr die Sporozoiten „111“ injiziert werden: Epi.Ref_Rhesus.Z.7458#17490850“68“9“111“0.
7.2) Infektion
Mensch und Mücke leiden unter einem Parasiten, dessen Klientel im Klimawandel wächst. Im unbekannten Zeilenlauf müssen sich mehrere Entwicklungsstadien in einem Kreislauf zeigen. Zugleich muss sich der Parasit strukturell entwickeln.
Die Apicomplexa (lat. Apex=Spitze) sind ein Stamm der einzelligen Parasiten, die infektiöse Oozysten produzieren und einen charakteristischen Generationswechsel durchlaufen, bei dem sich geschlechtlich vermehrende Zellen im Wirt (Mücke) und ungeschlechtlich vermehrende Zellen im Zwischenwirt (u.a. Mensch) abwechseln (siehe: Apicomplexa – Wikipedia). Vertreter der Apicomplexa sind die Gattungen Plasmodium (verursacht Malaria) und Toxoplasma (verursacht Toxoplasmose). Der Krankheitserreger (Sporozoit) gelangt beim Stich der weiblichen Mücke (Wirt=Endwirt) von den Blutkapillaren in der Haut über den Blutkreislauf auf mysteriöse Weise zu den Leberzellen des Zwischenwirts (u.a. Mensch). Für ihre Eierproduktion wird das Eiweiß im Blut der Säugetiere benötigt; die männliche Mücke ernährt sich vom Nektar. Über den Mückenspeichel werden antihämostatische und entzündungshemmende Enzyme übertragen, die die Blutgerinnung stören und die Schmerzreaktion hemmen. Beim Mückenstich werden 20-200 Sporozoiten übertragen.
Die besonderen Merkmale sind in einer Abbildung enthalten: „Apicomplexa. - ppt herunterladen (slideplayer.biz.tr); https://slideplayer.biz.tr/slide/3183260“. Die Parasiten teilen sich den Lebensraum im Blut mit den Makrophagen, so dass sie diesen im BiXnom-Zeilenlauf folgen. Die Erreger besiedeln im Zwischenwirt zuerst die Leberzellen (Hepatozyten).
Die Phase der vegetativen Vermehrung wird als präerythrozytäre Schizogonie bezeichnet. Bei der Schizogonie als eine ungeschlechtliche Form der Zellteilung bei Einzellern vollziehen sich mehrere Kernteilungen ohne nachfolgende Teilung des Zellkörpers. Diese Riesenzellen werden als Schizonten bezeichnet. Deren Zellkörper zerfällt und setzt viele einkernige, fortpflanzungsfähige Zellen (Merozoiten) frei. Nach dem die infizierte Leberzelle aufgeplatzt ist, gelangen die Merozoiten massenhaft in den Blutkreislauf, um die Erythrozyten des Zwischenwirts in einer erythrozytäre Phase zu infizieren. Innerhalb des Zwischenwirts erfolgt ein wiederholter Befall der Erythrozyten, der bis zu 60% der roten Blutkörperchen (Erythrozyten) zerstören kann. In den Erythrozyten bilden sich über Blutschizonten neue Merozoiten. Das Tropenfieber „Malaria tropica“ ist unbehandelt meist tödlich und wird durch Erreger „Plasmodium falciparum“ ausgelöst. Tritt eine Immunität gegen Malaria ein, wird der Erreger trotzdem weiter verbreitet. Bei den Erkrankungen „Malaria tertiana“und „Malaria quartana“ wird die Leber erneut infiziert [extraerythrozytäre Phase].
Erfolgt der nächste Mückenstich beim Malaria-Erreger nach etwa 10 Tagen der Reife, differenzieren sich diese Zellen noch innerhalb der Blutmahlzeit im Wirt (Mücke) zu männlichen Gameten (Mikrogameten) und weiblichen Gameten (Makrogameten). Dieser Zeitpunkt kann sich aber auf viele Wochen nach der Infektion beziehen. Diese Entwicklungsphase wird in der einschlägigen Literatur kaum erläutert. Wahrscheinlich teilt sich ein Zellenbereich in einen großen weiblichen Anteil, dessen Kerne sich zu einem Makrogamonten vereinigen. Daraus bildet sich die weibliche Makrogamete. Die Kerne im männlichen Mikrogamonten vereinigen sich nicht. Bei einer Zerfallteilung werden die Mikrogameten freigesetzt. Die Mikrogameten schwärmen aus, um die Makrogameten zu befruchten. [siehe: Mikrogamont - DocCheck Flexikon]. Die Entwicklung von „M.gamonten zu M.gamenten“ wäre im Zwischenwirt (Mensch) ggf. möglich, bliebe aber ohne den Darm der Mücke (Wirt) erfolglos. Die amtliche Meinung des allwissenden Instituts „RKI“ (Jahr 2015) sieht das anderes, statt M.gam“on“ten nimmt die Mücke im Blut angeblich bereits M.gam“e“ten auf, inclusive der spermienförmigen Mikrogameten [siehe: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Malaria.html ].
Die Verschmelzung beider haploider Keimzellen erzeugt eine diplode Zygote. Noch im aufgenommen Blut des Zwischenwirts bildet sich im Wirt (Mücke) aus der Zygote eine bewegliche Ookinete. Die Okinete wandert durch den Mitteldarm der Mücke und setzt sich innerhalb der Darmwand zwischen den Epithelzellen und der Basalmembran als eine Oocyste fest. In der Oocyste bilden sich durch meoitische Teilungen (Sporogonie) neue Sporozoiten als potentielle Krankheitserreger. Nach dem Aufplatzen der Oocyste erreichen die Sporozoiten in der zirkulierenden Körperflüssigkeit (Hämolymphe, enthält keine Erythrozyten) der Mücke die Speicheldrüse. Über den Speichelkanal und den Saugrüssel werden die Sporozoiten bei der Blutmahlzeit im Kreislauf wieder in einen Zwischenwirt injiziert, was eine Infektion zur Folge hat.
7.3) Eindringen der Sporozoiten in den Zwischenwirt [ab Zeile Epi.Ref_Rhesus.Z.7562]
Der Sporozoit ist das infektiöse Stadium parasitisch lebender Apicomplexa. Beim ungeschlechtlichen Zyklus (Schizogonie) wandert der Sporozoit beim Mückenstich vom Wirt zum Zwischenwirt (u.a.Mensch). Der Parasit dringt in die Zellen des Zwischenwirts ein und vollzieht weitere Vermehrungsvorgänge in Form einer Schizo- oder Merogonie. Form und Ort verändern sich gegenüber der Ausgangsstruktur.
Mückenstich: Beim Mückenstich wird eine Struktur-55 als Serie #Form=7_55_aus Endwirt / Zwischenwirt gebildet. Die Besonderheit „7“2“7_Form=7_7“1“7“ ist eine Rechenaufgabe für die Ziffer „2“. Der Mückenstich „1“ enthält als Zählbasis einen einzelnen Sporozoiten, der als QS 1+7+1=9 (Arterienbewohner /Arterie=9) zu einer „Gruppe injizierter Sporozoiten=44“ gehört. Mit QS=2+9=11=Zählgröße handelt es sich um eine Anzahl von 200 Sporozoiten in der Injektion als „2(9)00“. Bei einer Speicheldrüse, allgemein als 8888 o.ä., sind diese zuvor dem Speichelvolumen „80005“ entsprungen: Der mit „2_2“ markierte Bereich enthält als QS 2+7+7+7+1+7+1=32_Gruppe=44_2 einen Funktionsmangel. Der Mückenstich „1“ ergibt als Addition „QS 32+1 Aktion=33=Zellmembran“ – der Parasit wird den Stich zur passenden Zeit fördern: Epi.Ref_Rhesus.Z.7“55“0#1“7277717“1“44“29“00“. Bevor über 4 Zeilen eine 26er Blutserie #17“26“ das Blut ansaugen kann, muss eine Blutpumpe adressiert werden. Dieser Transport wird durch eine Dopplung „553“ zwischen Zeilen-Nr. und Code erreicht. Mit „70_07“ sind Nullen als Platzhalter vorhanden. Die Mücke ernährt sich in Richtung TOKEN-86, für den Parasiten ist es umgekehrt wie nachfolgend TOKEN-68 in „68“5“68“: Epi.Ref_Rhesus.Z.7“553“#17270854“553“0769 und Epi.Ref_Rhesus.Z.7554#17“26“85“68“2339674. Außer den Säugetieren werden auch die Dipteren (Zweiflügler, wie Fliegen) zu Opfern. Deren Hämolymphe enthält kein Erythrozythen=26, trotzdem ist Hämolymphe=Blut=26. Schädlich für den Parasiten wäre folglich ein eingebautes Merkmal „666“ der Bienenkönigin, weil die weibliche Mücke nur „66“ kennt.
Haut des Zwischenwirts: Die Anzahl der 200 Sporozoiten als 2(9)00 wiederholt sich in Kombination mit dem Gerinnungshemmer „Acetylsalicylsäure (ASS)= C9H8O4=6*9*8+8*4=54+8+32=94 E“. Die Wirkung beruht darauf, dass ein Acetylrest auf einen Aminosäurerest (Serin 530) übertragen wird [siehe: Acetylsalicylsäure – Wikipedia]. Serin= C3H7NO3=6*3+7+7+8*3=18+14+24=56E. Die Hemmung hält 8-11Tage an, weil sich die Thombozyten ohne eigenen Zellkern erst wieder neu bilden. Welche Stoffe die Mücke tatsächlich infiziert, ist momentan unbekannt. Die Zahl „56=Serin“ stimmt zufällig mit dem Schlüssel-Schloss-Prinzip überein, d.h. das Opfer wird nach Duftmolekülen wie ein Fingerabdruck ausgewählt. Die Restsumme QS 7+5+9+3+2=26=Blut gibt die Blutkapillaren als Ziel des Mückenstichs vor: Epi.Ref_Rhesus.Z.7558“#1725“942“9“00“75932“. Der Parasit muss nunmehr den Vorgang derart unterstützen, dass ein geeignetes Opfer (Zwischenwirt) angeflogen wird. Zu diesem Zweck läuft nunmehr das Schlüssel-Schloss-Prinzip=56 als Serie Z.x56x, um bevorzugte Duftmoleküle zu schnuppern. Maßgeblich und auch vorhanden ist der Schweißgeruch aus Ammoniak NH3=7+3=10 [Wasser H2O= 2+8=10 riecht nicht). Der Wasserdampf H2O=2+8 wird als Träger des Duftmoleküls zwecks Transpiration kombiniert als „2_10_8“.
Es müssen 2 Membranzeilen „33“ adressiert werden, weil der Mückenstich durch 2 der 3 Hautschichten dringen muss, um die subkutanen Blutkapillaren zu erreichen: Epi.Ref_Rhesus.Z.7560#172548630“2“10“8“33“ und Epi.Ref_Rhesus.Z.7561#172525809“33“6582.
Das Opfer wurde gestochen, wenn Serin=56 und der Gerinnungshemmer ASS=94 einwirken. Die Restsumme QS 4+9+8+0+0+3=24=Zeit startet den Timer: Epi.Ref_Rhesus.Z.7“56“2#1725029“94“498003.
Die Malaria-übertragende Anopheles-Stechmücke injiziert den Hemmstoff „Anophelin“. Bei der Entzündungsreaktion (Quaddelbildung) wird der Botenstoff „Histamin“ freigesetzt, der den Juckreiz auslöst. Histamin= C5H9N3=6*5+9+7*3=30+9+21=60 . Die Zeit=24 wird als Teil-QS=60 Sek. + 1 Aktionsstich auch in Minuten gezählt, weil die Leberzellen sehr schnell erreicht werden. Zeit=QS 1+7+2+4+8+0+1+8+5+6+9+2+7= „60 Sekunden_Timer=0_1=Mückenstich = 61“. Erst wenn der Mensch von der Mücke am Geruch erkannt wurde, werden die Farben Rot (600 - 780 Nm) und Orange (600 – „640“ nm) bevorzugt, weil es der Hautfarbe des Menschen entspricht.
Nach wenigen Minuten bis zu 1 Stunde heften sich Sporozoiten an die Leberzellen und dringen ein: Epi.Ref_Rhesus.Z.7“56“3#“17“24“801856927“01“.
Bereitstellung von Membranbaustoffen: Die vielen Membranen „33“ einer Zelle können nur mit einem verbindenden Oberflächen-Netzwerk im Zytoskelett unterschieden werden. Das Netzwerk gibt bei den Zellverformungen eine Steifigkeit und die Organellen können daran befestigt werden. Die Mikroskopie zeigt aber keine übichen Wabenformen, sondern parallele Längsstreifen. Die Filamente werden u.a. aus dem Strukturprotein Aktin und Tubulin=450 AS hergestellt. Aktin=374 AS [als Einzelmolekül=375AS]. Für die Bindung an Aktin wird bei den Plasmodien das Prolin benötigt [siehe: A unique profilin-actin interface is important for malaria parasite motility (desy.de) ; C. Moreau u.a. Mai 2017]. Prolin= C5H9NO2=6*5+9+7+8*2=30+9+7+16=62 E.
Der Apikalkomplex an der Sptze des Parasiten bildet eine Bixnom-Kuppenform“464“. Für die Bereitstellung der Baustoffe werden 2 Zeilen vorgelagert. In.Z.QS 7+5+6+6=24=Zeit wird der Bixnom-Code zwecks chemischer Verbindung in eine Bildsprache transformiert, weil eine Zählgröße=11 vorliegt: Für das unsichtbare Aktin=374 AS wird die Struktur=5_4_5 als Problemfall markiert, weil die Zahl „37“ am rechten Rand steht, und somit nicht durch die Zahl 4 ergänzt werden kann. Die notwendige Verschiebung der Zahlenteile wird über den Block Z.756x symolisiert, der in der Folgezeile als Code-Block „756_4“ die Ziffer 4 rechts andockt für Aktin=374AS. Hierdurch werden verschiedene Stoffe verbunden [Arbeitsaufgabe für KI]. Zugleich ist das Tubulin als Teilbild 45(0) in der markierten Bindung 5“4“5 enthalten, es folgt aber keine Null, die 5+5=10 liefern würde. Zur chemischen Verbindung wird die Null als 0_10 in der Folgezeile nachgeliefert und bereits avisiert als Tubulin 45_(QS 2+5+3=1“0“_7=Form): Epi.Ref_Rhesus.Z.“756“6“#17“24“11“79“545“253“7. Weil die Zahl „4“ mit dem Code-Block 756_4 funktionell gebunden ist, kann die Zahl 4 in 642 eleminiert werden, so dass Prolin =62 in 6(4)2 als notwendiger Stoff avisiert wird. Prolin=62 ist am Montageort in der Folgezeile vorhanden. Die Apicomplexa können ohne Prolin keine Membran bilden: Membranbaustoffe für die gekrümmte Zellmembran „646“ mit Prolin=62 E. In anderer Bedeutung ergibt die Zahl „64 E“ das Protein „Clathrin“, das an der Innenseite der Zellmembran liegt: Epi.Ref_Rhesus.Z.7568#17236“62“32081“646“.
Das Blut zeigt sich zunächst nur als Z.QS 7+5+7+7=26=Blut. Die beiden Blutkapillaren –Arten werden markiert im Gefäßnetzwerk-44 als 4_Arterie=9_4 und 4_Vene=8_8=Vene_4. Eingeschlossen zwischen den Markierungen liegt das Signal „57“. Um die Vene 4_8(8)_4 erkennen zu können, muss die Ziffer „8“ nach links rücken und am Signal ankoppeln, um das Heparansulfat als Bruchstück von 578 Elektronen zu bilden. Jedes Gefäß wird von der einer kohlenhydratreichen Schicht „endotheliale Glykokalyx“ ausgekleidet [siehe: Die endotheliale Glykokalyx als essentieller Bestandteil der glomerulären Filtrationsbarriere: Eine intravitale Multiphotonenmikroskopie-Studie (uni-muenchen.de); Diss. C. Gerhard (2019)]. Das Heparansulfat bildet mit 90% den Hauptanteil der 5 Glykosaminoglykane. Es ist eine Besonderheit der Leber, dass die Bruchstücke von Abbauprodukten verarbeitet werden [siehe: Physiologie: Mikrozirkulation & Lymphpropulsion; Wie der Organismus des Menschen funktioniert; H. Hinghofer-Szalka]. Die Summenformel von Heparansulfat ist unbestimmt, weil Ketten gebildet werden. Aufgrund der Bruchstücke kann nach der Simpel-BiXnom-Chemie (BiXnom erzeugt das Periodensystem) jedoch die Grundform gezählt werden: Heparansulfat= (C26H40N2O36S5)n] mit dem Grundelement der n-fache Kette von „6*26+40+7*2+8*36+16*5 = 156+40+14+288+80= 578 E“. Die Gefäße sind somit adressiert, wobei die Vene statt „8“ in geheimer Absicht als Wirkstoff=88=Hormon „Melantonin“ versteckt ist. Wenn der Parasit das Melantonin nutzen möchte, muss er die Dämmerung nutzen, weil die Mücke nachts nicht fliegt. Das Melatonin= C13H16N2O2=8*13+16+7*2+8*2=104+16+14+16=150 E wird in der Zwirbeldrüse des Menschen produziert. Das Hormon Melatonin steuert den Schlaf-Wach-Rhythmus des Menschen und ist auch ein Schlafmittel. Mit Z.7_“57“_7 wird eine Dopplung zur Markierung 4_“57“_4 hergestellt und auf die Zeilen-Nr. verwiesen. Über das Heparansulfat ist die Folgezeile angekoppelt. Beide Zeilen enthalten Z.75xx und die Folgezeile enthält die „75“ auch im Code als Übertrag. In der Addition sind 75+75=150 E = Melatonin: Epi.Ref_Rhesus.Z.7“577#172161“494“57“4884“. Der Prozess wird zerlegt, weil das Dunkelhormon Melatonin nur mit dem Gegenspieler Adenosin funktioniert. Am Tage wird beim Energieverbrauch Adenosin produziert. Der Anstieg signalisiert dann die Müdigkeit. Bei Dunkelheit steigt der Melatoninspiegel und die Schlafbereitschaft. Der Botenstoff Adenosin=C10H13N5O4=6*10+13+7*5+8*4=60+13+35+32=140E hemmt Entzündungsprozesse. Die 140 E werden zerlegt und in Z.7579 auf die Zeitbasis=60 Sek. bezogen, so dass nachfolgend in Z.75“80“ als Summe 60+80=140E gezählt werden: Epi.Ref_Rhesus.Z.7“577#172161“494“57“4884“.
Zeile Epi.Ref_Rhesus.Z.7577 ist eine Referenzeile aus der sich die Invasionszeit aus DELTA.TIME.Z.7577-Z.7581 ergibt. Die Differenz sind 3 Membran-Zeilen „33“ für 3 Hautschichten der Leber [Oberhaut (Epidermis) / Lederhaut (Dermis) / Unterhaut (Subcutis)]. In Z.7.“578“ wird Heparansulfat=578E adressiert: Zeile Epi.Ref_Rhesus.Z.7“578“#17“213“8775982“303“. Mit der Zeit=60 Sek_6 hat der Sporozoit exakt 6 Minuten nach der Injektion an der Leber angedockt: Zeile Epi.Ref_Rhesus.Z.7579#17211606“33“84866. Mit dem Schlüssel-Schloss-Prinzip=56 wird der Parasit nicht als Fremdkörper erkannt: Zeile Epi.Ref_Rhesus.Z.7580#17209“33“56“780197. In der Leberzelle bildet der Parasit eine Vakuole als Hohlform „070“, wobei der Zwischenwirt die Vakuolenmembran aus seiner Zellmembran selbst beisteuern muss. Die Kugelform der Vakuole ergibt sich aus der QS 1+7+2+0+7+0+6+5+6+1+6+5+9+2+7=64=Kugel: Epi.Ref_Rhesus.Z.7581#172070656165927. DELTA.TIME.Z.7577-Z.7581=#9083“8“40“8“9565. Die Bildung der Vakuole ist mit „8_40_8“ exakt nach 40 Minuten abgeschlossen. Die Vakuolen-Membran wurde mit QS 0+8+9+5+6+5=33=Membran geschlossen. Mit QS 9+0+8+3+8+4=32 hat die Leberzelle einen Verlust erlitten und muss ihre Zellmembran durch eine 1 Aktion auf 33=Zellmembran auffüllen. Das mittels Heparansulfat verwertete Restmaterial wird in allen Zellen für Membran- und Speichermoleküle sowie als Speicherfett (Adipozyten) verwendet. Der Parasit nutzt diesen Bedarf aus.
Um als nächsten Entwicklungsschritt aus der Leber auszubrechen und die Erythrozyten zu infizieren, muss der Parasit „Plasmodium falciparum“ das Merozoiten-Oberflächenprotein MSP-1 produzieren, das 539 Aminosäuren enthält (siehe: MSP1 - Merozoit-Oberflächenprotein 1 - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt): Epi.Ref_Rhesus.Z.7582#172047961“539“686.
Arzneimittel gegen Malaria wirken, wenn der Parasit existenziell als Form 7_Medikament_7 oder Struktur=5_Medikament_5 blockiert wird. Gegen die multiresistenten Stämmen von Plasmodium falciparum hilft bisher der Wirkstoff „Arteminisin“ in der Pflanze "Einjähriger Beifuß". Arteminisin= C15H22O5=6*15+22+8*5=90+22+40=152 E. Im Zeilenlauf wird damit bereits der Aufbau einer Zellmembran gestört und später läuft dominant eine lange Serie #152. Bereits während der Bildung der Sporozoiten wird in der Stechmücke (Endwirt) das Oberflächenprotein „CSP (circumsporozoite protein)“ für die Entwicklung in der Oozyte und den Eintritt in die Speicheldrüse der Mücke produziert. CSP wird für den Lebenszyklus bei der Wanderung zum Säugetier (Zwischenwirt) und zur Infektion der Leber benötigt. Entsprechend werden mRNA-Impfstoffe gegen den Parasiten erprobt. Das P. falciparum circumsporozoite protein (CS) enthält (412) Aminosäuren [siehe: Circumsporozoite Protein - ein Überblick | ScienceDirect-Themen / J. Vekemans MD /2016/ Das Impfbuch]. Das CSP bindet dann im Zwischenwirt an stark sulfatierte Heparansulfat-Proteoglykane (HSPGs) auf der Oberfläche von Wirtshepatozyten. Offensichtlich ist nur die Domäne „Circumsporozoit-Protein C-Terminus“ von Bedeutung, so dass eine abweichende Länge von 400 Aminosäuren wirkt [siehe: csp - Circumsporozoite protein - Plasmodium falciparum (malaria parasite P. falciparum) | UniProtKB | UniProt ]. Die CSB-Struktur besteht aus 3 Regionen: N Terminus (eine Wiederholungsregion mit 4 Aminosäuren) und dem C Terminus. Der N Terminus ist in der Lage, Heparinsulfatproteoglykane zu binden. Der C Terminus besitzt eine thrombospondinähnliche „type 1 repeat (TSR) domain“ [siehe: Malaria-Antigene in der Ära der mRNA-Impfstoffe - PMC (nih.gov); Monatsschr Kinderheilkd. 2022; doi: 10.1007/s00112-022-01554-0 ]. Die 400 AS können aus 2 Teilen als „200AS_2 =400 AS“ zusammengebaut werden. Aus der Zählgröße 11 und der Form=7 kann der Durchmesser des Proteins aus 418 gelesen werden, denn mit 02 werden 2 Kommastellen für den Durchmesser= 4,18 nm erzeugt. Die „4“ Aminosäuren vom bindenden N-Nerminus sind die Ziffer „4“ in der Zeilen-Nr. „Z.Form=7_Bindungselement=58_N-Terminus= 4 Aminosäuren“. Das Bindungselement „Struktur=5_8=Extra“ bezieht sich auf das angedockte CSP „QS 4+1=5_8“. Das ist der exakte Durchmesser von 4,18 nm. Der alternative Durchmesser = 4,58 nm ist mit dem Bezugselement „58“ am N-Terminus 4 AS gleichfalls verfügbar: Epi.Ref_Rhesus.Z.“7“58“4“#17“200“2“59“02“418“11“
Die Evolution ist auch nur ein Mensch - man kann sie verstehen
7.4) Merkmale eines Sporozoiten
7.4.1) Apikalkomplex
Bereitstellung der Proteine: Der Sporozoit hat die Leber infiziert und soll nachfolgend mit seinen Zellbestandteilen dargestellt werden. An der Spitze sitzt ein Apitkalkomplex, der den Eintritt in das Gewebe des Zwischenwirts ermöglicht. Adressiert ist das Zytoskelett als Netzwerk „444“. Das Netzwerk ist eine Organelle im Zytoplasma der Zelle. Das Zytoskelett stabilisiert die äußere, doppelschichtige Zellmembran (33_33). Das Zytoskelett besteht aus Mikrofilamenten (7nm), Intermediärfilamenten (10nm) und den Mikrotubuli (15nm) [siehe: Cytoskelett einfach erklärt - simpleclub]. Zur Bildung der fadenartigen Filamente ist das Protein „Aktin“ erforderlich, das im Zytoplasma eine Länge von 374 AS besitzt (Einzelmolekül 375 AS) [ siehe: Aktin – Wikipedia]. Das „Tubulin“ zur Bildung der röhrenartigen Mikrotubuli enthält 450 Aminosäuren (Tubuline – Wikipedia). Erkennbar ist zunächst nur die kuppenartig (64) gewölbte Struktur „55“ als Kombination für den Apikalkomplex als „5_6_5_4“. Als zählbare (11) Form „171“ kommen die Mikrofilamente im Durchmesser= 7 nm als „seitlich=9_7_99“ in Betracht. Die Intermediärfilamente im Durchmesser= 10 nm sind enthalten in „7_QS 1+9=10“. Die Zahl „13_565“ beschreibt die 13 Elemente im Ring-Querschnitt eines Mikrotubuli oder die Variante aus QS 5+6+5=16 Elementen. Die erforderlichen Oberflächenproteine müssen im Code erst entdeckt werden. Die Quersumme der Zeile QS=75 verweist auf die Serie Z.75xx, die einen weiten Zeilenbereich eröffnet. Die Ziffer „8“ in der Serie Z.xx8x ist in Z.7_5“8“5 markiert und steht mit der Markierung 4_“4“_4 als Bixnom-Schwerachse=84 in Beziehung. Das Ringsystem in der Spitze des Sporozoiten entwickelt sich, bis eine Achse mathematisiert ist: Epi.Ref_Rhesus.Z.“75“85#1“7197“99“13“5“6“5“444“.
Die Mikrotubuli setzen an den Polringen im Apikalkomplex an. In der Phase als Ookinete ist der obere Polring von meist 3 Ringen hervorgehoben [siehe: [siehe: The_skeleton__of_the_malaria_parasite_reveals_its_secrets.pdf (unige.ch) [2021]; Wie Malaria-Parasiten den Mückendarm kapern - Natur - derStandard.de › Wissen und Gesellschaft]. Die Mikrotubuli ziehen als parallelen vom vorderen Pole nach hinten, bei der Ookinte durchgehend bis zum hinteren Pol. Die Mikrotubuli unterstützen die gleitende Bewegung. Beispielsweise verformt sich die Zelle zu einer wandernden Einschnürung, wenn der Parasit in eine Zellmembran eindringt. Hier wird angenommen, dass ein Parallelnetzwerk entsteht, wenn am hinteren Ende ein 180°-Wendeschleife vorliegt. Weil eine Wende im Zeilenlauf nicht in die Vergangenheit führen kann, müssen ersatzweise 2x 90° vorliegen. Parallelität kann auch durch die Zahl „222“ unterstützt werden.
Das Tubulin wird sich nachfolgend entwickeln, wenn die enthaltene „45“ mit der 0(Null) zusammengeführt wird. Die 450 AS sind aber bereits mit der Anzahl der Ringelemente 13 bzw.16 enthalten, die eine Verbindung zur Null herstellen: Mit Z.xQS 5+8=13_x ist die Anzahl=„13“ enthalten und auch mit 1_(9)_3_45. Die „58“ aus der Zeilennummer bindet im Code 5_(7)_8 die Anzahl=16 als 1_(4)_6, so dass jetzt die vorhandene Nulle als 45“0“ AS lesbar ist. Die beiden Störgrößen einer korrekten Zählung der Elemente ergeben QS 9+4=13 Elemente, d.h. sie stören nicht, sondern verbinden. Am rechten Zahlenrand steht die Zahl „26“ nicht als Blut, sondern als 1. Anteil des Greiferproteins EB1=268 Aminosäuren, so dass die Zahl in der Folgezeile angelagert werden muss: Epi.Ref_Rhesus.Z.7“58“7#17“1“9“3“45“78“1“4“6“0“26. Die Proteine im Zytoskelett werden durch Greiferproteine zusammengehalten. Aber nur das Protein EB1 [EB=end binding] kann an den Enden der Mikrotubuli andocken [siehe: https://www.scinexx.de/news/biowissenvier-aminosaeuren-als-ansatzstelle-fuer-greiferproteine/ ]. Humanes EB1 hat eine Länge von 268 Aminosäuren [siehe: Crystal Structure of the Amino-terminal Microtubule-binding Domain of End-binding Protein 1 (EB1) - ScienceDirect; https://www.sciencedirect.com/science/article/pii/S0021925820834553 ]. Die Anlagerung „8“ an „26“ ist bereits in der Zeilen-Nr. avisiert. Die Zählgröße=11 hebt die Zahl „9“ heraus als 1“7“1_seitlich=9_11. Ersichtlich ist, dass ein Zugriff auf die 13 Querschnitts-Elemente der Mikrotubuli erfolgt, um die Ziffer „8“zu binden als „9“11“9“1“9“3“9_“8“. Mit der Restgröße QS 3+9+8+2+4+7=33=Membran erfolgt die Verbindung der Mikrotubuli mit der äußeren Plasmamembran: Epi.Ref_Rhesus.Z.7“58“8“#“171“911919“39“8“247. Die Parallelität „222“ der Mikrotubuli Form=7_“1“_7 wird über zwei 90°-Zeilen am kreisförmigen Querschnitt=64 erzeugt: Epi.Ref_Rhesus.Z.7594#1“717“7609“222“9“90“5 und Epi.Ref_Rhesus.Z.7596#1“717“308“64“1“90“876.
Beginn der Plasmamembran: Die avisierten Mikrotubuli „171“ sollen an den Polringen 64_0_4=räumlich ansetzen, wobei die Anzahl von „3“ Ringen in schematischen Darstellungen üblich ist. Nachfolgend diese getrennt in der Folge 1+2=3 Ringe in 5“2“55“1“3 zu finden. Startzeile der Plasmamembran: Epi.Ref_Rhesus.Z.7600#“171“64“0“4“79“5“2“551“3“.
++++
Sonderfall - Erythrozytäre Schizogonie von „Plasmodium falciparum“: Unendlich viele Plasmodien auf Futtersuche sind schlauer als 1 uninteressierter Mensch. Der erkannte Futterweg ist durch passend herstellbare Proteine genetisch fixiert. Schichtenaufbau und Lebenszyklus des Malaria-Erregers siehe: „Lebenszyklus der Malariaerreger (gigers.com)“. Der Malaria-Erreger gelangt nach der Leber als Merozoit mit der Besonderheit einer erythrozytären Schizogonie erneut in das Blut, um sich im Erythrozit in einem Kreislauf mit wechselnden Strukturen massenhaft zu vermehren. Am Kontakt zum Erythrozyten ist das „Merozoite surface protein (MSP 1)“ beteiligt. MSP1=1682 Aminosäuren [siehe: MSP-1 - Merozoite surface protein 1 - Plasmodium falciparum (isolate ro-33 / Ghana) | UniProtKB | UniProt ]. Bei der Verwendung zum Eindringen in den Erytrozyten dringt nur 1 Domäne ein, die nochmals gespalten wird. Der große Rest wird im Blut freigesetzt [siehe: Antibody_profiles_to_plasmodium_merozoite_surface_.pdf; Spring et al. Malar J (2016); DOI 10.1186/s12936-015-1058-8]. Das Protein sitzt auf der Zellmembran des Parasiten. Beim Eindringen in den Erythrozyten liegt diese Zahl nicht mehr günstig als eine Serie vor. Nachfolgend wird dennoch in der 1. Zeile statt 1682 AS eine Länge von 1684 AS angeboten. Die Aminosäuren sind Zahlenbilder, so dass in 1“6“8“4“ AS der BiXnom-Kreis=64 abgebildet ist, der den übergeordneten Zweck als Merozoiten-Kreislauf=64 adressiert. Die Folgezeile enthält das Blut als Z.QS=7+8+3+8=26 mit der Zeilennummer. Es wird bereits ein Korrekturversuch mit „64_28“ angeboten. Weil diese Austauschzahl noch zu „82“ gespiegelt werden muss, wird auf die nächste Blutzeilen-Nr. Z.QS7+8+4+7=26 gewartet. Dort steht die Austauschzahl „82“ am rechten Zahlenrand bereit. Der Korrekturbedarf treibt den Vorgang an. Von der Invasion bis zur Freisetzung neuer Merozoiten vergehen 48 Stunden. Die Funktion von MSP1 wird durch MSP3, MSP7 und Heparin-ähnliche Moleküle unterstützt [siehe:
Processing of Plasmodium falciparum Merozoite Surface Protein MSP1 Activates a Spectrin-Binding Function Enabling Parasite Egress from RBCs - ScienceDirect; M.Blackman; Okt. 2015https://doi.org/10.1016/j.chom.2015.09.007]. MSP7=275 AS [Putative MSP7-like protein - Plasmodium knowlesi | UniProtKB | UniProt]. MSP3=329 AS [msp3 - Merozoit-Oberflächenprotein 3 - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Diese Unterstützung erfolgt ebenfalls indirekt durch eine Bildsprache der Aminosäuren.
Bei der Invasion wird der Parasit durch eine parasitophore Vakuolenmembran (PVM) abgegrenzt, die durch Einstülpen der Plasmamembran des Erythrocyten gebildet wird. Zusätzlich bilden sich 2 intraerythrocytäre Membranstrukturen: Die flachen Membranzisternen „Maurer’s clefts (MC)“ und die Doppelmembranschleifen „Circular clefts (CC)“. Circular clefts (CC) bilden „Exported protein 1 und 2 (EXP-1 und EXP-2)“. In der Maurer`schen Spalte wurde eine Vielzahl von Proteinen nachgeweisen [ Pfsbp1, a Maurer's cleft Plasmodium falciparum protein, is associated with the erythrocyte skeleton - ScienceDirect; C.Breton; (2000); https://doi.org/10.1016/S0166-6851(00)00301-7]. Davon interagiert das Erythrocytenprotein LANCL1 mit PfSBP1, um einen vorzeitigen Zerfall der Erythozyten-Membran (RBC-Membran/ Membran der roten Blutkörperchen) zu verhindern [siehe: Analyse des Proteinrepertoires intraerythrocytärer Membranstrukturen des Malariaerregers Plasmodium falciparum (WELCH 1897); J. Fritsch Diss. 2007, Uni Kiel; https://core.ac.uk/download/pdf/250312702.pdf ]. Malariaprotein EXP-1=162 AS [EXP-1 - Malariaprotein EXP-1 - Plasmodium falciparum | UniProtKB | UniProt] Malariaprotein EXP-2=283 AS [EXP2 - Exportiertes Protein 2, mutmaßlich - Plasmodium malariae | UniProtKB | UniProt]. LANCL1=399AS [LANCL1 Gene - GeneCards | LANC1 Protein | LANC1 Antibody].
Pfsbp1 (Maurer-Spaltprotein/ P. falciparum skeleton binding protein 1)=338 AS [sbp1 - Skelettbindendes Protein 1 - Plasmodium falciparum (Malariaparasit P. falciparum) | Publikationen | UniProtKB | UniProt.
Blut: Im Zeilenlauf wird der infizierte Erythrozyt mit Blut=Eisen=26 adressiert, wobei das Eisen den Sauerstoff bindet. Der Parasit transportiert das Hämoglobin in seine Nahrungsvakuole, um das Hämoglobin zu zerlegen. Das Hämoglobin besteht aus 4 Untereinheiten, meist als Hämoglobin A aus Ketten von je zwei Hb alpha („142“ AS lt. Uniprot) und Hb beta (147 AS lt.Uniprot); jeweils minus 1AS bei Wikipedia). In einer Faltung ist Häm im Eisen-II-Komplex gebunden. Die Anzahl der Aminosäuren können auch doppelt und mit teilweise geänderte Ziffernfolge vorliegen, wenn es dem Funktionsbild dient. Dieses betrifft insbesondere „Topomyosin“ als Einzelkette („284“ AS) im Tubulin zum Aufbau der Mikrotubuli, das als Einzelkette der Länge von 2 Hb alpha-Ketten entspricht. Häm=C34H32FeN4O4=6*34+32+26+7*4+8*4=204+58+28+32=322E.. Häm wird für den Parasiten problematisch, wenn die Umwandlung zum Hämozoin in ein unlösliches Kristall, verhindert oder die Erzeugung von Glutathion zum Hämabbau gehemmt wird. Zum Abbau von Häm muss der Parasit das Tripeptid „Glutathion“= C10H17N3O6S= 6*10+17+7*3+8*6+16=162E erzeugen. Die Polymerisation zum Hämozoin-Kristall hemmt das Malaria-Medikament „Chloroquin“= C18H26ClN3=6*18+26+17+7*3=172E.
Malaria-Gametozytogenese (siehe: Analyse der Rolle von PfAP2-G bei der Malaria-Gametozytogenese - PMC (nih.gov); M. Llinas u.a. (mar 2020); doi: 10.1038/s41467-020-15026-0]: Der Wechsel von der asexuellen Vermehrung zur sexuellen Differenzierung in Gametozyten wird durch Proteine gesteuert. Die Krankheitssymptome der Malaria resultieren aus einem intraerythrozytären 48-Stunden-Zyklus. Es wiederholen sich die Vermehrungsphasen von Austritt und Reinvasion, während die Ring-, Trophozoiten- und Schizont-Stadien durchlaufen werden. Die Trophozoiten können in keine geschlechtliche Vermehrungsphase eintreten, weil diese durch die Proteine „Heterochromatinprotein 1 (HP1)“ und Histon-Deacetylase 2 (Hda2) blockiert wird. Für den Organismus P.falciparum ist das Heterochromatin protein 1 (PfHP1) momentan nicht bekannt. Für für die Fruchtfliege ist HP1=206 Aminosäuren. Für Süßwasserplattwurm Heterochromatin-Protein 1-like protein 1=222 Aminosäuren [ HP1-1 - Heterochromatin protein 1-like protein 1 - Schmidtea mediterranea (Freshwater planarian flatworm) | UniProtKB | UniProt ]. Histone deacetylase 2 (HDAC2)=488 AS [HDAC2 - Histon-Deacetylase 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Bei P.falciparum wird die HP1-Blockade durch das Protein „GDV1“ entfernt. Gametozyten-Entwicklungsprotein 1 (GDV1)=592 Aminosäuren [GDV1 - Gametozytenentwicklungsprotein 1 - Plasmodium reichenowi | Publikationen | UniProtKB | UniProt].
In der Throphozyten-Phase wird eine geschlechtliche Entwicklung für wenige Parasiten aktiviert, wobei die Vermehrung alle nur weiblich oder männlich erfolgt. Die Gametozyten-Entwicklung erfolgt in 5 Stadien. Das 1 Stadium wird durch das Protein PfAG2-G aktiviert. Transkriptionsfaktor AP-2 gamma=16 Aminosäuren [TFAP2G - Transkriptionsfaktor AP-2 gamma - Homo sapiens (Mensch) | UniProtKB | UniProt)]. Für die Regulation ist eine Interaktion mit PfAP2-I (=?AS) erforderlich.
Bei der geschlechtlichen Differenzierung wird das Stadium eines Schizonten entweder nicht mehr durchlaufen oder der Schizont erhält eine Orientierung für die nächste Invasion. Die Differenzierung zu reifen Gametozyten erfolgt innerhalb von 10-12 Tagen. Es werden 5 Stadien durchlaufen. Im „finalen Stadium V“ kann morphologisch in weibliche und männliche Gametozyten unterschieden werden. [siehe: Identifizierung neuer antiplasmodialer Wirkstoffe und Validierung von PfGSK3 als potentiellen Medikamentenangriffspunkt gegen Malaria; A. Adler; Diss.2020; Uni. Hamburg; https://d-nb.info/1216998183/34 ].
Kenntnisstand: Aufgrund der Serie#16... ist PfAG2-G=16 Aminosäuren für eine geschlechtliche Orientierung stets vorhanden, aber nicht ausreichend. Über die Struktur „Maurer’s clefts (MC)“ wird im zeitlichen Hintergrund der 48-Stunden-Zyklus einer ungeschlechtlichen Vermehrung vollzogen. Die geschlechtliche Differenzierung wird über die Proteine der „Circular clefts (CC)“ aktiviert und in den folgenden 5 Stadien vollzogen. Die Merozoiten können nach der ungeschlechtlichen Vermehrung nicht sofort die geschlechtliche Vermehrung fortsetzen, weil die Zellmembran des roten Blutkörperchens als Ernährungsgrundlage gerade gesprengt wurde. Im neuen Umlauf muss beim Durchlauf die Phase eines Schizonten zum Verständnis besser übersprungen werden. Der M.gamonten entwickeln sich innerhalb des Erythrozyten!
Auskopplung der geschlechtlichen Vermehrung aus dem Zyklus der ungeschlechtlichen Vermehrung:
A.) Invasion des Parasiten in rote Blutkörperchen (RBC): Die ungeschlechtliche Vermehrung beginnt nach dem Austritt aus der Leber und der Infektion eines roten Blutkörperchens (RBC / Erythrozyt) als Zyklus über 48 Stunden. Diese 180°-Wende muss über 2 Bögen 90° ausgeführt werden, wobei der zweite 90°-Bogen nur über 2 Zeilen als Winkelsumme 30°+60° vorliegt. Merozioten, die zur geschlechtlichen Vermehrung vorbestimmt sind, können diesen Zyklus nur verhindern, wenn sie an einer 1. Verzweigung im 90°-Winkel nach der Phase „Ringstadium“ und und vor den Phasen „Throphozoit/Schizont“ herauspringen. An einer 2. Verzweigung können die vorbestimmten Merozoiten dann mit einem zweiten 90°-Winkel in die geschlechtliche Vermehrung einsteigen, wobei entgegengesetzt, die ungeschlechtlich vermehrten Merozoiten entweichen. Der 1. Verzweigungspunkt wird mit diesem Konzept bestätigt!
B.) Austritt des Parasiten aus dem roten Blutkörperchen (RBC): Der Austritt wird von Enzymen angeregt. Davon gliedern sich die Proteasen in 5 Hauptgruppen (Cystein-, Aspartic-, Serin-, Threonin- und Metalloproteasen). An der Invasion und der späteren Ausscheidung aus den roten Blutkörpchen sind 3 wesentliche Proteasen beteiligt: Für die RBC-Ruptur ist die Serinprotease PfSUB1 [Calcium-abhängig] unter Mitwrkung von serinreichem Antigen 5 (Pf SERA5) und der Dipeptidylaminopeptidase 3 (PfDPAP3) entscheidend. Der neue Merozoit muss beim Austritt die parasitophore Vakuolenmembran (PVM) und die Erythrozytenmembran (EM) aufbrechen. Das PfSUB1 wird bereits vor dem Austritt aus Austrittsvesikel (Exonemen), in das PV-Lumen freigesetzt, indem es durch PfDPAP3 aktiviert wird. Eine erneute Parasiten-Invasion von Erythrozyten ist möglich, weil sich die Merozoiten an die Gefäßwand heften, um der Vernichtung durch Makrophagen in der Milz zu verhindern. Diese Bindung von der EM zur Gefäßwand mittels dem parasitären Protein PfEMP1 (Plasmodium falciparum erythrocyte membrane protein 1) erzeugt. Beim Anhaften werden auch bisher nicht infizierte Erythrozyten angelagert, was zu einer Rosettenbildung und einer krankhaften Verengung der Blutgefäße führt [siehe: „Charakterisierung von Proteasen in den Blut- und Sexualstadien des humanpathogenen Malariaerregers Plasmodium falciparum“; Diss. T.Weißbach /2018/ https://publications.rwth-aachen.de/record/726490/files/726490.pdf ].
C.) Prozesssteuerung: Durch die Calcium-abhängige Proteinkinase 1 (CDK1)=524 AS:
Kalziumabhängige Proteinkinase, die als Sensor und Effektor des intrazellulären Ca2+-Spiegels fungiert. CDK1 treibt den Prozess an, indem der Eintritt in den Erythrozyten unterstützt wird. Während der Gametogenese ist es essentiell für die Bildung von Geschlechtszellen (m /w). Kann Proteine der Erythrozytenmembranen phosphorylieren. Am Austritt der neuen Meoroziten aus dem Erythrozyten ist CDK1 nur indirekt durch die erforderliche Phosphorylierung von SERA5 p50 [Phosphorprotein erzeugen] beteiligt. Funktion: Im asexualen Blutstadium wird die Kinetik des Merozoitenausgangs aus dem Erytrozyten kontrolliert. Die vorzeitige Ruptur der parasitophoren Vakuole und der Erythrozytenmembran wird verhindert: 2 Varianten: Serine-repeat antigen 5 [P69193 · SERA5_PLAFD]=989 AS [SERA5 - Serine-repeat antigen protein 5 - Plasmodium falciparum (isolate CDC / Honduras) | UniProtKB | UniProt] und Serine-repeat antigen protein 5 [Q9TY95 · SERA5_PLAF7]=997 AS [SERA5 - Serine-repeat antigen protein 5 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ].
Die Vorbestimmung von Parasiten für eine geschlechtliche Vermehrung kann alternativ zur Steuerung im Ringstatium auch noch später im Stadium eines Schizonten erfolgen. Die epigenetische Steuerung erfolgt mit verschiedenen Proteinen (PfFH1, PfAP2_G, ap2-g-Lokus) [siehe: Gametogenesis in Plasmodium: Delving Deeper to Connect the Dots - PubMed (nih.gov); A. Sinha u.a.;Jun 2022; doi: 10.3389/fcimb.2022.877907].
D.) Nachweis des 1. Verzweigungspunktes: Vor „SERA5“ muss erst der erzeugende Hilfsstoff „Calcium-abhängige Proteinkinase 1 (CDK1)=524 AS“ entstehen. Der Zyklus-Ausstieg der avisierten Geschlechtszellen im Winkel=90° wird von Zeile Z.QS7+8+2+3=20=Calcium als dramatisches Ereignis avisiert, und Z.Nr. und Code zugleich aktivert. Der Code enthält 1_1=Zählgröße, der Rest wird summiert Z.QS=20#(1)+QS6+6+7+4+7+7+4+9+5+0+7+0+8=70_(1)= 1_Winkelsumme=90°_1=Zählgröße
In der Ausstiegszeile muss folglich die Signalsequenz=29 als „QS2+9=11=Zählgröße“ angeheftet werden, wie diese beim Wiedereinstieg unter 90° enthalten sein muss. Mit diesen beiden Qutput- und Input-Winkeln=90° wird gleichwertig zur asexuellen Zyklus-Wende „90°+ (30°+60°)=180°“ ein Umgehungszyklus angelegt. Die Zeile Z.QS7+8+2+3=20=Calcium baut am rechten Zahlenrand der Zeilennummer eine Spalte zum Vertikaltransport der Ziffer „5“ mit Z.xxQS2+3=5 auf, so dass in der Folgezeile die Zahl 24=Zeit zu CDK1=524 angelagert wird. Im Code muss SERA5_PLAF7=997 AS avisiert werden, damit Calcium einen Partner erhält. Die Zählgruppe QS4+7=11_QS7+4=11=Zählgröße enthält doppelt die Ziffer 7 als 4774_9, weil die Ziffer „7“ in die Folgezeile transportiert und an Ziffer „9“ angelagert werden muss. Aus „070“ soll die Ziffer „7“ in einen Platzhalter wandern. Dort fällt die „7“ in 9“0“9 als 9“7“9 statt 99“7“. Am rechten Rand steht das Problem QS8+1=9 zur Lösung an. Die Ziffer „7“ muss zu QS9+7=16 verschoben werden. Die Folgezeile enthält dazu die die Verschiebung „16_16“. Der Nutzen liegt in einer Zeilenverknüpfung mit der Zeit-Zeile „24“ und Aktivierung von. SERA5_PLAFD=989AS. Epi.Ref_Rhesus.Z.“78“23“#1667“4774“9“5“070“81. Anlagerung „24“ für CDK1 in der Z.Nr. und Outputwinkel=90°, verknüpft mit Seitenausstieg=seitlich=9. Weil in der Randspalte die Null für 9“0“=Inputwinkel avisiert wird, bleibt der Ausstieg temporär. TIME.DELTA.Epi.Ref_Rhesus.Z.“Z.7824-Z.7854=“6368“46589“6368“: Die Zeitdifferenz zeigt links den asexuellen und rechts mit seitlich=9 die geschlechtliche Vermehrung an. Jeder Seite enthält QS3+8=11=Zählgröße und QS=6+6=12=Halbzeit (beide=24) In „4“6“5“8“9“ erzeugt der Token=68 (statt 86) einen Stopp, weil die Vermehrung erst beginnen muss. QS6+5=11=Zählgröße, so dass 48 Tage für die Dauer der asexuellen Vermehrung gelten. Nachfolgend enthält die Zeile 2 Bereiche: „links=weiblich[66/1]“ und „rechts=männlich [33/2]“. Ergebnis: Die Summe „23“ ist die Dauer von maximal 23 Tagen der folgenden geschlechtlichen Vermehrung. Diese ist links und rechts mit 23 Tagen für die Geschlechter gleich lang und in der Mitte steht der 48-Stunden-Zyclus für die asexuelle Vermehrung: QS6+3+6+8=23_QS4+6+5+8=23_9_QS6+3+6+8=23. Die Zeilennummer Z.7_“824“ enthält das Protein „Glycophorin-bindendes Protein (GBP 130)= 824AS“ GBP130 - Glycophorin-binding protein 130 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Der Parasit besitzt viele Proteine, die eine übliche Signalsequenz von 20-30AS aufweisen. GP130 weicht als Besonderheit davon ab [siehe: „Untersuchung der Funktion der N-terminalen Verlängerung von GBP 130 von Plasmodium falciparum“; L. Barniol /Diss.2013/Uni. Marburg; http://archiv.ub.uni-marburg.de/diss/z2013/0080/pdf/dlfb.pdf]. Signalsequenzen zeigen eine dreiteilige Struktur (n-, h- und c-Region). Die h-Region ist der hydrophobe Kern der Signalsequenz. Dieser liegt als „28“ in Z.78 26/Z.7827 mit Wasser=H2O=2+8=10E vor. Weil die Zeilennummern aktiviert sind, wird in Z.78“29“ ein Ausgangssignal „29“=2+9=11=Zählgröße erwartet, wobei Ziffer „2“ eine Durchlaufzahl ist und die Zahl „9“ aus den beiden Randzahl der h-Region „7+2=9=seitlich“ entsteht.
Das Signal „29“ liegt direkt rechts für „männlich“ und auch als „1_(weiblich=666 als Königin)1_9“ vor, wenn QS1+1=2_9. Nur eines der beiden Geschlechter bekommt das Signal. Aus den Zahlen ergibt sich folgenden Eindruck. Die Realität ist hier absolut unbekannt!
„Weiblich steht links=1 mit Hormon=66“ und „Männlich steht rechts=2 mit Hormon=33“: Diese Filterung ergibt „1_66_(7=Form)=weiblich“_„ [5/1]“_„männlich= 3_02_(7=Form)_ 3“. Weiblich entsteht folglich mit der Ziffer „5“ bei hohem Calcium-Spiegel und männlich mit Low Energie=1, als Gegenteil von 5, bei niedrigem Calciumspiegel: Epi.Ref_Rhesus.Z.7825#“1667“051“30273“980. Die „h-Region“ enthält einen „Calcium-BiXnom-Trichter“ „2882“ mit QS2+8+8+2=20=Calcium, der sich in der Folgezeile als „282“ verengt. Wer diesen findet, kann sich geschlechtlich vermehren. Beispielsweise kommt dann jeder durchschnittliche Calciumspiegel nicht in den Trichter (Das ist das Prinzip des BiXnom-Würfels!): Epi.Ref_Rhesus.Z.7826#1666838“2882“6207 und Epi.Ref_Rhesus.Z.7827#16666253“282“1502. Die h-Region reicht mit H2O=“28“ jetzt in die Zeilennummer hinein, wodurch der Tichter mit“ „828“ zur Selektion noch enger wird. Auf die Schnelle wird dafür das Protein „Calcyclin-bindendes Protein =228 Aminosäuren“ gewählt, weil es eine Spiralspule [Coiled coil] für den Trichter enthält. „Kann an der Calcium-abhängigen Ubiquitinierung und dem anschließenden proteasomalen Abbau von „Zielproteinen“ beteiligt sein. Dient wahrscheinlich als molekulare Brücke in Ubiquitin-E3-Komplexen. Beteiligt sich am Ubiquitin-vermittelten Abbau von Beta-Catenin (CTNNB1)“ [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Im Code ist für „228“AS die Zahl „22“ verfügbar und gemäß Zeilennummer liegt die Ziffer „8“ dann neben der Zahl 22 als „228“. Als Aktion wird dafür keine Spiegelung benötigt, weil in der Vorzeile über der Zahl 22 die Zahl 28 bereits durch den Trichter gelaufen ist. Die Spiralspule liegt in der Proteinkette an Position 7-34 mit eine Länge 34-7=27AS vor. Nunmehr ist in 22“5“777 ersichtlich, dass die Spule mit einer Länge von 27 AS als Struktur 5 und als gewendelte ("64") Form „777“ vorliegt. Die Ziffer 8=EXTRA muss dann für den Durchgang die Ziffer 5=Struktur ersetzen, um „Calcyclin-bindendes Protein =228 AS“ darzustellen. Die Sperre durch die Ziffer „5“ wird zuvor in Zeile Z.7827 mit einer Spiegelung 25_5“0“2 als Schalter freigeschaltet, indem die Ziffer “5“ rechts in einen leeren Platzhalter „0(Null)“ springt: Epi.Ref_Rhesus.Z.7“828“#166“64“1“24“225“7779. Der Parasit kann dieser Spur nur folgen, wenn der BiXnom-Trichter stets im Verhältnis männlich/weiblich =1/8 passiert wird. Weil später aus „1 Mikrogamonten die Zahl von 8 Mikrogameten“ entspringt, wird das männliche Defizit kompensiert und jeder findet seinen Partner. Weil ohnehin nur Parasiten zur geschlechtlichen Vermehrung „in den Trichter fallen“, regelt der Schalter in Z.7827 das Geschlechterverhältnis m/w=1:8. Der Trichter enthält 8 weiblich markierte Parasiten als „2_8_2“. Diese Anzahl kann passieren, weil die Zahl „5“ in „225“ durch die Ziffer „8“ verdrängt wird, um das Protein= 228 AS zu erzeugen. Die Ziffer „5“ soll in den Platzhalter von Z.7827 theoretisch „hochspringen“. Das ist nur durch eine 180°-Wende möglich. Dafür sind aber keine 2x 90° vorhanden, um einen unmöglichen Zeit-Rücksprung zu verhindern. Möglich ist aber ein „Vorsprung als Trichterdurchgang, wenn 180° das Verhältnis 1:8 repräsentieren“. Wenn der Platzhalter nicht besetzt wird, kann die Ziffer 5 in „1“5“_O=Platzhalter“ die Ziffer „1“ nach links in den Trichter schieben, um den Wechsel 1:8 zu organisieren. „Wir schaffen das“, schwärmt der Parasit von fetten Zeiten - und tut es.
Der unbesetzte Platzhalter ist das Ende einer 4-Loch-Randspalte, durch die alle Erreger zur asexuellen Vermehrung „strömen“. Im Platzhalter wird der Durchlauf gestoppt, so dass der Durchlauf durch ein Protein geregelt wird, das ein bekanntes Verhältnis von „1x geschlechtlich / 156x asexuell“ garantiert. Die Evolution fordert das Protein=156AS, weil der Platzhalter mit 15“O“ das Signal=6 benötigt, denn es wird in der Vorzeile mit 2“6“2 markiert. Darüber liegt das Zink=30 vor. Auch ähnliche Proteine binden Zink. Eine Ähnlichkeitsliste für den Erreger ist enthalten für „C-Typ-Lektindomänen-enthaltendes Protein =156 AS [C-type lectin domain-containing protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ].
Die Signalstärke beider Geschlechtssignale ist gleich „1+6+6+6+1=20=Calcium“ und „2+9+5+4=20=Calcium“: Epi.Ref_Rhesus.Z.78“29“#“16661“995713“2954“.
Der 90°-Qutput-Bogen wurde nur avisiert und wird in Z.783“0“ tatsächlich vollzogen, weil am linken Rand nach dem Signal Z.xx„(2) 9“ die „0 (Null)“ für den Winkel=„90°“ einläuft. Der TOKEN=86 für die freie Fahrt ist „nur 1mal“ vorhanden: Epi.Ref_Rhesus.Z.783“0“#16659“86“77444942. Achtung Chaos! Aus 1 Zelle entsteht nur 1 Geschlecht, aber beide Geschlechter werden zwecks Befruchtung benötigt. Nicht der weibliche Parasit ist das Problem, sondern die weibliche Mücke.
Tarnung des Parasiten durch „Selbstinvasion“
Die geschlechtliche Vermehrung des Parasiten vollzieht sich im Zeilenlauf gleichzeitig mit den Zeilen seiner eigenen Entwicklung. Damals, als es noch 4 Jahreszeiten gab, statt immer Frühling, beherrschte das auch der umtriebige Gensch-Män, der sich mit altersgerechten Segelohren auf dem fliegenden Teppich selbst begegnete. Der Teppich hängt jetzt „jwd“ [j(g)anz weit draußen] als Staubfänger mit Brandflecken.
Die weitere Entwicklung im Zeilenlauf würde ihn den Bakterien und Viren ausliefern. Folglich benötigt der Parasit eine 180°-Wende, wozu er mit „zweimal 90°“ die sogenannte „Kurve kriegen muss“ oder „die Fliege (Mücke) macht“, um nicht an der Vergangenheit zu scheitern. Außer den beiden 90°-Zeilen benötigt der Parasit das Blut=26 als Taxi, um in den Blutstrom für den Mückenstich zu gelangen. Zur Verabschiedung des M.Gamonten in den Blutstrom zur Gametogenese mittels 2. Mückenstichs, d.h. die Erzeugung von M.gameten, wird eine Zink-Gruppe „44“ mit Z.7+8+9+6=30=Zink_#_30=Zink_44=Gruppe gebildet. Damit ist es möglich, den beiden „90°-Expeditionszeilen“ einen Beipackzettel als Montageplan anzuheften. Maßgeblich ist die Zählgröße 11 als 1_[QS6+5=11=Zählgröße_“2“06]_1. Das Protein „Ras GTPase-activating-like protein IQGAP1=165“7“ AS aus dem Bereich der „Circular clefts (CC)“ ist hier scheinbar nicht mehr vorhanden, weil die Ziffer „7“ bereits zur Ziffer „2“ heruntergezählt wurde. „IQGAP1...könnte als Montagegerüst für die Organisation eines multimolekularen Komplexes dienen, der eingehende Signale mit der Reorganisation des Aktinzytoskeletts an der Plasmamembran verbindet. Kann Neuritenauswuchs fördern. Kann eine mögliche Rolle bei der Regulation des Zellzyklus spielen, indem es zur Zellzyklusprogression nach DNA-Replikationsstillstand beiträgt“, siehe:
Iqgap1 - Ras GTPase-aktivierendes ähnliches Protein IQGAP1 - Mus musculus (Maus) | UniProtKB | UniProt ]. Aufgrund der Serie #165“1“ über 4 Zeilen legt sich die Summe 2+1+1+1+1=“7“ in die folgende Platzhalter „O“ der der Serie #165 „0“. Dieser Prozess zur plötzlichen Freisetzung von 8 Mirkogameten aus 1 Mikrogameten (Exflagellation) wird dann im Mückendarm in 15 min abgeschlossen. Das Gerüstprotein IQGAP1 integriert Zellsignalwege, indem es mehrere Wachstumsfaktorrezeptoren und intrazelluläre Signalmoleküle bindet [siehe: IQGAP1 binds the Axl receptor kinase and inhibits its signaling | Biochemical Journal | Portland Press /D. Sacks u.a. ; Biochem J (2018) ; https://doi.org/10.1042/BCJ20180594 ]. Vermutlich über das Zinkfingerprotein ZNF 350 kann aus diesem Zählvorgang die Größe „652“ abgegrenzt werden, so dass dann 1_06 = Xanthurensäure C10H7NO4=6*10+7+7+8*4=60+14+32=106E im Mückendarm den Countdown zündet. Mit „6_QS5+2=7“= 67 AS fordert die Evolution das Zinkfinger-Protein ZNF 350 an [ZNF350 - Zinc finger protein 350 - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“7896“#1“65“2“06“135“30“82“44“.
Erster Winkel „90°“: Das Taxi mit 4 Rädern „O“ fährt beide Geschlechter: QS1+6+5+1+6+4+3+0=26=Blut und QS3+7+9+0+7+0=26=Blut. Es gibt auch Parasitenarten, bei denen sich 2 Geschlechtspartner aneinanderlegen und gemeinsam weiter entwickeln. Zur Größe der „M.gamonten“ liegt momentan keine Information vor. In der Mikroskopie im Mückendarm entspricht die Größe der M.Gamonten etwa den gerade aufplatzenden roten Blutkörperchen des Menschen von D=7,5µm. Die Zahl „70“ am rechten Rand hat dann die Bedeutung „Form=7_O=Kreis“ bzw. erzeugen 3 Nullen den Faktor 1000 und die 4. Null am Rand ist ein Divisor zum resultierenden Faktor 1000/10=100. Aus der Zählgröße „16_51“* Faktor 1_00 ergibt sich D=QS1+6=75*100=7500nm=7,5µm [Erythrozyt – Wikipedia]:
Es kann aber keinesfalls so sein, dass die Evolution herzlos ist, und die Keimzellen mit dem Taxi ins Nichts expediert, denn nach dem 2. Mückenstich landen die infizierten Erytroziten (incl. Parasit) im Zeilenlauf an den Ausgang der Makrophagen. Diese haben dort den Glaskörper des Auges als Orientierungsraum. Genau diesen Anschub bekommen die Keimzellen dann auch von der Mücke, in dem aus der Synthese des Mücken-Augenpigments die Xanthurensäure= C10H7NO4=6*10+7+7+8*4=60+14+32=106E im Mückendarm einwirkt. Die Gametogenese von M.gamonten (Gametozyten) zu M.gemeten binnen 15 min, bewirkt eine Sprengung der Erythorzytenmembran und die Freisetzung von 8 Mikrogameten aus 1 Mikrogamonten (männlich) bei der Exflagellation. Die Ursache ist eine plötzliche Temperaturabsenkung um 5°C vom warmblütigen Menschen mit 37°C zur wechselwarmen Mücke mit 32°C, dem Anstieg des pH-Wertes und die Änderung der Xanthurensäure-Konzentration [Laborexperiment siehe: „Charakterisierung von Proteasen in den Blut- und Sexualstadien des humanpathogenen Malariaerregers Plasmodium falciparum“; T.Weißbach ,Diss.2018 /https://publications.rwth-aachen.de/record/726490/files/726490.pdf ]. Im Blut des Menschen ist die Xanthurensäure in schwacher Konzentration bereits vorhanden. Beim Start der Gametogenese zeigt der Zeilenlauf keine Xanthurensäure direkt erkennbar an. Diese kommt aus dem Makrophagen-Bereich mit Zeilen Nr. Z.x“106“, um anschließend mit einem Bezug zu einer Säure-Konzentration mit Wasser H2O=2+8=10 über die Zeilennummer [106+10=] Z.x116 zu starten. Nicht die Mücke, sondern möglichst sollte auch der Parasit ein Interesse an der Xanthurensäure bekunden. Das 106/116-Problem kann mit Na=11 dem Na+/H+-Austausch-Antiport-System in einen Zusammenhang gebracht werden: Das Blut im Mückendarm erhöht plötzlich den vorhandenen pH-Wert=6 auf pH=7,4 bis 8, weil vom Blut CO2=6+16=22E produziert wird, dass mit Wasser=10 durch das Enzym „alpha-Carboanhydrase (CA)=323 AS“ katalysiert wird zu Bicarbonat HCO3=1+6+24=31E und Wasserstoffionen H+ [siehe: Carboanhydrase - DocCheck Flexikon]. Die Senkung der H(+)-Konzentration erhöht den pH-Wert. HCO3-Ionen=31E, die freigesetzt werden, induzieren die Exflagellation über einen Ionenaustauchmechanismus [siehe.“ Gametogenesis in Plasmodium: Delving Deeper to Connect the Dots - PubMed (nih.gov)“; A.Sinha (2022); DOI: 10.3389/fcimb.2022.877907 ]. Aufgabe: In Z.7“116“ Zahl 116 in 106 verwandeln! Im Code ist HCO3=31E als Spiegelung 31_ (36)_“1“3 enthalten. Unterhalb der Ziffer „1“ enthält die Folgezeile die Austauchziffer „0“, weil der Austausch darin als Spiegelung „36“ zu „63“ gefordert wird. In der Z.-Nr.7_11=Natrium_7 wird erklärt, das Xanthurensäure plötzlich wirksam wird. Die Xanthurensäure=106E bildet über 3 Zeilen eine Spalte 1_0_“6“24_24“6“, in der die Endziffer „6“ mit der „Zeit=24“ gekoppelt wird: Die Doppelzeit bezieht sich auf die Aufnahme von Menschenblut=26=Eisen und dessen Folge das CO2=22 als „3_26_3_22“: Startzeile in der Mücke: Epi.Ref_Rhesus.Z.7“116“#18“3“31“47“336“1“3532; Epi.Ref_Rhesus.Z.7“11“7#832889“7“63“0“9385 und Epi.Ref_Rhesus.Z.7“11“8#18“3“26“3“22“624246“9. In der 4. Zeile wird der Temperaturabfall vom Menschenblut 37°C auf den Mückendarm=32° Celcius als Startschuss zur Exflagellation ausgelöst. Dieser ist bereits im mitgelieferten Bauplan hinterlegt, so dass der Plan anschließend lediglich ausgerollt wird: Epi.Ref_Rhesus.Z.7“11“9#18“32“37“483409734. Durch den Dezimalwechsel kann die Z.Nr. nicht mehr auf QS=20=Calcium erhöht werden, es ist aber direkt ablesbar. Als örtliche Umgebung wird der Mückendarm „808“ adressiert: Epi.Ref_Rhesus.Z.71“20“#1832“11“747“808“131.
Früher wurden Berliner Kinder ohne Begleitung zur Erholung in der Provinz in einen Zug der Deutschen Reichsbahn nach Köln verfrachtet. Die Eltern gaben als Proviant ein Stullenpaket [Stulle=Schnitte=Brotscheibe] mit auch die Reise: „Da kannst´de [Du] mit bis nach Köln fahr´n!“ Wo ist das Stullenpaket? Es ist der BiXnom-Kreis=“64“ als 1. Signal. Im Mückendarm verändert sich Bohnen/Nieren-Form der M.gamonten (Gametozyten) nach 5 Minuten in eine runde Form. Die gesplatzte Erytrozyten-Membran „33“ wird als „3003“ symbolisiert. QS 4+3=7_3003_7=Form. Die Zählgröße 1_1 kann als spätere Mückentemperatur und als Signal gezählt werden: Aus 3“11“37 zählen sich 3_QS1+1=2_37 und somit die Temperaturschwelle 32° / 37° als 2. Signal. Mit Wasser H2O=2+8=10 kann 3+7 durch 10 ersetzt werden QS 4+3=7_3003_7= „10_32°/37°_10“. Das 3. Signal ist somit die Säurekonzentration. Das 4. Signal ist die Xanthurensäure als 10_3003 mit 10_QS3+0+0+3=6=106E: Mit Z.7+8+9+8=32°Celisus hat die Evolution ihren Bedarf exakt selektiert. Der Unterschied von der wechselwarmen Mücke zum warmbütigen Menschen sind die enthaltenen „37°“Celsius. Die Zahl „37x“ kann als G-Aktin =37“5“ AS für ein Einzelmolekül „1 Mikrogamont“ und alternativ im Zuge der Exflagellation als filamentartiges F-Aktin=37“4“ AS für 8 Mikrogameten verwendet werden. Tatsächlich bildet sich nach der runden Parasiten-Form am Parasiten ein tubuläre Ausstülpung (Nanotubles) als Faden, der bis 10-fach länger ist, als der Parasit (Mikroskopie siehe: RWTH Themen Biologie & Biotechnologie by RWTH Aachen University - Issuu / „Cherchez la femme –Mechanismen der Partnerfindung beim Malariaparasiten“; G. Pradel; Dez.2013; https://issuu.com/rwth/docs/rwththemen2_2013/47]: Epi.Ref_Rhesus.Z.7898#“165“1“643“00“3790“70“.
In der zweiten 90°-Zeile wird der 37er-Anhang „5“ (G-Aktin) von 8 Mikogameten als „8_5_8“ geklammert. Aufgrund des F-Aktins müssen Filamente erzeugt werden, die jetzt mit dem 37er Anhang „4“_33 als 33=Membran 1 Klebefaden bei beiden Geschlechtern auslösen. Aber 1 Mikrogamont kann sich mit 33=männlich auf die Teilung in 8 Mikrogameten vorbereiten: Epi.Ref_Rhesus.Z.7899#16“5“1“4“33“90“858“830
Der Aktin-G/F-Umschalter „5/4“ ist bereits in der ersten 90°-Zeile als „flexibel=6_“5“1“6_“4“enthalten; es sind Zählgößen QS6+5=11_QS1+6+4=11=Zählgröße. Die Fäden verkleben die Partner lediglich, zur Bindung fehlt Prolin=62E. Die Fadenlänge entsteht in Zeile Z.Form=7_QS9+0+2=11=Zählgröße. Der Code enthält 3 Nullen zur „nm/µm“-Aufbohrung, so dass die Fadenlänge=90µm beträgt (gemessen bis 100µm). Falls es sich um röhrenförmige Mikrotubuli handelt, sind es unverzweigte Röhren im Durchmesser=25 nm, die sich aus Dimeren der globulären Proteine α- und β-Tubulin zusammensetzen [ Mikrotubuli - via medici: leichter lernen - mehr verstehen (thieme.de)]: Der Durchmesser muss direkt als 25nm abgelesen werden. Dies ist nur am rechten Rand ohne die Nullen möglich. Der Durchmesser wird somit aus der „Zeilen-Nr. Z.xx02#_05“ als 25nm zusammengesetzt: Epi.Ref_Rhesus.Z.7“90“2#165“0“8“0“694“0“51366. Der röhrenförmige Klebefaden „Nanotubles“ „505“ wird adressiert. Mit Z.7+9+0+3=19=Kalium ist eine mögliche Regelung vorhanden. Am rechten Zahlenrand wird das Protein EB1 [EB=end binding] mit einer Domäne =268AS adressiert bzw. auch als MAPRE1 (Mikrotubuli-assoziiertes Protein RP/EB-Familie Mitglied 1)=268 AS: „Plus-End-Tracking-Protein (+TIP), das an das Plus-End von Mikrotubuli bindet und die Dynamik des Mikrotubuli-Zytoskeletts reguliert. Wirkt auch als Regulator der Minus-End-Mikrotubuli-Organisation; Fördert die Verlängerung von CAMSAP2-dekorierten Mikrotubuli-Dehnungen am Minus-Ende von Mikrotubuli u.a. [MAPRE1 - Mikrotubuli-assoziiertes Protein RP/EB-Familienmitglied 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Schlüssel-Schloss-Prinzip „56“ ist zur Partnersuche geeignet, um sich nicht als letzte Generation ohne Sexbedarf auf die Straße zu kleben. Enthalten ist eine weibliche Spiegelung „6“5_5“6“ und tatsächlich über die Zeilennummer gibt es eine männliche Dopplung mit Platzhalter „O“ als Z.Form=7_seitlich=9_O_“3“#_seitlich=9“3“. Männlich „33“ muss weiblich „66“ wegen der Ziffer „5“ kontakten, damit sich der Platzhalter in der Zeilennummer mit der Ziffer „5“ füllt. Daraus resultiert dann mit Z.7+9+[5] +3=24=Zeit. Man weiß nicht, was damit immer genau gemeint ist, aber hier müssen es 5 min sein. Somit 5 min* 60 sek/min=300 Sekunden. Die Ziffer „3“ steht am Rand der Zeilennummer, so dass die beiden Nullen im Code mit „300 Sekunden“ den BiXnom-Eierkocher ergeben: Epi.Ref_Rhesus.Z.790“3“#16“5“0“5“98“0“56“93“268“.
Die Gametogese beim Übergang des Parasiten vom Blut des infizierten Menschen in den Mückendarm dauert 15 min= 15*60=900 Sekunden. Diese Zeitvorgabe entwickelt sich aus den beiden erforderlichen Austrittwinkeln„90°“7“90°“ als 180°-Wende im Zeilenlauf, mit denen die Mücke als Wirt adressiert wird. In dieser Konstruktion ist QS7+9=16=Schwefel eine Sperre für den Contdown=900 Sekunden. Die Z.Nr. „97“16“ enthält ebenfalls die 97er Sperre und Schwefel=16. Der Zeitbezug der Sperre „97“ ist aus der Folgezeile mit Z.QS9+7+1+7=24=Zeit ersichtlich: Epi.Ref_Rhesus.Z.“7917“#183288“97“6309385.
Zur Beschreibung der Geschlechtsunterschiede wird eine Reihenfolge gebildet:
A) Plan für Makrogamenten:
Die länglichen Makrogamonten sollen sich in der Mücke innnerhalb von 2-3 min rund formen, wobei das Volumen 3-fach zunimmt (was bei einer Kugel nicht viel ist). Osmiophile Körperchen im Zellplasma entleeren ihren Inhalt in die parasitophore Vakuole. Die Vakuolen- und Erythozytenmembran werden abgebaut, und durch Darmbewegungen etc. zerstört, so dass die unbefruchtete Eizelle frei in der Blutmahlzeit liegt. Zur Vorbereitung auf den erhöhten Proteinbedarf wird zur Stressbewältigung das Protein „7-Helix-1-Protein“=467 AS produziert. Getrennt durch 6 Transmembranen liegen 7 Domänen auf der Protein-Kette [7-Helix-1-Protein - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt].
Der Parasit wird orientierungslos in der Mücke ausgesetzt, so dass als Anschub ein gespeicherter Ablauf als Montageplan ausgerollt wird.
Für die 7 Domänen liegen 7 Zeilen vor. Über 5 Zeilen liegt die die Anteil „46“ ohne Anlagerung der Ziffer 7 über 4 Zeilen vor, 3 Zeilen wirken dann nur noch als Spiegelung „64“. Der Anteil „46“ wird weiblich=66 markiert als „6_“46“_6“. Die Anlagerung der Ziffer 7_9=seitlich steht am rechten Rand und am linken Rand der Zeilennummer. In Z.79“22“ ist CO2=22E enthalten, das aus der Blutmalzeit entweicht und durch alpha-Carboanhydrase (CA)=323 AS“ katalysiert wird zu Bicarbonat HCO3=1+6+24=31E und Wasserstoffionen H(+): Epi.Ref_Rhesus.Z.“79“22“#1“6“46“6“39“28“8555“79“. Die Zahl „7“ lagert sich in 2 Fällen als Quersumme an. Maßgeblich ist die letzte Zeile der Serie , inder der ein Platzhalter „46_O“ gebildet wird, der mit der Ziffer „7“ über die Zählgröße 11 an Ziffer „6“ als „7_11_6“ angelagert wird, sobald ein Bedarf besteht: Epi.Ref_Rhesus.Z.7925#16“46“0“15955“0“7“116“. Mit Darm=„808“ und Blutmahlzeit=26 in der Zeilennummer ist das Umfeld avisiert. Die osmiophile Körperchen „10181“, werden als Vielzahl mit der Zählgröße „11“ und dem Wasser H20=QS1+8+1=10 kombiniert. Die Haufenbildung der Körperchen wird der Folgezeile als Verbindung 2_88_2 verkörpert: Epi.Ref_Rhesus.Z.79“26“#1645“808“282“10“181“. In das Volumen der parasitophore Vakuole 6006=flexibel werden in die beiden Platzhalter „00“ die Wirkstoff-Körperchen „88“ geschüttet. Die Summe Zählgröße Z.x_QS9+2=11_x plus QS1+6+4+5+6=22 ergibt die Membran=33, wenn der Bedarf besteht: Epi.Ref_Rhesus.Z.7“92“7“#1645“60066“15“28“82“. Sobald die Wirkstoffe vorliegen, werden die Membranen von Valuole und Erythrozyt zerstört. Es ist eine Membrandehnung 3_9=seitlich_3_0=Loch_9=seitlich geplant, die mit 33_33 beide Membranen gedehnt und durchlöchert darstellt. Die Zeilen-Nr. QS7+9+2+8=26=Blut bewirkt, dass die Makrogamonten nunmehr als Makrogameten frei in die Blutmalzeit flüchten. Damit der Katalysator „alpha-Carboanhydrase (CA)“=323 AS“ nicht bereits im Menschen zur Aktivierung führt, wird er in der letzten Zeile adressiert: Epi.Ref_Rhesus.Z.“7928“#164539309“3“332“3“6.
B) Plan für Mikrogamenten: Der Zeitraum bis zur Exflagellation wird in Zelle als Bauplan abgespeichert und endet im Zeilenlauf am Anschluss der Bakterien/Viren. Die Strecke ist inhaltreich, so dass zunächst nur der Durchlauf ermöglicht wird.
Für die bevorstehende DNA-Replikation wird das Zellorganell „Zentrosom (Zentralkörperchen)“ als Ort der Mitose adressiert. Das Zentrosom besteht aus 2 Centriolen, wobei Mutter- und Tochterzentriole senkrecht (90°) zueinander angeordnet sind. Die Zentriole ist ein kurzer Hohlzylinder aus 9 Tripletts aus Mikrotubuli (Summe 27 MT). In der Liste der vielen Zellorganellen wird das Zentrosom nicht erwähnt. Das Zentrosom ist als Mikrotubulus-Organisations-Zentrum [microtubule organizing center (MTOC)]. Das MTOC ist zuständig für den Bau der Teilungsspindel bei der DNA-Replikation und liefern den „Basalkörper“ der Kinozilien „Flimmerhärchen“ („Kinetosom“). Kurze Kinozilien können auf Zelloberflächen als („Flimmerepithelien“) entstehen. Bei langen Kinozilien handelt es sich um den Spermienschwanz (Flagellen / Geißeln). Das Innengerüst wird als „Axonema“ bezeichnet. Der Außenring wird von 9 peripheren längsachsenparallelen Doppeltubuli gebildet und im Zentrum zieht ein zentrales Einzeltubulus-Paar mit (Summe 20 MT) [siehe: Histo (uni-giessen.de) https://www.uni-giessen.de/de/fbz/fb10/institute_klinikum/institute/vetanatomie/informationen-1-semester/histologie-skript-1-einfuehrung-zytologie-und-oberflaechenepithelien]. Die Begriffe Flagellen und Geißeln sind Synonyme. Im Meinungsbild wird ggf. für eine Zelle der Eukaryoten „Geißel“ bevorzugt. Beim Malaria-Parasiten, der als Mikrogamet (männlich) das rote Blutkörperchen zwecks Befruchtung der Eizelle verlässt, wird das Spermium komplett incl. Kopf als „Flagellum“ bezeichnet.
.
Zentrosom: Im Zentrosom wird ein für die DNA-Replikation erforderliches Netzwerk aus Mikrotubuli (MT) auf- und abgebaut. Das Zentrosom besteht aus 2 Centriolen, die sich rechtwinklig (90°) überdecken. Sie sind nur im Elektronenmikroskop sichtbar. Die Zentriole ist ein kurzer Zylinder, der sich aus „9“ im Ring schräg liegenden 3-MT-Tripletts formt, so dass darin 27 Mikrotubli eingebaut sind. Ein ähnlicher Zylinder zur Bildung der 8 Kinetosome bildet sich über 4 Zeilen Z.979x unter Mitwirkung des Proteins „Zentrosomales Protein (CEP104)=925AS [CEP104 - Zentrosomales Protein von 104 kDa - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein wurde am Menschen nachgewiesen [Biogenese der Zentriole | CENTRIOLE_LENGTH Project | Results in brief | FP7 | CORDIS | European Commission (europa.eu)]. Beim Menschen sind sekundär weitere Proteine am Zentrosom ermittelt worden (CP110, Cep97, Cep120, CPAP, SPICE1). Das „Spindel- und Zentriol-assoziiertes Protein 1 (SPICE1)“=855AS ist als Regulator für Centriolen-Duplikation, für die richtige bipolare Spindelbildung und die Chromosomenkongression in der Mitose erforderlich. Für „CPAP“ fehlt eine Datenquelle [Ersatz: Zentromerprotein J (CENPJ)=1338AS u.a. bei der Zellteilung und Zentrosomenfunktion durch die Teilnahme an der Centriolenduplikation beteiligt]. Zentrosomales Protein (CEP120)=986AS u.a. beteiligt an der Mikrotubuli-abhängigen Kopplung des Zellkerns und des Zentrosoms. Zentrosomales Protein (CEP97)= 856AS wirkt als negativer Regulator der Ziliogenese, indem es die Mutterzentriole kappt und so die Zilienbildung verhindert. Zentrosomales Protein (CEP110)= 2325AS u.a. am MTOC beteiligt. Bei der Erzeugung des Zentrosoms sind beim Parasiten nur SPICE1 und CEP104 direkt lesbar.
Das „Zentrosomale Protein (CEP104)“=925AS enthält verschiedene Symbole, um den Code zu spalten: QS 9+2=11=Zählgröße; Ziffer 2=paarig für 2 Centriolen, Zahl=25=MT-Durchmesser und Zahl 9=9 Tripletts. Das Zentrosom liegt in einer Codeserie #“1“64“, so dass ständig eine Kreisform=64 verfügbar. Die Ziffer „1“ bildet den Zentrosom-Durchmesser=1µm. Der Zeilenlauf startet die Tochter-Zentriole. Es ist daher ausreichend, wenn in der Serie Z.-Nr. 79“1“x die Ziffer 2=paarig noch fehlt. Die Mutter-Zentriole kann aufgrund ihrer 2 äußeren Änhänge am distalen Ende erkannt werden (Distal appendages und Subdistal appentages). Zwischen beiden Zeilenabschnitten liegt eine Zeile für den Kreuzungswinkel=90°. In Prinzipskizzen [Centriolen (u-helmich.de)] sind 5 Verbindungsfasern (Interconnectng fibers) zwischen den beiden Centriolen dargestellt. Aus der Konstruktion ergibt sich, dass bei der ungeraden Anzahl von 9 MT im Außenring nur dann 5 Verbindungen entstehen, wenn auf der maßgeblichen Seite 1 MT in der Mittelachse liegt.
Das Organell „Zentrosom (Zentralkörperchen)“ muss bereits vor den beiden im Zentrosom liegenden Centriolen adressiert werden, weil diese in einer Proteinmatrix (pericentriolaren Matrix) „33“ eingebettet sind. Der Zentrosom-Durchmesser=1µm=1000nm ist als Serie #1 immer vorhanden, aber es 3 Nullen für D=1000nm benötigt [Zentrosom – Wikipedia]. Die beiden Centriolen sind jeweils 500 nm lang. [Zentriol – Wikipedia]. Im Zentrosom ist der ringförmige Proteinkomplex „Cohesin“ enthalten, um die DNA-Moleküle bei der Zellteilung räumlich anzulagern. Cohesin ist in Interaktion mit dem Chromatin im Zellkern, aus dem die Chromosomen der DNA bestehen. Der Cohesin-Komplex liegt im Protein „Strukturerhaltung des Chromosomenproteins 1“=1818AS [„Strukturerhaltung des Chromosomenproteins 1, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt“]. Außer einer Vielzahl von Spiralspulen und Regionen ist als Einzelheit eine Domäne von 913 bis „1123“. Diese Domäne liefert die Zählgröße „11“ in Z.QS7+8+7+7=29=QS2+9=11 als „Matroschka-Puppe“ für die inneren Centriolen und „ausgepackt“ als „11“ am rechten Zahlenrand. Als Zeilenverbinder setzt sich die Protein-Domäne als Spalte „23“ fort, wobei die Ziffer „3“ dann in Protein-Matix „33 steckt. Das Zentrosom bildet die Struktur-5 eine Bixnom-Kugel 6_O_4, die eine Schwerachse=84 als Bezugsbasis enthält. Die Teilsumme QS 1+6+5+6=18 wird in der Ziffer „6=flexibel“ von QS6+0+4+6+2=18 überlagert. Das entspricht dem Protein=1818AS als Funktion zur Überlagerung beider Centriolen. Die Zeile ergibt QS=61, so dass in Bezug auf die enthaltene Zeitbasis=60 eine 1 Aktion QS 60+1=61 durchzuführen ist. Damit wird auf die Spalte am rechten Zahlenrand hingewiesen, die die Zahl „18“ als Zeilenverbinder aufbaut. Gemeint ist damit, dass die Zahl „60“ auch einen Winkel=60° abbildet, der sich mit der folgenden Ergänzungswinkel Z.Nr.QS7+8+7+8=30° zum Kreuzungswinkel von 90° beider Centriolen mit der Zählgröße „11“ errechnet. Prolin=C5H9NO2=6*5+9+7+16=62E ist für das Zusammenwirken mit dem Tubulin=450AS der Mikrotubuli enthalten: Epi.Ref_Rhesus.Z.“7877#“165“6“0462“66845“11“.
Die Protein-Matrix „33“ist kein Zeilenbereich der zwischen 2 Membranzeilen liegt, sondern bildet kompakt zwei 33er-Zeilen. Der Kreuzungswinkel zwischen beiden Centriolen „55“ von 90° ist nicht direkt ablesbar. Ersatzweise werden die Centriolen direkt als Ziffernbild in die Codezeilen geschrieben. Horizontal wird eine Linie „55_55“ aus einer vertikalen Serie #QS1+6=7=Form_55 gezogen. Im rechten Winkel zieht die vertikale Zentriole auf der linken Seite eine 55er-Spalte mit einer Serie aus 4 Zeilen, so dass beide Centriolen gleich lang sind. Die Centriolen-Länge=500nm muss wegen der „Strecke 55_55“ enthalten sein. Als Rechenkunststück ist rechts 6_2=paarig_5 zu lesen, wobei dazu auch ein Paar 836_“5“_QS5+3=8_36 angeboten wird, um die Ziffer „5“ zu markieren. Die Null liegt links von der Ziffer„5“, hat keine Bedeutung. Aus QS5+5=10 und QS5+5=10 wird zusammengesetzt die Länge=500nm gebildet. Epi.Ref_Rhesus.Z.“7878“#16“55“8360“55“33“6“2“5“.
Die Pericentriolaren Matrix „33“ wird als Form=7_18_7_33=Protein mit einen Anteil aus dem Protein=1818AS gekoppelt. Die vertiale Zentriole zieht mit „55“ als Spalte mit. Die Restzahl „589“ verweist auf das Zinkfingerprotein ZNF589=346AS beim Menschen, das sich zutreffend auf die DNA bezieht. Die Nr. eines Proteins wurde bisher nicht verwertet, aber die 346 AS sind zutreffend [ZNF589 - Zinc finger protein 589 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein arbeitet am rechten Zahlenrand über 2 Zeilen, um die Zink=30 als Spalte 3-0 neben dem Protein-Anteil 3-4 zu zeigen. Die Ziffer 6 wird aus der Membran QS3+3=6 gebildet. Nachfolgend ist die Ziffer 3 als Bestandteil der Domäne 11“23“ nochmals enthalten. Zusammen ergibt dieses die Umrechnungszahl „333“, die zur Umrechnung bei der Ermittlung der Proteinlänge AS verwendet wird. Im Cohesin-Komplex ist das Protein „Strukturelle Erhaltung des Chromosomenprotein-3-Homologs (PFD0685c)“= 1193 AS eine maßgebliche Bedeutung. Zentraler Bestandteil von Cohesin, einem Komplex, der für den Chromosomenzusammenhalt während des Zellzyklus benötigt wird. Der Cohesin-Komplex kann einen großen proteinartigen Ring bilden. Der Cohesin-Komplex spielt auch eine wichtige Rolle bei der Spindelpolmontage während der Mitose und bei der Chromosomenbewegung [PFD0685c - Structural maintenance of chromosomes protein 3 homolog - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Das Protein zerlegt den Zahlenteil 9-3, so dass am rechten Zahlenrand das Protein-Matrix geklammert wird. Der Zahlenteil „11“ bildet über der Ziffer 9 im Rechten Winkel eine Spalte mit QS 6+5=Zählgröße zu bilden. Über der geklammerten Zahll 18 sitzen als Spalte das Protein 33 und darüber die Schwerachse=84. In der Klammer sizen 7_QS1+8+7+3=20. Am Protein 33 in der Vorzeilen hängt 20 und steht 84. Die Kreisfunktion des Proteins ergibt folglich 84-20 (Calcium)=64=Kreis [Das ist die Hörschnecke rückwärts]. Der geklammerte Zahlenteil „18“ gehört zum Protein „Strukturelle Erhaltung des Chromosomenproteins 2“ =1218AS [Strukturerhaltung des Chromosomenproteins 2 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Die Ziffern „1+2“ bilden am rechten Rand, gefolgt von QS1+2=3, die zur Protein-Matrix gehört, ein Spalte. Horizontal liegt der Zahlenteil „18“. Das Protein ist an der Umwandlung von Interphase-Chromatin in kondensierte Chromosomen beteiligt. Kandidat als Malariaimpfstoff.
Epi.Ref_Rhesus.Z.7879#16“55“62“5829“7“18“7“33“. Das Zentrosom steht mit dem Zellkern in Verbindung, so dass anhand verschiedener Proteine der Beginn einer Interaktion gesucht werden kann. Ob die Proteins-Nr.„579“ einen Bedeutungshintergrund enthält, ist unbekannt.Es jedenfalls ein notwendiges Protein „Nucleotidyltransferase“=624AS [DNA-Polymerase II Untereinheit 2 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Als AS-Zahlenanteil liegt die Zahl „62“ in der Vorzeile vor und zieht als Verbindungsspalte mit der Ziffer „43 herunter – im Prinzip muss es dort auch wirksam werden: Epi.Ref_Rhesus.Z.7880#16“55“4“1“57“9“23“7804. Die vertikale Zentriole „55“ endet, so dass der Centriolen-Durchmesser=1000nm anhand der 3 Nullen lesbar ist. Der Durchmesser wird gezogen, indem die Ziffer „1“ in Z-Nr. xxx1 und im Zeilencode #1 als Strecke gezogen wird. Der Kreis=64 wird wegen der integrierten Centriolen erneut mit der Matroschka-Puppe Z.7+8+8+1=24=QS2+4=6 in den Zeilencode bis Ziffer 4_0=Kreis gezogen. Die Zeile enthält zur Steuerung „Calcium=20_574 AS“ das Protein „Spannungsabhängige L-Typ Calziumkanal-Untereinheit beta-2 (CACNB2)=574 AS beim Menschen [siehe: CACNB2 - Voltage-dependent L-type calcium channel subunit beta-2 - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Zelle speichert den Ablauf im „Zellgehirn“. Aktiviert wird die Routine bei der Exflagellation im Mückendarm, der als „808“ mit freigesetzten Wirkstoffen „88“ reagiert, sobald mit QS8+8+8+0+8=32°Celsius Körpertemperatur der Mücke vorliegen. Die Ziffer „1“ erzeugt in Z.Nr.x“88“1“ eine Aktion, mit der die Zahl „88“ in den Darm-Platzhalter „0“ als „808“ verschoben wird. Dieses hat zur Folge, dass am linken Zahlenrand in die Zahl #16 eine Lücke gesprengt wird als 1_0_6 E für Xanthurensäure=“106“E, deren Existenz der zweite Wirkungsfaktor ist. Als Doppelefffekt der Ziffer 1 am linken Zahlenrand und der Summer 32 am rechten Zahlenrand setzt sich das Protein „Histon H2A“=132AS [Histone H2A - Plasmodium falciparum | UniProtKB | UniProt]. Histone spielen eine zentrale Rolle bei der Regulation der Transkription, der DNA-Reparatur, der DNA-Replikation und der Chromosomenstabilität: Epi.Ref_Rhesus.Z.788“1“#16“55“2“0“57“4“0“88808“. Das Protein „Chromatin-Assemblierungsfaktor 1 P55-Untereinheit“ ist am Zusammenbau von Proteinen beteiligt [Chromatin-Assemblierungsfaktor 1 P55-Untereinheit, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Der Zahlenteil 42 ist vorhanden. Darüber liegt eine Platzhalter-O, wenn die Lücke in die Zahl „1-6“ gesprengt wird, schiebt sich die Zahl „4“ in den Platzhalter, so dass dann auch vertikal „42“ lesbar sind, die Ziffer 8 kann dann angelagert werden. Bei der Frage nach dem Sinn dieser Zeile wird ein extremer Ausnahmefall sichtbar: In Mitte der Zeilencodes bildet sich eine zweistellige Serie 57=QS5+7=12 über 4 Zeilen. Somit können sich als Zeitfunktion 2 Pole mit 12+12=24=Zeit bilden, um die DNA-Replikation zu starten. Hauptschalter: Epi.Ref_Rhesus.Z.7882#165499“57“42“6“97“15. Ende 4 „57er“-Zeilen für Spindelapparat: Mit QS7+8+8+3=26=Blutnahrung. Teil-Spiegelung für Pole im Spindelapparat „478_784“. Protein Fam-c Protein=97AS enthalten; Genomsequenz ohne Funktionsangabe [Fam-c Protein - Plasmodium falciparum Vietnam Oak-Knoll (FVO) | UniProtKB | UniProt ]: Epi.Ref_Rhesus.Z.7883#165“478“57“97“784“98.
Centriolen: Der Centriolen-Durchmesser=170nm lässt sich mit einer Geometrie bestätigen, wie sie hier für die Knetosome entwickelt wurde. Die 27 MT mit D=25nm bilden 9 Tripletts. Konstruktiv ist es gleichseitiges Dreieck mit 25nm Seitenlänge. Die beiden Eck-MT müssen jedoch vom Mittelunkt auf ein Endpunkt einwärts verschoben werden. Die MT verschmelzen, womit die Tripletts steiler stehen und abnorm eng stehen. Der Radius vom 57nm wird vom Schwerpunkt des Dreiecks abgetragen. Aus 1 Triplet wird dann eine polare 9er-Reihe erzeugt. Die Evolution ist in der Lage im Zeilencode Bilder wie Spalten und Dreiecke zu lesen. Die Dreiecksspitze „61“=QS6+1=7=Form liegt in der Code-Mitte: Epi.Ref_Rhesus.Z.7896#16520“61“353082“44“.
Die Dreiecksgrundlinie wird mit der Spiegelung der Randzahlen „16_61“ erzeugt. Der Systemradius ist nunmehr als „R=57nm“ ablesbar als Zählgröße „11“ mit 1_QS4+3=7=Form_“57“_QS6+1=7=Form. Mit „4_QS3+5=8“ muss das Dreieck nun noch nach oben gespiegelt werden, um dann die Bixnom-Schwerachse=“84“ als Zahlendreher zu lesen, d.h. der Radius wird vom Schwerpunkt des Dreiecks abgetragen. Zufällig besitzt das Kinetosom den gleichen Systemradius, so dass das Material austauschbar ist.
Die Tripletts werden jeweils durch ein Filament (A-C linker) zwischen inneren A-Tubulus und dem folgenden äußeren C-Tubulus verbunden. Das Protein „EB 1“ ist am Aufbau der Spindelappartes bei der Gametogenese der Parasiten beteiligt. Beim Menschen ist das Protein „Mikrotubuli-assoziiertes Protein RP/EB-Familie Mitglied 1 (EB1)=268AS bekannt [MAPRE1 - Mikrotubuli-assoziiertes Protein RP/EB-Familienmitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Das Protein ist vorhanden und zeigt in der Spalten unterhalb in der Folgezeile die gewünschte Anzahl von 24_7=Form verbindungen (A-C linker) entlang des Zylinders [Anzahl aus Prinzipskizzen abgezählt]. Anzahl, MT-Durchmesser und die Zylinderlänge passen nicht zusammen. Das ist aber unerheblich, weil die Ketten der Mikrotubuli gewunden sind und mehr Kugeln zählbar werden. Zur Übereinstimmung mit den Kinetosomen werden 10nm-Intermediärfilament statt 6nm-Mikrofilamente gewünscht. Die 10nm sind vorhanden, weil mit „99“ die 9 Tripletts verbunden werden und dann die Ziffer „1“ folgt als „24_7_99_1“. Als AC-Verbinder liegt dann die Ziffer „0“ als Spalte in der Folgezeile: Epi.Ref_Rhesus.Z.7893#165“268“927453933, Epi.Ref_Rhesus.Z.7894#165“24“799“1“435761 und Epi.Ref_Rhesus.Z.7895#16522706“0“721203.
Die Centriole wird von einem zentralen „Radkranz mit Speichen“ zu den inneren A-MT (A-Tublus) am Rand ausgefüllt. An der Ausbildung der „9 Speichen“ ist das Protein „Spindelanordnung abnormes Protein 6 Homolog (SAS-6)“=“474“AS beteiligt [siehe: Sas-6 - Spindelanordnung abnormes Protein 6 Homolog - Drosophila melanogaster (Fruchtfliege) | UniProtKB | UniProt ]. Mit dem Gruppensymbol „44“ am rechten Zahlenrand verbindet es, die folgenden 2- Speichen-Zeilen als Codespalte „7“ am rechten Rand. Die Speiche besteht aus 2 zur Helix verbundenen Protein-Spiralen. Der Radkanz, D=15nm, als „1“3“5“3_0=Kreis ist aufgrund QS8+“2“+4+4=18 mit 18 Kugeln, D=„2“nm besetzt. An jeder 2. Kugel spannt eine Speiche zum inneren A-MT des Tripletts. Mit Z.QS7+8+9+6=30=Zink kann ggf. 1 Zinkfingerprotein mitwirken. Die Speiche wird aus 2 Spiralen gewunden, weil 2 Folgezeile QS=64 besitzen und die 3. Zeile „Kreis=64“ direkt enthält. Die Helix setzt hier am Radkranz an als QS5+2=7=Form_O=Radkranz, um als Spalte unter der Null in der Folgezeile die Helix als EXTRA=8_QS5+2=7=Form zu verwinden: Epi.Ref_Rhesus.Z.7896#165206“1“3“5“3“0“8“2“44“. Nochmals die Geometie: Zeichnerisch überpüft, besitzt der Ring einen Durchmesser von 15 nm, um darauf mittig 18 Kugeln, D= 2nm, abzulegen. Damit kann von jeder 2. Kugel eine Speiche zu jedem Triplett am inneren A-MT gespannt werden. Der Centriolen-Zentralring ist im Zeilenlauf unsichtbar, weil er aus QS=1+6+5+1+8+5+2+1+5+1+9+4+8+7+1=64=Kreis resultiert [Der „Groschen“ für den Kreis „ist“ beim Autor endgültig erst am runden Elefantenfuß „gefallen“]. Die Geometrie ist kombiniert als Struktur 5_5 und als Zählgröße 1_1 als Verbindungskörper sowie als EXTRA=8 adressiert „51_8_5“2“15“1“. Als Spiegelung „51_15“ sitzt der „Kugeldurchmesser=2nm“ auf dem Ringdurchmesser=15nm“: Epi.Ref_Rhesus.Z.7897#1651“85“215“1948“71“.
Die Speiche kann nicht direkt am A-Tubulus (A-MT) andocken, weil die Mathematik der Evolution eine komplexe Aufgabe vor die Füsse wirft: Die Speiche soll nicht am A-MT befestigt werden, sondern an einer dazwischen geschobenene dreickigen Volumenform „3003_7=Form“. Für den Speichen-Verbindungskörper ist das Protein „CEP135“=1059AS zuständig [Cep135 - Centrosomal protein 135kDa, isoform A - Drosophila melanogaster (Fruit fly) | UniProtKB | UniProt]. Das Protein stellt die Verbindung zum rechten Rand mit seiner Ziffer „1“, springt vertikal die Rand-Null an, um in der Zeile zwischen den Ziffern „9“ und „5“ den Dreieckskörper zu präsentieren. Von der Grundlinie des Dreieckkörpers soll unter „90°“ eine Helix aus 2 Spiralen Helix „coiled coil“ tangental abgehen, um A-MT und B-MT zu überbrücken und am C-MT anzuschließen. Für die Helix „coiled coil“ ist das Protein CPAP zuständig. Hier als Ersatz getestet mit „Zentromerprotein J (CENPJ)=1338AS“. Mittels Ziffernspaltung „1_33_8 (58)“ und Zahlendreher erfolgt ein Verweis auf die Folgezeile. Es wird eine EXTRA=8 als Struktur „8_5_8“ adressiert, um auf die linke Helix-Ziffer-5 hinzuweisen: Der Verbindungsfaden „coiled coil“ „1“ liegt in QS5_[1]_4=9_3_3_9=seitlich. Mit QS5+1=6_4=Kreis wird eine Wicklung erzeugt [siehe: Structural Analysis of the G-Box Domain of the Microcephaly Protein CPAP Suggests a Role in Centriole Architecture (cell.com); I. Vakonakis, Nov.2013; ioannis.vakonakis@bioch.ox.ac.uk http://dx.doi.org/10.1016/j.str.2013.08.019 / https://www.researchgate.net/figure/The-Role-of-CPAP-SAS-4-in-the-Centriole-Ultrastructure-A-Schematic-top-view-of-the_fig4_257204838]: Epi.Ref_Rhesus.Z.7899#16“514“33“90“858830.
Während der Mitose bilden die Centriolen eine Teilungsspindel. Die Centriolen sind zu den Polen gewandert. In der Mittle sitzen die Chromoseen. Zur Verbindung wachsen Mikrotubili zwischen Chromosomem und den Centriolen. Bei der Zellteilung werden unterschiedliche Klebstoffe verwendet. Wenn die DNA als mRNA kopiert wird Chromosomen durch die Cohesin-Matrix fixiert. Die beiden Centriolen werden jedoch aus dem Protein-Gemisch der sie umgebeneden „pericentriolaren Matrix (PCM)“ „33“ im Winkel=90° zusammengehalten, so dass das Cohesin bei der Verdopplung des Centriolen nicht mehr maßgeblich ist. [siehe: Mehrere Mechanismen tragen zur Centriolentrennung bei C. elegans bei: Aktuelle Biologie (cell.com); M. Dammermann u.a. Jul 2013; DOI:https://doi.org/10.1016/j.cub.2013.06.043 [Wie Centriolen während der Zellteilung in Schach gehalten werden (idw-online.de)]. „Der molekulare Mechanismus der Zentrosomenduplikation ist noch nicht bekannt, jedenfalls muss an jedem der beiden MutterCentriolen ein Tochterzentriol auswachsen, was schließlich zu zwei vollständigen Zentrosomen führt (semikonservative Replikation)“ (siehe: Zentrosom – Wikipedia). Das Zentrisol wird bei anderer Sichtweise selbst als„Organell“ betrachtet, weil das Zentrisol als Doubel ein Zentrosom bildet oder alternativ einzeln an der Oberfläche 1 den Basalkörper/Kinetosom erzeugt, aus dem 1 Flagellum/Geißel herauswächst. Im Zentrosom liegt das Zentrisol immer als Paar von Mutter und Tochter zusammen, die bei jedem Zellzyclus dupziert werden. Die Mutterzentriole hat sich in einem früheren Zellzyclus zur Tochterzentriole zusammengesetzt. Mutterzellen sind mit Molekülen dekoriert, die auf der Tochterzentriole fehlen. Für die Positionierung in der Zelle ist der distale Teil entscheidend, wobei sich die Tochter nach der Mutter richtet [siehe: Das Mutterzentriole spielt eine lehrreiche Rolle bei der Definition der Zellgeometrie - PMC (nih.gov); J.Feldman; Juni 2007; doi: 10.1371/journal.pbio.0050149 ].
„SpermienCentriolen sind wichtig für 2 Funktionen: (1) um das Spermienflagellum und die Spermienbewegung zu bilden und (2) für die Entwicklung des Embryos nach der Befruchtung. Die Spermien liefern die Zentriole, die das Zentrosomen- und Mikrotubulisystem der Zygote bildet.“; [siehe:https://en.wikipedia.org/Centriole]. Es werden 20 Zeilen nach dem fiktiven Exflagellationssignal in Z.7881 zu einer Calcium-Zeile übersprungen, um die Verdopplung (Duplikation) der beiden Centriolen zu organisieren.
Die Zeile enthält 3 Nullen, um davon die Centriolen-Länge=500nm und das Mikotubuli (MT)-Material Tubulin=450AS zu bilden, wozu wegen „405“ erst eine Spiegelung „50_05“ als Schalter wirken muss. Die Spiegelung wird als Längensymbol benötigt. Form und Zählgröße in Z.7902 entahlten. Die „13“ Profilamente als MT-Außenwand sind enthalten sowie zwei „5“er Grundeinheiten. Die Folgezeile enthält passend das Protein „Mikrotubuli-assoziiertes Protein RP/EB-Familie Mitglied 1 (EB1)_Human“= 268AS. Funktion: Plus-End-Tracking-Protein (+TIP), das an das Plus-End von Mikrotubuli bindet und die Dynamik des Mikrotubuli-Zytoskeletts reguliert [MAPRE1 - Mikrotubuli-assoziiertes Protein RP/EB-Familienmitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt ].
Epi.Ref_Rhesus.Z.7902#16““50“8“0“694“05“1366 und
Epi.Ref_Rhesus.Z.7903#165059805693“268“.
Mit Z.QS7+9+0+4=20=Calcium wird im Zeilencode das CO2=22 aus der Blutmahlzeit=26 und Calcium=20 mit einer großen Klammer in den Mückendarm 8_0_8 verfrachtet.
Epi.Ref_Rhesus.Z.7904#16503“8“(92262)“0“(6)“8“5.
Es sind diverser Zufälligkeiten wie die Centriolen-Länge=500nm. Bicarbonat HCO3=1+6+24=31E ist enthalten und bildet mit der Zahl „3“ zur Folgezeile als Spalte darunter die Ziffer 2 und davon links die Ziffer 3 für „alpha-Carboanhydrase (CA)=323 AS“, die das aus der Blutmalzeit entweichende CO2=6+16=22E zu HCO3 und Wasserstoffionen katalysiert. Die pH-Werterhöhung löst mit weiten Einflüssen die Exflagellation aus. CO2 liegt in der Folgezeile als Z.QS=22 in der Zeilennummer. Das zur Reaktion erforderliche Wasser=H20=“28“=QS2+8=10E liegt zu spät erst in Z.7911 vor, wenn die Verdopplung der Centriolen bereits angeschlossen ist [α-Carboanhydrasen – Wikipedia]. Ein Zusammenhang wird nachfolgend dadurch erzeugt, dass die Serie der Kreiszahl #1„64“=QS=6+4=10 ersatzweise ins Spiel kommt: Epi.Ref_Rhesus.Z.790“5“#1“65“0“18“0“448“31“612.
Fortsetzung gleiche Zeilennummer: Es wird eine Centriolen-Gruppe „44“ gebildet, die nicht als Dopplung, sondern über die Z.Nr.Z.xx05#_50 als Spiegelung (Kopie) erscheint. Statt Calcium=20 hat die Z.Nr.um 1 Aktion und auch QS8+3+1+6+1+2=20+1=21 erhöht. Mit Zählgröße=1(6)1 wird verwiesen auf QS1+6+5=12 wie auch am rechten Rand als Kopie 12 vorhanden. Der Zahlenanteil „12“ gehört zum Protein „PfATPase4“=1264 AS. Funktion: Diese Analyse legt nahe, dass PfATP4 eine neue Unterklasse von Ca(2+)-ATPasen definiert, die einzigartig für apicomplexane Organismen sind. [ATPase4 - Nicht-SERCA-Typ Ca2+ -transportierende P-ATPase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt ]. Der Zahlenanteil kann jetzt auch am linken Zahlenrand gelesen werden, wo dann mit dem 2. Zahlenteil „64“ eine Spalte gebildet wird, die nachfolgend als „BiXnom-Zahlenspaltung“ „6-4“ über 5 Zeilen ausgerollt wird.
Gleichzeitig zielt auf die Serie #164 das Protein „D-aminoacyl-tRNA deacylase (DTD)=164 AS“ [ DTD - D-aminoacyl-tRNA deacylase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ]. Die Proteinbiosynthese setzt sich aus der Transkription und der Translation zusammen. Bei der Translation wird die Transfer-RNA (tRNA) wirksam, indem sie die „Abschrift der DNA“, die mRNA, in eine Aminosäure-Sequenz übersetzt. Das Protein entfaltet katalytische Aktivitäten:
A) Glycyl-tRNA(Ala) + H2O = Glycin + H + tRNA(Ala)[+]
B) a D-aminoacyl-tRNA + H2O = a D-alpha-amino acid + a tRNA + H[+]
C) D-tyrosyl-tRNA(Tyr) + H2O = D-tyrosine + tRNA(Tyr)
Daran sind beteiligt: Adenosin= C10H13N5O4=60+13+7*5+8*4=73+35+32=140E. Thyrosin=C9H11NO3=6*9+11+7+8*3=54+18+24=96E und Glycin=C2H5NO2=12+12+16=40E.
Das Resultat ist nur ausreichend. Zeilennummer und abgespaltener linker Zahlenrand bilden jeweils als Verdopplung eine Zahl 16, die als Matroschka-Puppe für die Tochter QS1+6=Form ergibt als Spalte Z.QS7+9=16_0_x #16 /[4=Spalt]. Die 5. Zeile enthält am rechten die Spiegelung „61“, wo durch die Matrix endet. Die Zeitdifferenz liefert eine Strukturspiegelung „2“55“2“, paarig=2, an einer paarigen Schwerachse=8_(3)_4(3)_84 in der PCM-Matrix „33“: DELTA.TIME.Epi.Ref_Rhesus.Z.7906-7910=#“8“3“4“3“7“2552“84“. Die abgespaltenen Restzahlen werden testweise in einer Reihenfolge aufgelistet. Die DNA-Replikation und der Aufbau der Centriolen folgen erst später. Es wird lediglich der Mechanismus zur Verdopplung bereitgestellt, weil die Centriolen die Anordnung von Organellen und die Lage des Zellkerns bestimmen. Zur Verdopplung liegen keine speziellen bildlichen Informationen vor. Die Duplikation des Zentrosoms korrespondiert mit der Duplikation der Chromosomen. Die gegensätzlichen Pole im Mitoseapparat zur Bildung des Spindelapparates entstehen nicht aus einer Trennung von Mutter- und Tochtercentriole, sondern nach der Verdopplung liegen in den Polen gleichartige „Schwester-Zentrosome“. Trotz dieses Sachverhaltes muss es vor Eintritt in die Mitose zur Verdopplung des Zentriolenpaares der Mutterzelle kommen. Der Mechanismus ist unbekannt, so dass ein Testmodell gebildet wird. Annahme: Die Ur-Centriolen sind bereits mit dem Kleber der PCM-Matrix „33“ verbunden und bilden als Centriolen-Paar ein Ur-Zentrosol. Aufgrund spezieller Anhänge soll zwischen Mutter-und Tochtercentriole unterschieden werden. Im Zeilenlauf folgt die Tochter der Mutter, auch real ist das so.
*1.1) Ur-Mutter-Centriole (Winkel 40°): Epi.Ref_Rhesus.Z.“79“06#“16“499717232“40“45.
*1.2) Ur-Tochter-Centriole (90°-40°=50°): Epi.Ref_Rhesus.Z.“79“07#“16“497630“50“95978.
Annahme: Jung-Centriolen werden durch eine Kleber-Zwischenzeile „33“ gekoppelt:
*2.1) Jung-Mutter-Zentriole (Winkel 40°): Epi.Ref_Rhesus.Z.“79“08#“16“4955443145“40“9
*2.2) Kleber-PCM-Matrix „64_33“: Epi.Ref_Rhesus.Z.“79“09#“16“493458“64“70“33“7
*2.3) Jung-Tochter-Centriole (90°-40°=50°): Epi.Ref_Rhesus.Z.“79“10#“16“491373“50“68761
Der 90°-Kreuzungswinkel von Mutter- und Tochtercentriole liegt auch in der Zeilennummer.
Unklar, was soll das bedeuten? „Im Zellplasma formt sich das die Mikrotubuli organisierende Zentrum (MTOC) innerhalb von 15 Sekunden „in acht in zwei orthogonalen Tetraden gestapelte Kinetosome um“ [siehe: Lebenszyklus der Malariaerreger (gigers.com)]. Die Zeitbasis=60 zieht sich als Besonderheit vertikal als Spalte über 2 Zeilen, daneben ist die „MTOC-Zeit: QS=9+6=15 Sekunden“ programmiert. Die beiden Tetraden „48“ liegen als Spalte doppelt vor sowie zwecks Zeitbezug nochmals doppelt in der Zeile.
*3.1) MTOC: QS=88; „8_Zeitspalte=6[0]_8“: Epi.Ref_Rhesus.Z.7911#16“48“9“28“88“93“8“6“8“0.
*3.2) MTOC: Zeitspalte=[6]“0“, Zeitdauer QS9+6=15Sek.: Epi.Ref_Rhesus.Z.7912#16“48“720“48“0780“96“.
*4.) Erste Mitosespindel: Unklar, was soll das bedeuten? „Unmittelbar danach formt sich die erste Mitosespindel aus einer einzigen Spindelplaque“. Zur Prozesssteuerung liegt in Z.QS7+9+1+3=20=Calcium vor. Man staune über „485_12_12_485“ – die Mitosespindel „5_0_11=Zählgröße“! Plaque =QS 4+8+5=17_ QS4+8+5=17= Summe 34. Zellteilung erfolgt, wenn sich Partner gegenseitig 1 Müllpaket zuschieben, um „34-1=“QS1+2=3_QS1+2=3“ =33=Zellmembran zu stabilisieren. Das Protein ATPase4=1264AS kann seinen Zahlenteil „12“ ins Zentrum spiegeln [ATPase4 - Nicht-SERCA-Typ Ca2+ -transportierende P-ATPase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]:
Das Protein „Einzelsträngiges DNA-bindendes Protein“=284AS kann einen Zahlenteil als „248“ Spiegeln, falls es extra für diesen Zweck produziert wird [Einzelsträngiges DNA-bindendes Protein - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Die Zahl „12_0_11=Zählgröße“ startet einen Timer [hochgedrehte 12 ist „21“] zur Zählung von 120 Sek.=2min bis zur Fixierung des Chromosoms zwischen den Polen der beiden Centriolen : Epi.Ref_Rhesus.Z.7913#16“485“12“12“485“0“21“1“.
*5.) Teilung der Mitosespindel: Unklar, was soll das bedeuten? „Mitosespindel teilt sich und die Spindelpole rotieren in der Kernhülle“. Die Teilung erfolgt, weil nochmals zwei „48er“-Zeilen folgen. Die Kernhülle „33“ liegt rund „64“ und hohl „303_QS2+1=3_5=Struktur“ vor. In der 2. Zeile wird die „33“er-PCM-Matrix als „seitlich=9_QS5+4=9=seitlich“ rechts aus Zeile geschoben, damit sich die beiden Schwester-Zentrosomen bewegen können.
Epi.Ref_Rhesus.Z.7914#16“48“3038“2157429 und Epi.Ref_Rhesus.Z.7915#16“48“095570“9“33“54“
Die beiden Schwester-Centriolen könnten eine Spiegelung „Form=7_8_8_7=Form“ darstellen. Gemäß einer Skizze mit einem T-förmigen Zentrosom als Symbol für das Centriolen-Paar wird das „T“-Zentrosom nur verdoppelt und nicht gespiegelt [Mitoseapparat siehe: https://www.uni-giessen.de/de/fbz/fb10/institute_klinikum/institute/vetanatomie/informationen-1-semester/histologie-skript-1-einfuehrung-zytologie-und-oberflaechenepithelien ]. Eine Rotation um ihre eigene Achse ist nicht erkennbar, notwendig ist es, sie sich die Schwester-Zentrosome symmetrisch ausrichten. Weil darin jeweils die Mutter-Centriole maßgebend ist, kann der 90°-Centriolen-Kreuzungswinkel als Symbol dienen, um eine Parallelität zu erzeugen: Winkelsumme= 90°+90°=180°=parallel als „90_Form=7_90“. Anschließend wandern die Schwestern zu gegenüberliegenden Polen: Epi.Ref_Rhesus.Z.7916#164“7887“372“90“7“90“.
*6.) Gegenüberliegende Pole: Unklar, was soll das bedeuten? „Nach „zwei Minuten“ stehen sich die Pole auf unterschiedlichen Seiten des Zellkernes gegenüber [siehe: siehe: Lebenszyklus der Malariaerreger (gigers.com) ].“
Die Schwester-Zentrosome liegen sich entfernt und parallel gegenüber als Strukturen „55_55“. Zwischen den beiden Polen werden Schwester-Chromatiden durch ein MT-Netzwerk mittig fixiert.
Schwesterchromatiden sind bei der DNA-Verdopplung entstandene Längshälften (Chromatiden) eines Chromosoms. Im Bauplan muss die dramatische Wirkung der Xanthurensäure=106E verhindert werden. In der Vor- und Folgezeile liegt „Zink=30_9=seitlich“. Die Verbindungsdiagonale hemmt die Säure, weil sie „ideel bildlich“ durchgestrichen wird. Damit ist das Zink im Spiel und legt sich mit dem „RING Zinkfingerprotein=615 AS in der gespiegelter Ziffernfolge auf die Säure [RING zinc finger protein - Plasmodium gonderi | UniProtKB | UniProt]. In der Zeilennummer liegt auch Calcium zur Steuerung vor. Mit der gleichen Funktion wird die Ziffer „1“ der Säure bei gespiegelter Ziffernfolge von der Folgezeile als Spalte 1-1 durch das „Erythrozytenmembranprotein 1 (PfEMP1)=1711 AS gehemmt [Erythrocyte membrane protein 1, PfEMP1 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ] gehemmt: Epi.Ref_Rhesus.Z.79“20“#16470“55“106“55“795. In Zeile Z.7913 wurde der Timer als. mit dem Symbol „021“ gespannt, d.h. die Ziffer 1 soll beim Countdown=120 Sek. in die Platzhalter-Null springen. Die Timer-Zahl 21 liegt nunmehr in der Zeilennummer vor, aber scheinbar fehlen die 120 Sekunden. Die Zeitbasis wurde durch die beiden Zinkzeilen 30+30=60 eingestellt. Das Zellgehirn alle Eindrücke zusammen, ist damit aber schon auf Addition vorbereitet. Somit ergeben sich aus „3090“ als „30+90=120 Sek.=2min“. Bei Bedarf kann man aus 3*120=360° eine Kreisfunktion erzeugen. Nein, der Timer wird jetzt auf 360 Sek=6min für die nächste Etappe hochgefahren!: Epi.Ref_Rhesus.Z.79“21“#164684“7171“30“9“0“5.
*5.) Zusätzliche Spindelpole: Unklar, was soll das bedeuten? „ Nach fünf bis sechs Minuten teilt sich jeder der separierten Spindeln innerhalb des Zellkerns noch einmal und nach acht Minuten teilen sich die vier resultierenden Spindelpole durch eine Mitose. In jeder der dazwischenliegenden Perioden repliziert sich das gesamte Genom ohne dabei je zu sichtbaren Chromosomen zu kondensieren [siehe: Lebenszyklus der Malariaerreger (gigers.com) ].“
Das Protein „Spindel- und Zentriol-assoziiertes Protein 1 (Spice1)“=“855“ Aminosäuren ist der Regulator für die Centriolenduplikation, für die richtige bipolare Spindelbildung und Chromosomenkongression in der Mitose [siehe: SPICE1 - Spindel- und Zentriol-assoziiertes Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Weil die Prozesssteuerung durch Z.QS7+9+2+2=20=Calcium bedingt ist, müssen die Protein im Gen-Code passend fixiert werden.
Epi.Ref_Rhesus.Z.79“22“#164663928“855“579. Die Bildung weiterer Pole ist mit der Folgezeile als Dopplung „6464“ in „Spalten über 2 Zeilen“ möglich. Die 2 Schwester-Zentrosome enthalten zusammen 4 Centriolen, verdoppelt sind 8 Centriolen im Spiel. Die Ziffer „792 _1646_8“ ergeben 8 Spalten „[7-7, 9-9, 2-2, 1-1, 6-6, 4-4, 6-6, 8-8]“. Null-Null ist Nichts. Struktur 5-5 ist unmöglich und wird durch 2-fach 6-6 ersetzt. Während der Mitose folgen 7-7 un 9-9: : Epi.Ref_Rhesus.Z.“792“3#“1646“43145“8“27830.
Mit Z.7924=Zeit sind „36_0“=360Sek=6min abgelaufen. Die Zeitbasis=60 liegt in der Folgezeile. Als Zeilenverbinder ergibt QS60+1=61, so dass die Ziffer „1“ am rechten Rand entfällt: Epi.Ref_Rhesus.Z.79“24“#164622“36“8“0“4567“1“ und Epi.Ref_Rhesus.Z.7925#164“60“1595507116. Die nach 6 Minuten vorliegenden 4 Pole mit 8 Centriolen können nicht durch 16 Spalten verdoppelt werden, sondern nur als Extra=8_paarig=2_8=Extra. Das ist nur mit 2 Proteinen zu leisten, die sich beidseitig hemmend auf den Zahlenrest mit vermischter Ziffernfolge legt. Diese Proteine sind beim Menschen nachgewiesen worden, sind auch beim Parasiten notwendig. Protein „Zentrosomales Protein (CEP97)=865 AS [CEP97 - Centrosomal protein of 97 kDa - Homo sapiens (Human) | UniProtKB | UniProt ]. Das Protein „CEP97“ ist für die Rekrutierung von CCP110 für das Zentrosom erforderlich. Protein „Centriolares Coiled-Coil-Protein (CCP110)“= 1012AS [CCP110 - Centriolar coiled-coil protein of 110 kDa - Homo sapiens (Human) | UniProtKB | UniProt ]. Das Protein „CCP110“ ist für die Zentrosomenduplikation in verschiedenen Stadien der Procentriolenbildung und die korrekte Spindelbildung erforderlich. CCP110=1012 AS liegt gespiegelt als „2101“ vor. Linker Rand mit CEP97 = 865 AS mit „8“gespiegelt „658“: 1“6“4“58“0 bzw. erfolgt die Spiegelung „865“ über die Spalte zur Vorzeile von „8“ zu „6“, herunter zur „5“, um die Zeitbasis „60“ mitzunehmen. Die Ziffer „4“ wurde noch nicht verwendet und zählt für 4_80 =480 Sekunden=8min. Die überschüssige Null in „101“ ist durch eine Zählgröße mit dem Protein CCP110 geklammert und zählt nicht mit. Die Mitose kann nachfolgend starten. Ein Zeitbezug liegt als Z.QS7+9+2+6=“24“ vor. Für die Mitose wird der Timer später über 3600 Sekunden neu gestartet. Die Mitose entwickelt sich über eine mathematische Matrix. Für die Spindelfasern des Spindelapparates ist das erforderliche Tubulin=450AS mit 45_(1)“0“(1) vorhanden. Die überschüssige Null in „808“ wird durch die Zeit= 480 Sek. verwendet, was nachfolgend genauer geprüft wird: Epi.Ref_Rhesus.Z.7926#16“4“5“80“828“2“101“81.
Spindelapparat: Zwischen den beiden gegenüberliegenden Polen (Kinetozentren), die jeweils von einem Schwesterzentrosom aus 2 unter 90°-kreuzenden Centriolen gebildet werden, sind Spindelfasern gespannt. Weil aktuell eine Serie #_“45“ über 4 Zeilen (2x 2Nullen, 1Null, kein Null) läuft, werden die Spindelfasern wie die Mikrotubuli der Centriolen aus Tubulin=450 AS hergestellt (kein Aktin für Mikrofilamente), davon ist aber nur 1 Zeile geeignet die passend 1 Null für 45_0=450AS enthält. Zuvor in Z.7926=QS=24=Zeit mit 2 Nullen „808“2“8“ und „101“ wird der doppelte Materialbedarf in 8“2“8 adressiert. Die Spindelfasern sind auf halber Strecke am Spindeläquator gekoppelt, um Funktionen auszuführen. Die beiden restlichen 45er-Null-Zeilen können 2 verschiedenen Spindelfasertypen zugeordnet werden. Für die Mitose tickt für beide Zeilen mit der Quersumme QS=60 der 3600-Sekunden-Timer. Die Null darf aber keine Zeilentrennung als QS30+QS30=60 erzeugen, so dass eine Kopplung mit unterschiedlichen Teilsummen vorliegen muss:
Typ A) Polmikrotubuli / Polfaser: Die Halbspindeln spannen sich beidseitig vom Pol zum Spindeläquator, wo sich überlappen. Die Zeitdifferenz zur 24er-Referenzzeile ergibt: DELTA.TIME.Epi.Ref_Rhesus.Z.7926-Z.7927=#207620572991 und somit „Calcium-Steuerung=20_76_20=Calcium=QS=33=männlich“. Die Teilsummen QS=1+6+4+5+6=22 und QS=6+6+1+5+2+8+8+2=38 zeigen eine Überlappung in der „Länge 22 um 8“, so dass das Protein „Calcyclin-bindendes Protein (CACYP)= 228AS zuständig ist, eine Spalte zur Referenzzeile zu legen. Das Protein kann an der Calcium-abhängigen Ubiquitinierung und dem anschließenden proteasomalen Abbau von Zielproteinen beteiligt sein. Dient wahrscheinlich als molekulare Brücke in Ubiquitin-E3-Komplexen [CACYBP - Calcyclin-binding protein - Homo sapiens (Human) | UniProtKB | UniProt]. In Z.7926 muss die Ziffer „2 in den benachbarten Platzhalter (2)1“0“1 springen, damit in der Spalte „22“ und rechts daneben die Ziffer „8“ lesbar sind. Weil die Initiative in der falschen Reihenfolge von der Calcium-Zeile nach oben gezogen ist, muss ein 90°-Bogen ausgeführt werden. Der Winkel 30° liegt aus der gemittelten Halbspindel vor, dass sich mit dem Ergänzungswinkel 30+60=90° ergeben. Zugleich wird die Überschuss-Null gebunden, damit Tubulin=450AS gebildet wird. Die Überlappung der beiden Halbspindeln „paarig=2882=paarig“ mit dem Mittelwert=30=Zink erfordert das Zinkfingerprotein „A0A0L7KJI5 · A0A0L7KJI5_PLAFX“=1588AS [Zinc finger protein - Plasmodium falciparum (isolate HB3) | UniProtKB | UniProt]. Das Zinkfingerprotein ist im rechten Zahlenteil lesbar „15“2“88“2“, wobei die Störgrößen „2_2“ die QS=22 der linken Seite ergeben.
Typ B) Chromosomenfasern/Zugfasern: Die Fasern spannen sich vom Centromer der Chromosomen zum Spindelpol. Die beiden Zahlenteile QS=1+6+4+5+3+9+3+0=31 und QS=9+3+3+3+2+3+6=29 mit der Summe=60 sind bezüglich der längerer Seite gegensätzlich.
Zeitdifferenz DELTA.TIME.Epi.Ref_Rhesus.Z.7926-Z.7928=#41518876945=QS11_QS40=QS51=QS6. Im Ergebnis wird eine Zählgröße 11 in Verbindung mit Glycin=40 ausgewiesen. Glycin gehört zur Gruppe der hydrophilen Aminosäuren und ist als einzige proteinogene (eiweißbildend) Aminosäure „achiral“. Ein achivales Objekt ist nicht zwangsläufig asymmetrisch, besitze aber keine Drehspiegelachse. Beispielsweise ist der normale Korkenzieher speziell für Rechtshändler mit Rechtsgewinde gewickelt. Das Molekül kann folglich nicht durch Drehung etwas anderes darstellen. Glycin ist die kleinste Aminosäure und erlaubt dadurch Windungen. Glycin ist Bestandteil von Fasern. In der sich widerholenden Sequenz G-X-Y liegt ein Glycin(G)-Rest an jeder 3. Position. Mit 1/3=0,333 ist erklärlich, weshalb „333“ in der Zeile liegt und zum männlichen „33“ Chromosom eine Beziehung herstellt [Kollagene – Wikipedia]. Prolin=62 ist in der Sequenz meist ebenfalls enthalten und ist hier als Spiegelung 2_6 mit Glycin im rechten Zahlenteil verwickelt als „9“333“2“3“6“. Für die Mikrotubuli ist Tubulin vorhanden als [QS1+6=Form]_ 45_[393]_0=450 AS. Zink=“30“ ist für ein Zinkfingerprotein =560AS enthalten. Das Protein liegt sichtbar in der Vorzeile, und kann nunmehr den Winkel 60° für 30+60=90° beisteuern, damit eine Spalte gegen den Zeilenlauf hochziehen kann. Es fehlt das Protein „Calcium-dependent protein kinase 4 (PfCDPK4)“=528AS, dass scheinbar nutzlos in der 2. Zeile herumliegt.
Das Protein ist u.a. während der männlichen Gametogenese im Mückendarm erforderlich, um die erste Runde der DNA-Replikation einzuleiten, wahrscheinlich durch Erleichterung des Zusammenbaus des präreplikativen MCM-Komplexes, um die erste mitotische Spindel zusammenzubauen [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Das Plasmodium enthält Calcium-abhängige Proteinkinasen (CDPKs)die bei vielzelligen Tieren (Metazoa) meist fehlen und bei Pflanzen ähnlich wirken. „Diese Enzyme haben eine katalytische Domäne ... und eine C-terminale Calmodulin-ähnliche Domäne (CLD), eine Junction-Domäne (JD) trennt die katalytische Domäne von der CLD. Biochemische Untersuchungen an Pflanzen CDPKs haben gezeigt, dass das „JD die CDPK-Aktivität reguliert“, ... Als nächstes untersuchten wir, ob die C-terminale Region der J-Domäne spielt eine Rolle bei der PfCDPK4-Regulierung. Zu diesem Zweck wird Peptid III „entsprechend den Resten 357-„368“ der J-Domäne“ verwendet wurde.“ [siehe: Dissection of Mechanisms Involved in the Regulation of Plasmodium falciparum Calcium-dependent Protein Kinase 4* - Journal of Biological Chemistry (jbc.org); P.Sharma u.a. (Mai 2009); doi: 10.1074/jbc. M900656200 ]. Das Protein „PfCDPK4“ enthält eine J-Domäne mit einer Länge von 368AS, die erforderlich ist, um alle 3 Zeilen als Spalte zu binden. Die Ablesung „3-6-8“ erfolgt steigend gegen den Zeilenlauf mit der Ziffer „3“ in „3“93_0_93“=“3“_QS9+3+0+9+3=24=Zeit.
Die Zeilen-Nr.xx33=männlich wird mit der Gruppe 44 und „8“ Mikrogameten am Zahlenrand als Startzeile gewählt, die aus 1 Mikrogamonten entstehen. Auch im Code ist männlich=33 als 3_Form=7_3 enthalten. Zeitbasis=60 Sek. enthalten. Die Zeit kann sich auf Z.xQS9+3+3=15 Sekunden beziehen. Im Zellplasma formt sich das die Entwicklung von Mikrotubuli organisierende Zentrum (MTOC) innerhalb von 15 Sekunden „in acht in zwei (???) orthogonalen Tetraeden gestapelte Kinesome um“[siehe 6.1.1.1 Gametogenesis: Lebenszyklus der Malariaerreger (gigers.com) ; „Unmittelbar danach formt sich die erste Mitosespindel aus einer einzigen Spindelplaque (???), teilt sich und die Spindelpole rotieren in der Kernhülle und wandern auseinander. Nach zwei Minuten stehen sich die Pole auf unterschiedlichen Seiten des Zellkernes gegenüber. Nach fünf bis sechs Minuten teilt sich jeder der separierten Spindeln innerhalb des Zellkerns noch einmal und nach acht Minuten teilen sich die vier resultierenden Spindelpole durch eine Mitose. In jeder der dazwischenliegenden Perioden repliziert sich das gesamte Genom ohne dabei je zu sichtbaren Chromosomen zu kondensieren.]: Epi.Ref_Rhesus.Z.79“33“#16“44“35“60“3“7“3“0“48“0“.
Das Mikrotubuli-Organisationszentrum (MTOC), das den gleichzeitigen Ablauf der DNA-Replikation und den Aufbau von Axonemen koordiniert, erfordert 2 Arten von Regulatoren:
1.1) Protein „Caseinkinase I (CK1)= „324“ AS [CK1 - Caseinkinase I - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.7937#164352733“324“165
Das Protein „Calcium-dependent protein kinase 4 (PfCDK4)=528AS ist am Beginn der DNA-Replikation beteiligt, um in der 1. Runde der DNA-Replikation die 1. Mitotische Spindel zusammenzubauen. Es wirkt am Zellzyklus bis zur Exflagellation mit [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ]: Epi.Ref_Rhesus.Z.7951#16406“33“43“528“348.
Das Protein „MAP2_PYRFU=295 Aminosäuren“ (gewählt, weil PfMAP-2 unbekannt) ist vorhanden [Karte - Methioninaminopeptidase - Pyrococcus furiosus (Stamm ATCC 43587 / DSM 3638 / JCM 8422 / Vc1) | UniProtKB | UniProt]. Info PfMAP-2 siehe: [Info siehe: PfMAP-2 is essential for male gametogenesis in the malaria parasite Plasmodium falciparum - PMC (nih.gov); T.Voss u.a. (Jul 2020); doi: 10.1038/s41598-020-68717-5.]. Der Zahlenteil „29“=QS2+9=11 ist eine Zählgröße und löst später die Exflagellation aus. Die Flagellen werden nur 1x als erwartete „111“ symbolisiert. Die 8 Flagellen entstehen einzeln als Gruppe „44“ in der Serie „1_flexibel=6_1“. MAP2 kommt mit der Ziffer „2“ in der Serie #16“2“ für die Exflagellation noch zu früh. Erst später wandert das Protein zum rechten Zahlenrand. Im Bauplan ist es dort aber als „29“0“5“ statt 295AS noch nicht aktiviert. Das Protein „Polyadenylat-bindendes protein 3“ =644AS liegt als Gesamtlänge vor [Polyadenylat-bindendes Protein 3, mutmaßlich - Plasmodium knowlesi (Stamm H) | UniProtKB | UniProt ]. Polyadenosin steht mit dem Thema „Genom“ in Beziehung [siehe: Plasmodium falciparum translationale Maschinerie duldet Polyadenosin-Wiederholungen - PMC (nih.gov)]; S. Djuranovic u.a., Mai 2020; doi: 10.7554/eLife.57799]: Epi.Ref_Rhesus.Z.7934#1“644“14“878““295“172.
Start des Mitose-Timers: Der Parasit sitzt im roten Blutkörperchen, so dass man mitlesen kann, wie er den BiXnom-Code studiert und darin seine Chance sucht. „Nach acht Minuten teilen sich die vier resultierenden Spindelpole durch eine Mitose. In jeder der dazwischenliegenden Perioden repliziert sich das gesamte Genom ohne dabei je zu sichtbaren Chromosomen zu kondensieren.“ [siehe:Lebenszyklus der Malariaerreger (gigers.com) ]. Jeder Pol besteht aus einem Schwester-Zentrosom (enthält 2 Centriolen). Bei der Mitose entstehen folglich aus 8 Schwester-Zentrosomen verdoppelt 16 Zentrosome. In einer nachfolgenden Matrix sind in 2 Blöcken zusammen 8 Doppelziffern zur Vermehrung durch 4 Verdopplung „xy_xy“ und 4 Spiegelungen „xy_xy“ als Symbolik vorhanden. Die Mitose-Zeitdauer=1 Std.=3600 Sek. ist hier real unbekannt, und wird nachfolgend analog zum Menschen mit 1 Stunde festgestellt. Wird der Timer nach den 8 min für diese 1 Stunde neu gestartet? Ja! Vor der Mitose liegt die Zeilen-Nr. Z.QS7+9+3+5=24=Zeit. Enthalten ist der Mückendarm „808“. Gleichzeitig ist das auch eine Kernpore, weil der Parasit mehrkernig bleibt, um das Genom durch die Kernporen in 8 Flagellen zu ziehen. Die Flagellen hängen dann sternförmig am Restkörper (suchen). Die Zeile enthält am Zahlenrand QS8+3+6+6+7=30=Zink. Zink ist auch in der Folgezeile vorhanden, um die Zeitbasis 30+30=60 als Sekundenzähler zu gewinnen. Die Basiszahl „36“(00)Sek. ist bereits enthalten und liegt auch in der Zeilennummer der Folgezeile, so dass die beiden Nullen im Doppel-Zink die Zeit erzeugen. Um die spaltenartige Lesart zu realisieren, wird das Protein „AP2-Domänentranskriptionsfaktor (AP2-I)“=1597AS als Molekültyp „Genomische DNA“ aufgebaut [AP2-Domänentranskriptionsfaktor AP2-I - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Das Protein wird zerlegt und gespiegelt als „15_7_9“. Es wird eine Teilzahl geklammert und 7-9 bilden die Randspalte beider Zeilen. Gleichzeitig läuft in der Zeilen-Nr. die Serie „79“. Notwendig ist es, in der 3. Zeile die Zahl „24“=Timerstart zu markieren. Vom Protein „Domänenhaltiges Protein vom C3H1-Typ =1733 AS liegt die Ziffer „1“ in der 1. Zeile [C3H1-Typ domänenhaltiges Protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]. Das Protein „DNA-gerichtete RNA-Polymerase-Untereinheit beta“=1449 AS legt sich direkt in diesen Pfad, weil die Gruppe „44“ enthalten ist und die Zahl 9 = QS3+3+3 ersetzt [DNA-gerichtete RNA-Polymerase-Untereinheit beta - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt ].
Rechts neben „24“=Timerstart liegt das Zinkfingerprotein=1689AS mit der Zahl „16“ und dreht sich darüber mit „89“ im Kreis [Zinc finger protein - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt]. Eine 90°-Drehung ergibt sich im Schalter 3“0“9_9“8“9, in dem die Ziffer „8“ in den Zinkplatzhalter „O“ springt, so dass aus „9“8“9“ im Tausch der Winkel=90° (9) erscheint:
Epi.Ref_Rhesus.Z.“7935“# 164394“1580283667“,
Epi.Ref_Rhesus.Z.79“36“# 164373“44“3093989“,
Epi.Ref_Rhesus.Z.“7937“# 1643527333“24“16“5.
Vorausblick: Die „Zeitdifferenz über die Dauer der Mitose“ muss einen erkennbaren Sinn ergeben: DELTA.TIME.Epi.Ref_Rhesus.Z.7936-Z.7969=#“70“1393“07“00018“. Das Mitose-Ergebnis besteht aus schönen Nullen und als Fazit „70_1393_07“= Form=7_0_QS1+3+9+3=16_0_7=Form und am rechten Rand Zähler=1_8. Die Ausgangsbasis „8“ Zentrosome wird am rechten Rand als ungültig herausgeschoben und durch „16“ Zentrosome vermehrt!
Das Oberflächenprotein „Gametocycte surface protein P230 =3135AS“ wird zur Interaktion mit den Erytrozyten des Wirts, der Fusion männlicher/weibliecher Gameten und zur Exflagellation benötigt [ PFS230 - Gametocyte surface protein P230 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Die Zahlenfolge ist verdreht als „3531“ vorhanden. Im Bauplan zeigt sich erst am Ende in Z.9131 ein Zahlenteil „313“ mit angelagerter Ziffer „5“ als 313_seitlich=9_1“5“1. Somit wird der Anschluss zum Zeilenlauf der Bakterien hergestellt. Das Protein ist im BiXnom-Kreis 64_6_Protein_4 geklammert, wobei außerdem die notwendige Zahlendrehung als Spiegelung seitlich 9_0_09 enthalten ist (2x „0“ für 2 Ziffern). Die Zeile verfügt mit Z.7+9+4+0=20=Calcium über eine Steuerungsfunktion: Epi.Ref_Rhesus.Z.7940#1“64“290“6“3531“4“093.
Zum Transmembran-Protein „Erythrozytenmembranprotein 1 (PfEMP1)=2858 Aminosäuren“ liegen erheblich abweichende Informationen vor. Beispielsweise ist auch nur die 3D-Struktur zwischen 2486 bis 2759AS von Interesse. Das Protein transportiert die Parasiten-Proteine auf die Oberfläche des Erythrozyten [Interaction Analysis of a Plasmodium falciparum PHISTa-like Protein and PfEMP1 Proteins - PMC (nih.gov); ;Q.Chen; Nov 2020; doi: 10.3389/fmicb.2020.611190]. Das Parasiten-Protein PfEMP1 ist mit dem Wirtsrezeptor CD36=472AS (Mensch) in Interaktion. Der Rezeptor zeigt sich mit seinen Ziffern an der Zählgröße=11: Epi.Ref_Rhesus.Z.7943#16“42“2858“42“11“746. Nach der Bereitstellung von Proteinen ist eine Zeit-und Gruppenfunktion für die DNA-Replikation geeignet Z.QS7+9+4+4=24=Zeit. Zur Steuerung ist Calcium=20E vorhanden: Epi.Ref_Rhesus.Z.79“44“#164“20“7910925“717“.
DNA-Replikation: Die Mikrogamonten (männliche Gametozyten) beginnen ihre Entwicklung zu Mikrogameten durch eine intrazelluläre Mobilisierung von Ca(2+), um „3 schnelle Runden“(?) einer Replikation von DNA (Endomitose) zu aktivieren. Die Endomitose vermehrt die Chromosonenzahl ohne Kernteilung. Die DNA wurde vor der Endomitose in einer S-Phase verdoppelt, deswegen resultiert jede Endomitose aus einer Endoreplikation [Endomitose – Wikipedia]. Die Synthese-Phase (S-Phase) liegt zwischen 2 Wachstumsphasen (G1; G1) [Interphase – Wikipedia]. Während der Mitose bildet sich ein Spindelapparat aus vielen Spindelfasern, die aus röhrenförmigen Mikrotubuli bestehen. Für diese Fasern als auch für die zu bildenden Flagellen außerhalb der Zelle wird das Protein „Tubulin (alpha+beta)“ benötigt. Die Fasern können zwischen Wachstum und Zerfall wechseln. Es bilden sich 2 Pole, von denen die Mikrotubuli entspringen und sternförmig zur Mitte ziehen. Es gibt 3 Organisationtypen von Mikrotubuli. Beim Parasiten zu erwarten: „Kinetochor-Mikrotubuli setzen an den Kinetochoren an – den Proteinstrukturen, die dem Zentromer eines Chromosoms aufsitzen – und reichen bis in die Nähe der Pole oder sind mit den polaren Mikrotubuli assoziiert“. Spindelapparat siehe „Spindelapparat – Wikipedia“. [Anmerkung: Es werden nur die Möglichkeiten festgestellt. Ein Zusammenhang mit der Mitose fehlt noch. Was könnten 3 Runden bedeuten? Verdopplungen: Basis=2 ; 1. Runde=4; 2. Runde=8, 3. Runde=16. Die Anzahl ist aufteilbar in 2 Gruppen von je 4x DNA-Replikation als Zifferndopplung (unmöglich: Spiegelung bei Doppelziffer) „xy_xy“ und 4x DNA-Replikationen als Ziffern-Spiegelung „xy_yx“]. Während dieser 3 Runden werden Axoneme zusammemgebaut, um 8 begeißelte Mikrogameten zu erzeugen. Die dynamische Architektur beruht auf zwei nicht-kanonischen Regulatoren (kanonisch sind 20 übliche Aminosäuren, 21. und 22. sind Selenocystein und Pyrrolysin) [siehe: Expansionsmikroskopie von Plasmodium-Gametozyten zeigt die molekulare Architektur eines zweigeteilten Mikrotubuli-Organisationszentrums, das die Mitose mit der Axochem-Assemblierung koordiniert - PMC (nih.gov); M. Brochet/ R.Rashpa; Jan. 2020; doi: 10.1371/journal.ppat.1010223]: 1.) Calcium-dependent protein kinase 4 (PfCDK4)=528AS [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt 2.) „Serin/Arginin-Protein-Kinase 1“ ist unbekannt: Es werden 2 Varianten verwendet: 2.1) Protein „Caseinkinase I (CK1)= 324 AS [CK1 - Caseinkinase I - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt].
2.2) Protein „Unspezifische Serin/Threonin-Proteinkinase= 699 AS“ [non-specific serine/threonine protein kinase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ] und Aufgrund der Symbolik gilt „CK1“: 3_24=Zeit“ für die DNA-Replikation und „non-specific“: 6_99=9 Tubulin-Paare im Mikrotubuli.
Im Unterschied zur Fliege, deren DNA im Zeilenlauf als Matrix erscheint, handelt es sich offenbar um ein rundes System mit einer Spindelachse. Die DNA-Vermehrung ist aufgrund der Entwicklung von 8 Mikrogameten notwendig. Es kann eine Matrix gebildet werden, die zunächst 90°-Winkel feststellt, um 3 Abschnitte für 3 Runden zu suchen. Zwischen 2 Zeilen mit einem 90°-Winkel kann ein Kreislauf im Zeilenlauf gebildet werden, der eine 180°-Wende als unmöglicher Weg in die Vergangenheit verhindert. Für die DNA-Replikation kann zwischen Dopplung und Spiegelung unterschieden werden. Weiterhin werden 8 Schwerachsen „84“ gezählt. Folglich wird die Evolution einen Erfolgspfad austüfteln und genetisch fixieren, der eine Protein-Symbolik 840AS enthält. Im Ergebnis ist erkennbar, dass es sich um 2 Stapel handelt, in denen jeweils 4 Ziffer-Dopplungen „xy_xy“ und 4 Ziffer-Spiegelungen „xy_yx“ vorliegen. Das ergibt 8 DNA-Doppelereignisse einer Replikation. Der Stapel beginnt mit der Serie #1_64=Kreis, woraus eine Spindelform entsteht.
Anfang 1. Stapel: Z.QS7+9+4+0=20=Calcium; Winkel „90°“: Epi.Ref_Rhesus.Z.7940#1“64“2“90“635314093. „Protein „Unspezifische Serin/Threonin-Proteinkinase= „699“ AS“; Dopplung „64_64“ / Spiegelung „69_96“: Epi.Ref_Rhesus.Z.7941#1“64“2“69“9“4“64“03“96“6. Protein PfEMP1=“2858“AS; Dopplung „42_42“ / Spiegelung „64-46“: Epi.Ref_Rhesus.Z.7943#1“6“42“2858“42“117“46“. Spiegelung „87-78“: Epi.Ref_Rhesus.Z.7945#1641“87“242843“78“8. Erste Dopplung „16¬_16“ / Die zweite Dopplung „99_99“ ist geeignet, um die gegensätzlichen Pole des Spindelapparates zu symbolisieren. Dabei bildet „99“ die Anzahl von 9 äußeren Paaren (99) [alpha+beto-Tubulin] eines Mikrotubuli. Hinter der Struktur-5 ohne „99“ zählt sich „7+6+3+4=20“ für 20 Tubulin-Einzelketten, weil im Zentrum das 10. Paar eines Mikrotubuli liegt. Die Pole „99“ klemmen „Physik=63“ für die Prozess-Dynamik ein. In der Folgezeile baut sich das Tubulin=450 AS auf. Vorhanden sind „45“ und die Ergänzungsnull „0“liegt in der Zählgröße 1_QS6+4=1“0“_1: Epi.Ref_Rhesus.Z.7946#“16“4“16“6“5“7“99“63“99“4 und Epi.Ref_Rhesus.Z.7947#“1“64“1“45“922284371. Spiegelung „64_46“: Epi.Ref_Rhesus.Z.7949#1“64“10“46“22517788.
Stapel-Mitte: Winkel 90° und 5. Schwerachse nur als 8_“0=Kreis_“4: Epi.Ref_Rhesus.Z.7950#1640839“804“26“90“5. Anfang 2. Stapel: Spiegelung „43_34“: Epi.Ref_Rhesus.Z.7949#1640633“43“528“34“8.
Spiegelung „02_20“; Ungültig „30_Innen-Null_03“: Epi.Ref_Rhesus.Z.7953#164“02“20“85300377. Spiegelung „64_46“
Ungültig „40_Innen-Null_04“: Epi.Ref_Rhesus.Z.7954#1“64“001“46“3967048. Dopplung „23_23“: Epi.Ref_Rhesus.Z.7956#1“63“960“23“6“8519“23“. Dopplung „63_63“: Epi.Ref_Rhesus.Z.7957#1“63“939“63“1066218. Dopplung „91_91“; Winkel 90° stört, ist aber symmetrisch gebunden als „9_„0+3+0“_QS4+5=9“: Epi.Ref_Rhesus.Z.7958#163“91“903045“91“48. Dopplung 77_77: Epi.Ref_Rhesus.Z.7960#1638“77“844“77“3103. Ende 2. Stapel: Winkel „90°“: Spiegelung „72_27“: Epi.Ref_Rhesus.Z.7961#16385“72“596“90“2“27“.
Für jeden der beiden Stapel wird mit der Zeilen-Nr. die Zeit=24 aktiviert, die im Code auf Sekundenbasis=60 eingestellt wird: Z.QS7+9+4+4=24=Zeit. Die Quersumme ergibt „61“ statt 60, zu der mit der Klammer 7“1“7 als Aufgabe 1 Aktion nicht mitzählt. QS=1+6+4+2+0+7+“9+[1]+0“+9+2+5+7+1+7=61 bzw. [60]. Wird die Ziffer „1“ gestrichen, wird der Rundenmodus als Winkel „90°“ aktiviert: Epi.Ref_Rhesus.Z.7964#164207“9“1“0“9257“1“7. Für den 2. Stapel liegt entgegengesetzt ein Defizit mit QS1+6+4+0+0+1+4+6+3+9+6+7+0+4+8=59 zur Basiszeit=60 vor, so dass zum Ausgleich eine Bewegung ausgelöst wird. Es können in beiden Stapeln unsortierte Zeiten abgelesen werden. Um das Ergebnis in der richtigen zeitlichen Reihenfolge zu sortieren, sind statt 3 Runden 3 Zeilenverschiebungen notwendig. Beachte: Zeilennummer in falscher Reihenfolge!
Start: Dauer „15“ Sekunden (linke Nullen zählen nicht): Aktion: „Innerhalb von 15 Sekunden formt sich das Mikrotubuli-Organisationszentrum (MTOC) in 8 Kinetosome um, die in 2 orthogonale Tetraden gestapelt sind“. „Tetrade“= in der Prophase der Meiose auftretenden Vierergruppen zusammenliegender Chromtiden, die von den Paaren sich zusammenlagernder, homologer Chromosomen gebildet werden [Tetrade - Kompaktlexikon der Biologie (spektrum.de)] : Epi.Ref_Rhesus.Z.7952#164042711820“15“8.
Erste Verschiebungsrunde: Dauer 2 min=“120“ Sekunden als „12_[QS5+2+6+9+8=30=Zink]_0“; Zink für Zinkfinger-Protein. Aktion: „Nach 2 Minuten ist die 1. Mitotische Spindel sichtbar. 4 Basalkörper mit keimbildenden Axonemen befinden sich im Tetrad an den beiden gegenüberliegenden intranukleären Körpern. Alternativ: Unmittelbar nach Bildung der Kinetosome formt sich die erste Mitosespindel aus einer einzigen Spindelplaque, teilt sich und die Spindelpole rotieren in der Kernhülle und wandern auseinander. Nach „2“ Minuten stehen sich die Pole gegenüber [siehe: Lebenszyklus der Malariaerreger (gigers.com)].“ Ok, weil „seitlich=99_99=Pole als Mikrotubuli“! : Epi.Ref_Rhesus.Z.7948#164“12“52698“0“2956.
Zweite Verschiebungsrunde: Dauer 5 min (bis 6)=“300" Sek.: Aktion: „Nach „5“ (bis 6) Minuten teilt sich jeder der separierten Spindeln innerhalb des Zellkerns noch einmal. Das hat zur Folge, dass „6“ min den Basiswert für die nächste Runde bilden: Epi.Ref_Rhesus.Z.7953#164022085“300“377.
Dritte Verschiebungsrunde: Dauer (5) bis „6“ min plus „8“min =14 min=14*60=“840“ Sekunden: Aktion: „Nach 8 Minuten, zuzüglich 6 min Basiszeit=14 min, teilen sich die vier resultierenden Spindelpole durch eine Mitose. 14 min. sind nicht bestätigt [Die alternative Zählung von nur 8 min=480 sek. ist weniger geeignet!]. In jeder der dazwischenliegenden Perioden repliziert sich das gesamte Genom ohne dabei je zu sichtbaren Chromosomen zu kondensieren (vgl. www. Gigers.com).“ „Axoneme erreichen in nur 10 min eine Länge von etwa 14µm[*) ggf.falsch als 14 min übersetzt) und liegen gewunden um den Kern. Sie zeigen eine klassische Organisation mit „neun Dubletten von Mikrotubuli (99)“, die in einem kreisförmigen Muster angeordnet sind, das ein zentrales Paar von Singulett-Mikrotubuli (Summe=20 Ketten) umgibt.“[siehe: Expansionsmikroskopie von Plasmodium-Gametozyten zeigt die molekulare Architektur eines zweigeteilten Mikrotubuli-Organisationszentrums, das die Mitose mit der Axochem-Assemblierung koordiniert - PMC (nih.gov); M. Brochet/ R.Rashpa; Jan. 2020; doi: 10.1371/journal.ppat.1010223]: Epi.Ref_Rhesus.Z.7942#164249262703“840“.
Drei Runden sind als Kreislauf aufgrund der „Winkel-90°-Zeilen“ zulässig und zur korrekten zeitlichen Reihenfolge notwendig!
Dauer der Mitose: Es wurde eine mathematische Matrix aufgestellt, in der 16 Schwester-Zentrosime entstehen. Zur Vorbereitung dieser Mitose wurden Schwester-Zentrosome vermehrt, um nach 8min 4 Paare von Schwester-Zentrosomen für 4 Pole zu gewinnen. Bei der Mitose muss diese Anzahl noch verdoppelt werden. Das ergibt dann 8 Paare von Schwester-Zentrosome aus denen dann in irgendeiner Weise 8 Axoneme entstehen müssen. Wie lange die Dauer der Mitose nach den 8 min dauert wurde nicht erwähnt. Beim Menschen beträgt die „Mitose-Dauer= 1 Stunde=3600 Sek.“, die sich hier auch beim Plasmodium zeigt. Zuvor wurde hier bereits festgestellt, dass der Timer von Zeile Z.7935-Z.7897 für 1 Stunde neu gestartet wurde. Die Zeitzählung mit Z.Nr Z.QS=24=Zeit mit Ziffer „1“ für 1 Stunde ist zu trivial, um als Zeit auslesbar zu sein. In den Zeilen müssen „3600“ Sekunden lesbar sein. Weil darin dann auch die Zeitbasis=60 mit verbraucht ist, muss die Zeitbasis in Vorzeilen entstehen. Es werden dann aber Proteine benötigt, um hier 3 Zeilen zu binden, weil die Zeitbasis als 30+30=60 über 2 Zeilen entsteht. Nachfolgend werden die 3600 Sekunden bestätigt. Das „Merozoiten-Oberflächenprotein P113“=969AS bindet am Protein „RH5“ den N-Terminus von Plasmodium falciparum. Das Protein ist ein Membranrezeptor, der das Protein „RH5“ [während der Merozoiteninvasion von Wirtserythozyten an die Merozoitenmembran] absondert [P113 - Surface protein P113 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ]. Das Protein P113=969 Aminosäuren legt sich in die Zeilennummer Z.7“969“. Um die 3 Zeit-Zeilen zu verbinden, legt sich das Protein in eine Spalte „562“, was mit einer Zahlenspiegelung aus 526 Aminosäuren möglich ist (im Bauplan noch nicht aktiviert). Protein „Retikulozyten-bindendes Proteinhomolog 5“=526 AS [RH5 - Retikulozyten-bindendes Proteinhomolog 5 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Bei der Gametogenese ist keine Protein-Funktion bekannt. Retikulozyten sind die Vorstufe der roten Blutkörperchen. Weil deren Wanderung vom Knochenmark zur endgültigen Reifung in das Blut „1 Tag=24 Stunden“ dauert, ist auch die Z.-Nr. Z.QS7+9+7+1=24 funktionell besetzt. Daraus erklärt sich die Zahl „26“=Blut in 526AS. Als drittes Protein wird das Zinkfingerprotein „C3H1-Typ domänenhaltiges Protein“=1733 AS benötigt, um die Addition 30+30=60=Zeitbasis mit Zink=30 darzustellen. Die Vorzeile der beiden Zinkzeilen liefert im rechten Teil die Ziffernfolge „0_1_QS 3“+6+6+5=20“=Calcium=Summe 21 enthält den Überschuss „1 Aktion“. Die Ziffernfolge „0136“ spiegelt sich in einer Zinkzeile 61“30“=Zink. Das 4. Protein „Calcium-abhängige Proteinkinase 2 (CDPK2)=513AS“[ CDPK2 - Calcium-dependent protein kinase 2 - Plasmodium falciparum (isolate K1 / Thailand) | UniProtKB | UniProt ] klammert mit der Spiegelung „5 [66]31“ die Zinkspalte und transportiert den Überschuss „1“ in der Spalte nach unten. Beim herunterfahren zählt sich in der Spalte die Zahl „33“ für das Protein C3H1=1733 AS zusammen. Das Protein verbraucht zur Addition von QS6+1=7 die Ziffer 1 (als Energie), so dass CDPK2 den Nachschub liefert oder die Spiegelung „16_61“ zum linken Zahlenrand auslöst, um die Ziffer „1“ zu beschaffen. Im Ergebnis liegt die Zeitbasis=60 vor. Und wo sind jetzt die 3600 Sekunden? CDPK2 enthält „3[6“, um auf die Serie „36“ über 3 Zeilen hinzuweisen, von denen die beiden Zinkzeilen=30 eine „0“(Null) beisteuern und zugleich als Addition die Zeitbasis=60 bilden. Die „Zeitdifferenz über die Dauer der Mitose“ muss einen erkennbaren Sinn ergeben: DELTA.TIME.Epi.Ref_Rhesus.Z.7936-Z.7969=#“70“1393“07“00018“. Das Mitose-Ergebnis besteht aus schönen Nullen und als Fazit „70_1393_07“= Form=7_0_QS1+3+9+3=16_0_7=Form und am rechten Rand Zähler=1_8. Die Ausgangsbasis „8“ Zentrosome wird am rechten Rand als ungültig herausgeschoben und durch „16“ Zentrosome vermehrt!
Info: „Die acht Kinetosomen des Zellplasmas agieren als Zentrum für den Aufbau der 22 µm langen Axonem: Die Kinetosomen bleiben durch die Kernporen eng mit der mitotischen Spindelplaque verbunden und werden während der zweiten und dritten Kernteilung von einem vesikulo-tubulären Netzwerk eingeschlossen, das mit der Plasmamembran verbunden ist.
Im Moment der Exflagellation wird das Flagellum aktiviert und in 15 Sekunden aus dem Zellplasma gedrängt. Die noch immer existierende Verbindung der Kinetosomen zur Spindel zieht das haploide Genom in das Flagellum. Erst in diesem Stadium kondensiert das Genom. Folge dieses raschen Ablaufs sind bis zu 60% von der Norm abweichende oder kernlose Mikrogameten.
Der Mikrogamet (männlich) weist im Gegensatz zum Makrogamet (weiblich) keine Mitochondrien oder andere Plastidenstrukturen auf. Er bewegt sich mit alternierenden schnellen und langsamen Wellenbewegungen vorwärts. [Sherman, 1998, S. 36-37]“; [siehe: 6.1.1.1. Gametogenesis: Lebenszyklus der Malariaerreger (gigers.com)].
Vorabinfo: Die Axoneme bilden nach der DNA-Replikation einen eigenen Abschnitt. Weil der Faktor 1000 von „nm“ auf „µm“ selten ist, wird nur der Durchmesser=1400_0=14µm direkt angezeigt. In diese rechtsseitige Null-Abspreizung wird die Länge=2[X]2 eingeklemmt, damit analog 22µm gelten. Mit X=“Struktur=55_6“ folgt ein Rest „2+0+1+8=11=Zählgröße“, so dass diese Geometrie für 8 Axoneme ausgeführt wird. Das „Einklemmen" spiegelt symbolisch eine Code-„Länge“ wieder: Epi.Ref_Rhesus.Z.7996#163“1400“25562“0“18.
Das Protein „Calcium-dependent protein kinase 4 (PfCDK4)=528AS liegt bereits zur Unterstützung der DNA-Replikation in Z.7951 vor. Das Protein ist für den Zellzyklus der männlichen Gameten generell erforderlich, so dass eine spezielle Phase zu erkennen ist. Am Ende wird das Protein zur Axonemmotilität und Zytokinese. Es leitet die Exflagellation ein [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ].
PfMAP-2 ist essentiell für die männliche Gametogenese im Malariaparasiten Plasmodium falciparum. Es wird im Spätstadium IV/V exprimiert, aber erst sehr spät bei der Gametogenese benötigt. Erst nach den 3 Genom-Replikationsrunden wird PfMAP-2 benötigt, um das Axonemschlagen einzuleiten [siehe: PfMAP-2 is essential for male gametogenesis in the malaria parasite Plasmodium falciparum - PMC (nih.gov); T.Voss u.a. (Jul 2020); doi: 10.1038/s41598-020-68717-5 ]. Das Die Struktur von PfMAP-2 liegt nicht vor. Das Protein PfMap ist als MAP2_PYRFU=295 Aminonsäuren dokumentiert [siehe: Kristallstruktur der Methionin-Aminopeptidase aus hyperthermophilen, Pyrococcus furiosus. | Literaturzitate | UniProt].
Gamma-Tubulin ist kein Bestandteil der Mikrotubuli. Es ist in diesem Bereich aber vorhanden, weil es „alpha- und beta-Tubulin“ für die Mikrotubuli polymerisiert. Es entsteht ein „Gamma-Tubulin-Ring-Complex“ (gammaTuRC) als Erkennungsmerkmal. Gamma-Tubulin ist an der Keimung neuer Mikrotubuli am Zentrosom und den Basalkörpern beteiligt [Tubuline – Wikipedia]. Es hat ebenfalls eine Länge von 450AS, so dass es an der Kettenlänge nicht erkannt werden kann. Die zum Start der Exflagellation benötigte Xanthurensäure=106E wird erst etwas später benötigt. Aus der Ziffernfolge entsteht der Ring-Komplex „gammaTuRC“ als Zählgröße „1_O=Kreis_64_QS1+4=5=Struktur_Kreis=64_1“. Die folgende Zeilen-Nr. Zxxx4 und Z.xxx5 baut vertikal das Gamma-Tubulin=45(0)AS auf: Epi.Ref_Rhesus.Z.7973#1636“1“0“641464“1“79.
Eine interessante Darstellung für eine Polymerisation ist die Zahlenfolge 0-1-2-3-„4-5-0“, wobei darin Alpha-Tubulin=450AS und Beta-Tubulin mit 45(0 fehlt) angehängt ist: Epi.Ref_Rhesus.Z.797“4“#16359“0123450“45“1. Im Bereich der Axoneme liegt auch das Calcium-bindende Protein „Centrin“ vor. Von den Varianten „Centrin, Centrin 1 bis 4“ ist Centrin 1 =168 AS geeignet [Centrin-1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Centrine sind zur Duplikation von Zentriolen erforderlich. Centrine können Mikrotubuli durchtrennen, indem sie eine Calcium-vermittelte Kontraktion verursachen. Das Centrin-1 (analaog auch Centrin-2) liegt in einer Zeile mit dem Protein „Dihydroorotat-Dehydrogenase (Chinon), mitochondrial“=569 AS, das eine katalytische Aktivität entfaltet. Aufgrund 569 AS= QS5+6+9=20=Calcium ist die Zusammenwirken mit Centrin-1 erkennbar. Von Centrin-1 liegt der Zahlenteil #16 als Serie vor und wird im inaktiven Bauplan durch QS3+5=8 zu 168 AS. Die Aufspaltung als Quersumme ist erforderlich, weil der Katalysator=569AS auf die Ziffer „5“ als Gemeinsamkeit zugreift.
Das Gamma-Tubulin schließt nun die Polymerisation, indem die fehlende Null angelagert wird, als Spiegelung zur Z.xx7“5“#QS2+3=5_“0“_7: Epi.Ref_Rhesus.Z.797“5“#“16“3“5“69“61058“23“0“7“.
Intermediärfilament der Kinetosome: Bevor nachfolgend für den Basalkörper mit der Erzeugung von NHS-Ester und den entstehenden Kinetosomen über 3 Zeilen begonnen wird, müssen zunächst die Intermediärfilamente bereitgestellt werden, die 9 Tubulin-Tripletts mit insgesamt 27 Mikrotubuli (MT)als Zylinder zusammenfügen können. Es sind zwar MT-Tripletts, aber zugleich sind es 3 Ringe (innen, mittig, außen). Die 3-MT-Tripletts sind nicht radial zur Mitte ausgerichtet, sondern sind geneigt. Um die Tripletts zu koppeln, ist in Abständen ein Verbindungsfaden notwendig. Linksdrehend betrachtet, verbindet der Faden den Mikrotubulus im Innenring mit dem äußeren Mikrotubulus des folgenden Tripletts. Das Zentrosom enthält einen ähnlichen Zylinder [siehe: Biogenese der Zentriole | CENTRIOLE_LENGTH Project | Results in brief | FP7 | CORDIS | European Commission (europa.eu)]. Zur Bindung von Tubulin ist beim Menschen das Protein CEP104=925 AS wirksam [CEP104 - Zentrosomales Protein von 104 kDa - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein verschlüsselt seine Funktion „seitliche Bindung=9_25=Durchmesser Mikrotubus (MT) in nm“. Beim Parasiten wird mit der Trennung „9_[10]_25“ o.ä. der Durchmesser des Verbindungsfadens von 10nm markiert. Es handelt sich um das Intermediärfilament, dessen Durchmesser zwischen Mikrotubulus (MT) und Aktin-Mikrofilament (6 nm) liegt. Das Intermediärfilament beginnt vor den 3 Ringzeilen. Die Quersummer QS=60 fordert den optimalen Triplett-Neigungswinkel 60° (real unbekannt). Die Teilsummen QS=1+6+3+5+4+9+1=29 und QS =2+8+5+7+8+1+0=31 schließen Zink=30 ein, so dass ein Zinkfinger-Protein mit 1 Aktion mitwirken könnte - CEP104 besitzt keine Zinkdomäne. Der Parasit produziert 170 Zinkfingerproteine, davon 4 Ring-Finger Proteine [Zinc finger proteins of Plasmodium falciparum - Ngwa - 2021 - Cellular Microbiology - Wiley Online Library ]. Diese Unvollkommenheit ist zum Verständnis hilfreich, denn im gleichseitigen Dreieck, ist über der Grundline nur die linke Seite QS2+9=11=Zählgröße mit 3 MT besetzt. Konstruktiv wird die Grundlinie durch den Mittelpunkt des unteren MT auf der linken 60°-Dreiecksseite gezogen. Vom Mittelpunkt der Grundlinie des gleichseitigen Dreiecks wird der Zylindermittelpunkt im Radius 57nm abgetragen. Das Triplett wird dann als polare 9er-Reihe aus 3 Elementen erzeugt. Der Radius ist markiert als „8_“57“_8“ (Basiszahl QS=60 abzüglich 1 Aktion je Zeile =57nm). Aber warum ist das ein Kreis? Der Bixnom-Kreis „64“ als „6_QS3+5=8_4“ enthält die Markierungszahl „8“=Extra. CEP104 koppelt „9_10_2[8]5“ als EXTRA=8 an die Form=7_[8] erneut als Durchmesser „10“ bzw. ist „1_0“ der Filament-Faden. Die Steuergröße „78“ = EXTRA-Form wird verwendet, um in der 3. Ringzeile als Zahlendreher anzukoppeln. Die Zahl 87_0 liegt dann am Zahlenrand. Eine Zeilenverbindung wird erzeugt, indem das Protein CEP104=925AS in Zeile Z.797“9“ die Rand-Ziffer „9“ adressiert und den Durchmesser=10nm ebenfalls mit dem Zahlendreher „52“ statt „25“ ankoppelt, so dass dann mit der Kopplung 6_6 die gedrehte Steuergröße „87“ sichtbar ist als „6“10“52“6“87“0“. Mit dem Radius=57nm müssen viele Randbedingungen erfüllt werden. Die 9 Tripletts können gerade noch untergebacht werden, wenn der Durchmesser von 170nm für die Austauschbarkeit mit einer Zentriole (2 im Zentrosom) als Bedingung gewählt wird. Konstruktionsgrundlage ist ein gleichseitiges Dreieck mit Seitenlänge=Mikrotubuli (MT)-Durchmesser=i.M. 25nm. Die 3 MT müssen verschmelzen, so dass der innere MT (A-Tubulus) vollwertig erscheint. Hierfür werden die beiden Eckkreise nicht mit ihrem Mittelpunkt angesetzt, sondern zur Begrenzung der Dreiecksseite einwärts verschoben. Das Triplett steht dadurch steiler. Der Radius wird im Dreiecksschwerpunkt angesetzt: Epi.Ref_Rhesus.Z.7976#“1“6“35“4“9“10“2“8“57“8“10“
Basalkörper und 1.Ring-Zeile: Außer den Tubulinen für die Kinetosomen sind NHS-Ester für den Basalköper vorhanden. NHS-Ester wird aus N-Hydroxysuccinimid =C4H5NO3=6*4+5+7+8*3=24+12+24=60E hergestellt. Es ist eine Aktivierungsreagenz notwendig, die als 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC, EDCI oder EDAC)=C8H17N3=6*8+17+7*3=48+17+21=86E erkennbar ist [1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid – Wikipedia ]. Somit liegt kombiniert „86/60“ als NHS-Ester=„860“ vor. Das Protein „Calcium-abhängige Proteinkinase (CDPK4)=528 AS“ ist u.a. zur Zellzyklusprogression die männlichen Gametozyten notwendig [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. In der Lesart „5_“O“_28“ AS wird daraus für die Kinetosomen eine Ringform „O“ aufgebaut, weil sich Zahl „64=Ring“ erst über 3 Zeilen entwickelt. Der Basalkörper wird folglich mangels Struktur mit seinen Chemikalien adressiert. Gleichzeitig bildet der Basalkörper das „Kinetosom“ aus dem das „Axonem (Achsenfaden)“ [9 MT-Paare +1 Zentralpaar=Summe 20MT] als Gerüst für das „Flagellum“ hervorgeht. Vor der „Exflagellation“ ist alles 8-fach mit der Zahl 8 am Zahlenrand vorhanden. Mit Z.QS7+9+7+7=30=Zink könnte ein Zinkfingerprotein vermutet werden, aber es werden damit 3 „Zeilennummern“ aktiviert, die als Serie „Form=7_“9“_7=Form_x“ mit der Null im Zink =3“O“, die 3 gekoppelten Ringe (außen/mittig/innen) im Triplett aus „9“ Mikrotubuli über 3 Zeilen produzieren. Die Anzahl von „27“ Mikrotubuli ist enthalten. Der gesamte Zeilenlauf in der Serie #163 wird vom Protein „Crystal structure of the catalytic domain of Plasmodium falciparum ARF GTPase activating protein“=163 Aminosäuren repräsentiert. Darin ist auch eine Zinkfinger-Domäne enthalten [PDB 3sub structure summary ‹ Protein Data Bank in Europe (PDBe) ‹ EMBL-EBI]: Epi.Ref_Rhesus.Z.“7977“#“163“5“2“860“02“7“5“0“28“.
Der Mittelring ist als Nullspalte am Innenring angeschlossen und zeigt selbst einen Ring „202_5=Struktur“ jeweils aus 9 im Triplett gekoppelten Mikrotubuli. Auch dieser Ring-Null kommt eine Bedeutung zu, indem damit der Durchmesser des Basalkörpers=0,25µm=250nm adressiert wird. Lesbar sind zunächst nur 25nm, die mit dem Faktor 10 auf 250nm aufgebohrt werden. Das wird realisiert, indem der Faktor „10“ für alle 8 Basalkörper als QS=15_„8_10“_QS=15_“25“ markiert wird, wobei die 2 störenden Nullen gebunden werden. Die Quersumme der Zeile QS1+6+3+5+0+8+1+0+2+8+3+2+0+2+5=46 bildet die Gegenform als Kopplung an den Außenkreis mit QS=64. 2. Ring-Zeile Kinetosom: Epi.Ref_Rhesus.Z.“7“9“7“8#“163“50“8“10“283“20“25“ 3. Ring-Zeile Kinetosom: Epi.Ref_Rhesus.Z.“7“9“7“9#“163“487610526870. Der Enstehungsbereich des Basalkörpers und des Kinetosoms kann äußerlich von der Zellmembran abgedeckt werden, weil sich auf der Oberfläche erst noch Ausstülpungen zur Entwicklung der Axoneme als Zellgerüst für die Geißeln entwickeln müssen. Es ist im Anschluss auch kein Membranloch „303“ erkennbar, aus dem sich eine Geißel herausschieben könnte: Epi.Ref_Rhesus.Z.“7980#163467123357631. Es liegt momentan keine Information zum Aufbau des Flagellums beim Malariaparasiten „Plasmodium falciparum“ o.ä. vor. Wahrscheinlich spannt sich die Geißel über die Oberfläche zum anderen Ende, um dort als bewegliche Geißel auszutreten. Diese Art „Rückgrat“ ist unsichtbar, weil die Geißel durch eine gewellte Membran (Undulating membrane) überdeckt wird. Die Lageverschiebung des Austrittspunktes kann im Zeilenlauf durch eine Zwischenaktion verursacht sein, bei der sich der Parasit zunächst erst noch als 8er Gruppe aus dem roten Blutkörperchen befreit.
Austritt aus dem Wirt: Der Parasit tritt aus dem rote Blutkörperchen (Erythrozyt) aus und startet die Axonem-Biosynthese. Es werden Axoneme aufgebaut, um acht begeißelte bewegliche Mikrogameten zu erzeugen. Die Mikrogameten entwickeln weniger osmiophile Körperchen als Makrogameten, so dass weniger Zellgifte zum vollständigen Abbau von Membranen vorhanden sind. Der Austritt aus der Erythrozytenmembran (RBCM) erfolgt mit zuckenden Bewegungen. Vor dem Austritt aus der parasitophoren Vakuolenmembran (PVM) und der Erythrozyten-Membran (RBCM) werden die osmiophilen Körperchen nicht als „Blasen=O“ symbolisiert, sondern direkt mit dem Inhaltsstoff Protein „Osmiophilic body protein (PfG377)=3119AS“ [ Osmiophilic body protein G377 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt.]. Die Körperchen der Geschlechter (m/w) unterscheiden sich morphologisch, besitzen aber die für den Austritt notwendigen Proteine (PbGEST und PbMDV-1/PEG3). Das signalpeptidhaltige Protein „Egress and sporozoite traversal (GEST) (PbGEST)=249AS“ wurde bei der Nagetier-Malaria durch P. berghei ermittelt, wobei zwischen 149-167AS eine hydrophobe Sequenz liegt. Das Proteine ist bei den Übergängen Säugetier/Mücke und umgekehrt von Bedeutung, u.a. beim Austitt der männlichen und weiblichen Geschlechtszellen aus den roten Blutkörperchen [https://onlinelibrary.wiley.com/doi/pdfdirect/10.1111/j.1365-2958.2011.07823.x] Das Protein enthält selbst bereits die Zählgröße „11“ für eine Vielzahl von Körperchen. Das Protein darf im Bauplan noch nicht wirksam werden, so dass sich das Protein über 3 Zeilen zerlegt: Z.QS7+9+8+0=24=Zeit und 1. Protein-Anteil „31“: Epi.Ref_Rhesus.Z.7980#16346712“33“576“31“. Die Vielzahl als Gruppe 44 von Kugeln=64 mit Membranhülle „3_22_3“: Epi.Ref_Rhesus.Z.7981#163“44“6“64“1“3223“78. Osmiophil wird symbolisiert als Wasser (H2O) am Rand „1_ (seitlich=9)_1_8_Körperchen=O“.
Darin ist der 2. Protein-Anteil enthalten mit „19“: Epi.Ref_Rhesus.Z.7982#16342616“44“19“18“0“. Körperchen als Struktur „05“ und Vielzahl 11_O: Epi.Ref_Rhesus.Z.7983#1634“05“692646“11“0“. Für den Wirtsaustritt sind 5 Membran-Zeilen als Serie 33 vorhanden. Zuerst wird mit den Membranen „33“ durch Vereinigungen 64_Gruppe=44_64 der Körperchen ein größeres Volumen „600“ erzeugt: Epi.Ref_Rhesus.Z.7984#16“33“8522“600“1239 und Epi.Ref_Rhesus.Z.7985#16“33“64“76“44“82“64“2. Die Wirkstoffe „88“ der osmiophilen Körperchen werden als Gruppe 44 massenhaft in das Volumen „080“ der parasitophoren Vakuole geschüttet, um die Parasiten-Vakuolen-Membran „33“ zu zersetzen „33_44_3_080_88“: Epi.Ref_Rhesus.Z.7986#6“33“44“3“08088“392. Die Parasiten-Membran wird über 2 Zeilen mit dem Wirkstoff Z.xx“88“ durchlöchert von „33“ zu „33_Loch=0_3“: Epi.Ref_Rhesus.Z.7987#16“33“2“3“8“56“8165“64“. Für diese Aufgabe ist speziell das Protein „Perforin-like protein 2“=1073 AS“ zuständig [Perforin-like protein 2 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Im Bauplan wird Perforin in 3 Teile zerlegt 10_QS5+2=7_3 als 1073AS: Epi.Ref_Rhesus.Z.79“88“# 16“3303“4“10“66“52“3“5.
Der Austritt aus der Erythrozyten-Membran 33 als flexibel=6“3“_6“3“ wird von der Ziffer 9=seitlich als „9_6_9“ im Bauplan blockiert. Das Protein „Egress and sporozoite traversal (GEST)“ (PbGEST)=249AS“ wird später durch die Anlagerung der Ziffer 9 an 24 als PbGEST=249 AS aktiviert. Die hydophile Sequenz ist als H2O=“28“ enthalten. Die Sequenz endet in der Kette als „16_QS2+3 _[EXTRA=8]_2=7“ bei „167“ Aminosäuren. Zur Koordinierung im Mikrotubuli-Organisationszentrum (MTOC) ist das Protein „Caseinkinase I (CK1)= „324“ AS enthalten: Epi.Ref_Rhesus.Z.7989#163282“969“6“3“24“82. Mit Z.Form=7_99=seitlich_O tritt der Parasit aus der Erythrozyten-Membran „33“ aus und frei in das Blut=26 der Blutmalzeit im Mückendarm ein: Epi.Ref_Rhesus.Z.7990#163“26“25“33“716382. Der Mikrogamet kann sich nur durch unterstützende Bewegungen aus der Hülle befreien. „Z.QS7+9+9+1=26=Blut“ plus „QS1+6+2+4+2+1+0+2+9+1+5+0+1+6=40“ ergibt Summe=66=flexibel. QS2+9+1+5+0+1+6=24=Zeit: Epi.Ref_Rhesus.Z.“7991“#1“63“24“210“2915016
Wenn nachfolgend die Zahl 48 erscheint, wird sie bis zur Ankunft im Darm 808 gedreht als Schwerachse „84“ der Ruhe als „8084“. Das Protein „Ferlin-like Protein (FLP)=“1280“ AS (aus Skizze entnommen) unterstützt den freien Austritt der Gameten aus der Erythrocyten-Membran (RCBM) in den Mitteldarm [US20120308598A1 - Malaria vaccines based on apicomplexan ferlins, ferlin-like proteins and other c2-domain containing proteins - Google Patents]. Als Stressprotein ist es weit gespannt, darf aber nicht fehlen als „12_[56_64_48]_80“: Epi.Ref_Rhesus.Z.“7993“#16320“12“56648“80“5 und Epi.Ref_Rhesus.Z.7994#1631“8084“11“80122.
Aufbau von 8 Axonemen: Es werden 8 Zeilen mit der Schwerachse „84“ gezählt. Durch den Dezimalsprung auf Z.8000 bauen sich regelmäßig Steuerungen über die Z.QS 11, 19, 20, 24, 26 auf.
Der Bereich wird dann dem Protein Tubulin zum Aufbau von Mikrotubuli sondiert. Als Dimer paarig=2 (alpha- und beta-Tubulin): Tubulin 450AS gespiegelt wie Z.79_97 als „5_40“, Paarig=2: Epi.Ref_Rhesus.Z.“7997“#1631196“2“5408765.
1. Axonem „84“ : Die Exflagellation, bei der 8 Flagellen aus dem Zellplasma gedrängt werden, bewirkt, dass das haploide Genom jeweils in das Flagellum mitgezogen wird, weil die Flagellen aus der Zelle gedrängt werden. Dieser Prozess nur 15 Sekunden, zieht sich aber über einen weiten Zeilenlauf. Die 8 Flagellen hängen schließlich nur noch an einem Restkörper zusammen. Die Kinetosomen sind durch Kernporen eng mit der mitotischen Spindelplaque verbunden. Während der Kernteilung sind sie von einem vesikulo-tubulären Netzwerk eingeschlossen, das mit der Plasmamembran verbunden ist. Zunächst wird das vesikulo-tubuläre Netzwerk adressiert als „Kernpore=07_88_Netzwerk=“40404“_2_88: Epi.Ref_Rhesus.Z.7999#163“07“88“40404“2“88“. Um das Genom herausziehen zu können, wird zunächst der Kern in als Gruppe für 8 Flagellen dargestellt „5_8_4_555_4“. Zink=30 verweist auf die Steuerung durch ein Zinkfinger-Protein. Beispielsweise kommt eine Länge von 840 AS in Betracht. Mit dem Zinkfinger-Protein „454“AS wird der Kern direkt adressiert als „45_“Struktur=55“_4 AS“ [ Zinkfingerprotein - Plasmodium falciparum MaliPS096_E11 | Publikationen | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“8“000#16“30“5845554“9237. Die Kernpore kann sich über die Z-Nr.Z.xOxx später als Serie mitziehen. Zunächst ist die Kernpore mit einem Membranbezug „303“ vorhanden:
Epi.Ref_Rhesus.Z.“8“001#16“303“8075789763.
2. Axonem „84“: Tubulin 450AS gespiegelt wie 45_54 als „0_45“: Epi.Ref_Rhesus.Z.8000#16305“84“55549237.
Zur Vorbereitung der Exflagellation wird ein Prozess benötigt bei dem das Flagellum aus dem Zellplasma gedrängt wird. Möglicherweise stülpt sich die Zellmembran über das Flagellum, so dass die 8 Flagellen am ende nur noch an einem Restkörper hängen. Die 8 Kinetosomen des Zellplasmas sind eng mit der mitotischen Spindelplaque verbunden und werden während der zweiten und dritten Kernteilung von einem vesikulo-tubulären Netzwerk eingeschlossen, das mit der Plasmamembran verbunden ist. Das vesikulo-tubulären Netzwerk wurde zuvor als „40404“ aufgebaut und wird als Verbindung zum Zellkern erneut als Netzwerk „444“ erwähnt: Aus der Zeitdifferenz ergibt sich, das eine Gruppe aus 8 Flagellen am rechten Zahlenrand herausgeschoben werden soll:
DELTA.TIME.Epi.Ref_Rhesus.Z.7999-Z.8005=#1“222“3“2“73“4“8“44“: Im Zeilenlauf kann ein Kreislauf zum internen Materialtransport angelegt sein. Zuvor war Zink=30 auch als Winkel=30° mit der Zählgröße 11 vorhanden. Es folgte dann eine 90°-Zeile. Jetzt sind 60° als Ergänzungswinkel zu 90° vorhanden, um einen Kreislauf zum Auf- und Abbau von Proteinen zu starten. Dieser wird dann lediglich nur noch mit einer Zahl wiederholt erkennbar, eventuell wird hier die Zahl „76“ definiert (vgl. Fliege) Epi.Ref_Rhesus.Z.8005#162956“60“76“69“444“. Wesentlich verändert sich eine Membran, wenn sie von einer stabilen Struktur „5_33_5“ nachfolgend durch eine Zählgröße 11 als „1_33_1“ zerlegt: Epi.Ref_Rhesus.Z.8006#1629362“5335“9218 und Epi.Ref_Rhesus.Z.8006#162915904“1331“20. Die Exflagelation hat noch nicht begonnen, aber der Zellkern „555“ wird mit „seitlich=9_Anzahl 8 Genome_9“ bereits separiert. Zeit=24: Epi.Ref_Rhesus.Z.8008#1628“95559“989“248. Katalysator Protein „Dihydroorotat-Dehydrogenase (Chinon), mitochondrial“=569 AS [dhod - Dihydroorotate dehydrogenase (quinone), mitochondrial - Plasmodium falciparum (malaria parasite P. falciparum) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8009#16287522092“569“6. Tubulin 450AS als Zählgröße Z.xx11 mit Spiegelung X=QS5+8=13_31 als „45_[X]_0“: Epi.Ref_Rhesus.Z.80“11“#16283“45“(58)“0“(31)943.
Die Z.Nr.Z.80“51“ fährt den Timer für die 15-Sekunden-Exflagellationsdauer hoch, der dann als Zahlendreher zu 15 Sek. ablaufen kann. Es wäre verständlich, wenn die Zeile Z.80“15“ bereits als 15 Sek. definiert wird. Mit QS1+6+2+7+5+3+2+9+3+1+2+4+6+2+8=61 wurde die Zeitbasis=60 um „1“ bereits ausgeführte Aktion überschritten. Die Ziffer „1“ liegt am Rand der Vorzeile und enthält bereits die Zeitbasis „60_174_61“. Was sind 174? Es handelt sich bei dem Protein „W7JVJ6_PLAFA“=174AS“ um eine Palmitoyltransferase-Aktivität beim Parasiten „Plasmodium falciparum“. Durchgehend ist eine Funktion als Zinkfingerprotein erklärt [„W7JVJ6 (W7JVJ6) - Eiweiß - InterPro (ebi.ac.uk)“. Wo ist Zink? Zink fehlt, weil der Code mit QS=60 gespalten ist, um im Mittel „Zink=30“ zu adressieren: QS1+6+2+7+7+3+6+0=32 plus QS1+7+4+6+1+8+1=28= QS60. In den Mikrogameten fehlen die Mitochondrien einer Zelle, so dass Umlagerungen zu den Makrogameten (weiblich) einzuplanen sind, die ein Mitochondrium besitzen. Die Ziffer „2“ in „3“2“ am Rand gilt alternativ als männlich=2, so dass nach der Umlagerung am rechten Rand „männlich“ bei einer Zahl „28“ fehlt. Folglich müsste weiblich=66 etwas empfangen haben: Ja stimmt, ein Protein-Paket „O“ als „6_O_174_6“. Die Zählgröße 11 bezieht sich auf die 8 Mikrogameten als „181“. Anmerkung: Im parallelen Vorgang der Bildung einer Parasiten-Zellstruktur, sollte in diesem Bereich möglichst auch das Mitochondrium der Zelle entstehen. Auslagerung Mitochodrium: Epi.Ref_Rhesus.Z.80“14“#162773“6“0174“6“181“.
Die Hydrolase „Proteasome subunit alpha type=246 AS“ [Proteasome subunit alpha type - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt] ist ein Enzym, das verschiedene Stoffe und C-C-Bindungen reversibel spaltet. Hierzu ist Wasser=H2O=28 erforderlich [Hydrolasen – Wikipedia] als „Hydrolase=246_28=Wasser“. Das Proteasom ist ein Multikomponenten-Proteasekomplex, der für die Regulierung von Schlüsselprozessen wie dem Zellzyklus verantwortlich ist. Das Proteinen Adenylate kinase 2 (AK2)=275 AS ist speziell geeignet, weil eine pH-Abhängigkeit bei einem Optimum von pH=8 erreicht. Der pH-Wert ist direkt von der Bikarbonatkonzentration=HCO3=1+6+8*3=31E abhängig. HCO3=“3“1E ist adressiert. Der pH-Wert erhöht sich, weil aus dem angesaugten Blut=26 das CO2 entweicht. Der gestiegene pH-Wert als Auslöser der Exflagellation zählt sich als Vergleich „32°C“=Mückentemperatur > „31E“=HCO3, d.h. Äpfel werden mit Birnen vermischt, wenn der Gesamteindruck passt. Das CO2=22E ist 2_46_2 enthalten. Das Protein „AK2“ katalysiert den reversiblen Transfer der terminalen Phosphatgruppe zwischen ATP und AMP, daher ist Phosphor=15 in der Z.-Nr.Zxx“15“ enthalten und somit die Ursache der 15 Sekunden. Mit 29 AS wird das kleinste Proteine von „Plasmodium falciparum“ als 3_“29“_3 markiert [HSP20-like chaperone, putative - Plasmodium falciparum (isolate 3D7) | Publications | UniProtKB | UniProt ] oder es handelt sich um eine Signalsequenz, die als QS 2+9=11=Zählgröße wirkt, um den Vergleich 32>31 auszuzählen: Epi.Ref_Rhesus.Z.80“15“#1627532931“246“28
3. Axonem „84“: Epi.Ref_Rhesus.Z.80“20“#1626518259“84“276. Protein „Calcium-dependent protein kinase 4 (PfCDK4)=“528“AS ist am Zellzyklus und an der Exflagellation beteiligt. Tubulin 450AS gespiegelt „25_52“ als 50_4, paarig=2: Epi.Ref_Rhesus.Z.8025#1625“504“8“528“2728.
4. Axonem „84“: Epi.Ref_Rhesus.Z.8027#1625099“84“352049. Kernpore: In der Zeilen-Nr. liegt erneut das Symbol männlich/Membran=“33“ zur Vorbereitung der Exflagellation vor. Das Genom liegt in der Zelle, muss aber in die 8 Flagellen hineingezogen werden. Die Flagellen werden in 15 Sek. aus der Zelle gedrängt. Weil die Kinetosomen mit der Spindel verbunden sind, „zieht das haploide Genom zum Flagellum“. Die Verbindung zum Kern erfolgt über Kernporen. Im Zeilenlauf kann sich eine Kernpore über viele Zeilen ziehen, weil eine Porenserie Zeile „Z.8_“O=Kernpore“_xx“ durchläuft: Epi.Ref_Rhesus.Z.8“0“33“#162388“60“2563662. Tubulin 450AS als „45_X“ . X=0 aus Zählgröße QS1+9=10_“45“_QS1+9=1“0“, paarig=2: Epi.Ref_Rhesus.Z.8040#1622472“19“45“19“77.
5. Axonem „84“: Die 8 Kinetosomen des Zellplasmas sind durch die Kernporen eng mit der mitotischen Spindelplaque verbunden und werden während der 2. und 3. Kernteilung von einem vesikulo-tubulären Netzwerk eingeschlossen. Das Netzwerk ist mit der Plasmamembran verbunden. Als Netzwerk kann „444“ dienen. Die 8 Kinetosome sind das Zentrum für den Aufbau der 22µm langen Axoneme. Die Länge/Durchmesser liegen an anderer Stelle vor. Für eine Länge der Zahl 22 fehlen die Zahl „7=Form“ und 3 Nullen von „nm auf µm“: Epi.Ref_Rhesus.Z.8042#622068694“84“444. Tubulin 450AS gespiegelt wie „46_64“ in Z.x_“0_45“: Epi.Ref_Rhesus.Z.8“0“45“# 1621“46“382149“64“5. 6. Axonem „84“: Epi.Ref_Rhesus.Z.8043#162186702025“84“8.
Exflagellation: Für Z.“8“=Anzahl Flagellen_Kernpore=“0“_QS“4+7=11“=Zählgröße. Im Bauplan wird die Exflagellation nicht mit dem Temperatursturz „Mensch=37°C/Mücken=32°“ in 1 Zeile abgetan. Der Vorgang wird über mehrere Zeilen versteckt zelebriert, weil die Mücke erst noch zur zweiten Blutmalzeit stechen muss. Die Xanthurensäure=“106“E ist der Aktivator. Die Zellmembran=33 zielt mit [1“5“6] zunächst nur auf die Temperaturdifferenz von 6-1=5°C mit „1_5_6“ ab, weil darin mit der Zahl „15“ die 15 Sekunden für die Dauer der Exflagellation gespeichert sind. Die Zeitbasis =60 zur Sekundenzählung ist vorhanden. Die Flagellen/Geißeln müssen ihr haploides Genom über die Verbindung der Kinetosomen zur Spindel erst in sich hineinziehen. Erst dann kondensiert das Genom. Die Zeitbasis=60 kann aufgrund der Zählgröße vorgeben, dass 60% der Mikrogameten unvollständig ohne Zellkern entstehen (8*60%=4,8). In der Blutmalzeit muss folglich die Mindestanzahl von 20 Parasiten enthalten sein, damit 10 Mikrogamonten entstehen, aus denen 80 Mikrogamonten hervorgehen. Dann bleiben 48 als ganze Zahl kernlos, 52 Stück dienen der Fortpflanzung. Real sind es mehr, denn Mücken legen zwischen 50 und 750 Eier ab. Die Evolution beherrscht die Prozentrechnung, weil für eine Basiszahl 100% die Ziffer „6“ incl. 10(6)0 markiert ist: Anzahl Flagellen=8_QS2+3+1=6_Temperaturdifferenz=5°C_6=flexibel_Membran=33: Epi.Ref_Rhesus.Z.“8“0“47“#162“10“60“823“156“33“. Die Anzahl von 48 kernlosen Mikrogamenten folgt in der Z.Nr. Z.xx“48“. Die Körpertemperatur „Mensch=37° C“ „zieht“ sich als „9_“3“_9909_“7“ mit „4x Ziffer 9=seitlich“, bis 4 Zeilen später die Temperatur der Mücke mit 32° am rechten Zahlenrand als Aktivator herausgeschoben wird: Epi.Ref_Rhesus.Z.“8“0“48“#162085“9“3“9909“7“78. Calcium liegt zur Steuerung als Serie #16“20“vor. An Calcium binden verschiedene Proteine „Calcium-abhängige Proteinkinase“, die als Sensor und Effektor von intrazellulärem Ca(2+)- Konzentrationen eine katalytische Aktivität entfalten. Calcium [Ca(2+)] ist ein ubiquitärer sekundärer Botenstoff, der zur Regulierung einer Vielzahl physiologisch wichtiger Prozesse in allen Organismen verwendet wird [siehe: CDPKs: Die kritischen Decoder des Kalziumsignals in verschiedenen Stadien der Entwicklung von Malariaparasiten - ScienceDirect; A. Bansal u.a. (Aug 2021); https://doi.org/10.1016/j.csbj.2021.08.054 ]. Das CDPK5 =568 AS ist wissenschaftlich nur bei der asexuellen Vermehrung bekannt und liegt zwischen den bei der Exflagellation bekannten Proteinen CDPK 4=528AS und CDBK2=513AS. Das Protein „Calcium-abhängige Proteinkinase 4 (CDPK4)=528AS [CDPK4 - Calcium-abhängige Proteinkinase 4 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt] ist im Bauplan in der Zifferfolge verdreht, damit real keine Aktion ausgeführt wird. Es ist ein geplanter Vorgang im „Zellgehirn“, weil dem Parasit beim Wirtswechsel die Orientierung fehlt. Die Ziffer „6“ ist zur Markierung von Calcium gebunden als „6_20=Calcium_6 gebunden. Statt 528 AS wird an die Ziffer „5“ eine verdrehte Zahlenfolge „8“0“2“ angelagert, die an einem Ring „0“ gedreht werden muss. Hierzu ist eine Spiegelung 80_08 vorhanden, um die Ziffer nach der Drehung als unnützen Drehpunkt zu beseitigen. Erkennbar wird, das 5“0“8 einen Platzhalter „0“ enthält, in den die Ziffer „2“ geschoben werden muss. Die Ziffer „5“ als Zellkernsymbol wird als Zielstellung bei der Exflagellation in das Flagellum verschoben, Mit „08“ als Spiegelung zur Serie Z.8“0“xx für 8 Kernporen „0“ wird der Verschiebeweg adressiert. CDPK4=528AS: Epi.Ref_Rhesus.Z.“8“0“49“# 16“20“6“5802“5“08870. Das Flagellum wird in der erwarteten Form als „0“111“0“ mit der Null markiert, so dass es selbstständig wird. Als zusätzliches Protein ist das Protein „Calcium-abhängige Proteinkinase (CDPK5)=568 AS“ geeignet, weil es bei der Exflagellation mit „56(701)11 optimal am Flagellum mit QS7+0+1=8 als 568 AS bindet [CDPK5 - Calcium-abhängige Proteinkinase 5 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Calcium=20 ist in einem Kreislauf=64 als „6_20_4 eingebettet, der zum Materialumbau von der Zelle zu den Flagellen entsteht. Das Zellkern-Symbol „5“ liegt in der Z.Nr.: Epi.Ref_Rhesus.Z.“8“0“5“0“# 16“20“4“567“0“111“0“43. Die Körpertemperatur der Mücke von „32°C“ liegt nunmehr am rechten Zahlenrand. Von den 7 CDPK’s kann sich auch CDPK1=524 AS beteiligen [PDCK1 - Calcium-dependent protein kinase 1 - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt]. CDPK1 liegt in der falschen Ziffernfolge „542“ vor und muss 2 Zahlen als 542 drehen. Dafür ist der Z.Nr. Z.80„51“ ein Timer auf „51“ hochgedreht, der in 2 Aktionen (jede Zahl einzeln) auf „15 Sekunden-Exflagellatinsdauer“ ablaufen muss. CDPK1 organisiert hierfür die Zeitbasis=60, indem die Quersumme inclusive der Zeilennummer und ohne die 2 Aktionen am rechten Zahlenrand QS=60 ergeben. QS8+0+5+1+1+6+2+0+2+5+5+4+2+7+1+4+4+3+[2]=60[62]: Epi.Ref_Rhesus.Z.80“51“#16“20“25“542“71443“2“. Die kürzeste Proteinlänge bei „Plasmodium f.“ enthält 29 Aminosäurereste [siehe: Transcriptomic complexity of the human malaria parasite Plasmodium falciparum revealed by long-read sequencing | PLOS ONE ]: Epi.Ref_Rhesus.Z.8053“#16198530“29“17409. Das zur Exflagellation notwendige Protein „Calcium-abhängige Proteinkinase 2 (CDPK2)=“513“AS ist direkt lesbar [CDPK2 - Calcium-abhängige Proteinkinase 2 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Info zu CDPKs [siehe: CDPKs: The critical decoders of calcium signal at various stages of malaria parasite development - PMC (nih.gov) ]. Tubulin 450AS gespiegelt wie „01_10“ als „0_45“: Epi.Ref_Rhesus.Z.8050#162“045“67“01“1“10“43. 7. Axonem „84“: Epi.Ref_Rhesus.Z.80“56“#1619249806“84“446. 8. Axonem „84“: Epi.Ref_Rhesus.Z.8058#1618“84“790815822. Tubulin 450AS verbunden durch Zählgröße QS4+3+4=11 als „45_[11]_0“: Epi.Ref_Rhesus.Z.8061#16182“45“(434)“0“5768.
Die geplante Exflagellation beginnt mit der Xanthurensäure=106E. Das Oberflächen-Protein „Gametocycte surface protein P230 =3135AS“ ist mit seinen Ziffern im Schlüssel-Schloss-Prinzip =56 und der Membran-Oberfläche „33“ enthalten als „31“_“56“_3“3“: Epi.Ref_Rhesus.Z.8047#162“106“082“315“63“3.
Gruppe 44 aus QS1+6+1=8 Flagellen als „161_44“: Nr.1: Epi.Ref_Rhesus.Z.8060#“161“844620892543; Nr.2: Epi.Ref_Rhesus.Z.8062#“161“80“44“70899764;
Nr.3: Epi.Ref_Rhesus.Z.8063#“161“78“44“03372677;
Nr.4: Epi.Ref_Rhesus.Z.8065#“161“7“44“283247848;
Achtung: INHALTSDOPPLUNG? Der Mikrogamont (männlich) zieht bei der Exflagellation zum spermienförmigen Mikrogamet das Kerngenom in das Flagellum. Der Zeilenlauf wird dann vom Kerngenom bis zum Anschluss an die Bakterien fortgesetzt!
Nr.5: Epi.Ref_Rhesus.Z.8070#“161“6“44“069937286;
Nr.6: Epi.Ref_Rhesus.Z.8077#“161“5039797“44“199;
Protein „Calcium-dependent protein kinase 4 (PfCDK4)=528AS: Epi.Ref_Rhesus.Z.8080#16144401539“528“4.
Nr.7: Epi.Ref_Rhesus.Z.“808“5#“161“3“44“173703636;
Mückendarm „808 in Z.Nr.808x; Systemachse „84“, Zeit=60_QS2+3=5_60=Zeit: Epi.Ref_Rhesus.Z.8093#1611“84“683“602360“. Ringförmige Anordnung der Flagellen QS1+6+1+1=9=seitlich_Kreis=64_Form=7: Epi.Ref_Rhesus.Z.8093#“1611“64“7695075“24“. Flagelle Nr.8: Epi.Ref_Rhesus.Z.8095#“161“1“44“860332785.
Kopf der Gameten „505“: Epi.Ref_Rhesus.Z.8097#16“11“0“505“6736309.
osmiophile Körperchen als Serie #16_Wasser=10 von Epi.Ref_Rhesus.Z.8098#16“10“8“51623“10“92“8 mit Inhaltsstoffen 7-7 oder 8-8 massenhaft QS9+2=11 bis Epi.Ref_Rhesus.Z.8“101“#16“10“2“550“8504369. Die Parasiten-Membran „33“ umhüllt die Nahrungsvakuole „8000“. Darin wird der Inhalt der osmiophilen Körperchen entleert.
Epi.Ref_Rhesus.Z.“8102“#16“100“56“33“719316 und Epi.Ref_Rhesus.Z.8097#1“60“985763839“800“.
Bindung an benachbarte Erythrozyten=QS1+6+0+4+9+6+0=26=Blut und Bildung von Exflagellationszentren als Struktur „555“: Epi.Ref_Rhesus.Z.8128#1“604“906058“555“48.
Kerngenom : Zellenaufbau gehört nicht speziell zum Mikrogamet (männlich)
Chromosomen: Der DNA-Doppelstrang wird durch eine Anzahl sich gegenüberliegender Nukleobasen gebildet, die jeweils als Basenpaare (bp) gezählt werden. Vielfache sind 1kbp=1000 Basenpaare und 1Mbp= 1 000 000 Basenpaare. Das Kerngenom ist die DNA-Gesamtmenge innerhalb des Zellkerns. Das Kerngenom von „Plasmodium falciparum“ wird aus „22,8“ Megabasenpaare (Mbp) gebildet. Es enthält „14“ Chromosomen, die eine Anzahl von „5268“ proteinkodierende Genen abbilden [Form=QS5+2=7 aus QS6+8=14 Chromosomen]. Die Größe der Chromosomen variiert zwischen 0,643 bis 3,29 Mbp [[Genomsequenz des menschlichen Malariaparasiten Plasmodium falciparum - PMC (nih.gov); M. Gardner u.a.; Okt.2002; doi: 10.1038/nature01097].
Weil in der Zeile keine äußeren zählbaren Strukturen vorhanden sind, muss die Kettenlänge maßgeblichen Proteine bereits die Basisinformation des Kerngenoms enthalten. Die Chromosomen werden für beide Geschlechter getrennt hergestellt. Dafür sind 2 Zeilen vorhanden. Der Mikrogamet (männlich) besteht spermienförmig aus dem Axonem und dem aufgesetzten Kern mit dem Genom. Es wird die Serie Z.“8“068 verwendet, weil aus 1 Makrogamont „8“ Mikrogameten hervorgehen. Mit QS6+8=14 werden „14“ Chromosomen gebildet. Die Zeile enthält in der Zeilen-Nr.8=Oktamer_“68“, die auch im #Code mit „68“ und als Spiegelung QS3+5=8_6 vorhanden ist. Die Zahl „5_6“ ist darin verwickelt. Die Gen-Anzahl=“5268“ kann gespiegelt werden als „68_52“. Die Zahl „68“ liegt nunmehr in der Zeilen-Nr. Z.80“68“ und die Ziffer „5“ und „2“ sind rechts verteilt. In der letzten Zeile ist die Zahl „52“ mit der Ziffer „2“ Bestandteil des Kerngenoms von „2“2,8 Mbp. Die Anzahl der Gene beschreibt somit den Bereich der Matrix. Die Zahl kann auch in der Zifferfolge als Kreis gelesen werden „5_[QS1+1=2]_6_8“.
Den Mikrogameten wurde als männliches Merkmal ein Signal „29“ angeheftet, das nunmehr weitergeleitet wurde. Am Rand verbleibt seitlich=9. Die Schwerachse=84 ist mit „14“ Chromosomen gekoppelt. In der Symbolik „1616“ ist die Zählgröße=11 und die Zielgröße weiblich=66 enthalten. Weil die 8 Mikrogameten eine Zählgruppe 4_“1“_4 bilden, ergibt sich „QS16+16=“32“plus[4]_“1“_[4]“=33=männlich. Die maximale Anzahl der Basenpaare ist mit 3,29 Mbp vorgegeben. Diese zählen sich als Ziffernfolge aus den „3562“ Genen zusammen 3_[QS5+6=11=Zählgröße]2_9. Die Zählgröße wird Kommastelle mit Struktur-5 und 6 für 10^6 Mbp genutzt. werden. Summe QS=„56“=Schlüssel-Schloss-Prinzip aus QS=1+6+1+6+8+4+1+4+0=31 plus QS=3+5+6+2+0+9=25. In der Ziffernfolge „168_ 9“ liegt das Zinkfingerprotein „Domänenhaltiges Protein vom C3H1-Typ [W7JM64·W7JM64_PLAFO]“=1689AS in der Zeile [C3H1-Typ domänenhaltiges Protein - Plasmodium falciparum (Isolat NF54) | UniProtKB | UniProt]. Männliche Chromosom: Epi.Ref_Rhesus.Z.80“68“#“161684“14“0“3562“09.
Für das weibliche Chromosom muss am rechten Rand die Ziffer=2 als Spiegelung 26_62 gebunden werden, um die alternative Deutung „2=männlich=rechts“ zu vermeiden. Aufgrund der Spiegelung wird die Ziffer „4“ aus Zahl „410“ in die Nullstelle gespiegelt, um ebenfalls 14 Chromosomen im Kerngenom zu bilden. Weiblich ist als Dopplung 66_66 enthalten. Was für die beiden Chromatiden eines Chromosoms verwendbar ist. Die Mindestanzahl von „643“ kbp liegt als Ziffernfolge vor 64_QS1+0+2=3=643 vor, so dass noch der Faktor 1000 fehlt. Hierfür wird aus QS3+7=10 ein Basisfaktor gebildet. Wegen der Spiegelung wird die überschüssige „6“ beidseitig zu 2 Zählgrößen halbiert als QS2+6+(6/2)=11. Offensichtlich multiplizieren beiden Zählgrößen den Basisfaktor 10 auf 1000, weil die Null in QS 1+“0“+2=3 für „1000“ bereits adressiert ist. QS=1+6+1+6+6+4+1+0=25 plus QS=2+6+6+3+7+6+2=32=57. Die Zahlenteile QS=25 sind in beiden Chromosomen seitenverkehrt angeordnet und können mit paarig=2_5 das Zentromer als Verbindungspunkt der beiden Chromatiden darstellen. Im Vergleich muss sich der Mikrogamet als 1 Aktion zum Makrogamet bewegen um ebenfalls 56+1Aktion=57 zu erreichen. Die Anzahl der Gene ist zunächst am rechten Rand mit „3762“ Genen vermerkt, so dass für einen Gleichstand 200 Genen zu beseitigen sind. Diese 200 Gene werden in der Zeitdifferenz am linken Zahlenrand ausgeworfen: TIME.DELTA. Epi.Ref_Rhesus.Z.8068-Z.8069=“200“3769“24“472. Der Unterschied von 200 Gene liegt im Gegensatz Schwerachse=84 für die Flagellen und Kreis=64 mit einer Calcium-20-Differenz. Mit der gespiegelten Ziffernfolge „641_“0“_2“ wird die 200 auf Calcium=20 reduziert und dann der Ca+-Überschuss vom Protein „Non-SERCA-type Ca2+ -transporting P-ATPase“ =1264 AS aufgenommen [ATPase4 - Non-SERCA-type Ca2+ -transporting P-ATPase - Plasmodium falciparum (malaria parasite P. falciparum) | Publications | UniProtKB | UniProt]: Weibliches Chromosom: Epi.Ref_Rhesus.Z.8069#161“66“4102“66“3762.
Das Kerngenom aus 22,8“ Megabasenpaaren (Mbp) wird maßgeblich durch das Protein
Calcyclin-bindendes Protein =228AS mit gleicher Ziffernfolge bestimmt [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Das Protein liegt im Chromosom vor. Weitere Proteine werden eingebaut, weil für den Mbp-Faktor 10^6 noch Null-Zeilen benötigt werden. Weil im Protein=228AS bereits der Faktor 10 enthalten ist, müssen insgesamt noch 5 vorgelagerte Nullen in 4 Zeilen gefunden werden. In Z.8073 ist mit 0_QS7+3=10 erklärt, das über die Zeilennummer 3 Zeilen vorgelagert sind. Neben der Schwerachse 84_00 können bereits 2 Nullen gewonnen werden. Die 3 vorgelagerten Zeilen bilden 40er Glycin-Spalte, so dass insgesamt 5 Nullen vorliegen. Die Zeilen enthalten die Bildung eines Nukleosoms, das aus einem Oktamer aus 2-fachen Proteinen „Histone H2A=132AS, H2B=123AS, H3=136AS und H4=103AS“ besteht, um die sich jeweils Teilabschnitte der DNA von 146 bp (beim Menschen) als 1,65-fache DNA-Wicklung legen [Histon – Wikipedia]. Das Oktamer wird durch die Serie Z.“8“_0xx verursacht.
Epi.Ref_Rhesus.Z.8070#1616“44069“9“372“8“6
Epi.Ref_Rhesus.Z.8071#161624“0“42“1749“34
Epi.Ref_Rhesus.Z.8072#1616“0“4“0“19374863
Epi.Ref_Rhesus.Z.8073#161584“00“1535“228“
Histone: In Zeile Z.8070 wird die korrekte Faltung neuer Proteine durch das Protein „Histone chaperone ASF1“=273AS als Spiegelung „372“überwacht [Histone chaperone ASF1 - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt ]. Mit katalytischer Aktivität {H2O + N6-Acetyl-L-lysyl-[Histon] = Acetat + L-Lysyl-[Histon]} sind 2 Proteine enthalten, die mit 449AS und 446AS eine kombinierte Gruppe 44 bilden als „44_69“. Die angehängte Ziffer 9 als 99 ist Acetat=H3C=QS3+6=“9“. Wasser=H2O=28 [HDAC1 - Histon-Deacetylase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt; Histone deacetylase - Plasmodium falciparum UGT5.1 | UniProtKB | UniProt ].
In Zeile Z.8071 wird die Anzahl der gewickelten 149 Basenpaaren (statt 146bp) als „1_Form=7_49“ kombiniert, wobei darin mit „1/7“ die wicklungsbedingte Verkürzung der DNA adressiert wird. Mit kurzen DNA-Verbindungsstücken bilden die Nukleosome eine verkürzte DNA-Kette. Die Proteine H3 und H4 vor einem Tetramer zuerst das „Dimer-H3-H4“ mit der Summe 136AS+103AS=239AS. Kombiniert mit Form=7 ist das „Dimer-H3-H4“ gespiegelt als 93_Form=7_2 enthalten. Das Tetramer= 2*239AS=478AS wird mit der Dopplung 16_16 gebildet, in dem die Ziffer 4 aus der Gruppe 44 die Ziffern 7 und 8 aus der Zeilennummer entnommen werden.
Das Dimer „H2A+H2B“ =132AS+123AS=255AS wird gebildet und dann doppelt mit „510“AS dem Tetramer zur Summe=478AS+510AS=988AS zum Oktamer vereinigt. Aufgrund der Glycin-„4“0-Spalte über 4 Zeilen sind „4-4-4-4“ als Spaltenergebnis „88“ vorhanden. Die Ziffer „9“ wird in der letzten Zeile Z.8073 als QS1+5+3=9 gelesen. Rest= Struktur-5 bzw. 10^5 mit 228 für Kerngenom. Das Oktamer wird vertikal mit dem Bromodomänenprotein, „PfBDP1 (PF3D7_1033700)“=488AS zusammengesetzt und bildet mit Brom=35 die Ziffer 35.in der Zeile. [https://proteopedia.org/wiki/index.php/User:Saleh_Alkrimi/_Sandbox_898}.
Die Anzahl von 1,65 DNA-Windungen/Oktamer ist vorhanden, übersteigt aber das normale Interesse, weil der Parasit eine Fehleranalyse betreibt und darauf reagiert. Die beiden 10er Potenzen „00“ für das Kerngenom sollen gleichzeitig als 1/100 für die Kommastelle lesbar sein. Um eine andere Betrachtungsebene einzuziehen wird der Unterschied von Zeilen-Nr. und Zeilencode festgestellt. In Z.8“0“73 steht als Basis ein Null zur Verfügung. Die Zeilennummer ist gespiegelt „ähnlich“ auch am Zeilenrand als „3_QS5+2=7_[2]8“ vorhanden, wenn dort statt der Ziffer 2 eine Null stehen würden. Somit wird ein Zusammenhang nur Null in der Zeilen-Nr. hergestellt. Abgespalten wurde nunmehr #QS1+6=7=Form _15_Schwerachse=84_00_15. Die Nullen „00“ werden symmetrisch nach dem Gleichgewichtsorgan des Menschen [Schwerachse (84)=Bogengänge(64)+Calcium(20)] um die Schwerachse gelegt als „0_84_0“. Das ergibt „15/10=1,5_84_0,15“. Die Addition ergibt 1,5+0,15=1,65 DNA-Windungen/Nukleosom. Die gespiegelter Zifferfolge zieht das Protein „Histon-Acetyltransferase GCN5“=1465AS [Histon-Acetyltransferase GCN5 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt ]. Der Zahlenteil „65“ ist eine Zählgröße=1“6“1“5“ auch als QS6+5=11. Die beiden Nullen „00“ in „4001“ wurden verwertet, so dass „4_1“ verbleiben. Somit liegen [1]6[1]5_8=Oktamer_4 [00]1 statt 1465 AS vor.
Das Verbindungshiston H1 (Linker-Histon) ist kein Bestandteil des zentralen Histonoktamers, sondern lagert sich von außen zur Stabilisierung an. Bei Apicomplexa-Parasiten wurde das Protein H1 noch nie identifiziert [Bisher nicht identifiziertes Histon H1-ähnliches Protein ist an der Zellteilung und Ribosomenbiosynthese in Toxoplasma gondii beteiligt | mSphere]. Um die Fasern von 30nm zur Stabilisierung zu erzeugen, wird Aktin benötigt. Die Länge von 374AS ist theoretisch in Z.8072 auch vorhanden, aber der Parasit kann nur abweichend Aktin=376AS produzieren. Die Länge „374“ wird in anderer Ziffernfolge vom „Nukleosomen-Assemblierungsprotein [A0A2I0BYB4 · A0A2I0BYB4_PLAFO]“=347AS verwendet [Nucleosome assembly protein - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt]. Der Parasit erzeugt 2 zwei Nukleosomen-Assemblierungsproteine (PfNapS und PfNapL), aber nur PfNapS ist in der Lage, Histone auf DNA abzulagern [ Die beiden Plasmodium falciparum Nukleosomen-Assemblierungsproteine spielen unterschiedliche Rollen beim Histontransport und beim Chromatinaufbau - ScienceDirect].
Das Protein „Histon-Lysin-N-methyltransferase SET7“=793AS mit Lysin= C6H14N2O2=6*6+14+14+16=80 kann die Addition von jeweils zwei 40er-Glycin-Zeilen 40+40=80E mit einer gemischten Ziffernfolge „7-9-3“ ausführen: Z.8070 als „937“; in Z.8071 als „7“_4_“93“_4; in Z.8072 als „937“ und Z.8073 vom Ende Z.8072 mit QS 6+3=9 und Übertrag auf Zeilen-Nr. Z.8073 mit „73“.
Transfer-RNA: Das Kerngenom enthält 43 Transfer-RNA-Gene [siehe: Genome sequence of the human malaria parasite Plasmodium falciparum | Nature; M.Gardner; Okt. 2002; doi: 10.1038/nature01097]. Im Allgemeinen werden in der Literatur für die Axicomplexa-Parasiten und auch speziell für P. falciparum „45“ statt nur 43 tRNA-Gene genannt, so dass für 2 Gene eine Besonderheit zu erwarten ist. Die tRNA wird mit einer spezifischen Aminosäure beladen. Das Beladen erfolgt jeweils durch ein zur tRNA und zur Aminosäure passendes Enzym „Aminoacyl-tRNA-Synthetase (AaRS)“. Die tRNA wandert an der Boten-RNA [messenger ribonucleic acid (mRNA)] entlang, die den Bauplan eines Proteins als Kette von Aminosäuren enthält. Der Bauplan wird in die richtige Reihenfolge der Aminosäuren übersetzt. Jeweils 3 Basen der mRNA bilden das Triplett, welches zur spezifischen tRNA und ihrer Aminosäure passt.
Die Gene zur Erzeugug der Transfer-RMA gehören zum Kerngenom im Zellkern. Zuvor wird ein Muster für die Größe und Faltung der tRMA erzeugt. In der Zeilen-Nr. ist unverändert die Serie Z.80xx vorhanden, die statt Lysin=80 eventuell damit ausschließlich nur die Zuckerart „Ribose“=C5H10O5=6*5+10+8*5=30+10+40=80E in der tRMA adressiert. Der Parasit gewinnt die Nährstoffe aus den roten Blutkörperchen, besitzt aber auch die Fähigkeit die Transfer-RMA (tRMA) des Menschen als Zwischenwirt extern einzufangen und daraus Proteine herzustellen. Für die Faltung der tRNA wird daher als ähnliches Muster entwickelt. Der Import der externen tRMA wird in P. falciparum vom tRNA-Importprotein „PF3D7_1442300(tRip)“=402AS organisiert, das ein Intron (231 Nukleotide lang) enthält. Introns (intragenic regions) sind die nicht codierenden Abschnitte der DNA innerhalb eines Gens (intragen), die benachbarte Exons trennen. Introns werden transkribiert, aber dann aus der prä-mRNA herausgespleißt, bevor diese zur Translation aus dem Zellkern herausgeschleust wird“ [Intron – Wikipedia]. Das Import-Protein „tRIP“ wird von einem Gen codiert, das auf dem Chromosom 14 liegt und aus „1440“ Nukleotiden besteht [siehe: „Apicomplexa-specific tRip facilitates import of exogenous tRNAs into malaria parasites | PNAS“; M. Frugier u.a. Nov.2013; https://doi.org/10.1073/pnas.1600476113; Apicomplexa-spezifisches tRip erleichtert Import exogener tRNAs in Malariaparasiten | PNAS].
Das Struktur-Schema einer tRNA ist in Form eines 3-blättrigen Kleeblatts mit Stiel gefaltet, auf dem gemäß Skizze „76 oder 77“ Nukleotiden zählbar sind. In der gefalteten Kette sind 77 Basen gezeichnet, aber die teilweise Beschriftung ergibt nur 76 Basen. Zwischen Base Nr. 19 und Nr. 26 ist 1 Base entfallen. Nachfolgend werden hier 76 Basen nachgewiesen, wobei im Sonderfall 1 zusätzliche Base in der variablen Schleife zwischen Nr. 45 und 49 eingefügt wird [siehe: Aminoacylation of Plasmodium falciparum tRNAAsn and Insights in the Synthesis of Asparagine Repeats* - Journal of Biological Chemistry (jbc.org); M. Frugier u.a. Nov.2013; DOI:https://doi.org/10.1074/jbc.M113.522896: Aminoacylierung von Plasmodium falciparum tRNAAsn und Einblicke in die Synthese von Sparagin-Wiederholungen - PMC (nih.gov)]. Eine tRNA besteht üblich aus 73 bis 95 Nukleotiden. Die Anzahl variiert aufgrund einer zusätzlichen variablen Schleife [tRNA – Wikipedia]. Der DNA/RNA-Baustein „Nukleotid“ setzt sich aus 1 Basen-, 1 Zucker- und 1 Phosphat¬anteil zusammen. Die Anzahl der Basen in der Kette wird gezählt. Phosphor=15 ist als Serie #16“15“ vorhanden. Das Rückgrat (Backbone) eines RNA-Makromoleküls bilden die über Phosphorsäureester-Bindungen miteinander verknüpften Ribose-Einheiten. Ribose=C5H10O5=80E. Die Ribose ist als Serie in der Zeilen-Nr. Z.80xx vorhanden.
„A-Arm“ (17 Basen): Das mittlere Blatt bildet mit 7 Basen [Nr.33-39] eine Anticodon-Schleife auf der 5 Basenpaare einen Strang zum Zentrum ziehen (Nr.27-32/Nr.44-40). Am äußeren Rand der Schleife bilden 3 der 7 Basen ein funktionell spezifisches Basentriplett „Anticodon“. Ein Codon ist die kleinste Einheit im genetischen Code. An jeder der 3 Triplett-Positionen kann 1 von 4 verschiedenen Nukleobasen auftreffen, so das 4^3=64 Kombinationen und somit 64 Codons theoretisch möglich sind. Ein Basentriplett als spezielle Form=7 kann als „777“ dargestellt werden, wobei die 7 Basen in der Schleife als Ziffer „7“ mit enthalten sind. Die 5 Basenpaare werden als Dopplung „76-76“ mit der Zeilen-Nr.Z.80“76“#_Anticodon=777_flexibel=6_O=Ring_5=Paare adressiert. Am rechten Zahlenrand mit Ring=O_Struktur=5_12 kann die Zahl 12 aus 5 Basenpaaren plus 7 einzelnen Basen im offenen Ring gebildet werden. Anticodonarm: Epi.Ref_Rhesus.Z.80“76“#“1615“23“9“777“6“05“12“.
„D-Arm“ (20 Basen): In der Zeilen-Nr.Z.8075 ist im Code ebenfalls eine Ring-O(Null) vorhanden, die aber als „Extra=8“ mit „Ring-O(Null)=0_Form=7_ paarig=2_seitlich=9_EXTRA=8_9=seitlich“ für „D-Arm und T-Arm“ gemeinsam adressiert ist. Der D-Arm bildet eine Dihydrouridin-Schleife, die Dihydrouracilreste enthält. Die Schleife dient der Erkennung der tRNA durch die Aminoacyl-tRNA-Synthetase. Dihydrouridin= C9H14N2O6=6*9+14+14+8*6=54+28+48=130E. Der D-Arm [„16“1“54“3“98“0“] setzt sich aus entsprechend dem Zahlenteil „QS3+9+8=20 Basen aus 9 Basen [Nr.14-22] im offenen Ring, 8 Basen in 4 Paaren und 3 überschüssige Basen im Zentrum zusammen. Davon 1 Base im Ansatz zum A-Arm und 2 Basen im Ansatz zum Stiel. Die Zeilen-Nr. Z.QS8+0+7+5=20 zeigt ebenfalls 20 Basen für die linke Blattseite an. Die Ziffer „4“ muss zu 4 Basenpaaren erklärt werden. Dieses ist mit Z.QS8+0+7=“15“_x #_“15“_4 möglich, womit zusätzlich eine eigene O(Null) für die D-Schleife eingefangen wird. Dihydrouridin=130E grenzt die Zahlenteile QS5+4=“9“ und QS9+8=“17“ ab.
„T-Arm“ (21 Basen): Der T-Arm [„0“7“2989“4“] auf der rechten Blattseite bildet mit der Ziffer „0“ eine Schleife aus „7“ Basen [Nr.54-61], die beispielsweise (Ribo-)Thymidin, Pseudouridin und Cytidin darstellen.
Pseudouridin=C9H12N2O6=6*9+12+2*7+8*9=54+26+72=152E= QS1+5+2=8.
Cytidin=C9H13N3O5=6*9+13+7*3+8*5=54+13+21+40=128E=QS1+2+8=11
Thymidin=C10H14N2O5=6*10+14+7*2+8*5=60+14+14+40=128E=QS1+2+8=11
Mit dem offenen Ring=O_7 werden 7 einzelne Basen adressiert, die an einem Strang aus 10 Basen angeschlossen sind. Die beiden gegenüberliegenden Basen G-U bilden kein Basenpaar, so dass eine Lücke in den 4 Basenpaaren entsteht. Diese liegt mit der Ziffer 2 für 2 ungepaarte Basen an 2. Stelle im Strang. Die 10 Basen im Strang werden daher als „ungepaart=2_seitlich=9_Anzahl gepaart=8_9=seitlich“ adressiert. Am Zahlenrand verbleiben 4 Basen als Überschuss, die ergänzend die sogenannte „variable Schleife“ zwischen A- und T-Arm bilden. Problem: Die Zeichnung enthält mit A-G-G-U-C die Anzahl von 5 statt 4 Basen. Im Regelfall mit 76 Basen entfällt 1 Base in dieser variablen Schleife. Im Sonderfall mit 77 Basen kann die O(Null) in der Zeilen-Nr Z.“8“0“7“5 1 Base als Nr. 43 einfügen, weil u.a. die „807“ auch im „Code“ enthalten ist.
Die 4 Überschuss-Basen für den Regelfall mit 76 Basen werden dem T-Arm zugerechnet (Summe 7+10+4=21 Basen). Cytidin und Thymidin mit 128E ergeben als Quersumme QS=11 eine Zählgröße für eine Rechenaufgabe. Im Zeilencode ist mit QS2+9=11 ebenfalls eine Rechenaufgabe möglich. „29“-8(QSPseudouridin=8)=21 ergibt die Anzahl=21 Basen im T-Arm: D- und T-Arm: Epi.Ref_Rhesus.Z.8“0“75#“16“1“5“4“3“98“0“7“2“989“4“.
„Sonderfall: 77 Basen“ mit einer zusätzlichen Base in der variablen Schleife in Zeile Z.8075: Das Protein „Phenylalanin-tRNA-Ligase“=575 AS [Phenylalanin--tRNA-Ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt] kann einen Zusammenhang mit der Zeilen-Nr. „Z.8=Extra_O_75“ herstellen, sofern die Ziffer „5“ von „5“75AS in den Platzhalter kommt bzw. eine 5. Base in der Schleife liegt. Die Zahl „807“ der Zeilennummer stimmt mit „807“ im Code überein, so dass die variable Schleife mit der Null in der Zeilen-Nr. Z.8“0“7“5“ adressiert wird. In diesem Sonderfall können mit der Ziffer „5“ alle 5 Nukleinbasen: A(Adenin) – G(Guanin) - G
(Guanin) – U( Uracil) – (Cytosin) in der variablen Schleife liegen. Die tRNA soll mit der Aminosäure Phenylalanin=C9H11NO2=6*9+11+7+16=54+18+16=54+34=84 beladen werden. Welche Base wird in der variabalen Kette zu insgesamt 77 Basen ergänzt? Adenin=C5H5N5=6*5+5+7*5=30+40=70E; Guanin=C5H5N5O=78E; Uracil= C4H4N2O2=6*4+4+14+16=24+4+30=58“; Cytosin=C3H7NO2S=6*3+7+7+16+16=64E. In den Platzhalter-O soll die Ziffer „5“ gespiegelt werden, wozu Uracil=“5“8E benötigt wird.
„Blattstiel“(18 Basen): Der Blattstiel wird als Akzeptor-Stamm bezeichnet. 14 Basen bilden einen Stiel aus 7 Basenpaaren, wobei sich mittig als Querachse 2 gleiche Basen U-U gegenüberliegen. Am 5´-Ende des Stiels liegt in der Zählung die Base Nr.1. Nach der Faltung der Basen-Kette von 76 (77) Basen ergibt sich am 3´-Ende ein Überschuss mit einer Kette von 4 einzelnen Basen (Summe 17+20+21+18=76E). Das 3´-Ende zeigt die Sequenz CCA-3’, so dass Adenosin den Abschluss bildet. Adenosin=C10H13N5O4=60+13+7*5+8*4=73+35+32=140E. Das 5´-Ende ist phosphoryliert mit Phosphor=“15“. Die Basenanzahl=18 ist enthalten. Für das gleichartige Basenpaar U-U ist eine Doppelziffer EXTRA=88 geeignet. Beidseitig von dieser Achse liegen 3 Paare mit 6 Basen „6“_QS3+9=12_88_“6“. Damit ergibt die Kette der 4 überschüssigen Basen am 3`-Ende einen Zahlenteil „54186“ als „Struktur=5_4=Basen_18=Basensumme_6=flexibel“: Epi.Ref_Rhesus.Z.8074#1615“639886“54“18“6. Das Ende der Kette am 3´-Ende wird mit 4 Basen und immer zuletzt mit Adenosin=140E gebildet. Warum? Für die Vielzahl der Aminosäuren und den entsprechenden Enzymen „Aminoacyl-tRNA-Synthetase“ kann die Ziffer „6“=flexibel weitergehend verallgemeinert werden. Die tRNA muss ihre angehängte Aminosäure zu den Ribosomen transportieren. Das Enzym besitzt 2 Bindungsstellen jeweils für die tRNA und die Aminosäure. Für diesen Vorgang ist der Energieträger ATP (Adenosintriphosphat)=551AS notwendig [ATP synthase subunit alpha - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Die Aminosäure wird unter ATP-Verbrauch aktiviert, dabei gibt das ATP zwei Phosphatreste ab. Die aktivierte Aminosäure verbindet sich nunmehr mit dem Basentriplett C-C-A und zwischen dem Basentriplett und der Aminosäure bildet sich eine Esterbindung. Esterbindung: An der Verbindung reagieren eine Carboxylgruppe (-COOH=6+8+8+1=25) und eine Hydroxygruppe (-OH=8+1=9) miteinander zu einer intramolekularen Esterbindung (Lactone). Der ATP-Verbrauch=ATP abzüglich Adenosin=551-140=411 enthält als interessante Differenz ein Zählgröße 11. Werden von den 4 Basen nur das Triplett CCA mit 3 Basen angelagert, entsteht QS3+4=7=Form_11=Zählgröße. Das aktive Zentrum des Enzyms katalysiert die Esterbindung zwischen der Aminosäure und der tRNA, hierbei muss das Enzym die richtige Aminosäure erkennen. Bei der Kondensationsreaktion eines Esters wird Wasser freigesetzt [Ester - DocCheck Flexikon]. Wasser H2O=2_8 als „28“ wird bereits zuvor am rechten Rand abgesondert. Interessant ist, dass die bei der Aktivierung abgegebenen beiden Phosphatreste „Phosphor=15_84=Schwerachse_00_15=Phosphor“ enthalten sind, wobei die Ziffern von ATP und Adenosin vermischt sind. QS 1+6+1+5+8+4+0=25=COOH-Gruppe. Die Esterbindung wird über die Zeilen-Nr.Zxx73_#3_QS5+2=7 als Spiegelung dargestellt. Nun kann die Ziffer 8 der Zeilen-Nr. mit der Ziffer „1“=8+1=9=OH-Gruppe summiert werden. Der Ziffernrest „5_28“ ist das Wasser bzw. kann QS5+2+8=15=Phosphor gezählt werden. Die Ziffer „5“ stört scheinbar, ist aber erkennbar zumindest bei der Beladung der Aminosäure „Histidin“ unter Mitwirkung des Proteins „Histidin--tRNA-Ligase=1132AS“ zweckdienlich [ Histidin--tRNA-Ligase - Plasmodium falciparum (Isolat 3D7) | Weblinks | UniProtKB | UniProt]. Die zur Beladung der Aminosäuren erforderlichen „Aminoacyl-tRNA-Synthetasen (Aminoacyl-tRNA-Ligasen) werden in 2 Klassen (I / II) unterschieden, denen die Aminosäuren funktionell zugeordnet sind. Die Klasse II, zu der Histidin gehört, zeigt einen zweistufigen Reaktionsmechanismus. Es katalysiert zunächst die ATP-abhängige Bildung eines Aminoacyl-AMP-Zwischenprodukts und überträgt dann den aktivierten Aminoacylanteil auf eine Akzeptor-tRNA [siehe: Klasse II Aminoacyl-tRNA-Synthetase/Biotinylproteinligase (BPL) und Lipoylproteinligase (LPL) (IPR045864) - InterPro Eintrag - InterPro (ebi.ac.uk); IPR045864]. Histidin--tRNA-Ligase=1132AS enthält eine Zählgröße=11 und fängt die Ziffer „5“ im rechten Zahlenteil als Klammer „015“352“28 ein, so dass jetzt H2O=28 verdrängt wird. Die Zählgröße „11“ wird bereits avisiert, und zwar ohne Wasser und ohne geklammerte „5“ als QS1+5+3+[5]+2+[28]=11 ohne[]. Die Voraussetzung ist eine vorgelagerte Stufe als Adenosinmonophosphat(AMP)-Zwischenprodukt=811AS[AMP-abhängiges Synthetase/Ligasedomänen-enthaltendes Protein - Plasmodium falciparum NF135/5.C10 | UniProtKB | UniProt]. Das Zwischenprodukt ist im linken Zahlenteil erkennbar als 1“6“1“5“8“_4. QS6+5=11=Zählgröße_4. Enthalten ist die Schwerachse „84“. Diese ist auch am rechten Zahlenrand gespiegelt als QS2+2=4_8 vorhanden, so dass beide Stufen der Klasse II zusammengeführt werden. Wegen QS1+5+3+5+2+2+8=26=Erythrozyt wird auch die tRMA des Zwischenwirts eingefangen: Epi.Ref_Rhesus.Z.“8“0“73“#“161584“00“1“5“3“52“28“.
In Zeilen-Nr. Z.8075/8076 liegt das „tRNA-Importprotein (tRip)“ =402 AS mit den beiden Ziffern „4“ und „2“ als Spalte am Zahlenrand. Ein Import ist wie am benachbarten Triplett 777_6 als Kombination mit 6=flexibel möglich. Dem Triplett folgt hierfür ein „Platzhalter-O_QS5+1=6_Randziffer=2“. Die Zielstellung liegt darin O-5-1_2 in 1-5-O_2 zu spiegeln, damit die O(Null) an der Protein-Ziffer „2“ liegt. Zu diesem Zweck liegt das „Intron=231 Nukleotide“ mit dem Zahlenteil „23“ links neben dem Triplett und kann die Spiegelung anfordern, um die gespiegelte Ziffer 1 für „123“ Nukleotide aufzunehmen. Bei einem Ziffertausch 0/1 ergibt sich insgesamt eine Spiegelung 15_ [1]5[0]_2, so dass die Ziffer „1“ die vordere Position für „123“ Nukleotide“ erreicht: Epi.Ref_Rhesus.Z.8075#16154398072989“4“ und Epi.Ref_Rhesus.Z.8076#16“15“23“97776“0“5“1“2. Das Protein „tRip“ von einem Gen auf dem Chromosom 14 codiert, das aus „1440“ Nukleotiden besteht.
Transfer-RNA (tRNA), Gene Nr. 1-45:
Die 45 Gen-Code-Zeilen enthalten bei maximal 20 - 21 Aminosäuren einen Überschuss, der hier als „Gen-Varianten“ behandelt wird. Eine Aminosäure und die zugeordnete Transfer-RNA zum Ribosom werden somit teilweise mehrfach codiert. Welche Aminosäuren im Kerngenom mehrfach codiert werden, ist wissenschaftlich bekannt [Statistik ist hier momentan unbekannt“]. Die Transfer-RNA (tRNA) besteht aus kurzen Ribonukleinsäuresträngen (RNA) mit Bausteinen von 73 bis 95 Nukleotiden aus einem Basen-, einem Zucker- und einem Phosphoranteil, der bei Nukleosiden fehlt. Die nur zweistellige Anzahl der Nukleotide ist als Zähleinheit zur Zeilenverbindung ungeeignet. „Im Gen-Code fehlen“ die beiden notwendigen Teilnehmer: Energie „ATP“ und die Transfer-RNA (Datenbank „Uniprot“ ohne Aussage). Im „Gen-Code“ wird die zu transportierende „Aminosäure“ (Elektronen aus Strukturformel) gesucht. Das Gen bewirkt zur tRNA-Erzeugung eine „Katalyse“ mittels spezieller „Enzyme“. Aus der Anzahl der Aminosäuren [...AS (engl. „aa“=amino acid)] einer Enzym-Kettenlänge ergibt sich die Suchgröße [Zahl], die meist in einer abweichenden Ziffernfolge vorliegt und eventuell in einer vertikalen Spalte in die Nachbarzeile zieht. Die Gen-Code-Zeilen müssen teilweise eine zeilenübergreifende Gruppe bilden, um sich selbst für einen Zweck zu definieren. Die Aminosäuren kommen im Protein nur ihrer L-Form und nicht in der D-Form vor, so dass Spiegelungen grundsätzlich möglich sind..
Das Enzym „...“-tRNA-Ligand“ erzeugt eine Esterbindung zwischen „tRNA“ und einer bestimmten „Aminosäure“. Ester bilden sich infolge einer Kondensationsreaktion zwischen einer Säure und der Hydroxylgruppe eines Alkohols, wobei Wasser freigesetzt wird [siehe: Ester - DocCheck Flexikon]. In der Datenbank enthaltene „überzählige tRNA-Ligand“ werden einer Gen-Code-Zeile als „Modifikation“ zugewiesen, weil der gleiche Zweck erfüllt wird.
Die Energie für zelluläre Prozesse wird aus dem Abbau (Hydrolyse) eines kleinen Moleküls Adenosintriphosphat (ATP) = C10H16N5O13P3=60+16+35+104+45=260E freigesetzt. Das Protein „ATP-Synthase“=551AS gewinnt Adenosintriphosphat (ATP) aus Adenosindiphosphat (ADP)= C10H15N5O10P2=60+15+35+80+30=255E in Gegenwart eines Protonengradienten über die Membran [ATP synthase subunit alpha - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Im Gen-Code wird die „ATP-Synthase“=551AS mit der Ziffer „5“ gesucht. Vergleichsweise ist ein Muskel „55“ als Struktur-5 bekannt. Die Ziffer „1“ ist ein Aktionssymbol, so dass sich QS5+5+1=11=Zählgröße ergibt. Bei einem Energie-Mangel müssen Zeilen kooperieren. Das ATP-Molekül enthält eine Kette aus 3 Phosphaten, so dass bei der Lösung der Bindung Energie freigesetzt wird. Mit ATP=551“AS“ wird hier das erzeugende ATP-Enzym für die ATP-Bindung bezeichnet. Das Molekül ATP=260“E“ ist nicht erkennbar. Interessant sind aber „260“ für den Parasiten, der einen Unterschied zwischen Erythrozyt=26 und Blut=26=Eisen darstellen müsste. Im Ergebnis der ATP-Bindung entsteht das Nukleotid „Adenosinmonophosphat (AMP)“=C10H14N5O7P=60+14+35+56+15=180E. Aufgrund der End-Null ist es im Gen-Code nicht erkennbar.
Im Gen-Code können vorhandene Nullen als Trennstellen für mögliche Interpretationen genutzt werden. Im Gegensatz kann ein Lese-Rahmen AMP-Info=“16 [ ]7“ als Form=7_[Info]_7=Form hilfreich sein, weil „#16=QS1+6=7“ immer vorhanden ist. Es existiert Glu-AMP=C12H20N4O6=6*12+20+7*4+8*6=72+20+28+48=168E, so dass die Zahl „167“ das Zentrum des Gen-Codes beleuchtet. Für die „Zahl 167“ existiert im Parasiten ein „Histidin-reiches Protein III“=167AS [Histidin-reiches Protein III - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Die Aminosäure „Histidin“ im roten Blutfarbstoff „Hämoglobin“ ist der Bindungsort für das Eisenatom im Blut=26.
Vergleichsweise kann der Mensch 8 essentielle Aminosäuren [Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan, Valin] und 2 semi-essentielle Aminosäuren [Arginin, Histidin] nicht selbst aufbauen. Sie werden aus der Nahrung gewonnen. Die tRNA liegt im Unterschied zum Parasiten in mehreren Kopien vor.
tRNA-Gen_lfd.Nr.1: „Valin – Variante 1“: Aminosäure „Valin“ (2-Aminoisovaleriansäure) =C5H11NO2=30+11+7+16=64E. Strukturell leitet sich „Valin“ durch die Substitution des alpha-Wasserstoffatom durch eine Aminogruppe (-NH2) von der Isovaleriansäure (3-Methylbuttersäure)“ = C5H10O2=30+10+16=56E ab [Valin – Wikipedia]. Das Protein „Acetyl-CoA-Sythease“=997 AS ist im biologischen Prozess für die Bildung von Vorläufermetaboliten und Energie zuständig. Dieses Protein ist in anderer Ziffernfolge 797_[441]_99 lesbar. [Acetyl-CoA-Synthetase, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Für die Energie ist ebenfalls Phosphor=15 in „16“15“0“ codiert. Darin müsste mit „1+1=2“ das ATP=260E mit einer Differenz von „5“ als ADP=255E gelesen werden. Zusätzlich zur Zahl „15“=Phosphor ergibt „QS=1+6+“1+5“+0+3+9+7+9+7+4+4+1+9+9=“75“ nochmals 5* 15 = 5* Phosphor“. Das ergibt „6“ energetisch aufgeladene Gen-Zeilen für „Valin“, davon die 1. Zeile kombiniert mit einer Vorstufe „1“6“1“5“O[=Kreis=64]. Von QS=75 muss die Zählgröße „11“ als Rechenaufgabe subtrahiert werden um 75-11=64E für Valin=64E zu erkennen. Ab der Folgezeile steht die Zahl „64“ als Serie #1“6“1“4“ zur Verfügung. Zur Auslagerung der Vorstufe steht die Ziffer 1 rechts neben der Gruppe „44.“ Valin=64E ist „hydrophob“ und kann daher von den „hydrophilen“ Cystein=64E und Threonin=64E unterschieden werden. Die Bindung zwischen der Aminosäure Valin und der speziellen Transfer-RNA „Valin-tRNA-Ligase“ wird durch eine „Aminoacyl-tRNA-Synthetase (aaRSs)“ bzw. „Aminoacyl-tRNA-Ligase“ in einer hochspezifischen Reaktion katalysiert. Im Unterschied zum Menschen kann der Parasit offensichtlich alle 20 notwendigen Aminosäuren selbst produzieren: „20“ Aminoacyl-tRNA-Synthetasen (1 x je Aminosäure) werden in zwei Klassen unterteilt. Die „aaRSs“ werden offensichtlich in speziellen Genen adressiert: „Von den „36“ „Plasmodium falciparum-aaRSs“ befinden sich 15 im Apicoplast, 16 im Zytoplasma und vier in Mitochondrien: AlaRS, GlyRS, ThrRS und CysRS befinden sich sowohl im Apicoplast als auch im Zytoplasma, und jedes der vier wird von einem einzigen Gen kodiert und in die beiden Kompartimente exportiert, während nur die Phenylalanin-Aminoacyl-Synthetase (PheRS) in den Mitochondrien kodiert wird. Die Proteintranslation von P. falciparum in den Mitochondrien hängt von 81 Enzymen ab, die aus dem Zytoplasma importiert werden, einschließlich aaRSs“; siehe [https://www.biorxiv.org/content/ 10.1101/440891v1.full.pdf; A.Bishop; Okt.2018; published in Malaria Journal doi: 10.1186/s12936-019-2665-6]. Die Google-Suche zeigt täglich unterschiedliche „Uniprot-Datensätze“ für „Valine-tRNA ligase“ an, es sind mindestens 12 Enzyme vorhanden. Als Verwendung für die Vorstufe der Halbgruppe=22 (QS der Zeilen-Nr.) ist das Enzym „Valin-tRNA Ligase“=14“22“AS [valine--tRNA ligase - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt] geeignet. Überzählige Enzyme müssen dann als Modifikationen verteilt werden. Das Enzym=507AS liegt in der Datenbank nicht mehr vor. Zur Prozesssteuerung der folgenden 4 Valin-Zeilen kann die 0(Null)-Spalte in Z.8“0“xx genutzt werden, wozu Kalium=19 in 44_QS1+9+9=19=Kalium geeignet ist. Calcium ist dann in QS3+9+7=19=Kalium_QS9+7+4=20=Calcium kombiniert mit der Gruppe 44 lesbar. Das Protein CDPK2=513AS schließt hierfür in der Ziffernfolge „15“0“3“ die Kanal-0(Null) ein [CDPK2 - Calcium-dependent protein kinase 2 - Plasmodium falciparum (isolate K1 / Thailand) | UniProtKB | UniProt]. Das Kaliumkanal-Protein (PfK2)=1653AS schließt die Kanal-0(Null) ebenfalls ein [Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. Das Kaliumkanal-Protein (PfK1)=1966AS enthält lesbar Kalium=19 und kann 66=44+“22“ darstellen, um mt Z.QS8+“0“+7+7=22 auf die Kanal-Null-Spalte hinzuweisen [Kaliumkanal K1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Um eine Oberfläche als Membran „33“ darzustellen, ist zur Folgezeile eine Membran-Spalte „3-3“ angelegt. Diese kann durch das Zinkfingerprotein 1733 AS besetzt werden mit den Ziffern „1“ und „7“ als „7“_44_“1“. Zink=30E wird aus der Spiegelung „03“ an der Membranspalte gelesen. AMP-Info=“16_[ ]_7“ mit QS=18 als Block aus 16_[QS1+5+“0“+3+9=“18“]_7 ergibt ATP=180E, wenn die Kanal-Null ergänzt wird. Das „hydrophobe“ Valin mit Wasser H2O=28=QS=10 am Zahlenrand ist als QS1+9=10_seitlich=9 lesbar: Epi.Ref_Rhesus.Z.“8“0“77“#“1“615039“7“9“7“44“1“99“.
tRNA-Gen_lfd.Nr.2: „Valin – Variante 2“: Aminosäure „Valin“= C5H11NO2=30+11+7+16=64E. Die Zahl „64“ liegt als Serie #1“6“1“42 kombiniert mit der Zählgröße vor. Die „Valin-Var. 2 bis Var. 4“ bilden zwecks Energieversorgung eine Gruppe mittels Winkelsumme=360°. Aus den 3 Kanal-Zeilen Z.“80“xx und der Dopplung Z.“80“80“ sowie den „40°“ im Code ergibt sich Winkelsumme= (4*80°)+40=360°=Kreis. Für das „hydrophobe“ Valin wäre auch ein 10°-Überschuss für das Wasseräquivalent möglich, aber „Wasser (H2O)=28“ wird direkt in der letzten Zeile Z.8080 mit seitlich=9_5_“28“_4 erfasst und am Zeilenrand entsorgt. Für die ATP-Bindung mit dem ATP-Protein=551 häufig als „155“ im Code wird die Ziffer 5 als benötigt. Es wird das Enzym „Valin-tRNA Ligase“=524AS [Valin-tRNA-Ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt] ausgewählt. In der Zeitdifferenz zur Vorzeile ist die Ziffer 5 enthalten, die auch das Zink=30 für das mit der Ziffer „3“ einbindende Zinkfingerprotein=1733AS aus der Vorzeile anzeigt: TIME.DELTA.Epi.Ref_Rhesus.Z.8077-Z.8078=“1“999306“5“083“5“. Verbunden mit der Zählgröße 11 ist die Ziffer „5“ in „9_11_6“ als QS9+6=15=Phosphor enthalten. Mit der Zahlgröße am linken Rand folgt das QS1+1=2_4 für Enzym=524AS. AMP-Info=“16_[ ]_7“ mit 16_[QS1+4+8+3+9+8=33_66] ergibt die äußere Erythrozyten-Membran „33“ und als 33+33=66 die Membran des Parasitenmembran mit der umhüllenden Blase einer Vakuolenmembran. Durch die Membranen kann der Parasit Nährstoffe nach innen über spezielle Kanäle ziehen [Tropenkrankheiten: Malariaparasit öffnet Proteintor zur Zellmanipulation - Spektrum der Wissenschaft]. Hierzu wird der Protein-Komplex PTEX=993AS verwendet [Translokonkomponente PTEX150 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Dieser Kanals zieht sich über die Membranspalte 3-3-3 ab Valin-Var.1 als Zahl 39 und muss seitlich=9 ergänzt werden. In Valin-Var.4 wird der Kanal dann mit QS4+4+[0=Kanal]_+1=9_5“39“5 zu einer Struktur-5 erhoben, die mit einem Abwehr-Medikament wegen der geschützten Lage kaum zu erreichen ist: Epi.Ref_Rhesus.Z.8078#“1“6“1“4“8“39“8667“9116“.
tRNA-Gen_lfd.Nr.3: „Valin – Variante 3“: Aminosäure „Valin“= C5H11NO2=30+11+7+16=64E. Die Zahl „64“ liegt als Serie #1“6“1“4“ kombiniert mit der Zählgröße vor. Enzym „Valin-tRNA Ligase“=628AS [valine--tRNA ligase - Plasmodium falciparum (malaria parasite P. falciparum) | UniProtKB | UniProt]. Darin kann die Zahl 62 mit 1+1=2 aus #161 gebildet werden, um über die Spalte 4-4 zur Folgezeile mit QS 4+4=8 Enzym=628 AS zu bilden. Damit ist in der Folgezeile die überschüssige Ziffer 4 in (4)44gebunden. Die ATP-Bindung=551AS in häufigen Ziffernfolge „155“ erfolgt als Zahlenteil 1_[6] QS1+4=5 für „15“, so dass mit der Spiegelung [6]5_56 die fehlende Ziffer „5“ angelagert wird als „155“. Die Zeitdifferenz in der Gruppe reduziert in Bezug auf die Membranaktivität auf das Schlüssel-Schloss-Prinzip=56, die Zählgröße=11, Kalium=19 und die Restsumme 88_4 als QS8+8+4=10=Calcium: TIME.DELTA.Epi.Ref_Rhesus.Z.8078-Z.8079= QS“1+9+9“=19_“88“_11_“56“_ QS“9+2“=11_“4“: Enzym-Modifikation „Valin-tRNA Ligase“=1241AS kombiniert die Zählgröße „11“ aus dem Schlüssel-Schloss-Prinzip QS5+6=11 mit der Membran 3_42_3 als gespiegelte Zeitbasis=24 [Valin--tRNA-Ligase - Plasmodium falciparum FCH/4 | Externe Links | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8079#“1“6“14“63998“5“6“3423.
tRNA-Gen_lfd.Nr.4: „Valin – Variante 4“: Aminosäure „Valin“= C5H11NO2=30+11+7+16=64E. Die Zahl „64“ liegt als Serie #1“6“1“4“ kombiniert mit der Zählgröße vor. Enzym „Valin-tRNA Ligase“=1447AS [valine--tRNA ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt ]. ATP=551AS als „155“ mit „ATP= 15_“39“_5“ empfangen. Die Energieversorgung zieht sich mit dem Protein-Komplex PTEX=993AS über alle Valin-Zeilen [Translokonkomponente PTEX150 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Wegen QS1+6+1+4+4+4+0=20=Calcium wird das Protein „Calcium-abhängige Proteinkinase 4“ (CDK4)=“528“AS als „Sensor und Effektor von intrazellulärem Ca2+ Konzentrationen“ lesbar codiert [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Zugleich liegt Wasser(H20)=28 für das „hydrophobe Valin“ am Zahlenrand. Enzym-Modifikation „Valin-tRNA Ligase“=1106AS zählt QS1+5=6_“0“ und am Rand „1“[6]“1“[444] die Zählgröße für Enzym=1106AS [valine--tRNA ligase - Plasmodium falciparum Tanzania (2000708) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8080#“1“6“1“4“4401“5395“28“4.
tRNA-Gen lfd.Nr.4: „Valin – Variante 4“: Aminosäure „Valin“=C5H11NO2=64E. Die Zahl 64E ist mit der Zählgröße=11 als „1“6“1“4“ kombiniert, wodurch sich zugleich mit „1+1=2“ die Ziffer „2“ für das Enzym „Valine-tRNA ligase bzw. Valyl-tRNA synthetase“=1447AS bildet [valine--tRNA ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Als Besonderheit muss die Zahl „64“ auch alternativ über die Spalte [1614“6“39“]-„4 „zur Vorzeile gebildet werden. Darin bewirkt die angelagerte Zahl „39“ eine ATP-Energie-Versorgung. Das Energiepaket „39“ wird von ATP=551AS als „155“ mit „ATP= 15_“39“_5“ empfangen. Wegen QS1+6+1+4+4+4+0=20=Calcium wird das Protein „Calcium-abhängige Proteinkinase 4“ (CDK4)=“528“AS als „Sensor und Effektor von intrazellulärem Ca2+ Konzentrationen“ lesbar codiert [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Der Mensch kann „Valin“ nicht mittels einer „Valin-tRNA Ligase“ selbst produzieren. Aber vorhandene tRNA des Menschen kann der Parasit zu einer ergänzenden Nahrungsquelle mit dem „tRNA-Importprotein (tRip)“ =402 AS verarbeiten [tRNA-Importprotein tRIP - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Hierfür ist die übergreifende Spalte „40-40“ zum Gen lfd.Nr.5: „Phenylalanin-Var.1“ geeignet, die einen Kanal „0-0“ bildet. Die Ziffer 1+1=“2“ kann aus „1“_4440_“1“ summiert werden und wird in der Folgezeile als Gruppe 44 in 4_“2“_4 markiert. „Phenylalanin“=C9H11NO2=88E / Gruppe=44 ergibt ebenfalls die Ziffer „2“.
Mensch: Der Parasiten-Komplex bildet 6 Varianten, davon 4 Valin-Varianten in lfd.Nr.1-4 sowie lfd.Nr. 7/8, was hinsichtlich der Anzahl und Trennung zweifelhaft ist. Diese Verteilung nutzt auch der Mensch, wobei zum Vorprodukt in lfd.Nr. „1“ in Z.8077 beim Menschen keine Vergleichsinformation vorliegt. Valin=64E ist als Merkmal im Protein (Mensch) „Valin-tRNA-Ligase (VARS1)“=1264AS enthalten [VARS1 - Valin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weil das Protein über 3 Zeilen von Z.8078 bis 8079 über die konstante Serie #1614 zieht. Wird die kombinierte Zählgöße 11 ignoriert. Das Protein zählt sich aus der Spalte QS6+6=12 und fügt in der Folgezeile „64“ an für 1264AS. Das Protein (Mensch) „Valin-tRNA-Ligase (VARS1)“=1093AS zählt in Z.8079/Z.8089 in der Code-Spalte „39/01“ aufsteigend 1093AS [VARS2 - Valin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Valin-tRNA-Ligase“=286AS ist in der Spalte 42/28/[6] aufsteigend als 28_QS4+2=6 für 286AS lesbar. Als Besonderheit kann das Protein doppelte gebildet werden, weil über die Ziffer 6 in der Folgezeile eine Kopplung an den nächsten AS-Komplex möglich ist. Die Modifikation Protein (Mensch) „Valin-tRNA-Ligase (VARS1_ mitochondrial)“=1063AS mit einem Bezug zum Mitochondrium gehört zu Valin-Var.5/Var.6 in Z.8084/Z.8085 [VARS2 - Valin--tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Randspalte 1541/63[6] wird nach der Ziffer „1“ die Ziffer „0“ QS1+5+4=1“0“ gewonnen. Die Ziffer „1“ kann dabei ignoriert werden, weil in der Spalte 5/6 mit QS5+6=11 eine Zählgröße vorhanden ist. Die Zahl „63“ wird ergänzt für 1063AS. Zusätzlich kann mit QS1+5+4=10 begonnen werden, aus QS6+3=9 gezählt und links die Ziffer „3“ ergänzt werden, um nochmals Protein (Mensch) „Valin-tRNA-Ligase (VARS1)“=1093AS zu bilden: Epi.Ref_Rhesus.Z.8078#“1“6“1“4“440“15“39“5“2“84“.
tRNA-Gen lfd.Nr.5: Aminosäure „Phenylalanin“=C9H11NO2=6*9+11+7+16=88E ist hydrophob und enthält einen Benzolring. Phenylalanin=88E zählt sich aus der Zeilen-Nr. Z.“8“0“8“x. Im Protein kommt nur die L-Form vor [Phenylalanin – Wikipedia]. Der Zeilencode enthält ab Gen-Zeile-Nr.1 keine Anzahl von 0(Null)-Ziffern, um über die Winkelsumme=360° Funktionspartner über mehrere Zeilen zur Energieversorgung zu finden. Als Besonderheit bietet aber die Zeilen-Nr. eine Serie Z.80xx mit einer Dopplung Z.“80“80“ in der 4. Gen-Zeile. Mit 5x 80°=400° sind bereits 40° überschüssig sind, die äquivalent mit der „hydrophoben“ Eigenschaft von „Valin“ mit 4x [Wasser(H20)=28=QS2+80=]10=“40“ beseitigt wird. Phenylalanin kann anschließend die 5. Gen-Zeile nutzen. „Phenylalanin“ wird nochmals in tRNA-Gen lfd.Nr.26 codiert. Eine funktionelle Verbindung liegt nicht vor. Die Zeitdifferenz ergibt DELTA-TIME.Epi.Ref_Rhesus.Z.8081-Z.8102=#“4“18“4“034“5“3“5“461. Darin sind die Zahlen 18+3=21 als Gruppe „4_18_4“ und Struktur „5_3_5“ markiert, so dass sich zufällig die lfd.Gen.Nr. (5 + 21)= lfd.Gen.Nr.„ 26“ als Zusammenhang ergibt. Der „Rastplatz“, Gen lfd.Nr.18, in Z.Nr. 8094 kann die Form eines Benzolrings mit 1_6=hexagonal_1_Kreis=64 im Code und als QS=1+6+1+1+“6+4“+7+6+9+5+0+7+5+2+4=“64“ weiterleiten und die Energieversorgung sichern als „5“_O_Form=7_“5“. Für die ATP-Bindung mit Energie aus ATP=551AS fehlt die Struktur-„5“ im Code. Die Quersumme ergibt nur QS1+6+1+4+2+4+0+3+7+1+7+2+8+6+2=“54“, so dass zuzüglich „1“ Aktion über eine Metallionenbindung mit dem Cofaktor „Magnesium=12E“ =54+“1“Aktion= „55“ für ATP erzeugt wird. Das bei der ATP-Bindung entstehende AMP-Info=“16[ ]7“ grenzt den Informationsgehalt „16_[142403]_7“ ab. Der Cofaktor „Magnesium=12E“ ist darin mit der Gruppe 44 kombiniert lesbar als „1“_4_“2“_4. Der in „Phenylalanin“ enthaltene Benzolring zählt sich mit der Z.Nr. „Extra=8_Ring=O_8“ und ist im Code als BiXnom-Kreis=64 mit der Zählgröße „11“ kombiniert als 1_“6“_1_“4“, wobei sich der hexagonale (6) Kohlenstoffring QS2+4=“6“_Ring=O anschließt. Magnesium=12E liegt nochmals kombiniert vor als Form=7_“1“_7_“2“. Enzym „Phenylalanin-tRNA-Ligase“=623AS [Phenylalanin-tRNA-Ligase - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt]. Um 2 Magnesium-Atome zu binden, wird das Enzym aus der Code-Mitte heraus mit der Ziffer „3“ codiert und springt dann beidseitig zu den Ziffern „2“ und „6“ als “6“14“2“40“3“717“2“8“6“ für Enzym=623AS. „Phenylalanin“ ist „hydrophob“, so dass Wasser=28_QS6+2=Extra am Zeilenrand liegt: Epi.Ref_Rhesus.Z.“8“0“8“1#1“6“14“2“40“3“717“28“62.
Malariamedikament „Chloroquin (CQ)“= C18H26ClN3=108+26+17+21=172E ist in Z.8081 als „172“ kombiniert mit dem Abbauprodukt „Hämozoin“ gespiegelt als Blutsymbol „62“ lesbar. Die Ziffer „2“ bildet dabei den Zusammenhang zum Enzym „Häm-Ligase“= 205AS, das den Parasiten gegen Angriffe schützt. „Häm-entgiftendes Enzym, das Häm in kristallines Hämozoin (Beta-Hämatin) umwandelt, um den Organismus vor den toxischen Wirkungen von Häm zu schützen“ [HDP - Häm-Ligase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt] bzw. „PfHDP“ [Erforschung von Häm- und Hämoglobin-bindenden Regionen des Plasmodium-Häm-Entgiftungsproteins für die Entdeckung neuer Malariamedikamente | Zeitschrift für Medizinische Chemie (acs.org); DOI: 10.1021/acs.jmedchem.7b00089]. Der Parasit nutzt die Randspalte 2-0, um dann seitlich QS3+2=5 als Enzym „Häm-Ligase“=205AS anzulagern. Der Parasit muss in die Folgezeile ausweichen, indem die Randzahl „20“ gezählt wird und in Z.8083 über die Spalte 0-5 die Randziffer „5“ ergänzt wird. In Z.8083 ist mit Schwerachse=“84“_09_Struktur=555_“7“_8“2“5“ offensichtlich die Polymerisation zum Hämozoin-Kristall adressiert. Chlor=17 aus Chloroquin=172E steigt über die Spalte „1-7“ auf, so dass die Ziffer „7“ zwischen der Enzym-Randziffer „5“ und dem schützenden Kristall „84_555“ blockierend eingeschoben wird, wenn die Ziffer „8“ übersprungen und die Ziffer „2“ für Chloroquin=172E gezählt wird. Die Ziffer „8“ darf übersprungen werden, weil sich das Hämozoin-Symbol=26 über die Spalte QS8+3+8+2=“21“ zur Zeile Z.8080 hochzieht und links die Zahl „5“ für QS=“26“ addiert. Rechts bildet die Schwerachse=84 den Start der Kristallation. Das Malariamedikament „Hydroxychloroquin (HCQ)"=C18H26ClN3O=108+26+17+21+8=180E beginnt ebenfalls in Zeile-Nr. Z.80“84“ und blockiert die Kristallisation, indem die Schwerachse „84“ besetzt wird. Links neben der Ziffer „1“ wird die Spalte 4-4 zu QS4+4=8 addiert und die Ziffer „0“ angelagert als „8“40“95557825“ für HCQ=180E. In Zeile Z.8083 wird die Schwerachse „84“ am linken Zahlenrand dadurch unlesbar. Die durch HCQ und CQ verhinderte Kristallisation „Arterie=9_555_Nerv=7_Vene=8_Sehnerv=2_5“ wirkt je nach Dosis und Dauer retinotoxisch (Retinopathie) [siehe: Antimalariamittel (dgrh.de)]. Wie bei einer Diabetes kommt es zu Durchblutungsstörungen der Netzhaut „555_5“.
Chloroquin (CQ) lagert sich nicht nur in der Netzhaut ein, sondern wirkt auch entzündungshemmend in den Gelenken gegen Rheuma [https://dgrh.de/Start/Publikationen/Empfehlungen/Medikation/Antimalariamittel.html]. Auge und Gelenk sind thematisch mit der Gelenkflüssigkeit „Hyaluronsäure“=C14H21O11N=84+21+88+7=200E verbunden. Hyaluronsäure ist der Hauptbestandteil der Gelenkflüssigkeit (Synovia) und ebenfalls im Gelenkknorpel enthalten. Der männliche Parasit bezieht die zur Exflagellation erforderliche Xanthurensäure=C10H7NO4=60+7+7+32=106E über den Augen- und Gelenk-Codebereich direkt aus der Zeilen-Nr. Z.7“106“. Die Xanthurensäure=106E ist kompliziert mit der Hyaluronsäure verflochten: In Zeile Z.8082 liegt die Hyaluronsäure=200E nur als Teilziffer „20“ vor, so dass ein Faktor=“10“ notwendig ist. Dieser wird als Gruppe „44“ mit der Ziffer „0(Null)“ als „404“ markiert. Durch diese Verwendung wird zugleich sekundär die Xanthurensäure=106E verfügbar als „1“_[404]_“06“. Der Parasit schützt „seine“ Xanthurensäure und somit auch die Gelenke des Menschen. Die notwendige Gruppenbildung „44“ fällt in den Wirkungsbereich des Malaria-Medikaments. Die Zählgröße „11“ klammert die Ziffer „0“ mit ein, so dass die Xanthurensäure=106E für weibliche Parasiten=“66“ nicht benötigt wird gemäß 1_“6“_1_[4040]_“6“. Die „66“ erweist sich nachfolgend als Doppelmembran „33_33“. Die Hyaluronsäure wird aus 5*40=200E als Gruppe 44 zusammengesetzt. Über eine Spalte „4040-40-40“ sind erst 4*40=160 vorhanden, so dass die Randspalte „8“ der Zeilen-Nrn. 5-fach hochgezählt wird mit 5*8=40 bis Z.“8“078=16148398“66“79“11“6. Die Zählgröße „11“ ist wieder mit „66“ kombiniert. Die Zeilen-Nr. QS8+0+8+1=17 [Chlor] spiegelt sich im Zeilen-Zähler „1“ in „7“1“7_2“ mit der Ziffer „2“ für eine 2. Variante, die QS7+1+7=15 [Phosphor] als Hilfsgröße nutzt, die ebenfalls gespiegelt in Z.8082 als Code-QS=51 vorliegt. Hierfür werden die rechten Zahlenränder bis Hyaluronsäure=200E summiert. Begonnen wird nicht mit der Randziffer „20“, sondern höher aus der Vorzeile mit der Randziffer „2“. „I“=0+3+7+1+7+2+8+6+“2“=36; „II“==“0+1+5“+3+9+5+2+8+4=37. Die Null-Spalte endet, kann aber aufgrund einer Spalten-Spiegelung 15“0“3 / „0“153 mit der Versatzgröße 15+3=“18“ als QS6+3+9=“18“ mit versetzter Null-Lage weiterhin durchgezählt werden. „III“==6+3+9+9+8+5+6+3+4+2+3=58; „IV“==8+3+9+8+6+6+7+9+1+1+6=64. Entsprechend der Zwischensumme I-IV=195 wird die fehlende Ziffer (200-195)=“5“ nachfolgend links neben der 0(Null) addiert. Das Ziel ist erreicht, weil die Gruppe 44 enthalten ist: Z.80“77“=161“5“039797“44“199. Aufgrund der Dopplung „97_97“ ist die markierte Ziffer „9“ in „797“ am Zahlenrand als Doppelpack „99“ zu lesen, so dass QS 1+99=100 den Multiplikator auf die Randziffer „2“ für 2*100=200 eine weitere Zählart bildet. Aufgrund der Dopplung 9“7“9“7“ wird außerdem Ziffer „77“ in der Zeilen-Nr. Z.80“77“ aktiviert, so dass sich im Code der Block [QS5+0+3+9+7+9=33]=Gelenkmembran (Gelenkhaut)] ergibt aus Z.80“77“=QS6+1=7_[503979]_7_44_199. Die Addition 77+33=100 ergibt auch am linken Zahlenrand eine Faktor 100 und in der Summe=200. Der Hyaluronsäure=200E wird die Gelenkhaut=33 zugeordnet.
Die Gelenkflüssigkeit kann ihre Funktion nur erfüllen, wenn die hohe Viskosität (Klebrigkeit) erhalten bleibt. Die Hyaluronsäure bindet viel Wasser (bis 6 Liter/ Gramm) und kann die Fließeigenschaften (Viskosität) der Belastung anpassen (Thixotropie) [Hyaluronsäure – rheuma-online]. Das Wasser (H2O)=28 wird zwar am Zahlenrand nicht ausgeschieden, ist aber als Gleichgewichtsgröße auch in Z.80“82“.gespiegelt lesbar. Am Zahlenrand wird die Viskosität über die Randspalte Wasser=“28“_QS6+2=“8“ /“2“0 gezählt. Die belastungsabhängige Thixotropie der Hyaluronsäure wird aufsteigend als Randspalte 2-8_4 als Wasser „28“ in Kombination mit der Schwerachse=84 kombiniert. Erneut steigt eine Wasserspalte „2-8“ auf und zieht die Gelenk-Bewegung mit Physik=63 als Spalte am Zahlenrand bis Z.8078 hoch und wird von der Zählgröße 11_6 begleitet. Über die Spalte 1-1 wird die Ziffer „2“ gezählt und in Z.8077 eine Wassergruppe QS4+4=8/Spalte 1-1=QS=2 gebildet. Im Gesamtergebnis über die „6“ Zeilen Z.7077 bis Z.8082 hat sich in der Zählgrößenserie „1_“6“_1“ die Größe „11“ doppelt und 3-fach gebildet, so dass sich eine Doppelmembran als Summen-Spalte „33_33“ durchzieht. Jede der 6 Zeilen speichert somit jeweils 1 Liter Wasser je Gramm Hyaluronsäure.
Mensch: Phenylalanin=88E muss der Mensch extern über die Nahrung aufnehmen, um es mit seiner Transfer-RNA über 3 Zeilen 8080 /Z.808“1“/Z.808“2“, so dass außer „808“ für Phenylalanin=88E in der Spalte 1-2 der Cofaktor „Magnesium=12“ codiert wird. Von 5 tRNA-Ligase-Proteinen, wird Magnesium nur zweimalig benötigt. Protein (Mensch) „Phenylalanin-tRNA-Ligase“ =490AS zählt aufsteigend in der Spalte „172/94“ „4“_“9“_QS1+7+2=1“0“ für 490AS, wobei die Ziffer „1“ ignoriert wird, weil über alle 3 Zeilen QS5+2+4=11=Zählgröße entsteht. Magnesium=12 ist somit auch als 1_Form=7_2 lesbar [Phenylalanin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Phenylalanin-tRNA-Ligase (FARSB)“ =589AS liegt rechts in der Spalte 728/32 für QS3+2=5_8_QS7+2=9, wobei die Ziffer „2“ aufsteigend zur 3. Zeile QS2+8=10 mit der Summe 2+10=12=Magnesium entsteht [FARSB - Phenylalanin-tRNA-Ligase-beta-Untereinheit - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die weiteren Proteine sind ohne Mg^2+ in Z.8080 in #“16“144“401“5“ positioniert. Protein (Mensch) „Phenylalanin-tRNA-Ligase (FARS2)“ =451AS mit „4“_QS1+4=5“ und Spalte 1/“1“ für 451AS [FARS2 - Phenylalanin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein (Mensch) „Phenylalanin-tRNA-Ligase (FARSA)“=508AS mit QS4+0+1=5 über Spalte 0/40/4 entsteht Ziffer „0“ und im Spaltenversatz QS4+4=8 bildet 508AS über 3 Zeilen. Protein (Mensch) „Phenylalanin-tRNA-Ligase (FARSA_alpha)“=508AS liest analog QS4+4=“8“ beginnt aber in Z,8080 mit der Ziffer „5“ und Spalte QS1+3=“4“ für 548AS [FARSA - Phenylalanin-tRNA-Ligase-alpha-Untereinheit - Homo sapiens (Mensch) | UniProtKB | UniProt]. Es liegen 2 Proteine „Phenylalanyl-tRNA-Synthetase“ vor: Protein (Mensch) „Phenylalanyl-tRNA-Synthetase (FARS2)=101AS liest in Z.8080 „1_[444]_01“, wobei der funktionelle Zweck einer Gruppenbildung „444“ integriert ist für 101AS [FARS2 - Phenylalanyl-tRNA-Synthetase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein (Mensch) „Phenylalanyl-tRNA-Synthetase (FARSA)=159AS erfasst alle 3 Zeilen als Spalte „1“_QS1+4=“5“_QS1+4+0+4=“9“ für 159AS [FARSA - Phenylalanyl-tRNA-Synthetase-Untereinheit alpha - Homo sapiens (Mensch) | UniProtKB | UniProt].Die Kopplung der Aminosäure mit der „tRNA“ über eine „spezielle Aminoacyl-tRNA“ ist wahrscheinlich funktionell bereits mit enthalten [siehe: Phenylalanyl-tRNA-Synthetasen - Madame Curie Bioscience Database - NCBI-Bücherregal (nih.gov); M. Safro u.a. Austin (TX): Landes Bioscience; 2000-2013]: Epi.Ref_Rhesus.Z.“8“0“8“1#1“6“14“2“40“3“717“28“62.
tRNA-Gen lfd.Nr.6: Aminosäure „Histidin“=C6H9N3O2=36+9+21+16=82E. Histidin wird mit 6 C-Atome (wie auch Arginin und Lysin) zu den basischen Aminosäuren. Die zusätzliche basische Gruppe wird durch einen „Ring“ des Amins „Imidazol“ gebildet. Imidazol=C3H4N2=18+4+14=36E [Histidin – Wikipedia]. Enzym „Histidin-tRNA-Ligase“=1132AS [Histidin--tRNA-Ligase - Plasmodium falciparum (Isolat 3D7) | Externe Links | UniProtKB | UniProt]. Histidin=82E ist in der Zeilen-Nr. Z.80“82 enthalten. Die Hexonbase enthält einen Ring-O „räumlich=4O4_6=6 C-Atome“. Für die Ringform wird der Kreis=64 mit der Zählgröße „11“ im Enzym=1132AS kombiniert als „1“6“1“4. Die Zahl „32“ steht am rechten Zahlenrand und ist zur Bildung der Ziffer 7 als QS4+3=7 erforderlich. Somit wird AMP-Info=“16[ ]7“ für eine ATP-Bindung beteiligt als 16 [14040(63)89]_QS=7_2. Imidazol=36E ist am Ring gespiegelt als „63“ enthalten. Eine Energieversorgung mit ATP=551AS wird über QS1+6+1+4+0+4+0+6+3+8+9+4+3+2=“51“ hergestellt. Die fehlende Ziffer „5“ für [5]51 wird aus den „5“ aus den „5“ vorgelagerten Valin_Var. 1-5 parasitär gewonnen. Valin=64E wird mit dem enthaltenen Kreisring=64 symbolisiert. Zur Prozesssteuerung ist Calcium=20 enthalten. Codiert wird CDPK4=528AS, womit die Beschaffung der „ATP-Ziffer-5“ für Histidin=82 gespiegelt als „28“ enthalten sind [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt].
Mensch: Histidin=82E ist in der Z.Nr. 80“82“ codiert. Das Protein (Mensch) „Histidin-tRNA-Ligase (HARS1)“=512AS liest über Spalte 1614/14 zur Vorzeile aufsteigend QS1+4=5 und fügt QS1+6+1+4=12 für 512AS [HARS1 - Histidin-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Am rechten Rand nutzt 1 Protein die Besonderheit der Randziffer „0“, wobei sich dann 2 Proteine zum weiteren Aufstieg integrieren. Die Modifikation, das Protein (Mensch) „Histidin-tRNA-Ligase (HARS1)“=509AS, beginnt in der Folgezeile über die Spalte 4320/5 aufsteigend als „5“_“0“_QS4+3+2=9 für 509AS [HARS1 - Histidine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „Histidin-tRNA-Ligase (HARS2_mitochondrial)“=509AS fügt nach der Null die Ziffer „6“ diagonal aufsteigend in der Spalte 62/20 an, weil die Diagonale 2-2 als doppelte Zählgröße 11 für 2 kombinierte Proteine für 506AS zählt [HARS2 - Histidin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein (Mensch) „Histidin-tRNA-Ligase“=362AS zählt in Z.8082 die Ziffer 3 und fügte diagonal aufsteigend in der Spalte „62“/“3“20 ´die Zahl 62 ebenfalls wegen der doppelten Zählgröße an [Histidin--tRNA-Ligase - Homo sapiens (Mensch) | Geschichte | UniProtKB | UniProt]. Protein (Mensch) „Histidyl-tRNA-Synthetase 1( HARS1)“=60AS muss die 4 Proteine in 3 Zeilen mit nur 2 Ziffern katalysieren. In der Z.Nrn.-Spalte 80“81“/808“2“/8083 entstehen QS2+8+1=11=Zählgröße und nochmals QS8+3=11 für 3 Zeilen. Die Ziffer „6“ entsteht, wenn die Ziffer „8“ 6-fach gezählt und die Ziffer „0“ in 8“0“8 angefügt wird. Weil in Z.8083 am Zahlenrand Histidin=82_5=Struktur vorhanden ist, werden in der Randspalte 2/20/25 nochmals mit 2+2+2=“6“ und der Randziffer „0“ nochmals 60AS gebildet [HARS1 - Histidyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.80“82“#“1“6“1“4“04“063894“32“0“.
tRNA-Gen lfd.Nr.7: Aminosäure „Glutamin“=C5H10N2O3=6*5+10+14+8*3=30+24+24=78E [Glutamin – Wikipedia]. Glutamin ist direkt lesbar. Enzym „Glutamin-tRNA-Ligase“=835AS [Glutamin - tRNA-Ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt]. Das Enzym=835AS ist mit der Zahlenteil „83“ in der Zeilen-Nr. enthalten, der in den Code zu „38“ als Zählgröße QS3+8=11 gespiegelt wird, Die fehlenden Ziffer „5“ umklammert die Zahl „38“ als QS 1_[Zählgröße(38)]_+4=5. Das Enzym=835AS wird durch die Ziffernfolge „1384“ übereinstimmend als QS=16=QS1+6=7=Form dargestellt. Unter der Annahme, dass Glutamin von diesem Gen tatsächlich codiert wird, ist festzustellen, dass sich eine übergreifende Gruppe mit Valin-Var. 5 bildet. Valin setzt sich mit einem aufsteigenden Zahlenteil seines Enzym Valin-tRNA-Ligase in „Glutamin“ fest, um über die Kanalspalte „0-0-0-0“ mit der vorgelagerten Valin-Gruppe kommunizieren zu können. Umgekehrt ist für Glutamin eine Enzym-Modifikation „Glutamin-tRNA-Ligase“=929AS vorhanden, die sich in der Folgezeile in Valin festsetzt [Glutamin-tRNA-Ligase - Plasmodium falciparum NF135/5.C10 | UniProtKB | UniProt]. Der Zahlenteil „92“ als 40“9“[QS 5+5+5+7+8=“30“=Zink]“2“5 wird in der Folgezeile mit der Ziffer 9 als kombinierte Zählgröße 1_QS5+4=9_1 ergänzt. Für diese ungleichartige Zeilen-Verbindung ergibt sich folgende Winkelsumme: Aus der Z.-Nr. (80°+80°) und aus dem Code (40°)=200°. Der fehlerhafte Überschuss=200°-180°(Spaltenwinkel)=20° kann abzüglich Zink=30 in ein „10°-Defizit“ verwandelt werden. Das „hydrophile“ Glutamin unterscheidet sich vom „hydrophoben“ Valin, so dass dieses Defizit zur Aufnahme von Wasser=10 erwünscht ist [Wasser=28 ist in der falschen Reihenfolge „82“ enthalten]. Die beiden Enzyme benötigen kein Zink, aber alle Zahlen werden durch Proteine besetzt. Geeignet ist das Zinkfingerprotein=1719AS, das in der Ziffernfolge „7191“ in der Spalte „7“-1 beginnt und der Folgezeile als „1“_QS5+4=“9“_“1“ fortsetzt [Zinc finger protein - Plasmodium falciparum (isolate Dd2) | UniProtKB | UniProt]. Das Protein „Glutamin-tRNA-Ligase“=835AS“ transportiert die Aminosäure „L-Glutamin“: Katalytische Aktivität: „ATP + L-Glutamin + tRNA(Gln) = AMP + Diphosphat + L-Glutaminyl-tRNA(Gln)“. Die Beladung des Enzyms wird durch eine spezielle Aminoacyl-tRNA-Syntetase für jede Aminosäure katalysiert. Ein Datensatz ist jedoch nicht zu finden. Das gesuchte Protein „L-Glutaminyl-tRNA(Gln)“ ist auch keine Eingangsgröße, sondern wird als Ergebnis selbst katalysiert. Als Datensatz vorhanden ist eine „Glutamyl-tRNA(Gln) Transferase“=826AS [Glutamyl-tRNA(Gln)-amidotransferase-Untereinheit A - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Diese bildet den rechten Zahlenrand als „82“ und addiert die Randziffer „5“ in der Spalte „5-1“ mit der Folgezeile zu QS5+1=6 für Gln-Transferase=826AS.
Mensch: Die Aminosäure „Glutamin“=C5H10N2O3=78E ist im Code Z.8083 lesbar und wird über 3 Zeilen transportiert. Das Protein (Mensch) „Glutamin-tRNA-Ligase (QARS)“=618AS liegt in Z.8081/Z.8082 im Code Spalte „614/614“ aufsteigend „61“_QS4+4=8 für 618AS [QARS - Glutamin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Glutamin-tRNA-Ligase“=775AS liegt in der Spalte QS6+1=7/QS6+1=7/QS1+4=5 für 775AS [glutamine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Biosynthese ziehen 3 Proteine jeweils einzeln über alle 3 Zeilen: Das Protein (Mensch) „Glutamyl-tRNA-Synthetase (A-735G6.3)“=313AS zählt in der Spalte 14/14/13 aufsteigend „3_1“_QS1+1=2 und addiert die Randziffer „1“ in Z.Nr.808“1“ für 313AS. Das Protein (Mensch) „Glutamyl-tRNA-Synthetase 1 (QARS1)“=173AS zählt dieselbe Spalte alternativ Ziffer „1“ und aufsteigend QS3+4=7 und Ziffer „3“ wie zuvor für 173AS. Das Protein (Mensch) „Glutamyl-tRNA-Synthetase 2 (EARS2)“=99 AS zählt die Spalte 3/6/9 als QS3+6=9_9 für 99AS: Epi.Ref_Rhesus.Z.80“83“#16“1“38“4“09555“78“25.
tRNA-Gen lfd.Nr.8: „Valin – Variante 5“: Aminosäure „Valin“=C5H11NO2=64E ist direkt lesbar. Mit den entfernten Valin-Varianten Var.1 bis Var.4 kann kommuniziert werden, wenn das Enzym eine Verbindung zur Vorzeile Gen lfd.Nr.7: „Glutamin“ herstellt, weil dort der durchgehenden Kanal 4“0“- 4“0“ endet. Für den Aufstieg wird die Spalte 1-0 genutzt, so dass das Enzym und 2 Modifikationen die Form „10xx AS“ zeigen. Enzym „Valin - tRNA-Ligase“=1094AS beginnt mit der Ziffer „1“ und wählt in der Spalte 0-1 die Ziffer „0“ und die beiden anliegenden Ziffern „9“ und „4“ [Valin-tRNA-Ligase - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt]. Die tRNA-Enzym-Modifikation =1036AS wählt zur Fortsetzung den linken Zahlenrand der Vorzeile in gespiegelter Ziffernfolge #1“6“1“3“ [valine--tRNA ligase - Plasmodium falciparum (isolate Dd2) | UniProtKB | UniProt]. Die tRNA-Enzym-Modifikation =1062AS addiert die Zählgröße 1+1=2 in #1“6“1“ [Valin--tRNA-Ligase - Plasmodium falciparum (Isolat Camp / Malaysia) | Externe Links | UniProtKB | UniProt]. ATP-Bindung=551AS häufig als „155“ ist am Zahlenrand als „15_QS4+1=5“ möglich. Im Leserahmen AMP-Info=“16[ ]7“=16_[QS1+3+6+4+1+3+2=Calcium]_QS1+6=7 wird Calcium angezeigt. Calcium ergibt sich auch aus der Zeilen-Nr. Z.QS8+0+8+4=20. Zweckdienlich ist das Protein ATPase4=1264AS, dass in der Vorzeile mit der Schwerachse QS8+4=12 beginnt und als Spalte 84/64 die Zahl „64“ ergänzt [ATPase4 - Non-SERCA-type Ca2+ -transporting P-ATPase - Plasmodium falciparum (malaria parasite P. falciparum) | Publications | UniProtKB | UniProt]. Das hydrophobe Valin zeigt das Wasser=10 als QS5+4+1=10 am Zahlenrand. Die Folgezeile enthält nochmals Valin, muss für Wasser=10 aber die Randspalte „1-6“ für die Ziffer „1“ mitzählen als QS3+6+ (1): Epi.Ref_Rhesus.Z.“8084“#161“3“64“1“3216“15“41“.
tRNA-Gen lfd.Nr.9: „Valin – Variante 6“: Aminosäure „Valin“=C5H11NO2=64E ist als 6_QS1+3=4 lesbar. Das Enzym „Valin - tRNA-Ligase“=730AS ist als „73_[Form=7]_0“ für 730AS lesbar [valine--tRNA ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt]. Aus QS4+1=5 wird die fehlende Ziffer „5“ zur ATP-Bindung=551AS gewonnen und über die Spalte 1-1 in der Vorzeile ebenfalls 4+1=5 erzeugt. Die dabei verbrauchte Ziffer „1“ steht nochmals am linken Rand als Spiegelung zur Verfügung, so dass „155“ möglich wird. Zeitdifferenz an der Schwerachse=84 für eine Spaltenverbindung enthalten als TIME.DELTA.Epi.Ref_Rhesus.Z.8084-Z.8085=“1“99“5“84“5“7905. Aufgrund der Gruppe „44“ wird die Folgezeile „Arginin-Var.1“ in die Gruppe aufgenommen, so dass sich eine Winkelsumme=80+80+80+70+20=330° ergibt. Nunmehr kann Calcium=Z.QS8+0+8+4=20 addiert werden. Es verbleibt ein Defizit=10°, dass als Wasser-Äquivalent=QS2+8=10 dem hydrophilen „Arginin“ als Wasserbedarf zugewiesen wird. Das Enzym „Valin - tRNA-Ligase“=730AS ist als „73_[Form=7]_0“ für 730AS lesbar. Alternativ kann direkt die Spalte 3-0 zum Gruppenpartner „Arginin-Var.1“ gelesen werden. Wegen der Mittelposition kann außerdem in der Valin-Vorzeile QS6+1=7 gebildet und über die Spalte 1-3 in die Zahl „30“ für Enzym=730AS gelesen werden [valine--tRNA ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt]. AMP-Info=“16[ ]7“= [QS1+3=4_44_1] thematisiert die Gruppenbildung: Epi.Ref_Rhesus.Z.“8085“#16134“41“73“7“03“636.
tRNA-Gen lfd.Nr.10: Aminosäure „Arginin-Variante 1“=C6H14N4O2=36+14+28+16=94E setzt sich am rechten Rand aus QS1+8=9 und QS2+2=4 zusammen. Die „Arginin-Varianten 2 und 3“ können aufgrund des Anteils von Salzsäure (HCl) mit Chlor=17 „Arginin·Hydrochlorid“=“C6H14N4O2“·“HCl“ und Arginin·Hydrochlorid·Hydrat= „C6H14N4O2“·“HCl“·“H2O“ zugeordnet werden [Arginin – Wikipedia]. Enzym „Arginin-tRNA-Ligase“=590AS [Arginin-tRNA-Ligase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Katalytische Aktivität: ATP + L-Arginin + tRNA (Arg) = AMP + Diphosphat + L-Arginyl-tRNA (Arg). Adenosinmonophosphat (AMP)=C10H14N5O7P=167E wird geteilt als „16“ [ ]“7“ mit [1“32“4(22“018“22“]. Die Zeile enthält keine Energie als ATP=551AS und muss diese parasitär aus der Folgezeile beziehen. Entsprechend ist das Enzym=590 AS mit der Ziffer „5“ dort verankert und steigt in der Spalte „1-5“ auf, um QS1+8=9 zu bilden. Die Ziffer „0“ wird links angelagert als Enzym=„590“AS. In der AMP-Klammer [ ] wird zu diesem Zweck eine Gruppe 44 aus 22_018_22 adressiert. Aufgrund der 6 C-Atome werden die 3 basischen Aminosäuren Arginin, Histidin und Lysin als Hexonbasen bezeichnet, die spezielle Anhänge enthalten. Adenin bindet einen Guanidinyl-Rest. Guanidin= CH5N3=6+5+21=“32“E ist in der AMP-Klammer[] enthalten. Die Energiezufuhr gegen den Zeilenlauf aus der Folgezeile benötigt den Summenwinkel=180° (Kreislauf=360° nicht erforderlich). Beide Zeilen-Nr. (Z.“80“8 und Z.“80“87) sowie 20=Calcium ergeben 80°+80°+20°=180°. Für die Prozesssteuerung bindet sich das Protein CDPK4=528AS mit der Ziffer „5“ in die Folgezeile ein und zieht in der Spalte „2-5“ hoch zum rechten Zahlenrand mit der Ziffer „8“ [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Es wird eine Chlor-Gruppe 17_44 als QS1+6+1+3+2+4=17=Chlor_[„22_22“] gebildet.
Mensch: Die Aminosäure „Arginin“=C6H14N4O2=94E ist in Z.8086 mit der Zahl „18_22“ als QS=9_QS_4 enthalten. „Arginin“ muss mit der Nahrung aufgenommen werden. „Arginin“ liegt in 3 Varianten vor, deren Trennung in lfd.Nr.10 und 29/30 zweifelhaft ist. Das Protein (Mensch) „Arginin-tRNA-Ligase (RARS2)“=219AS zählt abwärts in der Spalte zur Folgezeile 2“20“/“271“ als QS2+0=2_1_QS2+7=9 [RARS2 - Wahrscheinliche Arginin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation, das Protein (Mensch) „Arginin-tRNA-Ligase (RARS2)“=171AS, liest in der Zeile Z.8085 in der Spalte „17/220/71“ ein Spiegelung 17_0=Drehpunkt_71 und die Zahl 22 als doppelte Zählgröße oder als Halbgruppe 44/2=22, so dass die Mittelzeile übersprungen wird als „1“_[220]_“71“ für 171AS [RARS2 - Arginin--tRNA-Ligase - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Die übersprungene Zahl „22“ bildet in der Spalte eine Dopplung „72“_“72“. Weil Ornithin=C5H12N2O2=30+12+14+16=“72“ und Carbamoylphosphat=CH4NO5P=6+4+7+40+15=“72“ für die L-Arginin-Biosynthese benötigt werden, handelt es sich um diese Vorprodukte. Hierfür liegt das Protein (Mensch) „Argininosuccinat-Synthase“=295AS bereits neben dem Drehpunkt und Arginin 22_0_“1822“ und zählt dabei absteigend die Spalte „182/5“ als 2_QS1+8=9_5 für 295AS [Argininosuccinat-Synthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. In den getrennten Varianten „Arginin Var. 2/ Var.3“ in Z.8105/8106 wird dann auf die Vorprodukte gewartet: Epi.Ref_Rhesus.Z.8086#“16“1“32“4“22“018“2“2“7“8“.
tRNA-Gen lfd.Nr.11: Aminosäure „Cystein“=C3H7NO2S=6*3+7+7+16+16=64E (ausgesprochen: Cyste-ín) [Cystein – Wikipedia] wird als Besonderheit von einem Zählgrößen-Gen-Nr.“11“ codiert. Die Form „D-Cystein“ liegt bei Proteinen nicht vor. In der L-Form sind keine Spiegelungen zu erwarten. Die Zahl „64“ kann nicht allein erzeugt werden, so dass mit „61“30“=Zink“ für „6_QS1+3=4_0“ der Cofaktor „Zink=30“ benötigt wird. Das Zink muss von Enzym „Cystein-tRNA-Ligase“=677AS [Cystein--tRNA-Ligase - Plasmodium falciparum NF135/5.C10 | UniProtKB | UniProt] durch ein Signal angefordert werden. Das Signal liegt im Protein auf Position 1 -17, so dass die Funktionskette erst ab Position 18 beginnt. Zink wird mit dem Kettenstart Pos.18 + Gen-Nr.11=18+11=30=Zink aufgerufen. Das Enzym=677AS ist nicht direkt lesbar und setzt sich aus 2 Teilen zusammen „QS4+2=“6_7“_[Zählgröße 11=5+6]_QS 3+4=“7“ [am Zahlenrand]. Grundsätzlich existiert auch D-Cystein=64E, so dass der Parasit auf diesen Nährstoff nicht verzichtet, indem das Gen-Nr.“11“ in der gleichen Codezeile das Protein „Cystein-tRNA-Ligase“=593AS zusätzlich codiert, indem 2 Zahlenteile mit der Zählgröße gekoppelt werden als „59“_QS5+6=11_“3“=593AS [Cystein --tRNA-Ligase - Plasmodium falciparum (Isolat 3D7) | Publikationen | UniProtKB | UniProt]. Welches Enzym jeweils wirkt, ist durch die gemeinsam eingekoppelte Zählgröße steuerbar. Zu diesem Zweck wird das Protein „UCH54=465AS“ codiert, das die Ziffern „5+6“ enthält. Funktion: Thiolprotease, die eine Peptidbindung am C-terminalen Glycin von Ubiquitin oder NEDD8 erkennt und hydrolysiert. Katalytische Aktivität: Thiol-abhängige Hydrolyse von Ester-, Thioester-, Amid-, Peptid- und Isopeptidbindungen, die durch den C-terminalen Gly von Ubiquitin (ein „76“-Rest-Protein, das als intrazelluläres Zielsignal an Proteine gebunden ist) gebildet werden. Molekulare Funktion:“ Cystein-Typ-Deubiquitinase-Aktivität“[UCH54 - Ubiquitin carboxyl-terminal hydrolase UCH54 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Cystein-Typ „Deubiquitinase-Aktivität“: Molekulare Funktion: Definition (GO:0004843 GONUTS page) Eine Thiol-abhängige Isopeptidase-Aktivität, die „Ubiquitin“ von einem Zielprotein abspaltet, an das es konjugiert ist. PMID:30783221[ QuickGO::Term GO:0004843 (ebi.ac.uk)]. Das Protein „UCH54=465AS liegt in gespiegelter Ziffernfolge „56_4“ geteilt vor. Die Ziffer „4“ liegt am rechten Zahlenrand. Es wird mit „3_O_4“ vs. Zahlenrand „34“ ein Platzhalter-O für ein Steuersignal gebildet. Das Protein „Ubiquitin“=76 AS [Ubiquitin – Wikipedia] liegt als 7_QS“1+5“ vor [161“304“2“715“9“56“34“]. Auf den Platzhalter wird vermutlich normal die Ziffer „1“ wirken und im Sonderfall die Ziffer „5“ als Gegensatz zu 3+“5“=8=EXTRA.
Mensch: Übereinstimmend wird Cystein=C3H7NO2S=18+7+7+16+16=64E aus „6130“ mit „6“_QS1+3=“4“ gebildet, so dass Zink=30 als Cofaktor beteiligt ist, weil auch Proteine auf diesem Pfad liegen. Das Protein (Mensch) „Cystein-tRNA-Ligase (CARS1_AUTOS1)“=76AS benötigt keine Zinkbindung, weil lediglich die Vorzeile in der Spalte Z.808“6“/Z.808“7“ aufsteigend als 76AS aktiviert wird, während 3 Zink-bindende Proteine die Folgezeile beteiligen [CARS1 - Cystein-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Es stehen somit 3 Zeilen nur Verfügung. Das Protein (Mensch) „Cystein-tRNA-Ligase (CARS1)“=739AS wird aus QS6+1=“7“_Spalte “3“/QS5+1+2=“9“ mit Zinkbindung gezählt für 739AS [CARS1 - Cystein--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Cystein-tRNA-Ligase (AUTOS1)=748AS entsteht mit dem Cofaktor „Zink (Zn^2+)“ aus QS1+6=7_QS1+3=4, wobei die Ziffer „8“ in der Spalte 04/84 entweder direkt als Ziffer „8“ oder alternativ QS4+4=“8“ entsteht [CARS1 - Cystein-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Ein kreatives Protein (Mensch) „Cystein-tRNA-Ligase (CARS2)“=564AS wird mit der Teil-Zahl=56 erzeugt, indem der Cofaktor Zink=30 selbst erzeugt wird. Dazu wird eine Zink-Spalte 3/7 zur Randspalte 4/6 übersprungen. Die Randspalte enthält die Ziffer „4“ für 564AS. Zugleich bieten die Randspalte und das Protein den Kreis=64 an. Im Kreislauf wird nunmehr aus der Zinkspalte QS3+7=10 der Faktor für 3*10=30=Zink erzeugt [CARS2 - Wahrscheinliche Cystein-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Glutamat-Cystein-tRNA-Ligase (GCL)“=637AS zieht durch die Spalte 63/7 für 637AS, wobei die Ziffer „7“ gespiegelt zu Glutamat=78 gehört. Die Glutathion-Biosynthese benötigt L-Cystein und L-Glutamat. Glutathion=C10H17N3O6S=60+17+21+48+16=162E liegt in Z.8088 am linken Zahlenrand als „16 [1/1] 2“, wobei die Verbindungsspalte als Zählgröße „11“ übersprungen wird [GCLC - Glutamat-Cystein-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Cystathionin-beta-Synthase“=508AS katalysiert aus Cystein und Serin die Bildung von Wasser und Cystathionin. Serin=56 und Wasser (H2O)=28 sind lesbar [Cystathionin-beta-Synthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Spalte „3042/2843“ wird für die Ziffer „2“ die Besonderheit 84/42=2 erkannt, wobei 2*28=56=Serin. Der Cofaktor „Pyridoxalphosphat“=C8H10NO6P=48+10+7+48+15=128E ist in Z.8088#16“128“4 lesbar. Das Cystathionin=C7H14N2O4S=42+14+14+32+16=102E entnimmt das Wasser (H2O)=28=QS2+8=10 und überspringt die Gruppenspalte 4/4 aufsteigend zur Ziffer „2“ für 102E. Das Protein „Cystathionin-beta-Synthase“ bildet nunmehr die Ziffer „5“ aus der Spalte 2/3, überspringt die Gruppenspalte 4/4 in Gegenrichtung, um die Ziffer „0“ aufzunehmen und dann aus der Gruppenspalte die Ziffer QS4+4=8 zu erzeugen für 508AS. Das Protein (Mensch) „Phosphopantothenat-Cystein-Ligase (PPCS)“=311AS katalysiert den zweiten Schritt in der Biosynthese von „Coenzym A“ aus Vitamin B5, bei dem „Cystein“ an „4'-Phosphopantothenat“ konjugiert wird, um 4-Phosphopantothenoylcystein zu bilden [PPCS - Phosphopantothenat-Cystein-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Pantothensäure (Vitamin B5)=C9H17NO5=54+17+7+40=118E entsteht aufsteigend aus der Spalte 018/1. Die Ziffer „1“ liegt dabei in Z.8087 links von Coenzym A (CoA) =C21H36N7O16P3S=126+36+49+128+45+16=355E [Coenzym A. - frwiki.wiki ] gespiegelt als „553“ in „1“5“9“5“6“3“. Aufgrund der eingeschobenen Zahl „9_6“ mit 96/3=32 ist CoA unlesbar. Aus 3x“32“ kann doppelt QS3+2=5 für CoA entstehen und 1x das Enzym=311. Phosphopantothenat-Cystein-Ligase (PPCS) besetzt die Spalte „13/1“ für 311AS: Epi.Ref_Rhesus.Z.8087#1“6130“4271“59“56“3“4.
tRNA-Gen lfd.Nr.12: „Threonin–Variante-1“: Aminosäure „Threonin“=C3H7NO2=24+9+7+24=64E ist nicht direkt lesbar [Threonin – Wikipedia]. Als Funktionsgruppe ist eine Schwerachse=84 als Spalte über der Zahl 64 in der Folgezeile vorhanden. Die Folgezeile hat die 64 nochmals als QS1+6+1+2+6+4+3+8+9+2+1+9+1+7+4=64 für den Partner übrig. Am rechten Zahlenrand liegt die Spalte 6-4 vor, so dass eine Verbindung besteht. Enzym „Threonin-tRNA-Ligase“=1397AS [threonine--tRNA ligase - Plasmodium falciparum (isolate Dd2) | UniProtKB | UniProt]. Am rechten Zahlenrand ist das kleine Molekül „Ubiquitin“=76AS für die molekulare Funktion des Enzyms=1397AS codiert: Ubiquitin-ähnlicher Modifikator mit aktivierender Enzymaktivität: Definition (GO:0008641 GONUTS Seite): Katalyse der Aktivierung kleiner Proteine, wie Ubiquitin oder Ubiquitin-ähnliche Proteine, durch die Bildung einer ATP-abhängigen hochenergetischen Thiolesterbindung [QuickGO::Term GO:0008641 (ebi.ac.uk)]. Eine Ester-Gruppe enthält 2 Sauerstoffatome bei der 1 Sauerstoffatom=8 durch Schwefel=16 in 2 möglichen Varianten ersetzt wird. 2x Sauerstoff=8 aber nur 1x Schwefel=16 sind vorhanden, so dass nochmals Schwefel aus QS1+2+[8]+4=16 zählbar ist [#16“12“8“4“]. Daraus ist zu schließen, dass die Ziffer „8“ für die ATP-Bindung zuständig ist. ATP=551 kann somit zusammengesetzt werden, wenn die Ziffer „8“ in beiden Zeilen 10-fach [für 5+5=10] vorliegt. Die Zeilen-Nrn. Z.8088 und Z.8089 enthalten 5x „8“. Im Code 2x „8“ und in der Folgenzeile 1x“8“ plus „64“ mit 8x8=64 für 5x „8“ im Code. Im Prinzip ist es möglich, dass eine Zählgröße wie Ziffer 5 auf Ziffer 8 umgeschrieben werden kann. Diese Funktion erfüllt das Protein „Calcyclin-Ca^2+ bindendes Protein“=228AS [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]: Für die Zahl 22 ist eine Spalte 2-2 vorhanden. Im Code liegt die Ziffer „8“ rechts daneben und links die Ziffer „1“ für die Funktions-Umschreibung „2+2+1=5“ in „8“. AMP-Info=“16[ ]7“ schließt in 16_[QS1+2+8+4+3+2=20=Calcium]_7 zur Funktionssteuerung „Calcium=20“ ein. Weil das Enzym=1397AS auf die Ziffer „13“ reagiert; kommt das Protein CDPK2=513AS in Betracht [CDPK2 - Calcium-dependent protein kinase 2 - Plasmodium falciparum (isolate K1 / Thailand) | UniProtKB | UniProt]. Die generell fehlende Ziffer „5“ wird zur Zeilenverbindung in der Spalte 4-1 genutzt. Zuerst wird QS9+4=13 gebildet. Dann wird die Ziffer „4“ in dynamischer Lesart nochmals in der Spalte als QS4+1=5 für CDPK2 gelesen: Epi.Ref_Rhesus.Z.“8“0“88“#“16“128432“7“9418“76“.
tRNA-Gen lfd.Nr.13: „Threonin–Variante-2“: Aminosäure „Threonin“=C3H7NO2=64E ist direkt lesbar und zusätzlich als QS=64 vorhanden [Threonin – Wikipedia]. Funktionsgruppe mit Threonin–Var.1 in der Vorzeile. Am rechten Zahlenrand liegt die Spalte 6-4 vor, so dass eine Verbindung besteht. Enzym „Threonin-tRNA-Ligase“=1013AS [threonine--tRNA ligase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Katalytische Aktivität: „ATP + L-Threonin + tRNA(Thr) = AMP + Diphosphat + H + L-Threonyl-tRNA(Thr)+“. AMP-Info=“16[ ]7“ klammert in 16[12643892191]7 die Zahl QS=46=QS4+6=10 die Zahl=10 verschachtelt als Matroschka-Puppe. Die Zahl 13 muss als 3 Spalten mit QS=10 gezählt werden QS2+8=10, QS=1+9=10 und QS=6+4=10.
Mensch: Threonin muss der Mensch mit der Nahrung aufnehmen. Threonin=64E ist lesbar und nochmals als Randspalte 6/4 in Z.8088/Z.8089 vorhanden. 4 Transfer-RNA werden eingeordnet: Das Protein (Mensch) „Threonin-tRNA-Ligase (Q6ST48 • Q6ST48_HUMAN)“=443AS besetzt die Spalte 43/4 für 443AS [Threonin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Threonin-tRNA-Ligase (TARS1)“=723AS liegt gespiegelt als „327“ nur in Z.8088. Alternativ aufsteigend in der Spalte [612/612] „QS6+1=“7_2“/QS1+2=“3“ für 723AS [TARS1 - Threonine--tRNA ligase 1, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Threonin-tRNA-Ligase (TARS2, mitochodrial)“=718AS liegt aufsteigend in der Spalte „8/17“ für 718AS [TARS2 - Threonine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Threonin-tRNA-Ligase (TARS3)“=802AS liegt stellt aufgrund der Ähnlichkeit mit der Z.8088 eine Beziehung zur Vorzeile Z.8087 in Spalte 04/284 aufsteigend in der Ziffernfolge 28_0 her. Weil die Spalte ein Gruppe 44 enthält, die nochmals QS4+4=8 ergibt, wird aus der Z.Nr.“80“_2 für 2 Ziffern „88“ gelesen als 802AS. Für Ziffer „2“ ist „88“ auch als Spalte 8/8 vorhanden. Alternativ kann es sich auch um die Spalte 12“8“4/1“2“64 handeln mit 8_QS6+4=10_2, wobei die überschüssige Ziffer wegen der Zählgröße 1/1 zulässig wäre [TARS3 - Threonin-tRNA-Ligase 2, zytoplasmatisch - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. 4 Threonyl-tRNA-Synthetase werden eingeordnet: Das Protein (Mensch) „Threonyl-tRNA-Synthetase (TARS1)“=123AS steigt in der Spalte „3/12“ mit der Ziffer „3“ in die Vorzeile Z.8087 auf für 123AS [TARS1 - Threonyl-tRNA synthetase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Threonyl-tRNA-Synthetase (DKFZp667F1511)“=235AS zieht in der Spalte „13/12/12“ über 3 Zeilen und zählt ab Z.8088 „2“_aufsteigend „3“_ ringförmig zurück bis Z.8089 mit QS1+1+1+ 2=5 für 235AS [DKFZp667F1511 - Threonyl-tRNA-Synthetase - Homo sapiens | UniProtKB | UniProt].
Das Protein (Mensch) „Threonyl-tRNA-Synthetase (TARS2_mitochondrial)“=135AS liegt in der Spalte „12/12/12“ mit der Folgezeile Z.8090, so dass insgesamt 4 Zeilen zum Threonin-Komplex gehören. Ziffer „1“ in Z.8089_QS1+2=3_ aufsteigend QS2+2=4 plus Ziffer „1“ in Z.8088 =“5“ für 135AS [TARS2 - Threonyl-tRNA-Synthetase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Threonyl-tRNA-Synthetase (TARS2)“=423AS zählt in der Spalte „12/12/12“ die Reihenfolge 2+2=4_QS1+1=2_im Z,8090 QS1+2=3 für 423AS [Tars2 - Threonyl-tRNA-Synthetase 2, mitochondrial (mutmaßlich) - Mus musculus (Maus) | UniProtKB | UniProt]. Sonstige Proteine: Das Protein (Mensch) „Threonylcarbamoyl-AMP-Synthase“=279AS ist in Z.8088 lesbar [YRDC - Threonylcarbamoyl-AMP synthase - Homo sapiens (Human) | UniProtKB | UniProt]. Aufsteigend von Z.8090 lagert sich rechts das „N6-Threonylcarbamoyladenosin“=C15H20N6O8=120+20+42+64=246E, als ein seltenes Nukleosid in der tRNA an, und zwar in der Spalte „41/21/42“ in Z.8089 als „2“_absteigend „4“_aufsteigend QS2+1+4+1=“6“ für 246E [N6-Threonylcarbamoyladenosin – Wikipedia]. Katalytische Aktivität: ATP + Hydrogencarbonat + L-Threonin = Diphosphat + H2O + L-Threonylcarbamoyladenylat. Wasser=28 in Z.8088 und Hydrogencarbonat-Ion (HCO3−)=1+6+18=25 in Z.80“90“. Enthält Zahl=90 von Diphosphorsäure= H4P2O7=4+30+56=90E für Diphosphat.
Das Protein (Mensch) „N(6)-L-Threonylcarbamoyladenin-Synthase“=149AS zählt sich ebenfalls in der Spalte 41/21/42 als 149AS [OSGEP - N(6)-L-Threonylcarbamoyladenin-Synthase - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Das Protein (Mensch) „Serin/Threonin Phosphat“=659AS zählt das Serin=56 in Z.8090 aufsteigend in der Spalte „9/56“ für 659AS [SSH3 - protein-serine/threonine phosphatase - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“8“0“8“9#“16“12“64“3892191“7“4“.
tRNA-Gen lfd.Nr.14: „Tyrosin – Variante 1“: Aminosäure „Tyrosin“= C9H11NO3=6*9+11+7+8*3=96E. Tyrosin 96E ist gespiegelt als „69“ lesbar, weil es sich über die gemeinsame Spalte „6“ als 69-96 spiegelt. Die richtige Reihenfolge wird über eine Spiegelung der Zeilen-Nr. Z.“8“0“9“0 zum rechten Zahlenrand=“98“ hergestellt. Enzym „Tyrosin - tRNA-Ligase“=567AS [Tyrosin-tRNA-Ligase - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt]. Das Enzym=567AS ist zunächst mit dem Zahlenteil „56“ sichtbar. Die Ziffer „7“ ist zwar ebenfalls im Enzym des Funktionspartner in 3“7“3 AS enthalten, fehlt aber generell. Beim Funktionspartner ist das Enzym 3“7“3AS vollständig unsichtbar. Beide Partner sind in Konkurrenz, weil jeder ATP=551AS als „1_55“ besitzt. Die Partner binden sich durch gegenseitige Ziffern-Fortsätze im Funktionspartner. Vor dem sichtbaren Zahlenteil liegt die Spalte 2-5 als QS2+5=7 für ein gespiegelte Ziffernfolge „756“ als Enzym=567AS: Epi.Ref_Rhesus.Z.“8“0“9“0#“1“612444“55“425“69“8“.
tRNA-Gen lfd.Nr.15: „Tyrosin – Variante 2“: Aminosäure „Tyrosin“=96E ist direkt lesbar. Enzym „Tyrosin - tRNA-Ligase“=373AS [tyrosine--tRNA ligase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Das Enzym 373 bildet die Ziffern 3 aus einer Spiegelung QS1+2=3_QS2+1=3 zum Zahlenrand. Die beiden Funktionspartner bilden in der Spalte 2-5 die Ziffer „7“ als QS2+5=7. Die Zahl „52“ ist gesondert im gespiegelten Kreis „46“ als „4_52_6 enthalten. In den beiden Zeilen ist eine scheinbare katalytische Aktivität erkennbar, weil das Protein „Dihydroorotat-Dehydrogenase (Chinon), mitochondrial“=569AS enthalten ist. [dhod - Dihydroorotate dehydrogenase (quinone), mitochondrial - Plasmodium falciparum (malaria parasite P. falciparum) | UniProtKB | UniProt]. Das Protein=569AS ist in Z.8091 direkt lesbar und in Z.8091 gespiegelt als „596“. Für die Existenz der Katalyse der Reaktion gibt es keine Beweise (obsolet): „(S)-Dihydroorotat + O2 = H2O2 + Orotat“ [siehe: QuickGO::Term GO:0004158 (ebi.ac.uk)]. [Sauerstoff „O2“=16 am linken Zahlenrand vorhanden] +[(S)-Dihydroorotate=C5H6N2O4=6*5+6+14+32=82E (KEGG COMPOUND: C00337 (genome.jp)) vorhanden als Spiegelung „2_QS4+4=8“] = [H2O2=2+16=18 liegt über beide Zeile ausgangsseitig als Spalte „8-1“ am rechten Zahlenrand] + [Orotate=C5H3N2O4=6*5+3+14+32=79 ((S)-dihydroorotate (CHEBI:30864)) mit Ziffer „7“ über beide Zeilen in der Spalte „2-5“ als QS2+5=7_9=angelagert. Somit wird Orotate=“79“ im Gen codiert]. Orotat ist im Parasiten vorhanden [siehe: Struktur der Plasmodium falciparum orotat Phosphoribosyltransferase mit autologen inhibitorischen Protein-Protein-Interaktionen - PMC (nih.gov); S.Kumar: Mai 2015; doi: 10.1107/S2053230X1500549X].
Mensch: Tyrosin=96 liegt in Z.8090 (Nr.14)/ Z.8091(Nr.15) gespiegelt als Spalte „69/96“ vor. Vor- und Folgezeile sind zu insgesamt 4 Zeilen aktiviert. 4 Transfer-RNA werden eingeordnet: Das Protein (Mensch) „Tyrosin-tRNA-Ligase (A0A0S2Z4R1 • A0A0S2Z4R1)“=528AS bildet die Teil-Zahl „52“ in der Spalte 5/26/2 und zählt zur Folgezeile QS6+2=8 für 508E [YARS - Tyrosin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Tyrosin-tRNA-Ligase (H0YHS6 • H0YHS6)“=291AS ist in der Folgezeile Z.8092 gespiegelt als 19-QS1+1=2 lesbar. Die Randzahl QS1+1+7=9 mit der Randspalte 21/117 ergibt 291AS [YARS2 - Tyrosin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Tyrosin-tRNA-Ligase (A0A6Q8PF15 • A0A6Q8PF15)“=218AS liegt in der Randspalte „8/21“ für 218AS [YARS1 - Tyrosin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Tyrosin-tRNA-Ligase (Q9Y2Z4 • SYYM)“=477AS liegt in der Spalte 43/44/52, wobei in der Vorzeile Ziffer „4“ und absteigend QS3+4=7 und QS5+2=7 in Z.8091 liegen für 477AS [YARS2 - Tyrosin--tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. 2 Tyrosyl-tRNA-Synthetase werden eingeordnet: 2 Tyrosyl-tRNA-Synthetase werden eingeordnet: Das Protein (Mensch) „Tyrosyl-tRNA-Synthetase (YARS1)“=133AS besetzt über 4 Zeilen die Spalte „1“2/“12“/“12“/“1“2 und bildet mittig doppelt QS1+2=3, so dass sich das Protein von der Vor- oder Folgezeile ergibt zu 133AS [YARS1 - Tyrosyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | Feature-Viewer | UniProtKB | UniProt]. Das Protein (Mensch) „Tyrosyl-tRNA-Synthetase (YARS_Isoform 2)“=44AS kann alternativ in der Spalte 1“2“/1“2“/1“2“/1“2“ doppelt QS2+2=4 für 44AS lesen [YARS - Tyrosyl-tRNA-Synthetase-Isoform 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Sonstige Proteine: Das Enzym „Tyrosinhydroxylase (TYH)“ katalysiert die Umwandlung von Tyrosin in die Aminosäure „Levodopa“ bei der Biosynthese der „Katecholamine“. katalysiert. [Tyrosinhydroxylase – Wikipedia]. Die Symmetrie ist aus dem Kreuz der Spalte „4/444/4/4=räumlich“ ersichtlich. TYH liegt in der Spalte „12/12/12/12“ aufsteigend in Z.8092/8091 mit QS1+2+2=5_2_QS1+1=2_QS2+2+2+1=7 für 527AS. Alternativ bildet sich das Enzym „Tyrosinhydroxylase“ absteigend QS2+2+2=6_QS2+2+1=5 für 65AS [TH - Tyrosinhydroxylase - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Levodopa“ =C9H11NO4=54+11+7+32=104E bildet sich in der Spalte „126/124“ aus QS6+4=10 und QS2+2=4 aufgrund der Zählgröße 11 in Spalte 1/1. Weitere Proteine nutzen das Magnesium=12 in der Z.Nrn.-Spalte Z.8081/8082 als Cofaktor können aber auch alternativ das Mangan=25 zählen, wenn im Code die Randspalte 4-fach die Ziffer „#1“ mitzählt. Der Bezug zum Phosphor=15 erklärt sich aus der Spalte „554[2]/655“, in der sich die Ziffer „1“ als QS4+6=10 bildet und kombiniert die Zählgröße 5+4+2=11 bzw.6+5=11 vorliegt. Protein (Mensch) „Tyrosyl-DNA- Phosphodiesterase 1“=161AS liegt ohne Cofaktor als Serie #161 vor. „Tyrosyl-DNA- Phosphodiesterase 2“=362AS mit Cofaktoren Mg^2+ und Mn^2+ in Z.8081 in der Spalte „12/12/122“ aufsteigend QS1+1+1=“3“, absteigend QS2+2+2=“6“_“2“ für 362AS. Das Enzym (Mensch) „Sulfotransferase 1“=41AS katalysiert die Sulfatierungsreaktion von Proteintyrosinen und liegt über alle 4 Zeilen in der Spalte „1/1/12“ wobei aufsteigend QS1+2=3 plus 1=4 und Ziffer „1“ in Z.8090 für 41AS zählen [TPST1 - Tyrosylprotein-Sulfotransferase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Gemäß Beschreibung sind eine Transmembran mit 17AS als Serie #16_1 für QS16+1=17AS und eine Stammregion mit 40AS als 4*12=36 plus „04“ für 40AS vorhanden. Weiterhin sind 2 Isoformen mit 370AS und 377AS AS bei Säugetieren bekannt [Tyrosylprotein-Sulfotransferase – Wikipedia]. Enzym (Mensch) „Sulfotransferase _Isoform1“=370AS liegt neben der Schwefelserie #16 in der Spalte 1/1/12/122/120 aufsteigend in Z.8092 als QS1+2=3_0_QS1+2+2=5 aufsteigend QS1+1=2 mit Ziffer QS5+2=7 für 370AS. Enzym (Mensch) „Sulfotransferase _Isoform2“=377AS liest statt der Ziffer „0“ in der Schwefelspalte QS1+6=“7“ abschließend in Z.8089: Epi.Ref_Rhesus.Z.8091#“1“6“12“2“4“52“6“55“96“21“.
tRNA-Gen lfd.Nr.16: Aminosäure „Asparaginsäure (L-Aspartat)“= C4H7NO4=6*4+7+7+8*4=70E. Enzym „Aspartat-tRNA-Ligase“=626 AS [Aspartat - tRNA-Ligase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt].Das Enzym=626 AS ist als „6026“ lesbar. Aufgrund der Zählgröße „11“ muss zunächst die Spiegelung 16_61=QS6+1=7=Form für eine Spiegelung von „07“ als „QS1+9=10_Zählgröße=11_7“ in „Asparaginsäure“=70E beachtet werden. Katalytische Aktivität: ATP + L-Aspartat + tRNA (Asp) = AMP + Diphosphat + L-Aspartyl-tRNA (Asp). Das ATP=551AS liegt gespiegelt und geteilt bereits in der Vorzeile, um das bereits erkennbare L-Aspartat mittels einer Klammer zu binden als „1“6“1“ und „5_“26“_5“. Das Protein=626AS wird dann nachfolgend als „6 (0)26“ direkt lesbar. Weil sich das Enzym „Aspartat-tRNA-Ligase“=626 AS im Vorgang über 2 Zeilen zieht, ist die „Asparaginsäure=70 E nicht erkennbar, weil sie aus 2 Anteilen wegen der Zählgröße=11 addiert werden muss. Mit QS1+6+1+2+0=“10“ plus 2. Anteil „60“=Summe=70E=Asparaginsäure.
Das Hämoglobin wird vom Parasiten als Blut=“26“ verdaut. Das Protein „Kelch13“=260AS ist maßgeblich beteiligt und enthält die Zahl „26“ in der Ziffernfolge „026_1“ [K13 - Kelch 13 - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. In Verbindung mit der Zählgröße „11“ entsteht eine Schaltfunktion 0/1: Wenn die Ziffer „1“ in den Platzhalter-O springt, entsteht aufgrund der Leer-Stelle die Ziffernfolge Kelch13=26“0“AS. Die beseitigte Ziffer „1“ gehört andererseits zur Spalte „2-5-1“ über 3 Zeilen. Die Spalte adressiert das Malaria-Medikament „Artemisinin“=C15H22O5=90+22+40=152E, so dass Artemisinin aktiviert wird und die toxische Wirkung des „Beifuß“-Pflanzenwirkstoffs auslöst. Der Parasit kann einen 2. Platzhalter als Alternative wählen, um Kelch13=260AS über die Spalte 4-2-0 zu bilden. Die Modifikation Kelch13=726AS beginnt mit der Randziffer „7“, addiert die Zählgröße QS1+1=2 und liest die Ziffer „6“ aus Zahl „6“2 (gespiegelte „26“) [Kelch-Protein K13 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniPro]. Wird weniger Hämoglobin aufgenommen, ist das Medikament wirkungslos. Artemisinin=152E beginnt fallend in Zeile Nr.“809“0“=Ring als Spaltenziffer „2“, mit dem rechten Zahlenrand „98“, der sich als Ring-Serie Z.“809x in Zeilen-Nr. spiegelt. Artemisinin besteht aus einem Trioxan-Ringsystem [Trioxan= C3H6O3=18+6+24=48E] und einer Peroxidbrücke[-O-O-]. Für die Trioxin-Zahl „48“= 6*8=48 ist die Zahl „seitlich=9_8“ notwendig in 2 Folgezeilen mit 9_QS6+2=8 und gespiegelt QS2+6=8_“1“_9 enthalten. Die Ziffer „1“ gehört zum Artemisinin=152E, so dass sie übersprungen wird. Über die Kopplung 8_8 von Zeilennummer und Code in 3 Zeilen ist auch mit Sauerstoff=“8“eine „–O-O-„Peroxidbrücke beteiligt. Artemisinin beeinflusst das Nervensystem, weil die Herstellung des Botenstoffs „Gamma-Aminobuttersäure (GABA)“ gehemmt wird [„Hemmung der Pyridoxalkinase durch Artemisinine reguliert hemmende Neurotransmission herunter | PNAS“; H. Schindelin u.a.; Dez. 2020; https://doi.org/10.1073/pnas.2008695117]. GABA=C4H9NO2=24+9+7+16=56E wird an Nervenenden freigesetzt. GABA wird durch das Enzym (Mensch) „Glutaminsäuredecarboxylase (GAD)“ synthetisiert. GAD 2=585AS [GAD2 - Glutamate decarboxylase 2 - Homo sapiens (Human) | UniProtKB | UniProt] mit dem Cofaktor GAD1=594AS [GAD1 - Glutamat-Decarboxylase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. In Zeile Z.8089/Z.8091 beginnt GAD2 aufsteigend in der Spalte 8-5 und summiert die beiden Randzahlen in „3“(8)[9]“2“ zu 3+2=5 für GAD2=585AS, wobei der Cofaktor GAD1 mit der Ziffer „9“ übersprungen wird. GAD1=594AS in der Ziffernfolge 9-5-4 als Spalte 9-5, angelagert Ziffer „4“. GABA kann nunmehr exprimiert werden als „5_QS4+2=6_56“, doppelt, GABA=56E_56E. GAD1 und GAD2 benötigen die Cofaktor-Bindungsstelle Protein (Mensch) „Vitamin B6 / Pyridoxal-5'-phosphat (PDXP)“=296AS, um den genannten Verlauf in der Spalte (9)2/QS4+2=6 zu bestätigen [PDXP - Pyridoxal (Pyridoxine, vitamin B6) phosphatase, isoform CRA_a - Homo sapiens (Human) | UniProtKB | UniProt]. PLP/Vitamin B6“ wird durch Pyridoxalkinase (PDXK) synthetisiert. Das Malariamedikament „Artemisinin“ hemmt die Bildung von PDXK und somit von GABA=56E. PDXK(Mensch)=312AS [PDXK - Pyridoxalkinase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Vergleichsweise: PDXK(Parasit)=497AS [Pyridoxalkinase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. In Zeile Z.8090 liegt Gaba=56E zwischen der Artemisinin-Spalte „2-5-1“ und dem Zahlenrand „98“, der als Spiegelung zur Zeilennummer strukturell mit der Struktur des Medikaments in Beziehung steht und ein Hindernis bildet. Zusätzlich liegen links von „Artemisinin“ 4-fach Gaba-Spalten „5-6“ verteilt. Um das Protein PDXK(Mensch)=312AS zu beteiligen, ist die Bildung von GABA am Zahlenrand maßgeblich.
GABA entsteht in Z.8090/Z.8091 kompliziert in der Spalte 6-1(1) am Zahlenrand, indem die Ziffer „1“ zum Wert „5“ summiert wird. Neben der Ziffer „6“ wird der Zahlenrand QS 2+1=3 addiert und über die Spalte 2-1 die Zählgröße 11 als 1+1=2 zur Summe „5“ für GABA=56E addiert. Durch diesen Kunstgriff wird am Zahlenrand die Ziffer 7=Nerv ignoriert, so dass offenbar ein Botenstoff zu beteiligen ist. PDXK(Mensch)=312AS bildet die Ziffer „3“ mit QS2+1=3 analog zu GABA und geht über die Spalte 2-1 zur Zählgröße 11 in Z.8092 mit der Ziffer „1“. In „1“_9_1 wird die linke Ziffer „1“ von Artemisinin=“1“52E beansprucht. PDXK(Mensch)=312AS muss für die Ziffer „2“ verschachtelt als QS1+9+1=11=QS1+1=“2“ bilden für 31“2“AS bilden und scheitert durch die Blockade.
Mensch: Die Aminosäure „Asparaginsäure (L-Aspartat / Aspartic acid )“=C4H7NO4=24+7+7+32=70E, abgekürzt Asp oder D, ist nicht lesbar [Asparaginsäure – Wikipedia]. Achtung: Die Aminosäure „Asparagin“= C4H8N2O3=24+8+14+24=70E, abgekürzt Asn oder N, wird gesondert gebildet, so dass unterschiedliche Proteine zu beachten sind. Asparagin ist ein ungeladenes Derivat der sauren Aminosäure Asparagin. Im Code wird eine Dopplung erzeugt, die eventuell bereits Asparagin codiert. Asparagin-Proteine sind daher im direkten Vergleich von Interesse. Als Spalte zur Vorzeile trennt Gruppenspalte „4/4“ die Zahlen 20 und 60. Die Zeile enthält eine Halbierungsspalte 52/26 =2. Somit kann die Zahl 20/2=10 zu Aspartat=60+10=70 addiert werden. Zu diesem Zweck ist in der Folgezeile eine Dopplung 60_60 vorhanden. Asparaginsäure besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. Die partielle Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung fossilen Knochenmaterials – herangezogen werden. Eine Racemisierung ist die Angleichung der Konzentrationen zweier spiegelbildlicher Moleküle (Enantiomere). Die Zeitbasis „24“ in der Vorzeile liegt mit einer Null als Platzhalter „2O4“ am Zahlenrand liegt die Zählgröße 11_7=Form [Sirin,Nazan_finale Fassung_Lebensaltersschätzung aufgrund des AAR_Einfluss von Dentinkaries (uni-duesseldorf.de); Diss.2018; Uni Düsseldorf]. Bei der Biosynthese entstehen die Proteine in der L-Form (L für links), trotzdem kann die D-Form (dexter=rechts) durch Umwandlung entstehen. Aufgrund der Razemisierung können sich D-Aminosäuren in bestimmten Proteinen ansammeln. Wie bei der Exflagellation von männlichen Parasiten beim Wechsel von 37°C auf 32° im Mückendarm, sind die 37°C mathematisch bedingt. Gleichzeitig mit der Dopplung [3]60+[20/2]=10=70E liest die Evolution die komplette Dopplung „36“02“36“0, so dass die Aufteilung „36+1=37°C“ Körpertemperatur Mensch ergibt. Im Unterschied zu Proteinen die wieder ausgetauscht werden zeigen permanente Proteine eine enge Beziehung zwischen Racemisierungsgrad von Asparaginsäure und dem Proteinalter. Im BiXnom-Zeitplan des Menschen ist ein Lebensalter von mindestens 97 Jahren hinterlegt. Dieses Alter liegt in Z. 8094 am rechten Zahlenrand kombiniert mit dem Muskel=55 und der Zeitbasis=24 kombiniert („der Löffel wird abgegeben“) vor. Der Zählgröße 11 liegt am Lebenskreis=64 mit “11_64_76_“9“50“7“5“24“. Mit Lebenskreis=360°/97Alter=3,71134° könnte sich beispielsweise eine Spirale um jährlich 3,7° verkürzen. Zufällig ergibt sich bei einem 10-fach geteilten BiXnom-Keis die Körpertemperatur von 37°. Bei einem Krankenstand von 5% mit dem enthaltenen Faktor 95 ergeben sich real mindestens 97*0,95=92,15 Lebensjahre. Die Protein-Veränderung beginnt mit dem Asparagin und führt über Succinimid=C4H5NO2=24+5+7+16=52E zur Asparaginsäure (L-Asp). Succinimid=52E ist in der Vorzeile Z.8091 enthalten. Schließlich kann sich aus L-Asp durch Isomerisierung D-Iso-Asp bilden [Isoaspartate - Wikipedia]. 3 Aspartat-Transfer-RNA werden eingeordnet: Das Protein (Mensch) „Aspartat-tRNA-Ligase (DARS)“=313AS beginnt Z.8092 in der Spalte „12/11/11“ aufsteigend als QS1+2=3, teilt die Ziffer 11 für Ziffer „1“ und überträgt die andere Ziffer „1“ als QS1+1+1=3 für 313AS über 3 Zeilen [DARS - Aspartate--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Aspartat-tRNA-Ligase (DARS1)“=501AS beginnt Z.8093 aufsteigend über 3 Zeilen in der Spalte „12/120/11“ als QS1+1+1+2=5_0_1 für 501AS [DARS1 - Aspartat-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „Aspartat-tRNA-Ligase (DARS1)“=645AS beginnt in Z.8092 absteigend mit Ziffer „6“_QS0+4=4_QS1+2+2=5 für 645AS [DARS2 - Aspartate--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. {Vergleichsweise ordnet sich das Protein (Mensch) „Asparagin-tRNA-Ligase (NARS1)=548AS für das Derivat „Asparagin“ mit in Z.8091 davon seitlich rechts und aufsteigend in der Spalte „45/46/46“ mit 5_4_QS4+4=8 für 548AS ein [NARS1 - Asparagin-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt].} 2 Aspartyl-tRNA-Synthetase werden eingeordnet: Das Protein (Mensch) „Aspartyl-tRNA-Synthetase (Q9H9J7 • Q9H9J7)“=463AS zählt am linken Zahlenrand die Ziffer „#1“ als QS1+1+1+1=“4“ über alle 4 Zeilen von Z.8091 bis Z.8094, rechtsdrehend Ziffer „6“_ absteigend QS2+2=“4“ für 463AS[cDNA FLJ12692 fis, Klon NT2RM4002623, schwach ähnlich wie ASPARTYL-TRNA-SYNTHETASE - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Aspartyl-tRNA-Synthetase (Q9H9J7 • Q9H9J7)“=135AS zieht über alle 4 Zeilen in der Spalte „12/12/11/11“ in Z.8092 mit Ziffer „1“, absteigend QS1+2=3, aufsteigend QS2+1_1+1=“5“ für 135AS [DARS1 - Aspartyl-tRNA synthetase - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8092#“1612“04“60“26“19117.
tRNA-Gen lfd.Nr.17: „Serin – Variante 1“: Aminosäure „Serin“=C3H7NO3=56E [Serin – Wikipedia]. Serin=56 besetzt mit QS2+3=5_6 ebenso wie der Funktionspartner mit „5_QS2+4=6“
den rechten Zeilenrand, so dass für die hydrophile Eigenschaft das Wasser nicht am Rand hydrophob ausgeschieden werden kann. Mit „Serin-Var.2“ ergibt sich ein Spaltensummen-Defizit=180°- (60+60+50]=10°. Das Defizit=10° wird als Äquivalent mittels Wasser=“QS 1+1=2_8=H2O=28“ kompensiert. Enzym „Serin tRNA-Ligase=618AS[Serin - tRNA-Ligase, zytoplasmatisch - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Das Enzym=618AS liegt als Kombination mit der Zählgröße=11 als 1“6“1“18“ für die Subtraktion vor. Weil beide Varianten mit Serin=56E die Ziffer 5 enthalten, steht Energie als ATP=551AS zur Verfügung bzw. ist QS1+6+1+1+8+4+6+8+3+6+0+2+3+6+0=“55“. Das bei der ATP-Bindung entstehenden AMP-Info=“16[ ]7“ kann in der Zeile wegen fehlender Ziffer „7“ nicht gebildet werden. Aufgrund der Zählgrößenspalte 11-11 stehen 16_16 und 7_7 in der Folgezeile doppelt zur Verfügung. Die Information wird in der Folgezeile von beiden Ziffern „7“ als „7_[Calcium=20]_7“ markiert: Epi.Ref_Rhesus.Z.“8093“#“1“6“1“18“4683“6“0“2360“.
Malaria-Kombinationsmedikament „Riamet (Artemether/Lumefantrin)“ enthält die Wirkstoffe Artemether=C16H26O5=96+26+40=162E [Artemether – Wikipedia] und Lumefantrin= C30H32Cl3NO=180+32+51+7+8=278E [Lumefantrin – Wikipedia]. Artemether=162E ist ab der Vorzeile Z.8092 als Spalte 1-6-2 direkt lesbar. Lumefantrin kann aufgrund einer störenden Rand-Null (6)“0“ nicht in die Ziffernfolge von Artemether eindringen, die „60“ ist in der Zeile aber doppelt vorhanden. Start in der Vorzeile „2“_QS6+1=“7“ in der Spalte 1-0 ist die Null ein Platzhalter-O, um darin beidseitig QS6+0+2=8 zu addieren für Lumefantrin=278E. Über die Zahl „23“, die QS2+3=“5“ erzeugt, stehen Artemether und Lumefantrin in Kontakt. Der Mensch nimmt die beiden Wirkstoffe in der Leber mit dem Enzym „CYP3A4“=503AS im Stoffwechsel auf [CYP3A4 - Cytochrom P450 3A4 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Zahl „23“ zieht in der Spalte „0-0-3“ herunter für Enzym CYP3A4=QS2+3=“5“_QS0+0=“0“_“3“. Die Ziffer „3“ gehört in Z.8095 zur Membran „33“ (Leber). An der Spalte „00“ sind Anlagerungen als Nebenwirkung möglich.
Das Testosteron=C19H28O2=114+28+16=158E liegt in der Randspalte 7524/“85“/2“1 absteigend als 1_58 für 158E. Die Manneskraft kann noch um 1 Zeile mit Sildenafil (Viagra)= C22H30N6O4S=132+30+42+32+16=252AS absteigen zum Zeilenrand Z.8094 mit „07524“. Darin liegt die Ziffer „7“ in einer „erregten Vertikalspalte“ „“(60)2/7/2“ für QS2+7+2=11=QS=“2“_5_2 für 252E=Viagra. Die Zeitbasis „24“ ist wird am Rand tangiert, an der erregten Spalte liegt die Zeitbasis=60. Bei sexueller Erregung wird der Botenstoff „Cyclisches Guanosinmonophosphat (cGMP)“= C10H12N5O7P=60+12+35+56+15=178E ausgeschüttet. Über die Randspalte ab Z.8083 aufsteigend als „17“_QS6+0_2=“8“ für 178E, wobei die Ziffer „2“ in Viagra übergeht. Die Wirkung hält 40 min bis 4 Stunden an, bei Viagra bis 5 Stunden. Die Wirkung hält 40 min bis 4 Stunden an, bei Viagra bis 5 Stunden. In der Spalte „360/ [9]50“ sind 360_0=“3600“ Sekunden_“5“ für 5 Stunden lesbar. Ohne eine sexuelle Stimulation wirkt das Medikament nicht [Viagra: Wirkung, Kosten und Gefahren | NDR.de - Ratgeber - Gesundheit; Stand: 19.12.2019]. Testosteron ist strukturell mit biologisch weniger aktive Formen 2beta- und 6beta Hydroxytestosteron (beide C19H28O3=114+28+24=166E) verwandt.
„Artemether entfaltet seine Wirkung durch eine Wechselwirkung mit Ferriprotoporphyrin IX („Häm“) oder Eisen(II)-Ionen in der sauren Nahrungsvakuole des Parasiten, was zur Bildung von zytotoxischen Radikalspezies führt“; [Artemether - Anwendung, Wirkung, Nebenwirkungen | Gelbe Liste (gelbe-liste.de)]. Der Parasit setzt beim Abbau von Hämoglobin der Erythrozyten das für ihn selbst toxische Ferriprotoporphyrin IX („Häm“) frei, das der Parasit zu ungiftigen Hämozoin ablagern muss. Der Parasit schützt sich mit dem Enzym (Parasit) „HDP-Häm-Ligase“=205AS. Katalytische Aktivität: 2 Fe(III)-Hämatin b = Beta-Hämatin [HDP - Häm-Ligase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Der Parasit muss das Eisen=26 in Z.8091 in die stabile Kristallform 5_“26“_55 schieben, so dass die Ziffer „2“ enthalten ist. Die Ziffer „0“ in der Spalte 2-„0“ ist nur eine Teillösung. Weil die Ziffer „0“ neben der Zahl=26 als „6026“ liegt, sich aber die Zahl „602“ in Z.8093 wiederholt, wird als Besonderheit eine Diagonale QS0+0=“0“ für Ziffer „0“ zugelassen. Die Zahl „602“ enthält das Eisen=26 gespiegelt (Eisen-Treppe). Die Ziffer „5“ wird nunmehr wie analog zum Kombinationsmedikament „Riamet“ aus der Zahl „23“=QS2+3=5 für Enzym (Parasit) „HDP - Häm-Ligase=205AS gezählt. Der Parasit „Plasmodium“ wird durch die Blockade vergiftet: Epi.Ref_Rhesus.Z.“8093“#“1“6“1“18“4683“6“0“2360“.
Bei Einwirkung des Medikaments „Riamet“ wird Testosteron mit dem Enzym (Mensch) „CYP3A4“=503AS in der Wirkung verändert. Das Medikament wird bei Schwangerschaft nicht empfohlen. Das Östrogen wird als weiblich=66 definiert. Für die Weiblichkeit=66 steht eine Kombination von Zählgröße „11“ und Arterie=9 ebenfalls als Hürde „1_9_1“ zur Verfügung. Die katalytische Aktivität geht vom Protein (Mensch) „NADPH-Hämoproteinreduktase“=683AS aus [NADPH--hemoprotein reductase - Homo sapiens (Human) | UniProtKB | UniProt]. Östrogene: Estron (E1/Östron)=C18H22O2 =108+22+16=146E [in Eierstöcken]; Estradiol (E2/Östradiol)=C18H24O2=108+24+16=148E [in Plazenta und Fettgewebe]; Estriol (E3/Östriol)=C18H24O3=108+24+24=156 [Stoffwechselprodukt von Estradiol und Estron (Estriol – Wikipedia)]. Beispiel: „Östron=146E“ + Sauerstoff O2 + reduziert [NADPH-Hämoproteinreduktase=683AS] = 16alpha-Hydroxyestron= C18H22O3=108+22+24=154E [16α-Hydroxyestrone - Wikipedia]. Für NADPH-Hämoproteinreduktase (Mensch)=683AS wird analog zum Enzym (Mensch) „CYP3A4“=503AS in Z.8093 neben der Zahl „23“ die Spalte 0-0-3 zur Ziffer „3“ genutzt. Die Ziffer „0“ ist ein Platzhalter-O, um darin „6O2“ zur Ziffer „8“ zu addieren. Der Start erfolgt links in der Spalte „6-6“ mit der Ziffer „6“ in Z.8092, so dass die Zahl „66“=weiblich verwendet wird. Neben der Startziffer „6“ startet Östron=146E mit der Ziffer „1“. Die Ziffer „4“ kann nur aus der Zählgröße 11 als 1+1=2 plus 2 in Spalte „9“62/“9“11 angrenzend Ziffer „6“ als Östron=146E gelesen werden, wenn die Ziffer „9“ übersprungen wird. Funktionell wird hierfür eine Subtraktion 9-1=8 zur Vene=8 ausgeführt, so dass die Spalte „9-9“ mit Arterie=9-8=Vene einen Blutstrom auslöst. 16alpha-Hydroxyestron=154E liegt mit der Zahl „15“ als Spalte „5“9/“1“9 links daneben und muss für die Ziffer „4“die Spalten „9-9“ und „6-1 (Sauerstoff O2=16)“ überspringen. Der Zahlenrand QS2+1=3 und absteigend die Ziffer „1“ in der Zählgröße „11“ ergeben Ziffer „4“ für Protein=154AS.
tRNA-Gen lfd.Nr.18: „Serin – Variante 2“: Aminosäure „Serin“=56E [Serin – Wikipedia]. Serin=56 mit „5_QS2+4=56E“ am den rechten Zeilenrand. Für „7_QS6+9+5+0=Calcium_7“ liegt das „Calcium-abhängige Protein (CDPK1)=524 AS am rechten Zahlenrand [CDPK1 - Calcium-abhängige Proteinkinase 1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Enzym „Serin tRNA-Ligase“=537AS [Serin-tRNA-Ligase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Das Enzym=537AS kann über die Spalte 3-5 zur Vorzeile aussteigen, um in der Vorzeile den linken Zeilenrand QS1+6=7 zu binden. Dabei wird ein 11er Zahlenpaket „QS1+1+8+4+6+8+3+6+0+2=39“ gebildet, dass sich aus einem wechselseitigen Calciumkanal=20 und einen Kaliumkanal als 20+19=39 zusammensetzt, Der Kanal wird durch die Spalte „0-0“ gebildet. Der Kanal wird links von der Spalte 6-5 mit QS6+5=11=Zählgröße besetzt. Der Calciumkanal ergibt sich bei Addition der rechten Seite aus 11+2+7=20=Calcium und der Kaliumkanal aus der anliegenden Spalte 3-5 mit 11+3+5=19=Kalium. Das Calcium-abhängige Protein „ATPase4“=1264AS beginnt in der Vorzeile mit der Ziffer „1“ und geht die Spalte 11-11 herunter, um QS1+1=2_64 für Protein=1264AS zu lesen [ATPase4 - Non-SERCA-type Ca2+ -transporting P-ATPase - Plasmodium falciparum (malaria parasite P. falciparum) | Publications | UniProtKB | UniProt]. Weil Ubiquitin=76AS enthalten ist über diesen Weg auch das Protein „UCH54-Hydrolase“=465AS darstellbar, wobei die Hydrolase das Wasser benötigt [UCH54 - Ubiquitin carboxyl-terminal hydrolase UCH54 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Die Kalium-Spalte 3-5 wird vom Kaliumkanal-Protein „PfK2“=1653AS besetzt , wobei an der Spalte 11-11 begonnen wird „161“16“[QS4+7+6+9+5+0+7=38=QS3+8=11]“5“2 mit Ziffer „3“ in Spalte 5-3. [Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. Am Zahlenrand beider Zeilen stehen die Zeitbasis „60“ und „24“, so dass das Gen eine Zeitfunktion erfüllt. Es liegen mehrere Enzyme vor, die lediglich eine „alternative Interpretation“ der Zeilenverbindung darstellen, davon sind 516AS, 535AS, 536AS und 538AS ähnlich. Das Enzym=745AS zählt von links nach rechts in der Markierung 6_“47“_ 6 und bildet die Ziffer „5“ als Addition der Ziffern „1“ über die Spalte 11-11 zuzüglich Ziffer „1“ der Vorzeile am Zeilenrand. Das Enzym=466AS könnte in der Zeile „6_11_64“ lesen, muss aber zur Zeilenverbindung die Ziffer „4“ als Spalte 11-11 lesen und über die Spalte 6-6 zurücklaufen.
Mensch: Aminosäure „Serin“= C3H7NO3=56E liegt als lfd. Nr.17/18 in Z.8093/Z.8094 und integriert Vor- und Folgezeile [Serin – Wikipedia]. 5 Serin-Transfer-RNA werden eingeordnet: Das Protein (Mensch) „Serin-tRNA-Ligase (SARS2)=328AS beginnt in Z.8092 aufsteigend in der Spalte „1/1/1/1/1144“ als „QS1+1+1=“3“_QS1+1=“2“¬¬_QS4+4=“8“ für 328AS [SARS2 - Serin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Serin-tRNA-Ligase (SARS2_mitochondrial)=518AS beginnt in Z.8093 aufsteigend in der Spalte „1/1/11/1144“ als „QS 1+1+1_1+1=“5“_“1“_QS4+4=8“¬¬für 518AS [SARS2 - Serin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Serin-tRNA-Ligase (M0R2C6 • M0R2C6)=588AS beginnt aufsteigend in Z.8093 in der Spalte „236/2/8“ als QS2+3=“5“_QS6+2=“8“_“8“ für 588AS [serine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Serin-tRNA-Ligase (Q5T5C7 • Q5T5C7)=536AS beginnt in Z.8094 aufsteigend in der Spalte 5/603 als „5“_“3“_QS6+0=“6“ für 536AS. Das Protein (Mensch) „Serin-tRNA-Ligase (SARS1 / M0R2C6 • M0R2C6)=514AS zieht über alle 4 Zeilen aufsteigend ab Z.8092 in der Spalte „1/1/1/114“ als QS1+1+1+1+1=5_1_4 für 514AS. Das Protein dient mehreren wesentlichen Zwecken. In der Hauptfunktion wird die Bindung von Serin an tRNA(Ser) in einer zweistufigen Reaktion katalysiert. Serin wird zuerst durch ATP aktiviert, um Ser-AMP zu bilden, und dann auf das Akzeptorende von tRNA(Ser) übertragen. In der Nebenfunktion ist das Protein an der Bildung einer Transfer-RNA für die 21. Aminosäure „Selenocystein“ beteiligt. „Ist wahrscheinlich auch in der Lage, tRNA(Sec) mit Serin zu aminoacylatieren, um die misacylierte tRNA L-seryl-tRNA(Sec) zu bilden, die weiter in Selenocysteinyl-tRNA(Sec) umgewandelt wird.“ [SARS1 - Serine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein bindet im Zellkern an den VEGFA-Kernpromotor. Der Wachstumsfaktor VEGFA=232AS liegt in der Spalte „12/11/11“ und wendet in Z.8092 (für andere Proteine der Cofaktor Magenesium=12) als QS1+1=“2“_QS1+2=“3“_QS1+1=“2“ für 232AS [VEGF - Vaskulärer endothelialer Wachstumsfaktor A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein wird durch den Transkriptionsfaktor MYC=454AS reguliert, indem VEGFA in den Pfad von MYC einbindet [MYC - Myc-Proto-Onkogen-Protein - Homo sapiens (Mensch) | UniProtKB | UniProt. MYC ist u.a. an der Entwicklung von Stammzeilen und der Blutgefäße beteiligt. MYC beginnt aufsteigend in Z.8092 in der Spalte „1204/11[84]/11[64]/11“ als QS0+4=“4“_QS1+2+1+1=“5“_QS1+1_1+1=“4“ für 454AS. Das Protein SIRT2=389AS ist beteiligt in dem es „Magnesium 1+2“_0=“3“ addiert, mit der Ziffer „8“ aufsteigend durch die Schwerachse=“8“4 zieht und in Z.8085 endet [SIRT2 - NAD-dependent protein deacetylase sirtuin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. VEGFA bildet eine Vielzahl von Varianten, deren biologische Funktion sich nach der Interaktion mit Heparansulfat [(C26H40N2O36S5)n=156+40+14+288+80=578E richtet. Die Ziffer „5“ von Heparansulfat setzt sich aus der Z.Nr. Randspalte Z.808“2“/Z.808“3“ als QS2+3=“5“ zusammen. Damit diese Besonderheit möglich ist, wird der Cofaktor „Neuropilin“=931AS benötigt, der den Startpunkt in Z.80“93#1“ mit 931AS besetzt [DKFZp686J1169 - Neuropilin - Homo sapiens (Human) | UniProtKB | UniProt]. Sonstige Proteine: Das Protein (Mensch) „Seryl-tRNA-Synthetase (cDNA FLJ58901)=133AS beginnt in Z.8092 aufsteigend in der Spalte „1[20]/11/11/11“ als „1“_QS1_1+1=“3“_ QS1+1_1=“3“ für 133AS. Hierbei wird der Startpunkt durch den Cofaktor „Magnesium=12E“ besetzt, damit das Protein nicht alternativ absteigend zählbar ist. Das Protein (Mensch) „Seryl-tRNA-Kinase (PSTK)=348AS beginnt in Z.8092 aufsteigend in der Spalte „1204/4/4/44 als QS1+2+0=“3_“4 _QS4+4=“8“, wobei der Startpunkt durch den Cofaktor „Magnesium“=12E markiert wird [ PSTK - L-Seryl-tRNA(Sec)-Kinase - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Zeile Z.8095 schließt sich dann das Protein „O-Phosphoseryl-tRNA(Sec)“=441AS als Zwischenprodukt bei der Selenocystein-Biosynthese an als „#_[1]144“ für 441AS [SEPSECS - O-Phosphoseryl-tRNA(Sec)-Selentransferase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Selenocystein=C3H7NO2Se=18+7+7+16+34=82E ist die 21. proteinogene L-Aminosäure und ein reaktives Analogon des natürlichen L-Cysteins. Selenocystein enthält statt des Schwefelatoms ein Selenatom [Selenocystein – Wikipedia]. Aus dieser Entwicklung heraus, liegt Selenocystein=82 in Z.8095 mit „#_1144“ gespiegelt als QS1+1=2_QS4+4=8 für 82E vor oder zieht für weitere Bindungen in der „Spalte „4/42“ als QS4+4=8_2 für 82E zur Folgezeile Z.8096: Epi.Ref_Rhesus.Z.“8094“#16“11“64“769507“524“.
tRNA-Gen lfd.Nr.19: „Alanin–Variante-1“: Aminosäure „Alanin“=C3H7NO2=6*3+7+7+16=48E. Das Gen Nr.19 eröffnet eine Gen-Gruppe „44“ [Gen-Nr.19-21] als Serie „11“ über 3 Zeilen, die mit der Zahl „33“ als 33/11=3 Teilnehmer adressiert ist. Aufgrund der Gruppenbildung brauchen die folgenden Mitglieder Alanin=48 nur als QS4+8=12 nachweisen. Die Energieversorgung wird vom 3. Teilnehmer geleistet, der Zink=30 als Cofaktor und ATP=551AS als 155 mit 1_505 enthält. Die Energie kann gegen den Zeilenlauf hochgeschoben werden, weil die erforderliche Spalten-Winkelsumme=180°=10°+50° +60°+60° vorhanden ist. Katalytische Aktivität: „ATP + L-Alanin + tRNA(Ala) = AMP + Diphosphat + L-Alanyl-tRNA(Ala)“ Die Bildung von Adenosinmonophosphat (AMP)=C10H14N5O7P=6*10+14+7*5+6*7+16=167 ist aufgrund der Serie #16_7 und der vorhandenen Ziffer „7“ in der Gruppe gesichert. Das Enzym „Alanin-tRNA-Ligase“=1393AS ist unsichtbar [Alanine--tRNA ligase - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]. Mit der Zahl „33“ wird die Ziffer 3 über die Spalte 11 in eine Lesart 13 als 1. Zahlenteil der 3 Ala-tRNA-Kettenlängen umgeformt. Die Ziffer „9“ wird aus der Gruppen-Zählung „1“144“8“ entnommen als QS1+4+4=9. Nach der Verteilung der Ziffer 3 aus „33“ wird die restliche Ziffer „3“ angehängt für 1393A“ vermerkt. Über das enthaltene Signal „15“ können die beiden Gruppen kommunizieren, weil im Gen Nr. 21 für „Alanin-Var.3“ ein Signalempfänger „15“ als Platzhalter 1_O_5 codiert ist [1161“105“056]. Die Serie „11“ liegt dort in der Zeilen-Nr. Z.x11x. Alanin=48E ist unlesbar gespiegelt in 2 Spalten 8 und 4 codiert. Mehrere Aminosäuren werden aus Pyruvaten gebildet. Durch Transaminierung von Pyruvat (Reaktionspartner L-Glutaminsäure) entsteht L-Alanin (Ala) [Pyruvate – Wikipedia]. Pyruvate sind Ester und Salze der Brenztraubensäure=C3H4O3=18+4+24=46E. Die Brenztraubensäure „46“ umklammert das Endprodukt „Alanin“=48 als „4_ 48_6“. Glutaminsäure=C5H9NO4=30+9+7+32=78E ist lesbar enthalten: Epi.Ref_Rhesus.Z.8095#16“11“4“48“6“0“33“2785.
tRNA-Gen lfd. Nr.20: „Alanin–Variante-2“: Aminosäure „Alanin“=C3H7NO2=48E. Gehört zur Alanin-Gen-Gruppe Nr.19-21. Alanin=48E ist als QS4+8=12 indirekt lesbar. Enzym „Alanin-tRNA-Ligase“=1362AS [Alanin-tRNA-Ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt]. Das Enzym=1362AS liegt mit vermischter Ziffernfolge „6321“ vor. Am abgrenzbaren Zahlenrand gehört die Ziffer 7 zu AMP-Info=“16[ ]7“ [07_6321]: Epi.Ref_Rhesus.Z.8096#“16“1“12“495607“6321“.
tRNA-Gen lfd. Nr.21: „Alanin–Variante-3“: Aminosäure „Alanin“=C3H7NO2=48E. Gehört zur Alanin-Gen-Gruppe Nr.19-21. Alanin=48E ist als QS4+8=12 indirekt lesbar. Enzym „Alanin-tRNA-Ligase“=1394AS [Alanin-tRNA-Ligase - Plasmodium falciparum FCH/4 | UniProtKB | UniProt]. Das Enzym=1394AS liegt in vermischter Ziffernfolge „6321“ vor. AMP-Info=“16[ ]7“ liegt am linken Zahlenrand als „16_QS1+1+0+5=7“. Die Cofaktor-Bindestelle bindet Zink=30. Das Enzym katalysiert die Bindung von Alanin an tRNA(Ala) in einer zweistufigen Reaktion: Alanin wird zuerst durch ATP aktiviert, um Ala-AMP zu bilden, und dann auf das Akzeptorende der tRNA(Ala) übertragen. Für das Enzym=1394AS fehlt die Ziffer „4“. Der rechte Zahlenrand ist zur Zeilen-Nr. „Z.xx97#7[QS 3+6+3=12=Alanin als QS4+8=12]_O_9“ gespiegelt. Z.xx97 als Z.xxQS=16 ergibt insgesamt 4x Ziffer „1“ für die fehlende Ziffer „4“. Die Zahl „4“ ergibt sich auch aus den 4 Zink-Bindungsstellen [Pos. 996,1000,1159 und 1163]. Gemeint ist Folgendes: Die Vorzeile enthält am rechten Zahlenrand die Ziffer „1“ in einer Folge „1, 2 und 3“. Die Energie wird hochgeschoben und Ziffer „1“ in ATP=551 kommt als Signal für weitere Energielieferungen zurück. Über die gemeinsame Spalte 3-3 wird die Ziffer „3“ aufgeladen und gelangt als Ziffer „4“ in den Platzhalter-O9 als [1 fehlt]3[4]9. ATP=551AS baut sich in der Zeile als „505“ und in der Spalt als 55 auf. AMP-Info=“16[ ]7“ ist geteilt aus „1“ und „67“ enthalten, so dass die Ziffer „1“ in der Zählgröße „11“ enthalten ist. Die Ziffer „1“ muss dann in den Platzhalter „5O5“ weiterziehen, so dass dort die Ziffer „1“ steht für insgesamt [1]3[4]9 für 1394AS.
Mensch: „Alanin“=C3H7NO2=18+7+7+16=48E bildet in lfd.19/21 in den Zeilen Z.8095/Z.8097 die Ala-Varianten 1 bis 3 und bindet als 4. Zeile die Vorzeile Z.8094 ein [Alanin – Wikipedia]. Im Stoffwechsel wird L-Alanin durch Transaminierung aus dem Endprodukt der Glykolyse, dem Pyruvat (Acetylameisensäure)=C3H4O3=18+4+24=46E erzeugt. Pyruvat=46E liegt gespiegelt als „64“ in Z.8094, so dass sich Alanin=48 in der Spalte „64“[7]/[4]“48“ bildet, wobei die Klammerwerte „7+4=11“=Zählgröße ergeben. Bei der „Transaminierung“ wird die alpha-Aminogruppe einer Aminosäure auf eine alpha-Ketosäure verschoben. Diese Reaktion wird durch 2 Alanin-Aminotransferasen und das Coenzym=Pyridoxalphosphat=C8H10NO6P=48+10+7+48+15=128E katalysiert. Die Aminotransferase GPT1=496AS liegt ab Z.8093 ringförmig aufsteigend in der Spalte „118/116/11“ mit QS1+1_1+1=“4“_QS1+8=“9“_“6“ für 496AS [GPT - Alanine aminotransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Aminotransferase GPT2=523AS liegt ab Z.8093 absteigend in der Spalte „11/11/114“ als QS1+4=“5“_QS1+1=“2“_QS1+1+1=“3“ für 523AS [GPT2 - Alanine aminotransferase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. 4 Proteine „Alanin-tRNA-Ligase“ werden eingeordnet. Als Voraussetzung wird Alanin durch ATP katalysiert um Ala-AMP zu bilden. Hierfür legen sich die beiden Proteine AK1=194AS [AK1 - Adenylatkinase-Isoenzym 1 - Homo sapiens (Mensch) | UniProtKB | UniProt] und AK2=239 [AK2 - Adenylatkinase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt] links und rechts neben Alanin=48, wobei AK1 mit der Ziffer „1“ bereits am linken Zahlenrand von Z.8094 startet für AK1=194AS: „1“_QS1+6+1+1=“9“_“4“_[48=Alanin] _QS6+0+3=“9“_“3“_“2“ für AK2=239AS. Das Protein (Mensch) „Alanin-tRNA-Ligase (AARS1/A0A6Q8PHP7 • A0A6Q8PHP7)=560AS hat nur den Zweck die Vorzeile=Z.8094 in den „Alanin-Komplex“ ringförmig über die Spalte „50/33“ als „5“_QS3+3=“6“_“0“ für 560AS einzubinden [AARS1 - alanine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Alanin-tRNA-Ligase (AARS2_mitochondrial)=985AS benötigt den Cofaktor „Zink=30“ in Z.8097 aufsteigend in der Randspalte „85/321/“30“=Zink_9“ als „5“_“8“_QS3+2+1_3+0=“9“_[9=seitlich] für 589AS [AARS2 - Alanine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Alanin-tRNA-Ligase (AARS1)=968AS benötigt den Cofaktor „Zink=30“ in Z.8097 absteigend in der Randspalte „5/321/30=Zink_9“ als „9“_QS0+3_3=6_QS2+1_5=8 für 968AS [AARS1 - Alanin-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Alanin-tRNA-Ligase (AARS1/A0A6Q8PF33 • A0A6Q8PF33)=961AS ist nicht im Detail dokumentiert. Der Cofaktor „Zink=30“ ist als notwendig erkennbar in der Randspalte 321/309/92_8=Extra. Die Z.8098 soll als EXTRA=8 nicht zum Alanin-Komplex gehören, soll aber zur Bildung einer Ziffer „1“ aus der Zählgröße „9+2=11“ angerechnet werden, um das Zink unterseitig zu begrenzen. Ringförmig absteigend „9“_QS2+1=3_3=“6“_durch Zink [3]0 herunter zu QS9+2=11, so dass die Ziffer „1“ von der Zählgröße 11 in die Zink-Null als Platzhalter „3-O“ springt für 961AS. Ob dieses Protein real existiert, ist nicht bekannt. Sonstige Proteine: Das Protein (Mensch) „Alanyl-tRNA-Synthetase“=79AS muss mit nur 2 Ziffern die 4 Zeilen des Alanin-Komplexes in der Spalte „1611/11[44]/112/11[0]“ vom linken Zahlenrand Z.8094 aufsteigend und ringförmig zurück neben Gruppe „44“ in Z.8095 aktivieren, und zwar als QS1+6=“7“_Spalte QS_Spalte „1+1+1+1“ _Spalte 1_1+2_1=“9“ für 79AS [AARSD1 - Alanyl-tRNA synthetase domain containing 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Editing-Protein (AARS1)“=412AS bearbeitet falsch geladene Ala-tRNA. Zur Bereichsfindung ist der Cofaktor „Zink=30“ vorhanden und als Kontrollfunktion muss die Schwerachse=84 angesteuert werden. Durch den Platzhalter Zink „3-O“ wird eine Spalte „2/0/10[9]2[8]“ für QS2+0+2=“4“ gelegt, so dass ein Kontakt zur Randziffer 8 als Schwerachse=“84“ besteht. Die Ziffer „2“ wird nunmehr mit „9+2=11“ als Zählgröße gebildet. Die wird in die Ziffer „1“ und „1“ zerlegt. Damit entsteht die Ziffer „1“ und liegt wird QS1+0+1=“2“ für 412AS gebildet. Die Kontrollzeile Z.8098 ist eine Folgezeile, die nicht direkt zum Alanin-Komplex gehört: Epi.Ref_Rhesus.Z.8097#“16“11“0“505“6736“30“9.
tRNA-Gen lfd.Nr.22: „Leucin–Variante-1“: Aminosäure „Leucin“= C6H13NO2=36+13+7+16=72E ist in allen Varianten unsichtbar. Der Mensch kann Leucin nicht selbst herstellen, so dass auch der Parasit ein Versorgungsproblem lösen muss. Leucin-Var.1 ist vorgelagert und kann ggf. das Modell erklären. Bei einer ATP-abhängigen hochenergetischen Thiolesterbindung durch die Katalyse der Aktivierung kleiner Proteine, wie Ubiquitin=76AS, ist mit dem Austausch von „1x Sauerstoff=8 gegen 1 Schwefel=16“ verbunden [QuickGO::Term GO:0008641 (ebi.ac.uk)]. Aus diesem Missverhältnis kann ein erforderlicher „Teiler ½“ konstruiert werden. Der Teiler zeigt sich als „8[51]16_2“, wobei die Zahl „51“ zum Enzym=1451AS gehört. Wenn sich Schwefel=16 halbiert, dann muss sich auch Sauerstoff=8 zu 8/2=“4“ formal halbieren. Damit wird die Zeilen-Nr.Z.“8“_09=oben¬_“8“ als Bedeutung in eine Gruppe „44“ umgeschrieben. Die Zeilen-Nr. geht für die entfernten Gruppenmitglieder in Z.“81“1x über, so dass sich die Halbierung der Zahl „8“ wie „4“ liest. Alle Gruppenmitglieder besitzen ein Enzym=14xxAS. Für „Leucin–Variante-1“ setzt die Zahl 14 bzw. gespiegelt 41 aus dem Code zusammen, wenn die halbierte Ziffer 8/2=4 in den Platzhalter-O als 16_O_8_[51]16_2 springt. Als alternative Möglichkeit steht Wasser=H20=“28“ am rechten Zahlenrand, so dass „28/2=14“ für die Teilzahl der Enzyme 14xxAS gebildet wird. Die Gruppenmitglieder bekommen die Information über die Zeilennummer Z.811x mit QS8+1+1=10 für Wasser. Die Nullspalte mit dem Platzhalter-O springt in Zeile Z.8101 im Code um eine Stelle nach links, so dass die Ziffer „8/2=4“ ideell durchläuft. Der Teiler „½“ zeigt sich durch die Spiegelung der beiden Ränder „Z.8“O“9x vs. #_9“2“8“. Aufgrund der Spiegelung kann nunmehr das halbierte Leucin als „72/2=36“ gespiegelt als „6[2]3“ gelesen werden. Es liegen insgesamt „Leucin–Var.1 bis Var.5“ vor. An der letzten Position „tRNA-Gen lfd.Nr.38: „Leucin–Variante-5“ stimmt das Enzym=“14“81AS gespiegelt mit der Zeilen-Nr. Z.“8114“ überein. Die Besonderheit ist, dass auf QS8+1+1+4=“14“ reduziert wird, womit die Zahl wunschgemäß durchgelaufen ist.
Mensch: „Leucin“= C6H13NO2=36+13+7+16=72E bildet hier 2 Leucin-Komplexe (A und B), und zwar Leu-Var.1/“A“ in lfd. 22 (Z.8098) und Leu-Var.2/3 in lfd.Nr.34/35 (Z.8110/Z.8111/“B“), wozu auch Vor- und Folgezeilen gehören. In diesen 3 Kern-Zeilen ist das Leucin=72E nicht direkt lesbar. Der Mensch muss diese Eiweiß-bildende Aminosäure aus der Nahrung erzeugen. Leucin ist ein Energielieferant und für den Aufbau und Erhalt des Muskelgewebes wichtig. Ein Leucin-Mangel ist die Folge einer Unterversorgung mit Vitamin B6. Das Protein (Mensch) Pyridoxal (Vitamin B6)=296AS kann aufgrund seines Cofaktors „Magnesium“=12E eingeordnet werden, wobei dabei „Leucin“ erkennbar wird [PDXP - Pyridoxal (Pyridoxin, Vitamin B6) Phosphatase, Isoform CRA_a - Homo sapiens (Mensch) | UniProtKB | UniProt]. Im „Komplex Leu-A“ liegt Magnesium (Mg) in der Spalte [#16]11[0505]/10 als Summe „10+QS1+1=2 =10+2=12E=Mg, so dass „Leucin“ den linken Zeilenrand der Vorzeile Z.8097 als QS1+6=7_QS1+1=2 für 72E bildet. Das Vitamin B6 zieht durch diese Ziffern in der Spalte „11/108/6“ als QS1+1=“2“_QS1+0+8=“9“_“6“ bis zur Folgezeile für 296AS. Im „Komplex Leu-B“ sind „Leucin“ und der Cofaktor „Magnesium“ von Vitamin B6 sowohl in der Z.-Nr. als auch am rechten Zahlenrand enthalten. Somit kann das „Leucin“ aus dem Komplex Leu-A übernommen werden, um den Zusammenhang der Komplexe A+B zu erzeugen. Das Transportprotein GLUT4 kann auch im Komplex Leu-„B“ entstehen, um die Transportstrecke zu verlängern. Magnesium=12E liegt in Z.Nr. Z.81“12 und “ Leucin“ absteigend und ringförmig in der Spalte „110/111/112“ als QS „1+1_1+1_1+1_0_1“=“7“_“2“ für 72E. Das Vitamin B6 zählt in Z8109/Z.8110 links QS1+1=2_QS0+9=9 und dann aufsteigend die Ziffer „6“ bis zum Magnesium. Das Muskelgewebe wird mit der anliegenden Spalte „505/5/5“ als Muskel=55 adressiert. Alternativ liegt „Leucin“ in der Randspalte 7/1/1 für 72E. Vitamin B6=296AS nutzt die Ziffer „2“ vom Magnesium=12 und zählt dann absteigend QS4+0+1_1=6 für 296AS. Somit sind bisher die Bereiche Z.8097 bis Z.8099 und Z.8110 bis Z.8113 aktiviert. Die beiden Proteine (Mensch) „Leucyl-tRNA-Synthetase“ müssen diese Bereiche zur Proteinentwicklung darstellen. Die Zeile Z.8099 wird zunächst einzeln erfasst mit „Leucyl-tRNA-Synthetase (Komplex A/ LARS2_mitochondrial)“=70AS als #[1]QS6+1=“7“_“0“ für 70E. Gesondert Abstieg über 3 Zeilen bis Z.8096 in Spalte „112/110/1“ als QS1+1_1+1_1_2=7_0 für 70E [LARS2 - Leucyl-tRNA-Synthetase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Ergänzung zu Komplex Leu-„A“: In der Vorzeile Z.8097 ist Zink=30 enthalten, so dass es als Cofaktor direkt nutzbar ist oder zur Animation dient, den Cofaktor Zink unsichtbar an anderer Stelle 3-fach aus der Ziffer „10“ für 30E dazustellen. Beispielsweise wird der Cofaktor „Zink=30E“ vom Protein (Mensch) „Leucyl-cystinyl aminopeptidase“=1025AS verwendet. In der Zeile Z.8097 liegt aber eine Lücke zum Zink, so dass man darin die Spaltprodukte Oxytocin, Vasopressin und Angiotensin III entsprechend der Protein-Funktion suchen könnte [LNPEP - Leucyl-cystinyl aminopeptidase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein beginnt in Z.8098 absteigend in der Spalte „1105[05]/10“ als „10“_QS1+1+0=“2“_“5“ für 1025 AS. Das Protein kann sich im Protein (Mensch) „Insulinregulierter unterstützender Glukosetransporter (GLUT4)“=509AS befinden, weil die Ziffern „05“ enthalten sind und die Ziffer 9 über 9 Zeilen „1“ auf- oder absteigend als Transporter zählbar ist [SLC2A4 - Solute carrier family 2, facilitated glucose transporter member 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Mit der Dopplung „0505“ hat GLUT4 mehrere Möglichkeiten [GLUT4 – Wikipedia]. Qxytocin=9AS und Vasapressin=39AS [Vasopressin-neurophysin - Homo sapiens (Human) | UniProtKB | UniProt]verwenden das Zink=“3“0 mit der Ziffer 3 in „630“ als QS6+3=“9 AS“ bzw. als Spalte 3/630 für 39AS. ACHTUNG: Angiotensin III im Protein „Angiotensionogen“=485AS baut sich das Zink=30 indirekt aus der Ziffer „10“, indem es wegen der Kombination mit der Zählgröße 11 als „110“ über 3 Zeilen für 3*10=30E in der Spalte „6112“/1“10“[5]/“10“85“ zieht bzw. enthält auch die 3. Zeile die Zahl „10“ als QS6+1+1+2=“10“ [AGT - Angiotensinogen - Homo sapiens (Human) | UniProtKB | UniProt]. Die entfernte Lage vom „Komplex Leu-B“ wird durch das Protein (Mensch) „Leucyl-tRNA-Synthetase (Komplex A/ KIAA0028_mitochondrial)“=101AS bestätigt, weil es am Rand der beiden Kernzeilen als Spalte Z.8“10“9/Z.81“10“/Z.811“1“ auf– und absteigen kann, um 3 Zeilen zu aktivieren [KIAA0028 - Leucyl-tRNA-Synthetase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Durch die Interaktion mit dem Protein (Mensch) „Dehnungsfaktor1“=437AS werden in der Z.Nrn. Spalte „Z.8“1“09/Z.8“1“1“0/Z.8“1“1“1/Z.8“1“1“2“ 4 Zeilen erfasst und über die Ziffer „7“ QS#1+6+0=7 am Code angeschlossen [EEF1G - Elongation factor 1-gamma - Homo sapiens (Human) | UniProtKB | UniProt]. „Leucyl-tRNA-Synthetase“ interagiert mit der „Arginin-tRNA-Synthetase“. „Arginin“ ist nicht benachbart, sondern die 101AS können lediglich wegen der Zählgröße „11“ in Z.8105 mit Form=7 _9011_7=Form mit QS9+0+1=10_1 in der Arginin-Kernzeile entstehen [Leucyl-tRNA-Synthetase – Wikipedia]. Von den 8 Proteinen „Leucin-tRNA-Ligase“ entfallen auf den Komplex-Leu-„A“ 4 Proteine: Die Bereitstellung der Energie „ATP“ für wird durch das ATP-Protein=553AS in der Spalte „5“_“5“_QS1+2=“3“ organisiert für die Katalyse: ATP + L-Leucin + tRNA(Leu) = AMP + Diphosphat + L-Leucyl-tRNA(Leu). Zweckmäßig wird „Adenosinmonophosphat (AMP)“=C10H14N5O7P=60+14+35+56+15=180E als Zusammenhang in der Gesamt-Spalte „1105/851/52“ gelesen, wobei die Ziffer 0(Null) wegen der Zählgröße 11 aus 5+5=1“0“ zu gewinnen ist. Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS2_mitochondrial)=903AS zieht in Z.8097 gespiegelt ohne Cofaktor direkt durch Zink als „309“ für 903AS [LARS2 - Leucin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „Leucin-tRNA-Ligase (LARS1)=1130AS endet mit der Zahl 30 ebenfalls im Zink=30, in dem es die Zählgröße 11 in der Spalte 30/QS0+9+2=11 für 1130AS bildet [LARS1 - leucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Weiterhin endet das Protein (Mensch) „Leucin-tRNA-Ligase (B4E266 • B4E266)=233AS in der Spalte „32/3[0]“ ohne Zinkbindung im Zink=30 [leucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS2)=114AS kann alle 4 Zeilen von Z.8096 bis Z.8099 gespiegelt in der Spalte 1[0]/1[0]/11/11 absteigend als QS1+1+1+1=4_11 f0r 114AS bilden [LARS2 - leucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. 4 Proteine „Leucin-tRNA-Ligase“ im Komplex-Leu-„B“: Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS2/E9PHM2 • E9PHM2)=860AS liegt in der Z.-Nrn.-Spalte „[8]110/[8]11[1]/811[2]“ absteigend als „8“_QS1+1_1+1_1+1=“6“_“0“ für 860AS [LARS2 - Leucin--tRNA-Ligase - Homo sapiens (Mensch) | Externe Links | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS2/Q15031 • SYLM)=903AS beginnt aufsteigend am Rand der Z.-Nrn.-Spalte Z.810“9“/Z.811“0“ und zählt im Code die Randziffer „1“ als „9“_“0“_QS1+1+1=“3“ für 903AS [LARS2 - Leucin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS2/Q15031 • SYLM)=575AS zählt den rechten Zeilenrand im Code aufsteigend ab Z.8109 in der Spalte „5[8]/07/[29(1)]/4001“ als „5“_QS0+7=7_passiert Zählgröße QS2+9=11 um Randziffer „1“ zu blockieren_QS[1]_1+0+0+4=“5“ für 575AS [LARS2 - Leucin--tRNA-Ligase - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA-Ligase (LARS1/Q9P2J5 • SYLC)=1176AS zieht mit der Zahl „11“ aus der Z.-Nr. 8110 aufsteigend in der Code-Spalte „#16/6“ für „11“_QS1+6=7_6 für 1176AS [LARS1 - Leucin-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. ADP muss kein Katalyse-Ergebnis sein, sondern kann selbst zur Energieversorgung mit dem Protein (Mensch) „ATP-Synthase (ATP5MC1)=136AS verwendet werden, indem es die Z.Nrn. 8“1“09/8“11“0 mit dem Code #16 als „1“_QS1+1_1=“3“_“6“ für 136AS verbindet [ATP5MC1 - ATP synthase F(0) complex subunit C1, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Im Ergebnis der Katalyse „ATP + L-Leucin + tRNA(Leu) = AMP + Diphosphat + L-Leucyl-tRNA(Leu)“ wird AMP=180E mit der Randziffer Z.[811]“1“ zur Code-Spalte „1/160[80]“ als 1_QS1_1+6=8_0 für 180E gebildet. „Diphosphat“ kann mittels Protein (Mensch) „NME4 - Nucleoside diphosphate kinase (NME4)=195AS dargestellt werden, weil der Cofaktor „Magnesium“=12 in Z.Nr. Z81“12“ verfügbar ist. Das Protein zählt sich dann mit der Z.-Nr. Z.8“1“0“9“ und aufsteigend in der Spalte „1“0“9“/11[0]/11[1]/1[12=Magnesium] mit QS1+1_1+1_1=5 für 195AS [NME4 - Nucleoside diphosphate kinase - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“8“09“8“#1610851623109“28“.
tRNA-Gen_lfd.Nr.23: Aminosäure „Methionin – Variante 1 (codiert für Apicoplast)= C5H11NO2S=30+11+7+16+16=80E. Methionin=80E liegt in der Z.Nr.“80“99 und im Code #QS1+6+1=8_0 vor. Die schwefelhaltige Aminosäure muss der Mensch mit der Nahrung aufnehmen. Der Parasit verfügt im Kerngenom über 2 Varianten der „Methionyl-tRNA-Synthetasen“, und zwar PfMRS-API (Apicoplast)=749AS und PfMRS-cyto (Cytoplasma)=889AS. Die Kettenlänge wurde hier aus einer Skizze entnommen [siehe: Inhibition of Protein Synthesis and Malaria Parasite Development by Drug Targeting of Methionyl-tRNA Synthetases - PMC (nih.gov) ; A. Sharma u.a.; Mar 2015 doi: 10.1128/AAC.02220-13]. PfMRS-cyto)=889AS besetzt die Spalte QS7+2=“9“ /“88“ für 889AS. PfMRS-API (Apicoplast)=749AS bildet die Ziffer „4“ aus der Dopplung der Zählgrößen QS6+5=11_QS2+7+2=11 mit jeweils QS1+1=2. Die Ziffer „7“ wird rechts angefügt und links in der Spalte 65/QS4+5=9 die Ziffer 9 gebildet für 749AS. Das Organell „Apicoplast“ besitzt eine Wand aus 4 Schichten „33“. In der Z.Nr.80“99“ und im Code als Spalte 9-9 fehlt mit „99“/3=33 Schichten noch 1 Schicht „33“ als Besonderheit. Beide Zeilen sind diagonal über eine Spiegelung 8“3“5 und 5“3“8 verbunden, die mittig jeweils die Ziffer „3“ für „33“ enthält. Für 4 Schichten ist 4-fach Ziffer „7“=Form als Randspalte „7/777“ vorhanden. Die zusätzliche Schicht entsteht aus „3_5=Struktur“, indem eine Spiegelung 35_53 zur Folgezeile (Cytoplasma) für die äußere Schicht als EXTRA=8_“3“_7=Form existiert: Epi.Ref_Rhesus.Z.8099#161065“2“72“79“8“35“7.
tRNA-Gen_lfd.Nr.24: Aminosäure „Methionin – Variante 2 (codiert für Cytoplasma)= C5H11NO2S=80E. „Methionin=80E liegt im Code #QS1+6+1=“8_0“ und als Spalte „8-0“ zur Folgezeile vor. Die „Methionyl-tRNA-Synthetasen“ PfMRS-cyto (Cytoplasma)=889AS und PfMRS-API (Apicoplast)=749AS sind über Methionin – Var.1/Var.2 verknüpft. In den Z.Nrn. bildet sich die Spaltenwinkelsumme=80+100=180°, so dass sich ein Zeilenverbund ergibt. Für die Energieversorgung mit ATP=551AS (im Code üblich 155) wird nach der Ziffer „5“, die Spalte QS2+3=5 gezählt und entnimmt die Ziffer 1 aus der Zählgröße 6+5=“1“1 der Vorzeile. Methionin-Var. 1 beginnt in der Vorzeile rechts neben der Spalte 5-5 für „55“ und entnimmt die Ziffer „1“ aus der Zählgröße QS2+7+2=“1“1. Die Zeitdifferenz TIME.DELTA.Epi.Ref_Rhesus.Z.8099-Z.8100=1“988“4“60“15“80“ enthält Methionin=80E. Fumagillin=C26H34O7=156+34+56=246E „bindet über das Spiroepoxid irreversibel an eine Histidingruppe von Methionin-Aminopeptidasen (MetAP), die neu synthetisierte Proteine um die dem Start-codon entsprechende N-terminale Methioningruppe verkürzen. Da dieser Schritt für die Biosynthese funktionaler Proteine essentiell ist, sterben Organismen mit nur einem Subtyp an MetAP. Beim Menschen der zwei MetAP-Subtypen besitzt, wird die Angioneogenese gehemmt [Fumagillin – Wikipedia]. Angioneogenese bzw. Tumor-induzierte Angiogenese bezieht sich auch das mitwachsende Kapillarnetz von Tumoren. Fumagillin=246E kann sich aus beiden Zeilen in der Spalte „106/104“ mit QS1+1=2 für Ziffer „2“ bilden. Die beiden Proteine „Methionin-Aminopeptidase“ können in Z.8099 nur gemeinsam entstehen, weil für Methionin-Aminopeptidase (RAJ116)=657AS die Zahlenteile „65“ und „7“ durch die Zählgröße QS2+7+2=11 getrennt sind [Methionin-Aminopeptidase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt]. Methionin-Aminopeptidase (FCH/4)=517AS nutzt die Zählgröße „11“ als Verbindung „5-7“, indem der Brücken-Zählgröße 11 die Ziffer „1“ entnommen wird für 517AS [Methionin-Aminopeptidase - Plasmodium falciparum FCH/4 | Externe Links | UniProtKB | UniProt]. In einer der beiden Zeilen können 3 Zählgrößen [65/272/6104] und 2 Zählgrößen als Spalte [106/4; 2/81] plus 1 Spalte in den Z.Nrn.[81/101] gezählt werden.
Beim Menschen werden dieselben beiden Zeilen verwendet. Mit geschlossenen Augen würde man bereits als Wirkstoff gegen Tumore die Hyaluronsäure=C14H21O11N=84+21+88+7=200E vermuten und kann deren Einfluss theoretisch beurteilen. Protein (Mensch) „METAP1“=386AS. „Katalyse: Freisetzung von N-terminalen Aminosäuren, vorzugsweise Methionin, aus Peptiden und Arylamiden. Cofaktor: Bindet 2 zweiwertige Metallkationen pro Untereinheit. Hat eine Metallbindungsstelle mit hoher Affinität und eine Metallbindungsstelle mit geringer Affinität. Die wahre Natur des physiologischen Cofaktors ist umstritten. Das Enzym ist mit Zink-, Kobalt-, Mangan- oder zweiwertigen Eisenionen aktiv. Hat eine hohe Aktivität mit Zink; Der Zink-Cofaktor wird durch das ZNG1-Zink-Chaperon in die Region des aktiven Zentrums übertragen.“ [METAP1 - Methionin-Aminopeptidase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein (Mensch) „METAP2“=478AS [METAP2 - Methionine aminopeptidase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die beiden Proteine besetzen jeweils eine Spalte und sind durch 4 Spalten getrennt, so dass zur Verbindung Cofaktoren notwendig sind. Für METAP2=478AS wird die Zahl „78“ nicht ziffernweise, sondern kompakt als Spalte QS5+2=7/QS5+3=8 gelesen, damit die Ziffer „4“ in der richtigen Ziffernfolge links vorgelagert wird für 478AS. METAP1=386AS entsteht in der Spalte 83/6. Obere Lücke=QS7+2+7+9=25=Mangan (Mn^2+). Untere Lücke=QS8+8+1+9=26=Eisen (Fe^2+). Die Zahl „10“ wird 3-fach für Zink=30 (Zn^2+) in der Spalte 10/10 und in der Z.Nr.8“10“0 gezählt. Cobalt=27 (Co^2+) ist in der oberen Lücke direkt lesbar.
Das Protein (Mensch) ZNG1-Zink-Chaperon liegt in 3 Modifikationen als ZNG1A=ZNG1B= ZNG1C=398AS mit gleichen Kettenlängen vor [ZNG1A - Zink-regulierter GTPase-Metalloprotein-Aktivator 1A - Homo sapiens (Mensch) | UniProtKB | UniProt; ZNG1B - Zink-regulierter GTPase-Metalloprotein-Aktivator 1B - Homo sapiens (Mensch) | UniProtKB | UniProt; ZNG1C - Zink-regulierter GTPase-Metalloprotein-Aktivator 1C - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Weil sich Zink=30 aus 10+10+10=30 zusammensetzt, sind zum Transport 3 Proteine vorhanden. Das Zink kann in die Lücke transportiert, weil sich die Z.Nrn. mit Spalte 8/8 und Zahl „99“ in der Lücke als Spalte 9/9 und 88 spiegeln. „ZNG1-Zink-Chaperon“=395AS kann als Zahl in der Z.Nr. mit 3-fach Ziffer „3“ für „39“ aus „99“ und QS8+1=9 gezählt werden. Die Ziffer „5“ ergibt sich aus der Anzahl von „5“ Nullen, davon 3 in Z.8099/Z.8100 und 2 im Code in der Zinkspalte „10/10“ für 395AS. Wie wirkt die Hyaluronsäure=200E? In der Z.Nr. wird die Zahl „100“ avisiert, so dass in als Addition von 099 die Summe 199 vorliegt, die im Code um Ziffer „1“ für 200E erhöht werden muss. Dieses Ziel wird mit der Zinkspalte „10/10“ realisiert, bei der sich die fehlende Ziffer „0“ für „100/100“ für QS100+100=200 aus den folgenden beiden Spalten QS6+4=“10“ und QS5+5=“10“ zählt. Aufgrund der Verwendung der Zahl 55=Struktur kann diese nicht mehr entstehen. Der Zinktransport beruht auf der Übertragung von 99=Arterien und 88=Venen gespiegelt in die Lücke. Eine Spiegelung in dem Sinne, dass sich Gefäße funktionell vermischen, ist auf das Kapillarnetz begrenzt, dessen Wachstum im Tumor verhindert wird, wenn das zweite Protein „METAP2“=478AS zerstört wird. Die Hyaluronsäure=200E steht zum Abbau von Zellen in einem Zusammenhang mit Makrophagen.
Um Himmels willen, nein: Wieso wird das unsichtbare Zink kreiert, statt es einfach zu ignorieren? Der Mensch hat Probleme sein Protein (Mensch) „Transfer-tRNA-Methionine-Ligase (MARS1)“=900AS zu basteln und verwendet daher die Zeilen-Nr. mit Z.Nr.QS8+1=9_00 für 900AS [MARS1 - Methionine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Im Code wird die Zinkspalte “1“06“/“1“042/ [“102=Magnesium=12] vom Protein (Mensch) „Spermidin EEF1A1“=426AS mit 4-6-QS1+1=2 umkreist. Bei dieser Linksdrehung das Magnesium sekundär mit aktiviert. „Enzymaktivität möglicherweise durch Förderung der Dissoziation des Komplexes zwischen dem Enzym und seinem Produkt.“[ EEF1A1 - Elongationsfaktor 1-alpha - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation mit einer Linksdrehung mit Protein (Mensch) „Spermidin EEF1A1_alpha1“=462AS ergibt keinen Bezug zum Magnesium. Das Protein wird zur Vermehrung viraler Proteine u.a. bei Coronavirus SARS-CoV-2 benötigt [EEF1A1 - Elongationsfaktor 1-alpha 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Methionyl-tRNA-Synthetase (MetRS)=119AS verknüpft in der Protein-Biosynthese die Transfer-RNA mit dem Methionin, und zwar zur Folgezeile über die Spalte Z.QS8+1=“9“_00 / Z.8“1“0“1“ aufsteigend für 119AS [MARS1 - Methionyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation Protein (Mensch) „Methionyl-tRNA-Synthetase (MetRS)=114AS zieht weiter bis Z.8“102“, um darin Magnesium=12 mit Z.8“1“00/8“1“0“1“/8_QS1+0+2=“3“ für 114AS [MARS1 - Methionyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Modifikation Protein (Mensch) „Methionyl-tRNA-Synthetase“=427AS zählt über die 3 Zeilen die Ziffer „1“ 4-fach als Ziffer „4“, lagert die Ziffer „2“ an und findet im Code #QS1+6=7, weil die folgende „100“ zurück auf Z.8“100“ verweist [MARS - Methionyl-tRNA-Synthetase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Nach diesen Vorbereitungen kann die zweite Transfer-RNA, das Protein (Mensch) „Transfer-tRNA-Methionine-Ligase (MARS2)“=593AS, mit einem Bezug zum Mitochondrium bestimmt werden. Eine Suche in der Kombination von Z.-Nr. und Code ist nicht erfolgreich, so dass das Protein im Code von Z.8099/Z.8100 die Spalte „5/QS4+5=9_3“ für 593AS füllt [MARS2 - Methionine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Diesem Protein kann dann offensichtlich die Modifikation Protein (Mensch) „Methionyl-tRNA-Synthetase“=58AS für die Protein-Biosynthese zugeordnet werden. Das Protein erfasst die Ziffer „3“ der tRNA als Spalte „2/38“ mit QS2+3=5_8 für 58AS [MARS1 - Methionyl-tRNA synthetase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Feststellung: Falls die tRNA (Mensch) besondere Merkmale zeigt, kann sie im „tRNA-Gen-Komplex“ von „P. falciparum“ gefunden werden (dat02.05.2023). Der Mensch kann Methionin nur mit der Nahrung aufnehmen.
Mensch: Methionin=C5H11NO2S=30+11+7+16+16=80E besetzt mit seiner Kern-Zeile lfd.Nr.23 (Z.8099) und bindet Vor- und Folgezeilen ein. „Methionin“ wird vom Protein (Mensch) „Methionin Synthase“=1265AS erzeugt [MTR - Methionine synthase - Homo sapiens (Human) | UniProtKB | UniProt]. Methylcob(III)alamin (MeCbl) [Vitamin B12]= C63H91CoN13O14P=378+91+27+91+112+15=714E wird durch den Transfer einer Methylgruppe zu Homocystein=C4H9NO2S=24+9+7+16+16=72E katalysiert, wodurch enzymgebundenes cob(I)alamin=C62H89CoN13O14P=372+89+27+91+112+15=706E und Methionin=80E entstehen. Cobalamin ist der Cofaktor für die Methionin-Biosynthese. Das Protein (Mensch) „Methionin Synthase“ beginnt in Z.8097 aufsteigend in der Spalte [1]10/10/10/1065 mit QS10_1_1_0=“12“_“65“ für 1265AS, wobei aufgrund der Zählgröße „11“ die Zahl „10“ ungeteilt bleibt für 1265AS. In Z.8099 liegt der Cofaktor „Cobalamin“=706E in der Spalte [61]08/6106 als QS1+6=“7“_“0“_“6“, so dass Methionin als QS8+0=8_0 für 80E entsteht. 2 Proteine „Methionin-tRNA-Ligase: Protein (Mensch) „Methionin-tRNA-Ligase (MARS1)“=900AS [MARS1 - Methionine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Katalytische Aktivität: „ATP + L-Methionin + tRNA(Met) = AMP + Diphosphat + L-Methionyl-tRNA(Met)“. Das Protein läuft absteigend über 2 Zeilen Z.8099/Z.8100 in einer Null-Spalte [1]“0“[6] / [1]_“0“_QS4+5=“9“ für 900AS. Zusätzlich ist eine Spiegelung aufsteigend in Z.8097/Z.8098 möglich, und zwar mit QS1+6+1+1=“9“_“0“/[1]“0“[8] möglich. Aufgrund der Zählgröße „11“ ist der Null-Versatz zur Null-Spalte zulässig. Die Verlängerung der Nullspalte „102“ enthält QS1+0=1_2= Magnesium=12, das bei höherer Konzentration die Enzymaktivität erhöht. )“. Die Enzymaktivität wird weiterhin durch Spermidin, EEF1A1=462AS, erhöht [EEF1A1 - Elongationsfaktor 1-alpha - Homo sapiens (Mensch) | UniProtKB | UniProt ]. EEF1A1 umgrenzt die Nullspalte in “1[0]6/1[0]4“ mit „4“_“6“_QS1+1=2 für 462AS. ATP ist aufgrund der Spalte 5/5/5/5 vorhanden und AMP=180E liegt in der Spalte 110/108. Diphosphat“ kann mittels Protein (Mensch) „NME4 - Nucleoside diphosphate kinase (NME4)=195AS wird in Z.8099/Z.8100 absteigend in der Spalte [106]“5“/“1“_QS0+4+5=“9“, wobei der Cofaktor „Magnesium (Mg)“=12 in Z.8101 in der Spaltenverlängerung „102“ vorhanden ist, so dass „Diphosphat“ mit der Endziffer „5“ alternativ gespiegelt neben Mg enden kann. Das Protein (Mensch) „Methionin-tRNA-Ligase (MARS1_mitochondrial)“=539AS [MARS2 - Methionin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt] liegt absteigend in Z.8100 in der Spalte 27[27]/53 als „5“_“3“_QS2+7=“9“ für 539AS. 3 Proteine „Methionin-tRNA-Synthetase: Das Protein (Mensch) „Methionin-tRNA-Synthetase 1 (0YI94 • H0YI94)=119AS aktiviert alle 4 Zeilen von Z.8097 bis Z.8100 in der Spalte [6]“11“/“61“/[6]“1“/[6]“1“ als „11“_QS6+1_1_1=“9“ für 119 AS [MARS1 - Methionyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Methionin-tRNA-Synthetase 1 (H0YIC2 • H0YIC2)=58AS aktiviert denselben Bereich, in dem die Ziffer „1“ 5-fach gezählt wird und in Z.8098 an der Nullspalte die Ziffer 0“8“ ergänzt wird für 58AS [MARS1 - Methionyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Methionin-tRNA-Synthetase 1 (H0YIC2 • H0YIC2)=427AS liegt absteigend in der Spalte 231/[272)“7“] als QS 3+1=“4“_“2“_“7“ für 427AS, wobei der Spaltenversatz wegen der Zählgröße QS2+7+2=11 zulässig ist bzw. mit der Zahl „11“ auch das Protein mit 119AS alternativ erzeugt wird [MARS - Methionyl-tRNA-Synthetase - Homo sapiens (Mensch) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8100#“1610“45388196“777“.
tRNA-Gen lfd.Nr.25: Aminosäure „Prolin“=C5H9NO2=6*5+9+7+16=62E. Prolin „62“ ist mit der Zählgröße „11“ als „16102“ gekoppelt. Enzym „Prolin - tRNA-Ligase“= 746 AS [Prolin - tRNA-Ligase - Plasmodium falciparum MaliPS096_E11 | UniProtKB | UniProt]. Katalytische Aktivität: ATP + L-Prolin + tRNA (Pro) = AMP + Diphosphat + L-Prolyl-tRNA (Pro). AMP-Info=“16[ ]7“ vorhanden als „16“_[„1“02“55“0850]_QS4+3=“7“_69. In der Klammer[ ] ist ATP=551AS als „1_55“ enthalten. Als Überschuss ist die Zahl „55“ zusätzlich in QS=1+6+1+0+2+5+5+0+8+5+0+4+3+6+9=55 enthalten, der die Vorzeile „Gen.Nr.24“ mit Energie versorgt. Der Überschuss „69“ am rechten Zahlenrand spiegelt ist an einer Kreis-Spalte „6-4 mit der Vorzeile als 96_69. Das Enzym=746AS kann nunmehr aufsteigend in der Ziffernfolge „4-67“(77) gelesen werden. Der notwendige Spaltenaufstieg im Winkel=180° wird durch ein Zählgrößen-Gleichgewicht „11_0“ beider Zeilen über die Spalte „10-10“ ersetzt als [Z.8]_100° + #10°=110° vs. 10°+50°+50°=110°“.
Für das Protein (Mensch) „Prolin-tRNA-Ligase (PARS)“=475AS verbleibt zwischen mehrzeiligen humanen Methionin und Glycin für Prolin nur 1 Zeile. Weil Prolin=62 zweifelhaft als Kombination mit der Zählgröße 11 als 1“6“10“2“ codiert wird, kann diese Zählung überprüft werden [PARS2 - Wahrscheinliche Prolin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Vorzeile Z.8100 wird im Code die Teil-Zahl „47“ mit 4_QS1+6+1=7 als Linksdrehung gezählt, wobei die Ziffer „5“ dann als Ring über die Z.Nr. 3x „1“=3 in Spalte Z.8100/Z.8101 und 2x „1“=2 im Code Spalte #1/#1 folgt. Der Methionin-Komplex wird somit teilweise mit verwendet. Für komplexe Aufgaben wird das Protein (Mensch) „Bifunctional glutamate/proline-tRNA ligase (EPRS1)“=1512AS verwendet, dass auch anderweitig für „Glutamat“ benötigt wird [EPRS1 - Bifunctional glutamate/proline--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Für Prolin=62E wurde die verknüpfte Zählgröße 1“6“10“2“ ignoriert. Umgekehrt wird jetzt die Spalte 6/6 ignoriert, weil die Zahl QS6+6=“12“ in Z.8101#_102 die alternativ gebildet werden kann. Das Protein beginnt mit der Ziffer „1“ im Code Z.8100, überspringt die Zahl „6“, zählt die Ziffer „5“ analog als 5x Ziffer “1“ und lagert in Linksdrehung die Zahl „12“ an oder zählt die Spalte 6/6 als QS=12. Im „Glutamat“ in Z.81“15“#_“12“ besetzt das Protein „EPRS1“=1512AS die Randspalten.
Mensch: Prolin=C5H9NO2=30+9+7+16=62E ist im „Kollagen“ enthalten, das zur Bildung von Bindegewebe und Knochen benötigt wird. Prolin entsteht mittels Biosynthese aus Pyrrolin-2-carbonsäure [3,4-dihydro-2H-pyrrole-2-carboxylic acid] =C5H7NO2=30+7+7+16=60E. In der Kern-Z.-Nr.Z.8“1“0“1“ ist die Zählgröße „11“ enthalten, die auch im Code kombiniert wird, um die Zahlen 60 und 62 aus „#1610“ darzustellen [Prolin – Wikipedia]. Das Protein (Mensch) „Delta-1-pyrrolin-5-carboxylat-synthase“=795AS ist ein bifunktionelles Enzym, das „Glutamat“ in „Glutamat-5-Semialdehyd= C5H9NO3“=30+9+7+18=64E umwandelt, und zwar in Z.8100 mit #[1]“6“[1]_[0]_“4“ als ein Zwischenprodukt in der Biosynthese von Prolin, Ornithin und Arginin. Das Enzym liegt somit aufsteigend in Z.8110 mit QS6+1+0=7_QS 4+5=9 und Spalte 5/“5“ für 795AS [ALDH18A1 - Delta-1-pyrrolin-5-carboxylat-synthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Nach dem Einbau von „Prolin“ in das „Kollagen“ entsteht unter Beteiligung des Vitamins C (Ascorbinsäure)=C6H8O6=36+8+48=92E das Hydroxyprolin= C5H9NO3=30+9+7+24=70E. Vitamin C zählt in Z.Nr. Z.[810]“1“#“161“0“ die Zahl 90 und sorgt durch Addition der Ziffer 2 für den Zeilenvorschub zur Z.Nr.[810]“2“ mit QS90+2=92. Hydroxyprolin ist somit in Z.8103#“160“ als QS1+6=7_0 für 70E enthalten. Die Bindung von Hydoxyprolin im „Kollagen“ wird durch das Protein (Mensch) „Prolyl-4-Hydroxylase“=534AS mit 2 Cofaktoren katalysiert, und zwar Fe^2+=26E und L-Ascorbat= C6H7O6=36+7+48=91E. Der Cofaktor L-Ascorbat=91E definiert die Z-Nr. Z.8101 als QS8+1+0=“9_1“ für 91E, so dass sich das Eisen=26 von der Z.Nr. weiter in den Code erstreckt über die Z.[810]1#16[1025] als QS1_1=2_6 für Fe=26E. Das Enzym folgt als „5“_QS1+0+2=3 und ergänzt absteigend die Ziffer „4“ in Z.8100 in der Spalte 10“4“5/“102“5“ für 534AS [P4HA1 - Prolyl-4-Hydroxylase-Untereinheit alpha-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Prolylhydroxylase EGLN2“=407AS verwendet diese beiden Cofaktoren ebenfalls aufsteigend mit „4“_“0“_QS0+2+5=“7“ für 407AS [EGLN2 - Prolylhydroxylase EGLN2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. 2 Proteine Prolin-tRNA-Ligase: Das Protein (Mensch) „Bifunktionelle Glutamat/Prolin-tRNA-Ligase (EPRS1)“=1512AS gehört zum Multisynthetase-Komplex [EPRS1 - Bifunktionelle Glutamat/Prolin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein steigt in Zeile Z.8100 in der Spalte „1“/“5/[3]371“93“ auf. Weil sich in dieser Strecke die Zählgröße 3+7+1=11 bildet, ist ein Spaltenversatz zu QS9+3=12 für 1512AS zulässig. Die Aminosäure wird durch ATP=553AS in Z.8101 aufsteigend in der Spalte 550/3 aktiviert. Das Zwischenprodukt AMP=180 entsteht aufsteigend im Z.8100 in der Spalte [38]“81“/“0“, weil die Zählgröße 3+8=11 ein Spaltenversatz zur Ziffer „0“ erlaubt. Das Protein fungiert auch als Effektor des mTORC1-Signalwegs, indem er die Aufnahme von langkettigen Fettsäuren durch Adipozyten mittels des Fettsäure-Transportproteins „SLC27A1“=646AS fördert [SLC27A1 - Langkettiges Fettsäure-Transportprotein 1 - Homo sapiens | UniProtKB | UniProt]. An der Kontrolle des Rapamycin-Komplexes 1 (mTORC1), das das Zellwachstum und -überleben reguliert, ist das Protein „mTOR“=1335AS beteiligt [RPTOR - Regulatory-associated protein of mTOR - Homo sapiens (Human) | UniProtKB | UniProt]. „SLC27A1“ beginnt aufsteigt in Z.8100 in der Spalte 6/504/371 als 6_4_QS5+1=6 für 646AS, wobei aufgrund der Zählgröße 3+7+1=11 ein Spaltenversatz nach rechts zur Ziffer „1“ erfolgt. Dieses hat zur Folge, dass die Ziffer „7“ als Teil der Zählgröße nicht gelesen wird, wenn das Protein „mTOR“ über 1_33 /05 absteigt für 1335AS. Das Protein (Mensch) „Prolin-tRNA-Ligase_mitochrodrial (PARS2)=475AS liegt ab Z.8100 aufsteigend in der Spalte 4/25/05 als 4_QS2+5=7_QS0+5=5 für 475AS [PARS2 - Probable proline--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Sonstige Proteine: Das Protein SENP3=574AS beeinflusst die Expression von Protein „PYCR1“=319AS.
SENP3 beeinflusst die Expression von PYCR1. „PYCR1“=319AS liegt in Z.8102 absteigend in der Randspalte „36“[9]/“3“1“[6] als „3“_“1“_QS3+6=“9“ für 319AS [PYCR1 - Pyrrolin-5-carboxylat-Reduktase - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. „SENP3“=574AS liegt in der Spalte 504/[3]7[1]. Die zuvor aufgrund der Zählgröße 3+7+1=11 ignorierte Ziffer „7“ wird gelesen und dafür die Ziffer „1“ ignoriert für 574AS: Epi.Ref_Rhesus.Z.8101#“1“6“1“0“2“550850“4“3“69.
tRNA-Gen lfd.Nr.26: Aminosäure „Phenylalanin“=C9H11NO2=6*9+11+7+16=88E ist als Zahl nicht vorhanden [Phenylalanin – Wikipedia]. Der Mensch muss Phenylalanin mit der Nahrung aufnehmen, so dass der Parasit eine Lösung entwickeln muss. Mit der Vorzeile „Prolin“ werden die Spalten 5-5 und 3-3 gebildet, die als Addition „88“ für Phenylalanin ergeben. Diese Lesart folgt aus Spalte 5-6 mit der Zählgröße als QS5+6=11. Phenylalanin kann durch diese parasitäre Methode die Energie ATP=551AS gewinnen. Enzym „Phenylalanin-tRNA-Ligase“=575AS. [Phenylalanin-tRNA-Ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Das Enzym erfüllt den Zweck beide Zeilen zu binden. Beginnend in „Prolin“ wird eine Spalte 5-7 gebildet. Die anschließende Ziffer „5“ im Enzym=57“5“AS liegt links entfernt, so dass der übersprungene Überschuss „5_[QS6+3+3=12=Magnesium]¬_7“ vom Enzym mit einer „Metallionenbindung“ für Magnesium gebunden werden muss. Magnesium wird zusätzlich in der Zeilen-Nr. Z.8“102“ sowie als Zählgröße „1_QS9+3=12=Magnesium_1“ codiert. Das bei der ATP-Bindung entstehende AMP-Info=“16[ ]7“=“16_[1005633]_7“ grenzt das Schlüssel-Schloss-Prinzip „56“ zusammen mit der Oberflächen-Membran „33“ ab. Die Summe 56+33=89 spiegelt sich mit der Folgezeile „Lysin-Var.1“, in dem sich eine Spalte 100-098 bildet. Die 3 Zeilen bilden im Code die Winkelsumme=(10+50+50)+(100)+(60)+(80)=350°. Der Kreis=360° entsteht mit dem Winkel=10° aus der Zeilen-Nr. Z.8“10“2, so dass die Nachbarzeilen lediglich ohne Partnerschaft benutzt werden, um das „Schlüssel-Schloss-Prinzip“ breiter zu streuen. Die 3 Zeilen bilden eine Schlüssel-Schloss-Gruppe „44“ mit 3 Mitgliedern 64_“3“_64. Enthalten ist ein Platzhalter-O für die Zahl „56“ in „5_96_O_96_QS4+0+3=7=Form“: DELTA-TIME.Epi.Ref_Rhesus.Z.8101-Z.8103=#“596096“4036“44“. Die Addition der Quersummen der 3 Zeilen ergibt mit QS=55+QS=52+QS=73 den Spalten-Summenwinkel=180°, um Phenylalanin einseitig zu versorgen.
Mensch: „Phenylalanin“=C9H11NO2=54+11+7+16=88E muss der Mensch über die Nahrung aufnehmen. Phenylalanin“ ist chemisch gebunden und liegt meist nicht frei vor. In Pflanzen wird Phenylalanin über den Shikimisäureweg synthetisiert. Dabei teilen sich die Synthesewege der beiden Aminosäuren Tyrosin und Phenylalanin erst beim Prephenat. Für die Tyrosinsynthese wird Prephenat durch eine Prephenatdehydrogenase in 4-Hydroxyphenylpyruvat umgewandelt. Im Phenylalaninzweig des Syntheseweges katalysiert die Prephenatdehydratase die Reaktion von Prephenat zu Phenylpyruvat. In einem letzten Transaminierungsschritt entstehen aus den beiden Vorstufen die jeweiligen Aminosäuren Tyrosin und Phenylalanin. Phenylpyruvat=C9H8O3=54+8+24=86E. „Phenylalanin“ liegt als lfd.Nr.26 mit der Kern-Zeilen-Nr. Z.8102 vor. Weil darin mit „1“_QS0+2=“2“ das Magnesium (Mg)=12E enthalten ist, wird es von Proteinen als Cofaktor Mg^2+=12E verwendet. Das Protein (Mensch) „Phenylalanyl-tRNA-Synthetase (FARSA)“=159AS steigt in der Z.Nr.Spalte „8102/3/4/5“ als „1“_QS2+3=5_QS4+5=9 für 159AS bis zur Z.8105 auf [FARSA - Phenylalanyl-tRNA-Synthetase-Untereinheit alpha - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Z.Nr. Z.8105 wurde die Ziffer „1“ dabei 4x durchlaufen. Absteigend über die Ziffer „0“ in die Z.8“1“0“4“ ergibt die Addition „8“_QS1+1+1+1=“4_“4“=“8“ für „Phenylalanin“=88E, die auch im Code der Zeile enthalten sind. Das Protein (Mensch) „Phenylalanyl-tRNA-Synthetase2 (FARSA2)“=101AS findet den Cofaktor Mg^2+ gespiegelt als „21“, weit entfernt am rechten Zeilenrand in Z.8106. Das Protein steigt ab Z.8101 in der Null-Spalte “1“[6]/“0“[0]/“0“[5]/“1“[7]/[“21“] auf für 101AS [FARS2 - Phenylalanyl-tRNA-Synthetase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Phenylalanin-tRNA-Ligase, mitochondrial (FARS2)“=451AS beginnt bereits in Z.8101#_“5“0“4“/[37]“1“, wobei wegen der Zählgröße 3+7+1=11 ein Spaltenversatz zulässig ist [FARS2 - Phenylalanin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Alternativ kann die Zählgröße 11 addiert werden mit 1+1=“2“ für das Protein (Mensch) „Phenylalanin-4-Monooxygenase“=452AS. Statt dem Cofaktor „Mg“ in der Z.-Nr. Z.8102 wird wegen einer 2. Zählgröße 5+6=11 mit 1+1=“2“ und 3+3=“6“ in „0563371“ der Cofaktor „Fe^2+=26 (Eisen) erzeugt [PAK - Phenylalanin-4-Monooxygenase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die abnorme Ansammlung von „Phenylalanin“ im Zentralnervensystem hat die Erkrankung „Phenylketonurie (PKU)“ durch eine Verringerung der Anzahl von Axonen, Dendriten und Synapsen zur Folge. Ein Zusammenhang besteht mit dem Protein „AMP-aktivierte Proteinkinase (AMPK)“= 550+269+331 (3 Untereinheiten: α, β ,γ) = 1150 AS [AMP-aktivierte Proteinkinase – Wikipedia]. Ersichtlich ist, dass die „geistige Leere“ durch die lange Null-Spalte über „8_7_9“=Vene_Nerv_Arterie und Zählgröße=11_7=Nerv entsteht, so dass das Protein von Z.8102 über 6 Zeilen aufsteigt, und zwar in der Randspalte 1[6]/0[0]/0[5][1]1[7]/32[1]/0[4] als QS1+0+0=“1“_“1“_QS3+2=“5“_“0“ für 1150AS [siehe: „AMP-aktivierte Proteinkinase-Aktivierung bei der Vermittlung von Phenylalanin-induzierter Neurotoxizität in experimentellen Modellen der Phenylketonurie - PubMed (nih.gov)“; L. Lu; Jul 2018; DOI: 10.1007/s10545-017-0115-6]. Untereinheit alpha=550AS ist in Z.8101 direkt lesbar. Die Untereinheit beta=269AS liest den bekannten Cofaktor „5633“ als Eisen=“26“ mit QS5+6=11=QS1+1=“2“ und 3+3=“6“. In der Spalte 5633/63 folgt QS6+3=“9“ für 269AS. Untereinheit gamma=331AS liegt in der Spalte „3/31“, so dass darin die Ziffer „1“ das Gesamt-Protein=“1“150AS startet: Epi.Ref_Rhesus.Z.8“102“#“16“100“56“33“7“1“93“1“6.
tRNA-Gen lfd.Nr.27: Aminosäure „Lysin-Variante 1“: Lysin=C6H14N2O2=36+14+14+16=80. Gemeinsam mit L-Arginin und L-Histidin gehört L-Lysin mit 6 C-Atomen zu den Hexonbasen und besitzt 2 basische Aminogruppen (H2N; NH2=7+2=9) [Lysin – Wikipedia]. Das spiegelbildliche D-Lysin kommt in Proteinen (Eiweiß) nicht vor. Der Mensch kann Lysin nur aus der Nahrung gewinnen, so dass der Parasit eine eigene Lösung findet. Energie als ATP=551AS ist nicht vorhanden, so dass mit dem Funktionspartner „Lysin-Var.2“ ein Ringverbund über die Winkelsumme=360° als Transportsystem aufgebaut wird. Die enthaltene Zahl „800“ ist als Winkel > 360° ungeeignet, wird aber zu Lysin=80_O=Transportring reduziert. Die Codeserie #1“60“ zählt nicht mit, so dass die Winkelsumme= 80 (Var.1) + [90+40+80 (Var.2)]= 80+210=290° ein Defizit von 360-290=70° ergibt. Über die Serie Z.x10x können in 7 Zeilen 7*10°=70° bis Gen.lfd.Nr 31 für Valin-Var.11 für die Winkelsumme=360° gewonnen werden. Dort ist aber noch keine Energie zu gewinnen, so dass mit der folgenden Zeilen-Nr. Z.8“110“ von der Zahl „10“ auf die Serie Z.x11x=Zählgröße umgestiegen wird, die am rechten Rand mit „7“ weitere Zeilen als Extra=8_11_8 vorgibt [160846“8“11“8“8580“7“]. Damit wird die Energiequelle [Schwerachse=84_seitlich=9_Energie=„55“] in Gen–lfd.Nr.40 für „Isoleucin“ in „Z.8116#“160“7“2“7“9009“849“55“ erreicht. „Isoleucin“ ist an den 360°-Kreislauf angeschlossen, in dem die Energie zu Valin-Var.11 mit dem Spaltenwinkel=180° hochgeschoben wird. Dieser ist mit 2*90° als 7_2=doppelt_7_90_09 adressiert. Im Ergebnis der ATP-Binding liegt AMP-Info=“16[ ]7“ als 16_[QS0+9+8+5=22=CO2]_7 vor. „CO2“ führt im Mückendarm zusammen mit der Bikarbonatkonzentration als HCO3=1+6+8*3=31E, der Xanthurensäure=106E und der 5°C Abkühlung (37°-32°=5°C) zur Exflagellation. Interessant ist, das HCO3=31E beim Funktionspartner „Lysin-Var.2“ die Spiegelung „1[6_9=seitlich_6]_33=männlich“ enthält, und den Mückendarm „808“ am rechten Zahlenrand mit „40804“ summieren kann. Beide Zeilen zeigen gemeinsam die Körpertemperatur des Menschen von 37° als Spalte „3-7“ an und die Differenz „5°“ steht links daneben. Die Endzahlen der Zeilen-Nrn. ergeben 37° und die Spiegelung „103“ die Zahl 3[0]1°. Die überschüssige Ziffer „0“ kann dann in die Spalte „8[0]8“ als Mückendarm geschoben werden. Enzym „Lysin-tRNA-Ligase“=583AS [Lysine--tRNA ligase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Um den entfernten Funktionspartner zu erreichen, liegt die Zahlenfolge gespiegelt vor. Im Code ist der Zahlenteil „85“ enthalten. Dieser Teil wird mit AMP-Info=“16[ ]7“ als „16_[9=seitlich_85]_7“ abgegrenzt. Die Ziffer „3“ im Enzym=58“3“AS ist die Randziffer der Zeilen-Nr. 810“3“. Der Funktionspartner „Lysin-Var.2“ kann aus dem Zahlenteil mit „QS0+6+3+3+3+3+4+0+8+0“=30=Zink das Zinkfingerprotein=1733AS anfordern [Zink-Bindung ist im Enzym wissenschaftlich nicht festgestellt]. Der Zahlenteil „33“ bindet im Code bindet und der Zahlenteil „17“in der Zeilen-Nr. Z.8_“1[0]7“, um den Funktionspartner in Z.8103 zu erreichen [C3H1-type domain-containing protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]. In reifen Gametozyten wird das Zinkfingerprotein ZNF4=1722 AS stark exprimiert, das an der männlichen Exflagellation beteiligt ist [siehe Abb. 1; Das Plasmodium falciparum CCCH Zinkfingerprotein ZNF4 spielt eine wichtige Rolle bei der Gametozytenexflagellation durch die Regulation männlich angereicherter Transkripte - PMC (nih.gov); G-Pradel u.a. Mai 2022.; doi: 10.3390/cells11101666]. Die Zahl „17“ wird mit der Zählgröße „11“ als „117“ in Z.8105 (Aginin_Var.2) am rechten Zahlenrand kombiniert. Die Zahl „22“ entsteht über 2 Zeilen, in dem in der Randspalte die Zahl „21“ und dann gespiegelt als QS0+8+0+4=12 gebildet wird. Wie in der Eingangsgröße „17“ ist die Zählgröße „11“ eine Hilfsgröße, um 3 Gen-Zeilen mit dem Protein ZNF4 zu verbinden.
Mensch: „Lysin“=C6H14N2O2=36+14+14+16=80E verteilt sich 2 weit entfernte Kern-Zeilen lfd.Nr.27 (Z.8003) und lfd.Nr.31 (Z.8007), die jeweils Lysin=80E lesbar enthalten. Die Proteine besetzen diesen Zeilenbereich, in dem Glycin und Arginin mit überlaufen wird. Der Mensch muss Lysin mit der Nahrung aufnehmen. Vergleichsweise kann der einzellige Pilz „Saccharomyces cerevisiae (Bäckerhefe)“ eine Lysin-Biosynthese entwickeln: Der 1. Schritt des „Alpha-Aminoadipat (AAA) Lysin-Biosyntheseweges“ wird vom Protein (Bäckerhefe) „Homocitratsynthase, mitochrontrial (LYS21)“=440AS ausgeführt, um Homocitrat= C7H10O7=42+10+56=108E zu erhalten: „2-Oxoglutarat + Acetyl-CoA + H2O = (2R)-Homocitrat + CoA + H+“ [LYS21 - Homocitratsynthase, mitochondrial - Saccharomyces cerevisiae (Stamm ATCC 204508 / S288c) (Bäckerhefe) | UniProtKB | UniProt]. Coenzym A (CoA) =C21H36N7O16P3S=126+36+49+128+45+16=355E [Coenzym A. - frwiki.wiki]. Das Protein „Homocitratsynthase“ hat 1 Cofaktor-Bindungsstelle für Mg^2+=12E oder Mn^2+=25E. Magnesium liegt in der Vorzeile Z.Nr. 8“102“ und für Mangan ist noch die Start-Z.Nr. Z.8103 der Spalte 102/103 als QS1+1=2_QS2+3=5 für Mn=25E zu addieren. Das Protein „Homocitratsynthase“ zählt sich in der Spalte „1“01/“1“02/“1“03/“1“0“4“/105/106/107 als QS1+1+1+1=“4“_“4“ für 44[0] und zählt die fehlende Null weiter folgend als Summe QS8+1=9_1=10 zusammen, die anschließend als Zeilen-Verbund in Z.8107 vorliegt für 440AS. (2R)-Homocitrat ist momentan nicht bekannt. Homocitrat=C7H10O7=42+10+56=108E besetzt ab Z.8102 am rechten Zeilenrand aufsteigend die Randspalte 3“1“6/“80“0, so dass sich Coenzym A (CoA)=355E entgegengesetzt von Z.8106 aufsteigend in der Randspalte 00“5“/11[7]/“3“21 als „3“_QS2+1_1+1=“5“_“5“ für CoA=355AS bildet [Ende Bäckerhefe].
Im Code liegt zur Zeilenverbindung der beiden Bereiche eine Nullspalte #_16“0“9 vor, zu der aber kein passendes Protein „Synthetase“ gebildet wird. Die Verbindung erfolgt vielfältig über die Z.Nr.-Matrix. Lysin ist im Kollagen enthalten. Aus Lysin=80E kann Carnitin=C7H15NO3=63+15+7+24=109E gebildet werden, das als Transportmittel für Fettsäuren über die innere Mitochondrienmembran dient [Biochemie und Pathobiochemie: Carnitin-Stoffwechsel – Wikibooks, Sammlung freier Lehr-, Sach- und Fachbücher]. Carnitin=109E beginnt in Z.8102 aufsteigend in der Spalte 93“1“/398“0“0/4005, wobei die Ziffer „0“ aus dem Lysin=80E und die Ziffer „9“ aus QS4+0+0+5=“9“ stammen. Weil in der Membran 33_QS7+1+9=17=QS1+7=“8“_3 die Zahl 719 auf „8“ reduziert wird, ergibt sich wegen der Wiederholung in der Folgezeile 3_“8=Extra_3 ein Transporteffekt. Das Protein (Mensch) „Lysin tRNA-Ligase (KARS1)“=579AS ist dreifach vorhanden, und zwar direkt in Z.8103#_5763 als 57_QS6+3=9 für 579AS sowie 2-fach in der Randspalte „4005/117/321“ von Z.8106 aufsteigend als QS3+2=5_[Versatz wegen 11]_“7“_QS4+0+0+5=“9“ für 579AS. Die 3. Variante ist eine Verbindung zur Membran=33 in Z.8107 über die Spalte „6“16“32“[1]“/[333]“3“ als QS3+2=“5“_QS1+6=“7“_QS6_3=“9“ für 579AS [KARS1 - Lysin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „Lysin tRNA-Ligase (KARS1)“ teilt sich 1 „bidirektionalen Promotor“ mit TERF2IP/RAP1=393AS, weil dieses Protein die Spalte „36“/33“3“3“ ringförmig als „3“_QS 3+6=“9“_“3“ für 393AS gleichfalls besetzt [Terf2ip - Telomeric repeat-binding factor 2-interacting protein 1 - Rattus norvegicus (Rat) | UniProtKB | UniProt]. Das Protein „Lysin tRNA-Ligase (KARS1)“ kann am Zeilenrand Z.8104#_“005“ aufgrund der Spiegelung mit dem GAG-Protein=500AS des HIV-1-Virus interagieren [gag - Gag polyprotein - Human immunodeficiency virus type 1 group M subtype B (isolate HXB2) (HIV-1) | UniProtKB | UniProt]. Das Protein „Lysin tRNA-Ligase (KARS1)“ katalysiert die Synthese des Signalmoleküls Diadenosintetraphosphat (Ap4A) und vermittelt dadurch die Störung des Komplexes zwischen HINT1=65AS [HINT1 - Histidine triad nucleotide binding protein 1 - Homo sapiens (Human) | External links | UniProtKB | UniProt] und MITF=526AS [MITF - Microphthalmia-associated transcription factor - Homo sapiens (Human) | UniProtKB | UniProt] und die gleichzeitige Aktivierung der MITF-Transkriptionsaktivität mit MITF=361AS [MITF - Melanozyten-induzierender Transkriptionsfaktor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Signalmolekül „Diadenosintetraphosphat (Ap4A)“=C20H28N10O19P4=120+28+70+152+60=430E liegt in Z.8107 aufsteigend in der Randspalte „[3]21/[8}04“ als „4“_QS2+1=“3“_“0“ für 430E. Ap4A aktiviert Monozyten/Makrophagen als Immunantwort, weil die Zählgröße QS3+8=11 gekoppelt ist und die Membran „0_6_3333_4_0“ vom Bixnom-Kreis als Kreislauf markiert wird. HINT und MINT sind benachbart. Die Modifikation HINT1=103AS beginnt in der Zählgröße 11 mit der Randspalte „01“[17]/“163“21 als „1“_QS 0_nochmals Ziffer „0“ aus QS1+6+3=10, wobei die überschüssige Ziffer „1“ in die Nullstelle der Folgezeile Z.8107 geschoben wird =“0“_QS2+1=“3“ für 103AS. Das Protein (Mensch) „ATP-Synthase alpha“=553AS kann absteigend aus den Z.Nr.-Spalte 810“3“/8“104“/810“5“ als „5“_QS1+4=5_“3“ gezählt werden für 553AS [ATP5F1A - ATP synthase subunit alpha, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Die „ATP Synthase, Unterheit C“=136AS ist im Code 3-fach in Kombination mit der Zahl 38 bzw. 83 vorhanden, und zwar in der Spalte 1 /[38]3/6 und in der Spalte „6“0“3“[8]/6“1[83] sowie 0“1/“6“3“ für 136AS. In der Z.8106 mit 61“83“6163 wird die Ziffer „1“ als Aktion benötigt, um mit QS83+1=84=Schwerachse zu bilden. Die Schwerachse bewirkt eine Beziehung zum Rückenmark. Das Protein (Mensch) „ATP Synthase subunit C lysine N-methyltransferase“=233AS sorgt durch eine Trimethylierung für den ordnungsgemäßen Einbau der C-Untereinheit, dabei werden 3 Methylgruppen (-CH3) auf ein Molekül übertragen. An jeder Untereinheit C kann aus dem Kreis=6+4=10 ein Transport von CH3=6+3=9 gezählt werden [ATPSCKMT - ATP synthase subunit C lysine N-methyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Hydroxylysinkinase (HYKK)=373AS katalysiert die GTP-abhängige Phosphorylierung von 5-Hydroxy-L-Lysin: (5R)-5-Hydroxy-L-Lysin + GTP = (5R)-5-Phosphooxy-L-Lysin + GDP + H^+ [HYKK - Hydroxylysinkinase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E liegt in der Spalte Z.8105#_“160“94“6“[0]/#_1609“2“6“[1] als QS160+94+6=260_QS2+6=8 mit Summe 260(ATP)+8=GTP=268E vor. Daraus ergibt sich Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E in der Spalte #[1]“6“0“9“[4]/#[160]“9“2“ als „2“_QS9_6+0+9=24 mit 2_24 für GDP=228E. Darin liegt Lysin=80E in der Spalte „60“9“[4]/[60]“9“2“ als QS60+9_9+2=Lysin=80E. „HYKK“=373AS liegt in der Spalte „4“6“0“3“/“2“61“[8] als „3“_QS4+6+0=10_QS2+61=63 mit „3“_Summe=10+63=“73“ für „HYKK“=373AS._[HYKK geändert_dat11.09.2023] Entgegengesetzt „(5R)-5-Phosphonooxy-L-lysine“=C6H15N2O6P=36+15+14+48+15=128E von der Zählgröße 11 zur Zeile Z.8107 in der Spalte [1]“1“[7]/[3]“2“[1]/“8“0“[4] aufsteigend als „1“_“2“_QS0+8=“8“ für 128E. Das Protein (Mensch) “Lysyl-Oxidase (LOXL1)“=574AS ist auf Elastin- und Kollagensubstraten aktiv. Hierzu wird ein Bezug zur Membran „33“ als Spalte „3371/383“ benötigt, weil darin das Protein (Mensch) „Elastin“=786AS enthalten ist, und zwar als 7_8_QS3+3=6 für 786AS [ELN - Elastin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der Cofaktor „Lysin-Tyrosylchinon“=C21H27N3O6=126+27+21+48=222E aktiviert die Z.Nrn. Z.8102/Z.8103 und den Code ringförmig absteigend als QS1+1=2_2_Code-Randziffer aufsteigend 1+1=2 für 222AS. Der 2. Cofaktor „Kupfer=29“ steigt bereits ab Z.8101 in der Spalte 10/10/09 als QS10+10+9=29=Kupfer zusammen mit dem Protein „LOXL1“=574AS auf. LOXL1 in der Spalte „5“[0]/“7“1“/[8]“3“ als „5“_“7“_QS1_3=“4“ für 574AS: Epi.Ref_Rhesus.Z.810“3“#“16“09“85“763839“80“0.
tRNA-Gen_lfd.Nr.28: Aminosäure „Glycin“=C2H5NO2=12+5+7+16=40E. Enzym „Glycin-tRNA-Ligase“=889AS [glycine--tRNA ligase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Glycin ist in Proteinen und häufig an jeder 3. Position vertreten, so dass der Faktor 1/3=0,333 vorgegeben sein muss. Glycin=40E ist in Z.8104 direkt lesbar. Zur Energieversorgung mit ATP (adenosine 5'-triphosphate)=551AS müssen aber 4 Zeilen gegen den Zeilenlauf passiert werden. Dafür ist als Kreislauf die Zahl „64“ vorhanden. Es muss dann aber auch die Winkelsumme=360° vorliegen. Die Zahlen 400 und 800 zählen nicht mit, weil es wegen Grenzwinkel=360° keine Winkel sind. Weiterhin entfällt, die Zahl „10“ in der Zeilen-Nr.8“10“1 als Zielzeile, es wird aber eine Zählgröße 11 als „1“0“1“ gebildet, um in der folgenden Nr.-Spalte 3x10°=30° zu gewinnen. Im Code ergibt sich die Code-Winkelsumme= 10+50+50+100+60+60=330° und im der Z.-Nr.-Winkelsumme=10+10+10=30°. Winkelsumme=330+30=360°. Beim Aufstieg liegt in Z.81“0“2#161“00“56“33“7“1“9“31“6 nunmehr „QS5+6=11=Zählgröße_Ziffer=33_7=Form“ vor, die durch eine Zählgröße „1_seitlich=9_“3“_1“ die Anlagerung der Ziffer „3“ zu „333“ enthält. Aufgrund Winkelsumme wird mit 10° (in Z.8102) und 100° zugleich der Glycin-Verteilungsfaktor=333/1000=“0,333“ gebildet. Das Enzym „Glycin-tRNA-Ligase“=889AS ist als Spiegelung „988“ lesbar.
Mensch: „Glycin (Aminoessigsäure)“=C2H5NO2=40E lfd.Nr. 28 (Z.8104) ist direkt lesbar. Das Protein „Glycyl-tRNA-Synthetase 1 [GARS1]“=79AS kann aufgrund der Serie „#1609“ den weiten Bereich von Z.8103 bis Z.8107 als QS1+6+0=“7“_“9“ für 79AS nutzen [GARS1 - Glycyl-tRNA-Synthetase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Lysin hat diesen Bereich alternativ durch 2 Lysin-Kernzeilen überbrückt. Weiterhin ist Arginin in diesem Bereich aktiv. Glycin nimmt der Menschen meist chemisch gebunden mit der Nahrung auf, kann es aber selbst synthetisieren. „Die Umsetzung von Serin=56E zu Glycin=40E dient neben der Erzeugung von Glycin auch der Umsetzung von Tetrahydrofolsäure=C19H23N7O6=114+23+49+48=234E zu N5-N10-Methylen-Tetrahydrofolsäure (TH4), die unter anderem für die Synthese von Thymin-Nukleotiden (DNA-Bestandteil) benötigt wird“ [Glycin – Wikipedia]. Das Protein (Mensch) „Serin-Hydroxymethyltransferase, mitochondrial“=504AS katalysiert die Spaltung von Serin zu Glycin, wobei „5,10-Methylentetrahydrofolat“=C20H23N7O6=120+23+49+48=240E produziert wird [SHMT2 - Serin-Hydroxymethyltransferase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Cofaktor=“Pyridoxal-5'-phosphat (VitaminB6)“=C8H10NO6P=48+10+7+48+15=128E [Pyridoxalphosphat – Wikipedia]. Serin=56E liegt in der Zeile Z.8102, in der auch das „5,10-Methylentetrahydrofolat“=240E mit der Ziffer „1“ in der Randspalte 1[6]/0[0]/0[5]/11[7]/32[1] beginnt als QS1+0+0+1=2_QS1+3=4_QS2+0+8+0=[1]0 für 240AS. Die überschüssige Ziffer „1“ aus „10“ kann in eine Leerstelle 0(Null) verschoben werden bzw. fällt bei der Katalyse Wasser= H20=28=QS2+8=10 an: „(6R)-5,10-Methylen-5,6,7,8-tetrahydrofolat + Glycin + H2O = (6S)-5,6,7,8-tetrahydrofolat + L-Serin“. Serin=56E zieht sich durch die Zeilen und umklammert das Glycin=40E in Z.8104 gespiegelt als „6“_40_[0]“5“. Der Cofaktor „Vitamin B6“=128E besetzt in Z.8105 aufsteigend die Randspalte 1[7]/2[1]/80[4] als „1“_“2“_QS0+8=“8“ für 128E bis Z.8107. Der Cofaktor durchläuft die Zählgröße 11 in 0387901“1“ in einem Zahlenteil, der sich über Eck zum Zink=30 zählen lässt. Der Zählung QS0+3+8+7+9+0+1+[17/21]=28=H2O folgt in der Randspalte die Zählgröße QS1+7+2+1=11. Wird die Ziffer 2 des Cofaktors über Eck addiert, entsteht Zink=28+2=30E. Der Zahlenrand kann nunmehr vom Zinkfingerprotein (Mensch) „ZNF 280C“=737AS besetzt werden, und zwar in Z.8105 aufsteigend bis Z.8108 als „7“_QS2+1=3“_QS4_3=“7“ [ZNF280C - Zinc finger protein 280C - Homo sapiens (Human) | UniProtKB | UniProt]. „ZNF280C wird stark in primären Darmkrebsen und Fernmetastasen exprimiert, und ein höherer ZNF280C-Spiegel sagt eine schlechtere Prognose der Patienten voraus“ [„Zinkfingerprotein 280C trägt zur kolorektalen Tumorgenese bei, indem es die epigenetische Repression an H3K27me3-markierten Loci aufrechterhält | PNAS“; Y.Ying u.a., Mai. 2022; https://doi.org/10.1073/pnas.2120633119]. Das Protein (Mensch) „Serin-Hydroxymethyltransferase, mitochondrial“=504AS wird durch Succinylierung an Lys-280 gehemmt. Bei der Succinylierung wird eine Succinylgruppe über eine Isopeptidbindung an ein Lysin in einem Protein gekoppelt. Daran ist Succinyl-CoA=C25H40N7O19P3S=150+40+49+152+45+16=452E beteiligt. Succinyl-CoA füllt die aktive Spalte 4005/011[7 /21] als „4“_QS0+0+5=“5“_QS1+1=“2“ aus, wobei für den Spaltenversatz die Zählgröße in der Spalte 7/21 als QS7+2+1=11 zur Regulation angehängt ist. Das Protein (Mensch) „Glycin-Amidinotransferase, mitochondrial (GATM)“=423AS katalysiert die Biosynthese von Guanidinoessigsäure (Guanidinacetat)=C3H7N3O2=18+7+21+16=62, die als Vorstufe direkt zum Kreatin führt. Aktivität: Glycin + L-Arginin = Guanidinacetat + L-Ornithin [GATM - Glycin-Amidinotransferase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein zählt die Ziffer „4“ von Glycin=40E in der Randspalte 4[005]/(90)11(7)/(3)21. Das Ornitin=C5H12N2O2=30+12+14+16=72E bildet mit „7“_QS1+1=“2“ für 72E zugleich die Ziffer „2“, so dass sich mit QS 2+1=“3“ das Protein „GATM“=423AS bildet. „Arginin“ =C6H14N4O2=36+14+28+16=94 wird für das „Kreatin“ ebenfalls benötigt und zählt sich in der Spalte „9“_QS 0+1_3=“4“ für 94E. In der Zeile Z.8103 kann aufsteigend ein Diagonale von der Ziffer „8“ zur „4“ als Schwerachse „84“ und weiter zur Ziffer „9“ in Z.8105 gezogen werden, die mit der Zählgröße als „90_11“=Zählgröße_7=Form verbunden ist. Daraus bildet sich das Protein (Mensch) „Aminoacyl-tRNA-Deacylase 1“=209AS als QS1+1=“2“_“09“ für 209AS. Dieses Aminoacyl-tRNA-Editing-Enzym deacyliert fehlgeladene D-Aminoacyl-tRNAs [DTD1 - D-Aminoacyl-tRNA-Deacylase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Monoglycylase TTLL8“=850AS modifiziert Proteine, indem sie ein einzelnes Glycin zu den Gamma-Carboxylgruppen spezifischer Glutamatreste hinzufügt, um Monoglycin-Seitenketten innerhalb des C-terminalen Schwanzes der Zielproteine zu erzeugen [TTLL8 - Protein monoglycylase TTLL8 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Tubulin-Monoglycylase TTLL3“=772AS ist an dieser Funktion beteiligt und benötigt den Cofaktor „Magnesium“. Zusammen mit TTLL8 glycyliert es die Spermiengeißeln, die die axonemale Dyneinmotorik regulieren [TTLL3 - Tubulin-Monoglycylase TTLL3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Daraus ergibt sich, dass die beiden Proteine in einer Spalte liegen, in der die Männlichkeit=3333, Spermienflexibiltät 666 sowie Flagellen-Bewegung mit Physik=63 vorliegen. Protein TTLL8“=850AS steigt in Z.8104 mit „58“/[4+6=10]“0“[8+3=11 mit Spaltenversatz] für 850AS auf. Protein „TTLL3“=772AS setzt über Z.8106 in der Spalte 61/[6]3[333]/[6]4/[6]66 fort als QS6+1=7_QS3+4=7_QS6+6=12=Cofaktor „Magnesium“=12, davon die Ziffer „2“ für 772AS. Fortsetzung in Z.8109 mit dem Motorprotein „Axonemales Dynein (DNAH1)“=4265AS in der Spalte [666]4/11/1[1]/55 als „4“_QS1+1=“2“_QS1_5=5_5 für 4265AS bis Zeile Z.81“12“, worin nunmehr der Cofaktor Mg=12 für TTLL3 direkt lesbar ist [DNAH1 - Dynein axonemal heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. 3 Proteine Glycin-tRNA-Ligase besetzen die Randspalte: Das Protein (Mensch) Glycin-tRNA-Ligase (P41250 • GARS)=739AS beginnt in Z.8108 absteigend in der Randspalte „[90]117/21/3/4“ als QS3_4=“7“_QS2+1=“3“_QS1+1+7=“9“ für 739AS, weil das produzierte Signalmolekül „Ap4A“= C20H28N10O19P4=430E in der Randspalte mit enthalten ist [GARS1 - Glycine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) Glycin-tRNA-Ligase (A0A6Q8PHH9 • A0A6Q8PHH9)=705AS nimmt die Ziffer „7“ auf und bildet mit dem Zeilenrand der Vorzeile 705AS, wobei wegen der Zählgröße 9+1+1=11 ein Spaltenversatz möglich ist [GARS1 - Glycin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) Glycin-tRNA-Ligase (A0A6Q8PGZ8 • A0A6Q8PGZ8)=745AS vervollständig den aktivierten Zeilenbereich, indem es in Z.8102 absteigend in der Randspalte 16/800/4005 als QS1+6_0=“7“_“4“_QS0+5=“5“ für 745AS bildet [GARS1 - Glycin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8“10“4“#“160“96589886“40“05.
tRNA-Gen lfd.Nr.29: Aminosäure „Arginin-Variante 2“=C6H14N4O2=94E plus Salzsäure HCl= Arginin-Hydrochlorid. Bei mehreren basisch reagierenden funktionellen Gruppen wird die Anlagerung statt (+)Plus-Symbol mit einem Punkt (.) mittig hochgestellt „C6H14N4O2. HCl“, weil die protonierte Gruppe nicht genau festgelegt ist [Hydrochloride – Wikipedia]. Arginin=94 ist direkt lesbar. Chlor=17 bildet den rechten Zahlenrand. Von der Salzsäure HCl fehlt somit die H als Ziffer „1“, die benachbart als Salzsäure=“1“17“ codiert ist. „Arginin-Variante 3“ für Arginin-Hydrochlorid-Hydrat wird um einen Wasseranteil ergänzt und liegt in der Folgezeile. Am rechten Rand der Folgezeile beginnend mit der Ziffer „1“ kann als Spalte „17=Chlor“ gelesen werden. Zugleich liegt eine „Zählgröße 11_Randspalte=7-1“ vor, so dass sich QS 1+1+7+1=10=Wasser (H2O) ergibt. Somit bildet die Folgezeile das Hydrat. Enzym „Arginin-tRNA-Ligase“=306AS [Arginin-tRNA-Ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Das Enzym=306AS ist gespiegelt als „603“ enthalten. Die Folgezeile Z.8106 liefert als QS1+6+0+9+2+6+1+8+3+6+1+6+3+2+1=“55“ die Energie ATP=551 AS. Um diese hochzuschieben wird eine Winkelsumme=180° benötigt. In Z.8105 muss eine Winkel-Überschuss von (90+60+60) – 180“=210°-180°=30° beseitigt werden. Das Enzym=603AS hat die Funktion eines Teilers 3/6=1/2, mit der statt 60° nur der Winkel=30° eingeht. Dieses hat zur Folge, dass Zink=30 mitwirkt, obwohl diese Funktion unbekannt ist. Das Zinkfingerprotein=1715AS muss zur Energiebeschaffung mit der Ziffer „5“ in die Folgezeile einbinden und mit der Zahl „17“ einen Bezug zur Chlorgruppe herstellen. Das Protein enthält eine Zinkfinger-Domäne von Pos. 1-23, so dass es sich mit der Spiegelung „32“ in die Folgezeilen einbinden kann. Die 2. Zinkfinger-Domäne Pos.31-58 kann die Aufgabe zufallen, die Zahl „60“ auf „30“ spiralartig zu schrumpfen [Zinkfingerprotein - Plasmodium falciparum (Isolat Camp / Malaysia) | UniProtKB | UniProt ]. Das Zinkfingerprotein=1715 AS beginnt mit Chlor=17 am Zahlenrand, findet die Ziffer „1“ in der Spalte 7-1 und bildet links QS3+2=5 für 1715AS am gemeinsamen Zahlenrand. Die Folgezeile adressiert Blut=26= Erythrozyt. Arginin ist für Wachstum und die Nährstoffbeschaffung zuständig. Arginin wird zur Produktion von Ornithin und Citrullin benötigt. Wissenschaftlich wird ein Harnstoff-Zyklus vermutet. Das Prinzip ist aber ersichtlich: Am halbierten 60°-Winkel liegt die Zahl „4603“. Bei der Winkelteilung entsteht 46/2=23 und gespiegelt „32“. Der Harnstoff=CH4N2O=6+4+14+8=“32“ wird in der Folgezeile durch die Zinkfinger-Aktion adressiert. Die 2. Zahl „60“ ist in beiden Zeilen als Zeitbasis=60 geeignet, weil das Wachstum nur in bestimmten Entwicklungsstadien durch Arginin unterstützt wird. Citrullin=C6H13N3O3=36+13+21+24=“94“[wie Arginin=94E]. Citrullin liegt als Zwischenprodukt des Harnstoff-Zyklus neben der Zeitbasis vor als „94_60“ [Citrullin – Wikipedia]. Bei der Bildung von AMP-Info=“16[ ]7“ infolge der ATP-Bindung als „16“_[0946038]_“7“ als „16[ ]7“ ist es mit QS9+4+6+0+3+8=30=Zink beteiligt, folglich muss eine Zink-Bindestelle vorhanden sein. Arginin-Hydrochlorid=94E+Chlor=17=111E wird mit 3x Ziffer „1“ als 111E codiert. Die 4.Ziffer 1 für HCl vs. Cl muss dann als Energie in der „Zeilen-Nr. Spalte 1-1“ hochgeschoben werden: Epi.Ref_Rhesus.Z.8105#“16“0“94“60“3“8“7“90“1“17“.
Das Malaria-Medikament „Marone“ enthält eine Wirkstoff-Kombination aus Atovaquon=C22H19ClO3=132+19+17+24=192E [Atovaquon – Wikipedia] und Proguanil=C11H16ClN5=66+16+17+35=134E [Proguanil – Wikipedia]. Proguanil liest die Ziffer „1“ in der Zählgröße „11“ und gewinnt die Ziffer „3“ fallend aus der Spalte 1-3. Die Ziffer „4“ wird aus dem Zahlenrand QS2+1=3 und steigend zurück, um über die Spalte 1-2 die Ziffer „1“ zu addieren für Proguanil=134E. Atovaquon startet mit der Ziffer „1“ in der Folgezeile und findet die Ziffer „9“ in der Spalte 9-1. Nach rechts wird der Ring-O übersprungen und aus der Zählgröße 11 QS1+1=2 gewonnen für Atovaquon=192E. Die beiden Wirkstoffe besetzen gemeinsam den Zahlenrand über 2 Zeilen. Die Bildung von Proteinen im Mitochondrium wird verhindert, weil der Parasit für das Enzym „Cytochrom-bc1-Komplex“ =355AS am Zahlenrand hochziehen muss [Cytochrom b-c1-Komplex-Untereinheit Rieske, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Der Wirkmechanismus von Atovaquon beruht auf einer durch Strukturanalogie zu Ubichinon (Coenzym Q) bedingten Störung des Cytochrom-bc1-Komplex des Krankheitserregers. Das Enzym „Cytochrom-bc1-Komplex“= 355AS beginnt in der Folgezeile mit der Ziffer „3“ und zählt die Ziffer „5“ am Rand QS2+1= 3 und addiert dann steigend die Zählgröße 11 als QS1+1=2. Die zweite Ziffer „5“ wird steigend am Zahlenrand der Vorzeile Z.8104 gelesen, wobei 2 Ringe OO durchlaufen werden. Die Vorzeile hat den Nutzen, dass darin mit der Zahl „88“ das zweite Enzym „Cytochrom-bc1-Komplex“=88AS codiert [Cytochrom b-c1 Komplex Untereinheit 6 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. In Kombination mit dem Kreis=64 als „88_64_00_5“ wird ein Kreislauf angelegt. Die folgende Spalte 38/83 kombiniert das Enzym=88AS mit der Membran=33. Das Enzym=355AS kann die maßgebliche Membranzeile Zeile Z.8107 mit „Membran=3333_4 (zweischichtig)“ nicht direkt erreichen, besitzt aber 1 Cofaktor-Bindungsstelle als Ligand „[2Fe-2S]-Cluster“. Doppel-Eisen=26*2=56E zählt die Ziffer „5“ steigend aus der Spalte 1-4 als QS1+4=5 und lagert die Ziffer „6“ seitlich an für 2Fe=56E, so dass Doppel-Schwefel=2S=32E benachbart ist. Das Enzym=355AS zeigt eine Ubiquinol-Cytochrom-C-Reduktase-Aktivität: „Ermöglicht die Übertragung eines oder mehrerer gelöster Stoffe von einer Seite einer Membran auf die andere entsprechend der Reaktion: CoQH2+ 2 Ferricytochrom c = CoQ+ 2 Ferrocytochrom c + 2H+“. Ubichinol=C59H92O4=354+92+32=478E beginnt in Z.8107 mit der Ziffer „4“ findet in Z.8206 die Ziffer „7“ als QS 1+6=7 und zählt die Ziffer „8“ am Rand „3+2+1=6“ und addiert aufsteigend die Zählgröße 11 als QS1+1=2 für Ubichinol=478E. Der Zeilenrand wird aber vom Medikament blockiert: Epi.Ref_Rhesus.Z.8105#“16“0“94“60“3“8“7“90“1“17“.
tRNA-Gen lfd.Nr.30: Aminosäure „Arginin-Variante 3“=C6H14N4O2=94E plus Salzsäure (HCl) vertreten mit Chlor=17 und Wasser (H2O)=2+8=10=„Arginin-Hydrochlorid-Hydrat“=94E+17E+10E=111+10 =121E (fehlt H von HCL). Bei einer Hydratation lagert sich Wasser an gelöste Salze an. Chlor=17 bzw. HCL=“1_17“ werden von Arginin-Var.2 über den gemeinsamen rechten Zahlenrand mit der Ziffer 1 zugeführt und die Ziffer 2 schließt sich an. Die Ziffer „1“ wird durch eine Spiegelung QS=3+6=9=seitlich markiert als 36_1_63, so dass Arginin-Hydrochlorid-Hydrat“=121E codiert ist, wobei H=1 von HCl fehlt und als Extra „1“_8 vorgelagert ist. Um die Energie ATP=55“1“ hochzuschieben kann das Protein „rRNA-Adenin-N(6)-Methyltransferase“=247AS [rRNA-Adenin-N(6)-Methyltransferase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt] zur Bildung eine Methylgruppe= „–NH3=7+3“=10E mitwirken [Methylgruppe – Wikipedia] Das Protein liest sich von der Vorzeile in der Ziffernfolge 4_über die Spalte 4-2 zur Ziffer herunter und rechts als QS6+1=7. In der Vorzeile wird Ziffer 4 durch 60 zur Matrix mit der Folgezeile ergänzt, wobei Kreis=64 den Antrieb und QS6+4=10 die Methylgruppe darstellt. L-Arginin dient als Substrat der NO-Synthase. Die NO-Synthasen (NOS) kommen in verschiedenen Zellen vor, um den gasförmigen Botenstoff „Stickstoffmonoxid (NO)“ [NO=7+8=15=QS1+5=6] zu synthetisieren [NO-Synthase - DocCheck Flexikon]. Der Botenstoff 6_O kann zur Verteilung in die Zeilennummer gespiegelt werden. Der entfernte Gruppenpartner Arginin-Variante 1“ in Z.8“O“86 kann seinen Platzhalter-O mit der Ziffer „6“ als Z.8“[6]“86 auffüllen, so das „6+8=14 doppelt“ als Kombination von Gruppe „44“ und Zählgröße „11“ ähnlich „1_44_1“ vorliegt. Beim „L-Arginin-Paradox“ wird ein hoher Arginin-Bedarf für die NO-Synthasen im Gegensatz zu einer geringen Aktivität durch Sättigung festgestellt und eine Hemmung der NO-Synthase durch endogene guanidino-substituierte L-Arginin-Analoga vermutet. Es wurde beobachtet, dass die NO-Synthasen Guanidin-basierte Verbindungen ohne Aminosäurefunktion als Substrate akzeptieren. [„Substituierte L-Arginin-Derivate als Modulatoren des Stickstoffmonoxid-generierenden System“; J. Kotthaus (2007): Dissertation Druckversion 25.1.09 (uni-kiel.de) zitiert: „MANSUY, D.; BOUCHER, J. L. Alternative nitric oxide-producing substrates for NO synthases. Free Radic Biol Med 2004, 37, 1105-21.“]. „L-Arginin“ kann über die „Arginin Decarboxylase“ zu „L-Agmatin und CO2=22“ verstoffwechselt werden. Die „Arginin-Glycin-Amidinotransferase“ katalysiert die Bildung von „L-Ornithin“ und „Guanidinoacetat“ aus L-Arginin und L-Glycin. „Guanidinoacetat“ wird zu Kreatin umgesetzt. Guanidinoessigsäure (Guanidinoacetat)= C3H7N3O2=18+7+21+16=62E. Die Guanidinoessigsäure=62E wird mit seitlich=9_26=Blutzelle „Erythrozyt“ zusammengesetzt und von der Zählgröße 11 umklammert als „1“6[Vakuole=O_9=seitlich]2[6]“1“. In diesem Zusammenhang wird das Protein „Malaria protein EXP1“=“162“AS codiert. „Dieses Protein ist an ein neues Kompartiment innerhalb des Zytoplasmas der infizierten roten Blutkörperchen gerichtet. Es umgibt auch den Parasiten, wahrscheinlich in der parasitophoren Vakuolenmembran [EXP-1 - Malaria protein EXP-1 - Plasmodium falciparum | UniProtKB | UniProt]. Eine Transferase liegt als Protein „Arginin-N-Methyltransferase“=726AS vor [Protein Arginin-N-Methyltransferase - Plasmodium falciparum UGT5.1 | UniProtKB | UniProt]. Enzym „Arginin-tRNA-Ligase“=888AS [Arginin-tRNA-Ligase - Plasmodium falciparum (Isolat Dd2) | Externe Links | UniProtKB | UniProt]. Der Zweck des Enzyms ist das Zusammenwirken von Zeilen Z.8105 und Z.8106, die als Spalten-Summe 88 und 11 sowie „5+6=11=Zählgröße“ erzeugen. Die 3.Ziffer 3 erfüllt einen Zweck, indem in der „Spalte 38/83“ gespiegelt die Anteile „88“ und Vakuolenmembran „33“ codiert werden. Jede tRNA besitzt eine Sequenz von 3 Nukleotiden (Anticodon) für die spezielle Aminosäure, die mit der mit einem Codon von mRNA (messenger-RNA) durch Basenpaarung in Wechselwirkung tritt. Eine Katalytische Aktivität wird beim Enzym nicht vermerkt. ATP=551AS wird über die Quersumme QS55 entwickelt. AMP-Info=“16[ ]7“ kann als „16[092]QS6+1=7“ mit [QS9+2=11=Zählgröße] gebildet werden. Damit wird der rechte Rand der Vorzeile „11_7“ zur ATP-Bindung angeschlossen bzw. ist innerhalb einer Gruppe keine formale Bindung nötig. In der Zeilennummer wird die Xanthurensäure=106E zur Start der Exflagellation der Mikrogamonten (männlich) zu Mikrogamonten codiert. Interessant ist, dass männlich „33“ ein Spermium „1“ in weiblich „66“ einfügt als „36163“. Die direkte Verhütungs-Umklammerung mit „5-5“ ist direkt schwierig, weil eine Spiegelung der „18“ zur Zeilen-Nr. vorliegt. Den Mikrogamonten wird ein Signal „29“ angeheftet. Das Signal wird gespiegelt im weiblichen (66) Empfänger als 6_“O“92“_6 codiert.
Mensch: Fortsetzung von Arginin-Var.1 in lfd.Nr.10 mit Z.8086, beim Menschen von Z.8085-Z.8087, als Var.2 /3 in einem mehrstufigen Prozess: Im Code Z.8105 ist Arginin=94E lesbar und nochmals als Spalte „9011/2“ QS9+0=“9“_QS1+1+2=“4“ vorhanden. Für die Biosynthese sind L-Ornithin=72 gespiegelt als QS1+1=“2_7“ und Carbamoylphosphat=72 gespiegelt aus „2“_QS6+1=“7“ von der Arginin-Var. 1, verteilt auf beide Zeilen, eingetroffen. Das Protein (Mensch) „Argininosuccinat-Synthase“=295AS liegt ebenfalls nochmals vor, wenn in der Randspalte die Startziffer in einer Kreiszählung nochmals addiert wird mit „2_QS1+1+7=9_QS3+2+1=5“ für 295AS. In der Zählgröße 11 wird dabei die Ziffer „1“ aktiviert, die in der Spalte 1/63 die Zahl 63=Physik zur Kreisfunktion=64 addiert [Argininosuccinat-Synthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Zwei zusätzliche Proteine aktivieren der Matrix der Z.Nrn.: Das Protein (Mensch) „Arginin-tRNA-Ligase (RARS1)“=660AS koppelt beide Z.Nrn. in einer Rechtsdrehung QS1+0+5=“6“_“6_0“ für 660AS. Funktion: Bildet einen makromolekularen Komplex, der die Bindung spezifischer Aminosäuren an verwandte tRNAs während der Proteinsynthese katalysiert. Moduliert die Sekretion von AIMP1 und kann an der Bildung des inflammatorischen Zytokins EMAP2 aus AIMP1 beteiligt sein. EMAP2=649AS liegt in der Spalte 901/63 als &_QS3+1=4_9 für 649AS. Zu diesem Zweck liegt AIMP1=312AS in der Ziffernfolge 321 am rechten Zahlenrand [AIMP1 - Aminoacyl-tRNA-Synthase-Komplex-interagierendes multifunktionales Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt ; EML2 - Stachelhäuter-Mikrotubuli-assoziiertes Protein-like 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Katalytische Aktivität: „ATP + L-Arginin + tRNA(Arg) = AMP + Diphosphat + L-Arginyl-tRNA(Arg)“. Diphosphate sind Salze und Ester der Diphosphorsäure=H4P2O7=4+30+56=90E und in Z.8105 lesbar. Das Protein (Mensch) „ATP-Syntase (ATPase 6)“=226AS ist in der Spiegelung Spalte „38/836“ enthalten, so dass sich aus einer doppelten Zählgröße, jeweils 8+3=11 und QS1+1=2 mit angefügter Ziffer „6“ daraus 226AS ergeben: Epi.Ref_Rhesus.Z.8106#“16“O“09“26“18“36“1“6“321“.
tRNA-Gen lfd.Nr.31: Aminosäure „Lysin-Variante 2“: Lysin=C6H14N2O2=36+14+14+16=80.
Funktionspartner „Lysin-Var.1“ als „tRNA-Gen lfd.Nr.27“ in Zeile Z.8103. Energiekreislauf über Winkelsumme=360°. Aufruf von Zink mit der Teilzahl „QS0+6+3+3+3+3+4+0+8+0“=30=Zink. Zinkfingerprotein 1733AS [C3H1-type domain-containing protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt zur Zeilen-Verbindung angefordert. Zum Energie-Transport von ATP=551AS mit QS1+6+0+9+0+6+3+3+3+3+4+0+8+0+4=“50“ als „Ziffer-5_O=Ring“ an der Winkelsumme=360° mit 90+40+80=210°(ohne Serie „60“) beteiligt. Das Defizit wird über den Winkel „10°“ in der Serie Z.x10x über 7 Zeilen bis Valin-Var.11 ausgegleichen. Über 7 weitere Zeilen wird mittels Zählgröße „11“ die Energiequelle „55“ am rechten Zahlenrand von Isoleucin erschlossen. Die entfernte Energiequelle ist über Spaltensummenwinkel=180° am Kreislauf=360° angeschlossen. Das Enzym „tRNA(Ile)-lysidine synthetase“=1241AS beteiligt eine tRNA für Isoleucin (Ile) mit einer komplexen katalytischen Aktivität für „Lysin-Var.2“ : „ATP + Cytidin34 in tRNA(Ile2) + L-Lysin = AMP + Diphosphat + H + Lysidin+34 in tRNA(Ile2)“. [Vergleich mit „Lysin-Var.1“: ATP + L-Lysin + tRNA (Lys) = AMP + Diphosphat + L-Lysyl-tRNA (Lys)]. Lysidin ist ein Lysin-haltiges Cytidin-Derivat. Isoleucin=72E Cytidin=C9H13N3O5=6*9+13+7*3+8*5=54+13+21+40=128E; Lysin=C6H14N2O2=80E; Lysidin=C4H8N2=24+8+14=46 [ Lysidin – Wikipedia]. Enzym „Lysin-tRNA-Ligase“=1241AS [tRNA(Ile)-lysidine synthetase - Plasmodium falciparum (isolate 7G8) | UniProtKB | UniProt]. Das Enzym=1241AS ist unsichtbar und kombiniert die Zeitbasis=24 mit der Zählgröße=11. Zu vermuten ist, dass die „11“ Varianten von Valin ein Bezug zu einem Zeitzähler herstellen. Die Zeit 24 kann somit über 3 Zeilen der Serie Z.“8“10x mit 3x „8“=24 gezählt werden. Weil dort Valin-Var. 11 endet und als Serie Z.x11x weiterführt, ist die Zählgröße=11 im Enzym=“1241“AS codiert. Valin= C5H11NO2=6*5+11+7+16=64 stellt einen Kreis=64 zur Verfügung. Über diesen Umweg kann nunmehr in Z.8107 das Enzym=1241AS mit dem Kreis=64 einen Zahlenteil umklammern als „6“3333“4“. Mit QS 6+3+3+3+3+4=“24“ wird die Zeitbasis des Enzyms=“1241“ sichtbar. Bei der ATP-Bindung grenzt AMP-Info=“16[ ]7“ als „16_[0906333]_QS3+4=7“ eine Markierung ab. Aus [0906333] folgt „9_6_QS3+3+3=9“, so dass die Zahl „6“ maßgeblich ist, und mit dem Funktionspartner in der Spalte die Zählgröße QS6+5=11 bildet.
Der Mensch reagiert auf die Invasion seiner Erythtozyten durch den Parasiten mit einer Immunantwort. Der Selbstmordmechanismus beim Programmierten Zelltod (PCD) wird über spezielle Rezeptoren auf der Zellmembranoberfläche ausgelöst. Beispielsweise erfolgt die Immunregulierung über den „Apoptose-signalisierenden Zelloberflächenrezeptor CD95 (Fas, APO-1)“, der vom „Gen FAS“ kodiert wird. FAS=335AS (Mensch) [FAS - Tumor necrosis factor receptor superfamily member 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Am Wirtstod hat der Parasit kein Interesse, so dass die Fieberkurve der Erkrankung bei Malaria tropica (Erreger „Plasmodium Falciparum“) eine Gegenreaktion anzeigt [siehe https://www.gigers.com/matthias/malaria/tropica.pdf]. Der „Rezeptor TNFRSF6 / FAS“ überträgt das apoptotische Todessignal in den Zellen. Das Protein FASLG=281AS des Menschen kann an den Rezeptor binden und dessen Wirkung beeinflussen [FASLG - Tumor necrosis factor ligand superfamily member 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Zeile Z.8107 für „Lysin –Var.2“ kann mit „33_33“ die Vakuolenmembran „33“ des Parasiten und die äußere Zellmembran „33“ des Erythrotzyten darstellen kann. Es folgt der Platzhalter „4[0]8[0]4“, um das Protein FASLG=281AS des Menschen möglichst mit der Fiebersenkung zu beauftragen. Die Ziffer „8“ ist bereits enthalten, so dass der Grundzustand „nicht infiziert oder fieberfrei“ bei 37°C Körpertemperatur gespiegelt als „4 [1] 8 [24]“ erscheint, d.h. diese Aussage wird blockiert, so dass der Mensch gesund erscheinen soll. Der Zelltod wird vermutlich mit Wasserstoffperoxid H2O2=2+16=18E als Signalmolekül in Beziehung stehen, insbesondere wenn eine Zeitbasis=24 aufgerufen wird. Um die Fieberkurve für P. falciparum in 8 Intervallen darzustellen, werden diese beiden Bedingungen nacheinander eingeführt. Lebensgefahr bezüglich der Temperaturgrenze besteht, wenn der Platzhalter-O mit Null als unbesetzt gilt, d.h. das Fieber nicht aktiv gesenkt wird. Andererseits müssen die Makrophagen mit Hilfe des Fiebers die Infektion erkennen:
Zeit= 0 Stunden: 4 [1] 8 [2] 4 / 37°C; fieberfrei oder nicht infiziert
Zeit= 6 Stunden: 4 [1] 8 [0] 4 / 40°C; hohes Fieber
Zeit=18 Stunden: 4 [0] 8 [1] 4 / 38°C; leichtes Fieber
Zeit=30 Stunden: 4 [0] 8 [0] 4 / 41°C; Lebensgefahr max. Fieber
Zeit=48 Stunden: 4 [1] 8 [2] 4 / 37°C; fieberfrei !!!
Zeit=54 Stunden: 4 [1] 8 [0] 4 / 40°C; hohes Fieber
Zeit=66 Stunden: 4 [2] 8 [1] 4 / 39°C; Fieber
Zeit=78 Stunden: 4 [0] 8 [2] 4 / 41°C; Lebensgefahr max. Fieber
Zeit=96 Stunden: 4 [1] 8 [2] 4 / 37°C; fieberfrei !!!
Ersichtlich ist, dass die beiden Zeiten „96“ Stunden und „48“ Stunden zu Fiebersenkung wirksam werden, sobald im Platzhalter die Zeitbasis „24“ Stunden lesbar wird als„9_6“ [3333] „4_8“: Epi.Ref_Rhesus.Z.8“107“#“16“090“6333340“80“4.
tRNA-Gen lfd.Nr.32: Aminosäure „Tryptophan-Variante 1“= C11H12N2O2=66+12+14+16=108E. Der Mensch muss die Aminosäure mit der Nahrung aufnehmen. Tryptophan enthält ein Indol-Ringsystem [Tryptophan – Wikipedia]. Indol= C8H7N=48+7+7=62E [Indol – Wikipedia]. Tryptophan=108E ist in der Zeilen-Nr.Z.8“108“ direkt lesbar. Aufgrund der Serie Z.“81“0x kann QS8+1=9 gezählt werden. Zur Verbindung mit dem „Funktionspartner Var.2“ wird die gemeinsame Spalte „5-5“ genutzt, um ein Enzym „Tryptophan-tRNA-Ligase“=559AS anzufordern [Tryptophan--tRNA ligase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Somit ist auch zur ATP-Bindung ATP=551AS gemeinsam verfügbar. Ein Kreislauf ist dafür mit Kreis=64 in beiden Zeilen vorhanden, obwohl ein Kreislauf nur mit einem Kreis dargestellt werden muss. Ein Kreisteiler „64/2=32“ wird durch „8_8[64]8“ symbolisiert. Hierzu spiegelt sich an der Spalte der Schwerachse 8-4 das kleine Molekül „Ubiquitin=76AS“ als 8864“8“7“/866“6“4“74. Dieses Protein wird bei einer ATP-abhängigen hochenergetischen „Thiolesterbindung“ durch die Katalyse aktiviert. Der Austausch von „1x Sauerstoff=8 gegen 1 Schwefel=16“ ist mit einem 50%-Defizit im Vergleich Sauerstoff=8_8 [64]8 mit 8+8=16=Schwefel verbunden [siehe: QuickGO::Term GO:0008641 (ebi.ac.uk)]. Das Enzym des Funktionspartners kann damit aus „664“ idell ein Enzym=6“32“AS als Halbkreis in der Folgezeeile bilden. Die beiden Kreise 648/664 sind um eine Ziffer versetzt, damit die Schwerachse lotrecht steht. Damit ist gemeint, dass ein Calcium-Kanal = 2*(QS6+4)=20 in dieser Matrix liegt. Die Schwerachse wird zweckmäßig durch das Protein „Einzelstängiges DNA-bindende Protein“=284AS in der Spalte 8-4 besetzt. Die Ziffer „2“ fehlt in beiden Zeilen und muss am rechten Zahlenende aus der Spalte „8-3“ als QS8+3=11=Zählgröße gezählt und als Matroschka-Puppe=QS1+1=2 für das Protein=284AS reduziert werden. [Einzelsträngiges DNA-bindendes Protein - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Erst jetzt kann für Calcium das Protein ATPase4=1264AS links neben der Ziffer „3“ als QS7+5=12 gebildet werden und dann der Kreis=64 zu ATPase=1264 AS ergänzt werden [ATPase4 - Nicht-SERCA-Typ Ca2+ -transportierende P-ATPase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Als Calcium-Gegenspieler wird über die Spalte 7-7 eine Zeilenverbindung mit QS4+8+7=19=Kalium gebildet, dessen Ziffern sich in der Folgezeile mit 74[666]8 wiederholen. Das Protein „Kaliumkanal-Domäne (PfK2)“=1653AS teilt sich mit „16-53“ in den linken und rechten Zahlenrand [Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. Das Protein „Kalium-Kanal K1 (PfK1)“=1966 AS entnimmt die Zahl „19“ aus der Zeilen-Nr.Z.8“109“ und aus dem Code die Zahl „66“, wobei die Nullspalte „0-0“ den Kaliumkanal darstellt. In der Zeitdifferenz wird mit Kalium=19 ein Kanal „0“ in Verbindung mit der Zeitbasis „QS4+3+9+5+3=24“ zur Prozesssteuerung dargestellt als DELTA.TIME.Z.8108-Z.8109=#19_84“0“48_“43953“. Das Enzym „Tryptophan-tRNA-Ligase“=559AS zeigt eine „Liganden-Aktivität“, so dass ein dritter Teilnehmer als Ligand „Indolmycin“ beteiligt ist [Plasmodium falciparum tryptophanyl-tRNA synthetase | Aminoacyl-tRNA synthetases | IUPHAR/BPS Guide to PHARMACOLOGY]. Indolmycin=C14H15N3O2=6*14+15+21+16=136 [indolmycin – Wikidata]. Der Zweck liegt darin, für den Funktionspartner eine passende Moleküllänge in AS zu definieren. Das Indolmycin=136E zählt „1+ QS7+5=12=QS=13 und zieht aus der Spalte 5-5, die eine Spiegelung 53_35 zum Funktionspartner bildet, die beiden Ziffer 3 als 3+3=6 für Indolmycin=136E zusammen. Bei der ATP-Bindung entsteht AMP-Info=“16[ ]7“. Weil beide Zeilen eine gemeinsame Spalte 7-7 bilden, schließt AMP-Info=“16[ ]7“ über 2 Zeilen die Matrix [088648 /086664] ein. Die 64er Kreise sind enthalten. Beim Parasiten wird der enthaltene Token-86 für die Bewegungsrichtung der Nahrung zweckmäßig in der Richtung umgedreht, um beispielsweise die infizierten Leberzellen ins Blut zwecks Invasion der Erythrozyten zu verlassen. Die beiden Gene, die für „Tryptophan“ auf Chromosom 12 und 13 codieren, können aufgrund der Sequenzen der Basenpaare (bp) unterschieden werden. (PlasmoDB-ID: PF3D7_1251700)=1680 bp in der Ziffernfolge #1608 (PlasmoDB-ID: PF3D7_1336900)=1899bp in der Folgezeile in der Ziffernfolge „9981“ nur mit beiden Zeilennummern: Rückwärts in der Folgezeile „9_[0]-QS 1+8=9“ dann in der Spalte „81-81“ die Zahl „81“ entnehmen. Wissenschaftlich ist die genaue Anzahl der Gene für die codieren Aminosäuren bekannt, hier momentan aber noch nicht [siehe: Selektive Hemmung der Apicoplast Tryptophanyl-tRNA-Synthetase führt zu verzögertem Tod in Plasmodium falciparum - PMC (nih.gov); A. Stuart u.a. Jun 2016; Sci Rep. 2016; 6: 27531. doi: 10.1038/srep27531]: Epi.Ref_Rhesus.Z.8“108“#“160“88“64“8“79617“53“.
tRNA-Gen lfd.Nr.33: Aminosäure „Tryptophan-Variante 2“= C11H12N2O2=108E. Die Zahl „108“ wird zweckmäßig gespiegelt ebenfalls aus der Z.-Nr. als Ziffernfolge „810“ mit einer gemeinsamen Spalte „1-1“= Zählgröße zum Funktionspartner abgelesen. Enzym „tryptophanyl-tRNA synthetase“=632AS [„RCSB PDB - 4JFA: Crystal Structure of Plasmodium falciparum Tryptophanyl-tRNA synthetase“ mit Hinweis auf: „An appended domain results in an unusual architecture for malaria parasite tryptophanyl-tRNA synthetase“; Sharma, A.; (2013) PLoS One 8: e66224-e66224]. Das Enzym=632 AS ist nicht direkt lesbar. Die Ziffernfolge kann gespiegelt als „362“ zusammengesetzt werden. In Bezug auf das innere Tryptophan-Ringsystem (64=Kreis) wird die Ziffer „3“ als Ringanzahl [666] „Ring=O_EXTRA=8_666_4“ gezählt. Links folgt die Ziffer „6“, so dass sich zur Zeilenverbindung aus der Randspalte 1-1 die Zahl QS1+1=2 ergibt. Als Besondererheit ist als weiterer Zweck eine Lücke zur tatsächlichen ziffer „3“ als 08666[47477]3 mit 4+7+4+7+7=29 bildet. Über die gemeinsame Spalte 1-7 zählt sich mit der Ziffer 1 als Zeilenverbinder die Zahl Zink=30 zusammen. Das angeforderte Zinkfingerprotein „Domänen-enthaltendes Protein vom C3H1-Typ“=1689AS zählt sich als 1698 [Zinc finger protein - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt] In der Vorzeile wird die Ziffer 1 aufgenommen, links weiter mit Ziffer „6“ und „9“ [spalte7-7] _“8“.
Hotte Sauerland, Promotor der Heizkette "Wärmelskirchen", weigerte sich, seinem Nachbarn die Hand zur reichen.
Mensch: Tryptophan=C11H12N2O2=108E liegt in 2 benachbarten Kern-Zeilen als lfd.Nr.32/33 (Z.8108/Z.8109) vor, die Vor- und Folgezeilen als Komplex einschließen. Tryptophan enthält in der Struktur ein Indol-Ringsystem. Indol= C8H7N=48+7+7=62E. Der Indol-Test wird bei der Identifizierung von Bakterien verwendet, bei dem 1 Tropfen Dimethylaminobenzaldehyd=C9H11NO=72+11+7+8=98E eine kirschrote Verfärbung ergibt, wenn Tryptophan zu Indol abgebaut wird. Das Tryptophan=108E zieht sich unsichtbar als Serie #1[6]08 durch die Zeilen, weil es mit Sauerstoff O2=2*6=16E kombiniert ist, so dass eine störende 6er-Spalte trennt. In Z.8111 liegt Tryptophan neben Indol=62 (gespiegelt 26), wenn der Test-Tropfen=98E seitlich anliegt „1[6]08_26=Indol (62)_98=Dimethylaminobenzaldehyd. Die Indol-Gruppe kann durch das Protein (Mensch) TDO2 (P48775 • T23O)=406 AS katalysiert werden, wobei sich das gespaltene Ringsystem zwangsläufig mit dem BiXnom-Kreis=64 zeigen muss: L-Tryptophan + O2 =“N-Formyl-L-Kynurenin“= C11H12N2O4=66+12+14+32=124E [TDO2 - Tryptophan 2,3-dioxygenase - Homo sapiens (Human) | UniProtKB | UniProt]. Cofaktor=Häm=142AS [HBA1 - Hemoglobin subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Ringsystem liegt in der 64er-Kreis-Spalte „64/6664“, so dass das Ringsystem gespalten wird, wenn die Zahl „66“ zu QS6+6=12 verarbeitet wird, um die Ziffer „2“ zu erzeugen. Die Spalte“66=QS6+6=[1]2_“4“/“1“ enthält somit unsichtbar den Cofaktor „Häm“=142AS und “N-Formyl-L-Kynurenin“= 124E. Die Cofaktor-Spalte wird durch die Modifikation Protein „TDO2 ( D6RA50 • D6RA50)=65AS“ bestätigt, bei dem die Ziffer „5“ aus 4+1=“5“ entsteht [TDO2 - Tryptophan-2,3-Dioxygenase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „TDO2 (P48775 • T23O)“=406 AS spaltet das Ringsystem, in dem in der Kreis-Spalte 64/664[7] die Ziffer „0“ durch Addition erzeugt wird, und zwar absteigend als „4“_QS4+6=1“0“ in „0“_“6“ für 406AS, wobei die Addition aufgrund der Zählgröße 4+7=11 erfolgt. „Tryptophan“ muss der Mensch mit der Nahrung aufnehmen, wo es chemisch gebunden ist. Bei Pflanzen, Pilzen und Mikroorganismen wird bei der Synthese von Tryptophan die Chorisminsäure=C10H10O6=60+10+48=118E über komplexe Reaktionsmechanismen zu Tryptophan umgewandelt. Einige wichtige Enzyme sind dabei die Anthranilat-Synthase, die Anthranilat-Phosphoribosyl-Transferase und die Tryptophan-Synthetase“ [Tryptophan - Lexikon der Biologie (spektrum.de)]. Chorisminsäure=118E beginnt in der Z.Nr.-Matrix 8107/Z.8108 als 1_1_QS0+8=8 für 118E und zieht sich in Z.8110/8111 bis in die Code-Spalte „8118/8118“. Der Mensch synthetisiert zwar kein „Tryptophan“, muss es aber mittels Transfer-RNA transportieren. Das Protein (Mensch) Tryptophan-tRNA-Synthetase (G3V5U1 • G3V5U1)=153AS aktiviert in der Z.Nr.-Matrix den Bereich von Z.8107 bis Z.8111 aufsteigend als „1“_QS1+1+1+1+1=“5“_absteigend QS1+1_1+0=“3“ für 153AS. Das Protein (Mensch) Tryptophan-tRNA-Synthetase (G3V3P2 • G3V3P2)=150AS beginnt entgegengesetzt in Z.8111 als „1“_QS1+1_1+1_1=“5“_“0“ für 150AS. Das Tryptophan=108E kann somit über diesen Bereich ab Z.8107 gezählt werden aufsteigend als „1“_QS0+0+0=“0“_QS1+1+1_absteigend 1+1+1+1+1=“8“ für 108E. Das Enzym (Mensch) „Tryptophan-Hydroxylase (TPH)“=444AS wandelt L-Tryptophan in die Aminosäure „5-Hydroxytryptophan“=C11H12N2O3=66+12+14+24=116E um [Tryptophanhydroxylase – Wikipedia]. Das Protein (Mensch) „TPH1 - Tryptophan 5-hydroxylase 1 (TPH1)“=444AS benötigt den Cofaktor Fe^2+=Eisen=26 [TPH1 - Tryptophan 5-hydroxylase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Eisen=26 liegt in einer Spalte „666 [=6+6=1“2“__6=Eisen=26] / 8468 [QS8+4+6+8=26=Eisen] / 26=Eisen“ und dient dem Protein TPH1=444AS zur seitlichen Führung. Für „5-Hydroxytryptophan“ wird die Ziffer „1“ aus der Randziffer Z.811“1“ mit dem Code #16 zu 116E verbunden. Mit diesem Zeilenbezug wird „5-Hydroxytryptophan“=116E in der Code-Spalte „4“[7+4=11]/“1“1“[8]/“11“[8] absteigend als „11“_QS1_4+1=6 für 116E bis Z.8109 wirksam. Das Enzym „TPH“=444AS beginnt in dieser Zeile absteigend die Ziffer „4“ in der Spalte 8118/8118 aus 4 Zählgrößen „11“ zu zählen als QS1+1_1+1=4 _4[7]_4[7] für 444AS, wobei die Ziffer „7“ als 4+7=11 beseitigt wird, indem im Rücklauf Neurotransmitter Dopamin und Serotonin mit Bezug zum Nerv=7 produziert werden. Das Protein (Mensch) TPH1=33AS ist eine Modifikation, indem es nur 3 Zählgrößen als QS 11+11+(7+4=)11=33AS zählt [TPH1 - Tryptophan-Hydroxylase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Um aus „5-Hydroxytryptophan“ Neurotransmitter zu produzieren, wird das Protein (Mensch) „Aminosäure-Decarboxylase (DDC)“=480AS benötigt, weil dessen Cofaktor=“Pyridoxal-5'-phosphat (VitaminB6)“=C8H10NO6P=48+10+7+48+15=128E die Ausschüttung der Botenstoffe am Zeilenrand vermittelt. Das Protein (Mensch) „Aromatische-L-Aminosäure-Decarboxylase (DDC)“=480AS katalysiert die Decarboxylierung von Levodopa (L-3,4-Dihydroxyphenylalanin/L-DOPA)=C9H11NO4=54+11+7+32)=104E zu Dopamin=C8H11NO2=48+11+7+16=82E und L-5-Hydroxytryptophan zu Serotonin= C10H12N2O=60+12+14+8=94E [DDC - Aromatische-L-Aminosäure-Decarboxylase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Serotonin=94E besetzt den Zeilenrand Z.8111 in der Spalte [Nerv=7=5+2]91/001/129 aufsteigend als „9“_QS0+4=“4“ für 94 E und absteigend von Z.8113 als „9“_QS2+1+1=“4“ für 94E. Der Cofaktor „Vitamin B6“=128E hat diesen Weg zum Zeilenrand über die Spalte [81]“1“[8]/ [8]“118“[5291] aufsteigend als „1“_QS1+1=2_8 für 128E vermittelt. Weiterhin begrenzt der Cofaktor „Vitamin B6“=128E die Randspalte absteigend ab Z.8115 in der Spalte „8/12“ als 128E. Der Cofaktor enthält Wasser (H2O)=118=QS1+1+8=10, so dass das Protein „DDC“=480AS beim Durchlauf daraus die Ziffer „0“ gewinnt. Das Protein „DDC“ entsteht mit einem Membran-Bezug (33) absteigend von Z.8113 als [33]“4“_QS5+3=“8“_QS1+1+8=1“0“ für 480AS. Alternativ entsteht Protein „DDC“ mit einem Nerv-Bezug (77) aufsteigend ab Z.8109 als „4“ [77]_[11]“8“/QS1+1+8=1“0“ für 480AS. „Dopamin“=82E endet neben dem Start von Serotonin in der Randspalte „8“ [07=Nerv]/“2“[91] für 82E. Die Dopamin-Spalte steht senkrecht auf dem Vorprodukt „Levodopa“=104E am Zahlenrand „4001“ von Z.8112 als „1“_QS0+0=“0“_“4“ für 104E. Die Botenstoffe Dopamin und Serotonin beeinflussen als Signalmoleküle die Aktivität zugeordneter Gene, indem sie sich an das „Histon H3“ mittels „Histon-H3-Glutamin-5-Dopaminylierung (H3Q5dop)“ anlagern [„Dopaminylation of histone H3 in ventral tegmental area regulates cocaine seeking | Science“; A. Lepack u.a, April 2020; https://doi.org/10.1126/science.aaw8806]. Dieser Prozess kann mit dem Protein (Mensch) „Histone H3“=136AS im Code verfolgt werden [H3C1 - Histone H3.1 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Startzeile Z.8111 für Serotonin=94E entsteht das Histone-H3-Protein=136AS kreisförmig in der Spalte 11/53[7=Nerv] als „1“_“3“_QS1+5=“6“ für 136AS. Die enthaltene Spaltenzahl „53“ wird als Signalgröße=“53“ benötigt, um das Protein=136AS nochmals für „Dopamin“=82E zu finden. In beiden Z.Nrn. Z.8“10“8/8“10“9 kann 10+10=20=Calcium zur Prozesssteuerung addiert werden. Dieses ist auch in der signalisierten Randspalte 7“53“/“35“8 als Summe (7+3=10_5+5=10)=20=Calcium_QS3+8=11=Zählgröße möglich. Die Signalspalte hat die Energieversorgung über das ATP-Protein=553AS zum Inhalt. Histone-H3-Protein=136AS zählt sich nunmehr aus der Besonderheit [879=QS8+7+9=24=Zeit]_„6“/“4747“ als QS4+7=11_QS4+7=11 mit „1111“ in der Aufteilung „1“_QS1+1+1=“3“_6 für 136AS.
4 Proteine Tryptophan-tRNA-Ligase: Katalytische Aktivität: „ATP + L-Tryptophan + tRNA(Trp) = AMP + Diphosphat + H + L-Tryptophanyl-tRNA(Trp)+“. „Diphosphat“ liegt mit Bezug zur Diphosphorsäure=H4P2O7=4+30+56=90E in der Randspalte Z.Nr.-Matrix Z.810“9“/811“0“ für 90E. „Adenosinmonophosphat (AMP)“=C10H14N5O7P=60+14+35+56+15=180E zählt sich von Z.8108 bis Z.8112 als „1“_QS aufsteigend 1+1+1+1+1_absteigend 1+1+1=“8“_“0“ für 180E. Adenosintriphosphat (ATP)=C10H16N5O13P3=60+16+35+104+45=260E liegt am linken Zeilenrand der Serie „#160“ als QS1+1=2_60 für 260E in Z.8108/Z8109 vor, wobei das katalysierende ATP-Protein (Mensch)= 553AS die rechte Randspalte „53/35“ besetzt. Das Protein (Mensch) „Tryptophan-tRNA-Ligase (WARS1/ H0YJP3 • H0YJP3)“=185AS [WARS1 - Tryptophan--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt] und das. Protein (Mensch) „Tryptophan-tRNA-Ligase (WARS1/ B7Z448 • B7Z448)“=192AS [Tryptophan-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt ] besetzen in Z.8111 den rechten Zahlenrand als direkte Zahlenfolge „185“_“192“. Das Protein (Mensch) „Tryptophan-tRNA-Ligase (WARS2_mitochondrial)“=360AS [WARS1 - Tryptophan--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt] besetzt die Z.Nr.-Spalte „[8]11“0“/[8]111/[8]1“12“ als QS1+2=“3“_QS1+1_1+1+1_1+1=“6“_“0“ für 360AS. Das Protein (Mensch) „Tryptophan-tRNA-Ligase (WARS1_cytoplamic)“=471AS [WARS1 - Tryptophan--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt] liegt in der aktiven Code-Spalte von Z.8109 bis Z.8112 aufsteigend in „4“/11/11/3“74“ als 4_QS1+1_1+1_3=7_QS7+4=1“1“ daraus Ziffer „1“ für 471AS. In umgekehrter Zählrichtung wird das Protein „WARS1_Isoform 1“=471AS absteigend als „47“_QS3_1+1_1+1_4=11=Zählgröße für die Ziffer „1“ mit „Isoform 1“=471AS. Die Isoformen interagieren mit der oxydierten Form „GAPDH“=335AS [GAPDH - Glyceraldehyde-3-phosphate dehydrogenase - Homo sapiens (Human) | UniProtKB | UniProt], indem die Zahl 11 doppelt in der Wasserspalte „118/118“ gelesen und mit der Zählgröße 4+7=11 zu 11+11+11=33 addiert wird. „GAPDH“ liegt somit in der Spalte „47/11[8]/11[8]/5“ für 335AS, wobei die Ziffer=8=Sauerstoff darstellt. Das Protein Tryptophan-tRNA-Ligase=471AS durchläuft die Wasserspalte H2O=118 als „118/118“, woraus funktionelle Zusammenhänge resultieren. Ein Unterschied ergibt sich aus der „Isoform 2“=471AS, die seitlich rechts an der Wasserspalte vorbeizieht, und zwar senkrecht von Z.8112 aufsteigend als „4“_QS 5+5+7=“17“ mit einer Spiegelung für „Isoform 2“=471AS. Rechts davon ist eine Wasserspalte benachbart als Spalte „8/2“ für Wasser=28. Posttranslationale Modifikation von Tryptophan-tRNA-Ligase (WARS1_cytoplamic)“=471AS: Die proteolytische Spaltung erzeugt 2 Formen [T1-TrpRS und T2-TrpRS]. Daran ist vermutlich das „Interferon-Gamma“=166 AS beteiligt [Interferon-γ – Wikipedia], das zur Bildung von Fragmenten von Tryptophanyl-tRNA-Synthetase (TrpRS) beiträgt [Ein Fragment menschlicher TrpRS als potenter Antagonist von okuläre Angiogenese - PMC (nih.gov); P.Schimmel u.a.; Jan 2002; doi: 10.1073/pnas.012601899]. Das Interferon–Gamma in „[6]6647“ wird aufgrund der Zählgröße [6]66 QS4+7=11 für die Ziffer „1“ mit 166 AS gelesen: Epi.Ref_Rhesus.Z.“810“9#“160“86664“7477“3“58.
Das Medikament „Quetiapin“ beeinflusst biochemische Signalprozesse im Nervensystem, indem die Rezeptoren für Serotonin=94E und Dopamin=82E gehemmt werden. Ersichtlich ist, das Medikament „Quetiapin“=C21H25N3O2S=126+25+21+16+16=204E auf- und absteigend das „Serotonin“=C10H12N2O=60+12+14+8=94E durchkreuzt. Aufgrund der Hemmung des Serotonin-Rezeptors wird Dopamin=C8H11NO2=48+11+7+16=82E in erhöhter Menge freigesetzt. Das Kombinationsmedikament „Quetiapin•Hemifumarat“= (C21H25N3O2S)2•C4H4O4=2*204=408-(24+4+32)=60=408E+60E führt die Verdopplung 2*204=408 mit „4“_QS0+0=“0“_QS2+6=“8“ für 408E bereits seitlich an das Dopamin heran. Mit dem Hemifurmat-Anteil=“60“ wird Dopamin=82 über die Ziffer „0“ als „6“_QS8+2=10 als Ziffer „0“ für „60“E durchlaufen. Die Blockade des Dopamin-Rezeptors verhindert den hemmenden Einfluss auf das Nervensystem. Die Wirkung ist somit unübersichtlich und zweckmäßig auf die ausgewählte Gehirnregion abzustimmen. „Da durch „Quetiapin“ die Histamin-H1-Rezeptoren bereits in niedriger Dosierung blockiert werden, können vorübergehende quantitative Bewusstseinsstörungen (Somnolenz) tagsüber und eine Besserung des gestörten Tag-Nacht-Rhythmus auftreten [Quetiapin – Wikipedia]. Das Protein (Mensch) „Histamin-H1-Rezeptor (HRH1)=487AS bewirkt die „Kontraktion der glatten Muskulatur, die Erhöhung der Kapillarpermeabilität durch die Kontraktion der terminalen Venolen und die Katecholaminfreisetzung aus dem Nebennierenmark sowie die Vermittlung der Neurotransmission im Zentralnervensystem“[ HRH1 - Histamin-H1-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „HRH1“=487AS liegt links neben Dopamin=82E in der Randspalte „84“118“68/707257“4“12“ ab Z.8115 absteigend als 4_8_QS1+1=2 für 482AS. Beiden gemeinsam folgt in Z.8116 das komplette Gesamtsystem Nerv, Vene, Arterie sowie Schwerachse 84 und Muskel 55. Erwartungsgemäß liegt links neben dem Protein „HRH1“=487AS die Kombination von Schwerachse=84 und Zeit=24 als Spalte „84/2“ für den Schlafrhythmus. „Katecholamine“ werden im letzten Schritt durch die „Phenylethanolamin-N-Methyltransferase“ katalysiert und freigesetzt [Katecholamine – Wikipedia]. Protein (Mensch) „Phenylethanolamine N-methyltransferase (PNMT)“=282AS [PNMT - Phenylethanolamine N-methyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. „Katecholamine“ werden in der Randspalte „0129/[6]8/[1]2 ab Z.8114 aufsteigend als QS2+9=11=Zählgröße mit 1+1=“2“_“8“_“2“ gebildet mit dem Protein „PNMT“=282AS, wobei Dopamin=82E in Konkurrenz durchlaufen wird. Das Medikament „Mirtazapin“=C17H19N3=102+19+21=142E wird zu den tetrazyklischen Antidepressiva gezählt. „Es besetzt im Gehirn spezifische Bindungsstellen der Botenstoffe „Noradrenalin“=90E und „Serotonin“=94E und verändert damit den Einfluss dieser auf die Signalübertragung im Gehirn. Insbesondere steigert es indirekt die Freisetzung von „Dopamin“=82E im präfrontalen Cortex und die noradrenerge Übertragung in kortikal-limbischen Bereichen. Der Serotoninspiegel wird dabei nur unwesentlich beeinflusst“ [Mirtazapin – Wikipedia]. Das Medikament liegt links von Dopamin und nimmt den Schlafrhythmus in der Spalte [8]41/[0747707]“2“ als Kombination von Schwerachse=84 und Zeit=24 als „1_4_2“ für 142E auf. Weil das Medikament nicht wie Dopamin am Rand liegt, kann es nur auf das Nervensystem als QS0+7+4=11=Zählgröße_Nerv=7_707=Kanal einwirken. Hierüber kann in der Spalte 84/72 mit QS7+2=9_4 für 94E auch der Serotonin-Rezeptor erreicht werden. Der Botenstoff „Noradrenalin“= C8H11NO3=48+11+7+24=90E ist ein Katecholamin und erhöht den Blutdruck durch Verengung der Blutgefäße. Im Vergleich zum Adrenalin fehlt die Methylgruppe (-CH3), so dass zum Teil physiologisch unterschiedliche Wirkungen eintreten [Noradrenalin – Wikipedia]. Noradrenalin liegt doppelt in der Spalte „7072/9009“ als QS7+2=9_0 für 90E und verengt die Arterie=“9“_“0“0_9 um 1 Null für 90E, so dass sich der Blutdruck erhöht. Noradrenalin ist ein Neurotransmitter und wird von sympathischen Nervenfasern ausgeschüttet, dagegen stammt Adrenalin aus dem Nebennierenmark. Um die Wirkung der abendlichen Medikamente zu kontrollieren, kann eine unnötige Wirkung am Tage durch ein morgendliches Medikament „Venlafaxin“ =C17H27NO2=102+27+7+16=152E reguliert werden. „Venlafaxin“ ist ein Phenylethylamin-Derivat und wirkt als selektiver Serotonin-Noradrenalin-Wiederaufnahmehemmer im Zentralnervensystem, so dass der Wirkstoff bei Depressionen und Angsterkrankungen verwendet wird. Die Vorstufe als Derivat „Phenylethylamin“=C8H11N=48+11+7=66E liegt mit Membranbezug in der Spalte „33/51“ aufsteigend ab Z.8113 als QS3+3=6_QS5+1=6 für 66E. Das Medikament „Venlafaxin“=152E folgt in der Spalte 18“41“1“/707“2“57 und legt sich erwartungsgemäß in Z.8115 neben den Nervenkanal „707“ als „1“_QS4+1=5_2 für 152AS. Die Zeitspalte [8]4/2 an der Schwerachse „84“ wird dabei aufgenommen, so dass die Wirkung zeitlich begrenzt ist.
Im Zusammenhang mit der Partydroge „Ecstasy“ mit dem Wirkstoff „3,4-Methylendioxy-N-methylamphetamin (MDMA)“=C11H15NO2=66+15+7+16=104E können die Botenstoffe und „Noradrenalin“=90E und „Serotonin“=94E früher erkannt werden, weil Dopamin=82E dabei weiniger wirksam wird [MDMA – Wikipedia]. „Ecstasy“ wird teilweise als Medikament zugelassen, wobei einerseits ein Nutzen und andererseits dramatische Folgen festgestellt wurden. MDMA liegt scheinbar nur in Z.8112 am Zahlenrand Muskel=55_[3]_Nerv=7_„4001“ als „10“_QS0+4=“4“ für MDMA=104E. Die Ziffer „4“ ist in der Spalte 4/[45]01 verbunden, um MDMA=104E auch vertikal zu bilden. Die Ziffer „0“ gehört dabei als QS4+5=“9“_“0“ zum für „Noradrenalin“=90E und über die Spalte 4/0 ist ergänzend „Serotonin“=94E zählbar. In der Spalte ab Z.2118 „53/44/84“ wird vom Muskel 55 die Ziffer „5“ entnommen, um QS5+3=8_4 als Schwerachse=“84“ zu zählen, die in der Folgezeile Z.8114 als „84“118“ lesbar ist. Das Dopamin=82E ist mit der Schwerachse=84 verbunden, aber nicht mit den beiden MDMA-Zeilen als „8“_QS1+1=“2“ für 82E. Der antipsychotisch wirksame Wirkstoff „Haloperidol“= C21H23ClFNO2=126+23+17+9+7+16=198E liegt in Z.8112 in der Spalte in einer Nerv-7-Spalte [7]15/[7]33/[7]51 und zählt sich kreisförmig mit 3+3=6_4=Kreis als „1“_QS5+3+1=“9“_QS5+3=“8“ für 198E [Haloperidol – Wikipedia]. Die typischen „motorischen“ Nebenwirkungen liegen vor, weil das Muskel-Symbol „55“ zur Zählung der Schwerachse 5+3=“8“_“4“zerrissen wird. Bei der Zählung wird die Membran „33“ getrennt und durch den Kreis wieder neu als „33“ formiert. „Liquid Ecstasy“ (GHB / 4-Hydroxybutansäure)=C4H8O3=24+8+24=56E liegt in Z.8112 und kann die Nerv-7-Spalte doppelt tangieren in der Spalte 7155/7“33“4 als „5“_QS1+5=“6“ oder in der Spalte 5_QS3+3=6 für 56E. Das Hypnotikum (Schlafmittel) „Temazepam“=C16H13ClN2O2 =96+13+17+14+16=156E zählt ähnlich als „15“_QS3+3=6 für 156E. Das Hypnotikum „Flunitrazepam“ C16H12FN3O3=96+12+9+21+24=162E zieht mit einer Rechenaufgabe über die Randspalte seitlich an die Schwerachse=84 in der Spalte 74[001]/501[29]/[84]11[868] als QS7+4=11=Zählgröße, daraus nur die Ziffer „1“_QS5+0+1=6_QS1+1=2 für 162AS. In der Zeile 8113 sind der Histamin-H1-Rezeptor=12AS und Histamin-H3-Rezeptor=445AS lesbar und weitere sind zählbar. Ein Antihistaminikum (Histamin-Rezeptorblocker) blockiert diese Rezeptoren, so dass noch viele Wirkstoffe in diesem Zeilenbereich liegen. Bei Überdosierungen dient „Physostigmin“=C15H21N3O2=90+21+21+16=148E als Gegenmittel bei Vergiftungen. Dabei wird in Z.8114 die „verwirrte“ Schwerachse=84 lesbar mit „148E“ zur Problemlösung aufgenommen [K.-o.-Tropfen – Wikipedia; Antihistaminikum – Wikipedia]: Epi.Ref_Rhesus.Z.“810“9#“160“86664“7477“3“58.
Der körpereigene Botenstoff „Histamin“ wird gehemmt, wenn die Histamin-Rezeptor-Proteine durch Medikamente als Antihistaminikum verwendet werden. Chronische Entzündungsprozessen und allergischen Reaktion werden von Histamin begleitet [Histamin als Immunmodulator - Bäumer - 2010 - JDDG: Journal der Deutschen Dermatologischen Gesellschaft - Wiley Online Library; DOI: 10.1111/j.1610-0387.2010.07346.x]. Die 4 vier verschiedenen Histaminrezeptoren H1 bis H4 können im Zeilenlauf besser erkannt werden, wenn spezielle Medikament funktionell einwirken.
Die Hemmung des „Histamin-Rezeptors H1“=487AS erfolgt dadurch, dass sich das Antihistaminikum „Triprolidin“=C19H22N2=114+22+14=150E in den Pfad des Rezeptors legt [HRH1 - Histamin-H1-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt] Gleichzeitig wird auch der Neurotransmitter „Acetylcholin“=C7H16NO2=42+16+7+16=81E gehemmt. Der Neurotransmitter=81E in der Serie Z-Nr.“81“xx wird in der Zeile Z.“81“_“14“ im Code als „18_41_18“ gespiegelt. Daraus resultiert aber keine Hemmung. Der Histamin-Rezeptors H1=487AS muss in der Vorzeile die Zahl 44 durchlaufen. Deshalb ist kann nicht direkt mit der Ziffer „4“ gestartet weden, sondern mit der Ziffer „1“ absteigend als QS1_3=“4“_QS4+4=“8“_QS5+0+1_0+0+1=“7“ zur Randziffer „1“ in Zeile Z.8112. In Z.8110/8111 folgt weiter absteigend die Randspalte 7/1 für Chlor=17 der Salzsäure HCl für „Triprolidin•Hydrochlorid“. Über diese Randzeile kann der Neurotransmitter „Acetylcholin“=81E als QS5+0+1+2=“8“_QS0+1=“1“ für 81E gezählt werden. Das Medikament „Triprolidin“=150E liegt in Z.8114 absteigend in der Spalte 50/1 als 1_50 für 150E im Pfad des Rezeptors, so dass auch kein Neurotransmitter freigesetzt wird. Der „Histamin-Rezeptors H2“=359AS wird von Chlor =17 seitlich mit der Randspalte und im Kopfbereich in einer Randspalte 61753/7“35“8/58“0“7/52“9“1 ab Z.8108 flankiert, und zwar als „35“_QS0+9=“9“ für 359E [HRH2 - Histamin-H2-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Chlor=17 liegt seitlich und nochmals doppelt in Z.8107/8108. Das Antihistaminikum „Roxatidin“=C17H26N2O3=102+26+14+24=166E blockiert diesen Chlor -Kopfbereich als Spalte „1753/7358“, um die Zahl 5 in der Spalte 5/5 auf 6_6 zu erhöhen. Der Start liegt zur Bildung der Ziffer „1“ bereits am Zeilenrand Z.8111 absteigend als QS2+9=11, daraus die beiden Ziffern „1“ als „1“_QS1_0_5=“6“_ nach rechts Zählgröße 8+3=11 oder nach links Zählgröße QS1+7_3=11 nur für die Ziffer „1“ als QS5+1=6 für 166E. Das Medikament liegt im Pfad des Rezeptors. Ein Bezug zur Salzsäure ist damit ausgeschlossen, weshalb „Roxatidin“ bei Erkrankungen von Magen und Zwölffingerdarm angewandt wird [Roxatidin – Wikipedia]. Der Histamin-Rezeptor H3=445AS ist in Z.8113 direkt lesbar und die Modifikation als Histamin-Rezeptor H3_Isoform=301AS steigt in Z.8112 neben der Schwerachse=84 als QS1+1_01=“3“_“0“_QS0+1=“1“ zur Randziffer „1“ herab. Das Antihistaminikum „Pitolisant“= C17H26ClNO=102+26+17+7+8=160E liegt in der Spalte 50/11 als „1“_QS1+5=“6“_“0“ für 160AS verhindert, dass die Schwerachse=84[11] über QS1+1=2_4 mit der Zeitbasis „24“ kombiniert werden kann. Die die „verwirrte Zeitbasis“ blockiert wird, um eine Erkrankung durch Schläfrigkeit am Tage zu behandeln [Pitolisant – Wikipedia]. Die Schwerachse 84 hängt nochmals doppelt als Spalte und Zeile in Z.8115 an der potenziellen Zählgröße 74=QS7+4=11, so dass sich der Histamin-Rezeptor H3=445AS funktionell in der Spalte [8]“4“11[8]/[72]“5“74 ab Z.8114 aufsteigend als „4“_[QS1+1_QS7+4=11=QS1+1=2 für Summe 2+2=] „4“_“5“ für 445AS bildet. Die Schwerachse „84“=QS8+4=“12“ ist eine halbe Zeitbasis=24 und kann die Schläfrigkeit am Tage beschreiben.
Das Protein (Mensch) „Histamin Rezeptor H4“=390AS liegt in Z.8112 aufsteigend in der Spalte 3[740]/[334]450[1] als „3“_QS4+5=“9“_“0“ für 390AS [HRH4 - Histamin-H4-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Abweichend: Gewebshormon „Histamin“=C5H9N3=30+9+21=60E [als QS5+0+1=6_0 für 60E gemäß „Histamin – Wikipedia“] oder Histamin=C5H10N3=30+10+21=61E [als „5“_QS7+4=11, zerlegt für QS5_1=6_1 für 61E gemäß „PharmaWiki - Histamin“]. Histamin besteht aus einem Imidazolring mit einer Ethylaminseitenkette. Für das enthaltene Imidazol= C3H4N2=18+4+14=36 ist ein 64er Ring als Spalte „4“/QS5+0+1=“6“ vorhanden. „Histamin“ wird im Körper aus der Aminosäure Histidin biosynthetisiert. „Histamin“ wird nach der Bindung der Allergene an IgE-Antikörper freigesetzt und verursacht allergene Reaktionen. Im zentralen Nervensystem wirkt Histamin als Neurotransmitter zur Aufrechterhaltung der Wachheit, am zirkadianen Rhythmus und an der Appetitregulation mit [IGHE - Immunoglobulin heavy constant epsilon - Homo sapiens (Human) | UniProtKB | UniProt]. Der Histamin-Rezeptor wird um die Gruppe 44 angeordnet, um auf das seitlich anliegende Gewebe=Membran=33 einwirken zu können. Zu dieser Gewebsgruppe gehört im Protein-Kopfbereich eine Gewebsspalte 6[6]64“74“[7]/46[8]“11“[88]/269[8]“11“[8], die sich vorgelagert von Z.8109 bis Z.8111 aus 3 Zählgrößen „11+11+[QS7+4=]11=33 zusammensetzt. Im Krankheitsfall können als Normalfall Entzündungen eintreten, die die Aktivität von Gewebsmakrophagen auslösen. Eine dramatische Situation entsteht bei einer Allergie, die mit der potenziellen Zählgröße 74=QS7+4=11 zugleich den BiXnom-Kreis „64“74“ aktiviert. Über die Spalte 6/4 und die Gegenkrümmung „46“ kann aus der Serien-Z.Nr.811x ein Membran-Kreislauf „11+11+11=33“ inszeniert werden. Der Kreislauf=64 ist bereits in Zeile Z.8108 speziell auf die Ziffer „8“ fixiert, die sich über eine Code-Spaltenserie auch über 5 Zeilen der Serie „8“, „8“_64_“8“ und der Randziffer „8“ aus der Zeilen-Nr.Z.810“8“ zu einem Code-Ring 8*8=“64“ formieren lässt. Um den dramatischen Verlauf der Allergie zu stoppen, wird ein Antihistaminikum verwendet. Der Wirkstoff „Imetit“=C6H10N4S=36+10+28+16=90E hemmt den „Histamin Rezeptor H4“=390AS wirksam, weil die Ziffer „9“ übereinstimmt. Die Zahl „90“ ist aber unpräzise und kann viele Nebenwirkungen auslösen. Der Wirkstoff „Thioperamid“=C15H24N4S=90+24+28+16=158E ist funktionell angepasst, weil der Rezeptor im Kopfbereich inklusive der Zählgröße „11“ gehemmt wird, die für einen Bezug zum Gewebe „33“ erforderlich ist [Thioperamide - Wikipedia]. Das Medikament stimmt in der Summe mit dem natürlichen Testosteron= C19H28O2=158E überein. „Thioperamid“ liegt in der Spalte „1“[185]/“5“[374]/“44“[50] aufsteigend ab Z.8111 als „1“_“5“_QS4+4=“8“ für 158AS, so das der erregte Kreislauf mit der Ziffer „1“ unterbrochen und der Rezeptor mit der Ziffer „4“ blockiert wird. Das Medikament stimmt summarisch mit dem natürlichen Testosteron= C19H28O2=158E überein. Die Allergene werden vom Antikörper „IgE“=546E als 5_4_QS3+3=6 für 546AS freigesetzt, der von „Thioperamid“ ebenfalls gehemmt wird [IGHE - Immunoglobulin heavy constant epsilon - Homo sapiens (Human) | UniProtKB | UniProt]. „Thioperamid“ ist ein Antagonist von Histamin-Autorezeptoren [Thioperamid – Wikipedia]. In der intrazellulären Signalkaskade sind Ca2+, Ap-1 und cAMP bei den 4 Histamin-Rezeptoren H1-H4 unterschiedlich gerichtet. „Thioperamid“ steigert die cAMP-Aktivität, wenn der Histamin-Rezeptor H4 gehemmt wird. Weil das „Cyclische Adenosinmonophosphat (cAMP)“=C10H12N5O6P=60+12+35+48+15=170E als Teilgröße in den Histamin- Rezeptor H4 mündet, muss sich die „cAMP“-Aktivität zwangsläufig erhöhen. Das Molekül „cAMP“=170E muss hierfür in der Spalte „5“0“[1]/“11“[8]/[5]“74“ ab Z.8115 absteigend gelesen werden, und zwar als QS7+4=11, daraus nur die Ziffer „1“_QS1+1_5=“7“_“0“ für 170E. Das Protein (Mensch) „PDE4A“=886AS verarbeitet cAMP und liegt in der Spalte „501“[29]/“11“86“[8] als QS1+0+5_1+1=8_86 für 886AS. Funktion: Hydrolysiert den zweiten Botenstoff „3',5'-zyklisches AMP (cAMP)“, der ein wichtiger Regulator vieler wichtiger physiologischer Prozesse ist [PDE4A - cAMP-spezifische 3',5'-zyklische Phosphodiesterase 4A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „cAMP-specific 3',5'-cyclic phosphodiesterase 4D“=809AS kann den Histamin-Rezeptor H4 nicht erreichen und findet eine andere Position für „cAMP“ in einer Nerv-7-Spalte „747707_QS2+5=7_77_QS4+1+2=7“ in Z.8115 als QS7+4=11, davon die Ziffer „1“_“70“ für cAMP=170E. Das Protein „cAMP- Phosphodiesterase“=809AS zieht ab Z.8114 aufsteigend links neben der Schwerachse=84 in der Spalte „1“_[84]/47707/9009 durch „cAmp“ als QS1_0+7=8_09 für 809AS. Für das Protein wird ein wissenschaftlicher Zusammenhang mit Lern- und Gedächtnisleistungen vermutet [PDE4D - cAMP-spezifische 3',5'-cyclische Phosphodiesterase 4D - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt.
Zugang zu den Proteinen im Gehirn: Weil das Endhirn aus Proteinen besteht, handelt es sich nicht um einen wirren Eiweißhaufen, sondern um Funktionsträger. Für die Bedienung einer Raumstation wird im Kontrollzentrum auf der Erde ein Funktionsmuster vorgehalten. In diesem Sinne wird nachfolgend angenommen, dass im Gehirn ein Protein-Muster angelegt ist, das real z.B. massenhaft im Herzmuskel enthalten ist. In der Episode „Epi.Vir“ [Körper-Kontroll-Durchlauf nach Virusinfektion] wird der Hirn-Bereich „Claustrum“ als „BiXnom-Rechenmaschine (CPU)“ eingeschätzt. Wissenschaftlich ist dessen Funktion noch nicht geklärt. Weil Neuronen in diesem Bereich auf eine charakteristische Weise feuern, wird eine Sexualempfindung vermutet [Claustrum – Wikipedia]. In 3 Zeilen ist „cAmp“=170E lesbar: Episode.Epi.Vir.Z.38220#16“170“9“50868“24“34, Episode.Epi.Vir.Z.38221#161705277775“11“4“ und Episode.Epi.Vir.Z.38222#16“170“1047089“180“. Das Protein „cAMP- Phosphodiesterase“=809AS ist in der Zeile QS1+7=8_09 für 809AS enthalten und zieht nochmals als Spalte über alle 3 Zeilen absteigend als QS1+7=“8“_QS0+0+0=“0“_“9“ für 809AS. In der Randspalte „114/180“ sind kompakt die Zählgröße „11“, die Zeitbasis QS1+1=2_4 für „24“ und die Schwerachse „8“_QS0_4=“4“ für „84“ sowie Testosteron= C19H28O2=114+28+16=158E als „1“_QS1+4=“5“_QS0+8=“8“ für 158E. Die mittlere Nerv=Form=Bild-„7“-Zeile entwickelt eine extreme 7er-Länge mit „QS5+2=7_7777_QS5+1+1=7“. Als Rechenfunktion beherrscht das Protein mittels Membran=33 über eine Klammer „3_254_3“ die Zählgröße QS 2+5+4=“11“ in der Zeitdifferenz DELTA.TIME.EPI.VIR.Zeile.Z.38220-Z.38222=“84“6159“32543“. Diese Umkehrung bewirkt im Ergebnis die Auslösung einer aktiven Handlung. Die Zahl „6159“ beschreibt einen Rechenvorgang, dem die Schwerachse=84 als Kontrollinstrument beigeordnet isr. Der Mittelwert=(61+59)/2=60=Zeitbasis simuliert einen 1-Sekunden-Takt, wobei die Ziffer „1“ den üblichen Zähler bildet. Das Protein (Mensch) „Geschlechtsbestimmende Region Y Protein (SRY)“=204AS endet im BiXn-Punkt der Episode.HOV.Zeile.Z.210, weil das Protein nur die männliche Entwicklung steuert. Im männlichen erwachsenen Gehirn ist das Protein an der Aufrechterhaltung der motorischen Funktionen von dopaminergen Neuronen beteiligt [SRY - Sex-determining region Y protein - Homo sapiens (Human) | UniProtKB | UniProt]. Zufällig ist das SRY-Protein in Episode.Epi.Vir.Z.38“204“#161777233322234 in der Z.Nr.Zx“8“204“ lesbar, und zwar als Kombination mit Dopamin=82E. Im Code umklammert die Männlichkeit=33 die Zahl 66 (weiblich), so dass die Zeile einen männlicher Bezug mit „3_QS3+3=“6“_QS2+2+2=“6“_3“ enthält. Das Testosteron=158E liegt in der Randspalte „234/374“, in einer Ringzählung QS7+4=11, zerlegt in „1“_QS1_4=5_QS2+3_3=“8“ für 158E. Eine motorische Funktion als Muskel ist nicht direkt ersichtlich. Intrazelluläre Bewegungen erfolgen durch Motorproteine, die die Energie aus der Hydrolyse von ATP nutzen [Motorprotein - DocCheck Flexikon]. ATP (Adenosintriphosphat=C10H16N5O13P3=60+16+35+104+45=260E) wird vom Protein (Mensch) „Mitochondriale Membran-ATP-Synthase“=553AS katalysiert [ATP5F1A - ATP synthase subunit alpha, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Energieversorgung der „Rechenzentrale“ wird die Zahl 553 über eine Code-Randserie „1“ ausgedehnt über die Anzahl von QS5+5+3=13 Zeilen von Episode.Epi.Vir.Z.38199 bis Z.38211 gezählt, die die Zählgröße „11“ enthält, wobei das Protein mit 553 AS gespiegelt als 355 enthalten ist und den Muskel 55 symbolisiert. ATP=260E zählt sich in der letzten Z.-Nr. Z.38222 absteigend als „2“_QS2_2_2=“6“_“0“ für 260E.
Das Motorprotein „Dynein“ ist mit seinen beiden Ketten in der Randspalte zählbar. Protein (Mensch) „Dynein__Kette 1“=4307AS absteigend zur Vorzeile als QS2+2=“4“_“3“_QS4_6=10 nur für Ziffer „0“_“7“ [DYNC2H1 - Zytoplasmatische Dynein-2-Schwerkette 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein (Mensch) „Dynein__Kette2“=4427AS aufsteigend zur Folgezeile mit der Spalte 33/88 aufgrund der Zählgröße 3+8=11=QS1+1= 2, doppelt als Ziffer 4. Weiter mit QS2+2=4_2_QS3+4=7 für 4427AS [DNAH2 - Dynein axonemale schwere Kette 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Mototprotein (Mensch) „Kinesin, schwere Kette“=963AS in der Spalte 333/9 als „9“_QS3+3=“6“_“3“ für 963AS [KIF5B - Kinesin-1 heavy chain - Homo sapiens (Human) | UniProtKB | UniProt]. Motorprotein (Mensch) „Kinesin, leichte Kette“=573AS in der Randspalte 23[4]/37[3] als QS2+3=5_7_3 für 573AS [KLC1 - Kinesin light chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Motorprotein „Myosin“ bildet zusammen mit Aktin, Tropomyosin, Troponin die kontraktile Einheit des Muskels. In der Grobstruktur besteht das Myosin-Filament aus 200 Molekülen, die in Zeile Z.38204 als Spalte 2/0/0 vorhanden sind. Myosin besteht aus 2 schweren- und 4 leichten Ketten. Die Z-Nr. Z.38203 für die Myosin-Spalten ist erreichbar, wenn die leichte Kette mit 165AS in der Z.Nrn.-Matrix [Z.38]“201“/ [Z.38]“202“/ [Z.38]“203“ als „1“_QS2+0_2+0+2=“6“_QS2+0+3=“5“ für 165AS gezählt wird [Myosin light chain 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Z.38“2“0“4“ zeigt dann mit der Ziffer „2“ zwei schwere Ketten und die Ziffer „4“ vier leichte Ketten an, wobei die Serien-Zahl „38“=8+3=“11“ eine Zählgröße bildet. „Myosin“ bewirkt die Muskelkontraktion und zeigt verschiedene Modifikationen: „Myosin 11“=1972AS als linke Randspalte Z.38203 aufsteigend „1“_QS1_1+7=“9“_“72“ für 1972AS [MYH11 - Myosin-11 - Homo sapiens (Human) | UniProtKB | UniProt]. „Myosin 15“=1946AS als „Spalte 146/72[3] in Z.38203 als „1“_QS7+2=“9“_46“ für 1946AS [MYH15 - Myosin-15 - Homo sapiens (Human) | UniProtKB | UniProt]. „Myosin 1“=1939AS als „Spalte 1[46]/723/[29]9 in Z.38203 aufsteigend als „1“_QS7+2=“9“_“3“_“9“ für 1939AS [MYH1 - Myosin-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Myosin 2“=1941AS als „Spalte 1[46]/723/[29] 9 in Z.38203 absteigend als QS2+7+2=11, für Ziffer „1“ _QS3_6=9_4_1 für 1941AS[MYH2 - Myosin-2 - Homo sapiens (Human) | UniProtKB | UniProt].
„Tropomyosin“ ist an seiner Eigenart zu erkennen, dass das Protein im Protein „Aktin“ liegt und sich dort aus zwei spiralförmigen Ketten von je 284AS (Summe 568AS) zusammensetzt. Tropomyosin=568AS wird sich zu diesem Zweck in Z.38206 spiralartig mit der Endziffer QS1+7=“8“ neben den doppelten BiXnom-Kreis „6464017[8]“ gelegt. Eine der beiden Spiralen=284AS bildet den Zahlenteil 28… aus der Z.Nr. 38“208“ und zählt über 4 Zeilen die Coderandspalte #1 von Z.38206 bis 38209 zusammen als Ziffer „4“, wobei wegen der Serie #161 mit der folgende Ziffer „1“ mit dem BiXnom-Kreis „64“ eine Spirale kreiert wird. Die zweite Spirale liegt in der Randspalte [640]17/[63]16[2]/“84“4[70]/“2“[7940] absteigend von Z.38209 als 2_8_4 für 284AS und geht in der Gruppe „44“ weiter absteigend in die Gesamteinheit für Tropomyosin=568AS als QS4_1=5_6_QS1+7=8 für 568AS über. Diese 4 Zeilen enthalten die 200 Moleküle für Myosin-Filamente als Spalte Form=“7“_Anzahl=“2_0_0“. Aufgrund der 4 aktivierten Zeilen kann „Aktin“ aus der Code-Serie #161 absteigend als QS1+1+1=“3“, Wende in Z.38206 aus QS1+6=“7“, absteigend QS1+1+1+1=“4“ für 374AS gezählt werden. Weil „Topomyosin“ im „Aktin“ enthalten ist, kann „Aktin“ dessen Ziffer „2“ überspringen, um „Aktin“ alternativ zu zählen.
Und zwar in der Zeile Z.38209 als “3“_QS8+2=10 für die Ziffer „0“ aus der Topomyosin-Spalte, die dadurch die Zahl „2“ beseitig. Weiter gezählt mit den Ziffern „7“ und „4“ aus der Spalte 4/7 für Aktin=475AS. Tropomyosin=568AS folgt nunmehr absteigend dem Aktin=474AS. Weil „Aktin“ im Zeilenlauf dem „Tropomyosin“ folgt, muss die Lücke zum rechten Zeilenrand durch 3 verschiedene Untereinheiten (I, T und C) vom Protein (Mensch) „Troponin“ gefüllt werden, das die Herzmuskulatur bildet. „Troponin“ ist das zentrale regulatorische Protein der Kontraktion der quergestreiften Muskulatur. Wird der Herzmuskel geschädigt, ist „Troponin“ verstärkt im Blut=26 messbar, das gefäßartig „0“ in der Z.Nr.Z.38206 als „2“0“6“ vorhanden ist, so dass „Troponin“ nachfolgend in den Z.38307-Z.38309 liegt. Für den Herzmuskel muss „Troponin-C“ die Zeitbasis „60“ erzeugen, indem das Calcium=20E in der Z.-Nrn.-Serie Z.[38]“20“x über 3 Zeilen mit 3*20=60=Zeitbasis „Sekunde“ gezählt wird. „Troponin-C“=161AS ist die linke Code-Rand-Serie „#161“[TNNC1 - Troponin C, slow skeletal and cardiac muscles - Homo sapiens (Human) | UniProtKB | UniProt]. Die Bindung von Calcium an „Troponin-C“ hebt die hemmende Wirkung von Troponin auf Aktinfilamente auf, wenn die Zeitbasis aktiviert wird. Damit diese 3 Zeilen eine Einheit bilden, muss der Spaltensummenwinkel=180° vorliegen. Zwei Zeilen enthalten den Winkel=60° und mit 3x Calcium=60 sind zusammen 180° avisiert. In der 1. Zeile liegt aber nur der Winkel=30° und die Randzahl „29“ vor, so dass der Herzschlag von 1 Sekunde fehlt. Diese 1 Sekunde ist der Zahlenrand der 3. Zeile in der Randspalte 29/09/01. Von der Zahl „29“ zur Addition der Ziffer „1“ geht es am Zahlenrand nur durch Ziffer „9“=Arterie mittels Herzschlag. Weil das Calcium=20E in der Randspalte vorhanden ist, wird die Randziffer „9“ aus „29“ in der 1. Zeile ignoriert, indem die störenden 2. Randziffer „9“ über den Calcium-Weg für die Zählung verwendet wird. Ringzählung mit Herzschlag für Winkelsumme „60+60+30+[QS2_0=2_9 für 29 plus 1=]“30=180°. Das Herzmuskel-Protein (Mensch) „Troponin I“=210AS folgt diesem Herzschlag-Pfad als QS2_0=2_QS9+1=10 für 210AS, wobei ein 1-Sekunden-Takt auch über eine Hemmung erzeugt werden kann. „Troponin I“ ist die hemmende Untereinheit von Troponin und besitzt eine Calciumsensitivität [TNNI3 - Troponin I, Herzmuskel - Homo sapiens (Mensch) | UniProtKB | UniProt]. Eine Modifiktion vom Protein (Mensch) „Troponin I_ A8CLR6“=44AS benutzt die Gruppenbildung „44“ zwischen der Tropomyosin-Spirale=284AS und dem Gesamtmolekül aus 2 Spiralen=568AS zur lesbaren Orientierung. Die Ziffer „4“ stammt aus der Gruppe 44 in der Spalte [316]“2“[9]/[4]“470“[9]/[79]“40“[1] aufsteigend als 2_QS7+4=11=QS1+1=2 für 2+2=“4“_QS0+4=“4“ für 44AS. Hierbei wird die Randziffer „1“ für den Herzschlag „1“ bei der Zählung nicht verbraucht, d.h. nicht gehemmt. Das Protein (Mensch) „Troponin T“=298AS ist die Tropomyosin-bindende Untereinheit von Troponin und besitzt eine Calciumsensitivität [TNNT2 - Troponin T, Herzmuskel - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Troponin T“ liegt folglich neben „Tropomyosin“ in der Randspalte „8/29“ absteigend als 29_8 für 298AS..
Im Unterschied zu „Dynein“ ist das Enzym „Dynamin“ kein Motorprotein, sondern dient zur Einstülpung der Zellmembran, um äußere Stoffe aufzunehmen (Endozytose). „Dynamin“ ist an der Abschnürung neu gebildeter Vesikel und deren Transport beteiligt. Die Z.Nr. Z.38200 enthält ein Volumen „00“, mit „334“ eine Membran-Blase als 3+3=6_4=Kreis und mit 6666 Dopplungen der Membran 33, die bei einer Einschnürung entsteht. Enthalten ist auch eine Addition 17+17=34: Episode.Epi.Vir.Z.382“00“#16“17“94“17““334“6666“. Das Protein (Mensch) „Dynamin1“=864AS enthält bereits den Kreis für ein Vesikel und ist als QS 1+7=“8“_QS3+3=“6_“4“ für 864AS in der Zeile vorhanden [DNM1 - Dynamin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Ziffer „8“ ist zur Vor- und Folgezeile in der Spalte 8/3/8 doppelt als direkte Startziffer statt 1+7=“8“ vorhanden. Zur Nahrungsaufnahme der Zelle ist wie der Nahrungsweg beim Insekt in den Kropf, der Token-86 als Transportrichtung im Protein mit der Zahl „86“ enthalten. Funktion: vesikuläre Transportprozesse und Endozytose. Krafterzeugendendes Protein, das Guanosintriphosphat (GTP)= C10H16N5O14P3=60+16+35+112+45=268E binden kann, und an der Bildung von Mikrotubuli-Bündeln beteiligt ist. Mit #1_“617“_“1733“ ist eine Spiegelung zum linken Zeilenrand als Serie vorhanden, so dass GTP am linken Zeilenrand gebunden wird, was auch das spezielle GTP-Bindungsprotein=216AS anzeigt (RAN - GTP-binding nuclear protein Ran - Homo sapiens (Human) | UniProtKB | UniProt). Das Protein (Mensch) „Dynamin2“=870AS zieht durch die Spalte [89]0/[3]34/8[00] absteigend als 8_QS3+4=7_0 für 870AS, wobei die Membran „33“ beim Abstieg gekreuzt wird [DNM2 - Dynamin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynamin 3“=869AS liegt in der Spalte 89/33 als „8“_QS3+3=6_9 für 869AS durch die Membran „33“ [DNM3 - Dynamin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Weitere Hirn-Funktionsbereiche im „Claustrum“ sind für die Lunge mit Sauerstoff=Vene=8 zu erwarten und das Immunsystem ist über die Lymphdrüsen erreichbar, die als Kette über die Zählgröße „11“ gezählt werden:
Abbildung der Nervenzellen: Die Abbildung von Zellen im „Claustrum“ als BiXnom-Rechenzentrum im Gehirn enthält in der Empfangseinheit mit der der Startzeile Epi.Vir.Z.38“19“9#1“6“1798“40“8“90“7“109“ die Zahl „19“=Kalium und am Zahlenrand ebenfalls kanalartig die Zahl „1“0“9“. In den 10 folgenden Zeilen „Z.3820x“ zieht die Kanal-Ziffer „0“ mit, die zugleich mit der Zahl „20“ einen Calcium-Kanal bildet. Das Protein (Mensch) „Calcium-aktivierter Kalium-Kanal“=1236AS kann das Kalium=19 als „109“ vom rechten Zeilenrand als Startposition als Ziffer „1“ nutzen. Die Spalte 07/4[6] enthält die potenzielle Zählgröße 74=QS=11=QS=“2“ für Protein= 12 (36)AS. Die Aktivität des Proteins wird bei einer Konzentration von Magnesium=12E erhöht. Das Magnesium wird somit verbraucht und dient nicht als seitliche Begrenzung zur Pfadfindung als Cofaktor. In der Folgezeile „Epi.Vir.Z.381“20“#16179417334“6666“liegt Calcium=20E in der Z.-Nummer. Das Protein versteht den möglichen Zweck der Zahl „6666“ zur Verdrillung von Membranen 33 nicht und codiert daraus alternativ QS6+6=12=Magnesium, um es sofort zu verwenden als QS1+2=“3_6“[6] für Protein=“1236“AS. Die Aktivität des Proteins wird gehemmt durch „HÄM“=Fe-haltiges Protoporphyrin IX=C34H32FeN4O4=204+32+26+28+32=322E. Weil das Protein die Zahl „34“ in „3“34“6666“ durch die Zählgröße und Magnesium in (3)„22“ umformt, wird Häm=322E zählbar und wirkt hemmend, sofern es örtlich vorhanden ist. Die Kanal-Gifte „Iberiotoxin (IbTx)“ und „Charybdotoxin (CTX)“, jeweils mit 37AS, behindern nicht das Protein, aber das Gift würde die porenartige Kanallücke 3…7 in der Spalte [3]“3“[46]/[800]“7“zusammenziehen und dabei den Kanal verschließen [KCNMA1 - Calcium-aktivierte Kaliumkanal-Untereinheit alpha-1 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Die Nervenzellen sind durch Synapsen verbunden, an denen Signale in Form von Neurotransmittern übertragen werden. Eine Zelle sendet und die andere hört zu. Die Transmitter sind in der Senderzelle in synaptischen Vesikeln gespeichert. Die Freisetzung erfolgt durch einen Calcium-abhängigen Prozess von der Zelle in den Extrazellularraum mit einer Fusion von Vesikel- und Zellmembran (Exocytose). Hierbei sind SNARE-Proteine beteiligt. SNARE-Proteine katalysieren den Transport von kleinen Molekülen in den synaptischen Spalt „101“ in Epi.Vir.Z.38202#16178570289“101“7, der mit „02891“01“ das Calcium=20E zählbar enthält [SNARE (Protein) – Wikipedia]. Das Protein (Mensch) „SNARE (Snapin)“=136AS muss sich dort formieren. Die Ziffer „6“ liegt in der Folgezeile am Zahlenrand in Epi.Vir.Z.38203#16178146799577“6“. Das Protein zählt über 3 Zeilen ab Zeile Epi.Vir.Z.38201#16178993800797“5“ die Randspalte QS5+1+7=13 und ergänzt Ziffer „6“ für 136AS. Funktion: Gehört zum BLOC-1-Komplex, der für die normale Biogenese von Lysosomen-verwandten Organellen benötigt wird. In Verbindung mit dem AP-3-Komplex wird der BLOC-1-Komplex benötigt, um Membranprotein-Frachten in Vesikel zu bringen, um sie in Neuriten und Nervenendigungen zu transportieren [SNAPIN - SNARE-assoziiertes Protein Snapin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „BLOC1S1“=153AS gehört zum BlOC1-Komplex. Es nimmt die Ziffer „1“ im Spalt „1“01 auf und zählt aufsteigend in der Spalte „1“0 /“5“7/333222“3“ die Ziffer „5“ für „15(3)“. Es kann eine Zählgröße 7/4=74=QS=11 gebildet werden, die aber lediglich zum Zählen genutzt wird. Die Zahl „15“ wird nochmals alternativ linienförmig mit einem Membranbezug als 333222[3]=QS=15 durchgezählt und die Ziffer „3“ angelagert für 153AS [BLOC1S1 - Biogenesis of lysosome-related organelles complex 1 subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das SNARE-Protein steht auch mit dem Protein (Mensch) „SNAP25“=206AS in Beziehung [SNAP25 - Synaptosomal-assoziiertes Protein 25 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Dessen Lage kann mit dem Protein (Mensch) „Kaliumkanal (KCNB1)=858AS in Beziehung gesetzt werden [KCNB1 - Kalium-spannungsabhängige Kanal-Unterfamilie B Mitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der Kanal zieht sich vom synaptischen Spalt „101“ mit der Ziffer „1“ in der Spalte 1/5/223/44 als QS1+5+2=8_QS2+3=5_QS4+4=8 für 858AS. Darin ist die Zählung „15“+2+2=19=Kalium enthalten. Es verbleibt die Randziffer „34.“ Das Kaliumkanal-Protein wird gehemmt, wenn der Mensch von der „Stromatopelma calceata“ ungünstig mit 34AS kontaktiert wurde [Stromatoxin – Wikipedia]. Im Ergebnis übernimmt das Protein (Mensch) „SNAP25“=206AS die Block-Zählung der Kalium-Stecke=19 und addiert im Spalt 10“1“ die rechte Ziffer „1“ zu 20=Calcium. Aufsteigend wird dann die Ziffer „6“ angefügt, indem in der 200er-Spalte „2/0/0“ kanalartig gezählt wird: An der Nullspalte 0/0 liegt links die Zählgröße 74=QS=11=QS=2 an und rechts QS3+1=4 mit der Summe 2+4=6 für 206AS.
Der beteiligte „AP-3 Komplex“ kann aufgrund der Beziehung zu „Clathrin“ erkannt werden, dass an der Einstülpung von Zellmembranen und der Bildung von Vesikeln beteiligt ist. Das Protein verursacht die Membrankrümmung der Vesikel, so dass der BiXnom-Kreis in der Randspalte 6/4 liegt. Entsprechend ist das Protein (Mensch) „Clathrin, leichte Kette“=229AS ablesbar, und zwar in der Z.38204 als „22“_Spalte 7/2 mit QS7+2=“9“ für 229AS. In der folgenden Randspalte 76/34 bildet 7/3=QS=10 ein kugelförmiges Vesikel als 10er BiXnom-Schwingkreis und die Spalte 6/4 die Vesikel-Krümmung=64 [CLTB - Clathrin light chain B - Homo sapiens (Human) | UniProtKB | UniProt]. Die schwere Kette des Proteins (Mensch) „Clathrin“=1675AS kreuzt die leichte Kette [CLTC - Clathrin heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt], wobei die Ziffer „1“ im synaptischen Spalt „1“0“1“ startet, und zwar in der Spalte 1/5 als QS1_Spalte 1/5 als Block=15 mit Summe=“16“_QS2+2=4 über Spalte 2/3 Ziffer „3“ addiert für Ziffer „7“ (Ziffer „3“ nicht aus Zeile, sondern aus Spalte)_die 200er Kanalspalte in der Zahl (6)401 kreuzen für QS4+0+1=5 für 1675AS. Die enthaltene Ziffer „4“ gehört darin zum BiXnom-Kreis=6“4“. Im Ergebnis zieht sich somit das Protein (Mensch) „AP-3_Beta“=1094AS über diesen Pfad, indem im synaptischen Spalt „10“1 mit der Block-Zahl „10“ gestartet wird, als „10“_QS5_2+2=9_QS3_1=4 für 1094AS [AP-3 komplexe Untereinheit beta - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Untereinheit „AP-3_Beta“ endet neben der Kanal-Spalte 2/0/0, die nunmehr gebunden wird vom Protein (Mensch) „AP-3_Mu-1“=418AS , und zwar in Z.38206 absteigend als 4_QS0+1=1_QS3_23=5+3=8 für 418AS [AP3M1 - AP-3 komplexe Untereinheit mu-1 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Die elektrischen Signale werden in chemische Signale umgewandelt, wozu ein Protein-Superkomplex dient, der die Calium-Kanalstrecke bis zum Ende der Serie Z.3820x ausschöpft. In der Umgebung des Gehirns sind die spannungsgesteuerten Calciumkanäle (Cav2-Kanäle) von Enzymen NO-Synthase (NOS1) und Proteinkinase C (PKC) umgeben, um diesen Superkomplex zu bilden [Elektrische Signale in der Zelle in chemische Signalprozesse umwandeln - LABO; Identification of Cav2-PKCβ and Cav2-NOS1 complexes as entities for ultrafast electrochemical coupling - PubMed (nih.gov); C. Constantin u.a.; Mai 2017; DOI: 10.1073/pnas.1616394114]. Zur Funktion des Nervensystems müssen die Proteine zu einem „Show down“ geführt werden, der in einem Ungleichgewicht gipfelt, damit sich eine Spannung entladen kann. Dieser Gipfelpunkt wird von einem Zink-Ion markiert. Das Protein (Mensch) „PRKCA - Proteinkinase C alpha_J3KN97“=150AS besitzt zum Zink=30 als Ligand eine Metall-Ionen-Bindung. Zink ist in 3 Zeilen lesbar [PRKCA - Proteinkinase C alpha - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Nervensystem wird über die Z.-Nr.Z.3820“7“#1_6=flexibel_1_7=Nerv_64=Kreis_5=Struktur_“30“_6_“31“_6_“29“ mit dem Aktionspotential=1 als „30_31_29“ für eine Spannung um den Mittelwert Zink=30 codiert: Epi.Vir.Z.38207#1617645“30“6“31“6“29“. Das Zink zieht sich in den beiden Folgezeile über eine Spalte „[6]8/32“ als „3“_QS2+8=“10“ für 30E=Zink: Epi.Vir.Z.38208#161760296“8“44709 und Epi.Vir.Z.38209#16175606“32“79401. Die Zeitdifferenz DELTA.TIME.Epi.Vir.Z.38208-Z.38209=42“33“565“30“78 zeigt mit Zink=30 und der Membran=33 ein Gleichgewicht, weiterhin enthalten QS7+8=15=Phosphor und QS5+6+5=16=Schwefel sowie mit „42“ die Spiegelung der Zeitbasis=24. Proteinkinasen sind Enzyme die eine Phosphatgruppe (meist ATP) auf die Seitenketten-Hydroxyl-(OH-) Gruppe einer Aminosäure katalysieren – Kinasen sind Phosphoryltransferasen. Ersichtlich ist, dass in diesem erweiterten Zeilenbereich eine weitere 200er Spalte 2/0/0 zur Orientierung für die Proteine auftaucht. Das Protein (Mensch) „Proteinkinase PRKCA_J3KN97“=150AS zeigt Phosphor=15 bereits an, und zwar absteigend als „1“_QS 4_aus 74=QS11_zerlegen in 1+1, davon Ziffer „1“ für Summe 4+1=“5“_zweite Ziffer „1“ weiter verwerten und addieren „162“ zu QS1+1+6+2=10 mit Ziffer „0“ für 150AS. Aber wo zum Kuckuck ist jetzt Zink? Wenn in der Zahl „3“162“ die Anteil „162“ auf 0(Null) schrumpft, wird Zink=30E lesbar. Die Modifikation Protein (Mensch) „PRKCA - Proteinkinase C alpha_KPCA“=672AS ist nicht lösungsorientiert und schleust 3-fach alle Probleme dieser Welt ein, um die Spannungen zu erhöhen - die bodenlose Finanz-Schatulle „Sondervermögen“ ist hierfür unerschöpflich. Das „Dreifache“ wird durch Doppel-Calcium=2*20E=“40“ im Code und Calcium=20E in der Z.-Nr.38“20“6 repräsentiert. Erst in Z.38208 und Z.38209 ist die Zahl 3*20=60 lesbar. Die Kinase-Modifikation=672AS beginnt am 200er Spaltende absteigend als „QS1+0+4=5_Ziffer „1“ aus der Zählgröße 74=QS=11=1+1_ für Summe 5+1=“6“_Restziffer „1“ über Spalte mit QS1+6=“7“_die Ziffer 2 könnte direkt angelagert werden, wird aber verschmäht, um über QS1_0+1=“2“ für 672AS weiter abzusteigen. Die Spalte „401/162“ enthält das Doppel-Calcium=40. Die Kinase-Modifikation=672AS kann alternativ auch aufsteigend gezählt werden, in dem in Z.38204 die erste „20“0er Calcium-Spalte durchlaufen wird als QS2+0+40=“6“_QS3+4=“7“_Ziffer „2“ angefügt aus „47“=QS=11=QS=2 für 672AS, wobei Doppel-Calcium=40 enthalten ist und 1x 20 in der „20“0er Spalte insgesamt Tripel-Calcium.
Die Synapsen benötigen zum Eigenbedarf zu ihrer Erzeugung 3 „Alpha-2-Delta-Proteine“, die spannungsabhängige Calcium-Kanäle bilden und in 3 verschiedenen Genen codiert sind. Von Interesse ist, wo diese Proteine ihren Platz finden: Das Protein (Mensch) „Calcium-Kanal alpha-2/delta-1 (CACNA2D1)“=1103AS ist im Prinzip wegen der Zählgröße 11 erkennbar, die aber unlesbar verschlüsselt sein könnte. Das Medikament „Gabapentin“= C9H17NO2=54+17+7+16=94E zur Behandlung der Epilepsie und neuropathischer Schmerzen wird gebunden. Insgesamt müssen die 3 Proteine 1 Komplex bilden [CACNA2D1 - Spannungsabhängige Kalziumkanal-Untereinheit alpha-2/delta-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Leider ist der Synapsen-Protein-Eigenbedarf nur trivial am Ende der Calcium-Serie in der Z.-Nr.Matrix „38209/28210/38211“ im Niveau einer „synaptischen Übung im Kindergarten“ ablesbar als „11“_“0“_QS2+1=“3“ für 1103AS. Das Medikament koppelt sich aus der Z.Nr.38209 am Ende des Calcium-Kanals in die Protein-Spalte ein als „9“_QS0+2_2=“4“ für „Gabapentin“=94E. Damit sich das Medikament von anderen Stoffen der Art „94“ unterscheiden kann, ist „Gabapentin•Hydrochlorid“ geeignet. Hierbei wird die Summenformel mit Salzsäure (HCl) gekoppelt. Salzsäure wird mit Chlor=17 symbolisiert. Das Chlor=17E markiert das Calcium=20E in Z.38209 als „8+[20]+9“=17=Chlor. Das Protein (Mensch) „Calcium-Kanal alpha-2/delta-2 (CACNA2D2)“=1150AS bildet an derselben Stelle völlig verzweifelt die Zählgröße 11 aus der Randzahl „38“ als QS3+8=11 und zeigt zur Ziffer „0“ über QS2_2+1=5_0 für 1150AS. Unverändert wird auch das Medikament „Gabapentin“=94E gebunden [CACNA2D2 - Voltage-dependent calcium channel subunit alpha-2/delta-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Calcium-Kanal alpha-2/delta-3 (CACNA2D3)“=1091AS kann kein „Gabapentin“=94E binden, obwohl es ebenfalls an derselben Stelle codiert ist. Dieses resultiert daraus, dass die Ziffer „8“ für Chlor=17 und die Ziffer „2“ im „Gabapentin“=9_QS“2“+2=4 für 94E verwertet werden, um das Protein QS8+2=10_Spalte 09/10 als QS0+9=9_QS0+1=1 für 1091AS zu erzeugen [CACNA2D3 - Spannungsabhängige Kalziumkanal-Untereinheit alpha-2/delta-3 - Homo sapiens (Mensch) | UniProtKB | UniProt] _dat07.062023.
Neurogenese der Nervenzellen: Neue Nervenzellen im Gehirn werden aus neuralen Stammzellen gebildet, die sich hauptsächlich in der embryonalen Entwicklung zu Nervenzellen weiterentwickeln [Stammzellen im menschlichen Gehirn | Universität Basel (unibas.ch); Erzeugung neuer Neuronen im Gehirn als Strategie gegen neurodegenerative Erkrankungen – Chronobiology.com]. Später sind diese Zellen [adulte neuralen Stammzellen (NSCs)] im Ruhezustand und werden gelegentlich durch Transkriptionsaktivatoren „Yap1 (Yes-assoziiertes Protein 1)“ und „Taz (Transcriptional Co-Activator With PDZ-Binding Motif) bzw.WWTR1“ aktiviert. Das Protein „Yap1“ zeigt keine Besonderheiten, so dass hilfsweise die hemmenden Proteine LATS1/2 mit dem regulatorischen Protein MOB1 ebenfalls eingeordnet werden müssen. MOB1 ist der Aktivator von LATS1/2 im Hippo-Signalweg [Hippo=Flusspferd]. Ein MOB-Kinase-Aktivator 1A und 1B ist mit jeweils 216AS zu finden. MOB1 ist über 3 Zeilen als Code-Serie „161/161/161“ aufsteigend oder absteigend als QS1+1=2_16 doppelt als A/B vorhanden [MOB1A - MOB-Kinase-Aktivator 1A - Homo sapiens (Mensch) | UniProtKB | UniProt; MOB1B - MOB kinase activator 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Transkriptioneller Coaktivator YAP1“=504AS kann in einen abnormen Strukturzustand verfallen und statt eines gefalteten Proteins aus Amyloidfibrillen bestehen [YAP1 - Transkriptioneller Koaktivator YAP1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Amyloidfibrillen führen zu Erkrankungen wie Gehirntumoren, gehören aber auch zur normalen Alterung [Jahrbuch 2007/2008 | Fändrich, Marcus | Proteine und Amyloidfibrillen – Dr. Jekyll and Mr. Hyde; Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung; forschungsSchwerpunkt2.pdf (mpg.de); Protein fördert Nervenzellwachstum und birgt Krebspotenzial | MT-Portal; https://junge-erwachsene-mit-krebs.de/wp-content/uploads/2020/11/Poster_YAP_TAZ_JungeErwachsenemitKrebs.pdf]. Mit den beiden Strukturformen ist das Protein ein „Jekyll- und Hyde-Protein“. Der Hippocampus ist nur 1 von vielen Orten einer Neubildung von Nervenzellen. Der Begriff „Hippo“-Signalweg hat keinen direken Bezug zum „Hippo“campus. Die Pfade der beiden Proteine LATS1/2 werden ermittelt und wegen deren hemmender Funktion wird darin eine ansonsten unlesbare Spur für YAP1 gezogen. YAP1 pfeift ohne Motivation auf die Schwierigkeiten einer Faltung und verwendet die Z.Nrn.-Matrix „Z.83200/Z.83201/Z.83202 als QS2+0+2_absteigend rechts 1=“5“_links „0“_QS2_2=“4“ für 504AS. Aus den 3 potenziellen Zählgrößen 83=QS8+3=11 entstehen Fibrillen 11_11_11. Das Protein (Mensch) „YAP1_Isoform“=454AS verwendet alternativ die Randziffer „83“ zur Zählung als QS8+3=11=QS=2_QS2+0+0=2 mit Summe „4“_QS1_2+0+2=“5“_QS2+2 aus QS8+3=11=QS1+1=2 mit Summe 2+2=“4“ für 454AS. Statt 3x 83 verbleibt nur 1x 83 als Zählgröße für Fibrofibrillen [YAP1 - Yes-associated protein 1, 65kDa, isoform CRA_b - Homo sapiens (Human) | UniProtKB | UniProt]. Aufgrund MOB1 muss sich YAP1 auf 3 Zeilen beschränken, und zwar ab Z.38202 in der Spalte [41733]“4“[6]/[99]“3“8“0“0“[7]/“5“7“0“2“[891] absteigend 5_QS7+0+3=10 als 0_QS 8+2=10 als 0_0+0=Summe 0, Spalte 4/0 mit „4“ für 504AS. Das Protein streckt sich, weil doppelt eine Zahl 10 zu Null gezählt wird. Statt Protein=504AS mit QS5+0+4=9 werden QS=29 für QS=11 verarbeitet. Das Protein (Mensch) „Serin/Threonin-Protein-Kinase LATS1“=1130AS liegt in der Spalte Z.38200#_1733/0 als 1_ QS7+3+3=13_0 für 1130AS und hemmt mit der Ziffer „0“ den Pfad für das Protein „YAP1“=504AS [LATS1 - Serin/Threonin-Protein-Kinase LATS1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation, Protein (Mensch)= „Große Tumorsuppressorkinase 1 (LATS1)“=135AS zählt aufsteigend ab Z.38200 gespiegelt QS3+3+7=13_Spalte 1/9=QS1+9=10 als 0(Null)_Spalte 3/02 als QS3_0+2=“5“ für 135AS und hemmt den Pfad für „YAP1“ mit der Zahl „02“[LATS1 - LATS1 Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Transkriptionsfaktor TEF-5“=435AS spielt im Hippo-Signalweg eine Schlüsselrolle. Es ist an der Kontrolle der Organgröße und der Tumorunterdrückung beteiligt. Das Protein schließt zunächst 2 weitere Folgezeilen, fällt dann aber über 10er Null-Zählungen in Z.38200 zurück, was einem Kontrollgang ähnlich ist [TEAD3 - Transcriptional enhancer factor TEF-5 - Homo sapiens (Human) | UniProtKB | UniProt]. Aufsteigend ab Z.38202 Spalte 7/4/23 als QS7+4=11=QS=2_2=Summe „4“_“3“_absteigend Nullen 7+3=10; 2+8=10 weiter in Spalte 1733/0 mit Ziffer „0_QS3+2“ aus Summe 173=11=QS=2 mit Summe „5“ für 435AS. Das Protein (Mensch) „Transcription regulator 1 WWT1(TAZ)“=29AS zieht sich zentral als lange Spalte von Z.38200 bis 38204 als Summe Spalte QS7/3[8]=“10“+ Spalte QS ([3]8/02)=“10“ + Spalte QS(6/3)=“9“ als Summe 10+10+9=29AS [WWTR1 - WW domain containing transcription regulator 1 - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Modifikation mit 400 AS [WWTR1 - WW domain-containing transcription regulator protein 1 - Homo sapiens (Human) | UniProtKB | UniProt] zählt Spalte 73/38/2/7/3 als QS3+1 (aus 7+3=10)=“4“_QS8+2=10 mit „0“_QS7+3=10 mit „0“ für 400AS.
Das Protein „REST“ schützt im Alter vor der Alzheimer Erkrankung, indem es die alternden Gehirnzellen vor dem Verklumpen aufgrund von Fehlfaltungen schützt. Das Protein „REST“ blockiert Gene, die den Zelltod forcieren. Das Protein REST fungiert ansonsten als Genschalter in der Embryonalentwicklung. Zu diesem Zweck enthält Epi.Vir.Z.38“204“#161777233322234 in der Zahl „204“ die Zeitbasis „24“ und die Anzahl von 270 Schwangerschaftstagen als Spalte [333]2/70/0[3]; Epi.Vir.Z.3820“6“#16176876464“01“78 und Epi.Vir.Z.3820“7“#1617645“30631“629. Diese Zeitvorgabe gilt für die Weiblichkeit als QS3+3=“6“_QS3 + über Zeitspalte, rechts 3=“6“ für „66“=weiblich. Das staatlich verordnete Rentenalter ist in der Randspalte in Z.3820“6“/3820“7“ mit „67“Jahren lesbar. Die Zeitbasis „1 Jahr=365Tage“ wird definiert, und zwar in der Spalte [6464]“01“/“306“31“[6] als „3“_0+6=“6“_3+1_1=“5“. Alzheimer entsteht bereits viele Jahre vor den erkennbaren Symptomen. Wissenschaftlich kursieren 17 oder 20 Jahre zuvor, hier werden 21 Jahre erwartet. Diese sind auch direkt anliegend aus der Spalte 7[03]/401 mit QS7+4=11=QS2_1=21 Jahre zählbar. Ersichtlich ist, dass die Zeitbasis mit der Zahl „30“ das Zink aufgefressen hat, das für das REST-Protein als Ligand notwendig ist. Der Zeilenlauf wird von diversen Proteinen gemeinsam genutzt, so, wie wenn eine Platzkarte im Zug mehreren Personen verkauft hat. Bei Alzheimer ist dir das schnurzpiepe - einfach sitzenbleiben. Dem Zeilenrand [Zink=30]_QS6+6+1+6+2+9=27 fehlt zur alternativen Summe 30 die Ziffer „3“. Die Ziffer „3“ kann in der Schwangerschaftsspalte abgeholt werden. Wenn das Super-REST-Proteine diesen Pfad durchläuft, ist Zink alternativ als Ligand aktiviert. Das Super-REST-Protein (Mensch)=1097AS folgt diesem Pfad. Das Protein wählt in Z.38207 die Ziffer „0“ im Zink als Platzhalter, der in der kreuzenden Spalte die Anlagerung von „640“ oder gekreuzt mit „604“ mit QS=10 den Wert=10 für 10[97AS] repräsentiert. Weiter „10“_QS6+3=“9“_QS1_absteigend Spalte 7/4=QS=11=QS=2_QS0+3=3 _aufsteigend „1“ mit Summe 1+2+3+1=7 für 1097AS [REST - RE1-silencing transcription factor - Homo sapiens (Human) | UniProtKB | UniProt].
Das REST-Gen codiert für eine Referenzsequenz-mRNA von einheitlich 3663 Basenpaaren (bp) (NM_005612.3), die aus vier Exons besteht. Diese „3663bp“ sind enthalten, indem die Ziffer „0“ für Zink=30 eingefügt und die Zahl 66 eine Spalte 6/6 bildet. Aufgrund verschiedener Spleißvarianten sind 4 Isoformen bekannt: Isoform 1=1097AS, Isoform 2=313AS, Isoform 3=329AS, Isoform 4=1074AS [Info siehe: REST (RE1-Silencing-Transkriptionsfaktor) (atlasgeneticsoncology.org)]. Protein „REST-Isoform 1=1097AS, wie zuvor enthalten. Die REST-Isoform 2 =313AS hat zum Zink=30 nur einen scheinbaren Bezug, indem die Zahl „03“ mit der Zählrichtung „30“ durchlaufen wird. Wegen der Symmetrie „313“ ist dabei nur eine aufsteigende Zählrichtung möglich und die Gegenrichtung ist eine Sperrung, und zwar aufsteigend in Z.38205 mit der Spalte [7]03/[4]0[1]/31[6] als QS3+0_0=“3“_“1“_“3 für 313AS. Die Rest-Isoform 3 = Isoform 2 (313AS) + QS4+6=10 über Spalte 64/[30]6 mit Ziffer „6“ als 10+6=“16“ für 313AS+16AS=329AS legt sich mit der Ziffer „6“ direkt vor das Zink=30E und versperrt konkurrierenden Zink-Proteinen den Zugang. Unabhängig von den 4 Isoformen enthält die Datenbank weitere Proteine: Die Modifikation, Protein (Mensch) „REST_L0B1S6“=314AS findet einen Sonderweg bei der Zink-30-Suche, in dem die Zahl „03“ in gespiegelter Reihenfolge als 30=Zink durchlaufen wird, und zwar in Z.38205 mit der Spalte 703/4[01]/[306]3[16] als 3_QS0+7=7_4 mit 74=QS=11=QS=2=1+1 zerlegen als Ziffer 1 und QS1+über Spalte 4/3 als 3+1=4 für 314AS314AS [REST - RE1-Silencing-Transkriptionsfaktor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation, Protein (Mensch) „REST_A0PJ83“=460AS zieht als Spalte durch das Zink=30 aufsteigend in Z.38206 mit der Spalte [6]4[6]/[3]06/8/2 als QS4_0=“4“_“6“_QS8_2=10 mit Ziffer „0“ für 460AS [REST - REST-Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weiterhin ist Protein (Mensch) „REST_ A0A1W2PQA1“=1069AS bekannt [REST - RE1-Silencing-Transkriptionsfaktor - Homo sapiens (Mensch) | UniProtKB | UniProt].
Ganz speziell sorgen die Alzheimer-Schutzrpoteine TREM2=2“3“0AS und TYROBP=11“3“ dafür, dass die Ziffer „3“ mitgezählt wird. [siehe: TREM2: Ein Schutzfaktor gegen Alzheimer? • healthcare-in-europe.com/Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE); Aug2019)]. Im Bluttest wird Alzheimer am Alzheimer-Protein Beta-Amyloid=12AS [APP - Amyloid-Beta-Protein - Homo sapiens (Mensch) | UniProtKB | UniProt] und 528AS [Amyloid-beta A4 protein - Homo sapiens (Human) | UniProtKB | UniProt] erkannt, das durch Spaltung von Vorläuferproteinen=770AS [APP - Amyloid-beta precursor protein - Homo sapiens (Human) | UniProtKB | UniProt] entsteht. Das Vorläuferprotein ist in der Zink-Zeile Z.382“07“#“16“ als QS1+6=7_7_0 für 770AS über Code und Z.Nr. verteilt. „Protein Beta-Amyloid“ =528AS ist ähnlich als Serie Z.[3]82x, so dass die Ziffer „3“ auf „5“ erhöht wird, wenn jede 2. Z.Nr. die Zählgröße QS3+8=11 in 1+1 spaltet und jeweils den angrenzenden beiden Nachbarzeilen übergibt für QS3+1+1=5_28 für 528AS. Aus Z.832x=QS=11_2 entsteht bei der Spaltung 1_12 die Zahl 12AS alternativ für „Protein Beta-Amyloid“=12AS, und zwar ohne konkrete Z.Nr. als verstreutes Krankheitssymptom. Der Alzheimer-Bluttest wird mit dem Risikofaktor (APOE4) durchgeführt, vermutlich mit 128AS [APOE - Apolipoprotein E Isoform 4 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Darin werden der Zahlenteil [Z.3]“28“x und der Export der Ziffer „1“ symbolisiert.
Die Alzheimer-Erkrankung entsteht im Prinzip daraus, dass in der Serie Z.3820x#1617 keine Struktur-5 verfügbar ist, so dass benachbarte Z.Nr. über die potenzielle Zählgröße 38=QS3+8=11+QS=2=1+1 bei einer Spaltung die Ziffer „1“ gewinnen. Vergleichsweise liegen auf einem DNA-Einzelstrang in der statistischen Betrachtung häufig Ansammlungen der Nukleobasenfolge Cytosin (C)=C4H5N3O=24+5+21+8=58 und Guanin (G)=C5H5N5O=30+5+35+8=78. Inklusive der verbindenden Phosphor-Rückenstütze (p) werden diese Abschnitte als „https://homepagedesigner.telekom.de/.cm4all/uproc.php/0/.CodeBild%20T.Bix.png/picture-400?_=188b72d6025 CpG-Inseln“ bezeichnet. Bei einem Mittelwert „68“ wird die Zahl „10“ gesendet und empfangen, die in der Serie „Z.3820x als QS8+2=“10“ enthalten ist. Die Rand-Zahl Z.“38“xxx steht über eine Differenz-Treppe „20“ mit Cytosin=58E und Guanin=78E in Beziehung. Der Phosphor=15E für die Rückenstütze ergibt sich aus QS3+8+2+0=13, wenn eine Kopplung zu beiden Nachbarzeilen mit der Ziffer „1“ für 13+1+1=“15“ erfolgt. CpG-Inseln sind kurze Sequenzen von etwa 1.000 Basenpaaren, die reich an Cytosin und Guanin sind [CpG-Insel - DocCheck Flexikon]. Der Genomabschnitt muss mindestens 400 bis 500 Basenpaare (bp) besitzen, um als CpG-Insel zu gelten [CpG-Insel – Wikipedia].
Die Nukleinbasen (Nukleobasen) Cytosin (C) und Guanin (G) sind wie Adenin (A) und Thymin (T) Grundbausteine der DNA. In der RNA wird Thymin (T) gegen Uracil (U) ausgewechselt. Warum? Adenin (A)=C5H5N5=30+5+35=70E liegt in der Z.38200#16 und zieht spiegelbildlich vom Code-Rand in die Z.Nr. als QS6+1=7_0 für 70E. Für Adenin in der DNA ist das eine Notsituation, so dass Thymin in der Folgezeile in der RNA herausgeworfen wird, um Adenin in der Spalte Z.38200/Z.38201 mit QS3+8=11=QS=2_QS3+8=11=QS=2_2+0+1 mit Summe=7 sowie durch das Anlagern der Ziffer „0“ absteigend aus der Randziffer 38[20]“0“ ohne Code 70E zu bilden. Hierbei wird die Zahl „20“ nicht genutzt, die Uracil dann mitverwendet. Thymin (T)=C5H6N2O2=30+6+14+16=66E, nur in der DNA vorhanden, liegt in Z.38201#16 als QS3+8=11=QS=2_2+0+1 mit Summe=5_#1(Code-Rand)=Summe=6_6 für 66E. Das Uracil=C4H4N2O2=24+4+14+16=58 in der RNA benötigt einen anderen Platz. Welchen? Das Uracil=58E wird in der freien Z.Nr.38199 spiegelbildlich erzeugt. Die Summenbildung 9+9=18 wird wegen der Spiegelung 81_18=9+9 animiert. Uracil wird gespiegelt in der Folge 85 erzeugt und dann gedreht als 58E. Die Summe=18 wird gespalten in 1+8 mit Ziffer „8“ als Randziffer [5]„8“. Die Ziffer „5“ setzt sich mit der Spalte Z.38199/Z.[38]20[0] als QS3+8=11=QS=2_QS2+0=2_Spaltzahl 1[8]=Summe=“5“ zusammen für Uracil=58E.
Weil Adenin in der RNA den Code nicht benötigt, wird dort Methyladenin in 2 Varianten mit derselben Summenformel=C6H7N5=30+7+35=72E erzeugt. In der RNA ist „1-Methyladenin“=72E Bestandteil des Nukleosids „1-Methyladenosin“ und „N6-Methyladenin=72E ist Bestandteil des Nukleosids „N6-Methyladenosin“, beide mit C11H15N5O4=66+15+35+32=148E. Die 4 Stoffe sind zwar in der Randspalte #1617/#1617 zählbar, die Wirksamkeit rangt sich aber um einem schrecklichen 33er-Membran-Block. Methyladenin=72E liegt in Z.38200 spiegelbildlich QS3+4=“7“_QS1+7=8_3=QS=11=QS=“2“ für 72E. Methyladenosin liegt links und steigt in der Spalte Z38199.#_“8“[44089]/“41“[7334] über „1_4“ mit Spalte 8/4 zur Ziffer „8“ ab für 148E. Adenin=70E ist im Block als Spalte 0/7 enthalten. In diesen Block fällt 1 verbotenes Gift, das die Proteinsynthese sofort beendet. Die Spalte 40/733 ergibt wegen 74=QS=11=QS=2 und 3+3=6 auch das Blut=26. Die Zahl 20 in der Z.Nr. plus 40 im Code ergeben die Zeitbasis „60“, so dass mit den 72E auch der Tod nach 72 Stunden eintritt.
Die 4 Grundbausteine werden durch viele modifizierte Standardbasen ergänzt. Bei der Transfer-RNA sind es folgende Nukleoside: „Dihydrouridin (D), Inosin (I), 2-Thiouridin (s2U), 4-Thiouridin (s4U), Pseudouridin (Ψ), N4-Acetylcytidin (ac4C) und 5-Methyl-Uridin (Thymidin) (T)“. Wenn es keinen anderen Sinn dafür gibt, müssen diese Stoffe in einem „Code-Haufen“ von Z.38199-200 stecken: „Ionosin“=C10H12N4O5=60+12+28+40=140E liegt in der Spalte 40/1. „Dihydrouridin“=C9H14N2O6=54+14+14+48=130E mit Spalte 840/[4]1[7] als QS8+4_1=13_0 für 130E. „2-Thiouridin (s2U)“=C9H12N2O5S=54+12+14+40+16=136E mit Spalte „90“[7]/[3]“4“6“=QS9+0_4=13_6 für 136AS [2-Thiouridin (1-β-D-ribofuranosyl-2-thiouracil, s2U, CAS-Nummer: 20235-78-3) | Cayman Chemie]. 4-Thiouridin=C9H12N2O5S=54+12+14+40+16=136E mit Spalte „90“[7]/[3]“4“6“=QS9+0_4=13_6 für 136E in Spalte [8]“90“/“33“4“ als QS9+0_4=13_QS3+3=6 für 136E. Pseudouridin (Ψ)=C9H12N2O6=54+12+14+48=128E in Spalte 71/66 als 6+6=12_QS7+1=8 für 128E. 5-Methyl-Uridin=C10H14N2O6=60+14+14+48=136E mit Spalte [98]40[89]/“94“1“7“3“[3] als QS9+4=13_QS“1“+QS4+0_7=11=QS=“2“_“3“=Summe 6 für 136E. N4-Acetylcytidin (ac4C) wird repräsentiert durch die „RNA-Cytidin-Acetyltransferase“=1025AS in der Spalte „907109/346666“ als 10_QS6+6+6+4+3=25 für 1025AS [NAT10 - RNA-Cytidin-Acetyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt].
Eine CpG-Verbindung entsteht von Z.Nr.38202-204 mit der Spalte [20]2/[20]3/204 als QS2+3=“5“_QS0+2_2_0+4=“8“ für Cytosin=58E. Anschließend folgt bis Z.Nr.38205-206 mit der Spalte 205/206 als QS5+2=“7“_QS2+0+6=“8“ für Guanin=78E. Am linken Zahlenrand ist die Randziffer „3“ über diese 5 Zeilen enthalten, um die Rückenstütze aus 3*5=15=Phosphor zu bilden. Bei einem DNA-Doppelstrang kann diese Abfolge auf beiden Seiten als CpG-Dinukleotide vorliegen (palindromische Sequenz). Diese Dopplung folgt als Spiegelung. Die Folgezeilen enthalten von Z.Nr.38207 bis Z.Nr.38210 eine Spiegelung von Guanin zu Cytosin. Statt 5 Zeilen sind 4 Zeilen ausreichend, weil in Z.Nr.38210 mit QS2+1+0=3 die 5. Zahl „3“ für 5*3=15=Phosphor zählbar ist. Guanin=78E als „7“_QS0_0+8=“8“ für 78E. Cytosin=58E als QS1_0+2_2=5_8 für 58E, wobei die Ziffer „8“ verbraucht wird, um den Zugang zum 5. Phosphoranteil „2+1+0=3“ mit 5*3=15= Phosphor frei zu halten. Die 10. Zeile, Z.Nr.38211, wurde eingespart und wird nunmehr im Falle von CpG-Dinukleotide genutzt, das Cytosin mittels DNA-Methyltransferasen zu methylieren (Anlagerung –CH3). Bei diesem Prozess entsteht 5-Methylcytosin=C5H7N3O=30+7+21+8=66E. Cytosin endet in „Z.Nr.38210#16“ als QS3+8=11=QS=2_QS2+1+0=3 mit Summe=5, so dass das Defizit bei einem Code-Übergang als QS5+#1=6_6 folglich 66E=5-Methylcytosin erzeugt. Beim Menschen sind 5 Methyltransferasen codiert, von denen DNMT1, DNMT3A und DNMT3B die kanonischen 5mC-Methyltransferasen darstellen [DNA-Methyltransferase - DocCheck Flexikon]. Die Methyltransferase, Protein (Mensch) „DNMT1“=1616AS entsteht im Prinzip als Code-Randspalte 16/16 und ist daher geeignet, die Erzeugung von 5-Methylcytosin=66E zu katalysieren [DNMT1 - DNA (cytosine-5)-methyltransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Damit im Ergebnis eine Relevanz entsteht, muss sich die Zahl 1616 aus der Blockzahl 16, doppelt in Z.Nr.-Matrix und Code, gezählt werden. Es wird dadurch sichergestellt, dass DNMT1 mit der Ziffer „7“ und DNMT3B mit der Ziffer „4“ gemeinsam eine potenzielle Zählgröße „74“ in einer Zelltod-Matrix besetzen. Der Zelltod muss reguliert werden, damit sich Stoffe nicht als Plaque ansammeln. „DNMT1“ zählt die Z.Nr. QS3+8+2+1+1=“15“ und addiert absteigend in Z.Nr.382“1“0 die Ziffer „1“ als Blockzahl „16“. Wechsel zum Code in die Spalte 161[7]/[16]17 als QS1+6+1_1=9_7 mit Summe 9+7=Blockzahl „16“ für „DNMT1“=1616AS. Die Methyltransferase, Protein „DNMT3A“=853AS folgt seitlich in Z.38210 in der Randspalte [16]175/[16]174 als QS1+7=“8“_“5“_QS1_über Spalte mit 74=QS=11=QS=2 mit Summe 1+2=“3“ für 853AS [DNMT3B - DNA (Cytosin-5)-Methyltransferase 3B - Homo sapiens (Mensch) | UniProtKB | UniProt]. „DNA-Methyltransferase 1 und 3B aktivieren die BAG-1-Expression durch Rekrutierung von CTCFL/BORIS und Modulation der Promotor-Histon-Methylierung [BAG1 - Molekularer Chaperon-Regulator 1 der BAG-Familie - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) “BAG1“=345AS liegt ab Z.38210 in der Spalte [7]475/743[3] und wird ab Ziffer „3“ absteigend gezählt als „3“_QS7+4=11=QS=2_QS4+7=11=QS=2 mit Summe 2+2=“4“_“5“ für 345AS. “BAG1“ hemmt die Anti-Zelltod-Funktion von „BCL2“. BCL2 (nicht zu verwechselt mit BAG2) ist ein Apoptosis (Zelltod) Regulator. Als Zelltod kann in Z.38211 eine Spalte „7475/7433“ verstanden werden, in der im Prinzip 3 potenzielle Zählgrößen 74 oder 47 oder 4/QS4+3=7 ein Gleichgewicht finden, wenn die enthaltene Membran „33“ als Summe „11+11+11“ vs. 33=Membran mit „33-33=0“ beseitigt wird. Das Protein „BAG2“=211AS füllt diese Matrix ebenso wie „BAG1“, und zwar in der Spalte [7]47[5]/743[3] als QS7+4=11=QS=“2“_QS7+4=“11“ für 211AS. Der Apoptosis-Regulator „BCL2“ liegt in 2 Versionen vor, von denen jede Version eine der beiden Zelltod-Zeilen „verspeist“. Dieses können BAG-1 und BAG-2 hemmen. Protein (Mensch) „Apoptosis Regulator BCL2_A0A1L4AQQ4“=195AS in Z.38211#[16]17475 als „1“_QS7+4=11=QS=“2“ mit „7“ als Summe=„9“_“5“ für 195AS [BCL2 - Apoptosis regulator Bcl-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „Apoptosis Regulator BCL2_ P10415 • BCL2“=239AS in Z.38212#[161]74336 als QS7+4=11=QS=“2“ _“3“_QS3+6=“9“ für 239AS [BCL2 - Apoptose-Regulator Bcl-2 - Homo sapiens (Mensch) | UniProtKB | UniProt].
„Kontrolle zu DNMT1“: „Wo liegt eine direkte Bindung an „HDAC2“, um eine „transkriptionelle Unterdrückung (Repression) zu vermitteln?“ Das Protein (Mensch) „Histone Deacetylase 2 (HDAC2)_ H3BM24“=161AS enthält die Blockzahl „16“ für die Z.Nrn.-Matrix und zieht mit der Ziffer „1“ zum Code-Randrand hinüber [HDAC2 - Histon-Deacetylase 2 - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein (Mensch) „Histone Deacetylase 2 ( Q92769 • HDAC2)“=488AS zählt in der ZNr. 38211 die Ziffer „4“ als QS2+1+1=“4“ und steigt am Coderand „161/161“ wegen QS1+6+1=8 als „88“ zur Z.38210 ab für 488AS [HDAC2 - Histone deacetylase 2 - Homo sapiens (Human) | Publications | UniProtKB | UniProt]. Wo wird CTCFL/BORIS rekrutiert, um BAG1 zu aktivieren? Das Protein (Mensch) „Transcriptional repressor CTCFL“=663AS mündet wegen der Doppeldeutigkeit von Membran=33 und männlich=33 in der Zelltod-Spalte über Z.38212 mit #[16174]3363 als QS3+3=6_63 für 663AS. „Scheint als Tumorsuppressor [Zellzyclus-Kontrolle] zu wirken. In Assoziation mit DNMT1 und DNMT3B, das an der Aktivierung der BAG1-Genexpression durch Bindung an seinen Promotor beteiligt ist. Spielt eine Schlüsselrolle bei der Genprägung in der männlichen Keimbahn, indem es an der Etablierung der differentiellen Methylierung in der IGF2/H19-geprägten Kontrollregion (ICR) beteiligt ist [CTCFL - Transcriptional repressor CTCFL - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein Boris_C7=426AS [BORIS transcription factor transcript variant C7 - Homo sapiens (Human) | UniProtKB | UniProt] und das Protein „Boris_A5“=627AS sind mit 26_62 gespiegelt und diagonal mit „4“ und „7“ über die potenzielle Zählgröße „74“ verbunden, so dass die Zelltod-Spalte besetzt wird.
Zucker ist in der RNA/DNA das Bindeglied zwischen der Nucleobase und der Phosphor-Rückenstütze. Wenn eine Nucleobase in einer Randspalte „Z.382xx/ Z.382xx“ entsteht, ergibt sich der Zucker „Ribose“=C5H10O5=30+10+40=80E als QS38_38=76_QS2_2=4 mit der Summe 76+4=80 für Ribose=80. Abweichend beginnt das „Claustrum“ mit der Randspalte „Z.38199/ Z.38200“. Die Randspalte QS3+8=11/ QS3+8=11 als QS11+11=22 und die Restsumme QS19+9=28+QS0+0+2=30 ergeben die Spaltensumme 22+30=52. Aus der Folgezeile Z.Nr. 38“20“1 muss die Zahl „20“ gewonnen werden um die Zahl 52+20=72 für Zucker „Desoxyribose“=C5H10O4=30+10+32=72E zu bilden. Diese Zahl „20“ bleibt bei der Wechsel der unterschiedlichen Zählung von Adenin von RNA nach DNA frei, und wird zur Bildung von Uracil in der RNA verwendet. Umgekehrt bedeutet dieses, dass die Zahl „20“ in der DNA verfügbar ist, um den Zucker „Desoxyribose“ zu bilden. Weil die Startzeile Z.38199 für die Nucleobasen der DNA unnötig ist, wird der Zucker „Desoxyribose“ am Start bereitgestellt. In der RNA wird der Zucker „Ribose“ fortlaufend erzeugt. Das Claustrum ist in beiden Gehirnhälften vorhanden. Hier wird lediglich eine Abbildung von Proteinen zwecks Informationsverarbeitung untersucht, die reale Situation ist hier unbekannt.
Die Grundstruktur ist bei beiden Zuckerarten gleich, mit dem Unterschied, dass bei der DNA der Zucker „Desoxyribose“ an der Position einer OH-Gruppe [Hydroxyl] der Ribose noch der Wasserstoff verbleibt („Desoxy“=ohne Sauerstoff). „Die Einzelsträngigkeit erhöht die Zahl der Möglichkeiten für dreidimensionale Strukturen der RNA und erlaubt ihr chemische Reaktionen, die der DNA nicht möglich sind. Die RNA ist weniger stabil und wird wieder in ihre Nukleotide zerlegt. „Die OH-Gruppe an der 2'-Position des Zuckers wird durch ein negativ geladenes Hydroxidion einer Base ihres Protons beraubt und der dann zurückgebliebene Sauerstoff geht eine Ringbindung mit dem Phosphor ein, wodurch die Bindung zum nächsten Nukleotid jedoch gelöst wird“ [Ribonukleinsäure (chemie.de)].
Bei der Kooperation um die Besetzung der Startzeile Z.38199#16“17“98“408“90“71“09 besteht mit dem Einfachzucker (Monosaccharid)=C6H12O6=36+12+48=96E als Vergleichsbasis zur Nucleobase „Uracil“ die Differenz 96-58=38=QS3+8=11=Zählgröße und zur Desoxyribose die Differenz=96-72=24=Zeitbasis. Ein Gleichgewicht als Spiegelung 179_[8408]_9071 wird mittig von der Schwerachse „84“ unterstützt. Ein Zusammenhang ergibt sich wenn, in der Spalte „8408[9071]09/41[7}33[4]6666“ eine Reihenfolge gezählt wird: Uracil=QS4+1_8+4+0+8=25_33=Summe „58“ für Uracil=58E. Desoxyribose=QS6+6=12 –Spalte 0/6 mit 60 als Summe 12+60=72 für Desoxyribose=72E. Einfachzucker = Randspalte „9/6“ für Einfachzucker=96E. Die Ribose kann in „[9]071“ als 1+7=8_0 für Ribose=80E ergänzend eingefügt werden.
DNA und RNA kooperieren bei der Biosynthese in einer Folge von Transskription und Translation, so dass die Erbinformationen geschützt im Zellkern verbleibt und in Kopie zu den Ribosomen transportiert wird [Transkription (Biologie) • Ablauf und RNA-Prozessierung • [mit Video] (studyflix.de)]. Die Zeitbasis „60“ ist bei der Zählung des Zuckers „Desoxyribose“ in der Spalte 0/6 lesbar. In der Z.Nr.-Matrix Z.“38“199/Z.“38“20“0 haben RNA/DNA einen Zugriff auf die Zahl „20“, die in 2 Richtungen durch Addition der Randzahlen 38+2 (aus Zählgröße 11, aus 38)=“40“ als 20+38_QS3+8=11=QS=2= Summe 20+38+2=60=Zeitbasis erzeugt.
In der Phase der Elongation bewegt sich die RNA-Polymerase auf dem codierten Strang der DNA und erzeugt die Boten-RNA(mRNA). Bei diesem Vorgang werden die Nukleinbasen der DNA (A,T,G,C) in die Nukleinbasen der RNA (U,A,C,G) umgeschrieben. Anstelle des Thymins kommt Uracil und anstelle der Desoxyribose kommt Ribose in der RNA vor [ Proteinbiosynthese (chemie.de)]. Die Geschwindigkeit der Ablesung (Transkription) wird durch Sequenzen der DNA beeinflusst die von speziellen Proteinen (Transkriptionsfaktor) abgelesen werden. Dabei liest der Transkriptionsfaktor „Aktivator“ den Enhancer (Verstärker) und der „Repressor“ den Silencer (Hemmer)ab. Die Replikationsgeschwindigkeit bei Eukaryoten (Mensch u.a.) ist mit 30-50 Nukleotide/Sekunde gegenüber den Prokaryoten (500-1000) relativ gering [Folge 035 - DNA Replikation | Initiationsphase | Genetik Teil 7 (christian-schweda.de)]. Der Durchschnittswert 40 Nukleotide/Sekunde ist in der Serie Z.382x als QS38+2=40 stets vorhanden. In der Startzeile Z.38199 ist die Zahl „40“ in „8408“ enthalten, so dass die Summe QS8+4+0+8=20 die Ergänzung zur Zeitbasis 40+20=60 als Zusammenhang erzeugt. Es müssen viele Polymerasen gleichzeitig arbeiten. Für die Geschwindigkeit 50 Nukleotide/Sekunde ist zur Addition die Zahl „10“ enthalten und über die Zeitbasis „24“ verbunden als „40“_QS8+9+0+7=24_“10“. Zur Minderung auf 30 Nukleotide/Sekunde kann die Zahl 40 als Bestandteil der potenziellen Zählgröße „74“ gehemmt werden, und zwar als 1_QS7_4=11=QS=2 als Summe 1+2=3_0 für 30 Nukleotide/Sekunde.
In der Startzeile Z.38199 liegt das Protein (Mensch) „Coaktivator NCOA3“=1224AS in einer Ziffernfolge QS8+4=12_QS0+8+9+0+7=24 für 1224AS [NCOA3 - Kernrezeptor-Coaktivator 3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Repressor CTCFL“=633AS liegt in der Folgezeile mit der Ziffer „6“ und steigt in der Spalte 7/6 in die Startzeile ab, um die Ziffernfolge des Aktivators mit der Zahl „24“ hemmend aufzunehmen und das wieder aufsteigen die Summe „9“ mit 9+24=33 zu ergänzen. Mit 6_QS7+0+9+8+0=24_QS4+7=11=QS=2 _anlagern links 1 und rechts QS3+3=6 mit Summe 1+2+6=9 für 633AS [CTCFL - Transkriptioneller Repressor CTCFL - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch)= „Aktivator STATG“=847AS verdrängt den Repressor, indem die Schwerachse 84_7 mit der integrierten potenziellen Zählgröße „47“ kombiniert ist, um den hemmenden Umschalter mit seiner „Summe 9“ abzuräumen [STAT6 - Signalwandler und Aktivator der Transkription 6 - Homo sapiens (Mensch) | UniProtKB | UniProt.
Die Energie wird aus Adenosintriphosphat (ATP)=C10H16N5O13P3=60+16+35+104+45=260E gewonnen. Die Zahl 26 kann problemlos in der Startzeile aus der Folge von potenzieller Zählgröße „47“ mit QS=2 und der 24er Ziffernfolge addiert werden. Real muss ATP zunächst durch die membranständige Adenylylcyclase stimuliert werden, um im Zwischenschritt „cAMP“ zu bilden. Das Protein (Mensch) „Adenylylcyclase CAP1“=475AS liegt links neben der Membran=33, um mit der enthaltenen potenziellen Zählgröße „47“ das ATP anzulocken, die Ziffer „0“ durch Blockverschiebung fiktiv zu beseitigen [CAP1 - Adenylyl cyclase-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProtb]. In die 2. Ziffer „0“ rückt dadurch die 7 als Endziffer der 24er Zählung ein. Die Ziffer „0“ in ATP=26“0“E wird passend in der Folgezeile QS 3+3+4=1“0“ in der Spalte 0/4 positioniert für ATP=260E. Diese fiktive Blockverschiebung ergibt sich auch daraus, dass das erzeugte „Zyklische Adenosinmonophosphat (cAMP)=C10H12N5O6P=60+12+35+48+15=170E die Ziffer 0(Null) mit der gespiegelten Ziffernfolge „071“ besetzt. Das Signalmolekül „cAMP“ wirkt als „Second messenger“ und verstärkt auf der Membran eingehende Signale ins Innere der Zelle. [Second Messenger - DocCheck Flexikon]. Adenosinmonophosphat (AMP)= C10H14N5O7P=60+14+35+56+15=180E wird durch den Abbau von cAMP=170E erzeugt.
AMP=180E steht in der Randspalte Z.381“99“/Z.2820“0“ als QS9+9=18_0 für 180E am Start zur Verfügung. Dieser Prozess wird Phosphodiesterasen katalysiert mit „3',5'-zyklisch AMP + H2O = AMP + H+ “. Speziell werden 11 Isoenzyme unterschieden, die in verschiedenen Geweben lokalisiert sind. Am Hirn sind Typ 8 und 10 sowie Typ 2 [mit Hemmer „Erythro-9-(2-hydroxy-3-nonyl)adenin“] für Lern- und Gedächtnisprozess beteiligt [Phosphodiesterasen – Wikipedia]. Erkennbar muss das Protein die Aufgabe übernehmen die „sinnlose“ Randspalte der Code-Serie #1617/#1617 zu überbrücken. In ihrer Verzweiflung erfindet die Evolution, Cofaktoren die niemand vermuten würde. Die Cofaktoren besetzen die rechte Codeseite und schieben dadurch das erzeugte AMP in die Z.Nrn.-Matrix. Magnesium=12 als QS8+4=12, gefolgt von der 24er Zählung plus 1 für Mangan=25 als QS0+8+9+0+7+1+0=25. Weil es für mehrere Cofaktoren nur 1 Bindestelle gibt, bildet sich eine Sperrkette in der Zeile. Alternativ kann ein Protein auch statt der Addition der Ziffer „1“ auf der 24er Zählung über die Endspalte 7/6 mit 24+6=30 den Cofaktor 30=Zink erzeugen. Geeignet ist das Protein (Mensch) „Phosphodiesterase PDE 8A“=829AS [PDE8A - Hochaffine cAMP-spezifische und IBMX-unempfindliche 3',5'-zyklische Phosphodiesterase 8A - Homo sapiens (Mensch) | UniProtKB | UniProt]. An 1. Stelle wird Zink=30 bevorzugt und an 2. Stelle Mangan=25 oder Magnesium=12. Die „Phosphodiesterase=829AS erreicht mit der Ziffer 9 die Randziffer der Startzeile Z3819“9“ und im Prinzip wird über die Codespalte 161[7]/161[7] mit QS1_1=2_QS6+1_1=8 die gespiegelte Folge 928 für 829 AS gebildet. Speziell wird das Magnesium=[9]8+4=12 nach links gedehnt, indem die Ziffer „9“ als 9+8=17=QS1+7=8 weggedrückt wird. Das Ziel in der Z.Nrn.-Matrix ist aber nicht die rechte Randziffer „9“, sondern die Randzahl [3]81 für QS8+1=9 zwecks Energieversorgung über die potenzielle Zählgröße durchgehend in der Serie Z.38xxx. Die Ziffer „2“ folgt in der Randspalte 3“81“/38“2“00. Über die Code-Randspalte 1/1 mit QS=2 mit der Summe 2+2=4 folgt in der Startzeile QS6+1=7 und somit die potenzielle Zählgröße „47“=QS=11. Die Zählgröße 11 wird in 1+1 gespalten, weil das gedehnte Magnesium nochmals als Spalte 984/94[1] vorliegt. Die Ziffer “8“ im Protein=829AS doppelt als der Spaltziffer 1 plus 7 adressiert, so dass in der Startzeile der Kontakt zur Ziffer „9“=seitlich als Cofaktor-Bindestelle hergestellt wird. Das Protein (Mensch)= „Phosphodiesterase¬¬¬ B7Z7A2“=501AS bildet die Summe „50“ und lagert die Ziffer „1“ an [https://www.uniprot.org/uniprotkb/B7Z7A2/entry]. In der Spalte 1617984/161794“1“ wird die Ziffer „1“ für 501AS besetzt. Die Spalte „98/94“ zählt als Summe 18+12=30. Die Code-Randziffer Summe 1+6+1+7=15 muss durch die Zahl „5“ in der Z.-Nr.-Matrix ergänzt werden. In der Spalte Z.381/38200 wird ansteigend zum Rand der Startzeile QS 2+0+0_1=3 gezählt und die mit QS3+8=11=QS=2 die Summe 3+2=“5“ für Summe 5+15+30=“50“ gebildet und Ziffer „1“ angelagert für 501AS. Das Molekül „EHNA-Hydrochlorid“= Erythro-9-(2-Hydroxy-3-nonyl)adenin =C14H23N5O • HCl =84+23+35+8=150E, wirkt als Totalhemmer, weil die Verbindungsbrücke „1617/1617“ besetzt wird. Salzsäure (HCl) wird mit Chlor=17 symbolisiert und besetzt die Startzeile. In Z.38200 wird QS1+6+1+7=15 gezählt und die Z.Nr.-Randziffer "0" ergänzt für 150E (dat_3.Jun.2023).
Das Protein (Mensch) „Phosphodiesterase 11A“=933AS erreicht mit der Ziffer „9“ die Randziffer „9“ in der Startzeile Z.3819“9“ und zählt im Code die Zahl „33“ bis zur Lage links neben der Schwerachse in der Spalte 8/4 zugleich als Cofaktor=8+4=12=Magnesium mit QS1+6+1+7+9_9=33 für 933AS [PDE11A - Dual 3',5'-cyclic-AMP und -GMP Phosphodiesterase 11A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der Botenstoff „Cyclisches Guanosinmonophosphat (cGMP)= C10H12N5O7P=60+12+35+56+15=178E dient als „Second Messenger“ und wirkt als Aktivator, in dem er eine Verbindung zur Zahl „33“ im Code legt, um nochmals „9“ und „33“ zu über den Cofaktor Magnesieum zu koppeln. cGMP=178E verstärkt außerdem die Brückenverbindung 161[7]/[16]17 als 17_QS1+6+1=8 für 178E. Trotz der Zahl „33“ kommt das Protein nicht im Hoden vor, weil die „Schwerachse“ „84“ vom Cofaktor Magnesium besetzt wird. Weil das hemmende Molekül „3-Isobutyl-1-methylxanthin= C11H13N4O2=66+13+28+16=123E“ mit der Ziffer 12=Magnesium in dieser Achse liegt, wäre das Protein im Hoden nutzlos. Wenn Zink als Cofaktor bevorzugt wird, dann wird es bereits in der Zeilennummer genutzt, um die Randziffer „9“ mit der potenziellen Zählgröße „38“ in der Spalte [38]19[9]/[38]20[0] als QS1+9=10 _20 =QS10+20=30=Zink zu koppeln.
Das Protein (Mensch) „Phosphodiesterase PDE5A“=875AS katalysiert den Grundbaustein der RNA, Guanosinmonophosphat (GMP)=C10H14N5O8P=60+14+35+64+15=188E aus cGMP. „cGMP“ liegt in der Brückenverbindung „1617/1617“, so dass „GMP“ in der Spalte „98/9“ als QS9+9=18_8 für 188E direkt folgt. Die „Phosphodiesterase PDE5A“=875AS folgt in der Spalte [984]08/[9]417[3] als 8_QS0_7=7_QS1+4=5 für 875AS [PDE5A - cGMP-spezifische 3',5'-cyclische Phosphodiesterase - Homo sapiens (Mensch) | UniProtKB | UniProt]. .
Das Protein (Mensch)=“Phosphodiesterase (CNP)“=421AS verarbeitet mit der Zahl „21“, gespiegelt die Cofaktor-Bindestelle „84“ als QS8+4=12=Magnesium, so dass kein Cofaktor möglich ist [CNP - 2',3'-cyclische-Nukleotid-3'-Phosphodiesterase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Alternativ koppelt das Protein durch Ringschluss an sich selbst, in dem die Ziffern 4, 2 und 1 doppelt in einer Spalte „840890/417334“ erzeugt werden. Das Protein ist häufig im Myelin des Zentralnervensystems enthalten. Myelin umhüllt als fettreiche Substanz die Nervenfasern. Das Protein beginnt somit neben der Ziffer 33[46] als umhüllende Membran 33 mit QS3+4=7=Nerv und 46 gespiegelt als Hüll-Kreis 64 um die Nervenfasern. Mit Spalte „84/4“ als 4_QS8+4=12 für „412“ statt 421AS und Spalte 4_QS0+9+8+0+4=21 für 421AS. Aufgrund der Spiegelung wird das Protein gedehnt, um es bis in die Z.Nrn.-Matrix weiter zu dehnen. Der linke Zeilenrand kann addiert werden zu QS1+6+1+7+9 =24 und ergibt mit der Randspalte 1/1 die Ziffernfolge „124“ gespiegelt für 421AS. Die Spalte Z.38[1]/Z.38[2] ergibt 11/11 und somit QS1+1+1+1=“4“ und aus der Spalte „1/2“ folgen 421AS.
Über die Z.Nrn.-Matrix „Z.3820x“ werden funktionelle Verbindungen hergestellt, weil der Mineralstoff „Calcium=20E“ als Serie vorliegt. Calcium wird hauptsächlich im Zwölffingerdarm (Duodenum) aufgenommen und vom Hormon „Calcitriol“=C27H44O3 =162+44+24=230E aktiviert. Das Protein (Mensch) „Vitamin D3-Rezeptor“=427AS bewirkt die Transkription von Vitamin-D3-Zielgene zwecks Protein-Biosynthese [ VDR - Vitamin D3 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Bei der Suche nach einem Proteinbereich für die Lungenfunktion fällt die Zeile Epi.Vir.Z.38“204“#1617772333“22“234“ auf, weil außer Luftsauerstoff (O2)=8+8=16E auch Kohlendioxyd (CO2)=6+16=22E enthalten ist. Die Nährstoffe der Zelle übertragen Elektronen auf den Sauerstoff. Über die Atmungskette erzielt die Zelle den höchsten Energiegewinn. Die Atmungskette wird in der inneren Mitochondrienmembran aus 4 Proteinkomplexen gebildet. Die Energie wird im ATP gespeichert. „Calcitrol“ liegt in der Randspalte „6/234“ absteigend als 23_QS4+6=10 mit Ziffer „0“ für 230E. Weiter nach links verschoben als QS7+7+7=21_2=23_ über Spalte 46/2 mit QS4+6=“0“ für 230AS. Der Zweck liegt darin, mit dem Rezeptor die Z.Nrn.-Matrix punktgenau zu adressieren, um die Atmungskette zu starten. Der Vitamin-D3-Rezeptor=427AS liegt in der Spalte Z.38204/Z.38205 als 4_QS0+2=2_QS2+0+5=7 für 427AS. Der springende Punkt liegt in der Spalte O/O als fiktive Luftblasen. Denen geht mit dem Ende der Atmungskette mit dem Auslauf der Calcium-20-Serien in Z.38“20“x die Luft aus, um den Funktionsbereich der Organe zu erreichen. Der Calcium-Hub im Claustrum ist nächste Attraktion.
Tussi fackelt Licht auf Mr. Hubert´s Glückspfennig, der ihr eine Anaconda stiehlte.
Der Vitamin-D3-Rezeptor=427AS muss doppelt entstehen, weil er nach der Bindung von Calcitriol ein Heterodimer mit dem Retinsäure (VitaminA)-Rezeptor „Retinoid-X-Rezeptor/RXR“ bildet, und zwar als gesamte Spalte Z.38202/Z.38203. Spalte 38/38 über Zählgröße als QS=“4“. Mit „4“_“2“_QS0+2_3+0+2=“7“ für 427AS. Hierdurch kann die Randziffer „1“ als Retinol (VitaminA)=C20H30O=120+30+8=158E aufsteigend eingebunden werden. Die Retinsäure endet links neben Retinol und beginnt mit dem „Claustrum“ in Z-Nr. Z.38199, und zwar mit dem Protein (Mensch) „Retinsäure (RAI2)“=530AS als QS38_38_38 über die Zählgröße 11_11_11 mit 2+2+ 1 gespalten Rest 1 für „5“_QS Rest 1+2=“3_0“ für 530AS [RAI2 - Retinsäure-induziert 2, Isoform CRA_a - Homo sapiens (Mensch) | UniProtKB | UniProt]. Alternativ endet das Protein (Mensch) „Retinsäure (RAI1)“=1906AS an gleicher Stelle, beginnt in Z.38“19“9 jedoch mit der Zahl 19 [RAI1 - Retinoic acid-induced protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein Mensch „Retinoid-X-Rezeptor/RXR“=462AS“ bildet mit dem Vitamin-D3-Rezeptor ein Heterodimer und entsteht daher ebenfalls doppelt [NR2B1 - Retinsäurerezeptor RXR - Homo sapiens (Mensch) | UniProtKB | UniProt]. Randspalte Z.38199/Z38200 mit 38_38 als 11_11 aufsteigend für QS2+2=“4“_ 2_2_38=QS=2=Summe 2+2+2=6_38=QS=2 für 462AS. Die Dopplung wird spiegelbildlich gezählt, und zwar in Spalte Z.38[204]/38[205] mit Randspalte 38/38=11_11=QS=“4“ als „4“_38=QS2_2_2=“6“_QS0+2=“2“ für 462AS. Der Elektronenfluss über die Atmungskette bewirkt, dass die Protonenpumpen H^+-Ionen (Protonen) vom Matrixraum des Mitochondriums in den Intermembranraum treiben. Beteiligt sind 4 Proteinkomplexe: Komplex I: NADH-Dehydrogenase; Komplex II: Succinatdehydrogenase; Komplex III: Cytochrom-c-Reduktase und Komplex IV: Cytochrom-c-Oxidase [Atmungskette - DocCheck Flexikon].
Der „Komplex I“ besteht aus 43 Ketten, die dann ggf. im Code liegen. Der Komplex wird in Z.Nr.38203 mit QS38+2+3=43 Ketten avisiert, zieht dann aber gespiegelt in der Randspalte „3/4“ noch bis zur Folgezeile weiter. Das Protein (Mensch) „NADH-Dehydrogenase_Alpha-Unterkomplex“=90AS zeigt die Gesamtlänge aufsteigend ab Z.3“82“00 beginnend mit QS8+2=10_20_20_20_20=90AS bis Z.Nr.38“20“4, die im Code die Intermembran „333“ enthält [NDUFA1 - NADH-Dehydrogenase [Ubichinon] 1 alpha-Unterkomplex-Untereinheit 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der „Komplex II“ besteht aus dem Enzymkomplex „Succinatdehydrogenase“ und katalysiert die Reaktion von Succinat zu Fumarat. Das Protein (Mensch) „Succinat-Dehydrogenase (SDHA)“=550AS verbindet die Coderandziffer „1“ mit der Ziffer „4“ als Anschluss zum „Komplex I als QS1+4=5 und ergänzt über die spalte [38]20“4“#“1“/38“2“05“ mit 5_0 für 550AS [SDHA - Succinat-Dehydrogenase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der Cofaktor „Flavin-Adenin-Dinucleotid (FAD)“= C27H33N9O15P2=162+33+63+120+30=408E nimmt in der Spalte [38]20[4]/[3]820[5] die Zahl „20“ zur Bindung aus dem „Komplex I“ mit auf, um die Zählung der Zahl „20“ als Blockzahl mit QS20+20=40_8 für 408E zu definieren. Der „Komplex III“ enthält das Protein (Mensch) „Cytochrom-c-Reduktase (UQCC3)“=93AS, das die Rekrutierung von „Cytochrom-b“ vermittelt. Der Komplex wird stabilisiert, weil in Z.38205/Z.38206 der freie Rand neben Komplex mit besetzt wird. Die Randspalte 38/38 wird addiert zu QS38+38=76 mit Defizit 93-76=“17“. Aus Spalte „2/206“ mit QS2+2+0+6=“10“ wird im Code die Randzahl #QS1+6=“7“ addiert für 93AS [UQCC3 - Ubiquinol-cytochrome-c reductase complex assembly factor 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Cytochrom-b ist mit enthalten als „38_QS2_2+0+6=10“ als Ziffer „0“ für 380AS [MT-CYB - Cytochrome b - Homo sapiens (Human) | UniProtKB | UniProt]. Der „Komplex IV“ enthält das Protein (Mensch) „Cytochrom-c“= 105AS, das am Zelltod (Apoptose) beteiligt ist [CYCS - Cytochrome c - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein schließt die Strecke bis zur BiXnom-Calcium Schwelle, an der Calcium=20 in der Zeile Z.383“20“9 ohne Sonderaktion enden würde. Das Protein hat in der Ziffer „5“ aber bereits den Fuß in die Zeile Z.38210 gestellt, um die Verschiebung der Luftblase „0“ zu einer Randziffer „0“ zu symbolisieren. Die Ziffer „5“ liegt in der Spalte Z.[38]2[09]/21[0] als QS2_2+1=5. Die Zahl „10“ summiert sich in 382[07]/382[08]/380[9]/[38]210 als 38=QS=2_2=4_38=QS=2_2=4_38=QS=2=Summe 4+4+2=“10“ zuzüglich Ziffer „5“ für 105AS. Das Protein (Mensch) „Cytochrome c oxidase subunit 1 (COX1)“=513AS enthält in der Zahl 513AS als 51__13 die Differenz 51 - 38(Randziffer)=13 und symbolisiert die Spaltung einer Zählgröße 11 zur getrennten Verwendung 1+1 [COX1 - Cytochrome c oxidase subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Z.38209 ist beteiligt, weil die Zahl „2“_QS0+9=“9“=29=Kupfer als 1. Cofaktor bildet. Das Kupfer=29E für die 2. Cu-Bindestelle liegt im Code der Vorzeile Z.38208#161760“29“6844709. Protein ab Zeile Nr.38208 mit 38=QS=2_QS2+0+8=10=Summe 2+10=12 mit Defizit „1“ bis Ziel „13“. Zeile Nr.Z.38209 mit QS2+0+9=11, gespalten in 1+1 als Ziffer „1“ und Überschuss „1“ zur Kompensation für Zahl „13“. Weiter mit Ziffer „1“ und Randspalte 38[209]/38[210] als 38=QS=2_38=QS=2=Summe 1+2+2=“5“ für 513AS. An der 2. Bindestelle kann das Kupfer=29 als alternative Protein-Zielpostition durchlaufen werden, weil eine Ersatz-Bindestellen Z.Nr.xx“209“ vorhanden ist, und zwar aufsteigend in Spalte „5[306]/“29“[68]/0632“ als 5_QS2+9=11=QS=2_6+3+2=11 mit Summe 2+11=13 für 513AS.
Die Mitochondrien der Zelle dienen der Energieversorgung, wobei sich deren Anzahl nach der Zellfunktion richtet. Die Mitochondrien werden überwiegend nur von der mütterlichen Linie vererbt. Die innere Membran „33“ wird durch 4 Komplexe je 3x Rand zahl 38=QS=11 mit 3*11=33 erzeugt. Somit zieht sich die Atmungskette von Z.38199+ (12-1) bis Z.38210, um die BiXnom-Calcium-20-Schwelle zu überwinden. Die Zählgröße „11“ fungiert als Protonenpumpe und die Ziffer „1“ ist das Proton (H^+). Die Protonenpumpe „11“ stellt in Z.382“11“ die Beziehung zum Code her, in dem dort im Ergebnis der Atmungskette das Adenosintriphosphat [ATP)= (C10H16N5O13P3=60+16+35+104+45=260E gespeichert wird. Das Protein (Mensch) „Mitochondriale Membran-ATP-Synthase_alpha (ATP5F1A)“=553AS ist spiegelbildlich mit „355“ lesbar, weil sich das „ATP“ durch die Randziffern zieht. Funktion: „Mitochondriale Membran-ATP-Synthase (F1F0 ATP-Synthase oder Komplex V) produziert ATP aus ADP in Gegenwart eines Protonengradienten über die Membran, der durch Elektronentransportkomplexe der Atmungskette erzeugt wird“ [ATP5F1A - ATP synthase subunit alpha, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Vir.Z.382“11“#16174759681“355“2“, Epi.Vir.Z.38212#161743363912“97“6“ und Epi.Vir.Z.38213#161739131233942. ATP=260E liegt unsichtbar über 3 Zeilen in der Randspalte (355)“2“/97“6“/94[2], weil nach 2_6 keine Null folgt. Mit 2_6_QS7_4=11 wird eine Zählgröße erzeugt, die gespalten wird und doppelt 9+1=10 /9+1=10 mit Ziffer „0“ für 260E erzeugt. Das Protein (Mensch) „Mitochondriale Membran-ATP-Synthase_beta (ATP5F1B)“=529AS zieht links neben der Unterheit alpha ab Z.38210 eine Spalte und nimmt die Ziffer 9 aus ATP mit auf, und zwar in der Spalte QS3_1_1=5_29 für 529E [ATP5F1B - ATP-Synthase-Untereinheit beta, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weitere Proteine ATP-Synthase begleiten die Atmungskette: Protein „ATP-Synthase_ATP5MK=58AS mit Z.38209/210 in Randspalte „401/8“ mit QS4+0+1=5_8 für 58AS [ATP5MK - ATP-Synthase-Membran-Untereinheit K, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein „ATP-Synthase_ATP5PO =213AS mit Z.38207/208 in Randspalte „629/709“ mit „2“_6+7=“13“ für 213AS [ATP5PO - ATP synthase subunit O, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt ]. Protein „ATP-Synthase_ATP5MC1“=136AS mit Z.38204/205/206 in Spalte „222[34]/3[74]/1[78]“ mit „QS2+2+2=“6“_“3“_“1“ für 136AS [ ATP5MC1 - ATP-Synthase F(0)-Komplex-Untereinheit C1, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein „ATP-Synthase_ATP5MGL“=100AS mit Z.38201/202/203 in Spalte „75/1017/7[76]“ als QS75_17+0+1=93_7=100AS [ATP5MGL - Putative ATP-Synthase-Untereinheit g 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Protein „ATP-Synthase_ATP5ME“=69AS in Z.38199/200 in der Randspalte „9/6“ als 69AS [ATP5ME - ATP-Synthase-Untereinheit e, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Zusätzlich sind in Z.38204 zwei Proteine „ATP-Synthase“ mit 226AS und 256AS als Modifikation vorhanden [ATPase 6 - ATP synthase subunit a - Homo sapiens (Human) | UniProtKB | UniProt /ATP-Synthase-Untereinheit b - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die noch unbesetzte Randspalte in Z.38123/124 enthält Adenosindiphosphat (ADP)=C10H15N5O10P2=60+15+35+80+30=220E. Aus ADP und Phosphat wird ATP synthetisiert. Bei der Phosphorylierung von Substraten mittels ATP entsteht wieder ADP. ADP=220E in der Randspalte „3942/6434“ als „2“_4_QS3+4=7 mit „47“ als QS=11=QS=“2“_QS6+4=10 mit Ziffer „0“ für 220E. Der restliche Zeilenrand von Z.38115 bis 381222 wird nicht von der Atmungskette besetzt. Das „Claustrum“ umfasst weitere Bereiche.
Das Protein (Mensch)=“Phosphodiesterase (PLCB1)“=1216AS enthält den Cofaktor „Calcium^2+“ und ist somit geeignet, das an der „Bixnom-Calcium-20-Schwelle“ endende Calcium über die Schwelle zu heben. Das Protein „katalysiert die Hydrolyse von 1-Phosphatidylinositol-4,5-bisphosphat zu Diacylglycerin (DAG) und Inositol-1,4,5-trisphosphat (IP3) und vermittelt intrazelluläre Signalübertragung stromabwärts von G-Protein-gekoppelten Rezeptoren; reguliert die Funktion der Endothelbarriere“ [PLCB1 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die 3 Moleküle umschließen exakt 2 Nullen, die die Randverschiebung der Null in der Spalte Z.382“0“9/Z.3821“0“ als Luftblase darstellen. 1-Phosphatidylinositol-4,5-bisphosphat=C47H80O19P3=282+80+152+45=559E[ Phosphatidylinositol-4,5-bisphosphate – Wikipedia]. Diacylglycerin=C37H70O5=222+70+40=332E [Diacylglycerin | C37H70O5 | CID 6026790 - PubChem (nih.gov)]. Inositol-1,4,5-trisphosphat (IP3)= C6H15O15P3=36+15+120+45=216E [Inositoltrisphosphat – Wikipedia]. Das Protein „PLCB1“=1216AS zieht nunmehr in der Spalte Z.38209/Z.38210 absteigend über diese Schwelle als 12_QS8_8=16 für 1216AS. Der Zweck ist nunmehr aus der Spalte „82/82“= Summe=2*(QS8+2=10)=20=Calcium ersichtlich: Das Calcium zieht sich in der Serie Z.3821x unverändert weiter, wobei statt 1 Zeile nunmehr 2 Zeilen in Spaltenform mit 4 Ziffern auszulesen sind. Weiterhin werden transportiert: Randzahl „38“=QS3+8=11=Natrium. Stickstoffmonoxid (NO)=7+8=15E aus der Serien-Spalte „21/21“=QS2_2=4_Spalte 1/1=11. Summe 4+11=15E. Kalium=19E lückenlos in der Serie Z.3821x QS3+8+2+1=14_1+2_QS3+8=11=QS=2 als Summe 14+3+2=19=Kalium.
Die Proteine „Phosphodiesterase“ mit den Cofaktoren Zink, Mangan und Magnesium können nunmehr über die Schwelle wandern, und erneut im Code mit den Cofaktoren als Suchgrößen ankern. Das Protein (Mensch) „Phosphodiesterase (PDE7B)“=450AS ist zusätzlich aufgrund der Hemmstoffe „Dipyridamol“=C24H40N8O4=144+40+56+32=272E und „3-Isobutyl-1-methylxanthin (IBMX)“= C11H13N4O2=66+13+28+16=123E. Das Protein hydrolysiert den Botenstoff „Zyklisches Adenosinmonophosphat (cAMP)=C10H12N5O6P=60+12+35+48+15=170E“, wofür Wasser (H2O)=28 in der Zeile Z.38218 mit der der Randspalte „30[2]/15[8]“ direkt neben dem Protein liegt. Das Zink=30E wird dabei verschluckt, und zwar als QS3_1=“4“_“5_0“ für 450AS. Mg mit 1_QS1+1=2 für 12E und Mn mit 2_QS0+5=5 für 25E binden nur teilweise ein [PDE7B - cAMP-spezifische 3',5'-cyclische Phosphodiesterase 7B - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das „BiXnom-Claustrum“ verarbeitet nur Systemgrößen, die durch einen universellen Rechen-Parcours ziehen; was nicht passt, bleibt hängen. Die DNA wird im Zellkern rollenartig zwecks Verkürzung als 30nm dicke Faser gewickelt, deren Dicke sich aus der Serie Z.382xx mit 3_QS8+2=10 mit Ziffer 0 für 30nm zählt. Die Wicklungsverkürzung von 1:40000 kann ggf. auch als 1:38200 zählbar sein. Die „Histone“ müssen ebenfalls einer Vorprägung folgen. Die Kernhistone bilden einen Proteinkomplex als Oktamer aus je zwei Kopien der Histone H2A, H2B, H3 und H4. „H3/H4“ schließen sich als Dimer und dann als Tetramer zusammen, anschließend bindet das Dimer „H2A/H2B“ ein [Histon – Wikipedia]. Jedes „Histonoktamer“ wird von 1,65 Spiralwindungen des Nukleinsäurestranges umgeben, was etwa 146 Basenpaaren entspricht. Mit den Serienzahlen Z.382xx#1617 lassen sich die häufigen Aminosäuren der Histone „Arginin, Lysin und Histidin“ darstellen [Histon - DocCheck Flexikon]: Arginin=C6H14N4O2=36+14+28+16=94; Lysin=C6H14N2O2=36+14+14+16=80 und Histidin=C6H9N3O2=36+9+21+16=82. Lysin=80E mit Summe Z.38_2+Z.38_2=76+4=80E; Histidin=82E ist lesbar; Arginin=94E besetzt die Codeserie „1617“ in der Spalte (1)_617/(1)_(6)17 aus 2 Anteilen mit QS1+1=2_6 für 26 (Eisen) und Summe 61+7=68 als 26+68=94E. Zugleich wird damit die versteckte Transportstrecke für Eisen=26 definiert. Diese Aminosäuren ergeben die positive Ladung der Histone, so dass sich die negativ geladene DNA anlegen kann.
„Transferrin“ klingt stark nach dem DNA-Thema. Falsch: „Transferrin“ ist ein Transportprotein für Eisen. Es wird von der Leber produziert und besitzt „2“ Bindungsstellen für Eisen, das von „Transferrin-Rezeptoren“ aufgenommen wird [Transferrin – Wikipedia]. Das Protein „Transferrin“ gemäß Wikipedia (zu kurz mit nur 679 AS) wird als Protein (Mensch) „Serotransferrin“=698 AS bezeichnet. Funktion: Eisenbindende Transportproteine, die zwei Fe3+ Ionen in Verbindung mit der Bindung eines Anions, in der Regel Hydrogencarbonat-Ion „HCO3− =1+6+24=31E“ (TF - Serotransferrin - Homo sapiens (Mensch) | UniProtKB | UniProt), und zwar in Spalte Z.3“8“211/Z.38212/Z.3821“3“ mäanderförmig (um Zahl 31) absteigend als QS3_2_1=“6“_QS1_1_1_2_2_2=“9“_“8“ für 698AS. Das Protein (Mensch) „Transferrin_H7C5E8“=143AS ist als Isoform dem „Serotransferrin“ ähnlich [TF - Transferrin - Homo sapiens (Mensch) | UniProtKB | UniProt], und zwar ab Z.38“21“1 zweizeilig „1“_QS2+2=“4“_QS1+2=“3“ für 143AS. Weiterhin Protein (Mensch) „Transferrin_F8WC57“=102AS [TF - Transferrin - Homo sapiens (Mensch) | UniProtKB | UniProt]. 102], und zwar zweizeilig ab Z.382“10“ mit „1“_“0“_QS1+1=2 für 102AS. Diese 3 Proteine ziehen sich als Kette durch die Z.Nr.-Matrix, weil die Transferrin-Rezeptoren im Code liegen, um das doppelte Eisen=26 als Randspalte „2/6/2“ aufzunehmen. Das Eisen beginnt in Z.38211 um über die Zählgröße 11 mit QS2+1=3_1=31=Hydrogencarbonat (Bicarbonat) zu positionieren. Insgesamt sind 4 Zeilen beteiligt, so dass am linken Coderand doppelt eine Eisenspalte „1/16“ für 2x QS1+1=2_6=26=Eisen bindet.
Der Code-Zeilerand-Spalte von Z.3212 enthält in der Mittelposition die Ziffer (2)„6“(2) von Eisen=Blut=26 sowie in der Vor-und Folgezeile die Ziffer „2“ für eine Dopplung. Der Code-Zeilerand-Spalte von Z.3212 enthält in der Mittelposition die Ziffer (2)„6“(2) von Eisen=Blut=26 sowie in der Vor-und Folgezeile die Ziffer „2“ für eine Dopplung. Das Protein (Mensch) „Transferrin-Rezeptor 1_TFRC“=760AS ließ das erste Eisen 26(2) absteigend als 76_QS2+8=10 mit Ziffer „0“ für 760AS [TFRC - Transferrin receptor protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Transferrin-Rezeptor_ B7Z2I6“=478AS ließ nur das zweite Eisen „[2}62“ als „4“_QS3_4=“7“_QS2+6=8 [Transferrinrezeptor-Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Transferrin-Rezeptor 2_ TFR2“=801AS zählt in der Randspalte ab Z.38210 incl. „262“ aufsteigend über 5 Zeilen als „8“_QS2+6+2=1“0“ für „0“_links „4“_QS3+4=“7“ für 47=QS=11 daraus nur die Ziffer „1“ (Ende auch in anderer Richtung möglich) für 801AS [TFR2 - Transferrin receptor protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Die 146 Basenpaare ergeben sich mit QS1+4+6=11=Zählgröße mit der Windung als Kreis=64, gespiegelt als Linksdrehung „46“. Der Komplex „Histonoktamer“ und umwickelten DNA bildet das Nukleosom. Die Gesamtheit der Strukturen wird als Chromatin (Material der Chromosomen) bezeichnet. Bewegung der Histone: Die DNA kann erst abgelesen, wenn sich die gewickelte Verpackung gelockert hat (Atmung) - Nukleosomen bewegen sich und drehen sich zum Ein- und Auswickeln um die eigene Achse. Die entsprechenden Proteine können nur im Zeilenbereich mit Kreis=64 und Schwerachse=84 liegen. Geeignet sind 3 Zeilen ab Z.38215 mit der Code-Spalte „[30]“6“[6]“6“/[2]64[3]4/22202_84. Darin liegt der Kreis=64 und doppelt als Spalte „6/4“ für Drehrichtungen vor. Die beiden Kreis-Spalten „6/4“ bilden zugleich über ihre Ziffer „4“ eine Schwerachse, weil sich die Schwerachse mit der Ziffer „8“ um 90° gedreht als Zeile QS2+2+2+0+2=8 bildet, zugleich ist die Schwerachse nochmals direkt lesbar. Die gewickelte DNA ist mit der Faserdicke von 30nm vertreten (was in anderen Prozeduren Zink=30E ergibt). Die erforderliche Symbolik wird durch das Protein (Mensch) „Histoncluster 1_Hist1H1E“=219AS hergestellt. Beim Durchlauf wird Physik=“63“ beidseitig durch Biologie=“64“ als Symmetrie begleitet. Es wird ein 3. Kreis=64 für 3 Achsen erzeugt. QS6+6+6=18=QS1+8=“9“_QS4+3+4=11_QS6+2+2=10 mit Summe 11+10=21 für 219AS [HIST1H1E - Histoncluster 1, H1e - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Symmetrie zieht sich wie ein Reisverschluss für die DNA. Nachfolgend kann die DNA abgelesen werden.
In Z.38215 ist am Histon-Komplex in #1617“30“666“540433 seitlich Zink=30 für die Metall-Ionen-Bindung der Proteine „Histon-Deacetylase (kurz HDAC)“ vorhanden. HDACs regeln direkt die Transkription und kontrollieren den Zellzyklus. Das Protein (Mensch) „Histone Deacetylase 4“=1084AS sucht die Schwerachse 84 und ist dem Zink=30 vorlagert in Z.38213 mit Spalte „91/48“ als QS9+1=10_8_4 für 1084AS [HDAC4 - Histone deacetylase 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Wegen 3913=„3“_QS9+1=1“0“_“3“ ist das enthaltene Protein (Mensch) „STUB1“=303AS der bevorzugte Bindungspartner [STUB1 - E3 ubiquitin-protein ligase CHIP - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Histone Deacetylase_ J3KPH8“=1014AS nimmt die Ziffer „3“ vom Zink=30 auf, und zwar absteigend als QS3_3+4=10_QS9+1+3+1=14 für 1014AS [HDAC7 - Histone deacetylase - Homo sapiens (Human) | UniProtKB | UniProt]. Bei der Deacetylierung von Lysinresten wird Lysin=80E als Schwerachse durch die Zink-Null in der Spalte „48“/[3]“0“[666]/“6“ als „8“_QS4+0+6=1“0“ mit Ziffer „0“ für Lysin=“80“ vertikal dargestellt. Das Protein (Mensch) „Histone Deacetylase_ HDAC6“=1215AS nimmt die Ziffer „3“ vom Zink=30 auf, und zwar als QS6+6=12_QS4+6+2_3=15 für 1215AS [HDAC6 - Histone deacetylase 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Das Protein (Mensch) „Histone Deacetylase_ B7Z8G5“=763AS nimmt Zink komplett auf ab Z.39216 mit QS3+4=“7“_“6“_QS0+3=3 für 763AS [Histon-Deacetylase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Histone Deacetylase_ HDAC11“=347AS enthält keine Beziehung zum Zink als Orientierungshilfe und wird vermutlich deshalb besonders von Krebszellen gebildet. Das Medikament „Panobinostat“=C21H23N3O2=126+23+21+16=186E hemmt Proteine „Histon-Deacetylasen“, so dass sich die acetylierten Histone sammeln, was zum Zelltod (Apoptose) führt [HDAC-Inhibitoren (myelom.online)]. Das Ziel wird erreicht, weil die Zink-Strecke mit QS3_3=6_QS0+6+6=12 mit Summe 18_6 für 186E mittels „Dampfhammer“ total platt ist. Eine Beziehung zum „HDAC11“ ist aber nicht erkennbar. „HDAC11“ nutzt die Gruppenspalte 4/4, um links die Schwerachse 4+0+4=8_4 zu berühren, und zwar als „3“_“4“_QS4+3=“7“ für 347AS [HDAC11 - Histon-Deacetylase 11 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Zinkfingerprotein Gfi-1b“=330AS ist ersichtlich mit der Zahl „30“ in Spalte „3/30“ als Bestandteil des RCOR-GFI-KDM1A-HDAC-Komplexes [ GFI1B - Zinkfingerprotein Gfi-1b - Homo sapiens (Mensch) | UniProtKB | UniProt].
Polymerasen: Im weiteren Zeilenlauf müssen sich die Polymerasen entwickelt. Es ist 1 Protein in Datenbank zu finden, das eine Zinkbindung enthält, um einen neuen Bereich zu erschließen. Das Protein (Mensch) „RNA-Polymerase Q9H9Y6 • RPA2“=1135AS liegt erwartungsgemäß in der Zeile Z.38218 mit der Spalte [288]/130/115 als 11_QS3+0=3_5 für 1135AS, wobei Zink komplett aufgenommen wird [POLR1B - DNA-directed RNA polymerase I subunit RPA2 - Homo sapiens (Human) | UniProtKB | UniProt]. ATP=260E zählt aus der Vorzeile die Ziffer 2 aufsteigend und nimmt das Zink=30 auf, und zwar als „2“_QS1_1+1_3=“6“_“0“ für 260E. Cytidintriphosphat (CTP)=C9H16N3O14P3=54+16+21+112+45=248E in Z.38216 als Randspalte „2/84“ für 248AS. Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E zählt die komplette Randspalte als 2_QS4_2=6_8 für 268E. Uridintriphosphat (UTP)=C9H15N2O15P3=54+15+14+120+45=246E zieht vom Rand durch Zink=30 als 2_4_QS2+0+3=5_1 mit Summe 5+1=6 für 246AS. „Funktion: Die „DNA-gerichtete RNA-Polymerase I-Untereinheit“ katalysiert die Transkription von DNA in RNA unter Verwendung der vier Ribonukleosidtriphosphate (ATP, CTP, GTP, UTP) als Substrate. Zweitgrößte Kernkomponente der RNA-Polymerase I, die ribosomale RNA-Vorläufer synthetisiert. Bildet zusammen mit der größten Untereinheit das aktive Zentrum der Polymerase. Pol I besteht aus beweglichen Elementen und RPA2 ist Teil des Kernelements mit dem zentralen großen Spalt und wahrscheinlich einem Klemmelement, das sich bewegt, um den Spalt zu öffnen und zu schließen.“ Ersichtlich ist, dass das Protein seitlich nochmals zählbar ist. Weil die Verbindung eine potenzielle Zählgröße 74=QS=11=QS=2 enthält, kommt es zur Spaltbildung. Der Spalt „1/1“ liegt in der Spalte 6“1“3/“111“, so dass eine Spaltöffnung mit Physik=63=6_1+1+1 offen und 6“1“3 gesperrt ist. Zweitzählung in Z.38218: „11“_QS6+1=7_QS1+3=4 aus folgt QS=“2“ aufsteigend über Spalte 3/“1“_5 als Summe 2+1=3_5 für 1135AS. Über den links angeschlossenen 2.Teil wird über 2 Zeilen eine Matrix aus 4 Symmetrie-Einheiten angeschlossen, weil das Symbol X_Y_X ein „Kopiergerät“ darstellt. RNA-Polymerase: RNA-Polymerase I, II und III sowie mitochondriale RNA-Polymerase. Außerdem verfügen Eukaryonten über eine matrizenunabhängige RNA-Polymerase, die Poly(A)-Polymerase [RNA-Polymerase - DocCheck Flexikon]. Mit einer erkennbaren Position für die RNA-Polymerasen liegt nur das Protein (Mensch) „RNA-Polymerase Q9H9Y6 • RPA2“=1132AS wegen seiner Zinkbindung vor [POLR1B - DNA-directed RNA polymerase I subunit RPA2 - Homo sapiens (Human) | UniProtKB | UniProt]. Für sonstige Proteine wird eine Übergangsposition vom rechten Zeilenrand zur Codemittelachse gesucht: Das Protein (Mensch) „RNA polymerase II-associated protein 3“=665AS bildet eine Brücke, die sich aus dem Zentalteil „36“ und dem Verbindungsteil „30_5“ zusammensetzt. Ohne einen Cofaktor=Zink kann im Zink begonnen werden, weil eine Blockzahl gebildet wird, und zwar in Z.38218 mit der Randspalte 161302/81[11]58 ergibt ohne Zahl „11“ und separat „5“ die Summe 13/17=QS13+17=30 für 30_5. Für eine Regulator-Funktion wird eine 2. Zählung inklusive Zählgröße „11“ als Aktivator benötigt. Die Zentralspalte mit 971/739=17/19=QS17+19=“36“ ergibt somit die Summe 36+30_5=665AS [RPAP3 - RNA polymerase II-associated protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Mediator der RNA-Polymerase-II-Transkriptionsuntereinheit 1(MED1)“=1581AS bildet in Z.38218 eine Brücke in der Randspalte 11613[02]/98111[58] als „1“_QS3+1_1=5_QS1_6+1=8_“1“ für 1581AS [MED1 - Mediator der RNA-Polymerase-II-Transkriptionsuntereinheit 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Transkriptionsterminationsfaktor, RNA-Polymerase I, Isoform CRA (TTF1)“=905AS bildet in Z.38219 in der Spalte 37/95 als „9“_QS3+7=10 mit „0“_“5“ =905AS [TTF1 - Transkriptionsterminationsfaktor, RNA-Polymerase I, Isoform CRA_a - Homo sapiens (Mensch) | UniProtKB | UniProt].
DNA-gerichtete RNA-Polymerase: Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_ P52434 • RPAB3“=150AS liegt im Code neben der DNA. Diese ist zwar in Z.Nrn.-Matrix codiert, besetzt aber mit der Eisen/Schwefel-Bindung den linken Code-Rand als Serie #16“1“, darin gehört die Spalte „1/1/1/1“ gleichzeitig auch zur BiXnom-RNA-Box, die sich aus 4 Symmetrie-Tripel „X_Y_X“ über 2 x 2 Zeilen zusammensetzt. Ab Z.38218 aufsteigend in Spalte 17“1“797/17“13“73“ als 1_QS1+3=4_Dehnstück QS7+3=10 geteilt in „1+0“ für Summe 4+1=5_0 für 150AS [POLR2H - DNA-directed RNA polymerases I, II, and III subunit RPABC3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_ Q59E91“=1074AS liegt im Code über 2 Zeilen absteigend ab Z.3819 als Summe 27+40=67 in der Spalte 1“71“797/17“1“37“3 als QS3+7=10_QS1+71= 72 für 1072AS [DNA-gerichtete RNA-Polymerase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_ P62875 • RPAB5“=67AS liegt im Code über 2 Zeilen in Z.3818 Spalte 17/13_73=40 und links 17/1=QS1+1=2_7 für „27“ mit Summe 40+27=67 für 67AS [POLR2L - DNA-gerichtete RNA-Polymerasen I, II und III Untereinheit RPABC5 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_Q15161“=113AS liegt im Code über 2 Zeilen in Z.3818 in der Spalte 17“1“797/17“13“73 als 1_13 für 113AS. Das unberührte Feld „797“ betrifft wahrscheinlich das Mitochondrium, so dass das Protein für die RNA-Polymerase I, II und III aktiv ist [POLR2 - DNA-directed RNA polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Potein (Mensch) „DNA-gerichtete RNA-Polymerase_Q8TCW2“=299AS liegt in der Spalte „1“71/“1“[7]1/[17]“0“_“9“ als QS1+1=“2“_QS7+1_1=“9“_QS0+9=“9“ für 299AS [DNA-gerichtete RNA-Polymerase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_Q59E91=1072AS liegt in der Spalte [179]“7“/“13“7“3“ als QS7+3=10_7_QS3+1=4_7 mit QS=11=QS2 für 1072AS [DNA-gerichtete RNA-Polymerase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-gerichtete RNA-Polymerase_mitochondrial_O00411 • RPOM“=1230AS liegt mit dem Feld RNA_Mitochondrium „797“=Summe 23, so dass sich die Zahl 30-23=7 in der Achsspalte 9/7 für Summe „30“ vorhanden ist. Die Zahl „12“ bildet sich links anliegend aus „1713“ mit „1“_7_QS1+3=4 für 74=QS=11=QS=2 für 1_2 als Zahl „12“ für 1230AS. Funktion: Komponente des mitochondrialen Transkriptionsinitiationskomplexes, der mindestens aus TFB2M, TFAM und POLRMT besteht und für die basale Transkription mitochondrialer DNA benötigt wird [POLRMT - DNA-gerichtete RNA-Polymerase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Transcription factor A, mitochondrial (TFAM)=246AS“ ist zusammensetzbar über QS24+6=30 und ist somit im Pfad darstellbar [TFAM - Transcription factor A, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Alternatives Protein TFAM (TFAM)=40AS“ gehört zum Komplex und liegt seitlich in der Spalte „1/39“ als QS1+39=40AS an. Für die Bildung der U-Form muss XYX=“797“ außer der seitlichen 10er Spalte 1/[3] 9 mit einer U-Form 7/3_7_7/3 umrahmt werden, um Y=9 zu umgehen. [TFAM - Alternatives Protein TFAM - Homo sapiens (Mensch) | UniProtKB | UniProt- Homo sapiens (Mensch) | UniProtKB | UniProt].
Poly(A)-Polymerase: Die Bindung an die RNA wird durch das Protein (Mensch) „Cleavage and Polyadenylation Specificty Factor (CPSF)“=1443AS verstärkt. [CPSF1 - Spaltungs- und Polyadenylierungsspezifitätsfaktor Untereinheit 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „CPSF“ zieht in der Z.Nrn.-Matrix durch eine 2er Spalte und verursacht wegen Sehnerv=2 ein Krankheitsbild. Das Protein endet mit der Randziffer „1“ in Z.3822“1“. Diese Zeile ist eine Grenze für die Proteine „Poly(A)-Polymerase“, die wegen Magnesium=12E oder 38=QS=2_QS2+2+1=5 für Mangan=25E eine Bindungsstelle besitzen. Die 4 Proteine „RNA-Polymerase“ sind vorgelagert. Protein „CPSF“=1443AS ab Z.38“2“1“7 aufsteigend als „1“_QS2+2=“4“_QS2+2=“4“_QS2+0_1=“3“ für 1443AS. Das Protein (Mensch) „Poly(A) polymerase_B4DHB8“=740AS mit 1 Cofaktor-Bindestelle (Mg^2+/Mn^2+) liegt in der Spalte Z.“38“21“9/Z.“38“22“0“ als [38]=QS=2_[38]=QS=2_+2+1=“7“_QS2+2=“4“_“0“ für 740AS [Poly(A) polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Poly(A) polymerase_ Q9BWT3 • PAPOG“=636AS mit 1 Cofaktor-Bindestelle (Mg^2+/Mn^2+) liegt in der Spalte Z.“38“21“8/Z.“38“2“19/Z.“38“22“0 als [38]=QS=2_ [38]=QS=2_[38]=QS=2 mit Summe „6“_QS2+1=“3“_QS2_2+2=“6“ für 636AS [PAPOLG - Poly(A) polymerase gamma - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Poly(A) polymerase_Q6PIY7 • GLD2“=484AS mit 1 Cofaktor-Bindestelle (Mg^2+/Mn^2+) liegt in der Spalte Z.“38“21“8/Z.“38“2“19/Z.“38“22“0 als [38]=QS=2_[38]=QS=2 mit Summe=“4“_ [38]=QS=2_2_2_2=8_QS1_1_2=4 für 484AS [TENT2 - Poly(A) RNA Polymerase GLD2 - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Das Protein (Mensch) „Poly(A) polymerase_ Q9NVV4 • PAPD1“=582AS mit 1 Cofaktor-Bindestelle (Mg^2+/Mn^2+) liegt in der Spalte Z.“38“21“8/Z.“382“19/Z.“382“2“0 als [38]=QS=2_+2+1=“5“_[38]=QS=2_2_[38]=QS=2_2=Summe=“8“_“2“ für 582AS und bildet den Schwanz der mitochondrialen Transkripte [MTPAP - Poly(A) RNA Polymerase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt].
DNA-Polymerasen katalysieren die Synthese von DNA aus Desoxyribonukleotiden und spielen eine Schlüsselrolle bei der DNA-Replikation. Die Poymerase verknüpft einzelne Moleküle (Monomere) zu einer Kette (Polymer). Bei einer DNA-Polymerase wird das Polymer „Desoxyribonukleinsäure (DNA)“ aus den Monomeren „Desoxyribonukleotide [Desoxy-Nukleosidtriphosphate (dNTPs)]“.zusammengsetzt. „Die DNA-abhängige DNA-Polymerase nutzt stets einen bereits bestehenden DNA-Einzelstrang als Matrize (Vorlage) für die Synthese eines neuen, komplementären Stranges, dessen Nukleotid-Abfolge somit von der Matrize bestimmt wird“ [DNA-Polymerasen – Wikipedia]. Das Protein (Mensch) „DNA-Polymerase“=1133AS mit 1 Cofaktor-Bindestelle „[4Fe-4S]-Cluster“ besetzt die Randspalte der Z.Nrn.-Matrix 38=QS3+8=“11“ und summiert weitere 3 Randzahlen 38=QS=11 zu 11+11+11=“33“ für 1133AS, und zwar von Z.Nr.38219 bis Z.Nr.38222. Die Cofaktor-Bindungsstelle zieht sich über diese letzten 4 Zeilen des BiXnom-Claustrum-Portals in der Code-Serie #161“/#161“/#161“/#161“. Darin ist 4x Schwefel=16 ablesbar. Eisen=26 bildet doppelt die Spalten 16/1 und 1/61 als QS1+1=2_6 für Eisen=26 [DNA-Polymerase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Nukleosidtriphosphate (NTPs) sind Vorstufen-Bausteine der Nukleinsäuren. NTPs sind Nukleoside, die phosphoryliert sind. Nukleoside sind Nukleobasen, welche im Falle der DNA an Desoxyribose gekoppelt sind. Im Unterschied zur RNA-Polymerase werden folgende Nukleotide beteiligt, die neben der 38er- Randspalte liegen: Desoxyadenosintriphosphat (dATP)=C10H16N5O12P3=60+16+35+96+45=252E als „2“_QS1_1_1_2=“5“_“2“ für 252E; Desoxycytidintriphosphat (dCTP)= C9H16N3O13P3=54+16+21+104+45=240E als „2“_QS2+2=“4“_“0“ für 240E; Desoxyguanosintriphosphat (dGTP)=C10H16N5O13P3=60+16+35+104+45=260E als QS1+1=2_QS1+2_2+1=“6“_“0“ für 260E; Desoxythymidintriphosphat (dTTP)=C10H17N2O14P3=60+17+14+112+45=248E als 2_QS2_1_1=4_8 für 248E.
Das Protein (Mensch) „DNA-Polymerase_B7Z1W5“=181AS übernimmt Reparaturaufgaben, indem es neben der 38er-Spalte eine Beziehung zur Ziffer „8“ mit Schwerachse „84“ als „1“_[8]QS2+2=4/[8]2+2=4 mit Summe 4+4=“8“_“1“ für 181AS aufbaut [DNA polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-Polymerase_A8K860“=483AS enthält für Reparaturen bereits die gespiegelte Schwerachse und zieht mit dem Cofaktor „Mn^2+=25E“ bis in Z.38221 als 38=QS=2_QS2+2+1=5 für Mangan=25 vor, und zwar als 38=QS=2_2=“4“_ [38=QS=2_2=“4“_ 38=QS=2_2=“4“]=Summe 4+4=8_QS2+1=3 für 483AS [DNA polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-Polymerase_P06746 • DPOLB“=335AS trennt die 1 Mangan-Zählung in 2 Magnesium-Ionen auf, und zwar mit Z.38221 als 38=QS=11 zerlegt in „1“ und Rest „1“ ergibt 1_Rest „1_2“=Magnesium=12_21=gespiegelt Magnesium. Mit doppelt Mg=12 als QS1+2=3_QS1+2=3 für „33“ ergibt sich mit der linken Spalt-Randzahl „1“ und aus Z.Nr.“382“10 mit QS=4 die Summe=5 für 335AS [POLB - DNA-Polymerase beta - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Q9Y253 • POLH“=713AS kann den Cofaktor Mn=25 E wählen oder alternativ in 2x Mg=12E trennen, und zwar als QS1+2+2=5_[38=QS=]2=Summe „7“_38=QS3+8=11 spalten in 1+Rest 1 für „1“_QS Rest 1+2=“3“ für 713AS [POLH - DNA-Polymerase eta - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-Polymerase_ A6NMQ1“=1468AS besitzt eine Zinkfinger-Domäne. Hierzu wird an die Mangan-Zeile zur Spalte Z.38221/Z.38222 erweitert, und zwar absteigend als „22“_2_38=QS=2_ 38=QS=2_2 mit Summe 22+2+2+2+2=30=Zink. Das Protein zerlegt die Kette 1468AS mit Zink=30 in „14“_Randzahl=38+30=Zink“. Ab Spalte Z.38219/Z.38220 aufsteigend mit „1“_QS2+2=“4“ _“38“ folgt Zink=30 für 1468AS [POLA1 - DNA polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RNA-gerichtete DNA-Polymerase_O00363“=1275AS und ähnliche Proteine sind zur RNA zur Code-Seite gerichtet, indem sie zwar die Z.Nrn.-Matrix besetzen, sich aber am rechten Rand bewegen, um die Spaltzahl Z.38xxx zu vermeiden, dabei bleibt Ziffer „8“ verwendbar. Der rechte Rand wird komplett durchgezählt als QS8+2+2=“12“_QS1_20+19+18+17=“75“ für 1275AS [RNA-directed DNA polymerase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RNA-gerichtete DNA-Polymerase_ Q6PID2“=328AS zählt den rechten Rand als QS2+1=“3“_QS1+7=“8“_QS8+9+0+1+2=“20“ mit Summe 8+20=“28“ für 328AS [MGC4836 - RNA-gerichtete DNA-Polymerase - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein (Virus) „RNA-gerichtete DNA-Polymerase_Q89943_9HIV1“=219AS gehört nicht direkt zum Menschen, sondern zum Virus. Es ist als Zahl 219 in Z.38“219“ lesbar [POL - RNA-gerichtete DNA-Polymerase (Reverse Transkriptase) - Humanes Immundefizienz-Virus 1 | UniProtKB | UniProt]._dat2023.06.20
Im BiXnom-Claustrum-Portal enthalten die letzten 3 Zeilen die exakten Merkmale der „Polymerase-Kettenreaktion (polymerase chain reaction, PCR), jedoch ohne Vorgangsbeschreibung der Vervielfältigung (Replikation). Im Ergebnis entstehen zwei identische DNA-Moleküle, im Fall einiger Viren zwei RNA-Moleküle. Die Replikation findet, statt, weil die Evolution von ihr definierte Enzyme der Replikation funktionsgerecht vernetzt und koordiniert [Replisom]. Die „Polymerase-Kettenreaktion“ ist eine künstliche (in vitro) Vervielfältigung von Erbsubstanz (DNA), aufgrund der hohen Temperaturen ist es schwer vorstellbar, dass damit ein natürlicher Vorgang nachgebildet wird. Bei einer nur kurzzeitigen Einwirkung bildet sich die ursprüngliche Faltung wieder zurück. Proteine werden in Zellen teilweise vor einem Membrantransport durch Chaperone entfaltet und falten sich anschließend zurück. Die Basenpaarung von DNA wird durch verschiedene DNA-bindende Proteine abschnittsweise aufgehoben, zum Beispiel bei der Replikation oder der Transkription. Der Ort des Denaturierungsbeginns wird als Denaturierungsblase bezeichnet. Die Lebensdauer einer Denaturierungsblase beträgt zwischen einer Mikrosekunde und einer Millisekunde [Denaturierung (Biochemie) – Wikipedia]. Die Denaturierungsblase liegt in Z.38220 mit der Ziffer „Null“ als Blase und einer 3-zeiligen Spalte „0950/0527/0104“. Künstlich wird die Denaturierung mittels der enthaltenen Temperatur 95°C als „0950“ mit dem Bezug auf 100°C im Labor realisiert. Die chemische Denaturierung ist mittels Natriumlaurylsulfat (SDS)=C12H25NaO4S=72+25+11+32+16=156E möglich. Die Zahl „95°C“ wird über die Vorzeile äquivalent aufgenommen werden, und zwar in der Spalte „137/095“ mit der Zählgröße QS1+3+7=11=QS1+1=2. Die Ziffer „2“ wird in die folgende Denaturierungsblase „0(Null)“ geschoben und erzeugt mit „(2)95“ als Kette eine neue Spaltzahl=QS2+9=11=QS1+1_5 für Zahl „15“ mit Überschuss=1. Der Überschuss=1 wird in die folgende Blase „0(Null)“ geschoben und erzeugt mit (1)5[2] als QS1+5=6 Natriumlaurylsulfat (SDS)=156E. Das denaturierte Protein gewinnt bei Einwirkung von Beta-Cyclodextrin=C42H70O35=252+70+280=602E seine Aktivität teilweise wieder zurück, und zwar in Z.38221 mit der Spalte 095/0“5“2“/0“10“ als QS5+1=6_0_2 für 602E. Die Denaturierung mit Cetyltrimethylammonium bromide= C19H42BrN=114+42+35+7=198E wirkt sich auf die Proteinrettung günstiger aus [https://www.laborjournal.de/rubric/methoden/methoden/v93.php]. Hierbei werden die beiden Spaltzahl QS1+1 in der Spalte „095/052“ anderes verteilt, und zwar als (1)_9_5+(1)/[05]2 mit 19_QS5+1_2=“8“ für 198E. Für die natürliche Denaturierung werden Proteine benötigt, die durch diesen Pfad ziehen.
Die DNA liegt in der Z.Nrn.-Matrix und für den Zeit-Temperatur-Vorgang ist die Zeitbasis=60 zur Sekundenzählung in der Z.Nr. Z.38220=QS38+22+0=60 enthalten. Als Besonderheit bildet der Code die Quersumme=64=Kreis=Biologie und in der Folgezeile wird der Kopiervorgang beidseitig in Z.Nr. und Code jeweils mit „61_61“ inklusive Zählgröße=11 symbolisiert. Der Cofaktor Magnesium=12 wird in gespiegelter Form in Z.38221 als 21 gezählt. Wasser (H2O) „28“ ist ebenfalls gespiegelt mit „82“ vorhanden, so dass „8221“ eine Pufferlösung ergibt, um Magnesium-Ionen als Cofaktor zuzuführen. Bei der künstlichen Methode werden synthetisierte Nukleotidsequenzen (2 Primer-DNAs) – jeweils einen spezifischen für jeden Einzelstrang der DNA, erforderlich, um der „Polymerase“ den Kopieranfang zu signalisieren. Das Primer-Paar besitzt eine Länge von 18 bis 30 Nukleotiden und wird mit einer Schmelztemperatur passend zur „Annealing-Temperatur des PCR- oder Hybridisierungs-Prozesses“ nach Design bestellt [5°C bis max 20°C unterhalb der Temperatur des Elongationszyklus der verwendeten Polymerase]. Der Kettenlängen-Mittelwert der Nukleotide (18+30)/2=48/2=“24“ ist in Z.38220#0950_868_“24“34“ in Verbindung mit einem Doppelstrang als XYX=“868“ vorhanden. Die Temperatur von 95°C wird angezeigt „0950“. Die 95° werden bei der PCR–Methode anfangs eingestellt, um die Wasserstoffbrücken der Doppelhelix zu brechen. Durch Denaturierung werden 2 einzelne DNA-Stränge gewonnen. Die Temperatur wird dann abgesenkt und über ca. 30 Sekunden zur Anlagerung der Primer an DNA gehalten. Dafür ist die Randzahl „34“ Sek. geeignet [Primerhybridisierung (primer annealing)]. Das PCR-Verfahren benötigt weiterhin einzelne Nukleosidtriphosphat-Moleküle und eine hitzestabile Polymerase [üblicherweise aus Thermus aquaticus isoliert (Taq-Polymerase) [Polymerase-Kettenreaktion - DocCheck Flexikon]. Das Protein (Thermus aquaticus) „DNA-Polymerase I“=832AS steht in anderer Ziffernfolge (382) zur Verfügung und wird in der Spalte Z.38220/Z.38221 als 8_3_QS3+8=11=QS1+1=2 für 832AS gezählt werden. Zur DNA gehört im Code die Randspalte #„161“7 für 4x Eisen/Schwefel. Das künstlich verwendete Protein kann daher auch im Code zweizeilig als QS 7+1=8_QS16+16=32 für 832AS dargestellt werden [polA - DNA-Polymerase I, thermostabil - Thermus aquaticus | Veröffentlichungen | UniProtKB | UniProt]. Die DNA liegt in der Z.Nr.-Matrix und in der Code-Randspalte #161, so dass der Kopiervorgang der Art „XYX“ in Z.38220#161_ 0_868_2=Kopie_434 vertreten ist. Und, man staune: „2*434=868“ nach Adam Ries. In Z.38221 enthält die Spalte 70“527“7/7“0104“7 als weitere Informationen die Mitteltemperatur 52,7°C und den Kreis=64 als QS5_1=6_QS04=4 kombiniert mit der Zahl „10“ für den 10er BiXnom-Schwingkreis.
Die eukaryotische Replikation wird an den Replikationsursprüngen (Englisch: "origins of replication") initiiert, die vom „Origin recognition complex (ORC)“ erkannt und gebunden werden. Nur die von ORC erkannten Replikationsursprünge sind maßgeblich. Die Bindung erzeugt mit weiteren Proteinen (u.a. Helikase MCM) einen präreplikativen Komplex. Die Vervielfältigung wird mit der Form=7 als QS5+2=7_7777_QS5+1+1=7 dargestellt. Das Protein (Mensch)=“ Herkunftserkennungskomplex_Orc2“=577AS liegt in der Randspalte 82[4]“3“[4]/“75“11“[4] als QS3_1+1=5_Spalte 2/5=7_7 für 577AS. Die Spaltenzählung „2/5“ muss nicht als Folge lesbar sein, weil damit das Protein (Mensch) „ORC3“=711AS als 2+5=7_11 für 711AS stabilisiert wird. Die Ziffer „2“ liegt in der Schwerachse 84 mit 8“2“4 [ORC2 - Origin recognition complex subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt; ORC3 - Herkunftserkennungskomplex Untereinheit 3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „ORC1L“=861AS liegt ergänzend in der Spalte „8“24“3/[75]“1“[1] als 8_QS2+4=6 _1 für 861AS [ORC1L - Herkunftserkennungskomplex Untereinheit 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „ORC5“=435AS besetzt die Randspalte „34/14“ als 43_QS1+4=5 für 435AS [ORC5 - Origin recognition complex subunit 5 - Homo sapiens (Human) | UniProtKB | UniProt].
Weil kein Cofaktor erreichbar ist, müssen sich Proteine gegenseitig finden. Die Beladung der DNA mit dem MCM-Komplex ist ein entscheidender Schritt in der Initiation der Replikation [MCM-Komplex - DocCheck Flexikon]. Der MCM-Komplex [Minichromosome Maintenance (MCM)] ist ein hexamerer Enzymkomplex [6 Gene:MCM2, MCM3, MCM4, MCM5, MCM6, MCM7]. Die Gemeinsamkeit ist das aktive Zentrum der ATPase, das in einem Spalt mit 2 Untereinheiten liegt. Für ein Arginin-Finger-Motiv ist Arginin=C6H14N4O2=36+14+28+16=94E in der Randspalte „43“[4]/11[4] als QS1_4+3_1=9_4 für 94E verfügbar. Das Protein (Mensch) „Lizensierungsfaktor A8K521_MCM5“=743AS grenzt den Bereich ab Z.38220 mit der Randspalte „434/114/180“ als QS1_1+1+4=7_4_3 für 743AS, wobei ein Pfad zum Kreis „QS 1_1+1+3=6_4“ mit enthalten ist. Statt dreizeilig muss eine Änderung ahne Z38222 erst speziell als Komplex organisiert werden. Funktion: Ist für die Initiierung, Initiierung und Verlängerung der DNA-Replikation "einmal pro Zellzyklus" in eukaryotischen Zellen unerlässlich. Es wird „eine kritische Struktur eines konservierten Arginin-Fingermotivs in trans relativ zur ATP-Bindungsstelle der Walker-A-Box der benachbarten Untereinheit bereitgestellt“. Die „6“ aktiven ATPase-Zentren liegen im „MCM2-7-Ring [Lizenzierungsfaktor für die DNA-Replikation MCM5 - Homo sapiens (Mensch) | UniProtKB | UniProt]. ATP=260E zählt sich zusammen mit Protein (Mensch) „ATP-Synthase“ 553AS mit 5_QS4/1=5_3 für 553AS. ATP nimmt die komplette Randspalte „82434/5114“ auf. Zunächst wird aus QS3+4=7/4 die Spaltzahl QS=“2“ gebildet. Ziffer „6“ aus QS4+1+1=6 und Ziffer „0“ aus QS8+2=10 mit Ziffer „0“ für 260AS. Der enge Bereich enthält Zählvarianten mit der potenziellen Zählgröße 74=QS=11, die als „1+1“ spaltbar ist. Proteine können einen Komplex bilden, wenn 1 Protein die Restzahl „1“ =“Lizenzschlüssel“ produziert, die von Gruppenmitgliedern aufgrund eines Defizits existenziell notwendig aufgenommen werden muss.
Lizenzschlüssel-Überschuss Fall 1.) Protein (Mensch) „Lizensierungsfaktor A8K521_MCM5“=743AS erzeugt als Variante in der Spalte 24340/51140 eine Lizenzschlüssel als Überschüssel mit QS5+1+1=7_4_(3?), wobei die Ziffer 3 nicht gebildet werden kann, weil in der Randspalte 4/4 nur die Zahl 4 steht. Zusammen mit „434“ liegt die potenzielle Zählgröße 74=QS=2 vor. Mit der Spaltung 1+1 wird mit der Folgeziffer QS2+1 (Spaltzahl)= „3“ für 743AS gebildet und der überschüssige Schlüssel=“1“ kann vom Zahlen-Rand übernommen werden. Hierbei sind 6 Proteine beteiligt, wobei das Defizit „1“ vielfältig alle 3 Stellen betrifft.
Defizit-Fund Fall 2.) Das Protein (Mensch) „DNA-Helikase P49736_MCM2“=904AS entwickelt mit 2 Zahlenteilen [mit Teil 1 aus Spalte 24/51 und 3/1 mit QS24+51+31=89 und Teil 2=4] als 89_4 statt 904AS, was wegen der Blockzählung den erforderlichen Lizenz-Schlüssel=1 als Defizit=1 ergibt [MCM2 - Lizenzierungsfaktor für die DNA-Replikation MCM2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Defizit-Fund Fall 3.) Das Protein (Mensch) „DNA-Helikase P25205_MCM2“=808AS mit Spalte 2/5=QS2+5=7_QS4+3+1+1=9_ QS4+4=8 ergibt 79_8 statt 808, so dass ein Defizit „1“ für 808AS vorliegt [MCM3 - Lizenzierungsfaktor für die DNA-Replikation MCM3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Defizit-Fund Fall 4.) Protein (Mensch) „DNA-Helikase A0A3B3IRR8_MCM4“=191AS als 1_QS1+4_4=9 mit „19“AS hat 1 Lizenzdefizit=1 zum Anlagern für 191AS aus der folgenden Größe „434“ [MCM4 - DNA-Helikase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Defizit-Fund Fall 5.) Protein (Mensch) „DNA-Helikase Q14566_MCM6“=821AS enthält bereits die Zahl „82“ und zählt in Spalte 4/51 mit QS4_5+1=10 für Ziffer „0“ als 820 mit dem Defizit=1 für 821AS [MCM6 - Lizenzierungsfaktor für die DNA-Replikation MCM6 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Defizit-Fund Fall 6.) Protein (Mensch) „DNA-Helikase Q14566_MCM6“=719AS über Spalte „82/7“ mit 7_QS8+2=10 als „70“ und Spalte 43/11 als QS4+3+1+1=9 ergibt „709“ mit einem Defizit=1 für 719AS [MCM7 - Lizenzierungsfaktor für DNA-Replikation MCM7 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Defizit-Fund Fall 7.) Höhere Eukaryoten bildet sich außer dem „MCM2-7-Komplex“ noch eine Gruppe MCM8 /MCM9. Mit dem gleichen Prinzip wird das Defizit bei MCM8 durch MCM9 kompensiert. Das Protein (Mensch) „DNA-Helikase A0A0S2Z618¬_MCM8“=556AS als „5“_Spalte 4/1=“5“_QS1+4=“5“ mit „555“ und Lizenz-Defizit „1“ für 556AS [MCM8 - DNA-Helikase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Lizenzschlüssel-Überschuss Fall 8.) Das Protein (Mensch) „DNA-Helikase Q9NXL9 ¬_MCM9“=1143AS ist zwar in der Spalte 2„43“4/“11“ direkt lesbar, aufgrund der Spaltzahl „434“=QS4+3=7_4=QS=11=QS=2=1+1(Überschuss) wird aber ein Überschuss produziert weil die Zíffer „3“=QS 2+ Spaltzahl „1“ [+1=Überschuss]=“3“ entsteht für 1143AS [MCM9 - DNA-Helikase MCM9 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Die DNA-Helikase liegt mit der Energieversorung ATP am rechten Code-Rand, die DNA läuft in der Z.Nrn.-Matrix und einer Metallspalte am linken Code-Rand. Eine Verbindung könnte das Protein „Primase“ bilden, weil es die Replikation initiiert.
Das Protein (Mensch) „DNA-Primase_kleine Untereinheit_P49642 • PRI1“=420E liegt aufgrund der Cofaktoren „Mg/Mn“ eindeutig in der Spalte Z.38220/Z.38221 als QS2+2=4_20 für 429AS, wobei das benachbarte Zink-Ion als QS8+2=10_20 mit Summe 10+20=30=Zink enthalten ist [PRIM1 - DNA primase small subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-Primase/Polymerase_Q96LW4 • PRIPO“=560E liegt aufgund der Cofaktoren „Mg/Mn“ ebenfalls der Spalte „Z.38220/Z.38221“ mit QS2+2+1=5_38=QS=2_2_2=6_0 für 560AS. Erforderlich, um das Fortschreiten der mitochondrialen und nukleären Replikationsgabel zu erleichtern. [PRIMPOL - DNA-gerichtetes Primase/Polymerase-Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das „Endzeit“-Medikament „Cisplatin“=[Pt(NH3)2Cl2]=78(7+3)+2(34)]=780+68=848E enthält „1“ Platinatom und hemmt als Zytostatikum das Zellwachstum aufgrund einer Hemmung der DNA-Replikation. Es werden 2 benachbarte Guanin-Basen verbunden, so dass die Zelle abstirbt (Apoptose). Wegen Motivs „X_Y_X“=848E wird die DNA und die Schwerachse=84 adressiert. Guanin= C5H5N5O=30+5+35+8=78 ist im Code gespiegelt und doppelt als Spalte 8/7_8/7 vorhanden, die mit der Ziffer 7“7“7 vereinigt wird und in Z.38222 in der Spalte 7/7“0“8 als Guanin=7[0]8 gekoppelt lesbar ist.
Das Protein „ATR_Ataxia telangiectasia and Rad3 related“ ist eine Proteinkinase, die an der Messung von DNA-Schäden und an DNA-Reparatur beteiligt ist. Das Protein (Mensch)=“ATR serine/threonine kinase_Q13535“=2644AS dient als DNA-Schadenssensor. Hierzu wird der linke Code-Rand besetzt, der zur DNA-Metallspalte [Fe/S] „#161“. Ein 2. ATR-Protein=115AS kann daran anschließen, um die Reparatur auszuführen. Zeile Z.38221 mit Spalte „1“[6]“17“[05]/“1“6“17“010“ mit Spalte #1/#1 als QS1+1=“2“_“6“_Summe [QS17+17=34]+[QS0+10=10]=“44“ für 2644AS [ATR - Serine/threonine-protein kinase ATR - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=“ATR serine/threonine kinase_D6RIG7“=115AS sorgt offensichtlich dafür, dass der Körper mit der Wirbelzählung=115 komplett auf DNA-Fehler überprüft wird. In der inaktiven Position parkt das Protein=115AS in die Zählung für Protein=2644AS ein, um die Zählweise einzuüben, als 1_QS7+7=14_01=QS=15 für 115AS. Für Reparaturaufgaben muss das Protein nach rechts zur nächsten 7/7-Spalte ausparken und eine Spaltzahl [1+1] bilden, und zwar über Spalten 7/4=QS=74=QS=11 zerlegt „1+1“ sowie Spalte „7/7“=QS=14 für 1_14+1=115AS. Die medikamentöse Guanin-Kopplung wird beseitigt, sofern der Patient das noch erlebt [ATR - ATR serine/threonine kinase - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein „DNA-Topoisomerase_H7C4B0_TOP3B“=168AS spaltet vorübergehend während der DNA-Replikation und -Transkription einen Strang des DNA-Duplex und fügt diesen wieder zusammen. Der Spaltphosphodiester wird durch das katalytische Tyrosin= C9H11NO3=54+11+7+24=96E des Enzyms angegriffen. Zu diesem Zweck wird das Tyrosin in der Z.Nrn.-Matrix ab Z.38219 doppelt durchgezählt, wobei in der 1. Zählung eine 0(Null) für den Bruch vorliegt. Tyrosin-Bruch=9_QS“0“_2+2+38 [als QS=2]=6 für Tyrosin=96E; Tyrosin-Bindung (ohne Null)=38 [als QS=2] +2+2+1_2=9_QS2+2+38 [als QS=2]=6 für 96E. Das Protein=168AS bildet in der Z-Nr. 38219 die Zahl „68“ und ebenfalls in der Code-DNA-Metallspalte [#161] von Z.38219-Z.38222 als QS16+16+16+16=“64“_QS1+1+1+1=“4“ mit Summe=64+4=68. In Z.38220 wird aus 38=QS=11 gespalten „1+1(Rest)“ für 168AS gewonnen, die Restzahl „1“ wird vom Code für 168AS übernommen [TOP3B - DNA-Topoisomerase - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „DNA-Topoisomerase I_B4DYD2“=503AS ist ebenfalls an der vorübergehenden Spaltung des DNA-Duplex beteiligt. Der freie DNA-Strang durchläuft dann eine Passage um den ungebrochenen Strang und entfernt so DNA-Supercoils. Schließlich greift die DNA 5'-OH im Religationsschritt das kovalente Zwischenprodukt an, um das Tyrosin des aktiven Zentrums auszustoßen und das DNA-Phosphodiester-Rückgrat wiederherzustellen. In der Spalte Z.38219/Z.38220 mit [38=QS=]2_[38=QS=]2_2_1=“5“ wird in der Randspalte 9/20 eine potenzielle Zählgröße QS9+0+2=11 gespalten in „10+1 (Rest)“. Die Zahl „10“ wird gespalten in „1+0“ für Ziffer „0“ und QS1+2=3 für 503AS. Der Rest=“1“ muss im Code verwertet werden: In Z.3819 mit QS Codeübertrag=1_1=“2“_QS16+16+16=“48“ als Summe 2+48=“50“_QS1+1+1=“3“ für 503AS, wobei die Wicklung 4x 16=64AS=Kreiswicklung im Durchlauf entfernt wird [DNA-Topoisomerase I - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-Topoisomerase 2-alpha_P11388“=1531AS verändert die DNA-Topologie, indem es an zwei doppelsträngige DNA-Moleküle bindet, einen doppelsträngigen Bruch in einem der Stränge erzeugt, den intakten Strang durch den gebrochenen Strang führt und den gebrochenen Strang religiert. Kann eine Rolle bei der Regulierung der Periodenlänge der BMAL1-Transkriptionsoszillation spielen. Das Protein besteht in der Basis von Z.38219-Z.38220 aus der Code-Zahl „53“ aus 1_QS16+16+16=48_QS1+1+1+1=53. In der Z.Nrn.-Matrix wird an jedem Ende der Zählung 1531AS jeweils ein Überschuss produziert, der im Code mit „1“_53_“1“ für 1531AS angelagert wird. In der Spalte Z.3821“9“/Z,382“20“ entsteht die 1. Spaltzahl aus QS9+0+2=11, zerlegt „1“+1 (1. Rest). Mit 38=QS=11=QS=2_2_1=“5“. Randziffer „3“ aus Z.“3“8220. 2. Spaltzahl aus 38=QS=11 zerlegt „1“+1 (2. Rest) für 1531AS und Übertrag von 2 Resten in den Code [TOP2A - DNA-Topoisomerase 2-alpha - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „Protein timeless homolog_Q9UNS1 • TIM“=1208AS spielt eine wichtige Rolle bei der Kontrolle der DNA-Replikation, der Aufrechterhaltung der Stabilität der Replikationsgabel, der Aufrechterhaltung der Genomstabilität während der normalen DNA-Replikation, der DNA-Reparatur und bei der Regulierung der circadianen Uhr. Beteiligt am Überleben von Zellen nach DNA-Schäden oder Replikationsstress durch Förderung der DNA-Reparatur. Als Reaktion auf Doppelstrangbrüche (DSBs) akkumuliert es an DNA-Schadensstellen und fördert die homologiste Rekombinationsreparatur durch seine Interaktion mit PARP1. Negativ reguliert CLOCK|NPAS2-ARTNL/BMAL1|ARTNL2/BMAL2-induzierte Transaktivierung von PER1 möglicherweise über Translokation von PER1 in den Zellkern. Die Z.Nr. Z.38220 enthält den 24-Stunden-Rhythmus als 38=QS=“2“_QS2+2+0=“4“ für 24 Stunden. Das Protein liegt inaktiver Position in der Z.Nrn.-Matrix als „1“_QS0+2=“2“_QS8+2=10 für Ziffer „0“_“8“ für 1208AS. In der Codespalte [95]“08“/[52}“7“[7]/“10“4“[7] als „1“_über Spalte 7/4=74=QS=“2“_“08“ für 1208AS [TIMELESS - Protein zeitloses Homolog - Homo sapiens (Mensch) | UniProtKB | UniProt]. In Z.38222 schließt das Protein (Mensch)=“Poly [ADP-ribose] polymerase 1 (PARP1)“=1014AS direkt seitlich an, als „1“_“0¬“_QS7+1+6=“14“ für 1014AS [PARP1 - Poly [ADP-ribose] polymerase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Basisches Helix-Loop-Helix-ARNT-ähnliches Protein 1 (BMAL1)“=626AS ist ein transkriptioneller Aktivator, der eine Kernkomponente der circadianen Uhr für den 24-Stunden-Rhythmus bildet. Es sind zwei Hauptkomponenten: 1.) zentrale Uhr, die sich im suprachiasmatischen Kern (SCN) des Gehirns befindet, und 2.) peripheren Uhren, in fast jedem Gewebe- und Organsystem. Das CLOCK-BMAL1-Heterodimer reguliert die zirkadiane Expression diverser Proteine. BMAL1=626AS liegt in Z.38220, die im Code die Zeitbasis=24 in der Randspalte 2434/5114 enthält. Mit QS2+4=“6“_QS1+1=“2“_QS4+[Summe 4+3=7 für QS4+7=11=QS=]2 =“6“ für 626AS. Die enthaltene Zählgröße „11“ kann auch die Zeitbasis 60= Sekundenzählung mit „2434/11“ als QS24+34=58_QS1+1=2 mit Summe 58+2=60 erzeugen [BMAL1 - Basisches Helix-Loop-Helix-ARNT-ähnliches Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „CLOCK_variant_Q53EU0“=846AS liegt in der Spalte „2434/5114“ als QS4+1_3=8_4_QS5+1=6 für 846AS [Clock variant - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CLOCK interacting pacemaker“ liegt in der Spalte 24/51 und beseitigt die Zeitbasis=24 als 1_5_QS2+4=6 für 156AS [CIPC - CLOCK interacting pacemaker - Homo sapiens (Human) | UniProtKB | UniProt].
Das „BiXnom-Claustrum-Portal“ enthält erst in der letzten Zeile Z.38222 mit „Flavin-Adenin-Dinukleotid (FAD)=C27H33N9O15P2=162+33+63+120+30=408E [Flavin-Adenin-Dinukleotid – Wikipedia] wieder einen Cofaktor. Das Coenzym ist am Protein (Mensch) „Apoptosis-inducing factor 1“=613AS beteiligt [AIFM1 - Apoptosis-inducing factor 1, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Der Mensch synthetisiert FAD aus Riboflavin=C17H20O6N4=102+20+48+28=198E. Riboflavin ist gespiegelt als „891“ lesbar, so dass die Ziffer „8“ aus FAD=408E enthalten ist. Die Spalte „2“[777751]/“04708“91 enthält FAD als 2_ 47=QS4+7=QS=11=2 mit Summe 2+2=4_08 für 408E. Das „Protein (Mensch) „Apoptosis-inducing factor 1“=613AS dient als „Protein-Friedhof“, indem die Replikation in Zeile Z.38221 erwartungsgemäß aufgesammelt als „05277775114“, und zwar als QS0+5+2+7+7=21_QS 77+511+4=592 mit Summe 21+592=613AS._dat2023.06.25
Kernhülle: Damit Proteine die schützende Kernhülle überhaupt durch die Kernporen passieren können, sind für die poröse Membran des Zellkerns Kernporen-Proteine (NUP) erforderlich. Innerer Ring „Nukleärer Ring und Korb“: Auf der Innenseite der Doppelmembran liegen die Kernporen-Proteine NUP153, NUP50 und TPR [Nukleoporin - DocCheck Flexikon]: Das Protein (Mensch) „NUP153“=1475AS verwendet in der Zeile Z.38218#_“30“[2] den lesbaren Cofaktor Zink^2+=30E. Es muss dann aber noch die Zahl 4*30=120 für 4 Zinkionen ergänzend gezählt werden. „NUP153“ sitzt zusammen mit NUP50 und TPR in der Kernpore, um einen Innenring-Komplex aus nukleärem Ring und Korb zu bilden. Hierzu werden der Ring 64 oder O und die Faser 111 benötigt. Das Protein „NUP153“ liegt ab Z.38218 in der Spalte „16“13“[02]/[8]111[58]/“82“[434]/„75“[114] als QS1+6=7_QS1+3[0]_1+1+1=7 für Summe 7+7=“14“_QS8+2=10 für Ziffer „0“ als Ring in QS0+75=75 für 1475AS. Es können sich 4 Zinkionen als Cofaktor ansammeln, weil die Spalten-Summe 30+15+43+11=99+Randspalte QS 2+8+4+4=18 sowie ersatzweise für die Faserzahl 111 die Spalte 1/11 mit QS1_1+1=3 als Summe 99+18+3=120 für 4 Zinkionen*30E=120 summiert wird. Das Protein (Mensch) „Nucleoprotein TPR“ =2363AS beginnt in der Zeile Z.38221#_11[4] absteigend als QS1+1=2_3_QS5+1=6_3 mit der Ziffer „3“ im Zink(ohne Zinkbindung) für 2363AS [TPR - Nucleoprotein TPR - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Nukleoproteid NUP50“=468AS beginnt in der Zeile Z.38221#_“11“4“ absteigend als 4_QS1+1_4=6_QS3+5=8 für 468AS und endet neben der Faser 111 [NUP50 - Nuclear pore complex protein Nup50 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein NUP50 ist maßgeblich am Neuaufbau der Kernhülle nach deren Abbau bei der Mitose beteiligt. Daher wird nochmals alternativ für eine Gegenrichtung gezählt. Um ebenfalls eine Zählgröße „11“ zu durchlaufend, wird „8_11“ als 8_QS1+1=2 (Aufbau) mit Summe 8+2=1“0“ für Ziffer „0“ gedehnt eingebaut, und zwar ab Z.38218 in der Spalte [6“]13[02]/“11“[15(8)]/“8“24“3“[(4)]/[751]“14“ als QS3+1_QS1+1_8=10 für Ziffer „0“ mit Summe 3+1+0=“4“_QS2+4=“6“_QS3_1+4=“8“ für 468AS. Wenn der 10-fach geteilte BiXnom-Schwingkreis 1 Runde „0/10“ durchgelaufen ist, wird bei 10 mit „0“ weiter gezählt. Aufsteigend gezählt, ist es aber keine verständliche Importrichtung, oder? Es existiert ein Nup50-Fragment von 48 Aminosäuren. Diese 48AS stehen am rechten Zahlenrand für den Import absteigend in der Randspalte 84(4) in Folge der Protein-Zählung lesbar. „In dieser Arbeit habe ich gezeigt, dass ein Nup50-Fragment von 48 Aminosäuren dafür verantwortlich ist, dass dieses Protein an Kernporen lokalisiert.“ [Was lokalisiert das Nukleoporin NUP50 an die Kernpore? (uni-tuebingen.de); C. Gamminger (Diss. 2019); http://dx.doi.org/10.15496/publikation-15434].
Zentralkanal: Eine Vielzahl von Proteinen bilden einen Zentralkanal, der aus einem 3D-Netzwerk mit Wiederholungen von Phenylalanin(F)=C9H11NO2=54+11+7+16=88E und Glycin (G)=C2H5NO2=12+5+7+16=40E besteht. Diese "FG-Repeats" sind dem Inneren der Pore zugewandt und ragen in den Kanal als Filter hinein. Große Moleküle werden an Karyopherine (Transportrezeptoren) gebunden, um mittels Interaktion mit den "FG-Repeats durchgeschleust zu werden. Glycin ist als Serie Z.382xx mit QS38+2=40 immer vorhanden. Phenylalanin=88E zieht sich in der Z.Nrn.-Matrix über eine Strecke bis zur Schlusszeile als QS (Pore=)0_2+2_38=QS=2_38=QS=2 mit Summe=“8“_ 38=QS=2_2+2+2=8 für 88E. Über 3 Zeilen kann die Kernmembran „33“ mit 38=QS=11 als 11+11+11=33 erfasst werden. Im Code ist der Zentralkanal über 3 Zeilen als Null-Serie 16_17_“0“ sichtbar. Ab Z.38219, mit der Kanalspalte „713/0/0/0“, ist die Anzahl der Kernporen je Zellkern zählbar, und zwar als 7_QS1+3=4 mit 74=QS=11=QS=2_0_0_0 für 2000 Poren. Zeile Z.38219 enthält den Zentralkanal auch mit der Spalte 981/868[24], in der Phenylalanin (F)=88E die Ziffer „6“ [nützlich für 6 Ziffern] dreiseitig einklemmt, und sich die Spaltensumme QS9+8+1=18 + QS8+6+8=22 als Summe 18+22=Glycin(G)=40= Innendurchmesser 40nm ergibt. Durch Addition der angelagerten Zeitbasis=24 entsteht der Zentralkanal als Kreis=40+24=64 mit der geklammerte Ziffer „6“=flexibel für die zeitabhängige Durchmesser-Veränderung. Das Protein (Mensch) „Kernporenkomplex-Protein NUP214“=2090AS ist für die Formgebung des Zentralkanals offensichtlich zuständig, weil es diesen innenseitig durch eine Kreiszählung von Z.38220 mit Wende über die Schlusszeile Z.38222 und zurück zur Zeile Z.38219 auskleidet und zwar in der Spalte [71]“37“/7(0)9[5]/“7“0“5“[2]/ [7]“01“[0] als QS Form=7_7=14_QS0_0+1_5=6 mit Summe 14+6=“20“_“9“_QS3+7=10 mit Ziffer „0“ für 2090AS. Funktion: „Kann als Andockstelle für den Rezeptor-vermittelten Import von Substraten über den Kernporenkomplex dienen“[NUP214 - Kernporenkomplex-Protein Nup214 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch)=„Karyophherin-Untereinheit beta 1 (KPNB1)=60AS beschreibt den Zentralkanal als Addition von linker Seite [4 Zeilen mit QS1+7=8 mit Summe 4*8=32] und rechter Seite [Spalte 13/9/5/11=23] mit der Summe 32+28=60AS [KPNB1 - Karyophherin-Untereinheit beta 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die β-Untereinheit vermittelt den Kontakt des trimeren Komplexes aus α,β-Importin und Protein an die Kernpore [Kerntransport von Proteinen - Lexikon der Biologie (spektrum.de)]. Am eigentlichen Transport ist das Protein (Mensch)=RAN (ras-related nuclear protein)=216AS beteiligt. „RAN“=216AS nimmt in der Schlusszeile die 10er-Sequenz als Signal auf und durchläuft den Zentralkanal, und zwar als 47=QS11=QS=“2“_QS0+1=“1“_QS5_0_0_1=“6“ für 216AS. Die Null der 10er-Sequenz zählt als 3. Spaltennull, weil die Null in der Endzeile der Energieversorgung durch Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E dient, und zwar in der Spalte „[170]“5“2“/170“1“[0]“ als 2_QS5+1=6_QS0+7+1=8 für 268E. Das Protein (Mensch)=„Importin-Untereinheit alpha-1 (KPNA2)“=529AS „fungiert beim Kernproteinimport als Adapterprotein für den Kernrezeptor KPNB1. Bindet spezifisch und direkt an Substrate, die entweder ein einfaches oder ein zweiteiliges NLS-Motiv enthalten. Das Andocken des Importin/Substrat-Komplexes an den Kernporenkomplex (NPC) wird durch KPNB1 durch Bindung an Nukleoporin-FxFG-Wiederholungen vermittelt und der Komplex wird anschließend durch einen energieabhängigen, Ran-abhängigen Mechanismus durch die Pore transloziert“. Das Protein „KPNA2“=529AS liegt in der Spalte [0]“5“2“7“[77]/[010]“47“[0] als 5_2_QS7_47=QS11=QS=2 für 529AS [KPNA2 - Importin-Untereinheit alpha-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „KPNA4“=521AS nimmt die 10er-AS-Sequenz auf als 5_2_QS0+1=1 für 521AS [KPNA4 - Importin-Untereinheit alpha-3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch)=„KPNA5“=539AS nimmt die 10er-AS-Sequenz auf und durchläuft dann seitlich den Zentralkanal, und zwar als „5“_QS2_0_1=“3“_[QS0+7=7_QS1_1_1_1=4 für 47=QS=11=QS=“2“] mit Summe 2_7+0=“9“ für 539AS [KPNA5 - Importin-Untereinheit alpha-6 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Beim Protein „KPNA5“=539AS werden ARM-Wiederholungen und STAT1/STAT2 erwähnt. Das Protein (Mensch) „ARMC3“=872AS zieht durch den Zentralkanal und nimmt die 10er-AS-Sequenz auf, ab Z.38219 als QS#1+6+1=8_7_QS1_0_0_0_1+0=2 für 872AS. Hierdurch orientiert sich STAT1 nach links in der Kanalwand [ARMC3 - Armadillo repeat-containing protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „STAT1_Signalwandler und Aktivator der Transkription_A0A669KB52“=636AS bewegt sich am Zeilenrand #161 als „6“_QS1_1_1=“3“_“6“ für 636AS [STAT1 - Signal transducer and activator of transcription - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „STAT1_ Signalwandler und Aktivator der Transkription_A0A669KBA4“=779AS zählt die Kanalwand „17“ über 4 Zeilen als QS17+17+17+17=68_QS7+1_1=9 für Summe 77¬_QS0_9=9 für 779AS. Das Protein (Mensch) „STAT2_P52630“=851AS nimmt die 10er AS-Sequenz als Blockzahl 10 in der Spalte „1“705“[2]/[170]“10“ auf, und zwar in der Summe 10 + Block 7(0=Kanal)5 mit 75=“85“_“1“ für 851AS [STAT2 - Signal transducer and activator of transcription 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „STAT2_ B4DLC8“=460AS nimmt die 10er AS-Sequenz in der Spalte „0“5“/[0]“10“4“ auf als „4“_QS0+1_5=“6“_“0“ für 460AS [STAT2 - Signal transducer and activator of transcription 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Äußerer Ring „Zytoplasmatischer Ring und Filamente“: Auf der Außenseite der Doppelmembran liegen die Kernporen-Proteine NUP358, NUP214 und NUP88 [Nukleoporin - DocCheck Flexikon]: Das Protein „NUP214“ wurde zuvor bereits als maßgeblich für den Zentralkanal festgestellt. Der Zentralkanal erreicht die letzte Zeile des BiXnom-Claustrum-Portals, die die Maße des Porenkanals enthält: Der Transport von Ribonucleoproteinen erfolgt durch einen regulierten Kanal im Querschnitt von 26nm, zweizeilig über die linke Coderandspalte #16170/#16170 als QS1_1=2_6 für 26nm (wie Eisenspalte der DNA mit Fe=26E). Neben dem Zentralkanal liegen weiterhin 8 kleine wassergefüllte Kanäle im Querschnitt von 9nm mit QS1_1=2+7=9nm für die mit QS1_1+6=8 Kanäle sowie die Wasserfüllung H2O=QS1_1=2_QS6+1_1=8 für Wasser=28 [Kernporenkomplex - Lexikon der Biologie (spektrum.de)]. Die Porenhöhe ist mit 70nm enthalten. In der letzten Zeile wird die Porenhöhe 70nm nochmals mit der Spiegelung der Randzahl 80 als Form=7_08_80 kombiniert, um den mittleren Durchmesser=80nm als Strecke darzustellen [Kernporen Dr.Jastrows EM-Atlas (drjastrow.de)]. Der maximale Kernporendurchmesser=120nm kann über die Z.Nrn.-Matrix als QS38+38+38_2+2+2=114+6=120nm gezählt werden. Mit „104“ wird ein Poren-Innendurchmesser 4*10=40nm avisiert, der sich in der Spalte [05]27777/[0]10[4] als QS2+7+7+7+7=30/10 für Summe 30+10=40nm zählt. “0470“=QS=11=QS=2=paarig zeigt ein beidseitiges Loch in der Doppelmembran an. Weil es sich um die letzte Zeile handelt, kann im Prinzip nichts in den Zellkern importiert werden. Hierfür müssen die Importproteine bestimmte Merkmale (Kernlokalisationssignal) enthalten. Beispielsweise wird die Zahl „10“ als eine wiederholte Anzahl von Aminosäuren in einer Sequenz in die Kette eingebaut. Weiterhin werden Lysin=80E und Arginin=94E adressiert. Die enthaltene Zahl „0470“ enthält nur 50% von Arginin 94/2=47. Mit Einbeziehung der 10er-AS-Sequenz ergibt sich absteigend zur Vorzeile über die Spalte 0“52“77“/0“1“0[47] Arginin als 0“1“0_QS0+5+2=7 für 17 in der Summe 17+77=Arginin=94. Lysin=80E ergibt sich als QS70+10=80E. In der Vorzeile liegt mit „27777“ der Cofakor Zink=30 vor. Zuzüglich „10“ sind das ebenfalls nur 50% von Lysin, so dass 100% bei einer Zusammenarbeit entstehen. Die Ringform der Pore ist bereits in Z.38220 mit der Zeilen-Quersumme=1+6+1+7+0+9+5+0+8+6+8+2+4+3+4=64=BiXnom-Kreis bestimmt. In der Schlusszeile sind direkt keine weiteren Ringmerkmale ablesbar. Der Poren-Kreis kann aber ohne die transportierte 10er-AS-Sequenz als Summe 17_[0=Kanal_10]_47=17+[0+10]+47=64=Kreis gezählt werden. Die Kernpore „0“ ist mit einem dünnen Häutchen (Diaphragma pori) verschlossen. In Z.3822“0“ ist mit 38=QS=11+22=33 eine Membran auf der Pore „0“ vorhanden. Die mittlere Zeile der 3 Porenzeilen Z.38221#16170_777 enthält die Zahl „777“=QS77+7=Schwerachse=84, so dass damit der zentrale Stopfen (plug / Zentralgranulum) im Porenmittelpunkt sitzt.
Der äußerer Ring enthält das Protein (Mensch) „Nucleoprotein NUP88_Q99567“=741AS liegt in der Spalte [052]“7“[77]/[0]10“4“[70] als 7_4_QS0+1=1 für 741AS [NUP88 - Nuclear pore complex protein Nup88 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „Nucleoprotein NUP88_J3KMX1“ =757AS in der Spalte „70“[52]“7“/[7]“0104“ als 7_QS0_0+1+0+4=5_7 für 757AS [NUP88 - Nucleoporin 88 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Nucleoprotein NUP88_A0A8V8TQD5“=646AS liegt in der Spalte „[0]“5“27777“51“1“[4]“/[0]“1“[047089]“18“[0]“ zerlegt als QS1+5=“6“_Summe=30 (aus 2+7+7+7+7=30)_QS5+1=6_QS1_8+1=10 mit 30+6+10=46 für 646AS [NUP88 - Nukleoporin 88 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Nucleoprotein NUP214_ H0YDH2“=145AS entsteht aus QS7+7=14_5 für 145AS [NUP214 - Nukleoporin 214 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Damit wird anderen Proteinen der Weg zur Zahl „20“ in der Randspalte Z.38221#_775114/180 eröffnet, um bei der Bildung der Zahl 20 als QS1+1=2_QS18+“0“=18 die letzte Randziffer „0“ mitzunehmen für Summe=2+18=20. Das Protein (Mensch) „Nucleoprotein NUP214_A0A494C104“=203AS folgt der Zahl „20“ und ergänzt Ziffer „3“ absteigend in 4“3“4 für 203AS [NUP214 - Nucleoporin 214 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Nucleoprotein NUP214_P35658“=2090AS folgt der Zahl „20“, ergänzt Ziffer „3“ in 4“3“4 und verlängert als QS“3“+4_1+1=9 _QS8+2=10 mit Ziffer „0“ für 2090AS [NUP214 - Nuclear pore complex protein Nup214 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Nucleoprotein RANBP2 (NUP358)_P49792“=3224AS folgt der Zahl „20“ und fügt seitlich die Zahl „75“ als QS7+5=12 mit der Summe 20+12=Zahl „32“ an. Es folgt QS2+7+7+7=23, so dass die Ziffer „1“ über Spalte 2/10 mit QS0+1=1 für Summe=23+1=24 erzeugt wird, insgesamt mit 3224AS. Weil die Strecke QS2+7+7+7+7=30 passiert wird, gehört Zink=30E als Ligand zum Protein [RANBP2 - E3 SUMO-protein ligase RanBP2 - Homo sapiens (Human) | UniProtKB | UniProt]. NUP358=3224AS schleust die mRNA aus dem Zellkern. Weil die letzte Zeile keine Fortsetzung bildet, wird von der rechten Pore quer zur linken Pore symbolisch transportiert. Das Protein (Mensch) „NUP93“ kann dadurch mitwirken, dass mehrere Proteine sich nunmehr vertikal zur letzten Zeile durchziehen. Das Protein (Mensch)=“NUP93¬¬_Q8N1F7“=819AS ist in der Randzahl 08“918“0 lesbar, und verbreitert den Kanal [NUP93 - Kernporenkomplex-Protein Nup93 - Homo sapiens (Mensch) | Weblinks | UniProtKB | UniProt]. Das Protein (Mensch) =“NUP93¬¬_H3BMX0“=125AS zieht von Z.38219 eine Transport-Spalte 1/2/5/[9] [NUP93 - Kernporenkomplex-Protein Nup93 - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Weitere NUP-Proteine mit 229AS, 16AS und 132AS verlaufen ähnlich.
Das Protein (Mensch) „Exportin1_XPO1_O14980“=1071AS nimmt in Z.38217 das Exportsignal „Leucin=C6H13NO2=36+13+7+16=72E“ in „72“[2] auf und folgt dieser Spalte über alle 6 Zeilen bis zur Ziffer „1“ in [70]“1“, und zwar als QS7+2_1=“10“_[7_QS3+1=4 für 74=QS=11] mit 11=QS=2_0_0_5=“7“_“1“ für 1071AS [XPO1 - Exportin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Exportin1_ XPO1_A0A7I2V2H0“=979AS zählt ab Z.38217 in der Spalte „71/71“ mit 7_QS1_1=2 für Leucin=72E und Summe 7+2=“9“_QS0+7=“7“_QS7+1=8_1 mit Summe 8+1=9 für 979AS [XPO1 - Exportin 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Exportin2_CSE1L“=971AS zählt ähnlich als 7_QS1_1=2 für Summe 7+2=“9“_QS0+0+0+7=“7“_“1“ für 971AS [CSE1L - Exportin-2 - Homo sapiens (Human) | External links | UniProtKB | UniProt]. Das Protein (Mensch) „ExportinT_XPOT“=962AS zählt ähnlich und durchläuft in Z.38222 den breiten Ausgang „10470“ als 7_QS1_1=2 für Summe 7+2=“9“_QS0+0+5_1=“6“ _47=QS=11=QS=“2“ für 962AS [XPOT - Exportin-T - Homo sapiens (Mensch) | Geschichte | UniProtKB | UniProt]. Das Protein (Mensch) „Exportin4_ XPO4_ Q9C0E2“=1151AS durchläuft in der Spalte „1_1“ als „11“_QS0_0_5=“5“_“1“ für 1151AS [XPO4 - Exportin-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Exportin4_ XPO4_Q0VG75“=1124AS durchläuft in der Spalte „1_1“ als „11“_QS0_0_5=7“_Zahl 17 als Block mit 7+17=“24“ für 1124AS [XPO4 - Exportin 4 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Zellkernhülle: Die doppelschichtige Membran trennt das Kernplasma vom Zytoplasma. Außerhalb der 2000 Poren liegen Kernhüllen-Proteine in der Z._Nrn.-Matrix, in der sich die Membran „33“ aus der Randspalte Z.38xxx=QS3+8=11 zählen lässt. Speziell kann nach einer Mutation „c.T38>G“ gesucht werden, bei der 1 Leucin=72E gegen 1 Arginin=94 ausgetauscht wird. Das Protein (Mensch) „LEMD2 - LEM-Domänen-enthaltendes Protein 2“=503AS liegt in der Spalte Z.3821x/Z.3821x/Z3821x und muss die Zahl 50 aus Summe 38+12=50 erzeugen. Vorhanden ist statt „12“ nur die Spiegelung „21“. In der Z.Nr.38219 wird die Zahl 38 aufgenommen und in der Z.Nr.38218 wird die Zahl 38 gespalten als QS3+8=11, zerlegt 1+1(Rest). Aus „382“ kann nunmehr die Zahl „12“ gebildet werden: Summe 38+12=50 mit dem Rest=1. Die Spalte Z.38217/Z.3818 enthält Leucin mit 7_QS1_1=2 für 72E. Mit dem Rest=1_1_1=3 entsteht 50_3 für 503AS. Die Mutation erhöht die Randzahl „18“ als „Rest=1+1_8“ zerlegt als 10 für Ziffer „0“ und kommt dadurch in die Ausgangszeile, um über 0_2+1=3 Ziffer „3“ für 503AS zu erzeugen. Die Z.Nr.38219 enthält 9_QS2+1_(38=QS=)2=“5“ für Arginin=95E. Die Mutation verursacht verheerende genetische Erkrankungen (Envelopathien), die zumeist Herz und Skelettmuskulatur betreffen [LEMD2 - LEM-Domänen-enthaltendes Protein 2 - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Die Erkrankung „Emery-Dreifuss-Muskeldystrophie“ ist auf Mutationen der Proteine „Emerin und Lamin A/C“ zurückzuführen. Mutationen können von Proteinen angelockt werden, die das kleine Molekül „Ubiquitin=76AS“ ausschütten, und zwar zweizeilig in der Spalte Z.[382]“1“7“/ Z.“38“21“[8]“ als „7“_QS1_1+2+[38=QS=]2=“6“ für Ubiquitin=76AS. Statt der 38=QS=2 kann Ubiquitin in der Zeile Z.38“2“19 mit der Ziffer „2“ als Bindestelle locken. Das Protein (Mensch) „Emerin“=215AS liegt in der Spalte Z.38220/Z.38221 als 38=QS=“2“_38 über QS=11 gespalten 1+1(Rest). Mit „2“_“1“_QS Rest 1 +2+2*+0=5 für 215AS. Die Mutation entsteht, wenn statt der Randziffer „2“ die Ziffer „2“ aus der Spalte 2/2/2 der Vorzeile Z.38“2“19 gelesen wird für 215AS. Somit wird Ubiquitin von der Mutante gebunden [EMD - Emerin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Lamin A/C“=572AS zerlegt die 38=QS11 in 1+1(Rest) in Z.“38“219 und zählt zusammen mit Z.“382“20 die Ziffer „5“ als 1+38=QS2+2=“5“ +Rest=1. In der Spalte Z.382“2“0/38“22“1 wird die Zahl „72“ mit Rest=1+2_2+2=“7“_38=QS=“2“ für 572AS erzeugt. Das Protein (Mensch) „Lamin A/C“=572AS kann als Mutante in der Randspalte zur Bildung der Zahl „57“ das Defizit=60-57=3 erkennen und folglich Summe 18+19+20=“57“ zählen sowie Ziffer „2“ in Z.38“2“20“ anfügen für 572AS. Über diesen Pfad bindet die Mutante an Ubiquitin [LMNA - Lamin A/C - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „LEM domain nuclear envelope protein 2_ LEMD2“=114AS liegt in der Z.Nr.38220 als 38=QS11_QS2+2+0=4 für 114AS und wird durch die Mutationen gestört. Das Protein (Mensch) „Torsin-1A_ O14656“=332AS liegt in der Spalte Z.Nr.38220/Z.Nr.38220 als 3_QS8+2=10_20 mit Summe 30 und Ziffer „2“ (statt der Randzahl, wegen der Blockzahl 20) für 332AS [TOR1A - Torsin-1A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Torsin-1-_AA0A494BZT7“=315AS zählt alternativ „3“_QS8+2=10_QS2+0_1+2=5 mit Summe 10+5=“15“ für 315AS [TOR1A - Familie Torsin 1 Mitglied A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Torsin-1A-interacting protein 2“=470AS erkennt in der Spalte Z.38219/Z.38220 die Basiszahl „Summe 38+22=60“ und kann aus der Randzahl „19“ die Zahl 9+1=“10“ für Summe 10+60=“70“ erzeugen. Die Ziffer „4“ liegt am linken Rand als 38=QS=2_2=4_70 für 470AS. In dieser Zählung ist ATP=260E enthalten, um andere Proteine zu aktivieren [TOR1AIP2 - Torsin-1A-interacting protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „REEP4_Q9H6H4“=257AS ist an der Wiederherstellung der Kernhülle beteiligt. Folglich muss der Zeilen-Zähler als absteigende Zählung von Z.Nr.38222 mit der Zahl 38=QS=“2“ bis zur Z.38218 mit der Zahl „18“ in der Summe 18+19+20=“57“ für 257AS zurückgesetzt werden. Zur Streckung wird die Ziffer 0 aus Zahl 10 in der Spalte 2“(20)/“22“[1]/“22“[2] eingefügt, und zwar als QS2_2+2_2+2=10 für Ziffer „0“ [REEP4 - Rezeptorexpressionsförderndes Protein 4 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „BANF1_Barrier-to-autointegration factor“=89AS ist ebenfalls an der Wiederherstellung der Kernmembran beteiligt und zählt den gleichen Pfad entgegengesetzt aufsteigend. Die Zahl 89 entsteht als Summe 1+57+21+10=89AS, und zwar als „1“ (mit Ziffer „1“ aus Z.382“1“7)_57 (aus Randzahlen 18+19+20=57)_21_QS2_38=QS2_38=QS=2_2+2=10 bis Z.3822[2] für 89AS [BANF1 - Barrier-to-autointegration factor - Homo sapiens (Human) | UniProtKB | UniProt]._dat2023.06.30
Bei der Mutation „S143 Lamin A/C“ wird gegenüber Lamin A/C die Aminosäure Serin=C3H7NO3=18+7+7+24=56E gegen Phenylalanin=C9H11NO2=54+11+7+16=88E im Außenbereich der coiled-coil-Struktur des Lamins ausgetauscht. Wird von den Versionen das Protein (Mensch) Lamin A/C_W8QEH3=572AS betrachtet, liegt in der Zählung der Zahl „72“, die in 56 (Serin) +16 (zerlegt 8+8, gebunden 88=Phenylalanin) gegliedert werden kann, so dass wegen der Serien-Spalte „8/8“ das Phenylalanin stets leicht verfügbar Weiterhin sind Lamin A/C mit 491AS und 465AS vorhanden. Bis Zeile Z.38219 ergibt sich die Rand-Zahl 38[21] (für 3+8=“11“) alternativ mit [3]821 als QS8+2+1=11=QS=2, so dass eine Weiche in die Mitte der Z.-Nrn.-Matrix möglich ist, und die Ziffer „8“ somit am Rand liegt. [Der_Einfluss_von_Mutationen_im_LMNA_Gen_auf_die_Struktur_und_Funktion_des_Zellkerns.pdf (uni-wuerzburg.de); S. Kandert, Diss. 2009]. In der Hausnummer „88“ darf man in ´Schland wohnen, aber die obszön grüßende, protzige Limousine mit Dienstwagenprivileg kann die „Vergangenheit“ im VW-Kleinwagen auf der Autobahn vorsorglich nicht überholen. Die „AUTO ZEITUNG“ stellt am 21.4.2022 „Wasser-Schilder“ an den Pranger. Schön, dass LM erlaubt ist.
Die Kernhülle (Kernmembran) ist eine Doppelmembran, die außen mit Ribosomen besetzt ist. An die innere Membran grenzt zum Kerninnern hin eine 30–100 nm dicke Schicht von intermediären Lamin-Filamenten (nuclear lamina), die während der Mitose ab- und wieder aufgebaut werden. Im Zuge der Zellteilung wird die Kernhülle abgebaut, um die Chromosomen besser verteilen zu können. Zur Signalisierung eines Abbaus ist Ubiquitin mit 76AS als Randspalten-Serie #38/#38 mit 38+38=76 als Signal geeignet. Ubiquitin wird an Lysin angehängt. In Z.38220 ist mit 8+22=30=Zink eine Orientierungshilfe vorhanden. Das Protein (Mensch) „E3-Ubiquitin-Protein-Ligase RNF181“=153AS [RINGFINGER Protein 181] muss aufgrund der ungeraden Zahlen 1, 5, 3 die Zahl= 1 (Rest) durch Spaltung gewinnen. Beim Start mit der Ziffer „1“ in Z.38221 steht 22“1“ nicht mehr als QS=5 zur Verfügung, so dass mit „1“_Summe 2+2+Randzahl 38=QS=2, gespalten mit 1+1(Rest) für Summe 2+2+1=“5“+ 1(Rest). Die Rand-Zahl „38“ in Z.38220 zeigt mit 38=QS=2 zur gesuchten Ziffer „3“ ein Defizit und kann den Überschuss aufnehmen für 153AS. „Funktion: Katalysiert die Monoubiquitinierung der 26S-Proteasom-Untereinheit PSMC2/RPT1“ [RNF181 - E3-Ubiquitin-Protein-Ligase RNF181 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die alternative Bezeichnung „RINGFINGER Protein 181“ weist auf eine RING-Fingerdomäne (kurz für Really Interesting New Gene) vom Zinkfingertyp hin, die 2 Zink-Atome bindet. Wegen der Serie „822“ mit 8+22=30 ist Zink=30 doppelt vorhanden. Es wird 1x Histidin und 7x Cystein gebunden, aber wie? Spalte „Z.“38“220“]/Z.“38“[221]/Z.“38“[222]“ absteigend mit Summe=38+38+(38=QS=)2+2+2+0=Histidin=82E. Weiterhin 7-fach Cystein=C3H7NO2S=18+7+7+16+16=64E mit der Summe 7*64=448E Wie? Eine 3-fach vorhandene „22“ motiviert lediglich dazu, dass die „22“ erst aus 38=QS=2_2 mit „22“ kreiert wird. Spalte Z.“382“2“[0]/Z.[38]“2“2“[1]/Z.[38]“2“2“[2] ergibt 38=QS=2_2 für 22_Spalte 2/2 für 22, Summe 22+22=“44“_QS2+2_2_2=“8“ für 7-fach-Cystein=448E. Links wird Randspalte „38/38“ und rechts die Randspalte „0/1/2“ nicht verwendet. Die Ubiquitinierung zielt darauf ab, das Substratprotein abzubauen [RINGFINGER-Domain – Wikipedia]. Das katalysierte Protein (Mensch) „Proteasom (PSMC2)“=72AS liegt in der Spalte Z.38220/1/2 als 38=QS=2+2+2+0_1=7_2 für 72AS [PSMC2 - Proteasom 26S Untereinheit, ATPase 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weil im Code die Kernporen entstehen, kann die Kernhülle nicht ohne Poren erzeugt werden.
Der Zellkern ist 5-15µm groß: Porenquerschnitt=Pi*(d^2/4) mit d=80nm und als Test mit 50mm Umrandung als d*=180nm=0,18µm mit A* =Pi*(0,18^2/4)=0,0254469µm². 2000 Poren besitzen einen Einflussbereich von 50,89380µm². Kugeloberfläche =Pi*D² mit min D=5µm min O=78,54µm². Zwischen den Poren ist somit ein Steg >100nm vorhanden. Der Wiederaufbau der Kernhülle am Ende der Mitose ist ein faszinierendes Beispiel für die molekulare Selbstorganisation zellulärer Prozesse und Strukturen [Der Wiederaufbau der Kernhülle | Max-Planck-Gesellschaft (mpg.de); 2007]. Damit sich die Proteine korrekt falten, stellen Chaperon-Proteine einen schützenden Hohlzylinder bereit. Der Hohlzylinder schirmt die exponierten hydrophoben Aminosäuren vor anderen Proteinen ab [https://www.scinexx.de/dossierartikel/anstandsdamen-helfen-proteinen-beim-falten/]. Diese Aufgabe ist mit dem Wasser H2O=28 als gespiegelte Serie #3“82“ lesbar. Der Hohlzylinder zieht sich mit dem BiXnom-Kreis „64“ als Serie über jeweils eine Spalte „382/382/38[2]", um als QS 38+QS3+8+2_3+8+2=64 eine Röhre zu bilden. In der Summe 38+26=64 ist die Zahl „26“ für Adenosintriphosphat (ATP)= C10H16N5O13P3=60+16+35+104+45=260E bereits enthalten. ATP benötigen die Chaperon-Proteine als Energie, um fehlgefaltete Proteine vor dem Verklumpen zu retten. ATP liegt folglich in der Spalte „382/382/[3]82“ mit 382_382=QS=26_QS8+2=10 mit Ziffer „0“ für ATP=260E. Wechselseitig bleiben die Ziffern „2“ und „3“ übrig, um als Summe eine Struktur “5“ zu kontrollieren. Die Schwerachse zählt sich restlos über 4*(382) als 2*38+2*(38=QS=)2+2+2=84, hierzu wird die Faltung trichterförmig in das Energieminimum geführt. Das Protein benötigt folglich nicht mehrere Jahre, um eine optimale Faltung zu finden, sondern findet schnell einen Pfad. Die Faltung dauert mindestens 1 Sekunde, so dass die Zeitbasis „60“ über QS3+3=“6“_QS8+2=10 mit Ziffer „0“ für „60“ mitläuft. Liegt ein Chaperon-Protein in der Z-Nr.-Matrix? Das Protein (Mensch) „Zinkchaperon_Q8IUF1 • ZNG1B“=395AS überträgt den Zink-Cofaktor direkt auf Zielmetalloproteine, die daduch aktiviert werden. Zink wird in das aktive Zentrum der Methionin-Aminopeptidase METAP1 eingebracht. Verbrauch der Spalte „382/382“ mit Summe=38 + Spaltung „38“ über QS=2=1+1(Rest)=38+1+1Rest=“39“+1(Rest). Weiter mit QS2_2 incl. 1(Rest)=“5“ für 395A [ZNG1B - Zinc-regulated GTPase metalloprotein activator 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Sorry, 38AS ist trivial [METAP1 - Methionyl aminopeptidase 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die intermediären Lamin-Filamente, die von der inneren Kernhülle in das Kernplasma führen, sind um 42 AS länger als übliche zytoplasmatische Intermediärfilamente. Lamine sind Typ-V-Intermediärfilamente [Unterschied: „Laminine“ gehören zur in der Basallamina in der extrazellulären Matrix]. Folglich liegt ein Bezug zur Membran-erzeugenden Z.-Nrn.-Matrix in der Serie Z.3822x mit QS38+2+2=“42“ vor. Für 4 schraubenartige Abschnitte ( Coiled-Coil-Abschnitten) muss die Zahl 4*64(Kreis)=256AS verarbeitet werden. Geeignet ist die Spalte Z.“38“2“20“/Z.“38“221“ für 256AS=Summe1=„20+QS2+2+1“=“25“_Summe2=„38=QS=2_38=QS=2_2=“6“ für 25_6=256E=Schraube. Die „105-Box“ mit 105AS ist der Ansatz der Lamin-Filamente an der BiXnom-Atmungs-22(CO2)-Schwelle „Z.38220“, und zwar in der Spalte Z.[3]“821“[9]/Z.“38“2“20“/Z.“38“221“ als BOX-105= spiralförmig mit Summe1=38+38=“76=Ubiquitin“_mit Summe2=Weiche [3]“821“x=82+1=83=QS=11=QS=“2“_mit Summe3=20=Calcium_mit Summe 4=1+2+2+2=7 ergibt Summe=76+2+20+7=105AS (Box). Interaktionspartner der Lamine sind die Proteine „LAP2alpha, Rb (Retinoblastoma Protein), und BAF (barrier-to-autointegration factor) [Lamin – Wikipedia]“.
Das Protein (Mensch) Lamin „Lamin B_ P20700 • LMNB1“=586 AS nimmt faserartig die Code-Randspalte „1/1“ mit der Spalte Z.“3821“9#1“/Z.38220#“1“/Z.“38“2“2“[1] als „3“_Weiche QS8+2+1=11=QS=“2“ für Summe 3+2=“5“_QS9+#1_#1=“11“_QS0+22+38=“60“_38=QS=11_2+2=“15“ mit Summe 5_(11+60+15)=5_86 für 586AS [LMNB1 - Lamin-B1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Lamin A/C_W8QEH3“=572AS soll ebenfalls die Faser „11“ als Spalte #1/#1 aufnehmen, und zwar in der Spalte Z.“38“21“9#1“/ Z.“38“22“0“#“1“/ Z.[3]“82“[21] mit QS #1_#1_9=11=QS2_1+2=“5“_38+QS38=QS=2 für 38+2=40_QS8+2_22+0= 32 mit „5“_QS40+32=“72“ für 572AS. Wird bei einer Mutation Serien=56 gegen Phenylalanin=88 bei gleicher Gesamtlänge ausgetauscht, beträgt die Differenz 88-56=“22“. Die Mutation ergibt eine Verschönerung, indem die zentrale „22“ für einen Hohlkörper entfernt wird. Gleichwertig wird der rechte Zahlenrand „21“ aufgenommen und im Code an Ziffer #1 verankert für 21+#1=“22“. Das Protein (Mensch) „Prelamin-A/C“=664AS zählt die Randspalte in der Summe=Z.38=QS=11_22=“33“_Z.38=QS=11_22=“33“ für Summe 33+33=66. Abstieg in Z.[382]“1“9#1/#1 mit 1_QS9+1+1=11=QS=2 zurück in die Matrix in Spalte 0/1 mit Summe= 1+2+0+1=“4“ für 664AS [LMNA - Prelamin-A/C - Homo sapiens (Human) | UniProtKB | UniProt].
Der Durchmesser der Lamine beträgt 8-11nm [Lamin - DocCheck Flexikon; Intermediärfilamente Dr.Jastrows EM-Atlas (drjastrow.de)]. Zur Darstellung ist der 9nm-Zählweg über die Codespalte #1/#1 als Faser=11 zu führen. Das Querschnittssymbol bildet die zentrale 0(Null). Weiterhin muss der Auf-und Abbau in einer Spiegelung der Zeitbasis 24 als Prinzip enthalten sein. Aus diesem Grund ergeben sich 8nm, statt nur 7nm als Untergrenze, und zwar in der Spalte „2“1“9“#1/[2]“2“0#1/“2“1“[#1]. Der Nenndurchmesser beträgt d=9nm. Max d=#1_#1=11nm. Min d=QS1+2_2_1+2=8nm. Zeitbasis 21_QS2+2=4 für 24. Gespiegelt als #1+#1=2_QS0+2+2=4 für 24. Voraussichtlich kann nach diesem Schema auch der Durchmesser der Mikrotubuli bestimmt werden, weil diese für den Spindelapparat bei der Mitose ebenfalls vom Auf- und Abbau betroffen sind. Der Durchmesser beträgt 20-30nm, im Mittel 25nm. Intermediärfilamente sind die Zwischengröße zwischen den Mikrofilamenten=6nm und den Mikrotubuli=23nm [Intermediärfilament - DocCheck Flexikon]. Zur Unterscheidung von den Laminen wird die Code-Randspalte von #1/#1 auf #161/#161 erweitert. In der Z.Nrn.-Matrix muss die Ziffer „9“ nunmehr zur Bildung der Zeitbasis=24 in der Spalte [2]191/201/21[1] als QS“19“_0_“1“=“20“_QS2_2=“4“ verwendet werden, so dass der seitliche Zusatz-Ziffer „2“ entfällt. Die gespiegelte Zeitbasis ist unverändert als #1+#1=“2“_QS0+2_2=“4“ für Zeitbasis=24 lesbar. Mikrotubuli-Durchmesser= Summe aus Faser-Spalte #1/#1=„11“ plus QS6+6=12 für Grenzwert =11+12=23nm. Mittlerer Mikrotubuli-Durchmesser=23+ Spalte1/1=23+1+1=25nm.
Das Protein (Mensch) „Retinoblastom¬¬_P28749 • RBL1“=1068AS liegt in der Spalte Z.“38“2“1“9“/ Z.[3]“822“0“/ Z.[3]“822“1“ als QS9+0+1=10_8+22=30_8+22=30_QS2+1_38=QS=2_3=10_30+30+8=10_68 für 1068AS. Funktion: Schlüsselregulator für den Eintritt in die Zellteilung [RBL1 - Retinoblastom-ähnliches Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „BANF2_BAF (barrier-to-autointegration factor)“=90AS liegt in der Spalte Z.[3]“8“2“19“/ Z.[3]“822“0“/ Z.[3]“822“1“ als QS1+0_19+2=22_8=30_QS8+22=30_QS8+22=30=Summe 30+30+30=90AS [BANF2 - Barriere-zu-Autointegrationsfaktor-ähnliches Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „BANF“=89AS zählt die Startziffer „1“ nicht mit [BANF1 - Barrier-to-autointegration factor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Emerin (EMD)“=254 AS stellt die Verbindung zwischen der Lamina und der Kernhülle her, indem es C-förmig die Faserspalte #1/#1/#1 aufnimmt. In der Spalte Z.[382]“19#1“/Z.[38]“2“2“[0]“#1“/Z.[382]“21“#1“ bleibt die zentrale 0(Null) unbesetzt, so dass ein Hohlkörper entsteht, und zwar QS19+#1+#1+#1_1+2=25_2+2=4 mit 25_4 für 254AS [EMD - Emerin - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „NEMP1“=444AS arbeitet mit „Emerin“ zusammen. Weil es dadurch in Codespalte #1/#1 einbindet, bleibt der linke Matrix-Rand frei, um für Geschlechtsmerkmale 33/66 anzulagern. „NEMP1“ in der Spalte Z.[382]“19#1/Z.38220#1/Z.38221#1 mit QS19+#1_#1_0_1=22_22_2+2=44_4 für 444AS [NEMP1 - Kernhüllendes integrales Membranprotein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Motorprotein Dynein wird zum Aufbau des Spindelapparates und zur Bewegung der Chromosomen entlang der Mikrotubuli benötigt. Am Spindelapparat erreicht der „Goldene Schnitt“ offensichtlich ein Energieminimium, so dass sich die Position der Proteine punktuell nur minimal nach der Funktion unterscheidet. Es wird überprüft, ob das Protein „Dynein“ im Bereich des festgestellten Durchmessers der Mikrotubuli darstellbar ist. Die linke Code-Randspalte verbreitert als Faserspalte „#161“die Z.Nr.-Matrix. Das Protein (Mensch) „Dynein 1 heavy chain 1_ Q14204“=4646AS wird gewendelt gezählt und zerlegt als „4_60_4_6“ für 4646AS in der Spalte Z.“38“2“19“#161/ Z.[38]“2“20“#161/ Z.[38]“2“21“#161. Darin wird die Zahl „60“ aus der Spalte 19/20/21=QS=60 gebildet. Die Code-Spalte #161/#161/#161 mit 3*(QS1+6+1=8)=“24“ ergibt die Ziffer „6“ als QS2+4=6=flexibel. Protein „Dynein“=4646AS als 38=QS=2_2=“4“_ Spalte 2/2 mit QS2+2=4 und Spalte 19/20/21=QS=60 mit Summe 4+60=64_#Codespalte mit QS=6 für 4646AS. Funktion: Dynein hat ATPase-Aktivität; Es wird angenommen, dass der krafterzeugende Krafthub bei der Freigabe von ADP auftritt. Spielt eine Rolle bei der mitotischen Spindelmontage [DYNC1H1 - Cytoplasmic dynein 1 heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynein 1 heavy chain 1_ A0A7P0T8W5“=3668AS verbindet Z.Nrn.-Matrix und Code-Spalte #161/#161/#161=QS=24 durch einen 0(Null)-Tunnel. Die Rand-Spaltenzahlen „9/“0“/1“ werden dabei ignoriert, weil mit QS9+0+1=10 für Ziffer „0“ der Tunnel lediglich breiter wird. Das Protein beginnt in Z.“38“2“1“[9] mit QS1+2=3 und zieht über den Matrix-Rand aufsteigend mit 38=QS=11_38=QS=11_ 38=QS=11 für Summe 3+33=“36“. Die Spalte „220/22“ wird absteigend als QS22_22+0=“44“ gezählt und die Code-Spalte mit QS=24 angelagert Summe 44+24=“68“ mit 36_68 für 3668AS [DYNC1H1 - Dynein zytoplasmatische 1 schwere Kette 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynein light chain roadblock-type 1 _Q9NP97 ¬“=90AS nimmt die Spalte Z.[38]“2“19“#“161“/ Z.[38]“2“20“#“161“/ Z.[38]“2“21“#“161“ ohne den linken Matrix-Rand auf, und zwar als Block 2/2/2=QS=6_Block 19/20/21=QS=60_Code_Rand-Block 3*(QS1+6+1=24 mit Summe 6+60+24=90AS [[DYNLRB1 - Dynein light chain roadblock-type 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynein light chain 1_P63167¬“=89AS beginnt in der Spalte Z.“38219#“161“/Z.38220#“161“/Z.[38221]#“161“ als Block 2*(QS3+8+2)=“26“ und Block „19/20“=QS19+20=“39“ sowie Code-Randspalte 3*(QS1+6+1)=“24“ mit Summe= 26+39+24=89AS. Funktion: Bindet und hemmt die katalytische Aktivität der neuronalen Stickstoffmonoxid-Synthase. Fördert die Transaktivierungsfunktionen von ESR1 und spielt eine Rolle bei der nukleären Lokalisation von ESR1. Reguliert die apoptotischen Aktivitäten von BCL2L11 durch Sequestrierung an Mikrotubuli [DYNLL1 - Dynein-Leichtkette 1, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Stickstoffmonoxid-Synthase _NOS1¬“=1434AS wird vom Protein „Dynein-P63167¬“=89AS gebunden, wo durch die katalytische Aktivität der neuronalen Stickstoffmonoxid-Synthase gehemmt wird, bei der der Botenstoff „Stickstoffmonoxid (NO)“ produziert wird [NOS1 - Nitric oxide synthase - Homo sapiens (Human) | UniProtKB | UniProt]. Vorhanden sind 4 Cofaktor-Bindestellen [FAD; (6R)-L-erythro-5,6,7,8-tetrahydrobiopterin (Sapropterin)=C9H15N5O3=54+15+35+24=126E; Häm b (Fe-Protoporphyrin IX), Flavinmononucleotid (FMN)=C17H21N4O9P=102+21+28+72+15=238E]. Das „Protoporphyrin IX“=C34H34N4O4=204+34+28+32=298E [Randspalte 19/20/21=QS9+0+1=10_QS2+2+1=5 mit Summe 15 und Codespalte #161+#[1]61+#[1]61=283 für Summe 283+15=298E] wird vom Protein „Ferrochelatase“=422AS in der Spalte Z.“38“2“[19]/Z.[38]“220“ mit 38=QS=2_2=4_22+0 für 422AS katalysiert, um „Häm b“ mit der Aufnahme von Eisen^+2 in der Randspalte #1/#16=1+1=2_6 für Eisen=26 zu bilden [Ferrochelatase - Homo sapiens (Mensch) | UniProtKB | UniProt]. FMN= 238E kann den linken Matrix-Rand besetzen in der Spalte „382/382“ mit 38=QS=2_38 für 238E. Sapropterin=126E nimmt den Spaltenrest des Proteins [422AS] auf, und zwar gespiegelt als 1_2=12 _Summe =2_38=QS2_38=QS=2 mit 12_6 für 126E. Flavin-Adenin-Dinukleotid (FAD)=C27H33N9O15P2=162+33+63+120+30=408E [Flavin-Adenin-Dinukleotid – Wikipedia] zählt die Zeile Z.38219#161 komplett durch als QS38+2=40_QS1+9=10 für Ziffer „0“ mit 40_0 für 400. Summe 400+QS#1+6+1=408 für FAD=408E. Das Protein „Dynein-1“ besitzt den Cofaktor „Dynactin“ mit mehreren Untereineinheiten. Die Proteine markieren die Matrix-Ränder. Das Protein (Mensch) „Dynactin-assoziiertes Protein_ DYNAP“=210AS liegt in der Spalte Z.[3821]“9“/Z.[3822]“0“/Z.[382]“2“1“ als „2“_QS1_0_9=1+0+9=“10“ für 210AS [DYNAP - Dynactin-associated protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynactin-Untereinheit 1 -_ DKFZp686I0746“=1278AS liegt in der Spalte Z.[382]“1“[9]/ Z.“382“2“[0]/ Z.“38“[221] und setzt als Fortsetzung in der Spalte 1/2 für 1_2=“12“. Mit Summe= „12“_QS38+2_38=“78“ für 1278AS. Das „Dynein-1“ ist beim Aufbau des Spindelapparates in Interaktion mit dem Protein (Mensch) „Kinetochor-Protein ZW10_ R4GMS7“=48AS. Zur Darstellung einer Kopplung von 2 Filamenten am Spindel-Äquator wird sich die Faserspalte #“16“1“/“1“61“ spiegelbildlich überlappen, so dass die Code-Randspalte 2*(QS16+1)=34 zählt. Das Protein liegt in der Spalte Z.“38“2“19“#“161“/Z.[3822]“0“#“161“ als 38=QS=2_2_QS1+9_0=10 mit Summe= 2+2+10+34=48AS. Das Protein (Mensch) „ZW10-Interaktor _O95229“=277AS zählt ähnlich in der Spalte Z.“38“2“19“#“161“/Z.[38]“2“20“#“161“ als 38=QS=“2“ _Spalte 2/2=2+2=4_Spalte 19/20=19+20=39_Code-Summe=2*(QS16+1)=34 ergibt „2“_Summe 4+39+34=77 mit 2_77 für 277AS. Funktion: „Teil des MIS12-Komplexes, der für die Kinetochorbildung und die Spindel-Checkpoint-Aktivität benötigt wird“ [ZWINT - ZW10-Interaktor - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Dynein“ wird von weiteren Proteinen im Spindelapparat ausgerichtet. Das Protein (Mensch) „Kernverteilungsprotein (nudE)_I3L2R9“=173AS benötigt für den Auf- und Abbau der beiden Spindel-Pole prinzipiell eine Spiegelung der Zeitbasis „24“ und 2 Pole als 0(Null). Hierfür wird die Zahl 173AS auf Z.-Nrn.-Matrix und Code mit „17_3“ aufgeteilt, und zwar in der Spalte Z.[38]“219“#“1“[61]/Z.[38]“220“#“1“[61]/Z.[3822]“1“#“1“[61]. Die Matrix wird als Block-17 gezählt, so dass innerhalb der Matrix Berechnungen erfolgen können. Matrix-Summe QS2+1+9_2+2+0_1=12+4+1=“17“ mit Code-Spalte #1/#1/#1=1+1+1=“3“ für 17_3=173AS. Der Pol wird mit 2_0 im Prinzip mit paarig=2 dargestellt, und für den Abbau nochmals über Kreuz in der Spalte 19/(2)0/(2)1 verdeckt als QS19+0+1=20 dargestellt. Die Zeitbasis „24“ wird um den Pol „0“ beidseitig für den Auf –und Abbau gezählt als 2_QS2+2+0=2_4 für Zeitbasis=“24“ und alternativ in die Code-Spalte hinein als 2_QS0_1_#1_#1_#1=2_4 für Zeitbasis=“24“. [NDE1 - Nuclear distribution protein nudE homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Katanin_Q9BW62“=490AS kann eine vierzeilige Code-Randspalte 4*(#“161“) auf 4*(#“16“[1])=4*(QS1+6)=“28“ durch Schneiden von Mikrotubuli abtrennen. Die wechselnde Anordnung der Mikrotubuli (overlap-microtubuli), in der Spindel zwischen einer einfachen Überlappung von 2 Mikrotubuli-Enden und dem Einschluss des Chromosoms wird nicht dargestellt. Das Protein liegt in der Spalte Z.“38“2“19“#“16“[1]/Z.[3]“822“0“#“16“[1]/ Z.[3]“822“1“#“16“[1]/Z.[38222]#“16“[1] als (38=QS=)2_2=“4“_ 2*(QS8+22)=“60“_ Spalte „19/0/1“ mit QS1+9+0+1=11=QS=“2“_Code-Randspalte QS=#“28“ insgesamt „4“_QS60+2+28=90 für 490AS. Funktion: „Hat in vitro eine Mikrotubuli-durchtrennende Aktivität. Durchtrennt Mikrotubuli auf ATP-abhängige Weise, wodurch eine schnelle Reorganisation der zellulären Mikrotubuli-Arrays gefördert wird. Reguliert die Mikrotubuli-Dynamik in Sertoli-Zellen, ein Prozess, der für die Spermiogenese und die männliche Fruchtbarkeit unerlässlich ist.“ Die Matrix spart am linken Rand die Spalte „3/3“=33=männlich aus, so dass eine Bindung möglich ist. [KATNAL1 - Katanin p60 ATPase-containing subunit A-like 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Katanin-interagierendes Protein _O60303“=1618AS wird ohne Besonderheit zweizeilig aus der Code-Randspalte „#161/#161“ als „161“_QS1+6+1=“8“ für 1618AS gelesen. Funktion: „Kann die Stabilität von Mikrotubuli (MT) beeinflussen, möglicherweise durch Interaktion mit dem MT-durchtrennenden Katanin-Komplex“ [KATNIP - Katanin-interagierendes Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Kernverteilungsprotein (nudE_like)_ Q9GZM8“=345AS wird derart zerlegt, dass für den Spindelapparat die dreizeilige Code-Randspalte 3*(#161)=3*(QS1+6+1)=24 umgestaltet wird. Für die Aufnahme der Chromosomen wird die Ziffer 7=Form seitlich an der 1. Zeile angefügt. Bei den folgenden beiden Zeilen wird die Spalte 1/1=QS1+1=2 abgeschnitten, weil sich Chromosomen und eine Kopplung ohne Chromosomen abwechseln. Dieses ergibt eine Code-Randspaltensumme=24+7-2=“29“. Die Zeitbasis „24“ kann um den Pol „0“ auf beiden Zeiten für den Auf- und Abbau gezählt werden. Das Protein liegt in der Spalte Z.“3“82“19“#“16“17“/Z.[38]“22“0“#“16[17]/Z.[3822]“1“#“16“[17] als „3“_QS8+2=10_QS2+2=4_QS1+9+0+1=11=QS=2_#29 mit „3“_Summe 10+4+2+#29=“45“ mit „3_45“ für 345AS. Funktion: „Erforderlich für die Organisation des zellulären Mikrotubuli-Arrays und die Verankerung der Mikrotubuli am Zentrosom. Kann die Organisation der Mikrotubuli zumindest teilweise regulieren, indem das Mikrotubuli-durchtrennende Protein KATNA1 auf das Zentrosom abzielt. Reguliert auch positiv die Aktivität des minus-end gerichteten Mikrotubuli-Motorproteins Dynein“ [NDEL1 - Nuclear distribution protein nudE-like 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Protein regulator of cytokinesis 1_ H0YL53“=195AS ist in überlappenden Mikrotubuli (Brückenfasern) vorhanden, die sich neben den Kinetochor-Mikrotubuli befinden. Eine Überlappung in der Codespalte #161/#161 ergibt mit „16/1“ und „61/1“ eine unsymmetrische Werte-Verteilung als Summe „16+1“/“61+1“=17+62=“79“. Das Protein zerlegt sich in „1_16#79“, wobei wegen der Ziffer „1“ eine Spaltzahl 38=QS1+1(Rest) erforderlich ist. In der Z.Nrn.-Matrix wird daher eine Summe „15“ benötigt, um 15+1(Rest)=16 zu erzeugen. Das Protein=195AS liegt in der Spalte „Z.“38“219#“16“1“/ Z.“38“22“[0]#“1“61“, und zwar als 38=QS=11 mit „1“_1(Rest)_Summe (38=QS=)11_2+2=“15“ mit 1_1(Rest)+15=“1“_“16“_#„79“=1_16+79=1_95 für 195AS. Das Resultat sieht optisch häßlich aus, weil die Zahl „219“ nicht durchlaufen wird. Ursache: Das Protein ist durch den Tunnel „0“ in Z.38220 fixiert, aber die Ränder sind unbestimmt und können gespiegelt werden. Die Spieglung zeigt eine erkennbare Brücke. Die beiden ausgekammerte Zahlen 219/_/221 bilden die Zeitbasis „24“ als 2_QS2+2=4, weil 9+1=10 für Ziffer „0“ bzw. im Kreis zum Auf- und Abbau wechselnd [PRC1 - Proteinregulator der Zytokinese 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Protein regulator of cytokinesis 1_Isoform_A0A024RC67“=620AS reicht nicht bis in den Code. Es wird lediglich eine Spiegelung über die Spalte 2/220/2 mit dem Tunnelfixpunkt „20“ als QS2+2+2=“6“_“20“ für 620AS in Z.38220 dreizeilig angezeigt. Der Nutzen der Spaltenanzeige ist die Notwendigkeit einer Krümmung. Der Kreis=64 fehlt, aber eine konkave Gegenform „46“ ist möglich, so dass die Restzahl 62-46=16 entsteht, die im Protein =195AS vorliegt. Die Interaktion unterstützt somit die Faser-Krümmung in der Spindel [PRC1 - Proteinregulator der Zytokinese 1, Isoform CRA_e - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „Kinetochore NDC80_A8K031“=642AS bildet am Chromosom auf beiden Seiten [paarig=2] ein Kinetochor als Bestigungspunkt für ein Spindel-Mikrotubuli, und zwar in der Spalte Z.“38“2“19#“1617“/Z.“38“220#“1617“/Z.“38“221#[1617]. Die Chromosomen liegen auf dem Äquator-Kreis=64 zwischen den Polen. Das Chromosom wird im Code um die Ziffer „7“=Form als Serien-Spalte „1617“/„1617“ als Summe 2*(QS1+6+1+7)=“30“ erweitert. Das Protein wird seitenverkehrt vom Code zur Z.Nr.-Matrix gezählt, weil sich das Kinetochor entwickelt. Am linken Rand der Z.Nrn.-Matrix werden die beiden Mikrotubuli als Spalte „38/38“ mit 2*(38=QS3+8=11=Faser)=22 sowie die Endziffer 38=QS=11=QS=2=paarig dargestellt. In der Lücke liegt die Spalte 2/22/22 mit 5*2=“10“. Am rechten Rand wird die Spalte 19/0/1=QS1+9+0+1=11=QS=2 gezählt. Das Protein setzt sich aus Code-Randsumme=30 und Matrixsumme 2_22_10_2=34_2 zusammen als 64_2 für 642AS. Funktion: „Bestandteil des essentiellen Kinetochor-assoziierten NDC80-Komplexes, der für die Chromosomensegregation und die Spindel-Checkpoint-Aktivität benötigt wird“ [NDC80 - Kinetochore protein NDC80 - Homo sapiens (Human) | UniProtKB | UniProt]. Für den Start der Mitose werden zunächst „Cyclin A und B“ gesammelt, um den Zeilenbereich aufzubauen. Das Protein (Mensch) „Cyclin A1“=465AS kann beide Ränder abbilden, und zwar zweizeilig in der Spalte Z.“38“2“19“#“161“/Z.[3]“82“20“S#“161“ als 38=QS=2+2=“4“_QS8+2=10_20_19=“49“_#1+6+1=“8“_#1+6+1=“8“ mit „4“_Summe 49+8+8=“65“ für 465AS [CCNA1 - Cyclin-A1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Cyclin B2“=398AS liegt dreizeilig in der Spalte Z.“3“82“19“#“16“1“/Z.“3“822“0“#“16“1“/Z.[38]“2“2“1“#[161], und zwar als „3“_ QS8+2=“10“_QS8+22=“30“_QS2+2=4_QS19+0+1=“20“_#QS16+16+1+1=#“34“ mit „3“_Summe=10+30+4+20+34=“98“AS für 398AS [CCNB2 - G2/mitotik-spezifisches Cyclin-B2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das „Cyclin B2“=398AS ist besser als Cyclin A geeignet, sich mit dem Protein CDK1=297AS zu vereinigen. Mit 97-34=“63“=Physik vs. 98-34=“64“=Biologie bewirkt die Verschmelzung eine Versöhnung der Antagonisten bei der Zellteilung. Das Protein (Mensch) „Cyclin B2“=CDK1_Cylin-abhängige Kinase“=297AS liegt dreizeilig in der Spalte Z.“38“[219]#[161]/ Z.“382“20“# “161“/ Z.[382]“2“1“#“161“ als 38=QS=“2“_QS38+2=“40“_“20“_QS2+1=“3“_QS16+16+1+1=“34“ mit „2“_Summe 40+20+3+#34=“97“ für 297AS. CDK1 wirkt dann als „Mitose-promoting factor MDF“. Als wichtiger Regulator des Zellzyklus ist CDK1 ein potentes therapeutisches Ziel für Inhibitoren in der Krebsbehandlung [CDK1 - Cyclin-abhängige Kinase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Bei der Ingangsetzung der Zellteilung wird das NuMa-Protein freigesetzt [Cyclin-abhängige Kinase 1 – Wikipedia]. Das Protein (Mensch) „Nuclear Mitotic Apparatus (NuMA)_ Q9UPG3“=173AS ist ein Strukturknotenpunkt für die Position der mitotischen Spindel. Um das Chromatin im Zellkern zu berücksichtigen, wird hierfür die Code-Randspalte erweitert und als „#1617/#1617“=QS=30 gezählt. Für den Knotenpunkt, muss die Schwerachse=84 anthalten sein. Das Protein liegt dreizeilig in der Spalte Z.“38“2“1“[9]#[1617] Z.[3]“82“20“#“1617“/Z.[38221]#“1617“ als QS38+2+1=41_QS82_20=102_#30 mit der Summe=41+102+30=173AS. Die Schwerachse=84 wird an der Nahtstelle „82_2“ mit „22“ als Halbgruppe als 8_QS2+2=4 für „84“ erzeugt und durch die Blockzahl „173“= QS=11=Zählgröße als Knoten symbolisiert. Die Modifikation, das Protein (Mensch) „Nuclear Mitotic Apparatus (NuMA)_O75304“=124AS liegt dreizeilig in der Spalte Z.“38“2“19“#“1617“/ Z.[3]“8“22“0“#“1617“/ Z.[38]“22“1“#[1617] als QS=38+2=40_QS8+22=30_QS2+2=4_QS19+0+1=20_#30 mit Summe=40+30+4+20+#30=124AS. Die Schwerachse=84 liegt an der Naht 8_2/8_2 für 8_QS2+2=4 für 84. Zeitbasis „60“ als Spaltensumme „19/20/21“[NuMA - Protein des Kernmitoseapparates - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Die Modifikation, das Protein (Mensch) „Nuclear Mitotic Apparatus (NuMA)_ Q59HB8“=1585AS zählt seitenverkehrt dreizeilig in der Spalte Z.“38“2“19“#“16“17“/ Z.[38]“2“2“0“#“16“17“/ Z.[38]“2“2“1“#[1617] als #QS16+17=“15“_ #QS16+17=“15“_QS19+0+1=“20“_QS38+2=40_QS2+2_2+2=8_38=QS11=QS=2 mit „15“_Summe=15+20+40+8+2=“85“ für 1585AS [Nuclear mitotic apparatus protein 1 variant - Homo sapiens (Human) | Publications | UniProtKB | UniProt]. An der Positionsfindung für „NuMa“ ist das Protein (Mensch) „Aurora-Kinase A_O14965“=403AS beteiligt und nimmt am Tunnel „0(Null)“ die Code-Randspalte auf, und zwar als QS2+2=4_0_QS=#1+#1+#1=3 mit 403AS [AURKA - Aurora-Kinase A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation, das Protein (Mensch) „Aurora-Kinase_AQ5QPD1“=106AS nimmt an der Tunnel-Spalte „0/1“ die Randspalte mit der Summe 3*(#QS1+6+1)=24 als QS2+4=6 auf, und zwar als 1_0_6 für 106AS [AURKA - Aurora-Kinase A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Ein Rückbau des Spindelapparates ist notwendig, weil das Bixnom-Claustrum-Eingangsportal in Epi.Vir.Z.38222#“161701047089180“ endet. Dann Beginnen die eigentlichen Funktionen des Claustrums.
„Amuse-gueule“, zwinkert der Chefkoch bei BBQ-Pulled Pork
Sto perigiali to kryfo; Alexia Vassiliou - Στο περιγιάλι (Άρνηση) / Sto perigiali to kryfo (Live) - YouTube; https://www.youtube.com/watch?v=V2zaSwYekNQ
Chemotherapeutika werden in der Krebs-Therapie eingesetzt, um gezielt auf die Mitose einzuwirken. Taxane wie Paclitaxel (Taxol)=C47H51NO14=282+51+7+112=452E [Paclitaxel – Wikipedia] und diverser Epothilone [Epothilone – Wikipedia] wirken stabilisierend auf die Mikrotubuli, weil der linke und rechte Rand bedient wird sowie die Schwerachse „84“ gespiegelt mitgezählt wird. Das Medikament „Taxol“=452E liegt in der Spalte Z.[3821]“9“#“161“/Z.“38“22“0“#“161“/Z.“38“22“1“#[161] als Summe= 38=QS=2_38=QS=2=“4“_ Spalte 22/22=QS=“8“_Spalte 9/0/1=10_#3*[QS16+1]=34 mit „4“_Summe= 8+10+#34=52 für 452AS. Beta-Tubulin ist der Hauptbestandteil der Mikrotubuli. Vinca Alkaloide (Vinblastin, Vincristin und Vinorelbin) und Nocodazol binden direkt an das Beta-Tubulin und destabilisieren die mitotische Spindel durch Depolymerisierung. Das Protein (Mensch) „Beta-Tubulin_B2R6L0“=445AS nutzt nicht das Symbol der Faser =11, sondern reduziert auf 38=QS=2. Das Protein liegt dreizeilig ohne Code in der Spalte Z.“38“(21)[9]#[161]/ Z.“38“22“0“#[161]/ Z.[38]“22“[1]#[161] als Summe „38=QS=2_38=QS=2“=2+2=“4“_QS22+22+0+1=“45“ mit 4_45 für 445AS. Das Protein enthält einen Bezug zur Zahl 13, mit der sich 13 Profilamente zu 1 Windung zusammenschließen, und zwar als Restsumme 2+1+9+1=13 Profilamente. Der Kreis=64 zählt sich in der Spalte [9]#“1“6“/0#“1“[6]/“1“#[16] als “ 6“_QS#1+#1+#1+1=4 für „64“. Der Cofaktor Magnesium Mg^2+ =12E wird in der Spalte „2“0/[2]“1“ als QS10+2=Magnesium=12 gezählt. Beta-Turbulin bindet Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E zweckmäßig in der Code-Spalte #“1“6“1“/#“1“6“1“/[#161] als QS#1+#1=“2“_“6“_QS1+1+6=“8“ für „268E. Das „GTP“ des Beta-Tubulins wird kurz nach der Anlagerung an ein weiteres Protofilament zu GDP hydrolysiert. Die Hydrolyse einer Verbindung X-Y erfolgt als „ X-Y+“H-OH“->X-H+Y-OH“, so dass dafür die Matrix-Zahl „19“ mit H=“1“ und OH=8+1=“9“ verfügbar ist. Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E liegt in der Code-Randspalte Z.38219#“16“[17]/#[1]“6“1“7“] aufsteigend QS16+6=22_QS1+7=8 mit 22_8 für GDP=228E._[GDPgeändert 11.09.2023]
Bei Alpha-Tubulin der Protofilamente wird das „GTP“ an der Dimergrenzfläche von einem Loop des Beta-Tubulin eingeschlossen und so vor der Hydrolyse geschützt [Tubuline – Wikipedia]. Eine Umkreisung von „GTP“ ist nicht zu erkennen, aber der Rücken von „GTP“ ist geschützt, weil die letzteZeile als „Bullenwinkel“ durchzählbar ist, und zwar als 38=QS=2_QS2+2+2=6_QS#1+6+1=8 mit 2_6_8 für GTP=268E. Zu diesem Zweck kann das Protein (Mensch) „Alpha-Tubulin_ Q71U36“=451AS brutal in nur 2 Zeilen und ohne linken Matrix-Rand gezählt werden, und zwar zunächst trivial dann exklusiv als QS219+220=“439“_Code Summe 2*(QS1+6+1+7=15)=2*(QS1+5=6)=“12“ mit 439+12=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Die Variante Protein (Mensch) „Alpha-Tubulin _Q6QMJ5“=98AS, dient als Assistent und stürzt sich auf den noch freien linken Rand [38+38=76=Ubiquitin], und zwar als QS 38+38+22+0=98AS [TUBA1 - Tubulin alpha chain - Homo sapiens (Human) | UniProtKB | UniProt}. Beta-Tubulin ist im Gegensatz zu Alpha-Tubulin positiv geladen. Funktion: „Zylinder, der aus lateral assoziierten linearen Protofilamenten besteht, die aus Alpha- und Beta-Tubulin-Heterodimeren bestehen. Mikrotubuli wachsen durch Zugabe von GTP-Tubulin-Dimeren am Mikrotubuli-Ende, wo sich eine stabilisierende Kappe bildet. Unterhalb der Kappe befinden sich Tubulin-Dimere aufgrund der GTPase-Aktivität von Alpha-Tubulin im GDP-gebundenen Zustand“ [Tubulin beta chain - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation, Protein (Mensch) „Beta-Tubulin_Q9H4B7“=451AS kann in 2 Versionen vorwärts und rückwärts gezählt werden. Mit der folgenden Rückwärtszählung werden die 13 Profilamente und der Bixnom-Kreis=64 aufgenommen, in dem die Ziffer „1“ absschließend am linken Rand aus einer Spaltzahl 38=QS=11=1+1 (Rest) entsteht. Das Protein liegt dreizeilig in der Spalte Z.“38“2“19“/#“16/“Z.38[2]“2“0“/#1[6]/Z.[3822]“1“/#1[6] beginnend im Code QS6+#1+#1+#1=“9“_Matrix QS1+0+2=“3“_QS19+2=“21“_38=QS=“11“ mit Summe=3+21+11=35 mit Defizit=1 für Soll=36 und abschließend 38=QS=11=Spalt 1+1(Rest). Das Ergebnis Summe 9+35_1+1(Rest)=44_1(Rest)_1=45_1 für 451AS. Das Protein liegt alternativ als Vorwärtszählung dreizeilig in der Spalte Z.“38“21“[9]#[161]/ Z.“38“22“0“#“1“61/ Z.“38“22“1“#[161] als „3*(„38=QS=11)=“33“_QS2+1_2+2_2+2=“11“_QS1+0=“1“=Summe=33+11+1=“45“_#1
für 45_1 für 451AS [TUBB1 - Tubulin-beta-1-Kette - Homo sapiens (Mensch) | UniProtKB | UniProt].
Nunmehr kann die Destabilisierung von Beta-Tubulin durch ein Chemotherapeutikum in der Krebstherapie betrachtet werden: Vinblastin=C46H58N4O9=276+58+28+72=434AS bindet fest am Tubulin, so dass sich keine Mikrotubuli bilden können. Aus der Zeile Z.[38]220 mit QS2+2=4 und Code-Zahl 34 aus 2*(QS16+1)=34 entsteht 4_34 für 434AS [Vinblastin - DocCheck Flexikon]. Vincristin=C46H56N4O10=276+56+28+80=440AS verhindert die Bildung von Mikrotubuli und bewirkt eine Hemmung der DNA-Synthese und der RNA-Produktion. Hierfür muss der Code funktionell in voller Breite in der Spalte #1617/#1617 mindestens mit 2*(QS1+6+1+7)=“30“ angesetzt werden und in der Matrix 440-„30“=410 erzeugt werden. Zur Bindung bleibt der linke Rand frei, so dass QS2+2=4_QS1+9+0=10 für 4_10 und Code=#30 mit 4_QS10+30=40 für 440AS entstehen [Vincristin – Wikipedia]. Vinorelbin=C45H54N4O8=270+54+28+64=416AS verhindert die Ausbildung von Mikrotubuli in der Kernspindel, so dass keine Mitose möglich ist. Es ist eine Derivat von Vincristin. Der Wirkstoff zählt sich brutal schnell hoch, und vollzieht damit einen Übersprung vor in die Bildung der Kernspindel, und zwar in Z.“382“19“#“161“/#“161“/#“161“ als „382“_QS1+9=“10“_Codesumme 3*(QS1+6+1)=“24“ mit QS382+10+#24=416 für 416AS. Die Codesumme enthält die Zeitbasis „24“. Die Plasmahalbwertzeit von 40 Stunden setzt sich aus der Matrix-Spalte 19/0=QS=10 und der Codesumme 2*(QS1+6+1+7)=30 für 10+30=40 Stunden zusammen [Vinorelbin - DocCheck Flexikon]. Nocodazol= C14H11N3O3S=84+11+21+24+16=156E löst das Mikrotubuli-Zellskelett auf. Es liegt ein anderer Wirkmechanismus vor. „Nocodazol“ stimuliert die Expression von LATS2, das den Wnt-Signalweg stark hemmt, indem es die Interaktion zwischen den Wnt-abhängigen transkriptionellen Co-Faktoren „beta-Catenin“ und „BCL9“ aufhebt“ [Nocodazol – Wikipedia]. Der Wirkstoff „Nocodazol“=156E löst das Zellskelett durch eine gespiegelte Zählung der Z.38220#1617 als Codesumme QS1+6+1+7=15_Matrixsumme 0+2+2+(38=QS=)2=6 mit 15_6 für 156AS auf. Die erzeugte Trennlinie verläuft dazu senkrecht als Trennung zwischen Matrix und Code, ggf. ist dafür in der Summenformel die Schwerachse „84“ zuständig. Das Protein (Mensch) „Beta-Catenin“=781AS zählt spiegelbildlich die Code-Spalte #“161“7“/#“1“[617] als „7“_QS#1+6+1=“8“_#“1“ mit 7_8_1 für 781AS [CTNNB1 - Catenin beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „BCL9“=1426AS stützt sich durch eine Ergänzung auf den C-förmigen Pfad für das Protein (Mensch) „BCL9_Coaktivator“=1414AS. Der Coaktivator verzichtet darauf, die Zahl „14“ über die Zahl „38“ als Spaltzahl zu gewinnen, sondern beginnt die vierzeilige Zählung rückwärts in der Zeile Z.3821[9] als „1“_QS2+(38=QS=)2=“4“ für „14“. Die folgende Zahl „14“ wird durchgezählt über die Randspalte Summe 3*(38=QS=)2 =“6“_QS2_2+2_2=“8“ mit QS6+8=14. Insgesamt somit 1414AS. Dieser Pfad ist für die Anlagerung der 12AS für BCL9 notwendig [BCL9 - BCL9 transcription coactivator - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „BCL9“=1426AS übernimmt den Pfad des Coaktivators mit 1414AS und findet die fehlenden 12 AS in der Spalte [9]/[0]/“1“/“2“ als 1_2 für 12AS und insgesamt 14_14+12=14_26 für 1426AS [BCL9 - B-Zell-CLL/Lymphom-9-Protein - Homo sapiens (Mensch) | Weblinks | UniProtKB | UniProt]. Das Protein (Mensch) „Lats_2“ =924AS besetzt am Matrix-Rand die nicht verwendete Ziffer „9“ und fügt die Codesumme 3*(QS1+6+1)=“24“ an, mit 9_24 für 924AS [LATS, großer Tumorsuppressor, Homolog-2-Variante - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das „Proteasom“ ist ein Proteinkomplex, der intrazellulärer Proteine abbaut. Die Zerstörung eines Proteins wird eingeleitet, wenn ihm eine Kette von mehr als 4 Ubiquitin-Molekülen (je 76AS) angeheftet wurde. An diesem Prozess sind Enzyme wie Enzyme E1 (Ubiquistin-aktivierend), E2 (Ubiquitin-konjugierend) und E3 (Ubiquitin-ligierend) beteiligt. Aufgrund der Signalkette werden Proteine zum Proteasom transportiert. Das 26S-Prptesom besteht aus dem zentralen, katalytischen Kernpartikel „20S-Proteasom (20S CP)“, an dessen Zylinderform jeweils beidseitig 1 terminales 19S-regulatorischen Partikeln (19S RP) als Deckel gebunden ist. Ggf. sind „19S RP“ nicht oder nur einseitig gebunden. Das „19S RP“ erkennt ubiquitylierten Client-Proteine. „20S CP“ bildet einen Stapel aus 4 Ringen mit jeweils 7 „Ringkugeln“ als eine α1–7β1–7β1–7α1–7 Struktur. Der 4-Ringe-Stapel enthält mittig einen Beta-Doppelring, der im Zylinder eine Kammer bildet. Beidseitig an den Enden sitzt jeweils 1 Alpha-Ring, mit dem der Zylinder ein Poren-Innendurchmesser erhält. Jeder Alpha-Ring sitzt auf einem Beta-Ring, so dass sich der Alpha-Ring als Teil eines Doppel-Ringes verstehen kann [Das Proteasom: Aufbau und Funktionen im Überblick - PMC (nih.gov) ; The proteasome: Overview of structure and functions (jst.go.jp); K. Tanaka, 2009; https://doi.org/10.2183/pjab.85.12]. Die Kammer aus zwei β-Ringen enthält Threonin-Reste. Weil auch der Alpha-Ring mit Ring=“64“ gesucht wird, ist keine Unterscheidung möglich, weil Threonin=C4H9NO3=24+9+7+24=“64“ die „64“ bereits enthält. Es werden 2 Alpha-64-Ringe und 2 Beta-64-Ringe benötigt. Ring-Typ „Beta“: Vierzeilig in der Code-Spalte #“1“6“1“7/#“1“[6]“17/#“1“[6]“17/#“1“617 als Summe 4*QS=8=32 entstehen 2 gespiegelte Ringe „6“_QS#1+#1+#1+#1=4 für „64“ (QS=10) und eine Zentralkammer mit der Spalte „6/6“, die als QS6+6=“12“=QS1+2=“3“ Proteine entfaltet, in Bruchstücke von 3 bis „12“AS zerlegt und aus dem Proteasom freisetzt. Real 3-15AS (i.M. 7-9AS). Jeder Ring besteht aus 7 Untereinheiten. Hierfür ist für einen Ring die Ziffer „7“ angelagert und muss für den anderen aus QS6+1=“7“ gebildet werden. Ring-Typ „Alpha“: Der Ring ist nur 1-fach in der Spalte aus 4*#16 (1)[7]=4*16=64 zählbar. Es sind aber zusätzlich 2 Spalten „1/1“ =QS1+1=“2“=“paarig“ vorhanden, so dass jeweils 1 Ring aufsteigend und absteigend gezählt werden kann. Es sind Außenringe in der αββα-Struktur, weil keine Restgröße für eine Kammer verbleibt. Alternativ gehört der Alpha-Ring zu einem Doppelring, der statt „64“ mit 2*64=“128“ entsteht, um Alpha- und Beta unterscheiden zu können. Beim Doppelring verbleibt eine Restspalte „1/1“=Zählgröße=11 für eine Zählaktion. Hierzu wird 128=1_28 zerlegt. Wegen 4*7=“28“ und 4*(QS1+6)=“28“ sind es dann 2 Außenringe als Doppelringe jeweils mit dem Beta-Ring. Die Zählgröße „11“ ist als Zylindermaß=11nm zu gleich eine Proteasom-Abmessung „17nm/11nm“, wobei die Ziffer „1“ Bestandteil der Dimension 17nm mit Form=7 ist [Proteasom – biologie-seite.de]. Die real 3-15 Aminosäurereste werden von Oligopeptidasen und/oder Amino-Carboxylpeptidasen zu Aminosäuren hydrolysiert. Das Protein (Mensch) „Metalloendopeptidase Thimet-Oligopeptidase (TOP)“=568AS besitzt den Cofaktor=Zink^2+=30 und ist hierfür mit dem 26S-Proteasom assoziiert. Der Cofaktor=Zink=30 wird in den Code-Spalte Z.38220#“1617“/ Z.38220#“1617“ mit 2*(QS1+6+1+7=Zink=30 gezählt. Das Protein zählt sich dann gespiegelt in der Matrix QS1_0+2_2=“5“_absteigend QS2_2_2=“6“_aufsteigend_4*(38=QS=)2=“8“ mit 5_6_8 für 568AS. Hierbei ist zu beobachten, dass der Deckel-Schalter, die Spalte „1/0“, in Richtung „10“=„Entsorgung“ durchlaufen wird. Im Matrix-Rand ist Ubiquitin=38+38=76AS bei 4 Zeilen doppelt vorhanden. Im Code wird nochmals doppelt Ubiquitin aus QS6+1=7_6 für 76AS in der Spalte „61“/“6“[1]/“61/“6“[1] gebildet. Für ein Abbausignal wird ein 5. Ubiquitin-Molekül erforderlich, das als BiXnom-Apoptose-Umschalter („0/1“ plus Zink) zu erkennen ist. Hierzu wird der Cofaktor „Zink=30“ in der Code-Spalte Z.38220#“1617/Z.38221#“1617“ statt Summe=30 als 2*(#16+17)=“66“ gezählt. In der Matrix wird die Spalte „0/1“ passiert, so dass je nach Zählrichtung entweder QS0_1=“1“ oder QS1_0=“10“ entsteht, bei „10“ entsteht das 5. Ubiquitin=66+10=76AS als Abbausignal [THOP1 - Thimet-Oligopeptidase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Anstelle von Ubiquitin kann auch das Protein (Mensch) „FAT10“=165AS eine Markierung setzen „FAT 10“ muss den Mülleimer-Deckel-Schalter beim Durchlauf auf den „10er“ Durchgang schieben. Hierfür wird eine Blockzahl 165AS in einer Spiralform durchgezählt, die den Schalter als „10“ durchläuft und neben der „10“ in Zählrichtung ausläuft. Im Code wird in der Zeile Z.38221#“1617“ mit dem Mindestanteil QS#1+6+1+7=“15“ gestartet, so dass die Matrix 165-15=“150“ liefert. Nach dem Schalter „0/1“ mit QS1_0=“10“ verbleiben für die Spirale 150-10=“140“. Spirale vierzeilig ab Z.“382“19“ mit QS1+9=“10“_QS38_2=“40“_QS38_2=“40“_ QS38_2=“40“_Summe 38=QS=“2“_“2“=4_ 2_2_2=“10“. Spirale=10+40+40+40+10=“140“_Schalter=“10“_Code#“15“ mit Summe 140+10+#15=165 für 165AS [FAT10 - UBD - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „26S Proteasome subunit beta type-4 (PSMB4)“=264AS gehört zum Bauplan des 20S Proteasoms und zeigt mit „64“ bereits die Zylinderform an. Weil der Code beteiligt werden muss, teilen sich die „64“ auf Matrix 2_“32“ und Code mit der Spalte „#16[17]/#16[17]“ als QS16+16=“32“ auf. Beim spiegelbildlichen vierzeiligen Durchlauf muss der Zylinder „64“ wieder erkennbar sein. Es bildet sich eine Ringform, die eine Zentral-Kammer „22/22“ mit QS22+22=44=Gruppe des abzubauenden Proteins umringt, dann aber spiralartig bis auf eine Restziffer „2“ aufnimmt. Das Protein liegt in der Spalte Z.“38“2“19“#[161]/Z.“38“[2]“2“0“#“16“[1]/Z.“38“2“2“1“#“16“[1] als Codesumme=#16+#16=“32“_Schalter=QS1_0=“10“_QS1_9=“10“_Zentralkammer „[2]“2“/“2“2“ mit „2“ für Summe 2+2+2+2+2=“10“ mit Matrix-Zwischensumme 10+10+10=30. Fortsetzung in der Zentralkammer mit „2“ für Matrix-Summe 30+2=“32“ und inclusive Codesumme=“32“ als Hohlzylinder=“64“. Parallel zum Schalter wird die Ziffer „2“ aus der Spalte „2/2“ angelagert mit 2_64 für 264AS [PSMB4 - Proteasome subunit beta type-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „26S Proteasome subunit 14 (PSMD14)“=310AS ist eine Metalloprotease, die spezifisch 'Lys-63'-verknüpfte Polyubiquitinketten innerhalb des Komplexes spaltet. Das Protein setzt die Zylinderform bereits voraus, übernimmt den Matrix-Anteil=2_32 des Proteins „26S_Untereinheit Beta_PSMB4=“=264AS und modifiziert die Codesumme zu 310-232=Summe #78, und zwar zweizeilig aus der Code-Spalte (0)#“16[1]/(1)#“1“61“ mit QS16_61+1 mit Code-Summe 16+61+1=#“78“. Gesamtsumme 232_#78=“310“ für 310AS. In einer vierzeiligen Codespalte 4*#“161“ kann als Restsumme nochmals eine Summe 16_Spaltabstand_61+1 für #“78“ und eine Restspalte 1/1 mit QS1+1=“2“ für Restsumme #78+#2=#80(Rest)=Lysin=C6H14N2O2=36+14+14+16=80E gebildet werden [PSMD14 - 26S Proteasom Nicht-ATPase regulatorische Untereinheit 14 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „26S Proteasom_Untereinheit 7“=324AS gehört zum 26S Proteasom. Es bindet kein Metall-Ion. Folglich kann es sich um ein flexibles Element handeln, das den Deckel zuklappt und im Prinzip eine Zeitbasis „24“ enthält. Das Protein liegt dreizeilig in der Spalte Z.[3822]“0“#“161“/Z.[3822]“1“#“161“/ Z.[3822]“2“#[161] und läuft in die „01“–Sperr-Richtung, wenn die Zentralkammer bereits gefüllt ist, und zwar als Matrix-Spalte „0/1/2“ mit QS0+1+2=“3“_Code #QS1+6+1=“8“_#QS1+6+1=“8“_#QS1+6+1=“8“ mit 3*8=“24“ mit 3_24 für 324AS [PSMD7 - 26S Proteasom Nicht-ATPase regulatorische Untereinheit 7 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „26S Proteasom_Untereinheit 6A“=439AS stützt sich Matrix-Anteil=2_32 des Proteins „26S_Untereinheit Beta_PSMB4=“=264AS nimmt aber zusätzlich die Restzahl „2“ aus Zentralkammer auf für den Matrix-Anteil „4_32“. Der Code wird einzeilig reduziert auf #16 für QS#1+6=#7. Insgesamt mit 4_#32_#7=4_39 für 439AS [PSMC3 - 26S proteasome regulatory subunit 6A - Homo sapiens (Human) | UniProtKB | UniProt]. Beidseitig des katalytischen Zylinder, der aus 2 Alpha- und 2 Beta-Einheiten besteht, bilden die 2 regulatorischen 19S-Untereinheiten jeweils einen Deckel. Der Deckel liegt vierzeilig in der der Codespalte #“161“/#“161“/#161/#161 und wird veranschaulicht, indem der Deckel eine Blockzahl „#161“ bildet und mit der passenden Unterlage, ebenfalls als Blockzahl „#161“, summarisch mit QS161+161=“322“ erfasst wird. Wird mit der Matrix-Restzahl der Schalter „0/1“ als QS1_0=“10“ durchlaufen, wird geöffnet (für „10“ mit „0“, wie offen). Bei einer „1“ wird geschlossen. Das Protein (Mensch) „26S_Regulator_Untereinheit 1_PSMD1“=953AS reduziert nach Deckelkonstruktions-Abzug auf 953-322=“631“. Zerlegung mit der Deckelmototor=Physik=“63_1“. Die Ziffer „1“ bildet den Matrix-Anteil=“1“ als „Schließer=1“ und der Motor=“63“ bildet sich als QS1_+61_1=“63“ in der Code-Randspalte (9)#“161“/(0)#“1“61“/“1“#161/(2“#1[61]. Insgesamt spiegelbildlich gezählt als Summe #322_(#63_“1“)=Deckel=322+Antrieb=631=953 für 953AS [PSMD1 - 26S proteasome non-ATPase regulatory subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt ]. Das Protein (Mensch) „26S_Regulator_Untereinheit 6A_PSMC3“=439AS reduziert nach Deckelkonstruktions-Abzug auf 439-322=“117“. Abzüglich Mindest-Matrix-Anteil=10 und Deckelmotor QS#1+61_1=“63“ verbleibt eine Matrix-Restsumme 117-10-#63=44=Gruppe. Der Deckel ist folglich geöffnet und ein Protein als Gruppe „44“ liegt zwecks Spaltung in der Matrix-Zentralkammer „22/22“ als QS22+22=“44“. Das Protein liegt in der Spalte Z.[38219]#“161“/Z.[38]“22“0“#“161“/Z.[38]“22“1“#“1“61“/Z.[38222]#“1“[61] als Matrix „44_10“_Motor=#63_Deckel=#322 mit der Summe 44+10+63+322=439AS [PSMC3 - 26S proteasome regulatory subunit 6A - Homo sapiens (Human) | UniProtKB | UniPro]._dat10.07.2023
Mit immer neuen Kreationen baut sich die Evolution vergeblich vor der Endzeile „Nr.Z.38222“ im Claustrum-Eingangsportal auf, um diese Mauer zu durchbrechen. Entsprechend tummeln sich hier viele Proteine mit unterschiedlichen funktionellen und geometrischen Ziffernfolgen. Die Geschlechtsunterschiede werden im Unterschied zum Malaria-Erreger, auf dessen zeilenweise Protein-Analyse sich der Mensch erkennbar stützt, bereits mit dem Chromosomensatz mitgebracht. Das Betriebssystem des Parasiten nutzt der Mensch wie „Windows“, das von einem genial erleuchteten Vorturner stammt. Um wieder einen einfachen (haploid) aus einem doppelten (diploid) Chromosomensatz zu erzeugen, wird Crossovers eine „meiotische Rekombination“ veranstaltet. Die Meiose folgt der Mitose. Es werden dafür lediglich einige Proteine gesammelt:
Cohesin: Der Proteinkomplex „Cohesin“ hält die beiden Schwesterchromatiden nach der DNA-Replikation bis zur Anaphase ringartig zusammen. Erst die Entfernung von „Cohesin“ führt zur Trennung. Diese Umarmung erfolgt durch ein linkes und ein rechtes Protein sowie ein Verbindungsprotein zwischen diesen beiden Armen. Das Protein (Mensch) „SMC1B“=1235AS besetzt als linker Rand die Z.-Nrn.Matrix in der Spalte Z.“38“[219]/ Z.“38“[220]/ Z.“38“221“/ Z.[38222] ohne den Code zu erreichen als Zerlegung 38=QS=11=Spalt 1+1Rest_38=QS=11=Spalt 1+1Rest. Bei Übernahme des 1. Restes (1) entsteht „1_2+1Rest_38=2“. Bei Übernahme des 2. Restes (1) entsteht „12_2+1R=12_3“. Weiter in der Zeile mit QS2+2+1=“5“ mit Summe 123_5 für 1235AS [SMC1B - Structural maintenance of chromosomes protein 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SMC3“=1217AS zieht von der Matrix bis in die Zahl „17“ der Code-Rand-Serie, um mit der Ziffer=7=Form das Chromosom zu beteiligen und den entfernten rechten Arm darzustellen. Die Ziffer „12“ wird beginnend mit der Z.Nr.382“1“9 in der Spalte „1“[9]#[16]/“2“0“#“1“[6]/[21]/#“1“[6]/[22]/#“1“6“_“17“ mit QS1+2+0+1+1+1+6=12_17 für 1217AS durchgezählt [SMC3 - Structural maintenance of chromosomes protein 3 - Homo sapiens (Human) | History | UniProtKB | UniProt]. Das Protein (Mensch) „REC8“=547AS bildet das Körperelement zwischen diesen beiden Armen und wird zerlegt mit 20_#34_7 als Summe 20+#34=54_7. Das Protein setzt sich auf die Zahl „20“ im rechten Arm, weil der linke Arm mit der Zahl „21“ in Kontakt ist und zieht in den Code mit der Spalte Z.[38219]#“16“1“7“/Z[382]“20“/#“16“1“[7] mit der Codesumme „#16+1_#16+1_“7“=#34_“7“ für REC8=547AS [REC8 - Meiotic recombination protein REC8 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Das Verbindungselement „REC8“=547AS wird durch das Protein (Mensch) „Separin“=2120AS gespalten, um in der Meiose I eine homologe Chromosomentrennung und in der Meiose II die Trennung der Schwesterchromatiden zu ermöglichen. Die Zahl „20“ für den Spaltpunkt wird bereits in der Kettenlänge avisiert. Das Protein liegt in Z.38219 in der Spalte 21[9]/[2]20 mit „21_20“ für 2120AS [ESPL1 - Separin - Homo sapiens (Human) | UniProtKB | UniProt]. Separin (Separase) ist eine Cystein-Protease, so dass Cystein=C3H7NO2S=18+7+7+16+16=64E im Code liegt, und zwar in der Zeile Z.[382]“2“0“#“1“61“ mit QS2+0+1+61=Cystein=“64“. Das nur 2-zeilige „Separin“ zieht sich im Komplex mit dem Protein (Mensch) „Securin“=202 AS weiter. „Securin sendet ein Trennungssignal, indem es die Zählgröße „11“ an der Trennstelle „Matrix/Code“ trennt, und zwar in der Spalte Z.[382]“20“#[161]/ Z.[3822]“1“#“1“[61] als „20“_QS1+#1=“2“ mit 20_2 für Securin=202AS.
Dem „Cystein“=64E folgt als ähnlicher Name das „Cyclin B“=113 AS [Cyclin B1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Securin-Separase-Komplex bleibt bei Phosphorylierung durch das Protein (Mensch) „Cyclin-abhängige Kinase 1 (Cdk1)“= 297AS erhalten. „Cdk1“ zieht sich, aufgrund der Beteiligten als Diagonale vom oberen Matrixrand, der mit 38=QS=2 die Ziffer „2“ von ATP=260E bildet, bis zum rechten Serien-Code-Rand mit der Ziffer „7“, die zum Phosphor=QS1+6+1+“7“=“15“ gehört. Cyclin B=113AS wird spiegelbildlich geführt, damit die Zahl „20“ nicht als Calcium=20 verstanden werden kann, sondern in der Spalte „2“0“#“1“/[2]“1“#“1“/[22]#“1“ als „1_1“_QS2+0+1=“3“ mit 11_3 für Cyclin B=113AS. Serin=C3H7NO3=18+7+7+24=56 zählt diesen Pfad im Vorwärtsgang als QS2+0_1_1_1=5_6 für Serin=56E. Somit zählt sich „CDK1“=297AS mit dem Matrixanteil Spalte Z.[382]“1“9“#[1617]/Z.[3822]“0“#[1617]/Z.[3822]“1“#“1“[617]/[38222]#“161“7“ ab Ziffer „1“ für eine Zählgröße QS1+9_0_1=11=QS=“2“ sowie dem Codeanteil QS1_1+6+1=“9“_“7“ mit insgesamt 2_97 für CDK1=297AS [CDK1 - Cyclin-abhängige Kinase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Bei der katalytischen Aktivität von „CDK1“ entsteht das in der Z.Nr.38“220“ lesbare Adenosindiphosphat (ADP)=C10H15N5O10P2=60+15+35+80+30=220E als Teil der ATP-Zählung 38=QS=2_QS2_2+2=6_0 für ATP=260E. In der Cohesin-Proteinstruktur wird dem Protein „REC8“=547AS auf jeder „Arm“-Anschlussseite jeweils noch 1 Protein „STAG3“ zugeordnet [siehe Abbildung: „Schematische Darstellung der Cohesin-Struktur bei Mäusen und Menschen. (A) Die Kohäsin... | Wissenschaftliches Diagramm herunterladen (researchgate.net)“]. Das Protein (Mensch) „STAG3“=1225AS ist als 4. Untereinheit des Komplexes ein meiosespezifisches Cohesin, das als eine Interaktionsplattform darstellt, die mit der Spalte 22/22/22=6*2=“12“ eine Spalte aus Halbgruppen „44/2=22“ für die Schwesterchromatiden zeichnet und in der Zeile in Z.[382]“1“9“#“1617“ mit QS1+9=“10“_#QS1+6+1+7=“15“ als Summe „12_(10_#15)“ mit 12_25 für STAG3=1225AS die Chromosomen mit der Ziffer 7=Form beteiligt [STAG3 - Cohesin subunit SA - Homo sapiens (Human) | UniProtKB | UniProt]. Es müssen somit 2 Proteine STAG3 vorhanden sein, damit der Cohesin-Komplex die beiden Schwester-Chromatiden als Gruppe 22+22=“44“ aufnehmen kann.
Sorosin: Der Klebstoff „Sorosin“ reguliert die Schwesterchromatid-Kohäsion. Kohäsion stellt sicher, dass die Chromosomenteilung sowohl in meiotischen als auch in mitotischen Zellen korrekt ist. Das Protein (Mensch) „Sorosin_CDCA5“=252AS bewirkt eine DNA-Bindung, so dass der rechte Code-Rand „7“ beteiligt wird. „Sorosin“ liegt in der Spalte Z.[38219]#[161]“7“/Z.[38220]#“1617“/Z.[38221]#“1617“/Z.[3822]“2“#“1617“. Der Klebstoff wird symbolisiert, indem der Codeanteil als Summe 3*(QS#1+6+1+7)=45_7=“52“ mit der Ziffer „7“=Form eine Verbindung erzeugt, die mit dem Matrixanteil „2“ beide Teile als Paar=2 zusammenfügt. Insgesamt 2_#52 für „Sorosin“=252AS [CDCA5 - Sororin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Kohäsionsprotein PDS5“=1447AS wird von einem anderen Gen codiert. Der Klebeverbindung wird direkt am Code-Rand mit der Spalte „7/7“ als QS7+7=14 symbolisiert. Insgesamt kann der Code 4*QS1+6+1+7)=60 erzeugen, so dass 60-14=“46“ verbleiben und der Matrixanteil=1 ergeben könnte. Die Zählung windet sich jedoch spiralförmig durch den Code, so dass über die Matrix-Randspalte „0/1/2“ ein Matrixanteil QS0+1+2=“3“ als Ausstieg-Spalte entsteht und die Code-Randspalte „1/1“ mit QS=2 zur Kompensation ungenutzt bleibt. Zerlegung spiegelbildlich gezählt #14=DNA-Bindung_#44=Gruppe_3=Matrix-Rand (0-1-2) mit Ziffer „2“=Paar in Z.Nr.3822“2“ [PDS5B - Schwesterchromatid-Kohäsionsprotein PDS5 Homolog B - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „SUMO1“=101AS wird bei der Aktivierung um 4 AS auf 97 AS gekürzt [SUMO-Proteine – Wikipedia]. SUMO1=101AS wird aufgeteilt in der Spalte Z.[38219]#“1“61“/Z.[38]“220“#“16“1“ in Matrix QS22+0=22 und Code QS1+61+16+1=79 mit der Summe 22+79=“10“ für 101AS [SUMO1 - Small ubiquitin-related modifier 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Code-Anteil=79 entspricht dem Protein (Mensch) „SERCA Ca(2+)-ATPase“=79AS [ATP2A2 - SERCA Ca(2+)-ATPase - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Vermutlich bekannt als SERCA2A. SUMO1 aktiviert SERCA2A durch Bindung an Lysin-Reste. SERCA2A reguliert den Calcium-Spiegel in den Herzmuskelzellen [SUMO1 – Wikipedia]. SUMO1 ist in der Matrix durch 2_“20“=Calcium gelaufen und am Matrix-Rand kann über 2 Spalten Z.382xxx/Z.382xxx mit 2*(QS38+2)=Lysin=80E gebildet werden. Wird der Matrix-Anteil=“22“ für das reife Protein entfernt, sind das zwar QS2+2=4AS AS, aber der Wertverlust 22-4=“18“ muss durch Umbau kompensiert werden. Bei der Kürzung um die Zahl „22 im Matrixanteil „22“0“ bleibt die 0(Null) erhalten. In absteigender Zählrichtung von der Z.Nr.[3822]“1“#“161“ als „1_0“ mit Matrixanteil=“10“_Codesumme #79 plus QS1+6+1=“8 ergibt sich mit der Folgezeile Summe=10+79+8=97AS bei Kürzung um 4AS von 101AS. Ein Herzmuskel als „Muskel=55“ liegt in der Spalte Z.38219/Z.38220 als QS38+2+1+9=“50“_mit Spalte „20/21“ für QS2+0+2+1=“5“ mit Summe 50+5=Muskel=“55“. Die Spalte ist Teil der Zeitbasis=60 auf Sekunden-Basis als Spalten-Summe 19+20+21=“60“, so dass es den Herzmuskel betrifft. SUMO1 wird von verschiedenen Proteinen, wie UBE21=158AS akzeptiert, und zwar in der Zeile Z.38220#161 als 38=QS=11_2_2_0=15_QS#1+6+1=8 mit Summe 15_8 für UBE21=158AS [UBE2I - SUMO-conjugating enzyme UBC9 - Homo sapiens (Human) | UniProtKB | UniProt]. SUMO-Proteine werden durch Sentrin-spezifische Proteasen („SENP“) in ihre aktive Form überführt. Das Protein (Mensch) „Protease SENP1_Q9P0U3“=644AS katalysiert zwei wesentliche Funktionen im SUMO-Weg. Die erste besteht in der Hydrolyse einer alpha-verknüpften Peptidbindung am C-terminalen Ende der Propeptide der kleinen ubiquitinähnlichen Modifikatoren (SUMO), SUMO1, SUMO2 und SUMO3, wodurch die reife Form der Proteine entsteht. Der zweite Schritt ist die Dekonjugation von SUMO1, SUMO2 und SUMO3 von den Zielproteinen durch Spaltung einer epsilon-verknüpften Peptidbindung zwischen dem C-terminalen Glycin des reifen SUMO und der Lysin-Epsilon-Aminogruppe des Zielproteins. Nimmt die Ubiquitin-ähnlichen Proteine SUMO1, SUMO2, SUMO3, u.a. aus dem UBLE1A-UBLE1B E1-Komplex auf und katalysiert deren kovalente Bindung an andere Proteine mit Hilfe einer E3-Ligase wie RANBP2, CBX4 und ZNF451. Die Spalte Z.[38]“2“20“#“161“/Z.38“22“[1]#“161“/Z.[38222]#“161“ ergibt QS2+2_2=“6“_“20“_ 3*(QS#1+6+1)=#“24“ mit „6“_QS 20+#24=“44“ als „6_44“ für 644AS. [SENP1 - Sentrin-spezifische Protease 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Ähnlich wird das Protein (Mensch) „Protease SENP1_F8W0I8“=130AS funktionell beschrieben, Das Protein (Mensch) „SENP1“=130AS wird zerlegt in „66+1+#63“=130 mit Spalte „22/22/22“=QS=“66“_Spalte „0/1“=QS0+1=“1“_Codespalte #“1“61“/#“1“[61] mit Summe 66_1_#63=130 für SENP1=130AS [SENP1 - SUMO-spezifische Peptidase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Zinkfinger-Protein Mensch) „ZNF451=158AS zielt darauf ab, Zink=30 aus der Duchlaufzahl „20“ plus QS1+9=“10“ zu gewinnen. Mit der Spalte „1“9“#“161“/“2“0“#“1“[61]/“2“1“#[161] folgt „1“_QS2_2_1=“5“_QS9_0+#1=10 für Ziffer „0“ mit „150“_QS#1+6+1=“8“ als Summe 150+8=158 für 158AS [ZNF451 - Zinkfingerprotein 451 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein(Mensch) „E3 SUMO-protein ligase RanBP2“=3224AS kann mit den Anteil 32_24 zwar auch nur im Code liegen, vollführt aber zweckmäßig ein listiges Rechenkunststück mit der Spaltzahl 38=QS=11, gespalten als „1+1“ und mit beiden Anteilen verschoben, um aus Z.“38“2“1“[9] mit QS2+1(Rest)=“3“_QS1+1(Rest)=“2“ die Zahl „32“ zu erzeugen. Z.38220 folgt als 38=QS=“2“_QS2+2=“4“ mit 34_24 für 3424AS [RANBP2 - E3 SUMO-protein ligase RanBP2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CBX4“=90AS kann zweizeilig im Code die Schwerachse=84 als Summe QS#1+61+7=69_QS#1+6+1+7=15 erzeugen und über die Ziffer „0“ die Matrixspalte „2“0“/2[1]/2[2]“ als QS0+2+2+2=“6“ mit Summe=6+#84=90 für 90AS durchzählen [CBX4 - Chromobox 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Kürzung des reifen Proteins „SUMO2“ um 11AS bezieht sich wahrscheinlich auf das Protein (Mensch) „SUMO2“=95AS, weil 95AS-11AS=84AS als Schwerachse=84 einen Zweck erfüllt. Mit Z.Nr.38220#161 als QS38+2=40 _20=“60“ und einer dreizeiligen Vertikale 3*QS#1+6+1=“24“ folgt Summe 60+#24=“84“. In der Spalte „19“/(2)“0“/[2]“1“ kann nunmehr die Ergänzung QS1+9+(0)+1=“11“ zweckdienlich für SUMO2=84+11=95AS angefügt werden, weil sich die 11 AS als Überschuss abbilden [SUMO2 - Small ubiquitin-related modifier - Homo sapiens (Human) | UniProtKB | UniProt]. Die Kürzung des reifen Proteins „SUMO3“ um 2AS bezieht sich wahrscheinlich auf das Protein (Mensch) „SUMO3“=103AS [SUMO3 - Small ubiquitin-related modifier 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Ein Unterschied von 2 AS liegt in der Z.Nr.Z.38“219“, indem die Zahl „219“ mit „2+19“ eingeht, so dass die Ziffer „2“ kürzbar ist. SUMO3 wird zweckdienlich zweizeilig zerlegt in die Matrix-Summe QS2+19_20=“41“ und die Codesumme=QS#1+61=“62“ und insgesamt Summe 41+62=103AS. SUMO3 interagiert mit ARNTL und Thymin-DNA-Glykosylase [SUMO3 – Wikipedia]. Das Protein (Mensch) „ARNL_B2RCL8“=626AS kann sich an die Codezeile von SUMO3 mit der Spalte #(161)“7“/#“1617“ anlagern und mit der Ziffer „7“ die Chromosomen als Form=7 adressieren bei einer Codesumme QS1+61+7_7=“76“ [wie „Ubiquitin“=76]. Matrixsumme=626-76=550 dreizeilig in der Spalte Z.[382]“19“/ Z.“382“2“0“/ Z.[382]“21“ als QS38+2=“40“_QS1+9=“10“_QS2_2+1=“5“ mit Summe 40+10+5=“55“ und anlagern der Ziffer „0“ für „550“. Insgesamt Summe 550+76=“626“ für 626AS [cDNA, FLJ96151, sehr ähnlich dem Homo sapiens Aryl-Kohlenwasserstoff-Rezeptor-Kerntranslokator-ähnlich (ARNTL), mRNA - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weiterhin interagiert das Protein (Mensch) „Thymin-DNA-Glykosylase“=406AS mit SUMO3. Thymin= C5H6N2O2=30+6+14+16=“66“ liegt in der Spalte „21“[9]/22(0)/“22“1“ mit QS21+22+22+1=“66“ und reduziert auf 406-66=340. Die zweizeilige Codesumme beträgt QS#16+1#+16+1#=“34“, so dass eine Ziffer „0“ mit QS9+#1[61]=10 für Ziffer „0“ mit Summe „34_0_66“ als 340+66=406 für 406AS angelagert werden muss [TDG - Thymine DNA glycosylase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Pachyten-Checkpoint-2-Protein (Pch2)“=432AS zeigt sich bei der Bäckerhefe vergleichsweise als 6-zackiger Stern mit Innenstern und Zentral-Pore, durch die DNA gefädelt wird [PNAS Plus: Pch2 ist eine hexamere Ring-ATPase, die das Chromosomenachsenprotein Hop1 - PMC umbaut (nih.gov)].
Für die Menschen wird die gleiche Struktur angenommen. Für den Stern wird der Matrix-Kreis als Winkel=360° gezählt, in dem die Zahl „6“ =hexagonal und der Zacken-Winkel=60° lesbar ist sein muss. Aus der Restzahl 432-360°(Winkelsumme)=72 wird die Zentralpore=64 gebildet, so dass die Restzahl 72-64=“8“ mit QS1+7=8=EXTRA die Chromosomen mit der Ziffer Form=7 beachtet als Summe=360+64+1+7=432AS. Summenwinkel vierzeilig in der Spalte „19/20/21/22“ als Ringzählung QS1+2= „3“ (zugleich 2*6=12 Sternspitzen)_QS2+2+2=“6“_QS1+9+0=10 für Ziffer „0“ mit Summenwinkel 3_6_0=360°. Code-Spalte 3*(#1617) als “#16“+QS1+7=8_ QS#16+1+7=“24“_ QS#16+1+7=“24“ mit Code-Summe 16+24+24=“64“_„8“=“#72“ und insgesamt 360°+#72=Pch2=432AS. Bei einem Außenkreis von 16,1nm ergibt sich zeichnerisch ein Porendurchmesser von 4 nm, entsprechend der Zählung Durchmesser=0_QS1#1+#1+#1=4 nm_Form=7. „PCH2“ wird bei Männern für Geschlechtschromosomen und für die Geschlechtskörperbildung benötigt, was sich aus der Spalte #16[17]/161[7] mit QS16+16+1=“33“=männlich erklärt. PCH2“ ist für den HORMAD1 und HORMAD2 aus synapsierten Chromosomen notwendig. Das Protein (Mensch) „Hormad1“=394AS wird um die Kreiswinkelsumme=360° gekürzt, so dass mit 394-360=34 nur noch die zweizeilige Summe= #16+1_#16+1=“34“ ohne Chromosomen-Anteil mit Ziffer „7“ verbleibt [HORMAD1 - HORMA domain-containing protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. In Gegenwart von ATP bindet „Pch2“ an „Hop1“. „Hop1“ ist ein wichtiger Bestandteil des synaptonemalen Komplexes, der durch „Pch2“ umgebaut und aus der DNA verdrängt wird. Es wird angenommen, dass Hop1 ggf. nur zur Bäckerhefe einen Bezug hat, so dass das Protein (Mensch) „Homologous-pairing protein 2 (Hop2)“=217AS ggf. beim Menschen einen ähnlichen Effekt hat. „HOP2“ wird nicht herausgeworfen, sondern gemobbt, d.h. durch eine 2. Position ins Abseits gestellt oder gelockt. In der Ausgangsposition zieht sich „Hop2“ ab Z.Nr.[3]“821“9“/“0“/“1“#16 mit der Zahl „21“ gedehnt als QS8+2+1=11_QS9+0+1=10 mit Summe 11+10=“21“_QS#1+6=“7“ mit 21_7 für Hop2=217AS. „Pch2“ zieht Hop2 in die 360°-Spalte, in der direkt die Ziffer „21“ als Verkürzung gelesen wird, so dass Hop2 nicht mehr im Code liegt, sondern Hop2=21_QS2+2_2+1=7 für 217AS bildet. Ursächlich ist, dass Adenosintriphosphat (ATP)=260E die Ziffer „2“ aus der Zahl „21“ verwendet, und zwar als „2“_QS19+20+21=“60“ für ATP=260E [PSMC3IP - Homologous-pairing protein 2 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MAD2_Q9UI95“=211AS ist wie HOP1 ein HORMA-Domänenprotein, das einen offenen (O) oder geschlossenen Zustand annehmen kann [Die Konformationsdynamik der Hop1 HORMA-Domäne zeigt einen gemeinsamen Mechanismus mit dem Spindel-Checkpoint-Protein Mad2 - PMC (nih.gov) ; A.West; (2018); doi: 10.1093/nar/gkx1196 ]. MAD2=211AS kann in Z.[38]“2“1“9“#1“[617] spiegelbildlich als „2“_38=QS=“11“ mit 2_11 für 211AS oder als „2“_QS1+9+#1=“11“ für 211AS gewählt werden. In Verbindung mit einer anderen Protein kann somit über die Zählrichtung bestimmt werden, ob es sich bei „21“, um die „12“ oder die „21“ handelt [MAD2L2 - Mitotic spindle assembly checkpoint protein MAD2B - Homo sapiens (Human) | UniProtKB | UniProt]. „MAD2_Q9UI95“=211AS vermittelt die Interaktion zwischen der fehleranfälligen DNA-Polymerase Zeta-katalytische Untereinheit REV3L und dem Inserter-Polymerase REV1. Das Protein (Mensch) „REV1“=1251AS kann die Zahl „12“ gespiegelt als „21“ von MAD2=211AS aufnehmen. REV1 wird zweizeilig zerlegt als „12_38_38=QS=11_2“ mit 12_QS38+11+2=51 für REV1=1251AS [REV1 - DNA-Reparaturprotein REV1 - Homo sapiens (Mensch) | Weblinks | UniProtKB | UniProt]. Das Protein „REV3L_Polmemrase ZETA_ H0Y5T4“=184AS enthält die Schwerachse=84. Diese entsteht aus der Codespalte „#161/#161“ mit QS#16+1#1+61=“79“ und der Matrix-Summe=“5“ aus Spalte „20/21“ mit QS2_2+1=5, die als Puzzle-Stück in REV1 einrastet. Die Ziffer „1“ für „1_QS5+79=1_84“ für 184 ist die Startziffer von REV1 in Z.382“1“9. MAD2_Q9UI95“=211AS verbindet Matrix- und Coderand durch eine wechselbare Formationsrichtung. Die Modifikation, das Protein „REV3L_Polmemrase ZETA_ F2Z3A1“=47AS rastet ebenfalls mit der Zahl „20“ an REV1 in der Spalte „20/21“ als QS20+2+1=23 ein und schließt den Code-Rand dreizeilig mit 2*(QS1+6+1)=“24“ an, als Summe „23+24=47“ für 47AS [REV3L - REV3 like, DNA directed polymerase zeta catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt].
Die Modifikation, das Protein (Mensch) „MAD2_ B1AK43“=197AS liegt in der kompakten Formationsphase in Z.[382]19#16[17] mit 19_QS1+6=7 mit 19_7 für 197AS. Alternativ wird ein Ring mit der Anzahl von 7 Zählgrößen „11“ als Summe 7*11=77 mit der Zerlegung 120+77=197AS gezogen. Der Ring läuft über die linken Ränder von Matrix und Code [821=QS=11; 3*38=QS=11; QS2+2+1_2+2+2=11; 2*Spalte #1_#1=11]. Die Zahl „120“ liegt in der Spalte Z.382“1“9/Z.382“20“ mit „1_20“ für QS120+77=197AS. Darin ist die Ziffer „1“ die Startziffer im Ring mit der 1. Zählgröße [MAD2L2 - Mitotic arrest deficient 2 like 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der 77er-Ring schließt eine Restspalte „9/220“ als QS0+2=2_QS2+9=11 mit 2_11 für 211AS ein, aus dem ein modifiziertes Mad2=211AS als Isoform entsteht.
Eine HORMA-Domänenstruktur wird auch von ATG13 und ATG101 aufgebaut [HORMA domain proteins in Autophagy initiation (uni-goettingen.de); http://dx.doi.org/10.53846/goediss-9145 ]. Das Protein (Mensch) ATG13¬_A0A1B0GXJ3“=32AS zeichnet einen geschlossenen Ring, der die Ziffer „2“ umschließt, und zwar in der Spalte Z.“382“[19]#[161]/ Z.“38“22“[0]#[161]/ Z.“38“[2]“21“#“1“Ende [61]/ Z.“38222“#“161 Anfang“ absteigend aus Z. 38222 mit QS#1+6+1=8_Z.38=QS=2_2_2_2=8 als Summe 8+8=“16“. Weiter mit Spalte 3*(38=QS=2)=6 anlagern „2“ und aufsteigend gezählt als absteigende Treppe mit „2+2_2+1_#1“ als Summe=6+2+2+2+2+1+#1=“16“ mit QS16+16=32 für 32AS [ATG13 - Autophagy related 13 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) ATG13¬_E9PPR2 “=119AS zeichnet einen geschlossenen Ring mit Einschluss der Halbgruppe „22“, und zerlegt sich als Summe 40+#79=119AS. Zweizeiliger Codeanteil=QS#16+1+#1+61=“79“. Matrixanteil QS2+2+2=6_4*(38=QS=2)=¬8_2 mit Summe 6+8+2=16. Weiter aufsteigend 2+2=4_QS19+0+1=20 mit Summe 24 und gesamt 16+24=“40“ mit Summe 40+#79=119AS [ATG13 - Autophagie-verwandtes Protein 13 - Homo sapiens (Mensch) | Weblinks | UniProtKB | UniProt]. Die 3 Proteine „ATG101“ zeichnen in ihrer verkürzten Formation unterschiedliche Winkelformen an den rechten Matrixrand, wobei die Langform den Code erreicht. Das Protein (Mensch) ATG101_Q9BSB4“=218AS schreibt eine Z-Form in der Spalte „21“[9]/[2]“2“[0]/[2]“2“[1]/[2]“2“2“ zerlegt als 21_8 mit 21_QS2_2_2+2=8 für 218AS. In der Langform wird die Zahl „21“ einzeln ausgezählt, um den Code in der Endzeile zu erreichen. Die Zahl „21“ enthält bereits den Durchlaufwert 2+1=“3“, so dass 21-3=“18“ auszuzählen sind. Die Z-Form wird damit zur Z-Z-Form mit der Spalte (21)9#1/#1/#16 als Zusatz QS9+#1#1#1_6=18 und unverändert im Wert für 218AS [ATG101 - Autophagie-verwandtes Protein 101 - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein (Mensch) ATG101_F8VVA0“=141AS schreibt eine L-Form in der Spalte „1“[9]/“2“[0]/“2“1“, zerlegt als 1_4_1 mit „1“_QS2_2=“4“_“1“ für 141AS. Funktionell kann die Zahl „14“ als Langform einzeln ausgezählt werden, um den Code der Endzeile zu erreichen. Matrixanteil QS1_2_2_1=“6“. Anschluss Matrixspalte #“1“[61]/#“1“6“1“ mit QS#1_#1+6 =“8“_“1“ als (6+#8)_1=14_1 für 141AS [ATG101 - Autophagie-verwandtes Protein 101 - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein (Mensch) ATG101_ F8VQD9“=190AS verschließt die offene L-Form durch einen Winkel mit der Spalte „19“/[2]“0“ in der Spalte 19_0 für 190AS. Funktionell kann das Protein statt Endzahl 0(Null) mit dem Kunstgriff „Zahl 10“ für „0“ bis in den Code der Endzeile Z.[3822]2#16[1] ziehen, und zwar in der Spalte „0/1/2#16[1]“ mit der Summe 0+1+2+#1+6=10 für „0“ [ATG101 - Autophagie-verwandtes Protein 101 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Fortsetzung „HORMAD1 / HORMAD2“: „Hop1“ ist das „meiotische Chromosomenachsenprotein“ der Bäckerhefe. „HORMA domain-containing protein 1“ (HORMAD1) ist beim Menschen mit Hop1 funktionell vergleichbar [HORMAD1 – Wikipedia]. „HORMAD1“ interagiert mit dem Protein (Mensch) „HORMAD1-Interaktor“=594AS. Dieses besetzt den linken Matrix-Rand, wodurch HORMAT1 bis zum rechten Code-Chromosomen-Rand als Form=7 getrieben wird. HORMAD1-Interaktor“ als QS38+21=“59“_38=QS=2_2=“4“ mit 59_4 für 594AS, wodurch HORMAT1 neben der Ziffer „2“ startet [IHO1 - Interaktor des HORMAD1 Proteins 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „MEI4“=385 AS kann am „HORMAD1-Interaktor“=594AS passend seitlich anlegen und bis zum rechten Rand ziehen als QS2+0+#1=“3“_QS9+#1=10_QS61+7_6+1 mit „3“_Summe 10+61+7+6+1=85 mit 3_85 für 385AS [MEI4 - Meiose-spezifisches Protein MEI4 - Homo sapiens (Mensch) | UniProtKB | UniProt}. Das Protein (Mensch) „HORMAD1“=394AS besitzt im Interaktor keine Vorlage, weil dieser die Zahl „59(4)“ statt „(3)94“ zur Zerlegung verwendet. HORMAD1 liegt in der Spalte Z.[38219]#“16“[17]/Z.[382]“20#1“61“[7]/Z.[38221]#[16]“17“ als QS2+0+#1=“3“_Treppe aufsteigend QS16_61_17=“94“ mit 3_94 für HORMAD1=394AS [HORMAD1 - HORMA-Domänen-enthaltendes Protein 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Treppe erzeugen die lotrechten Anteile 6/6 =66 [=weiblich; Brust=20_QS#16+17=33 (Gewebe)] und 1/1(7)=11 die Summe 66+11=77, wobei inclusive Form=7 die Schwerachse 77+7=“84“ als Chromosomenachse=84 entsteht. Die Spalte „6/6=66“ wird vom Protein (Mensch) „Meiotisches Rekombinationsprotein REC114“=266AS aufgenommen und durch einen Kunstgriff 9+1=10 für „0“ verlängert, um sich ebenfalls neben „HORMAD1-Interaktor“ zu legen, und zwar als „2“_QS0_9+1=10 für „0“_“6_6“ mit QS2_0=“2_66“ für 266AS. Das Protein (Mensch) „HOMAD2“=307AS bildet das gleiche Motiv wie HOMAD1. Zu diesem Zweck erzeugt HOMAD2 die Treppenstufe am Versatz 61[7]/[6]17, indem die Stufe mittels einer Umkreisung dargestellt wird. Das HOMAD2=307AS zerlegt sich in „30_7“, absteigend von Z.[38221#16]“1“7“ als QS1+7_7=15_QS#1+6+1+7=15 mit Summe 15+15=30_ weiter mit Kunstgriff QS9+0+#1=10 für „0“, um rückseitig an die Treppe zu kommen_QS1+6=7 mit „30“_Summe 0+7=“7“ für HOMAD2=307AS. Die Treppe verkörpert reparaturbedürftige DNA-Brüche [HORMAD2 - HORMA domain-containing protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Poly-ADP-Ribose-Polymerasen (PARPs) lockern die Chromatinstruktur auf, damit DNA-Reparatur-Mechanismen eingreifen können. Sofern die Reparatur nicht gelingt, kann PARP Apoptose initiieren [ADP-Ribosylierung - DocCheck Flexikon]. Das Protein (Mensch) „PARP1“=1014AS nimmt die „Treppe“ komplett auf und kann sie mit dem linken membranartigen Matrixrand 3/3/3 verbinden (oder zerstören). Addition der Treppe QS#16+61+17=#94. Protein=920+#94=1014AS zerlegt als 9_20_#94 mit QS3+3+3=“9“_QS8+2+1+9=“20“_“#94“ addiert als Matrix=920+Code#94=1014AS. Für die Serin-ADP-Ribosylierung von Zielproteinen werden Adenosindiphosphat (ADP)=C10H15N5O10P2=60+15+35+80+30=220E und Serin=C3H7NO3=18+7+7+24=56. Diese Kombination lagert sich an die Rückseite der „Treppe“ an, und zwar in der Spalte „220“#1/221#16. ADP=220AS ist lesbar. Serin QS 2+1_0_#1_#1=5_6 für Serin=56. Even a blind chicken stumbles across a grain from time to time! [PARP1 - Poly [ADP-ribose] polymerase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HPF1“=346AS dient PARP1 und PARP2 als Cofaktor, indem es „ADP“ mit einer Spalte „1“/“2“/2 als QS1+2=“3 durchläuft und rechtwinklig durch Serin bis zur Ziffer „6“ zieht als QS2+1+#1=“4“_“6“ mit 3_4_6 für HPF1=346AS [HPF1 - Histone PARylation factor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Caspase 3_CASP3“=277AS leitet den Zelltod (Apoptose) ein, indem PARP1 durch Abbau von Eiweiß (proteolytisch) an einer '216-Asp-|-Gly-217'-Bindung gespalten wird. Bei der Erzeugung der Zahl „77“ wird die Schwerachse=84 in der Spalte 6/6_1/1_7=Form mit dem Anteil 66+11=77 aufgenommen und am linken Code-Rand QS#1+#1=“2“ vorgeschaltet mit 2_77 für 277AS. Die Spaltgrenze Asp –I- Gly beschreibt die Matrix-Code-Grenze mit Asparaginsäure (Asp)=C4H7NO4=24+7+7+32=70E und Glycin (Gly)=C2H5NO2=12+5+7+16=40E. In der Matrix zählt sich die Zahl 60 in der Spalte 19/20/21, vorgelagert Zahl 8+2=10 ergibt Asp=10+60=70E. Glycin liegt am Code-Rand in der Spalte #“1“6“[1]/#“1“6“1“/#“16“[1] mit QS #16_Spalte #1/#1=“11“ Spalte 6/61 mit QS6+6+1=13. Summe 16+11+13=Gly=40E [CASP3 - Caspase-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PARP2“=531AS nimmt die HPF1-Cofaktor-Spalte absteigend als QS2+2+1=“5“ auf und erreicht die Rückseite der „Treppe“ mittels Kunstgriff über die Spalte „9/01“ aufsteigend mit QS9+0+#1=10 für „0“_QS#16+1=17 _Randspalte 7/7 mit QS7+7=“14“ mit „5“_Summe 0+17+14=“31“ für 513AS. Bei einer gelungenen DNA –Reparatur gehört die Randziffer innerhalb der Treppe mit 6/6_1/1_7 =66+11+7=84 zur Schwerachse=84. Anderenfalls läuft PARP2 absteigend alternativ durch die Treppenstufen mit QS1+6=7_QS#1+6=7 und „5“_Summe 0_17_7+7=“31“ für 531AS. Eine Schwerachse kann nicht gebildet werden und am Ende entsteht mit QS1+6=7_6 =76AS=Ubiquitin als Protein-Abbau-Signal [PARP2 - Poly [ADP-Ribose]-Polymerase - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Meiotische DNA-Doppelstrangbrüchen (DSBs)“ werden unverzüglich repariert, wobei ein „Mre11-Rad50-Xrs2“-Komplex beteiligt ist. Das Protein (Mensch) „MRE11_ P49959“=708AS mit dem Cofaktor „Mangan“=25E lenkt dabei die Aufmerksamkeit auf die Matrix-Code-Grenze. „MRE11“ liegt in der Spalte Z.[38]“2“19“#“16“[17]/Z.[38]“220#1“[617]/Z.[38221]#“1“[617] als QS#1+6=“7“_Kunstgriff QS1+9=10 für „0“_Spalte 2/220#1/1 mit QS2_2+2+#1_#1=“8“ mit 7_0_8 für 708AS. Mangan=25 als Spalte 2/220#1 mit „2“_QS2+2+0+1=“5“ für 25E. Zu den „DNA-Reparaturproteinen“ nach DNA-Doppelstrangbrüchen (DSBs) gehört das Protein (Mensch) „RAD50_Q92878“=1312AS mit dem Cofaktor „Zink“=30E in der Spalte Z.“382“1“9/ Z.[382]“2“[0] als Spaltzahl 38=QS=11_Spalt „1“+1(Rest)_2 als „1_3“_ weiter Spalt 1/2 mit „1_2“ mit 1_3_1_2 für 1312AS. Die Reparatur zielt darauf ab, den rechten Matrixrand zu markieren, wozu Zink=QS21+9=30 benutzt wird. Ein anderes RAD50-Protein legt sich gegenüber von der Code-Seite an den linken Code-Rand, so dass gemeinsam eine Achse gezogen wird. Rechter Matrix-Rand Protein QS38+21+2=61/ Linker Code-Rand=#16+#1+6=23, Summe 61+23=Schwerachse=84 [RAD50 - DNA-Reparaturprotein RAD50 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „RAD50_H7C0V2“=157AS liegt in der Spalte Z.[38219]#“1“6“1“7“/ Z.38220#“1“6“[17] als QS#1+6+1+7=15_QS#1+6=7 mit 15_7 für 157AS [RAD50 - RAD50 Doppelstrangbruch-Reparaturprotein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „NIBRIN_NBN“=754AS ist Bestandteil des MRN-Komplexes [MRE11-RAD50-NBN]. „NBN“ modulieren die Erkennung des Schadenssignals an Schadstellen und rekrutieren und aktivieren dort Proteine. Die Schwerachse 6/“6_1“/1_7 als QS66_11_7=84 ergibt eine Treppenstufe, wenn ein Protein statt der Trennung „6-1“ eine Zahl „61“ erkennt. „Nibrin“ nähert sich der potentziellen Bruchstelle von beiden Seiten, so dass eine Schadensstelle erkannt wird. Das NIBRIN=754 AS wird zerlegt in 7_54=7_18_18_18, so dass sich 3 Zeilen um die Matrix-Code–Grenze positionieren und mit einem angehängten „Schwanz“ „1/1“ die Trennstelle „6-1“ aufreißen. NIBRIN startet am rechten Zeilenrand Z.[382]“20#16“17“ als „7“_absteigend in Spalte 1617/161“7“ mit QS#16+1+1=18_aufsteigend QS2+0+#16=18 als Verzahnung, aufsteigend in Z.[3822]1#161[7] als QS1+16+1=18. Mit „7“_Summe 18+18+18=7_54 für 754AS.
Geschlechtsmerkmale „33/66“:. Männlich=33 wird stets am Zahlen als 3*(38=QS=11)=33 oder doppelt als Randspalte „3/3/3/3“. Aufgrund der Doppeldeutigkeit kann der Matrixrand alternativ die Plazenta als Gewebe darstellen, was dann männlich=33 ausschließt. Die „Eizelle“ darf ihre Munition nicht voreilig verschießen, sondern muss auf das Ereignis einer Befruchtung während einer zeitlichen Pause vorbereitet sein. In der „Eizelle“ liegt der Typ „Cohesin B3“ vor. Das Protein (Mensch) „F-Box Protein 43 (EMI2)“=36AS interagiert mit dem Protein "Cohesin B3“. Bei dieser extrem kurzen Länge wird zweckmäßig die Zeitbasis=24 als „Eier-Uhr“ für die Pause beachtet. Für die schnelle Reaktion muss die Zeitbasis „60“ erst noch entdeckt werden. Die Zahl „24“ kann durch den Code-Rand 3*(QS1+6+1)=24 dargestellt werden, so dass der Matrixanteil 36-24=12 als Spalte 0/1/2 verbleibt. Short-EMI2=“36“ als 1_2 für „12“# 3*(QS1+6+1)=24 mit Summe 12#24=36 für 36AS [FBXO43 - F-Box-Protein 43 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Reale Funktion: Mitglieder der Familie der F-Box-Proteine, wie z. B. FBXO43, zeichnen sich durch ein etwa 40 Aminosäuren umfassendes F-Box-Motiv aus. F-Box-Proteine fungieren als Protein-Ubiquitin-Ligasen. F-Box-Proteine interagieren mit SKP1 über die F-Box und sie interagieren mit Ubiquitinierungszielen über andere Protein-Interaktionsdomänen. [FBXO43 F-box protein 43 [Homo sapiens (Mensch)] - Gen - NCBI (nih.gov)]. In der Version Long-Alpha-EMI2=“36“ wird die Chromosomen-Code-Spalte 4*“7“=28=QS2+8=10 für „0“ ohne Wertänderung angelagert. In der Version Long-Beta-EMI2=“36“ wird in Gegenrichtung der linke Matrixrand angesteuert, und zwar in der Spalte Z.“382“19“#[161]“7“/Z.“382“2“0“#[161]“7“/Z.“382“[2]“1“#[161]“7“/Z.“382“22“#“161“. Start am rechten Matrix-Rand mit der Ziffer „1“ zentral in der Spalte [19]/“2“0“/[2]“1“ mit QS1+0=1_2 gezählt für „12“. Die Zahl 19 als 1. Pause QS1+9=10 für „0“. Der linke Matrixrand als Spalte Z.“3“(82)/Z.“3“(82)/Z.“3“(82)/Z.“3“(82) liefert nochmals 4*“3“=12, wobei mit QS8+2=10 für „0“ die 2. bis 5. Pause direkt angelagert ist. In Ringform wird in der Zeile Z.“3“82“22“#“161“(7) mit QS2+2+#1+6+1=“12“ fortgesetzt. Die Summe 12+12+12=“36“ für 36AS liegt zwar vor, es wird aber noch die 6. Pause mit der Chromosomenspalte 4*“7“=28=QS=10 für „0“ angeschlossen. Der Code liegt neben dem kreisförmigen Matrix-Ring als gespiegelte L-Form, die mit 3*QS1+6+1)=24 die Zeitbasis 24 aufnimmt und zum rechten Matrixrand abgrenzt. Mögliches Funktionsprinzip: Legt sich das Protein Cyclin B3=163AS auf diese Zeitbasis=24, kann Long-Beta=36AS nicht in die Kurzversion Short-EMI2=36AS wechseln, um den Pausen-Modus zu beenden. Die 6 Pausen sind erforderlich, um mit 6*10=60 die Zeitbasis=60 zu erzeugen. Hierfür muss ständig zwischen Matrix und Code zwecks Addition gesprungen werden. In der Matrix wird die Zahl „2“ im Ring eingeschlossen. Wird ein Protein in diese Öffnung eingefädelt, wird es beim Switch auf Short-EMI2=36AS abgeschnitten. Ubiquitin=76AS liegt als Ligase in der Randspalte Z.38/Z.38 mit QS38+38=76AS. Bei der Interaktion von EMI2 mit dem Protein (Mensch) SKP1=163AS. wird der offene, gespiegelte L-Winkel mit einem Winkel verschlossen, so dass die Spalte „61/61“ eingeschlossen wird. SKP1=163AS wird zerlegt mit Spalte #1/_QS#1/#1=2_61=1_63 für 163AS [SKP1 - S-phase kinase-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Eizelle benötigt 2 Entwicklungspausen. In der 1. Pause kann die Eizelle wachsen und Nährstoffe aufnehmen. In der 2. Pause wartet die gereifte Eizelle auf ihre Befruchtung. EMI2 muss in ausreichender Menge vorliegen, damit die Reifeteilung pausiert. Während der Meiose I wird EMI2 unter einem kritischen Grenzwert gehalten, damit die Pause nicht zu früh eintritt. Am Ende der Meiose1 wird dann Cyclin B3 selbst abgebaut, so dass EMI2 ansteigen kann [Im richtigen Moment pausiert (uni-konstanz.de); Bouftas et al. (2022) Cyclin B3 implements timely vertebrate oocyte arrest for fertilization. Developmental Cell; DOI: https://doi.org/10.1016/j.devcel.2022.09.005]. Cyclin B3=27AS ist so kurz, das es sich in der Matrix QS2+1=3 und absteigend zur Zeile Z.[38219]#“161“ mit dem Codeanteil 3*QS1+6+1)=24 mit 3_24=QS3+24=27AS formieren muss. Erst wenn Cyclin B3 reduziert wird, kann EMI2 in der Long-Version Pausen gestalten. Die Zeitbais „24“ dient als Steuerungselement [CCNB3 - Cyclin B3 - Homo sapiens (Mensch) | Feature-Viewer | UniProtKB | UniProt]. Das Protein (Mensch) „CCNB3“=1395AS ist zwar dem Cyclin B3 ähnlich, enthält aber selbst eine Pause in der Zählung in der Spalte Z.38219#1617/ Z.38219#1617/ Z.38219#1617/ Z.38219#1617/ als 1. Matrixanteil „1“_QS2+0_1=“3“ mit 1_3 für „13“. Codeanteil in Spalte #“1“6“1“[7]/#“1“[6]“1“[7]/#“1“[6]“1“[7]/#“1“6“1“[7]_Summe=“5“ aus Rest Codeziffer #“1“ und Anschluss 2. Matrixanteil QS2+2=“4“. Im Code-Ring wird die Spalte „6/6“ eingeschlossen. Insgesamt „13“_“9“_(QS0 (Pause)+5=)“5“=13_95 für 1395AS [cDNA FLJ77187, highly similar to Homo sapiens cyclin B3 (CCNB3), transcript variant 3, mRNA - Homo sapiens (Human) | UniProtKB | UniProt].
Kinesin: Zur Funktion des Spindelapparates wird das Motorprotein „Dynein“ benötigt. In den Voräufenzellen der Eizellen (Oozyte) ist beim Menschen vergleichsweise zu Säugetieren ein Mangel bei Motorprotein Kinesin, und in der Version vom „KIFC1“-Gen festzustellen. Dieser Mangel führt zu einer instabilen Spindel. Entsteht dadurch ein Mangel oder ein Überschuss an Chromosomen, sind Fehlgeburten oder Erkrankungen (Down Syndrom u.a.) die Folge. Bei der Befruchtung vereinigen sich die Erbinformationen (DNA), wobei Spermium und Eizelle je 1 Kopie der 23 Chromosomen mit der DNA für den vollständigen Chromosomensatz aus 23 Paaren (46 Chromosome). Eines dieser 23 Chromosomenpaare bestimmt das Geschlecht, das bei Frauen aus zwei X- und bei Männern aus einem X- und einem Y-Chromosom besteht. Das Kinesin wird als Motor benötigt, der die Spindel stabilisiert und die Chromosomen während der Zellteilung trennt [Ein fehlender „Motor“ lässt unsere Eizellen versagen | Max-Planck-Gesellschaft (mpg.de)]. Das Kinesin besteht aus 2 schweren und 2 leichten Proteinketten [Kinesin – Wikipedia]. Das Kinesin laüft auf den röhrenförmigen Fasern der Spindelapparates entlang, wobei die Schritte durch den Wechsel von Adenosintriphosphat (ATP)= C10H16N5O13P3=60+16+35+104+45=260E und Adenosindiphosphat (ADP)=C10H15N5O10P2=60+15+35+80+30=220E. Kinesin wandelt chemische Energie in Form von „ATP“ in mechanische Energie um, wodurch Lasten transportiert werden können. Die Schrittweite von 8 nm „Tubulinheterodimer“ der Mikrotubuli als Wegstrecke bestimmt, und ist somit auch als die ATP-Strecke „38=QS2_2_2_2_0=8nm zählbar. In der Spalte Z.38219#1617/Z.38“220“#1617 ist ADP=220E direkt lesbar. ADP ist im Pfad von ATP enthalten, kann aber in 2 Varianten beginnen. Var.1: 38=QS=“2“_QS2_2+2=“6“_“0“ / Var.2: 38=QS=“2“_Summe 38=QS=2_2+2=“6“_“0“ für 260E. Die Variante 2 ist mit dem Zwischenschritt 38=QS=11=QS=2 langsamer als die direkte Ziffer „2“. In einem "Hand-über-Hand"-Mechanismus treten die Kinesinköpfe aneinander vorbei und wechseln die Führungsposition. So wird in jedem Schritt der führende Kopf zum nachlaufenden Kopf, während der nachlaufende Kopf zum führenden Kopf wird [https://en.wikipedia.org/wiki/Kinesin]. Die Beobachtung der Bewegung erweckt den Eindruck, dass sich die beiden Füße rechtsdrehend nach vorn bewegen, wodurch auch ein Wechsel der beiden Varianten erfolgt. Der Kreis ist als Summe 38=QS=2_2_38=QS=2 mit „6“_QS2+2=“4“ für Kreiselbewegung=“64“. Jeder 2. Schritt wird zum Problem, wenn ohne die potentielle Zählgröße „38“ die Summe „6“ aus der Spalte „2/220“ gelesen wird, weil im Code mit QS1+6+1+7=Phosphor=15 mit QS1+5=“6“ insgesamt 38=QS=11 (Zählgröße)_weiblich=“66“ erzeugt wird. Wenn ein „Kinesin“ nicht in diese Richtung gezählt wird, sondern gespiegelt, entsteht 1 Problem: Protein (Mensch) „Kinesin _KIFC1_A0A087X1W5“=154AS in Z.38220#1617 gespiegelt mit Code QS1+6+1+0=15_Matrix QS QS2+2=“4“ als 15_4 für 154AS mit dem Ligand: „ATP-Bindung“ [KIFC1 - Kinesin family member C1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation, Protein (Mensch) „Kinesin _KIFC1_A0A024RCS7“=673AS verschlingt das ATP, so dass es vollgestopft und bewegungsarm erscheint in der Spalte Z.“38“2“[1]“9“#“1“61“[7]/Z.[38]“2“2“0“#[1617] als Summe „6“ aus „38=QS=2_2_2“_Spalte [1]9/20 als QS9+0+2=“11“_Code QS#1+61=62. Insgesamt 6_QS11+#62=73 mit 6_73 für 673AS [KIFC1 - Kinesin-ähnliches Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Vergleich: Beim Protein (Mensch) „Kinesin 1_schwere Kette_KIF5B“=963AS in der Spalte [1]“9“#“1“[617]/20#161[7] als 9_QS1_1_61=63 legt sich das Protein direkt seitlich an das „ADP“ an [KIF5B - Kinesin-1 heavy chain - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „Kinesin 1_leichte Kette_KLC1“=573AS verwendet von ATP=260E nur den Anteil „Calcium=20“ als Ligand in der Spalte Z.38219#“161“[7] mit QS#1+61=#62_Spalte [21]“9“/[2]“20“/“221“ als QS9+2+0=“11“_QS2+2+1=“5“. Insgesamt „5“_QS11+#62=“73“ mit 5_73 für 573AS [KLC1 - Kinesin light chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]._dat16.07.2023
Sehpigmente (Opsine): Vor der Schlusszeile des Claustrum-Eingangsportals tummeln sich „Opsine“, um das Sehen zu vermitteln. Erst nachfolgend können die Seheindrücke auf elektrischem Wege über das Nervensystem verarbeitet und vor Veränderungen geschützt werden (Speicherung). „Opsine“ sind lichtabsorbierende Moleküle in der Netzhaut (Retina) des Auges. Im Unterschied zur Zellteilung mit der Verwendung ATP/ADP sind am biochemischen Prozess des Sehens das Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E und das Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E mittels G-Protein „Transducin“ der Retina-Photorezeptoren beteiligt. „Im Ruhezustand ist „Transducin“ an Guanosindiphosphat (GDP) gebunden. Durch einen Lichtreiz wird GDP durch Guanosintriphosphat (GTP) ausgetauscht, das sich mitsamt der α-Untereinheit löst und eine Phosphodiesterase aktiviert. Dieser Vorgang verbraucht „1“ Molekül „GTP“ [Transducin - DocCheck Flexikon]. Die aktivierte Phosphodiesterase spaltet in den Sehzellen (Stäbchen / Zapfen) das „Cyclische Guanosinmonophosphat (cGMP)“=C10H12N5O7P=60+12+35+56+15=178 zu Guanosinmonophosphat (GMP)=C10H14N5O8P=60+14+35+64+15=188E. Schließlich regeneriert sich „Transducin“ durch Hydrolyse des „GTP“ in „GDP“. „GTP“=268E enthält einen Zähl-Bezug zu Eisen=26, so dass es sich wie der Eisen-Schwefel-Komplex der DNA in der Code-Serien-Spalte Z.[38219]#“1“6“17“/#“1“[617] als QS#1+#1=2_6_QS1+7=8 [oder „2“_QS61+7=“68“] mit 2_6_8 für GTP=268E darstellt. Für „GDP“=228E wird die Randspalte Z.[38219]#“16“[17]/#[1]“6“1“7“] als QS16_6=“22“_QS1+7=“8“ mit 22_8 für GDP=228E gezählt. Das geometrische Augen-Funktionsmodell zieht sich in der Serie Z.382xx mit 38=QS=11 für die Stäbchen / Zapfen=11 kombiniert mit der Ziffer 2 als Sehnerv=2 durch. Die Z.-Nr.-Matrix durchzieht eine 8er-Matrix-Spalte, die auch im Code als 1+6+1=“8 oder 1+7=“8“ vorhanden ist. Über diesen Abstand kann eine Welle laufen, die mit 8*8=64 einen Bezug zum Kreis=Welle=64 enthält. Die Grenzmauer „Z.38222“ ist dann ein Bildschirm. Das Protein (Mensch) „Phosphodiesterase (PDE) 11A“=933AS findet zur Orientierung am rechten Matrix-Rand in der Spalte „1/2“ den Cofaktor „Magnesium=12 (oder Mangan=25). „PDE11A“ liegt in der Spalte Z.[3]“82“1“[9]/Z.“38“[2]“2“[0] als Summe 38=QS=“11“_“82“= 11+82=“93“_QS1_2=“3“ mit 93_3 für 933AS [PDE11A - Dual 3',5'-cyclic-AMP and -GMP phosphodiesterase 11A - Homo sapiens (Human) | UniProtKB | UniProt]. Das „cGMP)“=178E liegt in Linksdrehung zweizeilig in der Codespalte #“161[7]/#[16]“17“ als 17_QS1+6+1=8 mit 17_8 für 178E. Das GMP=188E liegt in Rechtsdrehung zweizeilig in der Codespalte #“161“[7]/#“1“[6]“17“ als 1_QS1+6+1=8 _QS1+7=8 mit 18_8 für 188E. _[GDP geändert 11.09.2023].
Transducin: An „GDP“ bindet beispielsweise das Protein (Mensch) „Transducin_Alpha_Q16162“=27AS (Protein der Zapfen-Transducin-Alp]ha-Untereinheit) am Code-Rand Z.[38220]#[16]“1“[7]/Z.[38221]#“16“1“[7] in der Spalte [#16]“1“[7]/“16“1“[7] als QS1_1=2_QS#1+6=7 für 27AS [Zapfen-Transducin-Alpha-Untereinheit - Zapfen-Transducin-Alpha-Untereinheit Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Transducin_Beta_C9J5F9“=79AS liegt mit einem Matrixanteil „1“ in der Spalte Z.[38220]#[1]“61“[7]/Z.[3822]“1“#“161“[7] als QS6+1=7_QS1+#1+6+1=9 für 79AS [TBL1X - Transducin beta like 1 X-linked - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Transducin_Beta_ähnlich_Q12788“=808AS dient anderen Zwecken. Es ist Vorläufer einer ribsomalen Untereinheit und dient zur RNA-Faltung, Modifikationen, Umlagerungen und Spaltung sowie zum gezielten Abbau der prä-ribosomalen RNA durch das RNA-Exosom. Das Protein durchläuft das „GTP“ mit Start am rechten Coderand QS1+7=“8“, verlängert den Pfad über Kunstgriff QS#1+6_0#1_1#1=10 für „Ziffer „0“ als Schleife über die Matrix zurück in den Code, um dort eine Code-Ziffer „6“ ringförmig mit QS6+1_1=“8“ einzuschließen, und zwar in der Spalte Z.[38219]#“1“6“17“/ Z.[3822]“0“#“1“[6]“1“[7]/Z.[3822]“1“#“1“6“1“[7] mit 8_0_8 für 808AS [TBL3 - Transducin beta-like protein 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Opsine für das Dämmerungssehen mittels Stäbchen in der Netzhaut:
Das Opsin für die Lichtsinneszellen zum Hell-Dunkel-Sehen vom Typ „Stäbchen“ ist der Sehfarbstoff „Scotopsin (Skotopsin)“ als spezielles Opsin-Protein. Details liegen hier nicht vor. Die AS-Kette von „Scotopsin“ überspannt die Zellmembran siebenmal. Die 7-Helix-Rezeptoren gehören zum „G-Protein-gekoppelten Rezeptor (GPCR)“ [https://www.sas.upenn.edu/~ghazwaa/507/whatisrhodopsin.html]. Charakteristisch für G-Protein-gekoppelte Rezeptoren sind die stets vorhandenen „7“ Transmembrandomänen. Eine Transmembrandomäne besteht aus ca. 20 Aminosäuren, die jeweils zu einer α-Helix angeordnet sind [G-Protein-gekoppelter Rezeptor - DocCheck Flexikon]. Es handelt sich um eine Endlosschleife, die mit einem Zähler in der Spalte „#1_(617)/#1“ nach 6+1=7 Runden _7=Form einen Ausgang findet. Eine Zellmembran liegt mit #1617 als QS16+17=Membran=33 vor. Die vielen Runden müssen mit dem Kunstgriff „10“ für „0“ gedreht werden, weil eine Zwickmühle im Spiel [Nine Man Morris] in Zeile 191 und Spalte 901 die Zahl „10“ auf „3“ Wegen summiert. Beim Protein (Mensch) „GPR39“=453AS ist diese Schleife vorhanden als 38=QS=2_38=QS=2 mit Summe 2+2=“4“_QS2+2+0_Spalte 0/1 mit 1=“5“_QS Spalte #1+#1+#1=“3“ mit 4_5_3 für „GPR39“=453AS. Das Protein kann nunmehr zuzätzlich mit dem Kunstgriff „9+0+1=10“ für „0“ in den „Kurzschluss-Kreis“ über die Codespalte #1+#1#1=“3“ eintreten und darin insgesamt „7“ Runden *“#3“= 21 zählen. Die Zahl 21 steht in Z.38“21“9#1617 links neben der Zwickmühle als Ausgang bereit. „Zink=30“ wird hier als Agonist bezeichnet, weil es den Code über 2 Zeilen „2*(QS1+6+7)=30“ besetzt und doppelt in der Matrix als Zeile QS“21“+9=30 und Spalte QS9+0+“21“=30 mit der Zahl „21“ zählbar ist, so dass es als Gegenspieler wirkt. Wenn der Ausstieg bei „21“ erfolgt können jeweils 20AS in der Transmembran-Domäne in 1 Lage verlegt werden (Zahl „20“ ist vorhanden). Die Zahl „21“ ist doppelt mit der Kunstgriff-Zwickmühle verbunden und mit 2“1#1“ an eine Zählgröße „11“ gekoppelt [GPR39 - G-Protein-gekoppelter Rezeptor 39 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Dieses Prinzip wird vom Protein (Mensch) „G-Protein_Q9Y653_AGRG1“=693AS als 38=QS_2+2+0=“6“_“9“_QS#1+#1_#1=“3“ mit 6_9_3 für 693AS bestätigt. Das Protein steigt in die Zwickmühle über die Spalte 9/0/1 ein. Der Ligand „COL3A1_Kollagen-Alpha-1(III)-Kette“=1466AS füllt den Code komplett aus, und zwar absteigend als QS#1+6_#1+6=“14“_QS#1+6=7_QS17+17+17=51 mit „14“_Summe=7+51=66 für COL3A1=1466AS [COL3A1 - Collagen alpha-1(III) chain - Homo sapiens (Human) | UniProtKB | UniProt]. Bindung von Heparin= C26H41NO34S4=156+41+7+272+64=540E [Heparin | 9005-49-6 (chemicalbook.com)]. „Heparin“ liegt im Zählweg mit QS#1_#1_1+2=5_QS20_19+#1=40 mit 5_40 für Heparin=540E [ADGRG1 - Adhesion G-protein coupled receptor G1 - Homo sapiens (Human) | UniProtKB | UniProt ]. Das Protein (Mensch) „G-Protein_ Q8IZP9_ADGRG2“=1017AS läuft nicht im Kurzschlusskreis, sondern bildet vierzeilig einen kompakten Stapel von 7 Kunstgriffen 10 für „0“, der die Zahl „20 (AS)“ ringförmig umklammert. Das Protein ist mangelhaft, weil das letzte 10er Packet, durch eine Code-Spalte „6/6/6/6“ getrennt, unzugänglich seitlich liegt. Das Protein ist in 2 Teile zerlegt „1“_“000000“_„017“. Als Orphan-Rezeptor ist das Protein auf Partnersuche. Das Orphan-Arzneimittel „Carglumsäure“=C6H10N2O5=36+10+14+40=“100“E würde in diesem Fall eine Verbindung herstellen. Die linke Matrixspalte „3/3/3/3“ wird nicht belegt, sie dient dem Protein als Bezug zur männlichen Fruchtbarkeit „33“ (weil weiblich „66“ geklammert ist). Erster Proteinanteil #“1“_QS1+9=10_Spalte [Z.3]82/[Z.3]82/[Z.3]82/[Z.3]82 mit 4-fach QS=10_QS2+2+#1_2+1+#1_#1=10 (6. Kunstgriff 10 für „0“). Der nicht angeschlossene rechte Code-Rand bildet das letzte 10er Paket in der Spalte „17“/“1“[7]/“1“[7]/“1“7“ als QS7+1+1+1=10 mit „0_17“ für („1“_Anschluss fehlt)_“017“. Funktion: Orphan-Rezeptor. Könnte an einem Signaltransduktionsweg beteiligt sein, der die Nebenhodenfunktion und die männliche Fruchtbarkeit steuert. Kann den Flüssigkeitsaustausch innerhalb der Nebenhoden regulieren [ADGRG2 - Adhesion G-protein coupled receptor G2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein „Scotopsin“ wandelt Lichtreize in elektrische Erregungen um, so dass bei schwachem Licht das skotopische Sehen ermöglicht wird [Skotopsin – Wikipedia]. Das Protein „Scotopsin“ bildet gemeinsam mit 11-cis-Retinal das Chromophor (Pigment) „Rhodopsin“ [Scotopsin - DocCheck Flexikon]. Einfallendes Licht (Photon) führt zur Isomerisierung des an „Scotopsin“ gebundenen „11-cis-Retinal“ zum „all-trans-Retinal“. Die Signalkaskade bewirkt eine Schließung von Na+ -Kanälen, so dass ein Aktionspotenzial zu einem Seheindruck führt. Das „all-trans-Retinal“ wird nach Freigabe durch das „Skotopsin“ zum all-trans-Retinol reduziert und mittels IRBP (interstitial retinoid binding protein) zum „retinalen Pigmentepithel (RPE)“ transportiert, wo es über mehrere Zwischenschritte wieder zum 11- cis-Retinal umgewandelt wird. Nach Rücktransport zum Photorezeptor steht es wieder für den visuellen Zyklus zu Verfügung“ [Neuroprotektive und neuroregenerative Eigenschaften von Norrin.pdf (uni-regensburg.de); C. Eimer, Diss. 2021; Uni Regensburg]. In den Stäbchen aktiviert das lichtaktivierte „Rhodopsin“ das G-Protein „Transducin“, wodurch eine Reaktionskaskade ausgelöst wird. Am Endpunkt wird ein elektrisches Signal über Nervenzellen an das Gehirn weitergeleitet. Es wird ein Schwarz-Weiß-Bild erkannt. Mikrobielle Rhodopsine sind in der Zellmembran lokalisiert. Das Rhodopsin-Absorptionsmaximum liegt bei einer Wellenlänge=500 nm [Rhodopsin – Wikipedia]. Das Protein (Mensch) „Rhodopsin“=348AS ist ein Photorezeptor für bildgebendes Sehen bei geringer Lichtintensität. Im Rodopsin wird das inaktive „11-cis-Retinal“=C20H28O=120+28+8=156E bei Lichteinfall in All-trans-Retinal überführt, wodurch das Rhodopsin aktiviert wird [RHO - Rhodopsin - Homo sapiens (Human) | UniProtKB | UniProt]. „All-trans-Retinal“ liegt in der Zeile Z.“38“2“1“9“#“1“6“[17] mit Z.38=QS=2+2+1=“5_QS9+#1=10_6 [17/7] als Summe 5+10=“15“_“6“ für „All-trans-Retinal“=156E. Wegen der Konformationsänderung gehört die Ziffer „6“ gleichzeitig zum „11-cis-Retinal“=156E, das sich spiegelbildlich in den Code-Rand zieht als „6“_Spalte 17/7 mit QS1+7_7=15 mit 15_6 für „11-cis-Retinal“=156E, und zwar in der Spalte Z.[38220#1]“6“1“7“/ Z.[38221#161]“7“. Für beide Anteile nimmt das Protein (Mensch) „Retinoid isomerohydrolase“=533AS die gesamte Zeile auf, und zwar als 38=QS2+2+1=5_Kunstgriff QS9+1=10 für „0“ mit Summe 5+0=“5“_QS16+17=“33“ als 5_33 für 533AS. Funktion [RPE65 - Retinoid isomerohydrolase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Lecithin retinol acyltransferase_LRAT“=230AS liefert „all-trans-Retinylestersubstrate“ für die Isomerohydrolase. Lecithin=C42H80NO8P=336+80+7+64+15=502E [Lecithine | 8002-43-5 (chemicalbook.com)] und „LRAT“ überschneiden sich und bilden gemeinsam eine Matrix-Code-Grenze. „LRAT“ füllt die Spalte 19/20/21 als QS21_0+2=“23“_QS1+9=10 für „0“ mit 23_0 für LRAT=230AS [LRAT - Lecithin retinol acyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Lecithin=502E liegt in der Spalte Z.“38“2“1“9#1“[617]/#“1“[617]/#“1“[617] als 38=QS=2_2+1=“5“_QS9+#1=10 für „0“_QS#1_#1=2 mit 5_0_2 für 502E.
Weil All-trans-Retinal die Zeile Z.38219 bereits besetzt, folgt Rhodopsin=348AS spiegelbildlich in der Spalte Z.[3]“8“2“2“0“#“1“[617]/Z.[3822]“1“#“1“[617], um „Transducin“ im Code zu binden, und zwar als „8“_QS2+2+0=4_QS1+#1_#1=“3“ mit 8_4_3 für 348AS. Die korrekte Zählrichtung wird mit dem Durchlauf der Lichtwellenlänge 500 nm gelesen. Die beiden Nullen entstehen nicht durch einen doppelten Kunstgriff 10 für „0“ in der Spalte 82/82=QS8+2=10/QS8+2=10 mit für „00“. Die Wellenlänge beginnt dreizeilig in der Code-Rand-Spalte [#1]/#1/#1 als Z.[3]“82“[19#1617]/Z.[3]“82“2“0“#“1“[617] Z.[3822]“1“#“1“[617] als QS aufsteigend #1¬_1+#1=“3“_absteigend QS 2+0=2 mit Summe=3+2=“5“_Kunstgriff mit Spalte 82/82=QS=10/QS=10 für „00“ mit „5_00“ für Wellenlänge 500 nm. Am Matrix-Rand kann an der unbesetzten Spalte 3/3 eine Membran=33 binden. Der linke Matrix-Rand ist der Bezug für das Symbol „Kreis=Welle=64“ als QS38+2=40+20=“60“ mit Spalte [9]#“1“/“0“#“1“/“1“#1“=QS=4 für Summe 60+4=Welle=64.
All-trans-Retinal entsteht bei Licht¬einwirkung aus 11-cis-Retinal, in dem eine Doppel¬bindung im 11-cis-Retinal neu aus¬gerichtet wird.¬ Das „All-trans-Retinal“ löst sich aus dem Rhodopsin, wodurch der Transducin-GDP-Komplex aktiviert wird. Das „All-trans-Retinal“ kann kein weiteres Lichtquant zu absorbieren. Es wird in die Pigmentzellen transportiert und zunächst von All-trans-Retinal zu All-trans-Retinol=C20H30O=120+30+8=158E reduziert. Nach Isomerisie¬rung ent¬steht dann 11-cis-Retinol=C20H30O=158E, wel¬ches dann durch Oxidati-on zu 11-cis-Retinal um¬gewandelt wird [Pschyrembel Online | all-trans-Retinal]. „All-trans-Retinal“ wird wegen gleicher Summenformel auch synonym für „11-cis-Retinal“ verwendet, unterschiedlich ist die räumliche Anordnung einer „cis-trans-Isomerie“.
Bei der Strukturänderung von 11-cis-Retinal zu All-trans-Retinal wird etwas Lichtenergie aufgenommen und binnen 1 ps=1*10^-12 Sek eine Drehung vollzogen. Am rechten Rand Z.38219#_15[8]/#_4(34) liegt mit QS1+5=6_4 ein Kreis=64_QS3+4=Form=7 für eine Drehung. In der Spalte Z.38221#_70527777“51“14/#_70104708“91“80 folgt eine Zeitbasis 60 in der Spalte 51/91 als QS5+1=6_QS9+1=10 für „0“ mit 6_0 als Zeitbasis=60. Links folgt die Zahl „4708“ als QS4+7=11=QS2_0_8 mit Summe 2+0+8=“10“ als Basiszahl „10“ für einen Zeilfaktor „10^-12“. Der Faktor ist rechts von der Spalte 0/0 negativ. Für den Rückfall nach der Drehung folgt in der Spalte 52/10 einerseits die Zeitbasis 60 als QS5+1=6_0 für Zeitbasis=60 und andererseits die Zahl 12 als QS10_2=12 als Potenz der Zeitspanne für die Retinal-Drehung innerhalb des umgebenden Proteins von 1 Pikosekunde=1*10^-12 [Villigen: PSI-Forschende entschlüsseln Mechanismus hinter Sehen (aargauerzeitung.ch); Ultrafast structural changes direct the first molecular events of vision | Nature (www-nature-com.translate.goog); V. Panneels u.a.; Mar 2023; doi: 10.1038/s41586-023-05863-6]_ergänzt_dat17.09.2023
Retinol (Vitamin A) ist in Nahrungsmitteln enthalten und erhält die gute Sicht bei Nacht. Eine zu hohe Dosis ist toxisch (Haarausfall, Knochenabbau etc.). Für das Farbsehen muss eine präzise Anschluss-Spalte (#1/#1/#1) für das „11-cis-Retinal“ kreiert werden. Hierfür müssen „Beta-Carotinoide“ aus rötlich gefärbten Pflanzen (wie „Mohrrüben“) aufgenommen werden, damit der Mensch schadlos das Vitamin A selbst erzeugt. Mittels Enzym „Carotin-15“ werden Beta-Carotinoide zu „2“ „all-trans-Retinalmolekülen“ gespalten, d.h. beim Spalten entsteht nicht die Hälfte, sondern das Doppelte. Es muss daher mit „2“ * (all-trans-Retinal =156E)=312E codiert werden. Das Protein (Mensch) „Carotin-15_Q9HAY6 • BCDO1“=547E katalysiert „all-trans-Beta-Carotin + O2 = „2“ all-trans-Retinal“ mit dem Cofaktor „Eisen Fe^2+=26E“. Das Protein liegt in der Spalte Z.[382]“1“[9]#“1“61“[7]/ Z.[382]“2“[0]#“1“[617]/Z.[382]“2“1#1“[617] in der Spalte 1/2/2 mit QS1+2+2=“5“_Summe Spaltzahl „1#1“=QS=2_#1+1 mit 2+1+1=“4“_QS1+6=“7“. Insgesamt mit 5_4_7 für „Carotin--5“=547AS. Darin liegt der Cofaktor Eisen=“26“ in der Randspalte #16/#1 als QS#1+#1=2_6 für Fe=26 [BCO1 - Beta,Beta-Carotin-15,15'-Dioxygenase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Katalyseprodukt=312E läuft im Enzym-Pfad im rechten Winkel, um eine Anschlussspalte in den Code zu legen, und zwar als QS#1+#1#+#1=#3_1_2 für „zwei All-trans-Retinalmoleküle=2*156=312E. „Retinal“ ist das „Chromophor“ des lichtempfindlichen Proteins „Opsin“. Es ist kovalent als Imin an einen Lysinrest gebunden und bildet dann „Rhodopsin“. [Retinal – Wikipedia]. Lysin=80E liegt in der Code-Serien-Spalte #“1“61“[7]/#“1“[6]“17“ als QS#1_#1_61_17=80E vor. Der Begriff „Opsin“ bezeichnet im englischen Sprachraum das gesamte Sehpigment, ansonsten bezeichnet „Opsin“ nur den „Proteinanteil“ ohne „Chromophor“. Das „Farbsehen“ mittels der „Zapfen“ erfordert die Verbindung mit dem „Chromophor“, für das „Schwarz-Weiß-Sehen“ in der Dämmerung mittels der „Stäbchen“ reicht der Proteinanteil aus. Die linke Matrix-Randspalte „38=QS=11“ gilt somit für Zapfen und Stäbchen, bei den Zapfen ist „11-cis-Retinal“ im Code angelagert.
Opsine für das Farbsehen mittels Zäpfen in der Netzhaut:
Das Protein (Mensch) „Opsin 1_ short wave_P03999“=345AS [Blue-sensitive opsin (BOP)] erhöht die spektrale Empfindlichkeit bei schwachem Licht bei einem Absorptionsmaxium Abs(max)=420 nm Wellenlänge. Das Protein liegt neben 38=Stäbchen/Zapfen mit QS=11 in der Spalte 21[9]/220/221 als QS2+1=3_QS2+2+0=4_QS2+2+1=5 mit 3_4_5 für 345AS. Innerhalb dieses Feldes ist die Wellenlänge als QS2_2=4_20 für 420 nm enthalten, und zwar in der Spalte 38“2“[19]/38“2“20“. Die Welle=64 summiert sich inclusive der 38er-Stäbchen-Spalte mit QS 38=QS=2_2=“4“_38=QS=2_2+2+0=“6“ mit „6_4“ für Welle=64. Weil das Protein eine sehr kompakte Zählung aufweist, muss es bei Bedarf mit dem Kunstgriff 10 für „0“ ohne Wertänderung breiter in den linken Code-Rand gezogen werden, um das „11-cis-Retinal“=156E seitlich gespiegelt als „6“_QS1+7_7=“15“ mit 15_6 für 156 E anzuheften. Die Ziffer 10 für „0“ wird als QS0+9+#1=10 für „0“ angesetzt. Insgesamt liegt das Protein in der Spalte Z.[38]“21“9#“1“617“/ Z.[38]“220#1“[61]“7“/ Z.[382]“21“#[1617]. „11-cis-Retinal“ ist inaktiv und wird bei Lichteinfall in „All-trans-Retinal“ verwandelt. In der Folge wird das Opsin aktiviert [OPN1SW - Short-wave-sensitive opsin 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Opsin 1_ long wave_ P04000“=364AS [Red-sensitive opsin (ROP) entwickelt ein Absorptionsmaxium Abs(max)=560 nm Wellenlänge. Das Protein zieht von der die Zäpfenspalte bis in eine Codespalte #1/#1/#1, so dass sich „11-cis-Retinal“=156E gespiegelt „6_1_7/7“ mit QS7+7=14_1=“15“_6 für 156E anlagern kann. In der Startzeile Z.“3“82“19#“1“617“ muss der Startziffer „3“ eine doppelte Kunstpause mit Kunstgriff 8+2=10 für „0“ und 9+1=10 für „0“ Ringverbindung zur Code-Spalte vorauseilen, um die Wellenlänge inclusive der Endziffer „0“ aus dem Kunstgriff zu gewinnen. Die Pausen verändern die AS-Kettenlänge von 364AS nicht. Opsin=364AS (Pfad ohne Vorschalt-Pausen „0+0“) als „3“_QS38+2=40_20_QS1_#1_#1+#1=4 mit 3_QS60+4=“64“ für 3_64 für 364AS. Das Wellenlänge-Symbol=Welle=64 ergibt sich in der Spannweite vom Matrix-Rand wurde bis zum linken Code-Rand als 38+2_20_1_#1_#1_#1=“64“. Die wird Wellenlänge=560 nm wird ohne Code gezählt, kann aber dort verlängert werden. Ziffer „5“ spiegelbildlich absteigend aus Spalte Z.“38“2“19“#(1)/Z.“38“220“#(1)/Z.[3822]“1“#(1)“ mit QS 2+2+0_1=“5“_Randspalte „382/38“ mit Summe 38=QS=2_38=QS=2_2=2+2+2=“6“_Kunstgriff 1+9=10 für „0“. Wellenlänge als „5_6_0“ für 560 nm [OPN1LW - Long-wave-sensitive opsin 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der menschliche L-Zapfen [Long wavelength receptor) ist eng mit dem M-Zapfen verwandt. Abweichend von der Wellenlänge 560 nm werden auch 563 nm genannt. Hierfür wird die Kunstpause 1+9=10 für „0“ in der Summe mit 0(Null) angerechnet und dann die Codespalte #1/#1/#1=QS=3 ergänzt für Wellenlänge 560+3=563*) nm [*) lt. Wiki-Text, in Skizze „564“]. Die Farbe ist gelbgrün. Rotes Licht wird wahrgenommen (Rotrezeptor) [Zapfen (Auge) – Wikipedia].
Das Protein (Mensch) „Opsin 1_ Mittelwelle_ P04001“=364AS besitzt bei gleicher Länge Absorptionsmaxium von Abs(max)=530 nm Wellenlänge, so dass ein Unterschied in einer variablen Zählweg vorhanden sein muss. Gemäß Wikipedia gelten die 530 nm für grün-sensitives M-Iodopsin mit M-Photopsin [Iodopsine – Wikipedia]. Im Prinzip wird das Protein statt 3_(60+4)=364AS für die Langwelle als 36_4=364AS für die Mittelwelle zerlegt. In der Startzeile Z.38219 wird am Rand Z.[3]“82“19“ mit der Startziffer QS8+2=“10“ gestartet, so dass daraus keine Kunstpause entsteht. Trotzdem muss dem Start noch ein 19=QS1+9=10 für „0“ als Ringverbindung und für die Endziffer „0“ der Wellenlänge vorauseilen. Die Kettenlänge wird dadurch nicht verändert. Nach der Kunstpause „0“ erfolgt der Start mit QS8+2=10_aufsteigend am Matrixrand mit 38=QS=2_38=QS=2 als Summe=10+2+2=“14“. In der Zeile Z.“38“22“1“#“1“ wird die Zahl „22“ angelagert für 14+22=“36“. Die Ziffer „4“ setzt sich unverändert aus der Summe 1+#1+#1#1=4 zusammen. Insgesamt „36_4“ für Mittelwellen-Opsin=364AS. Die Wellenlänge=530 nm bildet sich aus QS2+2+1=“5“_QS#1+#1+#1=“3“_Kunstgriff Zahl 19=QS1+9=10 für „0“. Insgesamt Wellenlängen-Summe=5_3_0=530nm. [OPN1MW - Medium-wave-sensitive opsin 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der menschliche M-Zapfen [Medium wavelength receptor) ist eng mit dem L-Zapfen verwandt. Abweichend von der Wellenlänge 530 nm werden auch 534 nm als genannt. Hierfür muss die Wellenlänge bis zum linken Matrixrand mit 38=QS=2_2=4+530 nm=“534“ nm ergänzt werden [Zapfen (Auge) – Wikipedia].
Zäpfen- und Stäbchen verwenden Rhodopsin. Zusätzliche „nicht-visuelle Opsine“ sind Neuropsin (Opn5-Gen), Melanopsin (Opn4-Gen) und Enzephalopsin (Opn3-Gen), die in der in der Netzhaut und anderen Geweben exprimiert werden:
Opsin-5 (Neuropsin / G-Protein-gekoppelter Rezeptor 136 ) wird bei Menschen vom OPN5-Gen codiert und im Auge, Gehirn, Hoden und Rückenmark exprimiert. G-Protein-gekoppelte Rezeptoren (GPCR) sind GTP-bindende Proteine, die eine zelluläre Signalkaskade auslösen. Opsin-5 ist bei 0°C bistabil und vermittelt einen UV-sensitiven, heterotrimeren G-Protein-Gi-vermittelten Signalweg [OPN5 – Wikipedia]. Opsin-5 gehört zur Sieben-Exon-Unterfamilie der Opsin-Gene von Säugetieren, zu der Peropsin (RRH) und der retinale G-Protein-gekoppelte Rezeptor (RGR) gehören. RRH=337AS [RRH - Visual pigment-like receptor peropsin - Homo sapiens (Human) | UniProtKB | UniProt]. RGR=291AS [RGR - RPE-retinal G protein-coupled receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Opsin 5_Q6U736“=354AS „wird in der Netzhaut benötigt, um die Regression der hyaloiden Gefäße während der postnatalen Entwicklung über den lichtabhängigen OPN5-SLC32A1-DRD2-VEGFR2-Signalweg negativ zu regulieren“ [OPN5 - Opsin-5 - Homo sapiens (Human) | UniProtKB | UniProt]. „Opsin_5“ wird dreizeilig aufsteigend und alternativ bistabil absteigend gezählt, wodurch sich 2 unterschiedliche Emissionsspitzen bei 380 nm (UVA-Licht) und 470 nm (blaues Licht) ergeben. In der Mittelzeile ist mit QS2+2+0_#1 ist QS2+2=“4“ enthalten, so dass sich beidseitig je nach Richtung die Ziffer „2“ für die Zeitbasis=24 anlagert. Das Protein wird daher als Rezeptor für die „circadiane Uhr“ verwendet. Weil die Mittelzeile zur Bildung der Ziffer „5“ als Summe QS2+2+0+#1 in den Code-Rand zieht, könnte seitlich das „11-cis-Retinal“=C20H28O=156E inaktiv spiegelbildlich mit „6“_QS1+7_7=15 mit 15_6 für 156 E angeschlossen werden. Um diesen Anschluss wie bei anderen Opsinen in die Zeile Z.3821“9“#“1“617 zu verschieben, werden ohne Wertänderung mit dem Kunstgriff 10 für „0“ die Zahlen „9#1“ mit QS9+1=“0“ eingefügt. Es kann auch als Variante dienen, um beide Wellenlängen zu unterscheiden. Diese „0“(Null) steht dann auch für die Zählung der Wellenlänge zur Verfügung. Das Symbol der Wellenlänge=64 zieht sich über den Zählweg plus Anschluss an den Matrixrand als Summe Matrix 1 (38=QS2_2+1+9=“14“)_Code QS#1+#1=“#2_Matrix 2 (QS38+2+2+0=42)_Matrix 3 (38=QS=2_2+2=“6“)=QS14+#2+42+6=Welle=64. Variante 1: Opsin-5 ab Z.38219 in Spalte Z.[38]“21“9#1“[617]/Z.38“220#1“[617]/Z.[38]“2“2“[1]#[1617] mit QS2+1_Kunstgriff QS9+#1=10 für „0“ für Summe 2+1+0=“3“_aufsteigend QS2+2+0+#1=“5“_QS2+2=“4“ mit 3_5_4 für „Opsin-5“=354AS gezählt werden. Die durchlaufende Zählrichtung der Ziffer „5“ wird durch die Schleife über den Kunstgriff realisiert. Bei der Wellenlänge wird als Kurzschluss der Schleife nicht gefolgt, sondern die Null hinten angehängt. Für einen Temperaturbezug zu 0° Celsius wird zunächst die Temperaturbasis 100°C benötigt, die sich als über den Kunstgriff QS“91“_2+2+0+1_2+2=91+5+4=100°C als Wunder zeigt, wobei der Kunstgriff 10 für 0°Celsius liefert. Dieser ist Variante ist die Wellenlänge 470 nm zugeordnet, und zwar absteigend als QS2+2=“4“_QS2+2_2+1=“7“_Kunstgriff 9+#1=10 für „0“ mit 4_7_0 für 470 nm Wellenlänge. Über diesen Zählweg zählt das Symbol der Wellenlänge=Welle=Kreis=“21“_QS9+#1=“10“+#1+20+ QS2+2=4=30+2+20+4= Variante 2: Opsin-5 ab Z.38219 in Spalte Z.[38]“2“1“[9]#[1617]/ Z.382“20#1“[617]/ Z.[38]“2“2“[1]#[1617]. Die Ziffer „5“ wird jetzt für Ziffer „3“ verwendet, und zwar mit QS2+0+#1=“3“_absteigend Zahl 21 als QS2+1=“3“_aufsteigend „2“ für Summe 3+2=“5“_QS2+2=“4“ mit 3_5_4 für „Opsin-5“=354AS. Dieser Richtung ist die Wellenlänge 380 nm zu geordnet, und zwar als QS#1+0+2=“3“_aufsteigend QS2+2=4_absteigend QS2_2=4 mit „3“_Summe 4+4=“8“ weiter mit Kunstgriff QS9+#1=10 für „0“ mit 3_8_0 für 380 nm Wellenlänge. Aufgrund der der Zahl „191“ erfolgt der Kunstgriff statt QS9+1 alternativ mit QS1+9=10 für „0“. Hierbei entsteht aber kein 100°C-Wunder. Für die Signalkette dient der linke Matrixrand als Zellmembran „33“ über die Serie Z.“3“ oder dreizeilig 3*(38=QS=)11=33, wobei mit Natrium=11 auch ein Natriumkanal mitläuft. Ohne Licht bleibt der Signalweg aufgrund der Hemmung durch Glutamat=C5H9NO4=30+9+7+32=78E verschlossen. Dieses ist ersichtlich, weil Glutamat am Matrix-Rand „38/382“ mit QS38_38+“2“=78E sitzt, und mit der Ziffer „2“ den Zählweg von Opsin-5 und seiner Wellenlängen blockiert. Erst wenn das Natrium=11 mit 38=QS=“11“ durch Lichteinwirkung durchzieht, wird die Hemmung des Glutamat-Hemmung je nach Licht Einfall beseitigt. Opsin-5 könnte somit für die Stäbchen beim Nachtsehen geeignet sein, ob es den Zäpfchen zum Farbsehen wird beim Protein-Text nicht erwähnt. [OPN5 - Opsin-5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RGR“=291AS bindet an „all-trans- und 11-cis-Retinal“. Das Chromophor liegt in 2 verschiedene Strukturen mit gleicher Summenformel vor. „11-cis-Retinal“=C20H28O=156E. Eine Unterscheidung ist möglich, weil der Zählweg für von „all-trans-Retinal“ als Dopplung mit 312E für 2 Moleküle läuft, und zwar über die Codespalte QS#1+#1+1=“3“_[Z.382]“21“ mit Zählrichtung 1_2=“12“ mit 3_12 für 312E. In der Spalte Z.[38219]#“1“617/Z.[38220]#“1“617/[Z.382]“21“#“1“[617] folgt direkt „11-cis-Retinal“ gespiegelt am Code-Rand Spalte „6_17/7“ mit QS1+7+7=15_6 für 156E. Das Protein „RGR“=291AS muss daher unterschiedlich gezählt werden. Variante „all-trans-Bindung“: Bindung von „all-trans-Retinal“ im Zählweg mit „21#1“=211_61 mit Zeilensumme=211+61=272_ weiter in Z.[382]“2“0“#“16“1“[7] mit QS2+0+16+1=19. Insgesamt 211+61+19=„RGR“=291AS. Statt der Dopplung wird eine Einzelanordnung für „all-trans-Retinal“=156E benötigt. Es wird direkt neben 11-cis-Retinal bis zum linken Matrixrand durchgezählt, und zwar „all-trans-Retinal“=156E in Spalte 3*(38=QS=2)=“6“_QS2+1+9+#1=“13“_QS2+0=“2“ mit Summe 13+2=15_6 für 156E. Variante „11-cis-Bindung“: Die Ziffer „0“ wirkt als Varianten-Drehpunkt, so dass sich RGR in der Spalte [1]“9#1“6“1“7“/“2“0“#[161]“7“ mit QS2+0=“2“_“9#1“ für „RGR“=291AS direkt vor das „11-cis-Retinal“=156E legt und bindet. Wenig Licht reicht aus, um die „11-cis“- in die „all-trans“-Form zu verwandeln. Aufgrund dieser Konformationsänderung trennen sich das Farbpigment und das Opsin. Das Fotopigment wird farblos („Bleichung“). Es wird eine Kaskade eröffnet, die am Ende einen Nervenimpuls auslöst [Stäbchen und Zäpfchen: Lichtsinneszellen in der Netzhaut (dasgehirn.info) ].
Das Protein (Mensch) „Opsin-4_Melanopsin“=478AS ist eine Photorezeptor, der cis-Retinaldehyde bindet, und am Pupillenreflex und anderen nicht nicht-bildbildenden Reaktionen auf das Licht beteiligt ist, wie Regulation des circadianen Rhythmus, Unterdrückung von Melatonin= C13H16N2O2=78+16+14+16=124E in der Zirbeldrüse u.a. Die Zeitbasis=24 wird beim Melatonin bereits gezählt. Das Hormon „Melatonin“ wirkt schlaffördert, so dass es zweckmäßig ungestört durch „all-trans Retinal“ zieht, weil es bei Dunkelheit nicht aktiviert wird. Melatonin zieht bei Nacht vom Code-Rand zum Matrix-Rand als Z.[3]QS 8+2=10_1_“9#1“=10+1+91=“102“_Z.38=QS=“11“_Z.38=QS=“11“ mit Summe 102+22=124E. „Melatonin“ bildet am Matrixrand die Zahl „10“ in einer L-Form in der Spalte 38=QS=“2“/Spalte 38=QS=“2“/38=QS=“2“_“2_+2“ mit Summe 5*2=“10“ und eine Zahl „114“ mit dem Winkel-Form „9#1“/“220#1“ als QS91+22+0+1=“114“ für Melatonin=10+114=124E. Am Tage muss das Hormon „Melatonin“ ausweichen, und zwar als 38=QS=11_22_absteigend Spalte 9/0 mit 0_9#1= „91“ mit Summe 11+22+91=124E. Melatonin wird gehemmt, weil es der Pfad von „Melanopsin“=478AS ist. „Melanopsin“ liegt in der Spalte Z.[38]“2“2“0“#“1“6“1“[7]/Z.[38220#1]“6“1“[7] als QS2+2+0=“4“_QS#1+6=“7“_Spalte 1/61 mit QS1+1+6=“8“ für 4_7_8 als „Melanopsin“=478AS [OPN4 - Melanopsin - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Melanopsin“ kommt in den „Melanozyten“ der Haut von Fröschen vor. Beim Menschen dient es nur in den Nervenzellen des Auges zur Wiedergabe der Umgebungshelligkeit [Melanopsin – biologie-seite.de].
Enzephalopsin (Opn3-Gen): Das Protein (Mensch) „Opsin-3_Enzephalopsin Q6P5W7“=189AS ist ein G-Protein-gekoppelter Rezeptor, der ohne weitere Erklärung notwendig ist, um sich mit einem Opsin-3-Partner zu einer verzahnten Einheit zu ergänzen. Das Protein liegt am rechten Serien-Code-Rand. Zwischen den Partner bildet sich eine Spalte „6/6“ mit 2*33=“66“ als Ziel für den Durchlauf der Wellenlänge - es ist auch eine Doppelschicht der Haut. Das Protein liegt in der Spalte Z.[38219]#“1“61“[7]/#[16]“17“/#[16]“1“[7] absteigend am Rand als „1“_QS17+61+11=“89“ für 1_89=189AS [OPN3 - Opsin 3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Opsin-3_Enzephalopsin_Q9H1Y3“=402AS (Enzephalopsin) enthält als kompletten Zählpfad die Summe=22+0+11=“33“=Membran, um in vielen Hautschichten inclusive der Netzhaut exprimiert zu werden. Opsin-3 liegt in der Spalte Z.[38]“220“#1617/ Z.[3822]“1#1“[617] als QS2+2=“4“_“0“_QS1+1=2 mit 4_0_2 für 402AS. Wellenlänge: „Induziert durch schwaches blaues Licht (453 nm) während der epithelialen Wundheilung;
Induziert durch ultraviolettes A-Licht in dermalen Fibroblasten“ [OPN3 - Opsin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Symbol „Welle“=64 entwickelt sich quer bis in die rechte Code-Rand-Spalte 17/17 als QS22+0=22_+QS#1+#1“_QS6+17=23_17 mit Summe=22+#2+23+17=“64“. Für die Wellenlänge 453 nm wird die Startziffer QS2+2+0=“4“ nicht verwendet, sondern durch eine doppelten Kunstgriff 10 für „0“ in einer Schleife zur rechten Matrixspalte 38=QS=2_2/38=QS=2_2+2 mit 4/6 als Summe 4+6= 10 für „0“ geführt, so dass die Schleife dann bis zum rechten Matrixrand mit QS1+9=10 für „0“ weiter zieht. Die Wellenlänge 453 nm wird zerlegt in 0+0+45_3, wobei sich die Ziffer „3“ aus der offenen Spalte 6/6 zwischen beiden Proteinen über eine Spaltzahl QS6+6=12, Spalt 1+2 mit QS1+2=“3“ ergibt. Die Zahl „45“ entsteht aus der gesteckten U-Form QS1+#1+#1+#1=4_QS6+1=7 mit Summe 4+7=11_Rand 17_17 mit QS11+17+17=45 mit 45_3 für Wellenlänge=453 nm. „Rotes Licht kann die Cytochrom-c-Oxidase aktivieren und dient zur Wundheilung. UV-blaues Licht kann die Rezeptoren Opsin 1-SW, Opsin 2, Opsin 3, Opsin 4 und Opsin 5 aktivieren. Sowohl blaues als auch rotes Licht stimulieren die Stoffwechselaktivität kultivierter Keratinozyten. Nur bei einer geringen Mengen an blauem Licht wird die DNA-Synthese reduziert und die Differenzierung von Keratinozyten stimuliert [Stellt blaues Licht die Funktion der menschlichen epidermalen Barriere durch die Aktivierung von Opsin während der kutanen Wundheilung wieder her? - Castellano‐Pellicena - 2019 - Laser in Chirurgie und Medizin - Wiley Online-Bibliothek; M.J.Thornton, Aug. 2018; https://doi.org/10.1002/lsm.23015]. „Keratinozyten“ werden in der Basalzellschicht gebildet und nach 4 Wochen als tote Hornschicht abgeschuppt. Die Transitzeit eines in der Basalzellschicht neu gebildeten „Keratinozyten“ durch das Stratum spinosum beträgt etwa 14 Tage. Bei dem hexagonales Muster steht jede Zelle mit sechs Nachbarzellen in Kontakt [Keratinozyt - DocCheck Flexikon]. Zeitbasis „24“ aus 3*(#1+6+1)=“24“ mit der Randspalte 7/7=QS7+7=14 Tage. Für die Basalschicht=333 wird die Spalte 6/6=QS=12_Spaltzahl QS1+2=“3“ beidseitig von den Spalten #1/#1/#1=3 und 1/1/1=3 eingefasst, so dass die Basalschicht „333“ gebildet wird._dat22.07.2023
Gipser&Kalker sockeln Victoria, die Ikone des ausgelosten Bürgerrates als Einzige ihrer Kategorie
Nervenzelle (Neuron): Zusammen mit den Gliazellen bilden alle Neuronen das Nervensystem. Die Gliazellen bilden das Stützgewebe des Nervensystems. Die Gliazellen sind nicht an der Erregungsleitung beteiligt, sondern erfüllen Hilfs- und Supportfunktionen [Gliazelle - DocCheck Flexikon]. Dem Zellkörper (Soma) entspringen faserartige Ausläufer, wobei zwischen „Axon“ und „Dendriten“, die Dornen-förmige Fortsätze ausbilden, zu unterscheiden ist. Das Axon leitet den Impuls von der Zelle weiter, während Dendriten fremde Signale empfangen. Der Begriff „Neurit“ bezieht sich unspezifisch auf alle Fortsätze, die eine Erregung an ausgewählte Zellen fortleiten (efferent). Beim Axon ist der Fortsatz von einer Myelinscheide umhüllt, beim „Neurit“ ist dieses keine Bedingung. Um mit nur 1 Nervenzelle das ganze Nervensystem darzustellen, wird 1 Synapse betrachtet. An der Synapse entsteht trotz Trennung am synaptischen Spalt ein Kontakt zwischen dem aufgezweigten Ende des Axons einer Nervenzelle (Präsynaptische
Endigung) und dem verästelten Dendriten einer anderen Nervenzelle (postsynaptische Region) [Synaptischer Spalt – Wikipedia]. Bei einer chemischen Synapse wird die „Präsynaptische Endigung“ auch als Synapsen-Endknöpfchen oder Axonterminale bezeichnet [Präsynaptische Endigung – Wikipedia]. Die Synapse überträgt eine Erregung, moduliert die Signalübertragung und kann Informationen durch anpassende Veränderungen speichern. Eine Synapse entsteht fiktiv aus nur 1 Nervenzelle, wenn sich der lineare Strang aus Dendrit und Axon zum Ring krümmen und sich das Axon-Ende und 1 Ast des Dendriten am synaptischen Spalt gegenüberstehen. Das „Axon“ verwendet den Code-Rand #1616 und der „Dendrit“ #1615, um damit Calcium zu erzeugen. Ein Reiz kann daher nur vom Dendrit zum Axon weitergeleitet werden. Kreist dieses System mit der Winkelsumme=360° nur um sich selbst, wird fiktiv eine Information gespeichert, obwohl die eigenen Enden real nie eine Synapse bilden. In der Startzeile Z.38“24“0“ wird hierfür die Zeitbasis „24“ mit 24_0 auf „0“(Null) gesetzt. Das Prinzip der Nervenzelle entwickelt sich über 14 Zeilen von Zeile Z.38240#1616_5“79“5 bis zum Bereich des Zellkörpers „7000“ in der Zeile Z.38253#1615_7000_53_“79“_35, wobei in beiden Zeilen eine Steuerungsgröße „79“ markiert wird. Real wird einer Information eine Markierung angehängt, wenn diese langzeitig gespeichert werden soll. Die Winkelsumme=360° als Funktionsgröße und der Kreis=64 für einen gekrümmten Nerv liegen nur als Zufallsfunde vor: Über die 14 Zeilen ergibt die Zählgröße Z.38=QS=11 die beiden Anteile 14 * „3“= „42“ und 14 * “8“ =“112“. Die Zahl „112“ ist ebenfalls im Code der Synapsen-Zeile Z.[38]“248“ enthalten, so dass die Winkelsumme 248 +112=360° entsteht. Die Zahl „42“ besitzt zum Kreis=64 ein Defizit=22. Hierfür zieht sich eine Nerv-7-Spalte [78]“4“[5]/[7]“4“2“2“/[7]0“0“[0] in den Zellkörper „7000“. Der Kreis „64“ ist darin aber nur zählbar, wenn auch eine Kurve auf- und absteigend gezählt wird, und zwar aufsteigend QS4+2+0=“6“_absteigend QS0+4=“4“ für „64“. Wird 1 Ziffer „3“ im Code geklammert (gestrichen), können sich Z.-Nr. und Code spiegeln und im Code die Synapsen-Winkelsumme=QS #161+5+70+0+0+0=“236°“_QS5+5+[3]+79+35=“124°“ [ohne Ziffer „3“]=Code-Winkelsumme=236+124=360° bilden. Die Ziffer „3“ ist die Differenz zwischen der Signalgröße „79“ und Ubiquitin=“76AS“. Aufsteigend von Z.38249 bildet sich eine Ubiquitin-Spalte „1“[8]/“6“[9]/“42“/[3]“6“/[5]“3“, die die Ziffer „3“ aufnimmt, so dass die Winkelsumme 360° entsteht, und zwar als QS1+6=7_ 4_QS2_6_3=11=QS=2 mit 7_QS4+2=6 für Ubiquitin=76AS. „Der Ubiquitin-regulierte Proteinabbau bietet einen Mechanismus, der Axon-Lenksignale – wie die Netrine, Semaphorine, Ephrine und Slit – mit der Wachstumszapfendynamik verbindet. Aus Arbeiten an der neuromuskulären Verbindung von Drosophila wurde auch die Ubiquitinierung als Schlüsselregulator der Synapsenbildung und des Synapsenwachstums in Verbindung gebracht“ [Ubiquitin und die Synapse | Nature Reviews Neurowissenschaften; A. Hegde; Nature Reviews Neurowissenschaften ; volume 3, pages854–861 (2002)].
Axon: Das Ende des Axons wird ringförmig und fiktiv (unwahr) in eine eigene Synapse gelegt. Die Synapsen sitzen an den Dornen der Dendriten. Das „Axon“ wird zunächst im Zeilenlauf übersprungen, um eine Übersicht bis zum Zellkörper zu gewinnen. Weil das „Axon“ als Zellfortsatz keine synthesefähigen und phagozytierenden Zellorganellen enthält, erfolgt die Verbindung zum Zellkörper über einen motorproteingekoppelten axonalen Transport. Die Transportrichtung vom Axon zum Zellkörper (Perikaryon) wird als retrograder (zentripedaler) Transport bezeichnet. Abbauprodukte werden zu Lysosomen im Zellkörper transportiert. Noch weitreichender ist der von Fibroblasten exprimierte neuronale Wachstumsfaktor (NGF), der in den Zellkern gelangt, um dort Zielgene zu induzieren [Axonaler Transport - DocCheck Flexikon]. „NGF“ besteht im Verhältnis 2:1:2 aus 3 Proteinen (Alpha /Beta/Gamma). Die Gamma-NGF ist eine Serinprotease und spaltet „Beta-NGF“ ab, das ein Signalmolekül enthält und das „funktionelle NGF“ bildet [Nervenwachstumsfaktor - DocCheck Flexikon]. Beta-NGF ist mit 296AS und 241AS bekannt [NGF - Wachstumsfaktor des Betanervs - Homo sapiens (Mensch) | UniProtKB | UniProt; NGF - Wachstumsfaktor des Betanervs - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Beta-NGF=241AS kann sofort in Z.38“241“ lesbar erzeugt werden und zieht sich dann als Code-Randserie #161 in Blöcke von je 4 Zeilen als Transportstrecke weiter, und zwar zerlegt als 3*(QS1+6+1=8)_“1“=24_1 für 241AS, wobei mit den Endziffern 1, 5 9, 3, 7 nach 5 Blöcken eine Wiederholung bzw. eine Qualitätsunterschied eintritt. „Beta-NGF“ enthält als Untereinheit 2 Ketten von je 118AS. Diese beiden Anteile sind im Block jeweils zählbar. NGF wird mit relativ hoher Affinität durch die membranständige Tropomyosinrezeptorkinase A (TrkA) gebunden. Dies stimuliert eine antiapoptotisch wirksame Kaskade von Kinasen, deren zentrales Enzym die Proteinkinase B (PKB = AKT) ist. Darüber hinaus bindet NGF an den Low-affinity-NGF-Rezeptor (LNGFR/p75NTR) [Nervenwachstumsfaktor - DocCheck Flexikon].
Synapse: Annahme: Der „Synaptische Spalt“ zwischen Dendrit und dem Axon einer anderen Nervenzelle wird als ein gesonderter Raum zwischen 2 Membranen betrachtet. Dieser Raum wird ausgelagert und der Betrachtung über Organellen und Zellkern mit Membran-Bezug zugewiesen. Die Synapse unterscheidet bei der Ringbildung zunächst nicht zwischen dem eigenen und dem fremden Axon, und „denkt“, dass die fremde die eigene Nervenzelle ist.
„Die Zahl der Synapsen, die eine einzelne Nervenzelle ausbilden kann, variiert sehr stark: Je nach Zelltyp kann sie zwischen genau einer und über 100.000 betragen“ [Wie Nervenzellen miteinander reden | Max-Planck-Gesellschaft (mpg.de); Forschungsbericht 2012 - Max-Planck-Institute für biophysikalische Chemie]. Das Protein (Mensch) Synapsin-1=705AS besitzt eine Isoform mit ebenfalls 705AS, die leider nur zum Meschenaffen gehört. Die Lücke zwischen beiden Proteinen wird als synaptischer Spalt gedeutet. Das Protein liegt ab Z.38248 vierzeilig aufsteigend in der Spalte „1“[12]/“69“[0]/[2]6[7]/[8]“4“5“ als QS1+69=“70“_Kunstgriff QS6+4=10 für „0“_“5“ mit Summe „70“_QS0+5=“5“ für 705AS. „Neuronales Phosphoprotein, das synaptische Vesikel umhüllt und an das Zytoskelett bindet. Der mit NOS1- und CAPANON-Proteinen gebildete Komplex ist für spezifische Stickoxidfunktionen auf präsynaptischer Ebene notwendig“ [SYN1 - Synapsin-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch?) „Synapsin-1_Isoform“=705AS ist eine gegenüberliegende Dopplung, die ab Z38248 in der Spalte „5“1“[84]/[2]“69“[0]_[02]“1“[89]/[77]“69“5“ absteigend als QS69+1=70_5 für 705AS zählbar ist, gleichzeitig aber auch aufsteigend als QS1+69=70_5 für 705AS [SYN1 isoform 1 - Pan troglodytes (Chimpanzee) | UniProtKB | UniProt]. Zum Komplex gehört das Protein (Mensch) „NO-Synthase_NOS1“=1434AS. „NOS1“ kann die Zahl „95“ aus der Isoform in Z.38250 aufnehmen und sich bis zum Zeilenrand zählen als QS9+5=14_QS2+32=34 für 1434AS. „NOS1“ kann am Original „Synapsin-1“ binden, und zwar mit der anliegenden Spalte 0“2“[1]/“7“[76]/“5“34“ als QS0+2_7_5=“14“_“34“ für 1434AS. „NOS1“ besitzt 4 Cofaktor-Bindestellen, so dass sich das Gebiet weiter verdichtet [NOS1 - Stickstoffmonoxid-Synthase, Gehirn - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) Synapsin-2=582AS liegt ab Zeile Z.38247 in der Spalte „5“3“5“/[11]“2“/[6](90) an der identifizierten Synapse, und zwar aufsteigend als „5“_QS3+5=“8“_“2“ für 582AS. Das Protein umhüllt synaptische Vesikel und kann eine Rolle bei der Noradrenalin-Sekretion spielen. Noradrenalin=C8H11NO3=48+11+7+24=90E liegt direkt an, wobei die Ziffer „0“ zum synaptischen Spalt gehört [SYN2 - Synapsin-2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) Synapsin-II_Modifikation=36AS liegt am synaptischen Spalt mit der Zahl „26“ über der Spalt-„0“(Null). Beidseitig ist entweder 1+9=10 oder 9+1=10 für QS26+10=36AS zählbar. Die ATP-Bindung ist mit „26“_QS9+1=10 für „0“ mit ATP=260E vorhanden. Calcium liegt in der Spalte 2/0 mit 2_0 für Calcium=20 vor [syn2 - Synapsin II - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) Synapsin-3=580AS liegt im synaptischen Spalt mit [11]“2“[69]“0“/69“0“2“1“8“ als QS2+0+2+1=5_8_0 für 580AS [SYN3 - Synapsin-3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Synaptic vesicle glycoprotein 2A“=742AS zieht durch den synaptischen Spalt “11“2“[69]/[69]“0“2“1/[267]“7“[6], und zwar absteigend als „7“_QS0+2_2=“4“_QS1+1=“2“ mit 7_4_2 für 742AS. „Der genaue molekulare Wirkmechanismus ist nicht bekannt, aber man geht davon aus, dass das Vesikelprotein 2A Vesikel fusionsfähig macht, sodass diese mit der präsynaptischen Membran verschmelzen und ihre Botenstoffe in den synaptischen Spalt freisetzen können“ [Synaptisches Vesikelprotein 2A – Wikipedia]. Die Zahl „11“ bildet zusammen mit der Randspalte QS1+6+1+5+9=22 +11=33 die präsynaptischen Membran „33“. Vergleichsweise ergibt der gegenüberliegende Rand QS2+1+8+9+4+0+7=31 und mit der Randspalte 2/31 dann QS2+31=Membran=33 [SV2A - Synaptic vesicle glycoprotein 2A - Homo sapiens (Human) | UniProtKB | UniProt].
Axon-Anfangssegment (AIS) [Axon initial segment]: Das „AIS“ erstreckt sich entlang der ersten 20-60µm des Axon-Schaftes und beginnt kurz nach dem Axonhügel. Als Merkmal liegen dort enge Bündel von 3–10 Mikrotubuli. Auf molekularer Ebene organisieren sich AIS-Proteine als geschichtetes Gerüst, das sich von den Mikrotubuli bis zur Plasmamembran erstreckt. Die zentrale Komponente dieses Gerüsts ist „Ankyrin G (ANK3)“ [The Axon Initial Segment: An Updated Viewpoint - PMC (nih.gov); Chr. Leterrier; Jan. 2018; DOI: 10.1523/JNEUROSCI.1922-17.2018]. „Ankyrin G“ wird vielfältig verwendet [Ankyrin-3 – Wikipedia]. Das Protein (Mensch) „Ankyrin G_Q12955_¬¬¬ ANK3¬“=4377AS beginnt in der letzten Calcium-Zeile der Art „#1615“ in Z.38246 und definiert die Länge des „AIS“ in der mittleren Länge von 40 µm als Nerv=Form=7_“40“. Der Faktor 1000 zur Umrechnung in Nanometer zieht sich als Randspalte „0/1/2“, wobei das Magnesium=12 mit QS1+2=3_0 als Potenz-Zähler 10^3=1000 dient. „Ankyrin G“ liegt in der Spalte „7“4“1““3“[0]/[752]“8“1“/[97]“4“0“2“ dreizeilig absteigend als „4“_QS0+2_1=“3“_Spalte 3/8 als QS3+8=11=QS=2 _1+4 mit 43_QS2+1+4=7_7 für 4377AS, wobei die Magnesium-Spalte mit enthalten ist. „Reguliert die Aktivität des KCNA1-Kanals in Abhängigkeit von diätetischem Mg2+ und trägt damit zur Regulation des renalen Mg-Spiegels bei2+ Resorption“ [ANK3 - Ankyrin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NRCAM“=1304AS ist mit „Ankyrin G“ eng verflochten, und zwar in der Spalte „13“/“2“8“/“4“[0] als „13“_QS2+8=10 für „0“_“4“ mit 13_0_4 für 1304AS [NRCAM - Neuronal cell adhesion molecule - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Neurofascin_O94856_NFASC“=1347AS ist mit „Ankyrin G“ eng verflochten, und zwar in der Randspalte [528]“1“/“7“4“0“2“ als QS1+2=3_QS0+4=4_7 mit 13_4_7 für 1347AS [NFASC - Neurofascin - Homo sapiens (Human) | UniProtKB | UniProt]. Mit Kalium=19E wird der Kalium-Kanal dreizeilig aufsteigend ab Z.38242 in der Spalte 164/122/080 als „1“_QS1_0+8=18 mit Summe 1+18=Kalium=19E gezählt. Das Protein (Mensch) „Kalium-Kanal _KCNA1_F1SL10“=495AS legt sich seitlich rechts, dreizeilig an, und zwar QS2+2=4_QS0+2+7=9_QS2+3=5 mit 4_9_5 für 495AS [KCNA1 - Kaliumspannungsabhängige Kanal-Unterfamilie A Mitglied 1 - Sus scrofa (Schwein) | UniProtKB | UniProt]. Der Kalium-Kanal liegt in der Endzeile Z.38245 in der Spalte mit der Ziffer „0“, die seitlich mit QS 16+“0“+3 [80]=19E ebenfalls Kalium enthält. Über die Ziffer „3“ ist auch das Protein (Mensch) „Kalium-Kanal _KCNA1_ A0A1W2PQM4“=38AS angeschlossen [KCNA1 - Kalium-spannungsabhängige Kanal-Unterfamilie A Mitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Kalium-Kanal _ A0A1W2PRI2“=441AS bindet in Z.38243 mit der Ziffer „1“ in den Kanal ein, und zwar als „4“_QS2+2=4_1 für 441AS [KCNA1 - Kalium-spannungsabhängige Kanal-Unterfamilie A Mitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Axonhügel (Axon hillock): Der Axonhügel folgt dem „AIS“ (Initialsegments Segmentum initiale). Das „AIS“ generiert und formt das Aktionspotential. Der Aktionshügel ist zwar nicht der Ursprung des Aktionspotentials, aber die hemmenden und verstärkenden Signale müssen im Vorfeld verrechnet werden, um den Schwellenwert überhaupt zu erreichen. Die beiden Folgezeilen sind als Axonhügel geeignet, weil in Z.38248 die Zählgröße „11“ enthalten ist. Vergleichsrechnungen für effektive Zeilen ergeben sich aus der Zeitdifferenz zur Startzeile Z.38240 und vom AIS zum Axonhügel. Diese Anhäufung von spannungsabhängigen Ionenkanälen ist eine Folge von Plasmamembran- und Zytoskelett-assoziierenden Proteinen wie Ankyrin [Axon hillock - Wikipedia]. Das Protein (Mensch) „Ankyrin-1“=1881AS verbindet in der Vor- und Folgezeile von Z.38248 zwei Zahlen „18“. In dieser Strecke wird ATP=260E als 26_QS9+1=10 für „0“ für ATP=260E tangiert. „Ankyrin-1“ liegt in der Spalte „[5]“1“8“[4]/[26]“9“0“/[02]“1“8“ als „1“+QS8_9=“17“ mit Summe 1+17=“18“_QS0_8=“8“_“1“ für 1881AS [ANK1 - Ankyrin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Spektrin“ ist Bestandteil des Cytoskeletts von Neuronen, Erythrozyten und Kardiomyozyten. Das Protein (Mensch) „Spektrin¬¬¬¬_Beta“=3674AS liegt ab Z.38245 in der Randspalte [28]“1“/[40]“2“/“4“7“[5]/[4]“8“2“/“4“0“7“ als QS1+2=3_QS0+4=4_QS4+7=11=QS=2_QS8+2=10 für „0“ mit „3“_Summe= 4+2+0=“6“_QS0+7=“7“_“4“ mit 36_7_4 für 3674AS [SPTBN5 - Spectrin beta chain, nicht-erythrozytär 5 - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Actin (Aktin)“ als Einzelmolekül ist seitlich mit 375AS lesbar. Actin=374AS ist in der Spektrin-Zählung als QS1+2=“3“_QS0_7=“7“_“4“ für 374AS enthalten. Das Protein (Mensch) „Spektrin¬¬¬-_Alpha“=2472AS bindet zur Verlängerung in Z.38249 in die Beta-Kette ein als „2“_“4“_QS0+7=“7“_“2“ für 2472AS [SPTAN1 - Spectrin alpha chain, nicht-erythrozytär 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Spektrin-Beta umgeht die Ziffer „5“ für 10^5, die benötigt wird, um die angeschlossenen Signale von „1“ bis 100000=“1*10^5“ dendritischen Synapsen-Eingangs-Signalen anderer Neuronen als Anzahl zu definieren [Nervenzelle – Wikipedia]. Die Basiszahl „10“ liegt in der Randspalte „8“1“/“0“2“/[7]“5“ als „1“_QS8_0+2=10_5 für 1*10^5. „Axonhügel“ und „AIS“ (Axon initial segment) ergänzen sich, indem der Axonhügel mit seinem Berechnungsergebnis dazu beträgt, die Erregungsschwelle=+20mV zu erreichen. Zu diesem Zweck zerfällt die Schwerachse „84“ in die Zeitbasis=60 und Calcium=20, zugleich ein Winkel +20° über der X-Achse und zugleich +20mV. Erregung maximal bis zum Winkel +90°=+90mV. Der Übergang Z.38246/Z.38247 enthält rechts die Randspalte [99]7402/[84]0475. Darin liefert der Axonhügel die Randzahl QS0+4+7+5=“16“, so dass über die Spalte 4/4 das „AIS“ die Summe 16+4=+20 mV erzeugen kann. Zugleich kann die maximale Erregung nur 16+74= +90mV bzw. den Winkel +90° erreichen. Ohne Erregung hängt die Schwerachse wie ein Lot in der Y-Achse bei -90°, bei maximaler Erregung erfolgt eine zeitliche Auslenkung (Drehung) in die horizontale X-Achse. Die Schwerachse „84“ liegt in einer Spalte mit dem Winkel „90°“ als „84/90“. Das „AIS“ kann die Ziffer „4“ nicht verrechnen, solange der Axonhügel mit der Ziffer „4“ selbst QS[8]4+0+4+7+5=20 summieren kann. Folglich muss die Ziffer „4“ der Schwerachse durch funktionelle Verwendung unlesbar zeitweilig unlesbar werden. Das ist der Fall, wenn die Summe der angeschlossenen Synapsen einen fiktiven Ringschluss „360°“ zwischen Dendrit und Axon erzeugen, und dazu die Ziffer [8]“4“ benötigt wird. Winkelsumme Z.[38248]#6159112690[4482] als QS#16+159+112+69=“356“_Spalte [8]“4“/[9]“0“ als QS0+4=“4“ mit Summe=356+4=360°=Synapsen-Winkel. Die Synapsen unterscheiden sich in der Verbindungsart, die statt elektrisch meist chemisch funktioniert. Membranproteine setzen dabei am synaptischen Spalt einen Botenstoff frei, der von speziellen Rezeptoren erkannt wird [Neurotransmitter: Acetylcholin, Serotonin, Dopamin, GABA & Glycin sind Botenstoffe (dasgehirn.info)]. In der Zeitdifferenz zum „AIS“ mit DELTA.TIME.EPI.VIR.Z.38246-Z.38248=#84500929198 ist die Schwerachse „84“; paarig=2 und ein Zähler „1“ in 9_“1“_9=seitlich/oben enthalten. Darin kann die gedehnte Ziffer „59“ als 5_00_9 einen Platzhalter für das Aktionspotential in „xx“ mV darstellen. Die Zahl „59“ bildet sich auch als Zeilensumme QS=#1+6+1+5+9+1+1+2+6+9+0+4+4+8+2=“59“. Zusammen mit dem Zähler „1“ kann die Zeitbasis „60“ erzeugt werden. Die Nervenleitgeschwindigkeit liegt beim Menschen zwischen 1 bis 100 m/s [Nervenleitgeschwindigkeit - DocCheck Flexikon]. In Z.38246 ist hierfür eine Kombination mit dem Muskel „55“ als QS1+6=7=Nerv_“1“ (m/s)_(5)_“99“ (m/s) _(5) vorhanden. Der Umrechnungsfaktor in Nanometer, gesucht als 10^9, wird mit der Zeitbasis kombiniert, um statt Länge eine Geschwindigkeit zu adressieren, und zwar mit der Spalte „6“0802/“6“0“3“[8]/(5)“99“(5)[76] aus 1_(5)_99_QS3+0+6=“9“ (Potenz)_Zeitbasis=“60“ _QS8+0+2=10 (Faktor) für Nervenleitgeschwindigkeit= 1 bis 99*10^9 nm/s.
Ergänzung: Neuriten / Myelinscheide (Markscheide):
Im Anschluss an das BiXnom-Claustrum-Eingangsportal müssen Informationen verarbeitet und gespeichert werden. Informationen werden gespeichert, indem sie nicht verändert werden. Um einen Einstieg in das Nervensystem zu finden, werden Proteine für „Neuriten“ ausgewählt, die Veränderungen verhindern. Das muss in der Umgebung der Z.-Nr. Z.38“240“ geschehen, weil die Zeitbasis 38=QS=11„24“_“0“ mit 24_0 auf „0“(Null) gesetzt wird.
Zur geometrischen Darstellung der „Neuriten“ muss der Code mit beteiligt werden. Zunächst wird mittels Opioid (Droge) der mögliche Zeilenbereich eingeschätzt. Das älteste künstliche Opioid „Pethidin“=C15H21NO2=90+21+7+16=134E [Pethidin – Wikipedia] liegt in Z.38241 als QS3+8=11+2=13_QS4_QS1_0_9=10 für „0“ mit Summe 4+0=“4“ für 134E. Die Serie Z.3824x ergibt noch keine fixe Z.Nr., so dass Kunstgriffe 10 für 0 einen Ring anschließen, und zwar absteigend bis Z.39239 in der Randspalte 9/0/1 mit 1. Kunstgriff QS=10 für „0“_2. Kunstgriff im Code QS#1+6+1_aufsteigend zurück bis Z. 38241 mit 1_1=10 für „0“_ 3. Kunstgriff weiter in die Randziffer „2“ der Z.Nr.Z.2824“2“ mit 2_#1+6+1=10 für „0“ mit Summe 134+0+0+0= Pethidin=134E. „Fentanyl“=C22H28N2O=132+28+14+8=182E ist ein künstliches Schmerzmittel (Analgetikum) mit einer 100-fach höheren Wirkstärke als Morphium, das im Zentralnervensystem als Handelnder (Agonist) an „µ-Opioidrezeptoren“ wirkt und zur Abhängigkeit führt [μ-Opioid-Rezeptor – Wikipedia]. Das Protein (Mensch) „Opioidrezeptor vom Mu-Typ“=400AS ist ein Rezeptor für körpereigene Opioide [wie Beta-Endorphin und Endomorphin] und Rezeptor für natürliche und synthetische Opioide [Morphin, Heroin, DAMGO, Fentanyl, Etorphin, Buprenorphin, Methad]. Der Opioidrezeptor findet in der Z.-Nrn.-Matrix in Z.382“40“ die Zahl „40“ bereits als Randziffer vor, so dass für einen G-Rezeptor eine Wanderung über 7 Kunstgriffe 10 für „0“ über den Code erfolgt, mit „40“_QS 7*0=“0“ für 400AS [OPRM1 - Mu-type opioid receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Schritt 1: Ziffer „1“ Z.3824“1“ und Spalte 161/[16]1 mit QS1_#1+6+1_1=10. Schritt 2: „61[6]/[6]12“ mit QS6+1_1+2=10. Schritt 3: „64“=QS=10. Schritt 4: Spalte [2]2/80 mit QS2+0+8=10. Schritt 5: Code in Z.38245 mit QS1+6+0+3=10. Schritt 6: #161/#1[6]1 mit QS1_1+6+1_1=10. Schritt 7: zurück in Z.Nr.-Matrix Z.38“2“4“4“ mit QS 2+4+4=10. Der Rezeptor wartet in dieser harmlosen Endposition auf ein „Opioid“ als Ligand, weil er sich im alternativen 7. Schritte nicht selbst als Doppelzählung in der Randspalte zur eigenen Randziffer „1“ im 1. Kunstgriff als QS“1“+2+3+4=10 für „0“ durchzählen kann. Legt sich ein Opiod dort hinein, erfolgt ein Ringschluss, der im Code diverse Prozesse auslöst. Die beiden Matrix- Z.Nrn. sind für 2 Untereinheiten geeignet, die sich trennen und mit nachlassender Wirkung des Liganden wieder verbinden. Liegt dort ein Opiod? „Fentanyl“=182E zählt die Z.38241 als QS 3+8+2+4+1=“18“ und hängt die Codespalte #1/#1 mit QS1+1=“2“ als 18_2 für Fentanyl=182E an. Der Anschluss erfolgt am 6. Schritt des Rezeptors, dessen 7. Schritt dann zeitweilig entfällt, bis die Wirkung des Opioids wieder nachlässt. In diesen beiden Zeilen ist Zeitbasis als Summe „38“_Spalte 2/2 =“22“=Zeitbasis=60 enthalten. Nach intravenöser Applikation verteilt sich „Fentanyl“ mit einer Halbwertszeit= „6“ [-10] Minuten=“360“ [-600] Sek. im Organismus [Fentanyl - DocCheck Flexikon]. Zwar wird in EPI.Vir.Z.38241#161620706096667 die Winkelsumme=360° zu anderen Zwecken in zur 1 Zeile gezählt, weil aber die Zeitbasis „60“ im Code enthalten ist, sind es gleichzeitig auch 360 Sekunden (nur Zählbares passiert). Halbwertszeit mit Z.38=QS3+8=11=QS=2_2_4_1 mit Matrix-Summe=2+2+4+1=“9“. Code mit QS#16+16=“32“_QS20+70+60=“150“_QS96+66+7=169 für Code-Summe=32+150+169=351. Zeilen-Winkelsumme=9+#351=360° zugleich 360 Sekunden=6 Minuten.
Hilfszeilen die Winkel-Summe=360° erzeugt, und zwar als Matrix mit Z.38=QS3+8=11=QS=2_2_4_1 mit Matrix-Summe=2+2+4+1=“9“. Code mit QS#16+16=“32“_QS20+70+60=“150“_QS96+66+7=169 für Code-Summe=32+150+169=351. Zeilen-Winkelsumme=9+#351=360°
Opioidrezeptoren gehören zu den „Guaninnukleotid bindenden Proteinen (G-Proteine)“. Der aus sieben Eiweißketten bestehende transmembranöse Opioidrezeptor interagiert mit dem G-Protein. Nach Bindung eines Liganden an den Rezeptor kommt es zur Abspaltung des Guanidindiphosphats (GDP) und zur Bildung von Guanintriphosphat (GTP); hierdurch wird die Trennung der Alpha- von der Beta- und Gammauntereinheit eingeleitet. Über das zyklische Adenosinmonophosphat (cAMP) wird die analgetische Wirkung der Opioide vermittelt. Mit dem Abfall der cAMP-Produktion wird ein Verschluss der spannungsabhängigen Ca²+-Kanäle, sowie ein verminderter Ionenstrom der K+- Kanäle ausgelöst [„Fentanylkonzentrationen im Blut von Verstorbenen im Vergleich zu Lebenden“; A.Gullans Diss. (2008); https://ediss.sub.uni-hamburg.de/bitstream/ediss/2584/1/veroeffentl_dissertation.pdf]. „GTP“ wird wieder zu „GDP“, die Untereinheiten schließen sich wieder zusammen und die Wirkung des Opioids ist damit beendet. Am Wirkmechanismus sind Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E, Guanosintriphosphat (GTP) =C10H16N5O14P3=60+16+35+112+45=268E und „Cyclisches Adenosinmonophosphat (cAMP)=C10H12N5O6P=60+12+35+48+15=170E [Cyclisches Adenosinmonophosphat – Wikipedia] beteiligt. Die Reihenfolge GDP GTP GDP beginnt mit „GDP“=228E in der Spalte Z.“38“2“4“[1]/Z.[382]“4“2 aufsteigend als QS3+8=11=QS=2_2_Spalte 4/4=QS=8 mit 22_8 für GDP=228E. „GTP“=268E in der Spalte Z.“38“2“4“[1]/Z.[382]“4“2 wird mit Zahl „38“ nicht von QS=11 auf QS=2 reduziert, und zwar als 38=QS=11+2=13_ 38=QS=11+2=13_QS4_4=“8“ mit QS13+13=“26“_“8“ für GTP=268E. „GDP“=228E wird bei wiederholter Zählung spiegelbildlich absteigend gezählt, und zwar in der Spalte Z.[382]“4“[1]/Z.“38“2“4“[2] als QS3+8=11=QS=2_2_Spalte 4/4=QS=8 mit 22_8 für GDP=228E. Das „cAMP“=170E legt im Code mit der Spalte Z.[38241]#“1“6“1“6“2“/Z.[38242]#[1616]“1“/Z.[38243]#[1616]“1“ als „1“_QS6+1=“7“_QS6+2_1_1=10 für „0“ mit 1_7_0 für cAMP=170E. Der Calcium-Kanal ist in Z.“38243“ mit QS Z.3+8+2+4+3=Calcium=20 adressiert._[GDPgeändert 11.09.2023]
Hemmer des Neuritenwachstums (Neurite Outgrowth Inhibitor): Der regulatorische Faktor für das Wachstum der „Neuriten“ ist dabei nur eine einzelne von den vielfältigen Funktionen dieser Proteine. Ein Neurit ist „1“ Fortsatz des Neurons, mit dem eine Erregung fort (efferent) vom Zellkörper an ausgewählte Zellen weitergeleitet wird. Meist liegt der Nervenzellfortsatz in einer Umhüllung (Myelinscheide) und wird dann synonym als Axon (Achsenzylinder) bezeichnet [Neurit – Wikipedia]. Das Protein „Reticulon-4_Q9NQC3_RTN4=1192AS (Neurite Outgrowth Inhibitor / Nogo) schützt vor Veränderungen. Es wird nur die Z.-Nr. Matrix und eine nunmehr von „#1617“ auf „#1616“ veränderte Code-Serien-Spalte betrachtet. Das Protein wird in der Spalte Z.38“24“0“#1616[„24“932579567]/Z.38241#1616[20706096667] entwickelt, und zwar ab Z.“38“241 absteigend als 38=QS3+8=11_absteigend QS38+2+40=80_Summe #1_aufsteigend QS1+#1=2 mit 1_2 als „12“. Insgesamt 11_QS80+12=92 für „Reticulon 4_RTN4“=1192AS. Eine Unterstützung zur Bildung der Zahl „12“ ist im Prinzip möglich, weil das Protein über eine Metall-Ionen-Bindung verfügt. Es gibt aber keinen speziellen Literaturhinweis auf das benötigte Magnesium=12E. Im Ergebnis wird eine Brückenplatte Summe 81 beidseitig von Brückenpfeilern „11“ gestützt, so dass unter der Protein-Brücke die Zeit=24 als Bächlein verrinnt. Wird die komplette Pfeiler-Zeile durchgezählt, steht diese unvergänglich auf ewig, weil sie ohne Hilfszeilen die Winkel-Summe=360° erzeugt, und zwar als Matrix mit Z.38=QS3+8=11=QS=2_2_4_1 mit Matrix-Summe=2+2+4+1=“9“. Code mit QS#16+16=“32“_QS20+70+60=“150“_QS96+66+7=169 für Code-Summe=32+150+169=351. Zeilen-Winkelsumme=9+#351=360° [RTN4 - Reticulon-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein bildet 3 Isoformen (A, B, C) mit jeweils unterschiedlichen Funktionen, so dass es außer der Brücken-Geometrie 2 weitere Zählpfade gibt. Als alternative Form werden die im Bächlein davon fließenden Erinnerungen „24“ dreizeilig mit Start in der Zeile Z.38239#1616[29159283523] in einer Diagonalen gespeichert, und zwar als 38=QS=“11“_Spalte 23/24/24=QS=“71“_Spalte 9/0/1=QS=“10“_Spalte #1/#1 als „11“ mit „11“_Summe 71+10+11=“92“ für Isoform „Reticulon 4“=1192AS. Wegen der Diagonale ergibt es eine Veränderung als weitere Isoform, wenn die entgegengesetzte Diagonale gezählt wird, weil die gleichen Werte mit anderen Endzahlen entstehen. Bei der Brückenform werden in Gegenrichtung lediglich dieselben Endzahlen verwendet. Das Reticulon-4_ RTN4 „Isoform A“ ist ein regulatorischer Neuriten-Wachstumsfaktor. Er reguliert die Faszikulation, Verzweigung und Ausdehnung von Neuriten. Reguliert die radiale Migration kortikaler Neuronen über einen RTN4R-LINGO1-haltigen Rezeptorkomplex[Leucin-reiche Repeat- und Immunglobin-ähnliche domänenenthaltende Protein (LINGO1)]. Das Protein (Mensch) „Lingo-1_Q96FE5“=620 AS wirkt in Verbindung mit RTN4 und RTN4R bei der Regulierung der Motilität neuronaler Vorläuferzellen während der kortikalen Entwicklung. Das Protein muss sich im Bereich der Fundstelle für Leucin=72E mit QS1+6=“7“_QS1+1=“2“ entwickeln. Als Merkmal wird eine Signalsequenz von 34AS als Merkmal erwähnt wird, die angehängt wird [LINGO1 – Wikipedia ]. Im Prinzip muss die Ziffer „0“ als Querschnittssymbol der Myelinscheide eingefangen werden. Mit „6“_QS#1_#1=“2“_QS1+0+9=Kunstgriff 10 für „0“_[Anhang Spalte „3/4“ als 34] für 620AS. Alternativ wird in Z.[382391 #1]“6“1/1 mit der Ziffer „6“ statt QS[1]+“6=[7]_QS1+1=“2“ für Leucin=72 begonnen und die Null aus QS1+#1+6+1=9_QS0+#1=1 mit Kunstgriff 9+1=10 für „0“ in „62_0“ für 620AS gewonnen [LINGO1 - Leucine-rich repeat and immunoglobulin-like domain-containing nogo receptor-interacting protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Lingo-1_H3BMW2“=18AS [Leucin-reiche Repeat- und Immunglobin-ähnliche domänenenthaltende Protein (LINGO1)] findet das Leucin=C6H13NO2=36+13+7+16=72E in der Codespalte QS#1+6=“7“_Spalte 1/1=QS=“2“. „Lingo-1=„18“AS kann einfach aus 6/6/6=QS6+6+6=18AS erzeugt werden, schließt dann aber nochmals einen geschlossenen Ring an, und zwar als #1_QS1+0+9=Kunstgriff 10 für „0“_QS3_4_(die bereits mitgezählte „0“ wird nochmals als Weiche durchlaufen) 0_1=“8“ mit „1“_Summe 0_3+4+0+1=“8“ für Lingo-1=18AS [LINGO1 - Leucinreiche Wiederholungs- und Ig-Domäne mit 1 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Der LINGO-1-Antagonist „BIIB033 kann das Überleben nach einer durch das Protein verursachten neuronalen Schädigung signifikant verbessern. Opicinumab (BIIB033)= C6406H9896N1708O2012S44 wird probeweise auf ein „1/44“ reduziert, und zwar auf ca. 456E und dann mit dem Faktor 44 als 4_QS1+#1_1_1=4 für „44“ verlängert. Diese Zählung legt sich seitlich neben „Lingo-1“ und nimmt die gesamte Protein-Brücke auf, nur die Spalte „9/0“ bleibt stehen. Die Reticulon-4_RTN4 „Isoform B“ hemmt das Protein (Mensch) „Serin-Palmitoyltransferase“ (SPTLC1)=473AS [SPTLC1 - Serine palmitoyltransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Transferase folgt der Katalyse: „H + Hexadecanoyl-CoA + L-Serin = 3-Oxosphinganin + CO2 + CoA+.“ Das Serin=C3H7NO3=18+7+7+24=56E liegt in der Spalte 2/2/2_QS4+1=5 für 56E. Hexadecanoyl-CoA=C37H62N7O17P3S-4 (mit Tetra-Ionen)=222+62+49+136+45+16=530E [Hexadecanoyl CoA | C37H62N7O17P3S-4 | CID 45266605 - PubChem (nih.gov) als QS2+3+ 0 (aus Kunstgriff 9+#1=10 für 0)=5_QS#1_1+1#=3_[4]“0“ mit 5_3_0 für 530E. 3-Oxosphinganin=C18H38NO2=108+38+7+16=169E [MetaNetX: MNXM559 - 3-Oxosphinganin] in 2 Richtungen zählbar als #16_QS1_1_1+6=9 für 169E. CoenzymA (CoA)=C21H36N7O16P3S=126+36+49+128+45+16=400E als „40“_Kunstgriff 9+#1=10 für „0“ mit 40_0 für 400E [Coenzym A – Wikipedia]. Reticulon- 4_¬ RTN4 „Isoform C“ hemmt gemeinsam mit „Isoform B“ die BACE1-Aktivität und die Verarbeitung von Amyloid-Vorläuferproteinen (APP). Das Amyloid-Precursor-Protein (APP) ist als Membranprotein eine Ausgangssubstanz für die Biosynthese von Beta-Amyloid (Aß). Protein (Mensch) „Amyloid-beta precursor (APP)“=770AS. Das Protein umrundet die Ziffer „0“ und nimmt sie auf, und zwar als QS3+4=7_QS4+1+#1_#1=7_0 mit 7_7_0 für APP=770AS [APP - Amyloid-beta precursor protein - Homo sapiens (Human) | UniProtKB | UniProt]. APP enthält eine Kupfer-bindende Domäne, so dass Kupfer=29 als Summe „2*(QS8+2=20“ + Spalte 3/3/3=9 für Kupfer=29E am Matrixrand liegt [Amyloid-Precursor-Protein - DocCheck Flexikon]. Bei der Spaltung von APP entsteht Beta-Amyloid (Aß), und zwar als Amyloid-beta 40=40AS und Amyloid-beta 42=42 AS, die im APP als Spalte „40“/QS41+#1=“42“ gestapelt sind und getrennt wurden. Es sind neurotoxische Bruchstücke, die zur Alzheimer Erkrankung führen. Die Vorläuferproteine (APP) werden durch das Protein (Mensch) „Beta-Sekretase1_A0A024R3E8 (BACE1)“=476AS gespalten. „Brace1“ kann zunächst dreizeilig verlaufen, dann aber noch ohne Wertänderung mit 2 Kunstgriffen eine Wellenform bilden. Aufsteigend als 38=QS=2_2 mit Summe 2+2=“4“_QS3_4=“7“_QS4+1+#1=“6“ mit „4“_“7“_QS6 +2 wertfreie Kunstgriffe [10 für 0]=“6“ für 476AS. Kunstgriffe QS#1+0+9=10_QS#1+6+1_1_1=10 für „00“. Die Kupfer-Bindung (Cu=29E) liegt wie für „APP“ am Matrixrand. Für die Zink-Bindung wird zusätzlich die Spalte 3*(QS8+2)=30E gezählt. Der angehängte Schwanz klammert eine Spalte „6/6“= QS6+6=“12“ ein [BACE1 - Beta-Sekretase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. In diese freie Spalte legt sich das Protein (Mensch) „BACE1_Q6YBQ9“=12AS [BACE1 - BACE1 - Homo sapiens (Human) | UniProtKB | UniProt]. Beta-Sekretase (Bace1) gehört zu den Proteasen und spaltet andere Proteine, die verändert oder abgebaut werden. Ihr aktives Zentrum, mit dem sie ihre enzymatische Funktion ausübt, befindet sich in der „extramembranären Domäne“ und enthält zwei Aspartat-Reste [Beta-Sekretase – Wikipedia]. Asparaginsäure (Aspartat)=C4H7NO4=24+7+7+32=70E. Für die Dopplung 140E ist die Null in falscher Position. Die Zahl QS3+4=7_0=70 und gespiegelt aus QS#1+6=7_0 =70 kann doppelt gebildet werden, wenn die zentrale Null doppelt verwendet wird. Als weitere Funktion reguliert „Reticulon-4_RTN4 „Isoform C“ die Apoptose von Herzmuskelzellen (Kardiomyozyten) bei hypoxischen Zuständen [RTN4 - Reticulon-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Für das Herz kann die Zeitbasis 60 aus der zentralen Zahl 40 und der dreizeiligen Spalte QS8+2=10 auf– und absteigend gezählt werden als QS10+10+40=60. Kardiomyozyten- Maße: Durchmesser =(10)–25 µm und Länge= (50)–100 µm. Die Basiszahlen sind vorhanden, gesucht wird der Längenzuwachs von 1nm auf 1µm: 100 aus QS91+6+Spalte 1/1/1=3 mit Summe=91+6+3=100; Breite 25 aus 38=QS=2_QS2+3=5 für 25 [Herzmuskelzelle - DocCheck Flexikon]. Die zentrale Null ist das geometrische Herz, so dass die „0“(Null) im Faktor 1000 aufgepumpt werden muss. Der Zeile Z.38241#16162“0“7“0“6“0“9666“7“ sind zu diesem Zweck zur Zählung 1000 im Code 3 Nullen für 100 µm=100.000nm nachgeschaltet und Endziffer Form=7. Ebenfalls ist die Zeitbasis 60 enthalten. Die Pumpfunktion ist mit QS=1+6+1+6+2+0+7+0+6+0+9+6+6+6+7=Physik=63 vorhanden. Die Bewegung „666“ ist flexibel und ist im „1616“ mit der Zählgröße „11“ kombiniert.
In diesem Bereich können weitere hemmende Proteine gesucht werden. Das Protein (Mensch) „Reticulon-4-interacting protein 1_ RTN4IP1“=396AS kodiert für ein mitochondriales Protein, das mit Retikulon-4 interagiert. Das Gen ist ein starker Inhibitor der Regeneration nach einer Rückenmarksverletzung. Bei der Interaktion legt sich das Protein mit der Startzahl „39“ zusätzlich auf die Proteinbrücke und berührt abschließend den rechten Brückenpfeiler, und zwar als „39“_QS#1+6+1_1_1=10 mit Kunstgriff 10 für 0_6 mit „39“_QS0+6=“6“ für 396AS. Mit dem Kunstgriff stört das Protein die Leucin-Zählung von Lingo-1, d.h. das Protein wirkt als Ersatzpartner. Ohne Kunstpause kann das Protein wegen der Blockzahl „39“ alternativ selbst nach links überspringen und die Sehnervspalte „2/2/2“=QS=“6“ für 396AS zählen. Funktion: Spielt eine Rolle bei der Regulierung des Neuritenwachstums der retinalen Ganglienzellen (RGC) und damit bei der Entwicklung der inneren Netzhaut und des Sehnervs. In der Code-Serien-Spalte #“1“61“[6]/#[1]“61“[6]/#[1]“61“6“ repräsentiert die Diagonale das Auge über die Hyaluronsäure=C14H21O11N=84+21+88+7=200E als Summe „1“_(3*61=)“183“_“6“=200E [RTN4IP1 - Reticulon-4-interacting protein 1, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Mast1_Q9Y2H9“=1570AS (Mikrotubuli-assoziierte Serin/Threonin-Proteinkinase 1) ist ein Mikrotubuli-assoziiertes Protein, das für die korrekte Entwicklung des Gehirns unerlässlich ist. Scheint das Dystrophin/Utrophin-Netzwerk über die Syntrophine mit Mikrotubuli-Filamenten zu verbinden. Das Protein verläuft wellenförmig als „1“_QS4+1=“5“_Spalte (3/4) mit QS3+4=“7“_QS9_0_#1=10 für 0_QS#1+6+1+1+1=10 für „0“ mit Summe=“157“_QS0+0=“0“ für 1570AS. Im Zählweg wird die leere Spalte 6/6=QS6+6=Magnesium=12 eingeklemmt. Das Protein kann diesen Zählweg nur finden, wenn der Cofaktor „Magnesium (Mg^2+)“ die Spalte besetzt. Bei der Katalyse wird ATP=260E in Adenosindiphosphat (ADP)=C10H15N5O10P2=60+15+35+80+30=220E verwandelt, und zieht dabei spiegelbildlich vom Code zum linken Matrix-Rand, der mit der Ziffer „0“ von ADP beginnt, und zwar in der Spalte Z.“38“2“/Z.[3]8“2“ als ADP=“2“_“2“_38=QS2_8=10 für „0“ für ADP=220E. „ATP“ schließt direkt an, und zwar als QS4+0+#1+6=11=QS1+1=2_Spalte 6/6 absteigend „6“_QS9+1=10 für „0“ mit 2_6_0 für ATP=260E [MAST1 - Microtubule-associated serine/threonine-protein kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Zwei Mast1-Proteine könnten sich zu einer Kette überschneidend in der Ziffer „1“ der Spalte 9/0/1 verbinden, wobei die „9/0“ leer bliebe. Das Protein muss dann noch durch 2 Kunstgriffe verlängert werden, um seitlich neben der Spalte 6/6=QS=12=Magnesium eine Magenesium-Ionen-Bindung auszuführen. Protein (Mensch) „Mast1_K7EME4“=475AS (Mikrotubuli-assoziierte Serin/Threonin-Proteinkinase) als 38=QS2_2=“4“_Spalte (3/4)=3+4=“7“_QS4+1=“5“ plus 00 und Mg=12E für 475 AS [ MAST1 - Mikrotubuli-assoziierte Serin/Threonin-Kinase 1 - Homo sapiens (Mensch) | UniProtKB | UniPrott]. Das Protein (Mensch) „Mast1_K7EJI7“=133AS (Mikrotubuli-assoziierte Serin/Threonin-Proteinkinase) liegt in der Spalte 9#16/0#16/1#16 als #“1“_QS#16_1+#16=“33“ mit 1_33 für 133AS. Die Bindung von Magnesium-Ionen ist mit enthalten, weil die Spalte 6/6=QS=12=Magnesium mit aufgenommen wird. Serin=C3H7NO3=18+7+7+24=56E liegt in der Spalte QS2+3=5/QS2+4=6 mit 5_6 für Serin=56E. Threonin=C4H9NO3=24+9+7+24=64E liegt in der Spalte #1616/#1616 als 4*16=64E [MAST1 - Mikrotubuli-assoziierte Serin/Threonin-Kinase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Mast1_Q9Y2H9“=1570AS (Mikrotubuli-assoziierte Serin/Threonin-Proteinkinase 1) „scheint das Dystrophin/Utrophin-Netzwerk über die Syntrophine mit Mikrotubuli-Filamenten zu verbinden“. Das Protein (Mensch) „Dystrophin_DMD“=3658AS verankert die extrazelluläre Matrix über F-Aktin im Zytoskelett. Ligand für Dystroglykan. DMD ist das größte Gen des Menschen. Es ist 2,4 Millionen Basenpaare groß, besteht aus 79 Exons und benötigt über 16 Stunden, um transkribiert und kotr Das DMD-Gen ist das größte bekannte Gen beim Menschen. Der Cofaktor Magnesium dient zur Orientierung, indem die Spalte 6/6=QS=12=Mg in der Ziffer „6“ durchkreuzt wird. Das Protein läuft spiegelbildlich als QS4+0+16+16=“36“_QS2+3=“5“_“8“. Die Ziffer „8“ von „Dystrophin“ bindet dabei in das Protein „Dystroglykan“ dessen Ligand es ist. Protein (Mensch) „Dystroglycan 1_ Q14118“=895AS liegt spiegelbildlich in der Zeile Z.38239 als QS1+6+1=“8“_“9“_QS2+3=“5“ für 895AS [DAG1 - Dystroglycan 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die Myelinscheide (Markschiede) ist eine lipidreiche Schicht, die die Axone mancher Nervenzellen umgibt. Sie wird gebildet aus der myelinhaltigen Zellmembran von Gliazellen (Oligodendrozyten im Zentralnervensystem, Schwann-Zellen im peripheren Nervensystem), die zu mehreren nebeneinander den Fortsatz der Nervenzelle umwickeln. Myelin ist eine Biomembran mit 70% Lipidgehalt gegenüber 30% Proteinanteil. Ohne Cholesterin=C27H46O=162+46+8=216E unter den Lipiden, kann die Isolations-Schicht eines Nervs nicht aufgebaut oder repariert werden [Myelin – Wikipedia]. Bei der saltatorischen Erregungsleitung werden Aktionspotentiale an den sogenannten „Ranvier-Schnürringen“ aufgebaut, wo zwischen zwei umhüllenden Gliazellen die dicke Myelinscheide des Axons unterbrochen ist. Das Aktionspotential läuft nicht kontinuierlich entlang der Nervenfaser, sondern “springt“ von Schnürring zu Schnürring. Die Zellmembran im Bereich der Ranvier-Schürringe hat eine hohe Dichte an spannungsgesteuerten Natriumkanälen [Ranvier-Schnürring - DocCheck Flexikon]. Die Zeilen Epi.Vir.Z.3841#“1616“2“0706096667/ Z.3842#1616“1“64“79“834806/ Z.3843#“1616“1“2253793966 enthalten aufgrund der angehängten Ziffer „1“ zweizeilig die Besonderheit #1616“1“=QS1+6+1+6+“1“=33=Membran, wobei mit dem angehängten Kreis=64 eine Umwicklung #“16161“64“97“dargestellt wird. Der jeweils circa „0,2 bis 1,5“ Millimeter lange Axonabschnitt zwischen zwei solchen Schnürringen wird als Internodium bezeichnet Myelinscheide – Wikipedia]. Mit der Spanne von „0,2 bis 1,5 mm“ wird eine symbolische Länge in den Code gezeichnet, um die Zeile für die Umrechnung von Nanometer (nm) Millimeter (mm) zu erreichen. Die Zeile EPI.Vir.Z.38241#161620“7“060“9666“7“ enthält bereits die 3 Nullen für den Bedarf einer Umrechnung von Mikrometer in Nanometer. Die Randzifer „7“ gilt für „7“=Nerv=Form. Die Umrechnung von Millimeter in Nanometer unterscheidet sich durch die Nutzung einer Potenzzahl „10^6“ als (Faktor 10^6)=„0“6“0“(0=Reduzierung)“, wobei aufgrund real 1,5mm statt „15“ die nachgeschaltete „0“(Null) gleichzeitig zu einer Reduzierung führt. Die Anzahl der Wicklungen richtet sich nach der benötigten Spannung. Je schneller die Übertragung, desto mehr Wicklungen sind erforderlich. Eine fixe Anzahl ist nicht bekannt [Beispiel siehe: outer mesaxon myelinated nerve Dr. Jastrow's electron microscopic atlas (drjastrow.de)]. In der Membran existieren Kalium-, Chlorid- und Natrium-Kanäle. Die beiden letzteren sind beim Ruhepotential geschlossen. Natrium ist als Serie Z.38=QS=11=Natrium und Chlorid als „161“=1_QS6+1=7 für Chlor=17 enthalten. Weil Kalium=19 fehlt, wird die über 5 Zeilen vorhandene Zahl „79“ als Nerv=7_“9“ gelesen muss, und die Ringverbindung mit Kunstgriffen 10 für „0“ jeweils als Gewinn einer nutzbaren Ziffer „10“ für Summe=(Kunstgriff)“10“+“9“=Kalium=19. Unter ATP-Verbrauch werden drei Na+-Ionen nach Außen transportiert und im Gegenzug zwei K+-Ionen nach Innen. Dafür ist im Code die Summe „3_2_5“ enthalten. ATP=C10H16N5O13P3=60+16+35+104+45=260E ist daran direkt gebunden, und zwar in der Spalte „325/060“ als „2_60“ für ATP=260E. Auf diese Weise wird das negative Membranpotential von ca. -70mV aufrecht erhalten [Das Ruhepotential (biologie-schule.de)].
Millivolt im Code: Die Evolution findet im Code den biologischen Winkel „-70°“, kann aber mit den physikalischen -70mV nichts anfangen. Basis ist die x-Achse als Ruhe-Winkel=0° [0 mV]m unter der sich im 3. und 4. Quadraten eine Halbkreis öffnet. Die Schwerachse=84 setzt sich im Ohr des Menschen aus den Bogengängen=64=Kreis und den liegenden Calcium-Kristallen=20E zu 64+20=84=Gleichgewicht zusammen. Die Schwerachse=84 hängt vertikal in der Y-Achse im Lot-Winkel = -90° [-90mV]. Wird dieser Ruhe-Zustand stark gestört, fällt das Calicium aus dem Gleichgewichtsensor 64+20=Calcium=84 heraus. Der -90°-Ruhe-Winkel verdreht sich, so dass der Drehwinkel +20°=Calcium [+20mV] die Erregungsschwelle ist, ab der plötzlich ein Reiz weitergeleitet wird. Durch die Erregungen kommt die vertikale Schwerachse in Bewegung, so dass der 90°-Winkel als Sektor zwischen Winkel +20° [+20mV] und – 70° [-70 mV] steht [Winkel-Summe +20°+ ABS(-70°)=90°]. Bei maximaler Erregung kann sich der Sektor um maximal 90° drehen, und zwar bis zum max. Erregungswinkel +90° [90mV], wobei das maximal erregte Ruhe-Lot jetzt horizontal in der x-Achse beim Winkel „0°“ steht. Bei der „Saltatorischen Erregungsleitung“ baut sich über die isolierte Strecke der Myelinscheide von 1,5 mm am Ranvier-Schnürring eine Spannung auf, über die der Reiz als Signal springen kann. Der Ranvier-Schnürring unterbricht die Markscheide, so dass über „1“ µm (Mikrometer) die Isolierung fehlt. Die Spalt-Länge=“1“µm steht als Ziffer am rechten Code-Rand, so dass für 1000 nm noch der Faktor 1000 benötigt wird. Hierfür wird folgende Symbolik verwendet: In der Spiegelung mit 8“0“2_28=QS2+8=10=Kunstgriff 10 für „0“ wird die „0“ als Unterbrechung der Markscheide in 8“0“2 eingeklemmt. Die Membran-Zählung „16161“=16+16+1=33 wird in Z.38244/45 zu „16160“ entwickelt, so dass eine Spalte „100“ in die Z38245 für 2 weitere Nullen einbindet, und zwar mit Spalte „1/0/0“ als „10“_[16_QS1+6=Form=7]_“0“ [3]8“0“2 [375]_28_“1“ für „1“*1000=1000 nm=Spalt=1µm [Ranvier-Schnürring - DocCheck Flexikon].
Paranodale Septate Junctions: Der Nerv=7 liegt im Schnürring frei, so dass beidseitig die der umwickelte Nerv sichtbar wäre. Eine Lochscheibe für dem durchgefädelten Nerv=7 muss für eine Seitendabdeckung abgebaut werden. Und zwar mit 2+3=5_Nerv=7_5=Struktur. Die beidseitige Lochscheibe versteckt sich mit dem Symbolloch in der Spiegelung 8_0_2 _28 mit QS2+8=10. Von der Scheibe=Kreis=64 wird das Loch mit QS=10 subtrahiert 64-10=54. In der Blickrichtung ist die „54“ in der Z.Nr. Z.382“45“ und einer Codespalte „4/5“. Natrium ist in der Serie Z.38xxx mit QS3+8=11 stets vorhanden, aber die Natrium-Kanäle sind am Schnürring besonders eng gepackt, weil die 38=QS3+8=“11“=Natrium nochmals im Kanal-Code sitzt mit Z.“38“245#_“0380“. Die seitliche Abdichtung wird vom Tunnelprotein „Connexin 32“ realisiert. Protein (Mensch) „Gap junction beta-1“=283AS [Connexin-32 (Cx32)]. Das Protein ist in der Z.[38245#16160]“38“0“2“[375281] als Basisversion gespiegelt mit Tunnelloch als „38_0_2“ für 283AS lesbar, und zwar bei 2 Hemikanälen doppelt, weil die Zahl „802“ in der Vorzeile nochmals vorliegt und über die Spalte „8/3“ verbunden ist. Beiden Zeilen ist die Anzahl= 6_0=Molekül vorgelagert, weil jeder Hemikanal aus 6 Molekülen besteht. Connexin-32 enthält vier Transmembrandomänen, die bei einem Zusammenbau „Gap Junctions“ bilden. Jeder dieser Gap Junctions besteht aus zwei Hemikanälen (Connexions), die wiederum aus sechs Connexin-Molekülen (Gap Junction Trans-Membrane Proteins) bestehen [ GJB1 – Wikipedia]. „Eine Gap Junction besteht aus einem Cluster dicht gepackter Paare von Transmembrankanälen, den Connexons, durch die Materialien mit niedrigem MW von einer Zelle zu einer benachbarten Zelle diffundieren“ [GJB1 - Gap junction beta-1 Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Mutationen des GJB1-Gens führen u.a. zur Charcot-Marie-Tooth-Krankheit (CMTX). Nervenimpulse aus dem Gehirn erreichen dabei nicht mehr die entsprechenden Muskeln, so dass diese Muskulatur abgebaut. Der Muskel „55“ ist in dieser Deutung mit dem Nerv=7 kombiniert, und zwar in QS2+3=“5“_7_“5“.
Ruhezustand und Erregung: In der Serie Z.3824x können bis zur Z.Nr.Z.38244 die Schwerachse „84“ aus Spalte Z.382“4“3/Z.382“4“4“ mit QS4+4=8_4 für Schwerachse=84 addiert werden. Die Maßzahl für die Länge der Myelinscheide „15“=1,5mm liegt in Z.38239 und über 6 Zeilen gezählt, ergibt 6*(QS8+2=)10=60 die Zeitbasis=60 zur Zeitzählung. Der mögliche Nutzen der Maßzahl 1,5mm ergibt sich als Kehrwert 1/1,5=0,666, so dass über 6 Zeilen mit 6*0,66666=[6*(1/1,5)]=“4“ entsteht, die sich mit 60+4=64=Kreis ergänzen. Am Code-Rand #16 kann der Kreis über 4 Zeilen mit 4*16=Kreis=64 entstehen. Das sind die ruhende Schwerachse in den Z.Nr.382“4“3/Z.382“4“4“ und der erregte Kreis von der Maßzahl in Z.38239 bis Z.38242 mit dem Code-Rand #“16“. Ruhezustand: Winkelsumme „180°“ zur Kooperation der Zeilen Z.38244/43 aus „60+80+30=170°“ mit Defizit „10“. Die Zeile Z.38243 enthält keinen Winkel bildet, aber die Spalte 1/0 =10° für Winkelsumme 170+10=180° für die unerregte Ausgangssituation mit der Schwerachse im Lot bei -90°. Erregung: Die darüberliegenden 4 Zeilen müssen zur Aktion die Winkelsumme=360° bilden, so dass sich dynamisch eine Erregungskurven auf- und abbauen kann. Daran sind zunächst nur die Zeilen Z.38241 mit den Code-Winkeln QS20°+70°+60°=150° und Z.38242 mit 80°. Erster Winkelanteil der Erregung (alpha)=150°+80°=“230°“ (Defizit 360°-230°=130°). Zur Kooperation müssen die Zeilen Z.38239/40 das Defizit durch den Spaltenwinkel 130° mit der dreizeiligen Spalte“91“592/24“9“3“2/207“0“6 kompensieren. Zweiter Winkelanteil der Erregung (beta)=Spaltenwinkel-Summe QS91+9=100_QS3_0=30 mit QS100°+30°=“130°.“ Fazit: Erregungswinkel=230°+130°=360°. Even a blind chicken stumbles across a grain from time to time! Der Ionenstrom depolarisiert die Membran am 1,5 mm entfernten, folgenden Schnürring ausreichend, um ein erneutes Aktionspotential auszulösen. In der Zeile Epi.Vir.Z.38238#161“63“33“86“20“8553 wird statt einer Membran=“33“ unpassend eine spezielle Basallamina „333“ angezeigt, die aber als Physik=63_Membran=33 umgedeutet werden kann, so dass Elektronen bewegt werden. Der Reizstrom wird mit dem Schalter „63“ zur Outsourcing-Aktivität. Bei einer Immunerkrankung wird diese Membran der Myelinscheide angegriffen und geschädigt. Normal ist, wenn die Zahl Maßzahl „15“ für 1,5mm gelesen wird. Das Problem ist eine Ringbildung, die über die „333“ in die Maßzahl „15“ als Umkreisung von der Gegenseite eindringt, weil statt 6 Zeilen zusätzlich die Vorzeile zur Maßzahl erreicht wird. Dieser Ringschluss kann durch Medikamente erschwert werden. Der Wirkstoff „4-Aminopyridin“=C5H6N2=30+6+14=50E ist im Medikament „Dalfampridine“ enthalten. „Fampridin“ ist ein Wirkstoff aus der Gruppe der reversiblen Kaliumkanalblocker, der bei Multipler Sklerose zum Einsatz kommt, um die Gehfähigkeit von erwachsenen MS-Patienten zu verbessern. „4-Aminopyridin“ kann 3 Isomere je nach Lage der Aminogruppe (–NH2) mit 7+1+1=“9“ am Pyridinring bilden. Wäre alle 3 Isomere im Medikament enthalten, ist das sinnvoll, weil dann zumindest der Muskel „55“ nicht mehr mitgelesen wird. Der Komplex zieht über 6 Zeilen, wobei die 3 Isomere lückenlos verschachtelt sind: „1. Isomere“ aufsteigend ab Z.38238 in der Spalte [6]“20“/“9“28“/“2“[57] mit QS20+28=48_QS9+2=11=QS1+1=2 mit QS48+2=50E. „2. Isomere“ als QS5+0+6=11=QS=2 _Spalte 5/3/0=QS5+3+0=8 mit Summe=2+8=10 für „0“_QS1_49=“50“ mit Summe 0+50=“50“ für 50E. „3. Isomere“ in der Spalte [249]/[2]“0“7“/“16“4“/“1“22“ als QS0+7_4=11_QS16_1+22 mit Summe 11+16+1+22=50E [Aminopyridine – Wikipedia].
Schädigung der Myelinscheide: Wird eine Maß-Codierung zerstört, ist eine Erkrankung zu erwarten. Die Maßliste liegt im Code, so dass darin das Protein (Mensch) „MOG_Q16653=247AS (Myelin-Oligodendrozyten-Glykoprotein) zur Verkörperung liegen muss [MOG - Myelin-oligodendrocyte glycoprotein - Homo sapiens (Human) | UniProtKB | UniProt]. „MOG“ ist Nebenbestandteil der Myelinscheide. „MOG“ wird erst zu einem „relativ späten Zeitpunkt“ auf den Oligodendrozyten und der Myleinhülle gebildet [Myelin-Oligodendrozyten-Glykoprotein – Wikipedia]. „MOG“ liegt zunächst mit Epi.Vir.38240#1616“24“2932579567/ Epi.Vir.38241#16162“07“06096667 in der Spalte „24/07“ als 24_QS0+7=7 für 247AS. Diese Zählung kann nunmehr durch eine Kette von Kunstgriffen 10 für „0“ verlängert werden. Mit der Zahl „24“ als Block kann die engste Kurve Z.38239#_QS9+1=“10“_Spalte 5/32/0 =QS5+3+2+0=“10“ mit 2 wertfreien Verlängerungen zu einem geschlossener Kreis geführt werden. Das Protein (Mensch) „MOG_C9JTE0=209AS (Myelin-Oligodendrozyten-Glykoprotein) entnimmt die Zahl „20“ in Z.38241 und steigt mit 2 Verlängerungen QS7_0_3=10 und QS9+1=10 lotrecht in die Zeile Epi.Vir.38239#1616“29“15“92“83523 herab, die das Längenmaß von 1,5 mm als Zahl 15 enthält. Darin gehört die Ziffer „1“ zum Kunstgriff, links liegt die Ziffer „9“ mit 20_9 für 209AS. Die Länge „15“ wird beidseitig mit der Natrium-Spiegelung „QS2+9=11_“15“_QS9+2=11=Natrium“ eingefasst [MOG - Myelin-oligodendrocyte glycoprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Darin ist die Zahl „92“ nochmals als Spalte 9/2 vorhanden, mit der Ziffer „2“ in Epi.Vir.38240#_2493“2“5. Die Ziffer „2“ soll für die minimale Länge 0,2 mm stehen, so dass die 92er Spalte zweckmäßig vom Protein (Mensch) „MOG_E9PG44=92AS besetzt wird [MOG - Myelin-Oligodendrozyten-Glykoprotein - Homo sapiens (Mensch) | UniProtKB | UniProt]. In der Spalte „29“15“92/2493“2“5“ mit QS2+9=11=QS2_24 für 224AS und eine wertfreie Verlängerung QS“1“+9 =10 für „0“ zurück mit der Ziffer „1“ im Längenmaß „15“, und zwar mittels Protein (Mensch) „MOG_ A0A0G2JHA9=224AS [MOG - Myelin-oligodendrocyte glycoprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MOG_A0A140T9L1“=179AS enthält zuletzt in Z.38242 die Ziffer „79“ die fortlaufend in 5 Zeilen vorhanden ist. Vorgelagert in der Z.38237 kann die Ziffer „1“ aus der Maßzahl „15“ entnommen werden. Die Verbindung zur Zahl „79“ wird durch 3 Kunstgriffe gelegt, und zwar aufsteigend von „1“_QS2+9=11=Natrium als QS=2_4+2_2+0=10_QS6+4=10_QS2+5+3=10_“79“ mit QS1+0+0+0=“1“_“79“ für 179AS [MOG - Myelin-oligodendrocyte glycoprotein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Immunglobulin (IgG) bindet über Rezeptoren an der Oberfläche von Blutzellen oder auf bestimmten Organzellen, um das Verhalten dieser Zellen zu beeinflussen. Auf diese Weise werden Zellvermehrung und Zellreifung, aber auch die Aktivität von Zellen des Immunsystems reguliert. Das Immunglobulin ist membrangebunden, so dass mit den beiden Zahlen 33 und 333 bereits eine Nähe zur Maßzahl 15 vorliegt. Die variablen Domänen werden durch einen Prozess namens V-(D)-J-Umlagerung zusammengesetzt. Es handelt sich um einen Prozess, bei dem die Erbinformation (DNA) in planmäßig verändert wird [V(D)J-Rekombination – Wikipedia]. Das Protein (Mensch) „Immunoglobulin gamma-1 heavy chain_P0DOX5¬_IGG1“= 449AS liegt zunächst in der Z.Nrn.-Matrix Z.[3823]“9“/Z.[382]“4“0]/Z.[382]“4“[1] als 4_4_QS0+9=9 mit 44_9 für 449AS [Immunoglobulin gamma-1 heavy chain - Homo sapiens (Human) | UniProtKB | UniProt]. Parallel liegt es auch im Code in der Spalte [2]“9“[1]/“2“4“[9]/“2“[07] als QS2+2=4_4_9 für 449AS. Die Ziffer „9“ kann dabei vertikal oder horizontal angeschlossen werden. Beide Anschlüsse lassen sich mittels 4 Kunstgriffen 10 für „0“ zu einem Ring durch die Membranzahlen 333 und 33 verbinden. Darin ist die Spalte „38“=QS=11=Zählgröße/“15“ mit der Maßzahl „15“ eingeschlossen. Ring-Verbindung: Spalte 7/3=QS=10_QS6+1+3=10_Spalte 62/2=QS6+2+2=10_Zahl 325=QS3+2+5=10. Das Protein (Mensch) „Immunoglobulin gamma-1 heavy chain_ P01857_IGHG1“= 399AS kann in die Ringverbindung mit der Spalte 613/386 eingreifen als „3“_QS1+8=“9“_QS6+3=“9“ mit 3_9_9 für 399AS, wobei nur noch die Maßzahl „15“ umrundet wird. Das Protein kann weiterhin Z.Nr.-Matrix und Code-Randspalte Z.[3824]“1“#1/#1/#1616/#1616/#1616_3 verbinden und am Ring anschließen mit QS1_#1_#1=“3“_ QS(6*16=)96_3=“99“ für 399AS [IGHG1 - Immunoglobulin heavy constant gamma 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Antikörper bestehen i.d.R. aus zwei leichten und zwei schweren Ketten, die über Disulfidbrücken miteinander verbunden sind. Somit liegt eine schwere Kette in der Matrix und die andere im Code. Mit Schwefel=16 ist die Serien-Randspalte „1616“ die Disulfidbrücke [Schwere Kette - DocCheck Flexikon]. Die leichte Kette kann den rechten Code-Rand nutzen, weil sich mit der Spalte [6]7“3“/55“3“/525 eine Membran=33 bildet. Das Protein (Mensch) „Immunglobulin-Lambda-Konstante1_IGLC1“=106AS als QS7+3=“10“_QS3+3=“6“ für 106AS [IGLC1 - Immunglobulin-Lambda-Konstante 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Immunoglobulin kappa constant_IGKC“=107AS liegt lückenlos neben der besetzten Randspalte als QS5+5=“10“_QS5+2=“7“ für 107AS [IGKC - Immunoglobulin kappa constant - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IGKV1-39 - Immunglobulin kappa variabel“=117AS liegt in 3. Reihe vom rechten Code-Rand und grenzt am Ringschluss der schwere Kette in der Spalte [2]“83“[523]/[5]“7“[9567] mit QS8+3=11_7 für 117AS. Beim Menschen beträgt das Verhältnis zwischen den beiden leichten Ketten Kappa zu Lambda ca. 2:1. Die Proteine werden nach der Schwerachse „84“ ausgerichtet. Die Basiszahl 28 und 2(0)8 sind enthalten und ergeben das Drittel mit 84/28=“3“. Für „2:1“ mit 56/28. Die Zahl 56 verbindet beide leichten Ketten als Spalte „6“73/“5“53 und die „[6]2(0)8“ bindet am Ringschluss der schweren Kette. Im Blut ist das Verhältnis umgekehrt, so dass dort mehr Lambda- als Kappa-Leichtketten vorhanden sind [Freie Leichtketten – Wikipedia]. Das Blut=26 bindet als Bezug gespiegelt in die Schwere Kette ein mit „[6]2“(0)8 bzw. liegt als Spalte 2/6=“26“ neben Lambda und stört Kappa. Ende der Ergänzung: Neuriten / Myelinscheide (Markscheide)_dat22.08.2023
Dornen (Spines / Spinulae dendriticae ) der Dendriten: Die Anreicherung von Actin in den Dornen ergibt einen Hinweis auf deren Position im Zeilenlauf. Nur bei jungen Nervenzellen konzentrieren sich die Actin-Filamente auf den Wachstumskegel von auswachsenden Axonen [Actin - Lexikon der Neurowissenschaft (spektrum.de)]. Das Protein (Mensch) „G-Actin“=375AS wird als globuläres Einzelmolekül (G-Actin) synthetisiert. Das Protein liegt in der Randspalte [9407]/[9]“5“2“3“2“]/“2“1“[940] zweizeilig von Z.38251 absteigend als QS2+1=“3“_QS5+2=“7“_QS3+2=“5“ für 375AS [ACTG1 - Actin, cytoplasmic 2 - Homo sapiens (Human) | UniProtKB | UniProt; ACTB - Aktin, zytoplasmatisch 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. In Z.38248 enthält die Spalte „1126904/6902189“ Kationen und Moleküle, die wegen der Polarität von G-Actin binden: „26“_Spalte 9/1 mit QS9+1=10 für „0“ als ATP=260E; QS1+1=“2“_“2“ über Spalte 2/0 mit „0“ für ADP=220E. Entweder QS“0+2+1+8+9“=Calcium=20E oder Magnesium=12E, weil Magnesium in Gegenrichtung gezählt wird und mit enthalten ist. G-Actin wird in F-Actin umgewandelt, wenn diese Polarität gestört wird. Entweder, weil ein Wechsel Calcium/ Magnesium vorliegt, oder weil Kalium=19E in der Spalte „9/1“= 1_9=Kalium=19E die Bildung der Ziffer „0“ für ATP verhindert, oder weil ADP ohne die Zählung von Calcium die Start-Null nicht mehr mitnutzen kann. Bei der Umbildung zum filamentösen F-Actin wird die Randzahl „32“ für QS3+2=“5“ durch Zählung einer Ziffer „4“ ersetzt. Die beiden Möglichkeiten bilden eine Doppelkette. Fall 1: Statt der Randzahl „32“ wird absteigend in der Spalte 4/2 die Ziffer „4“ gelesen. Fall 2: Aus der Zahl „32“ wird weiterhin die Ziffer „3“ gelesen und absteigend als QS3_0_8=11=QS=2_2 als Summe 2+2=“4“ bis zu einer alternativen Randziffer „2“ durchgezählt. Ist das Actin-bindende Protein „Topomyosin“=568AS aus 2 gewundenen Strängen von je 284AS im Actin versteckt? Ja [Tropomyosin – Wikipedia]. Beide Anteile liegen gekoppelt ab Z.38246 in der Randspalte 402/475/482 als „2“_QS0+4_4=“8“_ausweichend seitlich aufsteigend QS0_4=“4“ für 284AS. In der Achse 4/4/4 wird der 2. Anteil gespiegelt als Randzahl „482“ für 284AS gelesen. An den Dornen sitzen Synapsen. Als zusätzliche Funktion dienen die Synapsen zur Proteinsynthese, so dass dafür nicht allein der Zellkörper zuständig ist.
Dendrit: Die Dendriten bilden sich als Fortsätze um den voluminösen Zellkörper (Perikaryon). Mikrotubuli-assoziierte Proteine (MAPs) sind sowohl im Zellkörper (Perikaryon) als auch in den Dendriten vorhanden, so dass der Unterschied nur aus der doppelten Darstellung im Zeilenlauf erkennbar wird. Der Dendrit orientiert sich am rechten Code-Rand. Der Zellkörper folgt später. Das Protein „MAP2“ wird zusammen mit „Tubulin“ (Baustein für die Mikrotubuli) ausgewählt. „Tubulin“ besitzt den Cofaktor „Magnesium (Mg^2+)“=12E. „MAP2“ ist häufig, und zumeist im Gehirn zu finden. Es ist nur selten an Mikrotubuli gebunden und weist eine Tendenz zur Selbstassoziation auf. Es sind 3 Unterarten vorhanden: MAP2A und MAP2B sind schwerer und agieren als thermostabiles Paar in Nervenzellkörpern und Dendriten eines erwachsenen Hirns. Das leichtere MAP2C kommt zumeist im embryonalen Hirn in Axonen und Gliazellen vor [MAP2 – Wikipedia; Microtubule-associated protein 2 - Wikipedia]. Das Protein (Mensch) „MAP2_P11137“=1827AS liegt zweizeilig in der Spalte Z.38249#_ „2“189“[407]/“7“[695232] als QS1+8+9=18_2_7 für 1827AS [MAP2 - Microtubule-associated protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Bindung an Calmodulin=149AS mit 4 Calcium-Bindestellen: Calmodulin als QS9+5=14_QS2+3_4+0=9 für 149AS. Die Zahl „40“ enthält 2x Calcium. Die Zahl „02“=Calcium aufgrund der Leserichtung. Das 4. Calcium folgt als QS7+7+6=20E [CALM1 - Calmodulin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAP2_E7EV03“=567AS füllt die Lücke zum Zeilenrand als „5“_QS2_4=6_7 für 567AS [MAP2 - Mikrotubuli-assoziiertes Protein 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „4R-MAP2_Q16296“=125AS liegt in der Randspalte Z.38250#_95232/1940 als QS1+9_2=12_5=125AS. Die Ziffer „1“ stammt aus der Zahl „21“, so dass „Tubulin“ unterstützt wird, seinen Cofaktor Mg=12 zu erkennen [4R-MAP2 - Mikrotubuli-assoziiertes Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Potein (Mensch) „Tubulin-Alpha_ Q71U36¬¬¬_TBA1A“=451AS liegt in der Randspalte Z.38249#_[8]„94“[07]/[95]“23“[2]/[2]“1“9“[40] aufsteigend als QS9+4=13_23_9 mit Summe=13+23+9=“45“_“1“ für Tubulin-Alpha=451AS. Die Ziffer „1“ gehört zum Cofaktor Mg^2+=12E, der gespiegelt mit der Zahl „21“ erkannt wird. Die Zylinderform der Mikrotubuli wird aus Protofilamenten zusammengesetzt, die aus Alpha- und Beta-Tubulin-Heterodimeren bestehen. GTP und GDP sind beteiligt [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Potein (Mensch) „Tubulin-Beta_ P68371_TBB4B“=445AS liegt rechtwinklig in der Spalte Z.38248#_“04“[482]/“8“[9407]/“95“[232] als QS0+4=“4“_QS8_9+5_23=“45“ mit „4_45“ für Tubulin-Beta=445AS. Seitlich mit „21“_89 und als Spalte 95/“21“ wird das Protein rechtwinklig durch den Cofaktor Mg^2+=12E, gespiegelt als Zahl „21“ geführt. Weil der untere Faktor bereits durch Tubulin-Alpha verwendet wird, ist der Faktor „21“_89 zuständig [TUBB4B - Tubulin beta-4B chain - Homo sapiens (Human) | UniProtKB | UniProt].
Zellkörper: Die Position der Proteine „MAP2“ und „Tubulin“ wird als Dopplung zum Bereich der Dendrite ermittelt. Das Protein (Mensch) „MAP2_P11137“=1827AS liegt zweizeilig in der Spalte Z.38254#[16156]“57“8“1“/#[16156]“15“[58] als „1“_“8“_QS5+7=12_15 mit „18“_Summe=12+15=“27“ für MAP2=1827AS. „MAP2“ ist an Calmodulin=149AS gebunden, das über 4 Calcium-Bindestellen verfügt. Vier Bindestellen: Calcium Fall 1: seitlich mit der Ziffer „1“ eingebunden in Z.38254#_“1“9271“[88] mit QS“1“+9+2+7+1=Calcium=20. Calcium Fall 2: vorgelagert in Z.38253#16157000“5537“935 mit QS5+5+3+7=Calcium=20. Calcium Fall 3/4: seitlich doppelt angelagert in Z.38255#[16156](15)“5“[8]/#[1615573]“35“ mit Spalte „5/35“ für QS5+35=40 für 2*Calcium=20 als „40“ [MAP2 - Microtubule-associated protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Calmodulin=149AS muss diese verteilten Bindestelle erreichen, und liegt folglich in der Spalte (5)“5“(3)/“1“9“(2)/“8“(5)[3]/[353] als QS5+9=“14“_QS1+8=“9“ mit 14_9 für 149AS. Das Protein (Mensch) „MAP2_E7EV03“=567AS liegt vorgelagert in der Spalte Z.38253#[161]“5700055“/#[161] absteigend als „5“_QS57+000=57_QS5+5=10 mit „5“_Summe=57+10=“67“ für MAP2=567AS [MAP2 - Mikrotubuli-assoziiertes Protein 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „4R-MAP2_Q16296“=125AS liegt in der Randspalte Z.38254#_7188/7254 mit der Spalte „1/25“ als 1_25 für 125AS. In der Spalte wird das Magnesium=12E durchlaufen, so dass „Tubulin“ unterstützt wird, seinen Cofaktor Mg=12 in Spaltenform zu erkennen [4R-MAP2 - Mikrotubuli-assoziiertes Protein - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Potein (Mensch) „Tubulin-Alpha_ Q71U36¬¬-_TBA1A“=451AS liegt in der Randspalte Z.38253#_[79]“35“/#_[7]“1“88“/ [725]“4“, und zwar absteigend als „4“_QS35_8+8=“51“ für Tubulin-Alpha=451AS, wobei der Cofaktor Magnesium=12E als Spalte „1/2“ seitlich liegt [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Potein (Mensch) „Tubulin-Beta_ P68371_TBB4B“=445AS liegt in der Randspalte Z.38253#_“37“[935]/#_“2“7“[(1)88]/#_“3“[7(2)54] als QS37+7=44_QS2_3=5 für 445AS. Der Cofaktor Mg^2+=12E liegt in der Spalte „1/2“ zwischen Alpha- und Beta-Tubulin [TUBB4B - Tubulin beta-4B chain - Homo sapiens (Human) | UniProtKB | UniProt]. Alpha- und Beta-Tubulin können das Guanosintriphosphat (GTP) =C10H16N5O14P3=60+16+35+112+45=268E binden. „GTP“ liegt in der Randspalte Z.38254#_[27]“1“8[8]/#_[37]“25“[4] als QS1_25=“26“_“8“ für GTP=268E. Das GTP des Alpha-Tubulins wird von einem Loop des Beta-Tubulins eingeschlossen, um es vor der Hydrolyse zu schützen. Das GTP des Beta-Tubulins wird dann aber zu Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E hydrolysiert. Das Wasser=28 liegt seitlich in der Spalte [9]“2“/“5“3“ als „2“_QS5+3=“8“ für H2O=28. Entsprechend liegt GDP=228E in der Randspalte Z.38254#_[9](2)“7“1“8“[8]/#_(53)“7“2“5“[4] über Spalte 7/7 als Schleife absteigend QS7+7=14_QS1_2+5=8 mit Summe=14+8=22¬_8 für „GDP=228E“. Die freie Randspalte wird bei der Bindung durch Tubulin=451AS besetzt, und zwar in der Randspalte Z.38254#_7“18“8“/#_[7]“25“4“ als „4“_QS25+18+8=“51“ mit 4_51 für Tubulin=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Die Wasserspalte liegt zur Vorzeile gespiegelt 53_[9]2_53 vor, so dass für Beta-Tubulin=451AS eine andere Zählung möglich ist. Vorgelagert ist die Randspalte Z.38252#_“4“[229369514]/#_“00055“37“[935]. Mit Spalte QS37+7+7=“51“ muss die Ziffer „4“ linksseitig gelesen werden, die über eine Spalte 4/0 über eine Null-Strecke (Loop) QS0+0+0+5+5=10 für „0“ erreichbar ist als Beta-Tubulin=451AS [TUBB1 - Tubulin beta-1 chain - Homo sapiens (Human) | UniProtKB | UniProt]. Neben der Ziffer „4“ liegt die Zahl „22“. Im Streckenrücklauf wird darüber GTP=268E in einer geschützten Position gezählt. Mit „2“_QS2+4=6_Nullstrecke 0+5+5=10 für „0“_ aufsteigend in Spalte „3“[7]/“2“[7]/“3“[7] mit QS3+2+3=8 mit QS0+8=“8“ als 26_8 für GTP=268E._[GDPgeändert 11.09.2023]
Zellkern, Organellen und synaptischer Spalt: Zellkern, Organellen und synaptischer Spalt: Für die massenhafte Erzeugung diverser Proteine für Nervenzellen wechselt die Betrachtung von der Z.-Nrn.-Matrix in den Code. Weil der Code kein System enthält, liegt der Entwicklungs-Schwerpunkt in einer 12-zeiligen Spalte aus „Schnapszahlen "xx" (Repdigit / repeated digits)“ von Z.382“55“ bis Z.382“66“. Die Schnapszahl in der Z.-Nr. ist eine Zugabe. Damit enthält auch der Code ein System. Weil an den Enden jeweils eine Membran "33" vorliegt, kann die Membran verschiedenen Funktionen dienen._dat03.08.2023
Synaptischer Spalt: Im synaptischen Spalt wird der Neurotransmitter „Acetylcholin (ACh)“=C7H16NO2=42+16+7+16=81E freigesetzt [Acetylcholin – Wikipedia]. „ACh“ ist ein Ester der Essigsäure = C2H4O2=12+4+16=32E [am Spaltenende als 3_QS1+1=2 für 32E]. Acetylcholin liegt in der Synap.-Randspalte Z.38263#_779364991/#_557961599/#_336778849/#_115816721, und zwar am Ende des Repdigit-Spalts mit „55/33/11“ als QS5+3=8_1 für Acetylcholin=81E. Es erstreckt sich aber nochmals seitlich in einer Spalte. Die Zahl „Muskel=55“ eröffnet einen neuromuskulären Bezug. Acetylcholin wird sehr schnell abgebaut, um die Überlagerungsdauer von Erregungssignalen kurz zu halten. Das Protein (Mensch) „Acetylcholinesterase_AChE“=614AS hydrolysiert den Neurotransmitter, wodurch die Signaltransduktion an der neuromuskulären Verbindung beendet wird“. Katalyse: Acetylcholin + H2O = Acetat + Cholin + H^+, wobei Cholin= C5H14NO=30+14+7+8=59 in Z.38266 am Spalt als (11)QS 58+1=“59“ vorliegt und Wasser zur Folgezeile als QS1+1=2_8 für 28=H2O [ACHE - Acetylcholinesterase - Homo sapiens (Human) | UniProtKB | UniProt]. Die „AChE“ wirkt im Zentralnervensystem (ZNS), insbesondere an neuromuskulären Synapsen sowie im vegetativen Nervensystem, das den Neurotransmitter „Acetylcholin (ACh)“ zum Stofftransport (Exozytose) verwendet [Acetylcholinesterase – Wikipedia]. AChE=614AS enthält mit der Zahl „61“ den Schwefel=16, der für Disulfidbrücken-Bindungen benötigt wird. Eine Brücke wird durch eine doppelte Darstellung realisiert, wobei für Brücke als Klammer eine 3. Zählung notwendig wird. Die Doppelzählung hat den Zweck eine seitlich versteckte Zählung des Neurotransmitters ebenfalls mit zu beseitigen, der am Spalt (55)79_QS6+1=7_Spalte „4/1“ mit Ziffer 4 als QS7+4=11=QS=2 mit Summe 79+2=ACh=81E vorliegt. AChE_Teil1=614AS in der Spalte #_(77)[936]“4“/#_(55)[79]“61“ als 61_4 für 614AS. AChE_Teil2=614AS in der Spalte #_(3)3/#_1511[5] als QS1+5=6_1_Spalte 3/1 mit QS3+1=4 für 614AS. Brückenverbinder AChE_Teil 3 in Z.38265#_(33)677 als „6“_QS7+7=“14“ AChE 614AS. Das „Aktive Zentrum“ von AChE ist das Ende der Repdigit-Spalte mit der Zahl „11“. Zählbar für die mit QS1+1=2nm tiefe Tasche, in der 3 Aminosäuren liegen, und zwar Serin=C3H7NO3=18+7+7+24=56E als QS1+1_3=“5“_“6“ für 56E; Histidin=C6H9N3O2=36+9+21+16=82E als QS5+3=“8“_QS1+1=“2“ für 82E und Glutaminsäure=C5H9NO4=30+9+7+32=78E als QS1+5+1=7_QS3+5=8 für 78E. Nervenkampfstoffe hemmen die Acetylcholinesterase (AChE), so dass „Acetylcholin (ACh)“ nicht mehr aus dem synaptischen Spalt entfernt wird [Nowitschok – Wikipedia]. „Novitschok A-234“=C5H8Cl2F2NO3P (nach Mirsajanow)=30+8+34+18+7+24+15=136AS und A-234 (nach Hoenig)=C5H8Cl2F2NO3P=30+8+34+18+7+24+15=136AS binden im aktiven Zentrum von „AChE“ das Serin=56E. In der Zählung für „Serin“=QS1+1_3=5_6=56E ist „A-234“=1_36 für 136E enthalten, so dass das Protein außer Funktion ist.
Zellkern: Aufgrund des axonalen Transports trifft das Protein (Mensch) „Nervenwachstumsfaktor _Beta-NGF“ im „Zellkern“ als Zielort ein. Um den Zellkern mittels „Beta-NGF“ zu identifizieren, wird als weiterer Akteur das Protein (Mensch) „p75-Neurotrophinrezeptor (p75NTR)_[CD271/NGFR]“=427AS benötigt. „p75NTR“ öffnet die Kernpore in der Kernmembran für den Eintritt von Beta-NGF. „p75NTR“ ist an der Regulierung von Survival, Wachstum, Differenzierung und Apoptose von Neuronen beteiligt. „p75NTR“ kann als einzelner Rezeptor oder in Kombination mit Tropomyosinrezeptorkinasen wirken, wodurch unterschiedliche zelluläre Antworten auf Neurotrophine vermittelt werden [P75-Neurotrophinrezeptor - DocCheck Flexikon]. Der Neurotrophonrezeptot „p75NTR“ kann alle 5 Neurotrophine binden, was zum Zelltod (Apoptose) führt [Neurotrophin – Wikipedia; Low-affinity nerve growth factor receptor - Wikipedia]. Nachgewiesen ist die Kernporen-Öffnung durch „p75NTR“ für „Beta-NGF“ nicht an Nervenzellen, sondern an sternförmigen Gliazellen. Diese „Astrozyten“ übernehmen im Gehirn essentielle Funktionen und gehören zu den nicht-elektrisch erregbaren Zellen des Nervensystems. Die voluminöse Zahl „7000“ enthält nicht den gesamten Zellkörper, sondern kann als Kernpore im Eingangsportal für die folgende 12-Zeilen-Repdigit-Spalte aus Schnapszahlen „xx“ dienen. Der „Toröffner“, das Protein (Mensch) „p75NTR“=427AS ist im Pfad durch die Kernporen-Öffnung „Form=Nerv=7_000_55“ in der Spalte Z.38252#_[7]“4“2“[2] /#_[70]“0“[0]/#_[65]“7“[8] erkennbar, und zwar als „4“_“2“_QS0+7=“7“ für 427AS [NGFR - Tumor necrosis factor receptor superfamily member 16 - Homo sapiens (Human) | UniProtKB | UniProt].
„Beta-NGF“ liegt in der Spalte Z.38252#_[7]“4“2“[2]/#_“7“000/#_“65“[78]/#_[6]“1“[55}, und zwar vierzeilig aufsteigend als „2“_QS4_0+7=11=QS=2__QS6+5=11=QS=2 mit „2“_Summe 2+2=“4“ und Spalte 5/1[55] als „2_4_1“ für „Nerve growth factor, Beta-NGF“=241AS [NGF - Beta-nerve growth factor - Homo sapiens (Human) | UniProtKB | UniProt]. „Beta-NGF“ ist extrazellulärer Ligand und bindet sich an den Rezeptor „NTRK1“ und den Rezeptor „NGFR“, der mit „SORCS2“ ein Heterodimer bildet. „Beta-NKF“ hat die Kernpore passiert und liegt mit der Ziffer „1“ links neben der Startzahl „55“ für die „12-Zeilen-Repdigit-Spalte“. Nach der Bindung von Beta-NGF orientieren sich die beiden Rezeptoren an dieser „xx-Spalte“. Das Protein (Mensch) „Nerven Wachstumsfaktor_ P04629_NTRK1“=796AS liegt rechts neben „Beta-NGF“, und zwar 3-zeilig aufsteigend in der Spalte Z.38254#_[65]“7“8“1“92“/#_[61558]“5“3“/#_[57]“3“3“5“3“[6] als „7“_QS8+1=“9“_QS9+2=11=QS=2_QS5+3_3=11=QS=2_QS5+3+3=11=QS2 mit „79“_QS2+2+2=“6“ für NTRK1=796AS [NTRK1 - High affinity nerve growth factor receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Tumor necrosis factor receptor_P08138_NGFR“=427AS liegt in der Spalte Z.38255#_[6]“1“5“5“[853]/#_[573]“3“5“3“6“]#_[5]“3“1“1“2“4“1“ und bildet mit „SORCS2“ ein Heterodimer. Die Endziffer „1“ von Beta-NGF ist als Start in QS1+5+5+=11=QS=2 enthalten_QS3+5+3=11=QS=2 mit Summe 2+2=“4“_Spalte 6/41 mit QS6+1+4=11=QS=“2“_QS3+1+1+2=“7“ als 4_2_7 für NGFR=427AS [NGFR - Tumornekrosefaktor-Rezeptor-Superfamilienmitglied 16 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der NGFR-Rezeptor regiert auf Temperatur-Reize, indem eine Verbindung zur Temperatur-Basis „100°Celcius“ in Z.38260#_[4448]991[80] als QS99+1=100°Celcius über eine Randspalte mit der Körpertemperatur (991)_absteigend als „3“_QS1+7=8 mit 3_8 für 38°Celsius hergestellt wird, die am Protein über eine Zählgröße als Spalte 9/2=QS9+2=11 gekoppelt ist. Der NGFR-Rezeptor moduliert die Genexpression, so dass sich das Expressionsmuster (Frequenz, Geschwindigkeit, Ausmaß) regelmäßig alle 24 Stunden wiederholt. Zu diesem Zweck zählt sich das Protein in Z.38257#_311“24“1 durch die Zeitbasis „24“, die an die Zählgröße „11“ gekoppelt ist. Das Protein kann zu diesem Zweck die beiden Enden zu einem Ring=64 zusammenzählen, der mit dem Kunstgriff 10 für „0“ unauffällig ist, und zwar in der Spalte „15/73/31“ als QS1+5=“6“_QS7+3=10 für 0_QS3+1=“4“ mit „6“_QS0+4=“4“ für 64=Ringschluss. Der NGFR-Rezeptor führt keine Messung der Genexpression aus, weil sich diese ohnehin altersbedingt beschleunigt und die Transkriptionstreue nachteilig schwindet [Alterungsbedingte Veränderungen der transkriptionellen Elongation beeinflussen die Langlebigkeit | Natur (nature.com); A. Beyer, u.a.; Natur volume 616, pages814–821 (2023)]. NGFR-Rezeptor sitzt genau auf dem Zählweg des zuständigen Proteins „RNA-Polymerase-II“, das dadurch moderiert wird. Die „RNA-Polymerase II“ klemmt die DNA als Matrize ein, damit die RNA als Kopie entsteht. Für diesen Klemmspalt muss das Proteine in der 12er-Repdigit-Spalte die Schwerachse „84“ als Vertikale summieren, und zwar ab der Startzeile Z38255#_55/#_33/#112 mit QS5(5)+3(3)=“8“_QS1+1=“2“_“2“=parallel mit 8_4 =Schwerachse=Klemmspalt=84. Die größte Untereinheit „RPB1“, das Protein (Mensch) „RNA Polymerase II_P24928_RPB1“=1970AS liegt in der Spalte Z.38255#_[6]“15“[58537254]/#_[57]“3“[3]“5“3“[68116]/#_[53]“1“12“41“9“[757], und zwar aufsteigend als QS15_3_1=“19“_quer mit Welle absteigend und zurück QS12_5+3_41+9=12+8+50=“70“ für 1970AS. „RPB1 ist Teil des Kernelements mit der zentralen großen Spalte, dem Klemmelement, das sich bewegt, um die Spalte zu öffnen und zu schließen“ [POLR2A - DNA-directed RNA polymerase II subunit RPB1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RNA Polymerase II_ P30876_RPB2“=1174AS bildet zusammen mit RPB1 das aktive Zentrum der Polymerase. Die lesbare Zahl „11“ in der Repdigit-Spalte ist keine Startzahl, sondern wird wellenförmig durchlaufen. Die Zahl „11“ ist aber eine Motivation, die seitliche Randzahl „11“ über eine gespiegelte Zählung ersatzweise einzubinden. „RPB2“ liegt in der Spalte Z.38256#_[5]“7“3“3“5368116/#_[5]“3“1“1“2419757 als QS7_3+1=“11“_zurück über Spalte 3/1 mit QS3+3=6 zurück über Spalte 3/1 mit „1“ als „11“_Summe=6+1=“7“_störende Ziffer „2“ wird für Kunstgriff QS2_5+3=10 für „0“ verwendet_über Spalte 5/4 zur Ziffer „4“ mit 11_7_4 für RPB2=1174AS mit Spiegelung QS1+9=10 für „0“_“7“_“11“ (gespiegelt 4_(0)_7_11 für 1174AS). Eine Spiegelung ergibt eine Klemmfunktion. Das Protein (Mensch) „RNA Polymerase II_ P19387_RPB3“=275AS liegt gespiegelt in der Spalte Z.38256#[5]“73“[3]“5“3“/#_[53]“1“1“2“4“ als QS73_1+1=75_2 für 275AS, vorwärts „2“_QS3+4=“7“_“5“ für RPB3=275AS. Das Protein (Mensch) „RNA Polymerase II_O15514_RPB4=142AS kann den Klemmspalt verriegelt, damit keine doppelsträngige DNA in den Spalt des aktiven Zentrums gelangt. Es wird nur 1 Hälfte der Doppelziffer „33“ gebunden wird als „1“_“4“_QS3+5+3=11=QS=2 für RPB4=142AS [POLR2D - DNA-directed RNA polymerase II subunit RPB4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RNA Polymerase II_ P62487_RPB7=172AS bildet mit RBP4 einen Verriegelungskomplex, wobei die von RPB4 noch teils geöffnete Spalte von RPN7 zugeschoben wird. Der gelesene Block wechselt dabei von open=3“353“ auf close=„335“3. „RPB7“ als „1“_QS3_4=“7“_QS3+3+5=11=QS=“2“ mit 1_7_2 für RPB7=172AS [POLR2G - DNA-directed RNA polymerase II subunit RPB7 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RNA Polymerase II_P36954 _RPB9=125AS ist ein Zinkfingerprotein. Das Zink zählt in der Startzeile Z.38255 den linken Code-Rand als #QS1+6+1+5+6+1+5+5=30=Zink. Die DNA liegt folglich in der Z.-Nrn.-Matrix und wird von „RPB9“ ergriffen und durch den Klemmspalt gefädelt „RPB9“. „RPB9“ zieht vierzeilig durch die Spalte als „1“_QS7_3_1=11=QS=“2“_QS1+8=“9“ für RPB9=129AS [POLR2I - DNA-directed RNA polymerase II subunit RPB9 - Homo sapiens (Human) | UniProtKB | UniProt].
Damit Proteine die 12er-Repdigit-Spalte durch die Kernpore in das Zytoplasma verlassen können, wird u.a. das Protein (Mensch) „Exportin 1_XPO1“=1071AS benötigt. „XPO1“ füllt das Repdigit-Spaltenende dreizeilig wie ein Topf „55/33/11“ aus, und zwar als QS5+5=10_QS3+3_1=7_1 für XPO1=1071AS [XPO1 - Exportin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „XPO1“ interagiert mit Nucleoporin_NUP62, das mit der mRNA beim Transport aus dem Zellkern interagiert und weiterhin mit dem NTF2-Protein (Nuclear Transport Factor) [Kernporenglykoprotein p62 – Wikipedia]. Über die Interaktion mit dem Protein (Mensch) „Nucleoporin_NUP62“=522AS kann die Ziffer „0“(Null) in der Folgezeile als Kernpore symbolisiert werden, und zwar in der Spalte Z.38265#_[1933]“6“/#_[1]“5“1“1“5“/#_[1]“0“[895] als Pore=0_5_QS1+1=2_Spalte 6/5=QS6+5=11=QS=2 mit QS0+5=“5“_“2“_“2“ für NUP62=522AS [NUP62 - Nuclear pore glycoprotein p62 - Homo sapiens (Human) | UniProtKB | UniProt]. Bei einer Krebserkrankung können schädliche Proteine am Verlassen der Kernpore gehindert werden, was zum Zelltod führt. Das Krebsmedikament „Selinexor“=C17H11F6N7O=102+11+54+49+8=224AS hemmt speziell das Exportin-1 [Selinexor – Wikipedia], und zwar in der Spalte „1933/1511“ absteigend als QS1+1=“2“_QS5_19=“24“ für 224AS. „Selinexor“ zählt sich gespiegelt weiter, um einen Nebenausgang zur Z.Nrn-Matrix zu sperren, und zwar in der Spalte „2“(7)77/“23“55/“1“(933/1511) als QS1+23=24_2 für Selinexor=224AS. Darin liegt die Sperre in „2“(7), die aus Richtung der Repdigit-Spalte „Serin=72“ ergibt. Proteine die ein angehängtes NES-Signal besitzen, können den Kern verlasssen. XPO1=1071AS zieht sich hierfür alternativ mit der Ziffer „1“ bis in die Z.Nr.3826“1“. Das Protein (Mensch) „NTF2-Nuclear Transport Factor“=127AS zeigt, zerlegt als „12_7“, den langen Weg wie man außen über die äußere Membran [23+QS1+9=10 für 23+11=“33“] von der Kernpore „0“ für NUP62 außen vorbei zum NES-Schlupfloch „27(72)“ findet. Mit Ziffer „5“ aus NUP62_durch die Pore „0“, dann absteigend QS1+1+1+2+2=“7“ mit Summe 5+0+7=“12“_“7“ für NTF2=127AS. „NTF2“ interagiert mit GDP-gebundenem RAN im Zytosol, rekrutiert es über seine Interaktion mit Nukleoporinen in den Kernporenkomplex und fördert dessen Kernimport“ [NUTF2 - Nuclear transport factor 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Bevor ein Export möglich ist, muss zur Energieversorgung zunächst „RAN-GTP“ durch die Pore importiert werden. Für den Rückweg ist das Protein zweckmäßig in beide Richtungen zählbar. „RAN-GTP“ liegt in der Spalte Z.38265#_“1“[9336]/#_“1“5“1“[15]/#_“1“0“[895], und zwar als Import QS1+1=“2“_QS1+0=“1“_QS5+1(1)=“6“ mit 2_1_6 für RAN-GTP=216AS. Im Exportkomplex zusammen mit der Fracht und Exportin-1 als Export mit der Ziffer „2“ in der Vorzeile Z.38264#_“2“[3557] und Zahl „16“ aus Spalte 19/15/10 über Kunstgriff QS1+9=10 für „0“_“15“_“1“+“0“ mit „2“_Summe 0+15+1+0=16 für 216AS. „GTPase, die am nukleozytoplasmatischen Transport beteiligt ist und sowohl am Import als auch am Export von Proteinen und RNAs aus dem Zellkern“[RAN - GTP-binding nuclear protein Ran - Homo sapiens (Human) | UniProtKB | UniProt]. „RAN-GTP“ wirkt mit „RANBP1“ zusammen, so dass ein Konformationsänderung im Komplex eine Freisetzung des Frachtproteins bewirkt.
Das Protein (Mensch) „RANBP1“=201AS zählt seitlich der Repdigit-Spalte die Zahl „19“ nicht als wertloser Kunstgriff QS1+9=10 für “0“, sondern baut die „0“(Null) in die Zählung ein, wodurch die Transporteinheit getrennt und die Fracht freigesetzt wird. Mit „2“_QS1+9=10 für „0“_“1“ für RANBP1=201AS [RANBP1 - Ran-specific GTPase-activating protein - Homo sapiens (Human) | UniProtKB | UniProt]. „RANBP1“=201AS ist an Cadherin-1=882AS gebunden, dass seitlich in der Repdigit-Spalte 55/33/11 als QS5+3=8_QS5+3=8_QS1+1=2 mit 88_2 für Cadherin=882AS anliegt. „Cadherin“ ist Calcium-abhängig, und zwar seitlich mit 5+15=Calcium=20E [CDH1 - Cadherin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Abschließend wird das Ran-GTP zu Ran-GDP mittels GTPase-aktivierende Proteine (GAPs) hydrolysiert. Geeignet ist die entfernte Randspalte Z.38261#_“3"6“2“{228}[33764]/#_“3“2“[000989040]. Darin gehört die Spalte 3/3 zu einem vierzeiligen Kunstgriff als Spalte QS2_2_3_3=10 für „0“, um den Abstand zur Zeile Z.38264 überbrücken. GTP=C10H16N5O14P3=60+16+35+112+45=268E liegt in der Spalte „3“6“2“/“3“2“[0] als „2“_QS3+3=“6“_QS6+2=“8“ mit 2_6_8 für GTP=268E. Wasser (H2O)=28 für die Hydolyse ist seitlich lesbar, so dass damit auch GDP=228E lesbar ist und GTP direkt folgt. Das Protein „GTPase Eras“=233AS ist an GTP gebunden, besitzt aber auch eine GDP-Bindung. In der Spalte [6]“22“2“[8]/“2“0“[0]“0“9“ ist eine Kopplung für die Katalyse möglich, und zwar als Schleife „2“_QS0_22_2_0+9=“33“ mit 2_33 für „GTPase Eras“=233AS [ERAS - GTPase ERas - Homo sapiens (Human) | UniProtKB | UniProt]. Vergleichsweise wandelt das Protein (Mensch) „GTP-Austauschfaktor_ARHGEF2“=986AS umgekehrt das GDP in GTP um. „ARHGEF2“ liegt seitlich in der Spalte (228)“3“3“/0098[9] als 98_QS3+3=6 mit 98_6 für „ARHGEF2“=986AS. Für die Zink-Ionenbindung wird das GDP=228E als QS22+8=Zink=30E gezählt [ARHGEF2 - Rho guanine nucleotide exchange factor 2 - Homo sapiens (Human) | UniProtKB | UniProt]._[GDP geändert_dat12.09.2023]
Importin-Alpha: Importin-Alpha fungiert als Adapterprotein. Importin-Beta benötigt zur Bindung eines Frachtproteins zusätzlich ein Adapterprotein [Importin - DocCheck Flexikon]. Proteine, die ein Kernlokalisierungssignale (NLS) enthalten, werden von Importinen durch die Kernporen in den Kern geschleust. Im NLS-Signal sind Lysin (Lys)= C6H14N2O2=36+14+14+16=80E und/oder Arginin (Arg) = C6H14N4O2 =36+14+28+16=94E enthalten [Kernlokalisierungssignal - DocCheck Flexikon]. Die Energie stammt aus dem „GTP/GDP-Zyklus“ aus dem Bereich Z.38261/Z.38262, die über den linken Code-Rand aufsteigend zu den „3 Poren-Zeilen“ zu fördern ist, die der Repdigit-Spalte folgen. Lysin=80E liegt an den Null-Zeilen in der Spalte Z.38266#[161515“11“]/#[16151](0)[89]/#[1615](0)“6]67/#[1615]“0“2“[45] als QS6+2=8_0 für Lysin=80E. Arigin beginnt in Z.38264 gespiegelt als Spalte QS2_2=4_QS1_1_1_0_6= 9 für Arginin=94E. Die Proteine (Mensch) „Importin_KPNA3“ und „Importin_KPNA4“ beide mit 521AS werden mehrfach benötigt, um über die Serien-Randspalte #1615 die Energieversorgung mit den Kernporen-Zeilen zu verbinden [KPNA3 - Importin subunit alpha-4 - Homo sapiens (Human) | UniProtKB | UniProt ; KPNA4 - Importin subunit alpha-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Importine „KPNA6“=536AS, „KPNA1“=538AS und „KPNA5“=539AS nutzen unterschiedliche Randzahlen an der Pore „0“. Das Protein (Mensch) „Importin_KPNA2“=529AS dient als „Biomarker“ für Krebsformen, weil es durch Spalte Z.3864#[161]“5“2“3/#[1615]“1“9 zieht, die mit QS 23_1+9=33 die äußere Kernmembran „33“ darstellt. „KPNA2“ als „5“_“2“_QS1_1_1_0+6=“9“ für KPNA2=529AS [KPNA2 - Importin subunit alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Importin_KPNA7“=516AS ist bei einem Pankreaskarzinom auffällig. „KPNA7“ zieht sich langgesteckt von der GTP-Zeile ab Z.38262 bis zur Pore, und zwar als QS1_1_1=3_QS5+2=7_QS2_1_1=4_1_QS0+6=6 als Summe =3_QS7+4=11=QS=2 für QS3+2=“5“_“1“_“6“ für „KPNA7“=516AS. Bei schwerem Krankheitsverlauf schiebt sich eine Folgezählung in die Repdigit-Spalte als 0_5_1_QS3+3=6 mit QS0+5=5_1_6 „KPNA7“=516AS, wobei die innere Kernmembran „33“ gezählt. In der der Porenspalte „5/“0“/“6“ sitzt als Türsteher das Protein (Mensch) „NRF2“=605AS [NFE2L2 - Nuclear factor erythroid 2-related factor 2 - Homo sapiens (Human) | UniProtKB | UniProt ].
Die Ursache von Bauchspeicheldrüsenkrebs ist die Akkumulation des Proteins „p62/SQSTM1“ [Bauchspeicheldrüsenkrebs: Bestimmtes Protein begünstigt Entstehung von Pankreatitis und Tumoren (meduniwien.ac.at); DOI: http://dx.doi.org/10.1016/j.ccell.2017.10.011 ]. „p62/SQSTM1“ ist als „Ubiquitin-bindendes Protein p62“ bekannt [Sequestosom 1 – Wikipedia]. Das Protein (Mensch) „p62/SQSTM1“=440AS sitzt am Ende der Repdigit-Spalte „55/33/11“ mit QS1+1=11_QS33_QS5+5=10 für „0“. Für die Zink-Ionen-Bindung liegt Zink=15+15=30 seitlich in Z.38266#[16]“15“15“(11). Ubiquitin=76AS liegt in der Rebdigit-Spalte als 7_QS0+2+4=6 für 76AS [SQSTM1 - Sequestosome-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Wenn das Protein bereits die Pore verstopft, ist hier nicht erklärbar, wie dann noch das Protein „NRF2“ genötigt werden kann, einen neuen Platz direkt im Kern zu suchen. Statt „p62/SQSTM1“=440AS wird hier alternativ das Protein (Mensch) „NUP62“ als fiktiver Verursacher gewählt, wobei von den Modifikationen 23AS, 134AS, 446AS und 552AS das Protein „NUP62_M0QX64“=134AS ausgewählt wird. „NUP62“ zieht absteigend bis zur Z.38264 eine lange Spalte durch die Pore „0“, und zwar als QS2_6_0_5=“13“_QS1_1_2=“4“ für NUP62=134AS [NUP62 - Nucleoporin 62 - Homo sapiens (Human) | UniProtKB | UniProt]. Weil in der Zählung für „NUP62“ der Pfad für „NRF2“=605AS enthalten ist, kann „NRF2“ nicht mehr auf der Pore hocken, und sucht deshalb einen neuen Platz im Kern (Repdigit-Spalte) aufsteigend als 4(4)_QS2+2_0=4_7 mit QS4+7=11=QS=2 mit Summe 4+2=“6“_QS5+5=10 für „0“_QS3_1+1=“5“ für „NRF2“=605AS. „NRF2“ stimuliert die Produktion vom Protein „MDM2“. Erhöhtes „MDM2“ wandelt Azinarzellen in stark wuchernde Duktzellen um, aus denen das „Duktale Adenokarzinom der Pankreas“ wächst. Das Protein (Mensch) “MDM2“=491AS liegt in der Repdigit-Spalte Z.38261#161536222833764/#161532000989040 etc. als „2“_QS2+2=4_0_7 mit „2“_Summe=4+7=11=QS=2_QS5_3_1=9_1 mit Summe 2+2=4_9_1 für MDM2=491AS. Ersichtlich ist, dass sich eine Mutation über „000“ seitlich nach rechts ziehen kann, um die Ziffer „2“ alternativ in der Spalte 222833/000989 über die Zahl 83(3)=QS8+3=11=QS=2 zu erreichen. Hierbei wird die Membran, d.h. die Drüsenhaut „33“ angegriffen. Im Prinzip muss die Schwerachse=84 stabilisiert werden, um das seitliche Ausweichen zu verhindern [MDM2 - E3 ubiquitin-protein ligase Mdm2 - Homo sapiens (Human) | UniProtKB | UniProt]. Kontrolle: „MDM2“ vermittelt über die „22“ die Ubiquitinierung und den anschließenden Proteasomabbau von „DYRK2“ im Zellkern, weil die Ziffer „1“ nur schwer zu finden ist. Das Protein (Mensch) „DYCK“=601AS als QS36+2+2=40_0_20 mit Summe=60_Spalte 3/52 =QS3+2=5_5 mit 10 für „0“_“1“ als 60_Summe=0+1=1 für DYRK2=601AS [DYRK2 - Dual specificity tyrosine-phosphorylation-regulated kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt}. Das Protein „MDM2“ ubiquitiniert „IGF1R“ und „SNAI1“ und fördert sie zum proteasomalen Abbau. Das Protein „IGF1R“=1367AS wird am linken Rand beseitigt, und zwar über Z.38261 als QS #16+15+36=“67“_QS2+8+3=“13“ mit 13_67 für „IGF1R“=1367AS, wobei die „67“ in Richtung zum Rand „Ubiquitin“=76AS ergibt [IGF1R - Insulin-like growth factor 1 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Für das Protein (Mensch) „Zinkfinger_SNAI1“=264AS liegen Ubiquitin=76AS und die Zahl „64“ lesbar am rechten Zahlenrand in der Spalte Z.38261#_[6]“222833764“/“2“[000] zur Motivation. Um diesen Pfad zu finden, wird der Ligand „Zink“=30E zusammengesetzt aus QS5+3+2=10_QS6+2+2=10_QS2+8=10 mit QS10+10+10=30. „SNAI1“ als QS2+0=“2“_absteigend QS2+2+2+8+33+7+6+4=“64“ mit 2_64 für 264AS [SNAI1 - Zinc finger protein SNAI1 - Homo sapiens (Human) | UniProtKB | UniProt].
Importin-Beta: Importin-Beta benötigt ein Adapterprotein, um eine Fracht zu transportieren. Im Zellkern liegt ein RNA-Protein-Komplex „Spliceosom“, der aus 5 verschiedenen kleinen RNA-Molekülen (snRNAs) und mehr als 100 verschiedenen Proteinen besteht. Die nicht kodierten Abschnitte (Introns) werden beim Spleißen entfernt. Zum RNA-Prozessierungsschritte gehören weiterhin das Capping und die Polyadenylierung. An den Grenzen zwischen Introns und Exons befinden sich Konsensussequenzen, die als Erkennungssignal für verschiedene snRNPs ("small nuclear ribonucleoproteins") dienen. Für den Import von „snRNPs“ ist ein „Importin-Beta“ erforderlich [Spleißen - DocCheck Flexikon]. Das Protein (Mensch) „Importin-Beta_KPNB1“=876AS beginnt zwar neben dem Zielort in der Repdigit-Spalte kann aber außen seitlich aufsteigend nur den Zugang zum Kern erreichen, so dass im Kern das Adapterprotein „Snurportin-1“ absteigend die Fracht zum Zielort führt.
KPNB1 nimmt die Ziffer „5“ der Code-Rand-Serie #161“5“ auf, um ab Z.38262 nach Energieaufnahme aus dem GDP/GTP-Zyklus aufsteigend zur Kernpore zu gelangen, und zwar als QS5+3=8_QS5+2=7 mit „87“_Streckungsstrecke aufsteigend in den Porenraum bis Z.38268 und absteigend bis Z.38267 in Repdigit-Zahl „11“ für QS5+1=“6“, und zwar mit „87“_QS2_1_1_1_0+6=11=QS=“2“; „2“ wird reduziert auf „0“(Null) über „87“_ QS2_0+8=10 für „0“_QS9+1=“0“_QS5+1=“6“ mit „87“_Summe=0+0+6=“6“ für KPNB1=876AS [KPNB1 - Importin subunit beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. KPNB1 ist vom Frachtprotein weit entfernt, so dass das Adapterprotein „Snurportin-1“ im Kern eine Lücke schließen muss. Das Protein (Mensch) „Snurportin-1“=360AS muss im Kern ebenfalls gestreckt werden, um das Frachtprotein in Position zu bringen. In der Anschluss-Spalte „9“3“(36)/“511“[5] liegt zwar die Zahl „36“ als Motivation für 360AS vor, aufgrund der Zahlrichtung wird jedoch mit der Bindungsspalte „93“/51(für KPNB1) begonnen, und zwar als QS9+3=12_QS5+5=10_QS7+7=14 mit Summe=12+10+14=“36“_“0“ mit der Ziffer „0“ in Z.38261#1615320“0“0 für „Snurportin-1=360AS [SNUPN - Snurportin-1 - Homo sapiens (Human) | Publications | UniProtKB | UniProt]. Das Frachtprotein, Protein (Mensch) „U1 snRNP-binding protein homolog“=246AS liegt in der Spalte Z.38259#_[44]“6“6“[71]/#_[404]“4“[48]/#_[36]“2“2“[28]/#_[3]“2“0“[009] absteigend als QS2+0=“2“_QS2+2=“4“_Spalte 6/4=QS6+4=10 für „0“_“6“ mit QS0+6=“6“ als 2_4_6 für U1 snRNP=246AS [SNRNP35 - U11/U12 small nuclear ribonucleoprotein 35 kDa protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Frachtprotein „U1 snRNP“ wird im RNA-Protein-Komplex „Spleißosom“ benötigt, um durch das Spleißen (Splicing) eine reife mRNA zu bilden. Die Aufnahme der Fracht erfolgt vom „U snRNP-spezifischer Nuklearimportadapter“, Protein (Mensch) „U4/U6 snRNP 60 (WD-Spleißfaktor Prp4)_O43172 _PRP4“=522AS, so dass der Pfad von U1 snRNP bestätigt wird. PRP4=522AS liegt in der Spalte Z.38259#_„6“[6]/“44“/“2“2“ als QS6+44_2=52_2
aufsteigend als QS6+44+2=52_2 für PRP4=522AS. „PRP4“ ist beteiligt am „Trimethylguanosin“ (m3G)-cap-abhängigen nukleären Import von U snRNPs. Bindet spezifisch an die terminalen m3G-cap U snRNAs [PRPF4 - U4/U6 small nuclear ribonucleoprotein Prp4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Trimethylguanosinsynthase“ [TGS1 - Wikipedia] katalysiert die 2 seriellen Methylierungsschritte für die Umwandlung des 7-Monomethylguanosins (m7G) Kappen von snRNAs und snoRNAs zu einer 2,2,7-Trimethylguanosin (m(2,2,7)G) Kappenstruktur. „Die TMG-Kappe spielt eine zentrale Rolle bei der Rekrutierung von Telomerase zu Telomeren und der Einbindung der Cajal-Körper in die Telomererhaltung. Viele RNA-Moleküle enthalten die TMG-Kappe am 5'-Ende“[Die RNA-TrimethylGuanosin- oder TMG-Kappe (biosyn.com)]. Das Protein (Mensch) „Trimethylguanosin-Synthase_Q96RS0 _TGS1“=853AS liegt in der Spalte Z.38255#[16156]“1“5“[5853]/#[16155]“7“3“[3536], die
die Startzeile der Repdigit-Spalte enthält. Aufgrund der Spiegelung „5/3_8/5_5/3“ kann das Protein beidseitig mit „8_5_3“ für TGS1“=853AS gezählt werden. Aufgrund der dritten Spalte „5/3“ folgt alternativ, und zwar absteigend QS1+7=“8“_aufsteigend „5“_“3“ für TGS1“=853AS [TGS1 - Trimethylguanosine synthase - Homo sapiens (Human) | UniProtKB | UniProt]. „Trimethylguanosin“ kann für die beiden Moleküle aufgrund der Summenformel eingefügt werden: „7-Methyl-guanosin-5'-triphosphat-5'-guanosin“= C21H30N10O18P3+=126+30+70+144+45=415E mit QS33+5+3=41_Spalte 5/3 mit „5“ für 415AS [7-Methyl-guanosin-5'-triphosphat-5'-guanosin | C21H30N10O18P3+ | CID 135442196 - PubChem (nih.gov)]. „N2, N2, 7- Trimethylguanosine (m2,2,7G / TMG)“= C13H19N5O5=78+19+35+40=172E mit Spalte1/7 als 17_QS3+3+5=11=QS=2 für 172AS mit 33_5 als Kappe [m2,2,7G/TMG BIOLOG Life Science Institute]. Das Signal wird vom Ribosom erkannt. Das ist möglich, weil die Repdigit-Spalte auch als Ribosom dienen kann.
Mitochondrium: Die „12er-BiXnom-Schnapszahl-Spalte (Repdigit)“ enthält beidseitig eine Membran, so dass sich an diesem Hotspot Proteine zu einem Komplex finden können. Das Mitochondrium ist eine weitere Möglichkeit. Das Neuron verfügt über mehrere Hundert Mitochondrien, die in den Zellfortsätzen statt punktförmig eine gestreckte Form ausbilden; im Dendrit langgezogen (0,5-8,9µm), im Axon kurz (0,3-1,1µm). Die Mitochondrien können entlang des Axons wandern, wobei Mikrotubuli und Motorproteine mitwirken. Die Mitochondrien können verschmelzen oder sich teilen. Sehr viele Mitochodrien benötigen die Interneuronen als Taktgeber des Neuronenfeuers im Gehirn [Mitochondrien - mobile Energielieferanten in Neuronen | ScienceBlog]. Im mittleren Bereich der Repdigit-Spalte ist ATP=260E in der Z.-Nr. lesbar, und zwar in Z.38“260“#“16154“[0444899180]/#[1615]“3“[6222833764]. Calcium folgt am linken Code-Rand als QS1+6+1+5+4+[0]=17_Spalte 4/3 für Ziffer „3“ mit QS17+3=Calcium=20. Neben der Ziffer „3“ liegt das ATP nochmals im Code vor, Spalte „0/62“ für ATP=260E. Acetyl-CoA liegt in der Spalte „4[4]/22“ als 4_22=422E. Das Protein (Mensch) „ATPase“=498AS spaltet ATP in ADP und Phosphat auf [ATP8B1 - Phospholipid-transportierende ATPase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Gegenteil, ADP zu ATP, ist als ATP-Synthase= 226 AS gegenläufig zählbar [ATPase 6 - ATP-Synthase-Untereinheit a - Homo sapiens (Mensch) | UniProtKB | UniProt]. ADP=C10H15N5O10P2=60+15+35+80+30=220E liegt in der Repdigit-Spalte mit „22/0“. ATPase liegt in der Spalte Z.3826#_“22“[2833764]/#_[0]“0098“[9040] als QS2+2=4_QS0+0+98=98 für 498AS. Neuronen sind zur Energieversorgung auf Mitochondrien angewiesen, die ATP=C10H16N5O13P3=60+16+35+104+45=260E und Calcium=20E produzieren. Bei der neuronalen Aktivität strömen Na+- und Ca2+-Ionen in das Cytosol und umgekehrt strömen K+-Ionen in den Extrazellularraum. Diese ständigen Transportprozesse für Ionen an der Zellmembran (Na+/K+-ATPase, Ca2+-ATPase) und am endoplasmatischen Retikulum (Ca2+-ATPase) benötigen die Energie aus dem Triphosphat des Nucleosids Adenosin (ATP). Hierfür wird Pyruvat über eine Transferase in die mitochondriale Matrix aufgenommen [„Pyruvat“ aus Acetylameisensäure=C3H4O3=18+4+24=46] als Zwischenprodukt entsteht Acetyl-Coenzym A (Acetyl-CoA)=C23H38N7O17P3S=138+38+49+136+45+16=422E. Die Acetyl-Gruppe wird zu CO2 oxidiert. Die dabei reduzierten Dinucleotide (NADH, FADH2) dienen dem Energietransfer. Es entsteht eine Potentialdifferenz an der inneren Mitochondrienmembran von -150 bis -180 mV in Bezug auf das Cytosol und es wird Wasser (H2O) gebildet [„Funktionen der Mitochondrien bei neuronaler Aktivität im Hippocampus der Ratte und des Menschen“; Diss. O. Kann; Jun.2008 ; Microsoft Word - Schrift 150608.doc (fu-berlin.de)]. Elektrizität entsteht, wenn Physik=63 aufgerufen wird. Die Biologie bereitet dieses mit einer Winkelmessung mit 0°=0 mVolt auf der X-Achse und der unter -90° hängenden Schwerachse vor. Bei deren Auslenkung durch Erregung ändert sich der Messwinkel zur X-Achse. Bei einer maximalen Messung von -180°, steht die Schwerachse auf dem Kopf (+90°). Die ATP-Zeile Z. 38260#161540444899“180“ enthält den Winkel=180°. Die äußere Membran=33 bildet in der Randspalte Z.38255#_[5585]“3“7“2“[54}/#_“33“[536]“81“1“[6] mit QS2+54+1+1+6=Kreis=64. Aus „3“_QS7+2_81_“1“ mit „3“_QS9+81=“90“_“1“ entsteht mit 4*90=360° ein Winkelbezug. Die innere Membran=33 bildet in der Randspalte Z.38265#_“33“[67788]“4“9“/#_[115816]“721“ den Winkelbezug mit „4“_9_QS7+2+1=10 für „0“ als 4*(9_0)=360°. Der Winkel von 180° von durch weitere Analyse der Schwerachse und der Richtung außen/innen zu -180°= -180mV interpretiert werden. Für die Abweichung von 30mV ist die Zahl „180“ mit dem Winkel 30° verbunden und die Zahl „150“ für -150mV liegt in der Randspalte als (30)_QS6_80_64=150° vor. „Im Zellkörper hängt die mitochondriale Biogenese von einem Mechanismus ab, der vom „Peroxisom-Proliferator-aktivierten γ Co-Aktivator-1α-nukleären Atmungsfaktoren 1“ und „2-mitochondrialem Transkriptionsfaktor A (PGC-1α-NRF-1/2-TFAM)“ abhängt. Mitochondrien sind „Zwei-Membran-Organellen“, die ihre eigene DNA enthalten und sich unabhängig von der Wirtszelle vermehren können. PGC-1α ist der Hauptregulator der mitochondrialen Biogenese. Es aktiviert die Kernrespirationsfaktoren 1 und 2 (NRF-1 und NRF-2), was zur Expression mehrerer mitochondrialer Gene führt, darunter Proteine, die für die mtDNA-Transkription und -Replikation benötigt werden, nämlich der mitochondriale Transkriptionsfaktor A (TFAM)“ [Mitochondriale Biogenese in Neuronen: Wie und Wo - PMC (nih.gov) ; V.Morais u.a; Dez.2021; Int J Mol Sci.; doi: 10.3390/ijms222313059]. Das Protein (Mensch) „Atmungsfaktor NRF1“=503AS liegt als Ziffernfolge in der Z.38261#[1615]“3622283“[3764] als QS36+2+2+2+8=50_3 für NRF1=503AS [NRF1 - Nuclear respiratory factor 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Atmungsfaktor NRF2 (NFE2L2)“=605AS tangiert die „Schnapszahl-Spalte (Repdigit)“ in der Spalte Z.38260#[161]“54“0“4“[4]/#[161536]“2“[2]/#[1615]“3“2“0“[00] als QS54+0+4=“58“_Spalte 4/2/0 als QS2+0=“2“ mit Summe 58+2=“60“ _QS3+2=“5“ mit „60_5“ für NRF2 (NFE2L2)=605AS [NFE2L2 - Nuclear factor erythroid 2-related factor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PGC-1α (PPARGC1A)“=798AS ist der Hauptregulator der mitochondrialen Biogenese. Es aktiviert die Kernrespirationsfaktoren 1 und 2 (NRF-1 und NRF-2. Das Protein liegt in der Verbindung der Spalte Z.38261#_[222]“8“[3]/#_“000“9“[8]/#_“7“[7936] absteigend als QS7_0+0+0=“7“_9_8 für „PGC-1α“=798AS [PPARGC1A - Peroxisome proliferator-activated receptor gamma coactivator 1-alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Mitochondrialer Transkriptionsfaktor A_TFAM“=246AS ist Nutznießer der 12er-BiXnom-Schnapszahl-Spalte (Repdigit)“, weil er doppelt in der Spalte lesbar ist, und zwar in der Spalte Z.38259#_66/#_44/#22, und zwar aufsteigend als 2(2)_4(4)_6(6) für TFAM=246AS [TFAM - Transkriptionsfaktor A, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die „12er-BiXnom-Schnapszahl-Spalte (Repdigit)“ bildet die Zeitspanne DELTA.TIME.EPI.VIR.Z.38255-Z.38266=#“4644“2“7“20328“. Enthalten sind der Nerv=7; paarig=2, Netzwerk „444“ im Ringschluss=64_Calcium=20 enthalten in QS20+3+2+8=Membran=33. Dieses Netzwerk benötigt diese „Schnaps-Spalte“, in der eventuell eine Hälfte gedämpft werden muss, um eine schwingende Resonanz zu verhindern. Die die Repdigit-Spalte bei einer gestörten Energieversorgung zur Bewusstseinsstörung und es entwickeln sich neuronale Erkrankungen. Etwa 1% der Menschen erkrankt an Schizophrenie. Im Gehirn entwickelt sich ein erkennbares Muster als ein abweichendes Merkmal. Antipsychotika (früher: Neuroleptika) greifen in der Stoffwechsel der Botenstoffe, insbesondere des Glückshormons „Dopamin“ ein. Die Antipsychotika binden an Rezeptoren für Botenstoffe, die dadurch weniger effektiv sind (Dämpfung). Ein altes Medikament ist „Haloperidol= C21H23ClFNO2=126+23+17+9+7+16=198E, das direkt auf Dopamin= C8H11NO2=48+11+7+16=82E einwirkt, aber auch motorische [55=Muskel] Nebenwirkungen auslöst. Das Dopamin=82E besetzt beide Spalten-Enden. Anfang: Z.382“55“#161561“55“/#161557“33“/#161553“11“ als QS5+3=8_QS1+1=2 für Dopamin=82E [Ziffer 8 aus Halbspalte]. Ende: Z.382“64“#161523“55“/#161519“33“/161515“11“ als Duplikat mit QS5+3=8_QS1+1=2 für Dopamin=82E. „Haloperidol“=198E trifft die Spalte, wirkt funktionell nicht einseitig, sondern kompakt in der Spalte Z.38257#161553“11“/#161548“88“ aus Spalte „11/88“ mit 1_Spalte 1/8 =18 mit Summe 1+18=19_8 für Haloperidol=198E. Das Antipsychotika „Olanzapin“=C17H20N4S=102+20+28+16=166E liegt in der Spalte Z.38258#161548“88“/#161544“66“ aus „88/66“ mit QS8+8=16_6 für „Olanzapin“=166E [Olanzapin – Wikipedia]. Das Antipsychotika „Chlozapin“=C18H19ClN4=108+19+17+28=172E liegt in der Spalte Z.38261#161536“22“/#161532“00“/#161527“77“/161523“55“ absteigend als QS5+5=10¬¬¬_7 mit Summe=10+7=17_QS0+2=2 mit 17_2 für Chlozapin=172E [Clozapin – Wikipedia]. Chlozapin wirkt optimal einseitig, kann aber als Nebenwirkung eine Agranulozytose verursachen, die zu einer starken Verminderung von Granulozyten (weiße Blutkörperchen) führt. Dieses resultiert daraus, dass seitlich in der Spalte „6“22 /“2“00 aufgrund der Zählrichtung das Blut als Zahl „26“ mit aufsteigt, die sich mit der Spaltenzahl „2“ nochmals als Zahl „62“ zeigt. Die Summe 6+2=8 ist nochmals seitlich als 5+3=8 vorhanden. Es wurde hier festgestellt, dass das Gesamtsystem des Blutes ein Octogon bildet, das somit auch Granulozyten enthält. Weiterhin bildet „6“_QS2+2=“4“ zusammen mit der Ziffer 7=Form eine Kugelform=“64“, die Granulozyten und keine Erythrozyten adressiert. Das Medikament könnte auch die gegenüberliegende unbedenkliche Seite zählen. Dopamin ist ein Zwischenprodukt in der Biosynthese von Adrenalin. Die Aminosäure Tyrosin=C9H11NO3=54+11+7+24=96E wird durch Tyrosinhydroxylase=45AS mit Cofaktor Eisen=26 [TH - Tyrosinhydroxylase - Homo sapiens (Mensch) | UniProtKB | UniProt] in Levodopa=C9H11NO4=54+11+7+32=104 umgewandelt, und dieses wiederum durch Aromatische-L-Aminosäure-Decarboxylase=480AS [DDC - Aromatische-L-Aminosäure-Decarboxylase - Homo sapiens (Mensch) | UniProtKB | UniProt] in Dopamin. An beiden Enden bilden diese Stoffe jeweils am rechten Zeilenrand einen Komplex. Um jedoch das Dopamin lückenlos in der Repdigit-Spalte zu erreichen ist Ubiquitin=76AS erforderlich. In der Zeile Z.38256#_(33)“5368“(116) liegt die Lücke QS5+3=8_68 mit Summe 8+68=Ubiquitin=76AS. In der Spalte Z.38264#_(55)“7“(961599)/ #_(33)6(778849) bildet die Spalte 7/6=Ubiquitin=76 eine Lücke. Es wird somit Ubiquitin als Signalmolekül benötigt, um ein Glücksgefühl mit Dopamin auszulösen. Der Ubiquitin-Rezeptor =39AS leigt seitlich an [PSMD4 - Ubiquitinrezeptor der Proteasom-26S-Untereinheit, Nicht-ATPase 4 - Homo sapiens (Mensch) | UniProtKB | UniProt]. „Obwohl Zusammenhänge zwischen Ubiquitin-Proteasom-Systemstörungen und neurodegenerativen Erkrankungen schon seit einiger Zeit bekannt sind, sind ähnliche Zusammenhänge erst in jüngster Zeit für neurologische Entwicklungsstörungen wie Schizophrenie aufgetaucht“ [The ubiquitin proteasome system and schizophrenia - PubMed (nih.gov) ; S. Luza ; Jun 2020; DOI: 10.1016/S2215-0366(19)30520-6]. Das Proteasom ist Proteinkomplex, der eine ringförmige Struktur mit einer Pore bildet, um beim Proteinabbau kurze Peptidfragmente abzutrennen. Als Besonderheit können spezialisierte Proteasomen wichtige Peptide selbst erzeugen. Das Protein (Mensch) „Proteasom 26S_Ubiquitinrezeptor“=143AS liegt am Ende der Repdigit-Spalte Z.38265#_“3“3“/#_“1“1“ als „1“_QS1+3=4_3 für 143AS [PSMD2 - Proteasom 26S Untereinheit Ubiquitinrezeptor, Nicht-ATPase 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation=203AS als QS1+19=20_3 für 203AS [PSMD2 - Proteasome 26S subunit ubiquitin receptor, non-ATPase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation=217AS QS6+5=11=QS=“2“_QS15+1+1=“17“ für 217AS [PSMD2 - Proteasome 26S subunit ubiquitin receptor, non-ATPase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Ubiquitin-Proteasom-System“ sorgt für einen Proteinabbau, der außerhalb der ansonsten zuständigen „Lysosomen“ stattfindet._dat08.08.2023
Der genetische Code (gC) übersetzt die Nukleotidsequenz eines RNA-Einzelstrangs in die Aminosäurensequenz der Polypeptidkette eines Proteins [Genetischer Code – Wikipedia]. Das Ribosom stellt die Oberfläche zur Verfügung, damit mRNA und tRNA in Kontakt kommen. Das Ribosom ist am Zusammembau der entstehende Aminosäure-Kette wesentlich beteiligt, weil das Ribosom während des Elongationszyklus zwischen zwei Zuständen, dem prä- und dem post-translationalen Zustand oszilliert. Hier wird angenommen, dass das Ribosom nicht weiß, welche Aminosäure jeweils eingebaut wird. Im Labor werden auch künstlich entwickelte Moleküle katalysiert – Ribosom als Ribozym. Das Ribosom kennt die geometrischen Merkmale des genetischen Codes, muss ihn aber nicht selbst übersetzen. Die 64 Kombinationen werden dabei den 20 kanonischen Aminosäuren (Standard-Aminosäuren) zugeordnet. Die Ablesungen erfolgen aus einem Triplet, das die 4 Nukleobasen (U, C, A, G) als 3er-Gruppe kombiniert. Entsprechend dem Codon mit einem Triplet auf der Boten-RNA (mRNA) wird ein Transfer-RNA (tRNA) mit einem passenden Anticodon angefordert, das „1“ Aminosäure liefert, um die Peptidkette um „1“ AS zu verlängern. Sofern U=C=58E zusammentreffen, wird eine Definition für den Unterschied benötigt. Cytosin zeigt als spezielle Isometrie eine Tautomerie, deren beide Formen eine Spiegelung (1H-Tautomer und 3H-Tautomer) enthalten [Cytosin – Wikipedia]. An 1. Position CUx ist nur 4-fach das Leucin betroffen. An 2. Position xCU sind Serin, Prolin, Threonin und Alanin betroffen. Weiterhin ist generell eine Unterscheidung von „U“ und „C“ notwendig.
Die Punktmutation in der DNA von „Cytosin zu Uracil“ wird durch Platin (Pt)=78E (wie Guanin=78E) koordiniert [Mechanismus der metallvermittelten Desaminierung von Cytosin – Experiment und DFT‐Rechnungen - Šponer - 2004 - Angewandte Chemie - Wiley Online Library; P.Lippert u.a.; Okt.2004: https://doi.org/10.1002/ange.200460107]. Wenn dem Cytosin das Uracil ungünstig folgt, könnte Cytosin zur Unterscheidung „Platin=78E“ vortäuschen, und zwar mit Cytosin=58E plus 2 Kunstgriffen „10“ mit 58+10+10=Platin=78E, dann aber mangels Platin mit „10“ für „0“ nur Cytosin=58E darstellen. Die Spur vom vergeblichen Zählweg bleibt als Streckung erhalten und kann zu einer anderen Aminosäure führen. Im Startcodon und den 3 Stopcodons ist die problematische Spiegelung C/U nicht vorhanden. Die 1. Position ist entscheidend, weil allein hierbei eine Ladungsumkehrung möglich ist. Die Base in der Mitte des Tripletts bestimmt den Charakter der Aminosäure. Die 2. Position liegt in der Mitte des Codes, so dass die Spalte Z.38259#_“66“[71]/#_“44“[48]/_[22]“28=Wasser“ mit Spalte „66/44“ zweifach einen Kreis=64 und Wasser=28 enthält. Das Wasser „28“ kann verwendet werden, weil im Umfeld alternative Zählungen, wie QS1+1=“2_8“, möglich sind. Es ergibt sich ein Unterschied, ob Wasser von der Aminosäure hydrophil aufgenommen wird oder Wasser hydrophob abweisend seitlich liegt.
Der genetische Code wird in einem dreischaligen Kreismodell dargestellt, das heliozentrisch ein Zentrum aus 4 Quadranten (90°) bildet. Die 64 Triplet-Varianten auf der Außenschale müssen 20 Aminosäuren (AS) zugeordnet werden. Die 4 Quadranten ermöglichen 23 AS-Ablesungen, wobei Dopplungen für Leucin, Serin und Prolin enthalten sind. Das Zentrum und die beiden folgenden Schalen sind rechtsdrehend in der Reihenfolge „U“ [Uracil (U)=C4H4N2O2=24+4+14+16=58E], „C“ [Cytosin (C)=C4H5N3O=24+5+21+8=58E], „A“ [Adenin (A)=C5H5N5=30+5+35=70E], „G“ [Guanin (G)=C5H5N5O=30+5+35+8=78E] besetzt. Für die zweite Schale wird jeder 90°-Quadrant in 4 Teile 90°/4=22,5° geteilt. Die dritte Schale teilt jeden Sektor erneut in 4 Teile mit 90°/(4*4)=5,625°. Das ergibt insgesamt 64 Sektoren=BiXnom-Kreis=64. Der genetische Code wird in den Zeilen Z.38255-Z.38260 in einer Nukleobasen-Kette U, C, A, G und der Sektoren-Anzahl „64“ kombiniert mit dem Winkel 360° vorgegeben. Weiterhin sind die Teilungswinkel 22,5° und 5,625° darstellbar. Die Reihenfolge der Nukleobasen „U-C-A-G“ wird in einer wellenförmigen Kette über 3 Zeilen dargestellt, und zwar in der Spalte Z.38255#[1615]“61“[5]“58“5“/#[161]55733“53“/#[16]“15“[5]“31“[124]. Uracil=58E „lesbar in der Zeile“=Uracil=“58E“_Cytosin=58E in der Spalte (58)“5“/(3)“3“5“ aufsteigend, rechtsdrehend „5“_QS3+5=“8“ für Cytosin=“58E“_Adenin=70E in der Spalte „7“3“3“/“3“1“[1] als QS3+3_1=7_QS7+3=10 für „0“ mit 7_0 für Adenin=“70E“_Guanin=78E in der Spalte #[1615]“61“/#[16]155[7]/#[16]“15“[53] als QS61_1+5+5_1+5=QS61+11+6=78 für Guanin=“78E“.
In Z.38255#(16)“15“6“1“5“[5] ist der Teilungswinkel=22,5° als QS1+6=7=Form_QS15+6+1=“22“_“5“ angelegt, wobei die trennende Null als Komma-Ersatz zwar fehlt, aber in der Folgezeile passend mit QS7+3=10 für „0“ hinterlegt wird. Die Folgezeile enthält den 90°-Winkel als Bezugsgröße mit Z.38256#[615]“57“33“ für Quadrant=90° mit QS57+33=90°. Die Spalte „33/11“ enthält die Zählgröße „11“ und kann das doppelte Triplet (Codon/Anticodon) als „33“ und mit QS3+1=4 den Teiler „4“ für 90°/4=22,5° darstellen. Der Kreiswinkel=360° enthält eine überschüssige „0“(Null), weil darüber eine Kombination mit der Anzahl von 64 Sektoren erfolgt, und zwar mit dem Kreis in der Randspalte Z.38258#_160/#_306 mit QS3+0=“3“_Spalte „0/6“ mit „6“_“0“ für Kreis=360°. Sektoren-Anzahl als „6“ _Spalte „1/3“ mit QS1+3=“4“ für „64“. Die Diagonale wird durch den Teilungswinkel 5,625° ausgefüllt. Darin muss das Komma durch eine eingefügte Null bei der Zählung der Zahl 6 erkannt werden, und zwar absteigend in der Spalte Z.38256#_“5“[368]/#_“2“4“1“9“/#_(969)“2“/#_[718]“5“. Winkel als „5“_ [Ziffer „6“ avisiert hinter Komma: seitlich=9“6“9]_Summe=“2“_QS9_1=10 für „0“_“4“= „6“_Spalte 5/2 mit „25“ als 5_,_6_25 für Winkel=5,625°. Ergibt 64 Sektoren* 5,625°=360°. Die Entschlüsselung des genetischen Codes begann im Jahre 1961 mit dem Codon „UUU“ für die hydrophobe Aminosäure Phenylalanin (Phe)=C9H11NO2=54+11+7+16=88E [Phenylalanin – Wikipedia]. Der Code „UUU“ liegt zweizeilig in der Spalte Z.38261#_“5“3“6“2“[2]“28“3“3“7“[64]/#_-->“5“3“2“000“9“8“[9040] mit 1.Uracil=58E als “5“_QS5+3=“8“ für Uracil=“58E“_2.Uracil=58E mit QS3+2=“5“_QS6+2_0+0+0=“8“ für Uracil=“58“E_3.Uracil=58E verarbeitet zwar Wasser=28E erzeugt aber eine Alternative für den hydrophoben Wasser-Exit als „28“_QS9+8_3=20_QS3+7=10 mit Summe 28+20+10=58 für Uracil=“58E“. In der geschlossenen Matrix wird lediglich eine Ziffer „2“ nicht verwendet, die nunmehr zur Erzeugung von Wasser=28 und zur Positionierung von Phenylalanin (Phe)=88E maßgeblich wird, und zwar in der Spalte Z.38260#_[5404](44) (8)[99180]/#_“5“3“6“2“[2]“28“3“3“7“[64] darin liegt Phenylalanin (Phe)=88E in der Spalte 8/8 für 88E, wobei die 2.Ziffer „8“ aus dem Code „UUU“ von der Zahl 2“8“ stammt. In der Spalte „4“4“8“/2(2)“8“ ist neben Phe=88E das alternative Wasser „Kerbe=2“_QS4+4=“8“ für Wasser (H2O)=28 aus der Matrix-Kerbe „2“. Das Protein (Mensch) „Phenylalanin--tRNA Ligase_beta_FARSB“=589AS übernimmt den Transport zur Einbauposition von Phenylalanin (Phe)=88E. Für die Phe-Position ist das 2.Uracil=58E in den „58“9AS bereits enthalten. Die Ziffer „9“ schiebt sich in der Spalte (8)/(8)/“9“ unter Phe=88E für FARSB=589AS. Der Cofaktor Magnesium=12E liegt voluminös als Spalte vor, weil Phe=88E die Spalten-Form vorgibt, und zwar Spalte 44(8)/22(8) mit Mg=12E als QS2_4+4_2=Magnesium=12E [FARSB - Phenylalanine--tRNA ligase beta subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Phenylalanin--tRNA Ligase_alpha_FARSA“=508AS zieht vom rechten Code-Rand direkt in die Phe-Spalte „8/8“, und zwar in Z.38261#_“8“33764“ als QS6+4=10¬_QS3+37=40 mit Summe 10+40=50_8 für FARSA=508AS. Aufgrund des direkten Phe-Treffers ist kein Cofaktor erforderlich. Weil aber die Untereinheit „Beta“ den Cofaktor „Mg=12E“ besitzt, ist eine Mg-Ionen-Bindung vorhanden [FARSA - Phenylalanine--tRNA ligase alpha subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Phenylalanin--tRNA Ligase_mitochondrial_FARS2“=451AS transportiert Phe=88E und zusätzlich Tyrosin=C9H11NO3=54+11+7+24=96E zusammen in „1“ Paket als Spalte „8“9[9]/8“3“3“ mit Tyrosin=96E als „9“_QS3+3=“6“ für Tyrosin=96E. „FARS2“=451AS legt nunmehr eine Klammer um das Transportpaket in der Gesamt-Spalte Z.38259#_“4“4“6“6“7“1“8“5“[3]/#_“4“0“4“4“[4](8)(9)“9“1“/#_“3“6222(8)(33)[7]. „FARS2“=451AS absteigend in der Spalte 44/4[0]/3[6] mit QS3_4_4+4=“15“_M-förmige Einsenkung in Spalte 66/44 mit QS6+4=10 für „0“_QS6+4=10 für „0“_QS7+1+8=16_Spalte 5/9=QS5+9=14 mit Summe 15+0+0+16+14=45_1 für FARS2=451AS. Darin wird die Ziffer „1“ bei der Katalyse aufgenommen und anliegend mit der Zahl „80“ zu Adenosinmonophosphat (AMP)=C10H14N5O7P=60+14+35+56+15=180E verarbeitet. Unter der M-Form liegt 2_6_0 für ATP=260E. „Katalyse: ATP + L-Phenylalanin + tRNA(Phe) = AMP + Diphosphat + H + L-Phenylalanyl-tRNA(Phe)“ [FARS2 - Phenylalanine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]._dat19.08.2023
Problemfall C->U: Das Condon „CUU“ codiert für die Aminosäure „Leucin“ (Leu)=C6H13NO2=36+13+7+16=72E. Wegen C=U=58E ist ein Unterschied zum Codon „UUU“ vorhanden, das für die Aminosäure „Phenylalanin“ codiert. Cytosin=58E begibt sich mit der Vortäuschung von als Platin=78E über 2 Kunstgriffe 10 für „0“ in die Entschlüsselung und ist damit im Beispielfall erfolgreich. Wegen 10 für „0“ bleiben 58E notwendig erhalten, aber die verlängerte Strecke ergibt eine neue Konstellation. Der Unterschied zum Condon „UUU“ führt mit dem gestreckten Zählweg zu einer Drehung zum linken Serien-Code-Rand #161. Die unbestimmte Leucin-Position in der Code-Serie wird durch eine Spiegelung zur Z.Nrn.-Matrix fixiert, und zwar in der Spalte Z. [382]“6“1“#“1“61“/ Z. [3826]“2“#“1“[61]. „Leucin“ mit QS6+1=7_Spalte am Code-Rand 1/1=QS=2 für Leucin=72E. Codon „CUU“ mit Cytosin=58E in der Spalte Z.38262#[161]“5“3“/Z.38263#[161]“5“[2] als „5“_QS5+3=“8“ für Cytosin=58E (Basiszahl)_2 Kunstgriffe zur „Platin“-Erweiterung mit der Einkreisung von ATP=260E [über Spalte 0[4]/62] in der Spalte Z.38259#161544“6“[67]/Z.38260#161540“4“[4]/ Z.38261#(161)“5“3“[62]“2“2“/ Z.38262#(1)[61]53“2000“ mit 1.Kunstgriff QS2+0+0+0_2+2_4=10 für „0“_mit 2.Kunstgriff in Spalte „6/4“ mit QS6+4=10 für „0“ mit Cytosin= 58+0+0=58E (volle Länge)_Uracil=58E spiegelbildlich (!) in „544“ mit „5“_QS4+4=8 für 1. Uracil „58“E_2. Uracil=58E an 3.Position „CUU“ mit 5_QS5+3=8 für Uracil=“58“E. Das letzte Uracil in „CUU“ ist das erste Uracil in „UUU“.
Das Protein „Leucyl-tRNA Synthase 1“ katalysiert die ATP-abhängige Ligation von L-Leucin zu tRNA(Leu). Synonyme Bezeichnung „LRS“ [Leucyl-tRNA synthetase - Wikipedia l. Fundstelle ist Protein (Mensch) „Leucin-tRNA Ligase_cytoplasmic _Lars1_Q9P2J5“=1176AS. „Lars1_Q9P2J5“ ist ein Leucin-Sensor, weil Leucin=72E mit QS1+1=2_7 bereits in „117“6AS enthalten ist [Die Leucyl-tRNA-Synthetase ist ein intrazellulärer Leucin-Sensor für den mTORC1-Signalweg: Zelle (cell.com); DOI:https://doi.org/10.1016/j.cell.2012.02.044]. In der Spalte Z.38260#[16]“15“/#“1“6“1“[5]/“1“[615] wird QS1+5=6 ergänzt zu 117_6 für 1176AS [LARS1 - Leucine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | Publications | UniProtKB | UniProt Das Protein (Mensch) „Serine/threonine-protein kinase_ mTOR“=2549AS ist aufsteigend mit „25“ als Kette 5*5 =25 (Blockzahl) in der Serie #161“5“ und absteigend mit „49“(Blockzahl) zerlegt. In der Spalte Z.38260#161/#16[1]/#16[1] liegt „Leucin“ mit dem Messergebnis im Anteil QS16_16_16+1=“49“. Die 180°-Drehung wird in der Spalte Z.38260#_ „5“(40)/#_“5“(3)(6)/#_“5“(3)[2]/#_“5“[27]/#_“5“[23] von Threonin=C4H9NO3=24+9+7+24=64 als Ecke 40/[3]6 markiert mit QS6+0=6_4 für Threonin=64E. Serin=C3H7NO3=18+7+7+24=56E liegt mit der Ziffer „5“ im mTOR-Signalweg und seitlich als „5“_QS3+3=“6“ für Serin=56E. Die Haarnadel kreist um die Spalte „1/1“=Zählgröße [MTOR - Serine/threonine-protein kinase mTOR - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Leucyl-tRNA Synthetase 2, mitochondrial_Lars2_ A0A2R8Y581“=70AS wird im Zusammenhang mit dem Protein „Sirtuin-1“ eingeordnet. „Lars2_A0A2R8Y581“ liegt in der Spalte Z.38260#[16]“15“40“/#[16]“15“36/#161532 als QS15+15+40=70AS[LARS2 - Leucyl-tRNA synthetase 2, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NAD-abhängige Proteindeacetylase Sirtuin-1 (SIRT1)“=747AS setzt die Spalte fort, und zwar absteigend vom Code-Rand als QS#1+6=7_QS1+5+32_36=74 mit 7_47 für „Sirtuin-1“=747AS. „Sirtuin-1“ besitzt regulatorische Eigenschaften in Bezug auf LARS-B_Zellen und ist bei der Darmkrebstherapie von Bedeutung [Leucin-tRNA-Synthase-2-exprimierende B-Zellen tragen zur Immunevasion von Darmkrebs bei - PubMed (nih.gov); Z.Wang u.a. Jun 2022; DOI: 10.1016/j.immuni.2022.04.017]. Ersichtlich ist, dass in Sirtuin-1 in der Spalte 3/3 eine Membran enthalten ist, die am rechten Rand Kontakt zur Membran „33“ ist der Zeile sucht. Zwar ist in der Z.38261#_Spalte „3“62228“33“ Nerv=Form=7_rund=64/#_“3“20009“8“90[40] nur das Blut=QS0+9+8+9+0=Eisen=26 auffällig, zugleich sind die Nullen der Darm „808“ als QS6+2=“8“_000_seitlich=9_“8“_9 markiert für Darm=“808“. Nicotinamidadenindinukleotid=C21H27N7O14P2 (NAD)=126+27+49+112+30=314E liegt in der Spalte [3]“6“2“2“2“/“3“2“[000] als „3“_QS2_6+2+2+2=“14“ für NAD=314E. „NAD“ überträgt „2“ Elektronen (222) und 1 Proton H^+[SIRT1 - NAD-dependent protein deacetylase sirtuin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA Ligase_Lars 1_A0A6I8PIP7“=850AS liegt in der Spalte Z.38260#“16“1“(5)(40)[44]/#“16“(1)(5)(36)(2)(2)/#“16“1“5“3“[200]. Einerseits muss Kontakt mit Leucin am linken Code-Rand bestehen, andererseits gibt Adenosinmonophosphat (AMP)=C10H14N5O7P=60+14+35+56+15=180E die rechte Begrenzung. Lars1=850AS als QS5+3=“8“_QS16+1_16_16+1=“50“ mit 8_50 für „Lars1_A0A6I8PIP7“=850AS. „AMP“ mit „1“_QS5+5=10 für „0“_QS40_36+2+2=“80“ mit QS1+0=“1“_“80“ für AMP=180. AMP=180E liegt lesbar am rechten Zeilenrand, kann dort aber nicht gelesen werden [LARS1 - leucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Leucin-tRNA Ligase_Lars 2_A0A494C1E0“=596AS liegt in der Spalte Z. 38260#“16“154“(04)/#“161“5“[3](62) als 5_QS1+6+1_1=9_6_mit 5_9_6 für „596“_Kunstgriff QS1+5+4=10 für „0“ zwecks ATP-Bindung. Mit QS596+“0“=“596“ für Lars 2_A0A494C1E0=596AS. ATP angrenzend in der Spalte 0[4]/62 als 26_0 für ATP=260E [LARS2 - leucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt].
Problemfall C->U: Das Condon „CGU“ codiert für die Aminosäure „Arginin“=C6H14N4O2=36+14+28+16=94E“. Hierbei muss Cytosin=58E einen Unterschied zum gespiegelten Codon „UGC“ kreieren, weil Uracil=58E in der Startposition mit dem Codon „UGC“ für „Cystein“=C3H7NO2S=18+7+7+16+16=64E kodiert. Guanin=78E [analog Platin=78E]. Cytosin=58E täuscht durch 2 Kunstgriffe 10 für „0“ das Platin=78E vor, um einen längeren Weg bis zur Aminosäuren zu beschreiten. In die 1.Kunstgriff-Strecke „10“ legt sich das Arginin-Vorprodukt „Argininosuccinat“=C10H18N4O6=60+18+28+48=154E, und zwar lesbar „154“ mit QS1+5+4=“10“ in der Zeile Z.38259#(16)“154“(46)(6)[7]. „Argininosuccinat“ wird in „L-Arginin“ und „Fumarat“ gespalten. Fumarate sind Salze der Fumarsäure=C4H4O4=24+4+32=60E. „Arginin“=94E liegt in der Zeile Z. 38260#(1)[61]“5404“(44) als QS5+4+0=9_4 für „Arginin“=“94E“. Das spaltendende Protein (Mensch)=Argininosuccinate Lyase_ASL“=464AS liegt neben „Argininosuccinat“ und bindet mit der Ziffer „4“ in Arginin ein, und zwar in der Spalte 46/04 als 46_4 für „ASL“=464AS [ASL - Argininosuccinate lyase - Homo sapiens (Human) | UniProtKB | UniProt]. Rechts zieht sich Fumarsäure=60E dreizeilig als QS6_44_2+8=60E weiter. Das Codon „CGU“ bildet einen Ring, der das Arginin=94E einschließt. Dieses wird dadurch verursacht, dass sich aus der Zahl „5404“ einerseits das Arginin=94E mit QS5+4+0=“9_4“ bildet und andererseits aus „5“_QS4+0+4=“8“ das Cytosin=58E zum Start des Codons „CGU“ ergibt. „Cytosin“ zieht mit dem 2. Kunstgriff in der Randspalte Z.38259#16/#1/#1/#1 aufsteigend als „6“_QS1_1_1_1=“4“ mit QS6+4=10 für „0“ weiter. Das Guanin=78E liegt in der Spalte Z.38262#(1)“6“1“(5)[3]/# [16]“1“5“2“ als QS6+1=7_QS1+5+2=8 für Guanin=“78E“. Das Uracil=58E liegt in der Spalte Z.38261#(1615362/#(1)(6)(1)[5]“32“[0] als QS3+2=5_QS6+2=8 mit 5_8 für Uracil=58E. Das Protein (Mensch) „Arginin-tRNA Ligase_mitochondrial_RARS2_Q5T160“=578AS liegt in der Spalte Z.38261#/[16153]“6“2“/#[1615]“3“2“[0]/#[161]“5“2“[77] als „5“_QS2_3+2=7_QS6+2=8 mit 5_7_8 für „RARS2_Q5T160“=578AS [RARS2 - Probable arginine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Argininosuccinat-Synthetase (ASS)“=412AS katalysiert die Bildung von Arginosuccinat aus Aspartat, Citrullin und ATP und ist zusammen mit „Argininosuccinate Lyase (ASL)“=464AS für die Biosynthese von „Arginin“ im Körpergewebe zuständig [Argininosuccinat-Synthase – Wikipedia]. Die 3 Moleküle bilden einen geschlossenen Komplex. Asparaginsäure (Asp; Aspartat)=C4H7NO4=24+7+7+32=70E liegt am Zeilenrand, um mit einer Spiegelung zur Z.Nr. Z.382“61“#16153[62] eine Position zu fixieren, und zwar als QS1+61+5+3=70 für ASp=“70E“. In der Spalte Z.38“260“# [161]“54(0)4“/Z.382“61“#“16153“(62) kreuzen sich ATP=260E in der Spalte 0/62 und Citrullin=C6H13N3O3=36+13+21+24=94E mit QS5+4+0=9_4 für Citrullin=94E. Das lesbare AMP=180E ist am rechten Rand zu weit entfernt, so dass sich links „1“_QS5+3=“8“_absteigend QS1+5+4=10 für „0“ mit 1_8_0 für AMP=180E ergibt. Das Protein „ASS“=412AS liegt auf der ATP-Kreuzung in der Spalte „[5]“4“0“4“/[53]“6“2“ mit „4“_Spalte 0/6 mit QS0_6=6_QS2_4=6 mit „4“_Summe 6+6=“12“ für ASS=412AS [ASS1 - Argininosuccinate synthase - Homo sapiens (Human) | UniProtKB | UniProt].
Problemfall C->U: Das Codon „CCU“ codiert für die Aminosäure „Prolin“= C5H9NO2=30+9+7+16=62E und bewirkt eine Änderung gegenüber „CUU“, dass für Leucin=72E codiert. „L-Prolin“ wird biochemisch aus L-Glutamat hergestellt. Glutamate sind Salze/Ester der Glutaminsäure= C5H9NO4=30+9+7+32=78E. Das Prolin ist nur wie ein laues Lüftchen über dem Ätna. Der „Vulkan“ ist die Aminosäure „Glutaminsäure“, die direkt über das Codon „GAA“ und das Codon “GAG“ codiert wird. Die 4 Prolin-Codone „CCU, CCC, CCA, CCG“ beruhen primär auf der Glutaminsäure, benötigen aber eine Positionierung aus dem ATP-Zentrum zur Z.Nr.-Matrix. ATP=“26“0E wendet sich über Prolin=“62“E zum Zeilenrand. Für die biochemische Herstellung von Prolin werden 1 Molekül ATP=260E sowie zwei Moleküle Reduktionsäquivalente in Form von Nicotinamidadenindinukleotidphosphat (NADPH)=C21H29N7O17P3= 126+29+49+136+45=385E benötigt [Prolin – Wikipedia]. Eine Bezug zum ATP ergibt sich in einer gemeinsamen Spalte, wenn mit 2*NADPH=2*385=770E gerechnet wird. „ATP“ liegt als Merkmal auch in der Z.Nr. der Spalte Z.38“260“#_„0“[4]/“6“2“/[2]“0“/“77“.
Das Codon „CCU“ zieht als 5-zeiliger Ring zum linken Code-Rand. Für die CC-Doppelung wird nach dem 1.Cytosin eine Serie von 2*2=4 Kunstgriffen 10 für „0“ verfolgt. In dieser Variante wird das Prolin=62E seitlich tangiert und lagert sich erst abschließend in „CCU“ an das Uracil an. „1.Cytosil“=58E mit Prolin=62E in der Z.Nr. der Spalte Z.382“62“#[1]“61[5]“3“2“0“/#[16]“1“5“[2777] als „5“_Spalte 1/1=QS=2_6 mit 5_Summe 2+6=8 für Cytosin=“58E“_1.Kunstgriff absteigend in der Randspalte Z.38259#16“154“46“6“/#1/#1/#1 als QS#1+#1+#1+#1+6=10 für „0“_2.Kunstgriff QS1+5+4=10 für „0“_3.Kunstgriff QS4+6=10 für „0“_ 4.Kunstgriff in Spalte 6/4 mit QS4+6=10 für „0“_„2.Cytosil“=58E in der Spalte Z. 38260#“1“[61]“54“0“4“4“/#“1“[61]“5“3“(62)[2]/#“1“6“1“[5]“3“2“0“[0} gespiegelt im Laufweg „5“_QS4+0+4=“8“ mit 5_8 für Cytosin=“58E“_Uracil=58E als „5“_Spalte 3/3=QS3+3=6_2+0 mit „5“_Summe 6+2+0=“8“ für Uracil=58E.
Das bifunktionale Protein (Mensch) „Glutamat/Prolin-tRNA Ligase_EPRS1“=1512AS bedient beide Anteile als Verbindung zum Zeilenrand. Die Aminosäure wird zunächst durch ATP aktiviert, um ein kovalentes Zwischenprodukt mit AMP zu bilden, und dann auf das Akzeptorende der verwandten tRNA übertragen. In der Spalte Z.38258#1615488/16154466/#16154“0“44/#16153“62“2 ist ATP=260E mit „2“_Spalte 0/6 = „6“_“0“ für ATP=260E vorhanden. Absteigend setzt sich AMP=180E als Spalte 66/44 mit QS66+44=110 fort und wendet in „88“ mit QS8+8=16_aufsteigend über Ziffer „4“ und Ziffer „0“ von ATP=260E, um „40“ zu ergänzen mit Summe 44+66+16+4+40=170E_weiter absteigend in Z.38259#[16]“1“5“4“ mit QS1+5+4=10 für insgesamt AMP=170+10=180E. Aufgrund dieser Windungen liegt EPRS1=1512AS in der Randspalte Z.38260#[1]“6“15“(40)/#[1]“6“[15436] als Blockzahl 15_QS6+6=12 für 1512AS [EPRS1 - Bifunctional glutamate/proline--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Interferon-gamma_IFNG“=166AS kann in bestimmten Zellen die EPRS1-Funktion von der Proteinsynthese zur Translationshemmung umleiten. „IFNG“ liegt am Zeilenrand und bindet mit #1_6/6 in die Randspalte von „EPRS1“ ein [IFNG - Interferon gamma - Homo sapiens (Human) | UniProtKB | UniProt]. „Die humane Glutamyl-Prolyl-tRNA-Synthetase (EPRS) ist eine wichtige Untereinheit des IFN-γ-aktivierten Inhibitors des Translationskomplexes (GAIT), der die Translation des vaskulären endothelialen Wachstumsfaktors-A (VEGFA) reguliert“ [Proline Transfer RNA - an overview | ScienceDirect Topics; Isotope Labeling of Biomolecules - Labeling Methods Erich Michel, Frédéric H.-T. Allain, in Methods in Enzymology, 2015]. Das Protein (Mensch) „Wachstumsfaktor VEGFA“=395AS liegt in der Spalte Z.38259#[161]“5“[44]/#[161]“5“4“[0]/#[1615]“3“[6], und zwar dreizeilig absteigend als „3“_QS5+4=“9“_“5“ mit 3_9_5 für 395AS [VEGFA - Vascular endothelial growth factor A, long form - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Glutamin-tRNA Ligase_QARS1“=775AS entwickelt eine gewundene Form und spielt eine entscheidende Rolle bei der Entwicklung des Gehirns. „QARS1“ liegt in der Spalte Z.38259#_[4]“4“6“6“71“(853)[06]/#_“4“0“[4]“4“4“[899](180)/#_“3“[6222833764], und zwar absteigend in der Spalte „3/4“ mit QS3+4=“7“_1.Kunstgriff QS0_4+6=10 für „0“_2.Kunstgriff Spalte 6/4 mit QS=10 für „0“_Spalte 71/4[8] mit QS4+71=75 mit „7“_Summe=0+0+4+71=75 als 7_75 für QARS1=775AS. Das Protein (Mensch) „Glutamyl-tRNA Sythetase_ A-735G6.3_O14563“=313AS verlängert nach rechts, um das lesbare AMP=180E zu erreichen. Für die ATP-Bindung muss ATP=260E am rechten Rand erst entwickelt werden. In der Rand-Spalte Z.38258#_[9]“2“160“/#_(8)“5“3“(06)/#_“991“(80) liegt das Protein mit der Zahl „853“ in einer Teilung von 2 ATP-Zeilen-Anteilen aus Summe=“160“_Kunstgriff QS2_5+3=10 für „0“_QS99+1=“100“=ATP=160+100=260E. Das Protein „A-735G6.3_O14563“=313AS aus der Zahl „853“ liegt zunächst nur gespiegelt als QS8+5=13_3 vorn. „A-735G6.3_O14563“ wird für ATP mit einem Kunstgriff vertikal gekreuzt. Vermittelt über den 1.ATP-Anteil kann über den Zeilenrand QS6_0+6+1=13 erzeugt werden, so dass die Endziffer „3“ der Zahl „85“3“ in der Zählrichtung „3_1_3“ für 313AS ergibt [A-735G6.3 - Glutamyl tRNA synthetase - Homo sapiens (Human) | UniProtKB | UniProt]._dat22.08.2023
Ribosomen: Die Wiege der kugelförmigen Ribosomen versteckt sich im Zellkern, und zwar im Kernkörperchen (Nucleolus), das dem Aufbau ribosomaler RNA dient. Die Ribosomen bestehen aus „2“ Untereinheiten, die durch die Kernporen nach außen in das Cytoplasma geleitet und dort zum Ribosom zusammengesetzt werden. Das Ribosom wird in Z.38260 avisiert, der Transport der großen Untereinheit aus der Kernpore beginnt bereits in der Randspalte Z.38258#_92160/#_85306#_99180, indem ein angehängtes Leucin-reiches Exportsignal erkannt wird, und zwar mit Leucin=C6H13NO2=36+13+7+16=72 aus „216“ als QS6+1=7_2 für Leucin-Signal=72E. Vielleicht hängt die kleine Unterheit beim Export als Schwanz hinten dran. Das Exportprotein „XPO1“ wird durch das Protein (Mensch) „Adapterprotein 60S ribosomal export_NMD3“=503AS angelockt, das dem Export-Signal folgt und am Zeilenrand eine „0“(Null) als Kernpore findet, und zwar in der Randspalte Z.38258#_[9](216)0/#_[8]“5“3“0“[6]/#_[9]“91“[80] als „5“_aufsteigend QS9+1=10 für „0“_absteigend QS3+0(Pore)=“3“ für 503AS [NMD3 - 60S ribosomal export protein NMD3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Exportin-1“=1071AS liest mit etwas Abstand die Zahl 71 und ist auch mit QS18+89=107 dicht am Ziel, aber so geht das nicht! Das Signal „Leucin=72E“ kommt mit in die Bilanz 1071AS-72E=999AS. „Exportin-1“ addiert in Z.38260 am Zeilenrand QS99_QS1+8=9 für 999_ zieht absteigend durch die „0“(Null) des Adapterproteins und addiert QS6+1=7_2 für Leucin=72 zur Summe 999+0+72=1071AS [XPO1 - Exportin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Am Export der „kleinen Untereinheit“ ist das Protein (Mensch) „Serine/threonine-protein kinase RIO2“=552AS beteiligt. In der Spalte Z.38259#_161544667/#_161540444 werden zunächst Serin=C3H7NO3=18+7+7+24=56E und Threonin=C4H9NO3=24+9+7+24=64 am linken Rand in der Spalte #_1544/#_1540 als QS54+1_1=Serin=56E und Threonin als Fortsetzung mit QS54_Spalte 4/04=QS4+4=8 mit Summe 54+8=Threonin=64E zur Orientierung dargestellt. „RIO2“=552AS somit als QS1+54=55_0_Spalte 66/44 doppelt als QS=10 für 0_0 Spalte 7/4 als QS7+4=11=QS=2 mit „55“_QS0_0_0_2=“2“ für „RIO2“=502AS [RIOK2 - Serine/threonine-protein kinase RIO2 - Homo sapiens (Human) | UniProtKB | UniProt], „RIO2“=552AS ist am Reifungsprozess der „18S-rRNA“ beteiligt. Die „kleine 40S-Untereinheit“ besteht aus 33 ribosomalen Proteinen (r-Proteine) und der „18S“-rRNA (1874 nt). Die „1874“ Nukleotide der „18S“-rRNA sind in die in der Spalte 71/48 als 1_8_74 enthalten. Die Blockzahl „74“ läuft spiegelbildlich als „47“ durch, so dass die Blockzahl „74“ entsteht, weil die große Untereinheit mit dem Anteil 28S („4718“nt) dieselbe Spalte für ihre Nukleotide zählt. Die große 60S-Untereineinheit besteht aus „49“ rProteinen und „3“ rRNAs, und zwar 28S (4718 nt), 5,8S (160 nt), 5S (120 nt) Ribosom – Wikipedia]. Die „3“ rRNA füllen den rechten Zeilenrand und liegen insgesamt als große Untereinheit bis zur Zeile Z.38261 vor, indem der Svedberg-Koeffizient „S“ und die Anzahl der Nukleotide enthalten sind. 28S (4718 nt): Analog zur kleinen Untereinheit wird die Spalte 71/48/28 genutzt als QS4_7_1_8 für 4718 Nucleotide. Es folgt die „28“ für „28S“. 5S (120 nt): „5“ als „5S“ gefolgt von QS30_80=110-_QS6+4=10 mit Summe 110+10=“120“ Nukleotide. 5,8S (160 nt): Die Kommastelle wird über eine enge Klemmstelle aus den „5S“ des Nachbarproteins und der eigenen Zahl „8“ gezählt, und zwar als Spalte 921/8 mit QS9+2+1_8=20_QS99+1=100_QS3+37=40 mit Summe 20+100+40=160 Nukleotide.
Bei der „Translation“ wird die Nucleotidsequenz der mRNA auf die Aminosäuresequenz eines Proteins übertragen. Im Falle einer Aktivierung kann die „kleine-40S- Untereinheit“ den genetischen Code auf der „mRNA“ lesen und die „große-60S-Untereinheit“ verknüpft bei der Proteinbiosynthese die Aminosäuren zur Kette (Peptidyltransferaseaktivität). Mehrere Ribosome sind an ein mRNA-Molekül gebunden (Polysom). Die Ribosomen liegen bei eukaryotischen Zellen frei im Cytoplasma, sind in den Mitochondrien vorhanden und besetzen das „rauhe endoplasmatische Retikulum (rER)“. Das „ER“ umhüllt den Zellkern schalenartig. Die Code-Serien-Spalte wechselt nach der „12er-BiXnom-Schnapszahl-Spalte (Repdigit)“ und 3 „0“(Null)-Zeilen von #1615 auf #1“6“1“4“, so dass der Kreis „64“ mit der Zählgröße „11“ kombiniert wird. Dort kann sich das „ER“ schalenförmig ausbreiten. Die Ribosome müssen dann zuvor übergangsweise noch in der Repdigit-Spalte starten, wo sie auch als Untereinheit erzeugt werden. Wegen der vielfältigen Funktionen der Repdigit-Spalte besitzen Zellen ohne aktiven Zellkern (reife Erythrozyten, Spermien) keine Ribosomen. Die Anzahl der Ribosomen in der Zelle als Gruppe „44“ wird real mit 10^5 bis 10^7 eingeschätzt. Enthalten sind „40“ und „80“ für eine Kombination der Basis „10“ zur Zahl „x“ als Exponent. Die Zeilennummer enthält den Mittelwert für 10^6 als „60“, wobei mit Z.38=QS=11 immer eine Zählgröße vorliegt.
Das „Ribosom“ besteht aus „2 Untereinheiten (subunit) [klein / groß], die sich erst beim „Entzug“ von Magnesium=12E sichtbar formieren. Wie wird ein Verlust von Magnesium dargestellt? Magnesium wird abgetrennt über die Z.Nr. Z3826“1“/3826“2“ für die kleine Untereinheit mit der Randspalte 1/2=1_2=Mg=12. Weiterhin ergibt sich aus Z.-Nr.-Serien-Spalte „6/6“=QS6+6=Mg=12. In der großen Untereinheit liegt die Spiegelung „21“ am rechten Zahlenrand. Ist das alles? Nein, denn der BiXnom hat das „Periodensystem der Elemente (PSE)“ erfunden, das „94 natürliche Elemente=Elektronen-Basis=“94 Elektronen“ enthält. Der „Mg-Entzug“=„94-12=82“ Elektronen läuft in der Z.Nr.3“82“x als Serie mit. Ist das alles? Nein. Die Elektronen-Basis „94“ der Elektronen wird in Z.38260#161“5404“44899180 mit einem Magnesium-Gully-Abfluss (Manhole) „0/6“ kombiniert als QS5+4=“9“_Loch=0_“4“ für die Elektronen-Basis „94“ mit dem Mg-Entzug als Loch „0“. Das Geld ist nie weg, es besitzt jetzt nur ein anderer. Wo? Es liegt in der Folgezeile Z.38261#16153“6“222“833764 für die kleine Untereinheit als Kleingeld mit QS6+2+2+2=Magnesium=12. Das Magnesium wird künstlich im Labor entzogen. „Das ribosomale Protein L2 scheint einzigartig zu sein, indem es spezifische Magnesium-vermittelte Interaktionen mit der rRNA eingeht. Unter Verwendung optimierter Modelle, die aus Röntgenstrukturen abgeleitet wurden, unterzogen wir „rRNA/Magnesium/Wasser/rProtein L2-Assemblierungen“ einer quantenmechanischen Analyse“ [RNA-Magnesium-Protein-Interaktionen in großen ribosomalen Untereinheiten | Zeitschrift für Physikalische Chemie B (acs.org); D. Williams u.a., Jun 2012; https://doi.org/10.1021/jp304723w]. Auf natürlichem Wege wird die „rRNA“ mit den Mg-Ionen (Mg^2+) vom ribosolmalen Protein (Mensch) „MRPL2_Ribosomales Protein L2“=94AS katalysiert. Die Zahl „94“ ist kein Wunder, weil es die BiXnom-Elektronenbasis „94“ ist. Das Protein „L2“=94AS liegt in der Spalte Z.38261#_[6]“22“(28)[33764]/[320]“0“0“9“[89040] als QS9+0+0=“9“_2+2=“4“ für L2“=94AS, wobei Wasser „(28)“ direkt anliegt [MRPL2 - Mitochondrial ribosomal protein L2 - Homo sapiens (Human) | UniProtKB | UniProt]. Dem Wasser folgt die Anzahl der “small unit“- Proteine=“33“. Die Anzahl der “large unit“- Proteine=“49“ ist eine Spiegelung der Zahl „94“, die nochmals am Zahlenrand als „9040“ mit QS4+0=“4_QS0+9=9 für „49“ erscheint. Über die Zählgröße in der Spalte 3/8=QS=11 sind beide Anteile verbunden als Summe „33+49=82“. Wird das Defizit „Mg=12“ ergänzt, folgt Summe=33AS+49AS+ 12E(Mg)=“94“. Der Ribosomen-Durchmesser=20-25nm wird in der Z.38261#161536“22“2833“764“ mit der Form=7_64=Kugel am Zeilenrand entwickelt. Aus der Erweiterung der Repdigit-Zahl „22“ mit QS22+2=24_8=Extra bzw. 8+3=11=Zählgröße ergeben sich genauer 22-24nm und i.M. 23nm. Einschließlich der „3“ Null-Zeilen am Anhang zur Repdigit-Spalte werden die „9“ Ribosomen-Zeilen auf beide Untereinheiten über die Zählung an der linken Code-Randspalte #161aufgeteilt.
“small unit“-Proteine “33“: Für die Anzahl „33“ wird der Ziffer „1“ aus Z.3826“1“#_4 Zeilen*(#1+6+1) für QS“1“_(4*“8“)=“33“ ergänzend mitgezählt. Rechter Code-Rand QS6+4=10_QS4+0=4_QS9+1=10_[9]9=Summe=10+4+10+9=“33“. Die Evolution erkennt den Sedimentationskoeffezienten „S“ nach Svedberg [Svedberg (Einheit) – Wikipedia], der am rechten Code-Rand für die kleine Untereinheit mit „S=40“ in Z.38262 vorliegt. Der Svedberg-Koeffizient für die große Untereinheit S=60 wird für den funktionellen Zweck dynamisch als versteckter Mittelwert (61+59)/1=60 dargestellt. Der zeitabhängige Prozess wird auf Grundlage der Zeitbasis=60 abgewickelt. Hierfür enthält die Z.-Nr. Randzahl Z.382„61“ die Zahl „61“ und die Code-Summe QS1+6+1+5+3+6+2+2+2+8+3+3+7+6+4=“59“. Für das gesamte Ribosom gilt S=80, die bereits eingangs am rechten Zahlenrand in Z.3860#1615404448991“80“ avisiert wurden [Ribosom – Wikipedia]. Die kleine 40S-Untereinheit dient funktionell der mRNA-Erkennung (Boten-RNA). Das Protein (Mensch) „Translation initiation factor 3 subunit J_ EIF3J“=258AS gehört zum eIF-3-Komplex, der die mRNA auf das Startcodon „AUG“ zur AUG-Erkennung scannt. „EIF3J“=258AS rechts neben dem Startcodon „AUG“ mit der Zahl „22“ der Repdigit-Spalte in der Spalte Z.38260#_[0]“4“4“48“/#_[6]“2“2“[28] als „2“_QS2+4+4=“10_48“ mit „2“_Summe 10+48=“58“ für 258AS [EIF3J - Eukaryotic translation initiation factor 3 subunit J - Homo sapiens (Human) | UniProtKB | UniProt]. „EIF3j“ ist an der Initiierung der Übersetzung beteiligt. „eIF3j“ bindet an die A-Stelle des Ribosoms und den mRNA-Eintrittskanal der 40S-Untereinheit, was zur Platzierung von eIF3j direkt im ribosomalen Dekodierzentrum führt“ [eIF3j erleichtert das Laden von Freisetzungsfaktoren in das Ribosom | Nukleinsäure-Forschung | Oxford Akademiker (oup.com): E. Alkalaeva u.a.; Sept 2021; https://doi.org/10.1093/nar/gkab854]. „Der eIF-3-Komplex wird auch für die Demontage und das Recycling von ribosomalen Komplexen nach der Termination benötigt und verhindert anschließend eine vorzeitige Verbindung der ribosomalen Untereinheiten 40S und 60S vor der Initiation“[EIF3J - Eukaryotic translation initiation factor 3 subunit J - Homo sapiens (Human) | UniProtKB | UniProt]. Aufgrund des Startcondons wird die Aminosäure „Methionin“ eingebaut. Dieser Prozess zieht sich als Musterfall bis zur letzten Zeile des Ribosoms. Es wird somit ein Kreislauf für Wiederholungen erforderlich. EIF3J“=258AS kann folglich in der letzten Zeile die weitere Funktion beiden Untereinheiten erhalten. Als letzte Zahlen treffen die beiden Massen 60S und 40S in der Spalte Z.38267#_“1“9“9“/#_“2“6“6“/#_[9](04) mit „6[6]/04“ zusammen. „EIF3J“=258AS kann die Ziffer „6“ aufnehmen, so dass 40S gespiegelt als „04 (letzte Zahl)“ erhalten bleibt, und weiterhin mRNA scannen kann. „EIF3J“ als QS1+9=10_QS9+6=15_QS2+6=“8“ mit Summe 10+15=25_8 für „EIF3J“=258AS [eIF3j erleichtert das Laden von Freisetzungsfaktoren in das Ribosom | Nukleinsäure-Forschung | Oxford Akademiker (oup.com)].
Startcodon: Das Startcondon AUG enthält Mängel, wenn AUG nur aus dem Code entwickelt wird: 1.) Der Anfang #[1]61 mit QS6+1=7 für 70E ist als Code-Serie unbestimmt. 2.) Guanin=78E läuft in der Zählrichtung nur gespiegelt durch 3.) AUG codiert beim Start auch für das hydrophobe Methionin (Met). Weil „Met“ wasserabweisend ist, muss Wasser „28“ zwar seitlich stehen, sollte aber erkennbar besser direkt neben Guanin liegen. Diese Mängel liegen nicht vor, wenn aus der Z.Nrn.-Matrix gestartet wird, und zwar in der Spalte Z.[38260]#[1615404]“4“4“[8]/ Z.[38261]#[161]“5“3“[62]“2“(28)/ Z.[382]“62“#“1“6“1“5“3“2“0“0“[09] mit Adenin=70E aus Z.[382]“62“‘#161 mit QS62+1+6+1=Adenin=“70E“_Uracil=58E aus Spalte 53/5(3) mit „5“_QS5+3=“8“ für Uracil=58E_Guanin=78E mit QS3+2+0+0_2=7_QS4+4=8 für Guanin=“78E“.
„AUG“- Fehlstart mit Code-Start zum Vergleich: Das Startcodon „AUG“ in der kleinen 40S-Untereinheit enthält die 3 Nukleinbasen in einer 3-teiligen Spalte Z.38261#_[1]“6“1“5“3“6“/#_[1](61)“5“3“2“/#_[16](1)“5“2“7“. Adenin (A)=C5H5N5=30+5+35=70E liegt links, und zwar als QS6+1=“7“_Spalte 5/5 mit QS5+5=10 für „0“ als Adenin=70E. Die Zahl „7“ ragt aus dem Komplex heraus, weil eine Rücklaufschleife als Null-Serie anbindet, über Spalte „6“1/1/1/1“ für QS6+4=10 für „0“. [Anmerkung: Der BiXnom kennt die Temperatur-Basis 100°C, obwohl ein Protein natürlich nicht auf 100°C erhitzt wird. „Adenin“, das für fast alles, wie ATP, zuständig ist, besitzt einen Siedepunkt von 360°C mit einem Zahlenwert wie die Winkelsumme von 360°. Der Sublimationspunkt (fest zu gasförmig, ohne Verflüssigung liegt bei 220°C, was als Zahlenwert ADP=220E entspricht.]. Uracil (U)=C4H4N2O2=24+4+14+16=58E liegt eingeklemmt, absteigend als „5“_QS3_3_2=“8“ für Uracil (U)=58E. Guanin (G)=C5H5N5O=30+5+35+8=78E liegt rechts, absteigend „7“_QS6+2=“8“ für Guanin=78E. Das Protein „EIF3J“=258AS“ erkennt nicht das ganze Startcodon, grenzt aber an der Ziffer „6“. Diese Animation ist notwendig, weil man statt der Spalte 6-2-7 nachfolgend in der Zeile aus „5235“ die Zahl QS5+2=“7“_QS3+5=“8“ für „78“ bilden könnten. Die Zeile gehört aber zu einer Vorlauf-Null-Verbindung zum „Anticodon“ in der großen 60S-Untereinheit.
Stopcodon: Die Proteinsynthese wird am Stopcodon beendet. Das Stopcodon wird durch den Freisetzungsfaktor 1 (eRF1) dekodiert, der im Komplex mit dem GTP-bindenden Protein eRF80 in die A-Stelle des 3S-Ribosoms eindringt. Der Freisetzungsfaktor (Release) ermöglicht die Abspaltung der fertigen Polypeptidkette. „eRF1“ erkennt alle drei Stop-Codons (UAA, UAG und UGA). In Eukaryoten binden die beiden Releasefaktoren als eRF1/eRF3/GTP-Komplex an das Stopcodon. „eRF3“ katalysiert nach der Bindung die GTP-Hydrolyse, woraufhin „eRF1“ die Abspaltung der Aminosäurekette stimuliert [Releasefaktor - DocCheck Flexikon; Release factor - Wikipedia]. Die Boten-RMA (mRNA) einhält für das „Ende der Proteinbiosynthese“ „1“ von 3 Stopcodons (UAA, UAG, UGA), die nicht für eine Aminosäure codieren. Das Stopcodon besetzt ab Z.38260 lückenlos die Anfangszeilen, so dass keine weiteren Funktionen möglich sind. Die Matrix beginnt immer mit „Uracil=58E“. Die Varianten UAG/UGA enthalten ein „Extra-„8“-Paket“, das je anch Variante verschoben werden wird. U_A_“8“+A für UAG bzw. U_A+“8“_A für UGA. Diese beiden Varianten müssen in der 3. Zeile abschließend die Randziffer „4“ mit aufnehmen. Für die Variante „UAA“ sind im Prinzip „2“ Zeilen ausreichend. Günstiger ist es, wenn nur „1“ Startcodon existiert, das „3“ Modifikationen ermöglicht. Für „UAA“ ist es dabei nötigt, das „Extra-„8“-Paket“ in „U_A_“8“_A“ durch einen Kunstgriff 10 für „0“ wertmäßig zu neutralisieren, indem in der 3. Zeile eine Ziffer „2“ an das Paket geheftet wird. Die fiktive Stopcodon-Form „U_A_“Extra=8“_A“ setzt sich aus 4 Spalten zusammen, und zwar 1.) Z.38260#[161]“5“(4)/#_[161]“5“3“ mit „5“_QS5+3=“8“ für Uracil=58E. 2.) Z.38260#_“4“0“4“(4)/(3)622 als QS4+0+4=8_62 mit 8+62=Adenin=70E. 3.) Z.38260#_“(4)4/#_22“/#_2000 mit QS2+2_4=EXTRA=“8“_optional QS2+0+0+0=“2“ für QS8+2=10 für „0“ in „UAA“. 4.) Z.38260#_“899180/#_833764/#_[9890]“4“0“ als QS 8+9+9+1+8+0=35_QS8+3+3+7+6+4=31_QS4+0=“4“ mit Summe 35+31+4=Adenin=70.
Für das verkürzte Stopcodon „UAA“ ohne Kunstgriff wird die 3. Spalte durch Z.38260#_“(4)48/#_22[8]“ ersetzt als QS22+48=Adenin=70E. Je nach Stopcodon werden in der dritten Zeile entweder die Ziffer „2“ oder die Randziffer „4“ verwendet, wobei als Besonderheit in Z.38262#_“2“000“989“0“4“0 als QS9+8+9=Eisen=26E markiert wird. Wie nutzt die „mRNA“ den Bezug zum Eisen? Das „Iron Response Element (IRE, engl. etwa auf Eisen reagierendes Element)“ ist eine Struktur in der mRNA von Tieren. Bei Eisenmangel können IRE-Bindeproteine (Iron Response Proteine) zur Regulierung binden. Die Bindung der RNA an das Ribosom kann wie beim Eisenspeicherprotein „Ferritin“ blockiert werden. Oder die Eisenaufnahme erhöht sich, indem der Transferrinrezeptor über die Bindung des Eisentransportproteins „Transferrin“ die erhöhte Eisenaufnahme in der Zelle erlaubt [Iron Response Element – Wikipedia]. Das Protein (Mensch) „Serotransferrin_TF“=698AS nimmt das Eisen doppelt auf, in dem die Zahl “989“ mit QS9+8+9=Eisen=26 von beiden Seiten integriert wird, und zwar als QS2+2+2_0=6_98 und QS3+3=6_98 jeweils für TF=698AS [TF - Serotransferrin - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Ferritin_FTMT“=242AS blockiert von der linken Seite [FTMT - Ferritin, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Ferritin_FTH1“=183 AS blockiert von der rechten Seite [FTH1 - Ferritin heavy chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Ferritin_FTL“=175AS blockiert direkt das Eisen als QS8+9=“17“_Spalte 3/9 mit 3_ „7“_ [64 als QS=10 mit „0“]_0+4=11 mit QS=2 mit Summe 3+2=“5“ für „Ferritin_FTL“=175AS [FTL - Ferritin light chain - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Freisetzungsfaktor 1_Untereinheit¬_ETF1“=437AS ist eine Komponente vom „eRF1-eRF3-GTP-Komplex“, der an ein Stopcodon in der ribosomalen A-Stelle bindet, um die fertige Peptidkette freizusetzen [Eukaryotischer Translationsterminierungsfaktor 1 – Wikipedia]. Das Guanosintriphosphat (GTP)=268E nimmt in der Zeile Z.[38]“260“#“1“6“1“ den Wert für ATP=260E auf und addiert im Code QS1+6+1=“8“ mit Summe 260+8=GTP=268E. Damit grenzt GTP am Uracil=58E aller 3 Stopcodons neben der Spalte „5 /53“. „ETF1“ zieht eine Schlangenlinie um die Spalte „6/6“ mit QS6+6=Magnesium=12E, damit das zum Start der Translation entzogene Magnesium wieder freigegen wird. ETFI zieht dann in die Z.Nrn.-Matrix, um in der Randspalte „1/2“ mit 1_2=Magnesium=12E zu codieren. Damit wird der Code über 3 Zeilen vollständig aufgenommen, weil die Code-Ziffer „2“ in Z.38262#_“2“ bereits zum universellen BiXnom-Startcodon gehört. „ETF1“=437AS liegt in der Spalte Z.38260#161[54]/#161[53]/#16153 als QS1+2_#1=“4“_QS#1_#1+6=8_ Spalte 1/1 mit 1_1 für 11_QS15+3=18 als „4“_Summe 8+11+18=“37“ mit 4_37 für „ETF1“=437AS [ETF1 - Eukaryotic peptide chain release factor subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Mitochondrialer Freisetzungsfaktor 1_MTRF1“=226AS kann dann nur noch den linken Rand der Z.Nr. Z.3826[1]#_(622) als 38=QS3+8=11=QS=2_26 für 226 AS als Rest aufnehmen und zur Zeilen-Erkennung eine Code-Spiegelung „6_22“ realisieren, wobei die Ziffer „6“ ein neues Startcodon „AUG“ verhindert [MTRF1 - Mitochondrial translation release factor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die fiktive Stopcodon-Form „U_A_“Extra=8“_A“ setzt sich aus 4 Anteil-Spalten zusammen. Links neben dem EXTRA-8-Paket wird in der geschlossenen Matrix eine überschüssige Ziffer „4“ eingeklemmt, die im 4. Anteil angehängt wird. Anteil-Spalten im universellen Stopcodon: 1.) Z.38260#[161]“5“(4)/#_[161]“5“3“ mit „5“_QS5+3=“8“ für Uracil=58E. 2.) Z.38260#_“4“0“[4](4)“/#_(3)“6“2“2“/#_“/#_[3]20[0] mit QS4+0=4_ für Zählrichtung „62“ nicht quer, sondern als Spalte 6/2 mit QS62+0_2+2 mit Summe 4+66=70 für Adenin=70E. 3.) Z.38260#_“44/#_(2)2mit QS4+4=EXTRA=“8“ für QS70+8=Guanin=78E_optional in der Spalte „4/2“ ergänzend QS8+2=10 für „0“ in „UAA“. 4.) Z.38260#_“899180/#_833764/#_[9890]“4“0“ als QS 8+9+9+1+8+0=35_QS8+3+3+7+6+4=31_QS4+0=“4“ mit Summe 35+31+4=Adenin=70.
Die Zählrichtung ist kompliziert, so dass das Stopcondon „UGA“ im Sonderfall nicht erkannt wird. Statt dem EXTRA-8-Paket wird die 21. (proteinogene) Aminosäure „Selenocystein (Sec)“ =C3H7NO2Se=18+7+7+16+34=82E eingebaut. Hierfür ist eine strukturell einzigartige tRNA (tRNA^SEC) erforderlich, die neben Selenocystein auch mit Serin oder Phosphoserin beladen werden kann [Selenocystein - DocCheck Flexikon; Selenocystein – Wikipedia]. In der 3. Anteil-Spalte sitzt Selenocystein in der Spalte „44/2“ als QS4+4=8_2 für Selenocystein=82E. Die Beteiligten starten in der Spalte Z.38261/#161536/#161532 mit Serin=56E als QS3+2=5_6 für Serin=56. Das Protein (Mensch) „Serin-tRNA-Ligase_SARS2“=518AS entnimmt die Ziffer „5“ und ergänzt absteigend QS15+3=18 für SARS2“=518AS. „Katalysiert die Bindung von Serin an tRNA(Ser). Ist wahrscheinlich auch in der Lage, tRNA(Sec) mit Serin zu aminoacylieren, um die misacylierte tRNA L-Seryl-tRNA(Sec) zu bilden, die weiter in Selenocysteinyl-tRNA(Sec) umgewandelt wird“ [SARS2 - Serine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „L-seryl-tRNA(Sec) kinase_PSTK“=348AS ist ebenfalls an der Biosymthese von „Selenocystein (Sec)“=82E beteiligt. Mit“ Seryl“ liegt der Bezug zu Serin=56E in der Spalte Z.38259#_154/#_1[54] absteigend als QS1_1=2_54 mit Summe 2+54=Serin=56 vor. „PSTK“=348AS liegt aufsteigend in der Spalte Z.38259#[16]“15“[44667]/#[16]“15“4“0“[444]/#[16153]“62“(22)/#[16153200](0) mit QS15_15+4=34_gespiegelt ATP=260E mit QS„0_6+2“=8 für 34_8=„PSTK“=348AS. [ATP/ADP berichtigt dat25.08.2023]. Cofaktor Magnesium=12E als QS6+2+2+2=12E. ADP=220E folgt in der Spalte 22/0. „Selenocystein (Sec)“=82E in der Spalte „40“4“/[36]“2“ als QS40_Spalte 4/2 mit 42 =40+42=Sec=82E [PSTK - L-seryl-tRNA(Sec) kinase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Selenocysteine-tRNA-Synthase_SEPSECS_J3KP25“=112AS endet direkt im Selenocystein in der Spalte Z38259#_“44“66“7“/#_[4044]“4“, und zwar als QS44+66=110_Spalte „7/4“=QS7+4=11=QS1+1=“2“ mit Summe 110+2=“112“ für SEPSECS_J3KP25“=112AS [SEPSECS - Sep (O-phosphoserine) tRNA:Sec (selenocysteine) tRNA synthase - Homo sapiens (Human) | UniProtKB | UniProt]. Zwei weitere Proteine sind weiträumiger angelegt und benötigen den Cofaktor „Pyridoxalphosphat“=C8H10NO6P=48+10+7+48+15=128E zur Findung der Einbaustelle. Hierzu wird die Zählung für Magnesium mitverwendet, und zwar QS6+6=12_QS4+4=8 für 128E. Das Protein (Mensch) „Selenocystein-tRNA-Transferase_SEPSECS_ Q9HD40“=501AS liegt in der Spalte Z.38259#_“4“4“6“6“[71853]/#_[40]44“4“8“9“9“1“ mit der Spalte 66/44 mit QS6+6+4+4=20_QS4+8+9+9=30_“1“ mit Summe 20+30=50_1 für SEPSECS_ Q9HD40“=501AS [SEPSECS - O-phosphoseryl-tRNA(Sec) selenium transferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Selenocysteine-tRNA-Transferase_SEPSECS_A1A4F3“=441AS beginnt aufgrund der Katalyse: „H2O + O-Phospho-L-seryl-tRNA(Sec) + Selenophosphat = L-Selenocysteinyl-tRNA(Sec) + 2 Phosphat“ neben dem Wasser (H2O)=28 in der Spalte Z.38259#_6671/#_4448/#_22(28) mit QS22+4+4+6+6=42_Spalte „7/4“=QS7+4=11=QS1+1=2 mit Summe 42+2=44_1 für SEPSECS_A1A4F3“=441AS [SEPSECS - O-phosphoseryl-tRNA(Sec) selenium transferase - Homo sapiens (Human) | UniProtKB | UniProt].
43S-Präinitiationskomplex (PIK): Die kleine 40S-Untereinheit wird zu einem 43S-Präinitiationskomplex (PIK) erweitert, und zwar durch Initiator-tRNA^Met, zusätzliche Initiationsfaktoren und Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E. Die Intiator-tRNA^Met ist keine normale tRNA zum Einbau von Methionin, sondern ist nur beim Startvorgang aktiv, indem das Startcondon „AUG“ erkannt wird [tRNA – Wikipedia]. Zum Protein „Met-tRNAf“ liegt keine Information vor. In den Ribosomen der Mitochondrien wird mit N-Formylmethionin (fMet)=N-Formylmethionin= C6H11NO3S=36+11+7+24+16=“94“E initiiert [N-Formylmethionin – Wikipedia]. „fMet“ liegt wie das Protein „EIF3J“=258AS rechts neben der Ziffer „6“ am AUG-Komplex in der Spalte Z.38261#_[6]“2“2“[28]/#_[20]“0“0“9“ als „9“_QS0+0_2+2=“4“ für fMet=94E. An der Ziffer „6“ liegt in der Spalte Z.38260#_044/#_622 das ATP=260E als 2_6_0 für ATP=260, so dass seitlich mit QS4+4=8 das GTP=260+8=268E vorhanden ist. Die Masse „43S“ liegt rechts neben ATP als QS2+8=10_33 mit Summe 10+33=43S (Svedberg). Das 40S-Ribosom zählt sich als QS3+37=40S. Das Protein (Mensch) „ATP-dependent RNA helicase_DHX29“=1369AS ist Teil des 43S-Präinitiationskomplexes (PIK) [Präinitiationskomplex - DocCheck Flexikon]. Katalyse: „ATP + H2O = ADP + H + phosphate+“. ATP=260E wie auch in der Z.Nr. in der Spalte Z38260#_0444/#_6222 als 26_0 für ATP=260E, so dass ADP=220E integriert ist als „22“_QS6_0+4=10 für „0“ mit „22_0“ für ADP=220E. „DHX29“ wandert von links nach rechts neben die Null vom ATP, und zwar in der Spalte Z.38259#_[44667]“1“8“5“3“/#_[40]“4“4“4“[899]“1“ mit der Spalte „3/1“ für „13“_5_QS1+8=9 _Spalte 7/4 mit QS7+4=11=QS=2_4+4 mit „13“_und 5_9 für „59“ _ Summe 2_4+4=10. Insgesamt „13“_Summe 59+10=69 für „DHX29“=1369AS [DHX29 - ATP-dependent RNA helicase DHX29 - Homo sapiens (Human) | UniProtKB | UniProt].
Ribosomale 40S-Protein uS5: Das Protein (Mensch) „Ribosomale 40S-Protein uS5_RPS2“=293AS spielt eine Rolle beim Aufbau und der Funktion der ribosomalen 40S-Untereinheit. Weil es aber gleichzeitig an der Proteinbiosynthese und dem Tunnel beteiligt ist, ist es in der kleinen und der großen Untereinheit jeweils als Spiegelung vorhanden. Weiterhin ist eine lange Verbindungsspalte vorhanden, die das Ribosom durchzieht. „RPS2“ interagiert mit dem Zinkfingerprotein ZNF277, so dass eine Zusatzinformation vorliegt [Das ribosomale 40S-Protein uS5 (RPS2) assembliert mit humanem ZNF277 zu einem extraribosomalen Komplex, der mit der PRMT3–uS5-Interaktion (PMC) konkurriert (nih.gov); F. Bacand u.a.; Dez.2018; doi: 10.1074/jbc. RA118.004928]. Das Protein (Mensch) „Zinkfingerprotein ZNF277“=450AS liegt zusammen mit dem Zink=30 in der Spalte der großen Untereinheit „Z. 38265#_6778/#_5816/#_5075/#_4554“ und sitzt dort auf dem Tunnel-Loch „0“_Form=7 als 45_0 für ZNF=450AS. Der Wunsch ist es, dass es neben der Verbindungsspalte zwischen den beiden Untereinheiten 40S und 60S eine weitere Verbindung für einen Kreislauf existiert, damit die Proteinbiosyntese wiederholt ablaufen kann, beispielsweise, wenn ein Amionosäure mehrfach in die Peptidkette eingebaut wird. Für den Kreislauf ist das Zink=30 zuständig, indem es in „RPS2“ die Flügel-Zahl „77“ verwendet mit QS7+7=“14“_“1“ mit „15“_QS8_0(Tunnel-Loch)_7=15 mit Summe 15+15=Zink=30E bildet und im Tunnel-Loch 0_7=Form endet. Protein „uS5_RPS2“=293AS im Bereich der kleinen 40S-Untereinheit: Ab Z.38261 aufsteigend als 2_QS0+0+9=“9“ mit „29“_“3“ für 293AS_Spiegelung QS6+4=10 für „0“_QS6+1=7_8 mit 78_QS7+7=14 mit Summe 78+14=“92“ rechts an Ziffer „3“ als Spiegelung „392“ angelagert [RPS2 - Small ribosomal subunit protein uS5 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein „uS5_RPS2“=293AS im Bereich der großen 60S-Untereinheit: Mit der Spalte Z.38265#_“1“9“3“[36778849]/#_“1“[5115816721]/#_“10“89“5“0“[75199]/#_[0667]“45“[54266] beginnt als Spiegelung „392“ für 293AS aufsteigend als 3_9_Spalte 1/1 mit QS1_1=2 _10 (Loch) für „0“ (Kopplung) mit „39“_QS2+0=“2“ mit 39_2 für „RPS2“=293AS_Fortsetzung 89_QS5+0 (Tunnelloch)_5=10 für „0“¬_4 mit Summe 89+4=“93“. Vorgelagert ist die Ziffer „2“ aus der Spiegelung mit „2_93“ für „RPS2“=293AS [RPS2 - Small ribosomal subunit protein uS5 - Homo sapiens (Human) | UniProtKB | UniProt]. Verbindungsspalte als „0“(Null)-Serie aufsteigend ab Z.38261#_[53]“6“2“/#_[53]“2“[0]/#_[52]“7“[7]/#_[52]“3“[55] mit QS6+2_2=10 für „0“_QS7+3=10 für „0“ Summe 0+0=“0“. In der Zeitdifferenz DELTA.TIME.EPI.VIR.Z.38261-Z.38264=#126“64“8721“64“5 ist die Verbindungsfunktion als Doppelkreis „64_64“ enthalten.
“large unit“-Proteine=“49“: Die Anzahl „49“ steht am Zahlenrand in Z.38265#“16“151“93367788“49“. Die Anzahl „49“ setzt sich aus 5 Zeilen zusammen, die am linken Code-Rand 5*QS#1+6=5*7=35 ergeben. Für 7*7=49=35+14 liegt in der 2. Reihe Z.38265#16“151“/#16“151“/[16151] mit 2*QS1+5+1=2*7=14 der Rest vor. In Z.38267#1615“10“895075199 wird die mögliche Ergänzung nicht mitgezählt, weil die Zeile die Maßangaben zum „Ribosom-Tunnel“ enthält. Die Tunnellänge ist mit „10“nm enthalten. Die Spiegelung QS1+6=7=Form_15_Form =7_51_seitlich=9 enthält die Zahl 15 für den Tunneldurchmesser, wobei mit der gesonderten „0“ in 5“0“75 (Verschiebung der Ziffer „5“ hinter Komma) eine Kommastelle für Tunnel-Durchmesser=1,5nm eingearbeitet wird. Die Zeitbasis „60“ bzw. auch „S60“ für die große Untereinheit sind in der Tunnel-Zeile Z.38267 mit Summe 10+50=“60“ enthalten.
Das gesamte Ribosom muss funktionell die Winkelsumme=360° erzeugen, weil die beiden Untereinheiten einzeln keine Spaltenwinkelsumme=180° ergeben. Was könnte der Sinn sein? Bei unendlich vielen Prozessen muss der BiXnom-Kreis als Zählwerk wie ein Uhrwerk im Takt laufen. Summe große Untereinheit=10+50+50+50+90=250°. Summe kleine Untereinheit 20 (00?)+40=60+(00?). Gesamt=310°+(00?). Das Problem wird gelöst, indem sich die Zahl „26“ aus der Startzeile Z.Nr.38“26“0 in die Code-Spalte 444/222/000 über die Spalte 4/2 als QS4+2=6_2 für „62“ bildet, die nunmehr vor(über) dem Platzhalter „00“ steht. Der Kunstgriff besteht nunmehr darin, sich die Minderung um Magnesium=12 für 62-12=“50“ für die Winkelsumme „360°“ vorzustellen. Mit dem Katalyse-Protein “L2“=94AS in der Spalte QS2+2=4/“00“9 wird nunmehr die „00“ markiert und Magnesium entfernt. Mit „2228“=22+28 (Wasser)=50 ist nunmehr der Winkel von 50° in Z.38261 gefunden.
Das Prolin-62-Problem: Die Nutzung der Zahl „62“ zur ungewöhnlichen Winkelzählung 62° löst bei der Evolution eine krisenhafte Nebenwirkung aus. Die Aminosäure Prolin=“62“ kann nicht mehrfach in eine Peptidkette gebaut werden und die Proteinbiosynthese stoppt, bis ein spezielles Hilfsprotein das Problem löst. Trotz der Tunnel-Null „0_7“ enthalten die letzten 3 Zeilen jeweils noch eine Platzhalter-„0“(Null) als Bindestelle. An der 1. Null ist eine Aminosäure zu finden: Die Aminosäure „Prolin“= C5H9NO2=30+9+7+16=62E wird sehr langsam eingebaut, weil die Ringstruktur für die Peptidbindung ungünstig wirkt. Wenn das Protein (Mensch) „Initiationsfaktor eIF5A“=154AS unmittelbar neben dem aktiven Zentrum bindet, wird „Prolin“ dagegen ohne Zeitverzug eingebaut [Das Ribosom: ein vielseitiges Mega-Ribozym | Max-Planck-Gesellschaft (mpg.de); M. Rodnina 2013; https://www.mpg.de/7967321/mpibpc_jb_20131]. „Prolin“ zieht durch die Ziffer „0“ und die Spalte „511/0[89]“ als QS1+0_5=“6“_QS1+1=“2“ für Prolin=62E. Es wäre eine Alternative vorhanden, falls „eIF5A“=154AS den linken Code-Rand herunterzählt. Weil „eIF5A“ die TNF-alpha-vermittelte Apoptose reguliert und TNF-alpha (P01375_TNFA)=233AS in die Repdigit-Spalte zieht, muss auch „eIF5A“ dort liegen. „eIF5A“ liegt in der Spalte Z.38265#_[19]“3“[36]/#_“15“1“[15]/#_[10895] als „15“_QS1_3=“4“ für 154AS, wodurch Prolin unterstützt wird. Prolin und „eIF5A“ starten jeweils am rechten Rand der Kreis-Matrix „#16151/#16151“ mit QS16+16+15+15+1+1=Kreis=“64“ [EIF5A - Eukaryotic translation initiation factor 5A-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Kontrolle: Weiterhin interagiert „eIF5A“ mit Synthenin zur Regulation der Apoptose. Das Protein (Mensch) „Synthenin-1“=298AS ist mit „eIF5A“ passend verschachtelt in der Spalte Z.38264#_“2“3“5“5“/#_“19“[3]“3“ als QS19_2+3+5=“29“_Spalte 5/3=QS=“8“ für 298AS [SDCBP - Syntenin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Aminosäure Prolin=62E wird aus Polyprolin synthetisiert. Hierfür existieren eine Vielzahl (>33) von Proteinen „Peptidyl-prolyl isomerase“ [Prolyl isomerase - Wikipedia]. Zu diesen Proteinen gehört auch das Protein (Mensch) „Tumor-Erkennungsprotein_NKTR“=1462 AS, bei dem Prolin=62 zwar lesbar ist, aber über den Zählweg speziell entsteht. „NKTR“ liegt in der Spalte Z.38261#-[6]“2“2“2“/#_“2“0“[0]“0“/#_[7]“77“[9] als QS7+7_0+0=“14“_QS2+2+2_0=“6_2“ für NKTR=1462AS [NKTR - NK-tumor recognition protein - Homo sapiens (Human) | UniProtKB | UniProt]. Prolin=62E ist in der Spalte Z.38261#_[3]622283/#_3200098/#_[2]7[77936] mit „62/2[0]“ doppelt lesbar. Prolin wird zur Bildung des Proteins „Kollagen“ verwendet, indem es durch das Enzym „Prolinhydroxylase“ zu Hydroxyprolin=C5H9NO3=30+9+7+24=70E verarbeitet wird. Weil das Enzym „Prolinhydroxylase“ das Prolin=62E verarbeitet, liest es die Spiegelung „Prolin=62 vs. 26=Eisen“ und besitzt folglich links seitlich den „ersten Cofaktor (Fe^2+)“=Eisen=26“. Das Protein (Mensch) „Prolyl-4-Hydroxylase_ P4HTM“=502AS ist aufgrund der Winkelbildung „22+28(Wasser)=50°“ bereits bekannt, so dass QS22+28=50_Spalte „3/8“=QS=11=QS=2 mit 50_2 für 502AS. Eine Ziffer „2“ kann dabei aufgrund der Zählrichtung nicht exakt entnommen werden, deshalb wird zum korrekten Zählweg geführt, in dem die Ziffer „2“ für den 2. Cofaktor „Vitamin A_ L-Ascorbat“= 36+8+48=92E über „20009“ für QS9+0+0+0=9_2 für VitaminA=92E verbraucht wird [P4HTM - Transmembrane prolyl 4-hydroxylase - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation, das Protein (Mensch) „Prolyl-Hydroxylase_EGLN2“=407AS besitzt dieselben beiden Cofaktoren und beginnt in Z.38261 mit der Randzahl „40“ und zieht über Kunstgriffe 10 für „0“ über einen Bogen in die Zeile zurück, und zwar als 40_QS6+4=10 für 0_QS3+7=10 für „0“ mit Summe 40+0+0=“40“_QS8+3=11=QS=2_ über Spalte 8/9 mit QS2+0+0+0+9=11=QS=2_3 mit „40“_Summe 2+2+3=“7“ für EGLN2“=407AS [EGLN2 - Prolyl hydroxylase EGLN2 - Homo sapiens (Human) | UniProtKB | UniProt]. Und wo ist jetzt Hydroxyprolin=70E? In der Spalte [2]“0“0“[9]/[7]“7“7“[9] kann Hydroxyprolin=70E für beide Enzyme parallel, absteigend als 7_0 für 70E produziert werden.
Tunnel: Die engste Tunnel-Stelle wird durch die beiden ribosomalen Proteine „L4e“ und „L22“ begrenzt [Ribosom – Wikipedia]. „RPL4“ ist evtl. ein Synonym für „L4e“. Das Protein (Mensch) „Ribosomales Protein L4_RPL4“=170AS enthält das Tunnel-Loch als Form=7_0 in der Spalte „[8]1/07“ mit 1_7_0 für RPL4“=170AS [RPL4 - Ribosomal protein L4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „60S ribosomales Protein L22“=128AS kann in der Spalte 8“1“6“7/07“5“1 mit „1“_Spalte 6/5=QS6+5=11=QS=“2“_Spalte 1/07 =QS1+7+0=“8“ für RPL22=128AS ebenfalls am Tunnel-Loch 0_7 erzeugt werden [RPL22 - Large ribosomal subunit protein eL22 - Homo sapiens (Human) | UniProtKB | UniProt]. Kontrolle: RPL22 bindet an Heparin [Heparin disaccharide IV-A sodium salt | CAS 136098-07-2 | SCBT - Santa Cruz Biotechnology]. Das ist mit Heparin= C14H20NO11Na=84+20+7+88+11=210E in der Spalte „11“5“[816]/[89]“5“0“[75]“ als QS1+1=2_Spalte 5/5=10_0 mit QS10+0=“10“ für Heparin=210E zutreffend. Die Modifikation, das Protein (Mensch) „Ribosomales Protein L22 _Q9BYF5“=20AS liegt folglich im Heparin-Pfad am Loch als QS1+1=“2“_QS5_5+0=10 für „0“ als RPL22=20AS [RPL22 - Ribosomal protein L22 - Homo sapiens (Human) | UniProtKB | UniProt].
Die große Untereinheit, mit dem Protein (Mensch) „60S Ribosomales Protein L4_ Q59GY2“=441AS zieht über die 5 Restzeilen in der Spalte Z.38265#_[19]“3“3“/#_“15“1“1“/#_“10“[89]/#_[0]“6“[67]/#_[0]“2“4“[5] absteigend als QS2+4=6_6_10_15_Spalte 33/1=QS1_3+3=7 mit Summe 6+6+10+15+7=“44“_“1“ für 441AS. In der Z.38265 ist die Anzahl von „49“ Proteinen am Zahlenrand enthalten ist. Kontrolle: Citrullination (KW-0164) mit Citrullin=C6H13N3O3=36+13+21+24=94E [Wassermelone (Citrullus vulgaris)]. Citrullin unterstützt die Einfädelung in die Repdigit-Spalte über Spalte „1933/1511“ als QS5+1_3=9_QS3+1=4 für Citrullin=94E [60S ribosomal protein L4 - Homo sapiens (Human) | UniProtKB | UniProt].
Translation bei der Proteinbiosynthese: Für die drei „0“(Null)-Zeilen, die der Repdigit-Spalte folgen, wird ein Zusammenhang mit den „3“ tRNA-Bindungsstellen „ A-(Aminoacyl-, P-(Polypeptid-) und E-(Exit-)Stelle“ als „Platzhalter-Null“ auf der mRNA gesucht. Die A-Stelle ist das aktive Zentrum des Ribosoms ("Peptidyltransferase-Zentrum"). Die angeforderten Aminosäuren sind jeweils an eine Transfer-RNA gebunden, und erreichen als Aminoacyl-tRNA die A-Stelle. Durch eine Reaktion mit einer bereits in der P-Stelle gebundenen Peptidyl-tRNA entsteht eine neue Peptidyl-tRNA, die die entstehende Peptidkette um „1“ Aminosäure verlängert. Das Ribosom verschiebt sich, so dass die tRNA von der mittlere P-Stelle nach erfüllter Funktion in die E-Stelle gelangt und ins Cytoplasma abwandert [Video: Translation (Biologie) • Definition und Ablauf • [mit Video] (studyflix.de)].
Das Peptidyltransferase-Zentrum (A-Stelle) befindet sich auf der Oberfläche der großen 60S-Untereinheit der Ribosomen und wird durch eine Region der rRNA (28S rRNA in Eukaryoten) gebildet. Außer der Ausbildung von Peptidbindungen zwischen natürlichen Aminosäuren können unnatürliche Aminosäuren und andere Reaktionen katalysiert werden. Das aktive Zentrum wird dabei durch die Bindung eines Terminationsfaktors umprogrammiert, so dass ein Wassermolekül eindringen und die Esterbindung in Peptidyl-tRNA hydrolysieren kann. Das Ribosom ist vielseitig bzw. nicht selektiv [Das Ribosom: ein vielseitiges Mega-Ribozym | Max-Planck-Gesellschaft (mpg.de)]. Zwei Nullen sind im Kreislauf als Spalte „0/0“ integriert. Außer der gesonderten Tunnel-Null „07“ und der End-Null „04“ liegt eine dritte Null „10“ seitlich am Kreislauf, und zwar in der Spalte Z.38266#[161515]“11“[5]/#[16151]“0“8“[95]/#[1615]“0“[6674]/#[15]“0“[2454]. Weil in der Spalte Z.38266#_[15]11/[1]0“8“[9] das Wasser (H2O)=28 mit QS1+1=2 _QS8+0=“8“ für Wasser=28 direkt in die „0“(Null) eindringt, handelt es sich um das „Peptidyltransferase-Zentrum“ mit der A-Stelle. Die folgende „0“(Null) wird vom Protein (Mensch) „eIF5A_ Translation elongation factor P (EF-P)“=154AS integriert, das zwischen dem Ausgang (E) und der Peptidyl (P)-Stelle des Ribosoms bindet. „eIF5A“ liegt in der Spalte Z.38267#_5108/#_5066/#_5024 und kann alle 3 Nullen erkennen, und zwar als QS0+1=“1“_“5“_QS5+0+6=11=QS=2_2 mit „15“_Summe 2+2+0=“4“ für „eIF5A“=154AS. „eIF5A“ wurde bereits an anderer Stelle im Zusammenhang mit Prolin verwendet [EIF5A - Eukaryotic translation initiation factor 5A-1 - Homo sapiens (Human) | UniProtKB | UniProt]. An den 3 Bindestellen wird regelmäßig jeweils ein Triplet abgelesen und in diesem Raster weiter bearbeitet. Daher wird eine Verbindung zur Z.Nrn. Serie Z.“3“xxx mit der Ziffer „3“ als Triplet benötigt. Geeignet ist das Protein (Mensch) „Elongationsfaktor-1 alpha_(EF-1alpha)“=462AS, das für die GTP-abhängige Bindung von Aminoacyl-tRNA an die A-Stelle von Ribosomen während der Proteinbiosynthese zuständig ist. „EF-1alpha“ beginnt bereits in der Spalte Z.“38“2“6“5“#16“15“1“[933]/#[1615]“1“[511]. Das Protein wird in die Form „46_2“ zerlegt, und zwar als Z.38=QS=11=QS=2_2+6+5=“15“_weiter im Code QS#16+15=“31“ mit Summe=15+31=“46“_Spalte 1/1 =QS1+1=“2“ mit 46_2 für 462AS [Elongation factor 1-alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Die Spalte „1/1/1“ für ein Triplet wird nur als Duo „1/1“ durchlaufen. Die A-Stelle in Z.38267 kann nur über die GTP-Bindung erreicht werden. GTP=268E legt sich um die A-Stelle in der Spalte Z.38266#[1615]“1“5“[11]/#1615“1“[0]“8“[9] als QS1_1=2_QS1+5=6_8 mit 2_6_8 für GTP=268E. „EF-1alpha“ hält den Prozess in Gang, indem die Apoptose vermieden wird [Elongationsfaktor-1 alpha ist ein selektiver Regulator des Wachstumsfaktorentzugs und der ER-Stress-induzierten Apoptose | Zelltod & Differenzierung (nature.com)]. „EF-1alpha“ zeigt eine GTPase-Aktivität, so dass über verschiedene Hydrolase-Enzymen „GTPase“ das GTP=268E zu GDP=228E katalysiert wird. Für die hydrolytische GTPase-Aktivität wird das Wasser (H20)=28 in der Spalte 11/8[9] als QS1+1=2_8 für H2O=28 erkannt. Entsprechend formt sich GTP zu GDP um, in dem in einer Gegenkrümmung die umgangene Ziffer „0“ aufgenommen wird, und zwar in der Spalte Z.38266#[1615]“1“[51]15/#[1615]“1“0“8“9“5“. „GDP“=228E über Spalte 1/1 als QS1+1=2_QS0+8+9=17_QS1+5_5=11 mit „2“_Summe 17+11=“28“ als 2_28 für GDP=228E. GTP wird von GDP teilweise umschlossen, so dass in Z.38266 das GTP nur noch in der Zahl „51“ als Restgröße verbleibt. Damit das Protein (Mensch) „GTPase-activating protein 25_P42331_RHG25“=645AS für die Katalyse GTP und GDP erreichen kann, muss es sich somit in die Vorzeile legen, und zwar in der Spalte Z.38264#[1615]“2“[3557]/#[1615]1933“6“ als „6“_QS33+9+1_2=“45“ mit 6_45 für GTPase_RHG25=645AS [ARHGAP25 - Rho GTPase-activating protein 25 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Prozess erfordert „1“ Magnesium-Ion, das in der Spalte „2/1“ als Mg=12E lesbar ist [GTPase – Wikipedia]. Das Protein (Mensch) „Rho GTPase activating protein 25_C9JB56“=339AS ist eine Isoform, die im mittleren Verbindungsstück in der Zahl „933“ enthalten ist [https://www.uniprot.org/uniprotkb/C9JB56/entry]. _dat17.08.2023 [GDP geändert 12.09.2023].
Das endoplasmatische Retikulum (ER) ist ein verzweigtes Kanalsystem flächiger Hohlräume im Cytoplasma der Zelle, das von Membranen umschlossen ist. Das Hohlraumsystem inclusive der Zellkernhülle besteht aus Röhren (Tubuli), Zisternen (flache Kammern) und Vakuolen (große Hohlräume). „Reife“ rote Blutkörperchen besitzen mangels Zellkern kein „ER“. Die ER-Membran geht direkt in die Kernhülle des Zellkerns über, so dass das „ER“ die „Zellkern-Krümmung“ widerspiegelt. Das „ER“ entwickelt sich ab Z.38270, weil die Code-Serie #1“6“1“4“ den Kreis=64 mit der Zählgröße „11“ kombiniert. Es sind damit „Winkel-Kreisläufe“ statt unzulässige zeitliche Zeilen-Rückschritte in die Vergangenheit realisierbar. Mit einem Winkel-Kreislauf 360° oder als Zeilenbereich mit einem Spalten-Summen-Winkel 180° gehören Zeilen zu einer Einheit. In den „24 Zeilen“ vermischen sich das ER, der Golgi-Apparat und die Organellen. „1“ Protein-Komplex kann allein weite Bereiche füllen. Zuerst wird das Protein „Signalerkennungspartikel (SRP)“ betrachtet, weil es die Ribosome zum „rauhen ER“ lotst. Proteine werden im Zytosol synthetisiert oder alternativ enthält das Ribosom eine Signalsequenz, um am „rauhen ER“ angelagert zu werden. Ein Signalerkennungspartikel (SRP) erkennt die Signalsequenz neu gebildeter Proteine und führt den Komplex aus Ribosom und mRNA zum rauen endoplasmatischen Retikulum (RER), wo es an den SRP-Rezeptor [signal recognition particle receptor] bindet. Signalerkennungspartikel (SRP), der SRP-Rezeptor und das gemeinsam bindende Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E finden zur Orientierung am „ER“ zusammen. Der SRP-Rezeptor am „rauen ER“ besteht aus 2 Untereinheiten, die sich ab der ER-Startspalte Z.38270 parallel entwickeln, wobei das GTP=268E jeweils gesondert zugeordnet wird. Das Protein (Mensch) „SRP-Rezeptor-beta_ SRPRB“=271AS liegt auf der rechten Seite in der Spalte Z.38271#_„1“482“/#_[7]“607“ als QS6+0+7=13_QS4+8+2=14 mit Summe 13+14=“27“_“1“ für „SRPRB“=271AS [SRPRB - Signal recognition particle receptor subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Zugeordnet ist das GTP=268E in der Spalte Z.38271#_[3]“1“/#_“6“7“/2[5], und zwar absteigend als „2“_“6_QS7+1=8 für GTP=268E, wobei die Ziffer „1“ bindet. Für den Rezeptor „SRPRA“ folgt das GTP in der Spalte Z.38270#_„8“2“3“4“[1]/#_“4“0“1“4“3“ mit QS4+3=7_Spalte 3/1=QS=4 mit Summe 7+4=11=QS=“2“_QS2_0_4=“6“_“8“ mit 2_6_8 für GTP=268AS. Das Protein (Mensch) „SRP-Rezeptor-alpha_SRPRA“=638AS liegt auf der linken Seite in der Spalte Z.38270#_[8]“2“34/#_“4“0“[1]“4“ als QS4_0_2=“6“_QS34+4=“38“ mit 2_38 für „SRPRA“=638AS [SRPRA - Signal recognition particle receptor subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Signalerkennungspartikel (SRP) besteht aus sechs verschiedenen Polypeptiden. Hinzu kommt ein RNA-Molekül, das als 7SL-RNA bezeichnet wird. Der Komplex gliedert sich in 2 Domänen: 1.) Alu-Domäne: SRP9/SRP14-Heterodimer und Anteilen der RNA. Diese Domäne bindet an das Ribosom. 2.) S-Domäne: SRP19, SRP54 und SRP68/72 [Signalerkennungspartikel - DocCheck Flexikon]. Das Signalerkennungsprotein (Mensch) „SRP9“=89AS findet beide Rezeptor-Untereinheiten, und zwar links in der Spalte 8/4014 als „8“_QS4+0+1+4=“9“ für „SRP9“=89AS und rechts in der Spalte 174/314 als QS1+7=“8“_QS4_4+1=“9“ für „SRP9“=89AS [SRP9 - Signal recognition particle 9 kDa protein - Homo sapiens (Human) | UniProtKB | UniProt]. SRP9 bildet eine Domäne mit SRP14, und zwar links mit „1“_“3“_QS2+0+4=“6“ für „SRP14“=136AS und rechts mit „1“_Spalte 3/6=“36“ für SRP14=136AS [SRP14 - Signal recognition particle 14 kDa protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SRP54“=445AS liegt zentral und interagiert nur mit dem linken Rezeptor-Untereinheit „SRPRA“=638AS. SRP54=445AS liegt in der Spalte Z.38270#_[8]“2“3“4“/#_(40)[1]“4“ als „4“_“4“_QS2+3=“5“ für „SRP54“=445AS. Für die Hydrolyse liegt das Guanosindiphosphat (GDP)=C10H15N5O11P2=60+15+35+88+30=228E (berichtigt dat6.9.2023) mit der Ziffer 2 aus GTP als QS4+3=7_Spalte 3/1=QS=4 mit Summe 7+4=11=QS=2_2_8=GDP=228E vor. Die SRP54-Untereinheit fungiert als GTPase, die GTP zu GDP hydrolysiert. Diese Reaktion ist entscheidend für die Dissoziation vom SRP-Rezeptor“ [Signalerkennungspartikel - DocCheck Flexikon]. Das Protein (Mensch) „SRP19“=144AS könnte doppelt entstehen, weil die Spalte 4/14 doppelt vorhanden ist. Es wird nur die linke Spalte [3]4/14 mit 1_44 für „SRP19“=144AS gewählt, um die Bindung von SRP54 an den SRP-Komplex zu unterstützen [SRP19 - Signal recognition particle 19 kDa protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SRP68“=627AS liegt am Zeilenrand in der Spalte „24/72“ als QS2_4=6_2_7 für „SRP68“=627AS. „SRP68“ bindet die Signalerkennungspartikel-RNA (7SL-RNA), so dass daran anschließend SRP72 bindet [SRP68 - Signal recognition particle subunit SRP68 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SRP72“=671AS liegt mit einer Lücke seitlich vom SRP68 in der Spalte Z.38271#_3“1“[4(8)](24)/#_“6“7“[6(0)](72)/#_[257(8)22] als 6_7_1 für „SRP72“=671AS, wobei es durch 2 Kunstgriffe, als Ringschluss mit sich selbst, die Lücke schließen kann. „SRP72“ als 6_7_1_QS7+4=11=QS=2_0_8 mit Summe 2+8=10 für „0“_QS4+6=10 für „0“. „SRP72“=671+0+0=671AS. Die Lücke „48/60“ wird nunmehr durch die Aminosäure „Tryptophan“=C11H12N2O2=66+12+14+16=108E als QS6+4=10_8 für 108E gefüllt. In der Vorzeile Z.38270#_“4096“ liegt Kalium=19E als QS4+0+9+6=Kalium=19E zur Stabilisierung am Zeilenrand. „Ein konserviertes Tryptophan wird in die 5e-Schleife eingefügt und bildet eine neuartige Art von RNA-Kink-Turn, die durch ein Kalium-Ion stabilisiert wird, die wir als K-Turn definieren“ [Structures of human SRP72 complexes provide insights into SRP RNA remodeling and ribosome interaction. | Literature citations | UniProt]. Das von „SRP68“ gebundene Protein „7SL-RNA“ besteht aus ca. 300 Nukleotiden [7SL-RNA – Wikipedia]. Mit dem Kalium wird eine vierzeilige Randmatrix gebildet, in der 300 Nukleotide als 10er-Block zählbar sind, wobei der Sedimentationskoeffizient 7S (Svedberg) als Ziffer „7“ umringt wird. QS74_0_96=“170“_Spalte 14/76=QS=“90“_QS8+2=“10“_QS5+7+8=“20“_Spalte 1/3/6=10 mit Summe 170+90+10+20+10=“300“ Nukleotide, wobei in Z.38273#_[2]578[22] die Ziffern „2“ als Überschuss entfallen, weil kein 10er-Block entsteht.
Winkel-Sortierung: Für „1 Funktionsbereich“ wird die Winkelsumme=360° weit überzogen. Bei einem Zusammenhang von Spalten-Winkelsumme 180° zwischen Zellkernhülle und „ER“ und 3-fachem Zeilendurchlauf mit jeweils „1“ Kreis-Winkelsumme 360° für ER, Golgi-Apparat und Organellen ist eine Gesamt-Winkelsumme=180°+(3*360°)=180°+1080°=1260° erforderlich. Die Zählung ergibt nur 1250°, so dass der fehlenden Winkel=10° in Z.38275#_“370“8“2“[760] als EXTRA=8 mit 8+2=10° vorliegt, weil 370° statt 360° symbolisiert sind. Folglich ist die Gesamtwinkelsumme 1260° vorhanden. Innerhalb der Gesamt-Winkelsumme gibt es Aufteilungsprobleme, so dass das Zurückschieben von Proteinen von Golgi zum ER aufgrund angehängter AS-Motive mathematisch notwendig ist. Der Winkelanteil für das „ER“ mit 180°+360°=540° setzt sich aus Winkeln 60° und 40° zusammen, die als Kreis=64 ein gekrümmtes „ER“ erzeugen. Die Dopplung 6060(0) ist zur Paarbildung ungeeignet. Das Defizit=20° kann als 20°-Winkel durch Calcium=“20“E nützlich kompensiert werden. Mit 7*40° + 4*60° +“20°“=280°+240°+20°=240°+300°=540° können nur 4 Ziffernpaare 6[0]/4[0] gebildet werden. Weil sich „Ribosome“ zur Paarbildung nur auf dem „rauen ER“ befinden, ist das eine mögliche Ursache. Das „raue ER“ dient der Proteinbiosynthese und der Membranproduktion. Die Membranen bilden Röhren und Kanäle mit Durchmessern von 50–500 nm [endoplasmatisches Reticulum - Lexikon der Biochemie (spektrum.de)]. Mit Form=7 wird der ER-Röhrendurchmesser 4_“64“_4 als Gruppe „44“ markiert und mit QS8+1=9=seitlich in Z.38278#161“4“64“4“81“47“3“500“ mit QS47+3=“50“nm_“500“nm definiert. Das „glatte ER“ dient der Fettsäureproduktion und als Calciumspeicher. Es wird für die Synthese von Lipiden und Steroiden (Hormone) benötigt. Das sarkoplasmatische Retikulum (SR) ist das „ER“ in den Muskelzellen. Es verfügt wie das glatte ER über keine Ribosomen. Dort werden Calcium-Ionen als Nervensignale für Muskeln umgewandelt. Nach der Muskelkontraktion gelangen die Calcium-Ionen vom Sarkoplasma (Cytoplasma der Muskelzellen) wieder zurück in das sarkoplasmatische Retikulum. Das Calcium=20E ist in der Spalte Z.38279#_“02“63377/#_ „604“55“02“ nur indirekt als „02“ und lesbar als Spalte 2/0 mit dem Muskel 55 und dem Kreislauf „64“ als 6_0=Ring_4_Muskel=55_02 verbunden, wobei die „0“(Null) in der Spalte 02/0 zum Calcium=20E gehört. Zum lesbaren Calcium=20E in Z.38284 besteht eine Verbindung über 3 Kunstgriffen 10 für „0“, und zwar mit Calcium=20 in Spalte 2/(6)0(4)_QS8+2=10 für „0“_Spalte QS7_0_3=10 für „0“_QS1+9=10 für „0“ _Calcium=“20“. Weil das sarkoplasmatische Retikulum (SR) keine Ribosome besitzt, wäre ein Zeilensprung nötig, um das „rauhe ER“ zu übergehen. Alternativ wird das ER durchlaufen, aber beim Kurzschluss nicht gelesen. Der Muskel „55“ liegt vorab in Z.38273 vor. Es liegt zunächst noch keine Verbindung „55-55“ vor, sondern die Zeile enthält zusätzlich eine Muskelspalte „5“2“5“/[6]“0“[6] mit Calcium=20E als Spalte „2/0“. Eine Calcium-Vertikale zieht bis in den Muskel des SR, und zwar als Calcium=2-0/0/QS3_7=10 für „0“_QS4_3+3=10 (aus Kreis) für „0“_55=Muskel. In Z.3873 besteht ein Muskel-Verbund 5“5752“5 als QS 57+5+2=64=Kreis. Es bildet sich nunmehr ein Ring, weil beide Muskeln 55-55 in einer Rücklaufleitung verbunden sind. In Z.38273 liegt die Mündung der Ionen-Strecke im Muskel „55“ über Spalte „5“(5)/“1“[3] als QS5_1+3_1=10 (aus Kreis) für „0“_QS9+1=10 für „0“_QS99+1=100 für „0“_QS4_3+3=10 für „0“_55=Muskel. Das „rauhe ER“ kann sich von Muskel zu Muskel über Z.38273 bis Z.38280 positionieren, weil es mit sich selbst über 3*Winkel 60°=180° die erforderliche Spalten-Winkelsumme=180° bildet, die sonstigen Winkel (keine 40°) erzeugen 380°, d.h. Ionen-Kreislauf=360° plus 20° für verbrauchtes Calcium=20E. Im nachfolgenden „glatten ER“ sind zunächst Hormon-Pfade „33 / 66“ zu finden. Mit 5*40°(60° fehlt)=200° für die Spalten-Summenwinkel 180° plus Calicium-Speicher „20°“. Sonstige Restwinkel 350°..dat01.09.2023.
Das Aktin-assoziierte Motorprotein „Myosin V (myoV)“ ist bei der Zellteilung für die Weitergabe des „peripheren ER“ an die Tochterzellen verantwortlich [Endoplasmatisches Retikulum – Wikipedia]. Das „periphere ER“ enthält scheinbar kein Kanalsystem, es ist aber vorhanden und kann sich vom dichten Verbund bis zu einer losen Anordnung weiten, so dass die inneren Zellmembran erreicht werden kann. Im „Myosin“ bilden „2“ gleiche schwere Ketten ein Dimer für eine doppelköpfige „Motordomäne“, die sich auf Aktin-Filamenten schrittweise durch einen "Hand-über-Hand"-Hebelarmmechanismus mit einer Schrittweite von „36“ nm bewegt [Myosin – Wikipedia (engl.)]. Die beiden Köpfe stellen hierbei die Füße dar. Die V-förmig zusammengeführten Hebelarme, dienen als Laufbeine. Jeder der beiden Hebelarme wird durch 6 leichte Calmodulin-Ketten stabilisiert. Der V-förmigen Motordomäne folgen ein Stiel (rod region) und der Schwanzteil aus einer Doppel-Kugel (globular tail), an dem die Fracht bindet. Die „3“ Proteine „MYO5A“, MYO5B und MYO5C“ sind Varianten, die für unterschiedliche Gewebe spezialisiert sind. Aus der Myo5-Kettenlänge ergibt sich die Position der Motordomäne, jedoch kann damit nicht das komplette Protein dargestellt werden. MYO5 benötigt zunächst eine Aktin-Bindestelle, um entlang von Aktin-Filamenten mit einer Fracht zu laufen. Eine Verbindung von Aktin=374AS für Aktin-Filamente und Tubulin=471AS für Mikrotubuli steigt über die Randspalte Z.38277#_[789]“4“[99]/ #_(“473“)5“0“0“/#_[37790]“0“/#_[0268]“1“ auf. Aktin ist gespiegelt lesbar. Tubulin als 4_5_0_0_0_1 mit „45“_Summe 0+0+0+1=“1“ für Tubulin=451AS. Die Ziffer „1“ liegt neben dem lesbaren GTP=268E, das zum Wachstum der Mikrotubuli benötigt wird. Die Hydrolyse von GTP in GDP=228E ist als Spalte 02(68)/478[2] mit „2“_Spalte 0/4 mit QS0_4+7=11=QS=2_8 mit 2_2_8 für GDP=228E bereits als Zusammenhang vorhanden. Die gesuchte Aktin-Bindestelle liegt dreizeilig in der Spalte Z.38279#“37“[7900]/#_[50]“2“[681]/#_847826 als „37“_2_QS4+7=11=QS=2 mit „37“_Summe 2+2=“4“ für Aktin=374AS. Die Bindestelle für Nukleotide liegt seitlich in der Spalte „3[3]/55/78/0[4]“ für Cytosin=Uracil=58E als 5_QS5+3=8 für 58E; Guanin=78E ist lesbar und Adenin=70E in der Spalte 7/0 für 70E. ADP=260E kann sich als Ligand fünfzeilig in der Randspalte Z.38277#_[9]“9“/[0]0/[0]0/[8]“1“/“26“ ausbreiten, und zwar als „26“_QS1_0_0_9=10 für „0“ als ATP=260E. Die Ziffer „2“ kann alternativ den Schluss bilden, als „26“_Spalte 8/2 =QS=10 für „0“ als ATP=260E. Dieses ist für die Schrittfolge notwendig, die den Wechsel zu ADP=220E als „2“_QS4+7=11=QS=“2“_“0“ für ADP=220E benötigt. Die Schrittlänge von 36nm absteigend als Spalte 3/6 liegt optimal vor, wenn sie sich als Summe aus der Zahl „11“ als 47=QS=11 und der Hubhöhe von 25nm als Spalte „2[78]/“104“ mit „2“_QS1+0+4=“5“ für 25nm ergibt (25+11=36nm) ergibt.
Die „6“ Calmodulin-Ketten, die jeweils zur Stabilisierung für beide schwere MYO5-Ketten benötigt werden, werden vorab ermittelt und sind für MYO5A“, MYO5B und MYO5C verwendbar. Calmodulin kann vielfach gezählt werden, weil sich die Zählungen teilweise bis zum linken Serienrand #16“14“ mit der Zahl 14 erstrecken. Am V-Arm der Motordomäne sitzen zur Bindung „6“ IQ-Motive [Myosin-VA bindet an Aktinfilamente und koppelt Mikrotubuli mechanochemisch an Aktinfilamente - PMC (nih.gov); M. Mossecker u.a. (2004); doi: 10.1091/mbc. E03-07-0504]. Weil die IQ-Motive ebenfalls die volle Zeilenbreite besetzen, sitzt Calmodulin durch Überlagerung auf dem IQ-Motiv. Die „6“ IQ-Motive bestehen jeweils aus einem IQ-Aminosäuren-Paar „Isoleucin (I/Ile)“=C6H13NO2=36+13+7+16=72E / „Glutamin(Q/Gln)“=C5H10N2O3=30+10+14+24=78E. Die linke vierzeilige Serien-Randspalte Z.38280#“1“61“4“/#“1“61“4“/#“1“61“4“/#“1“61“4“ enthält gleichartig „2“ IQ-Motive mit „Ile“=72E absteigend QS6+1=7_QS1_1=2 für 72E. „Q“=78E aufsteigend QS6+1=7_QS4+4=8 für Q=78E. Das 3. IQ-Motiv liegt in der Spalte Z.38280#_ [5]“6“[04]/#_[5]“1“8“(2)/“47“(61)/“4“3[39], und zwar mit „Ile“=72E aufsteigend QS4+3=7_QS4+7=11=QS=2 für Ile=72E. „Q“ aufsteigend als QS6+1=7_8 für Q=78E. Für das 4. IQ-Motiv ist „Ile“=72E absteigend als QS6+1=7_2 für 72E mit enthalten. Q=78E liegt lesbar neben der Ziffer „2“. Das 5. IQ-Motiv folgt in der Spalte Z.38282#“04“1“331“8“/#_“3“19“[9139] mit Ile=72E als Ring absteigend QS3_0+4=7_aufsteigend QS1_9+1=11=QS=2 für 72E und QS3+3+1=7_8 für 78E. Das 6. IQ-Motiv ist vorgelagert in der Spalte Z.38280#_“5502681/#_7847826 die doppelte Zahl Q=78E und die Randspalte [8]1/26 mit Ile=QS1+6=7_2 für 72E werden wegen der falschen Reihenfolge nicht gelesen. Ile=72E beginnt mit QS5+0+2=7_47=QS=11=QS=2 für 72E. „Q“=78E beginnt am Zeilenrand absteigend mit QS6+1=“7“_Ziffer 8 für den Ile-Anschluss zu früh, deshalb in der Spalte 8/2 ein Kunstgriff 8+2=10 für 0_8 mit „7“_Summe 0+8=“8“ für 78E. Die verteilten Code-Matrix-Lücken bilden folgende Summe: Spalte 5/5=“10“_QS0+45=“45“_“6“_39_QS9+1=10_39 mit Summe=10+45+6+39+10+39=“149“. MYO5 fordert zum Lückenschluss ein Protein mit einer Länge=149AS an, wobei es sich folglich um Calmodulin-CALM1=149AS handelt. Bindet CALM1, ist MYO5 korrekt gefaltet. „CALM1“ liegt 6-fach ohne Überschneidung in Z.38280 bis Z.38283. CALM1/Nr.1 liegt in der Serien-Rand-Spalte Z.38280#[16]“14“5/#[161]“4“5“ als „14“_QS4+5=“9“ für CALM1/Nr.1=149AS. CALM1/Nr.2 liegt in der Serien-Rand-Spalte Z.38282#[1614]“47“/#[16]“14“4“3“ absteigend als 14_4+3=7_47=QS=11=QS=2 mit „14“_Summe 7+2=“9“ für CALM1/Nr.2=149AS. CALM1/Nr.3 schließt lückenlos an, und zwar in der Spalte Z.38282#_“6“1“[04]/#_“39“3“1“ als „1“_QS6_39_3+1=49 für CALM1/Nr.3=149AS. CALM1/Nr.4 liegt vorgelagert in der Spalte Z.38280#_[0]455/#_[8]278 aufsteigend als QS4+5+5=“14“_QS2+7=“9“ für CALM1/Nr.4=149AS. Nach einer Lücken-Spalte 8/4 =Schwerachse 84 folgt CALM1/Nr.5 in der Spalte Z.38280#[0]“2“[681]/#_“47“[826]/#_“1“[3(31)8] absteigend als „1“_QS47_2=“49“ für CALM1/Nr.5=149AS. CALM1/Nr.6 liegt in der Randspalte Z.38279#_(2)“6“8“1“/#_(7)[8]“2“6“/#_“3“3“1“[8]/#_“9“1“3“[9] aufsteigend als QS 6+8=“14“_am Zeilenrand 1. Kunstgriff QS1_2+6_1=10 für „0“ _2. Kunstgriff als Wende absteigend mit QS1+3_3+3=10 für „0“_aufsteigend Ziffer „9“ mit „14“_Summe 0+0+9=“9“ für CALM1/Nr.6=149AS. Die 6 Calmodulin-Ketten (CaM) sind als Spulenstiel zum Abschnitt „α-helikalen Coiled-Coils“ gewunden. „Calmodulin 1“ besitzt verschiedene Synonyme, u.a. CALM1, CALML2, [Calmodulin 1 – Wikipedia] für 149AS siehe CALM1 / CALM2 [CALM2 - Calmodulin-2 - Homo sapiens (Human) | UniProtKB | UniProt ; CALM1 - Calmodulin-1 - Homo sapiens (Human) | UniProtKB | UniProt ]. „Calmodulin“ besitzt 4 Calcium-Bindestellen, so dass Calcium in 4 Zeilen jeweils 1x in einem Kettenverbund in der Spalte Z.38281#[5]“18“[2784]/#_„47“6“10“4“1“/#_[43393]“19“/#_[39176]“20“ verfügbar ist. Calcium=20E absteigend QS4+7=11=QS=2_18 für Ca(Nr.1)=2+18=20E_in Zeile QS6+10+4=Ca (Nr.2)=20E_absteigend QS1_19=Ca(Nr.3)=20E_lesbar Ca (Nr.4)=20E.
Myosin „MYO5A“=1855AS (Dimer) wird in Neuronen und Melanozyten expremiert. Der Myosin-V-Motorkopf besitzt eine Nukleotid-Bindungsstelle und koordiniert zweiwertige Metall-Ionen (wie Magnesium) und eine ATP-Bindungsstelle [Myosin – Wikipedia]. „MyoV“ ermöglicht den kontinuierlichen Transport von Organellen, membranöser Fracht, sekretorischen Vesikel, mRNA, Lipiden und Proteinvesikeln auf Aktinspuren (Aktin=374AS), während Kinesin und Dynein vergleichbare Dienste auf Mikrotubulispuren erbringen“ [Myosin V from head to tail - PMC (nih.gov); K.Tribus (2008); doi: 10.1007/s00018-008-7507-6]. Für das doppelköpfige Protein (Dimer) wird eine doppelte Zählweise benötigt: 1.) Zählung: Weil sich im Motorkopf eine Nukleotid-Bindestelle befindet, die mit Magnesium=12E in Beziehung steht, ist das Protein (Mensch) „Myosin V_MYO5A“=1855AS in der Spalte Z.38281#_“18“27“8“(47)“8“2“[6]/#_[76104]“1“3“3“1[8]“ vorhanden, weil darin das Magnesium in 2 Spalten 2/1=Mg=12E verfügbar ist. Die Zeile Z.38280 enthält die Zahl 55(02) nur zur Animation, wird aber mit Ziffer „0“ benötigt, um mit der Folgezeile unsichtbar QS4+7=11=QS=2_0 das Calcium=20E dazustellen. Die benachbarte Ziffer „2“ wird dabei für Calmodulin-CALM1=149AS spaltenförmig als „1_4_QS7+2=9 für CALM1=149AS benötigt. „MYO5A“ mit Zahl „18“ nicht am Zeilenrand, sondern aufsteigend „18“_QS27_8_reduziert QS4+7=11=QS=“2“_8+2_1+3+3+1 mit „18“_Summe 27+8+(47) reduziert auf „2“+8_Magnesium-Spalte 2/1=QS=3+3+3+1=“55“ für „MYO5A“=1855AS. [MYO5A - Unconventional myosin-Va - Homo sapiens (Human) | UniProtKB | UniProt]. 2.) Zählung für Dimer: In der Spalte Z.38280#_5502681/#_[78]47[826] wird die Zahl 18 aus Spiegelung der Randzahl 81 gewonnen, indem nunmehr die Zahl 55 über ein Weiche „02/47“ zur Folgezeile gelesen wird, und zwar als 1_8_QS6+2=8_über Spalte 2/7 mit QS4+7=11=QS=2_über Spalte 0/4 mit QS0+55=55 als 18_Kunstgriff 8+2=10 für 0_55 als „18“_Summe 0+55=“55“ für „MYO5A“=1855AS (Dimer). Der Hebelarm bzw. die „Beinlänge“ entlang der Verstärkung durch 6 Calmodulin-Ketten beträgt 24nm, und zwar als Randspalte Z.38281#_[8]“2“[6]/#_[3]“1“[8]/#_[1]3[9]/#_[2]“7“[2] als „2“_QS1_3=“4“_als Form=7 für Hebelarmlänge=“24“nm. In der Spalte ist Calmodulin =149AS als „1“_QS1+3=“4“_QS2+7=“9“ enthalten. Myosin „MYO5B“=1848AS (Dimer): Das Protein (Mensch) „Myosin V_MYO5B“=1848AS liegt vierzeilig als Dimer in Randspalte Z.38282#_3“3“(„1“8“)/#_[9]“1“(39)/#_“5“2“(72)/#_“1“[700]. 1.) Zählung ab Z.38285 absteigend als „1“_QS5+2_1=“8“_QS1_3=“4“_“8“ mit 1_8_4_8 für MYO5B=1848AS [MYO5B - Unconventional myosin-Vb - Homo sapiens (Human) | UniProtKB | UniProt]. 2.) Zählung aufsteigend in der Randspalte „18“/“39“/“7“2“ als „18“_39_QS2+7=9 mit „18“_Summe 39+9=48 für MYO5B=1848AS (Dimer). Interaktion mit RAB11A=216AS in Randspalte [78]“2“[6]/“33“1“[8] mit 2_1_QS3+3=6 für 216AS, wobei die Membran „33“ als Ziel angesteuert wird. Myosin „MYO5C“=1742AS (Dimer) liegt neben MYO5B und ist ebenfalls an der Membran „33“ interessiert, die für die Zählung von Transferrin=698AS als QS3+3=“6“_“9“_QS9+1=10 für „0“_QS2+6=“8“ mit 6_9_QS0+8=8 für Transferrin=698AS benötigt wird [TF - Serotransferrin - Homo sapiens (Human) | UniProtKB | UniProt]. „MYO5C“ liegt in der Spalte Z.38282#_[041]“33“[18]/#_[319]“9“[139]/#_“6“2“0“[5272]. 1.) Zählung 3-zeilig absteigend als QS6+2+0_9=17_QS9_33=42 mit 17_42 für MYO5C=1742AS [MYO5C - Unconventional myosin-Vc - Homo sapiens (Human) | UniProtKB | UniProt]. 2.) Zählung aufsteigend „1“_QS1+3+3=“7“_Spalte „0“4“/“3“[1]/“6“2“ mit „4“_QS0_3_6+2=11=QS=“2“ als 17_4_2 für MYO5C=1742AS (Dimer).
Die beiden schweren Ketten für die „Motordomänen“ von „MYO5“ werden V-förmig zusammengeführt und mit einem Spulen-Stiel und dem Schwanz fortgeführt. Diese Verlängerung im Zeilenlauf ist nur möglich, wenn das Protein fiktiv federartig ausgerollt wird.
Der Spulenstiel ist spiralartig gewunden, enthält aber „2“ nicht gewundene Regionen, die das Ausrollen repräsentieren. Die Bildung von „α-helikalen Coiled-Coil“ wird von einem „7-AS-Motiv (Heptad-Repeats)“ verursacht, bei dem die 1. und 4. Position, die innere Naht der Coiled-Coil bildet und von hydrophoben Aminosäuren besetzt wird. Ohne die rechte Ziffer „6“=flexibel liegen „7“ Ziffernpaare in der Zeile Z.38281 mit der Zahl „82“ auf der 1. und 4. Position. Das Wasser=28 kann nicht „hydrophob“ am rechten Rand beseitigt werden, und muss deshalb alternativ in Verbindung mit der Zahl 7=Form als „unerwünscht (hydrophob)“ mit „82“ gespiegelt werden. Im Zentrum ist die Schwerachse „84“ für den Spulenstiel „82_7_“84“_7_82“ codiert. Die Windungen am Spulenstil werden von 2 Regionen ohne Windungen unterbrochen. Die erste Unterbrechung in der „Coiled-Coil“ ist eine PEST-Stelle (fehlt bei MYO5C), die die Aminosäuren „Prolin (P/Pro)“=C5H9NO2=62E, Glutaminsäure (E/Glu)=C5H9NO4=78E, Serin (S/Ser)=C3H7NO3=56E und Threonin (T)= C4H9NO3=64E enthält. Für einen kompakten „Punkt“ ergibt die Summe 62+78+56+64=260E. Der Energiebezug zum ATP=260E ist vermutlich nicht zufällig, weil der Spulen-Stiel beim Abknicken Energie benötigt. Die Spalte Z.38279#_„02/60“ mit den „4“ seitlich anliegenden AS kommt als PEST-Stelle zu früh. Es wird umgekehrt kein Punkt, sondern eine Streckung für eine ausgerollte Spule mit einer alternativen Zahl=260 gewählt. Im Labor wird die PEST-Stelle künstlich durch das Protein „Calpain“ gesprengt. Die Untereinheit „Calpain_CAPN1“=714AS liegt seitlich, aber die Untereinheit „CAPN2“=700AS“ trifft mit „7“ die Matrix der „4“ Aminosäuren an der Ziffer „7“ von (E/Glu)=“7“8E und sprengt damit die Form „7“ [CAPN2 - Calpain-2 catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt].
PEST-Stelle und Calpain liegen gestreckt in der Randspalte Z.38285#_[4](317)“0“[„0“]/#_[8](7)[84]“0“[„6“]/#_[5](4)[53]“7“[„2“]. CAPN2=700AS absteigend als Spalte „0“-0“-"7“ für 700AS. CAPN1=714AS liegt seitlich als „7_1“_Spalte 3/7=QS=10 für „0_4“ mit „71“_Summe 0+4=“4“ für CAPN1=714AS. Die Elektronen-Summe „PEST“=260E bildet neben CAPN2 den Außenrand, und zwar absteigend Spalte „2-6-0“. Die 4 Aminosäuren (P-E-S-T) verteilen sich in der Spalte Z.38285#_431700/#_87840“6“/#_5453“7“2“/#_432“5“8“0/#_540“01“5“. „Prolin (P/Pro)“= C5H9NO2=62E in der Randspalte Z.38286#_6/#_2 als 6_2 für Prolin=62E. Glutaminsäure (E/Glu)=C5H9NO4=78E links neben Prolin als Spalte 7/8=78 für Glutaminsäure=78E. Serin (S/Ser)=C3H7NO3=56E dreht sich am Zeilenrand mit einer Wende um die Glutaminsäure in der Randspalte Z.38288#_5(8)“0“/01“5“ als QS0_5=“5“_QS0+1_5=“6“ für Serin=56E. Threonin (T/THR)=C4H9NO3=64E zieht nunmehr in der Zeile Z.38288#_[2]“2“31“043“2“(580)/#_[1]“80"[945]“40“(015) neben Serin vom Zeilenrand nach innen, und zwar für die Ziffer „6" über die Spalte (3)2/40 mit QS2_0+4=“6“ als Schleife über die Spalte „32/40“ zurück über die Ziffer „3“ in Zeile Z.38288 mit QS3+4+0=7_QS3+1=4 als Summe 4+7=11=QS=2_2 mit QS2+2=“4“ für 6_4=Threonin=64E.
Bei diesem PEST-Zielpunkt liegen in der Spalte 23/80 die „80“ Aminosäuren, die nach der PEST-Stelle die 2. windungsfreie Stelle im Spulenstiel bilden. Die 80AS sind Teil des Wende-Winkel „180°“, der nochmals gesondert mit 2 Winkeln 90°=180° gebildet wird, um den ausgerollten Spulenstiel wieder einzurollen. Für den „Schwanz“ ist die Situation dadurch prekär. Einerseits entwickelt er sich als Struktur beim Einrollen gegen den Zeilenlauf in Richtung der Motordomänen nach innen und andererseits entwickelt sich das reife Protein im Zeilenlauf weiter nach außen, weil es Fracht aufnimmt und als Motorprotein zum Transport von Vesikeln freigesetzt wird.
Der 1. 90°-Winkel wird zusätzlich in der Z.Nrn. Z.382“90“#_“387“8“ angekündigt und im Code als QS3+87=Winkel 90° erzeugt. Die folgende Ziffer „8“ gehört absteigend zu einer Wendespalte 6-0-4-8, die den Spulenstiel als Schwerachse=84, den Kreis=64 für die Wende und den 2. 90°-Winkel als QS84+0+6=90° für Wende 90+90=180° enthält. Im Rücklauf liegt in Z.3828“7“#_„265“265“ eine doppelte Struktur, die als End-Kugelpaar geeignet ist. Im Labor zeigt sich, dass MYO5 beim Laufen auf Aktin-Filamenten auf der Suche nach einer Fracht kreuzende Mikrotubuli auf einer Strecke von >5,45µm über eine Zeit > 2 Sekunden scannt. Diese Strecke zwischen dem MYO5-Kopf und einer negativ geladenen Tubulin-Region ist der sogenannte „E-Haken“. Die Anzahl von 400 Aminosäuren in der Globulären Schwanzdomäne (Globular tail domain) ist in Z.38289#161“418“0“94“5“400“15 enthalten. Eine Spiegelung für die beiden End-Kugeln muss erst mit „4“_QS1+8=“9“=seitlich_0_“94“_Struktur=5 gebildet werden. Die Kugelform am Rand mit einem Volumen QS5+1=“6“_QS0+0+4=“4“ für eine Kugel=64 [Myosin V vom Kopf bis zum Schwanz - PMC (nih.gov)]. Die Frachtsuche liegt in der Spalte Z.38287#_“2“6“545“37“[2]/#_[1]“0“[432580]. Die Scan-Zeit von „2“ Sekunden ist mit der Zeitbasis „60“ in der Spalte „2“6“/[1]“0“ kombiniert, wobei der Zeitbasis ohne Trennstelle die Scan-Strecke von 5,45µm=5450nm folgt. Die Zahl „545“ ist lesbar, die Ziffer „0“ folgt als QS3+7=10 für „0“ als Scan-Strecke=5450nm. Aktin=374AS und Tubulin=451AS kreuzen sich dabei in der Spalte Z.38287#_[2654]“53“[72]/#_[1043]“2“[580]/#_[945]“40“[015]. „Aktin“ aufsteigend als „3“_QS5_2_0=“7_4“ für Aktin=374AS [Aktin – Wikipedia]. „Tubulin“ zieht schleifenförmig durch Aktin, und zwar absteigend als „4“_3+2=“5“_aufsteigend in Spalte 2/0 als QS0+0+1=“1“ für Tubulin=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt].
Die Schwanzregion nach der PEST-Stelle enthält die Exons „AF“ (6 Exons A bis F, durchschnittlich 8 in Genen). Zwischen den Exons liegende Introns werden bei einer reifen mRNA herausgeschnitten. Die Abgrenzung Exon/Intron ist ungenau, so dass mehrere Proteine möglich sind; Introns fehlen bei Pflanzen). Das hirnspezifische Exon B für Myo5A enthält nur 3 Aminosäuren (DDK) und ist für die Bindung der leichten Kette „DYNLL2“ für den zytoplasmatischen Dynein-1-Komplex essentiell [Myosin V from head to tail - PMC (nih.gov)]. Das „EXON B [DDK]“=70_70_80 mit doppelt Asparaginsäure (D/Asp)=C4H7NO4=24+7+7+32=70E und Lysin (K/Lys)=C6H14N2O2=36+14+14+16=80E liegt mit lesbaren Enden 70/80 in der Randspalte Z.38285#_“1“70“[0]/#_ „8“(406)/#_“5“(37)[2]/#_“2“[5]“80“, so dass seitlich eine vierzeilige Spalte „1-8_5-2“ mit QS18+52=70 eine Zeilenverbindung herstellt. Die Lücke (5) zwischen der D-Ziffer „2“ und Lys=80E kann dabei nicht geschlossen werden, so dass in der Randspalte zwischen 70/80 zwei Kunstgriffe QS4+0+6=10 für „0“ und QS3+7=10 für „0“ als Verbinder für die Reihenfolge D-D-K notwendig sind. Das Protein (Mensch) „DYNLL2“=89AS verdrängt einen Kunstgriff und klemmt sich in die freie Lücke [5] als QS3+5=8_QS7+2=9 für „DYNLL2“=89AS. „Dynein1“ fungiert als Motor für die intrazelluläre retrograde Motilität von Vesikeln und Organellen entlang von Mikrotubuli“ [DYNLL2 - Dynein light chain 2, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Die Bindung an Tubulin=451AS ist in „DYNLL2“=89AS enthalten. Seitlich am „DYNLL2“=89AS“ wird für Tubulin die Zahl „45“ gelesen, über die Kunstgriffe QS3+7=10 für „0“ und QS2_0+8=10 für „0“ wird die Ziffer „1“ aus der Spalte 8/1 für Tubulin=451AS gewonnen. „Dynein1“ liegt mit 2 schweren Ketten und einem Verbindungsprotein links vom EXON B. Das Protein (Mensch) „Dynein1_cytoplasmic_DYNC1H1“=3668AS liegt weit links, vierzeilig in der Spalte Z.38285#_959/#_[7]42/#_[5]26/#_[3]1(0), und zwar absteigend als QS1_2=“3“_QS4+2=“6“_QS59+9=“68“ mit 3_6_68 für „DYNC1H1“=3668AS [DYNC1H1 - Dynein cytoplasmic 1 heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynein1_ axonemal heavy chain _DNAI1“=4265AS kann an beiden Seiten über eine Ziffer „0“ links an „DYNC1H1“und rechts an „DYNLL2“ einen Kontakt herstellen. Diese lose „0“-Verbindung benötigt dann noch ein Verbindungsprotein. „DNAI1“=4265AS liegt 3-zeilig in der Randspalte Z.38288#10432580/#_94540015/#_78867658, und zwar schleifenförmig über die Spalte „04“3“/“4“[5]“4“ als „4“_QS0+4=4_Spalte „3/4“=QS=7 mit Summe 4+7=11=QS=“2“_QS0+0_65=65 mit 42_65 für „DNAI1“=4265AS [DNAH1 - Dynein axonemal heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Dynein1_ axonemal intermediate_DNAI1“=703AS verbindet lediglich die beiden schweren Ketten in der Randspalte Z.38287#_26545372/#_10432580, und zwar absteigend als QS4+3=7_0_Spalte 2/1=QS=3 mit 70_3 für „intermediate_DNAI1“=703AS. Es verbleibt zum „DYNLL2“ eine Lücke „2“, so dass MYO5a angefordert wird, um die Lücke (2) zu schließen, und zwar in der Randspalte Z.38288#_32580/#_40015 absteigend 1_8_5_QS3+2=5 für MYO5a=1855AS. Diese funktionelle Position ist gegenüber der Entwicklung von MYO5a im Bereich Z.38280 als Dimer nachrangig. „DYNLL2“ dient als Adapter zwischen MYO5a und dem präapoptotischen Protein „Bmf“ sowie dem postsynaptische Gerüstprotein „GKAP“ (Guanylatkinasedomänen-assoziiertes Protein) [Myosin V from head to tail - PMC (nih.gov)]. GKAP=366AS zählt in Spalte „4/3“ die Ziffer „3“ von MYO5a und liegt mit der Ziffer „4“ links neben „DYNLL2“. „GKAP“ absteigend als „3“_QS54+6_4+2=54+12=“66“ mit 3_66 für GKAP=366AS [GKAP1 - G kinase-anchoring protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „BMF“=184AS liegt vor „DYNLL2“ in der Randspalte Z.38285#_“1“[700] /#_“84“[06] als „1_84“ für „BMF“=184AS. MYO5a hat scheinbar keinen Kontakt, aber in BMF=“18“4AS ist die Zahl „18“ für MYO5a=1855AS bereits enthalten. MYO5a kann folglich als Dimer den Zahlenteil „185“_5 als Spalte 1-8-5 alternativ zählen und QS3+2=5 anschießen [BMF - Bcl-2-modifying factor - Homo sapiens (Human) | UniProtKB | UniProt].
Das Aktin-bindende Protein „canoe/AF-6“ wird funktionell auf der Frachtseite für MYO5 erwähnt. „Afadin“ ist ein Aktin-Filament (F-Aktin) und „Rap1“ ist ein kleines „G protein-binding protein“, das vom Gen „MLLT4/AF-6“ kodiert wird. „Afadin/AF-6“ und „Canoe“ sind zentrale regulatorische Elemente in vielen grundlegenden Signalkaskaden in Zellen [Afadin/AF-6 and Canoe: Roles in Cell Adhesion and Beyond - ScienceDirect; K. Mandai u.a., 2013; https://doi.org/10.1016/B978-0-12-394311-8.00019-4]. „Der kugelförmige Schwanz von Myosin V weist ein „DIL-Motiv“ auf, das als potenzielle Membranbindungsstelle identifiziert wurde [55]. Das „DIL“-Motiv findet sich in humanem „AF-6“ [Myosin V im Gehirn: Mutationen führen zu neurologischen Defekten - ScienceDirect; G.Langforf (1998); https://doi.org/10.1016/S0165-0173(98)00020-4]. Das Protein (Mensch) „Afadin“=1824AS muss einerseits Aktin=374AS binden, das im DIL-Motiv enthalten ist [AFDN - Afadin - Homo sapiens (Human) | UniProtKB | UniProt]. Das „DIL-Motiv“ enthält 3 Aminosäuren: Aspartat /Asparaginsäure D/Asp)=C4H7NO4=24+7+7+32=70E; Isoleucin (I(Ile)=C6H13NO2=36+13+7+16=72E (gleich wie Leu, aber stärker drehend); Leucin (L/Leu)=C6H13NO2=36+13+7+16=72E. Das Motiv zieht sich über den Schwanz absteigend mit zu einer Spalte 3/3=Membran am linken Rand. Das DIL-Motiv liegt nochmals am rechten Rand vor, um in Richtung der Motordomäne eine Membran „33“ zu erreichen. Der Raum zwischen Motordomäne und Schwanz ist beidseitig mit dem DIL-Motiv gefüllt, enthält aber eine vertikale Lücke mit der Spulenachse in der Mitte. Die rechtseitige Lücke wird exakt bis auf die Spulenachse vom Komplex Slit1/2 und Robo1/2 gefüllt. Im Prinzip benötigt ein Axon ein spezielles Signal, wenn es im Zentralnervensystem die „Mittellinie“ überschreiten soll. Offensichtlich sind unter der „Mittellinie“ die Bündel von Nervenfasern (Kommissuren) zu verstehen, die quer durch das „Corpus Callosum“ (Balken / Commissura magna) führen, das beide Hirnhälften teilt. Beim Menschen enthält das Corpus Callosum (CC) „250“ Millionen Nervenfasern [Corpus callosum – Wikipedia]. In Z.38284#_[2]“052“72 wird der Nerv „7“ von der Zahl „2“ als 2“7“2 markiert, die für das Corpus Callosum als Verbindung=paarig=“2“ steht. Die Zahl „2“ steht ohnehin oberhalb der Augen zur Verfügung, weil dort kein Sehnerv „2“ liegt. Die Evolution liest die „250 Mio“ nunmehr nach links gezählt als Zahl „250“. Der Faktor 10^6= 1 Mio=“06“ liegt am rechten Rand in Z.38286#_“06“, die über die Spalte „052“(72)/“3“[1700]/“7“84“06“ mit dem Kunstgriff QS3+7=10=Faktor_Symbol „Schwerachse=84=Mittellinie=Corpus Callosum“_Potenz „06“ erreicht wird. Das DIL-Motiv erstreckt sich links neben der Spulenachse 6-zeilig von Z.38284-289. DIL-Motiv: D(Asp)=70E liegt 4-zeilig in der Randspalte Z38284#[1614]“3“[917]/#[1614]“3“4“[95]/[1614]{3}“0“(7)[4]/[1614]{2}“6“(52)/ #1614{22}(31)/#1614{18}[09] und addiert Spalte 3/3=QS3+3=6 Spalte 6/0/4=QS=64 zur Summe „D“=6+64=70E. I(Ile)=72E liegt rechts neben dem Kreis in der Spalte „7[4]/52/31“ als „7“_QS5+2=7_QS3+1=4 mit Summe 7+4=11=QS=2 mit 7_2 für I(Ile)=72E. „L(Leu)“=72E liegt auf der linken Seiten und addiert QS_Spalte 3/2 mit 32_22_18=72E. Das DIL-Motiv ist lückenlos, kann aber nicht als eine Kette durchgezählt werden. „Afadin“=1824AS am „Global tail“ liegt im DIL-Motiv in der Spalte Z.38288#[16142]“2“31“/#[1614]“18“[09] als „18“_“2“_QS3+1=“4“ mit 18_2_4 für „Afadin“=1824AS [AFDN - Afadin - Homo sapiens (Human) | UniProtKB | UniProt].
Die Schwanz-Domäne wird adressiert, wenn Myosin Va als Transportprotein aktiviert wird, um „Pigmentkörner“ in der Zelle zu transportieren. „In Melanozyten und Nervenzellen synergisiert Myosin Va mit F-Aktin, um den Transport von Pigmentkörnchen zu fördern. Die Phosphorylierung des spezifischen Serinrestes Ser1650 in der Schwanzdomäne von Myosin Va durch Calmodulin-abhängige Proteinkinase II (CaMKII) führt zur Freisetzung von Myosin Va aus Pigmentkörnchen“ [New insight into role of myosin motors for activation of RNA polymerases - PubMed (nih.gov): A.Sarshad, u.a.; DOI: 10.1016/B978-0-12-800179-0.00004-0]; [ Myosin V - an overview | ScienceDirect Topics]. Die Phosphorylierung eines Serinrestes mit Serin=C3H7NO3=18+7+7+24=56AS bildet sie letzte Aktion in der Serie „#1614“ in der Randspalte Z.38292#_501/#_6[67] mit Phosphor „1“_QS0+5=“5“ für Phosphor=15E und Serin=56E in der Spalte 5/6=56E. Ein „Pigment“ ist üblich ein Wirkstoff „88“=Extra. Dieser wird in einer Form=7_88_6_7=Form verpackt, wobei die Ziffer „6“=flexibel als Spalte 4/6=64=Kugel=Pigment-Korn (Granula) erzeugt. Die Ziffer „7“ ist Bestandteil vom Protein (Mensch) „Proteinkinase_CaMKII“=478AS in der Randspalte Z.38289#_[5]“4“0“[015]/#_[86]“7“[658]/#_(41)“5“[493]/#_(18)“3“(„5“01)“/#_[171](“6“)[67] als QS 4_0 (Vesikel)=“4“_“7“ (Form)_5 (Teil von MYO5a)_3 mit „47“_Summe 5+3=“8“ für CaMKII=478AS [CAMK2A - Calcium/calmodulin-dependent protein kinase type II subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Startziffer „4“ für CaMKII ist die Endziffer von Aktin=374AS in der 88er-Pigment-Zeilennr. Z.382“88“#_32580/#_40015 als „3“_QS2+5=“7“_QS0+0+4=“4“ für Aktin=374AS. „CaMKII“ wird über die Spalte 2/0=Calcium=20E aktiviert. Der 2. Aktivator ist Calmodulin=149AS in Spalte „4“1“(5)/“1“8“(3) aufsteigend 1_4_QS1+8=9 für CALM1=149AS. In Gegenrichtung ergeben diese Ziffern gleichzeitig das mit der Fracht beladene „MYO5a“, und zwar absteigend als „18“_QS4+1=“5“_“5“ für MYO5a=1855AS. CaMKII=478AS aktiviert das Protein (Mensch) „Transcription factor_ FOXO3“=673AS. „FOXO3“ besetzt die Spalte, weil es die DNA-Sequenz „TAAA“ mit Threonin (T/Thr)= C4H9NO3=24+9+7+24=64E und Alanin (A/Ala)=C3H7NO2=18+7+7+16=48E erkennt. Darin ist T=64E die Pigmentkugel ist als Spalte 4/6=T=64E_als Schleife folgen 3_Spalte 4/5=45 als QS3+45=A=48E_seitlich Spalte 4/8=A=48_das Pigment 88 muss aufgenommen werden, weil die Spalte 8/4(154) für A=48 falsch herum liegt. Für die Drehung oder den Transport in der Kugel folgt der Kreis QS1+5=6_4= für „64“. Phosphor „15“ wird ebenfalls benötigt. FOXO3=673AS liegt in der Randspalte Z.38289#_40015/#_7658 als 67_Spalte 001/765 mit QS0+0+1=“1“_QS6+5=11=QS=“2“ mit „67“_Summe 1+2=3 für FOXO3=673AS [FOXO3 - Forkhead box protein O3 - Homo sapiens (Human) | UniProtKB | UniProt]. CaMKII=478AS phosphorylisiert weiterhin das Protein (Mensch) „Transcription factor_ETS1“=441AS in der Randspalte Z.38289#_[45]“4“00“1“[5]/#_[88]“6“[7658]/#_“3“41“[5493] absteigend als QS3+41=“44“_QS6¬_4+0+0¬=10 für „0“_“1“ mit „44“_Summe 0+1=“1“ für ETS1=441AS [ETS1 - Protein C-ets-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Myosin „MYO5a“=1855AS liegt abschließend nochmals in der Randspalte Z.38291#_[3]“41“5“[493]/#_“81“[8]“350“1“ als Dimer in einer Spiegelung „81“_QS4+1=5_5_QS3+5+1=8_1 vor. RAB27A=221AS liegt links in der Spalte Z.38292#161405“4“4“/#16140“1“2“3“ als Spalte 4/3=QS=7_4=QS=11=QS=2_ Spalte 4/2 mit 2_1 als 2_2_1 für RAB27=221AS [RAB27A - Ras-related protein Rab-27A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Melanophilin (SLAC2A)“=600AS erreicht die letzte Zeile über die Spalte 05/01 mit QS1+5=6_0_0 für Melanophilin=600AS. Die Zink-Bindung liegt als Ligand seitlich links als QS16+14=Zink=30E vor. Für die Katalyse ist Wasser =28 seitlich rechts als „2_QS4+4=8 für „28“ vorhanden. Zugleich ist in der Spalte „4“4“[8]/2“3“3“ die Aktin-Bindung als 3_QS4+3=7_4 für Aktin=374AS vorhanden. GTP=268E seitlich als „2“_QS3+3=“6“ Spalte 8/3 mit „8“ als 2_6_8 für GTP=268E. „Rab effector protein involved in melanosome transport. Serves as link between melanosome-bound RAB27A and the motor protein MYO5A“ [MLPH - Melanophilin - Homo sapiens (Human) | UniProtKB | UniProt]. MYO5A ist mehrfach vorhanden, es weil mehrfach spezialisiert ist._dat08.09.2023
Myosin 5b (MYO5b) ist für den Transport in Enterozyten (Saumzellen) spezialisiert, die die häufigste Zelle im Dünndarm-Epithel sind. Enterozyten sind für die Aufnahme der Nährstoffe aus der Nahrung zuständig. Die Zelle ist 20 µm hoch und zur Oberflächenvergrößerung mit einer apikalen Bürstensaummembran besetzt, die aus 1 μm langen Aktin-reichen Vorsprüngen (Mikrovilli) besteht [Enterozyt – Wikipedia]. Die Spitzen der Mikrovilli werden durch einen intermikrovillaren Adhäsionskomplex (IMAC) verbunden. „IMAC“ besteht aus CDHR2, CDHR5, den Gerüstproteinen USH1C, ANKS4B sowie Myosin 7b (MYO7B). „MYO5b“ ist ein molekularer Motor, der Ionentransporter zur apikalen Membran von Enterozyten transportiert. „MYO5B“ ist für Lokalisierung von IMAC-Proteinen zuständig [Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border - PubMed (nih.gov); S.Dooley, u.a. Nov.2022; DOI: 10.1152/ajpgi.00212.2022]. Die funktionelle Position von MYO5b=1848AS (Dimer) kann sich an den Mikrovilli orientieren. Optimal ist die Zeile Z.38282#16“1“44“76104“1331“8, die eine Vielzahl von Mikrovilli „1“ mit der Gruppe „44“ als 1_44 sowie mit der Membran „1_33_1“ kombiniert. Die Mikrovilli bestehen aus Aktin-Filamenten und werden mit dem Aktin=374AS in Bezug auf die Membran „33“ als EXTRA=8 markiert, und zwar in der Randspalte Z.38281#_EXTRA=(8)“47“(8)[26]/#_41“3“[318] absteigend als 3_7_4 für Aktin=374AS. Soweit der Dünndarm gegenüber dem Dickdarm nicht abweichend codiert wird, ist der Darm im Code mit „808“ fixiert, der sich 2-zeilig aus „8“_Spalte 2/1=QS=3_Spalte 7/0=QS=7_“8“ mit „8“_QS3+7=10 für „0“_“8“ für Darm=“808“ ergibt. Die Mikrovilli-Länge=1µm ist in der Spalte Z.38282#_“1“0“(4)/#_[9]“3“[1] mit der Ziffer „1“ und der Spalte 0/3 als Faktor 10^3 für 1000nm enthalten, und zwar mit QS4+0+3=7=Form. Die Schichtdicke=20µm schließt sich als Spalte 1/19=QS=20µm an, wobei der 10^3 als Faktor zugleich gültig ist.
Das Protein (Mensch) „Myosin 7b (MYO7B)“=2116AS läuft innerhalb der Mikrovilli auf den Aktin-Filamenten, und zwar in der Randspalte Z.38282#_[4]“1“3“3“[18]/#_“1“9“[9139]/#_“2“[05272] absteigend als „2“_“1“_QS9_1+3+3=“16“ für „MYO7B“=2116AS [MYO7B - Unconventional myosin-VIIb - Homo sapiens (Human) | UniProtKB | UniProt]. CHHR2=1310AS legt sich rechts an, und zwar aufsteigend als „1_3“_Spalte 3/1 mit QS1+9=10 mit 13_10 für CHHR2=1310AS [CDHR2 - Cadherin-related family member 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Es folgt CHHR5=845AS in der Randspalte Z.38283#_[91]“3“9“/#_“5“2“72“/#_“1“7“[00] als QS3+9=12_72=84 mit Summe 12+72=“84“_Kunstgriff 2_7+1=10 für „0“_5 mit „84“_Summe 0+5=“5“ für „CHHR5“=845AS [CDHR5 - Cadherin-related family member 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Spalte Z.38280#_44…1331/#_44…31_99=seitlich_13 enthält „Gruppe_Membran“ als Dopplung und die Mikrovilli „1“ an der Membran „33“ gespiegelt, so dass sich der Zwischenraum zwischen den Mikrovilli sich nach links entwickeln kann. Hier breitet sich zunächst das Motorprotein MYO5b=1848AS (Dimer) aus. Das Dimer ist über die gemeinsame Ziffer „1“ gekoppelt, wobei sich nur eine der beiden Domänen mit anderen Proteinen überlagert [Funktional MYO5b/ Non-funktional MYO5b]. „MYO5b“ ist ein Zubringer der Ionen-Transporter und wandert nicht selbst in die Mikrovilli hinein. Das Darmepithel nimmt Nährstoffe und Wasser über eine apikale Membran aus hochorganisierten Mikrovilli auf. Bei Verlust an „Myosin 5b“ ist der Bürstensaum unorganisiert, weil die IMAC-Proteine die distalen Spitzen der Mikrovilli nicht mehr erreichen können. Das Wasser (H2O)=28 und die Nährstoffe Extra=8 werden über die Zeilennummer als Serie Z.[3]“8“28“x abtransportiert und im Code als Extra=QS#1+6+1=8=Nahrung_Codespalte [4]“47“/“4“4“[3] als QS4+7=2_QS4+4=“8“ für Wasser=28 aufgenommen. Als Zubringer ist „MYO5b“ zusätzlich in der Z.Nr.„Z.[38]“2“81/Z.[38]“2“8“[2]“ mit 18_QS2_2=4_8 für 1848AS codiert. Im Code sind beide Motordomänen über die gemeinsame Zahl „48“ verbunden, die neben von MYO7B)=2116AS liegt. Die Domäne „Non-funktional-MYO5b“ liegt in der Spalte Z.38281#[16145]“18“27“8“/#[144761]“0“4“ als QS1+8=9_QS2+7=9 mit Summe 9+9=“18“_Spalte 7/0 mit QS0+4=“4“_Spalte 8/4 mit „8“ für 18_4_8 für MYO5b=1848AS. Die Domäne „Funktional-MYO5b“ folgt in der Spalte Z.38282#[16]“1“4“4“7“6“1“[04]/#[16144]“3“3“9“31“/#[16143917]“6“2“ als „1“_QS4+4=“8“_Kunstgriff-Schleife QS7+3=10 für „0“_ Spalte 6/3=QS=9_1=10 für „0“_ QS9+31=40_QS6+2=8 mit „18“_Summe 0+0+40+8=“48“ als 18_48 für MYO5b=1848AS [MYO5B - Unconventional myosin-Vb - Homo sapiens (Human) | UniProtKB | UniProt]. Die „6“ Calmodulin-Ketten je Domäne werden in kompakter Form als Summe= 12 Ketten Calm-1=149AS mit 12*149AS=1788AS in den Funktionsbereich überführt. Über Kunstgriffe werden beide Domänen gekoppelt und dann zur rechten Randspalte gelenkt, und zwar in Z.38281#_47826/#_13318/#_99139 absteigend in der Randspalte 8/9=QS=“17“_QS6+82=88_1. Kunstgriff Spalte 7/3=10 für „0“_ 2. Kunstgriff als Kopplung 99_1=100 für „0“ mit „17“_Summe 88+0+0=“88“ als 17_88 für 12-fach CALM-1=1788AS. ATP=260E wird als Spalte durch beide Motordomänen gezählt, und zwar absteigend als „2_6“_QS3_0_7=10 für „0“ mit 2_6_0 für ATP=260E, wobei eine anliegende Ziffer „2“=paarig in 8_“2“_Form=7_8 vorhanden ist. Aktin=374AS ist doppelt erkennbar. Das Gerüstprotein (Mensch) „Harmonin_USH1C“=552AS kann MYO5b am linken Rand aufsteigend in der Randspalte Z.38283#[16]“14“43/#[16]“14“[39]/#[161]“434“ folgen, um eine Lücke zwischen den Mikrovilli zu reißen, und zwar als QS1+4=“5“_QS1+4=“5“_QS4+3+4=11=QS=“2“ mit 5_5_2 für 552AS [USH1C - Harmonin - Homo sapiens (Human) | UniProtKB | UniProt]. Die Lücke „3917“ zum MYO5b ist auch als Spalte 39/17 vorhanden und ergibt QS3+9+1+7=Calcium=20E. Das Gerüstprotein (Mensch) „Ankyrin_ ANKS4B“=417AS liegt in der Spalte Z.38285#_[434]“9“5“9“4“3“/#_[430]“7“4“2“[87]/#_[426]“5“[2654] und begrenzt die Lücke als Schleife über Spalte 9/7/5=QS=21_ Spalte 5/4=QS=9_ Spalte 9/2=QS=11_QS4+3=“7“ mit Summe 21+9+11=“41“_7 für Ankyrin=417AS. Weshalb Calcium? „Darüber hinaus wird erwartet, dass Myosin-5B durch „Calcium“ durch die 6 Calmoduline, die an seine Halsdomäne gebunden sind, reguliert wird“[Untersuchung der Myosin-5B-Mechanosensitivität und der Kalziumregulation auf Einzelmolekülebene - PMC (nih.gov); L.Gardini u.a. (2018); doi: 10.1038/s41467-018-05251-z].
MYO5b ist zuständig, wenn etwas zur Ziffer „1“ in Form eines Stäbchens „1“ passend ist. Außer den Mikrovilli sind auch die Dornen von Dendriten (dendritic spines) in den Nervenzellen von Interesse [Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity - PubMed (nih.gov); Z.Wang u.a. (2008); doi: 10.1016/j.cell.2008.09.057]. MYO5b transportiert AMPA-Rezeptoren (AMPAR/α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor) in die Dornen (dendritic spines). Weiterhin muss das Recycling des Rezeptors organisiert werden. Mit „AMPA (α-Amino-3-hydroxy-5-methylisoxazol-4-propionsäure)“= C7H10N2O4=42+10+14+32=98E kann der Rezeptor im Labor künstlich aktiviert werden [AMPA-Rezeptor – Wikipedia]. „AMPA“ besetzt im Proteinkomplex eine Lücke (94) und kann sich absteigend nach links in MYO5b mit 94_QS0+3+1=4 als Summe „98“=AMPA oder nach rechts in den AMPA-Rezeptor als 94_QS0+4 als Summe „98“=AMPA hinein zählen. Es wird ein neuer Zeilenbereich abgegrenzt, der vom Glutamat 4-fach lesbar umschlossen ist. Um den Bereich zu füllen, bestehen AMPA-Rezeptoren aus 4 Untereinheiten mit jeweils 3 Transmembrandomänen pro Untereinheit. Der AMPA-Rezeptor bildet im Gehirn einen Ionenkanal für Kationen, der durch Bindung an Glutamat kurzzeitig geöffnet wird, so dass ein Aktionspotential entsteht. Der Rezeptor wird durch CACNG-4, -7 und -8 reaktiviert. Glutamate entstehen aus der Glutaminsäure (E/Glu)=C5H9NO4=30+9+7+32=78E. Die Zahl „Glu=78“ ist in Z.38286 und Z.38290 sowie in der Z.Nr.-Randspalte Z...[8]“7“/Z...[8]“8“ enthalten, die in der Code-Randspalte „7“[2]/“8“[0] nochmals Glu=78E enthält. „MYO5b“ wird als Dimer in den Zeilen Z.38282-285 entwickelt, wird aber funktionell im AMPA-Bereich speziell nochmals neu codiert. „MYO5b“ liegt 4-zeilig in der Randspalte Z.38287#_[30](7428)/#_“2“6“(52)/#_“2“2“(31)/#_“18“[09] absteigend als 18_QS2+2=4_QS2+6=8 für MYO5b=1848AS. Seitlich als Dimer nochmals „1“_Spalte 5/3=QS=“8“_QS4+7=11=QS2_2 mit 18_QS2+2=4_8 für MYO5b=1848AS [MYO5B - Unconventional myosin-Vb - Homo sapiens (Human) | UniProtKB | UniProt]. Die Lern- und Gedächtnisprozesse hängen von AMPAR-Recycling ab, um die Anzahl der AMPA-Rezeptoren (AMPARs) in den Synapsen zu erhöhen. AMPA-Rezeptoren (AMPARs) sind ionotrope „Glutamatrezeptoren“, die aus hetero-tetrameren Anordnungen der Untereinheiten „GluA1–4“ bestehen [Mechanismen der AMPA-Rezeptor-Endosomensortierung - PMC (nih.gov) G. Hanley u.a. (2018); doi: 10.3389/fnmol.2018.00440]. Die Glutamatrezeptoren „GRIA1, GRIA3, und GRIA4“ sind für Calcium durchlässig. GRIA2 ist aufgrund des Enzyms Adenosin-Desaminase (ADA1/ADA2) für Calcium undurchlässig, weil in der GluR2-Domäne das Glutamat zu Arginin=C6H14N4O2=36+14+28+16=94E umgewandelt wird [AMPA-Rezeptor - DocCheck Flexikon]. Das Protein (Mensch) „GRIA2_P42262“=883AS liegt in der Spalte Z.38289#_“80“945/#_“38“(788)[6] in 80/38 als „8_QS0_8=“8“_“3“ für 883AS. Seitlich liegt Glu=78E [GRIA2 - Glutamate receptor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIA2_D6RDX5“=124AS zählt Glu=78E als Summe QS38+78+8=124 für GRIA2=124AS [GRIA2 - Glutamate ionotropic receptor AMPA type subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte „94/78“ entsteht eine Konkurrenz von Arginin=94E und Glu=78E im Streit um Calcium. Das Enzym (Mensch) „Adenosin-Desaminase (ADA)=363AS zerlegt sich in „3“_Summe 5+38+ 20 (Calcium)=63, wobei Glu=78E im Anteil 5_“78“ =QS=20 geopfert wird. Arginin=94 wird mit der Ziffer „4“ durchlaufen, und kann aus ADA mit 3+1=“4“ alternativ entstehen oder Arginin wird in der Spalte 4[3]/54 mit QS5+4=9_4 für 94E seitlich neu codiert. „ADA“ liegt in der Spalte Z.38288#_[422]“3“1“0“[43]/#_[41809]“4“[54]/#“4“1“38“7“8“[86] aufsteigend als „3“_QS1+0_4=5_QS7+8=15_38_QS4+1=5 mit „3“_Summe 5+15+38+5=“63“ mit 3_63 für ADA=363AS [ADA - Adenosine deaminase - Homo sapiens (Human) | UniProtKB | UniProt]. ADA2=511AS bestätigt den Weg zur linken Randspalte als QS1+4=“5“_Spalte 1/1 mit „1_1“ für ADA2=511AS [ADA2 - Adenosine deaminase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Doppelt Zink=30 ist mit Orientierung an His=82E und Asp=70E in der Spalte 26/22 mit QS26+2+2=Zink=30 zählbar. Damit öffnet sich eine Lücke zum GRIA2, die für das 2. Zink auszählbar ist, und zwar als QS1_1+8+0+9=19_QS1+3_2+5=11 mit Summe 19+11=Zink=30E. Die beiden Isoformen ADA1/2 regulieren das Verhältnis von Adenosin=C10H13N5O4=140E und Desoxyadenosin=C10H13N5O3=132E [Adenosin-Desaminase - DocCheck Flexikon]. Das Protein (Mensch) „GRIA1_P42261“=906AS liegt in der Spalte Z.38287#_65/#_04 ringförmig als QS5_4=9_0_6 für GRIA1=906AS [GRIA1 - Glutamate receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. GRIA1_C5IJI6=59AS bindet mit der Ziffer „5“ in GRIA1=906AS und legt sich seitlich unter das Glu=78E als 5_QS4+5=9 für 59AS [GRIA1 - Glutamate receptor 1 variant - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIA3_P42263“=894AS liegt in der Spalte Z.38286#_“4“2“87“(84)/#_ [265(4)53] als 87+2=89_4 für GRIA3=894AS [GRIA3 - Glutamate receptor 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIA3_A0A087WYJ6“=824AS liegt in der Spalte „78“4/“4“[53] als QS4+78=82_4 für GRIA3=824AS [GRIA3 - Glutamate receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIA4_P48058“=902AS liegt in der Randspalte Z.38287#_[5(37)2]/#_2[5]“8“[0]/#_“0“0“1“[5] als QS8_0+1=9_0_2 für GRIA4=902AS [GRIA4 - Glutamate receptor 4 - Homo sapiens (Human) | UniProtKB | UniProt]. „GRIA4_G8HBB0“=44AS aufsteigend als QS37_QS2+5=7 mit Summe 37+7=44AS [GRIA4 - AMPA-selective glutamate receptor 4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CACNG8“=425AS reguliert unspezifisch alle AMPA-Rezeptoren. Hierfür wird Calcium in U-Form in der Spalte 2[3]1/809 als QS2_8_0_1_9=Calcium=20E gezählt und eine U-Gegenform in der Spalte 074/6[5]2 zur Ringbildung aufgesetzt, die „6“_QS0+7+4=11=QS=2_2 mit „6“_QS2+2=“4“ für Kreis=64 ergibt. Die Calcium-Ring wird inklusive der Einschluss-Spalte 5/3=QS=8 summiert zu QS20+8+6_[47=QS=11=QS=]2 _2=34+2+2=“38“. In der Z.38288 wird seitlich die Zahl „04“ für 38+0+4=“42“ am Ring angeschlossen. Über die Spalte 5/4/5 kann die Ziffer „5“ je nach Bedarfsrichtung gewählt 42_5 für CACNG8=425AS [CACNG8 - Voltage-dependent calcium channel gamma-8 subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CACNG7“=275AS reguliert GRIA1/GRIA2 in Winkelform als Spalte Z.38288#_2(„23“104“)_1_1 mit QS=4_seitlich wird 4+23=“27“ addiert und QS1+0+4=“5“ als 27_5 für CACNG7“=275AS erzeugt. Das Protein (Mensch) „CACNG4“=327AS reguliert speziell GRIA1/GRIA4 und zieht einen langen Querwinkel durch die Zeile Z.38289#_14180945(4) als QS1+4+1+8+0+9+4+5=32_ seitlich wird die Spalte „3/4“=QS=7 mit 32_7 für „CACNG4“=327AS angefügt [CACNG4 - Voltage-dependent calcium channel gamma-4 subunit - Homo sapiens (Human) | UniProtKB | UniProt].
Myosin 5c (MYO5c) ist am Aktin-basierten Membrantransport in vielen physiologisch wichtigen Geweben beteiligt, besonders häufig in exokrinen sekretorischen Epithel- und Drüsengeweben. Exokrine Drüsen geben ihr Sekret nicht an den Blutkreislauf ab. Der mathematische Zugang zum Gewebe zieht sich über die Hyaluronsäure (HA) [Hyaluronan / hyaluronic acid]=C14H21O11N (Wiederholeinheit)=84+21+88+7=200E vom Auge über die Gewebsmakrophagen zu den Gelenken mit einer Gelenkflüssigkeit. Hyaluronsäure ist Bestandteil des Bindegewebes und im Glaskörper des Auges markant. Für den Vesikeltransport sind die Zellen der Tränendrüsen (LG) [Glandula lacrimalis] der spezielle Zugang zum MYO5c. Die Tränendrüsenzellen (LGAC) regulieren die Sekretion von Proteinen als Tränenfilm. Unter der mit Aktin angereicherten apikalen Plasmamembran sind reife sekretorische Vesikel (mSVs) mit einer Größe von 0,5–1 μm lokalisiert. Die sekretorischen Vesikel (SVs) sind in der GTPase Rab3D sowie in Rab27a und/oder Rab27b angereichert. Die Tränendrüsen reagieren gegenüber Neurotransmittern. Das Ausschleusen von Substanzen (Exozytose) von mSV an der apikalen Plasmamembran kann im Labor künstlich mittels „Carbachol (CCh)“=C6H15ClN2O2=36+15+17+14+16=98E bewirkt werden [Der Myosinmotor der Klasse V, Myosin 5c, lokalisiert in reifen sekretorischen Vesikeln und erleichtert die Exozytose bei Tränenacini - PMC (nih.gov); S. Hamm-Alvarez Apr. 2008; doi: 10.1152/ajpcell.00330.2007]. MYO5c ist ein nicht-prozessiver Motor, d.h. im Unterschied zu MYO5a/b bewegt sich das Molekül zum intrazellulären Transport nicht kontinuierlich entlang von Aktinfilamenten. Für die „prozessive Bewegung“ muss sich der führende Kopf an Aktin schneller wieder anlagern als der hintere Kopf, so dass mindestens einer der beiden Köpfe befestigt bleibt [Kopplung zweier nicht-prozessiver Myosin-5c-Dimere ermöglicht prozessives Stepping entlang von Aktinfilamenten | Wissenschaftliche Berichte (nature.com); H. Weiß u.a., Artikelnummer: 4907 (2014)].
MYO5c wird von der Hyaluronsäure=200E in den Funktionsbereich der Randspalte Z.38284#_205272 /431700 gelockt, und zwar als „2“_Spalte 2/“00“ für HA=200E. Das Maß für den Vesikel-Durchmesser=1µm wurde für die Mikovilli-Länge mit dem Faktor 10^3 für 1000nm bereits in Z.38282 in der Spalte 10/[9]3(19) definiert. Über den Kunstgriff QS1+9=10 für „0“ wird eine Von-Bis-Durchmesser-Spanne D=0,5 bis 1µm aufgezogen, indem die 0,5µm über die Hyaluron-Randspalte Z.38284#_[2]“05“[27]“2“ #_[4]“3“[17]“00“ in Verbindung mit dem Faktor 10^3 als Spalte 05/3[1] in einer Verlängerung beteiligt wird. Die Zählung der Hyaluronsäure (HA) als 2/00=200E setzt sich mit einer Vesikel-„0“(Null) in 4“0“6=Kreis „64“ fort. Der MYO5c-Vesikelbereich zieht sich aus der Hyaluron-Spalte als Spalte mit dem Vesikel „0“ in der Zahl 2“0“ als 5-zeilige Lotrechte unter der Null mit QS 20_Spalte 3/7=37_ QS4_3=7 mit Summe=20+37+7=Kreis=Vesikel=“64“. Diese Vesikel-Falllinie (tropfendes und fließendes Sekret) wird in der Z.38286#_8784060 in der Form=7=Nerv=Neurotransmitter markiert als EXTRA(Drüse)=(2)8_7_8(4)[06]. Links ist das Tränenwasser=28 und rechts die Schwerachse=84 enthalten. Wird nach HA=200E in der Vesikel-„0“Null über die Schwerachse in die Vesikel-Falllinie eingefahren, ergibt sich QS0+84+7_4_3=Carbachol (CCh)=98E(Neuotransmitter) zur Ausschüttung der Tränenflüssigkeit über die Falllinie. MYO5c=1742AS wird passend angelockt, in dem die Zahl „42 (doppelt)“ und die Zahl „17“ einen Bereich avisieren. Die beiden Domänen passen sich dann Rücken an Rücken ein. Die Zahl „17“ ist verwendbar, weil eine Domäne gespiegelt rückwärts zählbar ist bzw. wird die „17“ als Blockzahl gelesen. Die erste Zahl „42“ wird auf beide Domänen 4-2 verteilt. 1.Zählung: MYO5c in der Spalte Z.38285#_“943“17“0“[0]/#_“2“[878406]/#_“6“[545372] als 0+17(Block)_QS9+4+3=16_Spalte 2/6 als 26 mit 17_Summe 16+26=“42“ für MYO5c=1742E. Eine Rand-Null wird mitgezählt, weil die 2. Rand-Null zum ATP=260AS als Ligand gehört. Die Ziffer „3“ grenzt in der Vesikel-Falllinie eine Spalte 3/7/4=Aktin=374AS zur Aktin-Bindung ab. 2. Zählung: MYO5c beginnt in der Spalte Z.38285#[1614307]“4“(2)/#[161]“42“6“5“2“(6) mit der gespaltenen Zahl „4“[2] und endet mit der lesbaren „42“ als QS4_6+5+2=“17“_“42“ für MYO5c=1742AS [MYO5C - Unconventional myosin-Vc - Homo sapiens (Human) | UniProtKB | UniProt]. In der 1. Zählung ist die Spalte 2/6 der Ansatz für die ATP-Spalte 2/6/0=260 als Ligand für die 2. Zählung. Aktin liegt ebenfalls als Spalte vor, absteigend als 3_QS5+2=7_4 für Aktin=374AS. Die angehängten Ketten aus Calmodulin=149AS werden 6-fach je Domäne und doppelt für beide als 12*149AS=CALM1-Kettensumme=1788AS gezählt, und zwar in der Spalte Z.38285#_[5943]“1“7“[00]/#_(4)“2“8“7“8“406 und halbseitig an die gespaltene Zahl 4-2 angehängt als QS2+8_7=“17“_“8“_QS1+7=“8“ mit 17_88 für „12-fach Calm1“=1788AS. Das Protein (Mensch) „GTPase Rab3D_ O95716“=219AS beginnt mit der Ziffer „5“ aus der GTP-Spalte „65/23“ mit GTP als 2_QS65+3=68 für GTP=268E. Anschließend wird Wasser (Tränen)=“28“ abgeholt und dann an die Vesikel-Falllinie verfrachtet. „RAB3D“ liegt in der Spalte Z.38286#[1614307]“4“2“8“[7]/#[161426]“5“2“[6]“5“4“ als QS5+2_4+2+8=21_QS5+4=9 für „RAB3D“=219AS.
MYO5c und Rab-Proteine sind in der Bauchspeicheldrüse in der sekretorischen Granula von Azinuszellen zu finden, die Proteine für das Drüsensekret bilden. Transmembranproteine (Claudinen / Occludin) umgeben die Zelle gürtelartig mittels „Tight Junctions“ zu einer dichten Diffusionsbarriere. Wie findet MYO5c den Hyaluron-Bereich? Geeignet ist das Protein (Mensch) „Claudin 14“=239AS, weil es bei einer Vielzahl von Claudinen in der Bauchspeicheldrüse verfügbar ist. Claudin 14 „glaubt“, dass die enge. 6-zeilige BiXnom-Vesikel-Falllinie eine „Tight Junktion“ sei und zählt sich durch, und zwar als 2_QS0_3=3_QS7_4=11=QS=2_3_7 mit „23“_Summe 2+3+4=“9“ für Claudin 14=239AS [CLDN14 - Claudin-14 - Homo sapiens (Human) | UniProtKB | UniProt]. „Claudin 14“ wird auch im Innenohr, Leber und Niere exprimiert. Der Vesikel-Falllinie von Z.38284 bis Z.38289 wird der Außenseite ab Z.38280 zwecks Spaltenverlängerung das Protein (Mensch) „Occludin“=522AS vorgelagert. „Occludin“ wagt es nicht, die Reduzierung „Zahl 47=QS=11=QS=2“ zu bilden, weil die Ziffer „4“ zur Schwerachse „84“ für die Vertikale der „Tight Junction“ gehört. „Occludin“ weicht seitlich im Bogen aus und findet Anschluss an „Claudin 14“. „Occludin“ als 5_QS0+2_7_3=12_Anschlußspalte 1/9=QS=10 mit „5“_Summe 12+10=“22“ für Occludin=522AS [OCLN - Occludin - Homo sapiens (Human) | UniProtKB | UniProt]. Den äußeren Abschluss bilden JAM-Proteine (Junctional Adhesion Molecule) [Tight Junction - DocCheck Flexikon]. In der Achse ist in Z.38275#_37“082“760 das hydrophobe Merkmal „082“ als Negation von Wasser=28 lesbar. „In einem hydrophoben Spalt ist Leucin=C6H13NO2=36+13+7+16=72E real vorhanden. Im Spalt („3“)_Form=“7“_“082“_Form=“7“_[6=flexibel] liegt das Leucin als 37_QS0+8+27=35 mit Summe 37+35=Leucin=72E vor. „Jams“ besitzen als Merkmal ein Motiv „Arg-Val-Glu“ [Junctional adhesion molecule - Wikipedia]. In Z.38277#_“78“94“ berühren sich fälschlich die Motiv-Enden „Arg“ und „Glu“, so dass Valin indirekt als Verbinder alles neu sortiert. In den 4 restlichen Zeilen zieht Valin (Val)= C5H11NO2=30+11+7+16=64E als Verbinder über 4 Zeilen. Parallel liegen „Arginin“=C6H14N4O2=36+14+28+16=94E und Glutaminsäure (E/Glu)=C5H9NO4=30+9+7+32=78E mit jeweils 2 Zeilen, und zwar in der Randspalte Z.38276#_“325“{9}[13]/#_“78“[9]{4}[99]/#_“47“(35)[00]/#_“37“(7)[900]. 1.) Valin (Val) als QS3+2+5=10_QS7+8=15_QS4+7=11=QS=2_37 mit Summe 10+15+2+37=Valin=64E. 2. ) Arginin (Arg) als Spalte 9/4=Arginin=94E. 3.) Glutaminsäure (Glu) absteigend als 7_QS3+5=8 mit 7_8 für Glu=78E. An „Tight Junctions“ sind „JAM-1“ und speziell „JAM-3“ lokalisiert, die jeweils 2 Zeilen in der Spalte besetzen. Das Protein (Mensch) „JAM-1_ Q9Y624“=299AS liegt in der Randspalte Z.38276#_[8325]“91“[3]#_“97“8“94“9“[9] als QS91_9=100_QS97+8+94=199 mit Summe 100+199=JAM1=299AS [F11R - Junctional adhesion molecule A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „JAM-3“=310AS liegt in der Randspalte Z.38278#_[4735[00]/#_ 3[77900] absteigend als „3“_QS4+7=11=QS=2_3+5 mit „3“_Summe 2+3+5=“10“ mit 3_10 für JAM-3“=310AS [JAM3 - Junctional adhesion molecule C - Homo sapiens (Human) | UniProtKB | UniProt]. Fazit: Für MYO5c besteht der Zugang zu den Epithelzellen über deren Zellkontakte, die als „Tight Junction (Zonula occludens)“ bezeichnet werden und als Spalte visualisiert ist._dat11.09.2023
Vesikel (vesicula / Bläschen / vesicle): Vesikel benötigen für einen Platz im Zeilenlauf ein geometrisches Symbol. Für die sekretorischen Vesikel (mSV) ist die Durchmesser-Spanne 0,5-1 µm die Basis für Vesikel-Motorproteine MYO5. Für die Vesikel-Oberfläche ist der Vesikel-Kontakt „OO“ maßgeblich und für die Apoptose wird der Zelltod über einen Trichter organisiert, der den großen Vesikel-Durchmesser bis 5 µm ermöglicht. Für sehr kleine Vesikel werden Nanometer (nm) direkt abgelesen. In der Serie #1614, die eine Krümmung=64 mit der Zählgröße 11 kombiniert, wird außer ER und Golgi-Apparat auch der Vesikeltransport codiert. Von den Vesikelproteinen, die sich auf der Membran von Transportvesikeln befinden, wird die Gruppe der „Syntaxine“ betrachtet, die eine Fusion von Vesikeln ermöglichen. Hierzu gehören die SNARE-Proteine [soluble N-ethylmaleimide-sensitive-factor attachment receptor]. Aufgrund der Membran-Fusion bauen sich die SNARE-Proteine zwischen den Vesikel-Kontakt-Symbolen, Spalte „0/0“ und Zeile „00“, auf. Die Evolution wird genötigt, in den Kontakt-Nullen an beiden Enden einen gespiegelten Vesikel-Null-Kreis zu erkennen, und zwar als „4“0“6“ und „4“00_QS1+6=“6“. In der Spalte Z.38286#_[28]“78“[406]/#_[654]“(5)[3)“7“2/#_[043]“(2)(5]“8“[0]/#_“45“(4)(0)(0)“[15] mit der Randspalte „[7]2/80“ Wasser=28 als „2“_QS0+8=“8“ für H2O=28 vorhanden. In dieser Randlage handelt es sich wegen der lieblosen „Ausschüttung“ um eine hydrophobe Eigenschaft. Die Spalte ergibt QS7+8+1=“16“ für 16 hydrophobe Aminosäure-Schichten im Kern der SNARE-Proteine. Der Kern enthält als Besonderheit ein Motiv „QQQR“ aus 3-fach Glutamin (Q/Gln)=C5H10N2O3=30+10+14+24=78E und Arginin (R/Arg)= C6H14N4O2=36+14+28+16=94E. Das Motiv zieht sich durch die Randspalte, und zwar lesbar 1. Glutamin (Q/Gln)=78E_ 2. Q/Gln gespiegelt als QS5+3=8_7 für 78E_3. Q/Gln als QS2+5=7_8 für 78E_Arginin (R/Arg) als QS4+5=“9“_QS4+0+0=“4“ für Arg=94E. Weil die 4 AS jeweils aus 2 Ziffern bestehen, kann die 4-zeilige Kette zweckmäßig nur von 3 SNARE-Proteinen als Komplex seitlich begleitet werden, wobei real bis 5 Proteine möglich sind. Das SNARE-Protein (Mensch) „Syntaxin-3“=289AS ist das einzige Protein dieser Gruppe mit einer Schnittstelle für die Interaktion mit Enzymen. Das Molekül trennt sich in einen intrazellulären, helikalen Teil und einen transmembranen Teil [Syntaxin - DocCheck Flexikon]. „Syntaxin-3“ liegt direkt in einer QQQR-Motiv-Spalte als 2_QS5+3=8_QS5_0+0+4=9 mit 2_8_9 für „Syntaxin-3“=289AS [STX3 - Syntaxin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Es wird ein 3er-Proteinkomplex ausgewählt, der aus t-SNARE, V-SNARE und einem SNARE t-v-Verbinder besteht. Der 3er-Komplex legt sich links mit 1 Protein an das Motiv an. Protein für die Vesikeloberfläche (v-SNARE=vesicle synaptosome-associated protein receptor) und Protein für das für das Ziel-Organell (t-SNARE=target synaptosome-associated protein receptor) [SNARE (Protein) – Wikipedia]. Links am Motiv liegt die Spalte Z.38286#_[3]“0“7“4“(28)[784]/#_[2]“6“{5}“[2](65)[453]/#_[22]{3}{1}(0)(4)(3)[25]/#_18{0}{9}[45400]. Protein (Mensch) „SNAP25_t-SNARE“=206AS in der Spalte „0“74“/“6“(5)[2] als QS7+4=11=QS=2_0_6 für „SNAP25“=206AS [SNAP25 - Synaptosomal-associated protein 25 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „VTI1A_v/t-Wechselwirkung“=217AS in der Spalte 28(7)/65[4]/043 als QS2+8_6+5_0=“21“_QS4+3=“7“ mit 21_7 für VTI1A_=217AS [VTI1A - Vesicle transport through interaction with t-SNAREs homolog 1A - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „YKT6 _v-SNARE“=198AS in der Spalte 5[2]/31/09 als Schleife 1_9_QS0+3+5=8 mit 19_8 für „YKT6“=198AS [YKT6 - Synaptobrevin homolog YKT6 - Homo sapiens (Human) | UniProtKB | UniProt].
Real liegt VTI1A_=217AS mit VAMP7=220AS im Komplex, das SNAP25 ersetzen kann in der Spalte Z.38287#_„0“74“/[6](5)“2“ als 2_QS7+4=11=QS=2_0 mit 22_0 für „VAMP7“=220AS [https://www.uniprot.org/uniprotkb/P51809/entry]. Andererseits liegt real SNAP25=206AS im Komplex mit VAMP2=116AS. Hierfür ist ein Ringtausch notwendig VAMP2 zählt sich aus dem Bereich SNAP25 mit QS7+4=11_Spalte 0/6=QS=6 mit 11_6 und SNAP25 ersatzweise aus dem Bereich „VTI1A“ mit QS4_3+4=11=QS=2_0_6 für SNAP25=206AS. Das 3. Protein in diesem Komplex ist das Protein (Mensch) „Syntaxin-1A_STX1A“=288AS in der Spalte (6)“5“2“/[2]“3“[1]/“8“0“[9] ersatzweise für „YKT6“ als „2“_QS5+3+0=“8“_“8“ mit 28_8 für „STX1A“=288AS.
Das Neurotoxin „Botulinumtoxin_Typ A (Botox)_botA“=1296AS mit Cofaktor „Zink=30E“ wird aus der Bakterie „Clostridium botulinum“ gewonnen. Es wirkt tödlich, weil es SNAP25 spaltet, wodurch die Synapsen blockiert und die Freisetzung von Neurotransmittern (Acetylcholin) gehemmt werden. Muskellähmungen sind die Folge. Das Neurotoxin wird zur Therapie medizinisch verwendet. „SNAP25“ in der Spalte Z.38287#_6[5]4/043 als QS4_3+4=11=QS=2_0_6 für SNAP25=206AS wird vom Cofaktor Zink=30E über die Ziffer „6“ blockiert, und zwar mit Zink in der Spalte Z.38286#_4[2]/2“6“ als 26+4=Zink=30. „botA“= 1296AS nimmt die Ziffer „6“ zur Zink-Bindung auf, und zwar in der Spalte Z.38287#_(2)“6“5“4“/[104]“3“/[94]“5“4“ absteigend als QS5+4_3=12_QS4+5=9_6 mit 129_6 für „botA“=1296AS. Funktionell ist es beeindruckender ist es, wenn die Endziffer „5“ nicht nach links, sondern alternativ an den rechten Rand neben den zu blockierenden Neurotransmitter über QS 0+Spalte 5/0=“5“ gezählt wird [botA - Botulinum neurotoxin type A - Clostridium botulinum | UniProtKB | UniProt]. Die Neurotransmitter werden in synaptischen Vesikeln gesammelt und von SNARE-Proteinen kontrolliert freigesetzt. Der Neurotransmitter „Acetylcholin“=C7H16NO2=42+16+7+16=81E liegt zur Freisetzung in der Randspalte Z.38288#_“8“{0}/#_“1“{5} als 8/1 für „Acetylcholin“=81E [Acetylcholin – Wikipedia].
Apoptose: Beim Zellen-Selbstmord werden Zellen im Gegensatz zur „Nekrose“ auf nicht-entzündliche Weise eliminiert und über den extrinsischen (TYP I Apoptose / von außen angeregt) oder den intrinsischen (TYP II Apoptose, innewohnende Gründe) apoptotischen Weg reguliert. Die Apoptose ist eine Form des programmierten Zelltods (PCD). Er wird auch als "active cell death" (ACD) bezeichnet [Apoptose - DocCheck Flexikon]. Ein äußeres Apoptose-Signal tritt über die Plasmamembran in Zeile Z.38270#161498“2“341“74“096 ein. In dieser 1. Zeile im Bereich #1614 erkennt die Evolution die Besonderheit einer Spanne von „2“ bis 74=QS=11=QS=“2“. Die Proteine werden nunmehr so zugeschnitten, dass die äußere Signalisierung links in der Zahl „2“ eintritt und rechts die Zahl „74“=QS=“2“ in einer Vorstufe markiert. Die Apoptose kann sich nunmehr so vollziehen, dass sich beispielweise, die inaktive Form des Proteins (Mensch) „Caspase 3“=277AS in die Spanne „2-2“ legt, als 2_QS3+4=7_Schleife über Spalte 174/31[4] mit QS1_3_1=5_QS7+4=11=QS=2 mit 27_Summe 5+2=7 für „Caspase 3“=277AS [CASP3 - Caspase-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die aktivierte Form von Caspase-3 bildet sich als Spiegelung „772“, wobei mit der Zahl „47“=QS=2 gestartet wird, um mit 3 Kunstgriffen 10 für „0“ die Zählung mit der Ziffer „7“ effektiv erst im BiXnom-Apoptose-Trichter zu beginnen. Der Trichter beginnt später, weil er auch den Lysosomen dient, die nicht außen an der Zellmembran liegen.
Caspase-3 mit Spalte 74„0“[96]/14“8“24/76072/57822 über „1. Kunstgriff“ mit QS7+4=11=QS=“2“_ mit Spalte 0/8 als Summe 2+0+8=10 für „0“_ 2. Kunstgriff QS2+4_2_2=10 für „0“_ 3. Kunstgriff QS8+2=10 für „0“_Ziffer „7“_QS2+5=“7“_ weiter über Spaltachse „(2)-0-0-3-7-(47)“ mit 4. Kunstgriff QS0_0_3_7=10 für „0“_Ziffer „2“ gewonnen aus QS4+7=11=QS=“2“ als Caspase-3 mit QS0+0+0+7=“7“_“7“_QS0+2=“2“ für „772“ gespiegelt für Caspase-3=277AS [CASP3 - Caspase-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die vertikale Spaltachse liegt somit erst in der Zeile Z.38278#161464481“47“3500 mit QS4+7=11=QS=“2“. Über die Trichterachse werden Proteine wie PARP, SREBP. FANCD, Myosin gespalten. Für eine Apoptose aus interzellulären Gründen (ohne äußeres Signal) endet der Prozess beim Protein (Mensch) „Caspase-9“=416AS. Bei der Bindung an „Apaf-1“ wird Caspase-9 aktiviert, um die Caspase-3 zu spalten, die dann die Apoptose ausführt. Der BiXnom-Apoptose-Trichter wird somit auch bei der Typ II Apoptose benötigt. Caspare-3 liegt inaktiv in Z.38270 setzt sich mit einer Verlängerung aus 3 Kunstgriffen fort und zählt das aktive Caspare-3 gespiegelt im Trichter. Casp9 bindet am Ende des inaktiven Casp3 und schneidet zur Aktivierung in dessen Kunstgriffe. „Casp9“ legt eine Schleife, die in Z.38273 mit der Ziffer „2“ in der Trichterachse beginnt, die bis zur Anfangszeile Z.38270 vertikal verlängert wird in der Spalte Z.28270#_[4]“1“74“0“[96]/#_[4]“3“[14]“8“2“4“/#_[4]“6“[7607]“2“/#[5]“2“[57822]. „Casp9“=416AS als „2“_Kunstgriff absteigend vertikal QS3_6_1=10 für „0“_“47“=QS=11=QS=“2“ mit Summe=2+0+2=“4“_QS8+2_Randspalte 4/2 mit 4_Summe=8+2+4+2=16 als 4_16 für Casp9=416AS [CASP9 - Caspase-9 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Schleifenform des Moleküls resultiert aus seiner typischen Kette mit einer AS-Folge „Leu-Gly-His-Asp-|-Xaa“ [72-40-82-70]“, und zwar mit Leucin (L/Leu)=C6H13NO2=36+13+7+16=72E; Glycin (G/Gly)=C2H5NO2=12+5+7+16=40E; Hisdidin (H/His)=C6H9N3O2=36+9+21+16=82E; Asparaginsäure (D/Asp)=C4H7NO4=24+7+7+32=70E. Leucin=72E mit Ziffer „2“ gespiegelt in Spaltachse als „2“_QS3_6_1=10 für „0“ mit QS2+0=“2“_“7“ für Leucin=72E_lesbar Glycin=40E_lesbar Hisdidin=82E_in Zählrichtung aus „07“ lesbar Asp=70E. „Casp9“ und sein Aktivator „APAF1“ bilden gestapelt die Mitte der Füllöffnung des Apoptose-Trichter 5“2“5/“606“ in der Spalte Z.38273#_5“2“57822/#_“606“0057. Das Protein (Mensch) “Apoptotic protease-activating factor 1_ APAF1“=1248AS summiert das Zentrum und dann aufwändig die Vorzeilen in der Spalte Z.38272#_[46760]“7“2“/#_“5“25“7“82“2“/#_“606“0057. Aus dem Mitochondrium wird „Cytochrom c“ ins Cytosol freigesetzt und dadurch „APAF1“ gebildet. In der Folge lagern sich dann aber 6 APAF1-Moleküle sternförmig zu einem „Apoptosom“ zusammen. Folglich gibt es weitere sekundäre alternative Zählungen. Maßgeblich ist „APAF1“ als QS6+0+6=“12“_QS5+25+7=37_Kunstgriff 8+2=10 für „0“_Randspalte „72/2“ mit QS2+2+7=11 mit „12“_Summe 37+0+11=“48“ mit 12_48 für „APAF1“=1248AS, wobei die Zwischengröße „37“ neben der Endzahl eine Bedeutung für Sekundärzählungen gewinnt, weil die Zählgröße „11“ eine Aktion ausgelöst. „APAF1“ benötigt ATP=260E über Spalte 2/0 mit QS2_0=“2“_“60“ für ATP=260E. Weil die Ziffer „2“ die Startziffer für Casp9 ist, wird es automatisch aktiviert. „ATP“=260E codiert Eisen=26E, das an das Elektronenübertragungsprotein (Mensch) “Cytochrome c_ P99999_CYC“=105AS bindet, das APAF1 reguliert. CYC=105AS liegt in der Spalte 82/05 als QS2+8=“10“_QS0+5=“5“ mit 10_5 für CYC=105AS. Der Ligand (Cofaktor) Häm=Hämb=Fe-Protoporphyrin IX=C34H34FeN4O4=204+34+26+28+32=324E nutzt die Zahl „82“ von CYC für einen Kunstgriff, und zwar QS25+7=32_Kunstgriff 8+2=10 für „0“_Spalte 2/2 mit „32“_Summe 0+2+2=4 für Häm=324E [iron(iii) protoporphyrin IX | C34H34FeN4O4 | ChemSpider].
Das „Apoptosom“ aus 6-fach APAF1=1248AS wird symmetrisch=paarig=2 ausgeführt, so dass nur 2 Sekundärzählungen aufsteigend notwendig sind. Diese formieren sich beidseitig der Trichterachse und schließen ringförmig eine „0“(Null) ein, die sich im „Apoptosom“ als royale Krone auf den Stern setzt [Apoptosom – Wikipedia]. Pro-Caspase 9 und APAF1 werden dabei aneinandergebunden und zu Caspase-9 aktiviert. Weil die Trichter-„0“(Null) lesbar zur Asparginsäure (Asp)=70E gehört, ist diese real auch im Trichter vorhanden. „APAF1_alternativ linke Seite“ liegt in der Spalte Z.38273#[35](“606“)(00)/#_“1“37“[0](8)(27)/#_“9“1“(83)(2)[59] als QS6+0+6=12_QS37_1+9_1=37+11=48 mit 12_48 für „APAF1“=1248AS. „APAF1_alternativ rechte Seite“ als QS6+0+6=12_QS0+0_27_Spalte 8/2 mit 8+2 =27+10=37_Ringschluss mit Zahl 83 als QS8+3=11 mit „12“_Summe 37+11=“48“ für „APAF1“=1248AS. Lysin=80E ist wegen der Spiegelung in 708 möglich, sowie ein weiteres Asp=70E als Spalte=0/7. Das Protein (Mensch) „Procaspase-9“=416AS verfolgt das Ziel, sich mit AFAF1 in Scheibenform als Form=7_Kreis=64 zu koppeln, so dass die Ziffer „1“ in 416AS alternativ ersetzt werden muss. Die Kopplung „4-6“ erfolgt in der Z.38272 über die Spalte Z.38272#_“4“6“[76]/#_“5“25“7“ als QS5+25+7=37_4=“41“_“6“ für Procaspase-9=416AS [CASP9 (Caspase 9, Apoptose-assoziierte Cysteinpeptidase) (atlasgeneticsoncology.org)]. Aus „46“ ergibt sich ein Kreis=64 in einer Leserichtung. Das Protein (Mensch) „Apoptose-Regler Bcl-2“=239AS reguliert die Apoptose, indem die Durchlässigkeit der mitochondrialen Membran bei der Freisetzung von „Cytochrom c“ kontrolliert wird. Für die Apoptose TYP II wird analog zum TYP I gestartet, indem statt einem äußeren Signal auf der Zellmembran alternativ die Mitochondrium-Membran als Bezug dient. „Bcl-2“ bindet aber nicht die Ziffer „6“ von Procaspase-9=41“6“AS, sondern die Ziffer „4“, so dass die Apoptose im Prinzip gehemmt wird. „Bcl-2“ liegt in der Randspalte Z.38270#_[41]“74“[096]/#_“4“31“[4824]/#_“4“[676072] als QS7+4=11=QS=“2“_31_Spalte 4/4 mit „2“_Summe 31+4+4=“39“ mit 2_39 für Bcl-2=239AS [BCL2 - Apoptosis regulator Bcl-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Nekrose“ ist im Unterschied zur Apoptose ein krankhafter (pathologischer) Zelltod, die durch Nährstoff- und Sauerstoffmangel, Gifte, Radioaktivität etc. verursacht wird. Entzündungen sind die Folge. Leberversagen kann z.B. aufgrund einer Vergiftung mit „Paracetamol“=C8H9NO2=48+9+7+16=80E oder durch das Breitbandspektrum-Antiepileptikum „Valproinsäure“=C8H16O2=48+16+16=80E entstehen [Nekrose – Wikipedia]. Der Stress führt zum Verlust des mitochondrialen Membranpotentials und der Fähigkeit der Mitochondrien, ATP zu synthetisieren. Ersichtlich ist, dass die Wirkstoffe „Valproinsäure und Paracetamol=80E“ in der Randspalte Z.38270#_„0“[96]/#_“8“[24]/#_“0“[72]/#_“8“[22]/#_“0“[57] eine offene Pore „0“ finden und dann über vertikale 2 Spalten 8/0 für 2-fach „80“E direkt bis zum Trichterrand in Z.38274 aufsteigen. Eine Spiegelung „doppelt 0/8“ statt „80-80“ wäre auch ausreichend, weil andere Wirkstoffe in der Ziffer „8“ in Z.38273 enden: Der Wirkstoff „Halothan“= C2HBrClF3=12+1+35+17+27=92E steigt über die Pore „0“ ein, zählt in der Randspalte doppelt Spalte 9/2=92_Zahl 72=QS 9_Spalte 2/2 mit 92_Rand 57=QS5+7=12_als Schleife zurück in „0“-Spalte 8/0 mit Summe 12+80=92E. Ohne Wiederholung als Gesamtheit: „Methyldopa“=C10H13NO4=60+13+7+32=112E als QS0+9=“9“_Zahl 82=QS=“10“_QS7+2_2=“11“_“82“ mit Summe=9+10+11+82=Methyldopa=112E. „Diclofenac“=C14H11Cl2NO2=84+11+34+7+16=152E über Randspalte QS96_24_2_22+8=152E.
Lysosome: Nach dem Zelltod folgt die „Autolyse (Selbstauflösung)“ abgestorbener Körperzellen durch vorhandene Enzyme, ohne die Beteiligung von Bakterien oder anderen Lebewesen. Diese Selbstverdauung geschieht durch lysosomale Enzyme wie Cathepsine [Autolyse – Wikipedia]. Das Protein (Mensch) „CTSC_Cathepsin C“=463AS ist Lysosome von Lunge, Nieren, Plazenta zuständig [Cathepsine – Wikipedia]. Die Ziffern für Aminosäuren überschneiden sich, so dass manche Nachbarschaft nicht möglich ist: „Freisetzung eines N-terminalen Dipeptids, Xaa-Yaa-|-Zaa-, außer wenn Xaa Arg oder Lys ist oder Yaa oder Zaa Pro ist.“ Cofaktor „Chlor=17E“ „Bindet 1 Cl-Ion pro schwerer Kette“. Prolin=C5H9NO2=62E und Arginin=C6H14N4O2=94E können im Bereich mehrfach gezählt werden, so dass Lysin (K/Lys)=C6H14N2O2=36+14+14+16=80E ungünstig mit durchlaufen wird. Ein Dipeptid kann in einer geordneten Reihenfolge freigesetzt werden, die in Ringform zu keiner Störung führt. „Prolin“ kann bereits aus Z.38274#_6060 starten. Eine Ringform bildet sich über die Spalte Z.38275#_[0]“8“2“760/#_[3]“2“59“1“[3]/#_[7]“8“94“[99] mit Prolin QS1+59_2=62E_Lysin mit 8_QS2_8=10 für „0“ mit Lysin=80E_Arginin lesbar 94E. Passend für jede AS steht der Cofaktor Chlor=17E zur Verfügung, und zwar für „Arg“ als QS8+9=Chlor=17E, für „Lys“ als Spalte QS7+3+0+7=17E und für „Pro“ als „7_9+1=Chlor=17. Das Protein „CTSC“=463AS unterstützt die Ringzählung der Problemfälle (Pro, Lys, Arg) als Ring, der durch den Cofaktor QS8+9=Chlor=17E geschlossen wird, und zwar in der Spalte Z.38275#_[08]“2“7“6“0“/#_“3“25“9“1“3“/#_“7“(89)“4“[99] als „4“_QS9+1+3=13_QS2+7+6+0=15_25_QS8+3_7=10 mit „4“_Summe 13+15+25+10=“63“ als 4_63 für „CTSC“=463AS [CTSC - Dipeptidyl peptidase 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CTSF_ Cathepsin F“=484AS ist für Lysosome von Herz, Muskeln, Gehirn, Genitalien, Ovarien zuständig. Es spaltet Phenylalanin (F/Phe)=C9H11NO2=88E [4/4-8], Leucin (L/Leu)=C6H13NO2=72E [7/2] und Valin (V/Val)=C5H11NO2=64E [4/6]. Der Muskel „55“ grenzt in der Vorzeile an. „CTSF“ wird im Ring doppelt gezählt, und zwar in der Spalte Z.38274#_“48“1“3“[5]/#_“4“[77]“1“3“/#_“47“2“9“1“/#_[4]“6“8“[69]. 1. Zählung als „48“_QS1+3=“4“ für „CTSF“=484AS_2. Zählung als QS1+3=“4“_ Kunstgriff QS9+1=10 für „0“_ Kunstgriff QS2_8=10 für „0“_6_QS4+7=11=QS=2 mit Summe 0+0+6+2=“8“_“4“(Ringschluss) mit 4_8_4 für „CTSF“=484AS. [CTSF - Cathepsin F - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CTSV_Cathepsin L2=“=334AS ist eine „Cystein Protease“ mit Cystein=64E in der Randspalte Z.38275#_„6“[0]/“1“3“ mit „6“_QS1+3=“4“ für 64E. „Albumin“ liegt an einer Wasserspalte 2/8=H2O=28 und endet im Cystein mit QS59+1=“60“_Schleife 6+0_3=“9“ mit 60_9 für „Albumin“=609AS [ALB - Albumin - Homo sapiens (Human) | UniProtKB | UniProt]. „CTSV“=334AS umfasst den Bereich in der Spalte Z.38275#_[0]“8“2“7“6“0“/#_“3“2“[5]“9“1“3“/#_[78]“9“4“[99] mit „3“_Kunstgriff Spalte 8/2=QS=10 für „0“_QS2+7+6+0_3=18_Kunstgriff QS9+1=10 für „0“_QS9+4_3=16 mit 3_Summe 0+18+0+16=34 mit 3_34 für „CTSV“=334AS [CTSV - Cathepsin L2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CTSZ_Cathepsin Z“=303AS bildet im Abstand Cystein=64E in der Randspalte „6“[0]/“1“3“ als „6“_QS1+3=“4“ für Cystein=64E und eine 2. Cystein-Spalte als Vertikale 60_0_QS3+7=10 für „0“_“4“ mit Summe 60+0+4=Cystein=64E im Abstand QS2+5+9=Schwefel=16 mit dem 2 .Schwefel in der Cystein-Spalte 6/1 für eine Disulfidbrücke „16-16“. „CTSZ“=303AS muss diesen weiten Bereich umfassen, und zwar in der Spalte Z.38274#_“3“[56060057]/#_“1“370“[82760]/#_[918]“3“2“5“91“3“/#_[699]“7“8“[9499]/#_[481]“4““7“[3500] als QS3+1=“4“_ Kunstgriff 3+7+0=10 für 0_Kunstgriff 3+7=10 für 0_“4“_Wende QS7_8_2+5=“22“_Kunstgriff 9+1=10 für 0_“3“ als Summe=4+0+0+4+22+0=“30“_“3“ für CTSZ“=303AS [CTSZ - Cathepsin Z - Homo sapiens (Human) | History | UniProtKB | UniProt].
Die lysosomalen Enzyme beginnen in einer 2-zeiligen Membran (1)3-(1)3 in der Spalte Z.38274#_[1](3)[5606]/#_“7“1(3)7“[08]/#_“2“91832, die auf der Innenseite zum Schutz gegen Enzyme stark glykolysiert ist. Der „Zucker“ ist nicht atomar als „24“, sondern als Zucker=C6H12O6=36+12+48=96E über eine 3. Zeile angehängt, und zwar über die Spalte 7/2=QS7+2=“9“_QS1+3+7=11=QS=2_QS8+3=11=QS=2_2 mit „9“_Summe 2+2+2=“6“ mit 9_6 für Zucker=96E. Bei der an die Membran 33 angehängten beiden Ziffern „1“ in „(1)3-(1)3“ handelt es sich um die beiden Protonen eines ATP-Moleküls, die in das Lysosom transportiert werden, um den pH-Wert unter „5“ [saures Mileau] zu halten [Lysosom - DocCheck Flexikon]. Hierfür ist das Protein „V-ATPase “ mit 3 katalytischen Domänen zuständig [V-ATPase - Wikipedia]. Für ADP=220E werden die beiden Protonen mitgezählt, und zwar in der Spalte Z.38274#_“13“[56060]/#_“7“137“0“[82] als QS1+3_7=11_QS1+3+7=11_“0“ mit Summe 11+11=“22“_“0“ für ADP=220E. Folglich ist ADP aus ATP mit QS1+3+7=11=QS=2_ignoriere 6 (für 60), sondern Abstieg über 0/0 wegen doppelt „60“ mit „2“_Summe=0+0+60=“60“ für ATP=260E. Nur nach der 2. Zahl „60“ schließt sich das notwendige Katalyse-Wasser (H2O)=28 aus der Zahl 82 in Leserichtung an. Das mittlere Protein (Mensch) „V-ATPase_ATP6V1A“=617AS liegt in der Spalte Z.38274#_(1)(35)(6)[0]“6“[00]{57}/#_[71](37)[0]“8“2“7“{6}[0] als „6“_QS8+2+7=17 mit 6_17 für ATP6V1A“=617AS [ATP6V1A - V-type proton ATPase catalytic subunit A - Homo sapiens (Human) | UniProtKB | UniProt]. Das rechte Protein (Mensch) „V-ATPase_ATP6V1B1“=513AS liegt in der Randspalte 57/60 als „5“_QS7+6=“13“ mit 5_13 für ATP6V1B1“=513AS [ATP6V1B1 - V-type proton ATPase subunit B, kidney isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das linke Protein (Mensch) „V-ATPase_ATP6V1B2“=511AS liegt in der Spalte „1“35“6“/[47]“3“7“ absteigend als QS3+7=10_6_35 mit Summe 10+6+35=“51“_1“ für ATP6V1B2“=511AS [ATP6V1B2 - V-type proton ATPase subunit B, brain isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Die 3 Proteine markieren die Blasenform „0“(Null) des Lysosoms. Lysosome werden teilweise im Golgi-Apparat gebildet. Der Lysosomen-Durchmesser=100nm (0,1µm) bis 1100nm (1,1µm) muss die Evolution über die Form=7 kreieren, und zwar in der Randspalte Z.38273#_0057/2760 als Form=“7“_Lysosom (Blase)=“0“_QS6+5=11_00 für Dmax=1100 nm. Die Vorzeile Z.38273#_7822/[7] enthält den Mindestdurchmesser=Dmin=100 nm als Randzahl QS78+22=100 nm [Lysosom – Wikipedia].
In diesem Zeilenbereich liegen 2 Enzyme die lysosomale Enzyme erkennen und markieren. Das Protein (Mensch) „Phosphotransferase_GNPTAB“=1256AS wird über die Calcium-Bindestelle positioniert. Funktionell wird das lysosomale Enzym markiert, indem an 1-2 Mannose-Zuckermoleküle [Mannose=C6H12O6=36+12+48=96E] das Mannose-6-phosphat [M6P]=C6H13O9P=36+13+72+15=“136“E angehängt wird. Diese Länge ist im Prinzip unsinnig, so dass ein anderes Protein diesen Anhang wieder abschneidet. Es muss aber irgendeinen Unterschied ergeben, der eine Markierung bildet. Wegen der Schnittführung überlagern sich die beiden Proteine als Kette. „GNPTAB“=1256AS wird vom Calcium zur Führung umschlossen: „6-teilige Calcium-Kette“ in der Randspalte Z.38273#_ [5]{75}{2}{578}[22]/#_{35}“6{0}6“005“{7}/#_{137}{082}[7]“6“{0}/#_[9]{18}{325}{913}, und zwar als Ring um die Randzahl „22“ über die Randspalte 7/0/3 als Ecke mit QS7+0+3=10_QS9+1=10 mit Summe 10+10=1. Calcium=20 E_QS0+8+2_3+2+5=2. Calcium=20E _QS1+3+7_1+8=3. Calcium=20E_QS3+5_7+5=4. Calcium=20E_Bindung 2/0=5. Calcium=20E_QS5+7+8=6. Calcium=20E. Der Ring enthält „GNPTAB“=1256AS als QS6+0+6=“12“_QS0+0+5=“5“_“6“ mit 12_5_6 für „GNPTAB“=1256AS. Die Endziffer „6“ ist Bestandteil der angehängten Mannose=96E als QS2+7=9_6 für Mannose=96E, so dass die noch freie Ziffer „7“ verwendet ist.
„M6P“ setzt absteigend an der Mannose in der Spalte Z.38274#_“1“3“[5606]/#_[7]“1“3“7“0“8“/[2918]“3“2“ seitlich an, und zwar mit QS0+8_3+2=13_Ziffer „6“ nicht aus dem Protein über 0+0+6=“6“, sondern in Z.38275 angehängt als QS1+3+7=11=QS=“2“_“1“+“3“ mit „13“_Summe 2+1+3=“6“ als 13_6 für „M6P“=136E. Das Protein (Mensch) „Phosphodiester_NAGPA“=515AS muss „M6P“=136E abschneiden, aber einen Unterschied als Markierung hinterlassen. „NAGPA“=515AS liegt zerlegt „5_13+2“ in der Spalte Z.38273#_[5]“5“[7525] /#_“13“[5606]#_“7“1“3“[708]/#_[291832] mit Ziffer „5“ in der Spalte [5]“5“/“13“ als „5“_“13“_QS7+1+3=11=QS=2 mit 5_Summe 13+2=“15“ als 5_15 für „NAGPA“=515AS. Von „M6P=136E bleibt nach der Abtrennung Ziffer „7“=Form aus der Reduzierung QS1+3+“7“=11=QS=2 für eine Markierung übrig. „M6P“ wird fast komplett entfernt, wenn „NAGPA“=515AS noch 2 Kunstgriffe mit QS7+0_3=10 für „0“ und QS8+2=10 für “0“ anhängt. An der Mannose=96E bleibt dann die Ziffer „0“ als Unterschied hängen. NAGPA“=515AS bildet ein Homotetramer, so dass sich der Bereich für 3 weitere Zählungen erweitert. Die 4-zeilige Serien-Randspalte #1614 zählt doppelt QS1+4=“5“_QS1+6=7_QS1+6=7_1 für 5_15AS. Zum 2. Dimer legt sich als Verbindung eine Disulfidbrücke mit Schwefel=“16-16“. Die Brücke bleibt beim Schnitt erhalten und markiert den Schnittrand, und zwar in der Spalte Z.38274#_“8“1“3“[560]/#_[7]“7“13“[(7)0] QS8+1_7=Schwefel=16_QS3+13=Schwefel=16. Die 4. Zählung überschneidet sich bei gleichem Schnitt in der Zahl „13“ mit der 1. Zählung in der Spalte Z.38274#_[813]“5“[6]/#_[77]“13“[7]/‘‘_[7]“29“[18] als „5“_13_QS2+9=11=QS=2 mit „5“_Summe 13+2=“15“ für „NAGPA“=515AS. „NAGPA“ endet mit einer „NPFKD“- Sequenz kreisförmig in der Randspalte Z.38273#_“5“2“57“8“22“/#_“6“[0]“60“0“57“/#_“70“[8]“2“[7]“6“0“/#_[832591]“3“ als Kette in der Folge „Asparagin (N/Asn)“=C4H8N2O3=70E lesbar für „Asn“=70E_Prolin (P/Pro)=C5H9NO2=62E als Spalte 60/[8]2 mit QS60_2=62 für „Pro“=62E_Phenylalanin (F/Phe)=C9H11NO2=88E in Randspalte 22/57/60/13 mit QS22_57_6+0_3=88E für Phe=88E_Lysin (K/Lys)=C6H14N2O2=80E lesbar in Spalte 8/0 als Lys=80E_Asparaginsäure (D/Asp)= C4H7NO4=70E lesbare Spalte 7/0 ist in Ziffer „0“ durch Prolin besetzt, alternativ weiter als QS57+2+5_6=70E für Asp=70E. „Das auf „Tyrosin [=C9H11NO3=54+11+7+24=96E]“ basierende Internalisierungssignal könnte für die Rückführung des Enzyms von der Plasmamembran zum TGN wesentlich sein. Die C-terminale „NPFKD-Sequenz“ ist ein attraktiver Kandidat entweder für ein Endozytose-Signal, das an der Plasmamembran wirkt, oder für ein Rückholsignal, das im „TGN“ [trans-Golgi-Netzwerk (TGN)] wirkt, um das Enzym in den „cis/medialen Golgi“ zurückzubringen.“ [NAGPA - N-acetylglucosamine-1-phosphodiester alpha-N-acetylglucosaminidase - Homo sapiens (Human) | UniProtKB | UniProt]. „NAGPA“ interagiert mit „AP4M1“=453AS in der Spalte Z.38274#_[8]“1“3“5“[606]/#_[771]“3“[708] an der Schnittkante mit QS1+3=“4“_“5“_“3“ für AP4M1“=453AS [AP4M1 - AP-4 complex subunit mu-1 - Homo sapiens (Human) | UniProtKB | UniProt]._dat19.03.2023
Endozytose: Zellfremde Substanzen werden an der Zellmembran in Vesikeln eingeschlossen und ins Zellinnere transportiert. Die „Clathrin-vermittelte Endozytose“ ist eine von 4 Mechanismen. Die Vesikel wandern in das Zellplasma und sammeln sich in einem Endosom. Der Zeilenbereich #1614 umfasst das gesamte Zellthema, so dass jeweils nur ein spezieller Zweck verfolgt und alles andere total vergessen wird. Die Evolution stellt eine muldenförmige Einschnürung mit der Kreis-Gegenform=“46_7“=Form zum Kreis=64 als zeichnerische Abbildung in das Zentrum. In dieser Initiationsphase binden endozytotische Gerüst- und Adapterproteine an die Membran, indem Sortierungsmotive in den Frachtproteinen erkannt werden. Der Adapterproteinkomplexes 2 (AP-2) gruppiert sich erwartungsgemäß um Z.38272#_„46_7“. Die Einschnürung durch Membrankrümmung mittels Protein „Dynamin“ setzt erst anschließend ein. Der Vesikeldurchmesser von 100nm ist zwar das Resultat der Abschnürung, der Durchmesser ist aber bereits in einer Matrix vorab fixiert. Hierbei wird eine Einschnürung als Matrix symbolisiert, die vertikal von 46_7 bis zur Membran in Z.38270 absteigt. Mit 4 Eckpunkten „Form=7“ wird QS=100 nm eingeschlossen, wobei ein Vesikel „0“ als „0“/7 seitlich anliegt. Der Durchmesser ist fixiert in der Form-7-Matrix Z.38270#_[2](34)“1“(7)/#_“0“1“43“[1]/#_(7)“9“46“(7) mit 3 Ecken „7“ plus 1 Ecke QS3+4=“7“, und zwar als Durchmesser von „Clathrin-coated Vesicles “(clathrinbeschichtete Vesikel) mit QS0+1_9+46_43_1=Durchmesser „CCVs“ =100nm. [Clathrin-vermittelte Endozytose – Wikipedia]. Für den Durchmesser von 750 nm bei einer Abschnürung via „Phagozytose“ wird die Matrix unter Einschluss von „34“ als QS3+4=“7“_QS1+4=“5“_QS4+6=10 für „0“ mit 75_0 für 750nm gelesen [Endozytose – Wikipedia].
Die Sortiermotive werden an das Membranlipid „Phosphatidylinositol(4,5) bisphosphat (PIP2)“=C47H80O19P3 (Bsp.)=282+80+152+45=559E gebunden, das sich auf der Innenseite der Membran befindet [Phosphatidylinositol-4,5-bisphosphate – Wikipedia]. Nach Aktivierung von Rezeptoren in der Zellmembran wird das Enzym „Phospholipase C“ aktiviert, um Signalstoffe freizusetzen. „Phosphoinositid-Phospholipase C“ [Phospholipase C (PLC)] sind Enzyme, die Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltrisphosphat (IP3) und Diacylglycerol (DAG) hydrolysieren [Phosphoinositid-Phospholipase C – Wikipedia]. Das Enzym „PLC“ ist erst nach einigen Zeilen mit dem Cofaktor „Calcium=20E“ als Spalte „2/0“ auffindbar, so dass „PIP2“=559E aufsteigt, und zwar über die Spalte Z.38270#_23“41“7/#_23“41“7/#_7“9“467 als QS4+1=5_QS4+1=5_9 mit 55_9 für PIP2=559E. Die „Phospholipase C“ kann neben dem Cofaktor beidseitig gezählt werden. Insgesamt existieren 3 Calcium-Bindestellen, so dass am rechten Rand in der Calcium-Spalte Z.38273#_“7“5“{2}“5“7“8“[2](2)/#_[5]“6“{0}(6)(0(0)(5)(7) zusätzlich doppelt Calcium gezählt wird, und zwar mit QS5+7+8=Calcium=20 und QS6+0+0+5+7_2=Calcium=20. Das Protein (Mensch) „Phospholipase C (PLC)=756AS liegt links neben Calcium in der Spalte 75/[5] als 75_6 für PLC=756AS [Phosphoinositide phospholipase C - Homo sapiens (Human) | UniProtKB | UniProt]. Der Mensch besitzt von „PLC“ verschiedene Typen (C_beta, C_gamma etc) [Phospholipase C - DocCheck Flexikon]. Das Protein (Mensch) „PLC_Typ beta-2“=33AS zieht durch die Ziffer „Null“ ohne eine Calcium-Spalte zu erkennen, und zwar absteigend als QS7_weiter einzeilig 1+3=11_QS5+6+0=11_QS6+0+0+5=11 mit Summe 11+11+11=33 für „PLC_Typ beta-2“=33AS [PLCB2 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase beta-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Am Spaltvorgang sind „Phosphodiesterasen“ aus der Gruppe der „Hydrolasen“ beteiligt. Das Protein (Mensch) „PLCG1_Phosphodiesterase gamma-1“=1290AS benötigt den Cofaktor „Calcium“=20E in der Spalte 0/2 in Z.38273#_“55“[75](2)[5]/#_[1]“35“6(0)6“ als QS6+0+6=12_QS35+55=90 mit 12_90 für PLCG1=1290AS [PLCG1 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLCD3_Phosphodiesterase delta-3“=789AS benötigt liegt mit einer Lücke zu den 3 Calcium-Zählungen. Um dieses Potential zu gewinnen, wird in Z.38275#_37082 mit QS3+7+0+8+2=Calcium=20E das 4. Calcium als Brücke gezählt und links am Protein das 5. Calcium in der Spalte 48/4/4 als QS4+8_4_4=Calcium=20E gezählt. „PLCD3“=789AS als 7_QS3+5=8_Q8+1=9 mit 7_89 für „PLCD3“=789AS [PLCD3 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase delta-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLCB2_Phosphodiesterase beta-2“=1185AS liegt links an der Calcium-Spalte „2/0“ als Ca^2+-Cofaktor in „5“5“[75](2)/[1]“3“5“6“(0) als QS5+6=11_QS5_3=8_5 mit 11_85 für „PLCB2“ [PLCB2 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase beta-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Bevor sich an der Zellmembran Einstülpungen zeigen, läuft zunächst eine Phase der Internalisierung („internalization“; lat. internus = innen befindlich) voraus. Bei diesem Vorgang nimmt die Zelle lösliche Stoffe (z.B. Nährstoffe) oder membrangebundene Moleküle (z.B. Rezeptoren) auf. Hierfür werden 3 Beispielfälle betrachtet:
Beispiel 1: Die Ephrin/Eph-Endozytose endet bereits nach der Kontaktaufnahme von Eph-Rezeptoren und Ephrinen zwischen 2 Zellen, die sich wieder lösen, um Zellen abzugrenzen. Auch wenn sich das Axon einer Nervenzelle einen Weg durch ein Gewebe sucht, wirkt das Gewebe kurzzeitig mit. Eph-Rezeptoren können als Ligand auf die gleiche Weise fungieren, wie ein Ephrin-Ligand als Rezeptor fungieren kann [Mechanismen und Funktionen des Eph- und Ephrin-Signalwegs | Nature Reviews Molekulare Zellbiologie; K.Kullander u.a Nat Rev Mol Cell Biol 3, 475–486 (2002). https://doi.org/10.1038/nrm856]. Die Familie der Eph-Rezeptoren umfasst 9 EphA- und 5 EphB-Mitglieder, die mit Ephrin-Liganden interagieren. Eph-Rezeptoren bestehen aus einer extrazellulären Struktur, die aus einer Ephrin-Bindungsdomäne besteht, die durch ein Cystein-reiches EGF-ähnliches Motiv mit Fibronektin-Typ-III-Wiederholungen verbunden ist. Das Protein (Mensch) „Fibronektin“=354AS enthält in „Pos.17-291“ 3 Domänen „Fibronektin-Typ III“. Fibrotektin liegt in der Membran-Spalte und kann mit 3 Kunstgriffen schleifenförmig verlängert werden, um in der Randspalte „6/4“=64 das Cystein= C3H7NO2S=18+7+7+16+16=64E und das EGF-Motiv mit einzuschließen. „EGF“ als Folge „78-40-88“ mit Glutaminsäure (E/Glu)=C5H9NO4=78E, Glycin (G/Gly)= C2H5NO2=40E und Phenylalanin (F/Phe)=C9H11NO2=88E. „Fibronektin“=354AS liegt in der Randspalte Z.38270#_“3“4“1“[7409](6)/#_[14]“3“1“(4)(8)(2)(4)/#_[9467](6)(0)[72] als „3“_QS4+1=“5“_QS3+1=“4“ mit 354_Spalte 4/6 als QS=10 für „0“_QS0_8+2=10 für „0“_Spalte 6/4=10 für „0“ mit Summe 354+0+0+0=354 für „Fibronektin“=354AS [Fibronectin - Homo sapiens (Human) | UniProtKB | UniProt]. Das „EGF“-Motiv überlagert „Fibronektin“ in der Spalte Z.38270#_“34“17“40“[96]/#_[14]“314“8“[24] mit (E/Glu)=78E als QS3+4=7_QS1+7=8 mit 7_8 für (E/Glu)=78E_(G/Gly)=40E ist lesbar mit „40“ als _(G/Gly)=40E_(F/Phe)=88E als „8“_QS3+1+4=“8“ mit 8_8 für (F/Phe)=88E.
Das Protein (Mensch) „GULP1“=304AS lagert sich am Komplex mit an, wodurch sich Nachbarzellen gegenseitig verschlingen. „GULP1“ wird vom „Guanin-Nukleotid-Austauschfaktor „TIAM2“ (T-lymphoma invasion and metastasis-inducing protein 2) [TIAM Rac1 assoziiert mit GEF 2, STEF oder TIAM2]“ unterstützt [TIAM2 – Wikipedia]. „GULP1“ rekrutiert weiterhin das Protein „Dynamin“, womit der Internalisierungsprozess der Endozytose an der Membran beginnt [Gulp1 kontrolliert die Eph/Ephrin-Trogozytose und ist wichtig für Zellumlagerungen während der Entwicklung - PubMed (nih.gov); R.Klein u.a. Okt. 2019; DOI: 10.1083/jcb.201901032]. „GULP1“ ist ein Homodimer, das seine 304AS doppelt zählen muss. Zwischen beiden Teilen gibt es Streit um die Ziffer „0“ als Zankapfel zwischen ihnen. Man beißt sich folglich gegenseitig. „TIAM2“ fischt sich die Ziffer „0“ bei Durchlauf als Niemandsland „0“ heraus [When two people argue, the third one is happy]. „GULP1“=304AS liegt in der Membranspalte Z.38270#16149“82“3“41/#16149“401431/#1614897946 als 1. Zählung „3“_QS8+2=10 für „0“_“4“ mit 30_4 für GULP1“=304AS_2. Zählung gespiegelt „Streit-0“_1. Kunstgriff über Spalte 1/9=QS=10 für „0“_“4“_2. Kunstgriff QS4+6=10 für „0“_“3“ mit 3_0_4_0_0 als „30“_Summe 4+0+0=“4“ für „GULP1“=304AS (Homodimer) [GULP1 - PTB domain-containing engulfment adapter protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TIAM2“=1701AS zieht 4-zeilig aufsteigend weiter, um mit seiner letzten Ziffer „1“ seitlich das GTP=268E gespiegelt QS3+5=“8“_“6“_Spalte 2/0 mit Summe „86“_Summe 2+0=“2“ mit 2_68 für GTP=258E zu erreichen, und zwar in der Spalte Z.38271#_[4]“0“1“[431]/#_[9]“7“[946]/#_“5“5“[7525]/#_“1“[35606] über Spalte 01/7[9] als QS „0+1=“1“_“7“_QS5+5=10 für „0“_“1“ mit 17_01 für „TIAM2“=1701AS [TIAM2 - Rho guanine nucleotide exchange factor TIAM2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation „TIAM2_H0YGV1“=64AS zählt dieselbe Strecke als QS1_0_7=8_55_1=QS=64 mit für „TIAM2_H0YGV1“=64AS [TIAM2 - TIAM Rac1 associated GEF 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RAC1“=192AS wechselt den Bezug zwischen GTP=268E und GDP=220E, indem die 5-zeilige Spanne zwischen ER und Membranzeile überbrückt wird. „RAC1“ nimmt die Startziffer „1“ von „GULP1“als Bindung auf und reicht über die Spalte 1/9 und einen Kunstgriff die Ziffer „2“ als 1_9_QS4+6=10 für 0_2 mit „19“_Summe 0+2=“2“ für RAC1=192AS, wobei über die Verbindung mit der Calcium-Spalte 2/0 in Z.38274 linksseitig ein Verbindung zum GTP als „2“_QS0+6=“6“_QS3+5=“8“ für GTP=268E besteht. RAC1 kann seine Ziffer „2“ für GDP=220E als „2“_Spalte 5/6=QS=11=QS=2_0 mit 22_0 für GDP=220E opfern, wenn die Ziffer „2“ alternativ in einer Wechselposition gezählt wird, um GDP statt GTP anzulagern. Alternativ: RAC2 als 1_9_QS4_6=10 für „0“_absteigend zur Membranziffer „7“ mit QS3+1_7=11=QS=2 mit 19_Summe 0+2=“2“ für RAC2=192AS (alternativ). „Plasma membrane-associated small GTPase which cycles between active GTP-bound and inactive GDP-bound states“ [RAC1 - Ras-related C3 botulinum toxin substrate 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Beispiel 2 (B-Familie): Bei der Ephrin-A- und Ephrin-B-Ligandenfamilie unterscheidet sich der Glycosylphosphatidylinositol „GPI“-Anker bei Ephrin-A-Liganden von einem zytoplasmatischen Schwanz der Ephrin-B-Liganden. Im Zeilenlauf folgt das „GPI“ für einen GPI-Anker nach einigen Zeilen. Bei der B-Familie bleibt der Vorgang 3-zeilig an der Membranzeile Z.38270. Das Protein (Mensch) „EFNB2¬_Ephrin-B2“=333AS ist ein Zelloberflächen-Ligand für Eph-Rezeptoren. „EFNB2¬“ liegt in der Randspalte Z.38270#_“2“3“4“1“7“4“0“[96]/#_“0“1“4“3“1“[4824]/#_[79](46)(7)[6072] als QS2_0_1=3_3_QS4_4+3=11=QS=2_1 mit Summe 33_3 für „EFNB2“¬=333AS. „EFNB2“ ist ein „Dimer“, ergibt aber keine Dopplung als „Homodimer“. Das „Dimer“ kann aber mit seinen 46000 Basenpaaren als „46“_Form=“7“_Spalte „74“0“/“1“[48] mit „1“_QS7+4=11=QS=“2“_“0“ als Faktor QS1+2=“3“_mit „0“ als Basiszahl „10“ für „46“ (Form=7) *10^3 gezählt werden, wodurch sich die Spanne in der Membranzeile zum Kontakt mit dem Rezeptor verbreitert [Ephrin-B2 - DocCheck Flexikon]. Es liegt somit eine Kette 3333 vor, von der 333 für AS und 1x als Faktor 10^3 gezählt werden [EFNB2 - Ephrin-B2 - Homo sapiens (Human) | UniProtKB | UniProt]. „EFNB2¬_Ephrin-B2“ bindet als Ligand am Protein (Mensch) „Rezeptor-Tyrosinkinase_EPHB4“=987AS. Der Rezeptor „EPHB4“ muss geeignet sein, bei der Katalyse ATP=260E in ADP=220E umzuformen, wobei das Tyrosin=C9H11NO3=96E bereits den Zeilenrand „96“ der Membranzeile besetzt. ATP liegt auf der rechten Seite in der Spalte Z.38270#_(82)“3“4“1740{96}/#_[401]“4“3“[14]“8“[24] als QS3+4_4=11=QS=“2“_über Spalte 17/3[1] mit QS3_1+7=11=QS=2¬¬_4_0_8 mit „2“_Summe 2+4+0=“6“_“8“ für ATP=268E. Weil die Ziffer 6 in „2“+4 zerlegt ist, ist bereits eine Trennstelle enthalten, um für die Umwandlung in Gegenrichtung für ADP zu zählen. „22“ ist dabei bereits vorhanden, so dass links QS8+2=10 für 0 als ADP 220E gebildet wird. Little joke: „Zur Bedeutung von Summenformeln: …In der organischen Chemie werden nur selten Summenformeln verwendet, da sie kaum Informationen enthalten, die für den Ablauf der Reaktionen in der organischen Chemie wichtig sind“ [Summenformel – Wikipedia]. Aufgrund der weiten ADP-ATP-Spannweite muss „EPHB4“ folglich als Dimer doppelt gezählt werden. „EPHB4“ liegt in der Randspalte Z.38270#_[2]“3“4“(1)(7)(4)(0)(9)[6]/#_“01“(4)(3)(1)(4)(8)[24]/#_“79“[467](6)(0)[72]. 1. Zählung (Monomer links) absteigend als „9“_QS7_0+1=“8“_QS3+4=“7“ mit 9_8_7 für „EPHB4“=987AS. 2. Zählung (Monomer rechts) aufsteigend mit Ziffer „9“ aus Tyrosin als „9“_QS0_8_0=“8“_Kunstgriff 4/6=QS=10 für „0“_QS7+4=11=QS=2_über Spalte 7/1 zur Kopplung als Homodimer mit QS1+3_1=5 als 98_Summe 0+2+5=“7“ für „EPHB4“=987AS“ (Dimer). Ligand und Rezeptor bilden ein Heterotetramer aus 2 Dimeren. „The heterotetramer is composed of an ephrin dimer and a receptor dimer [EPHB4 Gene - GeneCards | EPHB4 Protein | EPHB4 Antibody]. „Zusammen mit seinem verwandten Liganden/funktionellen Liganden EFNB2 ist es an der Regulation der Zelladhäsion und -migration beteiligt und spielt eine zentrale Rolle bei der Morphogenese des Herzens, der Angiogenese und dem Umbau und der Permeabilität von Blutgefäßen“ [EPHB4 - Ephrin type-B receptor 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Für eine geeignete Zelle muss der Rezeptor sein Zielgebiet erst kreieren, weil ein Herzmuskel=55 nicht direkt lesbar ist. Hierfür bildet jedes Monomer die Zeitbasis=60 für eine Herzkammer. Diese ist auf der rechten Seite bereits lesbar, erzeugt aber auf der linken Seite ein Problem, weil sich aus der gewünschten 3-zeiligen Spalte QS34_14_9+4=“61“ statt Zeitbasis=60 ergeben, d.h. der Herzschlag ist als 1 Aktion bereits addiert. Die Spalte [9](8)[2]“34“/[9](4)(0)“14“/[897]“9“4“ zeigt, dass eine Wechselposition mit QS34_14_4+0_8=Zeitbasis=60 vorhanden ist. Nerv=7, Vene=8 und Arterie=9 werden in der Spalte als Zusammenhang adressiert. Zwischen beiden Seiten liegt eine Symmetrie 14(3)14, die einen Herzmuskel QS1+4=“5“_(3)_QS1+4=“5“ als Muskel=55 darstellt. Die Ziffer „3“ gehört zur kreuzenden Spalte 1/3/6 mit QS1+3=4_6 für den Blutkreislauf als Kreis=64, der in der Zerlegung mit Physik=63 die Pumpfunktion des Herzens und in der Differenz 64-63=1 Aktion als Herzschlag enthält. ADP=220E enthält CO2=6+16=22E und ATP=260E enthält Blut=Eisen=26 bzw. Sauerstoff QS2+6=8E. Für die Deutung als ein „BiXnom-Herzmuskel-Kreuz“ muss eine der beiden Zahlen 60 als Puls „60 Schläge/Minute“ umgedeutet werden. Hierfür wird die Zahl „3600“ Sekunden = 1 Minute benötigt. Über die Spalte 3/6 folgt 3_6_QS76_14=90_QS8+2=10 mit „36“_Summe 90+10=100 mit Kunstgriff „00“ für „3600“ Sekunden. Eine der Zeitbasiszahlen „60“ wurde dabei zerstört, so dass nunmehr eine Herzfrequenz 60 Schläge / 3600 Sekunden vorliegt. Bei Erwachsenen liegt der Puls in Ruhe bei etwa 60 bis 80 Schlägen pro Minute.
Beispiel 3 (A-Familie): Ephrin-A-Liganden gehören zu den Oberflächenproteinen, die durch einen Glykosylphosphatidylinositol (GPI)-Anker an der Zellmembran befestigt sind. Das membranständige Phospholipid „Phosphatidylinositol“ wird über eine einige Oligosaccharide (Glykankette) und Phosphoethanolamin=C2H8NO4P=12+8+7+32+15=74E mit dem Protein auf der Außenseite der Zellmembran verknüpft. Polysaccharide (Glykane / Vielfachzucker) bestehen aus mindestens 11 Monosacchrideinheiten. Beispielsweise ist Glycogen= C6H10O5=36+10+40=86E (Wiederholeinheit) ein Polysaccharid. Die Phosphatidylinositol-4,5-bisphosphate (PIP2) sind eine Gruppe von Phospholipiden, die auf der Innenseite der Zellmembran auftreten und durch Weiterleitung extrazellulärer Signale in die Zelle, die Endozytose kontrollieren. Rezeptoren in der Zellmembran aktivieren das Enzyms Phospholipase „C“, das „PIP2“ in Diacylglycerine (DAG) und Inositol-1,4,5-trisphosphat (IP3) spaltet. Die Phospholipase „A“ erzeugt „Lysophosphatidylinositol“. Die 3 Spaltprodukte sind Second Messenger für Signale. Nachfolgend wird die beispielhaft „PIP2“=C47H80O19P3(Bsp.)=282+80+152+45=559E verwendet. Real liegt ein extrazellulärer Raum zwischen den Zellmembranen zweier Zellen vor. Im Zeilenlauf gibt es dagegen scheinbar nur eine Startzeile hinter der sich alle Vorgänge überlagern, an denen auch das „ER“ beteiligt ist: „Die Übertragung von Glykosylphosphatidylinositol auf den C-terminalen Aminosäurerest eines fertigen Proteins erfolgt im Rahmen der Prozessierung im endoplasmatischen Reticulum. Dabei wird eine C-terminale Signalsequenz aus mehreren hundert hydrophoben Aminosäureresten durch den bereits membranständigen GPI-Anker ersetzt“ [GPI-Anker - Lexikon der Biologie (spektrum.de)]. Die Menge des intrazellulären Transports von Ephrin-A zur Oberfläche wird als Gegenreaktion durch die Expression der Fyn-Tyrosinkinase regulierend verringert und umgekehrt [Die fyn Tyrosinkinase reguliert die Oberflächenexpression von Glycosylphosphatidylinositol-gebundenes Ephrin über die Modulation von Sphingomyelin Stoffwechsel - PMC (nih.gov); A. Baba u.a. April 2009; doi: 10.1074/jbc. M809401200]. Das Protein (Mensch) „Tyrosin-Protein-Kinase_ FYN“=537AS besitzt den Cofaktor Mangan=25E und benötigt ATP/ADP [FYN - Tyrosine-protein kinase Fyn - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Ephrin-A5_EFNA5“=228AS liegt in Z.38273#_822 mit 822 gespiegelt lesbar als GPI-gebundener Ligand für Eph-Rezeptoren am rechten Zeilenrand, so dass der Kontakt wieder leicht lösbar ist. Nach dem Transport kann das Protein nochmals in der Membranspalte Z.38270#_8234/4 über Spalte 4/4 als QS4_3+4=11=2_2_8 für 228AS erzeugt werden [EFNA5 - Ephrin-A5 - Homo sapiens (Human) | UniProtKB | UniProt]. FYN kann die Membran-Position von EFNA5 unterbinden, weil es dort selbst vorliegt. Ebenfalls liegt FYN an der alternativen Randlage des Liganden vor. Das Gleichgewicht zwischen beiden Positionszeilen ergibt DELTA.TIME.Epi.Vir.Z.38270-Z.38273=#1“2658“92“ mit dem Gewinner „2“_QS=6+5=11QS=2_8 für EFNA5=228_QS9+2=Zählgröße=11. Weil EFNA5 gespiegelt „822“ transportiert wird, ist die Zahl „82“ als Spiegelung von Wasser „28“ eine scheinbar „hydrophobe“ Größe, auf die die Evolution passend reagiert. Der Regulator „FYN“=537AS liegt als Position an der Membran in der Spalte Z.38270#_8234174/#_4014314 mit QS1+4=“5“_“3“_QS4+1=“5“_QS7+4=11=QS=“2“ mit „53“_Summe 5+2=“7“ für FYN=537AS. Cofaktor „Mangan“=25E liegt seitlich in der Spalte [8]“2“[3]/“401“ mit 2_QS4+0+1=“5“ für Mn=25E. Als Cofaktor wird „FYN“ passiert, so dass die Mn-Dreiecksform zulässig ist. „FYN“ blockiert „EFNA5“ und mit der Zahl „74“ zugleich die Startziffer des „Eph-Rezeptors“. In der Alternativposition teilt sich der Regulator „FYN“=537AS die Zeile mit EFNA5 in Z.38273#_(2)“5“7“8“22“ als „5“_QS7+8=15_22 mit „5“_Summe 15+22=37 für „FYN“=537AS. Der Cofaktor „Mangan“=25E ist seitlich lesbar. ADP=220E steigt in der Randspalte zur Z. 38270 ab mit 2_2_QS4+6=10 für „0“ mit 22_0 für ADP=220E. ATP=260E läuft bogenförmig zurück als „2“_QS2+4=“6“_Kunstgriff QS8+2_0=10 für „0“_8 mit „26“_Summe 0+8=“8“ für ATP=268E. Je nach Gewebeart wird EFNA5 bei Krebs über- oder unterdurchschnittlich exprimiert. Das Phospholipid „PIP2“=559E kann die Ziffer „9“ verschieden anlagern, wobei die Bindung zu „Phospholipase C“ maßgeblich ist, und zwar über die Spalte Z.38273#[16148]“55“[7]/#[1614] {8}“{1}“3“5“ als „55“_QS1+3+5=“9“ mit 55_9 für „PIP2“=559E. Zur Bildung eines GPI-Ankers müssen 3 Zeilen bis zur Membranzeile Z.38270 absteigend überwunden werden, wofür in die lotrechte Spalte Z.38270#_ 823/#_401/#_979/#_{557} mit Phosphoethanolamin=74E als 7_QS0+1_3=4 für 74E und eine Glykankette zum GPI-Anker geführt werden. Die Glykankette liegt seitlich und teils überdeckend aus „11“ Wiederholungen von Glycogen=86E mit 11*86=Glykankette=946E, und zwar als „9“_“4“_QS0+1_2+3=“6“ mit 94_6 für Glykankette=946E.
An der Glycosylphosphatidylinositol-Ankeranbindung sind verschiedene Proteine beteiligt. Der GPI-Anker bezieht sich nur auf die auf die Ephrin-A-Ligandenfamilie und den passenden Rezeptor. An der Ankerposition ist das Ankerprotein (Mensch) „GPAA1_ E9PLV6“=234AS in Zeile Z.38270#_8“234“ lesbar [GPAA1 - Glycosylphosphatidylinositol anchor attachment 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Ankerprotein (Mensch) „GPAA1_E9PM94“=98AS in Zeile Z.38270#[1614]“98“ ist lesbar [GPAA1 - Glycosylphosphatidylinositol anchor attachment 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Ankerprotein (Mensch) „GPAA1_E9PM11“=158AS liegt in der Spalte Z.38270#“8“2“3“/#[40]“1“ gespiegelt als 8_QS2+3=5_1 mit 1_5_8 für „GPAA1“=158AS [GPAA1 - Glycosylphosphatidylinositol anchor attachment 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Ankerprotein (Mensch) „GPAA1_O43292“=621AS liegt in der Spalte Z.38270#_98234/#_94014 als QS1_3+2=6_QS0_4_9+8=21 mit 6_21 für GPAA1=621AS. Das Protein „Phospholipase D_GPLD1“=840AS löst verankerte Proteine aus der Membran. Für die Hydrolyse ist Wasser gespiegelt „82“ lesbar, so dass die Leserichtung nach links dreht in der Spalte Z.38270#_“8“(2)[34]/#“40“[14] als 8_40 für GPLD1=840AS [GPLD1 - Phosphatidylinositol-glycan-specific phospholipase D - Homo sapiens (Human) | UniProtKB | UniProt].
Das Phospholipid „PIP2“=559E wird vom Protein (Mensch) „Phosphoinositid-Phospholipase C (PLC)_A0A384MR47“=756AS als 1 von 6 PLC-Typen (mit weiteren Isoenzymen) zu Inositoltrisphosphat (IP3) und Diacylglycerol (DAG) hydrolysiert. Dieses „PLC“ besitzt 1 Cofaktor-Bindestelle für Ca^2+, aber (Note): „Binds 3 Ca2+ ions per subunit. Two of the Ca2+ ions are bound to the C2 domain“. Bei diesem Reaktionsschritt werden Signale ins Zellinnere weitergeleitet. „PLC“=756AS liegt mit Calcium offensichtlich mit einer Homodimer-Spiegelachse zwischen „PIP2“=559E und der Calcium-Spalte „2/0“ als Cofaktor, in der Spalte Z.38273#_[8](55)“75“{2}“5“7“/#_[8](1)(3)(5)“6“{0}“6“0“ als „75“_“6“ für PLC=756AS und „75“_QS6+0=“6“ für PLC=756AS. 3-fach Calcium mit 3*20=“60“ zählt sich nach der Homodimer-Bindung, wenn Calcium statt vertikal alternativ horizontal gezählt wird [Phosphoinositide phospholipase C - Homo sapiens (Human) | UniProtKB | UniProt]. Die 1. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C (PLC)_ A0A140VJR9“=608AS liegt neben „PIP2“ in der Spalte Z.38273#_(55)[75]{2}[57]/#_(135)“60“[60]/#_[7137]“0“8“[2] aufsteigend 60_QS0+8=8 als 60_8 für PLC (Mod.)=608AS am Cofaktor „Calcium“=20E in der Spalte 2/0 [Phosphoinositide phospholipase C - Homo sapiens (Human) | UniProtKB | UniProt]. Die 2. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_ PLCH1“=1685AS liegt neben „PIP2“ in der Spalte Z.38273#_(55)75{2}“5“[7]/#_(135)“6“{“0“}“6“[0]/#_[71]“3“7“0“8“2“ als QS3+7_6=16_Kunstgriff QS0_0+8+2_0=10 für „0“_QS0+6_2=“8“_“5“ mit „16“_Summe 0+6+2=“8“_“5“ mit 16_8_5 für „PLC_PLCH1“=1685AS am Cofaktor „Calcium“=20E in der Spalte 2/0 [PLCH1 - Phosphoinositide phospholipase C - Homo sapiens (Human) | UniProtKB | UniProt]. Die 3. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_ PLCD4“=123AS erkennt kein Calcium und liegt neben „PIP2“ in der Spalte Z.38274#_(135)“606“0“/#_[7137]“0“8“2“/#_[2918]“3“[25] aufsteigend als QS6+0+6=12_Kunstgriff QS0_0+8+2=10 für „0“_“3“ mit „12“_Summe 0+3=“3“ für „PLC_PLCD4“=123AS [PLCD4 - Phospholipase C delta 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Die 4. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_ PLCG1“=132AS durchläuft Calcium unlesbar als „02“ ohne Cofaktor und liegt neben „PIP2“ in der Spalte Z.38273#_(55)[75]“2“/#_(135)“6“0“/#_“7“[1370] absteigend als QS7+6=“13“_QS0_2=“2“ für PLC_ PLCG1“=132AS [PLCG1 - Phospholipase C gamma 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die 5. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_ PLCB1“=33AS liegt aufsteigend nach links, daher ohne Cofaktor, neben „PIP2“ in der Spalte Z.38274#_#_(135)“6“[0]/#_7137[0] als QS7+13=20_QS6_7_13 mit Summe 20+13=33 für „PLC_ PLCB1“=33AS [PLCB1 - Phospholipase C beta 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die 6. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_ Q8N7X7“=403AS liegt nachgelagert ohne Cofaktor mit der Ziffer „3“ an der PIP2-Spalte (55)[7]/(135)/[71]“3“ in der Spalte Z.38275#_“3“7“0“8“[2]/#_[183]“25“ absteigend als QS25_7+0+8=40_3 für PLC_Q8N7X7“=403AS [Phosphoinositide phospholipase C - Homo sapiens (Human) | UniProtKB | UniProt]. Die 7. Modifikation, das Protein (Mensch) „Phosphoinositid-Phospholipase C_PLC_PLCD4“=794AS liegt neben dem Cofaktor „Calcium“ 2/0=20E in der Spalte Z.38273#_(55)“7“5“ /#_ (135)“6“ /#_“7“1“3“[7] als „7“_QS5+6=11=QS=2_7_QS1+3=“4“ mit „7“_Summe 2+7=“9“_“4“ als 7_9_4 für „PLC_PLCD4“=794AS [PLCD4 – Phosphoinositide phospholipase C – Homo sapiens (Human) | UniProtKB | UniProt].
„Hydrolyse“ von „PIP2“ durch „PLC“ zu „Inositoltrisphosphat (IP3)“ und „Diacylglycerol (DAG)“: Der Signalstoff Diacylglycerol (DAG) ist ein Glycerinderivat, das mit verschiedenen Fettsäureresten verestert wurde. In der Glycerin-Spalte Z.38275#_“37“082“76“0/#_(183)(25)[913] mit Glycerin=C3H8O3=18+8+24=50E als QS37_Wasserlücke QS0+8+2=10 für „0“_7+6 mit Summe 37+0+7+6=Glycerin=50E ist Cytidindiphosphat (CDP)=C9H15N3O11P2=54+15+21+88+30=208E vorhanden. „DAG“ wird in der Signalkaskade wieder zu „PIP2“ abgebaut. Cytidindiphosphat (CDP) als QS183+25=CDP=208E ist dabei ein Zwischenprodukt. Die Rückwandlung in „PIP2“ ist bereits enthalten, und zwar in Z.38276#_(18“3“)(„2“5“)„9“[13] als QS3+2=5_59 für PIP2=559E [Diacylglycerin - DocCheck Flexikon]. Das freigesetzte Signalmolekül „Inositol-1,4,5-trisphosphat (IP3)“=C6H15O15P3=36+15+120+45=216E besetzt in der Glycerin-Spalte den linken Zeilenrand Z.38275#[1]6147 als QS4+7=11=2_1_6 für IP3=216E. Die Bindung von „IP3“ an den IP3-Rezeptor am endoplasmatischen Retikulum (ER) führt zur Freisetzung von Calcium (Ca^2+) nach Öffnung eines assoziierten Calciumkanals. „Calcium“ wiederum agiert als Third Messenger in der Zelle [Inositol-1,4,5-trisphosphat - DocCheck Flexikon]. Das „ER“ ist im Zeilenbereich auf kurzem Wege erreichbar, so dass die Zahl 61 (in IP3-Leserichtung 16) bereits im IP3-Rezeptor=2671AS liegt, der durch die Serien-Randspalte #161/#161 windet, und zwar als QS1+1=2_6_QS6+1=7_1 mit 2_6_7_1 für IP3-Rezeptor=2671AS. Calcium=20E kann am Serien-Rand #1614 mit QS6+14=20E stets freigesetzt werden [ITPR3 - Inositol 1,4,5-trisphosphate receptor type 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLCD3_Phosphodiesterase delta-3“=789AS hydrolysiert „PIP2“ zu DAG und IP3. Hierzu wird mit der Ziffer „9“ PIP2 durchlaufen in der Spalte Z.38274#[16](14)“8“1“3“5“/#[16](14)“7“[713] als 7_8_QS1+3+5=9 mit 78_9 für PLCD3=789AS. Das Wasser speist sich aus QS1_1=2_QS4+4=8 mit H2O=28 (Symbol) [PLCD3 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase delta-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLCG1_Phosphodiesterase_ gamma-1“=1290AS vermittelt die Produktion der Botenstoffe DAG und IP3, indem ein Zeile vorgegeben wird, der „PIP2“ aufliegt, und zwar die Zeile Z.38275#[16]“1“47“7“13“70“[8] als 1_QS4+7=11=2_QS7+13=20_70 mit 12_Summe 20+70=90 als 12_90 für PLCG1=1290AS [PLCG1 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Ephrin Type-A Rezeptor: Das Protein (Mensch) „Ephrin type-A receptor 3_EPHA3“=983AS bevorzugt EFNA5=228AS als Ligand [„Highly promiscuous for ephrin-A ligands it binds preferentially EFNA5“]. Der Rezeptor startet rechts in Membranzeile Z.38270 und zieht dann aufsteigend seitlich an der Alternativposition von Ligand „EFNA5“ am rechten Zahlenrand vorbei, um eine L-Form zu erzeugen. In der Membranzeile entsteht somit ein Abstand zwischen Ligand (2. EFNA5-Position) und Rezeptor „EPHA3“. Mit diesem Seitenabstand zur lotrechten Mittelachse wird im Prinzip ein extrazellulärer Raum zwischen fremdem Zellen simuliert. „EPHA3“=983AS liegt 5-zeilig in der Spalte Z.38270#_{8234}[1]“74“xxx/#_[401]{4}[31]“4“xxx/#_[979467]“6“xxx/#_[557525]“7“{822=Ligand}/#_[81]“3“56060“xxx aufsteigend als QS7+4=11=QS=2_Kunstgriff QS4_6=10 für „0“_7_0 für vertikalen L-Schenkel mit Summe 2+0+7+0=“9“_6_QS0+5+6=11=QS=2_3 mit horizontaler L-Schenkel Summe 6+2=“8“_3 als 9_8_3 für „EPHA3-Rezeptor“=983AS. Dieser Endlage ist vertikal der Ligand in der Membranzeile vorgelagert. Die ATP-Bindung zieht nach der Startzeile seitlich mit, und zwar in der Spalte [1](74)/“3“1“(4)/“7“60“ als QS3+1_7=11=QS=“2“ _“60“ für ATP=260E. Die Fortführung ergibt die Umwandlung in ADP am Zeilenrand in der Spalte (60)[7]“2“/[7]“8“2“2“ mit „2“_“2“_QS8+2=10 für „0“ mit 22_0 für ADP=220E. Dabei wird die Alternativposition des Liganden verbraucht, der nunmehr an der Membran positioniert ist [EPHA3 - Ephrin type-A receptor 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EPHA2 - Ephrin type-A receptor 2“=976AS rundet die L-Ecke etwas aus und kann den horizontalen L-Schenkel um 1 Ziffer „1“ verbreitern. EPHA2-Rezeptor“=976AS aufsteigend als QS7+4=11=QS=2_Kunstgriff QS4_6=10 für „0“_7_0 für vertikalen L-Schenkel mit Summe 2+0+7+0=“9“_Eckausrundung QS2+5_0=“7“_ignoriert Endziffer „6“ und verlängert mit QS5+6=11=QS=2_3_1 mit „97“_Summe 2+3+1=“6“ als 97_6 für EPHA2-Rezeptor“=976AS [EPHA2 - Ephrin type-A receptor 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Transmembran-GPI-Transamidase-Komplex (GPI-TA): Ein Oberflächenprotein verfügt bereits über Merkmale, die zu einer Anbindung an die Zelloberfläche mittels GPI-Anker führen. Diese Bindung reicht bis in das endoplasmatische Retikulum (ER) und wird vom GPI-TA_Komplex katalysiert. Die Position des GPI-Ankers an der Membranzeile ist durch „GPAA1“ bestimmt. In dieser vertikalen Spalte werden die weiteren Untereinheiten PIGK, PIGU, PIGT, PIGS eingeordnet. Angenommen wird folgender Zusammenhang: Das Oberflächenprotein verfügt bereits über ein GPI-Anheftungssignalpeptid. Vom „ER“ der Wirtszelle geht eine „Transamidierungsreaktion“ aus, bei der ein vormontiertes „GPI“ der Wirtszelle das „GPI-Anheftungssignalpeptid“ ersetzt, wobei ein Carbonylzwischenprodukt entsteht. „PIGU“ kann wie „GPAA1“ im Bereich der Membranzeile festgestellt werden. PIGK, PIGT und PIGS sind erst am L-Schenkel des Eph-Rezeptors, d.h. im „ER“ zu finden.
Für „PIGU“ ist die Zugehörigkeit zum GPI-TA-Komplex über eine Verbindung zu „GPAA1“ mittels Antikörpern (Co-Immunpräzipitation) nicht nachweisbar, sondern erst mittels Verwendung von „Styrol-Maleinsäureanhydrid (SMA)-Copolymer“ [Investigation of the lipid environment of the mammalian transamidase complex - heiDOK (uni-heidelberg.de)]. „SMA“ enthält Maleinsäureanhydrid=C4H2O3=24+2+24=50E, das als Ligand seitlich am GPI-Anker mit QS1+49=50 liegt. Das Protein (Mensch) „PIGU“=435AS liegt seitlich weit entfernt als „43“_QS1+4=“5“ für „PIGU“=435AS. Der Ligand zeigt den Weg zur Alternativposition mit einer Links-Verschiebung zum GPI-Anker in der Spalte Z.38270#[16]{1}{49}“8“2“3“[4174]/#[16]{1}{49}“4“[0]“1“4“(3)(1)(4) als „4“_Kunstgriff QS8+2=10 für „0“_Spalte 3/1 mit „3“_QS1+4=“5“ als 43_5 für „PIGU“=435AS [PIGU - Phosphatidylinositol glycan anchor biosynthesis class U protein - Homo sapiens (Human) | UniProtKB | UniProt]. Die „3“ ER-Komplex-Teilnehmer „PIGK“, „PIGT“ und „PIGS“ müssen ihre Position im Zeilenlauf gegenseitig ohne Hilfsinformationen finden. Als Motiv wird ein Protein-Liebesspiel „33/66“ angenommen, weil „PIGK_Kurt“ und PIGT_Teutonia“ passend zusammenliegen. Diese Anordnung führt zunächst nicht zum Ziel, weil „Kurt“ keine Manneskraft „33“ erreicht, so dass „PIGS_Sigfried“ ins Spiel kommt. „Kurt“ wird herausgefordert und kann sein „33er Potenz-Problem“ lösen. Das Protein (Mensch) „PIGK_Kurt“=395AS liegt mittig zwischen „PIGS_Siegfried“ und „PIGT_Teutonia“ in der Spalte Z.38273#[16]14[8](5)(5)75/#[16]14[8](1)(3)56/#[16]1477(1)37/#[16]147(29)18 absteigend als „29“_über Spalte 3/1=QS=“4“_über Spalte 5/1=QS=“6“_“5“ mit Summe 29+4+6=39_5 für „PIGK_Kurt“=395AS. PIGK „Kurt“ kann funktionell eine Carboxyl-Gruppe=CO-Gruppe mit CO=6+8=14E über QS13+1=14E erzeugen und seine Potenz mit QS29+ Spalte 3/1=4=33 symbolhaft nachweisen. „Vermittelt die GPI-Verankerung im endoplasmatischen Retikulum, indem das C-terminale GPI-Bindungssignalpeptid eines Proteins durch ein vorassembliertes GPI ersetzt wird. Bei dieser Transamidierungsreaktion bildet die GPI-Transamidase mit dem Substratprotein ein Carbonylzwischenprodukt“ [PIGK - GPI-anchor transamidase - Homo sapiens (Human) | UniProtKB | UniProt]. Das begehrenswerte Protein (Mensch) „PIGT_Teutonia“=578AS liegt in der Spalte Z.38273#[16]14[8](5)(5)[7]“5“/#[16]14[8](1)(3)[5]“6“/#[16]1477(1)“37“/#[16]147(29)“18“Fortsetzung: Z.38270#[16]14982341/#[16]14940“1“4“3“/#[16]148979“4“6“, und zwar absteigend als QS18_37=55_QS6_5=11=QS=2 als Summe 55+2=“57“_Kunstgriff QS4+6=10 für „0“_QS3_1+4=“8“ (Membranzeile). Partnerin für „Kurt“ mit Spalte 56/37 als QS56+3+7=“66“. „Component of the GPI transamidase complex. Essential for transfer of GPI to proteins, particularly for formation of carbonyl intermediates“ [PIGT - GPI transamidase component PIG-T - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGS_Siegfried“=555AS baut am linken Serienrand #[16]14 von Z.38270–Z.38276 eine 7-zeilige Carboxyl-Transportstrecke aus Wiederholungen „CO=6+8=14E“ als „Beobachter-Leiter“ auf, und zwar als „1“_QS4+7=11=QS=“2“ für 1_2=“12“_5-fach QS1+4=5 mit Summe „25“_Ankerkontakt Spalte „seitlich=9/9“=QS=18_QS1+4=“5“ mit Summe 12+25+18=55_5 für „PIGS_Siegfried“=555AS. „Component of the GPI transamidase complex. Essential for transfer of GPI to proteins, particularly for formation of carbonyl intermediates“ [PIGS - GPI transamidase component PIG-S - Homo sapiens (Human) | UniProtKB | UniProt]. Im Ergebnis sitzt „PIGK_Kurt“ im „ER“, von dem links von PIGS_Siegfried und rechts von PIGT_Teutonia jeweils seitlich ein schmale Spalte zur Membranzeile absteigt, um den GPI-Anker dort in die Zange zu nehmen. Zwischen dieser Befestigung und dem „ER“ wird die Ankerachse vom GPI-TA-Komplex mittig in Z.38272#_979 mit seitlich=9_Form=7_9 nicht besetzt, so dass das angehängte Protein beweglich bleibt. „PIGK_Kurt“ und „PIGT_Teutonia“ sind über eine Disulfidbrücke „Schwefel=16_16“ verbunden. Die Kurt-Spalte ergibt QS2+9=11=QS2_1_13_QS5+5=10 für „0“ mit Summe 2+1+13+0=Schwefel=16. Im Kontaktbereich kann „Teutonia“ QS1+0=9=seitlich_Spalte [5]6/37 mit QS6_3+7=Schwefel=16 für eine Brückenbindung nachweisen. „PIGS ist eine unverzichtbare Untereinheit der GPI-TA-Aktivität, ihre Rolle ist jedoch unklar.“ [Funktionelle Analyse des GPI-Transamidase-Komplexes durch Screening auf Aminosäuremutationen in jeder Untereinheit – PMC (www-ncbi-nlm-nih-gov.translate.goog); T. Kato; Sep.2021; doi: 10.3390/molecules26185462]. Ohne PIGU zeigen die anderen Untereinheiten (PIGK, GPAA1, PIGT und PIGS) keine Aktivität. „PIGU“ ist mit PIGW und PIGM homolog, so dass PIGU den Lipidanteil von GPI erkennt. Das Protein (Mensch) „PIGM“=423AS liegt in der Membran neben der Endziffer „4“ von „PIGT“ in der Spalte Z.38270#161498“2“3“{41}/16149“4“0“[14]{3} absteigend als „4“_Spalte 2/0=QS=2_3 mit 4_2_3 für „PIGM“=423AS. Mannosyltransferase: Überträgt die erste alpha-1,4-Mannose während der GPI-Vorläuferassemblierung auf Glucosaminyl(acyl)phosphatidylinositol (GlcN-Acyl-PI)“[PIGM - GPI mannosyltransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Zucker „Mannose“=C6H12O6=36+12+48=96E kann mit der links angrenzenden Ziffer „9“ als 9_QS4_0+2=6 mit 96E gebildet werden. Die Ziffer „4“ gehört zur Spalte 8/4=Schwerachse=84. Der Anteil der Ziffer „6“ wird nach links gespiegelt als 9_QS4_Spalte 1/1=6 für 96E. „PIGM“=423AS zählt sich mit denselben Ziffern umgekehrt als QS2+3=5_0_4 für PIGW=504AS. Darin ist die Ziffer „0“ ein geeigneter Inertolring, der von „PIGW“ entfernt wird [PIGW - Phosphatidylinositol-glycan biosynthesis class W protein - Homo sapiens (Human) | UniProtKB | UniProt]. Der linke Zeilenrand, an dem „PIGS“ als Spalte entlang zieht, ist als Rückgrat für Glykosylphosphatidylinositol (GPIs) im GPI-Anker als Struktur „EtNP-6Manα-2Manα-6Manα-4GlNα-6myo-Inositol-P-Lipid“ geeignet. [Thematische Übersichtsreihe: Glycosylphosphatidylinositol (GPI) Anker: Biochemie und Zellbiologie: Biosynthese von GPI-verankerten Proteinen: besonderer Schwerpunkt auf GPI-Lipidumbau - PMC (nih.gov); M.FuJita;Ja. 2016; doi: 10.1194/jlr. R063313]. Das Protein (Mensch) „PIGB“=554AS wandelt die an den Rand gespiegelte Mannose in „Man2-GlcN-acyl-PI“ um. „PIGB“ bindet an „PIGM“ in der Randspalte Z.38270#[16]“1“4“98/#1614940 als QS1+4=5_QS1+49=50_4 mit Summe 5+50=55_4 für „PIGB“=554AS, womit insgesamt Membran und „ER“ im Ring verbunden sind [PIGB - GPI mannosyltransferase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „PIGA“=484AS ist als 1. Schritt an der Erzeugung vom Phosphatidylinositol beteiligt. UDP-Glucose=C15H24N2O17P2=90+24+14+136+30=294E liegt mit „29“ in PIGK_Kurt und „4“ als Spalte 3/1 in PIGT_Teutonia, so dass sich PIGA in der Kurt-Spalte als QS5+5_1_7+1=19_29=48_ in der Teutonia Spalte 3/1=4 mit 48_4 für „PIGA“=484AS ergibt [PIGA - Phosphatidylinositol N-acetylglucosaminyltransferase subunit A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGC“=297AS ist die Gegenbewegung zu „PIGA“ aus der Basis von PIGT zu PIGK mit QS18_1+3+7 =29_7 für „PIGC“=297AS [PIGC - Phosphatidylinositol N-acetylglucosaminyltransferase subunit C - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGO“=1089AS überträgt Ethanolaminphosphat=C2H8NO4P=12+8+7+32+15=74E [KEGG VERBINDUNG: C00346 (genome.jp)] auf die 3. Mannose, die den GPI-Anker an ein Protein bindet. Ethanolaminphosphat liegt in der Spalte Z.38271#[16149](4)(0)(1)/#[161489](7)(9) als „7“_QS9_1=10 für 0_0_4 mit „7“_Summe 0+0+4=“4“ für 74E. Der GPI-Anker liegt links, so dass mehrere Proteine in 3 Mannose-Schritten sich in einer Reihenfolge beim Transport unterstützen. PIGO=1089AS liegt weit links am Anker, und zwar in der Spalte Z.38270#_[1614]“98“2“3“/[1614]“9““(4)““(0)“(1)“/#[161489](7)(9) als 98+QS2+3_4+0+1=10 mit Summe 98+10=108_9 für PIGO=1089AS [PIGO - GPI ethanolamine phosphate transferase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGF“=219AS liegt im 3. Schritt ebenfalls weit links in der Spalte Z.38270#[1614]“9“8“/#_[16149]“4“/#_[16148]“9“ als 9_Spalte 8/4/9 mit Summe 9+8+4=“21“_“9“ für „PIGF“=219AS [PIGF - Phosphatidylinositol-glycan biosynthesis class F protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGG“=983AS liegt in der Spalte Z.38270#[1614982]“3“/#_[161494]“0“1“/#_[161489]“7“9“ absteigend als „9“_QS7+0+1=“8“_“3“ mit 9_8_3 für PIGG“=983AS [PIGG - GPI ethanolamine phosphate transferase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PIGN“=931AS liegt in der Spalte Z.38270#[16149]“8“2“[3]/#[16149]“4“0“1“/#[16148]“9“7“[9] absteigend über Zahl „97“ nach links mit 7_9 für 79_4_ QS8+2_0=10_“1“ mit Summe 79+4+10=“93“_“1“ für „PIGN“=931AS (alternativ mit lesbarer „79“ und die bereits gezählte Null kreuzen - doppelt gezählt) [PIGN - GPI ethanolamine phosphate transferase 1 - Homo sapiens (Human) | UniProtKB | UniProt].
ER-Lumen: Die Endozytose findet an der Zellmembran statt. Doppeldeutig wird die Membranzeile Z.38270 auch verwendet, um die ER-Membran vom inneren ER-Lumen abzugrenzen. Im ER-Lumen werden Proteine auf Fehlfaltungen geprüft. Außerhalb der ER-Membran liegt das Cytoplasma der Zelle, dessen Inhalt als Cytosol bezeichnet wird. Das Cytoplasma ist von der Zellmembran umgeben. Bei der Biosynthese von Proteinen wird N-Acetylglucosamin (GlcNAc) [Derivat der Glucose]= C8H15NO6=48+15+7+36=106E verwendet. „GlcNAc“ ist in der Hyaluronsäure enthalten, die einerseits einen mathematischen Zugang zum Auge und andererseits zum Gewebe bildet, das mit der Krebserkrankung verbunden ist. Die korrekte Faltung der Glykoproteine wird vom Komplex „EROC“ und der ER-assoziierte Abbau vom Komplex „ERAD“ für eine stabile „Glykoproteostase“ organisiert. Als Kontrollmaßstab dient die BiXnom-Schwerachse=84 in der Spalte Z.38270/#_3“4“1/#_1“4“3/#_9“4“6 als Vertikalachse mit QS4+4=8_4 für Schwerachse=84. Das Kontrollprotein (Mensch) „UGGT2“=1615AS erkennt bereits geringe Fehlfaltungen, wobei sich die Zahl „16“ aus 4-fach Ziffer „4“ mit 4*4=16 bildet. Weil die Achse 4/4/4 links von 3/1=QS=4 und rechts von 1/3=QS=4 umfasst wird, muss die letzte Ziffer „4“ in der Spalte 4/4/{4} als überschüssige Ziffer {4} mittels einer Schleifen-Zählung, nach links beginnend, umgangen werden. Anschließend wird die Zahl „15“ in 16“15“AS im ER mit den Cofaktoren „Calcium“=20E und „Mangan“=25E an der Calcium-Spalte Z.38273#_25/0[6] beim Durchlauf tangiert. „UGGT2“=1615AS liegt in der Spalte Z.38270#_“3“4“1“[7]/#_“1“4“3“[1]/#_[94]“6“[7]/#_[7]“5“2“{5}/#_“5“6“{0}[6], und zwar als QS3+4+1=8_QS1+4+3=8 mit Summe 8+8=“16“_Spalte [94]“6“[7]/[7]52{5 zu Mangan=25}/“5“6"{0 zu Calcium=20}[6] mit Spalte 6/2=QS=8_Spalte 5/6=QS=11=QS=2_5 mit „16“_Summe 8+2+5=15 als 16_15 für „UGGT2“=1615AS. Der ausgeklammerten Ziffer „4“ liegt seitlich die Kontrollspalte 23/01/79 mit QS3_0+1_7=11=QS=2_9 an, so dass UDP-Glucose=C15H24N2O17P2=90+24+14+136+30=294E vorhanden ist [UGGT2 - UDP-glucose:glycoprotein glucosyltransferase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Aufgrund von Fehlfaltungen fehlen den Krebszellen Nährstoffe und ihre Proteinsynthese ist gestört. Die Expression von Komponenten des Kontrollsystems können sich nur auch eine Krebsart beziehen oder eine gegensätzliche Prognose bedeuten. UGGT2 gibt als Krebsmarker eine ungünstige Prognose bei Lungen- und Leberkrebs, das UGGT1 dagegen bei Nierenkrebs. Das Kontrollprotein (Mensch) „UGGT1“=1555AS kompensiert Asymmetrien von „UGGT2“. Die Pegelzählung nach links gewinnt zusätzlich die Ziffer „2“ und verliert nachfolgend die Ziffer „3“. Das Protein ist im Membrananteil mit „15“ statt „16“ um 1 AS kürzer, so dass der Mittelwert für die Kontrolle der BiXnom-Schwerachse 50%/50% beträgt. Im ER-Anteil erfolgt eine 90°-Korrektur, in dem QS5+6=11=QS=2 nicht vertikal aus der Spalte 5/6, sondern folgend horizontal aus der Zeile 5_6 erzeugt wird. Fehlfaltungen werden vom Protein „Calreticulin“ =3“84“AS erkannt, dass die Schwerachse=84 bereits lesbar enthält [CALR3 - Calreticulin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. „UGGT1“=1555AS liegt in der Spalte Z.38270#_“2“3“4“1“[7]/#_“0“1“4“[31]/#_[79]“46“[7]/#_[57]“5“2“{5 zu Mangan=25}/#_[3]“5“6“{0 zu Calcium=20}[6] mit QS2+3+4+1=10_QS0+1+4=5 als Summe 10+5=“15“_QS46_5+2=53_QS5+6=11=QS=2 mit „15“_Summe 53+2=55 als 15_55 für UGGT1“=1555AS [UGGT1 - UDP-glucose:glycoprotein glucosyltransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „Sep15_Selenoprotein F“=165AS kompensiert Asymmetrien bei der Qualitätskontrolle, indem mit Selen=34E die Membran-Achse in der Spalte „34“1/1“43“ mit QS3+4+1_1+4+3=8=“16“ ausgezählt wird. In der Spalte [9]“4“6“/[7]“5“[2] folgt der Kunstgriff QS4+6=10 für „0“ und die Ziffer_“5=Struktur“ (Cofaktor unnötig) [SELENOF - Selenoprotein F - Homo sapiens (Human) | UniProtKB | UniProt]. Das Kontrollprotein „MOGS“ gibt als Marker eine ungünstige Prognose bei Nieren-, Leber – und Darmkrebs [Modulation von ERQC und ERAD: Ein Breitspektrum-Spanner in der Arbeit von Krebszellen? -PMC (nih.gov); P. Roversi u.a, Okt. 2019. doi: 10.1155/2019/8384913]. Das Protein (Mensch) „MOGS“=837AS spannt sich aufgrund seiner komplizierten Funktion als Kette von der Aminosäure „Asparagin (N/Asn)=C4H8N2O3=24+8+14+24=70E als Spalte 3[1]/67 mit QS3+67=“70“ bis zum Wasser (H2O)=28(Symbol) in der Randspalte Z.38271#_“3“1“4“8“[2]{4}/#_“67“[6]“0“7“{2}/#_[2578]{2}{2}, und zwar als QS67_3=70 (Asn)_QS1+4+8=13 mit Summe 70+13=“83“_zieht in Darmspalte „808“ seitlich zur Ziffer „7“ mit QS0+7=“7“ als 83_7 für „MOGS“=837AS. Wasser (H2O) wird oben und unten gespiegelt mit „82“ negiert und muss am Rand korrekt erkannt werden, in der Randspalte 24/72/22 als 2_QS2_2_4=8 für H2O=28(Symbol) [MOGS - Mannosyl-oligosaccharide glucosidase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Calnexin_CALX“=592AS ergibt ein günstige Prognose bei Darmkrebs, ist aber ein ungünstiger Marker bei Schilddrüsenkrebs. „Calnexin“ wird vom Ligand „Calcium“=20E in der Calcium-Spalte mit einem günstigen Ende und Ubiqitin=76AS mit dem Protein-Abbau am anderen Ende im „ubiquitin-dependent ERAD pathway“ bogenförmig seitlich begrenzt. Ubiquitin=76AS begrenzt die Endziffer „2“ nochmals am Zeilenrand. „Calnexin“=592AS liegt mit den beiden äußeren Führungen in der Spalte Z.38272#_[6]{76}[072]/#_{2}“5“7“8“2“2/#_{0}“6“0“[0]“5“7/#_[08]“2“[76]0, und zwar bogenförmig absteigend als „5“_über Spalte 2/5 mit Kunstgriff QS8+2=10 für „0“_passiert innenseitig die Ecke „Ubiquitin=76/20=Calcium“ mit 7_QS5_6=11=QS=2_0 mit „5“_Summe 0+7+2+0=“9“_“2“ als 5_9_2 für „Calnexin“=592AS. Der Darm „808“ wird kreisförmig in einer Ringspalte 060/082 mit QS2_0_6=8_08 für Darm=“808“ adressiert. Die Darmspalte liegt funktionell exakt im Koordinatensystem UGGT1/UGGT2 mit den horizontalen- und vertikalen Zählgrößen QS5+6=11. „Calnexin“ zeigt das Gleichgewicht und damit die Heilung bei Darmkrebs an. Diese Perfektion erzeugt eine abseits liegende „Lochspalte“ Z.38270#_0/#_8/#_0/#_8_/#0_quer „060“ bis zum Messpunkt. Die „Schilddrüse“ senkt sich mathematisch aus einer langen Ziffernspalte von einem embryonalen „Zungenloch“ zum „Kehlkopf“ herunter. Statt einer durchgehenden Ziffernfolge ist hier eine Lochreihe dargestellt, die den Bezug zum Zungenloch und somit zur „Schilddrüse“ herstellt. Das Schilddrüsenhormon „Thyroxin (T4)“=C15H11I4NO4=352E mit Jod=53E ist das Prohormon zu „Trijodthyronin (T3)“=C15H12I3NO4=90+12+159+7+32=300E. Das hochwirksame T3=300E zieht als Spalte durch Messpunkt 30“0“. Das notwendige Jod=53E kommt vom Rand der Lochspalte mit QS0+9+6=15_QS8_0_8_0=16_Schleife über Spalte 60/“8“2“ mit QS8+2=10_QS6_“0“=Messpunkt_6=12 mit Summe 15+16+10+12=Jod=53E herein. T3=300E wird in der Spalte absteigend (umgekehrt) gezählt und parallel ergibt die Spalte „0“6/“0“8“/“3“[2] in dieser Leserichtung den TOKEN=86 für die korrekte Verdauungsrichtung im Darm, die auch über die Lochspalte zum Messpunkt einläuft.
Das Protein (Mensch) „GLU2B_P14314“=528AS ist ein Merkmal für eine ungünstige Prognose bei Nierenkrebs. Der Harnweg „303“ ist in keiner Spalte lesbar, sitzt in der Membran aber exakt auf der Schwerachse in der Spalte „3“41/“14“3“ absteigend mit „3“_QS1+4_4+1=10 für „0“_“3“ mit 3_0_3 für „Harnweg“=303. „GLU2B“ muss Calcium als Ligand seitlich passieren. Vom „ER“ kommend kann der Harnweg=“303“ nochmals in Gegenrichtung gespiegelt werden, wobei mit Calcium=13+7=20 ein weiterer Ligand für „GLU2B“ vorliegt. Harnweg „303“ ab Z.38275#_137 mit QS13+7=20_Spalte 5/6 (neben Calcium 2/0)=QS=11=QS=2_4_Zahl „43“ getrennt 4_3 mit Summe 20+2+4+4=30_3 mit für Harnweg=„303“. „GLUB2B“ ab Ziffer „1“ als Schleife über Spalte Z.38270#_“2“34“1“/#_“0“1“[4]“3“/#_[79]“4“6“/#_[57]“5“(2)/#_“3“5“6“(0)/#_(13)(7)[0] als QS0+1_2=3_QS3+4=7_Spalte 1/3=QS=4 mit „3“_Summe 7+4=11=QS=2 als Summe 3+2=“5“_Kunstgriff QS4+6=10 für „0“_Spalte 5/6 (neben Calcium 2/0)=QS=11=QS=“2“_QS3+5=“8“ als „5“_Summe 0+2=“2“_“8“ mit 5_2_8 für „GLU2B“=528AS. Calcium=20E liegt mit 2/0 und 13+7=20 zweifach seitlich und wird beim Start in der Spalte 2/0 direkt verwendet [PRKCSH - Glucosidase 2 subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. „GLUB2B“ beginnt etwas asymmetrisch und aktiviert UGGT1, das ebenfalls eine ungünstige Prognose bei Nierenkrebs bedeutet.
Das Protein (Mensch) „Calreticulin_CALR“=417AS ist ebenfalls ungünstig bei Nierenkrebs (renal cancer), aber gibt bei Eierstockkrebs (ovarian cancer) ein günstige Prognose. Der Eileiterweg „606“ enthält mit der Ziffer „0“ den Koordinatenmesspunkt, so dass eine günstige Messung bestätigt, weil CALR am Weg „606“ liegt. „CALR“ liegt in der Spalte Z.38274#_[1]“35“6“[06]/#_[713]“7“[08] als QS35+6=41_7 für „CALR“= 417AS. Seitlich können verschiedene Liganden gezählt werden mit QS5+25=Zink=30E, Calcium= 2/0=20E, Eisen mit Spalte 2[5]/06 als QS2+0=2_6 für Eisen=26E. Der Harnweg „303“ ergibt einen Ring, und zwar in der Spalte 1356/7137 über die Spalte 6/7 als QS6+7=13_3+5=8_QS1_7+1=9_3 mit Summe 13+8+9=30_3 für Harnweg=303AS. Der Harnweg läuft kreisförmig durch „CALR“ mit Bezug zum Nierenkrebs.
Das Protein (Mensch) „MA1B1_Q9UKM7“=699AS ist an der Qualitätskontrolle (EROC) von Glykoproteinen beteiligt und gibt bei Leberkrebs (liver cancer) eine ungünstige Prognose. Die Zahl „99“ ist als Membranspalte „9/9“ bereits lesbar. Für die Katalyse liegt Wasser „28“ unbrauchbar nur gespiegelt mit „82“ vor, so dass mit 4-fach Wasser 4*28=112E gerechnet wird, das anliegend in #[16]“14“98“[23] QS14+98=112E verfügbar ist. „MA1B1“ wird absteigend über QS=2 (aus QS=11 aus 7+4)¬¬ _0 _4_ 99 gebildet. Für die Calcium-Bindung aus der Membranspalte 2/0=Calcium=20 wird die Ziffer „2“ im Kunstgriff QS8+“2“=10 für „0“ verwendet, und die Calcium-Null nur alternativ genutzt. In der Spalte Z.38270#_“9“82{3}/#_“9“{40}{1}/#_8979 als „40“_QS3+1=“4“ mit 40_4= „404“ ist über einen Zusammenhang mit dem Gallengang „404“ und ein Bezug zur Leber möglich. „MA1B1“ bleibt inaktiv, wenn die Schlusszahl „7“ beim Durchlauf durch die Calcium-„0“(Null) angehängt wird, dagegen ist die Zählweise nach rechts mit QS4+3=7 eine aktive Form, weil die Ziffer „4“ in der Schwerachse (Messachse) liegt. Eine Disulfid-Bindung liegt dort vor, weil der Block „34174/14314“ als Schwefel=16_16 ausgezählt wird, und zwar mit QS1+4+3=8_QS3+4+1=8 mit Summe 8+8=16_QS7+4=11=QS=2_14 mit Summe 2+14=16 für Bindung „16-16“. „MA1B1“ als QS4+3=7_Spalte 3/1=QS=4 mit Summe 7+4=11=QS=2_Kunstgriff 8+2=10 für „0“_4 mit QS0+4=“4“ als Summe 2+4=“6“_“9“_“9“ für „MA1B1“=699AS [MAN1B1 - Endoplasmic reticulum mannosyl-oligosaccharide 1,2-alpha-mannosidase - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein EDEM1=657AS ist in der ER-Membran eingebaut und liegt in der Spalte Z.38270#_“49“8“2“3“4“1“7“[4]/#_[494(0)1]“4“3“[14], und zwar gespiegelt QS49+8=57 gezählt und die Zahl 6 entweder aus Spalte 23/01 mit QS2+3_1=6 gezählt oder alternativ verlängert, um Ubiqitin für den Proteinabbau (ERAD-System) einzubauen. Ziffer „6“ aus 2_QS3+4_4=11=QS=2_3_1+7=11=QS=2 mit Summe 2+2+2=“6“ mit gespiegelt 57_6 für EDEM1=657AS. Von der Calcium-Spalte 2/0=20E wird die Ziffer „2“ als Bindung verwendet[EDEM1 - ER degradation-enhancing alpha-mannosidase-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein EDEM3=932AS ist bis auf die Ziffer 1 in 3“1“ in EDEM1 enthalten. EDEM3 besitzt den Cofaktor „Calcium“=2/0=20E und beginnt mit QS2+3+4=9_Spalte 1[7)/31 mit QS1+31=32 als 9_32 für EDEM3=932AS [EDEM3 - ER degradation-enhancing alpha-mannosidase-like protein 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein EDEM2=578AS beginnt an der Calcium-Spalte in Randspalte Z.38270#_“2“34174096/#_(0)14314824 als QS2+3=“5“_QS4+1=5_QS3+1_7=11=QS=2 mit „5“_Summe 5+2=“7“_QS4+4=“8“ als 5_7_8 für EDEM2=578AS. Bei Nierenkrebs wird EDEM2 und EDM3 bei ungünstiger Prognose überexprimiert. Der Harnweg „303“ in der Spalte „3“[41]/“1“[4]“3“/“9“46“ mit 3_QS1_9=10 für „0“_QS4+6=10 für 0_3 mit 30_Summe 0+ 3=“3“ für Harnweg=“303“ wird von den Proteinen durchlaufen. EDEM1 zieht dagegen nach links und ist selbst vom Abbau durch ERAD betroffen [EDEM2 - ER degradation-enhancing alpha-mannosidase-like protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „EDEM1“ bildet einen Komplex mit „SEIL1“, das mit „SYVN1“ verbunden ist. „SYVN1“ benötigt Ubiquitin, das aber nur spezifisch vom Protein (Mensch) „UBE2G2“=165AS stammt. Das spezielle Ubiquitin={76}AS liegt zweizeilig in der Membranspalte Z.38270#[“8“](2){34}{1}{7}(4)(0)/#_[401]{4}{3}[„1“4“](8) als „7“_Spalte 1/3=QS=4_Spalte 34/[1]4=QS=11=QS=2 mit „7“_Summe 4+2=“6“ für Ubiquitin=76AS. Die ATP-Bindung mit ATP=260E startet aus der Calcium-Spalte „2“/0, gefolgt von der speziellen Ziffer „6“. Die Ziffer „7“ wird zu QS7+4=11=QS=2 weiterverarbeitet und über Spalte 0/8 Summe 2+0+8=10 für „0“ für 26_0 für ATP=260E verwendet. „UBE2G2“=165AS liegt in der Spalte Z.38270#_“4“1“74“[0]/_[43]“14“[8] und übernimmt die freie Zahl „14“ für „14"_QS7+4=11=QS=2 mit Summe 14+2=16_QS4+1=5 für „UBE2G2“=165AS. Das Protein reagiert künstlich im Labor auf Lysin=80E, das seitlich als Spalte 0/8 anliegt [UBE2G2 - Ubiquitin-conjugating enzyme E2 G2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SYVN1“=617AS liegt an der Lysin-Spalte 8/0 und an der Endzahl „7“ ist eine Zink-Bindung über die Randspalte Z.38270#_[9]6/#_24 mit QS6+24=Zink=30E vorhanden. Als Monomer „SYVN1“=617AS wird kein besonderes Ubiquitin=76AS durchlaufen, sondern die lesbare Zahl „76“ in der Spalte Z.38271#_[31]“48“[24]/#[6]“7“6“0“7“[2] als QS7+6=13_48 mit Summe 13+48=“61“_QS0+7=“7“ mit 61_7 für „SYVN1“=617AS (Monomer). Um die Membranzeile zu erreichen, wird gespiegelt eine Dopplung als „Homodimer“ gezählt, und zwar in der Spalte Z.38270#_[2]“3“4“[174096]/#_“0“1“4“3“[14824]/#_“7“[94]“6“[76072] über Spalte 43/[4]6 mit QS6_4+3=13_Spalte 34/14 mit 4_QS3+4_1=8 mit 4_8 für 48 als Summe 13+48=“61“_QS0_7=“7“ mit 61_7 für „SYVN1“=617AS (Homodimer). Das Protein baut das „ER“ selbst und ungefaltete Proteine ab. Es wird in Lymphknoten und 25 Geweben exprimiert. Was ist Synoviolin? Synovium oder „Stratum synoviale“ ist ein spezielles Bindegewebe am Synovialgelenk und Sehnenscheide. Für Gelenke bildet die Hyaluronsäure=C14H21O11N=84+21+88+7=200E einen Zusammenhang. Hyaluronsäure in der Randspalte Z.38270#“1“[740]“96“/3“14“82“4“ über Spalte 1/3=QS=4_QS14+82=96_QS4_96=100 mit Summe 4+96+100=Hyaluronsäure=200E. Lymphknoten bilden eine Kette aus Zählgrößen „11“, die als „111“ in der Randspalte mit QS7+4=11_Knotensymbol=“0“_QS96_4 mit Summe 11+“0“+100=Lymphknoten-Kette symbolisiert ist [SYVN1 - E3 ubiquitin-protein ligase synoviolin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SEIL1“=794E liegt seitlich an der Calcium-Spalte Z.38270#_[2]“3“/#_[0]“1“/#_“7“9“ absteigend als „7“_“9_QS1+3=“4“ mit 79_4 für „SEIL1“=794E. Verbessert die Stabilität von „SYVN1“ und ist an der „LPL“-Reifung und –Sekretion beteiligt. Ist für die Funktion der Bauchspeicheldrüse (Pankreas) erforderlich. In der sehr schmalen Spalte muss irgendein Bezug zur „Pankreas“ vorliegen. Grundsätzlich muss die Nähe zum Zwölffingerdarm (Duodenum; Länge 25 bis 30 cm am Magenausgang) symbolisiert werden. Hierfür ist scherzhaft die Zahl „12“ als QS1_Anschlusskanal=0_2=12(Symbol) enthalten. Realistisch ist dagegen ein Kreis=64, weil der Drüsenkopf im Bogen vom „Duodenum“ liegt, und zwar in der Spalte [8]“2“3“/“4“0“1“ mit QS4_“0“=Drüsenkopf_2=“6“_Spalte 3/1=QS=“4“ mit 6_4 für Kreis=64 für Drüsenkopf am Darmbogen [SEL1L - Protein sel-1 homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Lipoprotein Lipase_LPL“=475AS liegt in der Calcium-Spalte Z.38270#_[8]“2“3“[4]/#_“4“0“1“[4]/#_97“9“[4] über Spalte [8]/4 mit „4“_QS0_7=“7“_QS9_1=10 für „0“_QS2+3=5 mit 47_Summe 0+5=“5“ für 475AS mit Calcium-Bindung in Spalte 2/0=Calcium=20E [LPL - Lipoprotein lipase - Homo sapiens (Human) | UniProtKB | UniProt]._dat28.09.2023
Physik-Serie #1613: Die Serie kombiniert die Zählgröße „11“ mit der Zahl „63“=Physik. „Physik“ bezieht sich auf die BiXnom-Gravitationsmatrix mit 7*9=63 BiXnom-Lichtkugeln. „Lichtkugeln“ bilden ihren Radius aus einer Differenz von Geometrie und Lichtgeschwindigkeit, wobei die Lichtgeschwindigkeit ebenfalls eine geometrische Größe ist, wenn der Beobachter der Bewegung folgt. Ein gleichwertiger Betrachtungsmodus aus den Besonderheiten des Sonnensystems im Goldenen Schnitt ist jedoch unbekannt. Die Zahl „64“=Biologie entsteht aufgrund der Linsenkrümmung, die Platz für eine zusätzliche Kugel spiegelbildlich bietet. Die „64“ ist stets auffällig, wird dann aber am Fuß des Elefanten ausreichend als Kreis sichtbar. Die Biologie=64 ruft die Physik=63 im Bedarfsfall auf. Nur was existiert, kann bewegt werden. Die Physik ist blind und kennt die Bedeutung der Kunstform „64“ nicht. Die „64“ ist nur in der Z.38306 vertreten, die die Zahl „63“, gespiegelt in Z.xx“306“, als Physik andeutet. Die Zahl „64“ wird möglichst unlesbar als 6-4 gesprengt, wird aber für eine „Welle“ funktionell benötigt. Die Serie wird mit bekannten Aktivitäten besetzt. Eine Stapelung mehrerer unterschiedlicher Prozesse ist zurzeit nicht bekannt.
Darmmotilität: Mit einer Kombination von Darm „808“ und Membran „33“ als „38083“ muss die Evolution die Darmbewegung (Motilität, Darmperistaltik, intestinal peristalsis) erfinden. Schrittmacherzellen (Cajal-Zelle) erzeugen langsame Potenzialwellen (slow waves) im Sekunden- oder Minutenrhythmus. Der Nahrungsaufnahme folgen lokale ringförmige Kontraktionswellen [Darmperistaltik - Lexikon der Ernährung (spektrum.de)]. Die im Darm „80“8 funktionell gebundene Zahl „80“ wird nicht als Winkel „80°“ mitgezählt. Der aktive Bereich zählt sich dann als Code-Winkelsumme von Z.38294-Z.38302 mit QS70+80+80+100[0]+30=360° (Kreislauf). Es folgen 2 Zeilen, die einen Zusammenhang als Spaltenwinkelsumme=90+90=180° ergeben. Eine Zeitbasis=60 fehlt und muss aus dem Muskel „55“ in „555“ mit QS55+5=60 zusammengesetzt werden. Die Zeitbasis für die Minutenzählung mit Zeitbasis 3600 Sek= 1 Stunde umklammert den Muskel {55}“5“ in der Zeitbasis „60“ und zieht mit einem Kunstgriff durch den Darm, weil die Endziffer „8“ unbestimmbar beidseitig als [8]“0“[8] anliegt und ignoriert wird. Zeitbasis „3600“ in der Randspalte Z.38294#_“8“3“7“[9972]/#_[38]“0“[8399]/#_[94]“5“[69]“3“[1]/#_[53]“2“{55}“5“1“/#_[14]“1“42“42“ über Spalte 3/5 mit „3“_QS5+1=“6“ für „36“_QS42+42=84_Spalte 5/2/1=QS=8_Kunstgriff QS 0(Darm)_7+3=10 für „0“_8 mit QS0+8=“8“ als „36“_Summe 84+8+8=“100“ als Kunstgriff für „00“ und somit 5-zeilig „36_00“ für Zeitbasis „3600“ (Minutenzählung). „Cajal-Zellen“ vermitteln eine Schrittmacherfunktion. Vom Auerbach-Plexus (Plexus myentericus) wird ein Schwellenpotential= „-40mV“ stimuliert, das am Zahlenrand ab der Startziffer „3“ der Zeitbasis 3600 gezählt wird, und zwar als QS31_1_2_6=“40“. Mit Winkel 1°= 1mV und abwärts auf der Y-Achse sind es „-40mV“. Im Gastrointestinaltrakt liegt der „Plexus myentericus“ in der „Tunica muscularis“ zwischen der longitudinalen und zirkulären Muskulatur der Darmwand. Die Spalte Z.38298#_161414242/#_947722986 muss nunmehr eine Welle erzeugen, die als Spalte 6/4=Kreis=64 avisiert ist. Am Zahlenrand liegt die Ziffer „6“, so dass die Welle nach links zur Ziffer „4“ über den 2-teiligen Weg QS77+22=“99“_QS“98“ zurückläuft. Die „Slow Waves“ entstehen, wenn die beiden Randziffern der Strecke „4…6“ zusammenfinden. Hierfür ziehen die beiden Anteile jeweils die Defizit-Ziffer „1 bzw. „2“ additiv aus einer Spalte zusammen, so dass mit 2 Kunstgriffen 10 für „0“ zur Kontraktion auf „0“(Null) wandert und schrumpft. 1. Kunstgriff mit QS=99+1(aus „1“/77)=100 für „0“ und 2. Kunstgriff mit QS=2 (aus „2“/98) +98=100 für „0“. Die Spalte „16/94“ liefert nunmehr für das Aktionspotential QS16+4=Calcium=20, mit QS1+6=Nerv=7 und Form=7 für die Welle sowie QS1+9=“10“ für den „Vagus-Nerv=“10.“ Hirnnerv“ zur Steuerung innerer Organe. Zugleich ist der Neurotransmitter „Serotonin“=C10H12N2O=60+12+14+8=94E lesbar. Über „Gap Junctions“ wird das Aktionspotential auf die Muskelzellen übertragen [Cajal-Zelle (Gastrointestinaltrakt) - DocCheck Flexikon]. Zu diesem Zweck nimmt das Protein (Mensch) „5-HT4-Rezeptor“=388AS das Serotonin „94“ auf und startet neben dem Muskel „55“ in der Spalte Z.38297#_[3753]“2“5“5“[51]/#_[1]“6“1“4“[14242]/#_“94“[7722986] aufsteigend als Spalte 2/1=QS=“3“_QS61+4=65_QS9+3=13_QS7+3=10 mit „3“_Summe 65+13+10=“88“ mit 3_88 für „5-HT4-Rezeptor“=388AS. Das lesbare „Serotonin“ wird verbraucht und dient der Zielfindung. Für den „Rezeptor“ wird das Serotonin am Ende seitlich in der Spalte Z.38299#_[94]“7“7“2“2“/(73)“4“[251] über den Nerv „7“ neu erzeugt und in die Welle (slow waves) geleitet, und zwar absteigend als Spalte 7/4=QS=11=QS=2_7_QS2+2=4 mit Summe 2+7=9_4 für „Serotonin“=94. Das Serotonin wechselt somit die Position „in/out“ der Welle [HTR4 - 5-hydroxytryptamine receptor 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Verbindung mit der Darmwand (Membran „33“) bilden die Geschmacksrezeptoren „TAS1R2 /TAS1R3“ ein Heterodimer. Analog zur Süße auf der Zunge reagiert „TAS1R3“ im enterischen Nervensystem auf die Glucose, um die Sekretion von Insulin und anderen Hormonen zu regulieren. Das Protein (Mensch) „Geschmacksrezeptor „TAS1R3“=852AS schmeckt sich durch die „Wellenlänge“ in der Zeile Z.38300#_(4)“2“5“1“7“(6)[6] und zwar als QS1+7=“8“_“5“_“2“ für „TAS1R3“=852AS [TAS1R3 - Taste receptor type 1 member 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Mit der Kopplung über die Ziffer „0“ schließt sich das Protein (Mensch) „TAS1R2“=839AS, und zwar in der Spalte Z.38301#_675210/#_633079 als QS5+2+1+0=“8“_QS33+6=“39“ mit 8_39 für „TAS1R2“=839AS [TAS1R2 - Taste receptor type 1 member 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der „Plexus myentericus (Auerbach-Plexus)“ ist mit dem „Plexus submucosus (Meissner-Plexus) “ in der Submukosa neuronal verbunden. Die Submukosa liegt zwischen der Schleimhaut (Tunica mucosa) und der Muskelschicht (Tunica muscularis) der Darmwand. Der „Plexus submucosus“ ist im gesamten Trakt von der Speiseröhre bis zum Dickdarm vertreten. Der Plexus submucosus innerviert die dünne Schicht aus glatter Muskulatur (Lami¬na muscula¬ris muco¬sae) und damit die Feinbewegungen der Darmschleimhaut [Plexus submucosus - DocCheck Flexikon]. Außerdem steuert er die Drüsensekretion des Magen-Darm-Trakts. Der Plexus submucosus externus (Schabadsch-Plexus) liegt der Ringmuskelschicht innen an. [Plexus submucosus – Wikipedia]. Die Membran „330“ ist mit dem Cofaktor „Zink“=30E gekoppelt. Folglich liegt das Protein (Mensch) „Somatotropin_GH1“=217AS in der Randspalte Z.38301#[16]“1367“[5]“21“/#[16136]{3(3)}(0)“7“ in der Spalte als „21_7“ für „GH1“=217AS vor. „GH1“ stimuliert Gewebe zur Sekretion von „IGF-1“ [GH1 - Somatotropin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IGF-1“=1367AS ist zur Zielfindung lesbar, muss dann aber alternativ durch die Membran „33“ ziehen, um Kontakt zu „GH-1“ zu halten, und zwar in der Spalte Z.38301#[16]{13}“6“7“5“[21]/#[161363]“3“[07]/#[1613]“59“[095] als QS6+7=13_QS5_3_0_59=67 mit 13_67 für „IGF-1“=1367AS. „ATP“=260E in der Vorzeile als QS17+3+4+2=26_ Spalte 2/0 mit 26_0 für ATP=260E. Umwandlung in ADP mit QS1+7+3=11=QS=2_QS4+2+5=11=QS=2 _Spalte 5/0 mit „0“ als 22_0 für ADP=220E [IGF1R - Insulin-like growth factor 1 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SST_Somastatin“=116AS hemmt im Gegenzug das Somatropin (GH1), indem es 3-zeilig aufsteigend bis in den GH1-Cofaktor „Zink“ zieht, und zwar als QS4+2+5=11_Spalte 4/1 mit QS2+1=3_Spalte 2/0 mit QS3+0=“3“ als 11_Summe 3+3=6 mit 11_6 für SST=116AS [SST - Somatostatin - Homo sapiens (Human) | UniProtKB | UniProt]. Die 2-zeilige Spalte Z.38303#_[16135]“9“0“9“{515}/#_[16135]“4“{88}[2]{56} mit der Spaltenwinkelsumme 180° ist ergänzend angehängt und enthält mit die Ziffer „88“ einen Drüsenbezug. Das Glycoprotein (Mensch) „Alpha-1-Antitrypsin (AAT)“=418AS wird von der Leber produziert. Ein Mangel führt zu Erkrankungen, andererseits ergibt die Ausscheidung in den Darm einen Zusammenhang mit Darmerkrankungen. „AAT“ liegt aufsteigend neben einem Drüsenhormon „88“ mit „4“_QS9+0+9=“18“ mit 4_18 für AAT=418AS. „ATT“ hemmt Serin-Proteasen. Serin=56E liegt seitlich als 5_5+1=6 für 56E und nochmals lesbar mit 56E vor [SERPINA1 - Alpha-1-antitrypsin - Homo sapiens (Human) | UniProtKB | UniProt].
Protonenpumpen: Eine „Protonen-Pumpe“ wird von Transmembranproteine gebildet, die positiv geladenen Wasserstoffionen (Protonen) über eine biologische Membran, gegen einen elektrochemischen Gradienten, transportieren. Beispiele sind der Komplex I und der Komplex IV der Atmungskette in Mitochondrien. In den Belegzellen im Magen findet sich die „Protonen-Kalium-Pumpe (H+/K+-ATPase)“. In der "sealed zone" der Osteoklasten befinden sich ebenfalls Protonen-Pumpen, die ein saures Milieu erzeugen, wodurch der Knochen aufgelöst wird [Protonenpumpe (chemie.de)].
Protonen-Kalium-Pumpe (H+/K+-ATPase)“: Das Protein (Mensch) „ATP4A_Kalium-transportierende ATPase-alpha-Kette 1“=1035AS wirkt als „Protonenpumpen“ in der Magenschleimhaut. Das Protein kann im Zeilenlauf nur über die medikamentöse Gegenwirkung mittels „Protonenhemmer“ erkannt werden. Wer dagegen allwissend ist, wird diese 6 Zeilen visuell vorhersagen, weil am Spaltenrand ab Z.38296#_13 die Zahl 3,1 [nach links gezählt] gefolgt von der Spalte 1/1/1/1=QS=4 für 3,14 entsteht. Es folgt der Kunstgriff QS 3+7=10 für „0“ als Anschluss von weiteren Kommastellen. Diese ziehen sich wellenförmig in der Zahl Pi=3,1415926535897“9“ bis die Bildung der Ziffer „9“ am rechten Zahlenrand der Ausgangszeile als Proton=“1“ mit der Ziffer „1“ endet. Der einfache Taschenrechner kann bereits die Ziffer „3“ nicht mehr darstellen und rundet auf. Pi=3,14_[1.Kunstgriff QS3+7=10 für „0“]_Spalte 5/1 mit „15“_“9“_QS4+7=11=QS=“2“_QS4+2=“6“_“5“_Spalte“1/2“=QS=“3“_QS1+4=“5“_QS5+3=“8“_QS4+5=“9“ (Ausgangszeile)_QS2+5=“7“_Kunstgriff QS4+2+4=10 für „0“_QS5+3+“1“=9 mit Summe 0+9=“9“ insgesamt als Pi=3,1415926535897“9“.
„ATP4A“ liegt 6-zeilig absteigend in der Spalte Z.38296#_[8]“5“[89]/#_[4]“3“[75] /#_ [0]“1“[61]/#_[5]“9“[47]/#_[1]“7“3“[4] als QS7+3=10_Kunstgriff QS9+1=10 für „0“_3_5 mit „10“_Summe 0+3=“3“_“5“ mit 10_35 für ATP4A=1035AS [ATP4A - Potassium-transporting ATPase alpha chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Adenosintriphosphat (ATP)“=C10H16N5O13P3=60+16+35+104+45=260E dient als Energiequelle. Das ATP liegt in der Zeile Z.38298#[16138016]“1414“2“4“2“ und zieht vom Zeilenrand nach innen, wobei Protonen=1 lesbar sind, und zwar als „2“_QS2+4=“6“_QS1+4+1+4=10 für „0“ mit 26_0 für ATP=260E. Die Magnesium-Bindung wird als Protonenkreuz in der Spalte „1“6“1“/[9]“4“[7] visualisiert, indem beidseitig 1 Protonen an die Spalte 6/4 =QS=10 für QS1+10+1=12 für Magnesium=12E angefügt wird. Dieses Bild wird mit einer Richtungszählung QS1+6=7_QS1_9=10 für „0“_5 mit Summe 7_0_5=Magnesium=12E bestätigt. Beim Durchlauf wird die Bindung an Kalium=19E in der Spalte 1/9 mit 1_9 für Kalium integriert. Die Protonenpumpe entwickelt einen Kreislauf: H-Ionen werden in das Magenlumen gepumpt, während K-Ionen vom Lumen in die Zelle transportiert werden. Für das Zwischenprodukt „L-4-Aspartyl phosphate =C4H8NO7P=24+8+7+56+16=111E [KEGG COMPOUND: C03082 (genome.jp)] wird die Protonenzeile gezählt und mit der Randziffer 86 als Übertrag addiert, und zwar mit QS0+1+6+1+4+1+4+2+4+2=25_86 mit Summe 25+86= Aspartylphosphat=111E. Die Magenschleimhaut wird in der Randspalte Z.38297#_325551/#_414242 dargestellt, indem der Magen einen Muskelbezug als 5_QS3+2=5_555 erhält. Über die Spalte „3“7“[5]/“1“6“[1] ist der Magenbezug mit Chlor=17 für HCl in QS3+7_6+1=“17“ enthalten. Die Magenschleimhaut „32“ muss „1“ Proton zur Membranbildung in der Spalte „32“/[4]“1“ für QS32+1=Membran=33 aufnehmen. Protonenpumpen-Hemmer: In der Spalte Z.38297#_437/#_016/#_594/#173 laufen 3 Medikamenten-Säulen aufsteigend auf die Zahl „173“=QS=11(Zählgröße) zu. Beim Durchlauf dieser Zahl wird Chlor=17E als Symbol für Salzsäure (HCl) verwendet, so dass zu 90% keine Salzsäure gesondert entstehen kann. Rechts verbleibt noch eine Zahl „17“, die nicht besetzt wird. Die reale 10%-Restproduktion kann dabei über die Spalte Z.38300#_42517/#_10005 mit dem Prozentsatz 100% und dem Anteile 10% unter der Zahl 17 als Trennung 100_0 erkannt werden. Die Zahl 17 ist als Chlor=17 zwar für die Ziffer 7=Form besetzt, über der Zahl 100 steht ersatzweise QS2+5=Form=7 für die Kommastelle zur Verfügung. Omeprazol=182E bzw. Esomerazol= C17H19N3O3S=182E laufen in der linken Spalte als QS4_0_5=“9“_“173“ mit Summe 9+173=“182“E. Lansoprazol=C16H14F3N3O2S=190E, Rabeprazol=C18H21N3O3S=190E und Dexlansoprazol=C16H14F3N3O2S=190E laufen in der rechten Spalte als „173“_QS7+6+4=“17“ mit Summe 173+17=“190“E. Pantoprazol=C16H15F2N3O4S=197E [PharmaWiki - Pantoprazol] wählt den Mittelweg und wechselt von rechts zur Mitte als „173“_QS4_9_1_3+7=“24“ mit Summe 173+24=“197“E. Bei Pantoprazol wird als Nebenwirkung ein Calcium-Mangel (Knochenbrüche) erwähnt. Ersichtlich ist, dass niedrige Kalium-Werte vorliegen, weil das Kalium 1_9 in der Mittelspalte liegt. Das Calcium ist dann mit QS1_9_3+7=20E betroffen. Protonenpumpen-Hemmer werden aber nur kurzzeitig verordnet.
Protonenpumpen in Osteoklasten: Osteoklasten bauen Knochen auf und Osteoblasten bauen Knochen ab. Osteoklasten setzen neben matrixabbauenden Proteasen (z.B. Cathepsin) auch Säure frei, indem sie hierfür eine spezifische ATPase exprimieren, die Protonen ins perizelluläre Milieu als Protonenpumpe abgibt [WO2002013796A2 - Verwendung von protonenpumpen-hemmern zur behandlung von erkrankungen des bewegungsapparates - Google Patents]. Ab Z.38301 liegen 5-zeilig 2 Calcium-Spalten 2/0=QS=20 vor, deren Lücke mit QS9+8=Chlor=17E (Salzsäure HCL) enthält. Ohne Säure entfällt das 2. Calcium-Paket. Protonenpumpen-Hemmer mindern die Magensäureproduktion. Osteoporose-Patienten fehlt dann Calcium, um dem Abbau der Knochenmasse zu begegnen. Die Aufnahme von Calcium-Glukonat=C12H22CaO14_H2O=72+22+20+112=226E_H2O erfolgt auch bei höherem ph-Wert im Magen, vergleichsweise ist Calcium-Carbonat=CaCO3=20+6+24=50E ungünstig [Wie der Magen die Stabilität der Knochen beeinflusst - Neue Erkenntnisse zur Kalzium-Therapie bei Osteoporose (gesundheitsforschung-bmbf.de); 2010]. „Calcium-Glukonat“=226E kann sich mit der Calcium-Spalte günstig direkt verbinden. „CaCO3“ ist ohne Spaltenanschluss im Zählweg mit enthalten, und zwar in der Randspalte Z.38299#_[9477]“22“986/#_[9342]“5“{17}[66]/#_(5)(2)“1“0“0“[0565]/#_(3){0}[7969366]. Zwar könnte Ca-Glukonat=226E aus der Spalte 22[9]/517 mit 22_QS5+1=6 gezählt werden, dann bleibe aber die Zahl „17“ für die Salzsäure ohne Funktion. Die Ziffer „1“ aus Chlor=17E wird folglich ignoriert. Mit „22“_Spalte 5/0=QS=5 (keine 50E für CaCO3)_QS1+0=“1“ als 22_Summe 5+1=6 mit 22_6 für Calcium-Glukonat“=226E. Zwischen CaCO3 in der Spalte 5/0 mit 5_0 für 50E und der Calcium-Spalte liegt die Ziffer „1“ als beherrschendes Element. Das Wasser „28“(Symbol) gehört zur Summenformel; es nimmt die Ziffer „2“ vom Calcium auf, und zwar in der Spalte „52/30“ mit 2_QS 5_3=8 für Wasser (H2O)=28. Das Protein „V-ATPase-Untereinheit a“ liegt in Zell- und Vakuolenmembranen, um den V-ATPase-Protonenkanal für die Protonenpumpe zu bilden. Die Isoform OC116 als lange Form des Proteins agiert nur in Osteklasten [V-ATPase-Untereinheit a – Wikipedia]. Das Protein (Mensch) “ V-type proton ATPase_TCIRG1“=830AS {Osteoclastic proton pump 116 kDa subunit (OC-116 kDa; OC116)}, 7-zeilig und zerlegt als „8_30“, könnte im Prinzip mit der Ziffer „1“ neben der Calcium-Spalte beginnen, benötigt aber einem wertlosen 1. Kunstgriff 100 für „0“ als Vorspann vor dem Calcium-Thema, um eine Chlor-Ecke „17/1“ mit Dopplung „17_17“ als Säure-Thema einzubeziehen, und zwar in der Randspalte Z.38300#_“17“34“25“17“[66]/#_“7“[5]“2“1“000“5“[65] über die Spalte „17“/“7“[5] mit der Startziffer „7“_QS17+34+25+17=“93“ als 1. Kunstgriff mit Summe 7+93=100 für „0“. Die Ziffer „8“ folgt aus Summe QS2+1+0+0+0+5+ 1. Kunstgriff „0“=“8“. Über die Calcium-Spalte „2/0“ wird die lesbare Endziffer „30“ ignoriert, um bis zum 2. Calcium-Paket durchzulaufen. Die Zahl „30“ entsteht aus einem 20er- und einem 10er-Anteil. Spalte „3“0“[7]/“0“9“[5]/[8]“8“2“/[67]“0“/[458] mit QS3_0_0_9_8=“20“_QS2_0_8=“10“ als 8_Summe 20+10=30 mit 8_30= für „OC116“=830AS [TCIRG1 - V-type proton ATPase 116 kDa subunit a 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Obwohl vor der Einahme von Protonenhemmer gegen einen Überschuss von Magensäure wegen des Calcium-Mangels gewarnt wird, wird im Gegenteil der Protonenpumpen-Hemmer „Omeprazol“=182E bei Osteoporose zum Einbau von Calcium verordnet. Omeprazol startet mit der Ziffer „1“ im Chlor=17 und schließt als Möglichkeit das 2. Calcium-Paket an. Die Protonen-Ziffer „1“ am 1. Calcium-Packet wird zur Zahl „10“ verarbeitet, und zwar 5-zeilig aufsteigend als „1“_QS0+0=“0“_QS10_52=“62“_QS3+0_9_8=“20“ mit „1“_Summe 0+62+20=“82“ als Omeprazol=182E. Die Hemmstoffe gegen „V-ATPase“ wie Amilorid=C6H8ClN7O=36+8+17+49+8=118E und Tributylzinn= C16H36Sn=96+36+50=182E können den Anschluss des 2. Calcium-Packets nicht nachweisen, weil das Protein nur mit dem Ziel gehemmt wird, die beiden Säure Zahlen „17“ in Z.38300#_17_17 (Chlor) zur Hemmung über die Z.38301 zu verbinden. Der Hemmstoff „Bafilomycin“=C35H58O9=210+58+72=340E addiert die beiden Chlor-Ziffern zu 17+17=34, muss dafür aber den Zwischenraum wertlos mit dem 1. Kunstgriff 100 für „0“ füllen. Der Säure-Zwischenraum in der Spalte {17}3425{17}/[75]2100[05] liefert die Spalten-Summe 34_21_25_00=“80“. Der fehlende Anteil „20“ für Kunstgriff 80+20=100 für „0“ wird beim Durchlauf des Proteins „OC116“ gewonnen, dass ebenfalls mit dem 20er Anteil endet. Die Ziffer „0“ wird mit der Spalte 7/3=QS=10 für „0“ angehängt. „Bafilomycin“ als „17“_1. Kunstgriff 80+20=100 für „0“_“17“_2. Kunstgriff QS7+3=10 für „0“ als Summe 17+0+17=34_0 für „Bafilomycin“=340E [Bafilomycin - Wikipedia]. Entsprechend enthält das Protein „OC116“, weil es die Langform von V-ATPase ist, ebenfalls einen Kunstgriff QS=100 für „0“.
Das Protein (Mensch) „ATP6B1_V-ATPase“=426AS ist für die Ansäuerung und Aufrechterhaltung des pH-Werts intrazellulärer Kompartimente verantwortlich. Das Protein muss mit der Membran „33“ beginnen und beide Säureanteil erschließen, und zwar 3-zeilig in der Spalte Z.38300#_“1“7“3“4“[25]“1“[7]/#_“7"[52]“1“0“0“0“/#_“33“[07969] als QS33_7=40_QS1+7+3=11=QS=2 als Summe 40+2=“42“_Spalte 4/1 mit QS4_1+0+0=“5“_Spalte 1/0 mit QS0_1=“1“ als 42_Summe 5+1=6 mit 42_6 für ATP6B1=426AS [ATP6B1 - Vacuolar proton pump subunit B - Homo sapiens (Human) | UniProtKB | UniProt].
Atmungskette: In den Mitochondrien wird Glucose abgebaut. Die während des Citratzyklus entstandenen Coenzyme NADH und FADH2 übertragen ihren Wasserstoff an Sauerstoff und bilden somit Wasser. Dieser Prozess wird auf mehrere Schritte über die Atmungskette mit 4 Proteinkomplexen vollzogen. Im Ergebnis entsteht ATP als Energielieferant [Atmungskette in Biologie | Schülerlexikon | Lernhelfer].
Atmungskette, Komplex 1: Das Protein (Mensch) „NDUFS2_ NADH dehydrogenase“=463E bindet 1 [4Fe-4S]-Cluster an der Cofaktor-Bindestelle. Nachdem alle Teilnehmer der Katalyse vierzeilig in der Spalte Z.38306#_161346458044240/#161342246112790/#161338034401238/#161333822909568 verteilt sind, entsteht das Protein „NDUFS2“ in der zentralen Spalte „46“1“1“/“3“4“4“0“ als „46“_QS1+1_0+4+4=10 für „0“_“3“ als „46“_Summe 0+3=“3“ mit 46_3 für „NDUFS2“=463AS [NDUFS2 - NADH dehydrogenase [ubiquinone] iron-sulfur protein 2, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Katalyse: „a ubiquinone + 5 H+(in) + NADH = a ubiquinol + 4 H+(out) + NAD+ “. In der Zeile Z.38306#_161“346“4“5“80442“4“0 sind die Ziffern „5“ und „4“ für die Anzahl H+ enthalten. Das Coenzym „Nicotinamid-Adenin-Dinukleotid (NAD)“ geht als oxidierte Form NAD+= C21H28N7O14P2=126+28+49+112+30=245E in der Katalyse aus der reduzierten Form „NADH“=C21H29N7O14P2=126+29+49+112+30=346E hervor. „NADH“ ist in der Zeile als Zahl „346“ lesbar. Die Umformung in NAD+ =245AS wird zum Problem, weil die Zahl „45“ folgt, die Ziffer „2“ für 245AS aber fehlt. Die Ziffer „2“ ist in der Spalte 4/2 zwar vorhanden, wird aber vom „Ubichinon-10 (UQ)“=C59H90O4=354+90+32=476E verwendet. „Die Elektronen zur Reduktion des Ubichinons entstammen der Oxidation des NADH [Ubichinon-10 – Wikipedia]. Die Zahl 2 könnte aber entnommen werden, weil sich die entstehende reduzierte Form „Ubichinol (QH2)“=C59H92O4=354+92+32=478E neu ordnen kann, wenn der Platz von „NADH“ frei wird [Ubichinol – Wikipedia]. Es gibt aber auch eine alternative Lösung, die sich über die Z.Nrn.-Spalte zieht und in Sprüngen 2 Elektronen beteiligt. In NADH ist Nikotinsäure=C6H5NO2=36+5+7+16=64 E enthalten. Ubichinon(UQ)= 476 E als QS2+2=4_Spalte 4/3=QS=7_Spalte 3/3=QS=6 mit 4_7_8 für UQ =476 E. In der Spalte Z.38307#_[3]“4“2“(2)“/#3“3“8“[0] wird für die Umwandlung in Ubichinol (QH2)“=478E statt Spalte 3/3 rechts die Zahl „8“ für QH2=478E gelesen, wobei die Startziffer „2“ umkämpft ist. Der rechte Spalten-Rand wird von 2 (Fe-S) des Clusters besetzt, und zwar Randspalte „4“2“[40]/“2“79“[0] mit 2_QS4+2=6 mit 2_6 für Fe=26E_QS7+9=Schwefel=16. Randspalte „12“[3]“8“/“9“5“[6]“8“ als 12_QS5_6_3=14 mit Summe 12+14=Fe=26E_QS8_8=Schwefel=16. Der linke Spalten-Rand wird ebenfalls von 2 (Fe-S) des Clusters besetzt, und zwar doppelt aus einer Serienspalte #[1]“6“1“/#“16“1“ als QS1_1=2_6=Eisen=26E_Schwefel=16E. Eine Ziffer [1] ist am Rand frei verfügbar. Die aus der Dopplung entstehende zweite [1] wäre im Durchlauf zählbar, wenn sich der Schwefel=16 in der Z.38“3“0“7“ in diese Z.Nr. zieht mit [Z.38]_QS3+0+7=10_Spalte 3/3=QS=6 mit Summe 10+6=Schwefel=16E. Das Coenzym „Flavinmononukleotid (FMN)= C17H21N4O9P=102+21+28+72+15=238E kann sich in „NDUFS2“ über die freie Spalte Z.38308#_03/#_82 mit der Ziffer „3“ von „NDUFS2“ ringförmig locker verbinden als „2“_“3“_QS0_8=“8“ für FMN=238E [Flavinmononukleotid – Wikipedia].
Atmungskette, Komplex IV: Das Protein (Mensch) „COX1_ Cytochrom-c-Oxidase_ MT-CO1“=513AS ist Bestandteil der Cytochrom-c-Oxidase als letztes Enzym der Elektronentransportkette. Im Ergebnis ist ATP als Energieliferant zu erwarten, und tatsächlich, es liegt in der Spalte Z. 38310#_161329611637761/#161325400585801 als Randspalte „61/01“ mit QS1_1=“2“_“6“_“0“ für ATP=260E vor. Diese beiden Zeilen werden an den 4-zeiligen Komplex I angefügt. „COX1“ wird vom Cofaktor „Kupfer“=29E im Zentrum in der Spalte Z.38309#_29/1[6] geleitet, wobei das vertikal integrierte Magnesium=12E unterstützend wirkt. Als Teilnehmer der Katalyse sind Sauerstoff O2 als Spalte 8/8 [nochmals kombiniert mit der Startziffer „5“ von COX1 in 5“8“[5]“8“] sowie doppelt Wasser=2*28(Symbol)=56E vorhanden. Weil das Protein ein Sauerstoff-Bindung enthält, ist es zweckmäßig, wenn O2 nochmals an der Startziffer „5“ von COX1 in 5“8“[5]“8“ ausgewiesen ist. Der Cofaktor „Häm“=Hämb=Fe-Protoporphyrin IX=C34H34FeN4O4=204+34+26+28+32=324E begrenzt [iron(iii) protoporphyrin IX | C34H34FeN4O4 | ChemSpider]. „COX1“ und legt eine Verbindung an den Zeilenrand zum Sauerstoff. Häm=324E liegt mit Cox1 in der Spalte Z.38307#_[61{1}{2}790]/#_[4]“4“0“{1}{23}8/#_(29)“0“[9568]/#_(1)“6“3“[7761]/#_[0]“5“[85801], und zwar in der Randspalte „1“2“[790]/[0]“1“23“[8] als QS1+2=3_QS1+23=24 mit 3_24 für Häm=324E. „COX1“=513AS absteigend als „5“_QS6+3_0=“9“_QS4+0=“4“ mit „5“_Summe 9+3=“13“ als 5_13 für „COX1“=513AS. Die Katalyse enthält im Eingang 8-fach H+ und im Ausgang 4-fach H+. Als Möglichkeit wird die Umwandlung mit der letzten Ziffer „4“ von COX1 in der Spalte 44/2(9)=Kupfer=29 als QS4+4=“8“ /2=“4“ dargestellt und die Zahl „4“ dann seitlich als QS1+1_2=“4“ gezählt [MT-CO1 - Cytochrome c oxidase subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt].
HCN-Kanal im Herz: Das Herz ist in der Serie #1613 mit dem Schrittmacherkanal (Funny Channel / HCN= hyperpolarization-activated cyclic nucleotide-gated channel) vertreten. HCN-Kanäle sind auch im Gehirn, in der Retina des Auges, in der Zunge und in Spermien vorhanden. Durch Senkung des Ruhepotentials (noch negativer als – 70mV bis i.M. -120mV) wird ein Kationen-Einstrom ausgelöst. „Funny“=seltsam, aufgrund einer Kanalaktivierung durch Hyperpolarisierung anstelle Depolarisierung. Kationen sind Atome, die weniger Elektronen als Protonen besitzen. Natrium ist als Natriumion „Na+“ positiv geladen, wenn es 1 Elektron abgegeben hat. Das Schließen von Natriumkanälen stellt das Ruhepotential wieder her. Zur HCN-Familie gehören die 4 Subtypen „HCN1-HCN4“. In der Zunge öffnen diese Kanäle bei sauren Reizen. Für den Sinusknoten am Herz ist der HCN4 bedeutsam, der nach der Repolarisation sofort wieder einen Kationen-Einstrom auslöst [HCN-Kanal - DocCheck Flexikon]. Die „HCN-Kanäle“ überschreiten mit der Code-Winkelsumme=420° die Kreislauf-Winkelsumme 360° um 60°. Im Prinzip könnte die Herzfrequenz=60 Schläge/min somit eine Korrektur bezwecken. Winkelfolge ab Z.38307: Nr.1_90°_Nr.2_80+40=120°_Nr.3_90°_Nr.4_““_Nr.5_40+80=120°_Nr.6 bis Nr.8_““(ohne) mit Summe=90°+120°+90°+0+120°+0+0+0=420°. Die 60 Schläge liegen in der 8-zeiligen Code-Randspalte. HCN-Kanäle werden durch das „Cyclische Adenosinmonophosphat (cAMP)“=C10H12N5O6P=60+12+35+48+15=170E aktiviert [Cyclisches Adenosinmonophosphat – Wikipedia]. Die membranständige „Adenylylcyclase (AC)“ wird durch Hormone, Neurotransmitter etc. stimuliert, zelluläres „ATP“ in den Botenstoff „cAMP“ zu verwandelt. Es existieren 10 verschiedene AC-Proteine. [Adenylylcyclasen – Wikipedia]. Für Herz und Gehirn kommt u.a. das Protein (Mensch) „ADCY5_Adenylatcyclase Typ 5“=1261AS in Betracht, dass 1 Cofaktor-Bindestelle für Mg2+ /Mn2+ besitzt. „ATP“{}=260E liegt in der Randspalte Z.38307#_[22]“4“6“{„1“}{1}{2}[70]/#_[80]“3“[44]{0}[1238]/#_[38]“2“2“[909568]
als „2“_QS1+1_4=“6“_“0“ mit 2_6_0 für ATP=260E. Die Zahl 6{1} bildet den Schluss von „ADCY5“=1261AS, wobei durch den Versatz „12/12“ dessen Cofaktor „Magnesium“=12E doppelt anliegt, Mangan alternativ über Spalte 1/0 als QS1_0+1=“2“_QS2+3=“5“ mit Mn=25E. „cAMP“()=170E liegt in der Spalte Z.38310#_[96](„1“)(„1“)[637761]/#_[5](4)(„0“)(„0“)[585801]/#_(11)[89753671] absteigend als QS11_4+0=“15“_QS1+1=“2“_“0“ mit Summe 15+2=“17“_“0“ für cAMP=170E. „ADCY5“=1261AS verbindet ATP/cAMP nadelförmig mit einer Schleife ab Z.38309 aufsteigend „2“_QS1_0+0=1_0 für „10“_absteigend Kunstgriff QS1_2_3_4=10 für „0“_“61“ als Summe 2+10+0=“12“_“61“ für „ADCY5“=1261AS. „Reguliert die Erhöhung des freien zytosolischen Ca2+ als Reaktion auf einen erhöhten Blutzuckerspiegel und trägt zur Regulierung von Ca2+-abhängige Insulinsekretion bei“. Die Regulierung erfolgt an der Wendestelle „11/00“ in der Calcium QS1+1=2_0=20E von links oder rechts zählbar ist [ADCY5 - Adenylate cyclase type 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Statt „„ADCY5“ kann künstlich der Pflanzenwirkstoff „Forskolin“= C22H34O7=132+34+56=222E stimulierend wirken, der die Verbindung als „22“_Kunstgriff Spalte 6/4=QS=10 für „0“ QS1+1=“2“ für 222E herstellt.
HCN1-Kanal: Das Protein (Mensch) „HCN1“=890AS wird scheinbar in der Spalte Z.38310#_[6116]/#_[540]“0“58/[11]“89“75 als 89_0 gebildet, wobei die Ziffer „0“ aus cAMP=170E stammt. Diese Zielorientierung erweitert sich um eine Schleife, weil eine Hemmung durch Cäsium=55E über Spalte 5[3]/14 mit 5_QS1+4=Cs=55E vorliegt. HCN1“=890AS in der Spalte Z.38310#_[6116]/#_[540]“0“58“/“1“1“8“9“7“5“ als QS1+1+8+9=19(Kalium)_QS7+5=12_58_0 als Summe 19+12+58=“89“_“0“ für „HCN1“=890AS. „Durch Hyperpolarisation aktivierter Ionenkanal mit schwacher Selektivität für Kalium- gegenüber Natrium-Ionen. Trägt zu den nativen Schrittmacherströmen im Herzen (If) und in Neuronen (Ih) bei“ [HCN1 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 1 - Homo sapiens (Human) | UniProtKB | UniProt].
HCN2-Kanal: Das Protein (Mensch) „HCN2“=889AS zieht von Zeilenrand, der die Spalte 1/1=QS=11 zum Transport von Ammonium NH3+=11 enthält bis zum cAMP, und zwar beginnend in der Randspalte Z.38310#_(1)“6“[37761]/#_[0]“5“[8]“58“0“[1]/#_97536“7“1“ als QS1+7_0=“8“_QS58_aufsteigend 3_Spalte 5/4=QS=9 mit 8_QS58+3+9=70_absteigend Kaliumspalte am cAMP mit QS6+5+7+1=19(Kalium) als „8“_Summe 70+19=“89“ für „HCN1“=889AS. Hemmung durch Cäsium. „Durch Hyperpolarisation aktivierter Ionenkanal mit schwacher Selektivität für Kalium- gegenüber Natrium-Ionen. Trägt zu den nativen Schrittmacherströmen im Herzen (If) und in Neuronen (Ih) bei“ [HCN2 – WikipediaHCN2 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 2 - Homo sapiens (Human) | UniProtKB | UniProt].
HCN3-Kanal: Das Protein (Mensch) „HCN3“=774AS mit Ringbildung unterhalb der „0“(Null) von cAMP in der Spalte Z.38311#(0)[585801]/#“9“7“5“3“6“7“1“/“9“1“41“3“5“3“
als „7“_ Spalte 9/9 mit QS9_9+1=19(Kalium)_41 _Kunstgriff für Schleife am Zeilenrand QS3+5=8_QS3_1_7=11=QS=2 mit Summe 8+2=10 für„0“_QS5+3+6=14 als „7“_QS19+41+0+14=74 mit 7_74 für „HCN3“=774AS. Hemmung durch Cäsium. Kein Kontakt zum Natrium „11“ in cAMP, aber in Randspalte 1/1=QS=11. „Durch Hyperpolarisation aktivierter Kaliumkanal. Kann auch die Permeation von Natrium-Ionen erleichtern“ [HCN3 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Ubiquitäre Expression in Leber, Zwölffingerdarm und 25 weiteren Geweben. Die „67“ ist im Ring gezählt das Ubiquitin=76. Bogen im Zwölffingerdarm an der Bauchspeicheldrüse als Spalte 6_QS3+1=4 mit 64=Kreis. Gewebe als Membran „33“ kombiniert mit der Struktur „5“ als 3“5“3 in der Spalte „3“{5}3/“8“{2} [9] QS8+3=11=Zählgröße für Anzahl Spalte 5/2 als 25 Gewebearten. Spalte 5/2/8 mit Summe 25+8=Gewebe=33 [HCN3-Hyperpolarisation aktivierter zyklischer Nukleotid-gesteuerter Kaliumkanal 3 [Homo sapiens (Mensch)] - Gen - NCBI (nih.gov)].
HCN4-Kanal: Das Protein (Mensch) „HCN4“=1203AS liegt vor der Aktivierung durch cAMP in einer 5-zeiligen Randspalte Z.38309#_6[8]/#_61/#_01/#_71/#_[5]3 als QS6+6=12_QS1_0+1_7+1=10 für „0“_“3“ mit 12_0_3 für HCN4=1203AS (Basisposition).
Über einen „wertlosen“ Klammerweg mit 3 Kunstgriffen wird „cAMP“ mit der Basisposition gekoppelt, um eine Aktivierung zu ermöglichen. Klammerweg in der Randspalte Z.38308#_“4“4“01238/#_“2“909568 als QS2_4+4+0=10 für „0“_QS1_9=10 für „0“_QS5_2+3=10 für „0“als Summe 0+0+0=“0“. Das aktivierte „HCN4“ beginnt an der„0“(Null) von cAMP und verbindet sich zum Schluss mittels Kunstgriff ringförmig mit dem anderen Ende der Basisposition von „HCN4, und zwar in der Spalte Z.38311#_0585801/#_9753671/#_9141353/#_8748829 mit Spalte 5/7=QS=12_QS5_4+1=10 (externes Cs=55E mit QS=10 als Hemmer) für 0_3 mit 12_0_3 für „HCN4“=1203AS. Kopplung mit der Basisposition über „wertlosen“ Kunstgriff über Summe „8“_QS2+9=11=QS=“2“ als QS8+2=10 für „0“. Der potentielle Kalium-Kanal Spalte 6/5/7/1=QS=Kalium=19E kann nicht vollständig besetzt werden. Wo ist der Kalium-Kanal? Der Kalium-Kanal liegt in der Spalte der Basisposition QS 6/6/0/7=QS=Kalium=19E. Wenn das Protein aktiviert wird, ist der Kanal aufgrund der Ersatzposition bereits geöffnet. Das Protein bildet bei der Aktivierung ein Tetramer. Varianten: Mit Ziffer „1“ von cAMP in der Spalte Z.38309#_2290/#_1163 als „1“_QS2+9=11=QS=2_Spalte 0/3 als 1_2_0_3 für„HCN4“=1203AS (2. Monomer im Tetramer). Retour seitlich von der Kanalspalte über Spalte 5/7=QS=12_Kunstgriff QS3+7=10 für 0_ 8_Spalte 3/8=QS=11=QS=2 mit „12“_Summe 0+8+2=10 für „0“_mit Ziffer „1“ von cAMP in der Spalte 2/1=QS=3 als 12_0_3 für „HCN4“=1203AS (3. Monomer im Tetramer). „HCN4“ in der Spalte Z.38310#_637/#_585 als QS7_5=“12“_8_QS6_5=QS=11=QS=2_“3“ mit 12_Summe 8+2=10 für 0_3 als 12_0_3 für „HCN4“=1203AS (4. Monomer im Tetramer) [HCN4 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Jeder homomere HCN-Kanal besteht aus 4 gleichen Untereinheiten, damit ist aber kein Tetramer als Zusammenschluss gemeint [Tetramer siehe: Gating movements and ion permeation in HCN4 pacemaker channels (cell.com)]. Die „ionenleitende Pore“ in HCN-Kanälen liegt in einer Gly-Tyr-Gly-Sequenz (40-96-40). Weil eine vertikale „0“(Null)-Spalte fehlt, wird die Zahl „400“ im cAMP umgedeutet. Hierbei wird der Anteil „40“ nicht als Glycin=40E gelesen, sondern in einer Schleife beseitigt, und zwar mit QS1+1=“2“_Kunstgriff QS4_6=10 für „0“_QS1+1=“2“_“0“ mit Summe 2+0+2=“4“_“0“ für Glycin=40E. In dieser Schleife kann die Zahl „4“ nützlich 4 gleiche Untereinheiten „0“ zusammenfügen, um eine Pore zu erzeugen. Der durch cAMP aktivierte HCN-Kanal wird mit einer Ionen-Füllung dargestellt, indem darin die Zahl „19“=Kalium zählbar ist. In der Zahl 40“0“ ist die Ziffer „0“ von cAMP =17“0“E das Kanalsymbol mit der seitlichen Spalte QS[9]6-5-7-1=Kalium=19E. Tyrosin=96E dient als Begrenzung. Rechte Kanalwand mit der Spalte 3/8 als 3_8 für „38“_Kunstgriff mit Spalte {7}“5“/“1“4“/(74) als QS5_1+4=10 für „0“_Begrenzung QS7+4=11=QS=2 mit Summe 38+0+2=Glycin=40E.
Herzschlag: „HCN4“=1203AS zählt 60 Schläge/Minute als Summe in der Randspalte, und legt die Zeitbasis 3600 Sek= 60min für die Minutenzählung seitlich an die Schlag-Spalte, und zwar in der Randspalte Z.38312#_[5]“36“{71}/#_413{53}/#_48829 als 36_QS3+1+4_4+88=12+88=100 für „00“ als 36_00 für Zeitbasis=3600 Sek (Minutenzählung). „8-zeilig Kette“ der Herzschläge bis an die Zeitbasis in der Spalte Z.38307 (bis Z.38314)#_9[0]/#_38/#_68/#_61/#_01/#_71/#_53/#_29 als QS „9“_QS3+8=“11“_QS6+8=“14“_QS6+1=“7“_QS0+1=“1“_QS7+1=“8“_QS5+3=“8“_[QS2+9=11=]QS=“2“ als Summe 9+11+14+7+1+8+8+2= Herzschlag=60 Schläge /Minute mit Zeitbasis 3600Sek. /60min=1h. DELTA.TIME.EPI.VIR.Z.38307-Z.38314=#2947736 mit QS29+4=33=Gewebe_QS4+7=Zählgröße_Form=Nerv=7_36 gespiegelt für Physik=63 (Herzfunktion). Der HCN4-Kanal in Schrittmacherzellen (Pacemaker) des Sinusknotens im Herz wird mit dem Arzneimittel „Ivabradin (Procoralan)“= C27H36N2O5=162+36+14+40=252E gehemmt, um die Herzfrequenz zu senken, wenn diese mehr als 60 Schläge/min beträgt. Für „Ivabradin•Hydrochlorid“ liegt für Chor=17E die Spiegelung „71“ in der 60er-Frequenz-Zählkette. In der Zählrichtung „Chlor“=17E zieht das „Ivabardin“=252E ringförmig durch die Zeitbasis=3600Sek, wodurch der HCN-4 Kanal blockiert ist, und zwar in der Spalte Z.38312#_3671/#_1353/#_8829 als über die 60er-Frequenz-Zählkette „1_7“ für Chlor=17 im Hydrochlorid (HCl)_Kunstgriff in der Zeitbasis QS3+6_“1“=10 für „0“ enthält H=1E für HCL. „HCL“ liegt am „Ivabradin“ seitlich an, kann sich aber nicht direkt an ein Ende von „252“ anhängen, sondern wartet, bis sich das „Ivabradin“ in die Zeitbasis hineindreht, um sich einzuflechten. „Ivabradin“ am Ende der 60er-Zählkette mit QS2+9=11=QS=2_5_Spalte 3/8 in der Zeitbasis mit QS3+8=11=QS=“2“ als 25_2 für „Ivabradin“=252E. Als Gegenreaktion beseitigt die 60er-Frequenz-Zählkette ihre Hemmung, weil diese selbst eine „Zeitbasis 60“ bildet. In der „3600-Zeitbasis“ wird ihre Spalte 3/8=QS=“11“ ausgezählt, so dass die Plasmahalbwertszeit von „Ivabradin“ „11“ Stunden beträgt [Ivabradin - DocCheck Flexikon]. Kettenreaktion: Wird in der 60er-Frequenz-Zählkette die Angangszeile Zeile Z.38307 als Referenzeile für eine Kettenreaktion gewählt, dann liegen im 60. Serien-Ergebnis=#268903744 das Blut=26, die Vene=8; die Arterie=9 und die „Körpertemperatur“=37°C als Zusammenhang mit dem Kreislauf als Gruppe=44 vor. Tatsächlich enthält die Spalte Z.38313#_41353/#_48829 aufgrund der Zeitbasis=3600 auch die Basiszahl von 100°C als QS1+3_4_4_88=100°C und die enthaltene Rand-Zählspalte „53/29“ mit QS29_5+3=37 somit die Körpertemperatur „37°C“. Die Einhaltung von „37°C“ ist in der Laborpraxis üblich: „Alle HCN4-Zelllinien wurden routinemäßig bei 37 °C gehalten“ [Entdeckung neuartiger HCN4-Blocker mit einzigartiger Blockkinetik und Bindungseigenschaften - PMC (nih.gov)].
HCN-Kanäle im Gehirn: Die letzten 3 Zeilen der Serie #1613 bilden mit Nr.1_30+60=90°_Nr.2_30+30=60°_Nr.3_30° die Spalten-Winkelsumme 90+60+30=180° und somit einen funktionellen Zusammenhang ohne Herzschlag-Unruhe. Hier wird HCN4 nochmals gebildet, um die Position in Hirnzellen darzustellen. Statt Herzschlag wird die „ionenleitende Pore“ mit einer „Glycin(=40E)-Tyrosin(=96E)-Glycin(=40E)-Sequenz“ an Poren „0“(Null) bestimmt, die zugleich am HCN4 liegt [„Untersuchung der Rolle des Schrittmacherkanals HCN4 im Gehirn adulter Mäuse - PDF Kostenfreier Download (docplayer.org)“; Diss. A. Blaich (2008); Uni Nürnberg]. „HCN4“ zieht durch einen Muskelbezug „55“, so dass die Kanal-Funktion u.a. an Bewegungen gekoppelt ist. Das Protein (Mensch) „HCN4“=1203AS liegt im Gehirn in der linken Randspalte Z.38315#[161308]“5“5“[8]/#[161304]“3“4“8“/#[161300138] als QS4+8=12_QS5+5=10 für 0_3 mit 12_0_3 für 1203AS [HCN4 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Wo liegt Kalium? Neben dem 0-0-00-Kanal als 1_QS3+3+3=9 mit 1_9 für Kalium=19E. Wo liegt Natrium? Am Kanal-Eingang „308“ als QS3+0+8=Natrium=11. Wo ist ATP? ATP=260E in der Spalte Z.38316#_[34]“8“6“2“/[1]“3“8“[88] als QS 2_6_Summe 8_QS3+8=11=QS=2 mit „26“_Summe 8+2=“0“ für ATP=260E. Das Protein existiert noch nicht, so dass dessen Ziffer „8“ genutzt wird. „cAMP“=170E liegt seitlich an ATP und zieht zwecks Aktivierung durch die Ziffer „3“ von HCN4 in der Spalte Z.38316#_“0“3“4“/#_[0]“1“[3] als „1“_QS4+3=“7“_“0“ für cAMP=170E. Wo liegen die Kanäle HCN1-HCN3? Das Protein (Mensch) „HCN2“=889AS umläuft die linke Kanalspalte. Am rechten Zahlenrand bildet die Spalte 0/0 für HCN3 und HCN1 einen 2. Kanal, der vorgelagert aus „3“(5)(3)/“8“(2)(9) mit 3/8=QS=Natrium=11 und QS2+9_5+3=11+8=Kalium=19E versorgt wird. „cAMP“ entsteht dort gesondert. HCN4 liegt seitlich von HCN2 und verliert scheinbar den direkten Kanalzugang, der aber über die Tyrosin(=96E)-Glycin(=40E)-Sequenz am Kanal vorhanden ist. Einzelstücke: Spalte 4_0 für Glycin=40_QS1+6+1_1=9_Spalte 3/3=QS=6 für Tyrosin=96_QS1+3=4_0 für Glycin=40. Sequenz im 2. Kanal: Vorzeile ist vom Herz abhängig. Glycin bereits ab Z.38313 als QS4+1+35=Glycin=40_Verbindung über Kunstgriff mit Summe 8+QS7+4=11=QS=2 mit QS8+2=10 für „0“_Tyrosin QS2+7=9_6 für Tyrosin=96_Glycin=40 mit QS30_0_8_2=40 für Glycin=40. Die HCN-Kanäle bestehen jeweils aus 4 gleichen Untereinheiten. Weil HCN2 und HCN4 hier zusammenliegen, ist verständlich, dass sich die Untereinheiten verschiedenartig zu einem heteromeren „HCN24“ im Unterschied zu einem homomeren Kanal zusammensetzen können [dissertationrose.pdf (db-thueringen.de)]. Ein HCN24 ist genauso schnell wie ein HCN2, folglich ist HCN4 langsam.
Das Protein (Mensch) „HCN2“=889AS liegt im Gehirn dreizeilig als Schleife absteigend QS1+3=4_Spalte 4/0=QS=4 mit Summe 4+4=“8“_“8“_aufsteigend QS3+0_3_3=“9“ mit 88_9 für HCM2=889AS mit Verbindung zu cAMP [HCN2 – WikipediaHCN2 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HCN3“=774AS liegt im Gehirn am rechten Zahlenrand ohne direkten Anschluss zur linken Kanalspalte, und zwar in der Randspalte Z.38315#_6084/#_3098 als 60_0_Spalte 8/9=QS=17_“4“ mit Summe 60+0+17=“77“_“4“ für „HCN3“=774AS. „cAMP“ ist speziell mit enthalten über die Spalte 8/9 mit QS8+9=17_0 für cAMP=170E. [HCN3-Hyperpolarisation aktivierter zyklischer Nukleotid-gesteuerter Kaliumkanal 3 [Homo sapiens (Mensch)] - Gen - NCBI (nih.gov)]. Das Protein (Mensch) „HCN1“=890AS liegt im Gehirn in der Randspalte Z.38216#_23098/#_89857 als 8_9_QS8+2=10 für „0“ mit 89_0 für „HCN1“=890AS [HCN1 - Potassium/sodium hyperpolarization-activated cyclic nucleotide-gated channel 1 - Homo sapiens (Human) | UniProtKB | UniProt]._dat06.10.2023
Physik-Serie #1612: In der Serie #1613=QS=11=Zählgröße arbeitet der 10-fach segmentierte BiXnom-Kreis als Schaltuhr im Sekundentakt. In der Serie #1612=QS=10 mit 23 Zeilen steht die Uhr auf 0/24Uhr und reagiert, vermittelt über spezielle Proteine, auf Gleichgewichts- und Resonanzstörungen. Mit QS#1+6+1=8.Hirnnerv (VIII) für Hören und Gleichgewicht_2=2.Hirnnerv (II) zum Sehen als Gleichgewichtsmodule.
Phototransduktion: Zur Anpassung an wechselnde Lichtstärke der Netzhautzellen liegt das Protein (Mensch) „Calcium/Kalium-Natrium-Austauscher_ SLC24A1(NCKX1)“=1099AS vor, bei dem 1x Calcium + 1x Kalium gegen 4 Natrium-Ionen ausgetauscht werden, um Calcium aus der Zelle zu transportieren [Phototransduktion – Wikipedia]. „SLC24A1“ liegt in der Randspalte Z.38320#[00](8)(4){20}/#_[15](3){9}[79]/#_[519]{1}“9“[6]/#_“10“4“0“5“[3] absteigend als „10“_QS4+0+5=“9“_“9“ mit 10_9_9 für „SLC24A1“=1099AS, angehängt Spalte 9/1 mit Kalium=19E_Spalte 8/3=QS= =11_4-fach mit Ziffer „4“_Calcium=20.
Das zyklische GMP (cGMP)=178E ist der primäre intrazelluläre Botenstoff für den visuellen Signalweg, um den Lichtreiz in ein elektrisches Signal umzuwandeln. „cGMP“ wird als Reaktion auf Stickstoffmonoxid (NO) synthetisiert und von Phosphodiesterasen (PDE) im Gleichgewicht abgebaut. Stickstoffmonoxid (NO)=7+8=15E liegt als Spalte „1/5“ mit 1_5 für NO=15E vor, wobei die Ziffer „1“ das Photon „1“ für den Lichteinfall darstellt. Phosphodiesterasen (PDE) katalysieren den hydrolytischen Abbau von „cAMP“ und „cGMP“. Für die Stäbchen- und Zapfen-Photorezeptoren ist das Protein (Mensch) „Photorezeptor-Phosphodiesterase (PDE6)“=860AS zuständig [„Photorezeptor-Phosphodiesterase (PDE6): Aktivierungs- und Inaktivierungsmechanismen während der visuellen Transduktion in Stäbchen und Zapfen | SpringerLink“ ; R. Cote (2021)]. Die Position ergibt sich hilfsweise bevorzugt aus dem Cofaktor „Zink“=30E und an 2. Position kreuzend „Magnesium=12E/Mangan=25E“. Bei der Katalyse wird zyklisch GMP (cGMP) in GMP umgeformt. „PDE6“ liegt folglich in der Spalte Z.38318#_[17]“2“[0]082/#_[7]“5“1“1“008/#_[3]“3“0“2“153, und zwar ringförmig als QS5+3=8_QS0+2_1+1_2=6_0 mit 8_6_0 für PDE6D=860AS [PDE6A - Rod cGMP-specific 3',5'-cyclic phosphodiesterase subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Im Ergebnis liegt GMP=C10H14N5O8P=60+14+35+64+15=188E seitlich als „1“_QS0+0+8=“8“_QS0+8=“8“ als 1_8_8 für GMP=188E vor. Das Auge wird durch die lesbare Hyaluronsäure=200E avisiert, hierbei handelt sich dann aber um das Protein (Mensch) „Guanylylcyclase-Aktivierungsprotein_GUCA1B“=200AS, das 2 retinale Guanylylcyclasen („GUCY2D“ /„GUCY2F) im Falle einer niedrigen Calcium-Konzentration aktiviert bzw. entgegengesetzt hemmt. Die „3“ Proteine liegen in der Randspalte Z.38319#_{200}(82535)/#_“11“00“8“420/#_“021“[53979]. „GUCA1B“=200AS ist lesbar [GUCA1B - Guanylyl cyclase-activating protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die beiden Guanylylcyclasen teilen sich die Zahl „11“. Rechts liegt dann mit „08“ das „GUCY2F“=1108AS [GUCY2F - Retinal guanylyl cyclase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Folgezeile wird die Zahl „11“ ergänzt mit 0_QS1+2=3 für „GUCY2D“=1103AS [GUCY2D - Retinal guanylyl cyclase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Calcium liegt bei einem Überschuss lesbar am unzugänglichen Zeilenrand. Bei einem Mangel wird die Strecke inclusive der Ca-Ziffern 2_0 als QS=20=Calcium summiert, so dass die beiden Proteine angeschlossen und aktiviert sind. Für die Katalyse liegen „GTP“=268E und das „Cyklische Guanosinmonophosphat (cGMP)“=C10H12N5O7P=60+12+35+56+15=178E links in der Spalte Z.38319#“12“[9](1)[7]{2}/#_“1“28“(7)(5){1}/#_“1“28“[3](3){0} für GTP=268E mit Spalte 1/1=QS=2_QS12+28+28=68 als 2_68 für GTP=268E. „cGMP“()=178E als Spalte 1/7 für 1_7_ Spalte 5/3=QS=8 mit 17_8 für „cGMP“=178E. Der Komplex wird vom Protein „Transducin“ erkennbar überlagert, weil eine Untereinheit eine Magnesium-Bindung benötigt, und zwar „GNAT2“ in der Spalte „1“[008]/“2“1“5/3“ mit „3“_“5“_QS0+2+1_1=“4“ für 354AS [GNAT2 - Guanine nucleotide-binding protein G(t) subunit alpha-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „GNAT1“ verkürzt mit 3_5_0 für 350AS [GNAT1 - Guanine nucleotide binding protein (G protein), alpha transducing activity polypeptide 1, isoform CRA_a - Homo sapiens (Human) | UniProtKB | UniProt]. “GNB1“ aufsteigend in der Spalte [7]“2“[00]/[5]“1“1“0“/[30]“2“1“ als QS2_1=“3“_QS2_2+1=“4“_“0“ mit 34_0 für „GNB1“=340AS [GNB1 - Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „GNGT1“=74AS liegt in der Spalte „7“2“0/[5]“1“1“ als „7“_QS2_1+1=“4“ für 74AS [GNGT1 - Guanine nucleotide-binding protein G(T) subunit gamma-T1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Transducin“ liegt am Photorezeptor „Rhodopsin“ von Stäbchen. „Rhodopsin“ enthält das Membranprotein „Opsin“ und „11-cis-Retinal“. Das „Rhodopsin“=348AS [RHO - Rhodopsin - Homo sapiens (Human) | UniProtKB | UniProt] liegt am rechten Zeilenrand, um das einfallende Licht mit der Ziffer „1“=1 Photon (Lichtquant) abzugrenzen, auf das es reagiert, und zwar in der Randspalte „34“{1}/[5]“3“5“ mit 34_QS3+5=8 mit 34_8 für „Rhodopsin“ =348AS. Am Rand folgt die Zahl „20“, und zwar statt Calcium=20E gilt die Zahl für das spezielle Opsin für Stäbchen „Scotopsin“ mit 20 AS. „11-cis-Retinal“=C20H28O=120+28+8=156E wird bei Lichteinfall in All-trans-Retinal=156E überführt, wodurch das Rhodopsin aktiviert wird. Am Zahlenrand nimmt „11-cis-Retinal“=156E das Photon „1“ auf, und zwar als „1“_“5“_QS4+2+0=“6“ mit für 156E. Der „BiXnom“ kennt somit auch ein neutrales, masseloses Elementarteilchen, so dass „BiXnom-Lichtkugeln“ thematisch ins Bild passen. Das „All-trans-Retinal=156E“ nimmt die Zählung der Ziffer „6“ für „11-cis-Retinal“=15“6“E auf und zieht als Schleife ins Zentrum, wobei „Rhodopsin“ aktiviert wird. All-trans-Retinal=156E liegt in der Randspalte Z.38318#_9376341/#_0082535/#_“1“0“0“8“4“2“[0], und zwar als „1“_Kunstgriff QS0+0_8+2=10 für „0“_“5“_QS4+2=6 mit „1“_Summe 0+5=“5“_“6“ als 1_5_6 für All-trans-Retinal=156E.
Binokular-Sehen: Beim räumlichen Sehen werden minimal verschiedene Bilder, die sich aufgrund abweichender Fixationspunkte der beiden simultan koordinierten Augen abbilden, im Gehirn gestützt auf Erfahrungen räumlich vereinigt. Bei weit entfernten Objekt laufen die Gesichtslinien parallel. Das „beidäugige Sehen“ ist für das „stereoskopische Sehen“ erforderlich. Für die Nähe beim Zeitungslesen ist zum Fokussieren ein erlernter „Kreuzblick“ erforderlich. Die „Evolution“ schneidet aus dem Zeilenlauf auf Mustern basierende Protein-Pfade als eine Kettenlänge zurecht, so dass das räumliche Sehen irgendwo bereits vorbestimmt ist. Ein geeigneter „Bildschirm“ wird in Z.38325#_6“64“6/#_6“22“6 abgebildet. Die Zahl Biologie „64“ ist lesbar und kann nochmals doppelt durch eine Kreuzblick erfasst werden, wenn keine Spiegelung erkannt wird, sondern beidseitig nach innen auf einen gemeinsamem Fixpunkt fokussiert wird [6_QS2+2=4 / QS2+2=4_6]. Retinale Ganglienzellen (RGZ) lösen ein Aktionspotential aus. Ihnen sind gegensätzlich wirkende Bipolarzellen (Nervenzellen der Netzhaut) vorgeschaltet. Die ON-Bipolarzelle wird mittels Protein (Mensch) „mGluR6)_Metabotroper Glutamatrezeptor“=877AS erregt [Bipolarzelle - DocCheck Flexikon]. Das erforderliche Calicium=20E ist in der Spalte Z.38326#_62{2}“6“1“1“{7}[6]/#_258{0]“5“3“6“{3}[9]/#_[253846]{32} als Spalte 2/0=Calcium=20E vorhanden. „GRM6“ ringförmig neben Calcium als QS5+3=“8“_QS6+1=“7“_QS1_6=“7“ mit 8_7_7 für „GRM6“ (Zentrum). Glutamat mit Glutaminsäure=78E seitlich als 7_QS3_3+2=8 mit 7_8 für Glutaminsäure=78E [GRM6 - Metabotropic glutamate receptor 6 - Homo sapiens (Human) | UniProtKB | UniProt]. „GRM6“ kann sich alternativ nach links verschieben, und zwar als 8_QS2+5=7_QS6+1=7 für „GRM6“ 877AS (Rand), wenn es aus der Spalte „61/53“ verdrängt wird. Die Erregung der OFF-Bipolarzelle wird durch das Protein (Mensch) „Connexin-36“= 321AS vermittelt, dass die Zentrum-Spalte „61/53“ selbst als „3“_QS6+5=11=QS=2_1 mit 3_2_1 für „Connexin-36“= 321AS (Zentrum) beansprucht. „Connexin-36“ kann bei Lichtwechsel ebenfalls links eine Ausweichposition besetzen, muss aber das für „GRM6“ notwendige Calcium umgehen, und zwar in der Spalte Z.38327#_“1“2“5“[8053]/#_[12]“5“3“8“4“6“ als QS1+2=“3“_Kunstgriff Spalte 5/5=QS=10 für „0“_QS3+8+4+6=“21“ mit 3_21 für „Connexin-36_GJD2“=321AS (Rand) [GJD2 - Gap junction delta-2 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAP1B“=569AS sucht einen Weg für das Axon der Ganglienzelle mit der Randspalte Z.38327#_[9540]/#_“2“3“4“0“/#_[4]“6“7“7“ als QS2+3=5_6_QS4_7=11=QS=2_0_7 mit „56“_Summe 2+0+7=“9“ für „MAP1B“=569AS [MAP1B - Microtubule associated protein 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Aktionspotential durch Anhebung von -70mV (-120mV) auf +20mV erfordert +90mV (+140mV) mit QS2+3_5+40_40=+90mV (QS2+3_95_40=+140mV). Der gesamte Zeilenbereich wird vom CNG-Kanal durchzogen, um diesen Stereo-Bereich mit anzuschließen. Das elektrochemische Kanal-Signal setzt sich über Nervenzellen bis ins Sehzentrum des Gehirns fort. Der Kanal schließt die Zahl „1“ für den Riechnerv (1. Hirnnerv) ein, weil die zyklisch Nukleotid-gesteuerten (CNG) Kanäle zugleich für die visuelle und die olfaktorische Signaltransduktion notwendig sind. Die Bildung des CNG-Kanal setzt voraus, das das Protein (Mensch) „CNGB1_Untereinheit Beta“=1251AS „drei“ Proteine „CNGA1_Untereinheit Alpha“ anlockt, um gemeinsam einen CNG-Kanal zu bilden. Merkmal für „CNGB1“ ist „1“ Molekül „Arginin (R/Arg)“= C6H14N4O2=36+14+28+16=94E, das als Sperre im Kanal liegt [Die Struktur des nativen CNGA1/CNGB1-CNG-Kanals aus bovinen Netzhautstäbchen | Natur, Struktur- und Molekularbiologie (nature.com); D. Barret u.a. (2022); https://doi.org/10.1038/s41594-021-00700-8]. „CNGB1“ liegt in der Spalte Z.38322#_[9](3)“51“[9]/#_[8](5){1}“0“{4}/#_[7](6){9}“0“8/#_(6)(8)“93“{2}/#_{61176}, und zwar als QS9+3=12_QS0+0+51=51 mit 12_51 für CNGB1“=1251AS. Arginin=94E markiert den 1. Hirnnerv{1} und wird in der Funktion als Kanalsperre von der Kanalspalte 9-„0/0“-4 symbolisch durchlaufen. Die Bindung an das „Cyclische Guanosinmonophosphat (cGMP)“=C10H12N5O7P=60+12+35+56+15=178E ist angehängt als „cGMP“=“17“_QS6_2=“8“ für „cGMP“=178E. Die Bindung an das Cyclische Adenosinmonophosphat (cAMP)“=C10H12N5O6P=60+12+35+48+15=170E ist in der Spalte Z.38319#_[2]“0“0“[82]/#_“1“1“0“0“[8]/#_[0](2)“15“[3] als Schleife vorgelagert, und zwar als QS1+1=2_QS0+0_0_15=15 mit Summe 2+15=17_0 für cAMP=170E [CNGB1 - Cyclic nucleotide-gated cation channel beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CNGA1_Untereinheit Alpha“=686AS besitzt eine Bindung an cGMP=178E und muss sich 3-fach bilden und dabei an „CNGB1“ orientieren. „CNBB1(1.Zählung/I)“ liegt am rechten Rand und enthält die Schwerachse „84“ als vertikale Z-Achse. Die Randspalte 0/9 ist mit 90° als rechtwinklig erkennbar. „CNBB1(I)“ in der Randspalte Z.38320#_100842/#_2153979 als QS1+5=“6“_QS0_8=“8“_QS4+2=“6“ mit 6_8_6 für „CNBB1(I)“=686AS. „cGMP“ aufsteigend in der Randspalte [9]“7“[9]/“1“9“[6]/[0]“5“3“ als QS7+9+1=17_QS5+3=8 mit 17_8 für „cGMP“=178E [CNGA1 - cGMP-gated cation channel alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „CNBB1(2.Zählung/II)“=686AS zieht sich weit, und wird als X-Achse gewählt werden, die den Horizont symbolisiert, und zwar 6-zeilig, in beide Richtungen zählbar, absteigend in der Spalte Z.38319#_“2“[0]/#_“1“1“/#_/#_[0]“2“/#_[9]“3“/#_[8]“5“/#_[7]“6“ als QS2_1+1_2=“6“_QS3+5=“8“_“6“ mit 6_8_6 für CNBB1(II)“=686AS. Der 90°-Achswinkel liegt als Horizont vor, und zwar mit „seitlich=“9“_0_“9“=seitlich“. „cGMP“ liegt links am Protein in der Spalte Z.38319#_“17“(2)[0]/#_[7]“5“(1)(1)/#_[3]“3“[0](2) als 17_QS5+3=8 mit 17_8 für cGMP=178E. „CNBB1(3.Zählung/III)“=686AS bildet die Y-Achse als Blick in die Tiefe und die Nähe. Die Zählung zur linken Seite beginnt mit einem Kunstgriff, um seitlich die Serienziffer „2“ als Symbol-Pfad für den „2“. Hirnnerv (Sehnerv) zu symbolisieren, und zwar in der Spalte Z.38323#“2“7“4“[8]{8}(5)/#_“2“[70]{6}{7}(6)/#_“2“6“[6]{4}[6]“8“/#_[2]“6““2“2“6“1“ als Kunstgriff mit „8“_QS2+2+6+1=11=QS=“2“ als Summe 8+2=10 für „0“_ absteigend „6“ mit Summe 0+6=“6“_QS2+6=“8“_QS2_2_QS7+4=11=QS=2 mit „68“_Summe 2+2+2=“6“ mit 68_6 für „CNBB1(III)“=686AS. „cGMP“{}=178E absteigend als QS4_6+7=17_8 für cGMP=178E [CNGA1 - cGMP-gated cation channel alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Seitlich an der 64er-Bildspalte erfolgt die Übergabe an die 63er-Physik-Spalte, die auf Ubiquitin=76AS verweist und in der Schlusszeile Z.38329 das lesbare Protein (Mensch) „ASB10“=467AS enthält. „ASB10“ bindet an der ANK-Domäne von abzubauenden Proteinen und markiert diese über den durch die SOCS-Box gebundenen E3-Ubiquitin-Ligase-Komplex mit einer Polyubiquitinkette. Die ANK- Domäne vieler Proteine ist eine Wiederholung von 33 Aminosäuren [ASB10 - Ankyrin repeat and SOCS box protein 10 - Homo sapiens (Human) | UniProtKB | UniProt]. „ASB10“ enthält „Ankyrin“, das im Gehirn spannungsabhängige Ionenkanäle mit dem Zellskelett verbindet [Ankyrin - Lexikon der Biologie (spektrum.de)]. Das Protein (Mensch) „Ankyrin-1“ =1881AS zieht durch die Spalte Z.38326#_“1“1“7“[6294]/#_36“39“[540]/#_“6“3“22“[340]/#_“9“2“2{467}[7] als „1“_QS1+7=“8“_QS39_22_6+3_9+2=61+9+11=“81“ mit 18_81 für Ankyrin-1=1881AS. Der Durchlauf der Zahl „22“ hängt sich in die ANK-Domäne „3“_22_“3“ [ANK1 - Ankyrin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Ankyrin-1“ bindet an das Protein (Mensch) „Spektrin Beta“=2364AS in der Spalte Z.38328#“6“3“2“[2340]/#_“9“2“[24677] als 2_3_6_QS9+2=11=QS=2_2 mit 236_Summe 2+2=“4“ für Spektrin-beta=2364AS [SPTBN1 - Spectrin beta chain, non-erythrocytic 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Innenohr enthält das Gleichgewichtsorgan (Vestibularapparat) mit „3“ Bogengänge (Canales semicirculares ossei) zur Wahrnehmung der Drehbeschleunigung im rechtwinkligen Koordinatensystem X_Y_Z über Sinneshaare. Kristalle rutschen nur versehentlich und schmerzhaft in die Bogengänge. Die Kristalle dienen mittels Sinneszellen zur Wahrnehmung der linearen Beschleunigung im „großen“ Vorhofsäckchen (Utriculus) und im im „kleinen“ Vorhofsäckchen (Sacculus). Im Zentrum liegt die Kristall-Spalte Z.38332#_(19)“2“(48)/#_xx„0“/#_xx„0“/#_x(1)„2“(48), die Calcium=20E in Spiegelform als eine Messspalte „2-0-0-2“ den Null-Durchgang enthält. An beiden Enden liegt das Calciumcarbonat=CaCO3=20+6+24=50E als QS2+48=50E vor. Integriert sind an beiden Enden mit „24“_“8“ die Zeitbasis „24“ und der speziell zuständige „8“. Hirnnerv (Hör- und Gleichgewichtsnerv / Nervus vestibulocochlearis). Der Proteinanteil im Bio-Kristall liegt etwa bei 10%. Die 3 Ohr-Bogengänge (Kreis=64) des Menschen liegen kompakt mit der Summe=3*64=“192“ an der Messspalte. „Otolithen“ (Otokonien) sind kleine Körnchen aus kristallinem Calciumcarbonat, die in einer Proteinmatrix eingebettet sind. Die Sinnesleiste in den Bogengängen enthält eine gelartige Masse, über deren Bewegung die Sinneshaare gebogen werden. Die Gallertmembranen werden vom Glykoprotein (Mensch) „Otogelin“=2925AS gebildet [OTOG - Otogelin - Homo sapiens (Human) | UniProtKB | UniProt]. Würde die Masse wie in Gelenken aus Hyaluronsäure=200E bestehen, ergäbe sich ein einfacher Zusammenhang: Die Summe der Bogengänge=“192“ summiert sich zur Hyaluronsäure=200E, wenn die Messpalte bis zum „8“. Hirnnerv in 4“8“ durchläuft, und zwar als „192“_QS_0_rechter Rand 2_2_4 {8}=Hirnnerv VIII mit Summe 192+0+2+2+4=Hyaluronsäure=200E. Die Sinneshärchen liegen in der Randspalte „1“6/“1“5/63 mit Härchen „1“, Vielzahl als Zählgröße QS6+5=“11“ und die Drehbeschleunigung mit Physik=63 sowie dem gekrümmten Härchen in der Spalte 01/63 mit der Haarbiegung QS1+63=Kreis=64. „Otogelin“ nähert sich dem 8. Hirnnerv von der rechten Seite, wenn die Haarspalte 1/1 über 2 Kunstgriffe an die Zählung anhängt wird. Die „3“ Bogengänge „192“ werden nach links durchlaufen, und zwar in der Spalte Z.38332#_„1“9“2“4/#_“1“3“0“2“ als „29“_Spalte 1/1=QS=“2“_QS3+0+2=“5“ mit „29_2_5“_1.Kunstgriff 2+8=10 für „0“_2.Kunstgriff QS8+1_0+1=10 für „0“ mit 2925+0+0=“2925“ für „Otogelin“=2925 AS. Das Protein „Otogelin-like_OTOGL“=166AS sammelt arbeitsteilig den Physik-Anteil ein, und zwar schleifenförmig in der Randspalte Z.38334#_[88]“1“/#_{8}“0“1“5“/#_[6]“6“3“[0] als „1“_QS6_5=11=QS=2_1_3=“6“_QS6_0{8.Hirnnerv}=“6“ mit 1_66 für „OTOGL“=166AS [OTOGL - Otogelin like - Homo sapiens (Human) | UniProtKB | UniProt]. Gegen Schwindel blockiert der Wirkstoff (Antivertiginosa) „Cinnarizin“=C26H28N2=156+28+14=198E die Calcium-Kanäle, was die Weiterleitung von Nervenimpulsen vom Vestibularorgan verhindert. Außerdem wird der Histamin H1-Rezeptor=487AS blockiert [HRH1 - Histamine H1 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „Cinnarizin“=198E zieht von den Bögengängen „192“ durch die „Ca-Messspalte“ bis an den 8. Hirnnerv und blockiert ihn, und zwar als „19“_QS2_0_0_2+4 {8}=“8“ mit 19_8 für „Cinnarizin“=198E. Der lesbare Botenstoff „Histamin“= C5H9N3=30+9+21=60E kann vom Rezeptor „HRH1“=487AS nicht in die vom Wirkstoff besetzte Messspalte abgegeben werden. „HRH1“=487AS in Z.38334 als QS2+2=4_8_Schleife mit Kunstgriff durch Histamin „60“ zum Nerv=7 mit 6_4_0_0=10 für „0“_7 mit „48“_Summe 0+7=“7“ als 48_7 für „H1-Rezeptor“=487AS. Der Kombinationswirkstoff gegen Übelkeit „Dimenthydrinat“= C24H28ClN5O3=144+28+17+35+24=248E ist in der Folgezeile lesbar und blockiert den 8. Hirnnerv am Ende der Messspalte.
Wie bereits bekannt, entsteht die BiXnom-Schwerachse aus Kreis=64+Calcium=20=„84“(Symbol). Im Vestibularorgan des Innenohres vermitteln die Kristalle die Wahrnhemung von Beschleunigung und Schwerkraft über Sinneshärchen. Beim Zebra-Fisch dient das Kristall dem Hören und nicht dem Gleichgewicht. Dessen kleine Steinchen (Otolithen / Statokonie / Otokonie) werden vom Protein (Zebrafisch) „STM_Starmaker=613AS gebildet, und zwar an der Messspalte als QS6_0=“6“_“13“ für STM1(Zebrafisch)=613AS [stm - Protein starmaker - Danio rerio (Zebrafish) | UniProtKB | UniProt]. Der Fisch kann damit die runde Kristallform über „6“_QS1+3=“4“ mit 6_4=Kreis=64 erzeugen. Die Merkmale sind in Proteinen vorinstalliert und werden über Hilfsprozesse realisiert. Die Kristallform bildet sich sternförmig statt rund, wenn das „Starmaker“-Protein nicht korrekt funktioniert. Die Abrundung erfolgt durch Schrumpfung, gemessen im Labor, von „58“µm auf „32“µm. Eine Gitter-Schrumpfung kann experimentell durch Magnesium aktiviert werden (kleinerer Ionen-Radius als Calcium) [Gitterschrumpfung durch Einbau von rekombinantem sternmacherähnlichem Protein in bioinspirierte Kalziumkarbonatkristalle - Różycka - 2019 - Chemie – Eine europäische Zeitschrift - Wiley Online Library]. Die Otokonie (Ohrsteinchen) des Menschen enthält im Inneren drei Aufzweigungen (branches), die von einer bauchigen Region (belly) umgeben ist [3 D Modell einer humanen Otokonie - Statolith – Wikipedia]. Im Zeilenlauf bilden 8 Zeilen einen Zusammenhang, der die Messpalte zentral einschließt. Die Kristall-Maße (Zebra-Fisch) beginnen 2 Zeilen vor der Messspalte mit der Zeile Z.383“3“0“#“16“12“454“32“34“65“34“ für den Kristalldurchmesser (Fisch) mit Schrumpf-Symbol Mg=“12“_Durchmesser QS4+54=58µm Ausgangsgröße [Zebrafisch]_32µm Zielgröße_QS3+4=Form_QS6+5=“11“=Zählgröße_Form=3+4=“7“. Der Faktor 10^3 für 1000nm=1µm liegt in der Z.Nr.xxx“3“0“# QS1+6=“7“=Form als Rundung „0“(Null). Die Zahl 34=QS=7=Form wiederholt sich am Ende des 8-zeiligen Bereichs in Z.3833“7“#_0_“34_4_Krümmung=64_5=Struktur. Mit DELTA.TIME.EPI.VIR.Z.38330-Z.38337=#“29“44“20“ ergibt sich QS2+9=“11“=Zählgröße_Gruppe „44“ [Mineral /Protein]_Calcium=“20“. Beim Menschen bilden die 3 Bogengänge ein rechtwinkliges dreidimensionales Koordinatensystem. Dieses System liegt zweizeilig in der Messspalte Z. Z.38333#[161232]“8“1“3“[02]“90“[52]/#[161]“2“2“86“[070]“2“88“[16]. Für die vertikale Z-Achse liegt der lesbare 90°-Winkel an die BiXnom-Schwerachse mit „8“_QS1+3=“4“ für Schwerachse=84_{02=gespiegelt Calcium}_Winkel=90°. Die X-Y-Ebene liegt in 1 Zeile, wobei die Achsen von der Messspalte getrennt werden, und zwar als QS2+2+86=X-Achse=90°_0_7=Form_0_QS2+88=Y-Achse=90°. Aufgrund dieser breiten Ebene benötigt der Mensch ergänzend zum Protein (Mensch) „Otolin-1“=477AS das Hilfsprotein (Mensch) „OC90“=477AS, dass den äußeren Rand mit umfasst. Der Fisch hat dafür keinen Bedarf. Das Protein (Mensch) „Otolin-1“=477AS liegt in der Spalte Z.38332#_[23]{7}{0}“1“9“2“[4]/#_{2}{3}{2}[8]“1“3“0“2“/#_{2}{2}[860]“7“0“2“ als Ring, und zwar aufsteigend QS1+3=“4“_“7“_absteigend QS0+2_0+2=4_QS9+2=11=QS=2_1 mit „47“_Summe 4+2+1=“7“ als 47_7 für„Otolin-1“=477AS. Es bildet sich ein organisches Gerüst für Otokonien (Ohrsteinchen) in beiden Vorhofsäckchen (Utriculus / Sacculus) und Calcium wird darin gebunden. Wenn sich der Ring schließt wird die Spalte 1/1 zusammengefügt. Das Protein verbindet hierbei die Verbindungsfibrillen „11“ zwischen den Otokonien [OTOL1 - Otolin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Am linken Rand ist das Protein (Mensch) „Otoconin-90“={}477AS über eine Ziffer „0“ mit Otolin-1=““477AS verbunden, und zwar als QS2+2=“4“_QS2+3+2=“7“_QS7+0=“7“ für „Otoconin-90“=477AS. Weil das Protein keine Phospholipase A2-Aktivität erkennen lässt, ist auch der übliche Cofaktor „Calcium“ einer „Phospholipase A2“ nicht vorhanden, so dass das Protein außerhalb der Calcium-Spalte liegt [OC90 - Otoconin-90 - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Messung wird die Erdbeschleunigung g=9,81m/s² auf Nanometer-Bsais mit 981*10^7nm/s² benötigt, wobei die Zeitbasis=60 an der Messspalte liegt. Für die Beschleunigungsbasis=„60^2“ als Kopplung ähnlich „60_60“ zieht eine S-förmige Kette durch die Messspalte um Calcium „20/02“ zu durchlaufen. Die Beschleunigungsbasis= „60^2“ liegt in der Spalte Z.38332#_[0]“19“2“[4]/#_[8]“1“3“0“2“/#_“60“7“[0]“2“/#_[401]“2“4“, und zwar als „60“_über linke Seite absteigend mit QS7_3=“10“_QS1_19=“20“_ aufsteigend in Calciumspalte 2/0=“20“_weiter an rechter Seite QS2_2_4_aus Spalte 2=“10“ als 60^2-Kette „60“_QS10+20+20+10=“60“ für „g-Basis“=60_60 um die Messspalte. Die Erdbeschleunigung 981*10^7nm/s² wird für die Koordinaten X, Y, Z gesondert codiert. Die Bögen messen die Drehbeschleunigung in 3 Achsen, Sacculus misst die vertikale (Z) und Utriculus die horizontale (X/Y) Beschleunigung. „g“(„Z“-vertikal) liegt zentral und L-förmig in der Randspalte Z.38332#_{7}[01]“9“2“48738/#_{2}{81}“3“029052/#_860“7“028816/#_440“1“2“4“8“0“1“[5] aufsteigend als QS9+2=11=QS=“2“_Kunstgriff 3_7=10 für „0“_QS1+2+4=“7“ mit Summe 2+0+7=9_8_QS0+1=1 mit 9_81 für g „Z“=981*10^7 nm/s². „g“{X}-horizontal liegt links neben der Ziffer „3“ von g(„Z“) über Spalte 7/2=QS=9_81 für „g{X}“=981*10^7 nm/s². „g“(Y)-horizontal liegt als lesbare 1.Variante unabhängig auf der rechten Seite in der Spalte „90“[5]/[8]“8“1“ mit QS9+0=“9“_“81“ für g(Y)=981*10^7 nm/s². Damit die horizontale Ebene X/Y erfasst ist, wird die Zahl „9“ alternativ mit einer Kopplung an g{X} gezählt, und zwar als QS0+1=“1“_QS9+2=11=QS=“2“_4_2=9_Kunstgriff 2+8=10 für „0“ mit Summe 9+0=“9“_“81“ für g(Y)=981*10^7 nm/s². Für die 3 Achsen der Drehbeschleunigung muss sich um jede Achse ein Kreis=64 als Drehmoment legen. Für die Z-Achse zieht der sich der Kreis durch die Messachse als „6“_QS2+0+0+2=“4“ für Kreis=64. Für die X-Achse liegt der Kreis neben der Zahl 7/2=QS=9 als Spalte „2“3“(7)/“2“3“(2) mit QS3_3=6_QS2_2=4 für Kreis=64. Für die Y-Achse zieht der Kreis durch den 90°-Winkel in der Spalte 290“5“ /288“1“ mit Spalte 5/1=QS=“6“_QS2+9=11=2_2 mit „6“ Summe 2+2=4 für Kreis=64. Für die Hörfunktion ist ein lauter Knall wie beim Raketenstart mit „4g“=4-fach 981*10^7 nm/s²=“3924“ nm/s² geeignet, den „irdischen Code“ gegen die Schwerkraft zu verlassen, um zurück im freien Fall die Zeilen-Nr.-Matrix zu testen, weil dort die Membran „33“ als Serie beginnt, und zwar in der Spalte Z.[383]“3“0“#[161245432]/#_161“2412“2“[5]/#[1612370]“1“[9]. Der Fisch bleibt im Wasser. Piloten üben in Human-Zentrifugen bis „10g“. „Raketenstart-4g“=3924nm/s² über Spalte 2/1 mit QS1_2=“3“_QS2+4+1+2=“9“_aufsteigend mit Kunstgriff zum Zeilenrand (Orbit) QS#1+6+1+2=10 für “0“ absteigend im freien Fall „2“_QS1_3+0=“4“ mit Landung in Z.383“30“ und einer „0“ als Schallempfänger an der Hörschnecke.
Die Erdbeschleunigung 981*10^7 nm/s² wirkt als Eingangsgröße in der Z.-Nrn.-Matrix „Z.“3“83“[30]/Z.[38]“3“3“1“]/ Z.[38]“3“3“[2] in der Schleife zur Randziffer „1“ über die Zeile Z.QS3+83=86_Spalte 33/33=QS=12 mit Summe 86+12=98_1 für die Zifferfolge „981“. Für die Potenz 10^7 bleibt die Kopplung am Code erhalten, die über 2 Halbwellen „32“ (je Ohr) als Balance zur Schallwelle=32+32=64 addiert wird. Das Protein (Mensch) „TMIE_Transmembran-Innenohr“=156AS nimmt die Ziffer „1“ auf und zieht neben die Ziffer „0“ als Schallempfänger (Mittelohr) und „0“(Null) in der Schallgeschwindigkeit=340m/s, und zwar in der Matrix Z.[383]“3“(0)/Z. [383]“3“1“/Z.[383]“3“2“ mit „1“_QS2+3=“5“_kompakt über Spalte 3/3 absteigend QS3_3=6 mit 1_5_6 für „TMIE“=156AS. Biologischer Prozess: „Sensorische Wahrnehmung von Schall“ [TMIE - Transmembrane inner ear expressed protein - Homo sapiens (Human) | UniProtKB | UniProt]. Die Schallgeschwindigkeit=340m/s=340*10^9nm/s liegt in der Spalte Z.[3833]“0“/Z.38“3“3“1“ absteigend als „3“_QS1+3=“4“_“0“ mit 34_0 für Ziffernfolge „340“_Anschluss Faktor 10^9 als „9_10“ am Matrixrand weiter absteigend in der Spalte Z.[383]“2“8“/Z.[3832]“9“ als „9“_QS2+8=“10“=Faktorbasis für „10^9“ als Schallgeschwindigkeit 340*10^9nm/s. Der Zebra-Fisch zählt sein Oberflächen-Protein (Zebra-Fisch/ Danio rerio) für das Hören über die Haut in der Code-Spalte Z.38331#[24]“1“{2}{2}/#“2“3“7/#_[0]{1}/#_[2328]{1} an einer Calcium-Spalte als Protein (Zebra-Fisch) „TMIE_Isoform A“=175AS als 1_7_QS2+3=5 für TMIE=175AS [Tmie - Transmembrane inner ear expressed protein isoform a - Danio rerio (Zebrafish) | UniProtKB | UniProt]. Protein (Zebra-Fisch) „TMIE_Isoform B“=231AS als 2_QS2_1=3_1 für TMIE=231AS [Tmie - Transmembrane inner ear expressed protein isoform b - Danio rerio (Zebrafish) | UniProtKB | UniProt]. Die leere „0“(Null) in der Calcium-Spalte dient als Schallempfänger und zugleich als Faktorbasis „10“ für die Schallgeschwindigkeit im Wasser=1500m/s=15*10^11nm/s mit QS2+3+2+8=15_Faktor Spalte 1/1 mit 11_0 für 10^11 als Schall im Wasser=15*10^11nm/s.
Der Mensch kombiniert die Halbwelle 64/2=32 am Z.Nr.-Matrix-Rand mit der Membran als Randspalte 32/3[3] als Spiegelung über den Code-Rand #1+6+1=QS=8 als Welle zum 8. Hirnnerv gespiegelt als Spalte 23/[2]3, wobei mit der Zahl -70mV das Ruhepotential anliegt, das keinen Nervenimpuls auslöst. Das Potential muss um 90mV angehoben werden, damit bei +20mV ein Impuls über Calcium=20E ausgelöst wird. Das Calcium liegt als QS1+19=20 gefolgt von der Calcium-Spalte „2/0“ an. Die Sinneshaare „1/1“ bilden einen Bereich für das Protein (Mensch) „STRC_Stereocilin“=1775AS in der Spalte Z.38332#[1]“2“3“7“0“1“[92]/#_[1]“2“3“2“[8130] mit „1“_QS7+0=“7“_QS2+3+2=“7“_QS2+3=5 mit 1_7_7_5 für Stereocilin=1775AS.
Das Protein ist an der Mechanorezeption von Schallwellen beteiligt. „Wesentlich für die Bildung von horizontalen Spitzenverbindungen zwischen den Stereozilien der äußeren Haarzellen“ [STRC - Stereocilin - Homo sapiens (Human) | UniProtKB | UniProt]. Seitlich in Z.38332#_19/1[3] liegt das Protein (Mensch) „G-Protein-Signal-Modulator_GPSM2“=92AS als 9_QS1_1=2 mit 9_2 für GPSM2=92AS, das mit G-Proteinen agiert [ GPSM2 - G protein signaling modulator 2 - Homo sapiens (Human) | UniProtKB | UniProt- G protein signaling modulator 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Serien-Code-Rand #16“1“2 enthält in der Härchen-Spalte „12/12“ den Cofaktor „Magnesium“=12E, um ein G-Protein anzulocken. Das Protein (Mensch) „G-alpha i3_guanine nucleotide-binding proteins (G proteins)_ GNAI3]“=354AS mit Guanin=C5H5N5O=30+5+35+8=78E liegt zentral in der Spalte Z.38332#_70/[2]8 als 7+0=7_8 für Guanin=78E. Das G-Protein wechselt die Bindungen von GTP=268E / GDP=228E, um Veränderungen (aktiv/passiv) wahrzunehmen. Das Heterotrimer kann 2-fach im Code mit Anschluss einer Zählung in der Z.Nr.-Matrix gebildet werden. Das GTP=268E wird über das „GPSM2=92AS“ in seiner Spalte 1/1 aufsteigend weiter gezählt. GTP in der Spalte Z.38332#_[2370]“1“9/#_[2328]“1“3/#_[228]“6“[07]/#_(22)(4)(4)[01] als QS1_1_0=“2“_“6“_QS4+4=“8“ mit 2_6_8 für GTP=268E. Das GDP=228E liegt lesbar an oder kann durch Umformung aus GTP mit „22“_QS4+4=8 als 22_8 für GDP ()=228E erzeugt werden. 1. Zählung: „G-alpha i3“=354AS wird mit einem Kunstgriff QS2+8=10 für „0“ an „GPSM2“ angeschlossen, und läuft C-förmig in der Spalte Z.38333#_“1“2“3“2“8“[1]/#_“1“[2286]/#_“1“2“2“[440] am linken Rand um GTP/GDP als „3“_2_QS1_1_1=3_QS2+2=“4“ mit „3“_Summe 2+3=“5“_“4“ als 3_5_4 für G-alpha i3“=354AS. 2. Zählung: „G-alpha i3“=354AS in der Randspalte Z.38331#“16“1“2“4“[122]_“16“[12](3)(7)(0)[1] mit Kunstgriff QS3+7+0=10 für „0“ mit GPSM2 verbunden, und zwar als QS16_16+1+2=35_4 für G-alpha i3“=354AS. 3. Zählung: „G-alpha i3“=354AS in der Z.Nr.-Matrix Z.[383]“3“1“/ Z.[383]“3“2“/ Z.[3833]“3“ als 3_QS3+2=5_QS3+1=4 für G-alpha i3“=354AS.
Die Haarbündel im Innenohr bestehen aus filamentösen (F)-Aktin-basierten Stereozilien. Diese werden durch Lärmeinwirkung geschädigt, wobei die Lücken durch das Protein (Mensch) „XIRP2“=3373AS repariert werden [Die Reparatur von rauschinduzierten Schäden an Stereozilien-F-Aktin-Kernen wird durch XIRP2 und seine neuartige Mechanosensordomäne erleichtert | eLife (elifesciences.org); E.Wagner u.a.; Juni 2023; https://doi.org/10.7554/eLife.72681]. Für die Reparatur ist ein Motiv aus 16 Wiederholungen erforderlich. Im Labor werden die Lücken mittels Phalloidin-Färbung von F-Aktin=374AS sichtbar. Phalloidin=C35H48N8O11S =210+48+56+88+16=418E [Phalloidin – Wikipedia]. Der Bruch einer Faser wirkt sich kaskadenartig aus, so dass Lücken im Haarbündel entstehen. Auch das monomere beta- und gamma-Aktin ist an der Reparaturstelle vorhanden. Die vestibulären Haarzellen des Utriculus werden ebenfalls repariert. Es existiert eine lange Isoform an Zellübergängen und eine kurze Isoform in Stereozilien. Phalloidin: In der Spalte Z.38330#_[4](3)(2)[34]/#_“(2)“(2){“(5)“68}/#_[0]“19“24/#_“8“13“02 wird die Lücke „0“(Null) von Phalloidin““=418E als QS2+2+5_19_13=41_8 für Phalloidin““=418E eingeschlossen. Das F-Aktin liegt als „3“_QS2_5=7_QS2+2=4 mit 3_7_4 für F-Aktin()=375AS vor der Lücke. Ein Aktin-Monomer=475AS kann durch die Lücke „0“ ziehen, um die Ziffer „1“ für 475AS zu addieren. Das aktinbindende Protein „Tropomyosin“ {}=568AS ist gekoppelt am Aktin lesbar. XIRP2=3373AS liegt in der Randspalte Z.38331#“1“6“1“2“[412]“2“[5]/#_[161]“23“7“0“1“[9]/#_161232813 und zieht mit der Ziffer „3“ durch die Lücke als QS1+6+1+2_23=“33“_“7“_QS0+1_2=3 mit 337_3 für „XIRP2“=3373AS [XIRP2 - Xin actin-binding repeat-containing protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „XIRP2_Isoform_A0A5F9ZHW6“()=946AS zieht direkt durch die Faser (1/1) als QS92+1_1=94_Kunstgriff QS2+8=10 für „0“_Membran als Spalte QS3_3=6 mit 94_6 für „XIRP2_Isoform_kurz“=946AS [XIRP2 - Xin actin binding repeat containing 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „XIRP2_Isoform_ A0A5F9ZH43“=3837AS zieht durch die Faser und umklammert ringförmig die Lücke [0] in der Spalte Z.38331#_[12]“4“1“22“/#_[12]“37“[0]“1“/#_[12328]“1“ als QS1_1_22=24_mit 1_4 für 14 als Summe 24+14=“38“_“37“ für„XIRP2_Isoform_lang“=3837AS [XIRP2 - Xin actin binding repeat containing 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Otoferlin“=1997AS ist ein Calcium-Ionen-Sensor, der mit den Synapsen der inneren Haarzellen der Hörschnecke (Cochlea) interagiert, um Neurotransmitter freizusetzen. Links neben der Calcium-Spalte 20_02 liegt eine Kalium-Spalte 1_00_9, die zusammen als Schleife durchlaufen wird, um am Anfang der Calcium-Spalte am Cofaktor „Calcium“ 2/0=20E 5-zeilig zu binden, wobei die Zahl „70“ als Ruhepotential -70mV eingeschlossen wird, und zwar in der Spalte Z.38332#_[1]“92“[4]/#_[1]“3“0“2“/#_„0“[70]“2“/#_“0“[1]“2“4“/#_[1]“9“5“6“[8] als „1“_QS0_0_9=“9“_Kunstgriff QS5+6=11=QS=2_2+4_2=10 für „0“_QS3+0+5_92=97 mit 19 (Kalium)_Summe 0+97=“97“ als 19_97 für „Otoferlin“=1997AS [OTOF - Otoferlin - Homo sapiens (Human) | UniProtKB | UniProt]. Im Unterschied zum Neuron wird kein Natrium benötigt, sondern die Haarzelle öffnet spannungsgesteuerte Kaliumkanäle. Kanal-Defekte führen zur Schwerhörigkeit. Das Protein (Mensch) „Kalium-Kanal_KCNQ4“=695AS legt einen Ring um die Kanal-Null [0] in der Spalte Z.38333#_“8“1“3“/#_“6“[0]“7“/#_“4“0“1“ als „6“_QS8+1=“9“_Kunstgriff QS3_7=10 für „0“_QS4+0+1=“5“ mit „69“_Summe 0+5=“5“ für „KCNQ4“=695AS [KCNQ4 - Potassium voltage-gated channel subfamily KQT member 4 - Homo sapiens (Human) | UniProtKB | UniProt]._dat11.10.2023
Die Serie „Physik #1611“ enthält QS1+6=“7“=Nerv, die Zählgröße „11“ und den Kreis „64“ in der letzten Z.Nr.383“64“, um die Lage der Nervenstränge im Hirnstamm zu ordnen. Die Proteine ziehen über mehrere Zeilen, so dass jeweils eine Kernzeile benötigt wird, um die Reihenfolge im Hirnstamm darzustellen. Der Hirnnerv XI (N. accessorius) ist ein motorischer Nerv. Der Hirnstamm (Truncus cerebri / brain stem) zieht sich vom Mittelhirn (Mesencephalon) bis zum verlängerten Mark (Medulla oblongata), wobei das Kleinhirn (Cerebellum) seitlich am Hirnstamm angeschlossen ist. Die Vierhügelplatte (Quadrigemina) bildet das Mittelhirn-Dach (Tectum mesencephali), so dass das Mittelhirn an der Z.38347 über die Spalte „4/4/4/4“ erwartet wird. Der im Tectum paarig angelegte „rote Kern (Nucleus ruber / RN)“ ist durch eisenhaltige Pigmente gefärbt und ist über das „Guillain-Mollaret-Dreieck“ mit dem Kleinhirn verbunden. Die folgende „Haube (Tegmentum mesencephali)“ ist durch die dunkle Farbe von „Melanin“ im Nervenknoten „Substantia nigra“ gekennzeichnet. Nach der Haube folgen die beiden Hirnschenkeln (Crura cerebri). Diese beiden Wülste umgrenzen eine Grube (Fossa interpeduncularis), die vom 3. Hirnnerv durchzogen wird, der an der Bewegung des Augapfels beteiligt ist. Schädigungen an den motorischen Nervenverbindungen beeinträchtigen die Ausführung der Bewegungen, führen aber nicht zur Lähmung, weil das Rückenmark nicht angeschlossen ist.
Vierhügelplatte (Lamina tecti /Lamina quadrigemina): Die Serie #1611 bietet wie ein leeres Blatt Papier zunächst keine Merkmale. Weil somit kein Protein einen lesbaren Cofaktor wie Zink und Calcium findet, kann der Raum bis zur Spalte 4-4-4-4 für die Vierhügelplatte zunächst einen Funktionsraum darstellen, der den äußeren Raum des Menschen nach innen zur Richtungsorientierung polysensorisch abbildet. Die Vierhügelplatte ist eine geschichtete Struktur. Es wird angenommen, dass eine Raumorientierung möglich ist, wenn sich links und rechts lange Spalten bilden, an denen seitlich Interaktionen möglich sind. Die grobe Gesamtstruktur der Vierhügelplatte ist auf der Protein-Ebene nicht erkennbar. Am linken Rand zieht mit #1611 als QS1+6=Nerv=7_QS1+1=“2“=2. Hirnnerv=Sehnerv in den Bereich ein. Die Bilderkennung ist bereits realisiert, aber die Augen können dem Richtungswechsel eines beobachteten Objektes folgen. Diese Funktion wird von den oberen zwei Hügel der Vierhügelplatte realisiert (Colliculi superiores / SC). Dieses optische Reflexzentrum ist ein Kerngebiet aus schichtweise angeordneter grauer und weißer Substanz. Der 3. und der 4. Hirnnerv (Augenmuskelnerven) wirken an der Bewegung des Augapfels mit. Der rechte Rand kann punktuell fixiert werden, weil in der Randspalte Z.38341_357/#_112/#_164 am Rand Nerv=7 vorliegt und der 3. Hirnnerv mit „3“_Nerv=7 als QS5_1+1=“7“ sowie 4. Hirnerv mit Nerv QS1+6=7_“4“ vorliegen. Das Auge wird über die Hyaluronsäure=200E adressiert, die in Z.38341#161199 mit QS1+199=“200“ für Hyaluronsäure=200E vorliegt. Grundsätzlich wird alles, was möglich ist, gleichzeitig gezählt, wobei nur einer relevanten Spur gefolgt wird – hier ist es die Spaltenform. Die Axone der Netzhaut ziehen entlang des Sehnervs über das „Chiasma opticum“ als retinaler Input zum Colliculus superior (SC). Am Wachstum sind Protein-Tyrosin-Phosphatasen (PTPs) beteiligt [Protein-Tyrosin-Phosphatasen-Expression während der Entwicklung des Colliculus superior der Maus - PMC (nih.gov) ; A. Faisner u.a., (2009), doi: 10.1007/s00221-009-1963-6]. Das Protein (Mensch) „PTPRJ_PTP-Rezeptor“=1337AS wird ausgewählt, weil es zum Erreichen des Calciums eine 10-zeilige Spalte ziehen muss, und zwar in der Randspalte Z.38342#_“1“12“/#_“1“[(6)4]/#_“4“[(9)5] /#_“0“[(8)9]/#_“9“[(2)8]/#_“9“[(9)5]/#_“2“[(7)(3)]/#_“7“[(4)(4)]/#_“3“[92]/#_“2[00] als QS12+1=“13“_Summe 1+4+0+9+9+2+7+3+2{0Calcium}=“37“ mit 13_37 für „PTPRJ_Protein-tyrosine phosphatase receptor type J (R-PTP-J)“=1337AS. Aufgrund der extremen Vertikalstrecke sind seitliche Interaktionen zur Raumorientierung zu vermuten [PTPRJ - Receptor-type tyrosine-protein phosphatase eta - Homo sapiens (Human) | UniProtKB | UniProt]. „PTPRJ“ bindet am Protein (Mensch) „JUP_Catenin gamma“=745AS“, das sich rechts parallel ebenfalls in der Randspalte als „( )“ zeigt. Über die Randspalte „3/4“=QS=“7“ absteigend in einer Parallelspalte als Summe 4+7+9+2+8+9+6=45 mit 7_45 für „JUP“=745AS. Plakoglobin=745AS enthält 12 Armadillo-Repeats aus jeweils 42 AS für Interaktionen [JUP - Junction plakoglobin - Homo sapiens (Human) | UniProtKB | UniProt]. „PTPRJ“ bindet weiterhin am Protein (Mensch) „CDH2_N-Cadherin / N-Cadherin-2“=906AS, das für das Nervensystem geeignet ist und ebenfalls das Calcium benötigt. Weil „PTPRJ“ 2 Zeilen weiter reicht als „JUP“, ist eine Bindung „Cadherin-2“ möglich, und zwar in der Randspalte Z. 38349#_744/#_392/#_200 über Spalte 9/0 für „90“_QS0_2_4=“6“ mit 90_6 für„CDH2_Cadherin-2“=906AS. Das Calcium liegt links in der Zahl „20“, so das die Spalte 2/0 in der falschen Richtung „0-2“ nicht benötigt wird [CDH2 - Cadherin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Zellbiologie werden fluoreszierende Proteine (FP) zur Beobachtung der räumlichen und zeitlichen Verteilung im Labor am lebenden Objekt (in vivo) mit anderen Proteinen fusioniert. Das Protein [Aequorea victoria (Water jellyfish)] „EGFP (enhanced GFP)“=238AS ist ein Grün fluoreszierendes Protein mit einem Absorptionsmaximum=395nm, das von „Calcium Ca2+“ aktiviert wird. „Zeigt einen kleineren Absorptionspeak bei 470 nm. Das Fluoreszenzemissionsspektrum erreicht Spitzenwerte bei 507-510 nm mit einer Schulter bei 545 nm“ [GFP - Green fluorescent protein - Aequorea victoria (Water jellyfish) | UniProtKB | UniProt]. Über die 10-zeilige Strecke können 2 Wellen, aus jeweils zwei 32er-Halbwellen in der Randspalte durchgezählt werden. Bereich1: ab Z.38342#_“1“12“/#_“1“[64] als QS2+1=“3“_Spalte 1/1=QS=“2“ für „32“; QS4_0+8_9+2_9=“32“; ABS=395nm mit QS1+2=“3“_QS6+4=10 für „0“ _“95“ mit „3“_Summe 0+95=“95“ mit 3_95 für ABS=395nm. Bereich2: ab Z.38348 als QS27+3=“30“_QS7+4=11=QS=“2“ für „32“_Spalte 3/2 für „32“; ABS=395nm als „39“_Spalte 7/4=QS=11=QS=“2“_“3“ mit „39“_Summe 2+3=“5“ mit 39_5 für ABS= 395nm. Calcium-Pumpen-Energie aus ATP=260E 4-zeilig absteigend als „2“_QS0+0_2_4=“6“_QS7+3=10 für „0“ mit 2_6_0 für ATP=260E.
Der GABA-Rezeptor ist im Gehirn und Rückenmark verbreitet und der wichtigste inhibitorische Rezeptor im zentralen Nervensystem (ZNS). Er erhält seine Wirkung durch die Erhöhung der Permeabilität für Cl-Ionen und wird durch ein hemmendes Signal (IPSP) auslöst. Beim Öffnen der Ionenkanäle strömen Kalium-Ionen aus der Nervenzelle heraus und Chlorid-Ionen in die Nervenzelle hinein, wodurch Aktionspotentiale erschwert werden. Der linke Code-Rand wird vom GABA-Rezeptor besetzt, wobei der Typ GABA“A“-Rezeptor ligandenaktivierte Ionenkanäle bildet. Die meisten GABA-A-Rezeptoren im Gehirn sind aus zwei alpha-, zwei beta und einer gamma-Untereinheiten aufgebaut [GABA-Rezeptor – Wikipedia]. Das Protein (Mensch) „GABA-A_Rezeptor_GABA Untereinheit alpha-1“=456AS besitzt die Gamma-Aminobuttersäure (GABA)= C4H9NO2=24+9+7+16=56E als Ligand. Das Protein wird am linken Zeilenrand neben der Serien-Spalte #1611 als Chlorid-Kanal mit Chlor als „1“_QS6+1=“7“ für Chlor=17E 8-zeilig als 4_“56“ durchgezählt, so dass damit „GABA“ in der Zahl „56“ mit enthalten. Die postsynaptische Zelle ist selektiv durchlässig für Chlorid-Ionen (Cl-) und für Bicarbonat-Ionen (HCO3- /1+6+24=31E). Wird die Spalte „11“ als QS1+1+1=3_1 für HCO3=„31“ besetzt, sind in 4 Zeilen 2 Zählungen verschachtelt. Der „GABA-A_Rezeptor_alpha-1“ liegt in der Spalte Z.38342#1611“9“4“/#_1611“9“0/#_1611“8“6/#_1611“8“2/#_611“7“8/#_1611“7“3/#_1611“6“9/#_1611“6“5“ als „4“_QS9_9_8_8_7_7_6=18+30+6=54_QS6+5=11=QS=2 mit „4“_Summe 54+2=“56“ als 4_56 für GABA-A-Rezeptor_alpha-1=456AS [GABRA1 - Gamma-aminobutyric acid receptor subunit alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das giftige „Picrotoxin“ blockiert den Chloridkanal und ist gemischt aus „Picrotoxinin=C15H16O6=90+16+48=154E und Picrotin=C15H18O7=90+18+56=164E. Picrotoxinin=154E zieht mit der Rand-Zählung von „54“ eine 7-zeilige Bahn. „Picrotin“ zählt die Gesamtstrecke im Chlor ab Z.38341#[16]“11“ in der „11er-Kanalstrecke“ 8-zeilig als 8-fach QS1+1=2 mit 8*2=“16“ und ergänzt in Z.38349#[16]“11“65“ die Zahl „4“ aus QS1+1=2_QS6+5=11=QS=2 mit QS2+2=4 für 164E. „Bicucullin“=C20H17NO6=120+17+7+36=180E hemmt im Labor versuchstechnisch den GABA-Rezeptor. Die Rezeptorstrecke wird mit der Kanaleinbindung durchgezählt und anfangs die Spalte 4/0 für „40“ ergänzt, und zwar als Summe 40_19+19_18+18_17+17_16+16=40+38+36+34+32=i.M. 5*36=180E. „Bicucullin“ blockiert ebenfalls von Calcium-Ionen aktivierte Kalium-Kanäle. „Kalium“ kann sich in das 2-zeilige Calcium einpassen {#16}{1}{1}/“#1“[6]{1}{1}/“#“16“1“1“ mit QS1_16+1+1=Kalium=19E. Der komplette GABA_A_alpha-1/beta-3/gamma-2-Rezeptor weist eine synaptogene Aktivität auf, so dass die Untereinheiten „Beta-3 und Gamma-2 spaltenförmig seitlich zum Komplex angelagert werden. Für ein „Pentamer“ werden Alpha/Beta doppelt eingefügt. Die Basiszeile enthält hierfür das Chlor=17E doppelt. 17+17=“34“. Die Zahl „34“ ist in der Z.Nr. enthalten, wodurch die Randziffer „1“ freigestellt wird Z.[38]“34“1“#“16“1199“17“1“17“0357. In der Summe mit dem Code-Rand wird nochmals QS1_#16=17=Chlor gezählt. Rechts sind „3“ von „5“ als Form=7 vermerkt. Insgesamt werden „2332“ Aminosäuren zusammengefügt. Das Protein (Mensch) „GABA-A-Rezeptor_beta-3=473AS“ liegt in der Spalte Z.38342#_(94)“9“669/#_(9)“0“7“6289/#_(8)“6“5“590/#_(8)“2“3“555/#_(7)“8“1“521/#_(7)“3“9“4898/#_(6)“9“7“4“605/#_(65)[5]“4“334, und zwar 8-zeilig absteigend als „4“_Summe 9+7+4_3+9_8+1_2+3_6+5_0+7_9=“73“ mit 4_73 für GABA-A-Rezeptor_beta-3=473AS [GABRB3 - Gamma-aminobutyric acid receptor subunit beta-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Untereinheit „Beta-3“ bindet an „Benzamidin“=C7H8N2=42+8+14=64E in der Spalte Z.38349#_[6554]“3“3“4/#_[613]“4“0“[85] als QS3+3=6_QS0+4=4 mit 6_4 für„Benzamidin“=64E. In der Spalte „3/0“ ist zugleich Zink=30E enthalten. Wenn 1 Zink-Ion dort bindet, wird die Untereinheit „Gamma-2“ gehemmt. Das Protein (Mensch) „GABA-A-Rezeptor_gamma-2=475AS“ wird seitlich { } angefügt, und zwar in der Spalte Z.38342#_(94)“9“{6}{6}[92]/#_(9)“0“7“{6}{2}[89]/#_(8)“6“5“{5}{9}[09]/#_(8)“2“3“{5}{5}[50]/#_(7)“8“1“{5}{2}[13]/#_(7)“3“9“{4}{8}[98]/#_(6)“9“7“4“{6}[05]/#_(65)[5]“4“{3}{3}{4} 8-zeilig absteigend als „4“_Summe 3+3_6_4+8_5+2_5+5_5+9_6+2_6+6=“75“ mit 4_75 für „GABA-A-Rezeptor_gamma-2=475AS“.
Der GABA-A-Rho-Rezeptor (GABA-C) ist eine Unterklasse der GABA-A-Rezeptoren [GABAA-rho-Rezeptor – Wikipedia]. Er wird vorwiegend in der Netzhaut exprimiert und ist in „Colliculi superiores“ vorhanden. Der Komplex startet 1 Zeile früher und kann daher am Ende nicht gehemmt werden. Aufgrund der Verkürzung enthält der Komplex nur den 90°-Winkel für die Spaltenform. Der gesamte 11-zeilige Calcium-Bereich bildet die Winkelsumme=360° als 70_90_50_50_60_40=360°. Insekten besitzen im Gehirn einen 360°-Winkel-Kompass. Der GABA-A-Rho-Rezeptor-Komplex liegt mit 3 Proteinen ( ) „“ { } spaltenförmig in der Spalte Z.38341#_(9)[9]“1“{7}{1}/#_(9)“4“9“{6}{6}/#_(9)“0“7“{6}{2}/#_(8)“6“5“{5}{9}/#_(8)“2“3“{5}{5}/#_(7)“8“1“{5}{2}/#_(7)“3“9“{4}{8}/#_(6)[9]“7"4“[6]/#_(6)(5)(5)(4)[3]. Das Protein (Mensch) „GABA-A_Rezeptor_GABA-A-Rho-1“=479AS zieht linienförmig mit einem L-förmigen Ansatz absteigend an der Code-Rand-Serie für Chlor=17E in #1611 entlang als „4“_QS5+5=“10“_Randlinie QS6_6_7_7_8_8_9_9_9=“69“ mit 4_Summe 10+69=79 mit 4_79 für GABA-A-Rho-1“=479AS [GABRR1 - Gamma-aminobutyric acid receptor subunit rho-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GABA-A_Rezeptor_GABA-A-Rho-2“=465AS passt sich absteigend in die L-Form ein, umgeht aber in 2 Fällen die Ziffer „9“, und zwar als „4“_Summe 7_3+9_8+1_2+3_6+5_0+7_4+9_1=“65“ mit 4_65 für GABA-A-Rho-2“=465AS. „Rho-1“ kann das kleine „Augen-Loch“ für einen Durchlauf praktisch nicht nutzen [GABRR2 - Gamma-aminobutyric acid receptor subunit rho-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GABA-A_Rezeptor_GABA-A-Rho-3“=467AS liegt seitlich 7-zeilig als Doppelziffer-Spalte an, und zwar als „4“_QS8_5+2_5+5_5+9_6+2_6+6_7+1=“67“ mit 4_67 für GABA-A-Rho-3“=467AS [GABRR3 - Gamma-aminobutyric acid receptor subunit rho-3 - Homo sapiens (Human) | UniProtKB | UniProt]. GABAnerge Neuronen sind auch in den unteren zwei Hügeln der Vierhügelplatte [Colliculis inferior (IC)] vorhanden. Eine Abnahme des Neurotransmitters „GABA“ führt zu einem signifikanten Verlust der Hemmung und zu einem übererregbaren Zustand. Nur 15% der Nervenzellen sind GABAerge Interneuronen, die als Taktgeber wirken und im Millisekundenbereich neuronale Netzwerke zu sensorischen, motorischen und kognitiver Leistungen synchronisieren [18_wie_beeinflussen_rythmische_hirnaktivitaeten_lernen_und_gedaechnis.pdf (uni-heidelberg.de): M. Monyer; „Marsilius-Kolleg 2010/2011“]. Die Zeitbasis „60“ liegt nur in lesbar in Z.38348#_“60“58273 vor. Um den Gesamtbereich zeitabhängig einzurichten zieht sich eine Diagonale aus 6 „10er-Kunstgriffen“ vom Nerv „7“ der Randziffer Z.38341#_035“7“ bis in die lesbare Zeitbasis „60“ als Kette QS7_1+2=“10“_QS6+4=“10“_QS9+1=“10“_QS2_0+5_3=“10“_QS1_9=“10“_QS4+6+0=10 mit Summe 6-fach „10“=Sekunden-Zeitbasis=“60“. Der rechte Rand bildet im Dreieck die Höhe=90, die für Aktionspotential +20 mV bei einem Ruhepotential von -70mV ausreicht, und zwar mit QS5+7_1+2_6+4_9+5_8+9_2+8_9+5_7+3=“90“. Im Dreieck kann neben der Zeitbasis „6058273“ die Zahl „05“ nicht als Faktor 10^-5 verwertet werden, weil Neuronen von Pyramidalzellen auf Basis von Glutamat mit 1*10^-3 (Millisekunde) schalten; GABA-Interneuronen sind noch langsamer [Neurokognition-stud-2.pdf (tu-chemnitz.de); W. Dilger (2003)]. In „60“582“7“3“ ist die Zeitbasis 58+2=60 doppelt vorhanden, so dass mit Nerv=Form=7_die Randziffer „3“ für die Millisekunde gelesen werden kann.
Die Calcium-bindenden Proteine Proteine (Calbindin [CB], Parvalbumin [PV] und Calretinin [CR]) werden von verschiedenen Neuronen exprimiert. PV-Neuronen sind über die Schichten konstant verteilt. CR-Neuronen nehmen von der Oberflächen bis zu mittleren Schichten stark zu, CB-Neuronen reduzieren sich über die Tiefe. Calcium-bindende Proteine existieren sowohl in erregenden als auch in hemmenden Neuronen des „SC“ [Neuronal density and expression of calcium-binding proteins across the layers of the superior colliculus in the common marmoset (Callithrix jacchus) - PubMed (nih.gov); M. Chong u.a. Dez.2022; DOI: 10.1002/cne.25388; Weißbüschelaffe=Callithrix jacchus].
Das Protein (Mensch) „Parvalbumin“ =110AS wird aufgrund der konstanten Verteilung und mangels besonderer Merkmale als „1“er-Spalte am linken Rand 11-zeilig ab Z.38341#[161]“1“ entlang gezogen. Die Ziffer „0“ in 11“0“AS“ wird 3-fach über Kunstgriffe angehängt. Die in einer Schleife das Calcium=QS6+5+5+4=20E seitlich einfangen. End-Schleife in Spalte Z.38348#[161]“1“[697](460)/#[161]1{6554=Calcium}(33)/161“1“(613)(40)[8] als „11“_QS6+1+3=10 für „0“_QS4+0_3+3=10 für „0“_QS4+6+0=10 für „0“ mit 11_Summe 0+0+0=“0“ mit 11_0 für „Parvalbumin“ =110AS. Die 3 Kunstgriffe können die 3 EF-Hand-Motive abbilden, weil damit Calcium gebunden wird. Beim EF-Hand-Motiv wird das Calcium sowohl durch „Proteinrückgratatome“ als auch durch „Aminosäureseitenketten“, insbesondere Aspartat und Glutamat gebunden [EF Hand – Wikipedia]. Die „1“er-Spalte bildet das Rückgrat. Aspartat/Asparaginsäure D/Asp)=C4H7NO4=70E schließt die Lücke am Calcium mit QS1+69=70E und das Glutamat/Glutaminsäure=C5H9NO4=78E folgt an der Ecke mit 7_QS4_4=8 für 78E [PVALB - Parvalbumin alpha - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Calb1_Calbindin--D(28k)“=261AS bindet Calcium. Der Gesamtbereich umfasst 12 Zeilen, davon wird „Calb1“ 6-zeilig für die beiden oberen Hügel (SC „Sehen“) gezählt. Der Bezug zu den unteren beiden Hügel (IC „Hören“) wird doppelt über den Zeilenrand und nochmals als lesbare Schwerachse „84“ neben Calcium als „Hörbahn“ durchgezählt, und zwar mit „Calb1“ für IC=84+84+84+Restschleife am Calcium „9“=261AS. Die Schwerachse entwickelt über das Gleichgewichtssystem eine Beziehung zum Ohr. „Calb1“ mit 1. Anteil: Randspalte Z.38341#_357=QS=15/#_112=QS=4//#_164=QS=11/#_495=QS=18/#_089=QS=17/#_928=QS=19 mit Summe 15+4+11+18+17+19=“84“=Schwerachse. 2. Anteil: Z.38347#_995=QS=23/#_273=QS=12/#_744=QS=15/#_392=QS=14 mit Summe 23+12+15+14=“64“_#200 gezählt als QS20+0=Calcium=“20“ für Summe 64+20=“84“ (Bogengang „64“ + Calcium „20“). 3. Anteil für Endschleife: Randspalte Z.38351#_“84“20“0“/_#“3“1“1“4“[9] mit „84“_QS3+1+1+4=“9“, somit „Calb1“=84+84+84+9=261AS.
„Calb1“ für die oberen Hügel (SC): Außer der Calcium-Ionen-Bindung erfolgt ein Bindung an Zink=30E „Calb1“ aktiviert „Ca2+-ATPase“, das Magnesium=12E benötigt. Im Prinzip besitzt „Calb1“ eine Bindung an „Vitamin D“=C27H44O=162+44+8=214E. Im Gehirn wird es aber unabhängig vom Vitamin D exprimiert, weil der Zeilenrand vom Protein selbst besetzt wird [Calbindin – Wikipedia]. „Vitamin D“ z.B. 4-zeilig ab Z.38341#_357 am Rand mit QS35+7_1+12_64_95=214E. Das Hormon „Calbindin“ wird mit „Calcitriol“ vermehrt synthetisiert, weil das Protein den Weg im Kunstgriff schneller findet [Calbindin - DocCheck Flexikon]. „Calcitriol“=C27H44O3=162+44+24=230E liegt in der Randspalte Z.38341#“0“3“[57]/#_5“1“[12]/#_“1“[64] über die Spalte „0“3“/[5]“1“/[9]“1“ als QS1_1=“2“_“3“_“0“ für „Calcitriol“=230E. „Calb1“ für „SC“ nimmt das Calcium mit dem klassischen Augapfel „505“ auf, und zwar in der Spalte Z.38341#_[0]“3“5“7“/#_[5]“1“1“2“/#_“9“1“6“4“/#_“2“[4]“9“5“/#_{55505}[0]“8“9“/#_[69]“2“8“ als {Calcium=5+5+5+0+5=20}_QS9+2=11=QS=“2“_QS1_1_3+5=10 für „0“_QS_7_1+2_6+4_9+5_8+9_2+8=61 mit „2“_Summe 0+61=“61“ mit 2_61 für „Calb1“=216AS im Colliculi superiores (SC). Das Zink=30E wird zweckmäßig als seitlich als Spalte 7_03/2/9/9 mit Einbindung der Ziffer „3“ als QS9+9+2+7+0+3=Zink=30E gezählt, um konkurrierende Zählungen für Calcium zu blockieren. „Calb1“ besitzt 4 Calcium-Bindestellen sowie 5 EF-Hand-Domänen. Die untere Ecke des Calciums wird mit QS 21+36_Lücken-Spalte 4/0/9=13=70E von Aspartat=70E begrenzt [ CALB1 - Calbindin - Homo sapiens (Human) | UniProtKB | UniProt]. Im Gehirn werden die ATP-getriebene Ca^2+Ionenpumpen vom TYP_PMCA „ATP2B2“=1243AS und ATP2B3=1220AS exprimiert, wobei das Magnesium bereits als Zahl „12“ enthalten ist. Das Calcium=20E steht seitlich in der Randspalte Z.38343#_ 0762899164/#_655{9092}495/#_23{55505}089 doppelt zur Verfügung, es wird aber nur „1“ ATP-Molekül gegen „1“ Calcium-Ion ausgetauscht. Calcium für „ATP2B2“ als QS9+0+9+2=20E. Calcium für „ATP2B3“=5+5+5+0+5=20E. ATP=260E ist in der Spalte 0/6/2 lesbar und als 2_6_QS5+5=10 für „0“ vorhanden. ADP=220E mit QS6+5=11_Spalte 6/5=QS=11 mit Summe 11+11=“22“_QS2+8=10 für „0“ mit 22_0 für ADP=220E. Das Protein (Mensch) „ATP2B3“=1220AS liegt in der Spalte „555/521“ als „1“_“2“_QS5_5+5+5=“20“ mit 12_20 für „ATP2B3“=1220AS [ATP2B3 - Plasma membrane calcium-transporting ATPase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ATP2B2“=1243AS liegt in der Spalte „6“2“8“[9]“9“1“/[59]“0“9“2“[4] als „1“_Spalte 9/2=QS=11=QS=“2“ _QS0+9_8=17_mit 2_6 für 26 als „12“_Summe 17+26=“43“ mit 12_43 für „ATP2B2“=1243AS. Diese Position wird rechts durch Calmodulin=149AS in der Randspalte [9]“1“[64]/[2]“49“[5] fixiert [ATP2B2 - Plasma membrane calcium-transporting ATPase 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein Mensch „Calb2_ Calretinin [CR])“=271AS ist dem „Calb1“ teilweise ähnlich, es wird über die Schichten-Tiefe in der Dichte jedoch gegenläufig exprimiert. „Calb2“ wird seitlich von „Calb1“ 11-zeilig als Hörbahn mit Fußpunkt durchgezählt, wobei links an einer Schleife zum Calcium=„QS6+5+5+4“=20E absteigend gestartet wird. Die absteigende Zählweise ergibt sich aus dem mobilen Rest „Phosphotyrosin“=C9H12NO6P=54+12+7+48+15=136E, der seitlich neben der Protein-Hörbahn {} 4-zeilig am ab Serie „#1611“ zählbar ist, und zwar in der Spalte Z.38341#_“99“1“7“1“{170}/#_[949]“6“6“{925}/#_[907]“6“[2]{899}/#_[86]“5“5“[9]{092} als QS99+1=100_QS7+1_6+6=20(Calcium)_QS6_5+5=16 mit Summe 100+20+16=Phosphotyrosin=136E [O-Phospho-L-tyrosin – Wikipedia]. „Calb2_Calretinin [CR])“=271AS beginnt mit einer Startschleife in der Spalte Z.38349#_{6554=Calcium}[3]“3“4“7“/#_[6]“1“34“0“_“8“5“6“/#_[5713]“85“[84] über Fußpunkt „1“34“0“(856 zu Hörbahn Calb2) / [713]“85“[84 zu Calb1] als {6554=QS=20=Calcium}_QS1+34+0=“35“_“85“ mit Summe Fußpunkt=35+85=“120“ [ergibt 6-fach Calcium für 6 EF-Hand Motive). „Hörbahn“ absteigend Z.38350#_856=QS=19/#_347=QS=14_/#_058=QS=13/#_987=QS=24/#_136=QS=10/#_505 (Auge)=QS=10/#_092=QS=11/#_899=QS=26/#_925=QS=16_/#_170=QS=8 mit Summe=19+14+13+24+10+10+11+26+16+8=“151“ als Summe Fußpunkt+Hörbahn=120 +151=271 für „Calb2_ Calretinin“=271AS [CALB2 - Calretinin - Homo sapiens (Human) | UniProtKB | UniProt].
Im auditorischen Mittelhirn, Colliculus inferior (IC), wird das „Neuropeptid Y (NPY)“=36AS exprimiert [Neuropeptide Y signaling regulates recurrent excitation in the auditory midbrain | bioRxiv; M. Roberts, u.a. Mai 2023]. Das Peptid (Mensch) „Pro-Neuropeptid Y“=97AS wird gespalten, so dass sich das Neuropeptid Y (NPY) bildet. Die verschiedenen Rezeptoren passen sich der möglichen seitlichen Verschiebung des Proteins an. „1. Position: Das Peptid (Mensch) „Pro-Neuropeptid Y“=97AS liegt in der Randspalte Z.38347#_[79]“9“[5]/#_[82]“7“{3}/#_[7]{7}{4}{4}. „Pro-Neuropeptid Y“=97AS ist in der Spalte „9/7“ für 97AS lesbar. „NPY“=36AS folgt als „3“_ 4_QS7+4=11=QS=2 mit „3“_Summe 4+2=“6“ für NPY { }=36AS [NPY - Pro-neuropeptide Y - Homo sapiens (Human) | UniProtKB | UniProt]. „Pro-Neuropeptid Y“ ( )=97AS wird vom Protein (Mensch) „FAB_ Fibroblasten-Aktivierungs-Protein“=760AS gespalten [Neuropeptide Y, B-type natriuretic peptide, substance P and peptide YY are novel substrates of fibroblast activation protein-α - PubMed (nih.gov); F. Keane u.a. (2011); DOI: 10.1111/j.1742-4658.2011.08051.x]. „FAB“=760AS liegt in der Randspalte Z.38347#[79](9)[5]/#_“8“2“(7)“3“/#_[7]“7“4“4“/#_[6]“3“9“[2] als QS3+4=“7“_Spalte 4/9=QS=13_Spalte 7/3 mit 3_7 für 37_QS8+2=10 mit 7_Summe 13+37+10=60 mit 7_60 für FAB=760AS [FAP - Prolyl endopeptidase FAP - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NPY1R_NPY-Rezeptor1“=348AS liegt in der Spalte Z.38347#_[605827]“3“/#_[3]3“47“74“4“/#_[0]“8“56“[392] als 3_4_74=QS=2_47=QS=2_Spalte3/8=QS=2_56=QS=2 mit 34_Summe 2+2+2+2=“8“ als 34_8 für „NPY1R“=348AS [NPY1R - Neuropeptide Y receptor type 1 - Homo sapiens (Human) | UniProtKB | UniProt]. 2. Position: „Pro-Neuropeptid Y“=97AS rückt in die Position 2, und zwar in der Spalte Z.38348#_[46058]“2“7“[3]/#_[43347]“7“[44]/#_[4085]{6}{3}[92] als „Pro-Neuropeptid Y“=97AS mit QS2+7=9_7 für 97AS. „NPY“ {}=36AS folgt gespiegelt in der Zahl „63“ mit 3_6 für NYP=36AS. Das Protein (Mensch) „NPY4R_NPY-Rezeptor4“=375AS liegt in der Spalte Z.38349#“4“3“3“47“[744]/#_“4“0“8“[5]“6“3“[92] und zieht eine Schleife zur Mittellinie 4-4 als „3“_“6“_mit 4_7 für „47“_QS3+3=“6“_Spalte 4/4=QS=“8“_“0“_8“ mit „3“_Summe 6+47+6+8+0+8=75 mit 3_75 für „NPY4R“=375AS. Im IC sind die seitlich der Mittellinie vertikal verlaufenden Nervenstränge durch einen Querstrang verbunden, in der ebenfalls NPY vorhanden ist [NPY4R - Neuropeptide Y receptor type 4 - Homo sapiens (Human) | UniProtKB | UniProt]. 3. Position: „Pro-Neuropeptid Y“=97AS verschiebt sich in der Spalte Z.38348#_[8]“2“[73]/#_“7“7“[44]/#_{6}{3}[92] mit Spalte 2/7=QS=“9“_“7“ für „Pro-Neuropeptid Y“=97A. „NYP“ folgt unverändert aus der Zahl „63“ für NYP {}=36AS. Das Protein (Mensch) „NPY2R_NPY-Rezeptor2“=381AS bildet einen Ring am Zeilenrand in der Spalte Z.38350#_56392/#_84200 als 3_QS56_8+4+2+0+0=70_QS9+2=11 mit 3_Summe 70+11=81 als 3_81 für NPY2R=381AS [NPY2R - Neuropeptide Y receptor type 2 - Homo sapiens (Human) | UniProtKB | UniProt]. 4. Position: „NPY“ liegt in 2 unterschiedlichen Positionen, die das Protein (Mensch) „NPY5R_NPY-Rezeptor5“=445AS mit seiner Lage am Zeilenrand verbindet, und zwar in der Spalte Z.38349#_47744/#_56392 als „44“_QS9+2=11=QS=2_3 mit „44“_Summe 2+3=“5“ mit 44_5 für NPY5R=445AS [NPY5R - Neuropeptide Y receptor type 5 - Homo sapiens (Human) | UniProtKB | UniProt]._dat09.11.2023
Vesikel: Für das „leere Blatt“ der Vierhügelplatte muss die Evolution ein Protein so zuschneiden, dass zur optimalen Besetzung der Mittelspalte „4-4-4-4“ keine besonderen Voraussetzungen notwendig sind. Das Protein (Mensch) „DNM1_Dynamin-1“=864AS ist ein Mikrotubuli-assoziiertes kraftproduzierendes Protein, das GTP binden und zu GDP hydrolysieren kann. Es ist an vesikulären Transport-Prozessen der Endozytose für Signalwege der Neuronen beteiligt. „Dynamin-1 (DNM1)“ erzeugt ein kugelförmiges Vesikel durch Abschnürung von der Zellmembran. „DNM1“ liegt als ringförmiger Kragen um das Vesikel und im Vesikel-Mantel, der von einem umhüllenden Clathrin-Netzwerk stabilisiert wird. Die spiralförmige Abschnür-Drehbewegung ist in 8“64“AS als Kreis=64 enthalten. „Dynamine“ sind „GTPase“-Enzyme. „Dynamin-1“ liegt in der Spalte Z.38346#_[7]“8“1“5“2“/#_[739]{48}/#_[697]{46}/#_[697]{46}/#_[655]{4}[3]/#_[613]{4}[0], in der zunächst das Guanosintriphosphat (GTP)=C10H16N5O14P3=60+16+35+112+45=268E produziert wird, und zwar als „2“_QS1+5=6_8 mit 2_6_8 für GTP=268E. Darin gehört die Ziffer „2“ zur Spalte „2/8“ für 2_8=Wasser „28“ (Symbol). Katalyse: „GTP + H2O = GDP + H+ + phosphat“. Das „Guanosindiphosphat (GDP)“=C10H15N5O11P2=60+15+35+88+30=228E zieht sich nunmehr durch die Spalte „4-4-4-4“ der Vierhügelplatte als QS4+8=12_QS4+6 mit Summe 12+10=“22“_Spalte 4/4=QS=“8“ mit 22_8 für „GDP“ {}=228E. Variante 1: „Dynamin-1“=864AS in der Spalte Z.38346#_[7]“8“1“5“2“/#_[739]“4“8“/#_[697]“4“6“/#_[655]“4“[3]/#_[613]“4“[0] als „8“_Kreis „64“ aus QS1+5+2=“8“_QS4+8=“12“_Kunstgriff zur reduzierenden Abschnürung mit 4+6=10 für „0“(Vesikel)_Spalte 4/4 mit 4_4 für 44 (Netzwerk-Hülle=Gruppe) als „8“_Summe 8+12+0+44=“64“ mit 8_64 für „Dynamin-1“=864AS [DNM1 - Dynamin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. 4 Moleküle legen sich zu einem Tetramer zusammen, und erst deren Vielzahl erzeugt eine abschnürende Spirale. Der 20°-Winkel für die Halskrümmung ist bereits im Tetramer voreingestellt. Der Vesikel-Durchmesser beträgt 50 nm und die Halseinschnürung verengt auf 16 nm [Kristallstruktur des Dynamintetramers | Natur (nature.com); O. Daumke; Sept 2015; doi:10.1038/nature14880]. Trotz gleicher Länge können für das Tetramer „3“ weitere „DMN1-Varianten“ in Gegenrichtung gelesen werden. Variante 2: „Dynamin-1“=864AS liegt in der Spalte Z.38346#_“1“5“{213}/#_[9]“48“[98]/#_[7]“4“6“{0}[5]/#_[5]“4“{33}[4]/#_[3]“4“[085] absteigend als QS4+4=“8“_QS4+6=“10“_“48“_QS1+5=“6“ mit „8“_Summe 10+48+6=“64“ mit 8_64 für „DNM1“=864AS [DNM1 - Dynamin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Varianten 3/4: Die Schlusszahl „6“ kann alternativ nach rechts mit QS[15]“2“1“3“=“6“ oder über eine Schleife in der Spalte [6]0/33 mit QS0+3+3=“6“ gezählt werden, so dass „4“ Varianten ein „DNM1-Tetramer“ erzeugen. Die Membran „33“ wird dabei zerlegt, was real während der Clathrin-Beschichtung zu einer Membranspaltung führt. Dynamine enthalten eine Pleckstrin-Homologie (PH)-Domäne, die zu einer Selbsthemmung führt, sich an andere Proteine zu binden. Beim Protein (Mensch) „PLEKHH2“=1493AS wird die Binding an Aktin=374AS gehemmt. Die Ursache der Selbsthemmung, erklärt sich somit daraus, dass der Zählweg von „Plecktrin“ und „Aktin“ in die Spalte 4-4-4-4 für „DNM1“ führt, so dass „DNM1“ zur externen Aktin-Suche nicht motiviert ist. Die Endozytose selbst kann in einen anderen Modus umschalten. „PLEKHH2“=1493AS aufsteigend QS1+5_4_4=14_QS6+0_3=9_3 mit 14_93 für „PLEKHH2“=1493AS [PLEKHH2 - Pleckstrin homology domain-containing family H member 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Aktin=374AS liegt in der Spalte Z.38348#_“4“6“0“/#_43“3“/#_“4“0“[8] linksdrehend als „3“_Kunstgriff QS0+6+4=10 für „0“_QS4+3=7_QS4+0=“4“ mit 3_7_4 für Aktin=374AS. Das Aktin-bindende Protein (Mensch) „Tropomyosin“=568AS, bestehend aus 2 Halbspiralen 284AS, ist in „Aktin“ integriert. Die beiden Anteile ziehen durch die Vierhügel-Spalte als Spirale, 2-fach 284AS über Spalte [5]{2}/{4}{8}/“4“[6]/“4“[3]/“4“[0]/“3“8“ kurz {} als „2_8_4“ und nochmals gespiegelt als „4“_QS4+4=“8“_QS3+8=11=QS=“2“ mit 2_8_4 für Tropomyosin-Halbspirale=284 AS. In Neuronen treten zur Regeneration während der anhaltenden Stimulation außer der „Clathrin-vermittelten Endozytose (CME)“ im Wechsel auch andere Endozytose-Formen auf. Bei der „aktivitätsabhängigen Massenendozytose (ADBE)“ ist das Tropomyosin beteiligt, um Aktinfilamente zu bilden [„Eine Rolle von Tropomyosinen in der aktivitätsabhängigen Massenendozytose? - ScienceDirect (Wissenschaft)“; F.Meunier u.a.; Okt.2017; https://doi.org/10.1016/j.mcn.2017.04.003].
Die Calcium- und Calmodulin-abhängige Phosphatase „Calcineurin“ dephosphoryliert das „Dynamin-1“, wodurch dessen Katalyse gehemmt wird. Die Vierhügel-Spalte ist mit 4+4+4+4=“16“_QS1+3=“4“ mit Summe 16+4=“20“ als „Calcium“=20E lesbar, so dass sich „Calcineurin“ darin ausbreiten kann. „Calcineurin“ bildet Heterodimere aus Calcineurin A und B. Insgesamt sind es 5 einzelne Proteine, die sich ringförmig verteilen und dabei die Zahl 4+3=7=Form umrunden [Calcineurin – Wikipedia]. Links von der Vierhügelspalte liegt das Protein (Mensch) „PPP3R1_Calcineurin_Type 1“=170AS als QS39_97=“136“_QS5+5=10 für „0“_“34“ (Ziffer „4“ in Spalte 4-4-4-„4“) mit Summe 39+97+0+34=170AS. Im Unterschied zur gleich langen Type 2 ist eine Bindung an Calmodulin=149AS vorhanden. Ein anderes Protein legt sich auf der rechten Seite vor die Type 2, so dass es auch vom rechten Calmodulin abgeschirmt ist. „Calmodulin“{}=149AS zieht seitlich in der Spalte Z.38346#_{178}{1}[521] {17}“39“(48)[9]/{16}“97“(46)(0)/{1}[6]“55“[43](3)/{16}{1}“34“(0)(8)/#_[1571]“38“[5]/#_[1529](36)[5] mit, und zwar aufsteigend als „1“_QS1+7+8=16_QS1+7=8_QS1+6_1=8_ QS16+1=17 mit „1“_Summe 16+8+8+17=“49“ mit 1_49 für Calmodulin=149AS [PPP3R1 - Calcineurin subunit B type 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PPP3R2_Calcineurin_Type 2“=170AS liegt parallel und zieht durch die Spalte „4“-„4“-„4“-[4] als QS48+46=“94“_Spalte 0/3/8=QS=11=QS=“2“_QS0_38_36=“74“ mit Summe 94+2+74=170AS mit 170 () für „PPP3R2“=170AS [PPP3R2 - Calcineurin subunit B type 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PPP3CC _Calmodulin-dependent calcineurin A subunit gamma isoform“=512AS liegt am linken Rand in der Spalte Z.38351#_“1“5“7“1“/#“1“[5]“2“9“ mit Spalte 1/9 für „19“_Spalte 7/2 für „27“_“5“ mit Summe 19+27+5=“51“_Spalte 1/1=QS=2 mit 51_2 für 512AS. Zink=29+1=30E / Eisen 2_QS5+1=6 für 26E [PPP3CC - Serine/threonine-protein phosphatase 2B catalytic subunit gamma isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PPP3CA_Calmodulin-dependent calcineurin A subunit alpha isoform“=521AS liegt lesbar in der Zeile Z.38346#_“521“ mit „PPP3CA“=521AS. Zink=21+9=30E / Eisen=2+QS5+1=6 mit 2_6 für 26E [PPP3CA - Protein phosphatase 3 catalytic subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PPP3CB_ Calmodulin-dependent calcineurin A subunit beta isoform“=524AS liegt auf der rechten Seite in der Spalte Z.38346#_3/#_8/#_5/#_4/#_5/#_8/#_311[49], und zwar als QS3+1+1=5_Spalte 5/8=QS=13_Spalte 5/4=QS=9_Spalte 3/8=QS=11=QS=2 mit 5_Summe 13+9+2=24 mit 5_24 für „PPP3CB“=524AS. Calmodulin=149AS ist am Rand lesbar und bildet vertikal mit 1_4_QS6+3=9 für 149AS eine Winkelform. Eisen 2_QS4_1_1=6 für 26E. Zink besetzt den restlichen Rand neben dem Protein in der Spalte Z.38346#_6/#_7/#_8/#_774 mit QS6_7_8_7=28_QS7+4=11=QS=2 mit Summe 28+2=Zink=30E [PPP3CB - Serine/threonine-protein phosphatase 2B catalytic subunit beta isoform - Homo sapiens (Human) | UniProtKB | UniProt].
Zur Interaktion finden sich Proteine zusammen, um sich mangels erkennbarer Cofaktoren gegenseitig zu bestätigen. Im Ergebnis wird das „Dynamin-1_Variante1“ präzise umringt, so dass nachfolgend diese „DNM1-Kontur“ als Ziel für „Clathrin“ zwecks Beschichtung markiert ist [DNM1 - Wikipedia]. Das Protein (Mensch) „PACSIN1_Syndapin-1“=444AS liegt in der Spalte Z.38349#_[55]{4}“3“3“/#_“1“3“{4}“0“8“/#_[7]“1“3“8“[5] und stabilisiert die Spalte „4/4“ von „DNM1“, und zwar als QS1+3=“4“_QS1+3=“4“_Spalte 3/0/8=QS=11=QS=“2“_Spalte 3/8=QS=11=QS=“2“ mit 44_Summe 2+2=4 mit 44_4 für „Syndapin-1“=444AS [PACSIN1 - Protein kinase C and casein kinase substrate in neurons protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Amphyphisin“ =695AS liegt am oberen Ende zwischen 2 Proteinen, die „DNM1“ seitlich flankieren, und zwar in der Spalte Z.38344#_“59“0“/#_“5“5“5“ als QS59+0_5+5=69_5 für „Amphyphisin“=695AS [AMPH - Amphiphysin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NCK1“=377AS flankiert „DNM1“ links in der Spalte Z.38344#_“6“5“/#_“2“3“/#_“8“{1}/#_“3“9“/#_[9]“7“/#_“5“5“ als QS5+5_7=17_QS3+9_8=20 mit Summe 17+20=“37“_QS2+3=5_QS6+5=11=QS=2 mit „37“_Summe 5+2=“7“ mit 37_7 für „NCK1“=377AS [NCK1 - Cytoplasmic protein NCK1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Endophilin-1“=352AS flankiert rechts in der Spalte Z.38344#(0)“9“2“/(5)0[5]/“13“[6]/“9“8“[7]/“0“5“[8] als QS0+5_9+8=“22“_“13“ mit Summe 22+13=“35“_QS0_9+2=11=QS=“2“ mit 35_2 für „Endophilin-1“=352AS [SH3GL2 - Endophilin-A1 - Homo sapiens (Human) | UniProtKB | UniProt].
„Clathrin“ muss sich außer der Kontur um „DNM1“ selbst maßlich beschreiben, so dass sich am rechten Rand zwischen 2 Zahlen „99“ dafür ein Bereich bildet (3. Knoten enthalten mit 909). An den beiden 99er-Positionen kann das Protein (Mensch) „Grb2_Wachstumsfaktor-Rezeptor“=217AS jeweils ansetzen, und zwar in Z.38343#_{6}“2“8“9“[9164] als „2“_QS8+9=“17“ für 217AS, wobei für das Prolin-reiche Protein das Prolin=62E direkt seitlich lesbar ist. Weiterhin liegt Prolin=62E in der Spalte Z.38346#_[6]{9}{28}/#_[7]{9}{9}5/#_[82]{7}3 als Summe „28“ + Spalte 9/9=QS=“18“_Spalte 9/7=“16“=28+18+16=“62“ für Prolin=62E. Folglich ergibt sich Grb2=217AS in der Randspalte als „2“_QS9+5_3=17 mit 2_17 für Grb2=217AS [GRB2 - Growth factor receptor-bound protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FNBP1_Formin-bindende Protein“=617AS füllt eine 6-zeilige Lücke, und zwar in der Spalte Z.38344#_[92]“4“9“/#_[0]“5“0“[8]/#_[3]“6“9“[2]/#_[8]“7“9“[9]/#_[5]“8“2“7/#_[47]“7"4"/#_[5639] aufsteigend als „9“_Spalte 4/0=QS=“4“_“5“ mit Summe 9+4+5=“18“_QS6+9=“15“_ QS7+9=“16“_QS8+2=“10“ mit Summe 18+15+16+10=“59“_Spalte 7/4=QS=11=QS=“2“ mit Summe 59+2=“61“_“7“ für FNBP1=617AS [FNBP1 - Formin-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Bindung von „FNBP1“ an Phosphatidylinositol-4,5-bisphosphate=C47H80O19P3=282+80+152+45=559E mit „5“_QS0_49_8_2=59 für 559E. Bindung von „FNBP1“ an „Phosphatidylserin“ mit dem Protein (Mensch) „PTDSS2_Phosphatidylserine synthase2“=487AS absteigend über Serin=C3H7NO3=18+7+7+24=56E als „56“=QS=“2“_47=QS=11=QS=“2“ mit Summe 2+2=“4“_QS8+79=“87“ mit 4_87 für PTDSS2=487AS [PTDSS2 - Phosphatidylserine synthase 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„Clathrin“ stützt sich auf eine geschlossene Funktionsebene aus „Dynamin-1“ und 6 weiteren Proteine. Wenn „Clathrin“ die Dynamin-1-Kontur umhüllt, kleidet Cathrin im großen Maßstab zunächst eine Grube aus, die von Rezeptoren besetzt wird. Im Labor (in vivo) schließt sich „Clathrin“ unter Einwirkung von Magnesieum (Mg2+) spontan zu einem kugelförmigen Polyeder zusammen. Mangels lesbarer Cofaktoren kann die Evolution alternativ Zeilenbereiche geometrisch deuten, und Proteine darauf passend zuschneiden. Für die Vesikel-Hülle setzt das „Clathrin“ aus 5- und 6-Eck-Flächen zusammen: 8 Hexagone (2 Hexagone für Pole, 6 Hexagone als Äquator) und 12 Pentagone für 2 Polringe. An den 36 Ecken liegen jeweils dreibeinige Knotenpunkte. Jede Ecke wird von einem „Clathrin“-Hexamer aus 3 schweren und 3 leichten Ketten besetzt, die ein 3-armiges „Triskelion“ bilden. Jedes Bein ist 47,5 nm lang und 2 nm dick und strahlt von einem Knotenpunkt aus, der ein spiralförmiges Stativ und eine „QLMLT“-Aminosäuresequenz enthält [Grenzen | Die Rolle von Clathrin und Dynamin bei Clathrin-vermittelter Endozytose/synaptischem Vesikelrecycling und Auswirkungen auf neurologische Erkrankungen (frontiersin.org); A. McCluskey u.a.; https://doi.org/10.3389/fncel.2021.754110]. Jedes der 3 Beine wird von „1“ Clathrin-Schwer-Kette gebildet, der seitlich eine kürzere Leicht-Kette anliegt. Die Kommastelle kann genutzt werden, um die Länge mit dem Durchmesser zwecks Zusammenhang zu koppeln. Dieses ist hier unnötig, weil das Komma=Ziffer „0“ passend vorliegt. Die Einzel-Beinlänge 47,5 nm ist in Z.38344#_[55]{909}“2“4“[95}/#_[355]“5“0“5“[089] mit „4“_Spalte 2/5=QS=“7“=Form für „47“_Ziffer „0“ als Komma_“5“ mit 47,5 für Beinlänge 47,5 nm vorhanden. Der Durchmesser=2 nm ist in der Länge enthalten und liegt neben dem Beinquerschnitt „0“ mit seitlich=“909“2“. Eine andere Maßskizze enthält abweichend D=3nm, Endknoten mit D=5nm abwinkelt unter 120° [Konformation eines Clathrin-Triskelions in Lösung | Biochemie (acs.org); R.Nossal u.a; Apr 2006; https://doi.org/10.1021/bi052568w]. Die „3“ Beine sind als Struktur-Kreuzung „Spalte/Zeile 555/555“ abgebildet. Die Spalte Z.38345#_5050/#_1“36“9 enthält die „36“ Eckpunkte, den Pentagon-Eckwinkel 360/5=72 mit QS3+69=72° und den Hexagon-Eckwinkel 360/6=60 mit QS50_1+3+6=60°. Der Durchmesser eines Clathrin-Vesikel von D=50-100 nm kann aus D=50+50=100nm gebildet werden. Synaptische Vesikel liegen im Bereich 30-50nm, wobei die Zahl „30“ als Spalte 3/0 für 30nm vorliegt [Clathrin – Wikipedia]. Die dreiarmige Triskelion-Beinlänge L=3-fach 47,5nm =142,5nm wird als Vorschub nunmehr für den Clathrin-Beschichtungsvorgang neben die Vierhügel-Spalte in die Spalte Z.38346#[5550]“5“/#_[5]“2“1“3“6“/#_{4}“8“[987]/#_{4}“6“[058] geschoben, und zwar absteigend als Spalte 8/6=QS=14_2 für „142“_QS1+3+6=10 für „0“=Komma_“5“ mit L=142,5nm.
Die Evolution findet die Clathrin-Proteine, indem die Kontur von „Dynamin-1“ umringt wird. Die „Dynamin-1-Kontur“ aus Leer-Stellen [*] liegt in der Spalte Z.38345#_8235550#_[7][*]“1“[**]13/#_[7]“39“[**]98/#_[6]“9“7“[**][05]/#_[655][*][334]/#_[613][*][08]/#_[5713858]/#_[5293653]. „Clathrin“ bildet ein Trimer aus 3 homologen Schwerketten „CLTC“ und 3 Leichtketten, in der Variante Form A „CLTA“ oder B „CLTB“. Zusätzlich existiert für die Schwerkette ein trimeres Homolog „CLTCL1“_Clathrin. „CLTCL1“ interagiert nicht mit den Untereinheiten von „CLTC“ und signifikant mit den Leichtketten, sondern ist mit dem AP1- und AP3-Adapterprotein-Komplex assoziiert. „CLTCL1“ wird für neuromuskulöse Verbindungen benötigt [WikiGenes - CLTCL1 - Clathrin, schwer, kettenartig 1]. Diese 4 Proteine umschließen „Dynamin-1“: Homologe Schwerkette: Das Protein „CLTCL1_Clathrin“=1640AS kann den oberen auskragenden Teil von „Dynamin-1“ nicht umhüllen, sondern ankert mit der Ziffer „1“, und zwar absteigend als QS9+7=16_QS39_1=40 für „CLTCL1“=1640AS. Der seitliche Überhang „8=Extra“ wird über die Serien-Randspalte von „Methionin“=C5H11NO2S=30+11+7+16+16=80E gebunden, und zwar in Z. 38346#[16]“1“1“78“{1} als QS1+1+78=Methionin=80E. „Zeigt Merkmale für Initiator-Methionin, modifizierter Rest“ [CLTCL1 - Clathrin heavy chain 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „Adapterproteine“ sind mit „Clathrin“ in der Vesikelhülle assoziiert, um die vesikuläre Fracht auszuwählen. Die Adapterkomplexe AP1 (8 Proteine) und AP3 (7 Proteine) besitzen keine markanten Merkmale. Der AP3-Komplex enthält 2 Paare mit gleicher Länge, so dass jeweils ein Unterschied lesbar sein muss. Das Protein (Mensch) „AP3M1“=418AS liegt in der Spalte Z.38346#_“8“1“[5]{21}{3}[6]/#_3“9“4“{8}{9}[87] und zählt von der Ziffer „4“ nach links als 4_QS9_8+1=18 mit 4_18 für „AP3M1“=418AS [AP3M1 - AP-3 complex subunit mu-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP3M2“=418AS liegt seitlich als „21“_Spalte 3/8=QS=“11“_“9“ mit Summe 21+11+9=“41“_“8“ für „AP3M2“ {}=418AS [AP3M2 - AP-3 complex subunit mu-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP3S1“=193AS liegt in der Spalte Z.38346#_[8]“1“[52]{1}[36]/#_“3“9“{4}{89}[87] über Spalte „1/9“ mit 19_3 für AP3S1“=193AS [AP3S1 - AP-3 complex subunit sigma-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP3S2“=193AS liegt seitlich als „1“_QS4+89=“93“ mit 1_93 für „AP3S2“=193AS [AP3S2 - AP-3 complex subunit sigma-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP1G1“=822AS liegt in der Spalte Z.38346#_“8“1“{52}{1}{3}[6]/#“3“9“{48}{9}[87] als „8“_Spalte „1/9“ für 19_3 mit „8“_Summe 19+3=22 mit 8_22 für „AP1G1“=822AS. Das Protein (Mensch) „KIF1C_ Kinesin“= 1103AS (1.Mitglied der Familie) bindet als QS52+48=100_Spalte 1/9=QS=10_3 mit Summe 100+10=110_3 für „KIF1C“{}=1103AS. Drei ähnliche Adaptine können unabhängig an „CLTCL1“ binden: Das Protein (Mensch) „AP1S1“ liegt in der Spalte Z.38346#_“8“1“5“2“{1}{3}/#_“39“4“[8]{9}{8}/#_[97]{46}{0}[5]/#_554334/#_134085 als „1“_QS8_39_Spalte 5/4=QS=9_2 mit „1“_Summe 8+39+9+2=“58“ mit 1_58 für „AP1S1“=158AS [AP1S1 - AP-1 complex subunit sigma-1A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP1S2“=157AS als „1“_Spalte 3/8=QS=11=QS=“2“_“9“_“46“_“0“ mit „1“_Summe 2+9+46+0=“57“ mit 1_57 für „AP1S2“ {}=157AS[AP1S2 - AP-1 complex subunit sigma-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP1S3“=154AS über Spalte „9/5/1“=QS=15_QS3+4+0_3=10 für 0_4 mit „15“_Summe 0+4=“4“ für „AP1S3“=154AS [AP1S3 - AP-1 complex subunit sigma-3 - Homo sapiens (Human) | UniProtKB | UniProt]. „CLTCL1“ findet örtlich somit passende Adaptine.
Schwerkette: Das Protein „CLTC_Clathrin“=1675AS setzt die Umhüllung am linken Rand fort. Die Zahl 9+7=“16“ muss aus der homologen Schwerkette übernommen werden oder alternativ unabhängig als Zahl 16 in der Serien-Randspalte gelesen werden, und zwar in der Spalte Z.38349#[161]“16“55“(*)/#[16116]“13“(*)/#[16115]“7“[138584200] als „16“_QS55_13_7=“75“ mit 16_75 für „CLTC“=1675AS [CLTC - Clathrin heavy chain 1 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Vesikelmembran ist „CLTC“ mit dem Heterotetramer „Adapterprotein-Komplex-AP2“ assoziiert, um bei der Endozytose über die Plasmamembran spezielle Frachten aufzunehmen. Der AP2-Komplex besteht aus 5 Proteinen, von denen die Beta-Untereinheit „AP2B1“ an Clathrin „CLTC“ in der aktiven Konformation bindet. „AP2B1“=“9“37AS kann nach der Ziffer „9“ die Zahl „37“ aufsteigend oder alternativ absteigend zählen, was wie ein „Ohr“ aus dem Komplex herausragt und somit die aktive Form darstellt. Die Alpha-Untereinheit erkennt zwar am rechten Zahlenrand das Ende vom Fracht-Motiv „[ED]-X-X-X-L-[LI]“ mit Leucin=72-72-72=Isoleucin, aber an das aktive „AP2B1“ bindet in der Spalte Z.38345#_[8]“2“3“55“505“/#_{78}[152136] der Motiv-Anfang „[ED]“ mit der lesbaren Zahl{78}=Glutaminsäure (E/Glu)= C5H9NO4=30+9+7+32=78E und Asparaginsäure (D/Asp)=C4H7NO4=24+7+7+32=70E als QS2+3+55+5+0+5=“70“ an, wobei „505“ das Clatrin-Trimere-Zentrum bildet bzw. im Hohlkörper mit dem Vesikel-Kugelmittelpunkt mit der Fracht symbolisiert wird. Erst bei einer Fracht-Motivation bildet Clathrin somit „36“ Trimere für eine Vesikel-Hülle. Das Protein (Mensch) „Necap1“=275AS besetzt den rechten Zeilenrand, so dass keine Fracht in dieser Motiv-Spalte andocken kann, folglich ändert sich dabei die AP2-Konformation mittels Deaktivierung vom offenen zum geschlossenen Zustand. „Necap1“ besetzt die Randspalte Z.38347#_5/#_3/#_4/#_2 als „2“_QS3+4=7_5 mit 2_7_5 für „Necap1“=275AS [NECAP1 - Adaptin ear-binding coat-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Adaptine „AP2A1“ und „AP2A2“ folgen als Matrix am rechten Rand. Das Protein (Mensch) „AP2A1“=977AS liegt in der Spalte Z.38348#_6974605(8)(27)3/6554334{77}(4)4/6134085{6}{3}(9)2 über „77/63“ mit QS6+3=“9“_“77“ für „AP2A1“{}=977AS [AP2A1 - AP-2 complex subunit alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „AP2A2“=939AS als „9“_QS4_8+27=39 mit 9_39 für „AP2A2“()=939AS [AP2A2 - AP-2 complex subunit alpha-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „AP2A2“ besitzt eine Bindestelle für „1,2-Diacyl-sn-glycero-3-phospho-(1D-myo-inositol-3,4,5-trisphosphat)“= C11H13O22P4=66+13+176+60=315E in der Randspalte Z.38351#_[84]{2}{„0“}“0“/#_[65]“3“1“{“1“}{„4“}“9“ als „3“_QS1+1+4_0+0_9=“15“ für 315E, wobei zur Bindung eine Schleife „0-0“ enthalten ist [MetaNetX: MNXM1105914 - ein 1,2-Diacyl-sn-glycero-3-phospho-(1D-myo-inositol-3,4,5-trisphosphat)]. Die Katalyse erfolgt durch das Enzym (Mensch) „PTEN“=403AS in der Spalte 20/14 als „4“_“0“_Spalte 2/1=QS=“3“ mit 40_3 für PTEN {}=403AS [PTEN - Phosphatidylinositol 3,4,5-trisphosphate 3-phosphatase and dual-specificity protein phosphatase PTEN - Homo sapiens (Human) | UniProtKB | UniProt]. Die Adaptine „AP-2 alpha“ und „AP-2 Sigma“ erkennen an der Fracht das Motiv „[ED]-X-X-X-L-[LI]“. Leucin [L] / Isoleucin [I] ergeben „72_72“. Das Motiv liegt in der Zeile Z.38351#_[3]“8“58“4“2“00“ mit QS8+58+4+2+0+0=“72“ für 72E. In der Randspalte „3/4/2/0“ folgt QS3+4=7_2 für 72E. Angrenzend nochmals „72“ in „AP2A2“ gespiegelt als „27“. Die beiden „Ohren“ [Skizze: AP2-Adapterkomplex – Wikipedia (en-m-wikipedia-org.translate.goog) ] sind nicht lesbar und werden von den Anhängedomänen, links von AP2-Beta und rechts von AP2-Alpha gebildet, wobei es sich um die beiden Seiten im Fracht-Motiv „[ED]“-X-X-X-L-„[LI]“ handeln könnte. Folglich besitzen in der Mitte „AP2M1“ und „AP2S1“ keine „Ohren“. Die µ-Untereinheit „AP2M1“ ist im offenen Zustand mit dem Zytosol verbunden oder inaktiv geschlossen. Beim offenen Zustand kann sich „AP2M1“ alternativ und gekoppelt nach links zählen, weil AP2-Beta diesen Platz im aktiven Zustand verlassen hat. Das Protein (Mensch) „AP2M1“=435AS liegt in der Spalte Z.38348#_[697](4)(6)[058273]/#_[65]{(5)}(4)“3“3“[4][7744]/#_[61]{3}{“4“}0“[8][5][6392]/#_[571]“3“8“[584200], und zwar inaktiv über Spalte 4/3 mit „4“_“3“_Spalte 3/0/8=QS=11=QS=“2“_“3“ mit 43_Summe 2+3=5 mit 43_5 für „AP2M1“=435AS. Aktiv absteigend als „4“ Spalte 5/3 mit „3“_5“ für „AP2M1“{}=435AS. „AP2M1“ besitzt die Funktion, an der Oberfläche mit einem Motiv „Y-X-X-Phi“ zu interagieren, wobei jedoch eine Phosphorylierung an Threonin=C4H9NO3=24+9+7+24=64E erforderlich ist, damit es sichtbar wird. „Threonin“ setzt an „AP2M1“ an der Endziffer „5“ mit „54“ an und ergänzt in der Vorzeile QS54_6+4=64 für Threonin ()=64E [AP2M1 - AP-2 complex subunit mu - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AP2S1“=142AS füllt den schmalen Spalt zwischen „AP2M1“ und „AP2A1/AP2A2“, und zwar vertikal 5-zeilig absteigend in Spalte Z.38346#_[21]“3“[6]/#_[89]„8“[7]/#_[60]“5“[8]/#_[33]“4“[7]/#_[08]“5“[6] über Spalte 5/4/5=QS=14_Spalte 3/8=QS=11=QS=2 mit 14_2 für „AP2S1“=142AS, wobei die Ziffer „0“ im Zentrum 5“0“5 in der Vorzeile angehängt werden kann [AP2S1 - AP-2 complex subunit sigma - Homo sapiens (Human) | Publications | UniProtKB | UniProt]. Das Protein (Mensch) „AP2-Beta_AP2B1“=937AS bindet auf der linken Seite an die Clathrin-Schwerkette „CLTC“, und zwar in der Spalte Z.38347#_{7}{3}[9]/#_[6]{„9“}[7]/#_[6]“5“5“/#_“6“1“3“ inaktiv aufsteigend als „9“_QS5+5=10 für „0“_3 mit QS0+3=“3“_QS6+1=“7“ mit 93_7 für „AP2B1“= 937AS aktiv {} absteigend als 9_3_7 für „AP2B1“=937AS [AP2B1 - AP-2 complex subunit beta - Homo sapiens (Human) | UniProtKB | UniProt].
Die Schwerkette „CLTC“ interagiert mit dem Clathrin-Assemblierungsprotein „PICALM“, das an PIP2 (Phosphatidylinositol-4,5-bisphosphate)= C47H80O19P3=282+80+152+45=559E bindet. Das Protein (Mensch) „PICALM“=652AS ist örtlich verfügbar, und zwar in der Spalte Z.38348#_[16]{9}[74]/#_6{„5“5“}“4“/#_[16]“1“3“4“ als Ring über Spalte 5/1=QS=“6“_“5“_QS4_3+4=11=QS=“2“ mit 65_2 für „PICALM“=652AS und PIP2=559E als 55_9 für PIP2 {}=559E [PICALM - Phosphatidylinositol-binding clathrin assembly protein - Homo sapiens (Human) | UniProtKB | UniProt]. „CLTC“ interagiert weiterhin mit dem „Hepatozyten-Wachstumsfaktor-regulierte Tyrosinkinase-Substrat (HGS)“. Das Protein (Mensch) „HGS“=777AS liegt am Cofaktor Zink {}=30E in der Spalte „3/0“, und zwar in der Spalte Z.38349#_55“4“{„3“}“3“4“/_[1}“3“4“{0}[85] als QS3+4=7_QS4+3=7_3+4=7 mit 7_7_7 für „HGS“=777AS mit „Thyrosin“=96E als QS5+4=9_QS3+3=6 mit 9_6 für Thyrosin=96E [HGS - Hepatocyte growth factor-regulated tyrosine kinase substrate - Homo sapiens (Human) | UniProtKB | UniProt]. „CLTC“ liegt in einer Rezeptoren-Grube. Um das Vesikel zu umhüllen muss der Zählbereich an die Position des Trimers mit Trimer-CLTC=3-fach 1675AS=5025AS gesetzt werden. Das Trimer-Zentrum liegt in der klassischen Größe „505“, und zwar in der Spalte 38344#_5590924/#_555050 als 50_QS9+2=11=QS=2_5 mit 50_2_5 für Trimer-CLTC=5025AS.
Leichtkette-Form A: Das Protein (Mensch) „CLTA_Clathrin“=248AS folgt in der Spalte Z.38348#[1611697](**)“0“5“/#[1611655](*)“3“3“[4]/#[1611613](*)“0“[85]/#16115713858/#[1611529]“3“6“[53] als QS13_3+6=22_Spalte 3/0/8=QS=11=QS=2 mit Summe 22+2=“24“_QS3_0+5=“8“ mit 24_8 für „CLTA“=248AS [CLTA - Clathrin light chain A - Homo sapiens (Human) | UniProtKB | UniProt]. Leichtkette-Form B: Das Protein (Mensch) „CLTB_Clathrin“=229AS schließt den Ring um Dynamin-1 (*) in der Spalte Z.38345#[161182]“3“5“5“5“0“/#[16117](****)“13“/#[1611739](**)“9“[8] als QS3+5+5+5+0=“18“_QS1+3=“4“ mit Summe 18+4=“22“_“9“ für „CLTB“=229AS [CLTB - Clathrin light chain B - Homo sapiens (Human) | UniProtKB | UniProt]. Was bewirkt Magnesium? Innerhalb der Dynamin-Kontur besetzt das Magnesium die Spalte „4/4/4“=QS=12=Magnesium. Die Restspalte „52/48“ zählt dann QS52+8+4=Kugel=64. Mit „64“=QS=10 für „0“ hängt sich diese Funktion als Kunstgriff an Clathrin „in vivo“ an.
Die Chlatrin-Hülle wird durch das Protein (Mensch) „Hsc70_HSPA8 - Heat shock“=646AS abgebaut. An diesem Prozess sind weiterhin die Proteine „Hsp70“ und „Hsp110“ beteiligt [Grenzen | Die Rolle molekularer Chaperone beim Clathrin-vermittelten vesikulären Transport (frontiersin.org); E. Lafer u.a.; Mai 2015; https://doi.org/10.3389/fmolb.2015.00026]. Hsc70=646AS zählt die Zahl „64“ wie unter Einwirkung von Magnesium, um den maßgeblichen Bereich zu markieren, und zwar in der Spalte Z.38346#_“52“[1]/#_“4“8“[9]/#_“4“6“[0]/#_[4]“3“3“ als QS52_4+8=“64“_QS4+6=10 für „0“ _QS3+3=“6“ mit „64“_Summe 0+6=“6“ mit 64_6 für Hsc70=646AS. Funktionell entsteht ein Zyklus von ATP-Bindung, ATP-Hydrolyse und ADP-Freisetzung [HSPA8 - Heat shock cognate 71 kDa protein - Homo sapiens (Human) | UniProtKB | UniProt]. „ATP/ADP“ sind dem Hsc70 zugeordnet in der Spalte Z.38346#_(1)(5){2}[1]/#_9(4){8}9/#_[7](4)“6“0“/#[5](4)“3“[3]/#_3(4)(„0“)“8“, und zwar in der Spalte „2/8“ mit Wasser {}=28(Symbol). „ATP“=260E als „8“_Spalte 3/0=QS=“3“ mit Summe 8+3=11=QS=“2“_“6“_“0“ für ATP=260E. „ADP“=220E als QS1+5=“6“_Spalte 4/4/4/4=QS=“16“ mit Summe 6+16=“22“_“0“ für ADP ()=220E, wobei die Ziffer „0“ bei der Umwandlung aus „ATP“ entnommen wird. Das Protein Mensch „Hsp110_HSPH1“=858AS reguliert „Hsp70_(HSPA8)“. Merkmale sind die ATP-Bindung und die Alpha-Tubulin-Bindung. „Hsp110“ liegt in der Spalte Z.38346#_“5“2“1“/#_“48“[9]/_“4“6“[0], wobei die Ziffer „6“ in ATP=260E bindet. „Hsp110“ als QS5+2+1=8_QS48_4+6=58 mit 8_58 für Hsp110=858AS [Hsp110 HSPH1 - Heat shock protein 105 kDa - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBA1A_Tubulin-1A=451AS ist unter mehreren Subtypen üblich, wobei der Cofaktor Magnesium unterschiedlich zu finden ist. Z.38346#_[5]“21(Magnesium=12E)“[36]/#_[48]“9“8“[7]/#_[46]“0“5“8/#_[43]“3“4“7“/#_[40]“8“[56] absteigend mit Spalte 3/8=QS=11=QS=2_47=QS=11=QS=2 mit Summe 2+2=“4“_QS0+5+8=“13“_QS8+9=“17“_“21“ mit „4“_Summe 13+17+21=“51“ mit 3_51 für „TUBA1A=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Hsp70_HSPA1A“=641AS startet im „ATP“ mit der Ziffer „6“ und benötigt für viele Funktionen einen langen Zählweg, und zwar in der Spalte Z.38346#_[8]“1“[521]/#_[3]“9“4“[89]/#_[9]“7“4“6“[0]/#_{5}“5“4“3“[3]/#_{1}{3}“4“0“[8] als „6“_Schleife Spalte 3/0=QS=“3“_absteigend “4“_ QS5+4_7+4=“20“_QS9+4_1=“14“ mit 6_Summe 3+4+20+14=41 mit 6_41 für „Hsp70“=641AS [HSPA1A - Heat shock 70 kDa protein 1A - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte „6/3/0“ ist die Ziffer „0“ der ATP/ADP-Umschalter, der über die Spalte 3/0=Zink=30E mit dem Zinkfingerprotein (Mensch)= „RBCK1_C3HC4-type“=510AS an „Hsp70“ bindet. „RBCK1“ über Spalte „5/1“ für „51“_QS3+4=“7“ _Spalte 3/0 (Zink=30E) mit 0_3 als „51“{}_Summe 7+0 +3=10 für „0“ mit 51_0 für „RBCK1“=510AS.
Die Clathrin-Schwerkette enthält eine QLMLT-Sequenz von Aminosäuren in der Folge „Glutamin (Q/Gln)=78E; Leucin (L/Leu)=72E; Methionin(M/Met)=80E; Leucin (L/Leu)=72E; Threonin(T/Thr)=64E“. Die lesbare Zahl „78“ am Protein kann dabei beispielsweise mit der lesbaren Zahl „64“ am Zahlenrand verbunden werden, wobei das Trimer-Zentrum tangiert wird. Beim Abbau von Clathrin findet das Proteine „Hsc70“ das „Clathrin-Triskelion“ im Bereich der QLMLT-Sequenz durch ein entfaltetes, freiliegendes hydrophobes Segment. Die Sequenz bildet nicht zwingend eine Kette, sondern nur eine Zahlenfolge, die eine gespiegelte Zahl enthalten kann. Nach der Zahl „Glutamin (Q/Gln)“ {}=78E folgt Leucin=72E in der Randspalte Z.38343#_[907](6)(2)(8)[991]{64}/#_[8]“65“5“(9)(0)[924]“9“5“/#_[8]“2“[35](5)(50)“50“8“[9]/#_{78}… über Spalte 655/2xx als Summe 2+65+5=72 für Leucin=72E_ Methionin(M/Met)=80E als QS6+2+8=“16“_QS9+0_5=“14“_“50“ mit Summe 16+14+50=“80“ für „Methionin“ ()=80E_ „Leucin“=72E als QS50_Spalte 9/8=QS=17_5 mit Summe 50+17+5=72 für Leucin=72E_ Threonin(T/Thr)=64E ist lesbar. Die QLMLT-Sequenz enthält einen Bogen der in der Spitze das Wasser=28 herausschiebt, so dass ein hydrophobes Merkmal vorliegt.
Membrankrümmung: Die Zellmembran kann sich nur krümmen, wenn sich ihre Lipid-doppelschicht aufgrund einer Membranlipidasymmetrie krümmt. Die hydrophilen, wasserlöslichen Pole der Lipiddoppelschicht bilden die innere und äußere Zellmembranoberfläche, wohingegen die hydrophoben, wasserabweisenden Pole der Lipiddoppelschicht zum Membranzentrum gerichtet sind [Zellmembran – Wikipedia]. „Phospholipid-Flippasen“ (Phospholipidtranslokatoren) verschieben Aminophospholipide von der extrazellulären zur cytosolischen Schicht. Im Dynamin-Komplex ist in der Vierhügel-Spalte „4-4-4[334]-4“ eine Membran „33“ angelagert. Das Protein (Mensch) „ATP8B3_Phospholipid-transporting ATPase“=1300AS zieht durch diese Membran „33“. An der Katalyse sind ATP/ADP, Wasser sowie Phospatidyl Serin [1,2-Diacyl-sn-glycero-3-phospho-L-serin]=C42H82NO10P=252+82+7+80+15=436E [UNII - 394XK0IH40 (fda.gov)] beteiligt. „Magnesium (Mg2+)“=12E liegt als Cofaktor am Ende der vertikalen Transportstrecke. „ATP“=260E liegt in der Spalte Z.38349#_[4]“33“47“[7]/#_[4]“0“[8563] als 47=QS=11=QS=2_33=QS=6_0 mit 2_6_0 für ATP=260E Bei der Umwandlung von ATP zu ADP entnimmt ADP schleifenförmig den Anteil „33“ aus ATP. „Phospatidyl Serine“ ist wegweisend an ATP/ADP beteiligt, und zwar in der Spalte Z.38348#_[4]“6“0“[5]/#_[43]“3“4“ als 4_3_QS0+6=“6“ mit 43_6 für Phospatidyl Serin=436E. Der Transport wird 4-zeilig als Spalte zwischen dem Magnesium=12E, gespiegelt als „21“, und der Membran „33“ dargestellt, darin beginnt „ADP“ im Magnesium und „ATP8B3“ endet dort. „ADP“=220E liegt in der Spalte Z.38346#_[5]{2}“1“[3]/#_[4]{8}“9“[8]/#_[4]{„6“}{„0“}5/#_“4“{„3“}{3}[4]/#_[4085], und zwar über die Wasser-Spalte 2/8 mit QS2+8+6+3_3=22_0 für „ADP“ {}=220E. „ATP8B3“=1300AS als QS4+3_6=“13“_“0“_Spalte 1/9=QS=10 für „0“ mit 130_0 für „ATP8B3“=1300AS. Aufgrund der Doppeldeutigkeit „Membran=männlich=33“ ist die „P4-ATPase-Flippase“ an Spermien beteiligt [ATP8B3 - Phospholipid-transporting ATPase IK - Homo sapiens (Human) | UniProtKB | UniProt]. Die Familie „P4-ATPase-Flippase“ mit 14 Proteine bildet Heterodimere mit dem Protein-TYP „CDC50“. Davon existieren aber nur 3 Proteine. Die Bezeichnung P-Typ resultiert aus Phosphor (P), weil ein Aspartatrest der ATPase durch ATP transient (temporär / vorübergehend) phosphoryliert wird. Der Transport ist mit dem Wechsel von 2 Enzym-Hauptkonformationen verbunden. Aspartat=Asparaginsäure (D/Asp)=C4H7NO4=24+7+7+32=70E setzt sich aus der Zahl „60“ und der Spalte 1/9=QS=10 als QS60+10=70 zusammen. „ATP8B3“=1300AS verfügt somit über einen entgegengesetzten Zählweg, und zwar über Magnesium in der Spalte Z.38346#_15“2“13“/#_94“8“98/#_7“4“6“[05] als „13“_Spalte „2/8“=QS=10 für „0“_QS4+6=10 für „0“ mit 13_0_0 für „ATP8B3“=1300AS. Das ATP=260E stammt dabei alternativ aus „74“=QS=11=QS=“2“_“60“ für ATP=260E. „ATP8B3“ benötigt im Unterschied zu ATP8B1/ATP8B2 keine Funktionsbindung an „CDC50“. Das Protein (Mensch) „CDC50C“=113AS liegt in der Spalte Z.38346#_[5]“21“3“/#_[4]“89“[8] als Block QS89+21=“110“_“3“ mit Summe 110+3=113AS für CDC50C=113AS, wodurch der linke und rechte Zählweg unverschieblich verbunden sind, was eine Bindung verhindert [TMEM30CP - Cell cycle control protein 50C - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CDC50A“=361AS verbindet beide Seiten unverschieblich mittels Ring in der Spalte Z.38346#_[15]“2“1“3“/#_[9489]“8“/#_[7]“4“[60]“5“/#_[5]“4“3“34“ als QS2+1=“3“_Spalte 3/8/5=“16“_“34“_“3“_Spalte 4/4=“8“ mit „3“_Summe 16+34+3+8=“61“ mit 3_61 für „CDC50A“=361AS. CDC50-Merkmal von „4“-fach Cystein=C3H7NO2S=64E für Disulfidbrücken ist zählbar (46 /33_4/ 13_6/ 15_4) [TMEM30A - Cell cycle control protein 50A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ATP8B1“=1251AS [ATPIC, FIC1, PFIC] ist bereits gespiegelt lesbar für „1251“ AS, wobei es sich um eine bekannte Mutation handelt könnte, die Leberschäden verursacht. „ATP8B1“=1251AS im 1. Zählweg: Spalte Z.38346#_[1]{5}“2{“1“}{3}/#_[9]{4}“8“[9]{8}/#_[7]{4}{“6“}[0]{5}/#_[54]{“33“}{“4“} über „21“ als „1“_“2“ (Magnesium=12E)_Spalte 8/6=QS=“14“_“33“_“4“=„51“ mit 12_51 für „ATP8B1“ =1251AS. Gegenrichtung als 2. Zählweg: Über [2]„1“_Spalte 3/8=QS=11 mit Summe 1+11=“12“_Spalte 5/4=QS=9_33_QS4+6=10 für „0“_Spalte 5/4=QS=9 als „12“_Summe 9+33+0+9=“51“ mit 12_51 für „ATP8B1“ {}=1251AS. Mit der „CDC50A“-Bindung wird die normale Funktion unterstützt [ATP8B1 - Phospholipid-transporting ATPase IC - Homo sapiens (Human) | UniProtKB | UniProt].
„Floppasen“ gehören zur Familie der „ABC-Transporter“ und erhalten die asymmetrische Verteilung von Phospholipiden der Zellmembran, indem sie bestimmte Phospholipide von der zytosolischen Seite zur extrazellulären Seite transportieren. Die ABC-Familie besteht aus 7 Unterfamilien. Das Protein (Mensch) „ABCA1“=2261AS gehört zur Familie „ABCA“ [ ABC-Transporter – Wikipedia]. „ABCA1“ transportiert „Cholesterin“=C27H46O=162+46+8=216E und Phospholipiden aus dem Zellinneren heraus, wobei ATP für ADP verbraucht wird. Zur Funktion ist das Phospholipid-Transferprotein (PLTP) unentbehrlich [Phospholipid-transportierende ATPase ABCA 1 – Wikipedia]. Das Cholesterin wird dann auf der Membranoberfläche präsentiert. Das Apolipoprotein (Apo A1) bindet das Cholesterin und es entstehen „High Density Lipoproteine (HDL)“ [ABCA1 - DocCheck Flexikon]. An der Katalyse von „ABCA1“ sind ATP/ADP, Wasser und Phospatidyl Serin [1,2-Diacyl-sn-glycero-3-phospho-L-serin]=C42H82NO10P=436E beteiligt. „ATP“=260E liegt in der Spalte Z.38349#_[4]“33“47“[7]/#_[4]“0“[8563] als 47=QS=11=QS=2_33=QS=6_0 mit 2_6_0 für ATP=260E Bei der Umwandlung von ATP zu ADP entnimmt ADP schleifenförmig den Anteil „33“ aus ATP, und zwar in der Spalte Z.38346#_[5]{2}“1“[3]/#_[4]{8}“9“[8]/#_[4]{„6“}{„0“}5/#_“4“{„3“}{3}[4]/#_[4085], und zwar über die Wasser-Spalte 2/8 mit QS2+8+6+3_3=22_0 für „ADP“ {}=220E. Das Wasser muss bei Katalyse nicht dem „ADP“, sondern zwecks Hydrolyse dem „ATP“ zugeordnet werden, so dass die Zahl „56“=QS=11=QS=2_8 für Wasser 28 (Symbol) in Z.38350#_0“8“5“6“ mitwirkt. Das Phospatidyl Serin=436E ist in diesem Katalyse-Weg bereits enthalten, und zwar als in der Spalte Z.38348#_[4]“6“0“[5]/#_[43]“3“4“ als 4_3_QS0+6=“6“ mit 43_6 für Phospatidyl Serin=436E. Die Katalyse erzeugt einen lotrechten linken Rand, dem auf der rechten Seite membranartig das Cholesterin=216E mit einem rechten Rand folgt, und zwar in der Spalte Z.38346#_[21]“3“[6]/#_[89]“8“[7]/#_[60]“5“[8]/#_[33]“4“7“ als QS4+7=11=QS=“2“_Spalte 3/8/5=QS=“16“ mit 2_16 für Cholesterin=216E. „ABCA1“ nimmt nunmehr das Cholesterin absteigend auf, indem es zuerst „Wasser“ und „ATP“ und dann „ADP“ addiert. Die vertikale Säule wird dabei als Schleife durchlaufen, um das Cholesterin auf der Innenseite abzuholen und nach links zu transportieren. Insgesamt bildet „ABCA1“ einen geschlossenen Ring um die Membranziffer „3“. „ABCA1“ liegt in der Spalte Z.38346#_[5]“21“3“6/#_[4]“89“8“[7]/#_[4]“60“5“[8]/#_“43“[3]“47“/#_“408“56“, und zwar absteigend als 56=QS=11=QS=“2“_47=QS=11=QS=“2“ für „22“_absteigend Spalte 3/8/5=QS=“16“_aufsteigend QS2+1_8+9_6+0=3+17+6=“26“_Schleife links QS4+3=“7“_QS4+0+8(Ringschluss)=“12“ mit „22“_Summe 16+26+7+12=“61“ mit 22_61 für „ABCA1“=2261AS [ABCA1 - Phospholipid-transporting ATPase ABCA1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Proteine „PLTP“ und „APOA1“ sind mit „ABCA1“ vernetzt. Sie regulieren sich, weil sich deren Zählweg überschneiden. Hierbei wird die Membranziffer „3“, so dass „ABCA1“ seinen komplizierten Ring-Pfad findet, bei dem die „3“ unbesetzt bleiben muss. Das Protein (Mensch) „Apolipoprotein (Apo A1)“=267AS enthält die Zahl „26“ als Bezug zum Blut. Im Zählweg ist Membran=männlich=“33“ von Bedeutung, weil es zur Beweglichkeit der Spermien beiträgt. „Apo A1“ dient weiterhin als Cofaktor für die Lecithin-Cholesterin-Acyltransferase (LCAT)=440AS, die mit 47=QS=11_33_0 als Summe 11+33=44_0 für LCAT=440AS im Zählweg mit enthalten ist [LCAT - Phosphatidylcholine-sterol acyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Apo A1“=267AS liegt in der Spalte Z.38349#_[554]“3“3“4“7“/#_[1]“3“4“0“[856] als 47=QS=11=QS=“2“_QS3+3=“6“_QS3+4+0=“7“ mit 2_6_7 für „Apo A1“=267AS [APOA1 - Apolipoprotein A-I - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLTP“=493AS liegt als inaktive Variante {} in der Spalte Z.38348#_[974]{„6“}{„0“}“5“/#_[5]“54“{„3“}{3}{„4“}/#_[1]“34“0“[85]/#_[71]“3“8“[58] als „4“_Spalte 0/3=QS=“3“_“6“ mit „4“_Summe 3+6=“9“_“3“ mit 4_9_3 für inaktiv „PLTP“ {}=493AS. In der aktiven Formation wird das „Phosphatidylcholin“=430E aufgenommen, weil es in der Spalte „43“/[4]“0“ im Zählweg liegt. Die Ziffer „3“ wird analog zu „ABCA1“ umgangen, und zwar als „4“_absteigend QS6+0+5=11=QS=2_Wende QS3_0=“3“_QS3+8=11=QS=2_Wende 34_54 mit 4_Summe 2+3+34+54=93 mit 4_93 für aktiv „PLTP“=493AS [PLTP - Phospholipid transfer protein - Homo sapiens (Human) | UniProtKB | UniProt].
Phospholipid-Scramblasen (PLSCRs) unterscheiden sich von „Flippasen“ und „Floppasen“, indem sie Phospholipide zwischen den beiden Monoschichten der Zellmembran in beide Richtungen transportieren. Zur Familie gehören 5 Proteine. Das Innenblatt ist dem Zellinneren zugewandt und enthält negativ geladene Aminophospholipide und Phosphatidylethanolamin. Das äußere Blatt enthält Phosphatidylcholin und Sphingomyelin. Weil das Enzym außerdem über Cofaktoren verfügt, sind Richtungsunterschiede möglich. Die Enzyme „hPLSCR1/hPLSCR3“ wurden im Gehirn nicht nachgewiesen. Ohne „hPLSCR1“=318AS würde das Gehirn nicht funktionieren, denn es liegt fast lesbar in Z.38346#_15“21“3{6928} an der Magnesiumposition „21“ mit „3“_“1“_QS2+5+1=“8“ für 318AS. „hPLSCR1“ kann nicht von Magnesium angelockt werden, weil es bereits im Ziel liegt. Es wird nichts transportiert, aber am linken Zeilenrand in der Ecke „6928/5“ mit QS6+9=15_QS2+8=10 (Wasser) für „0“_5 mit Summe 15+0+5=“20“ wird Calcium=20E kreiert, um überhaupt in gegensätzliche Richtungen transportieren zu können. Die folgende Quadrat-Ecke „2/200“ ist als Calcium am Rand lesbar. Das Protein (Mensch) „hPLSCR2“=297AS besitzt nur einen einzigen Cofaktor, und zwar „Calcium“. Das Quadrat wird nunmehr weiter besetzt, so dass sich eine freie Diagonale bildet, in der „hPLSCR2“ zählbar ist. Die rechte Quadratseite wird durch Wiederholungen von „Phosphatidylethanolamin (Kephaline)“=C41H78NO8P=246+78+7+64+15=410E [Kephaline | 39382-08-6 (chemicalbook.com)] besetzt. „Kephaline“=410E als Folge gestapelt über Spalte „4/46“ mit „4“_QS4+6=“10“ mit 4_10 für 410E_weiter „4“_QS3+3+4=“10“ mit 4_10 für 410E_weiter, noch breiter gezählt für diagonale Rampe mit „4“_QS0+8=“8“_QS5+6=11=QS=“2“ mit „4“_Summe 8+2=“10“ für 410E_weiter am Calcium-Rand in der Spalte Z.38352#“3“[85]“8“4“{20}{0}/#_“3“6“5“3“[1149] als „4“_Spalte 8/3=QS=11=QS=2_QS6+5=11=QS=2_Spalte 3/3 (Membran/männlich)=QS=6 mit „4“_Summe 2+2+6=“10“ für 410E. Am rechten Rand liegt zwischen beiden Calcium-Ecken das Phosphatidylcholin als 1,2-Di-[(2E,4E)-2,4-octadecadienoyl]-sn-glycero-3-phosphocholin [Bis-DienPC]=C44H80NO8P=264+80+7+64+15=430E [ChemicalBook --- Chemische Produkte Suche]. Folglich liegt „hPLSCR2“=297AS absteigend über die Ziffer „2“ aus Calcium in der Diagonale Z.38346#_“5“2“/#_[4]“8“9“8“/_#[460]“58“/#_[4334]“7“7“[44]/#_[40856]“3“[92]/#_[38584]“2“[00] als „2“_Spalte 7/3=10 für “0“_„7“_“58“_QS8+9+8=“25“_QS5+2=“7“ mit „2“_Summe 0+7+58+25+7=“97“ mit 2_97 für „hPLSCR2“=297AS [PLSCR2 - Phospholipid scramblase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Warum wird „PLSCR3“=295AS nicht im Gehirn gefunden? Weil das Protein die lesbare Calcium-Ecke besetzt. Es kann somit nur die Calcium-Ecke markieren, und zwar in der Randspalte Z.38350#_“3“9“2“/#_“2“[00] als 2_9_QS3+2=5 mit 29_5 für PLSCR3=295AS [PLSCR3 - Phospholipid scramblase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLSCR4“=329AS muss ebenfalls die Diagonale durchlaufen, und zwar aufsteigend mit Bindung im Cofaktor „Mg^2+“ bis zum vertikalen Calcium „2/0“ in der Calcium-Ecke als „3“_Spalte [2]1 (Magnesium) / 9=QS=“10“_QS8+7=“15“_Spalte 9/2=11=QS=“2“_Spalte 7/3=10 für „0“_QS9+2=11=QS=“2“ mit „3“_Summe 10+15+2+0+2=“29“ mit 3_29 für „PLSCR4“=329AS [PLSCR4 - Phospholipid scramblase 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Liegt das Sphingomyelin=C39H79N2O6P=234+79+14+48+15=390E am Rand würde, die Startziffer „7“ stören, und zwar als QS7+4+4=15_QS7+3=10_QS9+5=14 mit Summe 15+10+14= 39_QS2+8=10 für „0“ mit 39_0 für Sphingomyelin=390E. Die Ziffer „2“ aus Phosphatidylcholin=430E in „27“3“/“4“ wird aufgrund der steilen Strecke in Z.38346#_“1“3“[692]{8}/#_“9“8“7“9“[9]{5}/#_[058]“2“{7}{3}/#_[347]“7“{4}[4]/#_[856]“3“9“2“ ebenfalls verwendet. In der nunmehr schmaleren Randspalte bindet sich „PLSCR4“ günstiger an das Protein (Mensch) „CD4-Rezeptor“=458E, und zwar absteigend als „4“_QS7+3=10 für „0“_“5“_“8“ mit „4“_Summe 0+5=“5“_“8“ mit 4_5_8 für „CD4-Rezeptor“{}=458E [CD4 - T-cell surface glycoprotein CD4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Interleukin_16“=1332AS zieht sich links von „CD4“=458AS mit einer Einbindung mit Start am Calcium als „9“_Spalte 7/3=QS=10 für „0“_“4“ mit Summe 9+0+4=“13“_QS2+7=“9“_Spalte 9/9=QS=“18“_in Z.38345#_“5“0“[89] mit „0“_“5“ als „13“_Summe 9+9+9+0+5=“32“ mit 13_32 für „IL16“=1332AS [IL16 - Pro-interleukin-16 - Homo sapiens (Human) | UniProtKB | UniProt]._dat21.11.2023
Synaptische Vesikel (SV): Die Synapsen entwickeln sich an den Nervenenden (Präsynapse) der Axone als Kontaktstelle zu den postsynaptischen Neuronen. Das elektrische Signal wird in chemische Botenstoffe umgewandelt, die von anschließend von Nervenzellen empfangen werden. [Mechanismus entschlüsselt: So entstehen Synapsen (leibniz-fmp.de)]. Die Vorstufen (PV) der synaptischen Vesikel (SV) werden über das Axon durch Motorproteine in das synaptische Endknöpfchen transportiert. Dort versammeln sich ca. 600 dieser sekretorischen Vesikel. Die enthaltenen Botenstoffe werden, über die präsynaptische Membran in den synaptischen Spalt abgegeben. Der Begriff Membran „33“ bleibt somit mehrdeutig, im Ziel geht es um das sehr kleine Membran-Bläschen (synaptische Vesikel / SV) mit einer massenhaften Anzahl von Proteinen auf der Oberfläche. Diese speziellen Transportorganellen des Nervensystems werden vom Motorprotein Kinesin „KIF1A“ transportiert, so dass damit auch der Ort einer Synapsen-Entstehung fixiert wird [Phosphatidylinositol-3,5-bisphosphat erleichtert den axonalen Vesikeltransport und den Aufbau von Präsynapsen | Wissenschaft (science.org); V. Haucke u.a.; Okt 2023; DOI: 10.1126/science.adg1075]. Ein Transport setzt voraus, dass am Zielort zunächst auch der Zellmüll beseitigt wird (Apoptose). Eine Gegenreaktion ist möglich, wenn sich ATP/ADP und GTP/GDP regulatorisch an einer Position verdichten. Der Vorgang zieht sich daher vom Bereich der Vierhügel-Spalte „4-4-4-4“ zur nachgelagerten 3er-Spalte 4-4-4, woraus eine Transportstrecke resultiert. In der Vierhügel-Spalte wird zunächst das Phospholipid „Phosphatidylinositol-4,5-bisphosphate“ (PIP2)= C47H80O19P3=282+80+152+45=559E auf der Innenseite der Zellmembran adressiert. Der axonale Cotransport von synaptischen Vesikel- und Aktivzonenproteinen in Vorläufervesikeln wird vom endosomalen Signallipid Phosphatidylinositol 3,5-bisphosphat [PtdIns(3,5)P2] gesteuert. Das für „PIP2“ zuständige Enzym „Phosphoinositid-3-Kinase (PI3K) kann das spezielle Signalpeptid „Phosphatidylinositol-3,5-bisphosphat [PtdIns(3,5)P2]=C47H85O19P3=282+85+152+45=564E aber nicht produzieren [Phosphatidylinositol-3,5-bisphosphat | C47H85O19P3 | CID-46229858 - PubChem (nih.gov)]. „PIP2“ und „PtdIns(3,5)P2“ liegen in der Spalte Z.38350#[40856]{“3“}[92]/#_[3858]{4}{“2“}0“[0]/#_[36531]{1}“4“[9]/#_[3469]{7}{2}“2“4“ mit „PIP2“=559E als Spalte „3/2“=QS=“5“_Spalte „4/1“=QS=“5“_QS7+2=“9“ mit 5_5_9 für „PIP2“ {} =559E und „PtdIns(3,5)P2“=564E analog mit der Spalte 3/2=QS=“5“_Spalte 0/4/2=QS=“6“_“4“ mit 5_6_4 für 564E.
„PtdIns(3,5)P2“ wird vom Protein (Mensch) „PIKFYVE“=2098AS produziert, das eine Zinkfinger-Domäne zur Bindung an Zink=30E besitzt, und zwar in der Spalte Z.38351#_[38584]“20“[0]/#_[3]“65“3“1“1“4“9/#_[3]“4“697“2“2“[4]/[3]“3“[0{Zink=30E}_82407]_ 31[686681] als „20“_Spalte 4/2=QS=“6“_Spalte 1/2=QS=“3“ mit „20“_Summe 6+3=“9“ für „209“_QS3+1=“4“_QS6+5=11=QS=“2“ mit „209“_Summe 4+2=“6“_Spalte 4/3=QS=“7“_QS3+1=“4“ als „209“_“6“_Summe 7+4=11=QS=“2“ mit „209“_Summe 6+2=“8“ mit 209_8 für „PIKFYVE“=2098AS. Das Zink=“30“ liegt im Zentrum der 3er-Spalte „4-4-4“ und wird mit der Ziffer „3“ tangiert. Das Arzneimittel „Apilimod“= C23H26N6O2=138+26+42+16=222E hemmt „PIKFYVE“ als „22“_Spalte 1/7=QS=8_3 mit „22“_Summe 8+3=11=QS=“2“ mit 22_2 für „Apilimod“{}=222E. Weiterhin wird „PIKFYVE“ durch „YM201636“= C25H21N7O3=150+21+49+24=244E gehemmt. Hierfür wird die Zahl „22“ von „Apilimod“ 2_22 zu 2+2=4 addiert und die Randziffer „4“ [Endziffer von PtdIns(3,5)P2] angelagert für „YM201636“=244E [6-Amino-N-[3-[4-(4-morpholinyl)pyrido[3',2':4,5]furo[3,2-d]pyrimidin-2-yl]phenyl]-3-pyridincarboxamid | C25H21N7O3 | CID-9956222 - PubChem (nih.gov)].
Das Protein „CALM1_Calmodulin“=149AS ist am rechten Rand in Z.38352#_149 lesbar, wodurch „KIF1A“ seitlich fixiert ist [CALM1 - Calmodulin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Weiterhin können sich die Gerüstproteine „TANC2“ und „PPFIA2“ entwickeln.
Das Gerüstproteinen (Mensch) „TANC2“=1990AS übernimmt die Startziffer „3“ von „PtdIns(3,5)P2“ in der Randspalte Z.38350#392/#_200/#_149/#_224, und zwar als QS3+9=12_QS2+0=2_QS1+4=5 mit Summe 12+2+5=19_Spalte 0/9 mit 9_0 als 19_9_0 für„TANC2“=1990AS. Weil die Zahl „20“ in der Randzahl „200“ verwendet wird, erklärt sich bei einem Gendefekt der Zusammenhang mit dem Auge wegen der Hyaluronsäute=200E. Ist Calcium=20E vorhanden ist eine Bindung vorhanden, so dass die Interaktion mit „KIF1A“ reduziert wird. TANC2: „Gerüstprotein in den dendritischen Dornen, die als unbewegliche postsynaptische Pfosten fungieren und in der Lage sind, KIF1A-getriebene dichte Kernvesikel an dendritische Dornen zu rekrutieren“ [TANC2 - Protein TANC2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Gerüstproteinen (Mensch) „PPFIA2_Liprin-alpha-2“=1257AS ist eine Fortsetzung entlang der Randspalte. „KIF1A“ entnimmt aus der Interaktion die beiden Rand-Anteile von „TANC2/PPFIA2“. Bei der Zählung muss die falsche Richtung beim Lesen der Zahl „40“ korrigiert werden, indem ein Homodimer „1257_57_12“ als eine Spiegelung gebildet wird. Die Kopplung beginnt in der Spalte Z.38350#_“56“3“9“[2]/#_“8“42“[00]/#_“3“11“[49]/#_[9]{7}[22]{4}/#_[8]{2}{40}{7}/#_[866}{8}{1} als QS3+9=12_QS5+6=11=QS=2_Spalte 8/3=QS=11=QS=2_Spalte 42/11=QS=53 mit 12_Summe 2+2+53=57 mit 12_57 für Monomer „PPFIA2“=1257AS_Fortsetzung als Spiegelung aufsteigend QS7_2_40_8=57_absteigend Randspalte 4/7/1=QS=12 mit „57_12“ im Homodimer {} für „PPFIA2“=1257AS [PPFIA2 - Liprin-alpha-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „Forms homodimers and heterodimers with liprins-alpha and liprins-beta.
Interacts with the second PTPase domain of PTPRD, PTPRF and PTPRS.
Interacts with KIF1A; the interaction decreases in presence of calcium“ [PPFIA2 Gene - GeneCards | LIPA2 Protein | LIPA2 Antibody]. Das entlang von Mikrotubuli durch „KIF1A“ transportierte Vesikel (SV) kann nur mit einer definierten Geometrie existieren. Der „Stolperstein“, die Zahl „40“ für SV-Durchmesser 40 nm kombiniert mit der Randziffer Form=7 als „407“ ist dafür geeignet, wobei der erforderliche Kreis=64 in der Spalte „7“22“[4]/“2“40“7“ als QS2+40_[Form=7]22=64_[Form=7] vorliegt.
Das Protein (Mensch) „Kinesin KIF1A“ =1690AS ist an ATP=260AS gebunden, so dass sich die Möglichkeit ergibt, den Energiebedarf für lange Transportwege durch „wertlose“ Kunstgriffe gestreckt darzustellen. Im Ergebnis werden die 2 Kunstgriffe zwischen die lesbaren Zahlen „16“_QS0+0=“0“=Vesikel _Randspalte 0/9 für „90“ eingefügt, wobei die Zahl „16“ am Membran-Bläschen (SV) {0_33}“16“ liegt. Das ATP=260E wird in der Z.38353#_“2“2“[4]/#_“4“0“[7] mit „2“_QS2_4=“6“_“0“ mit 2_6_0 für ATP=260E im Kunstgriff durchlaufen. „Kinesin_KIF1A“=1690AS liegt in der Randspalte Z.38351#_[3858420]“0“/#_[3653114]“9“/#_[34697]“2“2“4“/#_[33082]“4“0“7“/#_[3]“16“[86681] als „16“_1. Kunstgriff 0+8+2=10 für „0“_mäanderförmiger 2. Kunstgriff über Spalte 2/4=QS=6_ Spalte 2/0=QS=2_ Spalte 4/7=QS=11=QS=2 mit „16“_Summe „0“_6+2+2=10 für „0“ (Vesikel-Null wird 0-0 transportiert)_Spalte 0/9 mit 9_0 für 90 als „16“_Summe 0+90=“90“ mit 16_90 für „Kinesin_KIF1A“=1690AS [KIF1A - Kinesin-like protein KIF1A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Gen „KIF1A“ codiert außerdem für das Protein (Mensch) „KIF1A_C9JBH1“=38AS, das den Kinesin-Startpunkt {16} in der Spalte Z.38354#_[45]“3“0“8“[2407]/#[033{16}86681] fixiert und mit „3“_QS0+8=“8“ für 38AS im ATP bindet [KIF1A - Kinesin family member 1A - Homo sapiens (Human) | UniProtKB | UniProt].
Damit das Motorprotein Kinesin „KIF1A“ das Vesikel balanciert tragen kann, sitzt das Protein „ARL8“ in der Vesikelmembran und interagiert mit „KIF1A“. „ARL8“ ist an „GTP“ gebunden, so dass die Enge der Proteine zum Showdown „ATP vs. GTP“ führt. Die Version „ARL8A“=186AS besitzt eine GTP-Bindung und die gleichlange Version „ARL8B“=186AS wechselt zwischen GTP/GDP. Es entsteht ein Heterodimer, wobei ARL8B=186AS weit entfernt von der Vesikel-Membran zusammen mit GTP/GDP gespiegelt {681} lesbar am rechten Zeilenrand liegt, und zwar in der Spalte Z.38353#_[97](“2“)(„2“)[4]/#_[82]“4“(„0“)[7]/#_86{6(“8“)1} mit GTP=268E als „2“_Spalte 2/4=QS=“6“_Spalte 0/8=QS=8 mit 2_6_8 für GTP=268E im Wechsel mit GDP ()=228E nach rechts gezählt als „22“_Spalte 0/8=“8“ mit 22_8 für GDP=228E [ARL8B - ADP-ribosylation factor-like protein 8B - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Verbindung von ARL8B=186AS mit den Mikrotubuli ist das Protein (Mensch) „PLEKHM2 (SKIP)“=1019AS notwendig. In der Randspalte [86{6]“8“1“}/“10“0“2“8“ dient die Zahl „100“ für die max. Mikrotubuli-Länge=“100“*10^3 nm. „PLEKHM2“ als „10“_QS0+2+8=“10“_QS8+1=“9“ mit „10“_Summe 10+9=“19“ mit 10_19 für 1019AS [PLEKHM2 - Pleckstrin homology domain-containing family M member 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das „GTP“ für die Bindung an „ARL8A“ wird beim Wechsel GTP/GDP nicht mit verbraucht, weil es seitlich gesondert verfügbar ist, und zwar in der Spalte [8]“2“/“8“6“ als 2_6_8 für GTP=268E. Die Spiegelung „8668“ in der Zahl „1{6}86681“ ist die Kopplungsstelle im Heterodimer, wobei ARL8A=186AS eine Schleife in die Membran „33“ legen muss, um die störende Ziffer „6“ in einen Kunstgriff 10 für „0“ zu beseitigen. Folglich liegt „ARL8A“ =186AS in der Spalte Z.38353#_[7346{9}7]/#_[5{3}{3}{0}{8}2]/#_[3]{“3“}1“6“86“/#_[1]“3“0“5“[100]/#_[9]“2“9“[5524] als „1“_Kunstgriff aufsteigend Spalte 3/3=QS=6_absteigend QS2+9_0=11=QS=2_Spalte 6/5=11=QS=2 mit „1“_Summe 6+2+2=10 für „0“_“86“ mit QS0+86=“86“ als 1_86 für ARL8A=186AS [ARL8A - ADP-ribosylation factor-like protein 8A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Gen „ARL5B“ codiert für das Protein (Mensch) „ARL5B_ADP-Ribosylierungsfaktor-like 8“=179AS, das mit der Bindung an „GTP“ die maßgebliche Bindung in der Membran herstellt, indem die Membran-Spalte 3/3 von „ARL8A“ absteigend verlängert wird, und zwar über die Spalte 9/8=QS=17_ QS3+3+0_3=9 mit 17_9 für ARL5B_8 like“ {}=179AS [ARL5B - ADP-ribosylation factor-like protein 5B - Homo sapiens (Human) | UniProtKB | UniProt]. Insgesamt wird das Membran-Bläschen (SV) Z-förmig als Spalte „0“33/33“0“ im Sinne einer Synapse mit dem synaptischen Spalt als Zielort sichtbar.
Über „ARL8“ wird die Position von „Tubulin“ für Mikrotubuli als Laufbahn für das Motorprotein „KIF1A“ gesucht. „ARL8“ reguliert zwar den Vesikeltransport, muss aber zunächst durch den Komplex „BLOC“ auf den Vesikeln rekrutiert werden. „BLOC“ kann alternativ direkt mit dem Signallipid „PI(3,5)P2“ interagieren, so dass dessen Niveau und somit der Transport direkt gehemmt werden kann [„Investigation of biogenesis of the presynaptic compartments using human iPSC-derived neurons“; F.Rizalar (2022); SR_Thesis_final_20220930.pdf (fu-berlin.de)].
Der 8-teilige Komplex „BLOC“ enthält 5 Untereinheiten speziell für Lysosomen und 3 Proteine [BLOC1S1 (BLOS1); BLOC1S2 (BLOS2); BLOC1S7 (Snapin)], die sich mit dem Komplex „BORC-1“ von Endosomen überschneiden [„BORC and BLOC-1: Shared Subunits in Trafficking Complexes: Developmental Cell“; C. Ungermann u.a; Apr 2015; https://doi.org/10.1016/j.devcel.2015.04.008].
Das Signallipid „PtdIns(3,5)P2“ () =564E kann das gespiegelt mit {681}am Zeilenrand lesbare ARL8B=681AS nicht erreichen, weil zunächst eine trennende Lücke {407} geschlossen werden muss. „BLOC1S2“ und „BLOC1S7“ teilen sich nach Einbindung in „PtdIns(3,5)P2“ die Lücke. BLOC1S1 liegt seitlich an „PtdIns(3,5)P2“ und „ARL8B“, weil die Lücke bereits besetzt wird. „ARL8B“ wird lediglich umgrenzt. Das Protein (Mensch) „BLOC1S1“=153AS
gehört zu einem Octamer [BLOC1S1 bis BLOC1S6, DTNBP1/BLOC1S7 und SNAPIN/BLOC1S8]. „BLOC1S1“ liegt gestreckt in der Spalte Z.38350#_“5“6“(3)[92]/#_“8“[4](2)(0)[0]/#_“3“11(4)[9]/#_“9“72(2)(4)/#_“8“2407/#_“8“6“{681}/#_“1“0“[028] absteigend als „1“_Spalte 6/0=QS=6_Spalte 9/8/8=25_Spalte 8/3=QS=11_QS5+6=11 mit „1“_Summe 6+25+11+11=“53“ als 1_53 für „BLOC1S1“=153AS [BLOC1S1 - Biogenesis of lysosome-related organelles complex 1 subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Interaktion bindet das Protein ATP5F1A=553AS seitlich über die Spalte 5“8“/5“3“ mit der Ziffer „3“ in „BLOC1S1“ ein [ATP5F1A - ATP synthase subunit alpha, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte Z.38354#_30“8“/#_16“8“/05“1“ interagiert „KXD1“=195AS seitlich als QS3_16=“19“_“5“ für „KXD1“=195AS [KXD1 - KxDL motif-containing protein 1 - Homo sapiens (Human) | External links | UniProtKB | UniProt]. Mit „08“ gespiegelt für Lysin=80E liegt in Z.38354#_330“8“/#_316“8“ das Ubiquitin=76AS als QS1+6=“7“_QS0_3+3=“6“ mit 7_6 für 76AS an Lysin vor [BLOC1S1 Gene - GeneCards | BL1S1 Protein | BL1S1 Antibody].
Das Protein „BLOC1S2“=142AS liegt in der Spalte Z.38352#_(31)“1“(4)[9]/#_(7)“2“2“4“/2{(40)“7“}=Lücke als „1“_QS2+2=“4“_Spalte 4/7=QS=11=QS=“2“ mit 14_2 für „BLOC1S2“=142AS. Methionin=80E als Initiator liegt seitlich in der Spalte „0/8“ mit dem Rückstand „N-Acetylalanin“=C5H9NO3=30+9+7+24=70E in der Lücke als „07“ vor. „Interagiert mit Gamma-Tubulin“ [BLOC1S2 - Biogenesis of lysosome-related organelles complex 1 subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „Gamma-Tubulin“ ist zusammen mit „BLOC1S2“ lokalisiert und an GTP=268E gebunden. Die beiden Ketten „TUBG1“ und „TUBG2“ enthalten jeweils 451AS. Die beiden Ketten formen sich zu einem ringförmigen Dimer, das als Innenring in einen äußeren Gamma-Tubulin-Ringkomplex aus 5 Proteinen (TUBGCP2 bisTUBGCP6) über die Randspalte „4/7“ (Außenring-Lücke) eingeflochten wird. Funktionell wird das Ende einer Mikrotubuli-Röhre (Tubulin alpha+ beta) gestaltet. Das ringförmige „TUBG-Dimer“ liegt zusammen mit „GTP“ in der Spalte Z.38352#_[3]“6“5“31“14“[9]/#_[3]“4“697{„2“}{„2“}(4)/#_[3](30)(8)(2){(4)}{(0)}(7)/#_[316866]{8}[1] mit GTP=268E als „2“_Spalte 2/4=QS=“6“_Spalte 0/8=QS=“8“ mit 26_8 für „GTP“ {}=268E. „TUBG2“ bildet im Unterschied zu „TUBG1“ mit der Ziffer „5“ über die Spalte „5/6“ einen Bezug zum Serin=56E, und zwar als „4“_QS6+5=11=QS=“2“_“31“_“14“_QS2+2=“4“ mit „4“_Summe 2+31+14+4=“51“ mit 4_51 für „TUBG2“=451AS [TUBG2 - Tubulin gamma-2 chain - Homo sapiens (Human) | UniProtKB | UniProt] „TUBG1“ beginnt in der Randspalte als „4“_QS4+0+7=“11“_QS8+2=“10“_“30“ mit „4“_Summe 11+10+30=“51“ als 4_51 für „TUBG1“ ()=451AS [TUBG1 - Tubulin gamma-1 chain - Homo sapiens (Human) | UniProtKB | UniProt]. Der Gamma-Tubulin-Ringkomplex beginnt mit einer 3-teiligen ersten Ringhälfte an der Außenring-Lücke in der Spalte Z.38349#_[54]“3“3“4“(7)(7)[44]/#_“3“4“0“[8]“56“(3)(9){2}/#_{1}[3858420]{0}/#_{9}[3653114]{9}, worin das Protein (Mensch) „TUBGCP2“=902AS absteigend in der Randspalte „2/0/9“ mit 9_0_2 „TUBGCP2“ {}=902AS lesbar ist [TUBGCP2 - Gamma-tubulin complex component 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP3“=907AS folgt als „9“_Spalte 7/3=QS=10 für „0“_“7“ mit 9_0_7 für „TUBGCP3“ ()=907AS [TUBGCP3 - Gamma-tubulin complex component 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP4“=667AS folgt als „56“_QS3+3+4=“10“ mit Summe 56+10=“66“_QS3+4+0=“7“ mit 66_7 für „TUBGCP4“=667AS [TUBGCP4 - Gamma-tubulin complex component 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Die zweite Ringhälfte folgt in der Spalte mit dem Protein (Mensch)=„TUBGCP5“=1024AS als QS1_9=“10“_QS7+3_5+3_3+3=“24“ mit 10_24 für „TUBGCP5“ {} =1024AS [TUBGCP5 - Gamma-tubulin complex component 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=„TUBGCP6“=1819AS folgt mit einer Gegendrehung, die an der vom TUBG-Dimer besetzten Außenring-Lücke ansetzt, und zwar über die Randspalte „1/8“ für „18“_Kunstgriff Spalte 8/2=QS=10 für „0“_“6“_QS5+1+0+0=“6“_QS1+6=7 mit „18“_Summe 0+6+6+7=“19“ als 18_19 für [TUBGCP6 - Gamma-tubulin complex component 6 - Homo sapiens (Human) | UniProtKB | UniProt]. „TUBG1“ wird aufgrund der Einbindung in den Außenring stabilisiert, aber „TUBG2“ liegt instabil im Freiraum, so dass es von Tubulin „TUBD1“ und „TUBE1“ als mathematischer Zweck positioniert wird. Die Mikrotubuli-Endkappe bildet sich real als eine asymmetrische, kegelförmige Struktur [Asymmetrische molekulare Architektur des humanen γ-Tubulin-Ringkomplexes - ScienceDirect; T.Kapoor u.a, Ja. 2020; https://doi.org/10.1016/j.cell.2019.12.007]. Das Protein (Mensch)=„TUBD1“=453AS füllt rechts die innere Lücken in der Spalte (4)“20“/(11)“4“/“7“22“ als „4“_QS20_4(„4“ bindet in TUBG2)=24_QS7+22=“29“ mit „4“_Summe 20+4+29=“53“ mit 4_53 für „TUBD1“=453AS [TUBD1 - Tubulin delta chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=„TUBE1“=475AS füllt links die Lücke zwischen Außenring und bindet mit der Ziffer „6“ in „TUBG2“ über die Spalte „3“8“5“/“36“[5] als QS“36“ („6“ bindet in TUBG2)_3+8=“47“_“5“ für „TUBE1“=475AS [TUBE1 - Tubulin epsilon chain - Homo sapiens (Human) | UniProtKB | UniProt]. Der TUBG-Innenraum enthält die unbesetzten Zahlen 8; 8; 69; 68. Das Protein „BLOC1S7_SNAPIN“=136AS liegt in der Randspalte Z.38352#_(3)“1“1“[49]/#_(9)“7“2“2“[4]/#_(8)“2“{„4“0“(7)}=Lücke als „1“_“1“_QS7+2+2=11=QS=“2“ mit „1“_Summe 1+2=“3“_QS0+4+2=6 mit 1_3_6 für „BLOC1S7“=136AS [SNAPIN - SNARE-associated protein Snapin - Homo sapiens (Human) | UniProtKB | UniProt]. „SNAPIN“ verstärkt die Aktivität von „SNAP-25“=206AS, und zwar über Spalte 2/0 mit „20“_QS2+4=“6“ mit 20_6 für „SNAP-25“=206AS, weil beide Proteine das gleiche Ziel verfolgen. SNAP-25 wird vom Protein (Mensch) „BLOC1S8_Dysbindin“=351AS reguliert [DTNBP1 - Dysbindin - Homo sapiens (Human) | UniProtKB | UniProt].
Der TUBG-Ringkomplex erfüllt nunmehr den Zweck „extern“ am Ringkomplex die Zahl 13_0 für die Tubulin-Röhre „0“ aus 13 „Protofilamenten“ aus Tubulin alpha/beta=451AS darzustellen, wobei sich die beiden Proteine diagonal durch den Ring ziehen und in der Zählgröße „1-1“ als „Heterodimer“ in Kontakt kommen [Protofilament - DocCheck Flexikon]. Durch die Zahl „11“ zieht die Spalte „[x]2/[1]1/[x]2“, so dass beide Proteine den Cofaktor „Magnesium“=12E lesen und zugleich teilen. Für die GTP-Bindung liegt das GTP in einer gemeinsamen Spalte „420/114/[7]22“ durch die Zählgröße „11“. „GTP“ ist für jede Richtung zählbar, so dass sich die Proteine zwangsläufig nur im Wechsel zu einer Röhre montieren können, und zwar mit „GTP“ als „2“_QS4_1_1=“6“_QS4_2+2=“8“ mit 2_6_8 für GTP=268E oder „2“_QS2+4=“6“_QS1+1_4+2=“8“ für GTP=268E. Das Protein (Mensch) „TUBA1A“=451AS findet in der Diagonale „extern“ am Außenring die Gruppe „44“ zur zwecks Röhrenbildung als Startpunkt, und zwar in der Randspalte Z.38349#_[7]“7“4“4“/#_“6“3“[92]/#_“4“[200]/#_“1“[149] aufsteigend als „4“_mit 74 in Richtung „47“_“3“ mit „4“_Summe 47+3=“50“_Kunstgriff über Spalte 6/4=10 für „0“_“1“ mit „4“_Summe 50+0+1=“51“ mit 4_51 für „TUBA1A“=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Als Unterscheidungsmerkmal „alpha vs. beta“ dient das Protein (Mensch) „PIK3R1“=724AS aufgrund der Interaktion mit dem Protein (Mensch) „TUBA1B“=451AS. „PIK3R1“ liegt in der Spalte „14/22/40“ als QS1_2_4=7_0_Spalte 2/4 für 24 mit 7_Summe 0+24=24 mit 7_24 für „PIK3R1“=724AS [PIK3R1 - Phosphatidylinositol 3-kinase regulatory subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „TUBA1B“ zählt absteigend über den externen Anteil Z.38356#_130 als QS1+3=“4“_Spalte 1/0=QS=“1“_“30“_QS8+2=“10“_“7“_Spalte 1/2=QS=“3“ mit „4“_Summe 1+30+10+7+3=“51“ mit 4_51 für „TUBA1B“=451AS [TUBA1B - Tubulin alpha-1B chain - Homo sapiens (Human) | UniProtKB | UniProt]. Die Zahl „13“ Protofilamente ist in der Spalte Z.38354#_[3]31686[6]/#_130510[0] über [3]“3“[1]/“1“3“[0] als Form „7“ mit QS1+3_3=“7“ zählbar, die an einem Tangens-Steigungssymbol mit Spalte „1/0“ für 10°_Spalte 5/6=11=Zählgröße_“10“ für 10°=Wicklungssteigungswinkel liegt. Über die Winkelspalte „1/0“ für 10 mit QS10_5_10=25 ist der Mikrotubuli-Durchmesser=25nm und aus QS5+10=15 der Innendurchmesser=15 nm zählbar. Über „13051“ ergibt sich die Kreisform aus QS5_1=6_QS1+3+0=4 mit 6_4 für Kreis=64 und mit 33/13 die Gegenkrümmung QS33_13=46. Für die maximale Mikrotubuli-Länge= 100 µm (Mikrometer) ist die Zahl „100“ verfügbar, auf die der Vergrößerungsfaktor=1000 als [1]“3“_“0“ _Zählgröße 6/5_“100“ mit der Ziffer „3“_“0“ für „10^3“ (links von 100) zum Bezug auf Nanometer anzusetzen ist. Das einzelne Dimer in der Röhren-Wandung besitzt einen Durchmesser von 5 nm [Mikrotubuli - Lexikon der Biologie (spektrum.de)]. Die GTP-Energie wird in einer Form entfaltet.
Die synaptischen Vesikel (SV) besitzen zunächst einen neutralen pH-Wert und nehmen dann die Neurotransmitter über ihre Membran auf. Für den häufigen Neurotransmitter „Glutamat= Glutaminsäure (Glu/E)“=C5H9NO4=30+9+7+32=78E sind die Glutamattransporter „VGLUT1“, „VGLUT2“, „VGLUT3“ und das Protein „Sialin“ zuständig. Mangels Besonderheiten finden müssen sich die 4 Proteine lückenlos in einer Matrix vereinen. In der Umrandung ist Chlor=17E und Natrium=11E vorhanden. Weil Natrium in die Katalyse „3“-fach eingeht, liegt Natrium als 3*11=33 zugleich als Membran vor. Das Natrium=11 wird vorab als „33“ definiert, und zwar in der Zeile Z.38352#_“29“3“65“3“11“[49] mit QS2+9=11_3_QS6+5=11_3_11 für {11_“3“_11_“3“_11}. VMAT2=514AS nutzt die Natrium-Definitionszeile mit der vom Glutamat-Transporter unbesetzten freien rechte Ecke in der Spalte Z.38352#_[653]“1“1“49“/#_[469722]“4“ als QS1+1+49=51_4 für VMAT2=514AS, wobei das Serotonin=94E in der Randspalte „9/4“ enthalten und lesbar ist.
Das Protein (Mensch)=“VGLUT1“=560AS wird lesbar eingeschlossen, und zwar über Spalte 0/6/5 mit 5_6_5 für „VGLUT1“=560AS. Der „Uniporter“ transportiert Glutamat, Chlorid, Proton, Kalium, Natrium und Phosphat [SLC17A7 - Vesicular glutamate transporter 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=“VGLUT2“=582AS liegt ebenfalls in einer Spalte mit 2/0/8/2/3 als QS3+2=“5“_“8“ QS0_2=2 mit 5_8_2 für “VGLUT2“=582AS. Der „Uniporter“ transportiert Glutamat, Chlorid, Proton, Kalium, Natrium und Phosphat. Fungiert als Chloridkanal, weil Chlorid 3-fach seitlich am Spaltenrand liegt, und zwar mit (4)“9“/2“4“/0{7}/8{1}/2“8“/(4)(3)“2“ an der Ecke QS4+9_4=Chlor=“17“E_in der Randspalte „7/1“ mit 1_7 für Chlor=17E_ an der Ecke QS8_2=10_QS4+3=7 mit Summe 10+7=Chlor=17E [SLC17A6 - Vesicular glutamate transporter 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=“VGLUT3“=589AS benötigt voluminöse Zählung, um das weite Mittelfeld zu schließen. Geeignet ist eine lückenlose Schleife, der mit der unbesetzten Ziffer „2“ als Randkerbe nur noch der Ringschluss fehlt. „VGLUT3“=589AS liegt in der Spalte Z.38352#_[29365]“3“1“1“[49]/#_[87346]“9“7“2“(2)[4]/#_[453]“3“{0}“8“2“4“(0)[7]/#_[033](1){6}“8“6“6“(8)[1]/#_[613](0){5}“10“0“(2)[8]/#_[192](95)“5“[2]“4“(3)[2] absteigend als „5“_“10“_QS8+6=“14“_QS8+2=“10“_Wendeschleife QS9+7_3+1=“20“_aufsteigend „1“_Spalte 2/4 für „24“_Spalte 6/0/4=QS=“10“ mit „5“_Summe 10+14+10+20+1+24+10=89 mit 5_89 für „VGLUT3“=589AS [SLC17A8 - Vesicular glutamate transporter 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SLC18A3_VACHT“=532AS nutzt die Kerbe „2“ zur Interaktion, indem ein Ringschluss in „VGlut3“ vermittelt wird, und zwar in der Spalte Z.38356#_[5](“1“)(„0“)(0)/#_[5](“5“)2“(4)/#_[81]“3“8“ intern gebunden als „5“_QS1+0_2 (Kerbe)=“3“_extern QS3+8=11=QS=“2“ mit 5_3_2 für „VACHT“=532AS. Das „Acetylcholin“=C7H16NO2=42+16+7+16=81E ist in „VACHT“=532AS mit QS5+3=8 und der seitlichen Ziffer „1“ in „1“83 für 81E nachweisbar. Die Kerbe „2“ kann „2“ Protonen symbolisieren: „Elektrogener Antiporter, der einen cholinergen Neurotransmitter, Acetylcholin oder Cholin, mit zwei intravesikulären Protonen über die Membran synaptischer Vesikel austauscht“ [SLC18A3 - Vesicular acetylcholine transporter - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Sialin“=495AS besetzt die linke Seite der 4-Transporter-Matrix aufsteigend über Spalte 3/1/0=QS=4_95 für „Sialin“ ( )=495AS. Die Glucoronsäure= C6H10O7=36+10+70=116E liegt in der Proteinspalte „16/05/95“ als Summe 16+0+5+95=116E. Die „Sialinsäure“=C11H19NO9=66+19+7+72=164E folgt extern angehängt „95/8813“ als QS8+8=“16“_QS1+3=“4“ mit 16_4 für 164E. [Multifunktionaler Anionentransporter, der über zwei unterschiedliche Transportmechanismen funktioniert. In der Proteinspalte „30/16“ kann das Aspartat [Asparaginsäure (D/Asp)]=C4H7NO4=24+7+7+32=70E als QS1+6=7_0 für 70E extern austreten. Das Glutamat=78E steht in Konkurrenz zum Aspartat, weil es die Ziffer „7“ lediglich nach links addiert und extern in der Spalte 3/3/2 mit QS3+3+2=“8“ mit 7_8 für Glutamat=78E ergänzt. Folglich bewegt sich „Glutamat“ schneller als „Aspartat“. „Aspartat“ kommt nur durch die Lücke an der Natrium-Definition nach links heraus [SLC17A5 - Sialin - Homo sapiens (Human) | UniProtKB | UniProt]. In der „Sialin-Katalyse“ liegt das „N-Acetylneuraminat“= C11H18NO9=66+18+7+72=163E innen ringförmig in der Spalte „30/16“ als „16“_QS3+0=“3“ mit 16_3 für 163E und folgt außen seitlich in der Spalte [5]“3“/[3]“3“/“13“ als QS13_3=16_3 für 163E [N-Acetylneuraminat | C11H18NO9- | CID-6857396 - PubChem (nih.gov)].
Der vesikuläre Monoamintransporter (VMAT2) transportiert Noradrenalin, Adrenalin, Dopamin und Serotonin in die synaptischen Vesikel. VMAT2=514AS nutzt die Natrium-Definitionszeile mit der vom Glutamat-Transporter unbesetzten freien rechte Ecke in der Spalte Z.38352#_[653]“1“1“49“/#_[469722]“4“ als QS1+1+49=51_4 für VMAT2=514AS, wobei das Serotonin= C10H12N2O=60+12+14+8=94E in der Randspalte „9/4“ enthalten und lesbar ist [ SLC18A2 - Synaptic vesicular amine transporter - Homo sapiens (Human) | UniProtKB | UniProt ]. Die Natrium-Zeile mit der Definition von 3-fach Natrium=Membran=33 ist zugleich eine Vesikelmembran installiert. Aufgrund der Katalyse „2 H(out) + Serotonin(in) = 2 H(in) + Serotonin(out)++“ ist das „Serotonin“ auch in Gegenrichtung zählbar, wobei die Zahl „11“ für „2H“ „steht. Das „Serotonin“ zieht in der Spalte Z.38351#_(5)(84)[200]/#_(5)[3]“1“1“4{9}“/#_[69722]{“4“} neben das Calcium und liegt existenziell in der Schwerachse „84“ mit QS84+Spalte 5/5=QS=10 mit Summe 84+10=Serotonin ( )=94E. Für die lebensnotwendige Funktion liegt die Zeitbasis „60“ mit QS11+49=“60“ in VMAT2 am Calcium. „Sialin“ sitzt auf der Ziffer „3“ [0], so dass der Winkel 30° unlesbar ist. Somit folgt aus der Winkelsumme=100+40+20 (Calcium)=160° für das VGlut-Aktionspotential „-160mV“. Diese Aussage stimmt mit der Natrium-Definition „ 2936531149“ als Summe 29+3+65+3+11+49=160 für -160mV überein. Die Schaltdauer von 600ms (Millisekunden=0,6 Sekunden), wird als Spalte „0/4/2/0“ mit 0_QS4+2+0=6 für 0,6 Sekunden durch die horizontale Zeitbasis als Komma-Symbol gezogen. Was nicht definiert ist, kann auch nicht geschehen. Es sind lediglich Fehlinterpretationen wie „Krebs“ möglich [Vesikuläre Glutamattransporter sind H+-Anionenaustauscher, die mit variabler Stöchiometrie arbeiten | Nature Communications; Kolen, B., Borghans, B., Kortzak, D. et al. Vesikuläre Glutamattransporter sind H-Anionenaustauscher, die mit variabler Stöchiometrie arbeiten. Nat Commun 14, 2723 (2023); https://doi.org/10.1038/s41467-023-38340-9]. Der Pflanzenwirkstoff „Reserpin“=C33H40N2O9=198+40+14+72=“324“E ist u.a. als Neuroepileptikum bekannt. „VMAT2“ wird über in den Bindungsanteil „32“4AS in Z.38352#_“3“1“1“4“[9] als 3_QS1+1=2_4 beeinflusst. Das Arzneimittel „Tetrabenazin“=C19H27NO3=114+27+7+24=“172“E ist u.a. im Zusammenhang mit der erblichen Gehirnerkrankung „Chorea Huntington“ bekannt. „Tetrabenazin“=172E liegt lesbar mittig in der Spalte 84//1/7/2 mit 172E, so dass das Medikament an der Schwerachse „84“ liegt und somit gegen die Gleichgewichtsstörung wirkt. Zum Krankheitsverlauf gehört die Demenz-Erkrankung.
Zur Familie „SLC17“ gehört weiterhin der vesikuläre Nukleotidtransporter, das Protein (Mensch) „SLC17A9_VNUT“=436AS als ein spannungsgesteuerter ATP-Nukleotid-Uniporter, der auch die Purinnukleotide ADP und GTP transportieren kann [„Identifizierung eines vesikulären Nukleotidtransporters | PNAS“; K. Sawada; Apr. 2008; https://doi.org/10.1073/pnas.0800141105“]. „Reguliert auch indirekt die Exozytose von ATP durch dessen Import …(u.a. in) synaptischen Vesikeln.“ „VNUT“ liegt links neben „Sialin“, grenzt dort an der Serien-Randspalte „#1611“ und zieht durch die Membran „33“, und zwar in der Spalte Z.38354#_(4)(“4“)[53]/#_[4]{“0“}“3“3“/#_[3]{6}{1}“3“/#_[3]{1}{9}[2] als 4_QS0_3=3_QS3_3=6 mit 4_3_6 für „VNUT“=436AS. „ATP“=260E als QS1+9_1=11=QS=2_6_0 für „ATP“ {}=260E. „GTP“ ist eine Verlängerung als „26“_QS0_4+4=“8“ mit 26_8 für „GTP“ ()=268E [SLC17A9 - Voltage-gated purine nucleotide uniporter SLC17A9 - Homo sapiens (Human) | UniProtKB | UniProt].
Die von den synaptischen Vesikeln aufgenommenen Neurotransmitter werden in der aktiven Zone der präsynaptischen Membran durch Exocytose in den synaptischen Spalt freigesetzt. Hierfür ist hauptsächlich der heterotrimere „SNARE-Komplex“ (Soluble NSF Attachment protein Receptors) aus den 3 Proteinen VAMP-1/2, SNAP-25 oder Syntaxin-1A/1B zuständig [Nachweis der VAMP-Proteolyse durch Tetanus und Botulinum-Neurotoxin Typ B in vivo mit einem spaltspezifischen Antikörper - PMC (nih.gov) ; T.Binz u.a.; Apr 2022; doi: 10.3390/ijms23084355]. Bei Neuronen sind 3 statt 4 Proteine als SNARE-Komplex (Synaptobrevin, Syntaxin und SNAP-25) ausreichend, weil „SNAP-25“ über kombinierte Merkmale (Qb- und Qc-SNARE) verfügt [SNARE - DocCheck Flexikon]. Das „Synaptobrevin“ [VAMP=vesicle-associated membrane protein] ist im Gehirn mit den Proteinen „VAMP 1, 2 und 4“ vertreten. Mangels Besonderheiten muss sich ein Komplex bilden. Labortechnisch kann die Protein-Struktur anhand der Reaktion auf Giftstoffe erkannt werden. Der Tetanusbazillus „Clostridium tetani“ produziert das bakterielle Zink-Protein „Tetanospasmin (Tetanustoxin)“. Der Bakterienstamm „Clostridium botulinum“ produziert das stärkste bakterielle Gift „Botulinumtoxin (BTX/BoNT/Botox)“, das in den 7 Formen „A bis G“ existiert. Das Bakterium umhüllt das Gift mit einer säure- und enzymstabilen Hülle, um den Magen passieren zu können. Durch die Darmwand gelangt das Gift im Falle einer über die Nahrung verursachten Infektion ins Blut.
Die Proteine werden nach folgendem Konzept erkundet: Das menschliche Protein „VAMP1“ ist das vertikale Leitprotein, während „VAMP 2/4“ horizontal ausgerichtet sind. Vergleichsweise ist das bakterielle Zink-Protein „Tetanospasmin (Tetanustoxin)“ eine lange vertikale Spalte, zu der die Botox-Giftstoffe „Form F, D, X und B“ quer verlaufen. Nunmehr wird „VAMP1“ mit „Botox“ und „Tetanospasmin“ mit „VAMP 2/4“ jeweils als Komplex gestaltet. „Synaptobrevin_(VAMP)“ wird von „Tetanospasmin (Tetanustoxin)“ gespalten. Die Spaltung verhindert die Freisetzung von Glycin=40E aus hemmenden Interneuronen, so dass „Glycin“ erkennbar ist. „Tetanospasmin“ orientiert sich an der 6-zeiligen Membranspalte aus Ziffer „3“, und zwar in der Spalte Z.38351#_[1157]{13}[858]/#_[11529]{3}[653]/#_11487{3}469/#_445{3}308/#_“1“(1)(4)(0)(3){(3)}(1)[68]/#_“1“1“3“6“(1){(3)}(0)[51]/#_[113]“1“9“{„2“}[955]/#_[11277]{„2“}[881] 8-zeilig auftsteigend als „13“_Spalte „3/3/3/3/3“=QS=15_Spalte 2/2=QS=4 mit 13_Summe 15+4=19 mit 13_19 für „Tetanus Neurotoxin“ {}=1319AS. Die Zink-Bindung entsteht mit der Ziffer „3“ im Zink=30 [Tetanus neurotoxin - Clostridium tetani | UniProtKB | UniProt]. „Tetanospasmin“ wird durch „Formalin“ auf Basis „Formaldehyd“=CH2O=6+2+8=16E inaktiviert. „Formalin“ besetzt das Gift-Protein am Startpunkt mit QS13+3=“16“ für Formaldehyd=16E. Bei der geprüften Version mit „Tetanustoxin_tetX“=1315AS entfällt die End-Spalte „2/2“=QS=4. Mit dieser Verkürzung ist der Angriff des Giftes auf „VAMP2“ an Position „Gln/Phe“ jedoch nicht darstellbar [tetX - Tetanus toxin - Clostridium tetani (strain Massachusetts / E88) | UniProtKB | UniProt]. Das Leitprotein „VAMP1“ mit „Botox“ folgt erst im Anschluss. Das Protein (Mensch) „VAMP2“ liegt aufsteigend ab Z.38355 in der Spalte „1/1“ für „11“_QS1+3+6_1=11=QS=“2“_QS9+2({2} Toxin)=11=QS=“2“_“2“ ({2} in Toxin) mit „11“_Summe 2+2+2=6 mit 11_6 für „VAMP2“. Die Toxin-Spalte „2/2“ trennt nach rechts das lesbare Phenylalanin (F/Phe)=C9H11NO2=88E und nach links, mit der Ziffer „1“ einbindend, über Spalte „1/77“ mit 7_QS1+7=8 als 7_8 für Glutamin (Q/Gln)=C5H10N2O3=30+10+14+24=78E. In der Spalte 1{3}0/9{2}9 liegt das Zink=30E angrenzend in der Toxin-Spalte und Glycin=40E ist darüber als Spalte 1/9=QS=10_30 mit Summe 10+30=Glycin=40E zählbar. „Zink“ gehört zum Toxin, ist aber kein erforderlicher Cofaktor für „VAMP2“. „Calmodulin_Calm1“=149AS bindet über „1319“ mit der Zahl „19“ ein, und zwar als „1“_QS3+1=“4“_“9“ für CALM1=149AS ein [VAMP2 - Vesicle-associated membrane protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „VAMP2“ passiert diagonal das Kalium=19E, so dass es mit dem spannungsabhängigen Kalium-Kanal über das Protein (Mensch) „KCNB1“=858AS interagiert. „KCNB1“ liegt in der Spalte Z.38355#_“1“{1}{4}[0331]/#_“1“1“{„3“}“6“[130]/#_[11]{3}{“1“}“9“2“[9]/#_[11]{2}{7}[7]“2“[8], und zwar als QS1+4_3=“8“_Spalte 3/2=QS=“5“_Spalte 1/7=QS=“8“ [im Kalium=19 mit Ziffer „1“] mit 8_5_8 für „KCNB1“ {}=858AS [KCNB1 - Potassium voltage-gated channel subfamily B member 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Vogelspinnengift, Protein (Stromatopelma calceata) „Stromatoxin“=36AS hemmt den Kalium-Kanal, weil die Ziffer „3“ von „KCNB1“ aus der Zahl „36“ für 36AS von „VAMP2“ stammt [Kappa-theraphotoxin-Sc1a - Stromatopelma calceatum (Featherleg baboon tarantula) | UniProtKB | UniProt]. Das lotrechte Leitprotein des Menschen „VAMP1“ kann mit den horizontalen „4“ Botox-Formen F, X, D, X und B als Ordnungsprinzip zusammenwirken. „VAMP2“ und „VAMP4“ gehören jedoch zum vertikalen Leitprotein des Bakteriums „Tetanospasmin“. Die horizontalen Proteine beider Leitproteine geraten in Konflikt, so dass „VAMP2“ von 3 der 4 Botox-Formen (F, D, X, [B]) gespalten wird. „Botox-Form B“ kann nicht getroffen werden, weil es im Zeilenlauf vorausgeht. Das folgende „VAMP4“ wird von „Botox“ nicht gespalten. Das Protein (Mensch) „VAMP4“=141AS besetzt die Zink-Zeile, wobei das Zink funktionell nur zum Neurotoxin gehört. Das Zink=30E wird beidseitig von Histidin=C6H9N3O2=36+9+21+16=82E koordiniert, und zwar als Spalte „61“{30}/“19“2“[9] als QS61_19_2=Histidin=82E_{30=Zink]_Spalte 68/5[1] mit 8_QS6+5=11=QS=2 mit 8_2 für Histidin=82E [Tetanustoxin ist ein Zinkprotein, dessen Hemmung der Freisetzung von Neurotransmittern und der Proteaseaktivität von Zink abhängt - PubMed (nih.gov); G. Schiavo u.a.(1992); DOI: 10.1002 /j.1460-2075.1992.tb05441.x]. „VAMP4“=141AS liegt in der Spalte als 14_0_Spalte 3/1=QS=4_Sspalte 3/3=QS=6 mit 14_Summe 0+4+6=10 für 0_1 als „14“_Summe 0+1=“1“ mit 14_1 für „VAMP4“ ()=141AS. Glycin=40E ist lesbar enthalten [VAMP4 - Vesicle-associated membrane protein 4 - Homo sapiens (Human) | UniProtKB | UniProt]. „VAMP4“ entwickelt eine Beziehung zum Protein (Mensch) „Synaptotagmin-4“=425AS, das am Calcium liegt, aber nicht bindet. Dieses resultiert daraus, dass zwar Calcium doppelt als Spalte und Zeile vorliegt, es jedoch in der falschen Leserichtung passiert wird, und zwar in der Spalte Z.38356#[30]“51“0“0“[28]/29“5“5“[2]“4“[32] als „4“_QS1+0+0_5+5=11=QS=“2“_“5“ mit 4_2_5 für „Synaptotagmin-4“=425AS [SYT4 - Synaptotagmin-4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das gewählte Leitprotein, Protein (Mensch) „VAMP1“=118AS liegt in der Spalte Z.38351#_57{1}3858/#_5{2}{9}3653/#_48{7}{3}{4}{6}[9]/#_44{5}{3}{3}{0}[8]/#_40{3}{3}{1}[68], und zwar aufsteigend als QS1_2+9=“11“_drei Kunstgriffe zum Wechsel von links nach rechts: QS7+3=10 für „0“_QS4+6=10 für „0“_Mäander in Spalte 330/31[6] =QS=10 für „0“_Spalte 5/3=QS=“8“ zurück nach links neben Leitprotein „Tetanustoxin“ mit „11“_Summe 0+0+0+8=“8“ als 11_8 für „VAMP1“ {}=118AS [VAMP1 - Vesicle-associated membrane protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Bindung der gleichlangen Proteine „Syntaxin_1A/1B“=288AS durch „VAMP1“ wird am „Calcium“ für „STX1B“ unterschieden. Die doppelte STX-Bindung erfolgt rechts am 3. VAMP1-Kunstgriff. „Calcium“=20E geht als Spalte (2)/(„0“) voraus und wird im Anteil der Ziffer „0“ von „STX1B“ durchlaufen. Die „Spermien“ werden dabei durch eine 33er-Spalte adressiert, die eine Spalte durch Calcium zieht, als „2/0/8/2/3“ mit Summe 20+8+2+3=“33“=männlich für Spermien. „Syntaxin“ liegt als Dimer gekoppelt in der Spalte Z.38353#_[734697](2)[2]/#_[5330]{8}{2}“4“(„0“)[7]/#_[331]“6“{8}“66“8“[1]/#_[130]“5“10“[028] mit „STX1B“ als Spalte 6/5=11=QS=“2“_absteigend „10“_“66“_“4“ mit „2“_Summe 10+66+4=“80“_aufsteigend Spalte „0 (von Calcium)/8“=QS=“8“ als „2“_Summe 80+8=“88“ mit 2_88 für „STX1B“=288AS [STX1B - Syntaxin-1B - Homo sapiens (Human) | UniProtKB | UniProt]. Syntaxin „STX1A“=288AS in der Spalte [0]{8}{2}/[6]{8}[6] als 2_8_8 für „STX1A“ {}=288AS [STX1A - Syntaxin-1A - Homo sapiens (Human) | UniProtKB | UniProt].
„Syntaxin“ ist in die Plasmamembran der Präsynapse, das „Synpatobrevin“ jedoch in die Vesikelmembran integriert. Das Protein (Mensch) „SNAP-25 (Synaptosomal-Associated Protein, 25kDa)“=206AS gehört zum Snare-Komplex mit einer Syntaxin-Bindung und bindet außerdem an spannungsgesteuerte Calciumkanälen (VGCCs). Bei Infektionen mit „Clostridium botulinum“ greift das freigesetzte Botulinumtoxin u.a. auch „SNAP-25“ an, wodurch die Transmitterausschüttung unterbrochen wird. Die dabei wirksamen Botox-Formen „E, A und C“ gehören nicht zum Angriff auf Synpatobrevin mit den Botox-Formen „F, X, D und B“, so dass „SNAP-25“ gesondert lokalisiert ist. Im Umfeld der Calcium-Spalte wird das Cystein= C3H7NO2S=18+7+7+16+16=64E ermittelt, damit es 4-fach im Zählweg lesbar wird. Ein „Schwefel-Eisen-Cluster“ liegt zusammen mit Zink in der Spalte [30]“8“(2)/“16“8“(6) als Schwefel „16“_Spalte 8/8=QS=“16“E=Schwefel_Spalte 2/6 für Eisen=“26“E. Im Ergebnis legt sich „SNAP-25“ neben die Membranspalte, und zwar in der Spalte Z.38351#_[3858]“4“2“[00]/#_[3]“65“[31149]/#_3“46“97224/#_3“30“82407/#_3“16“86681 als Spalte absteigend QS16_30_46_65=“157“_aufsteigend Spalte 3/9=QS=“12“_absteigend Spalte „4/1/7“=QS=“12“_aufsteigend Spalte „2/1/2“=QS=“5“_“2“_Randspalte 4/7=QS=11=QS=“2“_QS4+0=“4“ mit „157“_Summe 12+12+5+2+2+4=“37“_QS6+6=“12“ als Summe 157+37+12=206 für „SNAP-25“=206AS [
- Synaptosomal-associated protein 25 - Homo sapiens (Human) | UniProtKB | UniProt]. Zum Recycling der Plasmamembran kooperiert „SNAP-25“ mit dem Protein (Mensch) „CENPF“=3114AS. Die Startzahl „31“ liegt in der Spalte (3)“31“/(1)xx doppelt vor, so dass sich ein Homodimer bildet. Absteigend wird der Zahlenrand von „CENPF“ zum Membran-Recycling addiert und aufsteigend x“1/1“9“ wird die Zahl „19“ als Beziehung zum Kaliumkanal errreicht. „CENPF“ vermutlich absteigend in „SNAP-25“ über Spalte Z.38352#_[93]“6“5“3“1“1“/#_[7]“4“[6]/[53]3[0]/(3)“31“[6] als „31“_Spalte 4/3=QS=“7“ _QS6+5=11=QS=“2“_QS3+1+1=“5“ mit „31“_Summe 7+2+5=“14“ mit 31_14 für „CENPF“=3114AS (Monomer). Ergänzung mit „CENPF“=3114AS in der Spalte Z.38355#_“3“{31}[6]/#_“1“3“0“5“/#_“9“2“9“5“ über Spalte „3/1“ für „31“_Kunstgriff QS2+9=11=QS=“2“_QS3+0+5=“8“ mit „31“_Summe 2+8=10 für „0“_QS9+5=14 mit „31“_Summe 0+14=“14“ mit 31_14 für „CENPF“=3114AS (Homodimer) [CENPF - Centromere protein F - Homo sapiens (Human) | UniProtKB | UniProt]. „CENPF“ ist weiterhin mit dem Protein (Mensch) „STX4_Syntaxin 4“=297AS assoziiert. „STX4“ zieht durch das CENPF-Homodimer mit der lesbaren Zahl „29“ und der Vertikale durch beide Zink-30-Positionen, die aufgrund eines Sphingomyelin-Phosphodiesterase-Aktivators Protein (Mensch)=„B4DW34“=455AS mit 2-fach Zink notwendig sind [Acid sphingomyelinase-like phosphodiesterase - Homo sapiens (Human) | UniProtKB | UniProt]. „STX4“=297AS als „29“_Spalte 3/1/0=QS=4_3 mit 29_Summe 4+3=7 mit 29_7 für STX4=297AS [STX4 - Syntaxin-4 - Homo sapiens (Human) | UniProtKB | UniProt].
Aufgrund der vertikalen Ausrichtung greifen mehrere BOTOX-Formen auf „SNAP-25“ zu, die sich als Ring „A-E-C“ formieren [reale Spalt-Folge in SNAP-25 ist E-A-C]. Ein weitläufiger Ring ergibt sich, weil „botC“ den SNAP25-Bereich zur Motiv-Bildung ausschöpfen muss. Die bot-Formen können unterschieden werden, weil die Form „C“ das Zink doppelt benötigt. Hierbei werden die beiden lesbaren Zahlen „30“ verbraucht, so dass die Formen E/A das Zink alternativ mittels Addition finden.
Das Neurotoxin, Protein (Clostridium botulinum) „botA_Botulinum (Botox) Form A“=1296AS wird mit Schwer- und Leichtkette freigesetzt. Der Cofaktor „Zink“=22+0+8=30E wird addiert. Bei der kosmetischen Faltenkorrektur wird der Rezeptor für „Acetycholin“=81E blockiert, so dass sich der Muskel nicht zusammenzieht. Die Zahl „81“ ist in „botA“ lesbar. Der neuronale Acetylcholin-Rezeptor, das Protein (Mensch) „CHRNA2“=529AS entnimmt die Ziffer „5“ in Z.38357#_[5]“5“24“3“2“ aus dem Muskel „55“. Die Randziffer „2“ wird von „botA“ blockiert. „CHRNA2“ als „5“_QS24+3+2=“29“ für „CHRNA2“=529AS. Weil die Zeitbasis „24“ enthalten ist, erscheint der Mensch nach wenigen Tagen wieder ohne seine kosmetische Maske [CHRNA2 - Neuronal acetylcholine receptor subunit alpha-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „botA“=1296AS liegt in der Spalte Z.38353#_[34]“6“9“[7]{2}{2}{4}/#_[3]“3“0“82“[40]{7}/#_[3]“1“[68](6)(6){8}{1}/#_[3]“0“5“(1)(0)(0){2}{8}/#_„2“9“5“(5)(2)(43){2}, und zwar absteigend über Randspalte 8/2=QS=10_2 mit Summe 10+2=“12“_QS8+1=“9“_Randspalte 4/7=QS=11=QS=“2“_QS2+2=“4“ mit „129“_Summe 2+4=“6“ mit 129_6 für „Botox-A“ {} =1296AS [botA - Botulinum neurotoxin type A - Clostridium botulinum | UniProtKB | UniProt].
Das Protein (Clostridium butyricum) stammt zwar nicht vom Bakterium „Clostridium botulinum“, es wird aber das „Botulinumtoxin“ produziert. „botE_Botox Form E“=1251AS entsteht lückenlos aufsteigend als QS6+6=“12“_QS0+0=“0“_Spalte 1/5=QS=“6“_“2“_“43“ mit „12“_Summe 0+6+2+43=“51“ mit 12_51 für „Botox Fom E“ () =1251AS. Die leichte Kette hydrolysiert die Arg-Ile-Bindung in „SNAP25“, wodurch die Freisetzung des Neurotransmitters blockiert wird. Zur „Hydrolyse“ liegt das Wasser=28 (Symbol) am rechten Rand (hier auch botA), so dass Arginin (R/Arg)=C6H14N4O2=36+14+28+16=94E über die Randzahl „6681“ mit 1_8 für „18“ mit Summe 18+66=Arg=94E und Isoleucin (I/Ile)=C6H13NO2=36+13+7+16=“72“ als QS4+3=7_2 für „Ile“=72E mit Ziffer „2“ extern am Rand auf SNAP25 einwirken [Botulinum neurotoxin type E - Clostridium butyricum | UniProtKB | UniProt].
Das Protein (Clostridium botulinum) „botC_Botox Form C“=1291AS entsteht absteigend als QS2+9=11=QS=“2“_1. Kunstgriff Spalte 5/5=10 für „0“_ Spalte 3/1/0=QS=“4“ mit Summe 2+0+4=“6“_Spalte 6/0=QS=“6“_2. Kunstgriff Spalte 6/4=QS=10 für „0“_mit Summe 6+6+0=“12“_ Kopfschleife QS5+31_42+0_4+9 (Randziffer)=36+42+13=“91“ mit 12_91 für „botC_Botox Form C“=1291AS [Botulinum neurotoxin type C - Clostridium botulinum C phage (Clostridium botulinum C bacteriophage) | UniProtKB | UniProt]. Zink=30E ist lesbar enthalten. Das zweite Zink ist als QS29_[3]0_1=30 zählbar oder bindet mit Ziffer „0“. „Calcium“ wird blockiert, weil es im Zählweg verbraucht wird, mit Spalte „1/0“ für „10“_Spalte 5/5 =QS=“10“ mit Summe 10+10=Calcium=“20“. Die SNAP25-Bindung von Arginin (R/Arg)=94E und Alanin (A/Ala)=C3H7NO2=18+7+7+16=48 wird gespalten, und zwar in der Spalte Z.38352#_“6“5“(3)(1)/#_“4“„6“(9)[7] mit Alanin=48E über Spalte 6/4 für „46“_Spalte 5/6=QS=11=QS=“2“ mit Summe 46+2=“Ala“=48E. Arginin=“94“ als „9“_QS3+1=“4“ mit 9_4=“Arg“ () =94E. „botC“ erkennt die Region Asn-Met-Region von SNAP25, die aus einem rechten Winkel besteht. Innerhalb von „SNAP25“ liegt das Asparagin (N/Asn)=C4H8N2O3=24+8+14+24=70E in der Spalte Z.38354#_[3]“0“/#_“1“6“ mit QS1+6=“7“_“0“ mit Asn=70E. „Met“ folgt absteigend in der Z.38352#_“65“3“1“1“/#_“4“6“[972] als QS4+6=“10“_“65“_QS3+1+1=“5“ mit Summe 10+65+5=Met=80E. „botC“ besitzt ein „WY-Motiv“ mit Tryptophan (W/Trp)=C11H12N2O=66+12+14+8=100E und Tyrosin (Y/Tyr)=C9H11NO3=54+11+7+24=96E [„The biological activity of botulinum neurotoxin type C is dependent upon novel types of ganglioside binding sites | Request PDF (researchgate.net)“; J. Strotmeier u.a.; Mai 2011; https://doi.org/10.1111/j.1365-2958.2011.07682.x]. Für Sialinsäure=C11H19NO9=66+19+7+72=164E müssen 2 Bindungsstellen ermittelt werden, die mit dem „WY-Motiv“ korrespondieren. Kurze Additionen mit QS69_31=W/Trp=“100“E und QS72+24=Y/Tyr=96E liegen nicht exakt in „botC“, so dass die Gesamtstrecke für das Motiv benötigt wird, um darin 2 Sialic-Bindungsstellen zu lesen. „Sialinsäure“=164E in Z.38351#_[58]“4“2“0“[0]/[53]“1“[149] mit „1“_QS4+2+0=“6“_“4“ mit 164E (1. Bindestelle). Tryptophan (W/Trp)=100E in Kopfschleife mit QS5+3+1=9_42+0_49 (Rand)=W=100E. „Sialinsäure“=164E in Z.38351#_“6“[5]/#_“4“6“/#_30/#_16/#_05/#_95 als QS6_4+6=16_QS3_1=4 mit 16_4 für 164E (2. Bindestelle). Tyrosin (Y/Tyr)=96E über Spalte 6/4=QS=10_Spalte 6/0 für 60_16_Spalte 5/5=10 als Summe 10+60+16+10=Y=96E.
„Rab-Proteine“ sind periphere Membranproteine, die an einer Membran über Prenylgruppen auf zwei Cysteinen [Cystein=C3H7NO2S=64E] verankert sind [Rab (G-Protein) – Wikipedia]. Eine hydrophobe Prenyl-Gruppe ist eine ungesättigte 3-Methyl-2-butenyl-Gruppe (auch: Dimethylallyl-Rest) mit der Formel „-C5H9“=30+9=39E. Das G-Protein „Rab3“ ist für die Regulierung des Membrantransports zuständig. Weil kein direkter Zusammenhang mit den Vesikelproteinen zu erkennen ist, wird die Selbstfindungsgruppe der Isoformen Rab3 A, B, C, D in Neuronen gesucht. Im Zentrum teilen sich GDP=228E (inaktiv)/GTP=268E (aktiv) die Ziffer „8“, und zwar in der Spalte Z.38357#_{9}{5}(5)(2)/#_{8}{(8)}(1)[3] mit GDP=228E als QS9+5=“14“_“8“=“22_“8“ für „GDP“ {}=228E und GTP=268E als „2“_Spalte 5/1=“6“_“8“ mit 2_6_8 für „GTP“ ()=268E. In einer Matrix müssen sich die 4 Proteine an 3 Seiten zusammendrängen, um den Kontakt zum aktiven GTP zu halten. Das Signalprotein „GTP-Austauschfaktor (Guanosine triphosphate Exchange Factor, GEF)“ aktiviert das G-Protein mittels Austausch des gebundenes GDP gegen ein GTP. Diesen Zweck erfüllt das Protein (Mensch) „RabGEF (MADD/ RAB3GEP)“=1647AS. „Converts GDP-bound inactive form of RAB3A, RAB3C and RAB3D to the GTP-bound active forms, GTPases involved in synaptic vesicle exocytosis and vesicle secretion“. „RabGEF“=1647AS umringt den GDP/GTP-Komplex [ ] als Rand der Matrix in der Randspalte Z.38356#_“3“0“5“1“0“0“2“8“/#_“2“[955243]“2“/#_“2“[881387]“6“/#_“2“8“29“4“3“4“1“, und zwar rechtsdrehend als QS2+8=10_Spalte 2/2=QS=4_QS3+0+5+1+0+0+2=11=QS=2 mit Summe 10+4+2=16_Kunstgriff Randspalte 8/2=QS=10 für „0“_Randspalte 6/1=QS=7 mit 16_Summe 0+7=“7“_Restzahl „40“ als (Ringschluss links)29_QS4+3+4=11 mit „16“_Summe 7+29+11=“47“ mit 16_47 für „RabGEF“=1647AS [MADD - MAP kinase-activating death domain protein - Homo sapiens (Human) | UniProtKB | UniProt]. Weil sich die 4 Rab-Proteine rechts um das GTP drängen, wird die „Prenyl-Gruppe“ mit einem Musterstück am linken Matrix-Rand mit QS29+5+5=“39“E dargestellt. Für 4 Rab-Proteine mit je 2 Prenylgruppen wird die Membran „33“ als Spalte 3/3 über die Elektronenanzahl 39E *2* 4 Proteine=312E gefunden, und zwar in der Spalte Z.38356#_{3}613051/#_{„3“}“1“9“2“[955} als „3“_QS1+9+2=“12“ mit 3_12 für Summe „Prynyl-Gruppe der Familie“=312E. Das Cystein=64 liegt an der Matrix-Ecke mit 6_QS1+3=4 für Cystein=64E, gefolgt von der Anzahl „8“ für die Familie als QS5+1+0+0+2=“8“. Die Evolution kennt den „Kreis“=64, aber wie wird eine rechteckige Matrix erkannt? In der Matrixecke liegt die Spalte „43/87“ mit der Spalte 4/8 als Schwerachse=84, kombiniert mit einem 90°-Winkel für die Horizontale als QS87+3=90°.
Die GEF-Gegenspieler sind die „GTPase-aktiverenden Proteine (engl. GTPase-activating proteins, GAP)“. GAP-Proteine aktivieren die GTPase-Aktivität des G-Proteins, wodurch dieses das gebundene GTP unter Abspaltung eines Phosphat-Restes zu GDP hydrolysiert. Der Gegenspieler von „RabGEF“ ist der Rab3-GTPase-aktivierenden (Rab3GAP)-Komplex, der aus RAB3GAP1 und RAB3GAP2 besteht und u.a. auch für die Rab3-Familienmitgliedern RAB3A, RAB3B, RAB3C undRAB3D zuständig ist. Das Protein (Mensch)=“RAB3GAP2“=1393AS ist die regulatorische Untereinheit des Rab3-GTPase-aktivierenden (Rab3GAP)-Komplexes. Eine GTP-Bindung ist nicht vorhanden, sondern der Gegenspieler erzeugt eine linksdrehende Umgrenzung einer kleinen Matrix, in deren Mittelpunkt die Austauschzahl {8}=Extra steht. „RAB3GAP2“=1393AS liegt in der Spalte Z.38357#_“2“9“55“2“[432]/#_“2“[8{8}1]“3“[876]/#_“2“8“2“9“4“[341] als QS9+4=13_Spalte 2/3=QS=5_55 mit 13_Summe 5+55=60_QS9_Spalte 2/2 für 22_2=9+22+2=33_Ringschluss mittels Kunstgriff QS8+2=10 für „0“ als „13“_Summe 60+33+0=93 mit 13_93 für “Rab3GAP2“=1393AS [RAB3GAP2 - Rab3 GTPase-activating protein non-catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch)=“Rab3GAP1“=981AS ist Teil des Rab3GAP-Komplexes und wirkt als „GAP“, indem es aktives „RAB3-GTP“ in die inaktive Form „RAB3-GDP“ umwandelt. “Rab3GAP1“=981AS liegt in der Spalte Z.38357#_[295]“5“2“[432]/#_[2]“88“1“3876/#_“2“8“[294341] über Wasser=28=QS=“10“_“88“_“1“ mit Summe 10+88=“98“_“1“_Aufnahme der GTP-Reste mittels Kunstgriff QS5+2_3=10 für „0“ als 98_Summe 1+0=“1“ mit 98_1 für “Rab3GAP1“=981AS. Aufgrund der Bindung von „Rab3A“ werden die Positionen gegenseitig bestätigt [RAB3GAP1 - Rab3 GTPase-activating protein catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Rab3A“=220AS ist für die Calcium-abhängige Freisetzung der Neurotransmitter zuständig. „Rab3A“ liegt in der Spalte Z.38357#_[9]“5“5“2“432/#_8“8“13876/#_8“2“94341 als „2“_Spalte 5/8=QS=“13“_QS5+2=“7“ als „2“_Summe13+7=“20“(Calcium) mit 2_20 für „Rab3A“=220AS [RAB3A - Ras-related protein Rab-3A - Homo sapiens (Human) | UniProtKB | UniProt; RAB3A – Wikipedia]. „Rab3b“ und „Rab3d“ sind gleichlang und haben den Zweck, sich als Kopplung zu finden. Das Protein (Mensch) „Rab3B“=219AS rekrutiert auf präsynaptischer Ebene das Protein (Mensch) „Rabphilin-3A (RPH3A), das den Cofaktor „Calcium“ und Zink-Bindungen besitzt. „Rab3B“=219AS liegt in der Spalte Z.38357#_52432/#_8{1}{38}76/#_2{9}4341 als 38=QS=11=QS=2_Spalte 1/9 für 19 mit 2_19 für „RAB3B“ {}=219AS [RAB3B - Ras-related protein Rab-3B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Zink für „RPH3A“ für ist eine Anlagerung an Calcium in der Spalte „55“/“8“(1)“/“2(9) als QS5+5=10_QS8+2=10 mit Summe 10+10=Calcium=“20“_ QS1_9=QS=10 mit Summe 20 (Ca)+10 =Zink=30. Das Protein (Mensch) „Rabphilin-3A (RPH3A)=694AS liegt in der Spalte Z.38357#_[55]“2“4“3“2“/#_[8]{1}{„3“8“}“76“/#_[2]{9}[„4“3“4“[1] und füllt in Spiralform eine Matrix über Spalte 8/3=QS=11=QS=2_4 mit Summe 2+4=“6“_76_QS4+3+2=“9“_Spalte 2/3/4=QS=“9“ mit „6“_Summe 76+9+9=94 mit 6_94 für RPH3A=694AS [RPH3A - Rabphilin-3A - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Rab3D“=219AS liegt am Zeilenrand in der Spalte Z.38357#_“4“3“[2]/#_(8)“7“[6]/#_“3“4“[1]/#_“8“1“[2] aufsteigend als QS4+3=“7“_“7“_QS3+4=“7“ mit Summe 7+7+7=“21“_QS8+1=“9“ mit 21_9 für Rab3D“=219AS [RAB3D - Ras-related protein Rab-3D - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Rab3C“=227AS findet am „GTP“ nur mit einer einzigen Zahl Platz, so dass es sich gemeinsam mit „Rab3D“ vertikal streckt. „Rab3C“=227AS liegt in der Randspalte Z.38359#[9]“4“{34}[1]/#_[9]“3“{81}[2]/#_1“22“[71] absteigend als „22“_QS3+4=“7“ mit 22_7 für „Rab3C“=227AS [RAB3C - Ras-related protein Rab-3C - Homo sapiens (Human) | UniProtKB | UniProt]. Die Position von „Rab3C“ wird vom Protein (Mensch) „ZWINT (Zwint-1/ ZW10 Interaktor)“=277AS bestätigt, das an der Endziffer „22“ seitlich anliegt, und zwar in der Randspalte Z.38360#_{3}(81)[2]/#_{22}“7“1“/#_[9]“7“0“1“ schleifenförmig über die Randspalte 1/1=QS=“2“_“7“_QS0+7=“7“ mit 2_7_7 für „ZWINT“=277AS [ZWINT - ZW10 interactor - Homo sapiens (Human) | UniProtKB | UniProt].
Im inaktiven Zustand kann das Rab-Protein durch den „GDP-Dissoziations-Inhibitor (GDI)“ aus der Membran extrahiert und im Zytosol löslich gehalten. Das Protein (Mensch) „Rab GDI alpha“=477AS reguliert die GDP/GTP-Austauschreaktion der meisten Rab-Proteine (welche?). Interagiert mit den nicht-phosphorylierten Rab-Formen und fördert die Dissoziation von der Membran u.a. von „Rab3A“. Interagiert mit „RHOH“. „Rab_GDI“=477AS bildet eine S-förmige Kurve, die links mit „GTP“ und damit auch der Endziffer von „RAB3A“ verbunden ist, und zwar in der Spalte Z.38356#_[51]“0“0“2“[8]/#_[55]“2“[432]/#_813876/#_294341/#_993812 aufsteigend als QS0+0+2=“2“_“2“ für „22“_QS3+8=“11“_Spalte 7/4=“11“ mit Summe 22+11+11=“44“_QS3+4=7 mit 44_7 für „Rab GDI alpha“=477AS. Die Startziffer „2“ wird dabei am Zeilenrand dem Wasser „28“ (Symbol) entnommen, womit das Cytosol gekennzeichnet ist [GDI1 - Rab GDP dissociation inhibitor alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RHOH“=191AS bestätigt diese Position, in dem es das Wasser mit aufnimmt, und zwar in der Randspalte Z.38355#_[668]“1“/#_[0]“0“2“8“/#_[2]“4“[32]/#_[3]“87“[6] als „1“_Kunstgriff QS0+2+8=10 für „0“_QS4_87=“91“ als „1“_Summe 0+91=“91“ mit 1_91 für „RHOH“=191AS [RHOH - Rho-related GTP-binding protein RhoH - Homo sapiens (Human) | UniProtKB | UniProt]._dat04.12.2023
Postsynapse: Die Erregung wird über das Axon geleitet und über den synaptischen Spalte in ein Dendrit übertagen. Die Rezeptoren für die chemische Signalübertragung, die ohne Rückantwort erfolgt, sind in der Postsynapse lokalisiert. Die Postsynapse legt sich im Prinzip mit einem neuen Zeichenblatt auf der Code der Präsynapse. Die Synapse hat nur die rechte Seite des Codes ausgeschöpft, so dass der linke Code-Rand der Fortsetzung dient. Insbesondere ist ein synaptischer Spalt in der Code-Randserie #1611 mit der Zählgröße „11“=Spalt vorhanden. In der Zeilen-Nummern-Matrix liegt als Serie #38xxx mit QS3+8=11 über 3 Zeilen stets eine Membran für eine Präsynapse vor. Nunmehr kann der Vorgang zurück in den Code gespiegelt werden, in dem sich die Proteine der Postsynapse entfalten. Die beiden Gerüstproteine PSD-93 und PSD-95 (Postsynaptic density protein PSD-93/95) besitzen keine speziellen Merkmale, so dass deren Position erst aus Interaktionen entschlüsselt werden kann. Die Intensität der Weiterleitung einer Erregung wird von diesen Proteinen bestimmt. Die Gerüstproteine sind membranassoziierte Guanylatkinase-Proteine (MAGUKs), die eine Schlüsselrolle bei der Regulierung des intrazellulären Transports und der synaptischen Lokalisierung „ionotroper Glutamatrezeptoren“ spielen [Postsynaptische Dichtemembran-assoziierte Guanylatkinase-Proteine (PSD-MAGUKs) und ihre Rolle bei ZNS-Erkrankungen – PubMed (pubmed-ncbi-nlm-nih-gov.translate.goog); F. Gardon; Jan.2009; DOI: 10.1016/j.neuroscience.2008.07.068]. Das „Guanosinmonophosphat (Guanylat)“= C10H14N5O8P=60+14+35+64+15=188E bildet eine Hilfsgröße und ist in Z.[3835]“8“#“161“1“2772“881“[3876] gespiegelt als „881“ lesbar. Über die Ziffer „8“ kann als Wiederholung auch die Z.-Nr.-Matrix beteiligt werden als „1“_QS#1+6+1=“8“_“8“ (aus Z.3835“8“) weiter im Code mit QS2+7+7+2=“18“_“8“ für Guanylat=188E. Der synaptische Spalt wird muldenförmig dargestellt. Folglich „blickt“ ein postsynaptisches Protein seitenverkehrt auf die Membran als Kugeloberfläche „64“. Am linken Rand Z.“38“xxx werden hierfür 5 Zeilen benötigt, und zwar als QS38_2-fach 38=QS=11_ 2-fach 38=QS=11=QS=2 mit Summe 38+11+11+2+2=konvex=“64“. Diese 5 Zeilen sind variabel, jedoch muss die Entwicklung immer wieder auf einen Kernbereich zurücklaufen, in dem „PSD-93“ und „PSD-95“ zusätzlich auch in der Zeilen-Nr.-Matrix vorliegen. Diese 5 Zeilen bilden die Matrix-Spalte Z.(38)[35]“4“/ Z.(38)[35]“5“/ Z.(38)[35]“6“/ Z.“(38){35}“7“/ Z.38{35}{8}. Enthalten ist das Protein (Mensch) „PSD-95“=724AS als „7_QS6+5=11=QS=“2“_“4“ mit 7_2_4 für „PSD-95_DLG4“=724AS. Alternativ kann sich die Ziffer „4“ Spalte „83/83“ mit doppelt QS3+8=11=QS=“2“ zusammensetzen. Hierbei wird die Zahl „11“ dreifach mit einen Bezug 3*11=33=Membran=männlich durchlaufen. Das Protein wird daher außer im Gehirn auch in den Hoden stark exprimiert [Postsynaptisches Dichteprotein-95 - DocCheck Flexikon]. Das Protein ist direkt unterhalb der postsynaptischen Membran der Synapse lokalisiert. „PSD-95“ zieht sich als Homodimer in den Code, und zwar in Z. 38357#“16“11“31“ als QS1+6=“7“_QS1+1=“2“_QS3+1=“4“ mit 7_2_4 für „PSD-95“=724AS (Homodimer) [DLG4 - Disks large homolog 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Wissenschaftlich ist es kein Homodimer, sondern offensichtlich handelt es sich nur um eine Konformationsänderung, weil in der Z.Nrn-Matrix in der Spalte „5/6“ das Serin=C3H7NO3=18+7+7+24=56E ein Schalter zum Wechsel von der offenen zur geschlossenen Form darstellt [Die postsynaptische Dichte 95 (PSD-95) Serin-561-Phosphorylierung reguliert einen Konformationsschalter und die bidirektionale strukturelle Plastizität der dendritischen Dorn (PMC) (nih.gov); Q.Wu; Sep. 2017; doi: 10.1074/jbc. M117.782490]. „PSD-95_DLG4“=724AS interagiert mit dem Protein (Mensch) „FYN_Tyrosine-protein kinase“=537AS. „FYN“ enthält einen Bezug zu ATP/ADP und Tyrosin (Y/Tyr)=C9H11NO3=54+11+7+24=96E, und zwar in der Spalte Z.38358#[1611]“2“7“/#[161]“1“2“3“ mit Tyrosin=96E als QS2+7=9_QS1+2+3=6 mit 9_6 für Tyrosin=96E. Zugleich sind ATP/ADP in Z.38358#[16]“11“2“7“/#[16]“11“2“3“ enthalten, und zwar „ATP“=260E ringförmig als „2“_11=QS=2_11=QS=2_2 mit „2“_Summe 2+2+2=“6“_QS7+3=10 für „0“ mit 2_6_0 für „ATP“=260E. „ADP“=220E liegt dabei in der Spalte „2“7“/“2“3“ als „2“_“2“_QS7+3=10 für „0“ mit 2_2_0 für „ADP“=220E. Folglich liegt FYN=537AS in der Spalte Z.38358#[1]“6“1“1“2“[7]/#[1611]“2“3“ als QS2+3=5_QS1+2=3_QS6+1=7 mit 5_3_7 für „FYN“=537AS. „FYN“ vermittelt die Phosphorylierung der Palmitoyltransferase „ZDHHC5“, die von „FYN“ stabilisiert wird. Das Protein (Mensch) „ZDHHC5 (Zink-Fingerprotein 375)“=715AS liegt rechts neben „FYN“ in der Spalte Z.38358#[161127]“7“[288]/#[161123]“5“2“8“{2}, und zwar aufsteigend als „7“_QS5+2+8=“15“ mit 7_15 für „ZDHHC5“=715AS, weil das Zink mit QS28+2=Zink=30E seitlich mit der Zahl „28“ einbindet. An der Katalyse sind das Hexadecanoyl CoA=C37H62N7O17P3S-4=222+62+49+136+45+16=530E [Hexadecanoyl CoA | C37H62N7O17P3S-4 | CID-45266605 - PubChem (nih.gov)] und Coenzym A (CoA)=C21H36N7O16P3S=126+36+49+128+45+16=400E beteiligt, und zwar in der Spalte Z.38358#[1611277]“2“[88]“1“/#[161123]{5}{“2“8“}{2}“9“ mit „CoA“=400E über Spalte 2/2=QS=“4“_QS8+2=10 für „0“_Spalte 1/9=10 für „0“ mit 4_0_0 für „CoA“=400E sowie „Hexadecanoyl CoA“=530E über die Zink-Zählung als „5“_QS28+2=“30“ für 530E. Darin ist das Cystein=C3H7NO2S=18+7+7+16+16=64E in Z.38359#_“52“8“29“434“[1] als QS52+8=“60“_QS2+9=11=QS=2_QS4+3+4=11=QS=2 mit Summe 60+2+2= Cystein=64E für die Katalyse enthalten.
Ebenfalls ist das Protein (Mensch) „PSD-93_DLG2“=870AS in der Z.Nr.-Matrix vorhanden, und zwar als „8“_QS35+35=“70“ mit 8_70 für „PSD-93“=870 AS. „PSD-93“ bildet ein Heterodimer mit einem Familienmitglied, so dass der Partner das „PSD-95“ ist [DLG2 - Disks large homolog 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „PSD-93“ interagiert mit „GRIN2B“ und „KCNJ12“. Das Protein (Mensch) „KCNJ12“=433AS liegt in der Matrix-Spalte Z.“38“3“[58]/Z.“38“3“[59] als 38=QS=11=QS=“2“_38=QS=11=QS=“2“ mit Summe 2+2=“4“_Spalte 3/3 für „33“ mit 4_33 für „KCNJ12“, wobei Kalium als QS5_5+9=Kalium=19E enthalten ist. Der Zählweg für das Kalium entspricht dem „Phosphatidylinositol-4,5-bisphosphate (PIP2)“ C47H80O19P3=282+80+152+45=559E, das die Aktivierung auslöst [KCNJ12 - ATP-sensitive inward rectifier potassium channel 12 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIN2B“=1484AS liegt in der Zeile Z.[3]“83“5“7“#“161“13“[1]/ #[1611]{27}, und zwar Matrix/Code-übergreifend als 83=QS=11=QS=2_5_7 mit Summe 2+5+7=“14“#QS1+6+1=8_QS3+1=4 mit 14_8_4 für GRIN2B“=1484AS. Die Ziffer „3“ gehört zweizeilig zur Zinkbindung QS3_27=Zink=30E mit dem Zweck, das am rechten Matrix-Rand ebenfalls 2-zeilig das Glutamat als Spalte „7/8“ für Glutamat=78E erkannt wird [GRIN2B - Glutamate receptor ionotropic, NMDA 2B - Homo sapiens (Human) | UniProtKB | UniProt].
Die möglichen Veränderungen können unter den Begriff der „Heteromultimerisierung“ fallen, wobei ein heteromultimeres Protein entsteht. Beim Proteindesign (Proteinoptimierung) werden mittels ortsspezifischer Mutagenese der DNA die Eigenschaften der Proteine angepasst. Beim Begriff „Hetero“ handelt es sich im die Bildung von Proteinkomplexen aus PSD95/PSD93 zusammen mit der regulatorischen Untereinheiten des N-Methyl-D-Aspartat (NMDA)-Rezeptors sowie mit Kaliumkanälen vom Shaker-Typ [Kaliumkanäle - Lexikon der Biologie (spektrum.de)]. Kaliumkanäle sind Proteine zugleich muss aber irgendwo auch das Kalium=19E als Kanal erkennbar werden. In der Spalte Z.38357#_“3“{19}[2]/#_“2“[772]/#_“2“[352]/#_“1“{9}[32]/#_“1“512/#_“10“{9}[2] ist die Zahl „19“ mit einer Kanal-„0“(Null) als 1“0“9 enthalten. Vorgelagert ist die Zahl „19“ in 2 Zeilen lesbar. Der Kanal wird in der Spalte mit der Summe „Kalium“=19E gezählt, und zwar aufsteigend Zahl „19“ als Motiv lesbar und nochmals aufsteigend 6-zeilig als Summe 3+2+2+1+1+10=Kalium=19E. Bei der Kanalaktivität werden Ca^2+ und Na^+ in die Zelle hinein und K^+ heraus transportiert. Die Kanalöffnung erfolgt real durch Glutamat (als Glutaminsäure= C5H9NO4=30+9+7+32=78E) sowie im Labor alternativ mittels N-Methyl-D-Aspartat (NMDA)=C5H9NO4=30+9+7+32=78E. Die Zahl „78“ bildet sich als Spalte „7/8“ in der Matrix-Spalte Z.[3835]“7“/Z.[3835]“8“ als „7“_“8“ für Glutamat=78E, die fortführend auch im Code zählbar ist. Das Protein (Mensch) „GRIN1_Glutamat Rezeptor_NMDA“=938AS gibt mit „38“ ein Motiv zur Z.-Nr.-Matrix und liegt dort am seitlich am Glutamat, und zwar in der Spalte Z.{38}“3“5“[7] /Z. {38}“3“5“[8]/Z.[383]“5“9“ als „9“_QS5_5=10 für „0“_mit Summe 9+0=“9“_“3“_QS3+5=“8“ als 9_3_8 für „GRIN1“=938AS (Monomer). Eine Glycin-Bindung mit Glycin=C2H5NO2=12+5+7+16=40E liegt mit 38=QS=11=QS=“2“_“38“ als Summe 38+2=Glycin=40E vor. Als Heterotetramer kann sich ein Homodimer in den Code ziehen, und zwar in der Spalte Z.38359#_“1611“2“/#_[1]“611“1“ als QS1+6+1+1=“9“_Spalte „2/1“ (Magnesium=12E) mit QS=3_QS6+1+1=8 als 9_3_8 für „GRIN1“=938AS (Homodimer). Mit der Schleife über den linken Code-Rand #1611 durch das gespiegelte Magnesium wird auch das Calcium als „16“_QS1+1_1+1=“4“ mit Summe 16+4=Calcium=20E adressiert. Das Magnesium liegt im Zählweg von GRIN1 und hebt eine Kanalhemmung auf.
In der Postsynapse bildet das Protein (Mensch) „GKAP_Guanylatkinase-assoziiertes Protein_DAP-1“=977AS eine Fortsetzung von „PSD-95“, so dass es in der Spalte Z.38357#{161131}“9“/#[16112](77) scheinbar als 9_77 für GKAP=977AS vorliegt. Die Zählung wird aber in der Zeile fortgesetzt, damit das „Guanosinmonophosphat (Guanylat)“= C10H14N5O8P=60+14+35+64+15=188E gebildet werden kann. Die lesbare Spiegelung „881“ in der Spalte Z.38357#[161131]“9“29“5“{“5“}{“2“}[432]/#[1611277]{2881}[3876] dient ebenfalls nur zur Motivation und wird neu gebildet über „2881“ mit QS2+8+8=18_QS1_5+2=8 mit 18_8 für Guanylat {}=188E. GKAP=977AS als „9“_29=QS=11=QS=2_5 mit „9“_Summe 2+5=“7“_QS5+2=“7“ mit 9_7_7 für GKAP=977AS [DLGAP1 - Disks large-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „GKAP“ bindet weiterhin an „SHANK2“. Das Protein (Mensch) „SHANK2“=1849AS liegt in der Randspalte Z.38356#[305]{10}[028]/#_[29]{55}“243“(2)/#_“288“13“[87](6) als QS2+8+8=18_QS1+3=4_QS2+4+3=9 mit 18_4_9 für „SHANK2“=1849AS [SHANK2 - SH3 and multiple ankyrin repeat domains protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „SHANK2“ wird alternativ als „Prolin-reiches Synapsen-assoziiertes Protein 1(PROSAP1)“ bezeichnet. Hierfür liegt das Prolin=62E gespiegelt am rechten Rand in der Spalte „2/6“ für Prolin ()=62E. „SHANK2“ wird außerdem als „Cortactin-bindendes Protein 1 (CortBP1)“ bezeichnet. Das Protein (Mensch) „Cortactin“=550AS liegt seitlich an, und zwar als „55“_10 für „0“ mit 55_0 für „Cortactin“ =550AS [CTTN - Src substrate cortactin - Homo sapiens (Human) | UniProtKB | UniProt]. „Es wird angenommen, dass SHANK2 eine Rolle bei der Synaptogenese spielen könnte, indem es metabotrope Glutamatrezeptoren (mGluRs) an einen bestehenden Pool von NMDA-Rezeptoren (NMDA-R) bindet, indem es über PSD-95 an die NMDA-R und über HOMER1 an die mGluRs bindet.“ Das Protein (Mensch) „HOMER1“=354AS zeigt als Merkmal einen Bezug zum „circadianen Rhythmus“ mit der „Zeitbasis“=24 Stunden. Es reagiert auf Calcium-Ionen=20E (Leserichtung über „02“) und auf „Kokain“=C17H21NO4=102+21+7+32=162E. „HOMER1“ liegt in der Spalte Z.38356#_“1“0“0“2“[8]/#_“5“2“4“32“/#_[1]“3“{“8“7}[6]/#_[94]{3}{4}[1]/#_[93]{8}[12]. Das „Kokain“=C17H21NO4=102+21+7+32=162E liegt in der Randspalte „2“8“/[3]“2“/[7]“6“, und zwar absteigend als QS6_2_8=16_2 für „Kokain“=162E. Folglich ergibt sich „HOMER1“=354AS aus „32“_QS1+0+0+2=“3“ mit Summe 32+3=“35“_QS5+2+4=11=QS=“2“_38=QS=11=QS=“2“ mit „35“_Summe 2+2=“4“ als 35_4 für „HOMER1“=354AS [HOMER1 - Homer protein homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Schlusszahl „38“{7}[6] bindet das Glutamat=78E gespiegelt ein, um das Protein (Mensch) „GRM4_G-Protein-gekoppelter Rezeptor für Glutamat“=912AS darzustellen, und zwar als QS87_4=91_Spalte 3/8=QS=11=QS=2 mit 91_2 für „GRM4“ {}=912AS [GRM4 - Metabotropic glutamate receptor 4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „ANK1_Ankyrin-1“=1881AS erreicht den rechten Coderand in der Spalte Z.38355#_[8]“1“/#_[2]“8“/#_“3“2“/#_“76“ aufsteigend als 1_8_QS3+2_76=81 mit 1_8_81 für „ANK1“= 1881AS[ANK1 - Ankyrin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Gehirn verbindet „Ankyrin“ spannungsabhängige Ionenkanäle mit dem Zellskelett [Ankyrin - Lexikon der Biologie (spektrum.de)]. „Ankyrin“ besitzt eine Spectrin-Bindung, die sich am rechten Rand ausbreitet. Das Protein (Mensch) „SPTAN1_Spectrin alpha“=2472AS liegt in der Spalte Z.38356#_[5]{1002}{8}/#_{55}“24“3“{2}/#_[81]“38“7“{6}294]“3“4“{1}/#_[9938]{1}{2} als „24“_Spalte 3/7=QS=10 für „0“_QS3+4=“7“_38=QS=11=QS=“2“ mit „24“_Summe 0+7=“7“_“2“ für „SPTAN1 - Spectrin alpha chain“=2472AS [SPTAN1 - Spectrin alpha chain, non-erythrocytic 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SPTBN1_Spectrin beta“=2364AS als QS5+5_1+0+0+2=13_Spalte 8/2=QS=10 mit Summe 13+10=“23“_“6“_Spalte 1/2=QS=3_1 mit „236“_QS3+1=“4“ mit 236_4 für SPTBN1 {}=2364AS [SPTBN1 - Spectrin beta chain, non-erythrocytic 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Ankyrin besitzt eine ATPase-Bindung. Das Protein (Mensch) „Phospholipid-transportierende ATPase“=892AS liegt in der Randspalte Z.38356#_[5]100“2“}“8“/#_[55]“2“4“3“[2] mit dem Cofaktor „Magnesium“=12E als „1“_QS0+0+2=“2“ für Magnesium=12E, und zwar als „ATPase“=892AS mit „8“_Spalte 2/3=QS=5_4 mit „8“_Summe 5+4=“9“_“2“ mit 89_2 für „ATPase“=892AS. „Ankyrin“ ist teilweise an Tubulin gekoppelt. Das Protein (Mensch) „TUBA1A_Tubulin alpha-1A“=451AS liegt in der Spalte Z.38355#_[8668]“1“/#_{1}{0}“0(“2“)(„8“)/#_{5}[2](“4“)3“2“/#_{1}({3}[876] als „4“_QS0+2_3=“5“_Spalte 8/2=QS=10 für „0“_1 mit „45“_Summe 0+1=“1“ für TUBA1A=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. GTP=268E als 38=QS=11=QS=2_QS4_0+2=6_8 für GTP ()=268AS für TUBA1A und TUBB1. Zwischen beiden Ketten liegt die Ziffer „2“, die zum Magnesium=12E für „TUBB1“ gehört. Das Protein (Mensch) „TUBB1“=451AS liegt in der Spalte als QS1+3=4_5_1_“0“ (Kettenverbindung „0“=Röhre) für TUBB1{}=451AS [TUBB1 - Tubulin beta-1 chain - Homo sapiens (Human) | UniProtKB | UniProt].
Gap Junction (Nexus / Lücken-Verbinder): Im Unterschied zu „Tight Junctions“ werden 2 Zellen nicht undurchlässig, sondern mittels einer Ansammlung von „Gap Junctions“ über Porenkanäle verbunden. Es werden elektrische Signale und kleine sekundäre Botenstoffe wie Calcium (Ca^2+), cAMP, cGMP, IP3 sowie kleine Moleküle für den Stoffaustausch, wie Aminosäuren und Glucose, weitergeleitet. Für die Verbindung stellt eine Zelle dem Nachbarn vis-a-vis einen Halbkanal bereit, so dass im Porenkanal eine kleine Lücke zwischen beiden Halbkanälen verbleibt. Der Halbkanal wird bei Wirbeltieren von „6“ Proteinen „Connexin“ gebildet, die sich ringförmig zum Halbkanal / Hemikanal (Connexon) verbinden. Das Zentrum liegt dabei in der Spalte Z.38354#1611445{33}{0}/#16114{0}{33}[26] mit Bezug zum Kanal „0“(Null) und zur Membran „33“, doppelt in 2 Zeilen. Ein Connexon entsteht binnen weniger Sekunden, so dass die falsche, doppelte Zeitbasis=“24“ mit Tagesbezug in der Randspalte Z.38353#_7224/#_2407/#_6681 über eine Funktionsbildung unlesbar werden muss. [Momentan unklar ist, ob sich die kurze Zeit auf die Funktionsbereitschaft, die Montage in der Membran oder den Transportprozess vom Golgi-Apparat zur Zellmembran bezieht]. Aufgrund der Dopplung und der lesbaren Gruppe=44/2=Halbgruppe (Halbkanal)=22 sind beiden Anteile in der Zahl „2_4“ enthalten. Statt einer Zeitbasis werden damit Maße festgelegt, die sich erst am fertigen Halbkanal (Connexon) aus 6 Untereinheiten bilden: Der normale Membranabstand zwischen 2 Zellen von 20-30 nm reduziert sich in der Lücke zwischen den beiden Halbkanälen auf den Lücken-Abstand=2 - 4 nm. Diese Ziffern sind in der Zahl „24“ doppelt in 2 Zeilen erfasst, die als Form=7_Halbkanal=22_4 mit der Form=7 kombiniert wird. Der „Porendurchmesser der Transmembrankanäle“=0,8 – 2 nm muss verschiedenartig sein, weil die Ziffer „0“ in min D=0,8 nm als Symbol für den Porendurchmesser „O“ benötigt wird. Der Durchmesser kann nun in der Spalte „2/0/8“ für 0,8 -2 nm dargestellt werden. Die „0“ (Null) wird als 07 mit der Form=7 kombiniert. Wird winkelförmig statt vertikal „2_0_7“ abgelesen, ergibt sich der spezielle Lückenabstand von 2,7 nm der alternativ statt 2 – 4 nm genannt wird. Ersatzweise für die zerstörte Zeitbasis=“24“ wird die Zeitbasis=“60“ in der Spalte „0/6“ lesbar, weil sich diese über die „halbe Zeitbasis=30“ in der Spalte {3}{3“0“}/{3}1“6“/{3}0[5]“ als „30“_Spalte 3/3/3=QS=“9“_Spalte 1/0=QS=“1“ mit „30“_Summe 9+1=10 für „0“=Kanal für halbe Zeitbasis im Halbkanal als “30“ ergibt. Im Zentrum werden einerseits Proteine dargestellt, die diese beiden Halbkanäle erst zusammenfügen, andererseits wird übergreifend eine großer Gesamtbereich beansprucht der Platz zur Entwicklung von 6 gleichen Proteinen (Connexon) bildet, so dass dabei natürlich keine Lücke vorhanden ist, sondern die Zeilen insgesamt verarbeitet werden. Die überschüssige Ziffer [5] als „05“ dient als Nachkommastelle für die Maße der Untereinheit der Länge QS1+6=7_05 für 7,5nm und im Durchmesser von QS2+9=11=QS=2_05 für 2,5nm. In Bezug auf die elektrische Synapse enthält die Spalte „1/05“ den Exponent für die sehr kurze „Schaltverzögerung“=1*10^-5 Sekunden: „Wird der Schwellenwert an der postsynaptischen Membran überschritten, folgt hier ein Aktionspotential, und das Signal kann praktisch ohne Zeitverzögerung (10^−5s) weitergeleitet werden“ [Gap Junction – Wikipedia ; Universitätsklinikum des Saarlandes - Allgemeines (uniklinikum-saarland.de)].
Der interzelluläre Porenkanal wird „homotypisch“ (aus zwei gleichen Connexonen) oder „heterotypisch“ (aus unterschiedlichen Connexonen) aufgebaut. Die Connexone passen aber nicht immer optimal zusammen. Von den 26 bekannten Connexinen werden beim Menschen 21 Proteine „Connexin (CX)“ exprimiert. Jedes „Connexin“, d.h. das „Tortenstück im 6er Connexon“, besteht aus einem Bündel von 4 Transmembrandomänen [„M1-M4“], die über 2 extrazelluläre Schleifen (extracellular loop „E1“/„E2“) verbunden sind. Für die durchgehenden Kette sind weiterhin eine intrazelluläre Schleife (cytoplasmic loop „CL“) und 2 Enden (terminal domain „N“=NH2 mit QS7+2=“9“ / „C“=COOH mit QS6+16+1=23) notwendig [Connexine – Wikipedia]. Der Porenkanal öffnet sich, wenn sich die 6 Tortenstücke verdrehen. Hilfsweise wird folgendes Funktionsbild gewählt: Die beiden Schleifen E1/E2 bilden an der Lücke 2 Bögen (Halbkreis). Im Porenkanal können 2 Connexine vis-a-vis die beiden Halbkreise beidseitig fiktiv durch 1 Vollkreis ersetzen. Der stehende Kreis wirkt als Drosselklappe. Insgesamt werden die 6 Tortenstücke eines Halbkanals durch 6 Drosselklappen geöffnet. Mit 6 Klappen*64 (Kreis)=384 (Symbol) entsteht eine Symbol-Zahl, die zufällig die Schwerachse „84“ für die Achse der Drosselklappe enthält. Die Zahl „38“ ergibt einen Bezug zur Z.-Nr.-Matrix Z.“38“xxx, die für eine Regulierung sorgen könnte. Die Zahl „384“ ist 3-zeilig am Rand immer vorhanden, und zwar mit „38“_doppelt „38“=QS=11=QS=“2“ mit „38“_QS2+2=“4“ für Klappenfunktion=384 (Symbol). Das gewählte Funktionsbild ist teilweise realistisch: Die „Lücke“ entsteht, weil über die extrazelluläre Domäne eine Verbindung über Disulfidbrücken 16-16=Schwefel an Cystein-Resten zwischen den Halbkanälen besteht, die einen Abstand als Lücke verursacht. Cystein=C3H7NO2S=64E symbolisiert den Kreis=64 und die Disulfidbrücke mit Summe 16+16=64/2=32 den Halbkreis. Die Öffnung des Porenkanals wird wahrscheinlich durch Neurotransmitter (Adrenalin=C9H13NO3=98E / Noradrenalin=C8H11NO3=90E) oder Wachstumsfaktoren angeregt. Die Pore wird dann hohe intrazelluläre Calcium-Konzentration bei niedrigem pH-Wert wieder verschlossen. Dabei wird eine Konformationsänderung von Calmodulin an seinen Calcium-Bindungsstellen wirksam.
Die „Gap Junction“ wird in den Gewebearten über spezielle Connexine gebildet, wobei der Membranbereich erst mittels mindestens 12 weiteren Komponenten komplettiert wird. Hierzu gehören das Tight-Junction-Protein „ZO-1“ (hält Membranen eng zusammen), Natriumkanäle und Aquaporin [Gap Junction – Wikipedia]. Das Protein (Mensch) „ZO-1“=1748AS liegt in der Spalte Z.38354#_[445]“33“0“8“[2407]/#_[40]“33“16“8“[6681}/#_[36]“1“[30510028] und spannt die beiden 33er Membran-Zeilen im Zentrum zusammen. Das ist doppeldeutig, weil damit die Kopplung von 2 Connexinen an der Lücke gemeint ist. An derselben Stelle formiert sich dann aber auch das einzelne Connexin. „ZO-1“ interagiert im Bereich der Lücke mit den Halbkanälen, und unterstützt offensichtlich deren Kopplung. „ZO-1“=1748AS absteigend als „1“_QS33 (Membran)_33 (Membran)_0_8 mit „1“_Summe 33+33+0+8=“74“_aufsteigend „8“ (Extra=Spanner 8-8) mit 1_74_8 für „Tight junction protein ZO-1“=1748AS [TJP1 - Tight junction protein ZO-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Von den verschiedenen Aquaporinen (Wasserkanal) ist im Gehirn u.a. das Protein (Mensch) „AQP4_Aquaporin-4“=323AS erforderlich. Der „Wasserkanal“ ist im Umfeld der „Gap Junction“ anzunehmen, weil über die Konzentration bestimmt wird, welche Stoffe passieren. Der „Wasserkanal“ wird für den Zusammenhang im denselben Zeilenbereich entwickelt, und zwar in der Spalte Z. 38354#_[53]“3“0“82“4“[07]/#_[33]“1“6“8“[6681]/#_[1]“3“0“[510028]. Auf beiden Kanalseiten wird die Zahl „10“ für Wasser H2O=28 (Symbol) mit QS=2+8=10 erzeugt und als Summe über den Spanner=“8“ zum fließenden Wasser mit Summe 10+8+10=Wasser=28 verbunden. Zusammen mit Startziffer „4“ folgt 4+28=32, so dass über eine Kanal-Null die Ziffer „3“ folgt. „AQP4“=323AS als „4“_QS8+2=“10“_“8“_Spalte 0/6=QS=“6“_Spalte 3/1=QS=“4“ mit Summe 4+10+8+6+4=“32“_QS3+0=“3“ mit 32_3 für „AQP4“=323AS. „AQP4“ wird alternativ als „Quecksilber-unempfindlicher Wasserkanal“ bezeichnet. Die Unempfindlichkeit gegenüber Quecksilber (Hg)=80E resultiert daraus, dass die Hg-Leserichtung „80“ über „08“ ausgeschlossen ist, weil der Kanal eine Schleife bildet, die die Ziffern 0-8 trennt [AQP4 - Aquaporin-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AQP1“=269AS nimmt den rechten Zeilenrand auf, der angrenzend von „AQP4“ nicht erreicht wird. „AQP1“saugt ringförmig das am Rand lesbare Wasser „28“ auf. Weil die Zahl „26“ erzeugt wird, liegt das Protein mit Blut=26 auch in der Membran von roten Blutkörperchen (Erythrozyten). Das Glycerin=C3H8O3=18+8+24=50E ist tangiert, weil im Zählweg die Zahl „40“ an die Spalte 8/2=QS=10 grenzt, womit die Summe=50 entsteht. In der Spalte 0/8 wird das Quecksilber Hg=80 zwar nicht in Leserichtung durchlaufen, aber am Rand liegt die freie Ziffer „7“, die mit QS1+7=8_0 für Hg=80E erzeugt. Eine „intrazelluläre cGMP-aktivierte Kationenkanalaktivität“ wird über „cGMP“=C10H12N5O7P=60+12+35+56+15=178E ausgelöst, das in der Randspalte „07/81“ mit Spalte 7/1 für „17“_QS0+8=8 für „cGMP“=178E entsteht.
Die „Kohlendioxid-Transmembrantransporter-Aktivität“ wird mit CO2=6+16=22E über die Spalte 668/002 mit QS6+6+8_2=22 für „CO2“=22E erzeugt. Bei einer „Ammonium-Transmembrantransporter-Aktivität“ wird das Kation NH4+=7+4=11E von einer Membranseite auf die andere transportiert. Hierzu wird die linke externe Spalte „8/1“ mit der Spiegelung „1/8“ am Rand verglichen, indem die externe Ziffer „1“ über die zentrale Wasserspalte 8/2 mit der internen Ziffer „1“ in eine Beziehung gesetzt wird. In der Spalte „8“66(8)“1“/“1“00(2)“8“ kann somit die NH4+=11 in beide Richtungen gezählt werden, und zwar als QS1+0+0+8_2=“11“ und als 1_Spalte 8/2=QS=10 mit Summe 1+10=“11“. Die „Aktivität eines Kalium-Kanals“ liegt als 19er-Kalium-Ring in der Randspalte 407/681/028, der Kalium in beide Richtungen zählt, und zwar als Spalte 4/6=QS=10_QS0_8+1=9 mit Summe 10+9=Kalium=19E und Randspalte 1/8=QS=9_Spalte 8/2=QS=10 mit Summe 9+10=Kalium=19E. Die „Ephrinrezeptor-Bindung“ aktiviert Rho-GTPase-Proteine, die wiederum das Aktin-Zytoskelett regulieren [Eph-Ephrin-Signalweg in der Entwicklung des Nervensystems - PMC (nih.gov); K.Kramer; März 2016; doi: 10.12688/f1000research.7417.1]. Aktin=374AS liegt in der Spalte Z.38355#_[8]“6“68“[1]/#_“1002“[8] als QS1+0+0+2=“3“_QS6+68=“74“ mit 3_74 für „Aktin“=374AS. „Aktin“ enthält das Tropomyosin als Spirale aus 2 Einheiten mit je 284AS. Diese liegen der Randspalte {2}“4“0“[7]/[66]“8“[1]/[00]“2“[8] absteigend „2“_“8_QS0+4=“4“ für 284AS_paarig=“2“. Folglich liegt „AQP1“=269AS in der Randspalte Z.38354#_[33082]“4“0“[7]/#_[3168]“6“6“81/#_[3051]“002“8, und zwar absteigend als QS0+0+2=“2“_QS6+6=“12“_QS4+0_8=“12“ mit Summe 2+12+12=26_Spalte 1/8=QS=9 mit 26_9 für „AQP1“=269AS [AQP1 - Aquaporin-1 - Homo sapiens (Human) | UniProtKB | UniProt].
In Neuronen ist u.a. das Protein (Mensch) „SCN1A_spannungsgesteuerter Natriumkanal“=2009AS wirksam, wobei „SCN2A“=2005AS und „SCN3A“=2000AS ähnlich sind [Natriumkanal – Wikipedia]. Die Zahl „Calcium=20“ steht mit der „hochspannungsgesteuerten Calciumkanalaktivität“ in Beziehung, die eine Transmembranübertragung eines Calcium-Ions durch einen Hochspannungskanal bedeutet.
Das Calcium liegt im Code, wird aber zunächst unsichtbar über die Ziffer „2“ als Motiv am rechten Rand der Z-Nr.-Matrix fixiert und mittels Nullen aus 2 Kunstgriffen Spalte 5/5=10 für „0“ zur Zahl „200“ ergänzt. Mit den Randziffern QS4+5=“9“ für 2009AS werden exakt die beiden Zeilennummern für das Zentrum der „Gap Junction“ bezeichnet. Am rechten Rand besetzt die Ziffer „3“ eine Lücke für die beiden Spinnentoxine Hm1a=35AS [Delta-theraphotoxin-Hm1a - Heteroscodra maculata (Togo starburst tarantula) | UniProtKB | UniProt]
und Hm1b=34AS [Delta-theraphotoxin-Hm1b - Heteroscodra maculata (Togo starburst tarantula) | UniProtKB | UniProt], so dass der Natriumkanal entweder in der Randspalte „3/4“ für 34AS oder nach links gespiegelt in der Leserichtung 3-5 für 35AS inaktiviert wird. Über diese 4 Zeilen zieht das Natrium als begleitende Aktivität in der Matrix-Spalte Z.(38){3}“5“2“/ Z.(38){3}“5“[3]/ Z.(38){3}“5“4“/ Z.(38){3}“5“5“ als 38=QS=11=Natrium 4-fach mit, wobei die Membran „33“ in 2 Spalten „3/3“ für „33“ vorliegt. „SCN1A“=2009AS als „2“_Spalte 5/5=10 für „0“_ Spalte 5/5=10 für „0“_QS4_5=“9“ mit 2_0_0_9 für „SCN1A_Natriumkanal“=2009AS. Als Besonderheit bildet „SCN1A“ das Natrium auch als QS2+0+0+9=Natrium=“11“ [SCN1A - Sodium channel protein type 1 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Beim Natriumkanal „SCN2A“=2005AS wird die Randziffer „4“ nicht benötigt, so dass über diese mittels Code-Randziffer „#1“ zu Calmodulin=149AS als „14“_QS5+5=10 für „0“_Spalte 3/3/3 mit „14“_Summe 0+9=“9“ für Calmodulin=149AS verarbeitet wird. „Calmodulin“ zeigt, dass die linke Coderand-Serie #1611 das Calcium als „16“_Spalte 11/11=QS=4 mit Summe 16+4=Calcium=20E bildet [SCN2A - Sodium channel protein type 2 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Mit dem Übergriff in den Code #1 dient „SCN2A“ zur Vorbereitung für „SCN3A“=2000AS, so dass sich die Schlussziffer „0“ als Kunstgriff der Schlussziffer „9“ von SCN1A und der Addition mit Übergriff #1 aus QS4_5_#1=10 für „0“ bildet. Folglich sind ebenfalls nur 4 Zeilen erforderlich [SCN3A - Sodium channel protein type 3 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt].
Eine „Gap Junction“ wird in Neuronen als „elektrische Synapse“ bezeichnet. Die 3 für Neuronen beispielhaft benannte Proteine mit den Zusatz „m“=murine (Maus) werden hier hilfsweise für den Menschen mit „Connexin CX36 / CX45“ übernommen, wobei CX45 beim Herzgewebe bekannt ist. Das Connexin „mCX57“ ist mit dem humanen CX62 vergleichbar. „Connexin CX43“ wird ebenfalls in Neuronen exprimiert. Im Ergebnis kann lediglich aufgezeigt werden, dass sich jeweils 6 Connexine zu einem Proteinkomplex als Homohexamer im Code-Zentrum zusammenfügen. Es formiert sich allerdings keine schöne hexamere Rosette. Weil sich die Öffnungsfunktion durch gleichartige Drehung der „6“ Rosetten-Tortenstücke bildet, ist es ausreichend, die Funktion auch nur an „1“ Connexin festzustellen. Diese Betrachtung kann separat in der Z-Nr.-Matrix erfolgen. Die „3“ Neuronen-Proteine formieren sich als Besonderheit am rechten Matrix-Rand. Beim Connexin CX36=321AS ist die Zahlenfolge 1, 2 und 3 und beim CX62=543AS die Folge 3, 4 und 5 direkt aufsteigend ablesbar. Für CX45=396AS sind 4 Zeilen erforderlich, mit „3“_QS4+5=“9“_“6“ für 396AS für die Folge 3, 4, 5 und 6. Der Halbkanal aus 6-fach CX43 bildet mit dem Halbkanal aus 6-fach CX45 eine „heterotypische Gap Junction“ mit erhöhter Leitfähigkeit. Das Protein (Mensch) „CX43_Gap junction alpha-1 protein (GJA1)“=382AS bildet in der Z.-Nr.-Matrix „Z.[38]“3“5“2“/Z.38“3“[5]3“ eine Schleife über die Membranspalte „3/3“ als „3“_QS3+5=“8“_“2“ mit 3_8_2 für CX43=382AS. Die Ziffer „2“ am rechten Zeilenrand wird dann mit der Ziffer „3“ von CX45 als geeigneter Partner fortgeführt [GJA1 - Gap junction alpha-1 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Im Herzgewebe ist außer CX43/CX45 auch das Protein (Mensch) „CX40_Gap-Junction-Protein (GJA5)“=358AS vorhanden. „Connexin CX40“ liegt 5-zeilig mit der Ziffernfolge 3, 4, 5, 6 und 7 am Matrixrand als „3“_Spalte 4/5 für „45“_Spalte 6/7 für „13“ als „3“_Summe 45+13=“58“ mit 3_58 für CX40=358AS [GJA5 - Gap junction alpha-5 protein - Homo sapiens (Human) | UniProtKB | UniProt].
An der Regulierung der Kanalpore ist das Calcium am linken Code-Rand=#16_11/11=QS=4 mit Summe 16+4=Calcium=20E beteiligt. Das Protein (Mensch) „Calm1_Calmodulin“=149AS reagiert mit einer „Konformationsänderung“ aufgrund seiner Bindestellen auf das Calcium. Am Natriumkanal ist ersichtlich, dass „Calmodulin“ die Codeziffer „#1“ verwendet, um dann nach links in die Z.-Nr.-Matrix zu wechseln. Die Konformationsänderung beruht folglich auf eine alternative Leserichtung nach rechts. Dort grenzt ein Hexamer für den Halbkanal (Connexon) an.
Das Protein (Mensch) „Connexin CX45 (GJC1)“=396AS liegt als Monomer 4-zeilig in der Matrix-Spalte Z.[38]{35}{2}#[1]/Z.[38]“3“[5]{“3“}#[1]/Z.[38]{3}[5]{“4“}#{1}/ Z.3835“5“#[1]/Z.[38]{35}{“6“}#[1]/Z.3835“7“#[1], und zwar in der Randspalte als „3“_QS4_5=“9“_“6“ mit 3_9_6 für CX45 (GJC1)“=396AS. Die Vor- und Folgezeile werden erst im Code für das 6-zeilige Hexamer benötigt [GJC1 - Gap junction gamma-1 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Calm1_Calmodulin=149AS startet in Z.3835“4“#“1“ im Code mit der Ziffer #1, um dann in die Randspalte der Z.-Nr.-Matrix zu wechseln, und zwar als #“1“_4_Spalte 5/6=QS=11=QS2_7 mit „14“_Summe 2+7=“9“ für Calm1=149AS [CALM1 - Calmodulin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Um alle 6 Zeilen zu aktivieren, die vom Hexamer besetzt werden, muss ein Schleife in den Zählweg eingefügt werden, und zwar Calm1=149AS als #1_Randspalte 3/4=QS=7_2_QS3+5_3=QS=11=QS=2_Reduzierung mit „1“_Summe 7+2+2=11=QS=“2“_QS3_3+5=QS=11=QS=“2“ mit „1“_Summe 2+2=“4“_Randspalte 5/6=QS=11=QS=2_7 für „14“_Summe 2+7=“9“ mit 14_9 für Calm1=149AS. Über die Schleife wird die Membran „33“ doppelt als Spalte „3/3“ adressiert.
„Calmodulin“ mit Konformationsänderung nach rechts in das Hexamer: #“1“_Kunstgriff 6_Spalte 1/1=2_Spalte 1/1=2 mit #“1“_Summe 6+2+2=10 für „0“_“4“ mit Summe #“1“_Summe 0+4=“4“_QS4+5=“9“_Kunstgriff Spalte 3/3=QS=6_Spalte 3/1=QS=4_0 (Zentralpore) mit „#14“_9_Kunstgriff 6+4+0=10 für „0“ mit „14“_Summe 9+0=“9“ mit 14_9 für Calm1=149AS. In der Zentralspalte „3“3“0“{8}/“3“[168] werden für den Kunstgriff-Ziffern QS3_3+3=“9_0“ (Zentralpore) verwendet. Weil es sich dabei um Noradrenalin=90E handelt, könnte es sich bei der Konformationsänderung um die Öffnung der hexameren Rosette zum Porenkanal handeln. Neben der Zentralpore „0“ liegt die Ziffer „8“ für Adrenalin=98E als QS3_3+3=“9“_QS0 (Zentralpore)+8=“8“ mit 9_8 für Adrenalin=98E. „Adrenalin/Noradrenalin“ aktivieren die „Adrenorezeptoren“. Das Protein (Mensch) „ADRA2A_Alpha-2-Adrenorezeptor“=465AS liegt mit der Zahl „46“ im Zentrum vor und stellt mit der Ziffer „5“ zutreffend die „Noradrenalin-Bindung“ her, und zwar in der Zentralspalte Z.38353#_[3]“46“[9]/#_“3“3“0“[8]/#_“3“1“6“[8]/#_“3“0“5[1] als „46“_QS3+3+0_3+1=10 für „0“_Spalte 6/5=QS=11=QS=2_0_3 mit 46_Summe 0+2+0+3=5 mit 46_5 für „ADRA2A“=465AS [ADRA2A - Alpha-2A adrenergic receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „ADRA2C“=462AS mit „46“_QS0_6_5=11=QS=“2“ für „ADRA2C“=462AS zieht ohne Schleife vertikal durch, und kann daher „Noradrenalin“ nicht binden [ADRA2C - Alpha-2C adrenergic receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „ADRA2B“=450AS gewinnt zwar die Ziffer „5“ über die Spalte 4/3, weicht dann aber ebenfalls nach rechts aus, und zwar als „4“_QS3+0=“3“_Spalte 6/5=QS=11=QS=“2“ mit „4“_Summe 3+2=“5“_“0“ mit 45_0 für „ADRA2B“=450AS [ADRA2B - Alpha-2B adrenergic receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Das „CX45-Hexamer“ formiert sich schleifenförmig als Folge von 6-fach Connexin „CX45_(GJC1)“=396AS in der Spalte Z.38352#_[1]{15}{2}(9)(3)[65]“3“[1]{1}(4)(9)/#_[11]4{8}(73)[4]“6“9“{7}{2}(2)(4)/#_[11]4{45}(3)(3)[08]{2}[40](7)/#_[11]40{3}3[168]{6}6[8](1)/#_[11]“3“6“1“3“0“5“1“0“0“[28]/#_[11]“3“[1929552432], und zwar als Fall „CX45/1“ (links oben) absteigend mit Ziffer „3“ in Z.38355 mit „3“_QS4+5=“9“_Kunstgriff Spalte 2/8=10 für „0“_QS1+5=“6“ mit „39“_Summe 0+6=“6“ mit 39_6 für „CX45/1“ {}=396AS. Fall „CX45/2“ (Mitte links, oben) aufsteigend 3_9_Kunstgriff 7+3=10 für „0“_QS3+3=6 mit „39“_Summe 0+6=“6“ mit 39_6 für Fall „CX45/2“ ()=396AS; Fall „CX45/3“ (Mitte, oben) aufsteigend als 3_9_6 für „CX45/3“ („“)=396AS; Fall „CX45/4“ (Mitte rechts, oben) aufsteigend über Spalte 1/2=QS=“3“_Spalte 7/2=QS=“9“_“6“ mit 3_9_6 für CX45/4 {}=396AS. Fall „CX45/5“ (rechter Rand) ab Z.38355 absteigend „1“_Spalte 4/7=QS=11=QS=“2“ mit Summe 1+2=“3“_“9“_Spalte 4/2=“6“ mit 3_9_6 für CX45/5 ()=396AS; Fall „CX45/6“ (unten) von links nach rechts als „3“_QS3+6=“9“_Kunstgriff QS1+3+0+5+1+0+0=10 für „0“_“6“ mit „39“_Summe 0+6=“6“ mit 39_6 für CX45/6 („“)=396AS.
Im Unterschied zu CX45/CX40 kann CX43 durch „Insulin“ und „Wachstumsfaktoren“ stimuliert werden, „Gap Junction“ vermehrt zu bilden [„Expression der Connexine 40, 43 und 45 unter chronischer Stimulation durch Insulin und die Wachstumsfaktoren IGF-1, VEGF, TGF-β und FGF-2 bei neonatalen Rattenkardiomyozyten“; Diss. M.Neef; Aug 2016; Uni Leipzig]. „Connexin 43 (Cx43), ein Astrozytenprotein, fungiert als offene Pore, über die toxische Substanzen aus den Astrozyten zu Motoneuronen gelangen“ [Das Andocken von Insulin im offenen Hemikanal von Connexin 43 kann das Risiko einer amyotrophen Lateralsklerose (PMC) verringern (www-ncbi-nlm-nih-gov.translate.goog); S. Lehrer u.a.; März 2023; doi: 10.21873/invivo.13112]. „Motoneurone sind Neurone, deren Axone in die Skelettmuskeln ziehen und diese innervieren. Ihre Zellkörper liegen im Vorderhorn des Rückenmarks“ [Motoneurone und Messung des Muskelstatus - via medici (thieme.de)]. Das „CX43-Hexamer“ aus Protein (Mensch) „CX43_(GJA1)“=382AS sitzt mit einem zentralen „CX43“ exakt auf der Zentralpore „0“ und ordnet die „5“ weiteren „CX43“ sternförmig an [GJA1 - Gap junction alpha-1 protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das „CX43-Hexamer“ liegt in der Spalte Z.38352#_[1152]“9“3“[65](3)(1)[149]/#_[1]{1}[48]“73“[469](7)(2)[24]/#_[1]{1}{44}[5](3){3}{0}{8}{2}407/#_[114]{0}{3}(3)[1]“6“8“[6681]/#_[11361](3)[0]“5“1“0“0“2“[8]/#_[11319](29)(55)(2)[432], und zwar mit Fall „CX43/1“ (links) absteigend von Z.38355 als „3“_QS0_4+4=“8“_QS1+1=“2“ mit 3_8_2 für „CX43/1“ {}=382AS; Fall „CX43/2“ (Mitte, links oben) als „3“_QS9_73=“82“ mit 3_82 für „CX43/2“ („“)= 382AS; Fall „CX43/3“ (rechts, oben) als „3“_QS1+7=“8“_“2“ mit 3_8_2 für „CX43/3“ ()= 382AS; Fall „CX43/4“ (Zentrum) „3“_QS0!+8=“8“_“2“ mit 3_8_2 für „CX43/4“ {}= 382AS; Fall „CX43/5“ (links, unten) als „3“_Spalte 3/3=QS=6_QS2+9=11=QS=2 mit „3“_Summe 6+2=“8“_Kunstgriff QS5+5=10 für 0_2 mit 38_Summe 0+2=“2“ mit 38_2 für „CX43/5“ ()=382AS; Fall „CX43/6“ (rechts, unten) mit QS1+0+0+2=3_8_Spalte 6/5=QS=11=QS=2 mit 3_8_2 für „CX43/6“ („“)=382AS.
Das Hormon (Mensch) „Insulin (INS)“=110AS liegt in der Spalte Z.38354#_0/#_6/#_5 als
Spalte 6/5=QS=11_0 für Insulin=110AS, wobei die Ziffer „0“ die zentrale Kanalpore „0“ besetzt [ INS - Insulin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IGF-1_ Insulin-like growth factor 1“=195AS wird u.a. in Motoneuronen exprimiert und liegt seitlich neben dem „Insulin“ in der Spalte Z.38354#_{5}{3}[3]“0“/#_[3]{3}{1}“6“/#_[1]{3}{0}“5“als „1“_QS0_3_3_3=9_5 mit 19_5 für „IGF-1“ {}=195AS. „Aktiviert IGFR1, MAPK3/ERK1, MAPK1/ERK2 und AKT1“ [IGF1 - Insulin-like growth factor I - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IGFR1_IGF_Rezeptor1“=355AS wird aktiviert über die Spalte Z.38354#_[5]“3“3“0“[824]/#_[331]“6“[866]/#_[130]“5“[100]/#_[929]“5“[524]/#_[7288138] als „3“_QS3+0=“3“_QS6_5=11=QS=“2“ mit „3“_Summe 3+2=“5“_“5“ mit 35_5 für „IGFR1“=355AS [IGFLR1 - IGF-like family receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der aktivierte Rezeptor „IGFR1“ bindet „IGFL1“=110AS {links an „5/5“ als 29=QS=“11“_“0“ für IGFL1=110AS [IGFL1 - Insulin growth factor-like family member 1 - Homo sapiens (Human) | UniProtKB | UniProt]}, das „IGFL3“=125AS {rechts an 5/5 als QS10_2=12_5 für IGFL3=125AS [IGFL3 - Insulin growth factor-like family member 3 - Homo sapiens (Human) | UniProtKB | UniProt]} und schwächer das „IGFL2“=119AS {schmal unten an Ziffer „5“ als 38=QS=11_QS8+1=9 mit 11_9 für IGFL2=119AS [IGFL2 - Insulin growth factor-like family member 2 - Homo sapiens (Human) | UniProtKB | UniProt]}. Das „CX43-Hexamer“ wird weiterhin von „ERK (extracellular-signal regulated kinase)“ stimuliert. Das Protein (Mensch) „ERK-2“=360AS ist eine Serin/Threonin-Kinase, so dass die Spalte „6/5“ durch Serin=56E besetzt wird. Threonin=64E folgt in der Spalte 33/31 als QS3+3=6_QS3+1=4 mit 6_4 für Threonin=64E. Das ATP=260E ist zwar in der Spalte 2/6/0 lesbar, wird aber über das Serin dichter herangezogen, und zwar als Spalte 2/6 für „26“_8_Spalte 6/5=QS=11=QS=2 mit „26“_Summe 8+2=10 für „0“ als 26_0 für ATP=260E. ADP als QS6+8+6=“22“_“0“ (zentrale Kanalpore „0!“) für ADP=220E. „ERK-2“ wird inaktiviert durch „Pyrimidylpyrrol-Inhibitoren (Hemmer)“. Mit Pyrrolo[2,3-d]pyrimidin= C6H5N3=36+5+21=62E [7H-Pyrrolo[2,3-d]pyrimidin | C6H5N3 | CID-261591 - PubChem (nih.gov)] in Z.38356#[30]{51002} mit QS5+1=6_QS0+0+2=2 mit 6_2 für Hemmer=62E. Hierbei wird die Position für den Cofaktor „Magnesium“ mit „1“_QS0+0+2=“2“ mit „1“_“2“ für Magnesium=12E disfunktional für ERK-2 besetzt. Folglich liegt das Protein (Mensch) „ERK-2 (MAPK1)“=360E in der Spalte Z.38354#[53]“3“0“8“2“[407]/#_[331]“6“8“6“[681]/#_[130]“5“(1002)[8], und zwar als „3“_Kunstgriff QS0!+8+2=10 für 0_6 mit „3“_Summe 0+6=“6“_8_Spalte 5/6=QS=11=QS=2 mit „36“_Summe 8+2=10 für „0“ als 36_0 für „ERK-2“=360AS [MAPK1 - Mitogen-activated protein kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „AKT1“=480AS liegt mit einer ATP-Bindung in der Spalte Z.38354#_53308/#_33168/#_13051, und zwar über Spalte 3/1=QS=“4“_QS0+8=“8“_8_Spalte 6/5=QS=11=QS=2 mit „48“_Summe 8+2=10 für „0“ mit 48_0 für AKT1=480AS [AKT1 - RAC-alpha serine/threonine-protein kinase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FGF2_Fibroblast Wachstumsfaktor“=288E vermittelt die Phosphorylierung von „ERK-2“. „FGF2“ ist Zeit- und Temperatur-abhängig. In der Randspalte [86]“6“(8)[1]/{10“0“}“2“8“ wird die Temperaturbasis 100°Celcius als {100} mit der Spalte „6/0“ für die Zeitbasis=“60“s kombiniert. „FGF2“ inaktiviert nach 3 Minuten bei 60 Grad Celsius oder 1 Minute bei 80 Grad Celsius“. Die Kombination „1“ Minute bei 80°Celcius ist zutreffend, weil die Zahl 80°C mit „8“_QS2+8=10 für “0“ mit 8_0 für 80°C sowohl an 100°C als Bezug als auch an 60 Sekunden grenzt. Die „3“ Minuten liegen als 3*60=180 Sekunden als „1_8“_QS2+8=10 für „0“ als 180 Sekunden. Im Wechsel dient die Zeitbasis=60 dabei als 60° Celsius. Diese Abhängigkeit wirkt analog zu einem „Cofaktor“, um das Protein zu lokalisieren. „FGF2“ bindet Heparin=C26H41NO34S4=156+41+7+272+64=540E [Heparin | 9005-49-6 (chemicalbook.com)], und zwar in der Spalte „3“0“/“1“[6]/“0“5“ als 5_QS0_1_3=“4“_“0“ mit 5_4_0 für Heparin=540E. „FGF2“ ist Ligand von „ITGAV_Integrin“=1048AS. „ITGAV“ muss sich aufgrund der Calcium-Bindung an den Serienrand #1611 legen, und zwar in der Spalte Z.38354#1611“4“4“[5330]/#_[1611]“4“0“[3316]/#[16113)“6“1“3“0“[5] über Spalte 1/0 für „10“_QS1+3=“4“_Kunstgriff Spalte 0/6=QS=6_4 mit Summe 6+4=10 für „0“_QS4+4=8 mit 104_Summe 0+8=“8“ mit 104_8 für „ITGAV“=1048AS [ITGAV - Integrin alpha-V - Homo sapiens (Human) | UniProtKB | UniProt]. Folglich bildet „FGF2“=288AS eine Schleife, in der die Temperaturbasis 100°Celsius eingeklemmt wird, und zwar in der Spalte Z.38354#_[4453]“3“0“8“2“4“[07]/#_[4033]“1“6“866“8“[1]/#_[361]“3“0“5“[100]“2“[8] über Spalte 8/2 für „28“_1. Kunstgriff Spalte 4/6=QS=10 für „0“_2. Kunstgriff QS8+2=10 für „0“_3. Kunstgriff QS3+0_1+6=10 für „0“_QS3+0+5=“8“ mit „28“_Summe 0+0+0+8=“8“ mit 28_8 für „FGF2“=288AS [FGF2 - Fibroblast growth factor 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Connexin CX36“=321AS liegt als Monomer im der Z.-Nr.-Matrix aufsteigend in der Randspalte Z.3835“1“/_“2“/_“3“, jedoch formiert sich das CX36-Hexamer unpassend erst später. Das Monomer kann mit der Ziffer „3“ aufsteigend starten, die Randziffern seitlich über 2 Kunstgriffe 5/5=10 für „0“ umgehen und mit den Randziffern QS6+7+8=“21“ bilden als „3“_Summe 0+0+21=“21“ mit CX36=321AS (Monomer) [GJD2 - Gap junction delta-2 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Die Erzeugung der Zahl „21“ bleibt als Ziel im CX36-Hexamer erhalten. Das CX36-Hexamer legt 3 Untereinheiten mit je 321AS an den linken Code-Rand in der Spalte Z.38354#{1}{6114}[45]/#_{1}(6)(1)(14)(0)(3)/#{1}[6]“11“3“6“1“/#[1611]“3“1“9“, und zwar als Fall CX36/1 absteigend als Spalte 1/1/1=QS=“3“_QS6+1+14=“21“ mit 3_21 für CX36/1 {} =321AS; Fall CX36/2 mit „3“_(links von 3) QS6+1+14+0=“21“ mit 3_21 für CX36/2 ()=321AS; Fall CX36/3 absteigend mit „3“_Kunstgriff QS1+9=10 für „0“_QS11+3+6+1=“21“ mit „3“_Summe 0+21=“21“ mit 3_21 für CX36/3 (““) =321AS. Das CX36-Hexamer legt „3“ weitere Untereinheiten mit je 321AS an den rechten Codenrand in der Spalte Z.38354#_[3]3}{082}[407]/#_[3]“16“[8]{6681}/#_“3“0“5“(1)(00)(2)(8)/#_(29)(55)(2)(4)(3)(2), und zwar mit CX36/4 rechts, oben als „3“_Kunstgriff QS0!+8+2=10 für „0“_QS6+6+8+1=“21“ mit „3“_Summe 0+21=“21“ mit 3_21 für CX36/4 {}=321AS; CX36/5 rechts, unten mit QS2+9=11=QS=“2“_Kunstgriff QS5+5=10 für „0“_QS1+0+0=“1“ mit Summe 2+0+1=“3“_QS2+8=10_QS2+4+3+2=11 mit „3“_Summe 10+11=“21“ mit 3_21 für CX36/5 ()= 321AS; CX36/6 zentral als „3“_QS 0(alternative Kanalpore) + 5_16=“21“ mit 3_21 für CX36/6 („“)=321AS. Die Ursache zur Bildung einer Oberflächen-Rosette ist hier noch unbekannt, grundsätzlich kann einem Halbkanal aber das Motiv unterstellt werden, die 6-fache Einzelzählung durch eine Summenbildung zum Komplex zu verbinden, der ringförmig darstellbar ist. Für den CX36-Halbkanal ergeben sich als Summe 6-fach 321AS=1926AS. Der summarische CX-Halbkanal liegt somit ringförmig in der Spalte Z.38354#_[445]“3“3“0“8“2“/#_[40]“3“3“[168]“6“/#_[36]“1“3“[05]“1“0“/#_[319]“2“9“5“5“[2], und zwar absteigend als QS 5+5_1+0_6_2=“19“_aufsteigend QS3+0+8=11_QS3_3+3_1+3=13_QS2+9=11=QS=2 mit „19“_Summe 11+13+2=26 mit 19_26 für „CX36-Hexamer“=1926AS (Summe).
Im Labor wird eine „Gap Junction“ mittels Ablagerung eines Färbemittel in der „Lücke“ durch „Lanthanum (III) Nitrat Hexahydrat=H12LaN3O15=12+57+21+120=210E nachgewiesen [Der Nachweis komplexer Gap Junctions zwischen den Zellen des Schmelzorgans mit Lanthannitrat - ScienceDirect; P. Garant (1972); https://doi.org/10.1016/S0022-5320(72)90105-0]. Darin sind enthalten: La(NO3)3 * 6 H2O=57 + (7+24)*3=57+ (31)*3=57+93=150+ 60=210E. Der Wasseranteil 6* (H2O)=60E verteilt sich auf beide Halbkanal-Enden, so dass die Zahl „30“ kein Zink, sondern das 3-fache Wasser darstellt. Das hat den Vorteil, dass „3“30“ nicht zwingend eine Membran „33“ darstellen muss, d.h. es handelt sich um den Halbkanal und nicht insgesamt um eine „Gap Junction“. Diese entsteht erst durch Kooperation an der Lücke. Mit dem Wasserbezug enthalten „Gap Junctions“ hydrophile Kanäle. „Lanthanum (III) Nitrat Hexahydrat“=210E wird zusammengesetzt aus dem Nitrat-Rest QS4_33_53_3=“93“_Wasserspalte QS29_0_1_30=“60“_Lanthan QS6_51=“57“ mit Summe 93+60+57=210E. Das „Uranylacetat-Dihydrat“=C4H6O6U+2-fach Wasser=24+6+48+92+2*(2+8)=170+20=190E lagert sich als Färbemittel ebenfalls in der „Lücke“ mikroskopisch sichtbar ab. „Uranylacetat-Dihydrat“ mit beidseitig Wasser=28 (Symbol) und Uran=92E über „82 -> 92 -> 28“ in der Randspalte Z.38354#_“0“82“[407]/#_ „6“86“6“[81]/#_[510]“0“2“8“, und zwar aufsteigend als „82“ (Wasser gespiegelt)_über Kanalpore „0“ in Spalte 0!/6=QS=“6“_Uran QS86+6_0=92_Wasser QS2+8=10 mit Summe 82+6+92+10=“190“ für „Uranylacetat-Dihydrat“=190E.
Die Familie der „Pannexine“ (Panx1, Panx2, Panx3) ist mit den Connexinen verwandt. Diese bilden statt einem Zellkontakt über „Gap Junctions“ hauptsächlich nur Hemikanäle für den Transmembrantransport von ATP. “Panx1“ und „Panx3“ können „Gap Junctions“ bilden [Grenzen | Mögliche Rolle von Halbkanälen bei Krebs (frontiersin.org); K. Schalper: Jun. 2014; https://doi.org/10.3389/fphys.2014.00237].
Unregulierte Kanalöffnungen führen zu Erkrankungen. Die Kanalöffnung ist von der Calcium-Konzentration abhängig. Speziell ist „Panx2“ an der Differenzierung von „Neuronen“ beteiligt. Gemischte Kanäle (Panx1/Panx2) sind möglich. „Panx1“ interagiert mit Aktin=374AS [Die Biochemie und Funktion von Pannexin-Kanälen - ScienceDirect: D. Gutsherr u.a.; Jan. 2013; https://doi.org/10.1016/j.bbamem.2012.01.017]. Das Arzneimittel „Probenecid“=C13H19NO4S=78+19+7+32+16=152E gegen Gicht-Erkrankung ist geeignet, zwischen den Kanälen von Connexinen und Pannexinen zu unterscheiden [Pannexin – Wikipedia]. „Probenecid“ hemmt den Panx1-Kanal. Das Protein (Mensch) „Panx1“=426AS spannt sich in der Spalte Z.38355#[16]“1“1“4“[0331686681] /#[1611]“36“1“3“{(0)(5)(1)}{0}[028]/#[1611319]{(„2“9“)}[552432] vom Serienrand #1611 (enthält Calcium) bis zum ATP {}=260E als 29=QS=11=“2“_QS0+5+1=6_0 mit 2_6_0 für ATP=260E. Das „Probenecid“=152E zählt gegenläufig zum ATP als 1_5 _QS0_2+9=11=QS=“2“ für „Probenecid“ ()= 152E. Die Zahl „29“ gehört zum „Panx1“, so dass der Kanal gehemmt wird. Panx1=426AS als QS1+1+4=6_36 mit Summe 6+36=“42“_QS1+3=“4“_29=QS=11=QS=“2“ mit 42_Summe 4+2=6 mit 42_6 für Panx1=426AS [PANX1 - Pannexin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Panx1“ fügt sich 7-teilig zum Homo-Heptamer zusammen, weil in der oberen Reihe „4“ statt „3“ Panx1 angeordnet werden. Das ist aber nur erforderlich, weil das 5. Protein zur Fortsetzung ebenfalls den rechten Rand besetzt. Für die Kopplung mit „Panx2“ ist ein „Panx1-Trimer“ausreichend.
„Panx1“ bildet das „Panx1-Trimer“, indem seitlich 2-fach „Panx1“ angefügt wird, und zwar in der Randspalte als Z.38355#_{3}{1}{6}[8](6)“6“[81]/#_[30]{5}{1}(0)“0“2“8“/#_[295]{5}(2)(4)“32“ mit Fall 2/Panx1=426AS als QS3+1=“4“_Spalte 6/5=QS=11=QS=“2“_Spalte 1/5=QS=“6“ mit 4_2_6 für „Panx1“/2 {} =426AS; mit Fall 3/ Panx1=426AS absteigend „4“_über Spalte 6/0/2 mit „2“_QS0_6=“6“ mit 4_2_6 für „Panx1“/3 () =426AS. Das „Aktin“ bindet an Panx1(Fall1) in der Spalte Z.38355#_[1](1)(“4“)(“0“)“3“(3)(1)/#_[113](“6“)(“1“)(3)[0] mit Aktin=374AS als „3“_QS0_6+1=7_4 für Aktin=374AS. Das integrierte Tropomyosin=568AS ist enthalten, als QS1+4=“5“_Spalte 0/6=QS=“6“_QS1+3_3+1=“8“ mit 5_6_8 für Tropomyosin ()=568AS. Für ein Homo-Heptamer liegt Fall 4 /„Panx1“=426AS am rechten Rand als QS32_0+2+8=42_6 für Panx1“/4 („“) =426AS.
Zweckdienlich entsteht ein „gemischter hexamerer Hemikanal (Panx1/Panx2)“, in dem sich 2 verschiedene Trimere vereinen. Das Protein (Mensch) „Panx2“=677AS enthält den Nerv=“7“ als Motiv, und zwar in der Spalte Z.38357#[1611]“31“9“[29][5][52432] /#[1611]“27“{7}[288138](7)[6]/#[16]“1“1“2“3“{52}{8}(2)(9)(43)(4)[1]/#[16111932]{7}(9)(9)[3812] mit Fall1/„Panx2“=677AS als QS 9_31_27=“67“_QS1+1+2+3=“7“ mit 67_7 für „Panx2“/1 („“) = 677AS; Fall2/„Panx2“=677AS als QS7_52+8=67_7 für „Panx2“/2 {} = 677AS; Fall3/„Panx2“=677AS als QS9+9=18_29=QS=11=QS=2 mit Summe 18+2=“20“_QS43+4=“47“ mit Summe 20+47=“67“_“7“ für „Panx2“/3 () = 677AS [PANX2 - Pannexin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Ergebnis wird ein „mentales Loch“ im Nervensystem erzeugt: Unter der Struktur „5“ zieht sich eine „Informations-Lücke“, die von Nerv=Form=“7“ eingeklammert wird, und zwar als Leere (7)„288138“(7). Es wird damit die sinnvolle Botschaft „paarig=2_Extra=8_Schwerachse 8_QS1+3=4 für 84 (Symbol)_Extra=8 für Symmetrie“ transportiert, nach der sich die Axone an der Mittellinie des Körpers orientieren.
Der hälftig gemischte hexamere Hemikanal „Panx1/Panx2“ enthält 3*426AS + 3*677AS=1278+2031=“3305“AS. Eine Rosette ergibt sich, weil sich daraus ein Ring für Kreis=64 (Symbol) formieren lässt. Die Ziffer 7=Nerv=Form wird eingeschlossen, und zwar in der Spalte Z.38356#[361]“3“0“/#_“3“1“9“2“9“/#_“27“[7]“2“8“/#_[2]“3“5“2“8“/#_[19]“3“2“[7] aufsteigend als 1. Kunstgriff QS1+9=10 für „0“(Ring)_3_27_3 mit Summe 0+3+27+3=33_2. Kunstgriff QS5_3+2=10 für „0“_3.Kunstgriff QS2+8=10 für „0“_4.Kunstgriff QS2+8=10 für „0“_mit „33“_Summe 0+0+0=“0“_29=QS=11=QS=“2“_QS3+0=“3“ mit Ring als „330“_Summe 2+3=“5“ mit 330_5 für ringförmige 6-teilige Rosette „Panx1/Panx2“ =3305AS.
„Panx1“ bildet nicht - wie bisher angenommen - hexamere Kanäle, sondern eindeutig heptamere (7) Kanäle. Bei „Panx2“ werden oktamere (8) Kanäle vermutet [Structural and functional analysis of human pannexin 2 channel - PMC (nih.gov); Z. He u.a.; März 2023; doi: 10.1038/s41467-023-37413-z].
Das Gen „PANX2“ codiert für ein weiteres Protein (Mensch) „PANX2 protein_Q495U3“=354AS, das eine positive Regulation der Produktion von „Interleukin-1 (IL1)“ und Wechselwirkungen zeigt, und zwar mit Q9Y649 [Gw128=63AS], UBQL1 [Ubiquilin-1=589AS], BANP=519AS, NRF1[Nukleärer respiratorischer Faktor 1=503AS], NMDE3 [Glutamatrezeptor ionotrop, NMDA 2C=1233AS_Ligand Calcium], ATX1[Ataxin-1=815AS], FGFR3 [Fibroblasten-Wachstumsfaktor-Rezeptor 3=806AS], GELS [Gelsolin=782AS], CRYAA [Alpha-Crystallin-A-Kette=173AS]. Interleukin-1 =152AS besetzt die Position des Arzneimittels „Probenecid“=152E, weil der Interleukin-1-Rezeptor „ILR1“=569AS dort vorliegt, und zwar in der Randspalte Z.38356#_130{5}{1}0028/#_9295{5}2432/#_728{8}{1}3876 als „5“_Spalte 1/5=QS=6_QS8+1=9 mit 5_6_9 für „ILR1“ {}=569AS. „PANX2_Protein _Q495U3“=354AS zieht dann in die „mentale Lücke“, um darin die Zahlen „81-38“ zu besetzen, und zwar als QS1+0+0+2=“3“_52_QS3+8=11=QS=2 mit 3_Summe 52+2=54 mit 3_54 für „PANX2_Q495U3“=354AS [PANX2 - PANX2 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Bemerkenswert ist der Glutamatrezeptor „NMDA 2C“=1233AS, der einen Ring um Ziffer „0“ legt, wobei das „Calcium“=20E die Ziffer „0“ als Ligand benötigt mit 29=QS=11=QS=“2“_“0“ für Calcium=20E. Das Glutamat/Glutaminsäure=C5H9NO4=78E liegt im Ring als QS1+6=“7“_QS0_29=QS=11=QS=“2“_Spalte 3/3=QS=6 mit 7_Summe 0+2+6=8 für Glutamat=78E. „NMDA 2C“=1233AS liegt ringförmig in der Spalte Z.38355#“33“1“6“[86681]/#[1]“3“[0]“5“[10028]/#_[9]“2“9“5“[52432], und zwar als QS1+6_5=12_Kunstgriff 5_29=QS=11=QS=2_3 mit 12_Summe 5+2+3=10 für „0“_33 mit 12_Summe 0+33=“33“ für „NMDA 2C“=1233AS. „UBQL1_Ubiquilin-1 (UBQLN1)“=589AS liegt seitlich in der Spalte Z.38356#_6130/#_1929 mit Ubiquitin=76AS als Spalte 6/1=QS=“7“_QS1+3_2=“6“ mit 7_6 für „Ubiquitin“=76AS. „UBQL1“=589AS ringförmig über Spalte 3/2=QS=5_9_QS1_6+1=8 mit 5_9_8 für „UBQL1“=589AS. In dieser Spalte ist das CRYAA=173AS aufgrund der Bindung an Zink=30E mit enthalten, und zwar als 1_QS6+1=7_3[0] mit 1_7_3 für CRYAA=173AS.
„PANX2_Q495U3“ (!!)=354AS“ interagiert in der Spalte Z.38356#_[5](!1!)(!0!)(!0!)(!2!)(8)/#_[5](!5!)(!2!)(4)[3](2)/#_81{!3!}{!8!}[7](6)/#_29{4}{3}{4}{1} mit ATX1. Das Protein (Mensch) „ATX1-Ataxin-1“=815AS ist mit CIC und ATXN1L an der Entwicklung des Gehirns beteiligt. „ATX1“ als QS3+4+1=“8“_Spalte 3/4=QS=“7“_“8“ mit „8“_Summe 7+8=“15“ mit 8_15 für „ATX1“ {}=815AS [ATXN1 - Ataxin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „ATX1“ bindet vorgelagert an „Hey1“ in der Spalte „0“28“/“4“[3]“2“ als QS28+2=30_Spalte 0/4=QS=4 mit 30_4 für Hey1=304AS [HEY1 - Hairy/enhancer-of-split related with YRPW motif protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ATXN1L“=689AS bindet an „Hey2“=337AS in der Spalte „1“0“0“2“8“/“5“2“[4]“3“[2] als „3“_QS1+0+0+2=“3“_QS5+2=“7“ mit 33_7 für „Hey2“=337AS [HEY2 - Hairy/enhancer-of-split related with YRPW motif protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Folglich liegt „ATXN1L“=689AS in der „Panx2_Spalte“ ringförmig als „6“_Kunstgriff Spalte 8/2=QS=10 für „0“_QS1+0+0+2_5=“8“_QS2+4+3=“9“ mit 6_8_9 für ATXN1L ()=689AS [ATXN1L - Ataxin-1-like - Homo sapiens (Human) | UniProtKB | UniProt]. Der Transkriptionsrepressor, Protein (Mensch) „CIC_Capicua“=1608AS [cap-i-cua = "Kopf und Zahl"] offenbart keine Merkmale. Zur Entwicklung des zentralen Nervensystems (ZNS) ist eine Orientierung an der Mittellinie erforderlich. Diese wird dargestellt, wenn eine Kette beidseitig die Schwerachse „84“ ergibt. In diese Kette schiebt sich „CIC“ hinein. „Schwerachsen-Kette“ 3-fach „84“, und zwar aufsteigend von Z.38355 über Spalte 8/2 für 82_QS0+0_2=“2“ mit Summe 82+2=“84“_rechts Spalte 4/8 für „84“_QS1+3=4_8 gespiegelt für „84“. Folglich ergibt sich „CIC“=1608AS als QS8+2=“10“_“6“ mit Summe 10+6=“16“_“0“_QS2+4=“6“_38=QS=11=QS=“2“ mit „160“_Summe 6+2=“8“ für „CIC“ („“)=1608AS [CIC - Protein capicua homolog - Homo sapiens (Human) | UniProtKB | UniProt]. „CIC“ bindet das Protein (Mensch) „Sin3-Histon-Deacetylase-Corepressor-Komplexkomponente SDS3“=328AS am Zeilenrand in der Spalte [2](8)/(32) als 32_8 für „SIN3-HDAC“=328AS [SUDS3 - Sin3 histone deacetylase corepressor complex component SDS3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Expression des Proteins (Mensch) „VGF“=615AS wird von „CIC“ verhindert, weil „VGF“ die „SIN3“-Zahl „32“ als Startziffer benötigt [CIC is a critical regulator of neuronal differentiation - PubMed (nih.gov); J. Paik u.a., Mai 2020; DOI: 10.1172/jci.insight.135826]. „VGF“=615AS liegt mit „SIN3“ und „CIC“ in der Spalte Z.38354#_[6]“6“8“[1]/#_[0]“0“2“(8)/#_“2“4“{(32)}/#_“3“{“8“}{7}{6}/#_[4]{3}{4}{1}/#_{38}{1}{2} als QS32_7+6=“45“_Spalte 8/3=QS=“11“_QS4+1=“5“ mit Summe 45+11+5=“61“_QS1+2=“3“_38=QS=11=QS=“2“ mit „61“_Summe 3+2=“5“ mit 61_5 für „VGF“ {} =615AS. „VGF“ zeigt als Merkmal eine Insulin-Sekretion, die mit dem Hormon (Mensch) „Insulin (INS)“=110AS im Zählweg liegt, und zwar als QS32+76=“108“_Spalte 3/8=QS=11=QS=“2“ mit Summe 108+2=“110“ für „INS“=110AS liegt [VGF - Neurosecretory protein VGF - Homo sapiens (Human) | UniProtKB | UniProt].
Für das „Panx1-Heptamer“ wird die 2. Reihe mit den Fällen 5, 6 und 7 ergänzt, und zwar in der Spalte Z.38357#_[3]“1“9“[29552432]/#_[2]“7“7“[2881]{38}{7}[6]/#_[2]“3“5“(2)(8)(2)(9){4}{3}{4}[1]/#_[1]“9“3“(2)[79](9)(3){8}[12]/#_[1]“5“1“(2)[79](1)(2){2}[71] mit Fall 5/“Panx1“=426AS als Schleife absteigend mit QS4_38=“42“_aufsteigend Spalte 7/4=QS=11=QS=“2“_Spalte 3/8=QS=11=QS=“2“_“2“ mit „42“_Summe 2+2+2=“6“ mit 42_6 für „Panx1“/5 {}=426AS. Fall 6/“Panx1“=426AS über Spalte 3/2 für 32_Spalte 9/1=QS=10 nit Summe 32+10=“42“_Brücke 29=QS=11=QS=“2“_Kunstgriff QS2+8=10 für „0“_Spalte 2/2=QS=“4“ mit „42“_Summe 2+0+4=“6“ mit 42_6 für „Panx1“/6 () =426AS. Fall 7/“Panx1“=426AS als Schleife aufsteigend Spalte 3/1=“4“_ absteigend Spalte 9/5=QS=“14“_Kunstgriff Spalte 7/3=QS=10 für „0“_QS1+9=10 für „0“(Ringschluss_Bindung an Fall 1)_aufsteigend Spalte 7/5=QS=“12“ mit 4_Summe 14+12=“26“ mit 4_26 für „Panx1“/7 („“) =426AS. Unter der Brücke bleibt die Spalte „79/79“ unbesetzt, die mit QS7+9=16_QS7+9=16=Schwefel eine Disulfidbrücke darstellen kann. Die Engstelle im Kanal wird durch die Aminosäure „Tryptophan (Trp/W)“ =C11H12N2O2=66+12+14+16=108E ausgekleidet, wodurch die innen eingeschlossene leere Kammer {2881} funktionell geöffnet wird, und zwar in der Spalte Z.38356#_[305]“1“[0028]/_[29]“5“5“[2432]/#_{28“8“1}[3876] mit „Tryptophan“ über Spalte 1/5 als „1“_QS5+5=10 für „0“_“8“ mit 1_0_8 für „Tryptophan“=108E. Das Proteine „Caspase-3“ spaltet das „Panx-1“, so dass ein offener Kanal entsteht, von dem bei der Apoptose ein „Find me“-Signal an Makrophagen gesendet wird [Pannexin-1-Kanäle vermitteln die Freisetzung von „Find-Me“-Signalen und die Membranpermeabilität während der Apoptose – PubMed (pubmed-ncbi-nlm-nih-gov.translate.goog); F. Chekeni; Okt.2010; DOI: 10.1038/nature09413]. Am apoptotischen Prozess ist das Cystein=C3H7NO2S=18+7+7+16+16=64E beteiligt, so dass das „Cystein“ {} =64E [Thioalkohol] in der Cystein-Achse „6/0/4“ als Kunstgriff für „CASP3“ mitgezählt werden kann. Das Protein (Mensch) „CASP3_Caspase-3“=277AS schneidet das Panx1-Heptamer vertikal komplett durch, und zwar in der Randspalte Z.38355#_[6]{6}[81]/#_[0]{0}[28]/#_“2“{4}[32]/#_“3“(8)[76]/#_“4“[341]/#_“3“812/#_“2“(“2“)(7)(1) als Kunstgriff QS{6_0_4}=10 für „0“ _“2“ mit Summe 0+2=“2“_Spalte 3/4=QS=“7“_Spalte 3/2=QS=“5“_“2“ mit „27“_Summe 5+2=“7“ mit 27_7 für „CASP3“=277AS [CASP3 - Caspase-3 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Todesrezeptor „TNFRSF1A“=455AS bindet in der Spalte Z.38355#_[51}“0“0“2“[8]/#_“55“2“[432] an der Startziffer „2“ von „CASP3“ als QS0+0+2=“2“_“2“ mit Summe 2+2=“4“_“55“ für „TNFRSF1A“= 455AS [TNFRSF1A - Tumor necrosis factor receptor superfamily member 1A - Homo sapiens (Human) | UniProtKB | UniProt]. Der Ligand vom Rezeptor „TNFRSF1A“ ist das Protein (Mensch) „TNF-alpha (Kachektin)“=233AS, das am rechten Rand beginnt, als „2“_“3“_QS1+0+0+2=“3“ mit 23_3 für„TNF-alpha {}=233AS [TNF - Tumor necrosis factor - Homo sapiens (Human) | UniProtKB | UniProt]. „Caspase-3“ wird gehemmt, wenn die Schlussziffer „2“ von Isatinsulfonamid= C14H16N2O5S=84+16+14+40+16=170E besetzt ist, und zwar als 1_7_Spalte 8/2=10 für „0“ mit 17_0 für „Isatinsulfonamid“ () =170AS [Isatin Sulfonamid 17 Molekulargewicht - C14H16N2O5S - Über 100 Millionen chemische Verbindungen | CCDDS (molinstincts.com)]. Das „Find-me“-Signal bezieht sich auf die verstärkte Freisetzung von ATP=260AS und Uridintriphosphat (UTP)=C9H15N2O15P3=54+15+14+120+45=248AS bei der Apoptose (Zellabbau). Das Signal liegt als „UTP/ATP-Paket“ freigesetzt am rechten Rand in der Spalte Z.38357#_(24)“3“2“/#_[3](8)“7“6“ mit UTP=248E als „24“_“8“ für UTP () =248E und ATP=260E als 2_6_Spalte 3/7=QS=10 für „0“ mit 26_0 für ATP („“)=260E.
Kanalaktivität: Durch den Pannexin-1-Kanal wird „ATP“ geschleust, das nachfolgend von Rezeptoren aufgenommen wird. Ein hoher extrazellulärer ATP-Spiegel ist ein Gefahrensignal, das eine starke Immunantwort auslöst. Zugleich kann aber auch das Fortschreiten von Krebs gefördert werden [Modulation der P2X4/P2X7/Pannexin-1-Sensitivität gegenüber extrazellulärem ATP über Ivermectin induziert eine nicht-apoptotische und entzündliche Form des Krebszelltods | Wissenschaftliche Berichte (nature.com); D.Draganov, Okt.2015; https://doi.org/10.1038/srep16222]. Das Protein (Mensch) „P2RX7“=595AS ist ein ATP-Rezeptor, der als Liganden-gesteuerter Ionenkanal fungiert. Der Rezeptorstrom kann durch Zink, Kalzium, Magnesium und Kupfer blockiert werden, weil Zink/Kupfer als Spalte 30E/29E im Zählweg liegen und die Calcium-Spalte „0/2“ für 20E in das Magnesium „1002“ für 12E mündet. Der Rezeptor reagiert auf BzATP=C24H24N5O15P3=144+24+35+120+45=368E leichter als auf ATP=260E. Warum? Der Rezeptor ist vollständig im breiteren Zählweg für BzATP enthalten. „BzATP“ als QS30+5+1+0+0=36_QS2+4=6_Kunstgriff QS5+5=10 für „0“_29=QS=11=QS=2 mit „36“_Summe 6+0+2=“8“ mit „3'-O-(4-Benzoylbenzoyl)ATP“ =368E. Ein Purinrezeptor reagiert auf das Nukleosid „Adenosin“= C10H13N5O4=60+13+35+32=140E. Die „Autophagie“, „sich selbst verzehrende“ Zelle, wird im Labor künstlich mittels veterinärem Arzneimittel „Ivermectin“=C48H74O14=288+74+112=474E ausgelöst [Ivermectin, 95 %, MP Biomedicals | Fisher Scientific], wobei die Entzündungsmediatoren „ATP“ und „HMGB1 (Amphoterin)“ freigesetzt werden. Das High-Mobility-Group-Protein B1 (Mensch) „HMGB1“=215AS wird von abgestorbenen Zellen freigesetzt. Das „ATP“ liegt ringförmig in der Spalte Z.38356#_(“0“){„5“}{1}{0}/#_(“9“)({„5“}){5}{2} mit ATP=260E als „2“_QS5+1+0=“6“_QS5+5=10 für „0“ mit 2_6_0 für ATP {}=260E. Der ATP-Rezeptor „P2RX7“=595AS bindet seitlich ein, und zwar als „5“_“9“_QS0+5=“5“ mit 5_9_5 für „P2RX7“ („“) =595AS [P2RX7 - P2X purinoceptor 7 - Homo sapiens (Human) | UniProtKB | UniProt]. Darin ist das Adenosin=140E als QS9+5=14_0 für Adenosin () =140E enthalten. Der Wirkstoff „Ivermectin“=474E blockiert das ATP und den Rezeptor vollständig in der Randspalte Z.38356#_“3“0“5“1“0“0“2“[8]/#_“29“55“2“43“2“, und zwar als QS2+43+2=47_Kunstgriff QS5+5=10 für „0“_29=QS=11=QS=2_QS3+0+5+1+0+0+2=11=QS=2 mit „47“_Summe 2+2=“4“ mit 47_4 für „Ivermectin“=474E. Aus Energiemangel resultiert aus den absterbenden Zellen in der ATP-Spalte Z.38356#_[5]“1“0“028/[5]“5“2“432 das „HMGB1“=215AS ringförmig als 2_1_5 mit „HMGB1“=215AS. Aufgrund der Heparin-Bindestelle liegt das Heparin=C26H41NO34S4=156+41+7+272+64=540E am Seitenrand als QS3+2=5_Spalte 0/4 für 40 mit 5_40 für Heparin=540E [HMGB1 - High mobility group protein B1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Interaktion von „Pannexin 1“ mit dem „P2X7-Rezeptor“ ist an der angeborenen Immunität beteiligt. Die Kanalaktivität mit der Bindung von „ATP“ an den Rezeptor führt zur Freisetzung von „Interleukin-1β“ [Pannexin – Wikipedia]. Der zeitliche Ablauf wird als Stapel mit einer neuen Ebene abgearbeitet. Das „ATP“ kann nach dem Weg durch den Kanal von der Ziffer „2“ alternativ als Ausgangsgröße zum rechten Rand wechseln, und zwar in der Spalte Z.38355#_[8668]“1“/#_10“0“2“8“/#_5“2“4“[3](2) als „2“_Spalte 0/4=QS=“4“_“2“_mit „2“_Summe 4+2=“6“_Randspalte 8/(2)=QS=10 für „0“ mit 2_6_0 für ATP=260E. Die Zahl „26“ von ATP=“26“0E geht in Protein (Mensch) „Interleukin-1beta“=269AS über. In der Randspalte 1/8/(2) wird, von der Ziffer (2) lediglich auf die Ziffer „1“ für „26“_QS8+1=“9“ umgeschaltet [IL1B - Interleukin-1 beta - Homo sapiens (Human) | UniProtKB | UniProt]. „IL1B“= 269AS wird durch das Streptokokken-Protein (Streptococcus pyogenes serotype M1) „SpeB“=398AS gespalten. Die Spaltung ist ersichtlich weil die Zählung in einen Spalt 1-1 mündet, und zwar als 29=QS=11=QS=“2“_Kunstgriff QS5+5=10 für „0“_QS2+4+3=“9“_“28“ mit Summe 2+0+9+28=39_8 für „SpeB“=398AS (Streptococcus) [speB - Streptopain - Streptococcus pyogenes serotype M1 | UniProtKB | UniProt].
Wissenschaftlich wird ein „Panx2-Oktamer“ vermutet. Zunächst existiert ein „Panx2-Heptamer“ mit einem weiten Kanal, der für „ATP“ durchlässig ist. Die engste Stelle im Kanal besteht aus einem Filter-Ring mit „7“ Arginin-Resten [Kryo-EM-Struktur des menschlichen heptameren Pannexin-2-Kanals | Naturkommunikation (www-nature-com.translate.goog); H. Zwang u.a., März 2023; https://doi.org/10.1038/s41467-023-36861-x]. Mit Arginin=(R/Arg)=C6H14N4O2=36+14+28+16=94E liegt der Filter-Ring kompakt gezählt in der Zahl 7-fach „94“=658E, die einen Bezug zum Ring als QS6_58=Ring=64 (Symbol) enthält. Ist der Filter-Ring vorhanden? Mit „1“3“_“0“_QS5+1=6_“0“ liegt die Ziffer „6“ in einem weiten Kanal „0_0“. Die Ziffer „6“ kann links mit QS1+3+0=“4“ zum Kreis=64 ergänzt werden. Der Ziffer „5“ folgt die Spalte „5/8“ für „58“. Somit ist der 7er-Arginin-Filter-Ring mit QS5+1=6_58 für 658E vorhanden. Weil mit den Ziffer „1“ und „8“ zwei unbesetzte Matrix-Ziffern funktionell gebunden sind, ist nur noch das Wasser=28 (Symbol) offen. Der Energieträger „Adenosintriphosphat (ATP)“=260E passiert den Filter-Ring ringförmig in der Spalte „510“/“55“2“ als „2“_QS5+1+0=“6“_QS5+5=10 für „0“ mit 2_6_0 für ATP=260E. Dass „Panx2-Heptamer“ repräsentiert mit Nerv=Form=“7“ das Nervensystem und mit Extra=“8“ wird speziell nur für „Hochintelligente“ eine Rechenmaschine „PanX2extra“ als Fall „8“ angefügt, der beide Reihen zusammenspannt und am linken Rand die Zählgrößen „11“ erzeugt, um Calcium reguliert durch den Kanal zu schleusen. Weil Panx2/6 in der oberen Reihe die Ziffer „7“ für 67“7“AS am linken Rand aus #1+6=7 gewinnt, muss Panx2/8 ebenfalls dort mit #1+6=7 enden, um eine Schleife zu bilden.
Für das „Panx2-Oktamer“ wird die obere 1. Reihe mit den Fällen 5, 6 und 7 ergänzt. und zwar in der Spalte Z.38354#“1“6“11“4“4“5“33“0“8“2“4“{0}{7}/#16{1}1(4)(0)(33)(16)(8)(6)“6“{8}[1]/#[16]{11}“36“1“30“[5](1)(0)“0“{2}{8}/#[16]{11}319“29“5“(5){2}{43}{2}/#[16]{1}1277[288](1){38}7{6}/#[16]{1}12352829434{1}/#[16]{11}{19}{3}{2}799{38}{1}{2}/#[16]11151]{2}{7}{91}{2}[271]. Der Fall „8“ umschießt die Fälle 1, 2 und 3, so dass in der Spalte alle 8 Zeilen enthalten sind. Bereits im „Panx2-Trimer“ enthalten: Fall1/„Panx2“=677AS als QS 9_31_27=“67“_QS1+1+2+3=“7“ mit 67_7 für „Panx2“/1 (leer)= 677AS; Fall2/„Panx2“=677AS als QS7_52+8=67_7 für „Panx2“/2 (leer)= 677AS; Fall3/„Panx2“=677AS als QS9+9=18_29=QS=11=QS=2 mit Summe 18+2=“20“_QS43+4=“47“ mit Summe 20+47=“67“_“7“ für „Panx2“/3 (leer)= 677AS
Fortsetzung: Fall 4/“Panx2“=677AS ab Z.38356 als QS36+1+30=“67“_aufsteigend 29=QS=11=QS=2_5 mit 67_Summe 2+5=“7“ mit 67_7 für “Panx2“/4 („“)=677AS. Fall 5/“Panx2“=677AS. Fall 5/“Panx2“=677AS als QS4+0+33+16=“53“_QS8+6=“14“ mit Summe 53+14=“67“_10=QS=1_Spalte 5/1=QS=6 mit 67_Summe 1+6=7 mit 67_7 für “Panx2“/5 () =677AS. Fall 6/“Panx2“ absteigend zur Z.38384 über Spalte 4/6/0 mit Kunstgriff als Spaltenfüller QS4_6_0=10 für „0“_QS0+8+2=“10“_“33“_QS4+4+5=“13“_“11“ mit Summe 0+10+33+13+11=“67“_QS#1+6=“7“ mit 67_7 für “Panx2“/5 („“)=677AS. Fall 7/“Panx2“=677AS am rechten Rand absteigend als 38=QS=11=QS=2_2_43 mit Summe 2+2+43=47_Spalte 8/2=QS=10_Spalte 8/2=QS=10 mit Summe 47+10+10=“67“_QS0+7=“7“ für “Panx2“/7 {}=677AS. Fall 8/“Panx2“=677AS am linken Rand ab Z.38355 mit QS#1+6=“7“_über Randspalte „1/11/11/1/1/11“ mit Spalte 1/1 für „11“_ Spalte 1/1 für „11“_ Spalte 1/1 für „11“_ Spalte 1/1 für „11¬¬“_“1“ mit Summe 7+11+11+11+11+1=“52“_ QS1+9=“10“_„3“_QS2_2+7=11=QS=“2“ mit Summe 52+10+3+2=“67“_Kunstgriff QS9+1=10 für „0“_ „2“_38=QS=11=QS=“2“_bis rechter Rand QS1+2=“3“ mit „67“_Summe 2+2+3=“7“ mit 67_7 für “Panx2“/8 {}=677AS. Welche Rechenleistung ist möglich? In der Matrix unbesetzt sind die Ziffer „5“=Struktur und die Zahl „288“ [nützlich 28_8 / schädlich 2_88 (Radium)]. Am rechten Rand liegen die Ziffer „1“=Zähler und die Spalte 6/1=QS=“7“ als pulsierenden Umschalter für 67“7“AS in beide Zählrichtungen. Beim Umschalten wird die Schleife am linken Rand getrennt. Um die Matrix rechtswinklig auszufüllen, liegt unten am rechten Rand das Zählwerk QS2+7+1=“10“. Auf der linken Seite wird der rechte Winkel ausgefüllt mit 6-fach QS 1+6=7 mit 6*7=42_11_QS1+5+1=7 mit Summe 42+11+7=Zeitbasis=60 Sekunden. Folglich wird die Zeit präzise gezählt. „Pannexin 2 (Panx2)“ wird hauptsächlich im Nervensystem exprimiert.
Der „Pannexin-3_Heptamer-Hemikanal“ wird speziell in Odontoblasten-ähnlichen Zellen exprimiert. „Panx3“ wird außerdem in Knorpelzellen (Chondrozyt) exprimiert und reguliert die Knochenbildung [Das Pannexin-3-ER-Ca2+-Kanal-Gating wird durch Phosphorylierung am Serin-68-Rest in der Osteoblastendifferenzierung reguliert | Wissenschaftliche Berichte (nature.com); M. Ishikawa, u.a. Nov. 2019; https://doi.org/10.1038/s41598-019-55371-9]. Für das Gebiss (Zähne) wird zunächst ein Orientierungsblatt kreiert, in das „Panx3“ dann passend eingefügt wird. „Panx3“ bildet einen 7-teiligen„Panx3-Heptamer-Hemikanal". Eine Verdopplung als „Gap Junction“ ist bei Panx1 und Panx3 selten möglich. Analog zu Panx1/Panx2 wird ATP freigesetzt [Structural insights into the organization and channel properties of human Pannexin isoforms 1 and 3 | bioRxiv; N. Hussain; März 2023; doi: https://doi.org/10.1101/2022.09.09.507385]. „Odontoblasten“ sind zylindrische Zelllen, die das Dentin (Zahnbein) unter dem Zahnschmelz der Zähne erzeugen. „Dentin“ besteht aus einem Netz von Kollagenfasern, in denen mineralische Nanopartikel in Form von Calcium-Salzen [Carbonat-Hydroxylapatit-Kristalle (cHAp-Kristalle)] eingebettet sind. Dieser kollagene Dentin-Anteil beträgt 92%. Nach Abschluss der Zahnbildung geht die Teilungsfähigkeit der „Odontoblasten“ verloren. Die „Odontoblasten“ liegen am Rand des Zahnbeines (Pulpenperipherie). „Dentin“ kann von den „Odontoblasten“ zeitlebens als Sekundärdentin neu gebildet werden (reizbedingt bei Karies). Im Unterschied zum Zahnschmelz ist Dentin ein lebendes Gewebe. Das Manteldentin unter dem Zahnschmelz, 10-30µm dick, enthält dickere a-Fibrillen (Korff-Fasern) und wird von Mesenchymzellen und nicht von Odontoblasten gebildet. Die „Odontoblasten“ bilden Kollagenfasern mit b-Fibrillen. Das zirkumpulpale Dentin (Ebner-Dentin) entsteht aus der Odontobasten-Tätigkeit. Die Mineralisation erfolgt in Zyklen, die ein Linienmuster (Ebner-Linien) wie Baum-Ringe um die Kanäle bilden. Die bis 5 mm langen Odontoblastenfortsätze (Tomes-Fasern) strahlen durch unsichtbare Dentin-Kanälchen (Tubuli) bis an die Zahnschmelz-Dentin-Grenze ein. Der harte „Zahnschmelz“ (Enamelum / Substantia adamantinea) besteht aus Hydroxylapatit=[Ca5(PO4)3OH]x2=[100+(15+32)*3+(8+1)]*2=[100+141+9]*2=500E [Zahnschmelz – Wikipedia]. Der Zahnschmelz liegt in der Spalte Z.38356#_ {3}“0“5“[10028]/{2}(9)“5“5“[2432] neben der Spalte 3/2 für 32 Zähne als Struktur=5_QS5+5=10 für „0“_0 mit 5_0_0 für Zahnschmelz=500E, wobei die folgende Ziffer „9“ für „oben/seitlich“ steht. Aufgrund der Ziffer „9“ kann außer Phosphor auch Kalium mit QS9_Spalte 5/5=9+10=Kalium=19 aufgenommen werden. Mit „Fluor“=9E wird der Zahnschmelz durch Fluoride gehärtet. In den Tubuli liegen teilweise auch Nervenfasern. Die Zahnpulpa (Pulpa dentis / Zahnmark) besteht aus Bindegewebe mit Blut- und Lymphgefäßen sowie Nervenfasern. Die Evolution muss „Pannexin-3“ derart in der Länge zuschneiden, dass die erforderlichen Informationen für das Gebiss verfügbar sind. Insbesondere muss am rechten Zeilenrand die Ziffer „11“ zählbar sein, damit ein Zahn herauswachsen kann. Die Grundform des Säugetiergebisses besteht aus 44 Zähnen, 11 je Quadrant (beim Schwein). Der Mensch besitzt 32 Zähne mit 8 je Quadrant [2 Schneidezähne (Dentes incisivi), 1 Eckzahn (Dens caninus), 2 vordere Backenzähne (Dentes praemolares), 3 hintere Backenzähne (Dentes molares)]. Die Weisheitszähne brechen als letzter Zahn der 8er Reihe erst im Alter von 17-21 Jahren durch, so dass es nach den 20 Milchzähnen zunächst nur 32 - 4=28 Zähne sind. In der Randspalte Z.38355#_[100]{28}/#_[524(3]“2)“/#_[1387]“6“/#_[9434]“1“/#_[9381]“2“ ist diese Zahnanzahl als Wasser={28} (Symbol) lesbar. Seitlich wird damit die Temperaturbasis 100°C für die Kälteempfindlichkeit abgrenzt „[100]{28}“. Der Durchmesser des Heptamers von 10,4 nm würde erfordern, in der Spalte 10{0}/4 die {0} als Durchmesser und Kommastelle zu interpretieren. In der Randspalte 2/6/1/2 wird dann das Symbol=11 als QS2+6+1+2=“11“ für den Zahndurchbruch (Hub) addiert. Die Anzahl der Milchzähne ist als 10_0 mit Summe 10+0=“10“_QS2+8=“10“ mit Summe 10+10=20 Milchzähne vorhanden. Das externe Calcium=20E zur Kanal-Regulierung ist somit ebenfalls beteiligt. Unter der [100] folgt mit 5243“2“ die Zeitbasis gespiegelt als „3“ QS2+4=“6“_“5“ für 365=1 Jahr als Zeitbasis für die Jahreszählung der Weisheitszähne. Die Zeitbasis 24=1 Tag ist mit enthalten. Der Bezug zur Zeitbasis „365“ ergibt mit der Zahl 32 insgesamt (32) Zähne. Über die Spalte „10[0]/52(4)“ brechen die Weisheitszähne ab QS10_5+2=17 Jahre bzw. plus (4) Jahre mit 21 Jahren durch (falls das so interpretiert wird; anderenfalls bleiben sie überdeckt). Das Gebiss entwickelt sich an anderer Stelle im Zeilenlauf, darin sind die Weisheitszähne speziell erkennbar. Die Länge der Tubuli-Dentin-Kanäle=5 mm=5*10^6 nm ergibt sich, weil wegen der Dopplung 66/00 neben der Zeitbasis „60“ auch der Faktor 10^6 in der Spalte Z.38355#[68]“6“{6}[81]/ „5“10“{0}{28} für 5*10^6 =5 mm entsteht. Embryonal beginnt die Zahnentwicklung am 40.Tag als Spalte 0/4, die mit der Zeitbasis „24“=1 Tag in der Spalte [10]“0“/[5]“24“ gekoppelt ist. Nach 4-5 Monaten der embryonalen Entwicklung beginnt die Hartgewebebildung. An der Sekretion der „Dentinmatrix“ sind die Signalmoleküle „Fibronektin“ und „Fibroblasten-Wachstumsfaktoren (FGH)“ beteiligt [Odontogenese; Thieme E-Books & E-Journals (thieme-connect.de)]. Das Protein (Mensch) „Fibronektin“=2477AS liegt mit einer Heparin-Bindung ringförmig in der Spalte Z.38356#_[51]{0}{(0)}{(2)}{8}/#_[55]{„2“}{(„4“)}(„3“)[2]/#_[1]“3“[8]“7“[6]/#_[9]“4“34“[1] als 24_Kunstgriff Spalte 3/7=QS=10 für „0“_mit Summe 24+0=“24“_QS3+4=“7“_Spalte 3/4=QS=“7“ mit 24_7_7 für „Fibronektin“=2477AS [FN1 - Fibronectin - Homo sapiens (Human) | UniProtKB | UniProt]. Heparin=540E als Spalte 2/3=QS=5_über Spalte 0/4 mit 4_0 mit 5_4_0 für „Heparin“ ()=540E. „Fibronektin“ dient als Ligand für das Rezeptorprotein (Mensch) „LILRB4“=448AS als „4“_QS2_0+0+2=“4“_“8“ mit 4_4_8 für „LILRB4“ {}=448 AS [LILRB4 - Leukocyte immunoglobulin-like receptor subfamily B member 4 - Homo sapiens (Human) | UniProtKB | UniProt]. „Fibrotectin“ ist am Protein (Mensch) „ITGAE_Intergrin“=1179AS gebunden, und zwar in der Spalte Z.38356#_“1“00/#_“5“2“4/#_“1“3“8/#_943 mit Calcium als Spalte 0/2 für 20E und Aufnahme der freien Ziffer „8“ im Fibronektin-Ring als 38=QS=11_QS4+3=7_9 mit 11_9_7 für „ITGAE“=1197AS [ITGAE - Integrin alpha-E - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FGF-1_Fibroblast-Wachstumsfaktor“=155AS „bindet in Gegenwart von „Heparin“=540E an „FGFR1“, was zu einer Dimerisierung und Aktivierung von „FGFR1“ durch sequentielle Autophosphorylierung an Tyrosinresten führt“. Tyrosin=96E in der Randspalte Z.38356#_(1){“0“}{“0“}{2}{8}“/#_(5){(“2)4“}“32“/#_“1“(“3“)“8“[76] als QS32_28_0_0_24=“84“_QS1+3+8=“12“ mit Summe 84+12=Tyrosin=96E. Das Rezeptor-Protein (Mensch) „FGFR1“=822AS liegt in der Spalte als „8“_QS2+0+0=“2“_“2“ mit 8_2_2 für „FGFR1“ {} =822AS [FGFR1 - Fibroblast growth factor receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt] . Folglich entsteht „FGF-1“=155AS über die Spalte 1/5 für 15_Spalte 2/3=“5“ mit 15_5 für „FGF-1“ () =155AS [FGF1 - Fibroblast growth factor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Pannexin 3 (Panx3)“=392AS wird im Gewebe der Zahnpulpa gefunden. Weil die Bildung des Zahnbeins (Dentin) mit der Bildung von Kollagen verbunden ist, ist „Panx3“ sekundär von Interesse, weil Krebs-Metastasen ihr eigenes „Kollagen“ bilden, um sich darin einzunisten. Somit können Proteine dargestellt werden, die Metastasen fördern. „Panx3“ aktiviert und steigert die Produktion von „Interleukin-1 (IL-1)“. Das Zytokin „IL-1“ induziert Fieber bei Entzündungsreaktionen. Die Panx3-Kanalpore ist weitporig und unspezifisch [PANX3 - Pannexin-3 - Homo sapiens (Human) | UniProtKB | UniProt]. „Interleukin-1“ besteht aus 2 Untereinheiten [IL-1A/B]. „Panx3“ bildet ein 7-teiliges „Heptamer“ als Hemi-Kanal und kann sich als „Gap Junction“ aus 2 Halbkanälen zusammenfügen. Das „Interleukin-1“ ist dem „Panx3-Heptamer“ 4-zeilig direkt vorgelagert, und zwar in der Randspalte Z.38350#_[85]{6}({39})(“2“)/#_[5]{8}({4}{20})“0“)/#_{5}{3}“11“49“/#_{6}[97224]. Mit Protein (Mensch) „IL-1Alpha“=271AS als Spalte 5/6=QS=11=QS=“2“_Spalte 8/3=QS=11=QS=“2“_Spalte 6/4=QS=“10“_QS39_20=“59“ mit „2“_Summe 2+10+59=“71“ mit 2_71 für „IL-1Alpha“ {}=271AS [IL1A - Interleukin-1 alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Mit Protein (Mensch) „IL-1Beta“=269AS als 11=QS=“2“_“49“_Spalte 2/0 für „20“ mit „2“_Summe 49+20=“69“ mit 2_69 für „IL1-Beta“ („“)=269AS [IL1B - Interleukin-1 beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IL-1 Rezeptor“=398AS ist mit enthalten, und zwar als „39“_“2“_QS4+2+0+0=“6“ mit „39“_Summe 2+6=“8“ für „IL-1 Rezeptor“ () =398AS [IL1R2 - Interleukin-1 receptor type 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Interleukin-6 (IL-6)=212AS ist ebenfalls am Rand mit enthalten, und zwar in der Spalte Z.38350#_[63]{„9“}{„2“}/#_{4“2“0“}{„0“}/#_{114}{„9“}/#_[722]“4“ absteigend als QS1+1+4=“6“_QS4+2+0=“6“_“9“ mit Summe 6+6+9=“21“_QS2+0+9=11=QS=“2“ mit 21_2 für „IL-6“ {}=212AS [IL6 - Interleukin-6 - Homo sapiens (Human) | UniProtKB | UniProt]. Am Fieber ist weiterhin das Protein (Mensch) „Tumornekrosefaktor Alpha (TNF)“=233AS beteiligt. „Panx3“ lässt die Randziffer „4“ frei, so dass „TNF“ am Rand die Zahl 33 (Membran) erzeugt, und zwar als „2“_Spalte 9/0=QS=“9“ mit Summe 2+9=“11“, reduziert QS=“2“_Spalte 2/0 für 20_Spalte 9/4=QS=13 mit „2“_Summe 20+13=“33“ mit 2_33 für TNF („“) =233AS [TNF - Tumor necrosis factor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Fieber wird in der Spalte Z.38350#_“56“392/#_(8)“4“20“0“ mit dem Tod bei 42°C an die Schwerachse 84 in „842“ gekoppelt. Die normale Körpertemperatur ergibt ist aus der lesbaren Zahl 63(9), die mit dem Fieber 39°C kombiniert ist, als Differenz zur Temperaturbasis 100° als 100°C-63=37°C. Die Temperaturbasis 100° ist als 56_4_20_Spalte 2/0 für 20 mit Summe 56+4+20+20=100 für 100°C vorhanden. Die Z.-Nr.Z.38350 bildet mit Z.38=QS=11=QS=2_35_0 die Normaltemperatur mit Summe 2+35+0=37°C. Der Fieberschub liegt als Welle=64 im Wechsel zu 37°C in der Folgezeile neben der max. Temperatur=42°C als Summe #16+11+5+7+1+3+8+5+8=Welle=64.
Die Überexpression von „Panx3“ beschleunigt die ATP-Freisetzung in den extrazellulären Raum [Expression von Pannexin3 in humanen Odontoblasten-ähnlichen Zellen und seine Hemikanalfunktion bei der Vermittlung der ATP-Freisetzung - PubMed (nih.gov): D. Fu; Okt.2015; DOI: 10.1016/j.archoralbio.2015.07.005]. Weil die Temperaturbasis 100°C für den Kältereiz am Kanal liegt, taucht das ATP=260E lesbar als Spalte () 2/6/0 in die Temperaturbasis „100“ ein. Weder heiß noch kalt sind 22°C. Der Zahn ist abgestorben, wenn er auf das Kältespray auf dem Wattebauch von -40°C als Spalte „0/4“ nicht reagiert. Um eine Freisetzung von ATP am Zeilenrand zu erreichen, wird das ATP in der ähnlichen Neben-Spalten gelesen, und zwar in der Spalte Z.38354#_(2){“4“0“7“}/#_(6){“6“}[81]/#_(0){“0“}{28} als QS4+0+7=11=QS=2_6_0 für ATP=260E. Im Labor wird „in vivo“ das „ATP“ mit dem Wirkstoff „Chinacrin (Acrichine)“=C23H32ClN3O^+=138+32+17+21+8=216E erkannt. „ATP“ wird dabei mit aufgenommen, und zwar „Chinacrin“=216E C-förmig „2_6“ analog zu ATP, weiter zum Rand als QS0+2+8=10 mit „2“_Summe 6+10=“16“ mit 2_16 für „Chinacrin“=216E.
Der 8-zeilige heptamere „Panx3-Hemi-Kanal“ zieht im „Fall 1“ von „7“ Fällen mit „Pannexin-3“=„Panx3“/1=392AS über die „100“ linksdrehend absteigend zum rechten Zeilenrand, und zwar in der Spalte Z.38354#_[533082]“4“0“7"/#_[33168668]“1“/#_[1305]“1“0“0“2“8“/#_[9295]{5}{24}{3}[2]/#_[7288]“1“{38}{7}[6] als QS1+0+0+2=“3“_Randpalte 1/8=“9“_QS4+0+7=11=QS=“2“ mit 3_9_2 für „Panx3“/1 („“)=392AS. „Fall2/Panx3“=392AS ab Z.38357 aufsteigend als QS5+24=“29“_Spalte 3/7=QS=“10“ mit Summe 29+10=“39“_38=QS=11=QS=“2“ mit 39_2 für „Panx3“/2 {}=392AS. Um ein Heptamer zu erzeugen, muss der rechte Rand frei gehalten werden. Im „Fall3/Panx3“ wird daher statt der Randziffer „1“ die Vertikal-Ziffer „1“ gewählt. „Fall3/Panx3“=392AS liegt in der Spalte Z.38358#_[7]“2“8“8“[1]3876/#_[528]“2“[9](4)(34)[1]/#_[327]“9“9“(38)(1)[2]/#_[1279]“1“[2271], und zwar aufsteigend ab Z.38359 als QS4+34_1=“39“_38=QS=11=QS=“2“ mit 39_2 für „Panx3“/3 ()=392AS. Der „Fall4/Panx3“=392AS liegt schleifenförmig in der Spalte „81/29/99/[9]1“ ab Z.38361 absteigend als QS1+9+9+1=“20“_aufsteigend QS8+2+9=“19“ mit Summe 20+19=“39“_“7“_Spalte 2/2=4 mit „39“_Summe 7+4=11=QS=“2“ mit 39_2 für „Panx3“/4 („“)=392AS, wobei die herausstehende Ziffer „1“ nur gebunden wird, wenn sich der Fall „7“ für ein „Heptamer“ seitlich anlegt. Der „Fall5/Panx3“=392AS liegt in der Spalte Z.38356#_[1]{3}0510028/#_[9]{2}95{5243}!2!/#_[7]{2}{8}“8“1“{387}!6!/#_[5]“2“{8}“2“9“(434)!1! aufsteigend als „3“_Spalte 2/2=QS=4_Spalte 8/8 für „88“ mit „3“_Summe 4+88=“92“ mit 3_92 für „Panx3“/5=392AS. Der „Fall6/Panx3“=392AS schließt den Ring, und zwar in der Spalte
Z.38353#_[73469]722[4]/#_[533082]“4“0“7"/#_[33](1)(6)[8668]“1“/#_[1]{3}(0)(5)“1“0“0“2“8“/#_[9]{2}(9)(5){5}{24}{3}!2! über die Innenschleife aufsteigend Spalte 0/9=QS=“9“_absteigend Spalte 5/5=QS=“10“_“6“_Spalte 3/1=QS=“4“_QS0+8+2=“10“ mit Summe 9+10+6+4+10=“39“_QS7+2+2=11=QS=“2“ für „Panx3“/6 () =392AS. Der „Fall7/Panx3“=392AS ist ein Strang, der sich über den rechten Rand zwischen „Fall1“ über „Fall2/3“ bis zum „Fall4“ erstreckt, und zwar winkelförmig über die Randspalte Z.38357#_!2!/#_!6!/#_!1!/#_!2!/#_!2!271! als Spalte 2/6 für „26“_Spalte 1/2=QS=“3“ mit Summe 26+3=“29“_QS2+7+1=“10“ mit Summe 29+10=39_2 für „Panx3“/7 (!!) =392AS (Heptamer). Ergebnis: Es wird ein geschlossener Protein-Komplex erzeugt, der ringförmig eine Kanalöffnung „8668“ umschließt. Diese Pore enthält das Calcium=20E zur Regulation wahlweise links QS8+6+6=20E oder rechts QS6+6+8=20E. Der Kanal-Filterring ist als Einschnürung in „Panx1“ mit „Tryptophan“, in „Panx2“ mit „Arginin“ und in „Panx3“ mit der verzweigten hydrophoben Aminosäure „Isoleucin (Ile/I)“= C6H13NO2=36+13+7+16=72E ausgekleidet. Das „Panx3-Heptamer“ enthält real 2 Kammern. Hilfsweise wird angenommen, dass die 2. Kammer durch 2 gleiche Moleküle versperrt wird, und zwar mit „Isoleucin (Ile/I)“=72E mit „243“ als QS4+3=“7“_“2“ für „Ile/I“=72E und mit „387“ als 7_38=QS=11=QS=2 mit 7_2 für „Ile/I“=72E. Als Zweck kann hilfsweise angenommen werden, dass es sich um eine Calcium-Schalter handelt, weil sich das Calcium im Sinne einer geöffneten Pore vertikal als Spalte 8/2=QS=10_Spalte 7/3=QS=10 mit Summe 10+10=Calcium=20E durch das Isoleucin zieht. Ist dieser Weg geöffnet, wird auch das „ATP“ am Zeilenrand freigesetzt, und zwar in der Spalte „32/76“ als 2_6_QS3+7=10 für „0“ mit 26_0 für ATP=260E. Zugleich ist Ubiquitin=76AS als Signalmolekül lesbar.
Die „heptamere Rosette“ kann als kompakte Summen-Darstellung für 7-fach 392AS=2744AS als Ring um die weite Kanalpore „00“ geführt werden, und zwar in der Randspalte Z.38355#_{3}{16866}{8}[1]/#_{3}{0!Start}{5}{1}[00]{2}{8}/#_{29}{5}{5243}{2} spiralförmig rechtsdrehend über die Spalte „1/0“ als QS0_1+6+8+6+6=“27“_Spalte 8/2=QS=“10“_Spalte 8/2=QS=“10“_QS5+2+4+3=“14“ mit „27“_Summe 10+10+14=“34“_ _QS5+1=“6“_“5“ mit „27“_“34“_Summe 6+5=11=QS=“2“_29=QS=11=QS=“2“_Spalte 3/3=QS=“6“ als „27“_Summe 34_2+2+6=“44“ mit 27_44 für Summe „Panx3-Heptamer“ {}=2744AS._dat02.01.2024
Metastasen: In Krebszellen wird das Enzym „NNMT“ verstärkt produziert, wodurch die Aktivität von NAD+-verbrauchenden Enzymen gefördert wird. Hemmstoffe für Arzneimittel als NNMT-Inhibitoren werden erforscht. Weil „NNMT“ bei vielen Krebsarten erhöht ist, würde ein Medikament die Vielfalt der Metastasen universell bekämpfen. „NNMT“ wird durch „STAT3“ und „HNF1B (TCF-2)“=557AS“ nicht gehemmt, sondern nur funktionell angesprochen, d.h. „STAT3“ muss bekämpft werden, damit es „NNMT“ nicht fördern kann [R. Parsons u.a.; Sept.2021; Nicotinamid-N-Methyltransferase: Ein aufstrebender Akteur in der Makro(r)evolution von Krebs - PMC (nih.gov); doi:10.3390/biom11101418]. Der Hemmstoff, Vanillin=C8H8O3=48+8+24=80E hemmt bei Darmkrebs das „NNMT“ und schwächt die NNMT-induzierte Resistenz gegen das Krebsmedikament „5-Fluoruracil (5-FU)“ ab [Vanillin reguliert NNMT herunter und schwächt NNMT-bedingte Resistenz gegen 5-Fluorouracil über ROS-induzierte Zellapoptose in Darmkrebszellen ab - PubMed (nih.gov)]. Eine Gewichtsreduzierung wird im Labor bei Mäusen mit NNMT-Inhibitoren, wie „6-Methoxynicotinamide“=C7H8N2O2=42+8+14+16=80E, in Fettzellen festgestellt [Molecules | Free Full-Text | Novel Inhibitors of Nicotinamide-N-Methyltransferase for the Treatment of Metabolic Disorders (mdpi.com); A. Kannt; Feb.2021; https://doi.org/10.3390/molecules26040991]. Der Zusammenhang von „NNMT“ und „STAT3“ zieht sich über diverse andere Proteine:
Bei der Metastasierung von Brustkrebs (Breast cancer) nisten sich Krebszellen im Kollagen-Gewebe ein, das sie selbst produzieren können. Über den Bereich „Pannexin-3“ und „Dentin“ wird das „Kollagen“ avisiert. Die ungünstige Kaskade beginnt mit dem NAD-Stoffwechselenzym „Nicotinamid-N-Methyltransferase“ (NNMT). Bei einer Überproduktion von „NNMT“ wird auch mehr Kollagen gebildet. Im Vorstadium der Metastasierung hilft das Kollagen den Krebszellen, sich im neuen Gewebe anzupassen und zu überleben [Nicotinamid-N-Methyltransferase unterstützt ein epigenetisches Kernprogramm, das die Metastasierung bei Brustkrebs fördert | Das EMBO Journal (embopress.org); J.Couto u.a. ; Jun 2023; https://doi.org/10.15252/embj.2022112559]. „Kollagen“ besteht aus wiederholten Einheiten der Form „Gly-X-Y“, wobei dem Glycin=40E häufig das Prolin=62E und das Hydroxyprolin=C5H9NO3=30+9+7+24=70E folgen. Beispielhaft kann mit dem lesbaren „Glycin“ begonnen werden, und zwar in der Randspalte Z.38354#_{2}„40“[7]/#_{6}(68)[1]/#_[00](2)[8] mit lesbarem Glycin („“)=40E_Prolin {}=62E mit Spalte 2/6 für Prolin {}=62E_Hydroxyprolin () = C5H9NO3=30+9+7+24=70 als QS68+2=70 für Hydroxyprolin ()=70E. Die 3 linksgängigen alpha-Polypeptidketten verdrillen sich zu einer rechtsgängigen Superhelix. Drei Aminosäurereste bilden eine Umdrehung mit einer Ganghöhe von 0,96 nm [Taschenatlas der Biochemie, Koolman und Röhm, 2002; zitiert in C. Vogler; 2009; „Quantifizierung verschiedener Kollagentypen in Gewebeproben mittels elektrophoretischer und chromatographischer Methoden“; 2 Theoretische Grundlagen (hs-mittweida.de)] Die Differenz wird zwischen zwei „0“ (Nullen) dargestellt, und zwar in der Spalte Z.38355#[168668]{1}_“0“[510]{“0“}{28}/“9“55“2“4“[32] als Spalte 0/9 für „0,9“_55=Kunstgriff=10 für „0“_“2“_ Spalte 0/4 =QS=“4“ mit „0,9“_Summe 0+2+4=“6“ für 0,96 nm. Der Anstieg pro Aminosäurerest=0,29 nm wird in der Randspalte fortgesetzt mit 02 für „0,2“_Randspalte 1/8=QS=“9“ für 0,29 nm.
Das Protein (Mensch) „COL1A1_Kollagen Typ I, alpha 1“_CO1A1=1464AS besitzt eine Calcium-Bindestelle [COL1A1 - Collagen alpha-1(I) chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Kollagen Typ I“ ist ein fibrilläres Kollagen. Das Prokollagen Typ I besitzt eine Tertiärstruktur und setzt sich doppelt aus „COL1A1“ und als Trio mit dem „COL1A2“ zusammen [Kollagen-Typ 1α1 – Wikipedia]. Das Protein (Mensch) „COL1A2_Kollagen Typ I, alpha 2“=1366AS besitzt ebenfalls eine Calcium-Bindestelle [COL1A2 - Collagen alpha-2(I) chain - Homo sapiens (Human) | UniProtKB | UniProt]. Der Bereich enthält für die 3 Proteine ein 3-fach lesbares Calcium als Spalte !2/0! für „COL1A2_ und Zahl „02“ und Spalte !0/2! bei unbestimmter Zuordnung für doppeltes „COL1A1“. Es wird angenommen, dass Calcium mit keiner Ziffer in „COL1A1“ einbindet, sondern als Ligand dient und die Spalte !0/2! von beiden Proteinen aktiv eingeklemmt wird. Damit ist der Zweck von „NNMT“ leicht zu erkennen: „NNMT“ kann sich kreuzweise in dieser Kollagen-Klemmspalte mehrfach entwickeln. Fall1/„COL1A2“ („“) =1366AS liegt in der Spalte Z.38352#_[87346972]!2![4]/#_453308“2“4“!0!“7“/#_03316{8}“66“[81]/#_6130{5}{1}0028/#_1929{55}2432/#_7728{8}{1}3876 mit der Ziffer „0“ aus der Calcium-Spalte !2/0! aufsteigend als QS2+4+0+7=“13“_“66“ für Fall1/„COL1A2“ („“)=1366AS. Fall2.1/„COL1A1“ {} =1464AS aufsteigend als QS8_5+1=14_55_QS8+1=9 für „14“_Summe 55+9=“64“ mit 14_64 für Fall2.1/„COL1A1“ {} =1464AS. Fall2.2/„COL1A1“ () =1464AS absteigend als Randspalte 6/1=QS=“7“_“7“ mit Summe 7+7=14_QS32+28=60_Spalte 0/4=QS=4 mit „14“_Summe 60+4=“64“ mit „14“_“64“ für Fall2.2/„COL1A1“ () =1464AS. Vom Gen „COL1A1“ wird weiterhin das Protein (Mensch) „COL1A1 - Collagen type I alpha 1_ Q6LAN8“=1069AS kodiert, das vermutlich als Wiederholung ein Trimer bildet [COL1A1 - Collagen type I alpha 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Im Zusammenhang mit „NNMT“ ist die Modifikation „H3K9me3“ an „Lysin“ des DNA-Verpackungsproteins „Histon H3“ von Bedeutung. Das Protein (Mensch) „Histon H3“ („“) =136AS muss für eine korrekte Zählweise statt am rechten Rand aufsteigend als „1_36“ absteigend mit „13_6“ gebildet werden, und zwar über die Lysin-Spalte „0/8“ für Lysin=C6H14N2O2=36+14+14+16=80E mit Spalte Z.38354#_[3]{30}{82}“4“0[7}/#_[3168]{6}“6“8“1“ für „Histon H3“ als „1“_Spalte „0/8“=QS=8_[Lysin=80]_4 mit Summe 1+8+4=“13“_“6“ „Histon H3“ („“) =136AS [H3-3A - Histone H3.3 - Homo sapiens (Human) | UniProtKB | UniProt]. Diese H3-Spalte überlagert sich mit „COL1A2“. Weiterhin ist der DNA-bindende Transkriptionsfaktor, das Zinkfingerprotein (Mensch) „PRDM5“ { } =630AS beteiligt, das links neben „Histon H3“ liegt, und zwar als „6“_absteigend über Kunstgriff 82=QS=10 für „0“_30 (Zink) mit „6“_Summe 0+30=“30“ mit 6_30 für „PRDM5“ { }= 630AS [PRDM5 - PR domain zinc finger protein 5 - Homo sapiens (Human) | UniProtKB | UniProt].
Das NAD-Stoffwechselenzym „Nicotinamid-N-Methyltransferase“ (NNMT), Protein (Mensch) „NNMT“=264AS ist somit lokalisiert. Das „NNMT-Nest“ entsteht durch eine spezielle x-förmige Kreuzung von 2 Varianten plus Kopf- und Fußvarianten, die sich auf- und absteigend unterscheiden. Vorzugsweise „NNMT-absteigend“=264AS in der Randspalte Z.38354#_[82]“4“[07]/#_[86]“6“[81]/#_[1]“0“0“[28]/#_[5]“2“[432] als „2“_00=QS=“0“_Spalte 4/6 für „64“ mit „2“_Summe 0+64=“64“ mit 2_64 für NNMT_absteigend=264AS. „NNMT_aufsteigend“ als „2“_Spalte 6/0=QS=“6“_Spalte 0/4=QS=“4“ mit 2_6_4 für NNMT_aufsteigend“=264AS [NNMT - Nicotinamide N-methyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Vanillin=80E liegt lesbar neben der NNMT-Zahl „64“ aus Spalte „4/6“ in der Randspalte Z.38354#_“2“4“{07}/#_“6“6“{81} über die Spalte „0/8“. Eine NNMT-Hemmung erfolgt aber nur auf der linken Seite über Spalte 2/6=QS=8_ Spalte „4/6“=10 für „0“ mit 8_0 für Vanillin=80E. Der Nutzen der rechten Spalte 0/8 hat den Charme, dass bei Darmkrebs der Darm=„808“ als Zielort für das Vanillin angehängt wird, und zwar als 8_0_Randspalte 7/1=QS=8 mit 80_8 für „Darm“=808(Symbol). Das Medikament „5-Fluoruracil (5-FU)“=C4H3FN2O2=24+3+18+16=61E wird bei Brustkrebs zur Chemotherapie verwendet. „5_FU“ liegt Z.38354#_8240/#_86“6“8/“100“2/#_5“2“43 als „6“_100=QS=“1“ mit 6_1 für „5-FU“=61E. „5-FU“ kann dem rechten Winkel von NNMT folgen, mit dem der rechte Winkel ausgeführt wird, um in der Spalte 0/2 für Calcium oder speziell Milch=20(Symbol) die Ziffer „2“ zu finden. Das Medikament wirkt dann zielgenau.
NNMT-Katalyse: „Nicotinamid (NAM) + S-Adenosyl-L-Methionin (SAM)= 1-Methylnicotinamid
(1-MNAM) + S-Adenosyl-L-Homocystein (SAH)“ [Komplexe Rolle der Nicotinamid-N-Methyltransferase bei der Krebsprogression | Zelltod und Krankheit (nature.com); W.Wang; u.a. März 2022; https://doi.org/10.1038/s41419-022-04713-z; s41419-022-04713-z.pdf].
Input (Substrate von NNMT): Mit „Nicotinamid (NAM)“ in der Spalte Z.38354#_{3}{0(8)(2}{4}){0}[7]/#_[16](8)[66]{8}[1]/#_[05](10){0}{2}[8]/#_[955](2{4})[32]. „Nicotinamid (NAM)“ ist Bestandteil des Coenzyms „NAD+“, das zwei Elektronen [2 e-] und ein Proton [H+] überträgt. „Nicotinamid-Adenin-Dinukleotid (NAD)“ {} = C21H27N7O14P2=126+27+49+112+30=344E kann über 2 Kunstgriffe mit Start aus der Zahl „30“ spaltenförmig beide dramatischen Zahlen „24“ verbinden, um daraus die Zahl „44“ zu gewinnen, und zwar mit „NAD“ als „3“_1. Kunstgriff 082=QS=10 für „0“_“4“ mit „3“_Summe 0+4=“4“_2.Kunstgriff Spalte 0/8/2=QS=10 für „0“_Spalte 0/4=QS=“4“ mit „34“_Summe 0+4=“4“ mit 34_4 für NAD {}=344E. „Nicotinamid“ () =C6H6N2O=36+6+14+8=64E somit spaltenförmig als „24“_Spalte 8/8=QS=“16“_Kunstgriff 10 für „0“_“24“ mit Summe 24+16+0+24=“64“ für „Nicotinamid“ () =64E. Das „S-Adenosylmethionin (SAM)“=C15H22N6O5S =90+22+42+40+16=210E entsteht aus einer Reaktion von ATP (!!)=260E und Methionin= C5H11NO2S=30+11+7+16+16=80E. Das ATP=260E als 407=QS=11=QS=“2“_“6“_Spalte 8/2=QS=10 für „0“ mit 26_0 für „ATP“=260E kreuzt, das „Methionin“ in der Spalte {} „0/8“ für Methionin {}=80E. „S-Adenosylmethionin (SAM)“ („“) =210E liegt rechts neben „Nicotinamid (NAM)“ ()=64E in der Spalte Z.38354#[30](8)(2!4){0}7!/#_16(8)“6“6“{„8“}“1“/#[05](10)[0]“2“8“/#_[955](24)[32], und zwar als QS6+6+8+1=“21“_28=QS=10 für „0“ mit 21_0 für SAM („“) =210E.
Output: „1-Methylnicotinamid (1-MNAM)“=C7H9N2O+=42+9+14+8=73E wird körpereigen in der Leber aus Nicotinsäure (Vitamin B3)=C6H5NO2=36+5+7+16=“64“ hergestellt. „1-Methylnicotinamid“ liegt in der Spalte Z.38354#_[30]{82}{40}[7]/#_[16]{8}{668}[1]/#_[05]{100}(28)/#_[955]{24}(32)/#_[88138](7)(6) über Randspalte als „28“_“32“_ QS7+6=“13“ mit Summe 28+32+13=“73“ für „1-Methylnicotinamid“ ()=73E. Das „S-Adenosyl-L-homocystein“ (SAH)=C14H20N6O5S=84+20+42+40+16=202E ist in der Biosynthese der Vorläufer von Homocystein=C4H9NO2S=24+9+7+16+16=72E. „SAH“ {} =202E als 82=QS=“10“_“40“_668=QS=“20“_“8“_“100“_“24“ mit Summe 10+40+20+8+100+24=“202“ für „SAH“ {}=202E. Das Protein (Mensch) „AHCY_ Adenosylhomocysteinase“ (!!) =432AS ist lesbar und zerlegt „SAH“=202E mit dem Cofaktor „NAD“ {}=344E zurück in Homocystein () =72E und Adenosin („“) = C10H13N5O4=60+13+35+32=140E [AHCY - Adenosylhomocysteinase - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte Z.38355#_“866“8“[1]/#_“1{00“2“}“8“/#_[5]{(2)}!({4}{3})“2“! bindet „NAD“ {} =344E in „AHCY“ als „3“_“4“_“2“_002=QS=“2“ mit „34“_Summe 2+2=“4“ mit 34_4 für NAD=344E. Adenosin=C10H13N5O4=60+13+35+32=140E zieht als Ring über „AHCY“ mit „100“_866=QS=“20“_Spalte 8/2=“10“_Randspalte 8/2=“10“ mit Summe 100+20+10+10=“140“ für Adenosin=140E. Homocystein () =72E als 43 (aus AHCY)=QS=7_2 für Homocystein () =72E. Medikament: Vergleichsweise zum „Cisplatin“, das die DNA zwecks Apoptose am Rand über das Guanin=78E erreicht, sitzt der Kreuzungspunkt vom vielfältigen „NNMT“ in der Spalte „66/00“, so dass ein Medikament auf Adenin=70E (07/ QS“6“8+2=70) oder noch tiefer auf das Thymin=66E abzielen müsste. Eine Überexpression von „NNMT“ wird auch bei Nierenkrebs festgestellt. Um im Labor eine Überexpression von „NNMT“ anzuregen, kann das „Breitbandantibiotikum“ aus der Gruppe der Tetracycline „Doxycyclin“ verwendet werden [OPUS 4 | Charakterisierung der Nikotinamid-N-Methyltransferase im klarzelligen Nierenzellkarzinom (uni-greifswald.de); S. Holstein, Diss.2019; Dissertation+Sina+Holstein-1.pdf (uni-greifswald.de)]. „Doxycyclin“= C22H24N2O8=132+24+14+64=234E wirkt gegen Bakterien, indem die Biosynthese blockiert wird. Der Bereich der „Kollagen-Klemmspalte“ für NNMT=264AS wird von einer Schleife durchlaufen, und zwar in der Spalte Z.38354#_“8“24“0“7“/#_“8“66“8“1“/#_“100“2“8“/#_[5243]“2“ mit „Doxycyclin“ als Spalte 8/8=QS=“16“_“100“_“66“_“24“ mit Summe 16+190=“206“_Schleife 0+7_8+1_2+8_2=“28“ mit Summe 206+28=“234“ für „Doxycyclin“=234E. Die untere der beiden Zahlen „24“ wird nicht mit erfasst. „Doxycyclin“ tritt mit Calcium in Verbindung, so dass die fehlende Zahl „24“ über die Calcium-Spalte „0/2“ beteiligt wird - der Mensch verzichtet bei der Einnahme auf Milch.
„Posttranslationale Modifikation“ an „NNMT“ werden durch Zugriff auf die NNMT-Zahl „66“ von „PAD1“ / „PADI2“ bewirkt. Das Protein (Mensch) „PADI1“ {}=663AS liegt mit dem Cofaktor „Calcium“ in der Spalte Z.38355#_[1]{6}{8}{66}[81]/#_[0]{5}{(1}{0)0}{(2)}[8]/#_[5524](3)[2], und zwar als „66“_“8“_ Spalte 6/5=QS=11=QS=“2“ mit „66“_Kunstgriff 8+2=“10“ für „0“_1002=QS=“3“ mit „66“_Summe 0+3=“3“ für „PADI1“ {} =663AS [PADI1 - Protein-arginine deiminase type-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „PADI2“=665AS zählt die Zahl („10“) für „0“ als 2.Kunstgriff und bildet die Ziffer „5“ aus der Spalte (2)/(3)=QS=() “5“. Bei einer „Desaminierung“ wird eine Aminogruppe abgespalten, mit dem Eingangs-Rest „Arginin“=C6H14N4O2=94E mit Ziffer „9“ rechts über 1/8=QS=“9“ plus Kunstgriff 8/2=QS=10 (als Wasser in der Katalyse) für „0“ mit 9+0=“9“ und dem Ausgangsrest „Citrullin“=C6H13N3O3=94E mit der Ziffer „9“ links über Spalte 8/1=QS=“9“, wobei seitlich 6/5=QS=“11“ in der Katalyse für NH4+=7+4=“11“ steht. Die Ziffer „4“ in der mittleren Spalte „0/4“ ist die Gemeinsamkeit beider Stoffe [PADI2 - Protein-arginine deiminase type-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Die NNMT-Funktionalität wird durch das NNMT-Vorläufersubstrat „Methionin“=80E gesteuert. Die NNMT-abhängige Modulation der Stoffwechselaktivität wird durch „Interleukin-6 (IL6)“ vermittelt [Nicotinamid-N-Methyltransferase und ihr Vorläufersubstrat Methionin steuern direkt und indirekt den bösartigen Stoffwechsel während des Fortschreitens des Nierenzellkarzinoms | Anti-Krebs-Forschung (iiarjournals.org); S. Holstein u.a. Okt 2019; DOI: https://doi.org/10.21873/anticanres.13736]. „IL6“ aktiviert über „IL6ST“ den Stat3-Signalweg, so dass „NNMT“ mit „Stat3“ in einer Zusammenhang steht [Nicotinamid-N-Methyltransferase veränderte den Zellstoffwechsel und verschärfte proinflammatorische Reaktionen durch Aktivierung des STAT3/IL1β/PGE2-Signalwegs | ACS Omega; C. Yang u.a; Okt. 2022; https://doi.org/10.1021/acsomega.2c04286].
Die Expression von „Interleukin-6 (IL6)“ wird durch bakterielles Lipopolysaccharid (LPS) und proinflammatorische Zytokine wie „IL-1b“ und „TNF-alpha“ induziert. Im Zusammenhang mit „Panx3“ liegt „IL6“ ab Z.38350 vor. „IL6“ kann in einer anderen Verwendung die Kollagen-Klemmspalte „24/66/00/24“ umschließen und ist darin mit der Zahl 1“00“ selbst vertreten. „IL6“ bildet mit „IL6R“ und „ILST“ einen geschlossenen Komplex, weil das Methionin=80E als Spalte !0/8! eine Lücke füllt. „IL6R“ wird eingeschlossen, so dass nur „ILST“ in der Randlage ein Signal auslösen kann. Das Protein (Mensch) „Interleukin-6 (IL6)“ („“)=212AS liegt in der Spalte Z.38353#_“6“9“7“[224]/#_“0“8“24!0!7/#_“6“8“66!8!1/#_“5“100“28/#_[55]243[2] aufsteigend als 697=QS=“22“_“0“_Spalte 8/8 für „88“_Spalte 6/5=QS=11=QS=“2“_„100“ mit Summe 22+0+88+2+100=“212“ für „IL6“ („“)=212AS. „IL6“ wird nach der Muskelkontraktion ins Blut abgegeben, weil zum rechten Rand kein Zugang besteht. In der Spalte 6/0/6/5/“55“=Muskel ist das Blut=26 (Eisen) über Spalte 6/5=QS=11=QS=2_0_6 mit „2“_QS0+6=“6“ für Blut=26 vorhanden. [IL6 - Interleukin-6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Interleukin-6-Rezeptor_Alpha_IL6R“ {} =468AS in Spalte 24/66 ringförmig als 4_6_QS2+6=8 mit 46_8 für IL6R {}=468AS [IL6R - Interleukin-6 receptor subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Der Antikörper Tocilizumab“=C6428H9976N1720O2018S42=38568+9976+12040+16144+672=77400E hemmt „IL6R“. Als 1/100 mit 774E über die Randziffer „7“ als 407=QS=11_66 mit Summe 11+66=77_2_722=QS=11=QS=2 mit „77“_Summe 2+2=“4“ mit 77_4 für „1/100-Tocilizumab“=774E. Das Arzneimittel wird auch bei der Behandlung von „Covid19“ erprobt. Das signaltransduzierende Molekül, Protein (Mensch) „Interleukin-6-Rezeptor_Beta_IL6ST“ ()=918AS absteigend als 243=QS=9_28=QS=10_Spalte 7/1=QS=8 mit 9_Summe 10+8=18 für IL6ST=918AS [IL6ST - Interleukin-6 receptor subunit beta - Homo sapiens (Human) | UniProtKB | UniProt].
„Interleukin-6“ produziert den „Vascular Endothelial Growth Factor (VEGF)“, der die direkt an das Blut angrenzende Zellschicht (vaskuläre Endothel) stimuliert. Das Protein (Mensch) „VEGFA“ („“)=395AS bildet ein Homodimer und folgt „IL6/IL6ST“ zunächst absteigend als Monomer in der Randspalte Z.38357#_!29!5!“5“2432/#_!2“1“38“{7}{6}/#_!28!(2){94}{3}{4}(1)/#_[27](9)(9)(38)(1)(2) als „38“_Spalte „5/1“ mit Summe 38+1=“39“_“5“ für „VEGFA“ („“)=395AS (Monomer) [VEGFA - Vascular endothelial growth factor A, long form - Homo sapiens (Human) | UniProtKB | UniProt]. Seitlich liegt eine Calcium-Spalte „0/2“ an, über die Neuropilin-1 (NRP-1)=923AS über die Spalte [8/“1“] die Endziffer „3“ als QS 1+0_2=QS=“3“ bilden könnte. „NRP-1“ nutzt aber primär links außen ein verstecktes Calcium in der Spalte Z.38355#_“1“6“(8)/#_“0“5“(1) als 6/5=QS=11=QS=2_0_1 mit Summe 2+0+1=“3“, so dass das Calcium aus der Ziffer „0“ resultiert. Die Bindung von „VEGFA“ an „NRP-1“ in der Alternativposition resultiert als dem VEGFA-Homodimer {}=395AS (Teil 2/Dopplung). Für eine Disulfid-Bindung „Schwefel=16-16“ werden 2 Kunstgriffe in einem Membran-Bereich „33“ ausgeführt. Das „VEGFA-Dimer“ wird gespiegelt darstellt, und zwar in der Spalte Z.38355#_[403]{316}[86681]/#_[3]{613}[0510028]/#_[3]{1}{9}{29}{5}“5“[24327]/#_[277288]“1“38“[76] als 1.Kunstgriff „316“=QS=10 für „0“_ 2.Kunstgriff „613“=QS=10 für „0“_19=QS=“10“_“29“_“5“ mit Summe 0+0+10+29=“39“_“5“ für VEGFA {}=395AS (Homodimer). Am „VEGFA-Monomer“ binden 2 Rezeptoren: Das Protein (Mensch) „FLT1_VEGFR1“ {}=1338AS als 94=QS=“13“_“3“_Spalte 7/4=Q=11=QS=“2“_“6“ mit „133_Summe 2+6=“8“ mit 133_8 für „VEGFR1“ {}=1338AS [FLT1 - Vascular endothelial growth factor receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „KDR_VEGFR2“ ()=1356AS als „1“_12=QS=“3“_“38“_99=QS=“18“_Kunstgriff für IL6-Kontakt 8/2=QS=10 für „0“ mit „13“_Summe 38+18+0=“56“ mit 13_56 für VEGFR2 ()=1356AS [KDR - Vascular endothelial growth factor receptor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Heparin (!!)=C26H41NO34S4=156+41+7+272+64=540E [Heparin | 9005-49-6 (chemicalbook.com)] bindet seitlich an VEGFA als „5_ 29=QS=11=QS=“2“_“2“_28=QS=10 für „0“ mit „5“_Summe 2+2=“4“_“0“ mit 5_4_0 für Heparin (!!)=540E.
Der Zelloberflächenrezeptor, das Protein (Mensch) „Neuropilin-1 (NRP-1)“=923AS bindet an „VEGFA“. Weil „Heparin“ nach links die einzige freie Bindestelle besetzt hat, muss sich „NRP-1“ über die Vorzeile ausbreiten, zumal über die Spalte „0/2“ für eine Calcium-Bindung notwendig wäre. „NRP-1“ kann aber auch alternativ das Calcium am „VEGFA-Homodimer“ finden. „NRP-1“ nutzt mit „IL6“ einen gemeinsamen Zeilenbereich. „IL6“ regelt „NRP-1“ hoch und „Stat3“ nützlich regulierend herunter [Neuropilin-1 (NRP-1), hochreguliert durch IL-6/STAT3-Signalweg, trägt zur Invasion in neuroendokrine Neoplasien der Bauchspeicheldrüse bei - ScienceDirect; J.Yang; Nov.2018; https://doi.org/10.1016/j.humpath.2018.06.030]. „NRP-1“ dient der normalen Zellfunktion. „NRP-1“ erleichtert die Bindung des viralen Spike-Proteins (Covid19) an den ACE2-Rezeptor der Wirtszelle. „NRP-1“ („“)=923AS liegt in der Spalte Z.38355#_[33]“1“6“866“8“1“/#_[13]“0“5“(1)(0)[028]/#_[92955](2)[432] und beginnt am rechten Rand mit der Ziffer „1“, die auch zu ST6ST gehört, und zieht über ST6R weiter zum IL6, und zwar als 81=QS=“9“_866=QS=“20“. Statt über die Spalte 8/1 als (1)_Spalte (0)/(2) (Calcium)=QS=“2“ mit „9“_Summe 20+(1)+(2)=“23“ mit 9_23 für NRP-1=923AS ist die Alternativposition die Regellösung: 81=QS=“9“_866=QS=“20“¬_Spalte 6/5=QS=11=QS=“2“_“0“(Calcium)_“1“ mit „9“_Summe 20+2+0+1=“23“ mit 9_23 für„NRP-1“ („“)=923AS [NRP1 - Neuropilin-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die Ziffer „1“ kann den 1.Hirnnerv (Riechnerv) und der Bereich „33“ die Nasenschleimhaut darstellen. Das Protein (Mensch) „Semaphorin-3A“ {}=771AS bindet an „NRP-1“ und ist am olfaktorischen System (Riechwahrnehmung) beteiligt und liegt in der Spalte Z.38353#_[4]!873![4697224]/#_[4]!45!33![082407]/#_{4}{0}{3}{3}{“1“}6“866“8“1“/#_{3}{6}{1}{3}“0“5“(1)(0)[028]/#_[31 92955](2)[432]. Die Endziffer „1“ von NRP-1 ist mit einer Bindung auch die Endziffer von „Semaphorin-3A“=771AS, und zwar schleifenförmig von links 4/3=QS=“7“_0/6=QS=“6“_3/1 für „31“_3/3 für „33“_“1“ mit Summe 7+6+31+33=“77“_“1“ für „Semaphorin-3A“=771AS [(SEMA3A - Semaphorin-3A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Plexin-1“ (!!)=1896AS ist zur Bindung an SEMA_3A vorgelagert, und zwar als 873=QS=18_ 45=QS=9_33=QS=6 mit 18_9_6 für „Plexin-1“ (!!)=1896AS [PLXNA1 - Plexin-A1 - Homo sapiens (Human) | UniProtKB | UniProt]. „NRP-1“ und „Semaphorin-3A“ geben der Neuronen-Entwicklung „Leithinweise“. „Semaphorin-3A“ induziert einen Wachstumskegelkollaps, wobei der Botenstoff „CRMP2“ benötigt wird [Semaphorin-3A – Wikipedia]. Das Protein (Mensch) „CRMP2_DPYSL2“=572AS greift am linken Zeilenrand „#1611“ auf die Zahl „11“(Zählgröße) der gestreckten „Axone“ zu, und zwar ringförmig linksdrehend in der Spalte Z.38353#[16]“11487“3“[4697224]/#[161]“1“4“45“3“[3082407] als 14=QS=“5“_“45“_Spalte 3/3=QS=“6“_11487=QS=“21“ mit „5“_Summe 45+6+21=“72“ mit 5_72 für „CRMP2“=572AS. Am rechten Rand [7]3/53 über 5_3/3=QS=6 mit 5_6 für „Serin“=56E ist eine Phosphorylierung von Proteinen an „Serin“ möglich [DPYSL2 - Dihydropyrimidinase-related protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „STAT3“ {} =770AS zieht in der Spalte Z.38354#_[44](533)[08]!2!{4}[07]/#_[4](0)(3)“3“{„1“}“6“[8]{!6!6!}!8![1]/#_[3](6)(„1“)“3“{0}{510}[028]/#_(19)[29552432] horizontal durch die Zahl „66“, wodurch „NNMT“ auch angesprochen wird, das vertikal und variabel durch Spalte „24/66/00/24“ zieht. Falls dadurch „NNMT“ gefördert wird, statt es zu hemmen, muss „STAT3“ bekämpft werden - was dann auch „NNMT“ trifft. „STAT3“ beginnt mit der Ziffer „1“ in der Spalte „1/0“ am Endpunkt von Neuropilin-1 (NRP-1), weil „STAT3“ auf das Hormon „Leptin“=167AS und anschließend auf das Sexualhormon „Östradiol“ reagiert, das grundsätzlich bereits über die Zahl „66“ weiblich ist. „STAT3“ {} =770AS aufsteigend über Spalte 1/0=QS=“1“_510=QS=“6“ mit Summe 1+6=“7“_“66“_“4“ mit „7“_Summe 66+4=“70“ mit 7_70 für „STAT3“ {}=770AS [STAT3 - Signal transducer and activator of transcription 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „LEPR_Leptin-Rezeptor“ () =1165AS liegt ohne Bindung seitlich entfernt von „STAT3“ auf der linken Seite absteigend als „19“=QS=10_“1“ mit Summe 10+1=“11“_Spalte 0/6=“6“_3_533=QS=11=QS=2 mit 116_Summe 3+2=“5“ mit 116_5 für „LEPR“ ()=1165AS [LEPR - Leptin receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „LEP_Leptin“ („“) =167AS liegt mit der Spalte 3/3 in der Lücke und bindet jeweils mit der Ziffer „1“ in „LEPR“ und „STAT3“, und zwar als „1“_3/3=QS=“6“_16=QS=“7“ mit 1_6_7 für Leptin („“) =167AS [LEP - Leptin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Hormon „Östradiol“ (!!)=C18H24O2=108+24+16=148E zieht über die Zahl „66“ in der Spalte !2![40]/!6!68! als 68=QS=14_ Spalte 2/6=QS=8 mit 14_8 für „Östradiol“ (!!)=148E. Die rechte Ziffer „6“ von 6“6“ gehört zur Randzahl „681“, die gespiegelt mit 81=QS=9_6 das Tyrosin=96E für die Bindungsstelle von „STAT 3“ bildet. Das „Tyrosin“ kann mit einem Kunstgriff noch eine Schleife um die STAT3-Endziffer „4“ ziehen und endet dann in der linken Ziffer „6“, und zwar als Tyrosin über 81=QS=9_0_Kunstgriff Spalte 4/6=10 für „0“_6 mit „9“_Summe 0+0+6=“6“ mit 9_6 für Tyrosin=96E. Das „Tyrosin“ resultiert aus der „Dimerisierung“ von „IL6ST(gp130)“, weil „IL6ST“ im Komplex „IL6/IL6R/IL6ST“ im Tetramer oder Hexamer doppelt vorliegt [„Die Bedeutung des gp130-Internalisierungmotivs für IL-6-vermittelte Signale und das Antigenpräsentationspotential muriner Knochenmarksmakrophagen“; F.Reinsberg; März 2022; Reinsberg_Friederike_Dissertation.pdf (uni-wuerzburg.de)]. „IL6ST(gp130)“ nutzt für das „Dimer“ die freie „Methionin“-Spalte „0/8“ zwischen „STAT3“ bzw. “IL6R“ und „IL6ST-Monomer“=918AS in der Randspalte Z.38352#_[11]“4“9“/#_[72]“2“4“/#_[24]“0“7/#_[66]“8“1, und zwar linksdrehend absteigend über Spalte 9/4 für „49“_ aufsteigend über Spalte 4/2 für „42“ mit Summe 49+42=“91“_Spalte 0/8=QS=“8“ mit 91_8 für IL6ST=918AS (Dimer) zur Verstärkung der Signaleinheit. „STAT3“ kann Dimere bilden. Ein „STAT3“-Homodimer kann sich vorgelagert bis in die Randzahl „200“ ziehen, wodurch außer Calcium auch Milch=20(Symbol) und der Brustkrebs lokalisiert wird. Der Hemmstoff „Cispene E“ besetzt diesen Bereich, wodurch die STAT3-Dimerisierung verhindert wird [Crispene E, a cis-clerodane diterpene inhibits STAT3 dimerization in breast cancer cells - Organic & Biomolecular Chemistry (RSC Publishing) J.Manaj u.a. (2015); DOI https://doi.org/10.1039/C5OB00052A]. „Cispene E (Diterpen vom Clerodan-Typ)“ wird aus der Pflanze „Tinospora crispa“ isoliert. „Diterpene“ nimmt der Mensch über die Nahrung auf, z.B. mit der Butter (nur bei Grünfutter). „Diterpene“ basieren auf der Phytansäure=C20H40O2=120+40+16=176E. Das „STAT3-Dimer“, zerlegt als 7_70 (Monomer=770AS)_“0_77“ (Homodimer, gespiegelt) liegt mit der Endziffer „0“ neben der Endziffer (4)(Monomer) in der Spalte Z.38351#_“4“{20}“{0}“/#_“{1}{1“4}“{9}“/#_{7}“{22}“{4}“/#_[2](4)“0“{7}“, und zwar ringförmig als „22“_“11“_“4“_“20“_Randspalte 0/9/4/7=QS=“20“ mit Summe 22+11+4+20+20=“77“_0“ für „STAT3“=770AS (Dimer). Phytansäure {}=176E ringförmig als „1“_“7“_“22“_“14“_“20“_Randspalte 0/9/4=QS=13 mit „1“_Summe 7+22+14+20+13=“76“ mit 1_76 für „Phytansäure“ {}=176E. „Facin“ kann zur Kontrolle gesucht werden, wobei auch der Wirkstoff „Curcumin“=C21H20O6=126+20+48=194E, Hauptbestandteil des Würzmittels „Kurkuma“ erwähnt wird [The inhibitory effect of curcumin via fascin suppression through JAK/STAT3 pathway on metastasis and recurrence of ovary cancer cells - PubMed (nih.gov); M.J.Kim; Nov. 2020; DOI: 10.1186/s12905-020-01122-2]. Das Protein (Mensch) „Fascin-1“=493AS bündelt Aktinfilamente parallel zum starren Faser-Abstand=10nm mit Aktin=374AS. Für „Fascin-1“=493AS wird die lesbare Zahl „49“ ungenutzt umgangen. „Fascin-1“ liegt in der Spalte Z.38351#_[8]{4}{20}[0]/#_{3}{1}(“1“{4)9}/#_97“2“(“2“4“)/#_ [824]“0“(7)“/#_ [8668](1), und zwar über Randspalte 4/7, zerlegt als „4“_7_Spalte 2/0 mit „4“_Summe 7+0+2=“9“_Spalte 1/2=QS=“3“ mit 4_9_3 für „Fascin-1“ („“)=493AS [FSCN1 - Fascin - Homo sapiens (Human) | UniProtKB | UniProt]. „Fascin“ kann die Zahl „49“ nicht nutzen, weil für „Aktin“ reserviert. Aktin {} =374AS als „3“_Spalte 4/1=“5“_“20“_“49“ mit „3“_Summe 5+20+49=“74“ mit 3_74 für Aktin {} =374AS. „Fascin“ besitzt 2 Hauptbindestellen für Aktin, die nur vom integrierten Tropomyosin () =568AS zur Einbindung genutzt werden, und zwar als 14=QS=“5“_24=QS=“6“_Randspalte 7/1=QS=“8“ für Tropmyosin () =568AS. Die Fasern „11“ werden wegen paarig=parallel=“2“ als paralleles Bündel=“22“ dargestellt. Über die „0“(Null)-„0“(Null) mit O=Faserquerschnitt wird der Abstand von 10nm in der Differenz gezählt, und zwar als 0_“4/2“_“4“_[0_7=Form]=QS=10 für 10nm. Das „Curcumin“ {}=194AS kann im Prinzip die maßgebliche Endzahl !4! von NNMT und STAT3 ebenfalls als Endzahl besetzen und eine Hemmung bewirken. „Curcumin“ {}=194AS liegt in der Spalte Z.38352#_[3]{11}{4}[9]/#_[972]{2}{4}/#_[82]{!4!}{07}, und zwar aufsteigend als „11“_Spalte 4/2=QS=“6“_Randspalte 4/7=11=QS=“2“_“0“ mit Summe 11+6+2+0=“19“_“4“ für „Curcumin“ {}=194AS. Das Laborexperiment gegen Krebszellen ist zwar sehr erfolgreich, aber „Curcumin“ (gelber Ingwer) erreicht real nicht das betroffene Gewebe und kann in der Leber ungünstig auf andere Krebsmedikamente einwirken.
Die Bindungsstelle von „STAT3“ dient zugleich dem Protein (Mensch) „SHP2_PTPN11_Tyrosin-Protein-Phosphatase“=593AS als negativer Regulator des JAK-STAT-Signalwegs. „SHP2“ interagiert mit „STAT3“ und endet seitlich in der Methionin-Spalte „0/8“. Die im Tyrosin=C9H11NO3=54+11+7+24=96E mit 6_81=QS=9 am Rand enthaltene Zahl „81“ dient nur zur Motivation, denn die Zahl „81“ wird der Randspalte „1/8“ entnommen. Folglich liegt „SHP2“ für Arzneimittel leicht zugänglich am Zeilenrand, der durch „Cisplatin“ bereits bekannt ist. „SHP2“ liegt in der Randspalte Z.38353#_97224/#_82407/#_86681/#_10028/#_52432, und zwar absteigend über Spalte 2/3=QS=“5“_Spalte 1/8 für „81“_Spalte 4/7=QS=11=QS=2_absteigend Spalte 2/0/8=QS=10 mit „5“_Summe 81+2+10=“93“ mit „5_93“ für „SHP2“=593AS. Die Expression von Ubiquitin ist über die Randspalte 24/[0]7 mit 4/7 für „74“_“2“ mit Summe 74+2=Ubiquitin=76AS enthalten [PTPN11 - Tyrosine-protein phosphatase non-receptor type 11 - Homo sapiens (Human) | UniProtKB | UniProt]. „SHP2“ interagiert u.a. mit dem Protein (Mensch) „INSR_Insulin Rezeptor“=1382AS, der durch Insulin (INS)=110AS aktiviert wird. Insulin (INS) {}=110AS liegt mit einer ATP-Bindung in der Spalte Z.38353#_[97](„2“)(„2“)[4]/#_82(4)(„0“)“7“/#_[8668]“1“/#_{„1“0“0“}{„2}{8“}. Insulin (Ins) als Summe 100+2+8=110 für INS {}=110AS [INS - Insulin - Homo sapiens (Human) | UniProtKB | UniProt]. „ATP“ ()=260E in der Spalte (2)(2)“4“/(4)(0)“7“ als „2“_Spalte 2/4=“6“_“0“ mit 2_6_0 für ATP ()=260E. Somit „INSR“ („“) =1382AS als 100=QS=“1“_“28“_Spalte 7/1=QS=“8“_Spalte 2/0=QS=“2“_mit „1“_Summe 28+8+2=“38“_“2“ mit 138_2 für INSR („“)=1382AS [INSR - Insulin receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Der bakterielle Virulenzfaktor, das Protein (Campylobacter pylori) „cagA“=1186AS, führt durch die Vermittlung von „SHP2“ zu Magenkrebs [PTPN11 – Wikipedia]. Das Bakterium setzt „cagA“ in der Magenwand schädlich frei. Der Magen wird über das Chlor=17E (HCL) in der Randspalte 7/1 für „17“ adressiert, wobei nur die Ziffer „7“ als Startziffer dient. Funktionell wird ein „Toxin“ von einer Membranseite auf die andere transportiert, dabei wird eine Chlorspalte passiert. Die erste Membran „33“ ist bereits zerlegt über 11 +22=“33“ unsichtbar enthalten. Die Membran-Dopplung „33/33“ liegt weit entfernt auf der linken Seite, so dass der zentrale NNMT/STAT3-Bereich störungsfrei umgangen wird, und zwar in der Spalte Z.38353#_[7]“3“4“[6]“9“7“22“4“/#_[5]“33“0“8“[240]“7“ absteigend über Randspalte 4/7=QS=“11“_quer “22“_“7“ aufsteigend Chlorspalte 9/8=“17“ mit „11“_Summe 22+7+17=“46“_quer “0“_“33“_absteigend 34=QS=“7“ mit „11“_Summe 46+0+33+7=“86“ mit 11_86 für „cagA“=1186AS [cagA - Cytotoxicity-associated immunodominant antigen - Helicobacter pylori (strain ATCC 700392 / 26695) (Campylobacter pylori) | UniProtKB | UniProt].
Der „Transkriptionsfaktor 2“, das Protein (Mensch) „HNF1B (TCF-2)“=577AS wird in Krebszellen erhöht exprimiert. Die Proteine „FXYD2“=66AS (Kalium) und „Kinesin-12“=646AS (ATP) benötigen das „HNF1B“ und können es zur Orientierung durchlaufen. Seitlich muss sich das „HNF1A“=631AS zum Heterodimer anlegen können. Als Monomer erreicht „HNF1B“ mit der Ziffer „7“ den Zeilenrand. Das Krebsmedikament „Cisplatin“ wird damit nur punktuell getroffen und wirkt nicht. „HNF1B“{} =577AS liegt in der Spalte Z.38354#_[3]“3“0“[82]{4}{0}{7}/#_[3]“1“6“[8]{6}{6}[81]/#_[30]{5}!{1}{0}[0!28]/#_[29](5)(52)(!4!3)[2], und zwar als „5“_“1“_Spalte 6/0=QS=“6“ mit „5“_Summe 1+6=“7“_Kunstgriff Spalte 40/6=QS=10 für „0“_“7“ mit „57“_Summe 0+7=“7“ mit 57_7 für „HNF1B“ {}=577AS (Monomer) _mit (5)(52)(!4!)(3) als „5“_QS5+2=“7“_QS4+3=“7“ mit 5_7_7 für „HNF1B“ ()=577AS (Homodimer) [HNF1B - Hepatocyte nuclear factor 1-beta - Homo sapiens (Human) | UniProtKB | UniProt]. Die Bildung des Homodimers wird durch das Protein (Mensch) „PCBD1“=104AS unterstützt, und zwar als 100_4 mit Summe 100+4=“104“ für „PCBD1“ (!!)=104AS [PCBD1 - Pterin-4-alpha-carbinolamine dehydratase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HNF1A („“)=631AS liegt in der Spalte 30/16 als Spalte 0/6=QS=“6“_“3“_“1“ für „HNF1A („“)=631AS [HNF1A - Hepatocyte nuclear factor 1-alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „HNF1A“ kann „CYP1A2“=516AS über die Folgespalte 16/05 aktivieren. Die Spalte verlängert sich, so dass die HNF1A-Spalte mit QS=“10“ zuzüglich 5+95=“110“ für Insulin (Ins) ergibt [CYP1A2 - Cytochrome P450 1A2 - Homo sapiens (Human) | UniProtKB | UniProt]. „HNF1B“ kann sich alternativ als Modifikation aus der Startziffer „5“ zunächst nach links wenden, durch die Spalte 3/3 für 33=männlich (Hodenkrebs) und über „HNF1A“ absteigend zum rechten Rand in die Spalte 7/1 ziehen, und zwar in der Spalte Z.38354#_[3]“308“2“407“/#_“3“1“[68668]“1“/#_“3“0“5“[10028] als „5“_0_3/3=QS=“6“_“1“ mit „5“_Summe 6+1=“7“_308=QS=11=“2“_ „2“_407=QS=11=QS=“2“_“1“ mit 57_Summe 2+2+2+1=7 mit 57_7 für „HNF1B“ =577AS (Modifikation). Die Familienmitglieder hängen im Netzwerk zusammen [Hepatozyten-Kernfaktor 1 beta: Eine Perspektive bei Krebs - PMC (nih.gov); R. Parsons u.a.; Feb. 2021; doi: 10.1002/cam4.3676]. Wenn sich „HNF1B“{} =577AS mit der Endziffer „7“ auf den rechten Zeilenrand legt, kann sich das Protein (Mensch) „HNF4A“ („“)=474AS dort nicht mehr entfalten, so dass sich die Expression reduziert. „HNF4A“ liegt in der Spalte Z.38353#_[6972]!2“4“!/#_[08]!2{„4“}!{„0“}{„7“}/#_[68]{6}{6}[81]/#_{5}{1}{0}[028], und zwar als 4_07=QS=7_4 mit 4_7_4 für HNF4A“ („“)=474AS. Über die Ziffer „0“ zieht der Dickdarm „808“ in der Randspalte 07/81 als 8_0_QS7+1=8 für „808“. In der Leserichtung „71“ kann der Magen mit Chlor=17 nicht erkannt werden. Aber die Leber „8668“ kann sich funktionell an den Darm hängen, wenn man ein Erbe der Insekten unterstellt, und die beiden Verdauungsrichtungen mit Token „86“ (hinein) / Token „68“ (heraus) [beim Parasiten umgekehrt] auf die Enzym-Ebene erweitern würde. „HNF4A“=474AS spannt sich mit den beiden Endziffern „4“ jeweils zwischen die Zeitbasis=!2“4“! und kontrolliert somit den täglichen Zeitrhythmus des Menschen. „Unterdrückt die Transkriptionsaktivität von CLOCK-BMAL1 und ist essentiell für die Aufrechterhaltung des zirkadianen Rhythmus und die Regulierung der Periode in der Leber und den Dickdarmzellen“ [HNF4A - Hepatocyte nuclear factor 4-alpha - Homo sapiens (Human) | UniProtKB | UniProt].
Das experimentelle Krebstherapeutikum (Anticancer medication) „AOH1996“=C26H22N2O4=156+22+14+32=224E zielt auf die posttranslational modifizierte Isoform von PCNA, „caPCNA“, die in Krebszellen vorkommt. „Proliferating Cell Nuclear Antigen (PCNA)“=261AS ist im Körper für die DNA-Reparatur zuständig und bildet als Homotrimer einen Ring, um den DNA-Strang als Gerüst zu umringen [PCNA - Proliferating cell nuclear antigen - Homo sapiens (Human) | UniProtKB | UniProt]. Krebszellen erzeugen außer der normalen basischen Isoform zusätzlich die saure Isoform „caPCNA (cancer-associated PCNA)“ durch eine posttranslationale Veränderung, am fertigen Protein. Durch diese Modifikation wird eine kleine Peptidregion mit „8“ Aminosäuren (L126-Y133) besser zugänglich, wobei Leucin (L/Leu)=C6H13NO2=36+13+7+16=72E und Tyrosin (Y/Tyr)= C9H11NO3=54+11+7+24=96E mit enthalten sind. Dort bindet der Wirkstoff „AOH1996“ [Die zentrale Rolle von PCNA im Rahmen der Replikation (pharmazeutische-zeitung.de) ; Ein Peptid, das eine Region im proliferierenden Zellkernantigen nachahmt, die spezifisch für Schlüsselproteininteraktionen ist, ist zytotoxisch für Brustkrebs (PMC) (nih.gov); S. Smith u.a.; doi:10.1124/mol.114.093211]. „AOH1996“=224E liegt zur Positionierung lesbar in Z.38353#_224 am Zeilenrand und muss modifiziert werden, um an die modifizierte Krebsvariante von „PCNA“, das „caPCNA“, binden zu können.
Das Protein (Mensch) „PCNA“=261AS bildet einen 5-zeiligen Komplex als aus 3 gleichen Untereinheiten (Homotrimer). „PCNA“ verändert das fertige Protein durch eine „Posttranslationale Modifikation“, wodurch sich die Interaktion mit anderen Proteinen verändert. Es wird ein Homotrimer gebildet, an dem beim letzten der 3 Monomere 2 Varianten (PCNA/caPCNA) nach der mathematischen Möglichkeit gewählt werden. Der Fall1/„PCNA“=261AS kann die Endziffer „1“ in 2 Versionen erzeugen, so dass eine „PCNA-Zerlegung“=„2_60+1“ erfolgt. Der Unterschied beginnt in der Symmetrie (8)“66“(8), in der QS=20 links oder rechts zählbar ist. Fall 1A: „PCNA“_Normal aufsteigend in der Spalte Z.38353#_[697]!2![24]/#_[082]!40![7]/#_[6]!866!8![1]/#_[5]!1![0]!0!2![8] als „2“_“40“_Kunstgriff Spalte 8/2=QS=10 für „0“_“0“_absteigend QS8+6+6=“20“ mit „2“_Summe 40+0+0+20=“60“_aufsteigend “1“ mit „2“_Summe 60+1=“61“ mit 2_61 für „PCNA“/1A (!!)=261AS (Monomer). Fall 1B: „PCNA“_Krebs in der Spalte Z.38353#_[697]{2}[24]/#_[082]{40}[7]/#_[68]{668}{1}/#_[51]{0}{0}{2}{8} als „2“_“40“_QS6+6+8=“20“_Kunstgriff QS0+0+2+8=QS=10 für „0“ mit „2“_Summe 40+20+0=“60“_“1“ mit „2“_Summe 60+1=“61“ mit 2_61 für „PCNA“/1B {}=261AS (Monomer). Die „Fälle 2/3“ sind dem „Fall1B“ vorgelagert, und zwar in der Spalte Z.38352/#_[53](1)“1“4“[9]/#_[6](9)(7){2}“2“4“/#_[0](8)(2){40}“7“/#_[68]{668}{1}/#_[51]{0}{0}{2}{8} mit Fall2/„PCNA“=261AS absteigend über Randspalte 4/7=QS=11=QS=“2“_Spalte 4/2=QS=“6“_“1“ mit 2_6_1 für „PCNA“/2 („“)=261AS (Homodimer). Fall3/„PCNA“=261AS absteigend als QS8+2=10_QS9+7=16 mit Summe 10+16=“26“_“1“ mit 26_1 für „PCNA“/3 ()=261AS (Homotrimer).
Das „PCNA-Homotrimer“ (Ringklemmenprotein) bildet in der Außenkontur 3 Mulden=“46“ [gespiegelter Kreis=64]. Die Wellenform der 3 Halbkreis-förmigen Mulden erzeugt 6 Spitzen für ein Pseudo-Hexamer [PCNA - Proliferating cell nuclear antigen - Homo sapiens (Human) | UniProtKB | UniProt]. Ergänzend zum PCNA-Komplex aus 3 einzelnen „PCNA“ kann die Gesamtsumme gewählt werden. Das Homotrimer enthält 3-fach 261AS=783AS. Das System ist umgestülpt zu finden, indem außen ringförmig 3 Mulden „46“ gruppiert werden. Weil nur das „PCNA-Trimer“ die „DNA“ durch einen Ring ziehen kann, muss es irgendeine Besonderheit geben, die dieses ermöglicht. Die Standard-Variante erzeugt nach Abzug der 3 nach außen gewölbten Mulden die Restgröße=783AS-3*46AS=783-138=645AS. Im Ergebnis wird der Kreis=64 mit der Struktur=5 kombiniert als „64_5“. Es wird eine 5-zeilige nadelartige Spalte Z.38351#_“2“/#_“1“/#_“2“/#_“4“/#_“6“ aufsteigend als „6“_“4“_QS2_1_2=“5“ mit 6_4_5 für 645AS erzeugt, die einen fiktiven „DNA-Strang“ repräsentiert. Am Nadel-Fuß liegt die Poren-Zahl „100“, die als 100=QS=“1“ Aktion ergänzt wird. Beidseitig wird die Nadel von einer Doppelziffer-Spalte flankiert, so dass eine Mulden-Restgröße für 1 Mulde=“46“AS verbleibt, die an die Pore „00“ gelegt wird, und zwar in der Randspalte Z.38351#_{84}“2“{00}/#_{31}“1“{49}/#_{97}“2“{24}#_{82}“4“{07}/#_/{86}“6“{81}#_(1)(00){2}{8}/#_[5]!2!4!3![2]. Enthalten sind: Linke Mulden-Flanke als QS 8+4_3+1_9+7_8+2_8+6=12+4+16+10+14=“56“ und rechte Mulden-Flanke QS0+0_4+9_2+4_0+7_8+1=0+13+6+7+8=“35“ mit Flanken-Summe 56+35=“91“. Mulden-Rest=Trimer-Summe „783“AS - Nadel „645“AS – Porenzahl () „1“AS-Flankensumme {} „91“AS=738-645-1-91=“46“AS (1 Mulde). Fuß-Mulde „46“ AS als „2“_“4“_absteigend Spalte 2/3 für „32“_“8“ mit Summe 2+4+32+8= (!!) “46“. In der Folgezeile ist die Mulden-Summe „138“ zur Motivation lesbar. Der Transkriptionsaktivator, das Protein (Mensch) „E2F1“=437AS nimmt die Zahl „43“ in der Fuß-Mulde auf und durchläuft die „PCNA-DNA-Nadel“, und zwar mit E2F1=437AS als „43“_QS0+2=2_Nadel enthält Kunstgriff QS6_4=10 für „0“_QS2_1_2=5 mit „43“_Summe 2_0_5=“7“ mit 43_7 für Transkriptionsfaktor „E2F1“=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Birc2“=618AS stimuliert die Transkriptionsaktivität von „E2F1“, indem die Nadel-Öse „6“ in der Zahl „6“81 mit dem Zeilenrand verbunden wird, wobei die korrekte Zifferfolge für 618AS über eine Schleife mittels Kunstgriff passend gedreht und eingefädelt wird, und zwar in der Spalte Z.38355#_[86]{6}{8}{1}#_[10]{0}{2}{8}/#_[52432] als Nadelspalte „6/0“=QS=“6“_Spalte 8/2=10 für „0“_Spalte „1/8“ für Zählrichtung „18“ mit „6“_Summe 0+18=“18“ mit 6_18 für „Birc2“=618AS [BIRC2 - Baculoviral IAP repeat-containing protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „Birc2“ bindet das Protein (Mensch) „RRP1B“=758AS mit der gemeinsamen Zahl „68“ in der Spalte Z.38352#_[7]“2“2“4“/#_[24]{“0“}{“7“}/#_[6]“6{8}“1/#_[00]{2}[8]/#_[2]{43}[2], und zwar „RRP1B“=758AS als „68“_QS0+7=“7“ mit Summe 68+7=“75“_QS2+2+4=“8“ mit 75_8 für „RRP1B“ („“)=758AS [RRP1B - Ribosomal RNA processing protein 1 homolog B - Homo sapiens (Human) | UniProtKB | UniProt]. Der Transkriptionsaktivator, das Protein (Mensch) „E2F1“=437AS aktiviert „Birc2“, indem es „Birc2“ mit einem Kunstgriff passiert und sich in „RRP1B“, mit „Birc2“ als Sandwich, verankert, und zwar „E2F1“=437AS als „43“_Kunstgriff Spalte 8/2=QS=10 für „0“_QS0+7=“7“ mit „43“_Summe 0+7=“7“ mit 43_7 für „E2F1“ {} =437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Krebstherapeutikum „AOH1996“=224E liegt in der Spalte Z.38353#_[697]“2“2“4“/#_[08240]“7“/#_[68668]“1“/#_[5100]“2“8“ und kann die lesbare Randzahl „224“ 4-zeilig C-förmig und gespiegelt erweitern, wobei die Randziffer „1“ der Krebs-Version „PCNA“/1B=261AS zur Bindung mit aufgenommen wird, und zwar absteigend als 28=QS=10_1(!) mit Summe 10+1=“11=reduziert QS=“2“_Spalte 4/7=11=QS=“2“_QS2+2=“4“ mit 2_2_4 für „AOH1996“=224E. Die Besonderheit von „AOH1996“=224E liegt folglich im Gleichgewicht QS2+2=“4“ vs. „4“. Mit dem besetzten Zeilenrand werden Interaktionen von „caPCNA“ verhindert, wobei gesunde Zellen nicht betroffen sind. Die Eckziffer „8“ von „caPCNA“ kann den Bereich von 8 Aminosäuren in der Spalte Z.38353#_[97]“2“2“4“/#_[8240]{„7“}/#_[86]!6!8!{“1“}!/#_[100]!{“2“}!{“8“}! lokalisieren, in denen der Wirkstoff „AOH1996“ („“) bindet. Leucin=72E als „7“_QS1_2+8=11=QS=2 mit 7_2 für Leucin ()=72E und als Spalte 1/8=QS=9_Kunstgriff Spalte 8/2=10 für 0_6 mit „9“_Summe 0+6=“6“ mit 9_6 für Tyrosin (!!)=96E. „AOH1996“ („“)=224AS teilt sich den Zählweg mit dem Protein „RNA Polymerase II_RPB1“=1970AS, und zwar in der Spalte Z.38353#[97]“2“2“4“/#_824{0}{„7“}/#_866{8}{„1“}/#_100{„2“}{„8“} mit „RPB1“=1970AS als QS2+8=10_QS8+1=9 mit Summe 10+9=19_7_0 für „RPB1“ {}=1970AS [POLR2A - DNA-directed RNA polymerase II subunit RPB1 - Homo sapiens (Human) | UniProtKB | UniProt]. „AOH1996 verstärkt die Interaktion zwischen PCNA und der größten Untereinheit der RNA-Polymerase II, RPB1, und dissoziiert PCNA von aktiv transkribierten Chromatinregionen, während es in transkriptionsabhängiger Weise DNA-Doppelstrangbrüche induziert“ [Small molecule targeting of transcription-replication conflict for selective chemotherapy - PMC (nih.gov); L. Gu u.a., Aug. 2023; doi: 10.1016/j.chembiol.2023.07.001; PMCID: PMC10592352].
„AOH1996“ wird im Jahre 2024 zunächst als experimenteller Arzneistoff eingesetzt. Das Arzneimittel „Cisplatin (cis-Diammindichloridoplatin; DDP)“ ist ein Zytostatikum zur Hemmung des Zellwachstums bzw. der Zellteilung und enthält 1 Platinatom. Sobald „Cisplatin“ in die Zelle gelangt, werden die Chlor-Atome durch Wassermoleküle verdrängt und ein starkes „Elektrophil“ erzeugt. „Chlor“=17E ist in der Randspalte „7/1“ vorhanden und geht in Wasser={28} direkt über, und zwar in der Randspalte Z.38353#_[97224]/#_[824](0)“(7)“/#_[86]!6(8)!“1“/#100{!28!}. Auf der DNA wird das Wassermolekül dann bevorzugt durch Guanin=C5H5N5O=30+5+35+8=78E verdrängt. Die Wirkung beruht auf einer Hemmung der DNA-Replikation durch Querverknüpfungen zweier benachbarter „Guanin-Basen“ eines DNA-Strangs. In der Spalte „07/8[1]“ ist das „Guanin“ mit („7“)_Spalte (0)/(8)=QS=“8“ mit 7_8 für Guanin=78E vorhanden, was dafür nochmals mit der Ziffer als Dopplung verschmelzen muss, um erneut „Guanin“ anzukoppeln, und zwar mit der Ziffer („8“) in !68!_!28!(Wasser)=QS=10 mit Summe 68+10=Guanin=78E. Wasser wird durch Guanin verdrängt, indem es mathematisch zu Guanin verarbeitet wird. Das Verschmelzen „8-[6]8“=QS=22=11+11 (Zählgröße) ist eine Denaturierung, die zur Apoptose führt. Cisplatin=Pt(NH3)2Cl2=78+[(7+3)*2]+34=78+20+34=132E ist gleichgerichtet in „AOH1996“ enthalten und hemmt die Zellteilung (Wachstum). Für die Trans-Form ist die Startziffer „2“ die Endziffer. Beide Versionen verzweigen gabelförmig um die Ziffer „8“. Hilfsgrößen sind K2[PtCl4]=38+[98+68]=204E, Ammoniak=NH3=7+3=10E und Glutathion=C10H17N3O6S=60+17+21+48+16=162E. „Cisplatin“ liegt in der Spalte Z.38353#_[972]{2}{4}/#_[8](2)(4)[0]{7}/#_86(6)[8]{1}/#_(1)(0)(0){2}{8}, und zwar als „2“_Spalte 4/7=QS=“11“ mit Summe 2+11=“13“_Spalte 1/8=9_2 mit „13“_Summe 9+2=11=QS=“2“ mit 13_2 für „Cisplatin“ {}=132E. Die Trans-Form „Transplatin“ =Cl2H6N2Pt=34+6+14+78=132E ist ein trans-Stereoisomer von „Cisplatin“, das keine nützliche pharmakologische Wirkung entfaltet. Der Trans-Form „Transplatin“ als QS1+0+0_6_4_2=“13“_“2“ für „Transplatin“ ()=132E fehlt eine direkte Randlage zur Wirksamkeit. Die Endziffer „2“ ist die Startziffer von „Cisplatin“ aus „2“4 bzw. ist die „24“ in der Folgezeile nochmals vorhanden, und kann direkt seitlich entnommen werden. „Cisplatin“ entwickelt Resistenzen und Krebspatienten sind von starken Nebenwirkungen betroffen. Dazu gehört auch der mögliche Gehörverlust. Calcium=20E liegt in der Spalte 2/0. Das zum Hören ebenfalls notwendige Kalium=19E im Gegenlauf durch das Calcium, und zwar über die Randspalte 7/1 für 17_Spalte 2/0=QS=2 mit Summe 17+2=Kalium=19E. Die Schwerachse=84 in der Spalte 2/0/8/2 mit Summe 82+0+2=“84“ wird dadurch tangiert. Naturstoffe, wie Ellagsäure=C14H6O8=84+6+64=154E [Granatäpfeln (Punica granatum)] und Resveratrol=C14H12O3=84+12+24=120E verstärken im Labor experimentell die Wirksamkeit von „Cisplatin“ [„Neue Ansätze zur Überwindung oder Verhinderung der Cisplatinresistenz in verschiedenen Krebszelllinie“; L. Engelke; Mai 2015; norm Diss Engelke final pdfA.pdf (uni-duesseldorf.de)].
Die katalytische Einheit der DNA polymerase delta, Protein (Mensch) „Pold1“=1107AS ist mit „PCNA“ verbunden. Über die Zählgröße „11“ wird ein Ring um die Spitze der „DNA-Nadel“ gelegt, und zwar in der Spalte Z.38351#_[085](6)(3)[92]/#_858(4)“2“0“[0]/#_!6!{5}{3}“11“4“[9]/#_!4!{6}{9}“7“2“2“[4] als „11“absteigend 20=QS=“2“_aufsteigend Spalte 4/2=QS=“6“_“2“ mit „11“_Summe 2+6+2=10 für „0“_“7“ mit 11_0_7 für „Pold1“ („“)=1107AS. Der Eisen-Schwefel-Komplex [4Fe-4S] für Fe=4-fach „26“=104E und Schwefel=4-fach „16“=64E benötigt das Zink als weiteren Liganden, weil der Schwefel zwischen Zink und Eisen an der Ecke eingeklemmt wird. „Zink“ enthält zwar die gesuchte Zahl „64“ für 4-fach-Schwefel, die aber vom Eisen zur Komplex-Bildung zu weit entfernt liegt. „Zink“=30E als „3“_Spalte 6/4=10 für „0“ mit 3_0 für „Zink“ ()=30E. „4-fach-Schwefel“=64E liegt entweder im Paket „643/469“ verdeckt außen am Eisen als Spalte 6/4 für 64E mit an, oder kann direkt als 58+QS4+2=6 über Zink in „Pold1“ mit Summe 58+6=64E einbinden oder nur in Zink einbinden mit „58“_Spalte 5/6=QS=11=QS=“2“_“4“ mit Summe 58+2+4=“64“ für „4-fach-Schwefel“ (!!)=64E. „4–fach Eisen“=104E über Spalte 3/9 für 93_Spalte 5/6=QS=11 mit Summe 93+11=104 für „4-fach-Eisen“ {} =104E [POLD1 - DNA polymerase delta catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Die katalytische Einheit der DNA Polymerase Epsilon, Protein (Mensch) „Pole“=2288AS ist mit „PCNA“ ebenfalls verbunden. Weil die dieselben 3 Liganden vorhanden sind, müssen sich „Pole“ und „Pold1“ örtlich trennen, indem „PCNA“ doppelt vorhanden ist. Das Protein (Mensch) „Pole“ liegt am Führungsstrang (Leading strang) und „Pold1“ am verzögerten Strang /Folgestrang (Laaging strand). Folglich liegt „Pole“ in der Spalte Z. 38351#_[84]“2“[00]/#_[3]“1“1“[49]/#_[9]“72“2“[4]/#_“8“2“4“0“[7], und zwar über Spalte „2/1“ für „21“_“1“ mit Summe 21+1=“22“_“72“_Spalte 2/0=QS=“2“_QS8+2+4=“14“ mit „22“_Summe 72+2+14=“88“ mit 22_88 für „Pole“=2288AS [POLE - DNA polymerase epsilon catalytic subunit A - Homo sapiens (Human) | UniProtKB | UniProt]. Die DNA-Polymerase alpha, das Protein (Mensch) „Pola1“=1462AS trägt auf beide Stränge einen „Primer“ auf. Mit dem speziellen Zink-Motiv, einer Zink-Null 3“0“ als Spalte 6/4=QS=10 für „0“, liegt „Pola1“ in der Spalte Z.38350#_[085]“6“3“[92]/#_[858]“4“2“[00]/#_[653]“1“1“4“[9]/#_[46972]“2“[4], und zwar über Spalte „6/4/1“ absteigend als „1_4_6“_aufsteigend Spalte 3/2=QS=“5“_QS1+4=“5“ mit „146“_Summe 5+5=10 für „0“_“2“ mit „146“_Summe 0+2=“2“ mit 146_2 für „Pola1“=1462AS. An der Katalyse ist Desoxycytidintriphosphat (dCTP)= C9H16N3O13P3=54+16+21+104+45=240E beteiligt, und zwar in der Spalte „0/4/2“ als 2_4_0 für „dCTP“=240E [POLA1 - DNA polymerase alpha catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]._dat23.01.2024
Replikation zur Vervielfältigung von Erbinformationen: Die identische Verdopplung eines DNA-Moleküls ist die Voraussetzung für die Kernteilung und die spätere Zellteilung [siehe: DNA Replikation • Ablauf, Enzyme, Eukaryoten und Prokaryoten • [mit Video] (studyflix.de)]. Die Replikation startet an definierten Stellen (Replikationsursprünge). Während der „Initiation“ wird zuerst die DNA-Doppelhelix durch die „Topoisomerase“ entspiralisiert, d.h. der schraubenförmige Doppelstrang formiert sich in Form einer Strickleiter. Dann öffnet das Enzym „Helikase“ der beiden Stränge, indem die Wasserstoffbrücken getrennt werden. Die Einzelstränge müssen vor den Abbau mittels „Einzelstrang-bindende Proteine (SSBs)“ geschützt werden, d.h. die Stränge werden stabilisiert. An der Replikation sind diverse Proteinkomplexe beteiligt, die nachfolgend ermittelt werden: Um DNA zu synthetisieren, wird die doppelsträngige DNA von DNA-Helikasen vor den Polymerasen abgewickelt und bildet eine Replikationsgabel, die zwei einzelsträngige Matrizen enthält. „Helikasen“ sind Motorproteine, die das Erbgut entschlüsseln und 2 Nukleinsäurestränge unter Verwendung von Energie aus „ATP“ trennen. Am DNA-Leitstrang mit „PCNA“ und der „DNA-Polymerase Epsilon (Pole)“ liegt der „CMG-Komplex [Cdc45_Mcm2-7_GINS(Go-Ichi-Ni-San)-Komplex]“, über den die hetero-hexamere „MCM2-7_Helikase“ aktiviert wird. „Das Herzstück des Replisoms ist der „Mcm2-7-Komplex (MCM)“, der nach der Bindung an den „Origin Recognition Complex (ORC)“ aus QRC1-6 auf die DNA geladen wird“ [Ein chromatinisierter Ursprung reduziert die Mobilität von ORC und MCM durch Wechselwirkungen und räumliche Einschränkungen | bioRxiv (www-biorxiv-org.translate.goog); N.Dekker u.a. Jun 2023; Doi: 10.1038/S41467-023-42524-8]. Zuerst bilden sich „ORC2, 3, 5“ an einem speziellen ATP, dass nur als Ligand die Position lokalisiert, und zwar in der Spalte Z.38348#_{74}{„6“}{„0“}(5)(8)(2)!7!3!/#_[54]“3“34“(77)!4!4!/#_[3408]“5“6392 mit „ATP“ als QS7+4=11=QS=“2“_60 für ATP {}=260E. Das Protein (Mensch) „ORC3“=711AS liegt am rechten Rand als „7“_Spalte 3/4=QS=“7“_“4“ mit „7“_Summe 7+4=“11“ mit 7_11 für „ORC3“ (!!)=711AS [ORC3 - Origin recognition complex subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „ORC2“=577AS als „5“_Kunstgriff QS8+2=10 für 0_77 mit „5“_Summe 0+77=“77“ mit 5_77 für „ORC2“ () =577AS [ORC2 - Origin recognition complex subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „ORC5“=435AS als „3“_60=QS=“6“_“34“ mit Summe 3+6+34=43_5 für ORC5 („“) = 435AS [ORC5 - Origin recognition complex subunit 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das wirksame „ATP“ liegt in der Spalte 20/4/6/0, die vom Protein (Mensch) „ORC4“=436AS besetzt wird, und zwar in der Spalte Z.38350#_[8]5{6}{3}{9}{2}/#_[5](8)(4){2}{0}{0}/#_“5“3“(1)(14)[9]/#_“6“9“[72](2)(4)/#_0“82"40“[7}/#_ über ATP-Startziffer „2“ als 200=QS=“2“_92=QS=11=QS=“2“ mit Summe 2+2=“4“_“3“_“6“ für „ORC4“ {} =436AS [ORC4 - Origin recognition complex subunit 4 - Homo sapiens (Human) | UniProtKB | UniProt]. „ORC1“ und „ORC6“ sind nur lose gebunden. „ORRC1“ hat mit ATP die stärkste Aktivität als ATPase. „ORC1/4/5“ besitzen ein ATP-Motiv. Folglich enthalten „ORC2/3“ am rechten Rand kein ATP-Motiv. Nach erfolgreicher Bindung werden „Cdc6“ und „Cdt1/MCM“ an „ORC“ rekrutiert [Origin recognition complex - DocCheck Flexikon]. Protein (Mensch) „ORC1“=861AS aufsteigend als „8“_Spalte 4/1 für 41_14 mit „8“_Summe 41+14=55_QS2+4=6 mit 8_Summe 55+6=61 mit 5_61 für „ORC1“ ()=861AS. „ORC1“ zieht mit der Ziffer „1“ quer durch die Spalte „2/1/2“, so dass eine Bindung an Magnesium=12E erfolgt [ORC1 - Origin recognition complex subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ORC6“=252AS endet mit der ATP-Endziffer=“0“(Null), und zwar über die Schleife absteigend Spalte 5/6=QS=11=QS=2_aufsteigend Spalte 3/9=QS=12_Kunstgriff QS8+2=10 für „0“_“40“ mit „2“_Summe 12+0+40=“52“ mit 2_52 für ORC6 („“) =252AS. Die ORC-Komplex kann nicht lückenlos gestaltet werden, eine Lücke „72“ bleibt frei [ORC6 - Origin recognition complex subunit 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CDC6“=560AS ist ein ATP-bindendes Protein und wird zusammen mit „ORC“ benötigt, um MCM-Proteine auf die „DNA“ zu laden. Die MCM-Proteine lösen später die ORC-Proteine aus dem Komplex, damit im Zellzyklus [G1-, G2-, S- und G0-Phase] während der S-Phase keine erneute Replikation starten kann. Zusätzlich geht „CDC6“ wieder verloren und „CDT1“ wird durch „GEMININ“ gehemmt [ORC cycle. Cdc6 facilitates binding of Orc proteins to somatic cell... | Download Scientific Diagram (researchgate.net)]. „Während der S-Phase werden neben der DNA auch die Zentriolen verdoppelt sowie Histone zur Verpackung der DNA synthetisiert.“ [ S-Phase - DocCheck Flexikon].
Die Endziffer „0“ von „CDC6“ ist von der Original-ATP-„0“(Null) als ATP-Quelle seitlich 3 Ziffern entfernt, so dass sich „ATP“ speziell neu zählen muss, um Kontakt zum Ursprungs-ATP herzustellen. „CDC6“=560AS liegt lesbar am linken Rand in der Spalte „5/6/0“ mit 5_6_0 für „CDC6“=560AS [CDC6 - Cell division control protein 6 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. „CDT1 wird dann zusammen mit dem Protein „CDC6“ am „präreplikativen Komplex (Prä-RC)“ rekrutiert, gefolgt von „Minichromosomen-Erhaltungskomplexen (MCM2-7)“ [DNA-Replikationsfaktor CDT1 – Wikipedia]. Das Protein (Mensch) „CDT1_Chromatin Licensing and DNA Replication Factor 1“ =546AS legt sich als Schleife an die beiden Endnullen von „ATP“ und „CDC6“, so dass sich in dieser Schleife eine spezielles ATP in die Original-ATP-Spalte zieht, so dass „CDC6“ an „ATP“ angeschlossen wird. In dieser Schleife wird das Protein „MCM6“ als Bindung zum „MCM-Komplex“ aufgenommen [Regulation und Funktion von Cdt1; Ein Schlüsselfaktor für Zellproliferation und Genomstabilität - PMC (nih.gov); J.G. Cook, u.a.; Dez. 2016; doi: 10.3390/genes8010002]. „CDT1“ („“) =546AS liegt in der Spalte Z.38354#_[!0!824!0!7]/#_“6“866“8“[1]/#_“5“10“02“[8] absteigend als „5“_“10“_“0“_Spalte 8/2=QS=“10“_QS8+6+6=“20“_“6“ mit „5“_Summe 10+0+10+20+6=“46“ mit 5_46 für „CDT1“ („“)=546AS [CDT1 - DNA replication factor Cdt1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „GEMININ (GMNN)“ {}=209AS liegt im Zellkern und wirkt in der S-Phase als, „DNA-Replikationsinhibitor“, weil „CDT1“ gehemmt wird. Besondere Merkmale fehlen, so dass es direkt auf „CDT1“ liegt, und dann hemmend wirkt, wenn der „GMNN-Spiegel“ im Prozess angehoben ist. Die Zahl „20“ bezieht sich auf den 20er-Block von „CDT1“. „GMNN“ liegt in der Spalte Z.38355#_{1}{686}[681]/#_{0}{51002}[8], die das Zentrum aller wesentlichen Ereignisse bildet, und zwar als 686=QS=“20“_aufsteigend Spalte 1/0=QS=“1“_51002=QS=“8“ mit „20“_Summe 1+8=“9“ mit 20_9 für „GEMININ“ {} =209AS [GMNN - Geminin - Homo sapiens (Human) | UniProtKB | UniProt]. „GMNN“ enthält mit Spalte „6/5“ und Serin=C3H7NO3=18+7+7+24=56E eine Serin-Spalte. Die „Caseinkinase II (CSNK2/CK2)“ kontrolliert den Zellzyklus und phosphoryliert „GMNN“ an „Serin“, was zu einer verstärkten Bindung an „HOX“ führt. Das Tetramer besteht aus je 2 Alpha/Beta-Einheiten. Das Protein (Mensch) „CSNK2B“=215AS besitzt eine Zink-Bindung, so dass sich mit 2 Zink-Zeilen ein Homodimer in der Spalte Z.38354#_[44]{53!3}[0!=Zink _82407]/#_[4033]{168}[6681]/#_[361!30! Zink]“5“10“0“2“[8] bildet, und zwar als 53!3[0! Zink=30]=QS=11=QS=“2“_168=QS=“15“ mit 2_15 für „CSNK2B“ {}=215AS (Monomer) und mit „2“_“0“_“10“_“5“ mit „2“_Summe 0+10+5=“15“ mit 2_15 für „CSNK2B“=215AS (Homodimer) [CSNK2B - Casein kinase II subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Heterodimer „CSNK2A1/ CSNK2A2“ verbindet sich über das erforderliche „ATP“ {}=260E in der Spalte Z.38353#_[4](8)(7)(3)[4]_/#_{4}(4)[5](3)3/#_{4}{0}331/#_{3}{6}130/#_31929_aufsteigend 4/4/3=QS=11=QS=2_absteigend Spalte 0/6 für 6_0 mit 2_6_0 für ATP=260E. „CSNK2A1“ () =391AS über „3“_“7“_Spalte 8/4 für 84 „3“_Summe 7+84=“91“ mit 3_91 für „CSNK2A1“ () =391AS [CSNK2A1 - Casein kinase II subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „CSNK2A2“ („“) =350AS aufsteigend als „3“_Spalte 3/2=QS=5_absteigend Spalte 1/9=QS=10 für „0“ mit 3_5_0 für „CSNK2A2“ („“) =350AS [CSNK2A2 - Casein kinase II subunit alpha' - Homo sapiens (Human) | UniProtKB | UniProt].
„Hox-Gene“, in 4 ähnlichen Gen-Clustern (HOXA/HOXB/HOXC/HOXD), erzeugen Transkriptionsfaktoren, die andere Gene steuern und mit der „Homöobox“ eine charakteristische Sequenz enthalten. Das gemeinsame Muster ist eine Folge von „64“ Aminosäuren zur Bindung an die DNA (DNS). Sie regulieren die Körperstruktur und Körperentwicklung. Das Protein (Mensch) „HOXB9_HOX2“ () =250AS liegt in der Spalte Z.38353#_[48](7346)[9]_/#_{4}{4}(53)(30)[8]_/#_{4}{0}{3}(3)“1“6“8“_/#_{3}{6}{1}“30“51“_/#_{3}{1}“9“2“[955]_, und zwar ringförmig absteigend über Spalte 3/3=“6“_“5“ mit Summe 6+5=11=QS=“2“_7346=QS=“20“_aufsteigend_“30“ mit „2“_Summe 20+30=“50“ mit 2_50 für HOXB9 () =250AS [HOXB9 - Homeobox protein Hox-B9 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HOXC9_HOX3“ („“) =260AS enthält die Zahl „60“, kann aber nicht dem ATP=260E entsprechen, weil darüber „HOXA9“ läuft, um einen geschlossenen Ring zu bilden, der mit der Form der roten Blutkörperchen in Beziehung steht. „HOXC9“ („“) =260AS ringförmig als 92=QS=11=QS=“2“_“30“_168=QS=“15“_absteigend 51 für „15“ mit „2“_Summe 30+15+15=“60“ mit 2_60 für „HOXC9“ („“) =260AS [HOXC9 - Homeobox protein Hox-C9 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HOXA9_HOX1“ {} =272AS absteigend als „3“_Spalte 6/1=QS=“7“_“1“ mit Summe 3+7+1=11=QS=“2“_“3“_Spalte 4/0=QS=“7“ mit „2“ Summe 3+4=“7“_aufsteigend Spalte 4/4/3=QS=11=QS=“2“ mit 2_7_2 für „HOXA9“ {} =272AS. „HOX1-3“ bilden einen geschlossenen Komplex mit der gemeinsamen Spalte 73/[5]3/[3]3/[1]3/[9]2, die mit QS73+3+3+3+2=Schwerachse=“84“ erzeugt. „HOXA9“ kann mit QS44_40=84E selbst die Schwerachse erzeugen: „Sequenzspezifischer Transkriptionsfaktor, der Teil eines entwicklungsregulatorischen Systems ist, das Zellen mit spezifischen Positionsidentitäten auf der anterior-posterioren Achse ausstattet.“ [HOXA9 - Homeobox protein Hox-A9 - Homo sapiens (Human) | UniProtKB | UniProt]. Aufgrund der Spalte „36/31“ mit QS3+6=9_QS3+1=4 mit 9_4 für Arginin=94E wird „HOXA9“ durch die Arginin-Methyltransferase, das Protein (Mensch) „PRMT5“=637AS methyliert und damit modifiziert. „PRMT5“ zieht über „HOXA9“ in der Spalte „403“/“3“6“[1], und zwar als „6“_“3“_403=“7“ mit 6_3_7 für PRMT5=637AS [PRMT5 - Protein arginine N-methyltransferase 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Erythrozyten (rote Blutzellen) unterscheiden sich nach embryonalem, fötalem und adultem Stadium, weil sich die Expression von „HOXA9“ steigert [HOXA9 – Wikipedia]. Die bikonkave Form ist das Endstadium. Der Komplex „HOXA9/HOXB9“ kann die bikonkave Form „46_46“ als 2 Gegenkrümmungen „46“ zum Kreis=64 (konvex) darstellen. Die Spalte „7“[346]/“53“3“0“ kann die Zahl „7“ bis QS5+3=“8“ für Durchmesser=7,5 Mikrometer erzeugen, wobei mit „3_0“ der Faktor 10^3 für 7000-8000 nm folgt. Über die Spalte 30/61 folgt die Form=7 mit QS6+1=“7“. Der Durchmesser muss mit der Dicke kombiniert sein, dafür sind 7346=QS=20_30 vorhanden, um die mittlere Zahl 25 zu bilden. Davon kann die Ziffer „0“ als Durchmesser-Symbol dienen, so dass sich die Dicke=2,5 Mikrometer ergibt. Die 1. Krümmung „46“ ist lesbar. Der Spalte „3/3“ für Membran=33 folgt „4033“ mit „4“_QS0+3+3=“6“ mit „46“ für die bikonkave 2. Krümmung. In der Spalte 44/40 ist mit 44_4 ein Netzwerk „444“ vorhanden. Das Blut=26(Eisen) wird in der Spalte 7346/[5]330 mit 7346=QS=“20“_330=QS=“6“ mit Summe 20+6=26 für „Blut“=26 (Symbol) dargestellt. Formänderungen ergeben sich, wenn die 2. Krümmung alternativ nach rechts in „HOXC9“ einzieht, und zwar über „316“ mit QS3+1=“4“_“6“ für „konkav“=46 (ohne Netzwerk 444). Die bikonkave Krümmung deckt als beidseitige Radkappe den Schlauchring ab, der sich als Rotationskörper um die Schwerachse windet. Diese ist in der Netzwerksspalte „44/40“ summarisch enthalten. Der „Rotationsring“ zur Schlaucherzeugung ist über die Spalte 34/3[3] an die Membran gekoppelt, und zwar mit QS3+3=“6“_“4“ für Kreis ()=64. Die folgenden Zeilen weisen zum Rotationswinkel=360° mit der Winkelsumme {} =30-40-40-30-100=240° ein Defizit auf. Das Defizit („“)=120° wird gefüllt, indem der Kreis=64 über eine Winkel-Verbindungslinie eingebunden und 2 Winkel-Lücken gestopft werden, so dass der Rotationswinkel=360° im Komplex lückenlos enthalten ist. „Ringkomplex“ in der Spalte Z.38353#_[487](3)(4)[697224]/#_[4]“45“(3){30}“82“{40}[7]/#_{40}“33“1686“[681]/#_[361]{30}“5“{100}[28] mit Restwinkel=120° als 45_33_16866=QS=27 mit Summe 45+33+27=105_obere Lücke 82=QS=10_ untere Lücke=5 mit Summe 105+10+5=Restwinkel=120°. Zellkern und Organellen sind nicht vorhanden. „HOXC9“ wirkt als negativer Regulator auf Blutendothelzellen. „Stabilin 1/Stabilin 2“ sind Hyaluronrezeptor-Homologe [HOXC9 reguliert die Bildung von parachordalen Lymphangioplasten und des Ductus thoracicus im Zebrafisch über Stabilin 2 - PubMed (nih.gov); S.Stoll; März 2013; DOI: 10.1371/journal.pone.0058311]. „HOXC9“ teilt die Zahl „51“ mit dem Protein (Mensch) „STAB2“, und zwar in der Randspalte Z.38356#_“5“1“[0028]/#_“5“524“[32] als 524=QS=11=QS=“2“_Spalte 5/5 für 55_1 mit 2_55_1 für „Stabilin 2“=2551AS. Über die Spalte 002/2[43] sind Calcium=20E / Hyaluronsäure=200E gebunden [STAB2 - Stabilin-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „HOXD11_HOX4“ {} =338AS liegt ringförmig rechts neben „HOXB9/HOXC9“ und durchläuft die Zentral-Spalte „66/00“ als Schleife, und zwar in der Randspalte Z.38353#_[346]{9}[7224]/#_[330]{8}{(2)4}[07]/#_[3168]({6}){6}[81]/#_[3051}({0})({0})[28}/#_[2](9)(55)({2}{4})[32], aufsteigend über Spalte 9/8=QS=“17“_24=QS=“6“_Spalte 6/0/4=QS=“10“ mit Summe 17+6+10=“33“_absteigend Spalte 6/0/2=QS=8 mit 33_8 für „HOXD11“{}=338AS. Alternativ: „HOXD11“ ()=338AS absteigend „9“_55=QS=10 für „0“_“24“ mit Summe 9+0+24=“33“_0_Spale 2/6/0=QS=8 mit „33“_Summe 0+8=“8“ mit 33_8 für „HOXD11“ ()=338AS [HOXD11 - Homeobox protein Hox-D11 - Homo sapiens (Human) | UniProtKB | UniProt].
Der „Minichromosomen-Erhaltungsproteinkomplex (MCM)“ bildet ein Hetero-Hexamer aus den Proteinen „MCM2-7“, die zur Enzymsuperfamilie der „AAA+-ATPasen“ gehören. „AAA“ [„A“TPases „a“ssociated with a variety of cellular „a“ctivities] ist „kein“ Alanin („A“/Ala)-Motiv, aber ein Arginin(R/Arg)-Finger trägt zur Stabilität bei. Eine Magnesium-Abhängigkeit ist vorhanden, weil die ATP-Startziffer „2“ aus einer Mg-Spalte {„2“/1/2} entspringt. „ATP“ wird mittels Katalyse in „ADP“ überführt, und zwar in der Spalte Z.38351#_[584]!{2}!{0}![0]/#_[53]!1!1!{4}[9]/#_[972]{2}4/#_[824]{0}[7] mit „ATP“=260E über Spalte „20/4/2/0“ mit „2“_QS0_4_2=“6“_“0“ mit 2_6_0 für „ATP“ {}=260E. „ADP“=220E als 11=QS=“2“_“20“ für „ADP“ (!!)=220E und doppelt im Ring als 22_Spalte 0/4=QS=4_42=QS=6 mit 22_Summe 4+6=10 für „0“ mit 22_0 für „ADP“. Die Proteine auf der linken Seite müssen das „ATP“ alternativ finden. Real schließt sich eine Kette „MCM2-6-4-7-3-5“ ringförmig um die „DNA“ zusammen. Nachfolgend wurden die Proteine dagegen für einen lückenlosen Komplex ausgewählt, der einer zeitlichen Abfolge entspricht (zuletzt MCM6).
Das Protein (Mensch) „MCM3“ () =328AS liegt in der Spalte Z.38348#_[46058](2)(7)(3)/#_[433477](4)(4)/#_[408563](9)(2)/#_[385842]{0}{0}/#[3653]“1“1“{49}/#_[3469]“7“2“2“4“, und zwar vorgelagert am rechten Rand und angrenzend an „ATP“, und zwar schleifenförmig als „3“_aufsteigend Spalte 4/2=QS=“6“_absteigend Spalte 4/9=QS=“13“ mit „3“_Summe 6+13=“19“_QS2+7=“9“ mit „3“_Summe 19+9=“28“ mit 3_28 für „MCM3“ () =328AS. „MCM3“ verhindert mit der Ziffer „9“, dass „MCM2“=904AS die Spalte „9/0/4“ komplett lesbar ausfüllen kann. Zur Interaktion besteht Kontakt zu „MCM2/5, die MCM7 verdecken. Die Interaktion mit CDC6=560AS ist über „MCM5“ mit „56“-Spalte 7/3=QS=10 für „0“ für „CDC6=560AS vorhanden. „MCM3“ exprimiert Ubiquitin=76AS in Lymphknoten: „Ubiquitin“ über Randspalte 3/4=QS=7_92=QS=11=QS=2_in MCM2 Spalte 0/4 =4 mit 7_Summe 2+4=6 mit 7_6 für Ubiquitin (liegt neben „Lymphknoten“=11 in MCM7) [MCM3 - Minichromosome maintenance complex component 3 - Homo sapiens (Human) | UniProtKB | UniProt]. „MCM3“ interagiert mit „MCMAP“, und zwar über seitliche Spalte 7/3 [extern und MCM5)=QS=10_in MCM3 mit 9_QS4+4=8_QS7+3=10 für „0“ mit Summe 10+9=19_8_0 für MCMAP=1980AS [MCM3AP - Germinal-center associated nuclear protein - Homo sapiens (Human) | UniProtKB | UniProt].
Für das Protein (Mensch) „MCM2“ {}=904AS ist die Ziffer „9“ in der lesbaren Spalte „9/0/4“ bereits von „MCM3“ besetzt. Der Ligand „Zink“=30E, seitlich als „3“_Spalte 4/6=10 für „0“ für 30E, ist daher nicht nutzbar, sondern wird für „Zink“ über Spalte 4/6=QS=“10“_ATP-Zahl=“20“ als Summe 10+20=Zink=30E gezählt. „MCM2“ {} =904AS liegt in der Randspalte Z.38351#_00/#_49 mit „9“_QS0+0=“0“_“4“ mit 9_0_4 für „MCM2“ {} =904AS. Hexamer MCM2-7: Z.38348#_[46058](2)(7)(3)/#_!4!3!“3“4“[77](4)(4)/#_!4!0!8!“5“6“3“(9)(2)/#_[3]“8“!58![4]“2“{0}{0}/#[3]“6“5“!3!“1“1“{49}/#_[3]“4“6“[9]“7“2“2“4“.
„MCM 4/6“ werden von „MCM7“ zur realen Komplexbildung MCM2, 4, 6, 7 verdeckt. „MCM2“ wird von CDK1 (CDC2)=297AS und CDC7=574AS reguliert. „CDK1 Cyclin-dependent kinase 1“ in der Spalte #_[639]“2“/#_[4]“2“[0]“0“/#_[1]“1“4“[9] als Spalte 2/0/9 für 29_4_Spalte 2/1=QS=3 mit 29_Summe 4+3=7 für CDK1=297AS. „CDC7_Cell division cycle 7-related protein kinase“ zieht seitlich durch „MCM7“ in der Spalte #_[1]“1{„4“}{9}/#_“72“2“[4] als QS1+4=“5“_“2“_“72“ mit „5“_Summe 2+72=“74“ für CDC7=574AS. „MCM2“ wird direkt in „Lymphknoten“=11 (seitlich in MCM7) exprimiert, so dass vergleichsweise kein Ubiquitin benötigt wird, um eine Verbindung zu legen. Die Expression im Knochenmark resultiert aus der durchziehenden ATP-Spalte, die mit Blut=26 (Eisen) den Zusammenhang mit der Neubildung von Blutzellen (Hämatopoese) herstellt. Weil die ATP-Spalte durch MCM2 zieht, wird der Subkomplex „MCM4-6-7“ von MCM2 gehemmt. Die Randziffer 9 gehört über die Spalte 9/4 für Arginin=94 zum Arginin-Finger-Motiv. „ADP“=220E liegt mit der Startzahl QS1+1=“2“ (11=Lymphknoten) seitlich und die Endziffer „0“ liegt zur Bindung in MCM2. [MCM2 zhk- DNA replication licensing factor MCM2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MCM7“ („“) =719AS liegt in der Spalte In der Randspalte Z.38352#_“1“1“[49]/#_“7“2“2“4“, und zwar schleifenförmig als „7“_absteigend “1“_aufsteigend QS1_2+2+4=“9“ für MCM7 („“) =719AS. Hexamer MCM2-7: Z.38348#_[46058](2)(7)(3)/#_!4!3!“3“4“[77](4)(4)/#_!4!0!8!“5“6“3“(9)(2)/#_[3]“8“!58![4]“2“{0}{0}/#[3]“6“5“!3!“1“1“{49}/#_[3]“4“6“[9]“7“2“2“4“.
[MCM7 - DNA replication licensing factor MCM7 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Überexpression von Cyclin E1=283AS wirkt sich ungünstig auf die Beladung von MCM2, 4 und 7 aus. Die onkogene Aktivierung des Cyclin E/CDK2-Komplexes beeinträchtigt die normale DNA-Replikation, was zu DNA-Schäden führt. Der Replikationsstress führt zu genomischer Instabilität und trägt zur menschlichen Karzinogenese bei [Grenzen | Cyclin E/CDK2: DNA-Replikation, Replikationsstress und genomische Instabilität (frontiersin.org); L.Teixera, u.a., Nov.2021; https://doi.org/10.3389/fcell.2021.774845]. Das Protein (Mensch) „CDK2_Cyclin-dependent kinase 2“=298AS bindet 2 Magnesium-Ionen und muss sich daher an der gespiegelten Mg-Spalte 2/1/2 befinden, und zwar in Spalte Z.38352#_[6]“5“3“{„1“}{1}[49]/#_[4]“6“9“{„7“}{2}[24]/#_3[0]{8}[2407] über Mg-Spalte „1/2“=QS=3_Spalte „1/7“=QS=8 mit Summe=3+8=11=QS=“2“_über Spalte „9/8“ mit 2_9_8 für „CDK2“ {} =298AS. Weil sich „ADP/ATP“ aus dem Original von der Startziffer „2“ nach links umorientieren müssen, wird Stress erzeugt [CDK2 - Cyclin-dependent kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Cyclin E1“=283AS zieht als Ring über Spalte 1/7 für „17“_“9“_Spalte 5/6=“2“ mit Summe 17+9+2=28_3 für „Cyclin E1“ („“) =283AS [CCNE1 - Cyclin E1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Cyclin-D1/CDK4-Kinase bindet an MCM7 und MCM3 [Die Cyclin D1-abhängige Kinase assoziiert mit dem Präreplikationskomplex und moduliert RB• MCM7-Bindung - ScienceDirect; a.Diehl u.a; März 2003; https://doi.org/10.1074/jbc.M212088200]. Das Protein (Mensch) „CDK4“=303AS liegt in der Spalte Z.38351#_858(4)({2})00/#_65({3})({1}){1}49/#_469{7}{2}24. „CDK4“ wird an Threonin=64E phosphoryliert, womit die ATP-Startziffer „2“ in QS4+2!=“6“_QS3+1=“4“ mit 6_4 für Threonin ()=64E mit einem Bezug nach links markiert wird. „CDK4“ über Spalte „2/1/2“ mit QS2+1=“3“_“2“_Spalte 1/7=QS=8 mit „3“_Summe 2+8=10 für „0“_“3“ mit 3_0_3 für „CDK4_Cyclin-dependent kinase 4“ {}=303AS [CDK4 - Cyclin-dependent kinase 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Cyclin D1“=295AS zieht günstig nach rechts zum „ATP“ durch das „CDK4“, und zwar schleifenförmig über Spalte 5/6=QS=11=QS=2_9_QS3+1+1=5 mit 2_9_5 für „Cyclin D1“ („“)=295AS [CCND1 - G1/S-specific cyclin-D1 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Komplex „Cyclin D1/CDK4/CDKN1B“ erfüllt das Protein (Mensch) „CDKN1B“=198AS je nach Zustand eine hemmende oder verstärkende Funktion, in dem „CyclinD1/CDK4“ bis zum Rand umklammert werden, wobei zugleich an der linken Seite das Cyclin E über die Bindung der Ziffer „6“ gehemmt wird. Für den Phosphorylierungszustand ist der Phosphor in der Zahl „69“ als QS6+9=Phosphor=15E enthalten. „CDKN1B“=198AS liegt in der Spalte Z.38352#_[653]“1“1“4“9“/#_[4]“69“7“2“2“4“ als „1“_QS1+4+9=“14“_QS2+4=“6“_QS69+7+2=“78“ mit „1“_Summe 14+6+78=“98“ mit 1_98 für „CDKN1B“=198AS. Wird die Zahl „69“ als Phosphor=“15“ gezählt, resultiert daraus ein Defizit=69-15=“54“. In der Spalte „53“1“/“69“7“ liegt nur die Zahl „53“, weil die Ziffer „1“ bereits im Ring die Startziffer „1“ ist, was eine Störung auslöst [CDKN1B - Cyclin-dependent kinase inhibitor 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Die Interaktion von „CDKN1B“ mit dem Protein (Mensch) „SNX6“=406AS fördert den lysosomalen Abbau, weil die Ziffer „6“ aus der ATP-Spalte stammt, und zwar über die Randspalte Z.38352#_[1]“4“[9]/#_[2]“2“[4]/#_“40“[7] als „40“_Spalte 4/2=QS=“6“ mit 40_6 für „SNX6“=406AS [SNX6 - Sorting nexin-6 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MCM5“=743AS („“) liegt oben/mittig in der Spalte Z.38349#_“3“4“[77]/#_[8]“5“6“3“/#_[584]“2“ links neben „MCM3“ () mit einer trennenden Kerbe [„77“], die für „MCM5“ vom Aktivator „Methionin=80E in der Spalte „77“/[6]“3“ mit QS77_3=Methionin=80E besetzt ist, um eine vorgelagerte Zahl „34“ zu positionieren. „MCM5“=743AS beginnt mit der ATP-Startziffer „2“ absteigend in der Spalte Z.38350#_3/#2 mit 3/2=QS=“5“_QS5+6=11=QS=“2“ mit Summe 5+2=“7“_“4“_“3“ für MCM5 („“)=743AS. Die vorgelagerte Zahl „34“ wird an der Ziffer „3“ im Komplex links von MCM4 gebunden, benötigt zunächst aber das „Methionin“ als Aktivator. „Methionin“=80E als QS77_3=80 für Methionin (!!)=80E. „MCM4“ wird mit „08“ für 80E ebenfalls positioniert. Hexamer MCM2-7: Z.38348#_[46058](2)(7)(3)/#_!4!3!“3“4“[77](4)(4)/#_!4!0!8!“5“6“3“(9)(2)/#_[3]“8“!58![4]“2“{0}{0}/#[3]“6“5“!3!“1“1“{49}/#_[3]“4“6“[9]“7“2“2“4“.
[MCM5 - DNA replication licensing factor MCM5 - Homo sapiens (Human) | UniProtKB | UniProt]. Statt die ATP-Ziffer „2“ schwierig in einer Spalte zu beteiligen, kann alternativ am Rand aus „92“=QS=11=QS=“2“ interpretiert werden. Dann wird aber „2“00 nicht mehr als Hyaluronsäure=200E erkannt, was aufgrund der Gelenke zum Skelettproblem und zur Kleinwüchsigkeit führt. Das Arzneimittel „Vosoritid“=C176H290N56O51S3=1056+290+392+408+48=2194E, ein Peptid aus 39 Aminosäuren, wirkt bei angeborenem Kleinwuchs (Achondroplasie). Die falsch interpretierte Randzahl „92“ wird in eine Zählgröße „11“ verwandelt und durch den Anteil „200“=Hyaluronsäure ersetzt, und zwar mit „Vosoritid (Voxzogo)“=2194E als 200_92=QS=11_44=QS=8 mit Summe 200+11+8=“219“_Wende mit 1.Kunstgriff QS7+3=10 für „0“_“2“_2.Kunstgriff Input MCM5 über Spalte 7/3=QS=10 für „0“_56=QS=11=QS=“2“ mit 219_Summe 2+2=“4“ mit 219_4 für „Vosoritid“=2194E. [Vosoritid – Wikipedia]. Ein hoher MCM5-Spiegel wurde bei mehreren Krebsarten gefunden, darunter Darmkrebs, Gebärmutterhalskrebs und Schilddrüsenkrebs [Grenzen | Systemische Analyse des DNA-Replikationsregulators MCM-Komplex beim Ovarialkarzinom und dessen prognostischer Wert (frontiersin.org); Y.Li u.a. Jun 2021; https://doi.org/10.3389/fonc.2021.681261]. Der Darm „808“ wird seitlich in „MCM4“ in der Spalte „08/8“5“ als Struktur „5“ erkannt. Für den Gebärmutterhalskrebs liegt das Gewebe „33“ in der Spalte 33/0 angelagert von der Weiblichkeit „66“ als (33)“47“/ (0=Ring)“8“56“ mit QS 8_56=64_47=QS=11=QS=2_mit Summe 8+56+2=66 (weiblich). Für den Bezug zur Schilddrüse ist eine lange Spalte aus dem Zungenloch typisch. „MCM5“ interagiert mit dem Transkriptionsfaktor, Protein (Mensch) „Stat1“=750AS [STAT1 - Signal transducer and activator of transcription 1-alpha/beta - Homo sapiens (Human) | UniProtKB | UniProt]. Eine Überexpression einer MCM5-Domäne hemmt die Transkriptionsaktivität von „Stat1“. Geeignet ist die Endzahl „34“, die von „MCM5“ nach links (Folge 4-3) zerlegt wird, während „Stat1“ eine 34=QS=7 zählen muss, weil die rechte Startspalte „3/4“ nur fallend die notwendige Zahl „34“ ergibt. „Stat1“=750AS liegt in der Spalte in der Spalte Z.38348#_[460582]“7“3“/#_43“3“4“7“7“4“4“ als QS3+4=“7“_QS7+7=14_Spalte 7/4=11=QS=“2“ mit „7“_Summe 14+2=“16“_Randspalte „3/4“ (aus MCM3) für „34“ mit „7“_Summe 16+34=“50“ mit 7_50 für „Stat1“ =750AS [Der DNA-Replikationsfaktor MCM5 ist essentiell für die Stat1-vermittelte Transkriptionsaktivierung | PNAS; M.Snyder u.a. Sept 2005;
https://doi.org/10.1073/pnas.0507479102].
Das Protein (Mensch) „MCM4“ (!!)=863AS liegt auf der linken Seite in der Spalte Z.38349#_!4!3![34]/#_!4!0!8![5]#_[38]!58!/#_[365]!3!. Hexamer MCM2-7: Z.38348#_[46058](2)(7)(3)/#_!4!3!“3“4“[77](4)(4)/#_!4!0!8!“5“6“3“(9)(2)/#_[3]“8“!58![4]“2“{0}{0}/#[3]“6“5“!3!“1“1“{49}/#_[3]“4“6“[9]“7“2“2“4“.
Das „ATP=260E fehlt linksseitig und muss sich daher aus der Startziffer „2“ nach links drehen, und zwar „ATP“ als „2“_“4“_Spalte 8/3=QS=11=QS=2 mit „2“_Summe 4+2=“6“_Spalte 5/5=QS=10 für „0“ mit 26_0 für ATP=260E. Das ADP=220E schwingt ebenfalls aus der Startzahl „11“ zur linken Seite als 11=QS=“2“ Spalte 8/3=QS=11=QS=“2“_Spalte 5/5=QS=10 für „0“ mit 2_2_0 für ADP=220E. „MCM4“=863AS benötigt wie „MCM5“ den Aktivator „Methionin“=80E als „08“, um die MCM5-Zahl „34“ auch von der linken Seite zu stützen, und „MCM4“ durch mit einer Schleife von der linken Spalte „4/4“ durch die Zahl „08“ zu leiten. „MCM4“=863AS über Spalte 4/4=QS=“8“_QS3_0+8=11=QS=“2“_“58“_“3“ mit „8“_Summe 2+58+3=“63“ mit 8_63 für „MCM4“ (!!)=863AS [MCM4 - DNA replication licensing factor MCM4 - Homo sapiens (Human) | UniProtKB | UniProt]. „MCM4“ interagiert mit dem Replikationsprotein (Mensch) „RPA1“ {} =616AS in der Spalte Z.38349#_{4}{3}[347744]/#_{4}{0}[85639]{2}/#_[3]{8}{5}{8}{4}{2}[0]{0}/#_[3]{6}{5}{3}{1}{1}{4}{9}. Eine fiktive Replikationsgabel entsteht über 2 Stränge als Zählgröße, die zugleich ruhend als Kunstgriffe „wertlos“ werden, wobei eine Verbindung von der linken MCM4-Startspalte „4/4“ über die ATP-Startziffer „2“ bis vor die Gruppe „44“ am rechten Rand gelegt wird [Konformationsänderung in Gegenrichtung]. „RPA1“ startet in der Spalte „4/4“ für „44“(Gruppe)_linker „Gabel-Zinken“ Spalte 3/0/8=QS=11=QS=“2“_Kopplungschleife „6“_Spalte 5/5=QS=10 für „0“_rechter „Gabel-Zinken“ Spalte 8/3=QS=11=QS=“2“_mit „44“_Summe 2+6+0+2=10 für „0“_aufsteigend Spalte 1/4 für „14“ (sperrt Gegenrichtung)_aufsteigend Spalte 2/1=QS=“3“ mit Summe 44+0+14+3=“61“_“4“_Randspalte 2/0/9=QS=11=QS=2 mit 61_Summe 4+2=6 mit 61_6 für „RPA1“ {}=616AS [RPA1 - Replication protein A 70 kDa DNA-binding subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Während der Replikation ist der entwundene einzelsträngige Bereich der Replikationsgabel mit „RPA-Molekülen“ über „30“ Nukleotide abgedeckt. [Replication Protein A - DocCheck Flexikon]. Am rechten Rand ist ebenfalls ein Gruppe „44“ vorhanden, von der seitlich über Spalte 7/3=QS=10 und ATP-Zahl 20 die Summe 30 entsteht. Bei einer Konformationsänderung ist die Leserichtung „20“ nicht lesbar, sondern die Zahl „30“ wird auf der linken Seite über die Spalte „3/0“ gelesen.
„RPA1“=616AS (alternativ) in der Spalte Z.38349#_(4)(3)(3)47(7)(44)/#_(4)(0)(8)[56](39)[2]/#_(3)(8)(5)[84=Schwerachse](2)(0)[0]/#_[36](5)(3)(1)(1)[49] vom rechten Rand als 44=QS=“8“_“7“_“39“ mit Summe 8+7+39=“54“_0_2 (20 gespiegelt)_QS3+1+1=5 mit Summe 54+5=“61“_Kunstgriff Spalte 5/5=QS=10 für „0“_Spalte 3/8=QS=11=QS=“2“ mit „61“_Summe 0+2=“2“_Spalte 3/0/8 (enthält Zahl „30“)=QS=11=QS=“2“_Spalte „Gruppe 4/4/3“=QS=11=QS=“2“ mit „61“_QS2+2+2=“6“ mit 61_6 für „RPA1“ ()=616AS (alternativ).
Das Replikationsprotein „RPA1“ rekrutiert das Protein (Mensch) „ATRIP“=791AS, um die „ATR-Kinase“ als ein Hauptregulator der DNA-Schadensantwort zu aktivieren. Weil der „linke Hoden“ mit „links=1“ und der Hoden „männlich=33“ adressiert wird, liegt ein DNA-Schaden vor, wenn die „4“3_3“1“=QS=11 (Zählgröße), über mehrere Zeilen versetzt, gespalten ist. „ATRIP“=791AS liegt folglich in der Spalte Z.38349#_{4}{3}[347744]/#_[4]{0}[856392]/#_[3]{8}[584200]/#_[3]{6}{5}[31149], und zwar als QS4+3=“7“_Spalte 0/8/6 für „86“_“5“ [31] mit „7“_Summe 86+5=“91“ mit 7_91 für „ATRIP“ {} =791AS [ATRIP - ATR-interacting protein - Homo sapiens (Human) | UniProtKB | UniProt].
Die Serin/Threonin-Protein Kinase, Protein (Mensch) „ATR“ {}=2644AS wird als „Dimer“ an die „DNA“ gebunden. Das „Monomer“ (1.Zählung) endet rechts mit der Randzahl „44“ in der Spalte Z.38349#_{3}{47}{7}{44}/#_856{3}{92} als „3“_47=QS=11=QS=“2“_Spalte 7/3=QS=“10“_92=QS=11 mit Summe 3+2+10+11=“26“_“44“ für „ATR“ {}=2644AS (Monomer). Die Monomer-Startziffer „3“ erzeugt über die 2.Zählung (Homodimer) einen Ring, der die Spalte „56/[8]4“ für Serin=56 /Threonin=64E umschließt. „ATR“ (Ataxia telangiectasia and Rad3 related) liegt als 2.Zählung (Homodimer) L-förmig in der Spalte in der Spalte Z.38349#_{4}{3}[3!47744]/#_{4}{0}[856392]/#_{38}[584]{2}[00]/#_{3}{6}{53}{11}[49] und wird zerlegt als „2“_“64“_“4“.
„ATR“ kann nicht direkt am Startpunkt Serin=56 /Threonin=64E aus der Spalte „65/46“ nach links als „Serin“ bis zur Spalte „4/4“ für „44“ durchziehen, weil für die Katalyse ATP/ADP benötigt werden, so dass dort der Cofaktor „Magnesium=12“ die Position bestimmt, wobei über QS1+4=“5“/“2“ auch Mangan=25E bindet. Die Gruppe=44 bleibt als verstecktes Ziel auf der linken Seite erhalten. „ATR“=2644AS als „2“(aus ATP)_11(aus ADP)=QS=“2“_“53“_QS3+6=“9“ mit „2“_Summe 2+53+9=“64“ (Threonin)_38=QS=11=QS=“2“_Spalte 3/0=QS=3_Spalte 4/4=8 mit 264_2 Summe 3+8=11=QS=2 mit 264_Summe 2+2=4 mit 264_4 für ATR=2644AS, womit die gespaltene Gruppe 4-4 repariert wird [ATR - Serine/threonine-protein kinase ATR - Homo sapiens (Human) | UniProtKB | UniProt]. „ATR“ wird von Wirkstoffen gehemmt, die am rechten Rand einwirken und die Startziffer „2“ blockieren: „Coffein“=C8H10N4O2=48+10+28+16=102E in Z.38349 mit 44=QS=“8“_“92“_200=QS=“2“ mit Summe 8+92+2=Coffein=102E. „LY294002“=C19H17NO3=114+17+7+24=162E über Randspalte „56“[3]“92“/“84“200“ als QS56+84=“140“_“20“_92=QS=11=QS=“2“ mit Summe 140+20+2=„LY294002“=162E. „Wortmannin“=C23H24O8=138+24+64=226E als 11_4+200_92=QS=11 mit Summe 11+4+200+11=„Wortmannin“=226E.
Das Protein (Mensch) „ETAA1_ Ewings-Tumor-assoziierte Antigen 1“=926AS arbeitet parallel zu TOPBP1, um „ATR“ durch ein konserviertes „AAD“ zu aktivieren. Das „AAD-Motiv“=„48_48_70“ () [Alanin (A/Ala)=C3H7NO2=48E / Asparaginsäure (D/Asp)=C4H7NO4=70E] liegt am L-Schenkel von „ATR“ in der Spalte Z.38351#[385](84)(2)[00}/(3“6“)5“3““(1)(1)““4“9“/(“3“4“)[697224] mit Ala=48E gespiegelt als 84; Ala=48 als Startziffer 2+1+1=“4“_QS5+3=8 für Ala=48E; Asp=70E als Spalte 36/34=QS=70E. „ETAA1“=926AS als „9“_QS11+4=15_QS5+3=8_Kunstgriff Spalte 6/4=10 für „0“_“3“ mit „9“_Summe 15+8+3=“26“ mit 9_26 für „ETAA1“ („“)=926AS [ETAA1 - Ewing's tumor-associated antigen 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Gerüstprotein (Mensch) “TOPBP1_DNA topoisomerase 2-binding protein 1“=1522AS zeigt keine besonderen Merkmale. Um nadelförmig bis zur linken Gruppe „4/4“ abzusteigen, zieht “TOPBP1“ zur Stimulation von der ADP-Startzahl „11“ eine Schleife um die Zahl „33“ (Bezug zu männlichen Keimzellen). “TOPBP1“=1522AS liegt in de Spalte Z.38349#_[4]{3}{3}[47744]/#_[4]{0}{8}[56392]/#_3{8}{5}[84200]/#_[36]{5}{3}{1}{1}[49], und zwar als und zwar als QS 3+1+1=“5“_Spalte 5/5=“10“ mit Summe 5+10=“15“_absteigend Spalte 3/8=QS=“11“_aufsteigend Spalte 3/0/8=QS=“11“ mit „15“_Summe 11+11=“22“ mit 15_22 für “TOPBP1“{} =1522AS [TOPBP1 - DNA topoisomerase 2-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „TOPBP1“ gehört zum Zytoskelett, das aus Aktin und dazugehörigen Proteinen besteht. In der Gruppenspalte Z.38347#„4“3“[34]/#_“4“[085] ist das Aktin=374AS als „3“_QS4+3=“7“_4 mit 3_7_4 für Aktin=374AS enthalten. Das integrierte Tropomyosin=568AS liegt in der Spalte_„4“[3]“3“4“/“_“4“0“8“5“ über Spalte 4/5 als „54“_Spalte 3/8=11=QS=“2“ mit Summe 54+2=“56“_“0“_Spalte 4/4=QS=“8“ mit „56“_Summe 0+8=“8“ mit 56_8 für Tropomyosin=568AS. “TOPBP1“ reguliert die Aktivität vom Protein (Mensch) „E2F1“=437AS herunter. Wunschgemäß wird die Zeile Z.38347AS erreicht, und zwar mit der Ziffer 4 aus der Gruppenspalte „4/4“ mit „43“_QS3+4=“7“ für „E2F1“=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MCM6“ („“)=821AS füllt als Puzzle den linken Rand in der Spalte Z.38351#_[3]“8“!5!8!#_[3]“6“5“!3!/#_[3]“4“6“[9] aufsteigend als „8“_65=QS=“11“_46=QS=“10“ mit „8“_Summe 11+10=“21“ mit 8_21 für „MCM6“ („“)=821AS. Das ATP=260E wird in der Z. 38354#_[3]“308“24“0“[7] als 308=QS=11=QS=2_QS2+4=6_0 mit 2_6_0 für ATP=260E zur Bindung angehängt nach links als der Endzahl „0“(Null) der rechten Original-Spalte gespiegelt, so dass das ADP=220E auf der rechten Seite verbleibt [MCM6 - DNA replication licensing factor MCM6 - Homo sapiens (Human) | UniProtKB | UniProt].
Hexamer MCM2-7: Z.38348#_[46058](2)(7)(3)/#_!4!3!“3“4“[77](4)(4)/#_!4!0!8!“5“6“3“(9)(2)/#_[3]“8“!58![4]“2“{0}{0}/#[3]“6“5“!3!“1“1“{49}/#_[3]“4“6“[9]“7“2“2“4“.
Das „Hexamer“ kann sich ohne Randbedingungen wie ATP, Zink und Magnesium mit der Gesamtkettenlänge „MCM2-7“=904AS[2]+328AS[3]+863AS[4]+743AS[5]+719 AS[7]+821AS[6]=“4378AS“ zum lückenlosen Ring formieren, und zwar linksdrehend mit „MCM2“ als lesbare Spalte 9/0/4 für „MCM2“=904AS_“MCM3“ aus Z.38349#_“8“56“3“ mit 3_56=QS=2_8 für „MCM3“=328AS_“MCM4“ aus Spalte Z.38349#_[5]“43“3“/#_“3“40“(8) mit QS3+40+43=86_3 für „MCM4“=863AS_ „MCM5“=743AS aus Spalte Z.38351#_“38“58“4“(200)/#_[3](65)“3“1“(149)/#_ [34](69)(7)224/[3308](2)407 als 38=QS=“11“_“58“ mit Summe 11+58=“69“_Spalte 4/1=“5“ mit Summe 69+5=“74“_“3“ für „MCM5“=743AS_ für „MCM7“=719AS als 65=QS=11=QS=2_69 mit Summe 2+69=71_Spalte 7/2=QS=9 mit 71_9 für „MCM7“=719AS_„MCM6“=821AS mit 40=QS=4_Spalte 4/7=QS=11=QS=2_2 mit Summe 4+2+2=“8“_Spalte „1/2“ für 2_1 mit 8_2_1 für _„MCM6“=821AS. Der „MCM-Komplex“ kann sich ringförmig vorgelagerte Zeilen einbeziehen, weil ein Energiekreislauf über eine Winkelsumme=360° vorliegt. Hierfür wird die Startzeile Z. 38348 nicht berücksichtigt, weil der 60°-Winkel links vor „MCM3“ liegt. Der Winkel „60°“ kann funktionell in „7“46“0“5“ als Form=7_ räumlich=4_Hexamer=6_ Ring „0“_avisierte Struktur „5“ funktionell als Winkel beseitigt werden. Ersatzweise wird der Winkel „50°“ aus der Z. 383“50“ gezählt. Die als Z.38354 angehängte zusätzliche ATP-Zeile wird mitgezählt. „MCM-Winkelsumme“=[60 entfällt]_0_50 (aus Z.Nr.)+40_200_0_30+40=360°.
Sobald der „Präreplikationskomplex (Prä-RC)“ aus ORC1-6, Cdc6, Cdt1 und Heterohexamer der MCM-Proteine (MCM2-7) gebildet ist, wird die Aktivierung des Komplexes durch zwei Kinasen ausgelöst. Der „Prä-RC“ wird dabei vor der Initiierung der DNA-Replikation in den „Initiationskomplex“ überführt [Eukaryotische DNA-Replikation – Wikipedia]. Beteiligt sind die „Cyclin-abhängige Kinase 2 (CDK2)“ und die „Dbf4-abhängige Kinase (DDK)“ als Komplex „CDC7-DBF4A“ [Eukaryotische DNA-Replikation – Wikipedia]. Das Protein (Mensch) „CDK2“=298AS liegt in der Spalte Z.38352#_[93]{6}{5}[31149]/#_“(7)“{“(3)“(4)}6“9“[7224]/#_[5330]“8“[2407] und bindet mit der Ziffer „8“ im alternativen ATP, das für MCM6 an den Komplex angehängt ist, und zwar als QS7+3+46+9=29_8 für CDK2 („“)=298AS. Die enthaltene Zahl „69“ gehört zur festgestellten Position von Cyclin E. Das Protein (Mensch) „Cyclin A2“=432AS liegt ringförmig in der Spalte „3“6“5“/“34“6“ als „34“_QS3+6=“9“ mit Summe 34+9=“43“_Spalte 5/6=11=QS=“2“ für 43_2 für Cyclin A2 {}=432AS [CCNA2 - Cyclin-A2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Transkriptionsfaktor für Cyclin A, das Protein (Mensch) „E2F1“ () =437AS ist gespiegelt in „734“ lesbar [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Claspin“=1339AS rekrutiert „CDC7“ und liegt in der Spalte Z.38350#_[6]“39“[2]/#_[4]“2“[00]/#_“1“1“[49]/#_[7224], und zwar absteigend als „1“_Spalte 2/1=QS=“3“_“39“ mit 1_3_39 für „Claspin“ („“)=1339AS [CLSPN - Claspin - Homo sapiens (Human) | UniProtKB | UniProt]. Die Serin/Threonin-Kinase, das Protein (Mensch) „CDC7“=574AS nutzt für Serin=56 /Threonin=64E die Spalte „56“/[8]4“ als seitlich lesbares Motiv. „CDC7“ {} =574AS mit der Startziffer „3“9 aus „Claspin“, und zwar als Spalte 3/2! (ATP-Startziffer= 2!)=QS=“5“_11=QS=“2“_“72“ mit „5“_Summe 2+72=“74“ mit 5_74 für „CDC7“=574AS. Die Spalte „1/2“ enthält Cofaktor „Magnesium“=12E [CDC7 - Cell division cycle 7-related protein kinase - Homo sapiens (Human) | UniProtKB | UniProt]. „CDC7“ wird von der Untereinheit, dem Zinkfinger-Protein (Mensch) „DBF4“=674AS aktiviert. Das „Zink“=30E liegt oben-links im Bereich „MCM4“ in der Spalte „3/0“, so dass ein Kontakt nach rechts zum „CDC7“ mit der Startziffer „3“ hergestellt wird, und zwar „DBF4“ () =674AS als „4“_Spalte 3/0=QS=“3“_“8“ mit „4“_Summe QS3+8=11=QS=“2“ mit Summe 4+2=“6“_“56“_77=QS=“14“_“4“ mit „6“_Summe 56+14+4=“74“ mit 6_74 für Variante 1: DBF4“ () =674AS. Im Prinzip sind in der Spalte die 904AS für das phosphorisierte „MCM2“ lesbar. Weil aber „MCM2“ durch „MCM3“ verdrängt wird, die Ziffer „4“ nach einem Kunstgriff erst später. Variante 2: „DBF4“=674AS mit „6“_Summe 56+14=“70“_Kunstgriff 44=QS=“8“_Spalte 2/0=QS=“2“ mit Summe 8+2=10 für „0“_Spalte 0/4=QS=“4“ mit „6“_Summe 70+0+4=“74“ mit 6_74 für „DBF4“ ()=674AS. Serin liegt dabei in der der Randspalte Z.38352#_[1]“1“4!“[9]/[72]“2“4“ als QS1+4!=5_QS2+4=6 mit 5_6 für Serin=56E [DBF4 - Protein DBF4 homolog A - Homo sapiens (Human) | UniProtKB | UniProt]. „DBF4“ umhüllt „CDC7“ und begräbt etwa 6.000 Å(2) [=600nm^2] hydrophobe Moleküloberfläche in einer zweigliedrigen Grenzfläche.“ [Crystal structure of human CDC7 kinase in complex with its activator DBF4 - PubMed (nih.gov); S. Hudges u.a.; Nov. 2012 ; DOI: 10.1038/nsmb.2404]. „Hydrophob“ kann mit „82“ als gespiegeltes Wasser „28“ adressiert sein. Im umklammerten Bereich Spalte [4]“2“[00]/“1“1“[4!9]/“72“2“4“ liegt das Symbol „hydrophob“=82 als QS2_1+1_72+2+4=“82“ (Symbol) vor.
Der „Mcm2-7-Komplex“ bildet dann mit „Cdc45“ und dem „GINS-Komplex“ den sogenannten „CMG-Komplex“, der sich mit Replikationsgabeln bewegt und als „replikative Helikase“ fungiert [Die Cdc45• Mcm2–7• GINS-Proteinkomplex in Trypanosomen reguliert die DNA-Replikation und interagiert mit zwei Orc1-ähnlichen Proteinen im Origin Recognition Complex (PMC) (nih.gov); z. LI u.a. Juli 2011. doi: 10.1074/jbc. M111.240143]. Während des gesamten Zellzyklus
bleiben „Mcm2-7- und GINS-Proteine“ im Zellkern, während „Cdc45“ nach der DNA-Replikation aus dem Zellkern exportiert wird.
Der „Gins-Komplex“ bildet ein ringförmiges Tetramer aus den Proteine „SLD5-PSF1-PSF2-PSF3“ [japanisch: Go-Ichi-Ni-San (5-1-2-3)], das als Stapel auf dem MCM-Komplex liegt. Das Protein (Mensch) „GIN3_PSF1“ („“) =216AS liegt in der Spalte Z.38349#_[3]“47“7“[44]/#_[8]“5“6“3“[92]/#_(5)(8)“4“{200}/#_(5)(3)(1)(1){49}/#_!6!9![7]{2}{2}{4}/#_[0]!8!2!{4}{0}{7} über Spalte „47“7“/“56“3“ absteigend als QS 7_3=“10“_QS4+7=“11“ mit Summe 10+11=“21“_aufsteigend QS5+6=11=QS=“2“_“4“ mit „21“_Summe 2+4=“6“ mit 21_6 für „GINS3“ („“) =216AS [GINS3 - DNA replication complex GINS protein PSF3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GINS2_PSF3“=185AS absteigend über Spalte 5/5=QS=“10“_“8“ mit Summe 10+8=“18“_aufsteigend QS3+1+1=“5“ mit 18_5 für „GINS2“ () =185AS [GINS2 - DNA replication complex GINS protein PSF2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GINS1_PSF1“ (!!)=196AS absteigend als QS8+2_9=19_6 mit 19_6 für „GINS1“ (!!)=196AS [GINS1 - DNA replication complex GINS protein PSF1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GINS4_ SLD5“=223AS aufsteigend als 200=QS=2_49=QS=13_Randspalte 4/7=QS=11=QS=2_absteigend Spalte 2/0=QS=2_aufsteigend Spalte 2/4=QS=6 mit 2_Summe 13+2+2+6=“23“ mit 2_23 für „GINS4“=223AS [GINS4 - DNA replication complex GINS protein SLD5 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CDC45“=566AS ist MCM5 und MCM2 überlagert und fügt sich aufsteigend an „ORC2“ {}=577AS, mit dem es assoziiert ist. Das Thema „Kleinwüchsigkeit“ durch Fehlinterpretation ist tangiert, so dass auch die Hyaluronsäure=200E am rechten Rand beteiligt ist. Links liegt „HELB“ seitlich an „CDC45“, mit dem es interagiert. „CDC45“ („“) =566AS liegt in der Spalte Z.38348#_[60]{5}{82}73/#_(3)(3)(4){77}44/#_(08)(5)“6“3“92/#_[85](8)“4“2“00/#_[65](3)“1“1“!49!/#_[469]“72“!24!/#_[3082]“4“!07!, und zwar absteigend über Spalte 4/1=QS=“5“_“6“_aufsteigend Spalte 3/2/1=QS=“6“ mit 5_6_6 für „CDC45“ („“) =566AS [CDC45 - Cell division control protein 45 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Eine post-translationale Modifikation erfolgt als Ubiquitinierung an Lysin, und zwar nachgelagert als Lysin=80E über die Randspalte QS49_24_07=Lysin (!!)=80E und Ubiquitin („“)=76AS als QS72_4=76AS. Das Protein (Mensch) „HELB“ ()=1087AS als QS3+3+4=“10“_QS0+8=“8“_“5“_QS8_3=11=QS=2 mit „108“_Summe 5+2=“7“ mit 108_7 für „HELB“=1087AS [HELB - DNA helicase B - Homo sapiens (Human) | UniProtKB | UniProt]. Die Aktivität von „HELB“ wird durch Magnesium- oder Mangan-Ionen unterstützt, weil diese rechts in „CDC45“ enthalten sind, und zwar in der Spalte 42/1[1] als Mangan mit „2“_QS4+1=“5“ mit 2_5 für Mangan=“25E“. Das „ATP“ muss für ATP-Bindung aus der Startziffer „2“ nach links gezogen werden, und zwar als „2“_“4“_Spalte 8/3=QS=11=QS=“2“ mit „2“_Summe 4+2=“6“_Spalte 5/5=QS=10 für „0“ mit 26_0 für ATP=260E.
Um das „Replisom“ zusammenzusetzen wird zur Initiierung der Replikation das Protein (Mensch) „MCM10“=875AS benötigt. „Mcm10“ ist für die Beladung der Komplexe „Pol-alpha“ und „Pol-delta“ zuständig, nicht aber für „Cdc45“ [MCM10 spielt eine Rolle bei der Funktion der eukaryotischen replikativen DNA-Helikase, Cdc45-MCM-GINS - ScienceDirect; G. Watase; Feb 2012; https://doi.org/10.1016/j.cub.2012.01.023]. „MCM6“ folgen Zink-Zeilen, so dass „MCM10“ dort lokalisiert ist. Durch Bildung eines MCM10-Hexamers kann sich der Kontaktbereich ausdehnen. „MCM10“ {} =875AS mit Zink-Bindung liegt als Monomer in der Spalte Z.38354#_[44]{5}{3}[3]{0}{8}[2407]/#_[40]{3}{3}{1}{6}[86681]/_[3](6)(1)“3“[0]“5“1“[0028]/#_[3](1)(9)“2“9“5“[52432]/#_[27](72)[8](8)[13876]/#_[235](28)(2)[94341], und zwar über die Ziffer [3]“0“ von Zink=30E als QS8_0=“8“_aufsteigend QS1+6=“7“_Schleife „3“_QS5+3_3=11=QS=“2“ mit „87_Summe3+2=“5“ mit 87_5 für „MCM10“ {} =875AS [MCM10 - Protein MCM10 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. „MCM10“ ist Schlüsseleffektor der RBBP6- und ZBTB38-vermittelten Regulation der DNA-Replikation. Der Transkriptionsregulator, das Zinkfinger-Protein (Mensch) „ZBTB38“ („“)=1195AS folgt „MCM10“ an einem zweiten Zink=30E, und zwar aufsteigend als „1“_Spalte 5/5=QS=“10“ mit Summe 1+10=“11“_“9“ absteigend mit Ziffer „3“ von Zink „3“{0} in Spalte 3/2=QS=“5“ mit 11_9_5 für „ZBTB38“ („“)=1195AS. Die Bindung an die Konsensussequenz 5'-CGCG-3' als Dopplung von mit 2-fach „C/G“=64E/40E seitlich in der Randspalte Z.38355#_[86]!6!“8“[1]/#_10!0!“2“[8]/_{5}(2)!4!“3“[2]/#_{1}(38)[76]/#_{9}{4}[341] mit Cystein (C) {}=64E als Spalte 5/1 für 51_9_4 mit Summe 51+9+4=64E; Glycin (G) ()=40E als QS2_38=40E; Cystein (C) (!!) als Spalte 6/0/4 für 64E; Glycin (G) ()=40E als Spalte 8/2/3 mit 32+8=40E [ZBTB38 - Zinc finger and BTB domain-containing protein 38 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Transkriptionsregulator, das Protein (Mensch) „RBBP6“ ()=1792AS bindet mit QS6+1=“7“ (bindet mit der Ziffer „1“ am Zink=30E)_19=QS=“10“ mit Summe 7+10=“17“_“72“_28=QS=“10“_Spalte 8/2=QS=“10“ mit „17“_Summe 72+10+10=“92“ mit 17_92 für „RBBP6“ ()=1792AS. Ubiquitin=76AS liegt extern am linken Rand als [403]=QS=“7“_Spalte [3]/[3]=QS=“6“ mit 7_6 für „Ubiquitin“=76AS [RBBP6 - E3 ubiquitin-protein ligase RBBP6 - Homo sapiens (Human) | UniProtKB | UniProt]. Der „MCM8-MCM9-Komplex“ ist für die DNA-Replikation und die Progression der S-Phase nicht erforderlich [MCM9 Gene - GeneCards | MCM9 Protein | MCM9 Antibody].
DNA-Polymerase-alpha-Primase-Komplex (POLA1/POLA2/PRIM1/PRIM2): Der Komplex synthetisiert den „RNA-Primer“. Der „Pol-alpha-Komplex“ wird an der Replikationsgabel rekrutiert. Von den 4 Nukleinbasen sind 3 (Adenin, Guanin, Cytosin) übereinstimmen auch in der DNA enthalten, aber das „Uracil“ der RNA muss später gegen „Thymin“ ausgetauscht werden. Enzyme „Ribonuklease H (DNA-RNA-Hybride)“, speziell „RNase H1“ und „RNase H2“ sind dafür zuständig. Die „Primase“ trägt einen RNA-Primer auf, der von „POLA“ verlängert wird. Im Unterschied zum Leitstrang wird der Primer am Folgestrang wiederholt aufgetragen, weil sich dieser nur aus kurzen „Okazaki-Fragmenten“ zusammensetzt. Am Folgestrang kann die DNA nicht kontinuierlich, sondern nur abschnittsweise synthetisiert werden, weil die „Polymerase“ ausgehend von der Gabelungsstelle in die Gegenrichtung zur „Helikase“ synthetisiert. Anschließend werden die Fragmente von der „DNA-Ligase I“ miteinander verknüpft. Weil „POLA1“ mit „MCM4“ und „GINS1“ interagiert, kann der Komplex bereits vorgelagert entstehen. Nachfolgend wird die Zink-Bindung für „POLA1“ am lesbaren Zink gewählt. Das Protein (Mensch) „POLA1“=1462AS folgt „MCM10“ ohne Einbindung, weil die Proteine an verschiedene Zink-Atome binden. Das Protein (Mensch) „POLA1“ {}=1462AS liegt in der Spalte Z.38354#_[44][5330]“8“2“4“[07]/#_{4}{0}[3316][86]“6“[81]/#_[3]{6}{13}{051}[0]“0“[28]/#_!3!19!{29}{55}(2)4(3)(2)/#_!2![7]!7!2(87)(6) als „4“_Spalte 0/6=QS=“6“_13=QS=“4“_mit Summe 4+6+4=“14“_ 051=QS=“6“_Kunstgriff 55=QS=10 für “0“_29=11=QS=“2“ mit „146“_Summe 0+2=“2“ mit 146_2 für Pola1=1462AS [POLA1 - DNA polymerase alpha catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Die Wechselwirkung mit MCM10 und WDHD1 rekrutiert den Polymerase-alpha-Komplex an den präreplikativen Komplex. Das Protein (Mensch) „WDHD1“=1129AS zieht sich durch den Endabschnitt von „POLA1“ in der Spalte Z.38356#_[61305]“1“/#_[1]“9“29“55“ als „1“_55=QS=“10“ mit Summe 1+10=“11“_29=QS=11=QS=“2“_“9“ mit 11_2_9 für „WDHD1“=1129AS [WDHD1 - WD repeat and HMG-box DNA-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „POLA1“ interagiert mit „PARP1“=1014AS und RPA1=1720AS, dessen Zink in „POLA1“ liegt [POLR1A - DNA-directed RNA polymerase I subunit RPA1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „POLA2“ ()=598AS folgt „POLA1“ am rechten Rand, und zwar über Spalte 2/3=QS=5_87_Randspalte 2/6=QS=8_3 mit 5_87_Summe 8+3=11 mit 5_Summe 87+11=98 mit 5_98 für „POLA2“ () =598AS [POLA2 - DNA polymerase alpha subunit B - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PRIM1“ („“)=420AS legt sich in eine freie Kerbe, Ziffer „4“, in der Spalte Z.38354#_[44][5330]“8“2“4“[07]/#_{4}{0}[3316][86]“6“[81]/#_[3]{6}{13}{051}[0]“0“[28]/#_!3!19!{29}{55}(2)4(3)(2)/#_!2![7]!7!2(87)(6) an „POLA2“ und spannt seitlich bis an das Zink=30 von MCM10, und zwar als
„4“_Spalte 4/6/0=QS=“10“_82=QS=“10“ mit „4“_Summe 10+10=“20“ mit 4_20 für „PRIM1“ („“)=420AS. PRIM1 könnte den End-Anteil 824=QS=“14“ auch bereits mit 86=QS=“14“ bilden, liegt aber am Zink zeitlich vor POLA1, um den „Primer“ aufzutragen. Die Alternative stoppt den Primer. Cofaktor ist Magnesium, weil die Spalte die Zeile 1002=QS=12=Mg kreuzt. Alternativ ist „Mangan“=25E ein Cofaktor, der über 100/[5)24 mit 1+(00)+24=Mn=25E entsteht. „Vidarabin“=C10H15N5O5=60+15+35+40=150E hemmt „PRIM1“ in der Spalte [82]“40“/[866]“8“/“100“2“ als „100“_Spalte 8/2=“10“_“40“ mit „100“_Summe 10+40=“50“ für „Vidarabin“=150E. Der RNA-Zucker, die Ribose= C5H10O5=30+10+40=80E, entspricht der Formel, wenn das seitlich gebundene Zink=30E in die Summe einbezogen wird als Summe 30_(82=QS=)10_40 =80E. „Das gebundene Zink-Ion ist kein Cofaktor. Es ist an ein Zink-Knuckle-Motiv gebunden, das möglicherweise an der Sequenzerkennung und der Bindung von ssDNA beteiligt ist“ [PRIM1 - DNA primase smal subunit - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PRIM2“ (!!)=509AS wird zur Initiation des „Primers“ benötigt: „The presence of the regulatory subunit PRIM2/p58 accelerates the kinetics of initiation and primer extension“, der aber nur von „PRIM1“ aufgetragen wird: „the extension of the primer depends only on the catalytic subunit“. „PRIM2“ liegt links und kann „PRIM1“ auf der rechten Seite nicht direkt erreichen. „PRIM2“ besitzt jedoch als Cofaktor das Cluster „4Fe-4S“ mit dem am linken Rand eine Verbindung angelegt werden kann. „PRIM2“ (!!)=509AS liegt in der Spalte Z.38354#_[44][5330]“8“2“4“[07]/#_{4}{0}[3316][86]“6“[81]/#_[3]{6}{13}{051}[0]“0“[28]/#_!3!19!{29}{55}(2)4(3)(2)/#_!2![7]!7!2(87)(6), und zwar über Spalte 3/2=QS=“5“_19=QS=10 für „0“_72=QS=“9“ mit 5_0_9 für „PRIM2“ (!!)=509AS. Das Cluster „4Fe-4S“ liegt gewöhnlich in der Serien-Randspalte #1611, um alle 8 Atome dazustellen. „PRIM2“ nutzt den Cofaktor aber offensichtlich als „Primase-Schalter“ mit einer kurzen (horizontal) und einer langen (vertikale) Cofaktor-Version, die beide als Summe 4*26E (Eisen)=“104“ und 4*16E (Schwefel)=“64“ ein Summen-Cluster „104_64“. Weil das Protein „POLE“ zur nachfolgenden DNA-Synthese am Leitstrang ebenfalls dieses Cluster benötigt, ist das horizontale Cluster auch dafür verwendbar. Das „horizontale Summen-Cluster“ („€“)104_(„$“)64“ zieht aufsteigend zum rechten Zeilenrand und folgt dort „POLA2“. Die Evolution wird vermutlich die Spalte „8/8“ als Multiplikation für 4S=“64“ nicht interpretieren, so dass diese Spalte alternativ besetzt wird, und zwar in der Spalte Z.38357#[1611]!3!19!(29552)4(32)/#_[1611]!2![7]!72! 8€81€(3876)/#[1611]„$23$5$28$€29€43€41€ als „23“_“5“_“28“=QS=“56“_“8“ mit Schwefel-Summe ($) =56+8=“64“E. „4Fe“=104E folgen als 81=QS=“9“_29=QS=“11“_“43“_“41“ mit Eisen-Summe (€) 9+11+43+41=104E. Der „vertikale-Summen-Cluster“ („€“)104_(„$“) 64“ zählt den Eisen-Anteil (€) „104“ neu, und zwar vorgelagert über den linken Rand als Schalter durch „MCM10“ bis in das Zink=30 zum Kontakt an „Prim1“, und muss folglich den Schwefel-Anteil („$“) „64“ in die Gegenrichtung zum linken Rand verschwenken. Die Schwefel-Endziffer „3“ ist dabei eine freie Kerbe an „POLA1“, das seitlich umgangen wird. Das „vertikale Summen-Cluster“ liegt in der Spalte Z.38354#_€11€44€53€3€0€/#_€11€/#_[1]$1$3$/#_[1]$1$/#_[1]$1$/#_[1]$1$2$3$52$. Schwefel-Summe“ ($) =“64“ als „52“_verschwenkt nach links 23=QS=“5“_Spalte 1/1/1/1=QS=“4“_“3“ mit Summe 52+5+4+3=“64“ für „Schwefel-Summe“ ($) =“64“. Eisen-Summe (€) =“104“ als Spalte „11/11“=QS=“4“_“44“_“53“_“3_“0“ mit Summe 4+44+53+3+0=“104“ für Eisen-Summe (€) =“104“. „Die Kristallstruktur der Primase zeigte, dass der [4Fe–4S]-Cluster im Protein vergraben ist und eine strukturelle Rolle erfüllt… In den DNA-Polymerasen δ (delta) und ζ (zeta) können sie möglicherweise eine regulatorische Rolle spielen, indem sie Hürden während der DNA-Replikation erkennen und den DNA-Polymerase-Schalter durch Oszillation zwischen oxidierten und reduzierten Zuständen unterstützen.“
{Eisen-Schwefel-Cluster in DNA-Polymerasen und Primasen von Eukaryoten – PMC (www-ncbi-nlm-nih-gov.translate.goog): T. Tahirov; Dez.2017; doi: 10.1016/bs.mie.2017.09.003].
DNA-Polymerase-epsilon-Komplex (POLE, POLE2, POLE3, POLE4): Die „DNA-Polymerase-epsilon“ ist für die Synthese am Leitstrang zuständig. Das akzessorische Protein (Mensch) „POLE2“ (!!)=527AS ist dem Komplex in der Spalte Z.38354#_[1445]!33![082][4][07]/#_[1]!40!33“16![86681] vorgelagert, und zwar als „40“_33=QS=“6“_absteigend 33=QS=“6“ mit Summe 40+6+6=“52“_aufsteigend 16=QS=“7“ mit 52_7 für „POLE2“ (!!) = 527AS [POLE2 - DNA polymerase epsilon subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Membran „33“_0 ist mit Zink kombiniert. Das Protein orientiert sich an Gewebe „33“ und zielt speziell auf die Darmwand „808“ ab, weil an der angrenzende Spalte „8/8“ seitlich eine Verbindung QS30_16=10 für „0“ als „808“ gelegt wird. Die Blutspalte „2/6“ für das Knochenmark liegt außerhalb, kann aber aus der Spalte 30/16=QS=3_QS=7_Spalte 8/8=QS=16 mit Summe 3+7+16=Blut=26 für Knochenmark mit dem angehängten 668=QS=20 (Calcium) alternativ entstehen. „Pole2“ besitzt eine Wechselwirkung zum Zinkfingerprotein (Mensch) „ZNF620“=422AS, das außerhalb in der Spalte 22/40 praktisch lesbar ist, und nach links ein Homodimer als „4“_308=QS=11=QS=“2“_“2“ mit 4_2_2 für „ZNF620“=422AS(Dimer) bildet, das mit „POLE2“ die Ziffer „3“ teilt [ZNF620 - Zinc finger protein 620 - Homo sapiens (Human) | UniProtKB | UniProt].
Protein (Mensch) „POLE“ {} =2286AS bindet Zink=30, das als 2. Zink nach Zink in „POLE2“ vorliegt und anschließend das [4Fe-4S]-Cluster, das bereits von „Pol alpha“ bekannt ist, und zwar spaltenförmig in der Spalte Z.38356#_[1]|361|{30}§51§[0028]/#_>1<|31|[9]{29}§55§(2)(4)(3)[2]/#_>12<|7|72{8}§81§(38)(7)(6)/#_>1<2352{8}{29}{4}(3)(4)(1) als Zink 30=QS=“3“_29=QS=“11“_“8“ mit Summe 3+11+8=“22“_8“_29=QS=11=QS=“2“_“4“ mit „228“_Summe 2+4=“6“ mit 228_6 für „POLE“=2286A [POLE - DNA polymerase epsilon catalytic subunit A - Homo sapiens (Human) | UniProtKB | UniProt]. „Pole“ interagiert mit dem Protein (Mensch) „Rad1“ (§§)=681AS, das sich spaltenförmig rechts neben „Pole“ legt, und zwar als 51=QS=“6“_Kunstgriff 55=QS=10 für „0“_“81“ mit „6“_Summe 0+81=“81“ mit 5_81 für „Rad1“ (§§)=681AS [RAD17 - Cell cycle checkpoint protein RAD17 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation (Mensch) „POLE_Q96IE1“ () =797AS füllt neben „Rad1“ die Lücke zum Zeilentand. Eine „Cluster-Bindung“ ist ebenfalls vorhanden. Es ist eine Zinkfinger-Domäne aber keine Zinkbindung enthalten. Die Startziffer „2“ kann wahlweise als Ziffer „2“ ohne Zink-Kontakt beginnen, oder vorgelagert mit der Methode „QS=11=QS=2“ durch das Zink=30E ziehen. Protein (Mensch) „POLE“ () =797AS, Zink-freie kurze Version, aufsteigend „2“_38=QS=11=QS=“2“_“3“ mit Summe 2+2+3=“7“_“4“_Randspalte 6/1=“7“ mit „7“_Summe 4+7=11=QS=“2“_“7“_ mit „7“_Summe 2+7=“9“_QS4+3=“7“ mit 7_9_7 für „POLE_Q96IE1“ () =797AS (Modifikation) [POLE - DNA polymerase epsilon catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „POLE3“ (||) =147AS folgt POLE2 und liegt links neben „POLE“ als 361=QS=“10“_31=QS=“4“ mit Summe 10+4=“14“_“7“ mit 14_7 für „POLE3“ (||) =147AS [POLE3 - DNA polymerase epsilon subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CHRAC1“ (><)=131AS bildet mit „POLE3“ einen Komplex, der in die Randspalte mit der Ziffer „1“ einzieht, um dort „nackte DNA“ zu binden, und zwar als „1“_QS1+2=“3“_“1“ mit 1_3_1 für „CHRAC1“ “ (><)=131AS [CHRAC1 - Chromatin accessibility complex protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „POLE4“ („“) =117AS folgt POLE3 und ist zwischen „POLE“ und „CHRAC1“ eingeklemmt, und zwar als Spalte „9/7“ für „97“_Spalte 2/2/2=QS=“6“_Spalte 5/3=QS=“8“_“3“_Spalte 2/1=QS=“3“ mit Summe 97+6+8+3+3=117 für „POLE4“ („“) =117AS [POLE4 - DNA polymerase epsilon subunit 4 - Homo sapiens (Human) | UniProtKB | UniProt].
DNA-Polymerase-delta-Komplex (POLD1, POLD2, POLD3, POLD4): Die DNA-Polymerase-delta ist für die Synthese am Folgestrang zuständig [DNA-Polymerase - DocCheck Flexikon]. Das Protein „PCNA“ fungiert als Prozessivitätsfaktor für DNA-Polymerasen. Vom bereits dargestellten „homotrimeren PCNA“ ist 1 Monomer geeignet, sich vorgelagert am zentralen „POLD1“ rechts anzulagern. „POLD3“ liegt rechts vom zentralen „POLD1“, gefolgt von „POLD4“ am rechten Rand. „POLD4“ ist nur mit „POLD3“ und „PCNA“ verbunden. „POLD2“ liegt links von „POLD1“, interagiert aber ebenfalls mit „PCNA“, so dass es sich klammerartig um „POLD1“ legt und sich am Ende einerseits mit „PCNA“ und andererseits mit „POLD3“ verbindet. „POLD1“ ist die katalytische Komponente, „POLD 2, 3, 4“ sind akzessorische Proteine. Das Protein (Mensch) „PCNA“ (!!) =261AS (Monomer) liegt in der Spalte Z.38353#_[697]!2![24]/#_[082]!40![7]/#_[6]!866!8![1]/#_[5]!1![0]!0!2![8], und zwar schleifenförmig aufsteigend als „2“_“40“_Kunstgriff Spalte 8/2=QS=10 für „0“_“0“_absteigend QS8+6+6=“20“ mit „2“_Summe 40+0+0+20=“60“_aufsteigend “1“ mit „2“_Summe 60+1=“61“ mit 2_61 für „PCNA“ (!!)=261AS (Monomer) [PCNA - Proliferating cell nuclear antigen - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „POLD1“ {}=1107AS liegt in der Komplex-Spalte Z.38353#_[34697]!2![24]/#_(3)(308)(2)!40!7]/#_(3)[1]{6}!866!8![1]/#_(30){5}!1![0]!0!2“|8|/#_[9](29){55}§2§43§|2|/#_[2](8)(8){1}§38§7§|6|/#_[2](8)(2){9}{4}{3}§4§|1|/#_[2](7)(99)§381§[2] als 6/5=QS=“11“_55=QS=10 für „0“ mit 11_0 für „110“_Kunstgriff 1/9=10 für „0“_43=QS=“7“ mit „110“_Summe 0+7=“7“ mit 110_7 für 1107AS. Die Startspalte „6/5“ verbindet beide „Zink=30E“-Positionen, um dann aufsteigend das [4Fe-4S]-Cluster anzusteuern [POLD1 - DNA polymerase delta catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. „Pold1“ wird mit Mutationen in Verbindung gebracht, die bei Beteiligung vom Protein (Mensch) „ TREX1“=314AS ( "three prime repair exonuclease 1) mit Erkrankungen einer schnellen Alterung verbunden sind [POLD1: Zentraler Mediator der DNA-Replikation und -Reparatur und die Auswirkungen auf Krebs und andere Pathologien - PMC (nih.gov); S. Arora, u.a Jun 2016; doi: 10.1016/j.gene.2016.06.031]. Der POL-delta-Komplex ist bis auf die 2 unbesetzte Ziffern (1 und 0) lückenlos. „TREX1“ ist am Abbau von DNA im Rahmen der Apoptose beteiligt [TREX1 - DocCheck Flexikon]. „TREX1“ startet im Loch „1“, zieht durch die Startspalte „6/5“ von „POLD1“ kreuzt das Loch „0“ und endet mit der Ziffer „4“ in der Zeitbasis „24“, woraus sich die Alterung ergibt. „TREX1“ läuft durch die Spalte 1002/[5]24[3], die für den Cofaktor „Magnesium=12E“ 2 Mg-Atome enthält, und zwar über 1[00]2 für Mg=12E und nochmals über „1[0]/2“. Ersatzweise mit „52“ gespiegelt für Mangan=“25“, und wenn die Ziffer „1“ mit der Zeitbasis „24“ addiert wird. „TREX1“=314AS liegt in der Spalte Z.38355#_[3]|„1“|“6“[86681]/#_[30]“5“1“|„0“|“0“(2)[8]/#[2955(2)“4“[32] als „1“_Spalte 6/5=QS=11=QS=“2“ mit Summe 1+2=“3“_“1“_0_Spalte 0/4=“4“ mit „31“_Summe 0+4=“4“ mit 31_4 für „TREX1“=314AS. „TREX1“ arbeitet beim GZMA-vermittelten Zelltod mit „NME1“ zusammen: „NME1“ schneidet einen DNA-Strang und „TREX1“ entfernt Basen vom freien 3'-Ende, um DNA-Schäden zu verstärken und eine schnelle Reparatur des DNA-Endes zu verhindern. „Granzyme A und B“ sind „Serinproteasen“, die an Caspase-unabhängigen Signalwegen beteiligt sind: GZMA [Granzyme A (Granzyme 1, Cytotoxic T-Lymphocyte-Associated serine Esterase 3)]. „Serinproteasen“ sind Enzyme, die Proteine spalten. Das Protein (Mensch) „NME1“=152AS bildet mit „NME2“=152AS ein 8-zeiliges „Hexamer“. Der Cofaktor „Magnesium“ ist ebenfalls gleich. Für „NME1“ wird ein Trimer angenommen. Das „Serin“=56AS entsteht im Ring-Raum als Kurzschluss im Hexamer, und zwar in der Spalte Z.38354#_[3](308)(2)!407!/#_[3](1)[686]!681!/#_(30)[510]0§28§/#_$29$[55]{2}{4}§32§/#_$28$[81]{38}§7§[6]/#_$28$29$4$[3]§4§|1|/#_[279]|9|38|1|2|/#_[279]|1|2|[271]. Fall1/NME1 {}: ab Z.38357 ringförmig „4“ [Endziffer von Trex1]_38=QS=“11“ mit Summe 4+11=“15“_“2“ für NME1 {}=152AS; Fall 2/NME2 (§§): 28=QS=“10“_32=QS=“5“ mit Summe 10+5=“15“_Spalte=4/7=QS=11=QS=“2“ mit 15_2 für NME2 (§§)=152AS; Fall3/NME2 (||): enthält lesbaren Cofaktor „Mg“=12E, um im Hexamer ein loses Ende mit einem Kunstgriff anzuschließen: aufsteigend in Randspalte 1/2 =QS=3_1_38=QS=11 mit Summe 3+1+11=15_12(Cofaktor Mg=12) zerlegt als „2“ für „15_2“_Kunstgriff Spalte 9/1=“10“ für „0“ mit Summe 152+0=“152“ für NME2 (||)=152AS; Fall4/NME2 ($): 294=QS=“15“_1.+2.Kunstgriff je 28=QS=10 für „0“_29=QS=11=QS=“2“ mit „15“_Summe 0+0+2=“2“ mit 15_2 für NME2 ($$)=152AS; Fall 5/NME1 (): 30=QS=“3“_“1“ (Startziffer TREX2)_308=QS=“11“ mit Summe 3+1+11=15_2 für NME1=152AS; Fall6/NME1 (!!): 681=QS=“15“_407=QS=11=QS=“2“ mit 15_2 für NME1=152AS [NME1 - Nucleoside diphosphate kinase A - Homo sapiens (Human) | UniProtKB | UniProt ; NME2 - Nucleoside diphosphate kinase B - Homo sapiens (Human) | UniProtKB | UniProt]. Die „Episoden-Lebenszeit“= 97 Jahren * 365 Tage /Jahr =35405 Tage wird mit einer Kunstpause dargestellt, und zwar in der Spalte Z.38355#_0“0“28/#_“2“4“[32]/#_“3“87“[6]/#_[4]“34“[1]/#_[3]“8“[12] ab Z.38360 absteigend als „8“_34=QS=“7“_87=“15“_Spalte 2 (aus Zeitbasis 24)/3=QS=“5“ mit Summe 8+7+15+5=“35“_Spalte „4(aus Zeitbasis 24)/0“ für „40“_Spalte 2/3=QS=5 mit „35_40_5“ für 35405 Lebenstage=97 Jahre. Die „Telomere“ am Ende von Chromatiden gelten als Biomarker für das Lebensalter. Bei Wirbeltieren wiederholen sich „Hexanukleotide“ (6 Nukleotide) der Sequenz 5'–TTAGGG–3' mehrere tausend Mal [Telomer – Wikipedia]. Achtung: Die Buchstaben gelten nicht für Aminosäuren, sondern abweichend für Thymin=C5H6N2O2=30+6+14+16=66E, Adenin=C5H5N5=30+5+35=70E und Guanin=C5H5N5O=78E. Aufgrund dieser großen Anzahl wird die DNA geschützt. Mit jeder Zellteilung werden die „Telomere“ kürzer, da die (normale) DNA-Polymerase am Folgestrang nicht mehr ansetzen kann. Die „Telomerase“ gleicht die Verkürzung der DNA-Enden wieder aus. Die Sequenz der 6 Nukleotide bildet im Code eine Schleife, wobei für „Adenin“ ein Kunstgriff zum Anschluss an „Guanin“ angehängt wird. Die Ende schließen sich nicht zum Ring, sondern legen sich mit dem Überstand von 1 Ziffer als Sequenz lediglich als Schleife eng zusammen. Die Zeitbasis „24“ wird zerschnitten und die Ziffer „2“ wird im Zentrum unbesetzt umringt, und zwar in der „Hexanukleotid-Spalte“ Z.38356#_(5)(10)(028)/#_(55)!2!§43§|2|/#_$8$13$§8§7§|6|/#_$29$4${34}[1]/#_€9€9€$3${8}[[12]/#_€9€1€22€7€[1] linksdrehend über 1.Guanin {}=78E in Randspalte Z.38359#_{34}[1]/#_{8}[12] als 34=QS=“7“_“8“ für Guanin {}=78E_2.+3.Guanin in der Randspalte in Z.38358#_§43§|2|/#_§8§|7|6 als 43=QS=“7“_“8“ für 2.Guanin (§§) =78E und 3.Guanin (||)=78E mit „7“_Spalte 2/6=QS=“8“ mit 7_8 für 3.Guanin (||)=78E_Adenin ()=70E in der Spalte Z.38356#_(5)(10)(028)/#_(55)!2!§43§|2| als „55“_“5“_“10“ mit Summe 55+5+10=“70“_Kunstgriff 028=QS=10 für „0“ mit Summe 70+0=“70“ für Adenin () =70E_1.Thymin ($)=66E in der „Hexanukleotid-Spalte“ Z.38356#_(5)(10)(028)/#_(55)!2!§43§|2|/#_$8$13$§8§7§|6|/#_$29$4${34}[1]/#_€9€9€$3${8}[[12]/#_€9€1€22€7€[1] über Spalte 4/3 richtungsabhängig absteigend als „34“_29=QS=“11“_“8“_“13“ mit Summe 34+11+8+13=“66“ für Thymin ($) =66E_2.Thymin (€)=66E als „7“(Überstand)_“22“_Spalte 1/9 absteigend für „19“_aufsteigend Spalte 9/9=“18“ mit Summe 7+22+19+18=“66“ für Thymin (€) =66E. Die „Telomerase“ gleicht die Verkürzung der DNA-Enden wieder aus. Die „Telomerase“ wird folglich durch die Sequenz laufen und die verlorene Ziffer !2! der Zeitbasis „24“ wieder einsammeln. Der Schutz der „Telomere“ erfolgt vom Proteinkomplex „Shelterin“, der aus den Untereinheiten „TRF1, TRF2, POT1, RAP1, TIN2, TPP1“ besteht. Das Protein (Mensch) „TRF1_Telomer-Repeat-Bindungsfaktor 1“=439AS bindet an der Sequenz. Aufgrund der Schleifenform werden dabei die beiden Schleifenenden „G-T“ verbunden. Die entfernt liegende Ziffer !2! wird trotzdem mit aufgenommen, weil es sich bei „TRF1“, um ein „Homodimer“ handelt [Shelterin – Wikipedia]. „Das Telomer-Repeat-Bindungsfaktor-1-Protein ist während des typischen Zellzyklusprozesses an den Telomeren vorhanden, wo der Aspekt der Zellalterung überwacht wird“ [Telomer-Repeat-Bindungsfaktor 1 – Wikipedia]. Eine geringere Aktivität der schützenden Telomerase wird mit der Zellalterung assoziiert, zumal das Enzym nicht in allen Zellen vertreten ist. „TRF1“=439AS liegt in der Spalte Z.38356#_(10)[028]/#_(5!2!)[432]/#_(13)[876]/#_[9](4){3}{4}[1]/#_[93]{8}{1}[2]/#_[12]{27}[1], und zwar für Fall 1/ Monomer {} aufsteigend als „4“ Spalte 3/8=QS=11=QS=“2“_“1“ mit „4“_Summe 2+1=“3“_27=“9“ mit 4_3_9 für „TRF1“ {}=439AS (Monomer); Fall 2/ Homodimer () absteigend als „4“_“3“_Spalte 5/1=QS6_!2!_0_1=“9“ mit „43“_Summe 6+!2!+0+1=“9“ mit 43_9 für „TRF1“ () =439AS (Homodimer) [TERF1 - Telomeric repeat-binding factor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TRF2_Telomer-Repeat-Bindungsfaktor 2“=542AS fügt die Zeitbasis „24“ wieder zusammen, indem diese auf die beiden Untereinheiten im „Dimer“ verteilt vorliegt, und zwar in der Randspalte Z.38356#_[100](2)[8]/#_{5}{!2!}(!4!)(3)[2]/#_{13}(8)[76]/#_[94](3)“4“/#_ [9]“38“1“2“ für Fall 1/Monomer: „TRF2“ {} als „5“_aufsteigend 13=QS=“4“_absteigend_“!2!“ mit 5_4_2 für „TRF2“ {} =542AS und Fall 2/Homodimer: „TRF2“ () aufsteigend Spalte 2/3=QS=“5“_“!4!“_Spalte 8/3=QS=11=QS=“2“ mit 5_!4“_2 für „TRF2“ ()=542AS (Dimer) [TERF2 - Telomeric repeat-binding factor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „TRF2“ ist sehr kurz, so dass das Protein (Mensch) „DCLRE1B/Apollo“ („“)=532AS zur seitlichen Verlängerung rekrutiert wird, und zwar als QS4+1=“5“_12=QS=“3“_38=QS=11=QS=“2“ mit 5_3_2 für „DCLRE1B“ („“)=532AS [DCLRE1B - 5' exonuclease Apollo - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „POLD2“ () =469AS liegt links neben „POLD1“ und umklammert es vorgelagert, um PCNA auf der rechten Seite neben der Zahl „40“ zu erreichen. POLD2“ () =469AS als „2“_308=QS=11=QS=“2“ mit Summe 2+2=“4“_Spalte 3/3/3=QS=“9“_Spalte 0/9/8=QS=“17“_Spalte 8/2=QS=“10“_Spalte 8/7=“15“_99=QS=“18“ mit „4“_Summe 9+17+10+15+18=“69“ mit 4_69 für „POLD2“ () =469AS. „POLD2“ gehört gleichzeitig zum tetrameren „POL-Zeta-Komplex“ aus REV3L, MAD2L2, POLD2 und POLD3. „Interagiert mit KCTD10“ [POLD2 - DNA polymerase delta subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „POLD2“ ist mit „POLD3“ zunächst nur am Fußpunkt von „POLD1“ verbunden. Das Protein „MAD2L2“=211AS stellt ersatzweise für „PCNA“ die POLD2/3-Verbindung am Kopfpunkt her, und zwar in der Randspalte Z.38354#_“407“/#_[6]“8“1“/#_[0]“2“[8], wobei die Zahl „211“AS in beide Richtungen zählbar ist. „MAD2L2“ („“)=211AS als 407=QS=“11“_“1“_Spalte 8/2=QS=“10“ mit „11“_Summe 1+10=11=QS=“2“ mit 11_2 für „MAD2L2“=211AS [MAD2L2 - Mitotic spindle assembly checkpoint protein MAD2B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „KCTD10“ entnimmt das Ubiquitin {}=76AS aus einer PCNA-Schleife in der Randspalte als „7“_Spalte 0/8/2=QS=10 für „0“_Spalte 6/0=QS=“6“ mit 7_6 für Ubiquitin {}=76AS. „KCTD10“ ()=313AS schneidet dann den unnötigen Doppel-Kunstgriff „0_82“ den 2.Kunstgriff „82“=QS=10 für „0“ von „POLD2“ ab, der die Verbindung zu „PCNA“ herstellt. Abschließend werden die Startspalte „6/5“ von „POLD1“ sowie die unbesetzten Ziffer „0“ und „1“ mit aufgenommen. Vergleichsweise steigt die „Episoden-Lebenszeit“=35405 Tage aus Z.38360 ab und ist in der Randzahl [10]{(0)}{2}[8] über die Ziffern {(0)}{2} mit Ubiquitin und über die Ziffer (0) mit „KCTD10“ in Kontakt. Über das „Ubiquitin“ ist dann auch die Endziffer „5“ der Lebenszeit involviert. „KCTD10“ () =313AS liegt in der Spalte Z.38354#_[30](82)4{0}{7}/#_(1)(6)(86{6}){8}1/#_0(5)(10{0}){2}[8], und zwar als 82=QS=“10“_aufsteigend 866=QS=“20“_mit Summe 10+20=“30“_100=QS=“1“ mit Summe 30+1=“31“_absteigend Spalte 6/5=QS=11=QS=“2“_“1“ mit „31“_Summe 2+1=“3“ mit 31_3 für „KCTD10“ ()=313AS. „Substratspezifischer Adapter eines BCR (BTB-CUL3-RBX1) E3 Ubiquitin-Protein-Ligase-Komplexes. Der Komplex vermittelt die Ubiquitinierung von Zielproteinen, was zu deren Abbau durch das Proteasom führt“ [KCTD10 - BTB/POZ domain-containing adapter for CUL3-mediated RhoA degradation protein 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „POLD3“ (§§) =466AS zeigt Wechselwirkungen zu den anderen Untereinheiten und zu „PCNA“. Der Wirkstoff „Afimoxifen“ bestätigt, dass „POLD3“ rechts von POLD1 lokalisiert ist und POLD2=469AS links. Das „4-Hydroxytamoxifen“ (Afimoxifen)=C26H29NO2=156+29+7+16=208E ist ein selektiver Estrogenrezeptormodulator, der versuchstechnisch geeignet ist, speziell „POLD3“ zu hemmen [POLD3 Is Haploinsufficient for DNA Replication in Mice - PubMed (nih.gov) ; M.Murga; u.a.; Aug 2016 DOI: 10.1016/j.molcel.2016.07.007; 4-Hydroxytamoxifen – Wikipedia]. Das lesbare Symbol „weiblich=66“ für das weibliche Hormon „Östrogen“ liegt vorgelagert zu weit entfernt, um darüber die schmale Spalte für „POLD3“ zwischen „POLD1“ und „POLD4“ zu finden. Es wird nur die rechte Ziffer „6“ gelesen, und die 2. Ziffer „6“ aus der Spalte „6“[8]/“0“2“/“4“[3] mit 02=QS=“2“_“4“ mit Summe 2+4=“6“ für weiblich=66 als Spalte erzeugt, um den versteckten Einstieg in „POL3“ zu finden. Die Spiegelung von „02“ ist die Startziffer „20“ für den Wirkstoff. „Afimoxifen“=208E als „2“_“0“_4_Kunstgriff_Spalte 3/7=10 für „0“_4 mit 20_Summe 4+4=“8“ mit 20_8 für „Afimoxifen“=208E. „POLD3“ (§§) =466AS liegt schleifenförmig in der Komplex-Spalte Z.38353#_[34697]!2![24]/#_(3)(308)(2)!40!7]/#_(3)[1]{6}!866!8![1]/#_(30){5}!1![0]!0!2“|8|/#_[9](29){55}§2§43§|2|/#_[2](8)(8){1}§38§7§|6|/#_[2](8)(2){9}{4}{3}§4§|1|/#_[2](7)(99)§381§[2] und startet in der Z.38357 als „2“_aufsteigend 38=QS=11=QS=“2“ mit Summe 2+2=“4“_absteigend „43“_Spalte 7/4=QS=“11“_381=QS=“12“ mit „4“_Summe 43+11+12=“66“ mit 4_66 für„POLD3“ (§§) =466AS.
Das Protein (Mensch) „Spartan_DVC1_C1orf124“=489AS ist an der DNA-Reparatur bei Schäden durch UV-Licht beteiligt. Bei einem „ubiquitiniertem PCNA“ wird an die PCNA-Spalte 6/0=QS=“6“ die Zahl 43=QS=“7“ für Ubiquitin=76AS angehängt. Bei UV-Schäden wird das „Spartan“ rekrutiert und erkennt das „PCNA“, weil die Ziffer „4“ die Startziffer von „Spartan“ ist, die auf „POLD3“ liegt. „Spartan“ als Spalte 4/8 für 48_43=QS=7_38=QS=11=QS=2 mit „48“_Summe 7+2=9 mit 48_9 für „Spartan“=489AS [SPRTN - DNA-dependent metalloprotease SPRTN - Homo sapiens (Human) | UniProtKB | UniProt]. Für die Zink-Bindung fehlt zwar das „lesbar Zink“, aber mit der Startziffer „4“ in „24“ wird nunmehr die Ziffer „6“ aus „PCNA“ erkannt und zu 24_0_6=QS=30=Zink=30E verwendet. „Spartan“ interagiert mit dem Protein (Mensch) „VCP_CDC48_p97“=806AS an Stellen mit DNA-Schäden [DVC1 (C1orf124) recruits the p97 protein segregase to sites of DNA damage - PubMed (nih.gov); E. Davis; Nov 2012; DOI: 10.1038/nsmb.2394]. „VCP“=806AS liegt als Ring in der Randspalte, und zwar als Ring in der Spalte Z.38356#_02[8]/#_4“3“[2]/#_“8“7“[6] als „8“_absteigend Spalte 3/7=10 für „0“_“2“_aufsteigend Spalte 0/4=QS=4 mit „80“_Summe 2+4=6 mit 80_6 für „VCP“=806AS. Der Schaden, die Ziffer „0“, ist ein Stopp der Replikation [VCP - Transitional endoplasmic reticulum ATPase - Homo sapiens (Human) | UniProtKB | UniProt].
Die Transläsionspolymerase, das Protein (Mensch) „REV3L_Polymerase_Zeta=3130AS kann die DNA-Synthese an beschädigten Nukleotiden fortsetzen. Das Protein bewegt sich gegenläufig zu „POLD3“, absteigend aus dem [4Fe-4S]-Cluster zum Zink [The POLD3 subunit of DNA polymerase δ can promote translesion synthesis independently of DNA polymerase ζ - PMC (nih.gov); K.Hirota, Jan. 2015; doi: 10.1093/nar/gkv023]. Es ist aber nicht das „lesbare Zink“=30, sondern das speziell an der Schadenstelle „0“ erzeugte Zink. Weil die Zahl 30=Zink im Protein enthalten ist, erfolgt beim Durchlauf eine Reparatur, und zwar in der Spalte Z.38355#_[6]“6“[81]/#_[0]“0“[28]/#_“24“[32]/#_“38“7“[6]/#_[43]“4“[1]/#_[3]“81“[2] als 81=QS=“9“_Spalte 7/4=QS=“11“_38=QS=“11“ mit Summe 9+11+11=“31“_Zink als „24“_Spalte 6/0(Stopp)=“6“ mit „31“_QS24+6=“30“ für 31_30 für „REV3L_ Polymerase_Zeta“=3130AS [REV3L - DNA polymerase zeta catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt
Das Protein (Mensch) „POLD4“ (||) =107AS ist die kleinste Untereinheit und folgt „PCNA“ in der Randspalte Z.38355#_[86>6<>8<][1]/#_[>100<>2<]|8|/#_|2|/#_[7]|6|/#_|1| als QS8_2=“10“_QS6_1=“7“ mit 10_7 für „POLD4“ (||) =107AS [POLD4 - DNA polymerase delta subunit 4 - Homo sapiens (Human) | UniProtKB | UniProt].Bei einer Umschaltfunktion kann die Summe=10 als Kunstgriff 10 für „0“ dienen, weil die Ziffer zuvor in der Spalte liegt. Die Summe 1+8+2=“11“ erzeugt den Bezug zum Lymphknoten, die verteilt am Zeilenrand an passender Stelle als 11er Knoten-Kette durchgezählt werden. „Pold4“ wird verstärkt in Lymphknoten gebildet und exprimiert „Ubiquitin“=76AS, dass der Summe=11 lesbar folgt. „POLD4“ verstärkt die Aktivität von Pol-delta-Komplexes, ist an der DNA-Reparatur beteiligt und zeigt Wechselwirkungen mit dem DNA-Helikase-Bloom-Syndrom-Protein [POLD4 DNA-Polymerase delta 4, akzessorische Untereinheit [Homo sapiens (Mensch)] - Gen - NCBI (nih.gov)]. Im Labor wurde die Bildung eines Dimers festgestellt. POLD4 (>< ) Dimer =107AS zieht durch „PCNA“ und bindet damit an „POLD1“, und zwar als Spalte „8/2“ =QS=“10“_“6“_100=QS=“1“ mit „10“_Summe 6+1=“7“ mit 10_7 für „POLD4“ (>< ) =107AS (Dimer)[Die humane DNA-Polymerase delta ist ein pentameres Holoenzym mit einer dimeren p12-Untereinheit - PubMed (nih.gov) ; P. Khandagale;März 2019; DOI: 10.26508/lsa.201900323]. Die ATP-abhängige DNA-Helikase, Protein (Mensch) „BLM_Bloom-Syndrom-Protein (RecQ2)“=1417AS stellt DNA-Schäden fest und leitet die Reparatur ein. „BLM“ besitzt eine ATP-Bindung und den Cofaktor-Zink in der Spalte Z.38355#_331686“6“[81]/#_[1]“305“1“[0]“0“2“!8!/#_[929552432]. „ATP“=260E über Spalte „002/243“ als „2“_Splate 0/4=QS=“4“_ Spalte 0/2 für „2“_Summe 4+2=“6“_“0“ mit 2_6_0 für ATP=260E. „BLM“=1417AS mit Bindung seitlich an „POLD4“ mit „2“_Spalte 6/0=QS=“6“_“6“ mit Summe 2+6+6=“14“_Spalte 8/1=9_(Zink=)30_5=QS=“8“ mit „14“_Summe 9+8=“17“ mit 14_17 für BLM=1417AS. Eine mögliche Mutation kann statt der Bindung rechts an die Startziffer „“8 von POLD4 die vertikal vorgelagerte Ziffer „8“ wählen. Dafür müsste „Pold4“ aber diese alternative Verlängerung bevorzugen. „POLD4 wird vom KHDC3L-OOEP-Gerüst an DNA-Replikationsgabeln rekrutiert, wo es durch die TRIM25-Ubiquitinierung zurückgehalten wird, wodurch der Neustart von blockierten Replikationsgabeln gefördert wird“ [Uniprot „POLD4“]. Das Protein (Mensch) „TRIM25“=630AS überwindet die Distanz von der Zink-Bindung bis zum Ubiquitin=76AS an „POLD4“ mittels einer Schleife in der Spalte Z.38356#[30]“51“0“02“8“/#_[2955]“2“4“3“2“/#_[2881]“38“7[6], und zwar als [Zink=30]51=QS=“6“_Spalte 0/2=QS=“2“_38=QS=11=QS=“2“_Spalte 0/4=QS=“4“_“2“ mit „6“_Summe 2+2+4+2=“10“_Randspalte (im POLD4) 8/2=QS=“10“_Spalte 3/7 (aus Ubiquitin)=QS=“10“ mit „6“_Summe 10+10+10=“30“ mit 6_30 für „TRIM25“=630AS [TRIM25 - E3 ubiquitin/ISG15 ligase TRIM25 - Homo sapiens (Human) | UniProtKB | UniProt].
Ribonuklease Typ H: Die Enzym-Gruppe „H“ baut die RNA in DNA-RNA-Hybriden ab [Ribonukleasen H – Wikipedia]. Der für die Replikation erforderliche RNA-Primer wird abgebaut, um das „Uracil“=C4H4N2O2=24+4+14+16=58E der RNA gegen „Thymin=“ C5H6N2O2=30+6+14+16=66E für die verdoppelte DNA auszutauschen. Speziell sind die Enzyme „RNase H1“/„RNase H2“ zuständig. Das Protein (Mensch) „RNase H1_RNASEH1“=286AS besitzt den Cofaktor „Magnesium“ und kann nach der Bindung am Substrat ein 2. Mg-Ion binden. Diese Situation ist in der Spalte Z.38354#_[30]{8}(2)(407)/#_{16}{8}(66)[8](1)/#_{05}{100}{2}(8)/#_[95524]{3}(2)/#_[881387](6)/#_[82943](4)(1) mit dem lesbaren Mg=12 in „1(00)2“ vorhanden. Im RNA-Substrat ist die Nukleinbase „Uracil“=58E enthalten. Dieses zählt sich in der Spalte „51!0!/552“ als „5_Spalte 1/5=QS=“6“_“2“ mit „5“_Summe 6+2=“8“ mit 5_8 für „Uracil“=58E. Über die Null-Eckkonstruktion zieht sich das 2.Magnesium als Cofaktor über Eck mit. „RNase H1“ besetzt den zentralen Zeilenbereich, so dass sich „RNase H2“ bei der Komplexbildung links im Bereich der „PCNA“ entfalten muss. Die Aktivitäten von „RNase H1“ werden ansonsten von der DNA am selben Strang gehemmt. Für den Primer-Abbau ist „RNase H2“ notwendig. Das Thymin=66E wird lesbar eingebaut und das Uracil=58E liegt zum Abbau in einer 5-zeiligen Randspalte, und zwar absteigend als 41+6+2+8+1=Uracil=58E. „RNase H1“{}= 286AS als Spalte 8/8=QS=“16“_16=QS=“7“_05=QS=“5“ mit Summe 16+7+5=“28“_100=QS=“1“_Spalte 2/3=QS=“5“ mit „28“_Summe 1+5=“6“ für „RNase H1“{}= 286AS. „Spielt eine Rolle bei der Beendigung der RNA-Polymerase II (RNAp II)-Transkription, indem es die R-Loop-RNA-DNA-Hybridbildung an G-reichen Pausenstellen abbaut, die sich stromabwärts der Poly(A)-Stelle und hinter der elongierenden RNAp II befinden“ [RNASEH1 - Ribonuclease H1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die RNA-Pol-II, ein Komplex aus 12 Proteinen, verknüpft einzelne Nukleotide zu einer RNA während der Transkription. Dabei nutzt sie die DNA als Matrize.
„RNase H2“ besitzt ebenfalls den Cofaktor „Mg“=12E, muss diesen aber unsichtbar am Zeilenrand in der Spalte 407=QS=11=QS=2/1 für Mg=12E bilden. Für den 2.Cofaktor „Mangan“=25E ist am Zeilenrand nur die Ziffer „2“ enthalten. Die Mn-Ziffer „5“ liegt im Komplex, und zwar angrenzend in der Endziffer-Spalte 2/3=QS=5 von „RNase H1“. Protein (Mensch) „RNase H2_ RNASEH2A“ () =299AS als „2“_Schleife auf+ab über „66“ (=Thymin)_407=QS=“11“_Randspalte_1/8/2=QS=“11“_Randspalte 6/1=QS=“7“_“4“ mit „2“_Summe 66+11+11+7+4=“99“ mit 2_99 für „RNase H2“ () =299AS [RNASEH2A - Ribonuclease H2 subunit A - Homo sapiens (Human) | UniProtKB | UniProt].
Die „RNA-Polymerase II“ bildet einen Komplex aus 12 Proteinen [RNA-Polymerase II – Wikipedia]. Das katalytische Zentrum liegt in den Proteinen „RPB1“=1970AS und „RPB2“=1174AS. Die gemeinsame Bindung an Zink ist mit !2!8+2=Zink=30E unlesbar. Es liegt eine Verbindung vor, in dem sich die beiden Proteine die Ziffer !2! teilen, und zwar in der Spalte Z.38355#[161]|1|403|[3]“1“6“(8)(66)(8)(1)/#[16]|11|3|[6]|1|“3“0“5“(10)(0){(!2!)8}/#[16]|11|3|!1!|9|“2“[9]|5|{52}{43}{2}/#[1](6){11}{2}!7!72!“8“|8|{1}§38§7§[6]/#[1](61){12}35!2!“8“>29<>43<§41§/#[161]“1“1“93“27“!99!38!1!2“/#[16111512791227]!1!.
Die RNase H1“/„RNase H2“ stoppen die RNA-Polymerase in der Randspalte. Fall1: Das Protein (Mensch) „RPB1“ {}=1970AS in Z.38358 als „1“ absteigend Summe 52+43+2=“97“_absteigend 28=QS=10 für „0“ mit 1_97_0 für „RPB1“ {}=1970AS [POLR2A - DNA-directed RNA polymerase II subunit RPB1 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall2: Das Protein (Mensch) „RPB2“ ()=1174AS mit Zink als Randspalte 28/2=QS=30(Zink). Für die Bindung an Magnesium=12E als 1(00)2 wird, ansonsten unnötig, ein schleifenförmiger Kunstgriff Zahl 10 für „0“ eingebaut (bei einem Cofaktor könnte die Zahl „1“ extern bleiben). Randziffer „1“_aufsteigend Spalte 8/2=QS=“10“ mit Summe 1+10=“11“_“0“_“10“_mit „11“_Summe 0+10=10 für „0“_absteigend “8“_“66“ mit „11“_Summe 0+8+66=“74“ mit 11_74 für RPB2“ ()=1174AS [POLR2B - DNA-directed RNA polymerase II subunit RPB2 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall3: Das Protein (Mensch) „RPB9“ („“)=125AS als „1“_aufsteigend Spalte 6/5=QS=11=QS=“2“_über Zinkfinger „30“ in Spalte 30/2=QS=“5“ mit 1_2_5 für „RPB9“ („“)=125AS [POLR2I - DNA-directed RNA polymerase II subunit RPB9 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall4: Das Protein (Mensch) „RPABC2“ (||)=127AS in Z.38355 als „1“_aufsteigend Spalte 11/11=QS=“4“_absteigend Spalte 3/3=QS=6_mit „1“_Summe 4+6=“10“_403=QS=“7“_aufsteigend Spalte 1/9=QS=“10“_mit „1“_Summe 10+7+10=“27“ mit 1_27 für „RPABC2“ (||)=127AS [POLR2F - DNA-directed RNA polymerases I, II, and III subunit RPABC2 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall5: Das Protein (Mensch) „RPB7“ (!!)=172AS in Z.38357 als „1“_aufsteigend „7“_“7_aufsteigend Spalte 2/2=QS=“4“ mit „17“_Summe 7+4=“11“=QS=“2“ mit 17_2 für „RPB7“ (!!)=172AS [POLR2G - DNA-directed RNA polymerase II subunit RPB7 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall6: Das Protein (Mensch) „RPB3“ (§§)=275AS in Z.38358 interagiert mit „RPB11-a“ am rechten Rand als 38=QS=11=QS=2_7_41=QS=5 mit 2_7_5 für „RPB3“ (§§)=275AS [POLR2C - DNA-directed RNA polymerase II subunit RPB3 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall7: Das Protein (Mensch) „RPB11-a“ (><) =117AS liegt seitlich als 29=QS=11_43=QS=7 mit 11_7 für „RPB11-a“ (><) =117AS [POLR2J - DNA-directed RNA polymerase II subunit RPB11-a - Homo sapiens (Human) | UniProtKB | UniProt]. Fall8: Das Protein (Mensch) „RPB4“ {} =142AS liegt in Z.38358 links vom Fall5 „RPB7“, um einen gemeinsamen Komplex zu bilden, und zwar als „11“_aufsteigend 12=QS=“3“ mit Summe 11+3=“14“_absteigend „2“ mit 14_2 für „RPB4“ {} =142AS [POLR2D - DNA-directed RNA polymerase II subunit RPB4 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall9: Das Protein (Mensch) „RPABC5“ () =67AS ist Teil des Kernelements mit dem großen zentralen Spalt, der offenbar aus der Serie „#1“ am linken Rand angrenzt, und zwar in Z.38358#[1](6){11}/#[1](61){1} als „6“_61=QS=“7“ mit 6_7 für „RPABC5“ () =67AS [POLR2L - DNA-directed RNA polymerases I, II, and III subunit RPABC5 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall10: Das Protein (Mensch) „RPABC1“ („“) =210AS umgrenzt den zentralen großen Spalt. In Z.38358 aufsteigend Spalte 8/8 für „88“_zum linken Rand über „119327“ mit „88“_Summe 1+1+93+27=“122“ mit Summe 88+122=“210“ für „RPABC1“ („“) =210AS [POLR2E - DNA-directed RNA polymerases I, II, and III subunit RPABC1 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall11: Das Protein (Mensch) „RPABC4“ (||) =58AS füllt als Spalte in Z.38257#_5/#_8 für „58“ eine Lücke links von Fall 1 „RPB1“ für „RPABC4“ (||) =58AS [POLR2K - DNA-directed RNA polymerases I, II, and III subunit RPABC4 - Homo sapiens (Human) | UniProtKB | UniProt]. Fall12: Das Protein (Mensch) „POLR2H“ (!!) =150AS über Randspalte „2/1“ für „12“ absteigend zur Z.38360 über „99381“ mit „12“_Summe 99+38+1=“138“ mit Summe 12+138=“150“ für „POLR2H“ (!!) =150AS [POLR2H - DNA-directed RNA polymerases I, II, and III subunit RPABC3 - Homo sapiens (Human) | UniProtKB | UniProt].
DNA-Ligase 1 (Lig1) am replikativen Folgestrang (lagging strand): DNA-Polymerasen können DNA-Moleküle nur in 5'-3'-Richtung synthetisieren, so dass am Folgestrang nur kurze DNA-Fragmente (Okazaki-Fragmente) entstehen. Die „DNA-Ligase 1 (LIG1)“ arbeitet mit „PCNA“ zusammen, um die Kerben (Lücken) zwischen den vom Komplex „Pol δ“ und der „Flap-Endonuklease 1 (FEN1)“ erzeugten Okazaki-Fragmente zu verschließen. „PCNA“ legt sich als doppelter Ring um die „DNA“. „PCNA“ bildet mit „FEN1“ und der „eingekerbter DNA“ einen Komplex, der „LIG1“ rekrutiert. Die einzige Bindungsstelle von „LIG1“ an „PCNA“ liegt in einer exponierten Schleife, die als PIP-Box =(390_QRLML_394) bezeichnet wird [Mechanismus der humanen Lig1-Regulation durch PCNA in der Okazaki-Fragmentversiegelung - PMC (nih.gov); K. Blair u.a.; Dez. 2022; doi: 10.1038/s41467-022-35475-z]. Die Reaktion der „DNA-Ligase I“ ist ATP-abhängig. Es wird ein AMP-Ligase-Komplexes gebildet. „AMP“ wird zur Ausbildung einer Phosphodiesterbindung wieder abgespalten [DNA-Ligase I - DocCheck Flexikon]. Im Komplex PCNA-FEN1 nutzt „FEN1“ das in „PCNA“ mit „1(00)2“ liegende Magnesium, um über die Spalte 0/2 eine 2. Magnesium zu einer Ringbildung zu nutzen. Das 3.Magnesium=12E entsteht, wenn die FEN1-Startzahl „38“ zu QS=11=QS=2 reduziert wird und seitlich an die Ziffer „1“ aus POLD1 angefügt wird. Wie bekannt: Das Protein (Mensch) „PCNA“ (!!) =261AS (Monomer) liegt in der Spalte Z.38353#_[697]!2![24]/#_[082]!40![7]/#_[6]!866!8![1]/#_[5]!1![0]!0!2![8], und zwar schleifenförmig aufsteigend als „2“_“40“_Kunstgriff Spalte 8/2=QS=10 für „0“_“0“_absteigend QS8+6+6=“20“ mit „2“_Summe 40+0+0+20=“60“_aufsteigend “1“ mit „2“_Summe 60+1=“61“ mit 2_61 für „PCNA“ (!!)=261AS (Monomer) [PCNA - Proliferating cell nuclear antigen - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FEN1“ {} =380AS folgt „PCNA“ in Z.38358 (im Bereich POLD3) als „38“_absteigend Spalte 3/7=QS=10 für „0“ mit 38_0 für „FEN1“ {} =380AS [FEN1 - Flap endonuclease 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Zwischen „FEN1“, seiner Mg-Cofaktor-Spalte „0/2“ und „PCNA“ wird eine Ziffer „4“=räumlich (aus POLD3) eingeklemmt. Die beiden in „PCNA“ enthaltenen Nullen „OO“ repräsentieren die beiden um die DNA gelegten „PCNA-Ringe“, weil in der Spalte 4/6/0 bereits 1 Ring=64 zum „PCNA“ gehört und der 2.Ring über „6“6/00/[2]“4“ mit der Klemm-Ziffer „4“ zu 64 zum Doppelring ergänzt wird.
Das Protein (Mensch) „LIG1_DNA-Ligase 1“=919AS besitzt den Cofaktor Magnesium=12E als 1(00)2 in der Z.38356#_|0|5100|2|[8] und zerlegt „Lig1“ als 9_18_1, wobei die Summe 18 aus 66=QS=12 und 51=QS=6 entsteht. Die Zahl „51“ führt speziell den Phosphor=15E als wesentlich ein. Weil die 51=QS=“6“ nicht offensichtlich erkennbar ist, wird in dieser Zeile das ATP ||=260E als „2“_5100=QS=“6“_“0“ mit 2_6_0 für ATP ||=260E als Input der Katalyse gebildet. Das Abbauprodukt Adenosinmonophosphat (AMP) („“)=C10H14N5O7P=60+14+35+56+15=180E enthält nunmehr die für „LIG1“ erforderliche Zahl „18“ in der Spalte Z.38355#_[168]“66“[81]/_#_|0|“510“0“||2|[8] als 510=QS=6_66=QS=12 mit Summe 6+12=18_0 für AMP („“)=180E. In der Katalyse ist „AMP“ ein Endprodukt (Output), so dass eine umgewandelte Darstellung AMP (§§)=180E erfolgt, die am lesbaren Diphosphat liegt, das über die Diphosphorsäure (€€) = H4P2O7=4+30+42=76E (hier kein Ubiquitin=76AS) enthalten ist. „AMP“ (§§)=180E liegt in der Spalte als 510=QS=“6“_schleifenförmig um die Ziffer „2“ der Zeitbasis „24“, aufsteigend über Spalte 5/1=QS=“6“_38 (neben 76)=QS=11=QS=“2“_absteigend über Spalte „0/4“ als „4“_“0“ mit Summe 6+6+2+4=“18“_“0“ für „AMP“ (§§)=180E.
„LIG1“ {} =919AS beginnt am rechten Rand und zieht in die zwischen POLD2 und POLD1 eingeklemmte Ziffer „1“. Mit Mittelteil würde beim Weg über die Zahl „66“ die Doppel-Null nur hälftig wirksam, folglich führt der Weg über die Zeitbasis „24“. „LIG1“ {} =919AS liegt in der Spalte Z.38355#_[33]{1}[686]{6}{81}/#_[13613]{0}{510}{0}[28]/#_[92955]{24}[32] als QS8+1=“9“_aufsteigend Spalte 6/0=QS=“6“_Wende 24=QS=“6“_absteigend 510=QS=“6“_Spalte 1/0=QS=“1“ mit „9“_Summe 6+6+6+1=“19“ mit 9_19 für „LIG1“ {} =919AS [LIG1 - DNA ligase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die PIP-Box = “QRLML“ bezieht sich auf „5“ AS, die eine Ring-Null in der Spalte 6/“0“/4 umschließen. Funktionell wird mit der PIP-Elektronen-Summe {}=396E aus [Glutamin (Q)=]78+94+72+80+72[=Leucin (L)] =“396“E die Wendeschleife um die Zeitbasis „24“ ausgeführt, und zwar in der Spalte Z.38357#_{5}{24}{3}2/#_{1}{3}[876] als „3“_24=QS=“6“_“3“ mit „3“_Summe 6+3=“9“_Spalte 5/1=“6“ mit 3_9_6 für PIP-Summe=396E.
Das Protein (Mensch) „LIG3“=1009AS ist ein ähnliches Protein, das, gestützt auf ATP und den Cofaktor Mg=12E sowie einer Zink-Bindestelle, zur DNA-Reparatur dient [LIG3 - DNA ligase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. „LIG3“ bildet ein Heterodimer mit dem „DNA-Reparaturprotein „XRCC1“ =633AS [XRCC1 - DNA repair protein XRCC1 - Homo sapiens (Human) | UniProtKB | UniProt]. „LIG3“ {} =1009AS liegt in der Spalte Z.38355#_[316866]{8}(1)/#_{3051}{00}{2}(8)/#_/#_[2955](24)(32)/#_[2881](38)(76)/#_[2829434](1)/#_ [279938](12), und zwar aufsteigend über Spalte 8/2=QS=“10“_00=QS=“0“_3051=QS=“9“ mit 10_0_9 für „LIG3“=1009AS. Für Gerüstprotein „XRCC1“ () =633AS wird eine Bindung am Rand gewählt, und zwar als Spalte 1/8=QS=9_32=QS=5_24_38=QS=11_76=QS=13_1 mit Summe 9+5+24+11+13+1=“63“_12=QS=“3“ mit 63_3 für „XRCC1“ () =633AS. Die gewählte Randlage ist als Ladeplattform geeignet. „XRCC1“ ist leicht ablösbar, wobei „PCNA“ immer noch stabil mit DNA-Replikationsstellen assoziiert bleibt [XRCC1 und PCNA sind Ladeplattformen mit unterschiedlichen kinetischen Eigenschaften und unterschiedlichen Kapazitäten, um auf mehrere DNA-Läsionen zu reagieren | BMC Molekularbiologie | Volltext (biomedcentral.com); O. Mortusewicz; u.a., Sept 2007; https://doi.org/10.1186/1471-2199-8-81]. Ubiquitin=76AS ist lesbar mit enthalten. Die „CK2-Phosphorylierung“ stabilisiert „XRCC1“, indem die Ubiquitylierung und der proteasomale Abbau gestört wird [The structural basis of XRCC1-mediated DNA repair - PMC (nih.gov); R.London; Feb 2015; doi: 10.1016/j.dnarep.2015.02.005]. Der tetramere Komplex „Caseinkinase II/CK2“ wurde zuvor mit dem Protein „GEMININ (GMNN)“ bereits dargestellt. Für die Bindung an „XRCC1“ wird jedoch das folgende „Zink“ verwendet, so dass sich der „CK2-Komplex“ aufsteigend neu positioniert. Das Homodimer der Untereinheit „CK2-beta“ teilt sich die Ziffer „2“ aus der Zeitbasis „24“ mit „XRCC1“. Das Monomer ist als Spiegelung lesbar. Das Protein (Mensch) „CSNK2B“ (||) (Monomer) =215AS liegt in der Spalte Z.38354#_[445]“3“3“[082407]/#_[4]$0$3$“3“16“8“668“[1]/#_$3$6$1$§3§0|5|100|2|[8]/#_[319]§2§955!2!§[432] in Z.38356 als 002=QS=2_1_5 für CSNK2B“ (||) (Monomer) =215AS. Dopplung „CSNK2B“ (§§) (Homodimer) =215AS als 9552=QS=21_Spalte 3/2=QS=5 mit 21_5 für CSNK2B“ (§§) (Monomer) =215AS [CSNK2B - Casein kinase II subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CSNK2A1“ ($$)=391AS als „3“_Spalte 0/6=QS=“6“_“3“ mit „3“_Summe 6+3=“9“_“1“ mit 39_1 für „CSNK2A1“ ($$)=391AS [CSNK2A1 - Casein kinase II subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CSNK2A2“ („“)=350AS als „3“_Schleife auf und ab 33=QS=“6“_“16“_“8“ mit „3“_Summe 6+16+8=“30“_668=QS=“20“ mit „3“_Summe 30+20=“50“ mit 3_50 für „CSNK2A2“ („“)=350AS [CSNK2A2 - Casein kinase II subunit alpha' - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „LRIG2“=1065AS wird alternativ auch als „LIG2“ bezeichnet, funktionell besteht aber kein Zusammenhang zu „LIG1“ [LRIG2 - Leucine-rich repeats and immunoglobulin-like domains protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Nur die Mutationen sind von Interesse, weil die Funktion der Harnröhre „303“ gestört wird, und im Gesicht entgleitet ein Lächeln zur hässlichen Grimasse [Urofaziales Syndrom 2 (UFS2)]. Bei einem Lächeln schwiegt die Asymmetrie wieder über den Kreis=64 in die ausgewogene Schwerachse „84“ zurück, was bei einer Grimasse scheitert. Die sehr langsame Schwingung eines Lächelns, ist dem Merkmal der schnellen Schallwahrnehmung ähnlich. Überschläglich wird mit 333m/s Schallgeschwindigkeit gerechnet [bei 20°C mit 343,2m/s]. „Lig1“ enthält Leucin-reiche Wiederholungen, und zwar mit Leucin=C6H13NO2=36+13+7+16=72E. Die Regulation des
Thrombozyten-Wachstumsfaktor-Rezeptors (PDGF) ist ein weiteres Merkmal. Es handelt sich um eine Gruppe von 4 Proteinen (PDGF-A, B, C, D =“platelet-derived growth factor“), die aufgrund ihrer Dimer-Bildung mittels Disulfid-Bindung erkennbar ist. Bei einer Verletzung wird die Mitose zwecks Wundheilung stimuliert [PDGF - DocCheck Flexikon].
Beim PDGF-Komplex ist die Disulfid-Brücken-Bindung (§§) „16“_8/8=QS=“16“=Schwefel“ vorgelagert. Weil die Proteine einen weiten Bereich ausfüllen, ist über nur über Brückenbindung eine Regulation zu erwarten. Das Dimer aus „PDGFA/PDGFB“ legt sich passend an, und zwar in der Spalte Z.38353#_[7]$34$[697224]/#_$533$§0§8§€24€0€[7]/#_$3$3§16§8§66€8€[1]/#_13051002€8€/#_929552(4)€3€2€/#_[72881](38)[76]. Das Protein (Mensch) „PDGFA“ {}=211AS startet in der Ziffer „2“ der Zeitbasis „24“ in Z.38357 als „2“_Kunstgriff 55=QS=10 für „0“_absteigend 05=QS=“5“_Membranspalte 3/3=QS=“6“ mit „2“_Summe 0+6+5=“11“_mit 2_11 für PDGFA“ {}=211AS [PDGFA - Platelet-derived growth factor subunit A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PDGFB“ ()=241AS nimmt die Ziffer „4“ der Zeitbasis „24“ (in Z.38357) auf, und zwar absteigend von Z.38358 als 38=QS=11=QS=2_4_100=QS=1 mit 2_4_1 für „PDGFB“ ()=241AS [PDGFB - Platelet-derived growth factor subunit B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Dimer „PDGFC/PDGFD“ nutzt die Disulfid-Brücke 16_16 unverändert mit einem anderen Brücken-Anschluss. Das Protein (Mensch) „PDGFC“ ($$)=345AS beginnt vorgelagert in Z.38353 als „34“_533=QS=11=QS=“2“_“3“ mit „34“_Summe 2+3=“5“ mit 34_5 für [PDGFC - Platelet-derived growth factor C - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PDGFC“ (€€)=370AS nimmt die mit der Blutspalte 2/6 gekoppelte Zeitbasis „24“ in Z.38354 auf, und zwar als „24“_Spalte 0/8/2/3=QS=“13“ mit Summe 24+13=“37“_Randspalte 8/2=QS=10 für „0“_ mit 37_0 für PDGFD=370AS. Beim Prozess der Phosphorylierung von Peptidyl-Tyrosin setzt sich Phosphotyrosin= C9H12NO6P=54+12++7+48+15=136AS über die Randspalte (100)28/2/(6) aus der enthaltenen Summe 28+2=“30“, der seitlichen „100“ und der folgenden Zahl „6“ zu 100+28+2+6 =136E zusammen [PDGFD - Platelet-derived growth factor D - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „LRIG2“ {}=1065AS enthält Wiederholungen von Leucin=72E, die eine Kette über verschiedene Pfade legen können. Das Protein (Mensch) „LRIG2“=1065AS beginnt am lesbaren „Leucin“ in der Spalte Z.38353#_[3469]{72}{24}/#_[33082]{407}/#_[31686]{6}{8}[1]/#_[305]{10}{0}{2}[8]/#_295{5}[2432], und zwar mit „72“_24=QS=“6“_407=QS=11=QS=“2“_“6“ mit Summe 72+6+2+6=“86“_Spalte 8/2=QS=“10“_100 zerlegt als “0“_“10“ mit Summe 86+10+0+10=“106“_“5“ für „LRIG2“ {}=1065AS, wobei die Zahl „10“ (aus der Spalte 8/2) optional auch erweitert den Zeilenrand mit besetzen, um die Bindung eines Signal-Rezeptors zu verhindern. Die Randspalte „81/28“ ergibt mit „8“_Spalte 1/8=“9“_“2“ mit „8“_Summe 9+2=“11“=QS=“2“ mit 8+2=“10“. „LRIG2“ enthält in der Spalte 407/68[1] den Nerv=7, den Kreis=64 absteigend über die Spalte 4/6 und die Schwerachse 84 im Wechsel absteigend über Spalte 0/8=QS=8_4 für 84 mit der gemeinsamen Ziffer „4“=räumlich. Die Schwingungsspalte 3/3/3 für die Schallgeschwindigkeit rd. 333 m/s liegt auf der linken Seite weit entfernt ab Z.38353# „3“469“72“24, kann aber den Kontakt zum Leucin=72E herstellen, weil die Verbindungszahl „469“ mit 46=QS=10_9 den notwendigen Umrechnungsfaktor 10^9 von Meter auf Nanometer enthält. Die genaue Schallgeschwindigkeit 343m/s liegt über die Spalte „34“6972/3“3“0824 mit 34_3 für 343_082=QS=10_72=QS=9 für 343*10^9 nm/s ebenfalls vor. Die „einsame“ LRIG2-Endziffer „5“ kann mit Signalmolekülen über das Protein (Mensch) „DBH_ Dopamine beta-hydroxylase“=617AS eingebunden werden, das sich weit links vom Cofaktor „Kupfer“=29E bis in die rechte Randspalte zieht, und zwar als „5“_1.Kunstgriff mit Umleitung nach links neben Kupfer über Spalte 5/5=QS=10 für „0“_ „1“ mit Summe 5+0+1=“6“_2.Kunstgriff 0028(Dopamin=82E)=QS=10 für „0“_absteigend Randspalte 7/1 für „17“ mit 6_17 für „DBH“=617AS. Die Umwandlung von Dopamin=82E in Noradrenalin=C8H11NO3=48+11+7+24=90E ist in der Randspalte 81/28 mit QS8+1=9_QS2+8=10 für „0“ als Noradrenalin=90E enthalten [DBH - Dopamine beta-hydroxylase - Homo sapiens (Human) | UniProtKB | UniProt]. Urofaziale Syndrom (UFS / Ochoa-Syndrom) [LRIG2-Mutationen verursachen urofaziales Syndrom: The American Journal of Human Genetics (cell.com); H. Stuart; Jan 2013; DOI: https://doi.org/10.1016/j.ajhg.2012.12.002]: „LRIG2“ kann eine Mutation zur scheinbaren Verbesserung einleiten, indem der 1.DBH-Kunstgriff mit der Spalte 5/5 am Kupfer=29E bereits in „LIG2“ zwischen 106_{5/5 für „0“(Null)}_5 als Mutante eingeschoben wird. Weil über die Spalte „3/1/0/29“ absteigend mit QS 29+0+1=30_3 üblich die Harnröhre „303“ adressiert wird, gibt es ein Problem, weil die „LIG2“-Mutante die Harnröhren-Adresse zu Leucin=72E verarbeitet, und zwar absteigend 29_0_1 mit Summe 29+0+1=“30“_über „3082407“ mit „30“_82=QS=“10“ mit Summe 30+30+10=“70“_407=QS=11=QS=“2“ mit 7_2 für Leucin=72E. Damit wird am Zeilenrand das Lächeln als Schwingung zurück in Schwerachse „84“ verhindert. Statt Lächeln gelingt nur eine Grimasse. Die Mutation wurde in mit Bindegewebe umfüllten Nervenfasern (Nervenfaszikel) zwischen den Muskelbündeln der fetalen Blase nachgewiesen. Die Mutation ist auch beim Protein „Heparanase-2 (HPSE2) festzustellen. „LRIG2“ und „HPSE2“ sind an der neuronalen Entwicklung der unteren Harnwege beteiligt. Der Muskel „55“ wird über den 1.Kunstgriff in der Spalte 5/5 adressiert, an der vorgelagert 16=QS=7 und nachgelagert seitlich 52=QS=7 der Nerv=7 anliegt. Zur Funktion des Enzyms „Heparanase-2“ gehört im Zuge der Immunreaktion die Überwindung der Basallamina „333“, so dass hier eine kuriose Analogie zur Schallwahrnehmung 333 m/s vorliegt [LRIG2 - Leucine-rich repeats and immunoglobulin-like domains protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]._dat08.02.2024
Lamin-Filamente als Gerüst (Kernlamina) für die Doppelmembran des Zellkerns (Kernhülle): Der präzise Abbau der „Zellkernhülle [nuclear envelope (NE)]“ bei der Zellteilung zu Beginn der Mitose und spätere erneute Aufbau in Tochterzellen erfordert eine mathematische Besonderheit, die als Serien-Grenze #1611/#1610 wirksam werden könnte. „Lamine“ liegen an dieser Grenze. Lamin-Monomere bilden Heterodimere, mehrere Tetramere bilden dann ein Protofilament. Beim Abbau wird die „Kernhülle (NE)“ zu „Membranvesikeln“ zerlegt. Die „Kernporenkomplexe [nuclear pore complex (NPC)]“ zerlegen sich in die Proteinbausteine „Nukleoporine“. Über die mitotischen Spindel (Mikrotubuli) werden anschließend die Chromosomen auf die Tochterzellen verteilt. Die Kernmembran besteht aus einer äußeren (outer) Elementarmembran (ONM) [Dicke ca. 7 nm; Phospholipiddoppelschicht], gefolgt vom perinucleären Raum / perinuclear space (PNS) mit einer Weite von 20 bis 100 nm und der inneren (inner) Elementarmembran [INM]. Von innen sind an die innere Kernmembran Lamin-Filamente als Kerngerüst angelagert. Diese besteht aus den Intermediärfilamenten Lamin A und C, die an den „Lamin-B Rezeptor (LBR)“, ein Protein der inneren Kernmembran gebunden und untereinander vernetzt sind. Der Rezeptor „LBR“ bindet „Lamin-B1/-B2“. „Lamin-Filamente“ besitzen ein Durchmesser von 8-11 nm [Kernmembran Dr.Jastrows EM-Atlas (drjastrow.de)]. Die Dicke der Schicht aus intermediären Lamin-Filamenten (nuclear lamina) beträgt 30–100 nm (i.M. 65 nm). [Lamina (Zellkern) – Wikipedia]. Der „Lamin-B Rezeptor“ vermittelt die Wechselwirkung von Chromatin und Lamin B (B1/B2). Außerdem wird „LBR“ zur Biosynthese „Cholesterin“ benötigt. Das Protein (Mensch) „LBR_Lamin-B-Rezeptor“ {}=615AS zieht spaltenförmig lesbar als „6/1/5“ über die Serien-Grenze, und zwar in der Spalte Z.38362#_[80]|49|7|[0];1;/#_[8]|40|{6}|0|;8;5;/#_[8]!98!{1}|405|/Grenze/#_[9]!77!{5}|645|/#_[07]!8!8![788] für „LBR“ {}=615AS. „LBR“ wird bei der Interaktion von „CBX3“ und „CBX5“ umhüllt [LBR - Delta(14)-sterol reductase LBR - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein Mensch) „CBX5“ (!!)=191AS bindet links von „LBR“ die Ziffer „8“ der Lysin-Spalte „0/8“ für Lysin=80E, und zwar als „98“_aufsteigend „77“_aufsteigend „88“=QS=“16“ mit Summe 98+77+16=“191“ für„CBX5“ (!!) =191AS [CBX5 - Chromobox protein homolog 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein Mensch) „CBX3“ (||) =183 AS interagiert mit „CBX1“, so dass der rechte obere Rand bereits besetzt ist. „CBX3“ liegt in Z.38363 vor „CBX5“ und legt sich um „LBR“, und zwar absteigend als „40“_“49“_aufsteigend Spalte 7/0 für „70“ mit Summe 40+49+70=“159“_aufsteigend am Zeilenrand 405=QS=“9“_645=QS=“15“ mit Summe 159+9+15=“183“ für „CBX3“ (||) =183AS [CBX3 - Chromobox protein homolog 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CBX1“ (;;)=185AS liegt in der Randspalte Z.38362#_[0]“1“/“8“5“ aufsteigend mit 1_5_8 für „CBX1“=185AS [CBX1 - Chromobox protein homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Lamin-B-Rezeptor {}=615AS wird in der Innenmembran (INM) exprimiert und ragt als Rezeptor in die aufliegende Lamin-Filament-Schicht. Die „B-Lamine“ liegen zur Einbindung auf dem „B-Rezeptor (LBR)“=615AS, wobei „Lamin-B1“ vor der Serien-Grenze in die Ziffern „6“ und „1“ einbindet. „Lamin-B2“ bindet nach der Grenze in die Ziffer „5“ ein. Das Protein (Mensch) „LMNB1_Lamin-B1“ (**)=586AS liegt in der Spalte Z.38363#_[840]{*6}*0*8*[5]/#_[898]{*1*}4*0*[5]/Grenze/#_[97]{°5°}°6°[45]/#_[078]°87°[88], und zwar über Spalte „608/140“ als QS1+4=“5“_absteigend Spalte 8/0=QS=“8“_60=QS=“6“ mit 5_8_6 für „LMNB1“ (**) =586AS [LMNB1 - Lamin-B1 - Homo sapiens (Human) | UniProtKB | UniProt]. „LMNB2_Lamin-B2“ (°°) =620AS über die Spalte „56/87“ mit „6“_aufsteigend 87=QS=“15“_absteigend „5“ mit „6“_Summe 15+5=“20“ mit 6_20 für „LMNB2“ (°°) =620AS [LMNB2 - Lamin-B2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die „Katalyse“ erfasst einen weiten Bereich, der den rechten Rand mit den enthaltenen Maßen und der Randspalte 1/1 für faserartige Filamente=„11“ lediglich umgrenzt, und zwar in der Spalte Z.38360#_[2799]!|38|1![2]/#_[279]|1|22|[71]/#_[280]|4|[9701]/#_[2]|84|0|{6}[085]/#_[2]|89[8]{1}[405]/Grenze/#_[29]*77*°{5}6°*[45]/#_[307]°88°[788]. „Lamin-B Rezeptor“ (LBR) besitzt den Cofaktor „NADP“ (!!)=NADP(3-) (CHEBI:58349)= C21H26N7O17P3=126+25+49+136+45=381E, der weit vorgelagert in Z.38360#_“381“[2] lesbar ist. In der Katalyse kann „NADPH“ (||)=NADPH(4-) (CHEBI:57783)= C21H26N7O17P3=126+26+49+136+45=382E als 38_2 zerlegt werden, wobei die Endzahl „2“ als 38 (für NADP=381E)=QS=11=QS=“2“ zur Verwendung für „NADP“ nutzbar ist. „NADPH“ (||)=382E in Z. 38364 absteigend 89=QS=“17“_absteigend 840=QS=“12“_Spalte 1/4=QS=“5“_22=QS=“4“ mit Summe 17+12+5+4=“38“_aufsteigend 38=QS=11=QS=“2“ mit 38_2 für „NADPH“ (||)=382E. „5alpha-cholesta-8,14-dien-3beta-ol (CHEBI:86131)“=C27H44O =162+44+8=214E wechselt zu „5alpha-cholest-8-en-3beta-ol (CHEBI:16608)“= C27H46O=162+46+8=216E. In der gemeinsamen Basiszahl „2“ aus „56“ gehört die Ziffer „5“ zum spaltenförmigen Lamin-B Rezeptor“ (LBR) {}=615AS. „5alpha-cholesta-8,14-dien-3beta-ol“ (**)=214E als 56=QS=11=QS=“2“_77=QS=“14“ mit 2_14 für (**)=214E. „5alpha-cholest-8-en-3beta-ol“ (°°)=216E als 56=QS=11=QS=“2“_aufsteigend 88=QS=“16“ mit 2_16 für (°°)=216Der „Wasserstoff“=1E ist in „LBR“ {}=6“1“5AS enthalten. „Lamine“ sind „hydrophob“. Hierfür wird das Wasser 28(Symbol) nicht abweisend rechts herausgeschoben, sondern es wird die Spiegelung „82“ verwendet. z.B. in der Randspalte Z.38360#_[3]“8“[1](2)/#_2“2“(71) als Spalte „8/2“ für „82“ und 71=QS=8_2 für „ 82“.
„Lamin B ist besonders eng mit der Kernhülle assoziiert. Dieser Kontakt wird durch eine Reihe von Lamin-assoziierten Proteinen (LAPs) hergestellt. Lamin B bleibt während der Mitose an die Fragmente der Kernmembran gebunden und trägt möglicherweise zu deren Wiederaufbau bei“ [Lamine - Lexikon der Biologie (spektrum.de)]. Das Protein (Mensch) „LAP2alpha“=694AS startet zur Bindung im „LBR“{} und bindet in Lamin-B1/-B2 ein. In der Zerlegung „6_64_15_15“ ist der Kreis=64 als Funktion enthalten. Die lesbare Zahl „64“ für den Kreislauf „Auf- und Abbau der Kernmembran“ wird nicht genutzt, weil 2 Varianten über die Spalte 4/6(4) absteigend für „64“ und aufsteigend 60/4 für Summe „64“ möglich sind. „LAP2alpha“ ist somit unempfindlich gegenüber Veränderungen. „LAP2alpha“ (§§)=694AS (rechtdrehend) in der Spalte Z.38363#_§0§{6}0§[85]/#_§8§{§1§}§4§[05]/#_§7§{§5§}§64§[5]/#_[88]§78§[8], und zwar aufsteigend über die LBR-Spalte 1/5=QS=“6“_links absteigend Spalte 0/8/7=QS=“15“_“60“_aufsteigend „4“_Kunstgriff 64=QS=10 für „0“_aufsteigend 78=QS=“15“ mit „6“_Summe 15+60+4+0+15=“94“ für 6_94 für „LAP2alpha“ (§§)=694AS (rechtdrehend). Alternativ „LAP2alpha“ ($$)=694AS (linksdrehend) als Spalte 1/5=QS=6_links aufsteigend Spalte 7/8=QS=“15“_ 87=QS=“15“_rechts absteigend Spalte 4/6 für „64“ mit „6“_Summe 15+15+64=“94“ mit 6_94 „LAP2alpha“ ($$)=694AS (linksdrehend) [TMPO - Lamina-associated polypeptide 2, isoform alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „LAP2alpha“ ist eine von sechs Splicevarianten des Gens LAP2. Das Protein (Mensch) „LAP2beta“ („“)=454AS ist wechselseitig zählbar und besetzt den rechten Rand, und zwar in der Spalte Z.38360#_“38“[12]/#_“227“1“/#_[97]“0“1“/#_{6}[0]“8“5“/#_{1}[40]“5“/Grenze#_{5}6“45“ in Z.38365 absteigend als „45“_1.Kunstgriff Randspalte 5/5=QS=10 für „0“_2.Kunstgriff Spalte 0/8=QS=“8“_Spalte 1/1=QS=“2“ mit „45“_Summe 0+8+2=10 für „0“ _227=QS=11=QS=“2“_absteigend 38=QS=11=QS=“2“ mit „45“_Summe 0+2+2=“4“ mit 45_4 für „LAP2beta“ („“)=454AS [TMPO - Lamina-associated polypeptide 2, isoforms beta/gamma - Homo sapiens (Human) | UniProtKB | UniProt]. Interaktion mit „NAKAP95“ (€€)=646AS seitlich in der Spalte Z.38364#_€1€4€[0]“5“/€5€6€“45“ absteigend als 1/5=QS=“6“_aufsteigend 4/6 für 46 mit 6_46 für AKAP8L=646AS [AKAP8L - A-kinase anchor protein 8-like - Homo sapiens (Human) | UniProtKB | UniProt].
„Lamine“ interagieren weiterhin mit dem Protein (Mensch) „RB_Retinoblastoma-associated protein“ {}= 928AS, das den Zellzyklus reguliert. Die Genmutation führt zum Krebs am Auge, was einen Bezug zur Hyaluronsäute (!!) =200E erfordert, und zwar in der Randspalte Z.38360#_[99](38)(1)[2]_[91](22){(7)1}/#_[04970]{1}/#_[!40!6]{0}!!{8}!{5}/#_[981]{4}{!0!}{!5!}/#_[77]{5}{!64!}!5!. Die Hyaluronsäure (!!) =200E ist unlesbar und wird summiert aus 40608/0=QS=180_Randspalte 5/5=QS=10_64=10 mit Summe 180+10+10=“200E“, wobei sich in der Restgröße „20“ ebenfalls 2_0_0 für „200“ bilden. Eine Mutation wird folglich verhindert, wenn die Spalte „8/0“ nicht in der Leserichtung „80“ durchlaufen wird. RB {}=928AS aufsteigend am Rand in Z.38361 als „71“_Spalte 1/5/5=“11“ mit Summe 71+11=“82“_aufsteigend Kunstgriff Spalte 0/4=QS=4_6 mit Summe 4+6=10 für „0“_absteigend Spalte 1/5=QS=“6“_absteigend Spalte 0/4=QS=“4“ mit Summe 82+0+6+4=“92“_“8“ für RB {}=928AS [RB1 - Retinoblastoma-associated protein - Homo sapiens (Human) | UniProtKB | UniProt]. Für die Phosphorylierung von „RB“ ist der Phosphor =15E bereits in der Randspalte 1/5 für 15E enthalten. Seitlich bildet sich eine Kerbe 70“1/5“, in die „E2F1“ ()=437AS mit seiner Endziffer „7“ endet. Dabei wird die Interaktion mit „RB“ durch die Ziffer „0“ noch verhindert. Zum passenden Zeitpunkt bindet „E2F1“ dann alternativ direkt in die Startziffer „7“ von „RB“{} ein [Cdk Phosphorylation Triggers Sequential Intramolecular Interactions that Progressively Block Rb Functions as Cells Move through G1 - ScienceDirect; D. Dean; Sept.1999; https://doi.org/10.1016/S0092-8674(00)81519-6]. Zum passenden Zeitpunkt bindet „E2F1“ () dann alternativ direkt in die Startziffer „7“ von „RB“ {} ein. „E2F1“ () in Z.38360 über 381[2] als 1_38_aufsteigend 22=QS=“4“ mit Summe 1+38+4=“43“_“7“ für „E2F1“ ()=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt]. „E2F Transcription Factor 1“ gehört zur Familie „E2F“ [E2F – Wikipedia].
Das „LAP2beta“ der inneren Kernmembran bindet an „Lamin B“ und das chromosomale Protein (Mensch) „BAF_Barrier-to-autointegration factor“ (!!)/(||)=89AS als Dimer. Die „LEM-Proteine“ [„L“AP2, „E“merin und „M“AN1] binden mit einem Strukturmotiv an „BAF“. LEM-Proteine orientieren sich am 45°-Winkel, der neben BAF am Rand lesbar ist: „The two helices, which are connected by a long loop (11 residues for LAP2-N and 12 for LAP2-C) are oriented at an angle of ∼45°.“ [Solution structure of the constant region of nuclear envelope protein LAP2 reveals two LEM-domain structures: one binds BAF and the other binds DNA - PMC (nih.gov); M.Cai u.a. Aug 2001; doi: 10.1093/emboj/20.16.4399]. „LAP2beta“ („“) hat den rechten Rand bereits besetzt, so das „BAF“ als Dimer an dessen Startziffer „45“ in Z.38365 der Serie #1611 liegen muss, und zwar in der Randspalte Z.38365#_!56!“45“/#_!87!|8|[8]/#_[0]|8|1|[6] als 56=QS=11=QS=“2“_aufsteigend „87“ mit Summe 2+87=“89“ für „BAF“ (!!)=89AS(Monomer). „BAF“ (||) als „8“ aufsteigend 81=QS=“9“ mit 8_9 für „BAF“ (||)=89AS(Dimer) [BANF1 - Barrier-to-autointegration factor - Homo sapiens (Human) | UniProtKB | UniProt]. Die „Breitseite“ von „BAF“ ist zur Interaktion begrenzt, so dass sich das Protein (Mensch) „PARP1“ (**)=1014AS von der Zink-Bindung absteigend vor die BAF-Zahl !56! legt. Die dort vorhandene Zahl „14“ dient nur zur Motivation, weil „PARP1“ als „101_4“ zerlegt wird. Neben Zink=30E liegt eine Lücken-Zahl „78“, die zur Bindung von „NAD+“ (°°)=C21H28N7O14P2=126+28+49+112+30=345E aufgenommen wird. „PARP1“ (**) liegt in der Spalte Z.38363#_[2840]°60°[85]/#_*28°9°*81°*4*0°“5“/Grenze/#_*29*°*77*°*!56!“45“/#_ *30*°78°!87!|8|[8], und zwar im Zink=30E absteigend als „30“_“29“=Summe 30+29=“59“_Schleife 289=QS=“19“_77=QS=“14“_81=QS=“9“ mit „59“_Summe 19+14+9=“42“ mit Summe 59+42=“101“_“4“ für „PARP1“ (**)=1014AS [PARP1 - Poly [ADP-ribose] polymerase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „NAD+“ (°°)=345E mit Lückenzahl „78“_absteigend „77“_absteigend „9“_“81“ mit Summe 78+77+9+81=“245“_absteigend „60“¬_aufsteigend „40“ mit Summe 245+60+40=“345“ für „NAD+“ (°°)=345E [Nicotinamidadenindinukleotid – Wikipedia]. Das Protein (Mensch) „MAN1“ (§§)=911AS liegt für den Signalweg seitlich von „BAF (||) am rechten Rand in der Spalte Z.38366#_[3078]!87!|8|§8§_/#_[3]€20€20€|81|§6§/#_[33]€4€7€[1]§7§;§12§;/#_[35]€1€4€§1§4§[5];9;/#_[3703004];0; , und zwar aufsteigend über Randspalte 8/6 für „86“_12=QS=“3“ aufsteigend Spalte 7/4=QS=11=QS=“2“ mit Summe 86+3+2=“91“_“1“ für „MAN1“ (§§)=911AS [LEMD3 - Inner nuclear membrane protein Man1 - Homo sapiens (Human) | UniProtKB | UniProt]. „MAN1“ (§§) hemmt das Protein (Mensch) „TGF-beta“ (;;)= 390AS, weil dessen Startziffer „3“ über 12=QS=“3“_aufsteigend Randspalte 9/0 für „90“ mit 3_90 für „TGF-beta“ (;;)= 390AS verwendet wird [TGFB1 - Transforming growth factor beta-1 proprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Emerin“ (€€) =254AS bindet an BAF (!!)/(||) links neben „MAN1“, und zwar als Schleife über Z.38368 über „20“_aufsteigend Spalte 4/1=QS=“5“ mit Summe 20+5=“25“_absteigend Spalte 7/4=QS=11=QS=“2“_20=QS=“2“ mit „25“_Summe 2+2=“4“ mit 25_4 für „Emerin“ (€€) =254AS. „Emerin“ fördert ein Aktin-Netzwerk mit Aktin=374AS über die Spalte „020/47[1]“. Die Lücken-Ziffer [„1“] wird über Spalte 0/1=QS=“1“_“2“ mit Summe 1+2=“3“_aufsteigend „7“_“4“ für Aktin=374AS verarbeitet [EMD - Emerin - Homo sapiens (Human) | UniProtKB | UniProt]. „Emerin“ (€€) trägt zusammen mit dem Protein (Mensch) „NEMP1“ („“) =444AS zur Steifigkeit der Kernhülle bei. „NEMP1“ ist für die weibliche Fruchtbarkeit erforderlich, weil die Spalte 3/3/3/3 für weiblich=“66“ durchlaufen wird, und zwar in der Spalte Z.38366#_“4“1“3“[07]_/#_[99]“3“€20€_/#_[57]“3“3“€4€_/#_[15]“3“5“€1€_/#_[7]“33“[70]_/ als „33“_absteigend „3“_Spalte 3/5=QS=8 mit Summe 33+3+8=“44“_Kunstgriff absteigend Spalte 3/3/3=QS=9_1 mit „44“_Summe 9+1=10 für „0“_“4“ mit 44_Summe 0+4=“4“ mit 44_4 für „NEMP1“ („“) =444AS [NEMP1 - Nuclear envelope integral membrane protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Zusätzlich zur Wirkung auf die Chromatinstruktur durch „BAF“ interagieren Lamine mit Regulator „INhibitor of Growth (ING)“, der an Kernhistone, Deacetylasen und Histonacetyltransferasen bindet [Vielfalt der nuklearen Lamin-A/C-Wirkung als Schlüssel zur gewebespezifischen Regulierung der zellulären Identität in Gesundheit und Krankheit – PMC (www-ncbi-nlm-nih-gov.translate.goog); K. Perepilina u.a., Okt. 2021;doi: 10.3389/fcell.2021.761469]. „ING1“ und „ING2“ sind mit der „Histone Deacetylase (HDAC)“ verbunden. Aufgrund der Zink-Bindung sind ING1/ING2 links von „BAF“ angeordnet. Das Protein (Mensch) „ING2“ {}=280AS liegt neben „BAF“ (!!)/(||) in der Spalte Z.38366#_(1){307}{8}!87!|8|[8]/#_(9)(32)(0){2}[0]|81|[6]/#_[73](47)[1712], und zwar absteigend über Spalte 8/2 für „28“_30(Zink)7=QS=10 für „0“ mit 28_0 für „ING2“ {}=280AS mit H3K4me3-Bindung. Lysin=80E hängt als Spalte 8/0 an BAF (!!), aber „ING2“ kann über 78/2 mit 78+2=80 ebenfalls Lysin adressieren. Das „Lysin“ stammt aus der Methylierung des Histons H3 (H3K4me3). „Histon H3“=136AS als „13“_0/2=QS=“2“_02=QS=“2“_47=QS=11=QS=“2“ mit „13“ Summe 2+2+2=“6“ für „H3“=136AS [ING2 - Inhibitor of growth protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „ING1“ ()=422AS neben Zink=30E aufsteigend über Spalte 1/9=QS=10_32 mit Summe 10+32=“42“_“0“_absteigend 47=QS=11=QS=“2“ mit 42_Summe 0+2=2 mit 42_2 für ING1“ ()=422AS. Das „Zink“ liegt nur seitlich an der Startziffer und wird nochmals zur Einbindung aus der Zahl „20“ und 307 (aus ING2)=QS=“10“ zu 30E summiert [ING1 - Inhibitor of growth protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die Kernlamine „Lamin-A/C“ werden aus dem Protein (Mensch) „Prelamin A/C“=664AS gebildet, wobei „C“ eine Isoform von „A“ ist. „Lamin C“ fehlt die „CaaX-Box“, daher wird das Lamin-C-Protein nicht farnesyliert [Lamin C - DocCheck Flexikon]. Das Cystein=64E an dem Modifikationen erfolgen, ist bereits in den 6“64“AS adressiert. Soweit bekannt, entsteht „Lamin-A/C“ zeitlich nach dem „Lamin-B“, so dass dieselbe Position in Betracht kommt. Das ist zweckmäßig, weil die Lamine einen einheitlichen Filament-Querschnitt definieren müssen.
Prelamin-A/C (§§)=664AS liegt in der Spalte Z.38363#_{0}{6}[085]/#_{8}*1*[°40°]{°5°}/Grenze/#_{7}*5°6*4°{°5°}/#_{8}{8*7*8}{8}/#_[20]*8*1*[6], und zwar in Z.38363 aufsteigend „6“_Spalte 0/8/7/8=“23“_878=“23“ mit „6“_Summe 23+23=“46“ _absteigend Randspalte 5/5/8=QS=“18“ mit „6“_Summe 46+18=“64“ mit 6_64 für Prelamin-A/C (§§)=664AS [LMNA - Prelamin-A/C - Homo sapiens (Human) | UniProtKB | UniProt]. Im 1. Prozessierungsschritt für reifes Lamin A/C erfolgt eine Farnesylierung am C-Terminus durch Farnesyltransferase, wobei eine Farnesylgruppe mit Farnesylpyrophosphat [FPP/(2E,6E)-Farnesyldiphosphat]=C15H28O7P2=90+28+56+30=204E am lesbaren Cystein=64E gebunden wird. Das Protein (Mensch) „FNTA_Farnesyltransferase“ (**) =379AS benötigt den Cofaktor „Magnesium“=12E, um in der Spalte 1/56 für Mg=12E eine unlesbare Ziffer „2“ aus 56=QS=11=QS=“2“ zu erzeugen. Die Ziffer „6“ bindet dabei in „Cystein“=64E. „FNTA“ (**) =379AS als „1“_56=QS=11=QS=“2“ mit Summe 1+2=“3“_Spalte 7/81 für „7“_QS8+1=“9“ mit 3_7_9 für „FNTA“ (**)=379AS [FNTA - Protein farnesyltransferase/geranylgeranyltransferase type-1 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „FPP“ (°°) =204E als 64(Cystein)=QS=“10“_absteigend Randspalte 5/5=QS=“10“ mit Summe 10+10=“20“_04=QS=“4“ mit 20_4 für „FPP“ (°°) =204E. Im letzten Prozessierungsschritt zu Lamin-A/C werden 18 Aminosäuren durch das Protein (Mensch) „ZMPSTE24_Zink-Metalloproteinase STE24“ (||) =475AS abgespalten [Lamin A - DocCheck Flexikon]. „ZMPSTE24“ kann sich zwar links neben „Prelamin-A/C“ legen, um das lesbare Zink=30E aufzunehmen, wäre dort aber wirkungslos. „Zink“ liegt rechts nochmals aus [Zink=30]7887=QS=30 für Zink=30E vor, wobei die linke Ziffer „7“ in eine Spalte 7/8 „hochgeklappt“ wird, damit „Zink“ in „Prelamin-A/C“ zählbar wird. Wunschgemäß soll das reife „Lamin A/C“ am Zeilenrand absteigen, um Definition der Lamin-Maße zu erreichen. Zu diesem Zweck wird Prelamin-A/C als 6_23_23_18 für 664AS durch „ZMPSTE24“ zwecks Kürzung teilweise besetzt, und zwar in der Spalte Z.38364#_|81|[405]/#_|7||5|[645]/#_|8|87|8|[8] als „8¬“_87=QS=“15“_absteigend Spalte 7/8=QS=“15“ mit „8“_Summe 15+15=Zink=“30“_81=QS=“9“ mit Summe 8+30+9=“47“_aufsteigend „5“ mit 47_5 für „ZMPSTE24“ (||) =475AS [ZMPSTE24 - CAAX prenyl protease 1 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Lamin-A/C“ ($$)=729AS (Monomer) liegt als reifes Lamin in der Spalte Z.38361#_€2€$71$/#_€7€0€$1$ /#_[0]8€$5$/#_€4€0€$5$/Grenze/#_€ 6€$45$, und zwar vom Rand mit „71“_aufsteigend „1“ mit Summe 71+1=“72“_Kunstgriff Randspalte 5/5=10 für „0“_45=QS=“9“ mit „72“_Summe 0+9=“9“ mit 72_9 für „Lamin-A/C“ ($$)=729AS (Monomer). Das Homodimer ergibt einen Ring, und zwar mit „Lamin-A/C“()=729AS absteigend über Spalte 4/6 für „64“_absteigend Spalte 0/8/0=QS=“8“ mit Summe 64+8=“72“_Spalte 2/7=QS=“9“ mit 72_9 für „Lamin-A/C“ (€€)=729AS (Homodimer) [LMNA - Lamin A/C - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifikation, das Protein (Mensch) „Lamin-A/C“ {}=529AS (Monomer) ist verkürzt und endet vor der Grenze, und zwar in der Spalte Z.38361#_[2](2){71}/#_[9](7){0}{1}/#_[6](0)[8]{5}/#_(1)(4)[05] vom Rand mit „5“_absteigend 01=QS=“1“_“71“ mit „5“_Summe 1+71=“72“ mit 5_72 für „Lamin-A/C“ {}=529AS (Monomer). „Lamin-A/C“ ()=529AS (Homodimer) in Z. 38364 absteigend als „1“_Spalte 0/4=QS=“4“ mit Summe 1+4=“5“_Spalte 2/7 für 72 mit 5_72 für „Lamin-A/C“ ()=529AS (Homodimer) [LMNA - Lamin A/C - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Lamin-Maße“ werden vor der Grenze über die Randspalte Z.3836#_*12*27*“1“/#_°4°[97]“0“1“/#_°0°60°“8“[55] definiert. Der Durchmesser der fadenförmigen Lamin-Filamente beträgt D=8-11nm. Die Ziffer 11 ergibt sich aus der Randspalte 1/1 für „11“ nm und zugleich das Fasersymbol „11“. Seitlich liegt die Spalte 0/8 für „8“ nm kombiniert mit der Ziffer „0“=Durchmesser. Die Ziffer „Form=7“ ist enthalten. Die Durchmesser-Spanne 8 bis 11 nm wird mit der Schichtdicke kombiniert, die [9]70/60[8] von 60-70 die mittlere Schichtdicke von 65 nm ergibt. Die reale Dicke der Schicht aus intermediären Lamin-Filamenten (nuclear lamina) beträgt 30–100 nm [Lamina (Zellkern) – Wikipedia]. Neben der Randspalte 1/1 sind mit „1227“ für QS1+2=“3“_“27“ für 3+27=30 nm vorhanden. Die Ecke Spalte 4/0 für „40“_ „60“ ergibt die Summe 40+60=100 für 100 nm, wobei die erzeugte Ziffer „3“ mit „97“ ebenfalls 100 nm ergibt.
Ein Teil der Lamine ist im Kern löslich, mobil und nicht polymerisiert. Die Phosphorylierung kernperipherer Lamine bildet die mechanistische Grundlage für den Abbau der Kernlamina während der Mitosephase des Zellzyklus. Cyclin-abhängige Kinase 1 (CDK1) und Proteinkinase C (PKC) phosphorylieren Kernlamine zu Beginn der Mitose. „ERK1“ und „ERK2“ phosphorylieren „Lamin A/C“ [Kernlaminphosphorylierung: eine neue Rolle bei der Genregulation und Pathogenese von Laminopathien – PMC (www-ncbi-nlm-nih-gov.translate.goog); K. Ikegami u.a.; Okt. 2020; doi: 10.1080/19491034.2020.1832734].
„ERK1“ / „ERK2“ (extracellular signal-regulated kinase) müssen „Lamin A/C“ in der Randspalte erreichen, die zugleich Phosphor=15E als Spalte „1/5“ enthält. Das für die „Serin/Threonin-Kinase“ erforderliche Serin/Threonin (56E/64E) liegt lesbar nur weit entfernt an der Serien-Grenze, so dass die Randspalte selbst zu betrachtet ist, die beides enthält, und zwar über Spalte 1/5/5 mit „5“_QS5+1=“62 mit 5_6 für Serin=56E und Spalte 12/1/1/5 mit Spalte 1/5=QS=“6“_Spalte 2/1=QS=“3“_“1“ mit „6“_Summe 3+1=“4“ mit 6_4 für Threonin=64E. Mit der Eckzahl =“12“ wird ein Cofaktor „Magnesium“=12E avisiert, der erst linksseitig !12! in der Folgezeile für die Ziffer „2“ in „ERK“ beteiligt ist. „ADP“ (**)=220E liegt in der Randspalte Z.38360#_[8]°1°*2*/#_°2°7°*1*/#_°7°*°0°*1* über Spalte 2/1/01 als Summe 21+1=“22_“0“ für „ADP“ (**)=220E, das in der Katalyse aus „ATP“ (°°) =260E seitlich aus Spalte 1/7 für „17“_aufsteigend Spalte 2/7=QS=“9“ mit Summe 17+9=“26“_“0“(mit ADP geteilt) für „ATP“ (°°) =260E hervorgeht.
Das Protein (Mensch) „ERK1_MAPK3“ {}=379AS ist zu „ERK2“ gegenläufig, um die gleichen Randziffern zu nutzen. „ERK1“ liegt in der Spalte Z.38360#_[27“99“]{38}{12}/#_[27“9“]!1{2}!27{1}/#_[„28“0“4970]{1}/#_[„2840608“]{5}/#_[2898140]{5}, und zwar in Z.38364 absteigend über Spalte 5/5=QS=“10“_1/1 für „11“ mit Summe 10+11=“21“_absteigend 12=QS=“3“_38=QS=“11“_QS=“2“ mit „21“_Summe 3+11+2=“16“ mit Summe 21+16=“37“_27=QS=“9“ mit 37_9 für „ERK1“ {}=379AS [MAPK3 - Mitogen-activated protein kinase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. „ERK1“ reagiert auf Cadmium (Cd)=48E in der Spalte „38“1“[2]/[2]“2“7“[2] als 38_27=QS=9_1 mit Summe 38+9+1=Cadmium=48E. Die Reaktion auf mechanische Reize ist mit der Störung der Schwerachse „84“ als 8_22=QS=4 mit 8_4 für Schwerachse „84“ in der Spalte mit enthalten. Die Bindung von Phosphotyrosin=C9H12NO6P=54+12+7+48+15=136E ergibt, zerlegt 108+28=136E, seitlich doppelt einen Ring mit „ERK1“, und zwar 1.) aus der Zeile Z.38363 mit „28“40“60“8“ {5} mit Summe 28+40+60+8=“136“E und 2.) in Z.38360 spaltenförmig aus „99“ absteigend 9/0=QS=“9“_“28“ mit Summe 99+9+28=“136“E [O-Phospho-L-tyrosin – Wikipedia].
Die ERK1-Aktivität erfordert eine Phosphorylierung. Hierfür wird der Phosphor=15E in der Randspalte !1!/!5! von einem Protein tangiert. Das Protein (Mensch) „MAP2K1_MEK1“ (**)=393AS liegt in der Spalte Z.38360#_*3°8°*°1°*°2°*/#_°2°2°[7]*°1°*/#_°97°[0]!°1°!/#_°60°[8]!°5°!/#_°140°[5] und zwar als Summe 38+1=“39“_Randspalte 2/1 (vor Phosphor=15E)=QS=“3“ mit 39_3 für „MAP2K1“ (**)=393AS [MAP2K1 - Dual specificity mitogen-activated protein kinase kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAP2K2_MEK2“ (°°)=400AS katalysiert die gleichzeitige Phosphorylierung der Reste von Threonin=64E und Tyrosin=96E in einer Thr-Glu-Tyr-Sequenz, so dass die Spalte „97/60/14“ mit der Spalte 9/6 für Tyrosin=96E gekoppelt über Spalte 0/4 als 60+4=64 für Threonin=64E und Spalte 7/0 für 70+6=76 für Glutaminsäure (Glu)=C5H9NO4=30+9+7+32=76E durchlaufen wird. „MAP2K2“ (°°)=400AS nimmt den Phosphor mit auf, und zwar über Randspalte 1/5 für „15“ (Phosphor)_ absteigend über Spalte 2/1=QS=“3“_“1“ mit Summe 15+3+1=“19“_Spalte 8/2 für „82“_“2“_“97“ mit „19“_Summe 82+2+97=“181“_“60“_“140“ mit Summe 19+181+60+140=400 für „MAP2K2“ (°°)=400AS [MAP2K2 - Dual specificity mitogen-activated protein kinase kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„MEK1/MEK2“ werden durch das Arzneimittel „Binimetinib“=C17H15BrF2N4O3=102+15+35+18+28+24=222E gehemmt, und zwar in der Spalte Z.38360#_“38“:1:2:/#_“22“:7:1:/#_970:1: mit 38=QS=11=QS=“2“_“22“ für „Binimetinib“=222E. Der rechte Rand wird in Kombination von „Encorafenib“= C22H27Cl1F1N7O4S1=132+27+17+9+49+32+16=282E besetzt, und zwar als Spalte 1/1=QS=2_Spalte 1/7=QS=8_2 mit 2_8_2 für „Encorafenib“=282E.
Das Protein (Mensch) „ERK2_MAPK1“ ()=360AS liegt in der Spalte Z.38360#_(38)(1)(2)/#_(2)(27)(1)/#_[970](1)/#_[608](5)/#_[14](0)(5), und zwar über 38=QS=11=QS=“2“_aufsteigend „2“_Kunstgriff 27=QS=“9“_absteigend „1“ mit Summe 9+1=10 für „0“ mit Summe 2+2+0=“4“_Randspalte 2/1 für 21_Spalte 1/5/5=QS=11 mit Summe 4+21+11=36_0 für „ERK2_MAPK1“ ()=360AS. „MEK1/MEK2“ analog „ERK1“. „ERK2“ reagiert auf externe Stimuli wie Insulin (INS)=110AS über Randspalte „1/01“ oder NGF (Beta-nerve growth factor)=241AS über Spalte 381/22[7] mit 38=QS=11=QS=2_22 mit Summe 2+22=24_1 für NGF=241AS [MAPK1 - Mitogen-activated protein kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DUSP1“ (°°)=367AS dephosphoryliert und inaktiviert „ERK2“, indem der Phosphor in der Randspalte 1/5 im Gegenlauf abgebaut wird, und zwar in der Spalte Z.38360#_(°38°)(°1°)(°2°)/#_(°2°)(°2°7)(°1°)/#_[9]°7°[0](°1°)/#_[6]°0°[8](°5°)/#_°1°4°(°0°)(°5°) nadelförmig oder ringförmig mit der Startziffer „0“ in Z.38364 absteigend als „0“_Randspalte 1/5/5=QS=“11“_Spalte 2/1 für „12“ mit Summe 0+11+12=“33“_1_38=QS=11=QS=2 mit Summe 33+1+2=“36“_aufsteigend „2“_Spalte 2/7/0=QS=“9“ mit „36“_Summe 2+9=11=QS=“2“_14=QS=“5“ mit „36“_Summe 2+5=“7“ mit 36_7 für „DUSP1“ (°°)=367AS [DUSP1 - Dual specificity protein phosphatase 1 - Homo sapiens (Human) | UniProtKB | UniProt]._dat11.03.2024
Mitose: Nach der DNA-Replikation bestehen die Chromosomen aus zwei identischen Kopien (Schwesterchromatiden), die punktuell miteinander verklebt sind. Während der Mitose (M-Phase) richten sich die verdoppelten Chromosomen einer Mutterzelle an einer mitotischen Spindel aus, um sich gleichmäßig voneinander als 2 Tochterzellen zu trennen [Mitose, der Teilungsvorgang von Zellen und Chromosomen | Max-Planck-Gesellschaft (mpg.de)]. Die Spindel wird von Mikrotubuli gebildet. Die Spindel ist erforderlich, weil das enthaltene „Tubulin“ einen Cofaktor zur Lokalisierung enthält, so dass sich die Chromosome ausrichten können. Ab Z.38“365“#161“0“ startet eine neue Randserie, die mit der Ziffer O (Null) ein Symbol enthält, das für den Zellzyklus als Kreislauf geeignet ist. Die Z.-Nr. endet mit der Zeitbasis =365Tage=1 Jahr zur ständigen Zellteilung. Unsympathisch ist, dass die Zeile auch die Zahl „97“ enthält. Was ist gemeint? Ach, ja! Nur 97 Lebensjahre – wir wollen mehr! Für die zeitliche Wiederholung im unveränderten Bereich ist die Winkelsumme 360°=Kreislauf erforderlich. Die 24 Zeilen gewinnen aus der Serie #16“10“ zunächst 24*10°=240°. Mit 10“60“ und 100“60“ wird die Winkelsumme 240+60+60=360° gebildet. Die überschüssige Zahl „10“ in 10“10“1 ist funktionell in der Kreisspalte 6/“0“/4 gebunden, und zählt daher nicht als Winkel. Das Mikrotubulus-Organisationszentrum (MTOC) ist die Basis zur Ausbildung von „Mikrotubuli“. Die Serie #1610 wird über die Randspalte 8/6/(1)2 mit dem lesbaren GTP=268E und dem Cofaktor „Magnesium“=12E für Alpha- und Beta-Tubulin erschlossen. Anschließend folgt Gamma-Tubulin, das zur Bildung einer Tubulin-Röhre erforderlich ist. Alpha- und Beta-Tubulin sind kugelförmige Proteine, die ein Heterodimer bilden. Bei gleicher Länge von 451AS liegt das Protein (Mensch) „TUBB1“ (!!)=451AS am rechten Rand, weil dort Medikamente an Beta-Tubulin binden, und zwar in der Spalte Z.38365#_[297756]{4}[5]/#_[307]!8!{8}{7}{8}§8§/#_[3]$2$0{!2!}{0}{!8!}{(!1!)}§6§/#_$33$|4|{71“7}!(„1“)!§“2“§/#_$35$|14|1|!(„4“5)![9], über die Zeile Z.38369 als „45“_“1“ mit Ziffer „1“ im Cofaktor „Magnesium“=12E für „TUBB1“ (!!)=451AS. Tubuline binden „GTP“, aber nur das „GTP“ von Alpha-Tubulin ist vor der Umwandlung (Hydrolyse) in „GDP“ geschützt, weil das Beta-Tubulin eine schützende Schleife um das „GTP“ von Alpha-Tubulin legt [Tubuline – Wikipedia]. Diese Fernwirkung kann über einen angehängten Kunstgriff realisiert werden, der das verwendbare Hydrolyse-Wasser „28“ blockiert, und zwar in der Spalte Z.38366#_[07]!8![8788]/#_[20]!2081![6] mit „TUBB1“ (!!)=45_1_Kunstgriff 2081=QS=11=QS=2_8 mit 451_Summe 2+8=10 für „0“ mit Summe 451+0=“451“ für TUBB1“ (!!)=451AS. „TUBB1“ kann sein lesbares GTP=268E in Randspalte 8/6/2 mit dem Wasser in der Randspalte Z.38366#_788/#_“8“1“6/#_[7]“1“2“ als Spalte 1/1=QS=2_8 für Wasser=28 in GDP=228E umwandeln, und zwar als „2“_Spalte 1/1=QS=“2“_“8“ mit 2_2_8 für GDP=228E [TUBB1 - Tubulin beta-1 chain - Homo sapiens (Human) | UniProtKB | UniProt]. Weil das Protein aufgrund der Zahl „45“ fast lesbar ist, findet die Zahl „64“ für die Kugelform keinen Platz. Die Protein-Länge „451“AS ist alternativ zusammen für beide Proteine aufsteigend als Spalte 1/5/4 über die Folgezeile lesbar, so dass sich aus DELTA.TIME.EPI.VIR.Z.38368-38370=#_839“64“4 der „Kreis“=64 (Symbol) kombiniert mit der „Gruppe“=44 (Symbol) ergibt. Mit „Extra“=8 kann „39“ mit der Ziffer „3“ zum Triplett aus „3“ Mikrotubuli und damit zum röhrenförmigen „Zentriol“ aus „9“ Tripletts verarbeitet werden. Das „Zentriol“ liegt doppelt unter 90° gekreuzt als „Diplosom“ vor und bildet in der Nähe des Zellkerns den Ursprung für den Spindelapparat [Zentriol - DocCheck Flexikon]. Der 90°-Winkel ist kombiniert mit der Ziffer „2“=paarig (Diplosom) als Randspalte 9/0 für 90° neben der Tubulin-Spalte „1/4/5“ lesbar, und zwar in der Spalte Z.38368#_1“2“/#_5“9“/#_4“0“.
Für das Heterodimer im Profilament liegt „TUBA1A“ (||)=451AS seitlich an [„TUBBA1B“=451AS wäre alternativ möglich], und zwar als „4“_14=QS=“5“_“1“ mit 4_5_1 für „TUBA1A“ (||)=451AS und dem GTP ($$)==268E seitlich in der Spalte [3]2/33/35 als 2_33=QS=6_35=QS=8 mit 2_6_8 für GTP=268E [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBA1C“ {}=449E mit dem Cofaktor Mg=12E füllte eine Lücke, und zwar aufsteigend aus der Startzeile Z.38365 als „4“_Spalte 8/1=QS=“9“_Schleife absteigend Spalte 7/8=QS=15_aufsteigend Spalte 8/0=QS=8_2_717=QS=15 mit „4“_Summe 9+15+8+2+15=49 mit 4_49 für „TUBA1C“ {}=449AS [TUBA1C - Tubulin alpha-1C chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Arzneimittel (chemotherapy medication) „Paclitaxel“ ()= C47H51NO14=282+51+7+112=452E setzt am Beta-Tubulin an, und zwar als „45“_ Spalte 1/1=QS=“2“ mit 45_2 für „Paclitaxel“ () =452E. Das Spindelgift blockiert den Abbau der Spindelfasern, und damit auch die mitotische Zellteilung. Das Arzneimittel (gegen Gicht) „Colchicin“ („“) =C22H25NO6=132+25+7+48=212E über Randzahl 12 für „2“_“1“_Spalte 7/4=QS=11=QS=“2“ mit 2_1_2 für „Colchicin“ („“)=212E.
Gamma-Tubulin bildet ein Dimer „TUBG1/TUBG2“ zur polaren Orientierung. Bei den gleichartigen Proteinen wird das Protein (Mensch) „TUBG1“ {} =451AS in der Spalte Z.38370#_370(3)(00){4}[0]/#_391(3)[7](4){38}/#_41!4!(6363){6}/#_!44!0![0]§8§6§{§1§}{§6§}/#_[4]!6!7![7]§236§3§ an den rechten Rand gesetzt, der die Schwerachse 84 enthält, um zum „Corpus Callosum“ als Mittellinie eine Bezug herzustellen, und zwar als „4“_“38“_“6“_16=QS=“7“ mit „4“_Summe 38+6+7=“51“ mit 4_51 für „TUBG1“ {} =451AS. Die GTP-Bindung erfolgt an der Endzahl „16“, die in einem Kunstgriff durchlaufen wird, und zwar „GTP“ (§§)=268E als 236=QS=11=QS=“2“_Kunstgriff Randspalte 6/3=“9“_“1“ mit „2“_Summe 9+1=10 für „0“_86 nach links für „68“ mit „2“_Summe 0+68=“68“ für „GTP“ (§§)=268E [TUBG1 - Tubulin gamma-1 chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBG2“ () =451AS ringförmig seitlich anliegend als „4“_00 (Pol-Nullen)=“0“_ Spalte 3/3 für 33_6363=QS=18 mit „4“_Summe 0+33+18=“51“ mit 4_51 für „TUBG2“ () =451AS. Die Ziffer „7“=Form wird umringt. Bindung an GTP (!!)=268E über Spalte 407=QS=11=QS=2_6_44=QS=8 mit 2_6_8 für GTP (!!)=268E [TUBG2 - Tubulin gamma-2 chain - Homo sapiens (Human) | UniProtKB | UniProt]. Der „Gamma-Tubulin-Ring-Komplex“ bildet mit 5 Proteinen eine 9-zeilige Kette am freien linken Rand. Das Protein (Mensch) „TUBGCP2“ {}=902AS liegt in der Spalte Z. 38365#_16{1}{0}{9}8/#_6{1}094/#_161089 als 09 nach links für „90“_Spalte 1/1=QS=“2“ mit 90_2 für „TUBGCP2“ {}=902AS [TUBGCP2 - Gamma-tubulin complex component 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP3“ ()=907AS als „9“ Spalte 0/0 für „0“_16=QS=“7“ mit 9_0_7 für „TUBGCP3“ ()=907AS [TUBGCP3 - Gamma-tubulin complex component 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP6“ („“)=1819AS liegt in der Spalte Z.38368#_161085/#_161081 als 10_8 mit Summe 10+8=“18“_“10“_QS8_1=“9“ mit „18“_Summe 10+9=“19“ mit 18_19 für „TUBGCP6“ („“)=1819AS [TUBGCP6 - Gamma-tubulin complex component 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP5“ (!!)=1024AS liegt in der Spalte Z.38370#_[16]!10!77!33!/#_[1610]§7§[3]!13!/#_[1610]§6“[894]/#_[1610]§6§[474] als 10_77=QS=14_33=QS=6_13=QS=“4“ mit „10“_Summe 14+6+4=“24“ mit 10_24 für TUBGCP5“ (!!)=1024AS [TUBGCP5 - Gamma-tubulin complex component 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBGCP4“ (§§)=667AS absteigend als Spalte 6/6/7 mit 6_6_7 für „TUBGCP4“ (§§)=667AS [TUBGCP4 - Gamma-tubulin complex component 4 - Homo sapiens (Human) | UniProtKB | UniProt].
Tubulin Delta/Episilon sind an der Struktur und Funktion von Zentriolen beteiligt und folgen dem „Gamma-Tubulin-Ring“. Das Protein (Mensch) „TUBE1“ (||)=475AS liegt in der Spalte Z.38373#_[16]€10€[6]|47|[4]/#_[16]€10€[60]|5|[4]/#_[16]€10€56€3€4€ als „4“_Spalte 7/5 mit „7“_“5“ für „TUBE1“ (||)=475AS. Das GTP liegt seitlich und wird ebenfalls von „TUBG2“ verwendet [TUBE1 - Tubulin epsilon chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TUBD1“ (€€)=453AS als 4_3_56=QS=11=QS=2 mit „4“_Summe 3+2=“5“_Spalte 10/10/10=QS=3 mit 4_5_3 für „TUBD1“ (€€)=453AS. In der Serienspalte #16“1“ verbleibt über 11 Zeilen eine unbesetzte Spalte 1/1, die durch GTP besetzt werden kann, und zwar über Spalte 1/1=QS=“2“_“6“_8-fach „1“ absteigend bis Z.38365 für „8“ mit 2_6_8 für GTP =268E [TUBD1 - Tubulin delta chain - Homo sapiens (Human) | UniProtKB | UniProt].
„Mikrotubuli“ werden im dynamischen Wechsel von Aufbau (Polymerisation) und Abbau (Depolymerisation) instabil. Es müssen sich Heterodimere mit ausreichender Geschwindigkeit anlangern, ansonsten wird das schützende „GTP“ zu „GDP“ + „P“ hydrolysiert. „Catastrophine“ sind Proteine, die den Abbau von Mikrotubuli und deren Verkürzung als Prozess „Mikrotubuli-Katastrophe“ bewirken. Das „Stathmin (Onkoprotein18)“ erhöht die Häufigkeit von Katastrophen oder verhindert die Bildung der Heterodimere. „Doublecortin (DCX)“ hemmt die Katastrophen [Catastrophin – Wikipedia]. Beide Proteine werden in einen Zusammenhang gebracht, um das Zeitregime von 10 Minuten als Wechselgröße darzustellen. Mikrotubuli werden nach dieser Zeit abgebaut, sofern sie nicht durch Einbau in Strukturen stabilisiert wurden. Im Prinzip stellt „DCX“ die Zeitbasis „60“ zur Verfügung. „Stathmin“ kann über das Wasser 28 als 208=QS=10 eine Zeitzählung von 10*60=600 Sekunden=10 min veranlassen, um den Abbau einzuleiten. Das Protein (Mensch) „DCX_Doublecortin“ {}=365AS enthält die Zeitbasis „1 Jahr“ als ständiger Prozess, und zwar in der Spalte Z.38365#_[3]!29!775645/#_{1}{!3!0!}788788/#_{9}!{3}{!2!}(0208)[16]/#_[7]!{3}!{3}(4!7)[1](7)[12]/#_[53514](1)(4)[59] ringförmig als „3“_Spalte 3/3=QS=“6“_Kunstgriff 1/9=QS=10 für „0“_30=QS=“3“_“2“ mit „36“_Summe 3+2=“5“ mit 36_5 für „DCX“ {}=365AS [DCX - Neuronal migration protein doublecortin - Homo sapiens (Human) | UniProtKB | UniProt]. Die Protein-Kinase (Mensch) „DCLK1“ (!!) =740AS konkurriert mit „DCX“ bei der Bindung an Zielproteine, und zwar mit Serin=56E in „32/33“ und Threonin=64E in „334“ als 34=QS=“7“_ringförmig absteigend Spalte 3/3 für „33“_30=QS=“3“_29=QS=11=QS=“2“_aufsteigend Spalte 0/2=QS=“2“ mit „7“_Summe 33+3+2+2=40 mit 7_40 für „DCLK1“ (!!) =740AS. Calcium=20E als Spalte 0/2(0) und seitlich für Calcium-Signalweg [DCLK1 - autoe/threonine-protein kinase DCLK1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „STMN1_Stathmin“ ()=149AS wird über die Zahl „14“ gezählt, wodurch ein Kurzschluss zwischen alpha –und beta-Tubulin entsteht, der das Heterodimer verhindert, und zwar als „1“_Spalte 7/4=QS=11=QS=“2“_Kunstgriff 0208=QS=10 für „0“_ über Spalte 0/4 nach rechts „47“ mit „1“_Summe 2+0+47=“49“ mit 1_49 für „Stathmin“=149AS [STMN1 - Stathmin - Homo sapiens (Human) | UniProtKB | UniProt]. Die Spalte „717/414“ ist ein Zählwerk 7/4=“11“_ 1/1 für „11“_ 7/4=“11“ für beide Seiten. Der Minuten-Faktor 208=QS=“10“ ist vorgelagert in der Spalte „208/717/414“. Die Zeitbasis „60“ beginnt am DCX-Kunstgriff und wird an den Faktor „10“ seitlich angeschlossen, und zwar mit Zeitbasis „60“ über 9/1=QS=“10“_“30“_“20“ mit Summe 10+30+20=“60“. Die Matrix „7887“/“0“2“0“8“/“4“7“1“7“/“1“414“ kann alternativ für 600 Sekunden als Zeitwert durchgezählt werden, und zwar als „414“_absteigend 2/7 für „72“_aufsteigend 0/1=QS=“1“_absteigend 8/7 für „78“_7887=“30“_0/4/1=QS=“5“ mit Summe 414+72+1+78+30+5=600 Sekunden.
Die Heterodimere lagern sich linienförmig zu Protofilamenten zusammen, wobei „13“ Protofilamente eine volle Drehung für eine Röhre ergeben. Zwar müsste zunächst die Bildung von gamma-Tubulin für ein Musterstück vollendet sein, aber „DCX_Doublecortin“ entwickelt ebenfalls einen Mechanismus, um die Krümmung mit „13“ Protofilamenten zu kontrollieren. Hierzu ist die enthaltene Zahl „130“ in Z.38366#_“130“7=Form“ geeignet, die Anzahl „13“ mit dem maximalen Durchmesser der Mikrotububli=maxD=30 nm kombiniert. Minimaler Durchmesser=minD=25nm vertikal als Form=7_93=QS=12_13_0=Röhre_7=Form mit Summe 12+13=minD=25nm [Doublecortin erkennt den 13-Protofilament-Mikrotubuli kooperativ und verfolgt die Mikrotubuli-Enden - ScienceDirect; S. Bechstedt u.a.; Jul 2012; https://doi.org/10.1016/j.devcel.2012.05.006].
Das „Kinetochor“ verbindet die Kinetochor-Mikrotubuli (kMTs) mit dem Zentromer. Die Proteine werden nach dem inneren und dem äußeren Kinetochor unterschieden. Es wäre möglich, dass sich das innere Kinetochor am Wechsel der Randserie aufsteigend von #1611 nach #1610 orientiert. Innere Kinetochor: CENP-S/-X; CENP-T/-W; CENP-L/-N; CENP-H/-I/-K; CENP-M; CENP-C; CENP-O/-P/-Q/-U; CENP-R. Das äußere Kinetochor wird vom „KMN-Netzwerk“ gebildet, das mit dem „SAC-Komplex“ und „Mikrotubuli-Bindeproteinen“ interagiert [Nie die Kontrolle verlieren: Das Kinetochor am Kontrollpunkt der Zellteilung | Max-Planck-Gesellschaft (mpg.de) ; A. F. Musacchio u.a.; 2015; DOI
10.17617/1.Q].
Das KMN-Netzwerk der Proteine KNL1, MIS12, NDC80 ist die primäre Schnittstelle zwischen dem Kinetochor und den Kinetochor-Mikrotubuli (kMTs) [The KMN protein network – chief conductors of the kinetochore orchestra - PMC (nih.gov); D.Varma u.a. ; Dez. 2012; doi: 10.1242/jcs.093724]. Der Komplex schreitet nicht weiter voran, sondern liegt als Stapel auf den Mikrotubuli, um diese zu befestigen. „KNL1“ dient zur Befestigung der Mikrotubuli an den Zentromeren der Chromosomen. Zunächst wird „BUB1/BUB1B(BUBR1)“ ermittelt, die jeweils mit „BUB3“ interagieren. „BUB3“ bindet konstitutiv (permanent) an BUB1B (BUBR1) [BUB3 – Wikipedia]. Die gesamte Matrix wird bis eine noch besetzbare Zentralspalte ab Z.38368 mit „3/5/7/9/39“ ausgefüllt, so das „BUB3“ diese Zentralspalte aufnimmt und zum Restbedarf das „BUB1B“ mit einem Kunstgriff durchläuft, um in die Zahl „85“ mit „BUB1“ zu teilen, und zwar absteigend über 39=QS=12_Spalte 3/5/7=QS=15 mit Summe 12+15=“27“_Kunstgriff 73=QS=10 für „0“_“5“ mit Summe 27+5=32_8 für „BUB3“=328AS [BUB3 - Mitotic checkpoint protein BUB3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Checkpoint-Protein (Mensch) „BUB1“ (!!)= 1085AS ist in Z38368#[16]!1085! lesbar. „ATP“ liegt in der Spalte #161/#161 als 1/1=QS=“2“_“6“_“1“_61=QS=“7“ mit „26“_Summe 1+7=“8“ für ATP=268E am linken Serienrand [BUB1B - Mitotic checkpoint serine/threonine-protein kinase BUB1 beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „BUB1B“ {}=1050AS folgt seitlich in der Spalte Z.38368#_[16]!1085!{73}[3]/#[16]{1081}{5}[35] als „BUB1B“ {}=1050AS als 73=QS=“10“_“5“_1081=QS=10 für „0“_mit 10_5_0 für „BUB1B“ {}=1050AS [BUB1B - Mitotic checkpoint serine/threonine-protein kinase BUB1 beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „KNL1 (CASC5)“ ()=2342AS liegt in der Spalte Z.38368#[16]!1085!{73}34/#[16]{1081}{5}(3)(5)(1)/#[16]§1§0§7§(73)(3)(7)(0)/#[16]§1§[0]§7§(3)“1“3“[91]/#[106](8)“9“4“1“[4], und zwar absteigend als 3/8=“11“_73=“10“_mit Summe 11+10=“21“_Spalte 3/3=QS=“6“_“5“ mit „21“_Summe 6+5=“11“=QS=“2“ mit Summe 21+2=“23“_“34“_aufsteigend Spalte 1/0=QS=“1“_“7“ mit „23“_Summe 34+1+7=“42“ mit 23_42 für „KNL1“=2342AS [KNL1 - Kinetochore scaffold 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „KNL1“ bildet mit dem Protein (Mensch) „ZWINT_ZW10 Interaktor“ (§§)=277AS ein Heterodimer, und zwar mit „ZWINT“ in der Randspalte #[16]§1§0§7§/#_[16]§1§[0]§7§ als 1/1=QS=“2“_“0“_Spalte 7/7 für „77“ mit „2“_Summe 0+77=“77“ mit 2_77 für „ZWINT_ZW10 Interaktor“=277AS [ZWINT - ZW10 interactor - Homo sapiens (Human) | UniProtKB | UniProt]. „KNL1“ rekrutiert weiterhin das Protein (Mensch) „CENPF_Centromere protein F“ („“) =3114AS in der Spalte „1“3“[9]/“941“ als „3“_“1“_941=QS=“14“ mit 31_14 für „CENPF“ („“)=3114AS [CENPF - Centromere protein F - Homo sapiens (Human) | UniProtKB | UniProt].
„MIS12“-Komplex (DSN1; MIS12; PMF1; NSL1)“: Der „MIS12“-Komplex“ zeigt keine Merkmale und wird kompakt auf freie Plätze platziert [Structure of the MIS12 Complex and Molecular Basis of Its Interaction with CENP-C at Human Kinetochores - PMC (nih.gov); A. Petrovic; Nov. 2016; doi: 10.1016/j.cell.2016.10.005]. Zunächst wird das Protein (Mensch) „AURKB_Aurora Kinase B“ (@@)=344AS in die Startspalte Z.38365#_[8]@3@29@77@€5€64€5€/#_!4!@13@[0]@78@€8€7€|88|/#_!9!93!{20}{2}{0}|81|[6]/#_[5733]{47}{1}|712|/#_[1535]$1$41$[459]/#_[337]$0$30$[040]/#_[139]$1$37$[438] gesetzt, um die Zahl „13“ zu besetzen, wodurch „CENP-C“ die Ziffer 13=QS=“4“ nicht vorgelagert, sondern alternativ seitlich über die Spalte 4 /9=QS=13=QS=“4“ wählen muss. Die Interaktion von „MIS12“ mit „CENP-C“ wird durch „Aurora B“ gefördert, und zwar 78=QS=“15“ (Phosphor)_absteigend 77=QS=“14“_29=QS=11=QS=“2“_“3“ mit Summe 15+14+2+3=“34“_aufsteigend 13=QS=“4“ mit 34_4 für „Aurora B“ (@@)=344AS. Für die Kinase-Aktivität liegt Serin=56E/Threonin=64E seitlich als Kombination „564“ lesbar an. „Serin/Threonin-Proteinkinase-Komponente des chromosomalen Passagierkomplexes (CPC), einem Komplex, der als Schlüsselregulator der Mitose fungiert“ [AURKB - Aurora kinase B - Homo sapiens (Human) | UniProtKB | UniProt]. Über den „CPC-Komplex“ wird „Aurora B“ lokalisiert, das mit INCENP (Inner Centromere Protein), Survivin und Borealin ein Heterotetramer bildet. „MIS12“ interagiert direkt mit dem Protein (Mensch) „CENP-C_Centromere protein C“ (!!) =493AS über die Spalte Z.38366#_!4!@13@/#_!9!93! als Spalte 4/9=QS=13=QS=4_93 für „CENP-C“= (!!) =493AS. „CENP-C“ und der CENP-LN-Komplex interagieren mit der zentromerspezifischen Histon-H3-Variante „CENP-A“, die als Dreh- und Angelpunkt der Kinetochor-Assemblierung gilt“ [CENPC - Centromere protein C - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MIS12“ {}=205AS in Z.38367 als „20“_aufsteigend 47=QS=11=QS=“2“ absteigend “2“_Spalte 0/1=QS=“1“_ mit „20“_Summe 2+1+2=“5“ mit 20_5 für „MIS12“ {}=205AS [MIS12 - Protein MIS12 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DSN1“ (||)=356AS über die Randspalte [7]88/81[6]/712 als 712=QS=“10“_81=QS=9_88=QS=16 mit Summe 10+9+16=35_6 für „DSN1“ (||)=356AS [DSN1 - Kinetochore-associated protein DSN1 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PMF1“ (€€)=205AS in der Randspalte Z.38365#_“5“64“5“/#“87“|88| als 87=“15“_absteigend „5“ mit Summe 15+5=“20“_Kunstgriff 64=QS=10 für „0“_“5“ mit „20“_Summe 0+5=“5“ mit 20_5 für „PMF1“ (€€)=205AS [PMF1 - Polyamine-modulated factor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NSL1“ ($$)=281AS in Z.38369 aufsteigend über Spalte 1/0/1=QS=“2“_absteigend 37=QS=“10“_“30“_“41“ mit „2“_Summe 10+30+41=“81“ mit 2_81 für NSL1“ ($$)=281AS [NSL1 - Kinetochore-associated protein NSL1 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
„NDC80-Komplex“ [NDC80; NUF2; SPC24; SPC24]: Der „NDC80“-Komplex“ erhöht synergistisch die Affinität des SKA1-Komplexes, zu dem das Protein (Mensch) „SKA1“=255AS gehört. „SKA1“ liegt in der freien Randspalte Z.38367#[16]“108“[9]/#“161“[0]8“5“, und zwar als #161=QS=“8“_absteigend 108=QS=“9“_aufsteigend „8“ mit Summe 8+9+8=“25“_“5“ für „SKA1“=255AS [SKA1 - Spindle and kinetochore-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SKA2“=121AS folgt aufsteigend (seitlich an SPC24/SPC25) in der Randspalte Z.38369#16/#[1]6 als 6/6=QS=12_1 für „SKA1“=121AS [SKA2 - Spindle and kinetochore-associated protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SKA3“ („“)=421AS folgt in der Spalte Z.38371#“16“10“|7|3|/#“16“10“[6]|8|/#“16“1064“ als Spalte 16/16/16=QS=“21“_Spalte 10/10 für „20“ mit Summe 21+20=“41“_1064=QS=11=QS=“2“ für „SKA3“ („“)=421AS [SKA3 - Spindle and kinetochore-associated protein 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Der „MIS12-Komplex“ bildet im Zeilenlauf mit „NSL1“ ($$) eine nadelartige zentrale Spalte, die vom NDC80-Komplex beidseitig eingefasst wird, und zwar in der Spalte Z.38369#“1“6“(10)(81){5}{3}[5]$1$41$!4![59]/#[1]“6“|10||7|(7){3}{3}[7]$0$30$!040!/#[1610]|7|3|{1}[39]$1$37$!4!38!/#[16106]|8|{9}{4}{146}{36}{36}. Am rechten Rand liegt das Protein (Mensch) „NUF2“ (!!)=464AS mit „4“_absteigend 38=QS=11=QS=“2“_040=QS=“4“ mit „4“_Summe 2+4=“6“_“4“ mit 4_6_4 für „NUF2“ (!!)=464AS [NUF2 - Kinetochore protein Nuf2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NDC80“ {}=642AS verbindet beide Seiten, und zwar als „36“_36=QS=“9“_146=QS=11=QS=“2“_“4“_3/1/9=QS=“13“ mit Summe 36+9+2+4+13=“64“_3/3=QS=“6“_“5“ mit „64“_Summe 6+5=11=QS=“2“ mit 64_2 für NDC80=642AS [NDC80 - Kinetochore protein NDC80 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SPC24“ ()=197AS folgt „SKA1“ am linken Rand als „10“_81=QS=“9“ mit Summe 10+9=“19“_“7“ für „SPC24“ ()=197AS [SPC24 - Kinetochore protein Spc24 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SPC25“ (||) =224AS folgt als 3/8=QS=11=QS=“2“_7/7=QS=“14“_“10“ mit „2“_Summe 14+10=24 mit 2_24 für „SPC25“ (||) =224AS [SPC25 - Kinetochore protein Spc25 - Homo sapiens (Human) | UniProtKB | UniProt].
Der Fortschritt der Mitose wird durch „mitotische Kinasen“ kontrolliert [Polo-, Aurora-, Bub-, NEK/NimA- und MPS1-Kinasen]. Statt „MPS1“ ist „TTK“ zuständig [Die MPS1-Familie der Proteinkinasen - PMC (nih.gov); D. Cleveland; Jul 2001; https://doi.org/10.1016/S0092-8674(01)00410-X]. Das lesbare „TTK“ ist von „MAD2L1“ durch die Spalte 6/4 (Threonin=64E) getrennt. Diese Spalte wird von „TTK“ mit aufgenommen. Das Protein (Mensch) „TKK“ (!!)=857AS liegt in der rechten Randspalte Z.38375#_!4!8!5!7!/#_!6!0!8![3] über Spalte 4/6 absteigend für „64“_ aufsteigend 8/0=QS=“8“_absteigend 5/8=QS=“13“ mit Summe 64+8+13=85_7 für „TKK“ (!!) =857AS [TTK - Dual specificity protein kinase TTK - Homo sapiens (Human) | UniProtKB | UniProt]. „TTK“ phosphoryliert „MAD1L1“, um die mitotische Checkpoint-Signalgebung zu fördern. Das Protein (Mensch) „MAD1L1“ (||)=718AS füllt eine vorgelagerte Lücke, und zwar in der Randspalte Z.38374#_|61|6|/#_|36|3| als 61=QS=“7“_Spalte 6/3=QS=“9“_36=QS=“9“ mit „7“_Summe 9+9=“18“ mit 7_18 für „MAD1L1“ (||)=718AS [MAD1L1 - Mitotic spindle assembly checkpoint protein MAD1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAD2L1“ liegt in 2 Konformationen rechtwinklig in der Spalte Z.38373#_64744[0]{0}{8}|61|6|/#_§605§46[7]{7}{2}|{3}6|3|/#_§56§(3)49[7]{5}!4!8!5!7!#_ [52](1)(5)(29)(5)!6!0!8![3]. Vertikaler Fall: „MAD2L1“ {}=205AS muss die Endziffer „3“ mit „MAD1L1“ (||)=718AS teilen oder „MAD1L1“ fehlt, und zwar absteigend über Spalte 0/7/5=QS=12_8 mit Summe 12+8=“20“_23=QS=“5“ mit 20_5 für „MAD2L1“=205AS; Horizontaler Fall: Spalte 3/1=QS=“4“_“5“_29=QS=“11“ mit Summe 4+5+11=20_5 für „MAD2L1“ ()=205AS [MAD2L1 - Mitotic spindle assembly checkpoint protein MAD2A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAD2L2“ (§§)=211AS in der Spalte „605“/“56“{3} als 56=QS=11=QS=“2“_605=QS=“11“ mit 2_11 für „MAD2L2“ (§§)=211AS [MAD2L2 - Mitotic spindle assembly checkpoint protein MAD2B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CDC20“=499AS wird durch „MAD2L1“ reguliert, und zwar als „4“_absteigend Spalte 4/4 für „44“_aufsteigend Spalte 4/6 für „46“_“9“ mit „4“_Summe 44+46+9=“99“ mit 4_99 für „CDC20“=499AS [CDC20 - Cell division cycle protein 20 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Der Östrogenrezeptor-Beta (Mensch) „ESR2“ {}=530AS interagiert mit „MAD2L1“ (), und zwar in der Spalte Z.38374#[16]{10}[605467]/#_[16]{10}[56](3)[497]/#_[16]{10}{5}!|2|!(|1|)(5)(29)/#_16!10|4!7|!9|5|[63]/#_!16!10![437600]. „ESR2“ besitzt keinen Cofaktor „Zink“=30E , so dass die Zink-Bindung selbst summiert wird, und zwar als „5“_absteigend Spalte 10/10/10 für „30“ mit 5_30 für „ESR2“=530AS. Die Lücke zum „MAD2L1“ () muss jedoch durch das natürliche Östrogen „Östradiol“ (!!)=C18H24O2=108+24+16=148E in der Lücken-Spalte 2/7 für „27“_“104“_16=QS=7_10 mit Summe 27+104+7+10=148 für Östradiol (€€) =148E zunächst als Aktivator besetzt werden [ESR2 - Estrogen receptor beta - Homo sapiens (Human) | UniProtKB | UniProt]. „ESR2“ {} bildet mit dem Östrogenrezeptor-Beta (Mensch) „ESR1“ (||)=595AS ein Heterodimer, und zwar als „47“_aufsteigend „2“_absteigend Spalte 1/9=QS=10 mit Summe 47+2+10=59_5 für „ESR1“ (||)=595AS [ESR1 - Estrogen receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „MAD2L1“ () interagiert mit dem Protein (Mensch) „Adam17“ (§§)=824AS, das mit dem Cofaktor „Zink“=30E das Zink als Spalte 3/0 mittig und am rechten Rand finden könnte. Gewählt wird die Randlage mit Zink-Bindung in der Ziffer „0“. Der Zeilenbereich enthält die lesbare „00“-Doppel-Null und als Spalte „0/0“, um die Bindung der Mikrotubuli vom Spindel-Äquator entgegengesetzt zu den beiden Polen fortzuführen. „Adam17“ liegt seitlich an der Null-Spalte in der Randspalte Z.38376#_[1](5)(29)(5)§6§[0]|8|3|/#_[95637]§6§0§|2|[3]/#_[760014]§6§6§0§/#_[56387197]§8§ über die Randspalte „3/0/8“ am Cofaktor „Zink“=30E absteigend über Spalte 0/8=QS=“8“_66=QS=“12“_“0“_Spalte 6/6=QS=“12“ [seitlich „MAD2L1“ ()] mit „8“_Summe 12+0+12=“24“ mit 8_24 für „Adam17“ (§§)=824AS [ADAM17 - Disintegrin and metalloproteinase domain-containing protein 17 - Homo sapiens (Human) | UniProtKB | UniProt]. „Adam17“ setzt an der Oberfläche lösliches „JAM3“ frei. Das Protein (Mensch) „JAM3“(||)=310AS liegt am Rand in der 33er-Membranspalte 83/2[3(aus Zink)] als „3“_Spalte 8/2=QS=“10“ mit 3_10 für „JAM3“ ($$)=310AS [JAM3 - Junctional adhesion molecule C - Homo sapiens (Human) | UniProtKB | UniProt].
Spindelpole: Epigenetische Regulatoren steuern Genaktivität, indem sie den Zugang zur DNA modulieren. Der „NSL-Komplex“ reguliert mehr als 4000 Gene. Zu Beginn der Zellteilung bewegen sich „KANSL1“ und „KANSL3“ zu den beiden Spindelpolen, wobei auch „MCRS1“ funktionell notwendig ist [Ein epigenetischer Regulator entsteht als Mikrotubuli-Minus-End-Bindung und stabilisierender Faktor in der Mitose | Nature Communications; A. Akhtar; Aug 2015 https://doi.org/10.1038/ncomms8889] Der Komplex wird derart angeordnet, dass „KANSL1“ und „KANSL3“ die 00-(Doppel-Null) zur Kontrolle halbieren. „MCRS1“ durchläuft seitlich eine 0/0-(Nullspalte), um den Bezug zu den Polen zu symbolisieren, und zwar in der Spalte Z.38375#_349754857/#_52956083/#_9{5}[6](3)76023/#_7{6}{0}(0)14660/#_{56}{3}(87)1978/#_[3679](4)[7958].
Das Protein (Mensch) „KANSL1“ {}=1105AS in Z.38377 aufsteigend über Spalte 5/6=QS=“11“_“0“_“3“_56=QS=11=QS=“2“ mit „110“_Summe 3+2=“5“ mit 110_5 für „KANSL1“=1105AS [KANSL1 - KAT8 regulatory NSL complex subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „KANSL3“ ()=904AS liegt spaltenförmig neben „KANSL1“, und zwar aufsteigend als Spalte 3/0=QS=3_87 mit Summe 3+87=90_4 für „KANSL3“ ()=904AS [KANSL3 - KAT8 regulatory NSL complex subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MCRS1“ (!!)=462AS schleifenförmig über „0/0“ zum rechten Rand, und zwar in Z.38376 mit „29560“ für 29=QS=11=QS=“2“_aufsteigend 560=QS=11=QS=“2“ mit Summe 2+2=“4“_760=QS=“13“_146=QS=“11“_absteigend Spalte 2/6=QS=“8“_aufsteigend Randspalte 3/0 für „30“ (keine Zinkbindung)_mit „4“_Summe 13+11+8+30=“62“ mit 4_62 für „MCRS1“ (!!)=462AS [MCRS1 - Microspherule protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „KAT8“ („“)=458AS ist Teil des NSL-Komplexes und könnte an der Acetylierung von nukleosomalem Histon H4 an mehreren Lysinresten beteiligt sein. Die Ziffer „0“ von „MCRS1“ (!!) gehört zur Spalte „8/0“ für Lysin=C6H14N2O2=36+14+14+16=80E. Folglich liegt „KAT8“ vorgelagert in der Randspalte Z.38374#_“23“[63]/#_“4“8“[57]/#_!60![83] als 4_absteigend 23=QS=5_aufsteigend „8“ mit 4_5_8 für „KAT8“=458AS. Acetyl-CoA= C23H38N7O17P3S=138+38+49+136+45+16=422E ist mit „4“_“2“_Spalte 3/8=QS=11=QS=“2“ mit 4_2_2 für Acetyl-CoA=422E enthalten [KAT8 - Histone acetyltransferase KAT8 - Homo sapiens (Human) | UniProtKB | UniProt]. Im NSL-Komplex hat das Protein (Mensch) „KANSL2“ {}=492AS übernimmt die gleiche Funktion am „Histon H4“ wie „KAT8“. Das Lysin=80E ist gespiegelt alternativ in „008“ enthalten. „KANSL2“ findet vorgelagert eine eigene „00“-(Doppel-Null), deren Teilung im Unterschied zu KANSL1/KANSL3 von „KANSL2“ über eine Schleife allein bewirkt wird. „KANSL2“ ist funktionell für sehr feine Flimmerhärchen auf der Zelloberfläche zuständig, um den Stofftransport zu realisieren. Das Härchen „1“ liegt folglich in einem Oberflächen-Netzwerk 44 als 4“1“4. In der Spalte 4/008 ist zwar die gespaltene „00“-(Doppel-Null) enthalten, zugleich ist aber auch die Schwerachse 84 erkennbar, damit die Flimmerhärchen wieder funktionsgerecht vertikal zur Oberfläche ausgerichtet bleiben. Für die Verformung der Härchen sind in der Zählung beidseitige „Krümmungen“ 46/64 enthalten. „KANSL2“ teilt sich die Zahl „23“ mit „KAT8“ in gespaltener Form. „KANSL2“=492AS liegt in der Spalte Z.38372#_{4}{1}{4}63636/#_{4}{40}{0}{8}{6}[16]/#_{46}{77}{2}{3}[63]/#_49754857 über 414 mit „4“_nach links „1“ (Härchen)_aufsteigend Spalte 4/4 (Gruppe 44)=QS=“8“_46=QS=“10“_absteigend „40“_aufsteigend 77=QS=14_absteigend „0“ (Zelle)_aufsteigend Spalte 8/2=QS=“10“_absteigend Spalte 6/3=QS=“9“ mit „4“_Summe 1+8+10+40+14+0+10+9=“92“ mit 4_92 für „KANSL2“=492AS. Die gespaltene Zahl „86“ wird in Richtung TOKEN-86 als Versorgungsrichtung im Stofftransport passiert [KANSL2 - KAT8 regulatory NSL complex subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Histon“=103AS wird über die gemeinsamen Verbundzahl „23“ von „KANSL2“ und „KAT8“ mit den unterschiedlich als „08“ oder Spalte „8/0“ anliegenden Lysin=80E mit Summe 80+23=103AS enthalten [H4C1 - Histone H4 - Homo sapiens (Human) | UniProtKB | UniProt]. Der NSL-Komplex markiert Histon-Proteine, die im Zellkern um die DNA gewickelt sind. Anderen Regulatoren wird damit signalisiert bestimmte Gene der DNA einzuschalten. Hierzu gehören Gene die am Materialtransport im Zilum beteiligt sind. „Zilien“ sind röhrenförmige Zellausstülpungen, die ein Skelett aus Mikrotubuli enthalten [News Details - CIBSS Centre for Integrative Biological Signalling Studies (uni-freiburg.de); Transcriptional regulation by the NSL complex enables diversification of IFT functions in ciliated versus nonciliated cells | Science Advances; A. Akhatar u.a.; Aug 2023; DOI: 10.1126/sciadv.adh5598]. Im Laborexperiment werden die Zilien mittels „Ac-α-Tubulin“ grün eingefärbt. Die Acetyltransferase „αTAT1“ katalysiert die „Lysin-40-Acetylierung von alpha-Tubulin (Ac-α-Tubulin)“ und stabilisiert die Mikrotubuli. „αTAT1 (ATAT1)“ ist an der „DNA-Schadensantwort (DDR)“ beteiligt. [Die Rolle der α-Tubulin-Acetyltransferase αTAT1 bei der DNA-Schadensantwort - PubMed (nih.gov); J. Kim u.a.; Sep 2020; DOI: 10.1242/jcs.246702]. Das Protein (Mensch) „ATAT1“ {}=409AS liegt in der Spalte Z.38371#38371_[39]!1![37438]/#_!4!1(4!6)(“3“)x6x“3“[6]/#_@4{(4@0)@}{0}(8)x(6)x[16]/#_@4@[6]@7@{7}({2}3)[63] über Z.38373 als „40“_Spalte „0/7“(Null von Lysin=80)=QS=7_2 mit „40“_Summe 7+2=“9“ für „ATAT1“=409AS“ [ATAT1 - Alpha-tubulin N-acetyltransferase 1 - Homo sapiens (Human) | UniProtKB | UniProt ; ATAT1 unterscheidet sind von tierischem ATAT1 mit 421AS bei denen Glutamin (Gln/Q)=C5H10N2O3=30+10+14+24=78E für die Katalyse wirksam wird.] „ATAT1“ benötigt für die Katalyse Lysin=80E und Acetyl-CoA=422E. „ATAT1“ ist für die Funktion von Spermiengeißeln erforderlich. Das „Beta-Tubulin“ (!!)=451AS ist direkt am Härchen „1“ für KANSL2 in Z.38371#_[39]!1!/#_!4!14! als „4“_QS1+4=“5“_“1“ mit 4_5_1 für Beta-Tubulin“=451AS lokalisiert. Das erforderliche Alpha-Tubulin (@@)=451AS folgt am Lysin=80 (gespiegelt 08) im Heterodimer als „4“_absteigend „44“_aufsteigend Spalte 0/7=QS=“7“ mit „4“_Summe 44+7=“51“ für „Alpha-Tubulin“=451AS. Die Männlichkeit der Spermien „33“ wird in der Spalte „3“x6x“3“/[8]x6x[1] mit der Weiblichkeit „66“ als Spalte x6x/x6x gekreuzt. „Acetyl-CoA“ ()=422E als 40 (am Lysin „08“)=QS=“4“_absteigend Kunstgriff 46=QS=10 für „0“_aufsteigend Spalte 3/8=QS=11=QS=“2“_23=QS=“5“_absteigend „6“ mit „4“_Summe 0+2=“2“ mit „42“_Summe 5+6=11=QS=“2“ mit 42_2 für „Acetyl-CoA“=422E.
Die Serin/Threonin-Proteinkinasen „ATM“ und „ATR“ werden bei genotoxischem Stress aktiviert und fungieren zusammen mit „ATAT1“ {}=409AS als DNA-Schadensensor, und zwar mit „ATM“ in der Spalte Z.38371#_[391](3)(7)[438]/#_[4]|(1§4)(6)|§(3)|!63!§6§/#_|4{4|§0}!{0}|§8|![616]/#_[46]§7§{72}[363]. Die Katalyse benötigt ATP (!!)=260E in der Spalte Z.38372#_!6!3/#_!0!8! über 3/8=QS=11=QS=“2“_“6“_“0“ für ATP (!!)=260E. Das ADP (||)=228E wird nach links erweitert erzeugt, und zwar absteigend über Spalte 3/8=QS=11=QS=“2“_146=QS=11=QS=“2“_aufsteigend 44=QS=8 mit 2_2_8 für ADP (||)=228E. Das Protein (Mensch) „ATM“ ()=3056AS als „3“_aufsteigend Spalte 7/3=QS=10 für „0“_mit Serin=56E in 146 als QS1+4=“5“_“6“ mit 30_5_6 für „ATM“ ()=3056AS. „ATM“ wird durch den Wirkstoff „Wortmannin“=C23H24O8=138+24+64=226E gehemmt, weil der rechte Rand komplett summiert wird, und zwar als Spalte 8/6/6=QS=“20“_Spalte 43/63 für „106“_37/63 für „100“ mit Summe 20+106+100= Wortmannin=226E [ATM - Serine-protein kinase ATM - Homo sapiens (Human) | UniProtKB | UniProt]. „ATM“ interagiert mit „PEX5“, indem „PEX5“ vom rechten Rand über „ATM“ zum Ubiquitin=76AS in die Spalte „6/0/7“ geleitet wird. Das Protein (Mensch) „PEX5“ (§§)=639AS als „6“_363=QS=“12“_46=QS=“10“_00=“0“_“7“ mit „6“_Summe 12+10 +0+10+7=“39“ mit 6_39 für „PEX5“ (§§)=639AS [PEX5 - Peroxisomal targeting signal 1 receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „ATR“ („“)=2644AS liegt seitlich an „ATM“ und besitzt den unsichtbaren Cofaktor „Magnesium“=12E, und zwar in der Spalte Z.38371#_[391](3)(7)“43“[8]/#_[4](14)(6)(3)“63“6/#_“4{4“0“}{„0“}“8“61“[6]/#_467{7“2}“3“[63]. Der Cofaktor markiert einen Wendepunkt in [86]1[6]/236[3] als 236=11_1 mit Summe 11+1=12 für Magnesium=12E, wobei die Ziffer „6“ als Wegweiser extern bleibt. ATR-Startspalte mit Threonin=64E in „43/63“ aufsteigend für QS7+9=“16“_ Wendestelle „8“61“/“2“3“[6] mit 61=QS=“7“_“3“ mit Summe 16+7+3=“26“_absteigend Kunstgriff Spalte 8/2=QS=10 für „0“_00=QS=“0“_“44“ mit 26_Summe 0+0+44=“44“ mit 26_44 für „ATR“ ()=2644AS. Über die Nullstrecke „4“00 kann die Kinase mit der Ziffer „6“ von Serin=56 mit der Ziffer „4“ zu Threonin=64E als Kombination 56/64 ergänzen [ATR - Serine/threonine-protein kinase ATR - Homo sapiens (Human) | UniProtKB | UniProt]._dat11.03.2024
Checkpoint:+++++++++++++++++++++
Pisse überstrahlt den Sonnenaufgang
Zirkadianer Rhythmus / Kern-Uhr-Proteine: Der tägliche zirkadiane Rhythmus wird u.a. durch Licht und Temperatur gesteuert, indem bei Tagesbeginn und Lichteinfall die Transkription vom „BMAL1“ und „PER2“ beginnt. Die Transkripte verlassen den Nucleus und werden im Zytoplasma modifiziert. Bei steigender Konzentration bilden „PER2“ und „CRY“ ein Dimer und gelangen zurück in den Nucleus [Zirkadianer Rhythmus - DocCheck Flexikon]. Das setzt einen Mechanismus in Gang, bei dem Proteine in einer bestimmten Reihenfolge dimerisieren. „CLOCK“-„BMAL1“ sind am Tage maßgeblich. Unter Isolationsbedingungen wird beim Menschen statt 24 Stunden ein Rhythmus von 28 Stunden festgestellt, so dass 4 Stunden täglich von der SCN-Zentraluhr verkürzt werden müssen [„Zirkadiane Rhythmen und Hormonsekretion, Abb. 18.1: Das molekulare Uhrwerk“; Thieme E-Books & E-Journals (thieme-connect.de)]. Ein Zusammenhang von „24“ Stunden und der Zahl „28“ ergibt sich aus der Wirkung von „Vasopressin“, das mit der Rückgewinnung von Wasser „28“ (Symbol) über die Nieren in Beziehung steht. Das Homodimer „HNF4A“ hemmt das Heterodimer „CLOCK-BMAL1“. Das Dimer „CLOCK-BMAL1“ ist für zirkadianen Rhythmus zuständig, der Körperfunktionen im 24-Stunden-Takt synchronisiert. Das Heterodimer stimuliert die Transkription von „Per1-3“ und „Cry1-2“. „PERs“ und „CRYs“ heterodimerisieren anschließend und translozieren zurück in den Zellkern. Die Aktivität von „CLOCK-BMAL1“ wird dadurch gehemmt. „PERs/CRYs“ hemmen damit ihre eigene Transkription, wodurch „CLOCK-BMAL1“ über eine Rückkopplungsschleife wieder aktiviert werden. Die Serie #1610 enthält über eine weite Strecke keine lesbare Zeitbasis „24“. „HNF4A“ verlängert „Calcium“=20E horizontal zu „Zink“ und „BMAL1“ verlängert dieses Calcium in Konkurrenz in der Spalte 20/[3]4 zur Zeitbasis 20+4=“24“ für den täglichen zirkadianen Rhythmus. Das Protein (Mensch) „BMAL1“ {}=626AS steigt an der Grenze in Z.38365 auf, und zwar in der Spalte Z.38365#_[29]{7}[75645]/#_[3]{07}[88788]/#_[3]{202}[0816]/#_[3]{347}[1712]/#_[3](51414)[59]/#_[3](70)(300)[40]/#_(391)(37)(43)(8)/#_(414)(63)(63)[6]/#_[44008616] über die Spalte 7/7 für „77“_links “0“_aufsteigend 202_347 mit Summe 77+0+202+347=“626“ für BMAL1“ {}=626AS [BMAL1 - Basic helix-loop-helix ARNT-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CLOCK“ ()=846AS folgt „BMAL1“. „CLOCK“ muss ebenfalls die Zeitbasis „24“ nachweisen, so dass mit 846AS minus 24 (Symbol)=822AS als Rest verbleiben. Davon kann am Ende eine lesbare Motivationszahl „400“ subtrahiert werden, so dass der Rest=422AS gemäß Katalyse „Acetyl-CoA“=422E entspricht. Somit bindet „CLOCK“ an „BMAL1“ mit 22AS, weil der Rest „400“ dem Coenzym A(CoA)=C21H36N7O16P3S=126+36+49+128+45+16=400E entspricht. Aufgrund einer Zahl „300“ muss „CLOCK“ für die korrekte Leserichtung aus Zeile Z.38372 absteigen. Die lesbare Motivationszahl „400“ wird alternativ über die Spalte „391/414“ zusammengesetzt. „CLOCK“ ()=846AS bildet am Rand zunächst die Zeitbasis „24“ in Z.38371 über Randspalte „438“/“63“[6] als Schleife „8“_aufsteigend 3/3=QS=“6“_absteigend 4/6=QS=“10“ mit Summe 8+6+10=“24“(Zeitbasis)_aufsteigend Spalte 37/63 mit „24“_Summe 37+63=“100“_Spalte 391/414 mit „391“_414=QS=“9“ mit Summe 24+100+391+9=“524“_absteigend 70=QS=“7“_“300“_absteigend 51414=QS=“15“ mit Summe 524+7+300+15=“846“ für CLOCK“ ()=846AS. An der Bindungsstelle von „CLOCK-BMAL1-Heterodimer“ liegt Adenin=C5H5N5=30+5+35=70E, das links neben der Zahl „300“ vorliegt. „CLOCK|NPAS2-BMAL1|BMAL2-Heterodimer“ bilden den positiven Teil der Rückkopplungsschleife, die Kernuhr-Gene „PER1/2/3“ und „CRY1/2", die transkriptionelle Repressoren sind, bilden den negativen Teil“ [CLOCK - Circadian locomoter output cycles protein kaput - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PER1_Period Circadian Regulator 1“ (||)=1290AS liegt aufsteigend auf „CLOCK“ und nimmt am Rand dessen unlesbare Zeitbasis „24“ auf, und zwar in der Spalte Z.38369#_|3|514|[1459]/#_|3|70|30|[040]/#_[391]|37|438|/#_[414]|63|636|. „PER1“ (||)=1290AS in Z.38369 über 514=QS=“10“_links aufsteigend Spalte 3/3=QS=“6“_“70“_“30“ mit Summe 10+6+70+30=“116“_aufsteigend Spalte 37/63=QS=“100“_“636“_absteigend „438“ mit Summe 116+100+636+438=“1290“ für „PER1“ (||)=1290AS [PER1 - Period circadian protein homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PER2“ (!!)=1255AS steigt in „CLOCK“ an der Bindung zu „BMAL1“ bis zur Grenze auf, um die „BMAL1-Zeitbasis“ „24“ aufzunehmen. „PER2“ (!!)=1255AS liegt in der Spalte Z.38365*)#_[29]!77![5645]/#_[30]!78![8788]/#_[3]!202![0816]/#_[3]!347![1712]/#_|3|!514!|[1459]/#_|!3|7!0|30|[040]/#_[391]|37|438|/#_[414]|63|636|, und zwar in Z.38370 als „37“_lotrecht absteigend „514“_absteigend „347“_absteigend „202“_absteigend „78“_absteigend „77“ mit Summe 37+514+347+202+78+77=“1255“ für „PER2“ (!!)=1255AS [PER2 - Period circadian protein homolog 2 - Homo sapiens (Human) | UniProtKB | UniProt]. *)Z.-Nr.berichtigt_dat25.06.2024
„PER2“ teilt sich den Startbereich mit „PER1“, so dass zeitgleich kein Heterodimer „PER1-PER2“ vorliegt. „PER2“ ist für den Rhythmus bedeutender und reguliert „PER1“ [Neurobiologische Funktionen des Perioden-circadian-Clock-2-Gens, Per2 - PMC (nih.gov); H. Kim u.a.; Jul. 2018; doi: 10.4062/biomolther.2017.131].
Das Protein (Mensch) „PER3“ (§§)=1201AS (Monomer) stabilisiert „PER1“ und „PER2“ als Monomer und zeigt sich doppelt als Homodimer. Der Einfluss auf den Tagesrhythmus ist unbedeutend, weil „PER3“ die beiden Zeitbasen „24“ (**) von BMAL1 / CLOCK“ nur tangiert und über die Kopplungsspalte einen Kurzschluss initiiert. Aufgrund der Sperrzahl „300“ ist „PER3“(Monomer) absteigend ausgerichtet. „PER3“ (§§)=1201AS liegt in der Spalte Z.38366#_§307§[88788]/#_[32]§0*20*8§[16]/#_[33]*4*§717§[12]/#_[351]§414§[59]/#_^370^§30§0§[40]/#_^391^§37§*4*§*3*8*/#_^414^[63]§*6*§^*3*^[6]/#_^4400^861^[6], und zwar in Z.38372 absteigend über Spalte 4/6=QS=“10“_37=QS=“10“_“30“_“0“ mit Summe 10+10+30+0=“50“_absteigend „414“_absteigend „717“ mit Summe 50+414+717=“1181“_absteigend 208=QS=“10“_absteigend 7/0(aus Calcium)=QS=“7“_30 nach links=QS=“3“ mit Summe 1181+10+7+3=1201AS (Monomer) für „PER3“ (§§)=1201AS. Fortsetzung „PER3“ (^^)=1201AS (Homodimer) in Z.38370 als „370“_aufsteigend „391“_aufsteigend „414“ mit Summe 370+391+414=“1175“_aufsteigend 4400=QS=“8“_861=QS=“15“_absteigend „3“ mit Summe 1175+8+15+3=“1201“ für „PER3“ (^^)=1201AS (Homodimer) [PER3 - Period circadian protein homolog 3 - Homo sapiens (Human) | UniProtKB | UniProt].
„CRY1“/„CRY2“ bilden zusammen mit PER1/2/3 den negativen Teil der Rückkopplungsschleife der Kern-Uhr. „CRY1“/ „CRY2“ besitzen gemeinsam 2 verschiedene Cofaktoren, und zwar in der Spalte Z.38365#_[77]$5$;64;€5€/#_[78]$8$;78;€8€/#_[02]$0$;81;€6€/#_[47]$1$;€71€;€2€/#_µ1µ4µ$1$4$59/#_[0]µ3µ004µ[0]. Am Fußpunkt sitzt der gemeinsame Cofaktor „Flavin-Adenin-Dinukleotid (FAD)“ (µµ)=C27H33N9O15P2=162+33+63+120+30=408E in Z.38370 mit „004“ nach links für „400“_absteigend Spalte 4/3=QS=“7“_“1“ mit Summe 400+7+1=408 für FAD (µµ)=408E. „PER2“ bildet ein Heterodimer mit „CRY“ (welches?). Zutreffend ist das „CRY1“ rechts neben „PER2“ liegt. „CRY2“ kann außen vom rechten Rand starten, mittels Kunstgriff die Spalte des 2.Cofaktors passieren und in der Endposition die CRY1-Position besetzen. Das wäre funktionell erforderlich, zumal „CRY1“ und „CRY2“ redundant sind [CRY1 Gene - GeneCards | CRY1 Protein | CRY1 Antibody]. Ein real mögliches Heterodimer „CRY1–CRY2“ ist mit diesen Annahmen aufgrund der teilweisen Überlagerung nicht möglich. Der zweite Cofaktor „(6R)-5,10-methylen-5,6,7,8-tetrahydrofolat“ als Säure=C20H21N7O6= 120+21+49+48=238E [(6R,S)-5,10-Methenyl-5,6,7,8-tetrahydrofolic Acid | CAS 7444-29-3 | Cayman Chemical | Biomol.de] wird zweckmäßig als „5,10-Methenyltetrahydrofolat (MTHF)“=C20H23N7O6=240E gewählt. Cofaktor „MTHF“ (;;) in Z.38365 aufsteigend als Spalte mit Summe 64+78+81=“223“_71 nach links für „17“ mit Summe 223+17=“240“ für „MTHF“ (;;) =240E. „CRY1/CRY2“ liegen links und rechts am Cofaktor „MTHF“.
Das Protein (Mensch) „CRY1“ ($$)=586AS startet von Z.38365 neben dem nadelartigen Cofaktor „MTHF“ aufsteigend in der Spalte 5/8/0 für „580“_aufsteigend Spalte 1/1=QS=“2“_“4“ mit Summe 580+2+4=“586“ für „CRY1“ ($$)=586AS [CRY1 - Cryptochrome-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das kleine Molekül „KL001“ interagiert mit Cryptochrom (CRY) und verhindert den Ubiquitin-abhängigen Abbau von CRY, was zu einer Verlängerung der zirkadianen Periode führt.[Identifizierung von niedermolekularen Aktivatoren von Cryptochrom - PMC (nih.gov); T.Hirota u.a. doi: 10.1126/science.1223710]. „KL001“ mit (N-[3-(9H-carbazol-9-yl)-2-hydroxypropyl]-N-(2-furanylmethyl)-methansulfonamid)=C22H22N2O3S=132+22+14+24+16=208E bindet an CRY1 [hier aber nicht seitlich, sondern mit Einbindung]. Diese 208E sind in Z.38367 in der Spalte 0„208“/4717 zwar zur Motivation lesbar, müssen aber die Zählung von Ubiquitin=76AS am Ende von „CRY1“ verhindern, um dessen Abbau zu hemmen. Der Ring aus 47=QS=11=QS“ =“2“_absteigend „0“_Kunstgriff 208=QS=10 für „0“_aufsteigend 17=QS=“8“ mit „20“_Summe 0+8=“8“ mit 20_8 für 208E verhindert Ubiquitin. Der Ring besetzt zugleich FBXL3=428AS [FBXL3 - F-box/LRR-repeat protein 3 - Homo sapiens (Human) | UniProtKB | UniProt], das ebenfalls CRY1 abbaut.
Das Protein (Mensch) „CRY2“ (€€)=593AS startet in Z.38365 absteigend über die Randspalte 5/8/6 für „586“_aufsteigend „2“_seitlich 71(im Cofaktor)=QS=“8“ mit „586“_Kunstgriff 2+8=10 für „0“_ in CRY1-Position Spalte 1/1=QS=“2“_“4“ mit „586“_Summe 0+2+4=“6“ mit Summe 586+6=593 für „CRY2“ (€€)=593AS [CRY2 - Cryptochrome-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) “NPAS2“ (°°)=824AS ist eine Kernkomponente der Uhr in der Spalte Z.38369#_°51°414°59°/#_°70°30°04°0°/#_~91~°37°°43°8°/#_~14~°63°[6]°36°_/#[4]~0086~[16]. Die Zeitbasis „24“ wird nicht speziell gesucht, weil sie bereits in der AS-Länge enthalten ist. Cofaktor ist Häm=C34H32FeN4O4=6*34+32+26+7*4+8*4=204+58+28+32=322E. NADH und NADPH= C21H26N7O17P3=126+26+49+136+45=382E verstärken die Aktivität des Heterodimers „NPAS2- BMAL1“, wobei „NPAS2“ analog zu „CLOCK“ wirkt. Die Aktivität von „NPAS2“ wird durch Kohlenmonoxid (CO)=6+8=14E gehemmt. „NPAS2“ soll in Z.38372 mit Start und Ziel in „63“ [6] „36“ eine Schleife mit gespiegelten Enden bilden. Die Trennziffer „[6]“ wird in der Spalte 4/0/4/6=QS=14 für CO=14E hemmend von Kohlenmonoxyd besetzt. Im Gegensatz dazu erzeugt „NADPH“= 382E eine Ringklammer, und zwar in Z.38370 aufsteigend über „3“[00]_37=QS=“10“_aufsteigend „63“ _63=QS=“9“ mit „3“_Summe 10+63+9=“82“ mit 3_82 für “NPAS2“ (°°)=824AS. Durch die Mithilfe von NADPH wird die Endzahl „63636“=QS=24 für die Zeitbasis „24“(Symbol) aktiviert [NPAS2 - Neuronal PAS domain-containing protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Zeitspanne von der Grenze bis zur Zeitbasis „24“ DELTA.TIME.EPI.VIR.Z.38365-Z.38372=#_293883120095231 enthält Calcium=20E, den Rhythmus als Ring „0“ und Calcium nochmals als Randzahl 95231=QS=“20“. Am linken Rand 29=QS=“11“ (Zählgröße)_“3883“ enthält die Haut „33“ den Wirkstoff „88“, der auf die Sonnenaktivität reagiert_“12“ ist halbtags im „24“ Stunden-Rhythmus. Die Evolution hat die Proteine passend zugeschnitten. „NPAS2“ und das Protein (Mensch) „EP300“ (~~)=2412AS interagieren zeitabhängig synchronisiert. „EP300“ wird als Coaktivator der Clock-Genexpression an „NPAS2“ rekrutiert. EP300=2414AS enthält ebenfalls die Zeitbasis „24“ in der AS-Länge und liegt links winkelförmig an „NPAS2“. Die Zeitbasis „24“ liegt in Z.3871 in der Spalte 91/14 mit 91=QS=10_14 mit Summe 10+14=“24“_aufsteigend 0086=QS=14 mit 24_14 für „EP300“=2414AS [EP300 - Histone acetyltransferase p300 - Homo sapiens (Human) | UniProtKB | UniProt].
„Vasopressin“ [Antidiuretic hormone (ADH) / Arginine-Vasopressin (AVP)] reguliert den Tagesrhythmus und die Schaltkreise der zirkadianen Uhr als Wirkstoff Vasopressin=C46H65N13O12S2=276+65+91+96+32=560E [Vasopressin | CAS 11000-17-2 | SCBT - Santa Cruz Biotechnology]. „Vasopressin“ ist ein Peptidhormon aus 9 Aminosäuren. Die Verarbeitung des Vasopressin-Prä-Pro-Peptids führt 1:1:1 zu 3 Peptiden: Wirkstoff „Vassopressin“; Trägermolekül für Vassopressin „Neurophysin II“ und „Copeptin“. Vasopressin wird hauptsächlich im Gehirn produziert. Der Vasopressin-V2-Rezeptor stimuliert die Niere [Polyklonaler Prä-Pro-Vasopressin-Antikörper (PA5-143640) (thermofisher.com)].
Das Neurohormon „Arginin-Vasopressin (AVP)“ verändert endokrine (Hormonausschüttung in die Blutbahn) und synaptische Signale. „Zirkadiane Rhythmen bei der AVP-Freisetzung und andere biologische Prozesse werden durch den suprachiasmatischen Kern (SCN) des vorderen Hypothalamus gesteuert“ [Vasopressin reguliert den Tagesrhythmus und die Schaltkreise der zirkadianen Uhr in einer Weise, die durch Sex beeinflusst wird - PMC (nih.gov); K. Rohr u.a.; Dez. 2020; 10.1016/j.yhbeh.2020.104888]. „AVP“ ist ein wichtiger SCN-Output, der nachgeschaltete Gewebe reguliert. Die „3“ AVP-Rezeptoren sind auf spezielle Gewebe ausgerichtet. „Vasopressin“ veranlasst die Nieren das Wasser aus dem Harn zurückzugewinnen, so dass weniger Urin entsteht. „Ethanol“ hemmt die Produktion von „Vasopressin“, so dass nach dem Trinken von Alkohol ein Gang zur Toilette folgt. Nikotingenuss bewirkt das Gegenteil. Im Prinzip wird das Wasser 28(Symbol) als Urin unlesbar „208“. Soll Wasser wieder gewonnen werden, wird es als „H2O“=„1_1_8“ zusammengesetzt, um wieder als Symbol „28“ umgeschrieben zu werden. Hierzu kreuzen sich in Z.38366 die Wasser-Spalte 8/1/1 in Z.38367 mit der Zeile „208“; die Spalte 8/2 für Wasser 28(Symbol) ist vorhanden. Das Neurohormon „Arginin-Vasopressin (AVP) bzw. Antidiuretisches Hormon (ADH), das Protein (Mensch) „AVP“ {}=164AS bindet an die Vasopressinrezeptoren [V1bR/AVPR1B, V1aR/AVPR1A und V2R/AVPR2) und liegt in der Spalte Z.38365#_[75]|645|/#_[88|7|{88}/#_[20]|8|{1}[6]/#_[7]|1|7|{1}{2}/#_[4]|1|45|[9], und zwar über die Randspalte 88/1[6]/12 als 88=QS=“16“_aufsteigend Spalte 1/1=QS=“2“_“2“ mit „16“_Summe 2+2=“4“ mit 16_4 für „AVP“=164AS. Die Randziffer „6“ ist eine trennende Kerbe im Wassersymbol „28“ in der Randspalte 8/[6]/2, seitlich liegt das Ziel einer Wasserrückgewinnung als Spalte 8/1/1 für H2O. Eine Disulfidbrücke „16-16“ (Schwefel) wird erst erkennbar, wenn ein Rezeptor auf der Ziffer „[6]“ liegt. Die Aminosäure „Arginin (Arg/R)“=C6H14N4O2=36+14+28+16=94E setzt sich aus der Startzahl {88} und der Kerbzahl [6] mit Summe 88+6=Arg=94E zusammen [AVP - Vasopressin-neurophysin 2-copeptin - Homo sapiens (Human) | UniProtKB | UniProt]. „Vasopressin“ (||) =560E zieht sich auf Elektronenbasis breiter, um die Anbindung von Rezeptoren zu ermöglichen, und zwar absteigend über die Randspalte 8/6/2 für „268“_Wende an der Grenze in Z.38365 mit Randzahl 645=QS=“15“ mit Summe 268+15=“283“ in Spalte aufsteigend „283“_Summe 78+81+71+45=“275“ mit Summe 283+275=“558“_links absteigend Spalte 1/1=QS=“2“ mit Summe 558+2=“560“ für „Vasopressin“=560E.
Der Vasopressin-V2-Rezeptor, das Protein (Mensch)=„V2_AVPR2“ (!!)=371AS wird in der Niere exprimiert und muss die Wasser-Rückgewinnung ermöglichen. Hierzu wird an das unlesbare Wasser „208“ hakenförmig links das Wasser-Symbol „28“ als Spalte 8/2 und rechts das zerlegte Wasser als 81/1 für H2O kombiniert. In der Wasserspalte „8/1/1“ wird die Ziffer „8“ nicht benötigt. Für den Empfang von „Vasopressin“ wird der rechte Rand besetzt, und zwar in der Spalte Z.38366#_!887![8]!8!/#_!*208**!1!6!*/#_[71]!7*1!2* als 887=QS=“23“_aufsteigend „208“_aufsteigend „71“_absteigend „1“_absteigend Spalte 8/6 für „68“ mit Summe 23+208+71+1+68=371 für „V2_AVPR2“ (!!)=371AS [AVPR2 - Vasopressin V2 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Arzneimittel „Tolvaptan“ (**)=C26H25ClN2O3=156+25+17+14+24=“236“E blockiert die Bindung von „Arginin-Vasopressin (AVP)“ am „V2-Rezeptor“ im distalen Bereich des Nephrons, der kleinsten Funktionseinheit der Niere. Hierfür wird der Funktionskern des V2-Rezeptors „208“ besetzt. „Tolvaptan“ in Z.38367 als „208“_über Randspalte 16/12 als „208“_Summe =16+12=“28“ (Wasser als Abgang) mit Summe 208+28=“236“ für „Tolvaptan“ (**) =236E [Tolvaptan - DocCheck Flexikon]. Für den Wassertransport ist speziell „Aquaporin-2“ zuständig. „Die Stimulation der Rezeptoren führt zu einer verstärkten Expression von Aquaporin-2 (AQP2) in der luminalen Membran der Sammelrohrzellen“ [Antidiuretisches Hormon - DocCheck Flexikon]. Das Protein (Mensch) „AQP2“ (~~)=271AS bindet links am V2-Rezeptor (!!) in der Spalte
Z.38366#_[0]~7~!887![8]!8!/#_[2]~0~!208!1!6!/#_[3]~4~71~!71![2] aufsteigend in der Spalte 7/0(Volumen)/4=QS=11=QS=“2“_“71“ mit 2_71 für „AQP2“ (~~)=271AS [AQP2 - Aquaporin-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Der Vasopressin-V1B-Rezeptor, das Protein (Mensch)=„V1b_ AVPR1B“ ($$)=424AS empfängt in der AS-Länge die Zeitbasis „24“, die am Zeilenrand in der Spalte 6/2 das Blut=26 (Symbol wie Eisen) mit enthält. Die Funktionszeile ist der Empfang von Wirkstoffen „88“ im Nerv „7“ markiert als „88_7_88“, die Kernzeile mit Wasserbezug „208“ bleibt erhalten, und zwar in der Spalte Z.38365#Grenze_[756]$45$/#_$88788$/#_$208$[1]$6$/#_$7171$2$ in Z.38365 als 45=QS=“9“_“88“_“7 (Nerv)“_“88“_“208“ (Funktionskern) mit Summe 9+88+7+88+208=“400“_7171=“16“_Spalte 6/2=QS=“8“ mit „400“_Summe 16+8=“24“(Zeitbasis) mit Summe 400+24=“424“ für AVPR1B“ ($$)=424AS [AVPR1B - Vasopressin V1b receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Der Vasopressin-V1A-Rezeptor, das Protein (Mensch)=„V1a_AVPR1A“ (€€)=418AS kann mit V1B-Rezeptor ein Dimer bilden. Ob eine Jacke, hier als „Wasserkonzept“, falsch zugeknöpft ist, wird erst am Ende festgestellt. Im Prinzip liegt der „V1A-Rezeptor“ exakt auf dem V1B-Rezeptor ohne die unnötige Kerbzahl „[6]“ mit V1a = V1b (“424“AS) – Kerbzahl („6“AS) für „V1a“=418AS. Einem Hetero-Dimer „V1a-V1b“ wird eine „Volumen-Suche“ zugeschrieben, um das gewonnene Wasser in einer Zisterne zu lagern. „V1a_AVPR1A“ (€€)=418AS als Hetero-Dimer links an „V1b“ mit einem Volumen „0“ und dem gespeicherten Wasser in Z. 38366 über Spalte „0/2/3/5“ aufsteigend mit 0+2=QS=“2“ mit „2“_Summe 3+5=“8“ mit 2_8 für „Zisternen-Wasser“ 28(Symbol), und zwar in der Spalte Z.38366#_€0€7€[88788]/#_€2€€0€[20816]/#_€3€€4€[71712]/#_€5€1€[41459]. Die Startspalte wird summiert zu Summe 2+8=“10“_Spaltenwechsel „1“_absteigend Spalte „7/0/4“ für 407 mit Summe 10+1+407=“418“ für „V1a_AVPR1A“ (€€)=418AS. Die Endziffer „7“(Nerv) ergibt im Dimer eine volle Besetzung der Dopplung „7“88788 als Besonderheit. Die Spalte „7/0/4“ wird mit Aquaporin-2 seitlich am V2-Rezeptor geteilt [AVPR1A - Vasopressin V1a receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Nur weil die zuständige Nebenniere an der Niere liegt, kann das Stresshormon „Hydrocortison (Cortisol)“ {} =C21H30O5=126+30+40=196E ohne direkten Zusammenhang links neben dem Vasopressin-Rezeptor „V1a_AVPR1A“ (€€) liegen. „Cortisol“ folgt dem zirkadianen Rhythmus und liegt in der Spalte Z.38365#_[98329775645]/#_[94]{1}{3}0€7€[88788]/#_[89]{9}{3}€2€0€[20816]/#_[8573]€3€4€[7171}/#_[8153]€5€1€[41459], und zwar in Z.38366 in der Spalte „1“3/“9“3 mit Spalte 1/9 für „19“_3/3=QS=“6“ mit 19_6 für „Cortisol)“ {}=196E [Cortisol – Wikipedia]. Der Gegenspieler, das „Melatonin“ senkt das „Cortisol“ abends ab. Die maximale Ausschüttung von „Cortisol“ ins Blut erfolgt in der 2. Nachthälfte, steigt erneut beim Aufwachen (CAR=Cortisol awakening response) an und reduziert sich im Tagesverlauf. „Cortisol“ wird von der Nebenniere produziert, die auf der paarigen Niere sitzt. Die Ausschüttung von „Cortisol“ wird von Hormonen stimuliert. „Proopiomelanocortin (POMC) (!!)=267AS, das von „CRH (Corticotropin-Releasing-Hormon)“ stimuliert wird, ist ein Vorläuferprotein von „7“ Peptidhormonen. Die„3“ Hormone der oberen Teilungsebene liegen in „POMC“ (!!). In der Spalte 8[3]/4“1“ kann die Ziffer „1“ kann aber nicht mit ausgefüllt werden. Wird darin „1“ Photon für den Lichteinfall als externer Input eingesetzt, liegt das „1“ Photon neben der Schwerachse, um das Aufwachen darzustellen. Die Biologie reagiert auf „1“ Photon. Es müsste die Zeitbasis „60“ gefunden werden, um die maximale Cortisol-Ausschüttung von 30min=30*60=1800Sek nach dem Aufwachen zu entdecken (aufwachen=senkrecht=Schwerachse). Erst das „1“ Photon stellt die Zeitbasis „60“ in der Spalte 8[3]29/4“1“30 mit „1“+“30“_absteigend „29“ mit Summe 1+30+29=“60“ her. Die gesuchte Zahlenfolge 180… ist als „1“_absteigend 32=QS=“5“_aufsteigend „3“ mit „1“_Summe 5+3=“8“_“0“ mit 1_8_0 vorhanden. Das „Photon“ erzeugt als externer Zugang eine Kommastelle für 1,80… und die Zahl 30 einen Potenzfaktor 10^3 für „1800 Sekunden“. Das „Melatonin“=C13H16N2O2=78+16+14+16=124E aus der Zwirbeldrüse (Epiphyse) muss zum Vergleich als Gegenspieler gefunden werden [Melatonin – Wikipedia]. Das Schlafhormon „Melatonin“ ignoriert das „1“ Photon bei Lichteinfall mit der Zeitbasis „24“ für den zirkadianen Rhythmus. Folglich kann auch keine Zeitbasis „24“ gefunden werden, sondern nur halbtags „12“_4 für Nacht. „Melatonin“ bindet an die Melatoninrezeptoren MT1 und MT2. Das Protein (Mensch) „MT2 (MTNR1B)“=362AS ist mit einer angehängten Beziehung zum Calcium weitgehender und schließt MT1 (MTNR1A)=350AS mit ein. Das „MT2 (MTNR1B)“=362AS liegt in der Spalte Z.38365#_[98]“3“2“9“…/#_...[94]“1“3“0“/#_[8993]“2“... in Z.38365 als „3“_aufsteigend 13=QS=“4“_aufsteigend „2“ mit „3“_Summe 4+2=“6“_absteigend Spalte 9/0/2=QS=11=QS=“2“ mit 1_6_2 für „MT2“=362AS, wobei Calcium aufsteigend in der Spalte 0/2 einwirkt [MTNR1B - Melatonin receptor type 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Für das nachts wirkende „Melatotin“ wird die Photon-Ziffer „1“ umgangen, weil sie für „Cortisol“ reserviert ist. Melatotin=124E liegt in der Spalte Z.38365#_[9]“8“3“2“9“…/#_...[9]“4“[1]“3“0“/#_[8993]“2“..., und zwar absteigend links neben der Ziffer [1] über die Spalte 8/4=QS=“12“_“3“_ aufsteigend Spalte 2/3/3=QS=“8“ mit „12“_Summe 3+8=11=QS=“2“_absteigend Spalte 9/0/2=QS=11=QS=“2“ mit „12“_Summe 2+2=“4“ mit 12_4 für „Melatonin“=124E. Der „Calcium-Spiegel“ sinkt bei der Einnahme von „Melatonin“ [Kalzium spielt eine zentrale Rolle bei der Melatonin-Antitumoraktivität in Sarkomzellen - PMC (nih.gov); V. Martin u.a; Mai 2022; doi: 10.1007/s13402-022-00674-9].
Das Protein (Mensch) „Proopiomelanocortin (POMC) (!!)=267AS liegt in der Spalte Z.38365#_!98!!3!2!9![775645]/#_!94!{!1!}{!3!}!0!€7€[88788]/#_[8]!9!{!9!}{!3!}€2€0€[20816]/#_[8573]€3€4€[7171}/#_[8153]€5€1€[41459], und zwar in Z.38365 als „98“_aufsteigend „94“ mit Summe 98+94=“192“_aufsteigend 99=QS=“18“_absteigend Spalte 3/1 für „13“_“2“_aufsteigend Spalte 9/0=QS=“9“_aufsteigend Spalte 3/3 für 33 mit Summe 192+18+13+2+9+33=“267“ für POMC (!!)=267AS. Die Signalübertragung mittels Calcium erfolgt, weil „2“ Zeilen am linken Serienrand #16“10“ mit 10+10=Calcium=20E binden [POMC - Pro-opiomelanocortin - Homo sapiens (Human) | UniProtKB | UniProt - Pro-opiomelanocortin - Homo sapiens (Human) | UniProtKB | UniProt].
Das linke POMC-Fragment „Gamma-MSH“ (||)=“Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-NH2” wird als Mischung von “11”AS+NH2=7+2=”9”E symbolhaft mit Summe 11AS+9E=”20” gezählt. Ein Anteil “1” fehlt, um mit den “3” Proteinen “POMC” lückenlos zu füllen. „Gamma-MSH“ (||)=20 (Symbol) liegt in der Spalte Z.38364#[16110”25”2…]/Grenze/#[1610]|9|83|[2…]/#[16109413…] in Z.38365#_983… als „9“_“83“ mit „NH2”=9E und 83=QS=11 für 11AS und Summe 9+11=”20” (Symbol). „Gamma-MSH“ (||) aktiviert die Rezeptoren „MC1“ und „MC3-5“ [Gamma-Melanozyten-stimulierendes Hormon – Wikipedia]. „MC1“=317AS ist bereits in „Gamma-MSH“ (||) enthalten, und zwar als „3“_98=QS=“17“ mit 3_17 für „MC1“=317AS [MC1R - Melanocyte-stimulating hormone receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „MC3“ =323AS liegt in Z.38365 in der Spalte 32/3 für MC3=323AS. „MC4“=332AS in Z.38366 als „1“_absteigend „32“ mit Summe 1+32=“33“_“2“ für MC4=332AS. Die Rezeptoren liegen zugleich auf der POMC-Ebene. Eine Einbindung von „MC5“=325AS ist unbekannt, weil die Zahl „25“ in der Spalte „25“/[8]“3“ außerhalb von „POMC“ in Z.38364 liegt. Das Arzneimittel „Bremelanotid“ [Vyleesi]=C50H68N14O10=300+68+98+80=546E ist ein künstlicher Melanocortin-Rezeptor aus „7“AS zur Regulation der Sexualität. Zur Funktionalität wird die Zahl 33+33=“66“ als 480+“66“=546E gesucht, und zwar in der Spalte Z.38364#_[0]“25“[2]…/Grenze/#_[9]“8“3“2“…/#_[9]“4“1“3“…/#_ [899]“3“… /#_[857]“3“… passend in Z.383“66“ absteigend über Spalte 8/4 für „48“_25(Grenze)=QS=“7“_aufsteigend „3“ mit „48“_Summe 7+3=10 für „0“ als „480“ mit „480“_aufsteigend Spalte 2/3 für „23“_Spalte 1/9=QS=“10“_aufsteigend Spalte 3/3 für „33“ mit Summe 480+23+10+33=“546“ für „Bremelanotid“ =546E.
Das rechte POMC-Fragment „Beta-Lipotropin“ (°°) besteht aus 90 AS und liegt in der Spalte Z.38365#_[9832]°9°…/#_[9413]°0° mit 9/0 für 90 als „Beta-Lipotropin“ (°°) =90AS [Lipotropin – Wikipedia].
Das mittlere POMC-Fragment, „Adrenocorticotropin /Corticotropin (ACTH)“ () besteht aus 39 Aminosäuren [ACTH - DocCheck Flexikon]. „ACTH“ ()=39AS und liegt in der Spalte Z.38365#_|9|83|*(2)°9°[7*]…/#_(94)[1](3)°0°[7]…/#_[8](99)(3)[2]…, und zwar in Z.38366 als 94=QS=“13“_99=QS=“18“_absteigend Spalte 2/3/3=QS=“8“ mit Summe 13+18+8=“39“ für „ACTH“ ()=39AS.
Der ACTH-Rezeptor, das Protein (Mensch) „MC2R“ (**)= 297AS ist in Z.38365 lesbar. „Dieser Rezeptor wird durch G-Proteine (G(s)) vermittelt, die die Adenylatcyclase (cAMP) aktivieren“ [MC2R - Adrenocorticotropic hormone receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „cAMP“=C10H12N5O6P=60+12+35+48+15=“170“E steigt in „MC2R“ vorgelagert in Z.38364 als Schleife ab, und zwar über die Spalte 8/9=QS=17_52=QS=7 aufsteigend 3 (in „Gamma-MSH) mit 17_Summe 7+3=10 für „0“ mit 17_0 für cAMP=170E zur Stimulation ab.
Das Peptidhormon, das Protein (Mensch) „CRH_Corticotropin-Releasing-Hormon“ {}=196AS wird in Neuronen des Hypothalamus gebildet und gelangt in die Hypophyse, um die Freisetzung von „ACTH (Corticotropin)“.zu stimulieren. Die Länge von 196AS entspricht den 196 Elektronen von „Hydrocortison (Cortisol)“, trotzdem wird für „CRH“ eine alternative Position benötigt, und zwar zwischen „Cortisol“ auf der linken Seite und „Vasopressin“ am rechten Rand. „CRH“ {}=196AS liegt auf der Grenze in der Spalte Z.38364#_{28}{98}[1405]/#_{29}{77}[5645], und zwar als 28=QS=“10“_“98“_aufsteigend „77“_29=QS=“11“ mit Summe 10+98+77+11=“196“ für „CRH“ {}=196AS. „Induziert „NLRP6“ in Darmepithelzellen und kann daher das Profil der Darmmikrobiota beeinflussen“ [CRH - Corticoliberin - Homo sapiens (Human) | UniProtKB | UniProt]. Nach der Modifikation entfällt die Zählgröße „11“ und die Zahlen werden nur als Quersumme gezählt, und zwar mit 28=QS=“10“_98=QS=“17“_77=QS=“14“ mit modifizierte „CRH“-Summe 10+17+14=“41“AS. Die CRH-Position korrespondiert mit der Bindung der Rezeptoren „CRHR1 / CRHR2“. Aufgrund der zentralen Lage von „CRH“ kann „CRHR2“ mit dem „Vasopressin-V1B-Rezeptor“ ein Heterodimer bilden, so dass „CHR1“ auf die Position vom V1A-Rezeptor legen muss [V1b- und CRHR1-Rezeptor-Heterodimerisierung vermittelt synergistische biologische Wirkungen von Vasopressin und CRH | Molekulare Endokrinologie | Oxford Akademiker (oup.com); B.Murat u.a.; März 2012; https://doi.org/10.1210/me.2011-1202]. Über Bindung an „CRH-Rezeptoren“ erhöht „CRH“ die intrazelluläre cAMP-Konzentration und aktiviert u.a. die Proteinkinase A. Dadurch kommt es zur gesteigerten Synthese von Proopiomelanocortin (POMC), aus dem u.a. „ACTH“ abgespalten wird. Das Protein (Mensch) „CRHR1“ ()=430AS (Monomer) kann mit sich selbst ein erkennbares Homodimer bilden. Das Monomer liegt zunächst in der Spalte Z.38364#_[25]{28}{98}§1§[405]/#_|8|3|{29}{77}§5§[645]/#_|4|1|3|(0)(7)§8§8§[788]/#_[99]|3|(2)(0)§2§0§[816]/#_[57]|3|(3)(4)[7]§171§[2], und zwar in der Z.38366 absteigend über die Spalte 7/0/4 für „407“_aufsteigend über die Spalte 0/2/3 für „0“_“23“ mit „407“_Summe 0+23=“23“ mit Summe 407+23=“430“ für CRHR1“ ()=430AS (Monomer). „CRHR1“ (||)=430AS ergänzend als Homodimer in Z.38366 absteigend über die Spalte 3/3/3 für „333“_absteigend Spalte 3/1 für „13“_aufsteigend Spalte 8/4 für 84 mit Summe 333+13+84=“430“ für „CRHR1“ (||)=430AS (Homodimer) [CRHR1 - Corticotropin-releasing factor receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CRHR2“ (§§)=411AS in Z.38364 aufsteigend über Spalte 1/5/8 für „158“_aufsteigend Spalte 8/2 für „82“_“0“_aufsteigend „171“ mit Summe 158+82+0+171=“411“ für „CRHR2“ (§§)=411AS. Das durch die CRH-Rezeptorbindung gesteigerte „cAMP“ (zyklisches Adenosinmonophosphat) (!!) =170E wird im Bindungsbereich der Rezeptoren „CRH1-Homodimer“ und „CRHR2“ gefunden, und zwar in der Spalte Z.38365#_[3]{!29!}{!77!}[5645]/#_!1!!30!78![8788] in Z.38366 schleifenförmig an der Grenze als „1“_absteigend Spalte 29/30=QS=“14“ mit Summe 1+14=“15“_aufsteigend 77/78 mit 15_Summe 77+78=“155“ mit Summe 15+155=“170“ für cAMP (!!) =170E.
Die Serin/Threonin-Kinase „Proteinkinase A (PKA)“ wird durch „cAMP“ (!!) intazellulär aktiviert [Proteinkinase A - DocCheck Flexikon]. „PKA“ bildet 1 Heterotetramer aus 2 regulatorischen (R) und 2 katalytischen (C) Untereinheiten [„R2/C2“]. Weil mehr Isoformen bekannt sind, wird kombiniert. Diese Variation wird durch gleich lange Untereinheiten unterstützt, die im Zeilenlauf insgesamt einen Komplex bilden. Der „R2/C2“-Komplex ist inaktiv, weil das aktive Zentrum von „C“ blockiert wird. Nach Bindung von „cAMP“ zerlegt sich der Komplex in den R2-Komplex und „2“ getrennte, aktive „C“ [Proteinkinase A – Wikipedia]. „cAMP“=170E kann bei „4“ Molekülen eventuell auch als 4*170=680E in Erscheinung treten. „PKA“ verfügt variabel über „3“ katalytische Untereinheiten (PRKACA, PRKACB, PRKACG) und 4 regulatorische Untereinheiten, Typ I (PRKAR1A, PRKAR1B) und TYP II (PRKAR2A, PRKAR2B).
Um die Untereinheiten über ATP (@@) mit Energie zu versorgen, ist es zweckmäßig, das „ATP“ als Gemeinsamkeit in Spaltenform darzustellen. Entsprechend ist es dann auch sinnvoll, das cAMP=170E vertikal mit „4“ cAMP-Molekülen als „cAMP-Summe“ (&&)= =4*170=680E auszuweisen, und zwar in der Spalte Z.38364#_[2];5@2;8@[981405]/#_[8];3!2;@9@!!77![5]&6&[45]/#_[4]!1!;3@!0;@!78![8]&78&[8]/#_[993@;2@@0;20;@8]&1&[6]/#_[573]@3@@4@[7];1;[7]&1&[2]/#_[153]@5@1@;4;1;[459] über die Serin-/Threonin-Ziffer „6“ in Z.38365 als „6“_aufsteigend „78“_Spalte 1/1= QS=“2“ mit „6“_Summe 78+2=“80“ mit 6_80 für „cAMP-Summe“ (&&)=680E („4“ Moleküle). Damit können nur „2“ von „7“ Proteinen direkt aktiviert werden, so dass zur Verteilung 2 Einzelzählungen, horizontal und vertikal, notwendig sind. Horizontal für cAMP (!!)=170E wie zuvor ermittelt. Vertikal für cAMP (;;)=170E in Z38364 aufsteigend Spalte 52/32 mit Summe 52+32=“84“_aufsteigend 30_aufsteigend 20_20 mit „84“_Summe 30+20+20=“70“_aufsteigend Spalte 1/1 für „11“_14=QS=“5“ mit Summe 84+70+11+5=170 für cAMP (;;)=170E. „ATP“=260E wird 6-zeilig gekoppelt, und zwar in Z.38367 am Calcium 020=QS=“2“_aufsteigend Spalte 4/1=QS=“5“_ absteigend bis Z.38365 in Spalte 9/0/2/3/5 mit QS=“19“ mit Summe 2+5+19=“26“_absteigend in Z.38364 mit 28=QS=10 für „0“ mit 26_0 für ATP=260E. Das A-Kinase-Ankerprotein (Mensch) „AKAP18“ verankert „PKA“ an zellulären Kompartimenten, womit der Zugang zu den Substraten eingeschränkt wird. „AKAP18 (AKAP7_alpha+beta)=104AS bildet die Ziffer „4“ aus dem Doppel-Calcium mit 2020=QS=“4“ und zählt zuerst die Zahl „10“ aus der Natrium–Spalte „81/1“ [AKAP7 - A-kinase anchor protein 7 isoforms alpha and beta - Homo sapiens (Human) | UniProtKB | UniProt]. Weil es „2“ Natrium-Spalten „1/1“ gibt, kann „AKAP18 (AKAP7_gamma)=348AS den Natrium-Kanal hemmen oder fördern. Zur Förderung wird in der Variante über „3471“ mit „34“_QS7+1=“8“ nur „1“ der beiden Natrium=11-Ziffern besetzt [AKAP7 - A-kinase anchor protein 7 isoform gamma - Homo sapiens (Human) | UniProtKB | UniProt].
Das „C“-Protein (Mensch) „PRKACA“ (~~)=351AS besitzt eine Beziehung zum Calcium=20E, die links gekoppelt ist mit 3/3=QS=“6“_ und Dopplung 20_20=“40“ als QS=“4“ mit „64“ für „Calcium-Welle“. „ATP“ fehlt, aber in der Katalyse ist „ADP“=220E beteiligt. „PRKACA“ (~~) liegt in der Spalte Z.38367#_/#_[99320]~20~8~[16]/#_[5733471]~7~1~[2], und zwar als in Z.38367 als „20“ (Calcium)_rechts aufsteigend Spalte 8/7=QS=“15“(Phosphor) mit Summe 20+15=“35“_rechts “1“(aus 4-fach cAMP) mit 35_1 für „PRKAR1A“ (~~)=351AS. „Phosphoryliert eine große Anzahl von Substraten“ [PRKACA - cAMP-dependent protein kinase catalytic subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das „C“-Protein (Mensch) „PRKACB“ (//)=351AS liegt in der Spalte Z.38367#_[9]€9€$320$~20~8~[16]/#_[57]/33/47/1/~7~1~[2]/#_ [15]\351\[41459], und zwar in Z.38368 als „33“_(Cofaktor Mg=12) 47=QS=11=QS=“2“ mit 33+2=“35“_“1“ für „PRKAR1B“ (//)=351AS [PRKACB - cAMP-dependent protein kinase catalytic subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. „PRKAR1G“ (\\)=351AS in Z.38369 ist mit „351“ lesbar für „PRKAR1G“ (\\)=351AS [PRKACG - cAMP-dependent protein kinase catalytic subunit gamma - Homo sapiens (Human) | UniProtKB | UniProt].
Das „R“-Protein (Mensch) „PRKAR1A“ ($$)=381AS bildet eine vertikale Nadelform, so dass das vertikale „cAMP“ bindet. „PRKAR1A“ ($$) liegt in der Spalte Z.38364#_€2€5€$2${89}{81}{4}[05]/#_€8€3e$29${77}(56)[45]/#_€4€1€$30$(78)(8)(7)(8)[8]/#_[9]€9€$320$~20~8~[16]/#_[5]€7€/33/47/1/~7~1~[2]/#_ [15]\351\[41459], und zwar in Z.38364 als „2“_aufsteigend über Spalte 29/30 mit „2“_Summe 29+30=“59“ aufsteigend „320“ mit Summe 2+59+320=“381“ für „PRKAR1A“ ($$)= 381AS [PRKAR1A - cAMP-dependent protein kinase type I-alpha regulatory subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Mit gleicher Länge liegt „PRKAR1B“ (€€)=381AS linksseitig parallel. Die Angst-Reaktion=Aufschrecken=Schwerachse=“84“ und der Nerv=“7“ sind enthalten. „PRKAR1B“ (€€) in Z.38364 absteigend in Spalte 2/8/4 für 48+2=“50“_“5“_aufsteigend in Spalte 3/1/9 für „319“ mit Summe 50+5+319=“374“_aufsteigend „7“ mit Summe 374+7=“381“ für PRKAR1B“ (€€)=381AS [PRKAR1B - cAMP-dependent protein kinase type I-beta regulatory subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das „R“-Protein (Mensch) „PRKAR2A“ {}=404AS in Z.38364 als 89=QS=“17“_aufsteigend 77=QS=“14“ mit Summe 17+14=“31“_absteigend 81=QS=“9“ mit Summe 31+9=“40“_“4“ für 404AS [PRKAR2A - cAMP-dependent protein kinase type II-alpha regulatory subunit - Homo sapiens (Human) | UniProtKB | UniProt]. „PRKAR2B“ ()=418AS in Z.38366 als 78=QS=“15“_“8“_absteigend 56=QS=“11“_aufsteigend „7“ mit Summe 15+8+11+7=“41“_“8“ für „PRKAR2B“ ()=418AS. „Bindet Verankerungsproteine einschließlich der MAP2-Kinase“ [PRKAR2B - cAMP-dependent protein kinase type II-beta regulatory subunit - Homo sapiens (Human) | UniProtKB | UniProt].
Das Verankerungsprotein (Mensch) „MAP2“ {}=1827AS verbindet PRKAR2B“ () mit dem rechten Rand und besitzt eine Bindung an „Calmodulin“ und das „Tau-Protein“. Es bildet sich ein Komplex aus 4 Proteinen, und zwar mit „MAP2“ {} in der Spalte Z.38364#_[98]°14°0°[5]/#_[77](56)°4°5°/#_(78878){8}/#_[0208]{16}/#_€4€[717]{12}/#_€14€1€{45}{9}/#_[0300]$4$[0] in Z.38369 als 459=QS=“18“_absteigend 12=QS=“3“_absteigend „16“_“8“ mit „18“_Summe 3+16+8=“27“ mit 18_27 für „MAP2“ {}=1827AS. „Die genaue Funktion von MAP2 ist unbekannt, aber MAPs können die Mikrotubuli gegen Depolymerisation stabilisieren. Sie scheinen auch eine versteifende Wirkung auf Mikrotubuli zu haben“ [MAP2 - Microtubule-associated protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „CALM1_Calmodulin“ (%%) =149AS bindet an MAP2 über Z.38364 in der Randspalte 1405/(56)45 als „14“_aufsteigend Spalte 0/4=QS=“4“_“5“ mit „14“_Summe 4+5=“9“ mit 14_9 für CALM1=149AS. Die Wirkung von Tubulin „TUBA1A“ ($$)=451AS als Baustein der Mikrotubuli ist ersichtlich, weil die Startziffer „4“ in Z.38370 als 0“4“0 am Rand markiert ist, um in „MAP2“ in der Spalte „1/5“ als Einbindung abzusteigen mit 4_5_1 für TUBA1A=451AS. Ein 2. Tubulin, wie „TUBB1“ (€€)=451AS, bindet nicht ein, sondern legt sich seitlich an, und zwar in Z.38368 als „4“_aufsteigend 14=QS=“5“_“1“ für TUBB1“ (€€)=451AS.
Das Tau-Protein (Gen „MAPT“) mit 758AS ist für die Alzheimer-Krankheit (AD) von Bedeutung, und wird als „35_20_20_8“ für 75_8 zerlegt. Der Startanteil „35“ kann zwei verschiedenen Versionen folgen. Tau (!!) startet aufsteigend und ist eventuell die Normalvariante, die allerdings auf dem Alzheimer-Ast sitzt. Die Tau-Modifikation () startet absteigend in Z.38369 aus dem lesbaren „PRKACG“=351AS und bindet stabilisiert an „Tubulin“ =451AS. Nur dieser Tau-Ast wird vom radioaktiven Diagnosemittel erreicht, so dass der Befund dann nur den schrumpfenden gesunden Anteil darstellen würde.
Das Protein (Mensch) „Tau“ (!!)=758AS liegt mit „MAP2“ {} in der Spalte Z.38365#_[8329775645]/#_!41!30!78878{8}/#_[99](3)!(*20*)!(*20*)!(*8)!{1*6*}/#_[57]*(3)(3)*€4€[717]{12}/#_[15]*(3)*(5)€14€1€{45}{9}, und zwar in Z.38366 als 41=QS=“5“_“30“_aufsteigend „20“_“20“ mit Summe 5+30+20+20=“75“_“8“ für „Tau“ (!!)=758AS. Die Tau-Modifikation () bildet den Startanteil 5_30=“35“ alternativ. Die Alternative ergibt sich aus dem radioaktiven Diagnosemittel „Flortaucipir“ (**)=C16H10FN3=96+10+9+21=136E, das an Tau-Isoformen bindet. „Flortaucipir“ bindet an Tubulin (hier als TUBB1“ (€€) über die Gewebespalte 33/3[5] mit der Startziffer „Fluor“=“9“ in Z.38369 als „3“_aufsteigend 33 (Gewebe)=QS=“6“ mit Summe 3+6=“9“(Fluor)_aufsteigend „2020“ als „9“_Summe 20+20=“40“_“81“_“6(„Randziffer) mit Summe 9+40+81+6=„Flortaucipir“ (**)=136E. Tau-Modifiakation ()=758AS mit dem alternativen Startanteil „35“ in Z. 38368 in der Spalte 33/35 als „3“_absteigend in 3/5=QS=“8“ mit Summe 3+8=11=QS=“2“_absteigend in Z.38367 in Spalte 3/3 für „33“_2020 für „40“ mit Summe 2+33+40=“75“_“8“ für Tau-Modifikation ()=758AS [MAPT - Microtubule-associated protein tau - Homo sapiens (Human) | UniProtKB | UniProt].
Die Entwicklungszeit der Erkrankung hängt an der Calcium-Dopplung 3“2020“/1, und zwar rechts mit der Spalte „20/1“ für 21 Jahre und links für Zeitbasis „365“=1Jahr, und zwar mit „320“ und Rest „45“ über eine Spalte 4[7]/14 mit Tubulin(TUBB1)-Einbindung über Spalte 4/1 für „41“_“4“ mit Summe 320+41+4=Zeitbasis=“365“=“1“ Jahr. Der Anteil der unbedenklichen Modifikation reduziert sich dann ständig. Bei Arzneimittel-Studien zum Antisense-Oligonukleotid (ASO) „MAPTRx (ISIS 814907/BIIB080)“ wird das Ziel verfolgt, die Konzentrationen von MAPT-Boten-RNA zu reduzieren.
Ein weiterer Biomarker für die Erkrankung ist das Protein „Amyloid-β 42 (Aβ42)“ [Tau-gerichtetes Antisense-Oligonukleotid MAPTRx bei leichter Alzheimer-Krankheit: eine randomisierte, placebokontrollierte Phase-1b-Studie | Naturmedizin (nature.com); J. Mummery u.a. April 2023; DOI: https://doi.org/10.1038/s41591-023-02326-3]. Ablagerungen von „Beta-Amyloid“ sind Hauptbestandteil von senilen Plaques [Beta-Amyloid - DocCheck Flexikon]. Amyloid-Beta (36-43AS) entsteht durch Spaltung aus dem „Amyloid-Beta-Vorläuferprotein (APP)“, und zwar über die Spaltung durch „Beta-Sekretase“ und der „Gamma-Sekretase“.
Das Protein (Mensch) „APP“ (§§)=770AS liegt in der Spalte Z.38365#_[83]§29§77§[5645]/#_[41]§30§[788788]/#_[99]§32§[020816], und zwar in Z.38365 mit „77“ und der Ziffer „0“(Null) links über die anliegende Metall-Spalte „29/30/32“ mit Kupfer=29E, Zink=30E und Eisen als „2“_3/3=QS=“6“ mit 2_6 für Eisen=“26“. „APP“ (§§) als „77“_29=QS=11=“2“_aufsteigend 30=QS=“3“_aufsteigend 32=QS=“5“ mit „77“_Summe 2+3+5=10 für „0“ mit 77_0 für „APP“ (§§)=770AS. „Das gespaltene APP-Fragment wird durch Gamma-Sekretase freigesetzt“ [APP - Amyloid-beta precursor protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Spaltungsprotein (Mensch) „BACE1_Beta Secretase“ (||) =501AS bzw. das synonyme Enzym „membranassoziierte Asparaginprotease 2 (ASP2) mit dem Spalt „Leu-|-Asp“ trennt das Leucin=72E in Z.38365 gespiegelt als „29_7“ ab und die Asparaginsäure (Asp)=C4H7NO4=24+7+7+32=70E bleibt gespiegelt in der Folgezeile als „07“ für Asp=70E erhalten. „BACE1“ (||) =501AS liegt mit „APP“ (§§)=770AS in der Spalte Z.38365#_[83]§29§77$…/#_[4]|1|§30§|7|[8…]/#_[99]|§32$|0|[2…] in Z.38367 mit 32=QS=“5“_absteigend Spalte 7/0=QS=“7“_30=QS=“3“ mit „5“_Summe 7+3=10 für „0“_“1“ mit 5_0_1 für „BACE1“ (||) =501AS. Der „Gamma-Sekretase_Komplex“ setzt „Amyloid-beta“ frei. „Amyloid-beta 42“ vermutlich in Z.38366 über Spalte !30!7!/!32!0! als „32“_absteigend 7/0=QS=“7“_30=QS=“3“ mit „32“_Summe 7+3=“10“ mit Summe 32+10=“42“ für 42AS. „Amyloid-beta 40“ über *1*30*/*9*[32] als 1/9=QS=“10“_“30“ mit Summe 10+30=“40“ für 40AS. „Amyloid-beta 40“ ist für das Herz weniger schädlich, weil die Ziffer „1“ als Taktgeber „1“ enthalten ist. „Amyloid-beta 42“ ist ungünstiger, weil die Metallspalte „29/30“ mit Summe 59 die Ziffer „1“ für die Zeitbasis „60“ anhängen möchte. Alternativ käme dann die Zeitbasis „365“ in Betracht. Die Zahl „32“ in Amyloid-beta 42 kann im Labor künstlich mit dem Schilddrüsen-Hormon „Calcitonin“ (©©)=32AS besetzt werden, das faserartige Pro-Filamente (D=4 nm) bildet. Es entsteht aus dem Protein (Mensch) „Procalcitonin („“)=141AS. „Procalcitonin“ senkt den P- und Ca- Spiegel, weil Phosphor=15E in der Zerlegung „14“_Kunstgriff für „0“_“1“ enthalten ist, wobei im Kunstgriff das Calcium 20_20 durchlaufen wird, das in Knochen eingebaut wird. Die Calcitonin-Maßvorgabe für die Profilamente ist bereits im „Procalcitonin“ in der Kreuzung „7/(2)0(2)“ für Form=7 und Durchmesser „O“ sowie quer 202=QS=“4“ für Durchmesser 4nm enthalten. „Procalcitonin“ („“) =141AS endet dann zweckmäßig in einer Faserspalte 1/1=QS=2. Die Variante lesbar „130“ mit dem Faseranteil „11“ für 130+11=“141“AS wäre nicht umfassend genug. „Procalcitonin („“)=141AS in der Spalte Z.38366#_“1“30“7“[88788]/#_“9“32“020“[816]/#_[73347]“1“[712]/#_[53514]“1“4“[59], und zwar in Z.38367 als 32=QS=“5“_absteigend Spalte 1/9 für „91“_“30“_“7“ mit Summe 5+91+30+7=“133“_aufsteigend 020=QS=“2“_aufsteigend Spalte 1/1=QS=“2“_“4“ mit „133“_Summe 2_2_4=“8“ mit Summe 133+8=“141“ für „Procalcitonin („“)=141AS [CALCA - Calcitonin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CALCR_Calcitonin Rezeptor“ (^^) = 474AS bindet in die Ziffer „2“ von „Calcitonin“ (©©)=32AS ein, und zwar in der Spalte Z.38367#_©3^2^©02^[0816]/#_[33]^47^[1712] in Z.38368 als 47_absteigend zum Calcium 202=QS=4 mit 47_4 für „CALCR“ (^^) =474AS [CALCR - Calcitonin receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „CALCR“ interagiert mit „Apolipoprotein B“ und „LRP1“ [Calcitonin-Rezeptor – Wikipedia]. Das Protein (Mensch) „APOB_Apolipoprotein B“ (@@)=4563AS liegt mit CALCR (^^) in der Spalte Z.38366#_@3@[0788788]/#_@©3@^*2*©0*2^0816/#_@3@*3*^4*7^1712/#_35141459, und zwar in Z.38369 über „14“ nach links für „41“_“4“ mit Summe 41+4=45_51__Spalte 3/3/3/3 (Fetttransport)=QS=“12“ mit „45“_Summe 51+12=“63“ mit 45_63 für „APOB“ (@@)=4563AS [APOB - Apolipoprotein B-100 - Homo sapiens (Human) | UniProtKB | UniProt]. „APOB“ (@@) besitzt eine Heparin-Bindung mit Heparin= C26H41NO34S4=156+41+7+272+64=540E, und zwar über die Spalte „20/34“ als Spalte 2/3=QS=“5“_Spalte 0/4 für 40 mit 5_40 für Heparin (**)=540E [Heparin | 9005-49-6 (chemicalbook.com)]. Das Protein (Mensch) „LRP1“ =4544AS bindet an „APOB“, in dem in die Start- und Endziffer eingebunden wird und „CALR“ winkelförmig umgangen wird, dabei wird vom Doppel-Calcium ^202^“0“ nur die Ziffer „0“ durchlaufen. „LRP1“=4544AS in Z.38366 über „3078“87“ als Summe 30+7+8=“45“_über Spalte „87/08/17/[1]4“ mit 87=QS=“15“_08=QS=“8“_“17“_“4“ mit „45“_Summe 15+8+17+4=“44“ mit 45_44 für „LRP1“ =4544AS [LRP1 - Prolow-density lipoprotein receptor-related protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „CALCR“ reagiert auf das bakterielle Gift, Protein (Vibrio cholerae) „CTXA_Choleratoxin A“=258AS, das winkelförmig über die Spalte 1/1=QS=“2“_14=QS=“5“_35=QS=“8“ mit 2_5_8 für „CTXA“=258AS angrenzt. Die Untereinheit „CTXB“=124AS ist für ein Hexamer 5-fach mit Summe 620AS vorhanden, die über die Randspalte 6/2 für „62“ als 62_über „0“ an „CTXA“ binden.
Das „Corticotropin-Releasing-Hormon“ (CRH“) {} steht außer der Stimulation von „ACTH (Corticotropin)“ mit dem Protein (Mensch) „NLRP6“ (**) =892AS in Beziehung, dessen Bildung in Darmepithelzellen induziert wird, wo es als Sensorkomponente des „NLRP6-Inflammasoms“ auf Krankheitserreger reagiert. Das benötigte ATP=260AS folgt „CRH“ ersichtlich in Z.38366 über die Spalte „30/32“ als „2“_Spalte 3/3=QS=“6“_“0“ für 2_6_0 für ATP=260E. „NLRP6“ enthält eine Pyrin-Domäne [Das NLRP6-Inflammasom - PMC (nih.gov); L. Kern u.a. Dez. 2020; doi: 10.1111/imm.13293]. Das Motiv einer Pyrin-Domäne umfasst ca. 90 AS, die zwischen „CRH“ und ATP über die Spalte 9/0 für 90AS gekoppelt sind [Domäne Pyrin – Wikipedia]. „NLRP6“ (**) startet in „CRH“ und folgt der anatomischen Ebene mit dem Darm „808“, der vom Epithel „33“ im ATP überdeckt ist. Die Darm-Ziffer „0“(Null) wird durch eine Wasserspalte „8/2“ als Kunstgriff verlängert. Darm „808“ als Spalte 3/3=QS=“6“_“2“ mit Summe „8_“0“_absteigend Kunstgriff Spalte 8/2=10 für „0“ mit „8“_Summe 0+0=“0“_“8“ mit 8_0_8 für Darm=808(Symbol). Folglich liegt „NLRP6“ (**)=892AS in der Spalte in Z.38364 vor der Grenze in CRH als „98“_absteigend „77“ mit Summe 98+77=“175“_links in „CRH“ mit 29=QS=“11“_aufsteigend in Epithelspalte 3/3=QS=“6“_20=QS=“2“ mit Summe 175+11+6+2=“194“_absteigend „788“ mit Summe 194+788=982AS [NLRP6 - NACHT, LRR and PYD domains-containing protein 6 - Homo sapiens (Human) | UniProtKB | UniProt]. „Caspase 1 (CASP1)“ spaltet Vorläufer-Proteine von „IL-1B/IL- 18“ am absteigende Ende und „Caspase 4“ am aufsteigenden Ende, um sich mit deren reifen Formen lückenlos seitlich an „NLRP6“ (**) zu legen. Die Funktion von Caspase 11 bei Mäusen entspricht beim Menschen von CASP4 und CaSP5. Protein (Mensch) „CASP1_Caspase 1“ ($$)=404AS liegt in der Randspalte Z.38364#_$40$[5]/#_[6]4[5] mit „40_aufsteigend „4“ mit 40_4 für „CASP1“=404AS [CASP1 - Caspase-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CASP4_Caspase 41“ (€€)=377AS liegt in der Spalte Z.38368#_€33€[47]€1€71€[2]/#_[3]€5€1€[41459], und zwar als „3“_aufsteigend Spalte 3/5=QS=“8“ mit Summe 3+8=11=QS=“2“_“1“ mit Summe 2+1=“3“_“4“_1/1==QS=“2“_“71“ mit „3“_Summe 4+2+71=“77“ mit 3_77 für „CASP4“ (€€)=377AS [CASP4 - Caspase-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IL18_Interleukin-18“ (||)=193AS liegt seitlich am „NLRP6“ (**) in der Spalte Z.38364#_[28]*98*|1|$40$[5]/Grenze/#_*2977*|56|$4$[5]/#_*3*[0]*788*|7|^8^[8]/#_*320*|20|8|^1^6^/#_€33€|47|€1€71€^2^/#_[3]€5€1€4€1€[459], und zwar in Z.38368 als 47=QS=11=QS=2_absteigend 20=QS=2_absteigend Spalte 7/8=QS=15 mit Summe 2+2+15=“19“_absteigend 56=QS=11=QS=“2“_absteigend „1“ mit „19“_Summe 2+1=“3“ mit 19_3 für „IL18“ (||)=193AS [IL18 - Interleukin-18 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IL1B_Interleukin-1B“ (^^)=269AS liegt am Rand, und zwar in Z.38367 absteigend in der Spalte 6/2 für „26“_absteigend Spalte 8/1=QS=“9“ mit 26_9 für „IL1B_Interleukin-1B“ (^^)=269AS [IL1B - Interleukin-1 beta - Homo sapiens (Human) | UniProtKB | UniProt].
Um ein Inflammasom zu bilden, kann „NLRP6“ unter Umständen das „Adapter-Apoptose-assoziierte Speck-ähnliche Protein (ASC_PYCARD)“ rekrutieren, das hier an „NLRP6“ und „CASP1“ bindet; die Rand-Position von „IL1B“ wird dabei besetzt. Außerdem wird hier „CASP5“ gebunden, dass dabei „CASP4“ ersetzt. Das Protein (Mensch) „ASC_PYCARD“ (°°)=195AS liegt in der Spalte Z.38366#_{30788}°78°8°/#_{320}[208]°1°°6°/#_[33]µ4µ7µ1µ7µ]°12°/#_[351]µ4µ1µ4µ[59], und zwar als „1“_aufsteigend „12“_absteigend Randspalte 8/6 für „68“_78=QS=“15“ mit „1“_Summe 12+68+15=“95“ mit 1_95 für „ASC_PYCARD“=195AS. „Scheint die Inflammasom-vermittelte Reifung von Interleukin-1 beta zu hemmen“ [PYCARD - Apoptosis-associated speck-like protein containing a CARD - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CASP5“ (µµ)=434AS in Z.38368 aufsteigend über Spalte 4/1 für „41“_absteigend Spalte 7/4=QS=11=QS=“2“ mit Summe 41+2=“43“_aufsteigend Spalte 1/1=QS=“2“_absteigend Spalte 7/4=QS=11=QS=“2“ mit „43“_Summe 2+2=“4“ mit 43_4 für „CASP5“ (µµ) =434AS [CASP5 - Caspase-5 - Homo sapiens (Human) | UniProtKB | UniProt].
Das „Amyloid-beta 42“ (!!) entsteht aus der Spaltung von „APP“ {} durch Beta- und Gamma-Sekretase, letztere muss noch gefunden werden. Eine Alzheimer-Erkrankung wird verhindert, indem sich die „Alpha-Sekretase“ der ADAM-Familie (9, 10, 17) in den Vordergrund schiebt und „APP“ durch „Ectodomain-Shedding“ korrekt nahe der Zellmembran (hier Grenze #1611/#1610 schneidet. Beta-Sekretase schneidet „falsch“, und zwar innerhalb der Zellmemban, wobei der größere Abschnittt „Amyloidplaques“ erzeugt [Alpha-Sekretasen – Wikipedia]. Weil ADAM-Metalloproteasen den Cofaktor „Zink“ besitzen, wird die Amolyd-Spaltstelle zwischen Kupfer und Zink durch Kopplung „29/30“ verhindert. Das Protein (Mensch) „ADAM9“=819AS in Z.38364 aufsteigend Spalte 2/8=QS=10_41_30 (Zink) mit Summe 10+41+30=“81“_absteigend „9“ (aus Kupfer 29) mit 81_9 für „ADAM9“=819AS [ADAM9 - Disintegrin and metalloproteinase domain-containing protein 9 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ADAM10“=748AS in Z.38364 aufsteigend über „25“2/2 als 25=QS=“7“_Spalte 2/2 (aus Kupfer 29)=QS=“4“_aufsteigend 413[0]=QS=“8“ (mit Ziffer „3“ aus Cofaktor „Zink“) mit 7_4_8 für „ADAM10“=748AS [ADAM10 - Disintegrin and metalloproteinase domain-containing protein 10 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ADAM19“=824AS zieht in Gegenrichtung in Z.38366 absteigend optimal (inclusive Zeitbasis 24) als 4130(Zink=30)=QS=“8“_absteigend 8329(Kupfer=29)=QS=“22“_absteigend „2“ mit „8“_Summe 22+2=“24“ mit 8_24 für „ADAM19“=824AS. Spezieller Spalt „Ala-|-Val“ mit Alanin(Ala)= C3H7NO2=18+7+7+16=48E intern Z.38365 am Spalt „2“_absteigend extern „28“ für Summe 2+2=“4“_“8“ für Alanin=48E. Valin (Val)=C5H11NO2=30+11+7+16=64E extern in Z.38363 mit „6“ absteigend 2/83(Ziffer 3 an Spaltstelle) für „4“ mit 6_4 für Valin=64E. Der Spalte trennt die Zahl 32[9] mit „3-2“ aus Kupfer 29 [ADAM17 - Disintegrin and metalloproteinase domain-containing protein 17 - Homo sapiens (Human) | UniProtKB | UniProt].
„Gamma-Sekretase“ wird durch das Protein (Mensch) „GSAP_Gamma-Sekretase-aktivierendes Protein“ (||)=854AS aktiviert. „GSAP“ wird durch das Arzneimittel „Imatinib“ (**)=C29H31N7O=174+31+49+8=262E gehemmt, weil es in „GSAP (PION)“ einbindet. „Imatinib“ ist ein spezifischer Hemmstoff, der die Aktivität der Tyrosinkinase ABL blockiert, um die unkontrollierte Zunahme von weißen Blutkörperchen zu verhindern (CML-Leukämie). Die Tyrosinkinase „ABL1“=1130AS enthält eine ATP-Bindung und den Cofaktor „Magnesium“. „Imantinib“ (**)=262E absteigend in Spalte 6/2 für „26“_Kunstgriff aufsteigend Spalte 1/1=QS=“2“_17=“8“ mit „26“_Summe 2+8=“10“ für „0“ mit Summe 26+0=“26“_absteigend 20=QS=“2“ mit 26_2 für „Imatinib“ (**) =262E. Das Protein (Mensch) „Tyrosinkinase „ABL1“ (§§)=1130AS durchkreuzt „Imatinib“ nadelartig in Z.38368 absteigend Spalte 1/1[2] mit Start am Mg-Rand für „11“_absteigend 78=QS=15_aufsteigend Spalte 8/7=QS=15 mit „11“_Summe 15+15=30 mit 11_30 für „Tyrosinkinase „ABL1“ (§§)=1130AS. „Imatinib“ ist vom rechten Rand bis zur Mitte aktiv und besetzt GSAP erst zur Einbindung mit der Ziffer 2 (im Doppel-Caclium 20“2“0). „GSAP“ (||) =854AS darf zwecks Spaltung nicht ins Kupfer „29“ aufsteigen, und ergibt sich somit in Z.38366 als „78“_aufsteigend „2“_320=QS=“5“ mit Summe 78+2+5=“85“ absteigend 13=QS=“4“ mit 85_4 für „GSAP“ (||) =854AS.
Der Komplex „Beta-Sekretase“ besteht aus 4 Untereinheiten: 1.) Entweder „Präsenilin-1-Homodimer“ oder „Präsenilin-2-Homodimer“; 2.) Stabilisationfaktor „APH-1“; 3.) Präsenilin-Enhancer 2 (PEN-2); 4.) Nicastrin (nicht aktiv, unterstützt aber den Protein-Transport).
„Präsenilin“ besitzt innerhalb der Membran eine Asparagin-Endopeptidase-Aktivität, so dass 2 Stellen von Asparaginsäure (Asp)=C4H7NO4=24+7+7+32=70E in der Nähe liegen. Ein „Auseinander-Dividieren“ setzt voraus, das eine Masse vorhanden ist, folglich wird das Protein als Homodimer zweckmäßig doppelt gezählt. Der funktionelle Zweck ist ersichtlich, indem die Asp-Spalte 7/0 für Asp=70E schleifenförming in einer geschlossenen Matrix umringt vom zweiten Asp=70E eingefasst wird - gedehnt als „Asp-Kette“. Diese Hydrolyse startet in der Spalte „8/2" für das notwendige Wasser 28(Symbol), und zwar in Z.38366 über die 130“7“8/932“0“2/73347 mit Asp „7/0“ für „Asp“=70. Zweites „Asp“ bindet aufsteigend über Wasser-Spalte 8/2=QS=10_aufsteigend 47=QS=11=QS=“2“_absteigend Spalte 2/3=QS=“5“_“3“ mit „10“_Summe 2+5+3=“10“_73=QS=10_absteigend Spalte 1/9=QS=10_30 (neben Asp) mit Summe 10+10+10+10+30=“70“ für Asp=70E. Die beiden alternativ verwendbaren Homodimere „Präsenilin“ -1/-2 nutzen nur die Ziffernfolge „202“ gemeinsam. Das Protein „PSEN1_Präsenilin-1“=467AS liegt als Homodimer 2*467AS=934AS kompakt in der Asp-Kette in der Zeile Z.38366#_93202… als „93“_202=QS=“4“ mit 93_4 für PSEN1-Homodimer“=934AS. „PSEN1 wirkt durch die Kontrolle der präsynaptischen „SYT7“-Expression“ [PSEN1 - Presenilin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SYT7“=403AS benötigt das in „PSEN1“ enthaltene Calcium, und zwar als 202=QS=“4“_absteigend „03“ mit 4_03 für „SYT7“=403AS [SYT7 - Synaptotagmin-7 - Homo sapiens (Human) | UniProtKB | UniProt]. Das „PSEN2_Präsenilin-2“=448AS zieht als Homodimer 2*448AS=896AS über die Wasserspalte 8/2 für „82“_aufsteigend „7“ mit Summe 82+7=“89“_4_absteigend 20=QS=“2“ mit „89“_Summe 4+2=“6“ mit 89_6 für PSEN2-Homodimer“=896AS. „Calcium“ wird über die Ziffer „2“ in „82“ bereits tangiert, woraus ein Ca-Transport resultiert [PSEN2 - Presenilin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „APH-1“ und „PEN-2“ regulieren die Reifung von „Präsenilin“. „APH-1“ enthält das Interaktionsmotiv „Glycin“-X-X-X-„Glycin“ mit Glycin=40E. Hierfür wird die Calcium-Dopplung 2“0“20 als Summe „40“ mit der enthaltenen Spalte „0“/4 für Glycin=40E gekreuzt. Der Stabilisationfaktor, das Protein (Mensch) „APH1A“=265AS liegt in der Spalte Z.38367#_“30“[788]…/#_“3“202“[0]…/#_“3“[3471]… und zählt sich über die gemeinsame „Präsenilin-Zahl „202“, und zwar in Z.38368 absteigend in Spalte 3/3 für „33“_absteigend „30“_aufsteigend mit Summe 33+30+202=“265“ für „APH1A“=265AS [APH1B - Gamma-secretase subunit APH-1B - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „APH1B“=257AS ist seltener und läuft in die Gegenrichtung, und zwar in der Spalte Z.38367#_“3“202“[0]…/#_“3“3“47“[1]…/#_“35“[141]… als „202“_aufsteigend Spalte 3/3 für „33“_aufsteigend 35=QS=“8“_absteigend „3“ mit „202“_Summe 8+3=“11“_47=QS=“11“ mit Summe 202+33+11+11=“257“ für APH1B“=257AS [APH1B - Gamma-secretase subunit APH-1B - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PEN-2“=101AS reguliert den zytosolischen CTNNB1-Spiegel. „PEN-2“ steigt seitlich parallel auf. Das Protein (Mensch) „CTNNB1_Catenin beta-1“=781AS in Z.38366 in der Spalte „87/0/1“ mit „7“_“8“_0/1=QS=“1“ mit 7_8_1 für „CTNNB1“=781AS. Reaktion auf „Östradiol“=148E in Z.38365 77/[7]8 mit 77=14_8 für Östradiol=148E, wobei die Ziffer „8“ die Startzahl von „PEN-2“ ist [CTNNB1 - Catenin beta-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „PEN-2“=101AS liegt in der Spalte Z.38366#_“1“3“[07]“8“[87]…/#_[9]“320“2“[08]…/#_[5733]“47“[17], und zwar in Z.38366 aufsteigend Spalte 8/2=QS=10_aufsteigend Kunstgriff als Wende 47=QS=11=QS=“2“_absteigend 320=QS=“5“_absteigend „3“ mit „10“_Summe 2+5+3=10 für „0“ mit Summe 10+0=“10“_“1“ mit 10_1 für PEN-2=101AS [PSENEN - Gamma-secretase subunit PEN-2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Potein (Mensch) „Nicastrin“=709AS reguliert analog zu PEN-2 den CTNNB1-Spiegel. Weil Nicastrin links neben PEN-2 startet, muss „CTNNB1“ alternativ durch „PEN-2“ laufen. Das Protein (Mensch)_alternativ „CTNNB1“=781AS in Z.38366 über die Spalte „78“[8788]/0“208“1“[6] läuft quer statt vertikal, und zwar als „78“_aufsteigend Kunstgriff 208=QS=10 für „0“ mit Summe 78+0=“78“_“1“ für „CTNNB1“=781AS(alternativ). „Nicastrin“=709AS zeigt nunmehr die maßgebliche Schnittführung, indem es in die Zink-Zahl „30“ in die Ziffer „0“ absteigt und über die Ziffer „3“ in der Spalte Z.38366#_[41]“3“0“[788788]/#_[99]“3“2“[020816]/#_[57]“3“3“47“[1712] absteigt, und zwar in Z.38368 als 47=QS=11=QS=“2“_links absteigend in Spalte 2/3=QS=“5“ mit Summe 2+5=“7“_absteigend „0“_aufsteigend Spalte 3/3/3=QS=“9“ mit 7_0_9 für „Nicastrin_short“=709AS. Um statt Amyloid-beta 42“ (!!) das Amyloid-beta 40 (**) zu erzeugen, muss links ein Kunstgriff über die Spalte [1]/[9]=QS=10 für „0“ eingefügt werden, und zwar „Nicastrin“=709AS mit „70“_“3“_Kunstgriff 1/9=10 für „0“ mit „70“_Summe 3+0=“3“_aufsteigend Spalte 3/3=QS=“6“ für „70“_Summe 3+6=“9“ mit 70_9 für „Nicastrin_long“=709AS. „Nicastrin_long“ (^^)=709AS mit „Amyloid-beta“ „42“ (!!) / “40“ (**), und zwar „Amyloid-beta 42“ über !30!7!/!32!0! als „32“_absteigend 7/0=QS=“7“_30=QS=“3“ mit „32“_Summe 7+3=“10“ mit Summe 32+10=“42“ für 42AS. „Amyloid-beta 40“ über *1*30*/*9*[32] als 1/9=QS=“10“_“30“ mit Summe 10+30=“40“ für 40AS. Nicastrin_long“ (^^)=709AS in der Spalte Z.38366#_[94]^*1*!^3^0^!*!7![88788]/#_[89]^*9*^!^3^^2^!0![20816]/#_[857}^3^^3^47^[1712]. Gegen die Alzheimer-Erkrankung wirkt das Arzneimittel „Lecanemab“= „C“6544“H“10088“N“1744“O“2032“S“46=39264+10088+12208+16256+736=“78552“E, das aus einem „Maus-Antikörper“ entwickelt wurde. Die Formel ist nicht ganzzahlig reduzierbar. Die große Länge ist erforderlich, um vom rechten Medikamenten-Rand weit zur Mitte zu ziehen. „Lecanemab“ besetzt die Stabilitätszahl „202“ der Gamma-Sekretase und blockiert „Ambolyd Beta“. „Lecanemab“ folgt zunächst Ziffern, die zu einer Disulfidbrücke 16-16 (Schwefel) gehören, die sich über Startzahl „16“_8_8 entwickelt. „Lecanemab“ {}= 78552“E liegt in der Spalte Z.38366#_{130}{7}[88788]/#_[93]{2}{0}{20}[8]{16}/#_[73]{3}{47}{1}{71}[2], und zwar in Z.38367 als 16=QS=“7“_statt Ziffer [8] aufsteigend 71=QS=“8“_“1“_als Schleife aufsteigend 20=QS=“2“_absteigend 47=QS=11=QS=“2“ mit „78“_Summe 1+2+2=“5“_aufsteigend Spalte 2/3=QS=“5“_aufsteigend Spalte 7/0=QS=“7“_130=QS=“4“ mit „7855“_Summe 7+4=11=QS=“2“ mit 7855_2 für „Lecanemab“ {}= 78552“E. [Lecanemab – Wikipedia]._dat10.04.2024
„Vasopressin / Oxytocin“
Das Kuschelhormon „Oxytocin“ unterscheidet sich von Vasopressin in „2“ der „9“ Aminosäuren. Bei mechanischen Reizen wird „Oxytocin“ von „Neurophysin I“ abgespalten und in den Blutkreislauf freigesetzt. „Oxytocin“ wirkt über den „Oxytocin-Rezeptor (OXTR)“, der an Stellen exprimiert wird, die funktionell Kontraktionen auslösen und diese verstärken (u.a. Geburt). Der Rezeptor ist aber auch in der Niere vorhanden, um die Aufnahme von Natrium zu reduzieren [Oxytocin - DocCheck Flexikon]. Das Vorläufer-Protein (Mensch) „QXT_Oxytocin-neurophysin 1“ (||)=125AS liegt in der Spalte Z.38364#[16110]|25|28|[98…]/Grenze/#[16109]|83||29|[77]…/#16109|41|[3078…] in Z.38366 als 41=QS=“5“_absteigend „83“_absteigend „25“_28=QS=“10“_aufsteigend 29=QS=11=QS=“2“ mit Summe 5+83+25+10+2=“125“ für „QXT“ (||) =125AS. „Oxytocin bewirkt eine Kontraktion der glatten Muskulatur der Gebärmutter und der Brustdrüse. Bindung am Oxytocin-Rezeptor (OXTR)“ [OXT - Oxytocin-neurophysin 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Überlagerung von „OXT“ mit „QXTR“ ist bei einem Rezeptor notwendig, umfasst aber mehrere Ziffern. Die „OXT“-Position könnte zutreffend sein, weil die weite Lücke zum rechten Rand als „äußerer Einfluss“ durch den Wirkstoff „MDMA (Midomafetamin)“=C11H15NO2=66+15+7+16=104E“ überbrückt wird. Der Oxytocin-Spiegel erhöht sich rauschartig unter „MDMA“-Einfluss, weil positive Emotionen verstärkt wahrgenommen werden [MDMA – Wikipedia]. Der Nerv „7“ liegt als „77“ neben „OXT“, und zwar „MDMA“ (!!)=104E in Z.38365 als „77“_absteigend 98=QS=“17“_14=QS=“5“_“5“(Randziffer) mit 77+17+5+5=“104“ für „MDMA“ (!!)=104E. „MDMA“ enthält eine Beziehung vom Nerv „7“ zum „Muskel“=“55“. Der Nerv „77“ produziert die unlesbare Disulfidbrücke „16-16“. Nur die Zahl „32“ oder die Zählung Schwefel=“16“ ist möglich; aber über 29=QS=“11“=QS=2_Kopplung an 77=QS=14 mit Summe 2+14=“16“ folgt der 2.Brücken-Schwefel. Ist die notwendige Bindung an den „Vasopressin-V1A-Rezeptor“ (€€) vorhanden? Ja, weil dieser in der Metallspalte mit der Zink-Null [3]“0“ als Volumen nadelartig aufsteigt. Ist Natrium=11E vorhanden? Ja, das letzte Natrium in der Serien #16“11“… bindet seitlich.
Die Freisetzung des aktiven „Oxytocin“ mit „9“ AS, „Oxytocin-Nonapeptid“, wird vom Protein (Mensch) „PAM_Peptidylglycin-alpha-amidierende Monooxygenase“ {}=973AS katalysiert. Die Position von „PAM“ {} muss aufgrund der beiden Cofaktoren „Kupfer/Zink“ an der Serien-Rand-Grenze in der Metallspalte „29/30“ liegen. Weil für Kupfer aber „2“ Bindestellen vorliegen, muss das Doppel-Kupfer bereits in Z.38374 über die Spalte 25[2]/3/1 „erfunden“ werden, in dem eine Spalte 3/1 links neben der Metallspalte für Summe 25+3+1=Kupfer=29E liegt. Die Cofaktoren „Kupfer/Zink“ „2“[9]/“3“[0]“ dienen mit der linken Ziffer zur Weg-Findung. „PAM“ {}=973AS liegt in der Spalte Z.38364#[161]{102}{5}{2}8…/#[161098]{3}{2}“9“…/#[161094]{1}{3}“0“…, und zwar in Z.38364 aufsteigend über die Cofakor-Spalte 2/2/3=QS=“7“_absteigend für „Oxytocin“ in der Spalte 5/3/1=QS=“9“ (9 Aminosäuren)_Freisetzung am linken Rand 102=QS=“3“ mit 7_9_3 für PAM“ {}=973AS. Nebenprodukt der PAM-Katalyse ist „Glycolat“, das Anion der Glycolsäure=C2H4O3=12+4+24=40E. „Arginin“=94E ist bei der Katalyse von Bedeutung und ist seitlich lesbar. Die „Glycolsäure“ kreuzt „Arginin“ in der Spalte {0}{„2“}/9“8“/9“4“ als „4“_Spalte 2/8=QS=10 für „0“ mit 4_0 für Glycolsäure= C2H4O3=12+4+24=“40“E. [PAM - Peptidyl-glycine alpha-amidating monooxygenase - Homo sapiens (Human) | UniProtKB | UniProt].
Der Oxytocin-Rezeptor, das Protein (Mensch) „OXTR“ (**)=389AS ist zur Motivation in Z.38365 gespiegelt als „983“ lesbar und muss nach dem Bedarf erweitert werden. In der Funktion kommen faserartige Zellfortsätze (Mikrovillus) in Betracht, wobei keine einzelne Zelle, sondern eine mehrzellige Struktur wie die Plazenta gemeint ist. Zutreffend ist die Ziffer „11“ als Verbindung zum linken Rand. Zur rechten Seite muss zur „Vasopressin-Rezeptor-Aktivität“ die Vertikale durch die linke Seite der Metallspalte „2“9/“3“0 erreicht werden. „OXTR“=389AS zieht einen Ring um die Ziffer [3] in der Spalte Z.38364#[16]*110*252*[8]…/#[1610]*98*[3]*2*[9]…/#[16109]*41**3*[0]…, und zwar in Z.38364 als „110“_“252“ aufsteigend Spalte 2/3=QS=“5“_41=QS=“5“_absteigend 98=QS=“17“ mit Summe 110+252+5+5+17=“389“ für „OXTR“ (**)=389AS [OXTR - Oxytocin receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „OXTR“ muss für die Sexualität nachgeordnet über die Niere die Harnröhre „303“ erkennen. Dieser Pfad ist verborgen, weil er nur bei Bedarf benötigt wird. Zweckmäßig wird die ringförmig umschlossene Ziffer [3] zur Lokalisierung der Harnröhre mit verwendet, und zwar in der Spalte Z.38364#_“25“[2]…/#_[8]“32“…/#_[41]“3“… als „25“_aufsteigend 32=QS=“5“ mit Summe 25+5=“30“_aufsteigend „3“ mit 30_3 für „Harnröhre“=303 (Symbol). „OXTR“ reagiert auf „Östradiol“=148E in der Spalte 8[3]/41 mit „1“_“4“_absteigend „8“ mit 1_4_8 für Östradiol=148E. „OXTR“ reagiert auf „Progesteron“ =C21H30O2=126+30+16=“172“ in der Spalte [0]2/98 als 98=QS=17_2 für „Progesteron“=172E. Gleichzeitig ergibt Summe 98+2=100 die Temperaturbasis 100°C zur kälteinduzierten Wärmebildung (Thermogenese) aufsteigend über die Zahl „41“ für maximal 41°C (extremes Fieber). Regulation von „Calcium“ in der Spalte „10“2“/[09]“8“ mit „10“_Spalte 2/8=“10“ mit Summe 10+10=Calcium=20E. Reaktion auf „Kokain“=C17H21NO4=102+21+7+32=162E, und zwar ringförmig in Z.38366 als „1“_absteigend 8/4 für „48“_absteigend 252=QS=“9“_aufsteigend 2/3=QS=“5“ mit „1“_Summe 48+9+5=“62“ mit 1_62 für „Kokain“=162E. Die Ziffer [3] ist unbesetzt, so dass für die Muskelkontraktion mit „Muskel“=55 wechselseitig ein Ring über die Spalte 252/8[3]2/413 nutzbar ist. 1.Ringmuskel: „8“_aufsteigend „25“_absteigend 2/2 für „22“ mit Summe 8+25+22=Muskel=“55“ (Symbol). 2.Ringmuskel: „41“_absteigend 2/3=QS=“5“_252=QS=“9“ mit Summe 41+5+9=Muskel=55 (Symbol). Für den Blutdruck mit Blut=26 (Symbol) über „1025“ mit „1“_O=Gefäß_“25“ mit Summe 1+0+25=Blut=26 (Eisen) und der kreuzenden Spalte 0/9 mit O=Gefäß und Arterie=9 (Symbol) bzw. wegen „98“ mit Vene=8 (Symbol). Weiterhin über 983/941 mit 41+3=Netzwerk=“44“. Regulation der Noradrenalin-Sekretion
mit „Noradrenalin“=C8H11NO3=48+11+7+24=90E. „Nordadrenalin“ bindet seitlich über die Metallspalte 29/30 mit „9/0“ für „Noradrenalin“=90E. „Penis-Erektion“ über die Spalte „8[3]2/413“ über die Spalte 8/4 als „Schwerachse“ 84 seitlich gekoppelt mit „1“_absteigend Spalte 2/3 für „32“ mit Summe 1+32=männlich=“33“ (Symbol). Natürliches Arzneimittel bei Erektionsstörungen „Prostaglandin E1 (Alprostadil)“=C20H34O5=120+34+40=“194“ als 110=QS=“2“_aufsteigend in die Schwerachse 8/4 als 98=QS=“17“_mit Summe 2+17=“19“_“4“ für „Prostaglandin E1“=192E [Prostaglandin E1 – Wikipedia].
„VIAGRA“ potenziert bei Männern die blutdrucksenkende Wirkung von Nitraten, zwecks Aufrechterhaltung einer befriedigenden Erektion. Die glatte Muskulatur im paarigen arteriellen Schwellkörper (Corpus cavernosum penis) muss erschlaffen (Relaxion), damit mehr Blut einströmen kann. Weil die paarigen Schwellkörper von einer faserreichen Bindegewebsschicht (Tunica albuginea) eingekapselt sind, kommt es zu einer Versteifung und Verlängerung des Penis (Erektion). Im 3.Schwellkörper auf der Unterseite (Corpus spongiosum penis) wird der venöse Blutabfluss durch den äußeren arteriellen Druck gedrosselt. Erst durch sexuelle Stimulation wird der Transmitterstoff „Stickstoffmonoxid (NO=7+8=15E)“ über den Nerv „Nervi splanchnici pelvici“ freigesetzt. Das Enzym „Guanylatcyclase“ wird durch „NO“ aktiviert, um den Spiegel an „zyklischem Guanosinmonophosphat (cGMP)“ zu erhöhen [1 (pfizer.com)]. Über „cGMP“ werden Kalium-Kanäle geöffnet und Calcium-Kanäle geschlossen. „cGMP“ besetzt die Spalte Z.38364#_52[8]/_32[9]/_13[0], so dass seitlich die Ziffer „0“ einen „Kanal=0“ repräsentiert. Über 29=QS=11=“2“_“0“ wird das Calcium=20E verhindert, wenn die Ziffer „9“ für Kalium=19E verwendet wird, und zwar mit dem Hydrolyse-Wasser 28=QS=“10“_aufsteigend „9“ für Summe 10+9=Kalium=19E. Der niedrige „Calcium-Spiegel“ entspannt die glatte Muskulatur. Achtung! Das von Viagra adressierte Enzym scheint die natürliche Funktion der „Proteinkinasen G (PKG)“ lediglich zu verstärken [Proteinkinase G - DocCheck Flexikon]. Der hohe „cGMP-Spiegel“ bleibt lange erhalten, weil „Viagra“ selektiv die „Phosphodiesterase Typ 5 (PDE5)“ daran hindert, das „cGMP“ schnell wieder abzubauen. Aufgrund der gleichzeitigen Hemmung der „PDE6“ verändert sich kurzzeitig das Farbsehen (Blau/Grün).
Der „PDE5A“-Hemmer, das Arzneimittel „Sildenafil (Viagra)“ (°°) =C22H30N6O4S=132+30+42+32+16=“252“ ist in der Spalte Z.38364#[16110]°25°°2°[8[…/#[16109]°8°[3]°2°[9]…/#[16109]°413°[0]… zwar lesbar, muss aber zwecks Erektion als Ring über die Schwerachse um die Ziffer [3] gezogen werden. „Viagra“ in Z.38364 als 25=QS=“7“ (Stickstoff)_aufsteigend „8“(Sauerstoff) mit Summe 7+8=“15“ [Freisetzung von „Stickstoffmonoxid (NO)“=7+8=15E]_aufsteigend 413=QS=“8“ absteigend „2“ mit Summe 15+8+2=“25“_absteigend „2“ mit 25_2 für „Viagra“=252AS. „NO“ aktiviert das Enzym „Guanylatcyclase“, wodurch über GTP=268E das „cyclische Guanosinmonophosphat (cGMP)“ (§§)=C10H12N5O7P=60+12+35+56+15=178E erhöht wird.
„cGMP“ (§§)=178E nimmt in der Spalte Z.38364#[161102]§5§§2§[8[…/#[161098]§3§§2§[9]…/#[161094]§1§3§[0]… ringförmig die unbesetzte Ziffer [3] auf, und zwar in der Spalte „52/32/13“ als „1“_absteigend in der Spalte 2/2/3=QS=“7“_aufsteigend 5/3=“8“ mit 1_7_8 für „cGMP“ (§§)=178E, wobei über den Ringschluss über die erzeugte Zahl „8“_13=QS=“4“ oder 2/2=QS=“4“ mit 8_4 die Schwerachse „84“ erzeugt wird.
Die lösliche „Guanylatcyclase“, das Protein (Mensch) „GUCY1A2“ ($$)=732AS erkennt in der Spalte Z.38364#[1]$61$10$2$[52]/#[16109]“83“[2] in der Zahl „1025“ die Nähe zu Magnesium=12E und Mangan=25E, und zwar als „61“_“10“_“2“ mit Summe 61+10+2=“73“_aufsteigend 83=QS=11=QS=“2“ mit 73_2 für „GUCY1A2“ ($$)=732AS. Wo ist „NO“=7+8=15E zur Aktivierung? In der Spalte 2 (5)/“8“ ist Sauerstoff=8E enthalten. Extern liegt die Ziffer „5“, die zu QS=2+“5“=7=Stickstoff=Nerv=“7“ addiert wird. Die Ziffer „5“ liegt dann mit der Spalte „5“/3 im „cGMP“.
. „GUCY1B1“ (€€)=619AS bindet an „GUCY1A2“, und zwar in Z.38365#[1]“61“09“ als „61“_Summe 0+9=“9“ für „GUCY1B1“ (€€)=619AS.
In der vermutlich normalen Funktion mit der „Proteinkinase G“ wird nicht das spaltenförmige „NO“ wirksam, sondern seitlich aus „5“28=QS=15 für „NO“=15E. Die „Serin/Threonin-Protein-Kinase“ das Protein (Mensch) „PRKG1“ (!!) =671AS liegt in der Spalte Z.38364#[1]!6!11!0!25!28!9![81405]/#[16109];83;2;9;!7!7!56![45]/#[161094];13;0;7;[88788], und zwar in Z.38364 als „6“_“11“_“0“_“25“_28=QS=“10“_aufsteigend Spalte 9/7=“16“_“7“ mit „6“_Summe 11+0+25+10+16+7=“69“_Serin=56=QS=11=QS=“2“ mit „6“_Summe 69+2=71 mit 6_71 für „PRKG1“ (!!) =671AS. Das ATP=260E ist in 102528 als Summe 1+0+25=“26“_28=QS=10 für „0“ für ATP=260E enthalten. Für die Umwandlung in ADP=220E muss der „0“(Null aus 28) die Zahl „22“ aufsteigend aus 8329=QS=“22“ vorgelagert werden. Diese Zahl wird zugleich vom Protein „PRKG2“ besetzt. „In Abwesenheit von cGMP wird die PRKG1-Aktivität durch autoinhibitorische Kontakte unterdrückt.“ [PRKG1 - cGMP-dependent protein kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „PRKG2“ (;;) =762AS in Z.38366 als „7“_absteigend Spalte 9/0=QS=“9“_“2“ mit „7“_Summe 9+2=11=QS=“2“_aufsteigend 13=QS=“4“ mit „7“_Summe 2+4=“6“_absteigend 83=QS=11=QS=“2“ mit 76_2 für „PRKG2“ (;;) =762AS. Seitlich liegt das „Arginin“=94E extern lesbar an, das „PRKG2“ aktiviert. Es fehlt aber Serin/Threonin=“56E“/“64E“ für eine erkennbare Kinase. „Serin“ ergibt sich intern 83=zu „2“_absteigend extern „52“_aufsteigend intern 29 zu „2“ mit Summe 2+52+2=Serin=56E [PRKG2 - cGMP-dependent protein kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„Viagra“ hemmt das Protein (Mensch) „PDE5A_cGMP-spezifische Phosphodiesterase Typ 5“ (||) =875AS, das im Corpus cavernosum und in der Netzhaut vorhanden ist und für Herz-Kreislauf-System von Bedeutung ist [cGMP-spezifische Phosphodiesterase Typ 5 – Wikipedia]. „PE5DA“ katalysiert die spezifische Hydrolyse von „cGMP“ (§§)=178E zu „5'-GMP“(^^)=C10H12N5O8P=60+12+35+64+15=186E [guanosine 5'-monophosphate(2-) (CHEBI:58115)]. Das Hydrolyse-Wasser (~~) „28“(Symbol) ist in Z.38364 lesbar. „5'-GMP“ (^^)=186E liegt seitlich am Wasser in der Spalte Z.38364#[16110]^25^~28~…/#[16109]^83^29^…/#[161094]^1^30^…, und zwar als „1“_“30“_absteigend „29“_83=QS=11=QS=“2“_absteigend “25“ mit „1“_Summe 30+29+2+25=“86“ mit 1_86 für „5'-GMP“ (^^)=186E. „PDE5A“ (||)=875AS besitzt die beiden Cofaktoren „Zink“ und „Magnesium“, wobei Magnesium nur schwach bindet. In der Nähe von Zink fehlt ein lesbares Magnesium – es wird kunstvoll kreiert in Z.38365#_„83“[29]/#_[4]1“30“=Zink als 83=QS=“11“_aufsteigend „1“ mit Summe 11+1=“12“ für 2.Cofaktor „Magnesium“=12E. Das Protein „PDE5A“ (||) =875AS liegt in der Spalte Z.38365#_„83“[29]/#_[4]1“30“, und zwar in Z.38366 als „4“_absteigend „83“ mit Summe 4+83=“87“_aufsteigend 2/3=“5“ mit 87_5 für „PDE5A“=875AS[PDE5A - cGMP-specific 3',5'-cyclic phosphodiesterase - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Weiblichkeit“=66(Symbol) wird über die Spalte Z.39364#_„2“52“…/#_“8“[3](2)…/#_“4“(13)… dargestellt, und zwar absteigend über Spalte 2/8/4=QS=“14“_“52“ mit Summe 14+52=weiblich=“66“ (Symbol), wobei die nicht existierende „Schwerachse“ „weggerechnet“ wird. „Pink-Viagra“, das Arzneimittel „Flibanserin (Addyi)“=C20H21F3N4O=120+21+27+28+8=“204“E gegen Lust-Flaute wirkt nicht auf den Körper, sondern auf die Psyche. Die Neurotransmitter werden umverteilt, weniger sexualitätshemmendes „Serotonin (Enteramin)“=C10H12N2O=60+12+14+8=94E, mehr „Dopamin“/„Noradrenalin“. „Serotonin“ steuert die Sexualität: Zu viel blockiert, zu wenig macht süchtig. „Serotonin“ (!!)=94E liegt lesbar am linken Rand in der Spalte Z.38365#[1610]*9{83}*{29}…/#[1610]!9{4!*1}{3*0}…. Die Serotonin-Ziffer „4“ bindet in den Serotonin-Rezeptor, das Protein (Mensch) „HTR2A“ {}=471AS, ein. „HTR2A“ {} über „8329“ als 29=QS=11=QS=“2“_83=QS=11=QS=“2“ mit Summe 2+2=“4“_aufsteigend „41“_“30“ mit „4“_Summe 41+30=“71“ mit 4_71 für „HTR2A“ {}=471AS. „Flibanserin (Addyi)“ (**)=204E besetzt diesen Rezeptor, wodurch die Freisetzung von „Serotonin“ gehemmt wird, und zwar als 983=QS=“20“_aufsteigend 13=QS=“4“ mit 20_4 für „Flibanserin (Addyi)“ (**)=204E. Zur Wirksamkeit muss die Lust-Pille ständig eingenommen werden. „Flibanserin“ {} wird vom Protein (Mensch) „CYP3A4“ () =503AS über den Cofaktor „Häm“ (||)=C34H32FeN4O4=204+32+26+28+32=322E abgebaut, und zwar in der Spalte Z.38365#[1610]|*983*2|[9]…/#[1610](!9)(4!*1)(|3|)*[0]… mit „Häm“ (||)=322E in Z.38366 „3“_absteigend 9832=QS=“22“ mit 3_22 für „Häm“ (||)=322E. „CYP3A4“ ()=503AS in Z.38366 mit „9“_“41“ mit Summe 9+41=“50“_“3“ für „CYP3A4“ ()=503AS [CYP3A4 - Cytochrome P450 3A4 - Homo sapiens (Human) | UniProtKB | UniProt]. „CYP3A4“ ()=503AS wird durch das Protein (Mensch) „CYB5A_Cytochrom b5“ (§§)=134AS mit Eisen-Bindung aktiviert, und zwar in der Spalte Z.38365#_[09]§83§2§[9]…/#_(9)(4§1§)(§3§)[0]… als „1“_absteigend Spalte 2/3 für „32“_83=QS=11=QS=“2“ mit 1_Summe 32+2=“34“ mit 1_34 für „CYB5A“ (§§)=134AS, wobei sich das Eisen=26E die Ziffer „2“ in Gegenrichtung aus der Zahl „83“ und über “9413“ mit 94=QS=“13“_“13“ mit Summe 13+13=26E zählt [CYB5A - Cytochrome b5 - Homo sapiens (Human) | UniProtKB | UniProt]. Der „Flibanserin“-Spiegel (**)=204E ist ungünstig zu hoch, wenn das Medikament nicht abgebaut wird, beispielweise bei gleichzeitiger Einnahme des CYP3A4-Hemmers „Ketoconazol“ (^^)=C26H28Cl2N4O4=156+28+34+28+32=278E in der Spalte Z.38365#[16]^10^*98^3*[29]…/#[16109]^4*13*^[0]…, und zwar als „10“_98=QS=“17“ (Chlor) mit Summe 10+17=“27“_aufsteigend 413=QS=“8“ mit 27_8 für „Ketoconazol“ (^^)=278E, wobei „CYP3A4“ ()=503AS über den Anteil „41_3“ blockiert wird.
Das verbotene Doping-Mittel „Dehydroepiandrosteron (DHEA)“=C19H28O2=114+28+16=158E dient als Vorstufe (Prohormon) zur Bildung von „Testosteron“ und „Östradiol“. „DHEA“ setzt über Rezeptoren an der Gefäßwand an und setzt Stickoxid (NO)=7+8=15E frei, wodurch sich Gefäße weiten und die Durchblutung steigt. Die Zahl „15“ ist in DHEA=158E bereits enthalten. „Testosteron“ besitzt die gleiche Summenformel, so dass ein Unterschied entsteht, wenn die hängende „Schwerachse“ alternativ um „90“ Grad pompös-extraordinär gedreht wird. Der „DHEA-Spiegel“ erschlafft mit dem Lebensalter. „DHEA“ zieht sich über die „Schwerachse“, und zwar in der Spalte Z.38364#[161]“1025“[28…]/#_[16109]“83“[29…]/#_[16109]“4“[130…] in Z.38366 als „4“_absteigend „8“_“3“ mit Summe 4+8+3=“15“_absteigend 1025=QS=“8“ mit 15_8 für „DHEA“=158E. „DHEA-S“=C19H28O5S=114+28+40+16=198E entsteht durch Sulfatierung von „DHEA“. „DHEA-S“ bildet die Zahl „19“, indem die Zahl „15“ aus „DHEA“ seitlich um die Spalte 2/2=QS=4 für Summe 4+8+3+2+2=“19“_1025=QS=“8“ für „DHEA-S“= 198E erweitert wird. „DHEA-S“ speichert „DHEA“, weil es zurückverwandelt wird. Für „Testosteron“ (**)=158E (wie „DHEA“) entfällt die „DHEA-Startziffer“ „4“, die in der Summe „15“ durch die „DHEA-S-Ziffer“ Spalte 2/2=QS=4 wertgleich ersetzt wird.
Im Gegensatz zu „DHEA“ ist „DHEA-S“ nicht an das Transport-Protein für Sexualhormone, das „Sexualhormon-bindende Globulin (SHBG)“ gebunden, weil der linke Serien-Rand die Transportstrecke bildet und „DHEA-S“ nicht als lesbarer Unterschied zu „DHEA“ gebunden werden kann. Das Protein (Mensch) „SHBG“ („“)=402AS könnte absteigend durch die Schwerachse über einen Kunstgriff 8/2 zur Endziffer 11=QS=“2“ am Rand gezählt werden. Zweckmäßig wird aber nur eine seitliche Bindung als Dimer (Transporter + Hormon) gewählt, und zwar in der Spalte Z.38364#“161“°10°[2]°5°[28…]/#_“161“[0]°98°3°[29…]/#_[1]“61“09“413[0…]/#[16]“10“[8993…] in Z.38364 als „#161“_aufsteigend „#161“_aufsteigend „61“_aufsteigend „10“_absteigend 09=QS=“9“ mit Summe #161+#161+61+10+9=402 für „SHBG“=402AS. Außer „DHEA“ und „Testosteron“ bindet Östradiol (17-Beta-Östradiol) (°°)=C18H24O2 =108+24+16=148E als Dimer am Transporter „SHBG“. Im Blut zirkuliert „Östradiol“ frei zu 1%, ist zu 69% fest an „SHBG“ und zu 30% lose am Transporter „Albumin“ gebunden, das rechts an „Östradiol“ bindet. „Östradiol“ (°°)=148E ist beidseitig von Transportern begrenzt, und zwar in Z.38364 als „10“_aufsteigend „98“_aufsteigend Wende 41=QS=“5“_absteigend Spalte 5/3 für „35“ mit Summe 10+98+5+35=“148“ für „Östradiol“ (°°)=148E [SHBG - Sex hormone-binding globulin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ALB_Albumin“=609AS zieht durch die Metallspalte, und zwar in der Spalte Z.38364#[161]°10°[2]°5°@28@9@…/#[1610]°98°3°@29@[7]/#[16109]°41°@30@[7] in Z.38367 als „30“(Zink)_absteigend 29(Kupfer)=QS=11=QS=“2“_“28“ mit Summe 30+2+28=“60“_“9“ für ALB (@@)=609AS. „Der wichtigste Zink-Transporter im Plasma bindet typischerweise etwa 80% des gesamten Plasmazinks“. Aus Wasser/Kupfer „28/29“ kann unlesbar Magnesium 28=QS=“10“_“2“ für Mg=12E und Calcium über 29=QS=11=QS=“2“_28=QS=10 für „0“ mit 2_0 für Ca=20E gezählt werden [ALB - Albumin - Homo sapiens (Human) | UniProtKB | UniProt]. Das freie „Östradiol“ wird ohne Transport direkt von den beiden „Östradiol-Rezeptoren (ER-alpha/ER-beta)“ eingebunden, die gemeinsam ein Heterodimer bilden können. Das Protein (Mensch) „ER-alpha_ESR1“ ($$)=595AS liegt in der Spalte Z.38364#“161“°10°[2]°$5$°$2$8$…]/#_“161“[0]°9$8°3°$$2$$9$[…]/#_[1]“61“09“€41€30€[…]/#[16]“10“[8993…], und zwar in Z.38364 als „5“_“2“_aufsteigend Spalte 8/9 für „89“_“2“_83=QS=11=QS=“2“ mit „5“_Summe 2+89+2+2=“95“ mit 5_95 für „ESR1“ ($$)=595AS ESR1 - Estrogen receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ER-beta_ESR2“ (€€)=530AS nimmt das Zink auf, und zwar über „4130“ als 41=QS=“5“_“30“ für „ESR2“ (€€)=530AS [ESR2 - Estrogen receptor beta - Homo sapiens (Human) | UniProtKB | UniProt].
„Cholesterin (Cholesterol)“ führt über Zwischenstufen zum „Östradiol“. In der letzten Stufe katalysiert die Aromatase, das Protein (Mensch) „CYP19A1“ (&&)=503AS mit Cofaktor „Häm“ (||)=322E die Umsetzung von „Testosteron“ (**)=C19H28O2=114+28+16=158E zu „Östradiol“ (°°)=148E.
„CYP19A1“ (&&)=503AS liegt in der Spalte Z.38364#[16110]&2&5&28&/#[16109]&8&329&/#[16109]&4&1&[30] und startet mit der Endzahl vom Cofaktor „Häm“ (aus Kupfer der Metallspalte), und zwar in Z.38365 über „329“ als 29=QS=11=QS=“2“_“3“_aufsteigend „1“ mit Summe 2+3+1=“6“_absteigend Spalte 2/8/4 für „482“_“5“_28=QS=“10“ mit Summe 6+482+5+10=503AS. „Häm“=322E bildet die Zahl „22“ aus 8329=QS=“22“, wobei die Ziffer „3“ vorgelagert aus 102=QS=“3“ oder nachgelagert aus 30=QS=“3“ stammt [CYP19A1 - Aromatase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Östron (Estron)=C18H22O2=108+22+16=146E kann aus „Androstendion“ von „CYP19A1“ katalysiert werden, stammt aber zu 50% (extraglandulär) aus anderen Quellen - hauptsächlich aus dem Unterhautfettgewebe, wo es chemisch aus dem Hormon „Androstendion“ umgewandelt wird.
Die Fett-Spalte „3/3/3/etc.“ liegt in der Zeilen-Nrn.-Matrix Z.38“3“{64#1}[61…], so dass „Östron“=146E im Code #1 startet und nach links über Zeilen-Nr. Z.38“3“64 gespiegelt #1_4_6 (aus Z.Nr.) für Östron=146E seitlich an der „Fett-Spalte“ bindet. Bei einem Anteil von 50% kann nunmehr das Östron (;;)=146E im Code katalysiert werden, wobei es wie ein Homodimer seitlich für insgesamt 100% angelagert wird. „Androstendion“(~~)= C19H26O2=114+26+16=156E liegt neben dem externen Fett-basierten „Östron“ in der Spalte Z.38364#[1]~61~10~[2528…]/#[1610]~98~[329…]/#[16109]~41~[30…], und zwar in Z.38364 als 61=QS=“7“_“10“_aufsteigend „98“_aufsteigend „41“ mit Summe 7+10+98+41=“156“ für „Androstendion“ (~~)=156E. Entsprechend liegt Doppel-Östron {}(;;)=146E in der Spalte Z.[38]“3“{6}{4}{#1};61;10;[2528…]/#[1610];98;;329;[…]/#[16109];41;;30;[…], und zwar mit Östron (;;)=146E in Z.38364 als „61“_“10“_aufsteigend 98=QS=“17“_aufsteigend „41“ mit Summe 61+10+17+41=“129“_absteigend 329=QS=“14“_aufsteigend 30=QS=“3“ mit Summe 129+14+3=“146“ für Östron (;;)=146E.
… im April zu kalt, im nu weg mit Entourage, fett im Fliega, zur Conferenz zum Klima. Wo? Tonga
Das fettähnliche Steroid „Cholesterin (Cholesterol)“ (©©)=C27H46O=162+46+8=216E ist eine lipidähnliche Substanz, die die Zellmembran stabilisiert. Es dient außerdem als Hormon-Rohstoff, und zwar am linken Transport-Rand in der Spalte Z.38364#©161©10©©25©[28…]/#[1610]©983©[29...] in Z.38364 als #“161“_“10“_aufsteigend 983=QS=“20“_absteigend „25“ mit Summe 161+10+20+25=“216“ für „Cholesterin“ (©©)=216E. Die Umwandlung von „Cholesterin“ in „Testosteron“ wird vom Hypophysen-Hormon „Luteinisierendes Hormon (LH)_Luteotropin)“, ein Heterodimer „LH alpha+beta“, induziert [Luteinisierendes Hormon – Wikipedia]. Das Protein (Mensch) „CGA_LH-alpha“ (!!)=116AS liegt in der Spalte
Z.38364#[1]!6!11!0!|2|[528…]/#[16109]|8|[329…]/#[16109]|4|1|[30…], und zwar in Z.38363 als „0“_links „11“ mit Summe 0+11=“11“_“6“ für „CGA_LH-alpha“=116AS [CGA - Glycoprotein hormones alpha chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „LHB“ (||)=141 AS bindet an CGA spaltenförmig, und zwar als in Z.38364 aufsteigend über Spalte 2/8/4=QS=“14“_“1“ [LHB - Lutropin subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. „Cholesterin“ ist unlöslich, so dass es vom Protein (Mensch) „STAR“=285AS von der äußeren Mitochondrienmembran zur inneren Membran transportiert wird, wo es zum Vorläufer-Hormon (Prohormon) „Pregnenolon“ gespalten wird. Die Cholesterin-Endziffer „5“ bildet links mit der internen Spalte 2/8 für „28“ die äußere Membran 5+28=Membran=“33“ und kann mit „5“28 auch extern eine Membran „33“ darstellen. „STAR“=285AS zeigt diese Transport-Summen-Funktion an. „STAR“ kann aus seiner externen „28“ die Ziffer „5“ nicht links aus „Cholesterin“ ziehen, sondern muss in das Cholesterin über eine alternative Schleife in die Ziffer „3“ einbinden. „STAR“ (**)=285AS liegt mit Cholesterin (©©) in der Spalte Z.38364#©161©10©©25©*28*…]/#[1610]©98*3*©*29*...], und zwar in Z.38364 als „28“_aufsteigend 29=QS=11=QS=“2“_“3“ mit „28“_Summe 2+3=“5“ mit 28_5 für „STAR“ (**)=285AS [STAR - Steroidogenic acute regulatory protein, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Bildung von „Pregnenolon“ (;;) =C21H32O2=126+32+16=174E werden Hydroxylgruppen (-OH) in Cholesterin eingeführt und eine Seitenkette abgespalten [Pregnenolon - DocCheck Flexikon]. Der linke Cholesterin-Rand wird alternativ gezählt, und zwar in der Spalte Z. 38364#;16;110;[2528…]/#[1610];98;32;[9…]/#[16109];413;[0…] in Z. 38364 als 16=QS=“7“_“110“_aufsteigend 98=QS=“17“ mit Summe 7+110+17=“134“_aufsteigend 413=QS=“8“_absteigend „32“ mit Summe 134+8+32=“174“ für „Pregnenolon“ (;;) 174E. Das „Cholesterin“ wird rechts um die Zahl „25“ gekürzt und aufsteigend in Z.38366 mit der Zahl „41_2/3“=QS=10 ergänzt. Die Spalte 252/32 würde zwar ebenfalls 25+2+3+2=“32“ ergeben, kann aber als Ziffern-Folge nicht realisiert werden.
Die Umwandlung von „Cholesterin“ zu „Pregnenolon“ wird vom Protein (Mensch) „CYP11A1_Cholesterin-Monooxygenase“ (µµ)=521AS katalysiert. „CYP11A1“ besitzt den Cofaktor „Häm“=322AS und eine Bindungsstelle für Eisen=26E. „CYP11A1“ wird am rechten „Cholesterin-Rand“ gebildet, und zwar in der Spalte Z.38364#[16110]µ25µ28µ[…]/#[16109]µ8329µ[…]/#[16109]µ41µ[30…] in Z.38366 als 41=QS=“5“_ absteigend 83=QS=11=QS=“2“_29=QS=11=QS=“2“_absteigend 28=QS=“10“_25=QS=“7“ mit „5“_Summe 2+2+10+7=“21“ mit 5_21 für „CYP11A1“ (µµ)=521AS. „Häm“=3“22“E ist mit dem Anteil „8329“=QS=“22“ enthalten, wobei über die Spalte 8/“4“ das Eisen u.a. aus 22+4=Eisen=26 zählbar ist. Interagiert mit „Adrenodoxin“ [CYP11A1 - Cholesterol side-chain cleavage enzyme, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FDX1_Adrenodoxin“ (°°) =184AS liegt in der Rand-Spalte Z.38364#_°981°4°[05]/#_[775]°6°4°[5] rechts an „CYP11A1“ und pendelt zwecks Übertragung von Elektronen. Ursache ist die Möglichkeit, die Endziffer „4“ direkt zu nutzen oder wechselweise als Verlängerung über einen Kunstgriff zu bilden. „FDX1“ (°°)=184AS über „9814“ als 981=QS=18_4 für 184AS (short); alternativ 981=QS=18_aufsteigend Spalte 4/6=10 für „0“_4 mit „18“_Summe 0+4=“4“ mit 18_4 für „FDX1“ (°°)=184AS (long). „FDX1“ besitzt den Cofaktor „[2Fe-2S]-Cluster“, der auch als Addition 2*26=“52“_2*16=“32“ unlesbar ist. Die Cluster-Summe 52+32=“84“E zeigt in der Spalte „4“/8 für 84E die Zielführung zur Ziffer „4“ (long) an [FDX1 - Adrenodoxin, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt].
„Pregnenolon“ wird durch das Protein (Mensch) „CYP17A1_Steroid-17-alpha-Hydroxylase“ {}=508AS verarbeitet, wobei für den Cofaktor „Häm“=3“22“E dessen Blockbreite 8329=QS=“22“ erwünscht ist. „CYP17A1“ liegt in der Spalte Z.38364#{161}{102}{5}{2}[8…]/#[16]{10}[9]{8}{3}{2}{9}[…]/#[16109]{4}{1}{3}{0}[…], und zwar in Z.38364 als „161“_Schleife aufsteigend „10“_ absteigend 102=QS=“3“_aufsteigend Spalte 8/4 für „84“_absteigend Spalte 3/1 für „13“_absteigend „5“_aufsteigend Spalte 2/2/3 für „223“_absteigend Spalte 9/0 für „9“ mit Summe 161+10+3+84+13+5+223+9=“508“ für „CYP17A1“ {}=508AS. „Häm“=322E als 102=QS=“3“_aufsteigend 8329=QS=“22“ mit 3_22 für „Häm“=322E. „CYP17A1“ wird durch den intrazellulären „cAMP-Spiegel“ reguliert. „cAMP“=C10H12N5O6P =60+12+35+48+15=170E liegt in „2“ Zeilen am Serien-Rand über #16109 als Summe #161+0+9=“170“ für cAMP=170E vor. In Z.38366 erfolgt eine wirkungslose seitliche Bindung. Wechselweise wird in Z.38365 aber die Schleifen-Zahl „10“ eingebunden. Die männliche Geschlechtsdifferenzierung des Menschen erfordert die Produktion von fetalem Hodentestosteron, dessen Biosynthese die Aktivität des Steroids 17,20-Lyase erfordert [„Die genetischen und funktionellen Grundlagen des isolierten 17,20-Lyase-Mangels | Nature Genetics“; D.Geller u.a.; Okt.1997; https://doi.org/10.1038/ng1097-201]. Der Geschlechtsunterschied liegt im Häm-Block „8329/4130“. In der Spalte 32/1[2] ist absteigend 1+32=männlich=“33“(Symbol) zählbar. Gleichzeitig kann aber nicht aufsteigend „8329“=22_aufsteigend 41_3 mit Summe 22+41+3=weiblich=“66“ (Symbol) gezählt werden. „CYP17A1“ hydroxyliert Steroidhormone, Pregnenolon und Progesteron, um 17-Alpha-Hydroxymetaboliten zu bilden, gefolgt von der Spaltung der C17-C20-Bindung zur Bildung von C19-Steroiden, Dehydroepiandrosteron (DHEA) und Androstendion“ [CYP17A1 - Steroid 17-alpha-hydroxylase/17,20 lyase – Homo sapiens (Human) | UniProtKB | UniProt].
„Androstendion (Androst-4-en-3,17-dion)“ (~~)=C19H26O2=156E wird im letzten Schritt mittels der „17-beta-Dehydrogenase“ zu „Testosteron“ (**)=C19H28O2=158E konvertiert. Für die Katalyse ist „Testosteron-17β-Dehydrogenase“ zuständig [17β-Hydroxysteroid-Dehydrogenasen – Wikipedia]. Das Protein (Mensch) „HSD17B3“ (^^)=310AS nimmt die Gemeinsamkeit der Überlagerung beider Hormone auf. „HSD17B3“ liegt in der Spalte Z.38364#[1]^61^102^52^8^[981…]/#[1610]^98^32^9^[775…]/#[16109]^41^^3^^0^[788…]/#[1610899]^3^[2020…], und zwar in Z.38364 als „61“_“102“_aufsteigend 98=QS=“17“_aufsteigend „41“_absteigend „32“_absteigend 52=QS=“7“ mit Summe 61+102+17+41+32+7=Teilsumme=“260“. Die erforderliche Restzahl „50“ soll „NADP“= C21H29N7O17P3=126+29+49+136+45=385E und „NADPH“=C21H26N7O17P3=126+26+49+136+45=382E aktivieren, die seitlich anschließen. Restzahl „50“ als aufsteigend Spalte 8/9/0=QS=“17“_aufsteigend Spalte 3/3 für „33“ mit Gesamtsumme 260+17+33=“310“ für HSD17B3“ (^^)=310AS [HSD17B3 - 17-beta-hydroxysteroid dehydrogenase type 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Der komplizierte Zählweg wäre nur zufällig korrekt, enthält aber mit der Endzahl „33“=männlich einen erforderlichen Hinweis zur Ausbildung männlicher Genitalen. „Defekte bei der Umwandlung von Androstendion in Testosteron in den fetalen Hoden durch das Enzym 17-Beta-Hydroxysteroid-Dehydrogenase (17 Beta-HSD) führen zu genetischen Männern mit weiblichen äußeren Genitalien“ [Männlicher Pseudohermaphroditismus, verursacht durch Mutationen der testikulären 17 Beta-Hydroxysteroid-Dehydrogenase 3 - PubMed (nih.gov); W.Geissler u.a.; Mai 1994; DOI: 10.1038/ng0594-34].
„NADPH“($$)=382E liegt mit „HSD17B3“(^^) in der Spalte Z.38364#[1]^61^*102^5*2*^8^[981405]/#[1610]^9*8^3*2*^€9^77564€5€/#[16109]^41^^$3^^0$^$78$[8788]/#[1610899]^3^$20$2$[0816], und zwar in Z.38366 als 30=QS=“3“_“78“_aufsteigend „2“_20=QS=“2“ mit „3“_Summe 78+2+2=“82“ mit 3_82 für „NADPH“ ($$)=382E. Die Bindungsstelle für „NADP“ (€€)“=C21H29N7O17P3=126+29+49+136+45=385E liegt als Randzahl rechts am Testosteron (**), und zwar in Z.38365 über „977564“=QS=“38“_“5“(Randziffer) für „NADP“ (€€)“=385E. Testosteron“ (**)=158E liegt in der Spalte Z.38364#[161]“1025“2“[8…]/#_[16109]“83“2“[9…]/#_[16109]“4“[130…], und zwar in Z.38365 als 83=QS=11_absteigend Spalte „2/2“=QS=“4“ mit Summe 11+4=“15“_1025=QS=“8“ mit 15_8 für Testosteron“ (**)=158E.
Das Cholesterin wird im Blut als Cholesterinester in Form von Lipid-Protein-Partikeln, den „Low-Density-Lipoproteinen (LDL)“, transportiert. Lipoproteine (VLDL, IDL und LDL) transportieren selbst hergestelltes und aufgenommenes Cholesterin von der Leber zu den Geweben. „HDL“ nehmen Cholesterin aus den Geweben auf und bringen es zur Leber zurück. „LDL“ besteht zu etwa 50% aus Cholesterin, der Rest besteht zu etwa gleich großen Anteilen aus „Proteinen“ und „Phospholipiden“. „Phospholipide“ sind fettähnliche „Lipide“, die eine Esterbindung mit Phosphorsäure enthalten. Für diese unbestimmte Mischung liegt hier keine Strukturformel vor. „LDL“ kann die Größe der Colesterin-Packung aus der Cholesterin-Randspalte Z.38364#_025…/#_[9]83... als Vorgabe gewinnen, und zwar enthält „0“25“ den LDL-Durchmesser „O“_Summe 2+5=Form=“7“ mit max. Durchmesser=25 nm. Der min. Durchmesser als 2/8=QS=“10“_5/3=QS=“8“ mit Summe 10+8=“18“ für „min D“=18 nm. „LDL“ kann indirekt über seinen Rezeptor erkannt werden, der weit entfernt aufsteigend am rechten Rand liegt. Sobald eine Zelle „LDL“ benötigt, bilden sich „LDL-Rezeptoren (LDLR)“ auf ihrer Zellmembran. Zur Aufnahme von „LDL“ wird die Endocytose eingeleitet [Cholesterin – Wikipedia]. „LDLR“ besitzt hierfür das „Apolipoprotein B-100“ als Ligand. LDLR-PGRMC1-TMEM97-Komplex: Das Cholesterin liegt an der Serien-Grenze #1611/#1610, so dass der Rezeptor „LDLR“ diese Entfernung mathematisch überbrückt, indem er einen 3-teiligen (ternären) Komplex zusammen mit den Rezeptoren „PGRMC1“ und „TMEM97“ angehört. „TMEM97“ bindet am „Cholesterin“. „PGRMC1“ bindet an das Sexualhormon „Progesteron“ (??)=C21H30O2=126+30+16=172E, dessen Umwandlung von „Pregnenolon“ (;;)=C21H32O2=126+32+16=174E zu „Progesteron“ von der „3β-Hydroxysteroid-Dehydrogenase (3β-HSD)“ katalysiert wird [3β-Hydroxysteroid-Dehydrogenase – Wikipedia]. Die 2 Isoformen „HSD3B1“=373AS und HSD3B2=372AS unterscheiden sich aufgrund unterschiedlicher Bindestellen „NADP/NAD“. „Progesteron“ kann über Zwischenstufen zu Testosteron und Estradiol verarbeitet werden [ Progesteron - DocCheck Flexikon]. Wunschgemäß soll der rechte Rand von „Pregnenolon“ (;;) für „Progesteron“ (??) glatt verkürzt werden, um rechts die Testosteron-Spalte „2/2“ für Bindungen frei zu halten. Hierfür wird eine Schleife über die freie Zahl „25“ eingefügt und der Schwanz gekürzt. „Progesteron“ (??)=172E in Z.38364 als 16=QS=“7“_„110“_Schleife aufsteigend 98=QS=“17“_absteigend 25=QS=“7“_aufsteigend Spalte 3/1 für „31“ mit Summe 7+110+17+7+31=“172“ für „Progesteron“ (??)=172E. Das Protein (Mensch) „HSD3B1“ (\\)=373AS bindet am Coenzym „NADP“ (€€)“=385E, das den Zeilenrand in Z.38365 mit „977564“=QS=“38“_“5“(Randziffer) für „NADP“ (€€)=385E. „HSD3B1“ zieht durch die Ziffer-„2“-Lücke zwischen „Progesteron“ (??) und „NADP“ (€€), und zwar in der Spalte Z.38364#?16?110?25?/28/98/1/[405]/#[1610]?98?3?/2/€977564€5€/#[161094]?1?/3/[0788788)/#[1610899]/3/20/20/81/[6] in Z.38364 über „28981“ als „1“_98 links für „89“_28=QS=“10“ mit Summe 1+89+10=“100“_aufsteigend Spalte 2/3/3 für „233“_“20“_“20“ mit Summe 100+233+20+20=373 für „HSD3B1“ (\\)=373AS [HSD3B1 - 3 beta-hydroxysteroid dehydrogenase/Delta 5-->4-isomerase type 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Isoform, das Protein (Mensch) „HSD3B2“ (//)=372AS ist mit dem Coenzym „NAD“ ($$)=C21H27N7O14P2=126+27+49+112+30=344E als Ligand funktionell gleichwertig. „HSD3B2“ (//)=372AS klemmt sich in die Ziffer-„2“-Lücke in Z.38365 links neben „NADP“, bindet aber erst im aufsteigenden „NAD“($$), und zwar in der Spalte Z.38364#?16?110?25?/289/81/[405]/#[1610]?98?3?/2/€977564€5€/#[161094]?1?$3$0$78$87$88$///#[1610899]$3$2020$81$[6] als „2“_absteigend „289“_“81“ mit Summe 2+289+81=“372“ für „HSD3B2“ (//)=372AS. „NAD“ ($$)=344E liegt parallel an „NADP“ in Z.38366 vom Rand nach links als „88“_links 87 für „78“_links 78 für „87“_“0“_aufsteigend Spalte 3/3=QS=“6“_2020=QS=“4“_“81“ mit Summe 88+78+87+0+6+4+81=“344“ für „NAD“ ($$)=344E [HSD3B2 - 3 beta-hydroxysteroid dehydrogenase/Delta 5-->4-isomerase type 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Der LDL-Rezeptor, das Protein (Mensch) „LDLR“ {}=860AS liegt in der Randspalte Z.38366#_[130](788){788}/#_[932](0)(2)[0]{8}{1}{6}/#_[7334](7)[17]{1}{2}, und zwar in Z.38366 als „788“_Randaufstieg Spalte 6/2 für „62“_absteigend Spalte 1/1=QS=“2“_“8“ mit 788+62+2+8=“860“ für „LDLR“ {}=860AS (Monomer). Die Magnesium-Zahl „12“E wird getrennt, so dass keine Mg-Bindung entsteht. „Calcium“=20E bindet links an der Endziffer „8“. „LDLR“ kann ein Homo-Dimer bilden, sobald mitwirkende Proteine den Platz freigeben. Weil die Startzahl „788_788“ als Doppelpack vorliegt, ist ein Dimer bereits offensichtlich. „LDLR“ ()=860AS (Homodimer) in Z.38367 absteigend in der Spalte 2/7 für „72“_links „0“_absteigend „788“ mit Summe 72+0+788=“860“ für „LDLR“ ()=860AS (Homodimer) [LDLR - Low-density lipoprotein receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Aufgrund der Parallelität liegt das quer liegende Protein (Mensch) „Apolipoprotein_APOB“ (!!) =4563AS aufsteigend als Ligand am Homodimer, und zwar in der Spalte Z.38366#_[130](788){788}/#_[932](0)(2)[0]{8}{1}{6}/#_[7334](7)[17]{1}{2}/#_[5351]!4!14!5!!9!/#_[3370300]!4!!0! in Z.38369 als „4“_14=QS=“5“_aufsteigend Spalte 5/4 für „54“_absteigend Spalte 9/0=QS=“9“ mit 45_Summe 54+9=63 mit 45_63 für APOB“ (!!) =4563AS. „Heparin“=C26H41NO34S4=156+41+7+272+64=540E ist aufgrund der enthaltenen Zahl „54“ in der Randspalte „5“[9]/“40“ für APOB=540E als eine vollständige Einbindung in „APOB“ lesbar [APOB - Apolipoprotein B-100 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PGRMC1“ (!!)=195AS muss gemeinsam mit „TMEM97“ die Lücke zwischen „Progesteron“ bzw. „Cholesterin“ zum entfernten „LDLR“ überbrücken. „PGRMC1“ (!!)=195AS liegt recht neben „Progesteron“ und zieht wellenförmig zur Bindung am Homodimer „LDLR“ entlang, und zwar in der Spalte Z.38364#_?5?!2!89![8140]!5!/#_?3?!2![9]!7!75!64!5!/#_?1?“30788“{788} in Z.38364 absteigend in Spalte 2/2=QS=“4“_“89“_absteigend „7“_“75“_64=QS=“10“_absteigend Randspalte 5/5=QS=“10“ mit Summe 4+89+7+75+10+10=195AS. Die Startspalte 2/2/[3] liegt in einer Häm-Spalte für „Häm“=322E. Das „Eisen“ nutzt die Häm-Ziffer „3“ in Z.38364 mit „30788“=QS=Eisen („“)=26E zur Bindung an „PGRMC1“. Das aktivierte „Eisen“ stört das LDLR-Homodimer, aber das LDLR-Monomer {} am Rand ist nicht betroffen [PGRMC1 - Membrane-associated progesterone receptor component 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Rezeptor, das Protein (Mensch) „TMEM97“ (||)=176AS kann mit der Startziffer „1“ in Z.38366 eine Bindung an „Cholesterin“ (©©) herstellen, weil die Ziffer „1“ nur vom „Progesteron“ benötigt wird. „TMEM97“ (||)=176AS liegt seitlich neben „LDLR“ {}(Monomer), und zwar in der Spalte Z.38366#_[4]|1307|88|{788}/#_[99]|32020|{8}{1}{6}/#_^57^|33|47|17|{1}{2} in Z.38365 als 1307=QS=“11“_“88“_32020=QS=“7“_aufsteigend 33=QS=“6“_“47“_“17“ mit Summe 11+88+7+6+47+17=“176“ für TMEM97“ (||)=176AS. „Bindet das Speichelpeptid Histatin 1 (Hst 1)/HN1 an der ER-Membran“ [TMEM97 - Sigma intracellular receptor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Speichelpeptid, Protein (Mensch) „Histatin-1“ (^^)=57AS bindet lesbar, seitlich an der Membran „33“, die folglich die ER-Membran repräsentiert [HTN1 - Histatin-1 - Homo sapiens (Human) | UniProtKB | UniProt].
„Statine“ sind Cholesterin-Senker, die mehr LDL-Rezeptoren erzeugen, damit zum Schutz der Gefäße mehr LDL-Cholesterin aus dem Blut entnommen wird. „Bempedoinsäure“= C19H36O5=114+36+40=190E wirkt ähnlich, hemmt aber nicht wie „Statine“ die „HMG-CoA-Reduktase“ [Bempedoinsäure – Wikipedia]. „Bempedoinsäure“ wird in der Leber durch das Enzym „Very Long-Chain-Acyl-CoA-Synthetase (SLC27A2 / ACSLV1)“ zur aktiven „Bempedoinsäure-CoA“, indem „Coenzym A(CoA)“=C21H36N7O16P3S=126+36+49+128+45+16=400E an die Säure angehängt wird. „SLC27A2“ fehlt in der Skelettmuskulatur, so dass das Medikament „„Bempedoinsäure“ keinen Muskel-Schmerz auslöst [Wirkstoff Bempedoinsäure als neuer Blutfett-Senker (laborjournal.de): Holricher; Mai 2023]. Die Hemmung der „ATP-Citrat-Lyase“ senkt die Produktion von „Cholesterin“ in der Leber, wodurch dieser Mangel die Bildung von LDL-Rezeptoren erzwingt, so dass LDL-Cholesterin im Blut über die Aufnahme in die Zelle reduziert wird. „Bempedoinsäure“ {}=190E liegt in der Spalte Z.38365#_[2977]{|5|6}{45}|/#_[3]{0}{78}{|8|7}[88]/#_[3]|{2}(0)(2)|(0)|[816]/#_[3]|{3}|(4)(7)(1)[712], und zwar in Z.38366 absteigend in Spalte 0/2/3=QS=“5“_“78“_“87“ mit Summe 5+78+87=“170“_absteigend 56=QS=“11“_45=QS=“9“ mit „170“_Summe 11+9=“20“ mit Summe 170+20=“190“ für „Bempedoinsäure“ {}=190E. CoA ()=400E ringförmig angehängt, und zwar in Z.38367 absteigend als Spalte 0/4 für „40“_“2“_aufsteigend Spalte 0/1=QS=“1“_“7“ mit „40“_Summe 2+1+7=10 für „0“ mit 40_0 für „CoA“=400E. Das Protein (Mensch) „SLC27A2“ (||)=620AS muss zur Kopplung durch die Säure und CoA ziehen, und zwar vom Medikamenten-Rand in Z.28365 als 645=QS=“15“_aufsteigend Spalte 5/8/0 für „580“ mit Summe 15+580=“595“_links über 202 für „22“_aufsteigend „3“ mit Summe 595+22+3=“620“ für „SLC27A2“ (||)=620AS [SLC27A2 - Long-chain fatty acid transport protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Vermittelt über „SLC27A2“, hemmt die „Bempedoinsäure“ das Protein (Mensch) „ACL_ATP-Citrat-Lyase“ (!!)=1101AS. „ACL“ überträgt Acetylgruppen „–C(O)CH3“ von „Citrat“ auf „Coenzym A“=400E. Das entstehende „Acetyl-CoA= C23H38N7O17P3S“=138+38+49+136+45+16=422E ist Ausgangsstoff der Cholesterin-Synthese. „ACL“ (!!)=1101AS zieht winkelförmig parallel zu SLC27A2“ (||) in CoA ein und endet neben ACL-Cofaktor „Magnesium“=12E (Randzahl), und zwar in der Spalte Z.38365#_[977]|5|645|/#_[078]|8|!7!88!/#_|202|0|!8!16/#_|3|[47]!1!7!“12“ in Z.38366 als „88“_aufsteigend Spalte 7/8/7=QS=“22“ mit Summe 88+22=“110“_links „1“ mit 110_1 für „ACL“ (!!)=1101AS. Das ATP=260E ist klassisch in der Mg-Spalte „12/59“ als „2“_Summe 1+59=“60“ für ATP=260E angeschlossen [ACLY - ATP-citrate synthase - Homo sapiens (Human) | UniProtKB | UniProt].
Das „High Density Lipoprotein (HDL)“ transportiert das verpackte „LDL-Cholesterin“ im Durchmesser=5 - 17 nm aus dem Gewebe zur Leber zurück. Mathematisch ist „Cholesterin“ nicht beteiligt, weil es passiv verpackt wird und an der Serien-Grenze als Fixpunkt liegen bleibt. Zunächst wird in der Leber das Protein (Mensch) „LCAT_Lecithin-Cholesterin-Acyltransferase“ {}=440AS gebildet, das die Bildung eines „Vorläufer-HDL“ katalysiert. Aufgrund der Einlagerung von „Cholesterinester“ wächst eine runde Form [Lecithin-Cholesterin-Acyltransferase - DocCheck Flexikon]. Das Apolipoproteine „Apo1“ schließt als Ligand die Lücke zum „Cholesterin“. „LCAT“ {}=440AS liegt in der Spalte Z.38367#_{9}{320}{20}[816]/#_{7}{3}[3471712], und zwar in Z.38367 aufsteigend als Spalte 9/7 für „97“_“3“ mit Summe 97+3=“100“_absteigend „320“_“20“ mit Summe 100+320+20=“440“ für „LCAT“ {}=440AS [LCAT - Phosphatidylcholine-sterol acyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. „LCAT“ {} wird durch Dithionitrobenzoesäure (DTNB)=C14H8N2O8S2=84+8+14+64+32=202E gehemmt [Ellmans Reagenz – Wikipedia]. Die Zahl „202“ liegt lesbar in „LCAT“. „LCAT“ wird durch Haptoglobin=406AS gehemmt, und zwar in der Spalte „2020/3471“ als Summe 20+20=“40“_aufsteigend „1“_74=QS=11=QS=“2“¬¬_“3“ mit „40“_Summe 1+2+3=“6“ mit 40_6 für Haptoglobin=406AS [HP - Haptoglobin - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „APOA1“ (!!)=267AS (Monomer) ist „LCAT“ {} als Ligand vorgelagert und bindet am Cholesterin (©©) in der Spalte Z.38364#_©025©[2898]14[05]/#_©983©[29]775645/#_!94130!7![88788]/[89]{9}{320}{20}[816]/#_[85]{7}{3}[347171}, und zwar in Z.38366 als „94130“=QS=“26“_“7“_für „APOA1“ (!!) =267AS (Monomer). Der max. HDL-Durchmesser=17 nm wird aus „9413“07“ mit „9413“=QS=17nm_“O“_7=Form interpretiert. Fortsetzung: „APOA1“ (||) =267AS (Homodimer) in Z.38364 als „4“_aufsteigend_Spalte 1/5 für „15“_“7“ mit Summe 4+15+7=“26“_“7“ für „APOA1“ =267AS (||) (Homodimer) mit Kopplung an Monomer in Spalte „7/7“ [APOA1 - Apolipoprotein A-I - Homo sapiens (Human) | UniProtKB | UniProt].
Das fettbindende Protein (Mensch) „ApoE_Apolipoprotein E“ ist Bestandteil von Lipoproteinpartikel. Es entsteht vorwiegend in der Leber und ist u.a. im „HDL“ enthalten. „ApoE“ vermitteln den Transport von „Triglyzeriden“ und „Cholesterin“ im Blut. Die wissenschaftliche Darstellung ist momentan unverständlich, weil zum Gen „ApoE“ diverse Proteine dukumentiert sind. Gemäß Wikipedia besitzt „ApoE“ nur „299“AS und existiert in der Bevölkerung hauptsächlich mit den Allelen E2, E2 und E4, die evolutionär in der AS-Sequenz an 2 AS-Positionen modifiziert wurden. Hier werden „abweichend alle 3 Proteine“ der maximalen Länge von „ApoE“=317AS zugeordnet, und Unterschiede in der Zählweise festgestellt. Die Bezeichnung der „3“ Allele wird frei ausgewählt [Apolipoprotein E – Wikipedia]. Von den 3 Isoformen ist „ApoE3“ weit verbreitet und bindet wie „ApoE4“ verstärkt am Rezeptor „LDLR“, wobei sich bei „ApoE4“ das Risiko einer Alzheimer-Erkrankung durch einen zeitlich früheren Verlauf um 5-10 Jahre erhöht. Die Entwicklung über „21“ Jahre wird somit frühzeitiger gezählt. Von der Basis-Zählung „300“ bis zum „LDLR“ {} (Monomer) verbleibt eine Lücke „17“, die von den „3“ Isoformen unterschiedlich geschlossen wird. Die „3“ Isoformen unterscheiden sich an AS-Position 112 und 158. „ApoE4“ mit doppelt Arg, „ApoE2“ mit doppelt Cys und „ApoE3“ gemischt Cys/Arg [Apolipoprotein E - DocCheck Flexikon]. Im Normalfall „ApoE3“ (||) wird die lesbare Zahl „17“ neben „LDLR“ als Motivation zur Zielfindung gelesen. Mit doppelt Cystein=64E als Kreis=64 kann ApoE2 (!!) kompakt als Ring geschlossen werden, wobei „LDLR“ {} nur leicht tangiert wird. „ApoE4“ (§§) bindet intensiv an „LDLR“ {} mit einer weiten Schleife, die eine Zählgröße „11“ zur Alzheimer-Zeitzählung enthält. „ApoE2“ (!!) liegt mit „LDLR“ {} in der Spalte Z.38369#_[88]{788]/#_[20]{8]{1}{6}/#_[7]|1|7|1}{2}/#_|!41||4|!!5!9/#_|!300!|!4![0] in Z.38370 als „300“ _absteigend Spalte 5/4=QS=“9“_414=QS=“8“ mit Summe 300+9+8=“317“ für „ApoE2“ (!!). Im Normalfall wird die lesbare Zahl „17“ neben „LDLR“ als Motivation zur Zielfindung gelesen, und zwar für „ApoE3“ (||)=317AS als „300“_absteigend Spalte 7/4=“11“_absteigend 1/1=QS=“2“_“4“ mit Summe 300+11+2+4=“317“ für „ApoE3“ (||)=317AS. „ApoE4“ (§§) liegt in der Spalte Z.38369#_[88]{788]/#_[20]{8]{1}{6}/#_[7]|1|7|1}{2}/#_|!41||4|!!5!9/#_|!300!|!4![0], und zwar in Z.38370 als „300“_aufsteigend Spalte 7/4=QS=“11“¬_aufsteigend Jahreszähler „20/[7]1“ für „21“ Jahre als QS=“3“_absteigend Spalte 7/4=QS=11=QS=“2“_rechts „1“ mit Summe 300+11+3+2+1=“317“ für „ApoE4“ (§§)=317AS. „ApoE“ bindet „Heparin“=C26H41NO34S4=156+41+7+272+64=540E lesbar in der Randspalte 5[9}/40, so dass damit die Zeitbasis „365“ (1 Jahr) über „300“_“40“ absteigend 59=QS=“14“_absteigend Spalte 7/4=QS=“11“ (Zählgröße) mit 300+40+14+11=“365“ (Zeitbasis) vorliegt. Sobald „ApoE4“ am Rezeptor „LDLR“ andockt, kann auch ein kurzer Exot, das Protein (Mensch) „ApoE_D9ZB55“=91AS seinen Platz finden, und zwar in der Spalte in Z.38366 als „88“_absteigend Spalte 7/0/4=QS=11=QS=“2“_abstiegend „1“ mit Summe 88+2+1=“91“ für ApoE „Spezial“=91AS [APOE - Apolipoprotein E - Homo sapiens (Human) | UniProtKB | UniProt].
„Triglyzeride“ (Triacylglycerole/TAG) sind Verbindungen von Glycerin=C3H8O3=18+8+24=50E mit „3“ Fettsäuren, die zur Energieversorgung benötigt werden und von „ApoE“ transportiert werden. Folglich wird Glycerin=50E selbst das Bindungsmerkmal sein. In Z.38368#_3“3“47“1712 kann die Ziffer „7“ je nacb ApoE-Variante binden/einbinden und „Glycerin“ als 3_47 für „50E“ erzeugen. Links gehört die Ziffer „3“347 zur Fettspalte 3/3/3/…, die mit der Ziffer „3“ zur Verbindung mit „3“ Fettsäuren animiert. In der Synthese wird aus „Glycerin“ zunächst „Glycerin-3-Phosphat“=C3H9O6P=18+9+48+15=“90“E produziert. Die Erhöhung von „50“ auf „90“ ist vorgelagert als „20“20“/“3“47“[1]. Die anschließende Dehydrierung führt im weißen Fettgewebe und in der Skelettmuskulatur zu „Dihydroxyacetonphosphat“=C3H7O6P=18+7+48+15=“88“E, die in Z.38366#_7“88“7“88“ am Zeilenrand lesbar ist. Bei der 1. aktivierten Fettsäure ist die „Glycerinphosphat-Acyl-Transferase“ beteiligt, wobei „Lysophosphatidat“ entsteht. Das Protein (Mensch) „GPAT3“ (^^)=434AS wird durch den experimentellen Wirkstoff „N-Ethylmaleimid (NEM)“=C6H7NO2=36+7+7+16=66E gehemmt, der eine Abnahme der Lichtabsorption bei Wellenlänge 300 nm anzeigt. Als Möglichkeit kann „GPAT3“ von der Wellenlänge 300 nm, zugleich Basiszahl „300“AS von „ApoE“, über die Fett-Spalte bis zum paarigen Skelett mit Calcium „202“ und Dopplung „88“ am Zeilenrand absteigen, und zwar in der Spalte Z.38366#_[307]^88^7^88^/#_[3]^202^[0816]/#_^33^[471712]/#_^3^[5141459]/#_^3^70300^[40] in Z.38370 als 70300=QS=“10“_links absteigend Spalte 3/3=QS=“6“_absteigend „33“_absteigend „202“_“88“_“7“(Form)_“88“ mit Summe 10+6+33+202+88+7+88=“434“ für „GPAT3“ (^^)=434AS [GPAT3 - Glycerol-3-phosphate acyltransferase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Weil „GPAT3“ am rechten Rand die Zahl „788“ vom LDL-Rezeptor „LDLR“ besetzt, dient der VLDL-Rezeptor „VLDLR“ als Alternative, indem er die GPAT3–Enden am Zeilenrand zum Ring verbindet. Das „Very Low Density Lipoprotein (VLDL) ist voluminöser als „LDL“ und enthält außer Cholesterin u.a. „Triacylglyceride“ und „ApoE“. Das Rezeptor-Protein (Mensch) „VLDLR“ (°°)=873AS liegt in der Spalte Z.38366#_[88788]/#_[20]°816°/#_[7]µ1µ7µ°12°/#_[4]µ1µµ4µ°5°9/#_[0]µ0µ°4°0/#_[37]µ4µ38], und zwar in Z.38367 als „816“_aufsteigend 12 (nach links Mg nicht erkannt)=QS=“3“_aufsteigend Spalte 5/4 für „54“ mit Summe 816+3+54=“873“ für „VLDLR“ (°°)=873AS. Die Startzahl „816“ liegt zur Bindung neben Calcium=20E. An den nadelförmigen „VLDLR“ legt sich seitlich „CLU“ an. Weil die Zahl „88“ freigeräumt wird, ist die Interaktion mit „DAB1“=588AS vorgelagert in der Randspalte Z.38365#_[4]“5“/#_“88“. „DAB1“ ist links an der DAB1-Dopplung „5/88-7-5/88“ nochmals vorhanden. „VLDLR“ enthält in der Startzahl 8“16“ für eine Disulfidbrücken-Bindung „16-16“ den Schwefel „16“ und die Brücke über die Zahl 88=QS=“16“(Schwefel) [VLDLR - Very low-density lipoprotein receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) (µµ) „CLU_Clusterin“=449AS in Z.38369 als absteigend in Spalte 4/0/4 als 40=QS=“4_“4“_absteigend 17=QS=“8“_aufsteigend „1“ mit „44“_Summe 8+1=“9“ mit 44_9 für „CLU“=449AS [CLU - Clusterin - Homo sapiens (Human) | UniProtKB | UniProt].
Das Rezeptor-Protein (Mensch) „LPR8_Apolipoprotein-E-Rezeptor 2 (ApoER2)“ (**)=963E teilt mit „VLDLR“ den gemeinsamen extrazellulären Liganden „Reelin“. Der Rezeptor „LPR8“ (**) liegt seitlich an „VLDLR“ (°°) in der Spalte Z.38365#_~3~29~7~7~56~~45~/#_~1~3~~0~7~8~8~~788~/#_[9]~3~*20**2**0*°816°/#_733*4*7**1*7*°12°/#_35141*4*°5°[9]/#_[3370300]°4°[0], und zwar in Z.38367 als „20“_aufsteigend „4“_absteigend mit Schleife am linken, doppelten „DAB1“ über Spalte 2/7 für „72“ mit Summe 20+4+72=“96“_aufsteigend Spalte 0/1=QS=“1“_aufsteigend Spalte 7/4=QS=11=QS=“2“ mit „96“_Summe 1+2=“3“ mit 96_3 für „LPR8“ (**)=963AS [LRP8 - Low-density lipoprotein receptor-related protein 8 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „Reelin“ (~~)=3460E liegt an Grenze in Z.38365 am Rand 45=QS=“9“_aufsteigend 788=QS=“23“ mit Summe 9+23=“32“_Schleife über Serin=56E als QS=11=QS=“2“_aufsteigend „8“_absteigend Spalte 7/8=QS=“15“_aufsteigend Spalte 7/7=QS=“14“_“0“(aus Zink=3“0“E)_absteigend 29=QS=“11“_aufsteigend Spalte 3/1=QS=“4“_aufsteigend Spalte 3(aus Zink=“3“0E)/3=QS=“6“ (rechts neben LRP8) mit „32“_Summe 2+8+15+14+0+11+4+6=“60“ mit 32_60 für „Reelin“ (~~)=3460E [RELN - Reelin - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CETP_ Cholesterinester-Transferprotein“ (??)= 493AS bewirkt einen Austausch von Lipiden zwischen proteinreichen „HDL“ und lipidreichen „VLDL“, wobei einerseits „Triglyceride“ von „VLDL“ auf „HDL“ transferiert, und andererseits das „HDL“ Cholesterinester an „VLDL“ abgibt [Cholesterinester-Transferprotein - DocCheck Flexikon]. Im Prinzip darf das LDL-Cholesterin, das über die HDL aus dem Gewebe in die Leber zurück transportiert wird, keinen sich steigernden Kreislauf bilden. Cholesterin soll in Form von Gallensäure und freiem Cholesterin über die Galle ausgeschieden werden. Ursodeoxycholsäure=C24H40O4=144+40+32=216E gehört zur Gruppe der Gallensäuren, die auch Gallensteine auflösen. Das Verhältnis der Konzentration von pro-atherogenem „LDL“ zu anti-atherogenem „HDL“ wird als atherogener Index bezeichnet. Mäusen fehlt das „CETP codierende Gen“, so dass „LDL“ unproblematisch ist. „CETP“ (??)= 493AS besitzt Bindestellen für Calcium=20E. Die Tunnelstruktur für einen Austausch wird zweckmäßig über eine Strecke gesucht, die wechselseitig zählbar ist. Beim Doppel-Calcium „2020“ mit Schleife ist von links oder rechts kommend nur 1x die Zahl „20“ lesbar und das 2.Calcium liegt dann als Unterschied mit 20=QS=“2“ vor. Die Evolution schneidet „CETP“ exakt funktionsgerecht zu. In der Katalyse-Gleichung steht beidseitig allein nur das „Cholesteryl (9Z-Octadeconat)“, vermutlich Cholesteryloleat=C45H78O2=270+78+16=364E [cholesteryl oleate (CHEBI:46898) / Cholesteryloleat | C45H78O2 | CID-5283632 - PubChem (nih.gov)]. „CETP“ (??)= 493AS liegt in der Spalte Z.38367#_[3]?20??20?[816]/#_[33]?471?[712], und zwar in Z.38367 als „20“_Schleife aufsteigend „471“_absteigend 20=QS=“2“ mit Summe 20+471+2=“493“ für CETP (??)=493AS [CETP - Cholesteryl ester transfer protein - Homo sapiens (Human) | UniProtKB | UniProt]. Cholesteryloleat=364E enthält die Kreiszahl „64“. Die Katalyse-Gleichung „364=364“ ergibt in Z.38367 als „3“_aufsteigend 33=QS=“6“_202=QS=“4“ mit 3_6_4 für Cholesteryloleat=364E. In der Spalte „202“/[2]“4“[7] kreuzt sich Zahl 202=QS=“4“ für die Endzahl „4“ mit der Spalte 0/4 für QS=“4“ kreuzt. Die rechte Seite der Gleichung enthält somit das Doppel-Calcium in der Spalte 0/4 für „40“, und zwar mit Cholesteryloleat=364E als „3“_aufsteigend 33=QS=“6“_absteigend Spalte 0/4 für 40=QS=“4“ mit 3_6_4 für „Cholesteryloleat“=364E. An „202“ hängen „08“, gespiegelt für VLDL=80nm; an der Ziffer „4“ hängen „71“, gespiegelt für HDL=17nm zur Richtungswahl. „CETP“ liegt versteckt in 2.Reihe, hinter dem Rezeptor „LDLR“, der die Zelle zunächst versorgen muss, bevor ein Sonderproblem medikamentös gelöst wird. Der Wirkstoff „Torcetrapib“=C26H25F9N2O4=156+25+81+14+32=308E ist als Medikament wegen Blutdruck-Anstiegs nicht erfolgreich, wirkt aber als CETP-Hemmer. „Torcetrapib“ in Z.38368 am rechten Medikamenten-Rand als 12 links für „21“_17 links für „71“_“7“ mit Summe 21+71+7=“99“_absteigend „208“_“1“ mit Summe 99+208+1=“308“ für „Torcetrapib“ 308E. „Obicetrapib“=C32H31F9N4O5=192+31+81+28+40=“372“E ist ein experimenteller CETP-Hemmer, der den notwendigen „LDLR“ optimal umgeht, und zwar in der Spalte Z38367#_\3\202\0\[816]/#_\3\3\[47]\17\[12]/#_35141\45\9\ in Z.38369 als „9“_45 links für „54“_absteigend 17 links für „71“_absteigend „0“_“202“_aufsteigend Spalte 3/3 für „33“_“3“ mit Summe 9+54+71+0+202+33+3=“372“ für „Obicetrapib“(\\)=372E._dat27.04.2024
Cell cycle: Der Zellzyklus durchläuft wiederholte Runden von Wachstum und Zellteilung - in jeder Runde werden die genetischen Informationen dupliziert und auf 2 Tochterzellen aufgeteilt. Der Zellzyklus unterteilt sich in die Interphase (G1-, S- und G2-Phase) und die Mitose (Prophase, Metaphase, Anaphase und Telophase). Am Ende der Mitose wird die Zelle getrennt (Cytokinese=Zellteilung). Die Regulation erfolgt mittels Cyclin-abhängigen Kinasen (CDKs), die von Cyclinen aktiviert werden. Dieser Prozess durchläuft Kontrollpunkte (cell cycle checkpoints). Nach einer erfolgreichen Zellteilung verharrt die Zelle zunächst in einer Ruhephase (resting phase) „G0“ [„G“=Growth (engl)=Wachstum und/oder Gap (engl) für „Lücke“ zwischen 2 Phasen]. „G0“ folgen vier Phasen. In der erforderlichen Reihenfolge werden in Phase „G1“ notwendige Proteine für die DNA-Replikation produziert. Die genetischen Informationen werden dann in der Synthesephase „S“ repliziert. In der Phase „G2“ werden dann Proteine hergestellt, die für die Auftrennung der verdoppelten DNA und der anschließenden Mitose notwendig sind. Die Phasenübergange im Zellzyklus werden jeweils durch „Cycline“ und eine maßgebliche spezielle „Cyclin-abhängige Kinase (CDK)“ reguliert. CDKs bilden eine Unterfamilie der Serin/Threonin (Ser/Thr)-Kinasen. Der Wechsel der Serien-Randspalte #1611/#1610 ist für einen Kontrollpunkt geeignet, zumal Serin=56E lesbar ist. Diese Grenze kann auch den Zellkern vom Zellplasma abgrenzen. Der Zellzyklus ist nicht als Kreislauf von Proteinen erkennbar. Vorhanden sind zusammenhängende Protein-Komplexe und „3“ Zellzyklus-Kontrollpunkte [Cell cycle checkpoint - Wikipedia]. In der Wachstumsphase „G1“ wirkt das immer vorhandene „Cyclin-D“ mit „CDK4“ zusammen, bevor dann „Cyclin-E“ und „CDK2“ maßgeblich werden. Am Ende der Phase „G1“ liegt der G1-Kontrollpunkt (G1/S checkpoint) als beschränkender „Restriktionspunkt“, der unter ungünstigen Bedingungen unpassierbar. Wird der „point of no return“ jedoch überschritten, ist der weitere Zellzyklus (S-, G2-, M-Phase) vorbestimmt. In der DNA-Synthese-Phase „S“ bleibt „CDK2“ maßgeblich, jedoch zusammen mit „Cyclin-A“. Die Wachstumsphase „G2“ endet mit dem „G2-Kontrollpunkt (G2/M checkpoint)“, an dem „Cyclin-B“ und „CDK1“ aktiv sind. Der „M-Kontrollpunkt (Metaphase Checkpoint)“ ist der mitotische „Spindel-Kontrollpunkt“. Dieser bewirkt, dass die Chromosomen erst nach korrekter Anheftung der Mikrotubuli am Kinetochor getrennt werden [Zellzyklus-Kontrollpunkt - DocCheck Flexikon]. Die maßgebliche Zellzyklus-Spalte Z.38366#_30/#_32 enthält ATP-Energie (ATP=260E) und steuert den Zellzyklus. Einerseits treffen die hemmenden Checkpoint-Proteine „p21“/“p53“ zusammen und andererseits wird die Zellzyklus-Spalte von „CDKs“ besetzt, die im Zellzyklus an „Cycline“ gebunden sind. Kann die Spalte von einer „CDK“ nicht vollständig besetzt werden, drängt sich der Komplex-Partner „Cyclin“ hinein.
Checkpoint: Das Protein (Mensch) „Protein 53_TP53 (p53)“ (||)=393AS kann die Zellteilung in der G1-Phase vor dem Restriktionspunkt unterbrechen, damit die Zelle DNA-Schäden reparieren kann. Anderenfalls liegt „p53“ inaktiviert am hemmenden „Mdm2“. „p53“ wird bei einer Halbwertzeit von 20-30 min nach dem Abbau durch die „Mdm2-Ubiquitinligase“ ständig erneuert [P53 - DocCheck Flexikon]. „p53“ (||)=393AS liegt als Grundannahme am Grenzübergang #1611/#1610 in der Spalte Z.38364#_[5]^2^8^9^8^|140|5|/Grenze/#_[3]^2^9^7^7^5^64^]|5|_/#_[1]^3[0]|78|87|88|/#_[9]^320208^[16]/#_[7]^334717^[12]. Enthalten ist die Dopplung [30]“788788“, mit der ein Kopiervorgang nach Form=7 und Wirkstoffinhalt=88 überprüfbar ist. Das lesbare Zink=30E wird nur seitlich tangiert, so dass die Zink-Bindung unlesbar in „7887“=QS=Zink=30E versteckt. Der Zellzyklus wird gestoppt, bis korrekte Bedingungen vorliegen. Das „Protein 53 (p53)“ (||)=393AS steigt vor der Grenze in Z.38364 auf, und zwar als „140“_aufsteigend mit Kunstgriff über Randspalte 5/5=QS=10 für „0“ mit Summe 140+0=“140“_aufsteigend „788788“ als „140“_Summe 78+87+88=“253“ mit Summe 140+253=“393“ für „p53“ (||)=393AS. Für eine Halbwertzeit=20-30 min muss „p53“ die Zeitbasis „60“ in der Startspalte |140|5|/“56“4“5 aus „p21“ mit Summe 56+4=Zeitbasis=“60“ entnehmen, um „140“_5/5=QS=10 für „0“ mit 140_0 für 1400 Sekunden=23,33 min darzustellen [TP53 - Cellular tumor antigen p53 - Homo sapiens (Human) | UniProtKB | UniProt]. Die unschöne, gespiegelte C-Form von „p53“ verursacht eine Lücke, in die sich das Ckeckpoint-Protein „CDKN1A_p21“ (^^) legt. Erst wenn die Konzentration von „p53“ und „p21“ reduziert wird, kann sich der Zellzyklus fortsetzen. „CDKN1A_p21“ wird im Anschluss an Protein-Komplexe ergänzt, die sich bereits als Folge von „p53“ ergeben.
Das Protein (Mensch) „MDM2“ { }/(;;)=491AS interagiert mit „p53“ (||). Einerseits überlagert sich „MDM2“ teilweise mit „p53“, andererseits wird „MDM2“ induziert, wenn sich „p53“ stabilisiert hat. Das „MDM2“ ubiquitiniert und antagonistisiert „p53“ [Mdm2 – Wikipedia]. „MDM2“, long {}=491AS kann sich mit einer Einzelzählung überlagern. In der Variante „MDM2“, short (;;)=491AS entsteht nur eine seitliche Komplex-Bindung mit „p53“ (||), und zwar in der Spalte Z.38364#_^2^8^9^8^|140|5|/#_^2^9^7^7^5^64^|5|/#_^3^{0}{|78|87|88|}/#_[3]{202}{0}{8}{16}/#_[334717]{12}. „MDM2“, long {}=491AS liegt in Z.38366 auf der p53-Kontrollstrecke als „0“_„78_87_88“=Summe „253“. Die Folgezeile mit „202_08_16“=Summe 202+0+8+16=“226“ sowie der folgenden Randzahl „12“ mit Summe 0+253+226+12=“491“ ergibt „MDM2“ {}=491AS, wobei links die Ziffer „0“ zur Zeilenverbindung dient. Die enthaltene Zinkfinger-Domäne nimmt das unlesbare Zink aus „7887“=Zink=QS=30E auf. Aufgrund der Endzahl „12“ wird auf Magnesium=12E und aufgrund der Randspalte 6/2 für „26“ auf Eisen=26E reagiert. Zur Regulierung der „Herzfrequenz“ kann zwar keine Zeitbasis „60“ gezählt werden, aber der Herz-Muskel „55“ ist als Pumpen-Dopplung enthalten, und zwar links als 078=QS=“15“_aufsteigend „20“_“20“ mit Summe 15+20+20=Muskel=“55“ und rechts als ringförmige Kreislauf-Fortsetzung mit Sauerstoff=„8“_Randzahl=Luftsauerstoff „O2“=“16“_absteigend 88=QS=“16“_87=QS=“15“ mit Summe 8+16+16+15=Muskel „55“. Das Kohlendioxyd „CO2“=6+16=22E ist als Summe 20+2=CO2=“22“ enthalten. „MDM2“, short (;;)=491AS liegt in der Spalte Z.38367#_[93];202:081;[6]/#_[7334717];1;[2], und zwar als 2020=QS=“4“_81=QS=“9“_aufsteigend „1“ mit 4_9_1 für „MDM2“, short (;;)=491AS. „Wirkt auch als Ubiquitin-Ligase E3 gegenüber sich selbst und „ARRB1“. „Ubiquitin“ ist in der Kontrollstrecke absteigend über die Spalte extern=6 /7 mit 7_6 AS und nochmals mit sich selbst noch am linken Rand 07=QS=“7“ und die externe Spalte 3/3=QS=“6“ mit 7_6 für „Ubiquitin“=76AS vorhanden [MDM2 - E3 ubiquitin-protein ligase Mdm2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „ARRB1_Beta-Arrestin-1“ ()=418AS muss bei „MDM2“ liegen. „ARRB1“ bindet „1D-Myo-Inositolhexakisphosphat“ („“)= C6H19NaO24P6=36+19+11+192+90=348E [Myo-Inositol, Hexakis(dihydrogen-phosphat), Dodecanatriumsalz | 17211-15-3 (chemicalbook.com)], und zwar in Z.38368 über „3471“ als „34“_QS7+1=“8“ für 348E. „ARRB1“ ()=418AS liegt als Dimer mit „PKM2“ (µµ) in der Spalte Z.38367#_[9320208]µ1µ[6]/#_[73]“34“7“(„1“7)µ1µ[2]/#_[5351](41)[4]µ5µ/#_[3370300]µ4µ[0]/#_[139137]µ43µ[8], und zwar in Z.38369 als „41“ absteigend 17=QS=“8“ mit 41_8 für „ARRB1“ ()=418AS. Ubiquitin=76AS ist in „ARRB1“ () enthalten, und zwar aus „7“_aufsteigend Spalte 1/1=QS=2_4 mit „7“_Summe 2+4=“6“ für 76AS [ARRB1 - Beta-arrestin-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PKM2_(Pyruvatkinase PKM)“ (µµ)=531AS bildet mit „ARRB1“ () ein Dimer. „Die nukleäre ARRB1-Interaktion mit „E2F1“ reguliert die Expression proliferativer Gene hoch, während die zytoplasmatische ARRB1-Interaktion mit der „Pyruvatkinase M2-Isoform (PKM2)“ zu einer metabolischen Reprogrammierung führt, indem sie die PKM2-Tetramerisierung behindert, um die Pyruvatkinase-Aktivität zu reduzieren.“ [Doppelrolle von β-Arrestin 1 bei der Vermittlung des Zellstoffwechsels und der Zellproliferation bei Magenkrebs - PMC (nih.gov); H. Yu u.a.; Sept.2022; doi: 10.1073/pnas.2123231119]. „PKM2“ (µµ)=531AS in Z.38371 als „43“_nadelförmig absteigend Spalte 1/5/4=QS=“10“ mit Summe 43+10=“53“_absteigend „1“ mit 53_1 für„PKM2“ (µµ)==531AS. In der Spalte 1/5/4 ist der Cofaktor „Kalium“ mit „1“_QS5+4=9 für 19E enthalten, wobei die Ziffer „1“ mit der seitlichen Ziffer „2“ zugleich den Cofaktor „Magnesium“=12E bildet. „PKM2“ unterstützt in dieser Nadelform die Bildung von „ATP“. „PKM2“ katalysiert den letzten geschwindigkeitsbegrenzenden Schritt der Glykolyse, indem es den Transfer einer Phosphorylgruppe von Phosphoenolpyruvat (PEP) zu „ADP“ vermittelt und „ATP“ erzeugt“. Im Ergebnis muss das „klassische ATP“=260E in Z.38368 am Rand über die Mg-Zahl=12 als „2“_“1“_aufsteigend „59“ mit „2“_Summe 1+59=“60“ mit 2_60 (transportiert Zeitbasis „60“) für ATP=260E entstehen, womit „Pyruvat“ (CHEBI:15361)=C3H3O3=18+3+24=45E seitlich über „414“ mit Summe 41+4=Pyruvat=45E anliegt. Diese Reaktion basiert auf ADP=220E (wo?) und Phosphonatoenolpyruvat (CHEBI:58702)=C3H2O6P=18+2+48+15=83E [CHEBI ist korrekt, Uniprot-Text mit „Phosphoenolpyruvat“=86E ist falsch]. „Phosphonatoenolpyruvat“=83E in Z.38368 am Mg-Rand über „7“171“[2] als 171=QS=“9“_aufsteigend Spalte 7/4 für „74“ mit Summe 9+74=“83“E. Folglich versteckt sich „ADP“ in der Katalyse die Zahl „59“ für „ATP“, und zwar „ADP“ in Z.38369 über „459“=QS=“18“_aufsteigend Spalte 1/0=QS=“1“_“3“ mit Summe 18+1+3=22_0 für ADP=220E hier umgekehrt als Ausgangsmolekül [PKM - Pyruvate kinase PKM - Homo sapiens (Human) | UniProtKB | UniProt].
Der Transkriptionaktivator, Protein (Mensch) „E2F1“ (&&)=437AS kann ebenfalls mit „ARRB1“ () intergieren, indem er sich in den freien Winkel von „ARRB1“ mit dem vertikalen „PKM2“ (µµ) einpasst. „E2F1“ steigt dann links vertikal ab, um mittels Einbindung in der Zahl „20“ von „p53“, dessen Apoptose auszulösen. Seitlich bindet „BIRC2“, um „E2F1“ zu aktivieren. In der Vertikalstrecke grenzt „E2F1“ an „RB1“. „E2F1“ bindet bevorzugt zellzyklusabhängig an „RB1“. „RB1 ist ein potenter Inhibitor der E2F-vermittelten Transaktivierung“. „E2F1“ (&&)=437AS liegt zusammen mit „BIRC2“ (°°), „RBL1“ (**), „ARRB1“ () und „PKM2“ (µµ) in der Spalte Z.38366#_[41]°3°[0788788]/#_°99°3°&2&0&[208]µ1µ[6]/#_[57]*33*&4&[7](1)(7)µ1µ[2]/#_[15]*35*&1&(41)&4&µ5µ[9]/#_[73]*37*&0&30&0&µ4µ[0]/#_3139137µ43µ[8] und zwar in Z.38369 aufsteigend Spalte 4/0=QS=“4“_30=QS=“3“_absteigend Spalte 0/4/1/0=QS=“5“_“2“ mit 43_Summe 5+2=“7“ mit 43_7 für „E2F1“ (&&)=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „BIRC2“ (°°)=618AS besitzt eine Zink-Bindung, und zwar in Z.38366 aufsteigend als Spalte 3[0=Zink=30E]/3=QS=“6“_99=QS=18 mit 6_18 für „BIRC2“ (°°)=618AS [BIRC2 - Baculoviral IAP repeat-containing protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RBL1(p107)_Retinoblastoma-like protein 1“ (**) =1068AS ist ein Schlüsselregulator für den Eintritt in die Zellteilung. „RBL1“ (**) =1068AS in Z.38368 in der Spalte „33/35/37“ in Z.38370 als 37=QS=“10“_absteigend Spalte 3/3=QS=“6“_aufsteigend Spalte 3/5=QS=“8“ mit 10_6_8 für RBL1“ (**) =1068AS. Rekrutiert und zielt auf die Histon-Methyltransferasen „KMT5B“ und „KMT5C“ ab, die für die Zink-Bindung verschiedene Zink-Positionen binden [RBL1 - Retinoblastoma-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „KMT5B“ ($$)=885AS liegt mit „RBL1“ (**) in der Spalte Z. 38366#_[941]$30$[788…]/#_[8993]$20$[20…]/#_[857]*3*3*$4$$7$[…]/#_[815]*3*5*$1$$4$[1…]/#_[77]€3€*37*€030€[…]/#_[73]€1€39€13€7€[…], und zwar „KMT5B“ ($$)=885AS in Z.38368 als aufsteigend Spalte 7/4 für „74“_aufsteigend Spalte 4/1 für „14“ mit Summe 74+14=“88“_absteigend 20=QS=“2“_absteigend 30 (Zink)=QS=“3“ mit „88“_Summe 2+3=“5“ mit 88_5 für „KMT5B“ ($$) =885AS. Hemmung durch „A-196“ [CAS No. 1982372-88-2 ]=C18H16Cl2N4=108+16+34+28=186E intern mit „4“_Spalte 4/1 für „14“ mit Summe 4+14=“18“_extern 33 (aus RBL1)=QS=“6“ mit 18_6 für „A-196=186E [KMT5B - Histone-lysine N-methyltransferase KMT5B - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „KMT5C“ (€€)=462AS besitzt Bindungsstellen für „Zink“ und „S-Adenosyl-L-methionin (SAM)“=C15H22N6O5S=90+22+42+40+16=210E. „SAM“ liegt extern in „RBL1“ als „3“_35=QS=“8“_37=QS=“10“ mit Summe 3+8+10=“21“_“0“ für SAM=210E, das beidseitig von „KMT5C“ jeweils durch eine Ziffer „3“ verklammert wird. „KMT5C“ (€€)=462AS bindet an „KMT5B“ ($$), und zwar in Z.38370 aufsteigend Spalte 3/1=QS=“4“_“39“_“13“_“7“_absteigend 030(Zink=30E)=QS=“3“ mit „4“_Summe 39+13+7+3=“62“ mit 4_62 für „KMT5C“ (€€)=462AS. „Erleichtert TP53BP1 Bildung von Herden bei DNA-Schäden und kompetente nicht-homologe Endverknüpfung (NHEJ)-gerichtete DNA-Reparatur durch Katalyse der Di- und Trimethylierung von 'Lys-20' des Histon H4“ [KMT5C - Histone-lysine N-methyltransferase KMT5C - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte Z.38369#_5141…/#_7030…/#_9137… ist Lysin=80E in der Spalte 70/91 mit 70+9+1=Lysin=80E enthalten. Das Protein (Mensch) „Histon H4“=103AS ist als 37=QS=10_absteigend 30=QS=3 mit 10_3 für „Histon H4“=103AS enthalten. Das Protein (Mensch) „TP53BP1“=1972AS als 91 nach links für „19“_absteigend „7“_ringförmig 5141=QS=11=QS=“2“ mit 19_7_2 für „TP53BP1“=1972AS [TP53BP1 - TP53-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Cyclin-dependent kinase inhibitor 1_ CDKN1A (p21/Waf1/Cip1)“ (^^)=164AS kontrolliert den Zellzyklus, indem Cyclin-abhängige Kinasen gehemmt werden, um eine DNA-Reparatur zu ermöglichen. Mäuse, denen das p21-Gen fehlt, erlangen die Fähigkeit, verlorene Gliedmaßen zu regenerieren [p21 - Wikipedia]. Gemeinsam mit dem „Protein 53_TP53 (p53)“ setzt sich Zellzyklus erst bei sinkender Konzentration fort. Daraus ergibt sich, dass „p21“ großflächig ist, um viele „CDKs“ und „Cycline“ zu hemmen. Die Endzahl von „CDKN1A (p21)“ besetzt rechts die Bindungs-Zahl „64“ in einer Lücke, die von „p53“ erzeugt wird. Im Komplex tangiert „p21“ zugleich mit einer Schleife die Startzahl von „p53“.
Aufgrund der Dominanz eines Checkpoint-Proteins erfolgt eine 100er-Einzelzählung, die in „p21“=100+64=“164“AS mündet. „CDKN1A (p21)“ zieht sich C-förmig aus der Lücke, um weitläufig Bindungen zu ermöglichen. Die assoziierten Komplexe aus „CDKs“ und „Cyclinen“ phosphorylieren dann die „Retinoblastom (Rb)-Proteinfamilie“ einschließlich „pRb (RB1)“. [S.Bitar u.a; Jun 2019; Krebserkrankungen | Kostenloser Volltext | Die Rolle des Cyclin-abhängigen Kinase-Inhibitors p21cip1/waf1 bei der Bekämpfung von Krebs: Molekulare Mechanismen und neue Therapeutika (mdpi.com); https://doi.org/10.3390/cancers11101475]. „CDKN1A (p21)“ kann vom Zink=“3“0E vertikal nur die Ziffer „3“ binden. Das Defizit „27“ wird spiralförmig integriert, wobei die Startziffer von „TP53 (p53)“ tangiert wird.
„CDKN1A(p21)“ (^^)=164E liegt mit TP53 (p53)“ (||)=393AS in der Spalte Z.38364#_^2^8^98^|140|5|/Grenze/#_^2^9^7^7^5^64^|5|/#_^3^[0]|788788|/#_^320208^[16]/#_^334717^[12], und zwar in Z.38368 über 334717=QS=“25“_absteigend 320208=QS=“15“_absteigend „3“(aus Zink=“3“0)_absteigend Spirale ab 2/2=“4“_auf 8/9=QS=“17“_ab 9/7=QS=“16“_auf 8/7=“15“_“5“ mit Spiral-Summe=4+17+16+15+5=“57“ mit Summe 25+15+3+57+64=“164“ für „CDKN1A(p21)“ (^^)=164E [CDKN1A - Cyclin-dependent kinase inhibitor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Zinkfinger-Protein (Mensch) „ZNF385A“ (**)=386AS zieht in der Spalte Z.38366#_*3*078878*[8]/#_*3*[2020816] durch „TP53“ und Zink=30E und erzeugt als 78878=QS=“38“ mit der Zink-Spalte „3/3“=QS=6 die Endzahl „6“ für „ZNF385A“=386AS [ZNF385A - Zinc finger protein 385A - Homo sapiens (Human) | UniProtKB | UniProt]. Diese Einbindung in „p21“ wirkt als Aufstiegshilfe für „p21“ durch das Zink. „Die Bindung von ZNF385A (HZF) an die DNA-Bindungsdomäne von TP53 erleichtert die CDKN1A-Induktion und den daraus resultierenden Zellzyklus-Arrest“ [Reactome | TP53 stimuliert die Transkription von CDKN1A (p21)].
Am aufsteigenden Ende von „p21“ erfolgt die Interaktion mit dem „DDB1-CUL4A-DTL E3-Ligase-Komplex“ [DCX(DTL)-Komplex], der die zirkadiane Uhr durch Ubiquitinierung und Abbau von „CRY1“ reguliert. Der zirkadiane Photorezeptor „CRY1“ wurde hier im Zusammenhang mit Uhrenproteinen (Clock u.a.) ermittelt, wobei „CRY1“=586AS (Cofaktor „FAD“) nur mit seiner Endziffer „14“ im Komplex mündet. Das Protein (Mensch) „DDB1“{}=1140AS liegt in der Spalte Z.38367#_[99]^320208^{1}[6]/#_&5&7&^334717^{1}[2]/#_&153&°5°141°{45}9/#_&733&]°7°°030°{040}/#_&3&[139137438], und zwar in Z.38367 rechts neben „p21“ als Spalte 1/1=QS=“2“_aufsteigend 45=“9“ mit Summe 2+9=“11“_aufsteigend 040 für „40“ mit 11_40 für „DDB1“=1140AS [DDB1 - DNA damage-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CUL4A“(°°)=759AS folgt „p21“, in der Spalte Z.38369#_°5°141°…/#_°7°030°… als „7“_absteigend „5“_141=QS=“6“_absteigend 030=QS=“3“ mit „75“_Summe 6+3=“9“ mit 75_9 für [CUL4A - Cullin-4A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DTL“(Mensch) (&&)=730AS legt sich neben „CUL4A“ zweckmäßig in Z.38370 mit der DTL-Startziffer „7“ links an die p21-Zahl (^^) „33“=QS=“6“, um Ubiquitin=“76“AS für den Abbau von „p21“ zu vermittelt. „DTL“ (&&)=730AS in Z.38368 mit Spalte „5“7“[33]/“153“/“733“/“3“[13] als „7“_“5“_aufsteigend 153=QS=“9“_733=QS=“13“_“3“ mit „7“_Summe 5+9+13+3=“30“ mit 7_30 für „DTL“ (&&)=730AS. Der DCX(DTL)-Komplex vermittelt den Abbau bestimmter Proteine. Der Abbau von „CDT1“ dient der ordnungsgemäßen Zellzyklusregulation [DTL – Denticleless protein homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Der DNA-Replikationsfaktor, Protein (Mensch) „CDT1“=546AS reagiert auf „Sorbit“=C6H14O6=36+14+48=98E. Rechts von „DDB1“{}=1140AS ist die leere Randspalte „6/2/9“ für „9“_Summe 2+6=“8“ mit „98“ von „Sorbit“ besetzbar. Über die Randspalte in Z.38367 „16/12/59“ mit dem enthaltenen Sorbit-Rand ist zugleich „Ubiquitin“=76AS als 16=QS=“7“_Spalte 1/5=QS=“6“ mit 7_6 für Ubiquitin=76AS vorhanden. „CDT1“=546AS in Z38369 über „141“4“5[9] nach links als „5“ (Ubiquitin eingebunden)_“4“_141=QS=“6“ mit 54_6 für „CDT1“=546AS [CDT1 - DNA replication factor Cdt1 - Homo sapiens (Human) | UniProtKB | UniProt]. „L2DTL interagiert auch mit dem Replikationslizenzprotein CDT1 in vivo“ [L2DTL/CDT2 interagiert mit dem CUL4/DDB1-Komplex und PCNA und reguliert die CDT1-Proteolyse als Reaktion auf DNA-Schäden - PubMed (nih.gov); L. Higa u.a. Aug 2006; DOI: 10.4161/cc.5.15.3149]. „L2DTL“=730AS bindet in Z.38370 an „CDT1“ über „7030“, und zwar als 70=QS=“7“_“30“ für „L2DTL“=730AS [DTL - Denticleless protein homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CREB3L1_Cyclic AMP-responsive element-binding protein 3-like protein 1“ {}=519AS vermittelt in Astrozyten und Osteoblasten einen p53-unabhängigen DNA-Schaden-induzierten G2-Arrest, an dem CDKN1A (p21) (^^) beteiligt ist. CREB3L1 aktiviert Gene, die für Zellzyklus-Inhibitoren wie „p21/CDKN1A“ kodieren. „CREB3L1“ {} „p21“ ist mit der Einbindung der Spaltzahl „1“/1 von CREB3L1“ {} vorgelagert. „CREB3L1“ reagiert auf „cAMP“ =C10H12N5O6P=60+12+35+48+15=170E über die Spalte Z.38369#_41…/#_30… mit „1“_4/3=QS=“7“_“0“ mit 1_7_0 für „cAMP“=170E. CREB3L1“ {}=519AS liegt als Einzelzählung in der Spalte Z.38368#_[7]^3^3^4^7^{|1|}^|7|^|1||2|/#_[53]{51|4|}{|1|}459]/#_[3370]{3}{0}[040], und zwar als „514“_aufsteigend „3“_absteigend Spalte 1/0=QS=“1“_absteigend „1“ (geteilt mit „p21“) mit Summe 514+3+1+1=“519“ für „CREB3L1“=519AS [CREB3L1 - Cyclic AMP-responsive element-binding protein 3-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Arzneimittel „Doxorubicin“=C27H29NO11=162+29+7+88=286E spaltet „CREB3L1“, so dass eine Domäne in den Zellkern eindringt, um Gene zu aktivieren, die den Zellzyklus u.a. mittels „p21“ hemmen [Doxorubicin blockiert die Proliferation von Krebszellen durch proteolytische Aktivierung von CREB3L1 - PubMed (nih.gov); B. Denard u.a.; Dez. 2012; DOI: 10.7554/eLife.00090]. „Doxorubicin“ (||)=286E startet in Z.38368 am Rand als „2“_71=QS=“8“_aufsteigend „CREB3L1“ mit Spalte 1/1=QS=“2“_“4“ mit „28“_Summe 2+4=“6“ mit 28_6 für „Doxorubicin“=286E.
Eine Spaltung von „CREB3L1“ erfolgt ebenfalls durch die Serinprotease, Protein (Mensch) „MBTPS1“ (!!)= 1052AS. Die Position von „p21“ wird besetzt, weil der lesbare Cofaktor „Calcium“=20E weit vorgelagert ist, und zwar in der Spalte Z.38367#_[9320]!2!!0![816]/#_[7]^3^3^4^!7!^{|!1!|}^|!7!|^|1||2|/#_[53]{51!|4|}{|1|}!4![59]/#_[3370]{3}{0}[040]. „MBTPS1“ (!!)= 1052AS trennt die Spaltzahl 1/1 in einer Ringzählung, und zwar in der Spalte in Z.38367 absteigend Spalte 0/1 für „10“_Wende im Calcium=20E aufsteigend 2/7=QS=“9“_aufsteigend „41“ mit „10“_Summe 9+41=“50“_“4“(extern)_absteigend „7“(in p21) mit Summe 4+7=11=QS=“2“ mit „10“_Summe 50+2=“52“ mit 10_52 für „MBTPS1“ (!!)= 1052AS. Das Serin=“56“ für die „Serinprotease“ ist in Z.38369#_514145… als 51=QS=“6“_“41“_45=QS=“9“ mit Summe 6+41+9=“56“ für Serin=56E enthalten. Eisen/Kupfer liegen in der Randspalte 6/2/9 grenzen lediglich an „Serin“. Umgekehrt wären Nickel=28E oder Cobalt=27E dann wirksam. Dieses ist der Fall, weil die Ziffer „2“ aus der Spaltachse 0/1/1=QS=“2“ rechts mit der Spalte 8/7 für Nickel oder Cobalt adressiert. Der Serinprotease-Inhibitor „Aminoethyl)benzolsulfonylfluorid (AEBSF)“= C8H10FNO2S=48+10+9+7+16+16=106E hemmt das Serin=56E von „MBTPS1“ über Z.38369 Spalte „51414/70300“ als “51“_“41“_“4“_aufsteigend 70300=QS=“10“ mit Summe 51+41+4+10=106 für „AEBSF“=106E.
„Cyclin-abhängige Kinasen (CDKs)“ für „CDK-Cyclin-Komplexe“ im Zellzyklus: Es ist möglich, aber sinnlos, irgendwo „CDK-Cyclin-Komplexe“ darzustellen. Zunächst muss der Zellzyklus selbst begründet werden, weil er unterschiedliche Komplexe induziert. Die Zellzyklus-Spalte Z.38366#_„30/#_32“ ist die Keimzelle der „CDK-Cyclin-Komplexe“. Dieser kompakte Ursprung enthält außer der Energie aus „ATP“ keine Funktionen, so dass sich die Komplexe funktionsorientiert formieren. Aufgrund der minimalen Größe der Keimzelle ist nur 1 Komplex zeitweilig dominant, die anderen sind im Auf- und Abbau. Der Austritt aus der Ruhephase ist eine Quelle zur Entstehung des Zellzyklus. Die Differenzierung von Stammzellen erfordert eine Ruhezeit zur Entwicklung, damit ein Eintritt in den Zellzyklus möglich wird. Neuronen sind aufgrund des Entwicklungsprogamms fertig entwickelt und bleiben, zumindest bis zur Apoptose, in der G0-Phase [G0-Phase – Wikipedia]. Für den Ruhezustand sind das „p53- und das Rb-Gen“ sowie „Cyclin-abhängige Kinase-Inhibitoren (CKIs)“ wie „p21“ zuständig.
Der Austritt aus der G0-Phase wird vom Protein (Mensch) „CDK3_Cyclin-abhängige Kinase 3“ (!!)=305AS gefördert, das mit „Cyclin C“ einen Komplex bildet, um das „Retinoblastom-Protein (pRb/Rb)“ an „Serin (S)“=56E zu phosphorylieren. „Während des Austritts aus der Ruhephase zielt „CDK3/Cyclin C“ auf spezifische pRb-Substratstellen ab, die phosphoryliert werden müssen, damit die Zellen vor der pRb-Phosphorylierung durch „CDK4/6/Cyclin D1“ und „CDK2/Cyclin E“ in die G1-Phase eintreten können [Cyclin C - ein Überblick | ScienceDirect-Themen; „Rolle von CDK/Cyclin-Komplexen bei der Transkription und beim RNA-Spleißen“; P.Loyer; Sept. 2005; https://doi.org/10.1016/j.cellsig.2005.02.005]. „CDK3“ sorgt später ebenfalls für das Eintreten in S-Phase, indem die E3F-Familie aktiviert wird. Der Ruhepol würde mathematisch aufgelöst, wenn die hemmenden Proteine „p53“ und „p21“ in der halbiert genutzten Zink-Zahl „30“ tödlich verklammert werden. „CDK3“ enthält die Zahl „30“, die wegen der Trennung nicht als Zink-Bindung erkannt wird, und zwar „CDK3“ (!!)=305AS in der Spalte Z.38366#_!30![...]/#_!3!2![...] als „30“_aufsteigend 32=QS=“5“ mit 30_5 für „CDK3 “ (!!)=305AS. Die Bindung an ATP=260E ist direkt als Ring enthalten, und zwar mit „2“_Spalte 3/3=QS=6_0 für „ATP“=260E. In der Katalyse wirkt „ATP“ mit „L-serine residue (CHEBI:29999)“=C3H5NO2=18+5+7+16=“46“E zusammen, das sich in der Spalte Z.38366#_!30![78…]/#_!3!2![02…]/#_“33“4“[7…] aufsteigend als „334“ mit „4“_33=QS=“6“ für „46“E anschließt. Die Umwandlung in ADP=220E erfolgt als 02=QS=“2“_absteigend Spalte 0/2 für „20“ mit 2_20 für ADP=“220“E, und zwar „ADP“ zusammen mit „O-phospho-L-serine(2-) residue (CHEBI:83421)“=C3H4NO5P=18+4+7+40+15=“84“E als Spalte 3/3=QS=6_78 mit Summe 6+78=“84“E [CDK3 - Cyclin-dependent kinase 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Neuronen? Treten nur in den Zellzyclus ein, um den Zelltod (Apoptose) zu organisieren. Der Signalweg beginnt mit der Expression von „CDK4“ in Neuronen, weiteren Proteinen bis zum pro-apoptotische BH3-Protein „Bim“. Die Caspase-Aktivierung führt dann zum apoptotischen Tod [Zellzyklusmoleküle definieren einen Signalweg, der für den Tod von Neuronen in der Entwicklung und Krankheit erforderlich ist - ScienceDirect; L. Greeene apr 2007; https://doi.org/10.1016/j.bbadis.2006.12.003].
Wunschgemäß liegt das Protein (Mensch) „Bim_ BCL2L11“=198AS auf „CDK3“, um irgendeinen Zusammenhang mit der Apoptose herzustellen, und zwar in der Spalte Z.38366#_“1“30“[7…]/#_“9“32“[0…] mit „1“_aufsteigend „9“_32=QS=“5“_absteigend 30=QS=“3“ mit „19“_Summe 5+3=“8“ mit 19_8 für „Bim“=198AS. Ist „CDK4“ zur Eröffnung des Signalweges enthalten? Ja. Das „CDK3“ (!!) zählt rechtsdrehend und das Protein (Mensch) „CDK4“ (||)=303AS linksdrehend, und zwar in der Spalte Z.38366#_|1|!3!|0![7…]/#_|9|!3!|2![0…] als „3“_aufsteigend Spalte 1/9=QS=10 für „0“_“3“ mit 3_0_3 für CDK4=303AS [CDK4 - Cyclin-dependent kinase 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Die weiteren CDKs werden ebenfalls in der Zellzyklus-Spalte positioniert, wobei sich die Füllung mindert, damit Cycline nachrücken können.
„Cyclin D1“ ist unveränderter Position zugleich in Komplexen mit „CDK4“ und „CDK6“ vertreten, so dass sich „CDK6“ passend formiert. CDK4 hat in der Basis-Spalte 30 /32 bereits die rechte Hälfte 0/2 verloren, und ist nach links augewichen. CDK6 muss, vor- und nachgelagert, Ziffern zusätzlich besetzen. Das Protein (Mensch) „CDK6“ (§§)=326AS liegt in der Spalte Z.38365#_§3§[„29“77…]/#_§1§§3§[„0“78…]/#_§9§§3§[„2“02“…]/#_§7§3§[347], und zwar in Z.38365 als „3“_aufsteigend Spalte 1/9/7=QS=“17“_absteigend Spalte 3/3/3=QS=“9“ mit „3“_Summe 17+9=“26“ mit 3_26 für „CDK6“=326AS. „Hemmung durch INK4-Proteine (CDKN2C/p18-INK4c)“. Phosphoryliert „NPM1“ [CDK6 - Cyclin-dependent kinase 6 - Homo sapiens (Human) | UniProtKB | UniProt]. „NPM1“ („“)=294AS liegt mit 29=QS=11=QS=“2“ rechts neben der CDK6-Startspalte „3/1“. „NPM1“ wird phosphoryliert, weil sich der NPM1-Wert „2“ mit „CDK6“ zu §1§_Summe §3§+“2“=“5“ mit 1_5 zum Phosphor=15E verbindet. „NPM1“=294AS als „29“_aufsteigend Spalte 02=QS=“2“_“0“_“2“ mit „29“_Summe 2+0+2=“4“ mit 29_4 für „NPM1“=294AS [NPM1 - Nucleophosmin - Homo sapiens (Human) | UniProtKB | UniProt]. „CDKN2C“=168AS verhindert die Bindung von „Cyclin D1“ an „CDK4“ oder „CDK6“, indem die Cyclin-Startzahl „29“ besetzt wird. „CDK6“ ist stärker betroffen, weil die „CDK6“-Startzahl ebenfalls besetzt wird [Humaner p18INK4c/CDKN2C Antikörper AF7746: F&E-Systeme (rndsystems.com)]. „CDKN2C“ („“)=168AS liegt mit CDK6 (§§) in der Spalte Z.38365#_“8“§“3“§„29“77“[…]/#_“4“§1§§3§[078…]/#_[9]§9§§3§[202…]/#_[5]§7§3§[347], und zwar in Z.38365 als 77=QS=“14“_29=QS=11=QS=“2“ mit Summe 14+2=“16“_83=QS=11=QS=“2“_aufsteigend „4“ mit „16“_Summe 2+4=“6“ für „CDKN2C“=168AS [CDKN2C - Cyclin-dependent kinase 4 inhibitor C - Homo sapiens (Human) | UniProtKB | UniProt]. _dat08.052024
Das Protein (Mensch) „CDK2“ (**)=298AS lässt sich von einem unlesbaren Cofaktor „Magnesium“ begleiten, der „2“ Mg-Ionen bindet. Die beiden Mg-Positionen ziehen sich vom lesbaren Magnesium=12E am rechten Rand durch die Basis-Spalte in die Zahl „29“, indem für 2-fach Magnesium („“) „24“ Elektronen gezählt werden, und zwar in Z.38365 mit Mg-Strecke 29=QS=11=QS=“2“_aufsteigend Spalte 0/2=QS=“2“_020=QS=“2“_aufsteigend Spalte 8/7=“15“_Randzahl 12 (Magnesium)=QS=“3“ mit Summe 2+2+2+15+3=“24“ für „2“-fach-Mg=24E. Die Zahl „29“ wird für CDK2=“29“8AS direkt verwendet. „CDK2“ (**)=298AS liegt in der Spalte Z.38365#_[3]*“29“*[775645]/#_[1]*3**“0“*[788788]/#_[9]*3**“2“*[„020“8“16]/#_[733471"7“12“], und zwar „CDK2“ (**)=298AS als „29“_aufsteigend 0/2=QS=“2“_absteigend 3/3=QS=“6“ mit „29“_Summe 2+6=“8“ mit 29_8 für „CDK2“=298E. „Essentiell für die Meiose, aber entbehrlich für die Mitose. Phosphoryliert CTNNB1, USP37, p53/TP53, NPM1, CDK7, RB1, BRCA2, MYC, NPAT, EZH2“. „Stimuliert durch MYC“. Inaktiviert durch CDKN1A (p21). „CDK7“ ist lediglich ein Vorläufer für mehrere CDKs. [CDK2 - Cyclin-dependent kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MYC“ (µµ) =454 AS zieht „CDK2“ vom Mg-Weg „202“ lotrecht in die Zahl „29“. „MYC“ (µµ)=454AS liegt in der Spalte Z.38365#_µ32µ9µ[775645]/#_µ13µµ0µ[!78!8788]/#_[93]µ2µ02µ[0816], und zwar in Z.38366 als 13=QS=“4“_absteigend „32“_“9“ mit Summe 4+32+9=“45“_aufsteigend Spalte 0/2=QS=“2“_02=QS=“2“ mit „45“_Summe 2+2=“4“ mit 45_4 für „MYC“ (µµ) =454 AS [MYC - Myc proto-oncogene protein - Homo sapiens (Human) | UniProtKB | UniProt]. „Myc“ reagiert auf „Gamma-Strahlung“, die am Zerfallsschema vom Betastrahler „60Co“ zum „60Ni“-Zustand zwischen Cobalt=27E und Nickel=28E ersichtlich ist. Die Doppel-„0“(Null) ist ein Zerfall, der sich mit der Doppel-„2“ in der externen !78!-Ecke zu 27E /28E aufspaltet [Gammastrahlung – Wikipedia]. Wie für „Myc“ an anderer Position mit „TRIP13“ zeigen sich „6“ Lysin-Reste mit Lysin=80E, das sich aus der Spalte 78/02 mit 78+2=Lysin=80E zusammensetzt. Darin wird die Zahl „2“ …“2“… „29“ reduziert als „2“ für „6“ Moleküle durchgezählt.
„Myc“ induziert die Bildung der Telomerase, das Protein (Mensch) „TERT“ (^^)=1132AS, das bis an den rechten Rand zieht, und zwar in der Spalte Z.38367#_[020]^816^/#_^“47“^“17“^[“12“] in Z.38368 als 74=QS=“11“_“17“_absteigend 816=QS=“15“ mit „11“_Summe 17+15=“32“ mit 11_32 für TERT“ (^^)=1132AS. Es entsteht scheinbar eine Fehlfunktion, die die Lebenszeit des Menschen verkürzt: Das lesbare Magnesium=12E dient wie ein Cofaktor nur zur Wegfindung, wird aber nicht eingebunden. Die Telomerase fügt an die Telomerenden die Telomerwiederholung „TTAGGG“ an, und zwar mit 2-fach Threonin (T)=64E; Alanin (A)=48E und 3-fach Glycin= C2H5NO2=12+5+7+16=40E. „2-fach „Glycin“ ist in einer externen Treppenstufe 4/0_40 lesbar. Das „Mg=12E“ wird im dritten Glycin („“) gebunden, indem vom „TERT“-Start bis in den Mg-Rand durchgezählt wird, und zwar als 47=QS=“11“_“17“_“12“(Mg) mit Summe=“40“ für Glycin („“)=40E. Die Telomerase-RNA-Komponente „TERC“ ist 451 nt (Nukleotide) lang [Telomerase-RNA-Komponente – Wikipedia]. Die Zahl „45“ gehört zur Treppenstufe „45“[9]/040 und die Ziffer „1“ absteigend zum Mg=“1“2 für „TERC“=„451“nt. Für die Zählung des Lebensalters ist keine Zeitbasis „365“ lesbar; zählbar über „347“17“1“[2] ist Summe 347+17+1=Zeitbasis „365“.
„CDK2“ wird durch „p21“ (!!)=164AS gehemmt, in dem alternativ zur großflächigen Einzelzählung speziell „CDK2“ direkt hemmend besetzt wird, und zwar in der Spalte Z.38365#_[3]“!29!“[7]/#_!1!“!3!““!0!“[7]/#_9“!3!““!2!“[0] in Z.38366 als „1“_aufsteigend 3/3=QS=“6“_“2“_absteigend „0“_absteigend 29=QS=11=QS=“2“ mit „16“_Summe 2+0+2=“4“ mit 16_4 für „p21“=164AS [CDKN1A - Cyclin-dependent kinase inhibitor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Wirkstoff „Aminopurvalanol A“ (°°) =C19H26ClN7O=114+26+17+49+8=“214“E hemmt u.a. CDK1, CDK2 und CDK5 in der Spalte Z.38365#_°3°“29“[775645]/#_°1°“°3°““0“[788788]/#_[99]“°3°““°2°“°020°[816]/#_[573347]°171°2°, und zwar über den Rand in Z.38368 als „2“_171=QS=“9“_absteigend 020=QS=“2“ mit „2“_Summe 9+2=“11“=QS=“2“_32=QS=“5“_absteigend „3“_absteigend Spalte 3/1=“4“ mit „2“_Summe 2 +5+3+4=“14“ mit 2_14 für „Aminopurvalanol A“ (°°)=214E [Aminopurvalanol A | C19H26ClN7O | CID-6604931 - PubChem (nih.gov)].
Das Protein (Mensch) „CDK5“ {}=292AS ist eine „Prolin-gerichtete Serin/Threonin-Kinase“. „CDK5“ startet in der Spalte Z.38365#_{29}[7…}/#_[3]{0}[7…]/#_[3]{2}[0…] als „29“_aufsteigend Spalte 0/2=QS=“2“ in der rechten Hälfte der Basiszeile mit 29_2 für CDK5“ {}=292AS [CDK5 - Cyclin-dependent kinase 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Extern (unbesetzt) liegt die Basis-Spalte 3/3=QS=“6“, die sich mit der internen Ziffer „2“ zu 6_2 für Prolin=62E zählt. Somit besteht noch eine Kopplung an die Basis-Spalte. CDKs binden sich an Substrate über eine „S/T-P-X-K/R-Sequenz“. „S/T“ mit Serin (S) oder Threonin (T) ist die Phosphorylierungsstelle, gefolgt von P= Prolin, X = beliebige AS. Sequenz endet mit Lysin (K) oder Arginin (R). Weil „Prolin“ erst an 2.Stelle steht, wird „CDK5“ durch Bindung an Aktivatoren (CDK5R1 / CDK5R2) aktiviert [Cyclin-abhängige Kinase 5 – Wikipedia]. „CDK5“ bildet mit dem Aktivator einen Komplex. Hier wird aber angenommen, dass der Aktivator nicht notwendig seitlich bindet, sondern auf CDK liegt. Die linke Seite der Basis-Spalte kann nicht besetzt werden, weil dort der Aktivator „CDK5R1 (p35)“=307AS lesbar mit der Ziffer „3“ startet. [CDK5R1 - Cyclin-dependent kinase 5 activator 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „CDK5R2 (p39)“=367AS wählt dieselbe Ziffer „7“ rechts neben der Basis-Spalte startet jedoch mit der CDK5-Startziffer als 29_7=Summe 29+7=36_aufsteigend 7 mit 36_7 für „CDK5R2“=367AS [CDK5R2 - Cyclin-dependent kinase 5 activator 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Beide Aktivatoren interagieren mit dem Protein (Mensch) „Alpha-actinin1 (ACTN1)“ (!!)=892AS in der Spalte Z.38365#_!2!!9![7]…/#_!3!!0“[7]…/#_!3!!2![0]…, und zwar absteigend in der Spalte 2/3/3=QS=8_ aufsteigend über Spalte 9/0/2 mit „8“_Summe 90+2=“92“ mit 8_92 für ACTN1 (!!)=892AS, wobei die Endziffer „2“ aus dem Ligand „Calcium“=“2“0E resultiert [ACTN1 - Alpha-actinin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Calpain“ kann die beiden Aktivatoren spalten. „CDK5“ bildet mit dem Spaltprodukt einen Komplex. Die längere Halbwertzeit erhöht den CDK5-Spiegel, was ungünstig bei einer Alzheimer Erkrankung wirkt. „Calpain-1“=714AS besitzt den Cofaktor „Calcium“ mit „4“ Ca-Ionen, die sich doppelt als „20“_“20“ und gekreuzt doppelt als Spalte 0/4 für „40“ zeigen. „Calpain-1“($$)=714AS liegt in der Spalte Z.38367#_[32020…]/ [3]$34$[71…]/#_[35]$14$[1…] ohne Bindung an den Aktivator in Z.38368 als 34=QS=“7“_aufsteigend „14“ mit 7_14 für „Calpain-1“ ($$)=714AS [CAPN1 - Calpain-1 catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. „Calpain-2“ (€€)=700AS wird vom Cofaktor „Ca“ mit „7“ Ca-Ionen für 7*20E=140 E mit der Spalte 7/7/0 als 14_0 für 140E gekreuzt. „Calpain-2“ (€€)=700AS trennt vom lesbaren Aktivator „p35“=307AS die Endziffer „7“ ab, und zwar in Z.38366#_[30]€7€8€/#_[32]€0€2€ als „7“_aufsteigend Spalte 8/2=10 für „0“_“0“ mit 7_0_0 für „Calpain-2“ (€€)=700AS [CAPN2 - Calpain-2 catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Der CDK-Hemmer „Roscovitin“ („“) =C19H26N6O=114+26+42+8=190E hemmt „Calpain“, indem die Spaltzahl „7“ über das Calcium=20 zum rechten Rand weggezogen wird, und zwar in der Spalte Z.38366#_[30]“7“88“[788]/#_32“0“20“81“[6]/#_[334717]“12“ in Z.38366 als „88“_aufsteigend Spalte 7/0 für „70“_“20“_81=QS=“9“_absteigend 12(Randzahl)=QS=“3“ mit Summe 88+70+20+9+3=“190“ für „Roscovitin“=190E. Der Kurzschluss ohne die Spalte 7/0=QS=7=Nerv_über 88/20 ergibt 88=QS=“16“_20=QS=“2“ mit 16_2 für „Kokain“=162E. Allein die Spalte 8/2 für 82 enthält die Belohnung „Dopamin“=82E. Das Protein (Mensch) „DARPP-32_Dopamin- und cAMP-reguliertes neuronales Phosphoprotein_ PPP1R1B“=204AS startet mit der Ziffer „2“ aus Dopamin und zieht dann über die „0“ komplett durch „CDK5“. „DARPP-32“=204E als „2“_“0“_absteigend Spalte 0/2=“2“_absteigend 29=QS=11=QS=“2“ mit „20“_Summe 2+2=“4“ mit 20_4 für DARPP-32“=204AS. „CDK5“ phosphoryliert „DARPP-32“ und moduliert die Dopamin-Signalübertragung in Neuronen [Phosphorylierung von DARPP-32 durch Cdk5 moduliert Dopamin-Signalübertragung in Neuronen - PubMed (nih.gov)]. Das findet am Threonin=64E über die Spalte 3/3=“6“_absteigend Spalte 3(neben CDK5-Start „29“)/1=“4“ mit 6_4 für Threonin=64E statt [PPP1R1B - Protein phosphatase 1 regulatory subunit 1B - Homo sapiens (Human) | UniProtKB | UniProt]. Der Dopamin-Wiederaufnahmehemmer, das Arzneimittel „Bupropionhydrochlorid“ aus Bupropion=C13H18ClNO=78+18+17+7+8=128E und Salzsäure „HCL“ (1_17) erhöht das „Dopamin“ (auch zur Raucher-Entwöhnung), soll aber wunschgemäß nicht weit nach links auf das „CDK5“ einwirken. Das könnte funktionieren, und der Einfluss auf die Zeit „24“ lässt sich auf die morgendliche Einnahme begrenzen. Der Wirkstoff liegt in der Spalte Z.38365#_[329775645]#_#_[1307]!8![8788]/#_[9320]{!2!081}{6}/#_[73347]§17§{12}/#_[53514]§1§[459] mit Dopamin (!!)=82E in Z.38366#_!8!/#_!2“ für Dopamin=82E. „HCL“(§§) über „17/1“ dient incl. Wasserstoff als Startpunkt in Z.38369 als „1“ (für H)_absteigend „17“ (für Chlor). Bupropion {}=128E folgt in Z.38368 als „12“(Randzahl)_absteigend 6(Randzahl)_081=QS=9_2(aus Dopamin) mit „12“_“6“_Summe 9+2=11=QS=“2“ mit „12“_Summe 6+2=“8“ mit 12_8 für Bupropion {}=128E. Plasmahalbwertszeit: 9–25 Stunden mit der Zeitbasis „60“ aus „20“_“20“_aufsteigend „17“(Chlor)_12(Randzahl)=QS=3= mit Summe 20+20+17+3=Zeitbasis=“60“. Statt Sekunden werden Stunden gezählt, wenn zusätzlich ein Umrechnungsfaktor „3600“ Sek/Stunde gefunden wird. Hierfür sind „320“_Spalte 8/2=10 für „0“ mit 320_0 für „3200“ vorhanden, wobei der Rest kreuzend über die Spalte 0/4 für „40“ zählt und erneut (weil kreuzend) liefert die Spalte 8/2=QS=10 für „0“ für 3200+400=Extra-Zeitbasis=“3600“. „Die „9“ Stunden sind direkt links am „Umrechner“ vorhanden: “9“3202“0. Die Ziffer „9“ von CKD5=“2“92AS ist davon nicht betroffen, aber die Startziffer „2“, wenn „9“ absteigend Spalte 3/1 für „13“_“2“ mit 9+13+2=24 Stunden erreicht werden (auch in Gegenrichtung 32=QS=“5“_1/9=“19“ mit Summe 19+5=24). Der Wirkstoff wird für die Tageszeit verordnet. „CDK5“ reguliert die Uhren-Proteine im zirkadianen Rhythmus (24). „CDK5 phosphoryliert PER2 am Serin-Rest tagaktiv. Diese Phosphorylierung erleichtert die Interaktion mit Cryptochrom 1 (CRY1) und den Kerneintritt des PER2-CRY1-Komplexes“ [Cyclin-abhängige Kinase 5 (CDK5) reguliert die zirkadiane Uhr | eLife (elifesciences.org); U. Albrecht u.a. Nov. 2019; https://doi.org/10.7554/eLife.50925]. [Kein Kommunikations-Erfolg mit dem morgentlichen „Bupropion“ ? … Weil starke Nacht-Pillen zu Dauerschlaf auch bei Tage führen. Alternativ abends (20 Uhr) „Olanzapin“ möglich, wenn ärztlich angeordnet und keine Alzheimer Erkrankung vorliegt._dat07.06.2025].
Juice Newton: Queen Of Hearts - On Solid Gold (1981)
„CDK7“ aktiviert „CDK5“, so dass sich die Interaktion als Überlagerung darstellen kann [Cdk7 fungiert als cdk5-aktivierende Kinase im Gehirn - PubMed (nih.gov); J.Rosales (2003); DOI: 10.1159/000074543]. Das Protein (Mensch) „CDK7“ {}=346AS besetzt die Zellzyklus-Basisspalte inclusive die CDK5-Position, und zwar in der Spalte Z.38365#_{3}{29}[…]/#_[1]{3}{0}[…]/#_[9]{3}{2}[…] als „3“_29=QS=11=QS=“2“_aufsteigend Spalte 0/2=QS=“2“_mit „3“_Summe 2+2=“4“_absteigend Spalte 3/3=QS=“6“ mit 34_6 für CDK7=346AS [CDK7 - Cyclin-dependent kinase 7 - Homo sapiens (Human) | UniProtKB | UniProt].
Beim Menschen sind 20 CDKs bekannt, die den Zellzyklus, die Transkription sowie die neuronale Funktion und Entwicklung steuern. Der Zellzyklus wird weitgehend von CDK1, CDK4 und CDK5 kontrolliert. „CDKs“ sind heteromere Serin/Threonin-Kinasen, deren regulatorische Untereinheit von den „Cyclinen“ gebildet wird. Das Protein (Mensch) „CDK7“=346AS ist die katalytische Untereinheit des CDK-aktivierenden Kinase-Komplexes (CAK). „CDK7“ bildet einen trimeren Komplex mit „Cyclin H“ und „MAT1“, der als Cdk-aktivierende Kinase (CAK) fungiert, aktiviert CDK1, CDK2, CDK4 und CDK6. „CDK7“ dient als Bindeglied zwischen der Regulation der Transkription und dem Zellzyklus [Cyclin-abhängige Kinase 7 – Wikipedia]. Das Protein (Mensch) „MAT1“ ()=309AS zählt seine in „30“9 AS enthaltene Zink-Bindung speziell in Z.38366 über (7887)=QS=“30“_aufsteigend (0) mit Summe 30+0=“30“_Spalte (2)/(7)=QS=“9“ mit 30_9 für „MAT1“ ()=309AS. Das lesbare Zink=30E liegt besetzt seitlich im „CDK7“. „MAT1“ grenzt bei der Interaktion mit der Endziffer am „Östrogenrezeptor alpha“, der das folgende Zink in Z.38370 ebenfalls besetzt hat [MNAT1 - CDK-activating kinase assembly factor MAT1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Cyclin H“ (!!)=323AS bindet an CDK7 {}/MAT1 () in der Spalte Z.38365#_{3}{29}[775645]/#_[1]{3}{0}(7887)[88]/#_[9]{3}{2}(0)(2)[0816]/#_[73]!3!4!(7)[1712]/#_[535]!1!41!4![59], und zwar in Z.38369 über „414“ als „4“_41 links für „14“_absteigend Spalte 4/1 für „14“ Summe 4+14+14=“32“_“3“ für „Cyclin H“ (!!)=323AS [CCNH - Cyclin-H - Homo sapiens (Human) | UniProtKB | UniProt]. In der Reihenfolge liegt das Protein (Mensch) „XPD“=760AS am CAK-Komplex, das die Öffnung DNA-Doppelstranges katalysiert [TFIIH-Helikase XPD – Wikipedia]. Der Cofaktor „Magnesium“ schneidet das „ATP aus dem klassischen „ATP“ am Rand heraus, weil „1“ ATP-Molekül verbraucht wird. Die Spalte 16/12 enthält Eisen und Schwefel. Die Bindestelle benötigt ein [4Fe-4S]-Cluster, das 4Fe=4*26E=104E (aus 88/16 für 104) und 4S=4*16=64E (lesbar) erfordert, zuzüglich Magnesium „12“, womit der rechten Rand absteigend bis zur Grenze besetzt wird. „XPD“=760AS aufsteigend als Randspalte 6/2 für „62“_nadelförmig absteigend Spalte 8/1/1=QS=“10“_“4“ mit Summe 62+10+4=“76“_Grenzüberschreitung „0“ mit 76_0 für „XPD“=760AS [ERCC2 - General transcription and DNA repair factor IIH helicase subunit XPD - Homo sapiens (Human) | UniProtKB | UniProt].
„CDK1“ leitet im Komplex mit „Cyclin B“ die S-Phase im Zellzyklus ein, indem es das NuMA-Protein und die RNA-Polymerase II phosphoryliert. „CDK1“ kann in der Zellzyklus-Basis-Spalte „30/32“ den Anteil „32“ nicht besetzen, so dass „Cyclin B“ funktionell nachrückt. Wegen dieser Spezialität ist „CDK1“ unverzichtbar. „Avotaciclib“ ist ein „CDK1-Hemmer“ [Avotaciclib | C13H11N7O | CID-137150099 - PubChem (nih.gov)]. Das Protein (Mensch) „CDK1“ {}=297AS liegt in der Spalte Z.38365#_„3“29“…/#_“130“… als „29“_aufsteigend 130=QS=“4“_absteigend „3“ mit „29“_Summe 4+3=“7“ mit 29_7 für „CDK1“=297AS [CDK1 - Cyclin-dependent kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „NUMA1_Nuclear mitotic apparatus protein 1“=2115 AS nimmt den Phosphor links am „CDK1“ auf und muss „CDK1“ mit einer Schleife umgehen, um auf der rechten Seite als Homodimer zu interagieren. Im Prinzip wird der Phosphor dabei rechts wieder abgeladen. NUMA1 ($$)/(€€) liegt mit CDK1 {} in der Spalte Z.38364#_$2$5$2$[8981]€4€[05]/Grenze/#_$8${3}{29}€7€7€56€[45]/#_$4${130}€7€$8$[8788]/#_$9$9$32$0$2$[0816], und zwar Protein (Mensch) „NUMA1“ ($$)=2115AS (Monomer), zerlegt als „2_115“, in Z.38364 als „2“_“5“_aufsteigend 2/8=“10“ mit „2“_Summe 5+10=“15“ (Phosphor)_aufsteigend Spalte 4/9 für „49“_“9“_“32“_“0“_absteigend Spalte 8/2=QS=“10“ mit „2“_Summe 15+49+9+32+0+10=“115“ mit 2_115 für „NUMA1“ ($$)=2115AS (Monomer). Anschluss: „NUMA1“ (€€)=2115AS (Homodimer) absteigend Spalte 7/7=QS=“14“_7“ mit Summe 14+7=“21“_“5“_absteigend Spalte 4/6=QS=“10“ mit 21_15 für „NUMA1“ (€€)=2115AS(Homodimer) [NUMA1 - Nuclear mitotic apparatus protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Cycline: Den ermittelten „CDKs“ werden „Cycline“ zugeordnet:
CDK-Free / Cyclin F: Das mangels „CDK“ verwaiste Protein (Mensch) „Cyclin F“ (©©) =786AS ist für den G2/M-Übergang essentiell. „Cyclin F“ startet mit der Zahl „78“ rechts neben der Zellzyklus-Basis-Spalte 30“78“/32[02] und zieht dann selbst nach links in die Basis hinein. Die Startzahl „7“ verbindet sich quer mit der externen Spalte 3/3 (in Basis-Spalte) zu 07=QS=“7“_3/3=QS=“6“ mit 7_6 zu Ubiquitin=76E, so dass die Basis-Spalte einer Funktion dient. „Cyclin F“ vermittelt die Ubiquitinierung und den proteasomalen Abbau von „CP110“ während der G2-Phase und wirkt dadurch als Inhibitor der Zentrosomenreduplikation.
„Cyclin F“ (©©)=786AS liegt in der Spalte Z.38365#_[83]©29©[775645]/#_[13]©0©©78©[8788]/#_[93]©202©[0816], und zwar in Z.38366 als „78“_aufsteigend 02=QS=“2“_absteigend Spalte 0/2=QS=“2“_absteigend 29=QS=11=QS=“2“ mit „78“_Summe 2+2+2=6 mit 78_6 für „Cyclin F“ (©©)=786AS [CCNF - Cyclin-F - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CP110“ {}=1012AS liegt in der Spalte Z.38366#_{1}{3}[0788788]/#_{9}{3}[2020816]/#_[7]{3}{3}[471712], und zwar in Z.38366 aufsteigend in der Spalte 1/9=QS=“10“_zieht seitlich absteigend durch die Basis-Spalte 3/3=QS=“6“ (vertikal)_absteigend 33=QS=“6“ (horizontal) mit „10“_Summe 6+6=“12“ mit „10“_Summe 6+6=“12“ mit 10_12 für „CP110“=1012AS. Extern liegt jeder „6“ die Zahl „4“ direkt bzw. als „202“ an, so dass sich der Kreis „64“ dupliziert [CCP110 - Centriolar coiled-coil protein of 110 kDa - Homo sapiens (Human) | UniProtKB | UniProt]. Die Regulation erfolgt zweckmäßig derartig, dass „Cyclin F“ zum Abbau von „CP110“ nicht existiert, solange die „Cyclin F“-Position von „CENT2“ vollständig selbst besetzt wird. „CENT2_Centrin2“=172AS liegt in der Spalte Z.38366#_[0]78[…]/#_202[…] als „7“_aufsteigend Spalte 8/2=QS=10 mit Summe 7+10=17_20=QS=2 mit 17_2 für „CENT2“=172AS [CETN2 - Centrin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „CALM1“=149AS hängt sich aufsteigend an die Endzahl „33“ von „CP110“, um zum rechten Rand zu ziehen, und zwar in Z.38369#_“35141“45“[9] als 35141=QS=“14“_45=QS=“9“ mit 14_9 für „CALM1“=149AS. „CP110“ arbeitet mit „CEP97“=865AS zusammen, indem es die Mutterzentriole verschließt. Hierfür werden die beiden 2“0“2“0“ passiert, wobei zur Calmodulin-Bindung die „Calm1“ ($$)-Zeile folgt. „Cyclin F“ existiert in dieser Phase nicht, weil es besetzt ist. „CEP97“ ()=865AS liegt in der Spalte Z.38366#_[13078](8)[788]/#_[932](02)(0)[816]/#_[733](47)(1)[712]/#_[5]$35141$$45$[9], und zwar in Z.38366 aufsteigend als Spalte 8/0=QS=“8“(Loch zu)_02=QS=“2“ (Loch zu)_aufsteigend „47“_“1“_mit „8“_Summe 2+47+1=“50“_absteigend als Verschluss-Ring Spalte 8/7=QS=“15“ mit „8“_Summe 50+15=“65“ mit 8_65 für „CEP97“=865AS [CEP97 - Centrosomal protein of 97 kDa - Homo sapiens (Human) | UniProtKB | UniProt]._dat13.05.2024
Der „Cyclin C“/„CDK3“-Komplex beendet den Ruhezustand der G0-Phase [Cyclin C/cdk3 promotes Rb-dependent G0 exit - PubMed (nih.gov): S. Ren u.a. Apr. 2004; DOI: https://doi.org/10.1016/S0092-8674(04)00300]. Weiterhin bildet „Cyclin C“ mit „CDK8“ und 2 Untereinheiten (Med12 / Med13) das „Cdk8-abhängige Kinasemodul (CKM)“. Bei oxidativem Stress verlagert sich „Cyclin C“ in das Zytosol, wo es das Mechanoenzym „Dynamin-verwandte Protein 1 (Drp1)“ bindet und aktiviert, um die Mitochondrienspaltung zu induzieren [Cyclin C: Die Geschichte eines nicht-cyclischen Cyclin – PMC (www-ncbi-nlm-nih-gov.translate.goog); R. Strich, u.a; Januar 2019. DOI: 10.3390/biology8010003]. Die Position von „Cyclin C“ gilt unverändert in beiden Komplexen. „Cylin C“ steigt nadelförmig auf. An diesem „Schwanz“ bindet „CDK8“ mit einer Schleife am Zeilenrand, um das „ATP“ statt aus der besetzten Zellzyklus-Basisspalte „30/32“ aus dem „klassischen ATP“ „12/59“ zu entnehmen, indem zur Wegfindung der enthaltene Cofaktor „Magnesium“ genutzt wird. „CDK3“ (!!)=305AS besetzt ausschließlich die Basis-Spalte „30/32“.
Das Protein (Mensch) „Cyclin C“ {}=283AS liegt rechts an CDK3 (!!) in der Spalte Z.38364#_[2898]€1€4€[05]/Grenze/#_[29]$77$5$€6€4€5€/#_!30!{7}{8}$8$€7€8€8€/#_!3!2!{0}{2}$0$8$€16€/#_[33]{4}(71)(71)(2)/#_[35]{1}(4)(1)(45)(9), und zwar in Z.38366 absteigend als Spalte 8/2 für „28“_am CDK3 nadelförmig aufsteigend Spalte 7/0/4=QS=11=QS=“2“_aufsteigend „1“ mit „28“_Summe 2+2=“3“ mit 28_3 für „Cyclin C“ {}=283AS [CCNC - Cyclin-C - Homo sapiens (Human) | UniProtKB | UniProt]. Der Wirkstoff „H8* 2HCL“ ist ein selektiver „Cyclin C“–Hemmer. „HCl“ wird hier meist nur als „Cl“=17E gezählt, so dass sich 8+34=“42“E ergeben. In der „Cyclin C“-Spalte „78/02/4[7]/1[4]“ wird die Schleife hemmend mittels Kurzschluss verhindert, und zwar als aufsteigend Spalte 0/4 für „40“_“2“ mit Summe 40+2=“42“ für „H8* 2(H)CL“=42E [cyclin C Inhibitoren | SCBT - Santa Cruz Biotechnology].
Das Protein (Mensch) „CDK8“ () =464AS bindet rechts an „Cyclin C“ {}, und zwar in Z.38369 seitlich an der „Cyclin C“-Endziffer als „4“_“1“_“45“_absteigend Randspalte 2/9=QS=11=QS=“2“_7171=QS=“16“ mit „4“_Summe 1+45+2+16=“64“ mit 4_64 für „CDK8“ () =464AS, dessen Randschleife wieder seitlich an „Cyclin C“ bindet [CDK8 - Cyclin-dependent kinase 8 - Homo sapiens (Human) | UniProtKB | UniProt].
Bei der Bindung an „CDK8“ () füllen „MED12“ ($$) und „MED13“ (€€) die Lücke zwischen „Cyclin C“ {} und dem rechten Rand. Das Protein (Mensch) „MED12“=2177AS steigt seitlich an „Cyclin C“ ab, und zwar in Z.38367 als „8“_absteigend Spalte 5/8/0=QS=“13“ mit Summe 8+13=“21“_“77“ für „MED12“ ($$) =2177AS [MED12 - Mediator of RNA polymerase II transcription subunit 12 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Unterschied zu „MED13“ interagiert „MED12“ mit diversen Proteinen. „CDK3“ gehört nicht zum CKM-Komplex und kann daher vom Schilddrüsenhormon-Rezeptor, Protein (Mensch) „THRA“=490AS besetzt werden, und zwar in der Spalte Z.38365#_“83“2“9“$77$.../#_[413]“0“{7}{8}… als 83=QS=11=QS=“2“_“2“ mit Summe 2+2=“4“_aufsteigend Spalte 9/0 für 90 mit 4_90 für „THRA“=490AS [THRA - Thyroid hormone receptor alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Der Östrogen-Rezeptor, Protein (Mensch) „ESR1“=595AS zieht als Ring mit Zink-Bindung durch die komplette Zellzyklus-Basis-Spalte „29/30/32“, und zwar aufsteigend Spalte 2/3=QS=“5“_absteigend Spalte 9/0 für „90“_32=QS=“5“ mit „5“_Summe 90+5=95 mit 5_95 für „ESR1“=595AS [ESR1 - Estrogen receptor - Homo sapiens (Human) | UniProtKB | UniProt]. „CDKs“ sind mit Phosphor beschäftigt, so dass diese ihr eigenes Zink=30E nicht lesen können. Das Protein (Mensch) „UBC“ =695AS dient in der Spalte „329/130/932“ als Quelle für Ubiquitin=76AS, so dass Zink ebenfalls nicht erkannt wird. „UBC“ in Z.38266 als 13=QS=“4“_aufsteigend „2“ mit Summe 4+2=“6“_absteigend Spalte 9/0 für „90“_32=QS=“5“ mit „6“_Summe 90+5=“95“ mit 6_95 für „UBC“=695AS. „Ubiquitin“ versteckt über „4130“ als Summe 41+30=“71“_aufsteigend 32=QS=“5“ mit 71+5=Ubiquitin=76AS [UBC - Polyubiquitin-C - Homo sapiens (Human) | UniProtKB | UniPro]. „MED12“ bindet und aktiviert „CDK8“. „Versuche, CDK8 zu inhibieren, müssen zumindest auf Dreierkomplexe von CDK8, Cyclin C und MED12 fokussiert sein. Werden, wie in der Vergangenheit geschehen, Inhibitoren nur gegen CDK8 in Komplex mit Cyclin C entwickelt, so sind die daraus resultierenden Wirkstoffe sehr wahrscheinlich kaum wirksam gegen CDK8“ [Auf dem Weg zu besseren Wirkstoffen gegen Krebs - 2020 - Wiley Analytical Science; F. Klatt et al.: A precisely positioned MED12 activation helix stimulates CDK8 kinase activity, Proc. Natl. Acad. Sci. U.S.A. (2020), DOI: 10.1073/pnas.1917635117].
Das Protein (Mensch) „MED13“=2174AS steigt am Rand vor der Grenze auf, und zwar in Z.38364 als „1“_aufsteigend Spalte 4/6=QS=“10“ mit Summe 1+10=“11“=QS=“2“_aufsteigend „7“_absteigend Spalte 4/8=„12“ mit Summe 2+7+12=“21“_aufsteigend Randspalte 5/8=QS=“13“_aufsteigend 16 links für „61“ mit „21“_Summe 13+61=“74“ mit 21_74 für „MED13“=2174AS [MED13 - Mediator of RNA polymerase II transcription subunit 13 - Homo sapiens (Human) | UniProtKB | UniProt]. Unter Stress bindet „Cyclin C“ am Protein (Mensch) „DNML (DRP1)“ (§§)=736AS. Hierbei zieht sich „DRP1“ über die „Grenze“ hinweg, so dass „Cyclin C“/ CDK3 und verändert liegen bleibt - „MED12“ mit seiner Endzahl „77“ wird verwertet. „Cyclin C“ wird in das Zytosol gezogen, bleibt aber mathematisch unverändert als Anhang am Platz. Für die „DRP1“-Katalyse enthält die Spalte „84“0/898/9[77]“ das Phosphat=HO4P(CHEBI:43474)=48E gespiegelt als „[2]84“ (mit Wasser 28) und GTP=268E als „9“_absteigend 89=QS=“17“ mit Summe 9+17=“26“_“8“ für GTP=268E. Die Spalte „72/52“ enthält 2/2 für „22“_“5“ für „GDP(3−)“[CHEBI:58189]=225E. „DRP1“ (§§)=736AS liegt folglich in der Spalte Z.38363#_[7]§28§[40…]/#_[5]§28§§9§[8…]/#_329§7§7§[…], und zwar als „7“_absteigend Spalte 9/7=QS=“16“_absteigend 28=QS=“10“_absteigend 28=QS=“10“ mit „7“_Summe 16+10+10=“36“ für „DNML (DRP1)“ (§§)=736AS [DNM1L - Dynamin-1-like protein - Homo sapiens (Human) | UniProtKB | UniProt].
Der CDK3-Cyclin“C“-Komplex ist an den Phasenübergängen G0-G1 und G1-S beteiligt. „Für den G0-G1-Übergang ist eine „CDK3/Cyclin-C-vermittelte RB1-Phosphorylierung“ erforderlich. „Fördert den G1-S-Übergang, wahrscheinlich indem es zur Aktivierung von E2F1, E2F2 und E2F3 in einer RB1-unabhängigen Weise beiträgt“.
Das Protein (Mensch) „Cyclin C“ {}=283AS steigt nadelförmig neben CDK3 (!!) auf, um mit der Endziffer „1“ seitlich in „1“41 mit „1“_Summe 4+1=“5“ mit 1_5 für Phosphor=15E bereitzustellen. Das Retinoblastom-Protein (Mensch) „RB1“ (°°)=928AS liegt seitlich am Phosphor, d.h. zwischen „Cyclin C“ und „RB1“ klafft mit der Ziffer „4“ eine Lücke, die über den Phosphor geschlossen wird. In „RB1“ ist der aufgenommene Phosphor dann direkt als Spalte 1/5 für 15E lesbar. Die Interaktion von „Cyclin C“ mit „RB1“ im Zellzyklus kann nicht zeitgleich über dieselbe Bindestelle bei der Transkription im Komplex mit „CDK8“ erfolgen. „RB1“ verlangsamt den Zellzyklus. Phosphorylierung inaktiviert das RB-Protein.
„RB1“ (°°)=928AS liegt in der Spalte Z.38368#_{4}[7]°1°71°[2]/#_{1}[4]°1°45°[9], und zwar in Z.38369 als 45=QS=“9“_absteigend Spalte 1/1=“2“_“8“ mit 9_2_8 für „RB1“= (°°)=928AS [RB1 - Retinoblastoma-associated protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Zinkfinger-Protein (Mensch) „ZBTB7A“ =584AS wirkt sich hemmend auf die Funktion von „RB1“ aus, so dass es auf „RB1“ hemmend liegt. Aufgrund der gleichzeitigen Hemmung von „p53“ darf es sich um dessen verstecktes, unlesbares Zink [30]78“8“7=QS=30=Zink neben dem lesbaren Zink handeln, das in Z.38365 über die Spalte 5/8/0 aufsteigend für „5“_“80 (neben Cyclin C)“ in der Ziffer „8“ gekreuzt wird. Das Defizit=“4“ muss nunmehr die Lücke zu „Cyclin C“ mit besetzen, und zwar in Fortsetzung aufsteigend Spalte 1/1 (in RB1)=QS=“2“_absteigend durch die Lücke neben „Cyclin C“ Spalte 7/4=11 mit Summe 2+11=13=QS=“4“ mit „5“_Summe 80+4=“84“ mit 5_84 für „ZBTB7A“=584AS [ZBTB7A - Zinc finger and BTB domain-containing protein 7A - Homo sapiens (Human) | UniProtKB | UniProt].
„RB bindet und inhibiert die Aktivität von Transkriptionsfaktoren der E2F-Familie, die aus Heterodimeren des E2F-Proteins und des DP-Proteins bestehen [Retinoblastom-Protein – Wikipedia]. Die ausgeübte Hemmung der Transkription wird aufgehoben, so dass der Zellzyklus startet. „Dieses "hypophosphorylierte" „pRb“ bindet an Mitglieder der E2F-Familie und verhindert so die Transkription von E2F-responsiven Genen, indem es sowohl die transaktivierende Domäne von E2F physisch blockiert als auch Chromatin-modifizierende Enzyme rekrutiert, die die Transkription aktiv unterdrücken“. [Cyclin C/Cdk3 fördert Rb-abhängigen G0-Ausgang: Zelle (cell.com); S. Ren, April 2004; doi: 10.1016/s0092-8674(04)00300-9]. Die „E2F-Proteine“ verbinden den rechten Signalrand aufgrund einer Cyclin-Bindungsdomäne mit „Cyclin C“. „RB1“ legt sich folglich hemmend auf E2F1, E2F2 und E2F3. Die Familie zeigt keine besonderen Merkmale, aber „2“ gleiche Längen, die alternativ gezählt werden. Die gemeinsame „E2F-Startziffer“ „4“ liegt rechts neben der Cyclin-C-Endziffer „1“.
Das Protein (Mensch) „E2F1“ (||)=437AS liegt mit Cyclin-C {} und RB1 (°°) in der Spalte Z.38366#_{7}{8}[8788]/#_{0}{2}[08]|16|/#_{4}[7]|°1°7°1°2|/#_{1}|4°1|°45°[9], und zwar in Z.38369 als „41“_absteigend 1712=QS=11=QS=“2“ mit Summe 41+2=“43“_absteigend Randzahl 16=QS=“7“ mit 43_7 für E2F1=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt]. „E2F1“ (||) bindet in „PEG10“ direkt ein, das an seiner Zink-Bindung erkennbar ist. „PEG10“=708AS liegt in Z.38370#_ „70“3“[0040] als „70“_“3“, wobei die Restzahl „5“ für „70“_Summe 3+5=“8“ mit 70_8 für „PEG10“=708AS durch Einbindung in die E2F1-Startzahl „41“=QS=“5“ gewonnen wird [PEG10 - Retrotransposon-derived protein PEG10 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „E2F2“ (§§)=dito 437AS liegt mit Cyclin-C {} und RB1 (°°) in der Spalte Z.38366#_{7}{8}[8788]/#_{0}{2}[08]§1§§6§/#_{4}[7]§°1°7°§!§°1°§§2§/#_{1}§4§°1°§§°4§5°§[9], und zwar in Z.38369 als „4“_schleifenförmig „1“_absteigend „17“_aufsteigend „4“_absteigend Spalte 1/1/5=“7“_“6“ aufsteigend „2“ (Randziffer) mit „4“_Summe 1+17+4+7+6+2=“37“ mit 4_37 für „E2F2“ (§§)=dito 437AS [E2F2 - Transcription factor E2F2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „E2F3“ (^^)=465AS liegt mit Cyclin-C {} und RB1 (°°) in der Spalte
Z.38366#_{7}{8}[8788]/#_{0}{2}[08]^1^^6^/#_{4}[7]°1°7°^°1°^^2^/#_{1}^4^°1°^°45°^9^, und zwar in Z.38369 als „4“_“1“¬_“45“_“9“_absteigend Randspalte 6/2=QS=“8“_aufsteigend Spalte 1/1=QS=“2“ mit „4“_Summe 1+45+9+8+2=“65“AS mit 4_65 für E2F3“ (^^)=465AS [E2F3 - Transcription factor E2F3 - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin D“ in Komplexen mit „CDK4“ oder „CDK6“:
Nach der GO-Phase wird der CDK3-Cyclin“C“-Komplex wiederholt wirksam. Außerdem wirken in der G1-Phase der CDK2-Cyclin“E“-Komplex und Komplexe von Cyclin D mit CDK4/CDK6. „Cyclin D“ ist mit auf- und absteigender Konzentration im gesamten Zellzyklus vorhanden. „CDK4/CDK6“ verwenden übereinstimmend nur die linke Hälfte der Zellzyklus-Basis-Spalte „30/32“, so dass rechts die Spalte [9]/0/2 von „Cyclin D“ zur Komplex-Bindung angelagert wird, woraus „6“ Komplexe mit „CDK4/CDK6-Cyclin D1/D2/D3“ resultieren. Die Nadelform von „Cyclin D1“ ist im Vergleich zu „Cyclin C“ verkürzt, und um „1“ Spalte nach links versetzt. „RB1“ müsste seine Endziffer von links nach rechts wenden, um „Cyclin D1“ zu erreichen. „Rb wird während des frühen bis mittleren G1 durch Cyclin D-Cdk4, 6 monophosphoryliert“ [Cyclin D – Wikipedia].
Das Protein (Mensch) „Cyclin D1“ {}=295AS liegt, vorgelagert über die Zahl „29“, mit CDK4 („“) als Komplex in der Spalte Z.38364#_[52898…]Grenze/#_[3]{29}[77…]/#_“1“3“{0}[78…]/#_“9“3“{2}[02…]/#_[73]{3}[47…], und zwar in Z.38365 als „29“_aufsteigend Spalte 0/2/3=QS=“5“ mit 29_5 für Cyclin D1“ {}=295AS [CCND1 - G1/S-specific cyclin-D1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Cyclin D1“ kann aufgrund seiner Startziffer „2“ verdrängt werden, die sich mit der Zahl 13 in „CDK4“ zu Phosphor=15E summiert. „KAT2A (GCN5)=837AS zählt „83“_Spalte 2/3=QS=“5“_Spalte 0/2=QS=“2“ mit „83“_Summe 5+2=“7“ für „GCN5“=837AS [KAT2A - Histone acetyltransferase KAT2A - Homo sapiens (Human) | UniProtKB | UniProt]. „Der Verlust von hepatischem Cyclin D1 führt zu einer erhöhten Glukoneogenese und Hyperglykämie“ [Cyclin D1–Cdk4 controls glucose metabolism independently of cell cycle progression | Nature; Y. Lee u.a.; Jun. 2014; doi: 10.1038/nature13267]. Für eine Bindung an „RB1“ im Zellzyclus wird „RB1“ (°°)=928AS mit verschwenkter Endzahl „8“ an „Cyclin D1“-Endziffer {3} gebunden, und zwar verschwenkt als „RB1“(@@)=928AS in der Spalte Z.38368#_[73]{3}@47@1@[712]/#_[53]@51@[4]@1@45@[9], und zwar in Z.38369 als 45=QS=“9“_absteigend Spalte 1/1=QS=“2“_47=QS=11=QS=“2“_aufsteigend 51=QS=“6“ mit „92“_Summe 2+6=“8“ mit 92_8 für RB1“ (@@)=928AS.
Das Protein (Mensch) „Cyclin D2“ ()=289AS liegt in der Spalte Z.38364#_[5]|(28)9|[8…]/Grenze/#_[32](9)[77…]/#_“1“3“{0}[78…]/#_“9“3“[202…]/#_[73347] und ist vor der Grenze in Z.38364 lesbar als |289|, d.h. es liegt im Zytosol und erreicht erst bei erhöhter Konzentration den Zellkern [Die migratorische Lokalisierung des Cyclin D2-Cdk4-Komplexes deutet auf eine räumliche Regulation des G1-S-Übergangs hin (jst.go.jp); Z.Wang Okt. 2008; https://doi.org/10.1247/csf.08019]. Hierzu ändert sich die Position der Endziffer „9“ vertikal zur Bindung an „CDK4“ als Spalte 9/0=QS=“9“. Die Zahl „9“ wird zwecks Verlängerung modifiziert. „Cyclin D2“ ()=289AS als „28“_aufsteigend 9/0=QS=“9“_aufsteigend Spalte 0/2=QS=“2“ mit „28“_Summe 9+2=11=QS=“2“_aufsteigend 34=QS=“7“ mit „28“_Summe 2+7=“9“ für „Cyclin D2“ ()=289AS [CCND2 - G1/S-specific cyclin-D2 - Homo sapiens (Human) | UniProtKB | UniProt]. „RB1“ verschwenkt die Endzahl „8“ zur Bindung an „Cyclin D2-Endzahl“ „34“, und zwar als „RB1“(©©)=928AS in der Spalte Z.38368#_[73](34)©7©1©[712]/#_[53]©51©4©1©45©[9], und zwar in Z.38369 als 45=QS=“9“_absteigend Spalte 1/1=QS=“2“_aufsteigend Spalte 7/4=QS=11=QS=“2“_51=QS=“6“ mit „92“_Summe 2+6=“8“ für RB1(©©)=928AS.
Das Protein (Mensch) „Cyclin D3“ (^^)=292AS kann die mögliche Verkürzung gegenüber „Cyclin D1“ nicht anwenden, sondern muss zwecks Bindung an „RB1“ verlängert werden. Dieser verlängerte „Schwanz“ ist nur für „Cyclin D3“ (^^) im Komplex mit „CDK4“ passend. Im Komplex mit „CDK6“ wird der Schwanz modifiziert, indem die End-Spalte 3/3=QS=“6“ für „CDK6“ frei gehalten wird, und zwar als Cyclin D3“ (µµ)=292AS mit einem alternativen Anhang 51 (Phosphor=15E)=QS=“6“. „RB1“ kann daran nicht seitlich binden, sondern bis darin einbinden. Diese Kontur ist zur Bindung der „Pyruvatkinase M2 (PKM2)“ geeignet. „PKM2“ ist nur in fötalem und in Tumorgewebe vorhanden und dient als Tumormarker [Pyruvatkinase M2 – Wikipedia].
Der „Cyclin D3“/„CDK6“-Komplex ist eine Besonderheit: „Die Analyse der Expressionsniveaus von D-Cyclinen, CDK4 und CDK6 in humanen T-ALL-Zellen ergab, dass dieser Tumortyp überwiegend Cyclin D3 und CDK6 und reichlich D3-CDK6-Komplexe, aber wenig Cycline D1, D2 und CDK4 exprimiert“. „Unerwarteterweise fanden wir, dass die CDK4/6-Hemmung auch die Apoptose von T-ALL-Zellen verursachte, denen RB1 entzogen war, und RB1-verwandte RBL1 und RBL2. Daher stellten wir die Hypothese auf, dass die Cyclin-D3-CDK6-Kinase das Überleben von Krebszellen durch Phosphorylierung anderer Substrate fördert.“ „In-vitro-Kinase-Reaktionen zeigten, dass alle drei PFK1-Isoformen (PFKP, PFKL, PFKM) und PKM2 durch Cyclin D3-CDK6 phosphoryliert wurden“ [Die metabolische Funktion der Cyclin-D3-CDK6-Kinase beim Überleben von Krebszellen - PMC (nih.gov); H.Wang u.a; Jun 2017; DOI: 10.1038/nature22797]. Die „T-Zell-ALL“ ist eine Unterform der akuten lymphatischen Leukämie. Hierbei verdrängen die leukämischen Blasten die Zellen des Knochenmarks, die für die Blutbildung zuständig sind [T-Zell akute lymphatische Leukämie | Gelbe Liste (gelbe-liste.de)].
„Cyclin D3“/ „CDK4“-Komplex“: „Cyclin D3“ (^^) verhält sich gegenüber „Cyclin D1“ gegensätzlich, indem es bei der Muskeldifferenzierung zusammen mit „Rb“ erhöht exprimiert wird. „Cyclin D3“ fungiert als „CDK4-aktivierende Untereinheit“. „Die Expression von p21, Rb und Cyclin D3 wird direkt durch MyoD induziert und erfordert p300“ [Entscheidende Rolle von Cyclin D3 beim MyoD-vermittelten Arrest des Zellzyklus während der Myoblastendifferenzierung - PMC (nih.gov); M. Caruso u.a.; Jul 1999; DOI: 10.1128/MCB.19.7.5203]. Im Ergebnis wird „Cyclin D3“ nicht verkürzt, sondern gegenüber „Cyclin D1“ verlängert, so dass „RB1“ wie zur Bindung an „Cyclin D1“ als „RB1“(@@)=928AS modifiziert ist. Die Cyclin-Verlängerung ergibt eine zusätzliche Bindungsstelle von „Cyclin D3“ (^^) an „CDK4“. Das Protein (Mensch) „Cyclin D3“ (^^)=292AS AS liegt mit CDK4 („“) in der Spalte Z.38365#_[3]^29^[775645]/#_“1“3“^0^[788788]/#_“9“3“^2^[020816]/#_[7]{3}{3}@47@1@[712]/#_[5]{3}@51@[4]@1@45@[9], und zwar in Z.38365 als „29“_aufsteigend Spalte 0/2/3=QS=“5“ (wie Cyclin D1)_aufsteigend Spalte 3/3=QS=“6“ mit „29“_Summe 5+6=11=QS=“2“ mit 29_2 für „Cyclin D3“ (^^)=292AS (weniger ist mehr!) [CCND3 - G1/S-specific cyclin-D3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MyoD“ („“)=320AS bindet passend an der „Cyclin D3 (^^)-Verlängerung“. An der Schleife wird die lesbare Zahl „20“ zur Bindung an Proteine mit D=20nm adressiert. Im Komplex mit MYF5=255AS enthält dessen Zahl „55=Muskel“ zur notwendigen Differenzierung von Muskelzellen und füllt die Lücke am rechten Rand. MYOG=224E steigt weiter bis Z.38371 auf. Dort für den Vorläufer „Histone Acetyltransferase _p300 (EP300)“=2414AS bei der Katalyse das Coenzym A(CoA)=400E und Acetyl-CoA=422E zu finden. Das Protein (Mensch) „MyoD“ („“)=320AS liegt in der Spalte Z.38367#_[3]{2}[0]*20*[816]/#_{33}“4“7“*17*[1]*2*/#_{3}“5“1““4“1“*45*9*/#_[3]“70“3“~0040~/#_[3913]~7438~, und zwar in Z.38370 als „3“_links 70=QS=“7“_aufsteigend „5“(an Cyclin D3-Endziffer {3})_aufsteigend Spalte 4/1=QS=“5“_Schleife absteigend 7/4=QS=11=QS=“2“_“1“ mit „3“_Summe 7+5+5 (Ecke enthält Muskel „55“)+2+1=“20“ mit 3_20 für „MyoD“ („“)=320AS. [MYOD1 - Myoblast determination protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „MYF5“ (**)=255AS nimmt die Zahl „20“ auf und zählt den Muskel=55, und zwar in Z.38367 als 20=QS=“2“_aufsteigend 17=QS=“8“_aufsteigend „45“_absteigend Randspalte 2/9=QS=11=QS=“2“ mit „2“_Summe 8+45+2=“55“ mit 2_55 für „MYF5“ (**)=255AS [MYF5 - Myogenic factor 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „MYOG“ (~~)=224AS in Z.38371 als 7438=QS=“22“_aufsteigend 0040=QS=“4“ mit 22_4 für „MYOG“ (~~)=224AS. Reagiert auf „Östradiol“=148E über „7438“ mit 743=QS=“14“_“8“ für „Östradiol“=148E [MYOG - Myogenin - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin D3“/ „CDK6“-Komplex: „Cyclin D3“ (^^) ist im Komplex mit „CDK4“ passend. „Cyclin D1/D2“ im Komplex mit „CDK4“ sind auch „CDK6“ passend. Aber „Cyclin D3“ (µµ) ist speziell für „CDK6“ modifiziert. Das Protein (Mensch) „Cyclin D3“ (µµ)=292AS wird an der Endzahl zur Bindung an CDK6 (§§) passend gegenüber „Cyclin D3 (^^)“ modifiziert, und zwar in der Spalte Z.38365#_§3§µ29µ[775645]/#_§1§§3§µ0µ[788788]/#_§9§§3§µ2µ[020816]/#_§7§3§µ3µ[471712]/#_[53]µ5µ[141459] in Z.38365 als „29“_aufsteigend Spalte 0/2/3=QS=“5“_aufsteigend 51=QS=“6“ mit „29“_Summe 5+6=11=QS=“2“ mit 29_2 für „Cyclin D3“ (µµ)=292AS. [CCND3 - G1/S-specific cyclin-D3 - Homo sapiens (Human) | UniProtKB | UniProt ; Cyclin D3 - Wikipedia].
Das Protein (Mensch) „PKM2_ Pyruvatkinase PKM“ (??)=531AS findet die Bindung an Cyclin D3“ (µµ)=292AS über den kombinierten Cofaktor „Magnesium“=12E /“Kalium“=19E, der in Z.38338 in Z.38367 in der Spalte „20/71“ unlesbar enthalten ist, und zwar Mg=12E als „1“_20=QS=“2“ mit 1_2 für 12E, sowie Kalium=19E als „1“_Summe 7+2=“9“ mit 1_9 für Kalium=19E. Der Cofaktor wird zur seitlichen Katalyse-Ausdehnung über einen Kunstgriff benötigt. „PKM2“ wurde hier an anderer Stelle bereits mit dem lesbaren Cofaktor „Mg“=12E als Randzahl in Z.38368 in anderer Funktion abweichend ermittelt. Die Katalyse erfordert „Pyruvat“ (CHEBI:15361)=C3H3O3=45E und Phosphonatoenolpyruvat (CHEBI:58702)=C3H2O6P=83E. ADP=220E in der Spalte „02/47“ mit 47=QS=11=QS=“2“_“2“_“0“ für ADP=220E; ATP=260E als Spalte 1/1=QS=“2“_“4“_absteigend 47=QS=11=QS=“2“ mit „2“_Summe 2+4=“6“ _absteigend „0“ mit 26_0 für ATP=260E. „PKM2“ (??)=531AS liegt in der Spalte Z.38367#_§9§§3§µ2µ[020816]/#_§7§3§µ3µ[471712]/#_[53]µ5µ[141459], und zwar in Z.38369 als 41=QS=“5“_absteigend über „471“ (enthält „4“_Summe 7+1=“8“ mit „4_8“ für Pyruvat) mit „1“_47=QS=11=QS=“2“ mit „5“_Summe 1+2=“3“_Kunstgriff 0208=QS=10 für „0“_“1“ mit „53“_Summe 0+1=“1“ mit 53_1 für „PKM2“ (??)=531AS [PKM - Pyruvate kinase PKM - Homo sapiens (Human) | UniProtKB | UniProt].
Cyclin E1/E2-CDK2-Komplex: „CDK2“ besetzt die Zellzyklus-Spalte „29/30/32“ ohne Verlängerung. „Cyclin E1/E2“ finden sich mangels besonderer Merkmale abgrenzend gegenseitig nicht seitlich, sondern als Anhang an „CDK2“, so dass zu „RB1“ weiterhin keine Lücke bleibt. „Cyclin E1“ {}=410AS liegt mit CDK2 (!!) in der Spalte Z.38365#_!29!775645/#_!3!!0!788788/#_!3!!2!(0)(2)[0816]/#_{3}{3}(4)(7)[1712]/#_{3}{5}[1](4)[1459]/#_[3]{703}[0040], und zwar in Z.38368 aufsteigend als Spalte 3/3=QS=“6“_absteigend Spalte 3/5 für „35“ mit Summe 6+35=“41“_aufsteigend 703=QS=10 für „0“ mit 41_0 für „Cyclin E1“ {}=410AS [CCNE1 - G1/S-specific cyclin-E1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Wirkstoff „INCB123667“ hemmt CDK2/Cyclin-E1, ist hier aber inhaltlich unbekannt. „Cyclin E2“ ()=404AS bildet seitlich mit „Cyclin E1“ {} einen Ring, und zwar absteigend in Z.38367 in Spalte 0/4 für „40“_“2“_aufsteigend Spalte 7/4 =QS=11=QS=“2“ mit „40“_Summe 2+2=“4“ mit 40_4 für „Cyclin E2“ ()=404AS [CCNE2 - G1/S-specific cyclin-E2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der „Cdk2-Inhibitor II“=C14H11BrN4O3S=84+11+35+28+24+16=“198“E wirkt auf Phosphor und zieht von „Cyclin E“ über „CDK2“ zum rechten Rand, und zwar absteigend in Z.38368 als Spalte 4/1 für „14“_absteigend Spalte „2“ (aus CDK3)/“3“=QS=“5“ mit Summe 14+5=“19“_ 02081=QS=11=QS=“2“_“6“(Rand) mit „19“_Summe 2+6=“8“ für „Cdk2-Inhibitor II“=198E [Cdk2-Inhibitor II The Cdk2 Inhibitor II, also referenced under CAS 222035-13-4, controls the biological activity of Cdk2. This small molecule/inhibitor is primarily used for Phosphorylation & Dephosphorylation applications. | Sigma-Aldrich (sigmaaldrich.com)].
Das Protein (Mensch) „RBL2 (p130)“=1139AS interagiert mit „CDK2“ und „Cyclin E1“, so dass „RBL2“ seitlich rechts bindet, wobei die „Cyclin E2“-Position besetzt wird [Retinoblastom-ähnliches Protein 2 – Wikipedia]. „RBL2“ rekrutiert und zielt auf die Histon-Methyltransferasen „KMT5B“ und „KMT5C“ ab. Beide verfügen über eine Zink-Bindung. Das 1.Zink ist durch „CDK2“ besetzt ist und das 2.Zink müsste geteilt werden, so dass das breite, unlesbare Zink in „788788“ alternativ breiter und geeignet ist. „RBL2(p130)“ („“) =1139AS besetzt eine freie Randspalte in Z.38365#_[77]°5°[645]/#_“7“°88°[788]/#_“0“20816/#_“4“7“1712/#_1“4“14“59“, und zwar „RBL2(p130) („“) aufsteigend Spalte 7/0/4=QS=“11“ (bindet an CDK3 und Cyclin E1)_aufsteigend Spalte 7/4 („4“ bindet an Cyclin E1)=QS=“11“_“14“_59(Rand)=QS=“14“ mit „11“_Summe 11+14+14=“39“ mit 11_39 für „RBL2(p130)“=1139AS [RBL2 - Retinoblastoma-like protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„KMT5B“ (°°)=885AS bindet an der Startziffer von „RBL2(p130)“ („“) lesbar in der Spalte Z.38365#_[77]°5°[…]/“7“°88°[…] mit 88_5 für „KMT5B“ (°°)=885AS [KMT5B - Histone-lysine N-methyltransferase KMT5B - Homo sapiens (Human) | UniProtKB | UniProt]. „KMT5C“ (^^)=462AS startet in der rechten Zahl „88“ im unlesbaren Zink und bindet an der Endziffer von „RBL2“, und zwar in der Spalte Z.38365#_[77]°5°[645]/#_“7“°88°^7^^88^/#_“0“[20]^8^^16^/#_“47“[1]^71^^2^ als 88=QS=“16“_Spalte 7/8=QS=“15“_aufsteigend 71=QS=“8“_absteigend 16=QS=“7“ mit Summe 16+15+8+7=“46“_aufsteigend „2“ mit 46_2 für „KMT5C“ (^^)=462AS [KMT5C - Histone-lysine N-methyltransferase KMT5C - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin A1/A2“/ „CDK2“-Komplex: Wenn die Zelle von G1-Phase in die S-Phase übergeht, assoziiert sich „Cyclin A“ mit „CDK2“ und ersetzt „Cyclin E“. „CDK2“=298AS besetzt in Z.38365 unverändert die Zellzyklus-Spalte „29/30/32“. „Cyclin A“ initiiert die DNA-Replikation und verhindert zugleich den Aufbau weiterer Replikationskomplexe, damit die Replikation im Zellzyklus einmalig bleibt. Dies erfolgt durch Phosphorylierung von Replikationskomponenten wie „CDC6“, das mit „Cyclin A2“ interagiert [Cyclin A – Wikipedia]. „Cyclin A2“ besetzt den Fußpunkt an CDK2 (©©), so dass „Cyclin A1“ vom direkten CDK-Anschluss verdrängt wird. „CDC6“ liegt folglich auf der Cyclin A1-Position, um „Cyclin A2“ (°°) neben dessen Startziffer „4“ zu binden. Das Protein (Mensch) „CDC6“ (!!)=560E entnimmt seine Startziffer „5“ aus der klassischen „ATP“-Randspalte „12/59“ in der Spalte Z.38367#_©3©2©[020816]#_°3°3°4°!7!!1!!7![12]/#_°3°5°[1]!4!!1!!4!!5![9], und zwar in Z.38369 als „5“_aufsteigend Spalte 7/4 für „47“_absteigend Spalte 1/1 für „11“_aufsteigend Spalte 7/4=QS=11=QS=“2“ mit „5“_Summe 47+11+2=“60“ mit 5_60 für „CDC6“ (!!)=560E. Mathematik ist das Grußwort der Evolution – man ist schockiert! [CDC6 - Cell division control protein 6 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Cyclin A2“ (°°=im Komplex mit CKD2)=432AS in Z.38368 als „4“_links „3“_aufsteigend Spalte 3/3=QS=“6“_“5“ mit 43_Summe 6+5=11=QS=“2“ mit 43_2 für „Cyclin A2“=432AS [CCNA2 - Cyclin-A2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das seitlich verdrängte Protein (Mensch) „Cyclin A1“ (^^=im Komplex mit CKD2)=465AS ist bei der Komplexbildung mit CDK2 (©©) (von einer „0“(Null)-Lücke getrennt, deren Breite in der Spalte „0“/4 von der Cyclin A2-Startziffer „4“ mit „4“ nm bestimmt wird. Bei „Cyclin A“ liegt die Substraterkennungsstelle zur Rekrutierung mehr als „40 Angström=4 nm“ von der katalytischen Stelle entfernt. [The Role of the Phospho-CDK2/Cyclin A Recruitment Site in Substrate Recognition - ScienceDirect; L. Johnson, u.a.; Aug 2006; https://doi.org/10.1074/jbc.M600480200]. Cyclin A1“ (^^)=465AS in Z.38369 als Ring „4“_aufsteigend Spalte 1/5 für „51“_2081=QS=“11“_aufsteigend Spalte 7/4=QS=11=QS=“2“_“1“(Ringschluss) mit „4“_Summe 51+11+2+1=“65“ mit 4_65 für Cyclin A1“ (^^)=465AS [CCNA1 - Cyclin-A1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Während Cyclin A1 auf die Keimzelllinien beschränkt ist, wird Cyclin A2 in allen Zelltypen ubiquitär exprimiert“ [Cyclin A1 im Überblick | ScienceDirect-Themen]. Das Ubiquitin von „Cyclin A2“ liegt seitlich in der Cyclin A1-Position Spalte „71/41“ mit 7_4_Spalte 1/1=2 mit 7_6 für Ubiquitin=76AS. Das Protein (Mensch) „GPS2“=327AS interagiert mit „Cyclin A1“, indem es von der Randzahl „2“ in den Ring eindringt, und zwar über Randzahl 12=QS=“3“_081=QS=“9“ mit Summe 3+9=12=QS=“3“_aufsteigend Spalte 2/7 für „27“ mit 3_27 für GPS2“=327AS [GPS2 - G protein pathway suppressor 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „E2F1“=437AS kontrolliert und bindet an Cyclin A1/A2, weil es lesbar breit gezogen, an beiden Cyclinen lesbar angrenzt, und zwar in der Zeile Z.38370#_[3]“70“3“0040“ als 0040=QS=“4“_“3“_70=QS=“7“ mit 4_3_7 für „E2F1“=437AS [E2F1 - Transcription factor E2F1 - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin A1/A2“/ „CDK1“-Komplex: Am Übergang der G2-Phase zur Mitose bildet „Cyclin A“ einen Komplex mit „CDK1“ (!!)=297AS, der nach kurzer Zeit durch den Cyclin B/CDK1-Komplex ausgetauscht wird [Cyclin A - DocCheck Flexikon]. „Cyclin A“ im Komplex mit „CDK2“=298AS in Z.38365 in der CDK2-Spalte „29/30/32“ erleidet eine lokale Formänderung, um in Z.38365 an die CDK1-Spalte „329/130“ für CDK1=297AS zu binden. Im Ergebnis wird die CDK2-Bindungszahl „32“ abgeschnitten, so dass „Cyclin A1/A2“ genötigt sind, ihre Endzahl für die „CDK1-Bindung“ neu zu formieren. Das Protein (Mensch) „Cyclin A1“ (€€=Komplex mit CDK1)=465AS liegt mit CDK1 (!!) in Spalte Z.38365#_!3!!29!€7€[75645]/#_!1!30!€7€[88788]/#_[93]$2$€020€[816]/#_[73]$3$4$[7]€1€7€1€[2]/#_[535141]€4€5€[9], und zwar in Z.38369 als „4“_aufsteigend Spalte 1/5 (Phosphor) für „51“_Kunstgriff 17=QS=“8“_absteigend 20=QS=“2“ mit Summe 8+2=10 für „0“_absteigend Spalte 7/7/0=QS=“14“ mit „4“_Summe 51+0+14=“65“ mit 4_65 für Cyclin A1“ (€€=Komplex mit CDK1)=465AS [CCNA2 - Cyclin-A2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Cyclin A2“ ($$=Komplex mit CDK1)=432AS in Z.38368 als „4“_links „3“_absteigend „2“ mit 4_3_2 für Cyclin A2“ ($$=Komplex mit CDK1)=432AS [CCNA1 - Cyclin-A1 - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin B1/B2/B3“/ „CDK1“-Komplex: „CDK1“ („“)=297AS wechselt nach kurzer Zeit den Komplexpartner von „Cyclin A1/A2“ zu „Cyclin B1/B2/B3“. Das Protein (Mensch) CDK1 („“) =297AS liegt in unveränderter Position in der Spalte Z.38365#_“3“29“[…]/#_“130“[…] als „29“_aufsteigend 130=QS=“4“ absteigend „3“ mit „29“_Summe 3+4=“7“ für 297AS [CDK1 - Cyclin-dependent kinase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Phosphorylierung zahlreicher Substrate ändert die komplette Zellarchitektur wie den Golgi-Apparat und die Ausbildung des Spindelapparats, um die Mitose zu ermöglichen. Die „3“ „B-Cycline“ bilden mit „CDK1“ jeweils selbstständige Komplexe, deren Unabhängigkeit aus der unteilbaren Bindung an „CDK1“ als Anhang mittels der Zahl „32“ aus der Zellzyklus-Spalte „30/32“ resultiert. Der „Cyclin B-CDK1-Komplex“ wird als Mitose-fördernder-Faktor (MPF) bezeichnet.
Vor der Mitose ist das inaktive „Cyclin B1“ in großer Menge vorhanden. Der „Cyclin B1-CDK1-Komplex“ wird aktiviert, indem „Cdc25“ die „Wee1-Kinase“ dephosphoryliert [Cyclin B1 – Wikipedia].
„Cyclin B1“ (1. Änderung): Weil „WEE1“ am rechten Rand weit entfernt ist, und „CDK1“ unerreichbar ist, muss „CDK1“ zumindest indirekt im „Cyclin B1-CDK1-Komplex erreichbar sein. „Cyclin B1“ bindet daher als Anhang und zusätzlich am rechten Rand von „CDK1“. „Cyclin B1“ (!!)=433AS liegt mit CDK1 („“) in der Spalte Z.38365#_“3“29“!7!!7![5645]/#_“130“!7!!8![8788]/#_!9320!!2!!0![816]/#_[73347]!1![712], und zwar in Z.38367 als 9320=QS=“14“_absteigend Spalte 77=QS=“14“_aufsteigend Spalte 7/8=QS=“15“ mit Summe 14+14+15=“43“_aufsteigend „2“_aufsteigend Spalte 0/1=QS=“1“ mit „43“_Summe 2+1=“3“ mit 43_3 für „Cyclin B1“ (!!)=433AS (1. Änderung_dat21.05.2024) [CCNB1 - G2/mitotic-specific cyclin-B1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der aktivierte „Cyclin B1-Cdk1-Komplex“ phosphoryliert und aktiviert „Condensin“, das zur Kondensierung der Chromosomen beiträgt. Der Komplex zerstört die Kernhülle durch Phosphorylierung der Lamine, wodurch die mitotische Spindel den Zugang zu den Chromosomen erhält [Cyclin B1 - Wikipedia]. Welches „Condensin“ beim Menschen betroffen ist, ist hier unbekannt. Beteiligt ist das Protein (Mensch) „NCAPD2“ (©©)=1401AS, dass von „Cyclin B1“ zerstörend besetzt wird, und zwar als Spalte 7/7=QS=“14“_aufsteigend Spalte 8/2=QS=10 für „0“_aufsteigend Spalte 0/1=QS=“1“ mit 140_1 für „NCAPD2“ (©©)=1401AS [NCAPD2 - Condensin complex subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Vor dem Abbau der Kernhülle greift der „Cyclin B1-Cdk1-Komplex“ auf „TPR“ zu, um „MAD1“ zu befreien, das für die „Kinetochore“ rekrutiert werden muss. „MAD1 bleibt mit TPR und kondensierenden Chromosomen assoziiert, wenn es Cyclin B1 nicht binden kann“ [Cyclin B1-Cdk1 erleichtert die Freisetzung von MAD1 aus der Kernpore, um einen robusten Spindelkontrollpunkt zu gewährleisten | Zeitschrift für Zellbiologie | Rockefeller University Press (rupress.org); M. Jackmann; April 2020; https://doi.org/10.1083/jcb.201907082]. „Cyclin B1“ bindet anfangs und mit seiner Endziffer „1“ in die Endziffer „1“ von „TPR“ ein. Das Protein (Mensch) „TPR_Nucleoprotein“ („“)=2363AS liegt in der Spalte Z.38367#_[9]“32“020816/#_33471712/#_35141459, und zwar als 32 links für „23“ _aufsteigend Spalte 3/3=QS=“6“_“51“_“4“_absteigend Spalte 1/1=QS=“2“ mit „23“_Summe 6+51+4+2=“63“ mit 23_63 für TPR („“)=2363AS. Tubulin (TUBA1A u.a.) liegt rechts mit „4“_Spalte „1/5“ mit 45_1 für 451AS [TPR - Nucleoprotein TPR - Homo sapiens (Human) | UniProtKB | UniProt]. Das Checkpoint-Protein „MAD1“ ist das Protein (Mensch) „MAD1L1“=718AS. „MAD1L1“ wird von der der TPR-Endziffer „1“ aus „1“7 gebunden. „MAD1L1“ über Spalte 80“1“/7 mit „7“_“1“_absteigend 08=QS=“8“ für MAD1L1=718AS(gebunden). Das befreite „MAD1L1“ startet aus der Ziffer „7“ zum rechten Rand als „7“_“12“_aufsteigend „6“ mit „7“_Summe 12+6=“18“ mit 7_18 für MAD1L1=718AS(befreit) [MAD1L1 - Mitotic spindle assembly checkpoint protein MAD1 - Homo sapiens (Human) | UniProtKB | UniProt].
Cyclin B1“ (!!) interagiert mit „GADD45A“ und „RALBP1“ [Cyclin B1 – Wikipedia]. „RALBP1“ (°°)=655AS bindet aufsteigend an Cyclin B1“ (!!) in der Spalte Z.38367#_!9320!2!0![816]/#_[7]°33°4°[7]!1![712]/#_[535]°1°°41°[459], und zwar in Z.38368 als 33=QS=“6“_aufsteigend Spalte 4/1=QS=“5“_41=QS=“5“ mit 6_5_5 für „RALBP1“ (°°)=655AS [RALBP1 - RalA-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „GADD45A“ („“)=165AS bindet an Cyclin B1“ (!!) am rechten Rand in der Spalte Z.38368#_!9320!2!!0!“8“16]/#_[7]°33°4°[7]!1!“7“1“[2]/#_[535]°1°°41°[4]“5“[9], und zwar in Z.38367 als Spalte 8/7=QS=15_1 mit Summe 15+1=“16“_aufsteigend „5“ mit 16_5 für „GADD45A“ („“)=165AS [GADD45A - Growth arrest and DNA damage-inducible protein GADD45 alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „GADD45A“ hemmt die Phosphorylierung und Aktivität von „p88“. „GADD45A“ enthält in der Endspalte „1/5“ den Phosphor=15E. Das Protein (Mensch) „Calnexin (p88)“=592AS wird gehemmt, indem die p88-Startziffer „5“ von der GADD45A-Endziffer besetzt wird. „Calnexin (p88)“=592AS als „5“_absteigend Randspalte 2/9 für „92“ mit 5_92 für „p88“=592AS. Wo ist die „Calcium-Bindung“ für „Calnexin (p88)“? Links wird die Ziffer „4“ mitgezählt, und zwar als „4“_59=QS=“14“_aufsteigend „2“ mit Summe 4+14+2=Calcium=20E [CANX - Calnexin - Homo sapiens (Human) | UniProtKB | UniProt].
Im „Cyclin B2“/ „CDK1“-Komplex“ liegt das Protein (Mensch) „Cyclin B2“ (||)=398AS mit CDK1 („“) in der Spalte Z.38365#_“3“29“[775645]/#_“130“[788788]/# [9]|32|[020816]/#_[73]|34|71|[712], und zwar in Z.38367 als „32“_aufsteigend 34=QS=“7“ mit Summe 32+7=“39“_ 71=QS=“8“ mit 39_8 für „Cyclin B2“ (||)=398AS. [Die alternative Zählung, Variante: 32=QS=“5“_aufsteigend „34“ mit Summe 5+34=“39“_71=QS=“8“ mit 39_8 ist ungeeignet, weil für Interaktionen die Zahl „34“ geschnitten werden müsste, das ist vergleichsweise unwahrscheinlich]. „Essentiell für die Kontrolle des Zellzyklus am Übergang G2/M (Mitose)“ [CCNB2 - G2/mitotic-specific cyclin-B2 - Homo sapiens (Human) | UniProtKB | UniProt]. Während „Cyclin B1“ an Mikrotubuli lokalisiert ist, ist „Cyclin B2“ mit der Golgi-Region assoziiert. „Cyclin B2“ bindet am transformierenden „Wachstumsfaktor beta RII“. „Cyclin B2“ interagiert mit dem TGF-Beta-Rezeptor 2, indem der Rezeptor den Wachstumsfaktor aufnimmt [Cyclin B2 – Wikipedia]. Die aktive Untereinheit vom Wachstumsfaktor beta, das Protein (Mensch) „TGFB3“ („“) =412AS bindet rechts an Cyclin B2 (||) in der Spalte Z. 38367#_|32|[020816]/#_[3]|34|71|“7“[12]/#_[351]“4“1“4“[59], und zwar in Z.38369 als „4“_“1“_absteigend Spalte 7/4=QS=“11“ mit „4“_Summe 1+11=“12“ mit 4_12 für „TGFB3“ („“)=412AS. „Methyliert an Gln-293 durch N6AMT1“ [TGFB3 - Transforming growth factor beta-3 proprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Welche Ziffern für Glutamin=C5H10N2O3=78E und Methionin=80E maßgeblich sind, ergibt sich aus der posttranslationalen Modifikation durch die Methyltransferase „N6AMT1“=214AS in Z.38368 in der Spalte „3471/xxx1“ als Spalte 1/1=QS=“2“_347=QS=“14“ mit 2_14 für „N6AMT1“. Das „Glutamin“ ist in der Strecke 34=QS=“7“_71=QS=“8“ mit 7_8 für Glutamin=78E enthalten. Die Glutamin-Zahl 71 für „8“ wird in der Spalte „208/717“ mit der Ziffer „0“ für Methionin=80E kombiniert, mit dem Ergebnis, dass daraus Glutamin seitlich in der Spalte 8/7 für 78E lesbar wird [N6AMT1 - Methyltransferase N6AMT1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Rezeptor-Protein (Mensch) „TGFBR2“ (;;) =567AS liegt in der Randspalte Z. 38367#_|32|020816/#_[3]|34|71|“7“12/#_[351]“4“1“4“59 und bindet mit der Startziffer 1 an Cyclin B2, und zwar in Z.38369 als 14=QS=5_absteigend Spalte 1/5=QS=6_16=QS=7 mit 5_6_7 für „TGFBR2“ (;;) =567AS. Für diese Z-Form wird der lesbare Cofaktor Magnesium=12E mit Mangan=25E kombiniert, und zwar aufsteigend in der Spalte 1/1/5 mit 1/1=QS=“2“_“5“ für Mangan=25E. Es wird klassische „ATP“ in der Spalte „12/59“ verwendet [TGFBR2 - TGF-beta receptor type-2 - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin B2“ ist in der G2-Phase am Zentrosom, in der Prophase an der Kernhülle und in der Prometaphase an ungebundenen Kinetochoren lokalisiert ist. „Humanes Mad2“ fördert die Cyclin-B2-Lokalisierung an den nicht ausgerichteten Kinetochoren. Das endogene Cyclin B2 zeigte eine exakte Überlagerung mit Mad2 an den Kinetochoren [Mad2 fördert die Rekrutierung von Cyclin B2 zum Kinetochor zur Steuerung eines genauen mitotischen Checkpoints - PMC (nih.gov); X.Liu; Jun, 2022; DOI: 10.15252/embr.202154171]. Die Wechselwirkung besteht vermutlich darin, das humanes „MAD2“ (MAD2L1 und MAD2L2) die Position von „Cyclin B2“ weitgehend alternativ besetzen kann. Das Protein (Mensch) „MAD2L1“ („“)=205AS liegt mit „Cyclin B2“ (||) mit einer teilweisen Überdeckung und einer externen „0“(Null) in der Spalte Z.38365#_|“32“|[„0“20816]/#_[3]|3“4|7“1|[712], und zwar als 47=QS=11=QS=“2“_absteigend „0“_32=QS=“5“ mit 2_0_5 für „MAD2L1“ („“)=205AS [MAD2L1 - Mitotic spindle assembly checkpoint protein MAD2A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAD2L2“ („“)=211AS liegt mit Cyclin B2 (||) mit einer teilweisen Überdeckung und einer externen „0“(Null) in Gegenrichtung zu „MAD2L1“ in der Spalte Z.38365#_|3“2|[0“20816]/#_[3]|3“4|7“1|[712], und zwar als 20=QS=“2“_aufsteigend 47=QS=“11“ mit 2_11 für „MAD2L2“ („“)=211AS [MAD2L2 - Mitotic spindle assembly checkpoint protein MAD2B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MAD1L1“ („“)=718AS rekrutiert „Cyclin B1“ in Kernporen, und zwar in der Spalte Z.38367#_08/#_17, bei der die Spalte „0/1“ in „Cyclin B1“ einbindet. In „Cyclin B2“ wird nur die Ziffer „1“ erreicht [MAD1L1 - Mitotic spindle assembly checkpoint protein MAD1 - Homo sapiens (Human) | UniProtKB | UniProt].
Im „Cyclin B3“/ „CDK1“-Komplex liegt das Protein (Mensch) „Cyclin B3“ (§§)=1395AS mit CDK1 („“) in der Spalte Z.38365#_“3“29“[775645]/#_“130“[788788]/#_§93§2§[020816]/#_§733§[471712], und zwar in Z.38368 als 733=QS=“13“_absteigend „93“_“2“ mit „13“_Summe 93+2=“95“ mit 13_95 für „Cyclin B3“ (§§)=1395AS „Seine Gewebespezifität deutet darauf hin, dass es während der frühen meiotischen Prophase I erforderlich sein könnte“ [CCNB3 - G2/mitotic-specific cyclin-B3 - Homo sapiens (Human) | UniProtKB | UniProt].
„Cyclin B3“ aktiviert die Ubiquitin-Ligase „Anaphase-Promoting Complex/Cyclosome (APC/C)“, die auf Proteine für den Abbau abzielt, was zur Trennung von Chromatiden führt. Die APC/C-Aktivierung erfordert die Phosphorylierung der „APC3“- und „APC1“-Untereinheiten, wodurch der APC/C seinen Co-Aktivator „Cdc20“ binden kann [Cyclin B3 aktiviert den Anaphase-fördernden Komplex/Zyklosom bei Meiose und Mitose - PMC (nih.gov); S.Hawley u.a.; Nov. 2020; doi: 10.1371/journal.pgen.1009184]. Das Ubiquitin=76AS ist als Besonderheit in der Spalte „717/414“ über Doppelspalte „7/4 für 74_Spalte 1/1=“2“ mit 74+2=“76“ für Ubiquitin=76AS verfügbar. Zugleich ist „Phosphor“ als 14+1=15E enthalten. „APC1“ und „APC3“ binden an „Cyclin B3“ und umgrenzen die Lücke „7171“, die dann vom „Cdc20“ verwertet wird.
Das Protein (Mensch) „APC1“ (**)=1944AS liegt mit „Cyclin B3“ (§§) in der Spalte Z.38367#_§93§2§°020°8°[16]/#_§733§°4°[7171]*2*/#_*535*14*14*59*/#_*33*[7030040], und zwar in Z.38371 als 33=QS=“6“_absteigend 535=QS=“13“ mit Summe 6+13=“19“_“14“_“14“_59=QS=“14“_absteigend „2“ mit „19“_Summe 14+14+14+2=“44“ mit 19_44 für „APC1“ (**)=1944AS [ANAPC1 - Anaphase-promoting complex subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „APC3_Cdc27“ (°°)=824AS in Z.38367 über „0208“ als „8“_20=QS=“2“_aufsteigend Spalte 0/4=QS=“4“ mit 8_2_4 für „APC3“ (°°)=824AS [CDC27 - Cell division cycle protein 27 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CDC20“ (^^)=499AS liegt in der Spalte Z.38368#_§733§[4]^7^1^[712]/#_[5351]^4^^1^45^[9], und zwar in Z.38369 als „4“_aufsteigend „7“_absteigend Spalte 1/1=“2“ mit „4“_Summe 7+2=“9“_45=QS=“9“ mit 49_9 für „CDC20“ (^^)=499AS [CDC20 - Cell division cycle protein 20 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Die meiotische Zellteilung erfolgt in 2 Teilungen (Meiose I und II) ohne dazwischen geschaltete S-Phase, um haploide Gameten zu erzeugen. Die weibliche Meiose erfordert 2 Zellzyklus-Arrests. In der Prophase der Meiose werden Komponenten für die Embryonalentwicklung angereichert. In der Metaphase der Meiose warten reife Eizellen auf die Befruchtung, damit väterliches Genom beteiligt wird. „Emi2“ ist eine Schlüsselkomponente, um den Anaphase-fördernden Komplex/Zyklosom (APC/C) direkt zu hemmen. „Der Abbau von Cyclin B3 am Austritt aus der Meiose I ermöglicht die Akkumulation von Emi2 und damit einen rechtzeitigen Stillstand in der Meiose II“ [Cyclin B3 implementiert rechtzeitigen Eizellarrest bei Wirbeltieren für die Befruchtung - ScienceDirect; T-Mayer u.a.; Okt 2022; https://doi.org/10.1016/j.devcel.2022.09.005]. Das Protein (Mensch) „FBX043 (EMI2)“ (~~)=708AS baut „Cyclin B3“ (§§) ab, indem es auf der Cyclin B3-Position mit einer Schleife liegt, die aufgrund der Zink-Bindung zum Wendepunkt in der Zink-Zahl „30“ von CDK1 („“) absteigt. „FBX043 (EMI2)“=708AS liegt in der Spalte Z.38365#_“3“29“[775645]/#_ „~1~30~“[788788]/#_§~9~3§~2~§[020816]/#_§~7~3~3~§[471712], und zwar in Z.38368 als „7“_absteigend Spalte 1/9=QS=“10“ für „0“_30 (Zink=30E)=QS=“3“_aufsteigend Spalte 2/3=QS=“5“ mit „70“_Summe 3+5=“8“ mit 70_8 für „FBX043 (EMI2)“=708AS [FBXO43 - F-box only protein 43 - Homo sapiens (Human) | UniProtKB | UniProt]_dat17.05.2024
Der „M-Phasen-Förderfaktor“ (MPF / Mitose-promoting factor) ermöglicht es der Zelle, von der späten Interphase (G2-Phase) zur Mitose (M-Phase) überzugehen. Der „MPF“ besteht speziell aus dem „Cyclin B-CDK1-Komplex“ [Mitosis-promoting Factor - DocCheck Flexikon]. „Cyclin A“ ist an der Bildung des „MPF“ beteiligt [„Eine Rolle von Cyclin A1 bei der Aktivierung des MPF- und G2-M-Übergangs während der Meiose männlicher Keimzellen bei Mäusen - ScienceDirect“; D. Liu , u.a.; Aug 2000; https://doi.org/10.1006/dbio.2000.9776]. Diverse Proteine sind um Umfeld des „MPF“ organisiert, die unübersichtlich hemmend oder aktivierend mitwirken. Die Phosphorylierung von „CDK1“ durch das eizellenspezifische „WEE2“ unterdrückt die MPF-Aktivität. [Entwicklung von WEE2-Kinase-Inhibitoren als neuartige nicht-hormonelle Kontrazeptiva für Frauen, die auf die Meiose abzielen - PMC (nih.gov); C. Hanna u.a.; Jun 2020; https://doi.org/10.1093/biolre/ioaa097].
„Cyclin A“ und „M-Phasen-Induktor-Phosphatase 1 (CDC25A)“ sind die Aktivatoren der CDKs. „Cyclin A“ ist die aktivierende Untereinheit im Cyclin A-CDK-Komplex. Die Phosphatase „CDC25A“ wirkt an hemmenden Phosphorylierungsstellen der CDKs.
[Cyclin A-CDK1 unterdrückt die Expression des CDK1-Aktivators CDC25A, um einen rechtzeitigen Eintritt in die Mitose zu gewährleisten - Journal of Biological Chemistry (jbc.org) R. Poon u.a., März 2023; https://doi.org/10.1016/j.jbc.2023.102957].
„CDK1“ füllt in Z.38365 die Spalte „329/130“, und verzichtet damit auf den Anteil „32“ der Zellzyklus-Spalte „30/32“ zugunsten der Bildung einer internen 5-fachen Phosphor-Quelle mit Phosphor=15E: 1.) „13“_“2“ für 15E; 2.) „13“_29=QS=11=QS=“2“ für 15E; 3.) „1“_32=QS=“5“ für 15E; 4.) 13=QS=“4“_29=QS=“11“ für 15E; 5.) 130=QS=“4“_29=QS=“11“ für 15E. „CDK1“ wird folglich gehemmt, wenn Phosphor aus dieser Quelle entnommen wird. Im Gegenzug kann „CDK1“ externe Ziffern anlagern und mit internen Ziffern „Phosphor“ gewinnen. Die 3 Phosphatasen „CDC25A/B/C“ grenzen an „CDK1“ und beeinflussen den Zellzyklus. „Cyclin A1/A2“ liegen hemmend auf „CDC25B/C“. „CDC25A“ zieht auf der linken Seite durch „CDK1“. „CDC25A“ aktiviert „CDK1/CDK2/CDK4“ [CDC25A – Wikipedia].
Proteinphosphatase 2A (PP2A): Die „CDC25-Familie“ und „Wee1-Familie“ werden von der Serin/Threonin-Phosphatase „PP2A“ gesteuert, die zur Regulation vieler zellulärer Prozesse unerlässlich ist. Bei Krebs und anderen Krankheiten wird „PP2A“ dereguliert [Wee1 und Cdc25 werden durch konservierte PP2A-abhängige Mechanismen in der Spalthefe - PMC - gesteuert (nih.gov) ; R. Lucena u.a.; Jan 2017; doi: 10.1080/15384101.2017.1281476]. „PP2A“ bildet ein Heterotrimer aus der Gerüst-A-Untereinheit, der regulatorischen B-Untereinheit und der katalytischen C-Untereinheit. Die PP2A-Proteinphosphatase wird ubiquitär exprimiert [Proteinphosphatase 2 – Wikipedia]. Hierfür liegt das Ubiquitin=76AS als Spalte extern an der C-Untereinheit. Die „PP2A-Untereinheiten“ A, B und C werden jeweils von verschiedenen Proteine gebildet. Untereinheit A: PPP2R1A oder PPP2R1B; Untereinheit C: PPP2CA oder PPP2CB; Untereinheit B: 13 Proteine wie u.a. PPP2R2A. Die beiden katalytischen Untereinheiten „PPP2CA“ und „PPP2CB“ sind aufgrund des gemeinsamen Cofaktors „Mangan=25E für 2 Ionen“ eine Besonderheiten, außerdem stimmt die Protein-Länge von 309AS überein (davon 1x lesbar). Die beiden „Untereinheiten C“ (PPP2CA/PPP2CB) interagieren mit beiden Formen der Gerüstmoleküle „Untereinheit A“ („PPP2R1A“/ „PPP2R1B“), aber nur „PPP2CA“ interagiert mit „7“ Proteinen der „Untereinheit B“. Die Untereinheiten bilden 2 verschiedene Komplex-Formen, und zwar für das dimere Kernenzym aus Untereinheiten „A/C“ oder trimeren Holoenzymkomplex ist, der aus drei Untereinheiten besteht: katalytisch (PP2Ac), Gerüst (PP2AA) und regulatorische Untereinheiten (PP2AB) [Phosphatase: PP2A strukturelle Bedeutung, Regulation und seine abweichende Expression bei Krebs - PMC (nih.gov); S. Batra. u.a.; Feb. 2013; DOI: 10.1016/j.canlet.2013.02.036].
Dimer „PPP2R1A/PPP2CA“: Das Protein (Mensch) „PPP2R1A“ ($$)=589AS liegt mit „PPP2CA“{} in der Spalte Z.38364#_$52$[8981405]/#_$32${9}[775645]/#_$1$[3]{0}{7}[88788]/#_$9${3}{20}[20816], und zwar in Z.38364 als „52“_aufsteigend 32=QS=“5“_aufsteigend „1“ mit Summe 52+5+1=“58“_“9“ mit 58_9 für „PPP2R1A“ ($$) =589AS. „Vermittelt zusammen mit dem RACK1-Adapter die Dephosphorylierung von AKT1 an 'Ser-473'“ [PPP2R1A - Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Die Phosphorspalte „1/5“ in Z.38364 gehört mit der Ziffer „5“ zum Serin= C3H7NO3=18+7+7+24=56E im Protein (Mensch) „AKT1“=480AS in der Spalte Z.38364#_“8“[1405]/#_“7“56“4“[5], und zwar in Z.38365 als „4“_56=QS=11=QS=“2“_absteigend Spalte 7/8 für „78“ mit „4“_Summe 2+78=“80“ für AKT1“=480AS [AKT1 - RAC-alpha serine/threonine-protein kinase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RACK1“=317AS verbindet „PPP2R1A“ mit AKT1, und zwar in Z.38366 als „3“_07=QS=“7“_aufsteigend Spalte 8/2=QS=“10“ mit „3“_Summe 7+10=“17“ mit 3_17 für RACK1=317AS [RACK1 - Small ribosomal subunit protein RACK1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PPP2CA“ {}=309AS bindet an der PPP2R1A-Endziffer, so dass von der seitlichen Zahl „30“ nur die Ziffer „0“ zählt. PPP2CA“ {} in Z.38367 als „3“_“20“_absteigend „7“ mit Summe 3+20+7=“30“_absteigend Spalte 9/0=QS=“9“ mit 30_9 für „PPP2CA“ {}=309AS. Bei dieser PPP2CA-Wegführung wird das Doppel-Mangan (Mg=25E) doppelt als 50E genutzt, um den Versatz 30[7]/[3]20 als Summe 30+20=50E für Doppel-Mg dazustellen. „Ubiquitin“ =76AS ist angehängt als „73“_absteigend „3“ mit Summe 73+3=76AS. „Aktiviert RAF1 durch Dephosphorylierung an 'Ser-259'“ [PPP2CA - Serine/threonine-protein phosphatase 2A catalytic subunit alpha isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RAF1“=648AS entnimmt der Spalte „32/33“ das erforderliche Serin=56E und ATP=260E. „RAF1“ folgt in der Z.38368 über „33471“ als 33=QS=“6“_“4“_71=“8“ mit 6_4_8 für „RAF1“=648AS [RAF1 - RAF proto-oncogene serine/threonine-protein kinase - Homo sapiens (Human) | UniProtKB | UniProt].
Dimer „PPP2R1B“/“PPP2CB“: Das Protein (Mensch) „PPP2R1B“ (€€)=601AS interagiert mit beiden katalytischen Proteinen. „PPP2R1B“ vermeidet aber die Interaktion mit dem anderen Gerüst-Protein „PPP2R1A“, die in Z.38368 über „7_3_3_47_1“ als „60_1“ eintreten würde. PPP2R1B“ (€€) liegt in der Spalte Z.38368#_[7]€33€[471712]/#_€535€!14![1459]/#_€33€!7!!0!!3![0040], und zwar in Z.38370 als „33“_absteigend „535“_absteigend „33“ mit Summe 33+535+33=“601“ für „PPP2R1B“ (€€)=601AS [PPP2R1B - Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A beta isoform - Homo sapiens (Human) | UniProtKB | UniProt]. „PPP2R1B“ interagiert mit dem Protein (Mensch) „STN4“ (!!)=753AS in der Spalte in Z.38370 als „7“_absteigend Spalte 0/1=QS=“1“_“4“ mit „7“_Summe 1+4=“5“_aufsteigend „3“ mit 7_5_3 für „STN4“=753AS [STRN4 - Striatin-4 - Homo sapiens (Human) | UniProtKB | UniProt]. Rechts liegt Calmodulin=149AS, das von STK24=442AS durchzogen wird [Der kaputte "Aus"-Schalter in der Krebssignalisierung: PP2A als Regulator der Tumorentstehung, der Arzneimittelresistenz und der Immunüberwachung - ScienceDirect; P. Ruvolo; Dez 2016;; https://doi.org/10.1016/j.bbacli.2016.08.002].
Das Protein (Mensch) „PPP2CB“ ()=309AS muss sich eng an PPP2CA {} legen, um klammerartig an beiden Enden „PPP2R1A“ und „PPP2R1B“ zu binden. Die Cofaktor-Wiederholung „Doppel-Mangan“ für 2*25E=50E resultiert aus dem Doppel-Calcium 20“20“. Die rechte Zahl „20“ wird statt „30“ mit dem „speziellen Zink“ Form=7887=QS=30 zu „50“E addiert. Der Protein-Pfad soll somit durch die Spalte „88/20“ ziehen. „PPP2CB“ ()=309AS liegt in der Spalte Z.38364#_$52$(89)(8)(1)[405]/#_$32${9}(77)(5)[645]/#_$1$[3]{0}{7}(88)[788]/#_$9${3}{20}(20)[816]/#_[7]€33€(471)[712], und zwar in Z.38364 als „89“_aufsteigend „77“_absteigend „8“_aufsteigend Spalte 1/5 für „15“_aufsteigend „88“_aufsteigend „20“_aufsteigend 471=QS=“12“ mit Summe 89+77+8+15+88+20+12=“309“ für „PPP2CB“ ()=309AS. „Reaktion auf Wasserstoffperoxid“ mit „H2O2“=2+16=18E. „PPP2CB“ enthält die Spalte 8/0/1, und zwar absteigend für 10+8=18E, wobei extern seitlich 0[81] für „H2O2“=„18E“ bindet. [PPP2CB - Serine/threonine-protein phosphatase 2A catalytic subunit beta isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TLX1“ (°°)=330AS bindet an „PPP2CA“ und „PPP2CB“ in der Spalte Z.38368#_[57]°33°(471)[712]/#_^1^5^^3^°514°^1^[459]/#_[73]^3^703^^0^[040], und zwar in Z.38368 als „33“_aufsteigend 514=QS=10 für „0“ mit 33_0 für „TLX1“ (°°)=330AS [TLX1 - T-cell leukemia homeobox protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TDI_ TLX1NB“ (^^)=122AS umklammert „TLX1“ (°°) als Nachbar in Z.38369 mit „1“_“5“_aufsteigend Spalte 3/3=QS=“6“_703=QS=“10“_absteigend Spalte 1/0=QS=“1“ mit „1“_Summe 5+6+10+1=“22“ mit 1_22 für „TDI_TLX1NB“=122AS [TLX1NB - Putative TLX1 neighbor protein - Homo sapiens (Human) | UniProtKB | UniProt].
Trimere „PP2A“: Für das trimere Protein „PP2A“ existieren „13“ verschiedene regulatorische „Untereinheiten B“, von denen sich jeweils „1“ mit einer dimeren Untereinheiten „A/C“ verbindet. Besonderheit: Die B-Untereinheiten „PPP2R2A“ und „PPP2R5A“ binden jeweils am selben Dimer „PPP2R1A/PPP2CA“: „Alles hat ein Ende, nur die Wurst hat zwei.“
Das Protein (Mensch) „PPP2R2A“ (||)=447AS liegt zwar in Z.38368 über „73347“ als Summe 7+33+4=44_7 am Dimer, funktionell ist jedoch eine Erweiterung bis zum rechten Rand erforderlich. „PPP2R2A“ (||) liegt in der Spalte Z.38367#_$9${320}[208]|16|/#|7|33|47|17|12|, und zwar in Z.38368 als „7“_33=QS=“6“_47=QS=11=QS=“2“_“17“_“12“ mit Summe 7+6+2+17+12=“44“_absteigend 16 (Rand)=QS=“7“ mit 44_7 für „PPP2R2A“ (||)=447AS. „Essentiell für die Serin/Threonin-Protein-Phosphatase-2A-vermittelte Dephosphorylierung von WEE1, die Verhinderung der Ubiquitin-vermittelten Proteolyse, die Erhöhung des WEE1-Proteinspiegels und die Förderung des G2/M-Checkpoints“. Die Erzeugung einer Endziffer „7“ in [8]|16|=QS=15(Phosphor) führt mit der externen Zahl [8] durch Dephosphorylierung von „WEE1“, das in der Randzahl |16| endet. „Reaktion auf Morphium“. Morphium=152E wird über die Randspalte [8]|16|/|7|12| aus der erzeugten Zahl „15“_Randziffer „2“ mit 15_2 zur Reaktion auf „Morphium (Morphin)“=C17H19NO3=102+19+7+24=152E [PPP2R2A - Serine/threonine-protein phosphatase 2A 55 kDa regulatory subunit B alpha isoform - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „PPP2R5A“ (§§)=486AS liegt in der Spalte Z.38363#_§6§728§[406085]/#_[2]$52$§89§[81405]/#_[8]$32${9}§77§[5645], und zwar in Z.38365 als 77=QS=“14“_ absteigend 89=QS=“17“_absteigend 728=QS=“17“ mit Summe 14+17+17=“48“_“6“ für PPP2R5A“ (§§)=486AS [PPP2R5A - Serine/threonine-protein phosphatase 2A 56 kDa regulatory subunit alpha isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Axin1“ (~~) =862AS interagiert mit „PPP2R5A“ (§§) [ AXIN1 – Wikipedia] „AXIN1“ reagiert auf Schall, so dass die Haut=33 mit der „Schallgeschwindigkeit“ 333 m/s erweitert wird, wofür der linke Zeilenrand geeignet ist. „AXIN1“ (~~) liegt in der Spalte Z.38362“#~161~11~[092804…]/#_“16“~110~§6§728§[40….]/#_“16“~110~2~$52“§89§[8]/#“161“[09832977…], und zwar in Z.38362 als 161=QS=“8“_11=QS=2_aufsteigend 110=QS=2_aufsteigend 110=QS=2 mit „8“_Summe 2+2+2=“6“_“2“ mit 8_6_2 für „Axin1“ (~~) =862AS [AXIN1 - Axin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die enthaltene Zahl „110“ gilt für Insulin „INS“=110AS.
„AXIN1“ (~~) wird vom Protein (Mensch) „LRP5“ („“) =1615AS rekrutiert, und zwar in Z. 38363 als „16“_aufsteigend 16=QS=“7“_aufsteigend 161=QS=“8“ mit „16“_Summe 7+8=“15“ mit 16_15 für „LRP5“ („“) =1615AS [LRP5 - Low-density lipoprotein receptor-related protein 5 - Homo sapiens (Human) | UniProtKB | UniProt].
An der Startzahl §77§ von „PPP2R5A“ bindet rechts zwecks Interaktion das Protein (Mensch) „PPP2R5C“ („“)=524AS in der Spalte Z.38364#_§9§[8]“14““0“[5]/#_§77§“5““64“[5], und zwar als in Z.38365 als „5“_absteigend in der Phosphorspalte 1/5 als 14_0_aufsteigend 64=QS=10 mit „5“_Summe 14+0+10=“24“ mit 5_24 für „PPP2R5C“ („“)=524AS, wobei „TP53“ an seiner Startzahl „140“ dephosphoryliert wird. „PP2A-PPP2R5C-Holoenzym kann TP53 spezifisch dephosphorylieren und aktivieren und eine Rolle bei der durch DNA-Schäden induzierten Hemmung der Zellproliferation spielen“ [PPP2R5C - Serine/threonine-protein phosphatase 2A 56 kDa regulatory subunit gamma isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CTLA-4“ („“)=223AS liegt zur Interaktion rechts neben „PPP2R5A“ (§§) in der Spalte Z.38363#_§8§“4“0“6“0“[85]/#_§89§“8“1“4“[05]/_{9}§77§“56“[45], und zwar als 56=QS=11=QS=“2“_aufsteigend Spalte 0/4=QS=“4“_absteigend Spalte 6/1=QS=“7“_absteigend 0/8=QS=“8“_“4“ mit „2“_Summe „4+7+8+4“=“23“ mit 2_23 für
„CTLA-4“ („“)=223AS. An der Startzahl „56“ binden die Liganden „CD80“ /“CD86“. Der Wirkstoff „Ipilimumab“ (!!)=1324AS zieht durch „CTLA-4“ in der Spalte Z.38363#_§8§“!4!“!0!“6“0“[85]/#_§89§“!8!“!1!“!4!“[0]!5!/_{9}§77§“5!6!“!4!!5!, und zwar in Z.38363 als „4“_aufsteigend Spalte 0/8=QS=“8“_“1“ mit Summe 4+8+1=“13“_aufsteigend Spalte 4/6=QS=“10“_“4“_absteigend Randspalte 5/5=QS=“10“ mit „13“_Summe 10+4+10=“24“ mit 13_24 für „Ipilimumab“ (!!)=1324AS [Ipilimumab – Wikipedia]. „Der therapeutische Antikörper Ipilimumab konkurriert um die Bindungsstelle der endogenen Liganden CD80/B7-1, CD86/B7-2 und ICOSLG“ [CTLA4 - Cytotoxic T-lymphocyte protein 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CD80“ (©©)=288AS liegt in der Spalte Z.38365#_{9}§77§“56“[45]/#_ [07]©88©788/#_[20]©2©[08]16, und zwar in Z.38367 als „2“_absteigend „88“ mit 2_88 für „CD80“ (©©)=288AS [CD80 - T-lymphocyte activation antigen CD80 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CD86“ (@@)=329AS liegt am Rand in Z.38367 als „16“_absteigend 88=QS=“16“ mit Summe 16+16=“32“_absteigend 45=QS=“9“ mit 32_9 für „CD86“ (@@)=329AS [CD86 - T-lymphocyte activation antigen CD86 - Homo sapiens (Human) | UniProtKB | UniProt].
Die B-Untereinheit „PPP2R3B“ besitzt eine Calcium-Bindung und kann mit beiden A-Untereinheiten, der C-Untereinheit „PPP2CA“ sowie mit „CDC6“ interagieren, das über die klassische ATP-Spalte den rechten Rand besetzt. Das Doppel-Calcium „2020“ ist besetzt, so dass alternativ die Spalte „514/703“=QS=20 (Calcium) durchlaufen wird. Das Protein (Mensch) „PPP2R3B“ (**)=575AS bindet an den „4“ Proteinen und liegt in der Spalte Z.38367#_$9${320}(20)816/#_*7**3*3*(471)712/#_*5*[3]*5**14*1459/#_33*70*[3]0040, und zwar in Z.38368 als 14=QS=“5“_aufsteigend 70=QS=“7“_absteigend Spalte „3/5“ für „53“_“3“_aufsteigend Spalte 7/5=“12“ mit „5“_Summe 7+53+3+12=“75“ mit 5_75 für „PPP2R3B“ (**)=575AS [PPP2R3B - Serine/threonine-protein phosphatase 2A regulatory subunit B'' subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CDC6“ (°°)=560AS in Z.38369 aufsteigend als Spalte 1/0=QS=“1“_004=QS=“4“ mit Summe 1+4=“5“_absteigend Spalte 1/5 für „51“_aufsteigend „1“_absteigend Randspalte 6/2=QS=“8“ mit „5“_Summe 51+1+8=“60“ mit 5_60 für „CDC6“ (°°)=560AS [CDC6 - Cell division control protein 6 homolog - Homo sapiens (Human) | UniProtKB | UniProt]._dat01.06.2024
Die „CDC25-Familie [CDC25A/B/C] besteht aus Phosphatasen, die Phosphatgruppen aus phosphorylierten Tyrosin- und Serin/Threonin-Resten dual entfernen. „CDC“="cell division cycle". Im mathematischen Komplex CDC25A/B/C sind die Familienmitglieder in Interaktionen verwickelt, so dass sie sich trotz der Nähe nicht gegenseitig binden. „CDC25C“ trennt „CDC25A/B“. „CDC25A“ ist meist im Zellkern lokalisiert. „CDC25B“ gilt als "Initiator"-Phosphatase, die zwischen Zytoplasma und Zellkern hin und her pendelt. Während der Interphase pendelt „CDC25C“ vom Zytoplasma zum Zellkern [Die Rolle von CDC25C bei der Zellzyklusregulation und der klinischen Krebstherapie: eine systematische Übersichtsarbeit | Krebszelle International | Volltext (biomedcentral.com); K. Liu; u.a. ; Jun 2020; https://doi.org/10.1186/s12935-020-01304-w].
„CDC25A“ wird während des G1 / S-Übergangs an der Zellzyklus-Spalte exprimiert. Um die S-Phase zu fördern, wird auf Cdk2/Cyclin A und nachfolgend auf Cdk2/Cyclin E eingewirkt. „Dephosphoryliert CDK1 direkt und stimuliert seine Kinaseaktivität. Dephosphoryliert CDK2 auch im Komplex mit Cyclin-E, in vitro.“ „Stimuliert durch PIM1-vermittelte Phosphorylierung“. Das Protein (Mensch) „CDC25A“ {}=524AS zieht durch „CDK1“ (!!)=297AS in der Spalte Z.38364#_[25]{2}[8981405]/Grenze/#_{8!3!}{2}9![775645]/#_{4!1}30![788788], um Phosphor zu übertragen, und zwar in Z.38366 als 41=QS=“5“_absteigend 83=QS=11=QS=“2“_absteigend Spalte 2/2=QS=“4“ mit 5_2_4 für „CDC25A“ {}=524AS. In der Katalyse verbindet sich die Endziffer „2“[8] extern zu Wasser „28“. „L-tyrosine-phosphate residue [CHEBI:82620]“=C9H8NO5P=54+8+7+40+15=124E ist in der Spalte {83}/{41} als Summe 83+41=124E enthalten [CDC25A - M-phase inducer phosphatase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „CDC25A“ wird durch „PIM1“ stimuliert, andererseits erzeugt „CDC25A“ mit der Reduzierung “2 aus 83“ den unlesbaren PIM1-Cofaktor „Mg“=12E. Das Protein (Mensch) „PIM1“ („“)=313AS liegt in der Spalte Z.38365#_{8“3“}{2}[9775645]/#_{4!“1“}“3“[0788788], und zwar in Z.38365 als „3“_aufsteigend „13“ mit 3_13 für „PIM1“ („“)=313AS. Die PIM-Endziffer „3“ liegt extern an „CDC25A“, so dass die Spalte [3]2/1“3“ mit Summe 13+2=Phosphor=15E erzeugt [PIM1 - Serine/threonine-protein kinase pim-1 - Homo sapiens (Human) | UniProtKB | UniProt].
„a-RAF/b-RAF/c-RAF“: Das Protein (Mensch) „c-RAF_RAF1“=648AS mit „Zinkbindung für 2 Ionen“ als Doppel-Zink=2*30=60E sowie ATP besetzt die Startziffer von „CDC25A“{}. „c-RAF“, ein Komplex mit „a-RAF/b-RAF“(Zink analog), liegt in der Spalte Z.38365#_“8“[3]“29“[…]/#_“4“1“30“[…], und zwar in Z.38365 als „29“_aufsteigend „30“_“1“ mit Summe 29+30+1=“60“ (Doppelzink)_“4“ mit Summe 60+4=“64“_absteigend „8“ mit 64_8 für RAF1“ („“)=648AS. „Assoziation mit anderen Proteinen wie KSR2“ [RAF1 - RAF proto-oncogene serine/threonine-protein kinase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „KSR2“=950AS bindet an „RAF1_c-RAF“ in Z.38367#_“9“32“0“[…] als „9“_QS3+2=“5“_“0“ mit 9_5_0 für „KSR2“=950AS. „Dimerizes with BRAF“ [KSR2 - Kinase suppressor of Ras 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „BRAF“=766AS liegt rechts an „RAF1“ und „KSR2“ in der Spalte Z.38365#_775645/#_788788/#_020816/#_471712, und zwar aufsteigend in Z.38365 als Spalte 77=QS=“14“_aufsteigend 78=QS=“15“_“20“_absteigend 87=QS=“15“_aufsteigend 81=QS=“9“_aufsteigend 12=QS=“3“ mit Summe 14+15+20+15+9+3=“76“_absteigend „6“ mit 76_6 für „BRAF“=766AS. „Phosphorylierte PFKFB2“ [BRAF - Serine/threonine-protein kinase B-raf - Homo sapiens (Human) | UniProtKB | UniProt]. Die „BRAF“-Endschleife „12“/[!5!9] ergänzt sich bei der Bindung an das Protein (Mensch) „PFKFB2“=505AS in der Spalte „1/5“ zu Phosphor=15E. „PFKFB2“ liegt in der Zeile Z.38369#_“5“1414“5“[9], und zwar als „5“_1414=QS=10 für „0“_“5“ mit „505“ für „PFKFB2“=505AS. „Synthese und Abbau von „Fructose-2,6-bisphosphat ( CHEBI:58579)“. „beta-D-fructofuranose 2,6-bisphosphate(4-)“=C6H10O12P2=36+10+96+30=172E liegt vorgelagert in Z.38368 über „5733471“ als 57_33_4_7_71 als Summe =172E [PFKFB2 - 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ARAF“=606AS zählt Doppel-Zink=60E und soll wunschgemäß als Familie an c-RAF/ b-RAF binden, und zwar in der Spalte Z.38367#_32020816/#_3347“17“12/#_35141459, und zwar absteigend in Z.38368 als 717=QS=“15“_absteigend Spalte 0/4 für „40“_32=QS=“5“ mit Summe 15+40+5=“60“_aufsteigend 33=QS=“6“ mit 60_6 für „ARAF“=606AS. Die Ziffer „1“ in 7“1“7 ergänzt sich in der „PFKFB2“-Folgezeile mit „14“ zu 1+14=Phosphor=15E. „Phosphorylate PFKFB2“ [ARAF - Serine/threonine-protein kinase A-Raf - Homo sapiens (Human) | UniProtKB | UniProt].
„CDC25B“: Die Tyrosinproteinphosphatase, Protein (Mensch) „CDC25B“ ()=580AS liegt in der Spalte Z.38366#_[/#_{41}[30](78)[8788]/#_[99](320)(2)[0816], und zwar in Z.38367 als 320=QS=“5“_aufsteigend „78“_absteigend „2“ mit „5“_Summe 0+78+2=“80“ mit 5_80 für „CDC25B“ ()=580AS (aktiv). Das inaktive „CDC25B“ (~~)=580AS liegt seitlich lesbar in Z. 38265 Spalte 5/8/0 für 580AS (inaktiv). Das inaktive CDC25B (~~) wird vom Protein „Exportin-1“ vom Zellkern in das Zytosol transportiert [CDC25B - M-phase inducer phosphatase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Ausschleusung erfolgt durch das Protein (Mensch) „Exportin-1“ (€€)=1071AS, indem in „CDC25B“ () über die Spalte 8/2=QS=10 aufsteigend ein Schleife „71“ an die inaktive Spalte 5/8/0 angehängt wird, und zwar mit 10_71 für „Exportin-1“ (€€)=1071AS [XPO1 - Exportin-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Bei der „CDC25B“-Interaktion bindet das Protein (Mensch) „ESR1_Östrogenrezeptor alpha“ („“)=595AS (Monomer) mit Zink-Bindung in der Spalte Z.38365#_“2“9“!7![7…]/#_“3“0“!7!!8![…]/#_“32“[02…] in die „CDC25B“-Startzahl „32“ ein, und zwar in Z.38367 als 32=QS=“5“_aufsteigend Spalte 9/0(aus Zink 3“0“E)=QS=“9“_absteigend Spalte 2/3 (aus Zink=“3“0E)=“5“ mit 5_9_5 für ESR1= („“)=595AS (Monomer). Die homodimere Ergänzung absteigend in Z.38367 als Spalte 0/4/1=QS=“5“_aufsteigend Spalte 2/7=QS=“9“_absteigend 41=QS=“5“ mit 5_9_5 für ESR1=595AS (Dimer). „Zink“ ist mit 02 links für „20“_4/1=“5“_41=“5“ mit Summe 20+5+5=Zink=30E enthalten [ESR1 - Estrogen receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Mütterliche embryonale Leucin-Reißverschlusskinase“, das Protein (Mensch) “Melk“=651AS ist eine Serin/Threonin-Proteinkinase mit einer „Calcium-Bindung“, die mit „CDC25B“ () interagiert [MELK – Wikipedia]. Der Leucin-Reißverschluss als Doppel-Leucin=72E mit Serin=56E am Rand liegt in Z.38365 über „297756“ mit 77=Doppel von Form=“7“ mit 29=QS=11=QS=2_7 für gespiegelt Leucin=72_7_56=QS=11=QS=2 mit 7_2 für Leucin=72E. Weiblich=“66“ muss enthalten sein. “Melk“ („“)=651AS liegt in der Spalte Z.38365#_“29“77“56“[45]/#_“3“[0788788]/#_“3“20“[2816]/#_[33]“4“[71712], und zwar in Z.38368 als „4“_aufsteigend 20(Calcium)=QS=“2“ mit Summe 4+2=“6“_absteigend Spalte 3/3 (ergänzt weiblich=66) für „33“_absteigend Zipper „297756“ mit „2+7_7+2“ für Summe=“18“¬ mit „6“_Summe 33+18=“51“ mit 6_51 für “Melk“=651AS [MELK - Maternal embryonic leucine zipper kinase - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CSNK2A1_ Casein kinase 2, alpha 1“ („“)=391AS phosphoryliert saure Proteine wie „Casein“ (§§) und interagiert mit „CDC25B“ () in der Spalte Z.38364#_[52898]§14§[05]/Grenze/#_“329“7“§756§[45]/#_[1]“30“7“[88788], und zwar in Z.38366 als 30=QS=“3“_absteigend Spalte 7/7 für „77“_links 329=QS=“14“ mit „3“_Summe 77+14=“91“ mit 3_91 für „CSNK2A1“ („“)=391AS [CSNK2A1 - Casein kinase II subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „Casein“ als Protein (Mensch) „CSN1S1_Alpha-S1-casein“ (§§)=185AS bindet seitlich im Phosphor und Serin als 756=QS=“18“_absteigend 14=QS=“5“ mit 18_5 für „CSN1S1“=185AS [CSN1S1 - Alpha-S1-casein - Homo sapiens (Human) | UniProtKB | UniProt].
„CDC25B“ steht zum Austausch von Phosphor mit dem angrenzenden „CDK1“=297AS aus der Spalte „3“29/“130“ mit 130 mit Summe 13+0=“13“ (extern in CDK1) über Spalte 0/2 mit „2“(intern) mit Summe 13+2=Phosphor=“15“E in Beziehung. Das 2.Phosphor aus „3“(extern)_aufsteigend 320=QS=“5“ (intern)_absteigend „7“(intern) mit Summe 3+5+7=Phosphor=“15“E.
„CDC25C“: Die Tyrosinphosphatase, das Protein (Mensch) „CDC25C“ (||)= 473AS steuert die Dephosphorylierung der „Cyclin B-gebundenen Kinase CDK1 (CDC2)“ und löst den Eintritt in die Mitose aus [Achtung!: CDK1 stammt aus dem Gen CDK1. „CDK1“ wird synonym als „CDC2“ bezeichnet. Diese Bezeichnung wird auch für das Protein „CDC2“ verwendet, das dem Gen CDC2 entstammt]. Weil hierzu der von „p53“ verursachte Wachstumsstillstand unterdrückt werden muss, orientiert sich „CDC25C“ am rechten Rand der mit „5645“ über „564“ Serin=56E/Threonin=64E einerseits und gespiegelt „6“_QS4+5=“9“ mit 6_9 auch das Tyrosin=96E enthält. Für die Katalyse gewinnt „CDC25C“ das „L-tyrosine-O-phosphate(2−) residue [CHEBI:82620]=C9H8NO5P=54+8+7+40+15=124E“ seitlich von „CDK1“ in Z.38365 über „775645“ als „77“_56=QS=11=QS=“2“_“45“ mit Summe 77+2+45=124E. Das Wasser „28“ ist als Spalte 8/2 für „28“ angelagert. CDC25A“{} und CDC25B“() umgrenzen die CDK1-Zahl „30“, die von „CDC25C“ besetzt werden muss, um „CDK1“ zu dephosphorylieren. Die Ziffer „3“ ergänzt sich links zu „13“ und absteigend über die Ziffer „2“ zu 13+2=Phosphor=15E, der aus CDK1-Spalte „329/130“ entfernt wird. Es wird eine Schleife über die Grenze für eine Phosphor-Spalte „1/5“ gelegt, um den aufgenommen Phosphor in „CDC25C“ einzulagern. „CDC25C“ (||)= 473AS liegt mit CDC25A {} und CDC25B () in der Spalte Z.38364#_[25]{2}[89]|8|1|[405]/Grenze/#_{83}{2}|97|7||5|64|[5]/#_{41}|30|(78)[8788]/#_[99](32)(0)(2)[0816], und zwar in Z.38365 nach links als 64=QS=“10“_absteigend Phosphor-Spalte 1/5=QS=“6“_aufsteigend 8/7=QS=“15“_97=QS=“16“ mit Summe 10+6+15+16=“47“_aufsteigend 30=QS=“3“ mit 47_3 für „CDC25C“ (||)= 473AS [CDC25C - M-phase inducer phosphatase 3 - Homo sapiens (Human) | UniProtKB | UniProt].
„CDC25C“ wird durch die Checkpointkinase „CHK1“ (§§) an Serin 216 phosphoryliert. Eine darauffolgende Ubiquitinierung markiert Cdc25C für den Abbau“ [Cdc25C - DocCheck Flexikon]. Alternativ kann das Protein (Mensch) „CHK1“ (;;)=476AS bei konstanter Endziffer-Spalte 1/5=QS=“6“ nach links verschwenken, um „CDC25A“ abzubauen. „CHK1“ (;;) kann während der S-Phase aktiviert werden, um den Übergang in die G2-Phase zu verhindern. Dies geschieht durch die Phosphorylierung von „CDC25A“. „CHK1“ (;;) bindet zwecks Abbau in „CDC25A“ ein. „CHK1“ (;;)=476AS liegt in der Spalte Z.38364#_[252898];1;[405]/#_[8];3;29;77;5;[645]/#_[4];1;[30788788], und zwar in „CDC25A“ absteigend in Z.38365 Spalte 3/1=QS=“4“_“29“ (intern/extern)_77=QS=“14“ mit Summe 4+29+14=“47“_absteigend Spalte 1/5=QS=“6“ mit 47_6 für „CHK1“ (;;)=476AS. Das Protein (Mensch) „CHK1“ (§§)=476AS liegt in der Spalte Z.38364#_[289]|8§1§|§405§/#_[2]|97|7||§5§||§64§|§5§/#_|30|[788]§78§§8§, und zwar in Z.38364 am Rand 405=QS=“9“_aufsteigend Spalte 5/8=QS=“13“_78=QS=“15“_absteigend 64=QS=“10“ mit Summe 9+13+15+10=“47“_absteigend zum Ring in Spalte 1/5 (Phosphor)=QS=“6“ mit 47_6 für „CHK1“ ()=476AS. Aktivität am modifizierten „Histon H3“. Histon H3=136AS ist eine Verbindung von „CHK1“ mit der ATP-Randspalte „12/59“ in der Randspalte „16/12“ mit 12+1=13_6 für Histon H3=136AS [CHEK1 - Serine/threonine-protein kinase Chk1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CHK2“ (µµ)=543AS phosphoryliert „CDC25A/CDC25C“, die dadurch abgebaut werden, so dass keine „CDKs“ aktivierbar sind [CHK2 - DocCheck Flexikon]. „CHK2“ bindet in „CDC25A“ ein und zieht zur Umgehung von „CDC25B“ winkelförmig zum Rand, um die Magnesium-Randzahl „12“ aufzunehmen. „CHK2“ (µµ) liegt in der Spalte Z.38365#_µ|3|µ29µ77µ56µ45µ/#_|13|07]|88|[78]µ8µ/#_[9]|32|[0]|20|8µ1µµ6µ/#_[73]|3|47|1|[7]µ1µ2µ/#_5351[41459], und zwar in Z.38365 als „3“_29=QS=11=QS=“2“ mit Summe 3+2=“5“_77=QS=“14“_56=QS=“11=QS=“2“_45=QS=“9“_aufsteigend Randspalte 8/6/2=QS=“16“_absteigend Spalte 1/1=“2“ mit „5“_Summe 14+2+9+16+2=“43“ mit 5_43 für „CHK2“ (µµ)=543AS [CHEK2 - Serine/threonine-protein kinase Chk2 - Homo sapiens (Human) | UniProtKB | UniProt]. „CHK2“ aktiviert „BRCA1“, das „RAD51“ rekrutiert. Der „BRCA1-RBBP8-Komplex“ reguliert „CHK1“.
Das Protein (Mensch) „BRCA1“ (||)=1863AS erzeugt massenhafte Interaktionen. Von den 6 bekannten Isoformen besitzen die Isoformen 1 und 2 jeweils eine Länge von „1863“ Aminosäuren [BRCA1 – Wikipedia]. Aufgrund der Interaktion mit „p53“ muss der rechte Rand in Z.38368 beteiligt werden. Der Tumorsuppressor „p53“ reguliert die Expression von „BRCA1“, so dass „BRCA1“ seiner der Startzahl „88“ in „p53“ einbindet [„Tumorsuppressor p53 wird benötigt, um die BRCA1-Expression zu modulieren - PMC (www-ncbi-nlm-nih-gov.translate.goog)“; S. Lee; Okt.2000; DOI: 10.1128/MCB.20.20.7450-7459.2000]. „BRCA1“ liegt in der Spalte Z.38365#_[29775645]/#_[307]|88|°7°°8°[8]/#_[320]|20|°81°[6]/#_[3]|34|71|[712]/#_ 3]|5|!14![1]!4![59]/#_[3]|7|!0!30!0!4![0], und zwar in Z.38366 als 88=QS=“16“_links aufsteigend 20 =QS=“2“ mit Summe 16+2=“18“_ aufsteigend 71=QS=“8“_34 links für „43“_aufsteigend Spalte 5/7=QS=“12“ mit „18“_Summe 8+43+12=“63“ mit 18_63 für „BRCA1“ (||)=1863AS. Die Bindung an „p53“ ist als Einbindung vorhanden (keine seitliche Bindung). „HERC2“ kann bei dieser BRCA1-Position über den rechten Rand „BRCA1“ winkelförmig zwecks Bindung an „RPA2“ umgehen. Dort endet aber zugleich auch „BRCA1“, so dass es abgebaut werden muss. Aufgrund des seitlichen Kontaktes von „HERC2“ mit „BRCA1“ als Ubiquitinierung wird „BRCA1“ abgebaut. Das Zink=“30“E für eine Zinkfinger-Domäne ist nicht lesbar. Mit der Startzahl „88“ erfolgt eine Einbindung in das unlesbare Zink von „p30“ als 7“88“7=QS=30 (Zink). „BRCA1“ gewinnt die beidseitige Ziffer „7“, weil es auf jeder Seite einen speziellen Komplex bildet. Eine integrierte Zink-Domäne kann „BRCA1“ mittels Addition selbst darstellen, und zwar als 47=QS=11_ab Spalte 8/0/1=QS=9_auf Spalte 8/2=QS=10 mit Summe 11+9+10=30 für Zink=30E. Die Fortsetzung wäre links möglich, erfolgt aber weiter aufsteigend, weil links „BARDI“ bindet. Die Weiblichkeit „66“ ist zunächst nur indirekt über die Drüsen-Zahl „88“ /“20“ mit Milch=20(Symbol) adressiert, jedoch wird über den links angelagerten „BARD1-BRCA1-Komplex“ die „66“ zählbar, so dass es im Normalfall keine Missverständnisse gibt [BRCA1 - Breast cancer type 1 susceptibility protein - Homo sapiens (Human) | UniProtKB | UniProt]. Die E3-Ubiquitin-Protein-Ligase, Protein (Mensch) „BARD1“ (©©)=777AS bindet als heterodimerer Komplex an der „BRCA1-Startzahl“ |88|. In der Spalte „30“7/3[20] ist „Zink=30E zur Bindung lesbar und „Ubiquitin“ als 07=QS=“7“_Spalte 3/3=QS=“6“ mit 7_6 für Ubiquitin=76AS vorhanden. „BARD1“ (©©)=777AS bildet zugleich ein Heterodimer mit „CSTF1“ (@@) in der Spalte Z.38364#_[025]@2@[8981405]/#98@3@@2@9©7©©756©4©[5/]#_[94]@1@©3©©0©7©|88|©7@8©[8]/#_[899]©3©[20]|20|[816], und zwar „BARD1“ (©©) in Z.38366 als „7“_absteigend Spalte 4/8=QS=“12“_“756=QS=“18“_aufsteigend Spalte 7/7=QS=“14“ mit 7_Summe 12+18+14=“44“_“0“(aus Zink)_aufsteigend Spalte 3(aus Zink)/3 für „33“ mit „7“_Summe 44+0+33=“77“ mit 7_77 für „BARD1“ (©©)=777AS [BARD1 - BRCA1-associated RING domain protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CSTF1“ (@@)=431AS findet zur Spaltung keine Spalte 1/1, sondern eine unsichtbare „Gruppe“ „44“. Die Spalt-Gruppe „44“ wird als Kreuzung der Zahl 83“2“9=QS=“22“ mit der Spalte 2/2 für „22“ verstanden. „CSTF1“ aufsteigend in Z.38364 als Spalte 2/2=QS=“4“_ aufsteigend Spalte 3/1 für „31“ mit 4_31 für „CSTF1“ (@@)=431AS [CSTF1 - Cleavage stimulation factor subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Die möglichen freien Bindungsstellen zur Komplexbildung mit „BRCA1“ (||) sind bereits besetzt. Das Protein (Mensch) „RBBP8“ (%%)=897AS bildet mit „BRCA1“ in der Spalte Z.38365#_[329775]!6![45]/#_&1&[307]|88|%7%%8%[8]/#_&9&32&0|2&0&|%8%%1%[6] ein Heterodimer. „RBBP8“ (%%) bindet rechts an der „BRCA1-Startziffer“ „88“, und zwar in Z.38366 Spalte „78/81“ als „8“_auf 81=QS=“9“_ab “7“ mit 8_9_7 für „RBBP8“ (%%)=897AS. Die Ziffer „7“ gehört zur Spalte !6!/7 zwecks Expression von Ubiquitin=76AS. „RBBP8“ ist mit dem Co-Repressor „CTBP1“ komplexiert [RBBP8 - DNA endonuclease RBBP8 - Homo sapiens (Human) | UniProtKB | UniProt]. „RBBP8“ ist im Komplex mit „CTBP1“ nicht mehr an „BRCA1“ gebunden, weil das Protein (Mensch) „CTBP1“ (&&)=440AS durch die „BRCA1-Zahl“ „20“ zieht, um mit der Endziffer „0“ an „RBBP8“ zu binden. Die „CTBP1-Zahl“ „44“ resultiert aus der Bindung vom Coenzym „NAD“=C21H27N7O14P2=126+27+49+112+30=“344“E. „CTBP1“ (&&) aufsteigend in Z.38366 Spalte 1/9=QS=“10“_“32“_02=QS=“2“ mit Summe 10+32+2=“44“_“0“ für „CTBP1“ (&&)=440AS [CTBP1 - C-terminal-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Der BRCA1-Endbereich nähert sich einem lesbaren Zink. Das Zinkfinger-Protein, Protein (Mensch) “ZNF350“ (!!)=532AS interagiert und bindet an „BRCA1“ [BRCA1 – Wikipedia], und zwar in Z.38369 als 14=QS=5_aufsteigend 0_30(Zink)_0 für „30“_absteigend Spalte 7/4=QS=“2“ mit „5“_Summe 30+2=“32“ mit 5_32 für “ZNF350“ (!!)=532AS [ZNF350 - Zinc finger protein 350 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DHX9_ ATP-dependent RNA helicase A“ („“) =1270AS interagiert und bindet an „BRCA1“ aus der der klassischen ATP-Spalte mit Mangan als Ecke 7/4=QS=11=QS=„2“_41=QS=“5“ mit 2_5 für Mangan=25E in der Spalte, und zwar in Z.38368 als 12(Randzahl)_absteigend 816=QS=“15“_aufsteigend Spalte 7/4=QS=11_1_aufsteigend Spalte 4/3 für „43“ mit „12“ Summe 15+11+1+43=“70“ mit 12_70 für DHX9 („“)=1270AS [DHX9 - ATP-dependent RNA helicase A - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RELA“=551AS, das zu einem Komplex aus „7“ Proteinen gehört, interagiert und bindet an „BRCA1“ (||) in der Spalte Z.38368#_[717]“1“[2]/#_[4]“14“5“[9]/#_[30040]/#_[37438], und zwar in Z.38369 als 14=“5“_absteigend Spalte 1/5 für 51 mit 5_51 für „RELA“=551AS. Für die Aktin-Bindung kann vom lesbaren Aktin=374AS eine Verbindung gezählt werden, und zwar als „3“_absteigend 3004=QS=7_absteigend „4“ mit 3_7_4 für Aktin=374AS. Das in Aktin integrierte „Tropomyosin“=568AS ist enthalten, und zwar als 45 links für „54“_aufsteigend 74=QS=11=QS=“2“ mit Summe 54+2=“56“_absteigend Spalte 41/30=QS=“8“ mit 56_8 für „Tropomyosin“=568AS [RELA - Transcription factor p65 - Homo sapiens (Human) | UniProtKB | UniProt]. „BRCA1“ interagiert mit „CDK2“, ist das möglich? Ja, „CDK2“ besetzt die Zellzyklus-Spalte „29/30/32“, die an „BRCA1“ (||) bindet.
Das Protein (Mensch) „PALP2_FANCN“ (xx)=1186AS rekrutiert „RAD1“ (°°) und „BRCA2“. Aus der „RAD1“-Fundstelle resultiert, dass „PALB2“ linksseitig vorgelagert startet, um an „RAD1“ zu binden. „PALP2“ bindet innenseitigt im „BRCA1“--Winkel. „PALP2“ (xx)=1186AS liegt in der Spalte Z.38365#_[109]x83x[29]x77x56x[45]/#_[109]x4x[130]x7x|88|[788]/#_[108]x9x9x32x0x|20|[816]/#_108°5°°7°°3°|34|71|[712]/#_108°15°°3°|5|[141459]/#_07733|7|[030040], und zwar in Z.38365 als 83=QS=“11“_links aufsteigend Spalte 4/9=QS=“13“_“9“_“32“_absteigend Spalte 7/0=QS=“7“_77=QS=“14“_56=QS=“11“ mit „11“_Summe 13+9+32+7+14+11=“86“ mit 11_86 für „PALP2“ (xx)=1186AS [PALB2 - Partner and localizer of BRCA2 - Homo sapiens (Human) | UniProtKB | UniProt]. „PALP2“ könnte die Endsumme 7+14+11=„32“ alternativ als Ring über Spalte 2/3 für „32“ zählen, um den „BARD1-BRCA1-Komplex“ nicht zu stören. „PALB2“ zieht aber durch „BARD1“, weil der Verlust ein analoges Defizit verursacht [PALB2- oder BARD1-Verlust führt zu homologem Rekombinationsmangel und PARP-Inhibitor-Sensitivität bei Prostatakrebs - PubMed (nih.gov); K. Dillon u.a.; Jun 2022; DOI: 10.1038/S41698-022-00291-7].
„PALB2“ bindet die „DNA“ und interagiert mit „RAD51“. Das Protein (Mensch) „RAD51AP1“=352AS wirkt kooperativ mit, indem es „RAD51“ verstärkt. Alle Ziffern sind bereits besetzt, so dass sich „RAD51AP1“ auf die RAD1-Startziffer „3“ legt und absteigend die „PALB2“-Position „3202“ mit „3“_Summe 3+2+0=“5“_“2“ mit 35_2 für „RAD51AP1“=352AS besetzt, um mit „DCM1“ zu interagieren [RAD51AP1 - RAD51-associated protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RAD54L“=747AS mit ATP- und Zinkbindung kann ebenfalls nur zeitlich versetzt als Zusatz ermittelt werden [Frontiers | RAD51AP1 and RAD54L Can Underpin Two Distinct RAD51-Dependent Routes of DNA Damage Repair via Homologous Recombination (frontiersin.org); C. Wiese u.a.; Mai 2022; https://doi.org/10.3389/fcell.2022.866601]. „RAD54L“ dissoziiert „RAD51“ von Nukleoproteinfilamenten, so dass „RAD51“ besetzt wird. „RAD54L“ („“) liegt mit RAD51“ (°°) in der Spalte Z.38368#_“8°5°““°7°°“°3°[…]/#_“8°1°““°5°“°3°“[…]/#_“77““3“[37…] , und zwar in Z.38368 als „7“_schleifenförmig 85=QS=“13“_aufsteigend 81=QS=“9“_aufsteigend 77=QS=“14“_absteigend 5/3=QS=“8“_“3“ mit „7“_Summe 13+9+14+8+3=“47“ mit 7_47 für RAD54L=747AS. Die Schleife folgt dem unlesbaren „Zink“ als Spalte 8/7=QS=“15“_“7“_Spalte 5/3=“8“ mit Summe 15+7+8=Zink=30E [RAD54L - DNA repair and recombination protein RAD54-like - Homo sapiens (Human) | UniProtKB | UniProt].
„PALB2“ dient im „BRCA1-PALB2-BRCA2-Komplex“ als molekulares Gerüst. Das Protein (Mensch) „BRCA2“ (;;) =3418AS (Monomer) kann nicht am rechten Rand beginnen, weil zusätzlich zur Komplexbildung „RAD51“ gebunden wird. „BRCA2“ bindet an der „PALB2-Startzahl“ und zieht eine große Schleife von links nach rechts bis zur Bindung nahe der „BRCA1-Startzahl“. „BRCA2“ wird als „351_8“ zerlegt, wobei die Endziffer „8“ als Mutation auf kurzem Weg zum rechten Rand durchbrechen könnte. Diese Zerlegung ist ein zufälliger Glücksfall, weil es trotz des ausgedehnten Zählweges möglich ist, eine notwendige dimere Spiegelung an der „BRCA2-Endziffer „8“ zu ermöglichen, die als „BRCA2“ (zz) (Dimer) bezeichnet wird. „BRCA2“(;;) =3418AS (Monomer) liegt mit „BRCA1“ (||), PALB2 (xx) und RAD51 (°°) in der Spalte Z.38364#_;025;[28981405]/#_;9;x83x[29]x77x56x[45]/#_;9;x4x[130]x7x|88|[788]/#_;8;x9x9x32x0x|20|;8;[16]/#_;8;°5°°7°°3°|34|71|;7;[12]/#_;8;°15°°3°|5|;14;1;;4;[59]/#_;7;;73;;3;|7|;0;[30040]/#_[731];3;;91;[37438], und zwar in Z.38364 mit Bindung an der „PALB2-Startzahl“ als 025=QS=“7“_seitlich an „PALB2“ als Spalte 9/9 für „99“_seitlich „PALB2/RAD51“ als Spalte 8/8 für „88“_seitlich „RAD51“ als Spalte 8/7 für „87“ mit Randsumme=7+99+88+87=“281“_in Z.38370 Schleife um „BRCA1“ als 73=QS=“10“_aufsteigend Spalte 3/3 für „33“_91=QS=“10“ mit Schleifen-Summe 281+10+33+10=“334“. Mutation: Restzahl „17_8(Endzahl)“ bis zum rechten Rand in Z.38381 über „3743“8“ als 3743=QS=17_8. Normal mit Bindung an „BRCA1“, und zwar absteigend in Z.38369 in der Spalte „14“1“/“0“[30] mit „334“_Summe 0+14+1=“15“ absteigend über Spalte „8/7/4“ als 7/4=QS=11=QS=“2“ mit Summe 334+15+2=“351“_“8“ für „BRCA2“ (;;) =3418AS (Monomer) [BRCA2 - Breast cancer type 2 susceptibility protein - Homo sapiens (Human) | UniProtKB | UniProt]. „BRCA2“ bildet bei Abwesenheit der DNA ein stäbchenförmiges Homodimer [„Der Brustkrebs-Tumorsuppressor BRCA2 fördert das spezifische Targeting von RAD51 auf einzelsträngige DNA - PMC (nih.gov)“; S. West u.a.; Aug 2010; DOI: 10.1038/NSMB.1905]. „BRCA2“ (;;) (Monomer) bindet zur Interaktion seitlich an „p53“. Weil in Abwesenheit der „DNA“ kein Zellzyklus aktiv ist, kann sich das dimere „BRCA2“ (zz) auf die „p53-Position“ legen. „PALB2“, das mit dem „BRCA2-Monomer“ komplexiert ist, wird lediglich seitlich tangiert, aber nicht besetzt. Die monomere Endziffer ;8; ist mit der Spalte „8/1“ zur Motivation einer Zahl „18“ für 34“18“AS zur dimeren Spiegelung vorhanden, die über eine End-Schleife korrekt wertgleich 9+9=“18“ angeschlossen wird. Das dimere „BRCA2“ (zz) =3418AS liegt in der Spalte Z.38365#_[6]z45z/#_[7]z8zz8z/#_;8;z1zz6z/#_;7;z1z[2]/#_;4;z5z[9]/#_[0]z4z[0], und zwar absteigend in Z.38370 als Spalte 5/4=QS=“9“_absteigend Spalte 1/1 für „11“_absteigend Spalte 8/6=QS=“14“ mit Summe 9+11+14=“34“_45=QS=“9“_aufsteigend Spalte 8/1=QS=“9“ mit „34“_Summe 9+9=“18“ mit 34_18 für „BRCA2“ (zz) =3418AS (Homodimer). Das Homodimer enthält 2 nadelförmige Startbereiche, woraus die Stäbchenform resultiert.
„RAD51“: Das Protein (Mensch) „RAD51“ (°°)=339AS (Monomer) wird mit einem männlichen Bezug (33) an der linken Seite von „BRCA1“ ringförmig rekrutiert, ist aber gleichzeitig in der Spalte Z.38368#_°5°°7°3°|3471|[712]/#_°15°°3°^51^[41459]/#_[73]^37^[030040] an „BRCA2“ gebunden, und zwar aufsteigend in Z.38368 Spalte 3/3 für „33“_15=QS=“6“_absteigend „5“ mit „33“_Summe 6+5=11=QS=“2“_“7“ mit „33“_Summe 2+7=“9“ mit 33_9 für RAD51 (°°)=339AS [RAD51 - DNA repair protein RAD51 homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Es können bis zu „6“ RAD51-Moleküle pro DNA-Windung binden. Es handelt sich dann um die Bindungssumme= „6“ Moleküle*339AS=2034AS, die seitlich in der Spalte „20/34“ lesbar sind, weil ohne Interpretation keine Wachstumsform gebildet wird [RAD51 - DocCheck Flexikon]. Die Ursache der Besonderheit resultiert aus der Erzeugung einer „ATP-Bindestelle“ für ATP=260E. Zwar motiviert die RAD1-Zahl „57_3“ zur Bildung der Summe 57+3=“60“, aber die Zählrichtung ist falsch, was eine externe Mitwirkung der „6-Molekül-Spalte“ erfordert. „ATP“ („“) liegt in der Spalte Z.38367#_[99]“3““2“[0…]/#_[°5°]°“7“°°“3“°“3“[4…]/#_[°1°]°“5“°°“3“°[51…] als absteigend in Spalte 2/3=QS=“5“_aufsteigend Spalte 3/3=QS=“6“ mit Summe 5+6=11=QS=“2“_“3“_absteigend Spalte 7/5 für „57“ mit „2“_Summe 3+57=“60“ mit 2_60 für ATP („“)=260E. „RAD51“ (°°) kann sich gespiegelt als „RAD51-Homodimer“ (&&) verdoppeln [BRCA2-Chaperone RAD51 an einzelne Moleküle von RPA-beschichteter ssDNA - PMC (nih.gov); J.Bell u.a.; Apr 2023; DOI: 10.1073/PNAS.2221971120]. Das „RAD51-Dimer“ (&&) wird über die „6-Molekül-Spalte“ in der Spalte Z.38366#_[41]&3&&0&[7…]/#_[99]&3&&2&&0&[…]/#_°5°°7°°3°&3&&4&[…]/#_°15°°3°[51…] positioniert, und zwar absteigend in Z.38366 als Spalte 3/3 für „33“_áufsteigend Spalte 0/2=QS=“2“_aufsteigend Spalte 0/4=QS=“4“_“3“ mit „33“_Summe 2+4+3=“9“ mit 33_9 für „RAD51“ (&&)=339AS (Homodimer). „RAD51“ interagiert nicht mit „BRCA1“, so die dimere Ausdehnung nach oben-rechts möglich ist, und die monomere Bindung links an „BRCA2“ ungestört ist. Ungünstig ist, dass das „RAD51-Dimer“ auf der „PALB2-Position“ liegt. Diese Interaktion ist aber nur eine Stimulation: „PALB2 bindet die Einzelstrang-DNA und interagiert direkt mit der Rekombinase RAD51, um die Stranginvasion zu stimulieren“ [PALB2 – Wikipedia].
Rekombinasen verknüpfen 2 DNA-Stränge neu, wobei „RAD51“ den Austausch einer beschädigten DNA-Sequenz katalysiert. „RAD51“ ist „DMC1“ zu 50% ähnlich, beide sind Homologe des Strangaustauschprotein „RecA“[DMC1 (Gen) – Wikipedia]. Das Protein (Mensch) „DMC1“=340AS wird im Unterschied zu „RAD1“ nicht in der Mitose, sondern nur in der Meiose exprimiert. Das ringförmig gestapelte „DMC1-Homooktamer“ liegt seitlich an „RAD51“ (°°) in der Spalte Z.38367#_[99320]!2!!0![816]#_°5°°7°°3°!34!7!!1![712]/#_°15°°3°{5}(14)(1)[459]/#_[7]{3}{3}{7}(0)(3)(0)[040]/#_[3]{1}[3](91)[37438]. Dieses „Octamer“ wird als Stapel 2-fach „4*340AS“=1360AS analog zu einem Homodimer abgebildet. Im Ergebnis sind die notwendigen Meiose-Geschlechtsmerkmale „33/66“ vorhanden. Das „DMC1-Tetramer“ {}=4*340AS=1360AS absteigend in Z.38370 als Spalte 3/1 für „13“_“3“_absteigend Spalte 5/7 für „57“ mit „13“_Summe 3+57=“60“ mit 13_60 für „DMC1-Tetramer“ {}=4*340AS=1360AS. Die homooctamere Dopplung, das „DMC1-Tetramer“ ()=4*340AS=1360AS aufsteigend in Z.38369 als Spalte 1/0 für 10_3 mit Summe 10+3=“13“_absteigend 14 links für „41“_aufsteigend „0“_aufsteigend 91 links für „19“ mit „13“_Summe 41+0+19=“60“ mit 13_60 „DMC1-Tetramer“ ()=4*340AS=1360AS erweitert zum „Homooctamer“. Das Symbol „männlich=33“ ist lesbar. Weiblich=66 (Symbol) liegt recht in der Spalte „5“141“/“7“03“[0] als 141=QS=“6“_aufsteigend Spalte 5/7 für „57“_“0“_“3“ mit Summe 6+57+0+3=66 (weiblich). Das einzelne DMC1-Molekül „DMC“ (!!)=340AS ist vorgelagert und nur zur Motivation in [2]0/34 lesbar, weil die „0“(Null) zur Interaktion mit „RAD51AP1“ alternativ erweitert wird, und zwar in der Spalte [20]!2!!0!/!34!7!!1! als 34_absteigend Spalte 2/7=QS=“9“_aufsteigend Spalte 0/1=QS=“1“ mit „34“_Summe 9+1=10 für „0“ mit 34_0 für "DMC1“ (!!)=340AS [DMC1 - Meiotic recombination protein DMC1/LIM15 homolog - Homo sapiens (Human) | UniProtKB | UniProt].
Das RAD51-Gen kodiert außer für das Protein „RAD51“ ergänzend für „5“ Paraloge mit ähnlicher Funktion (XRCC2, XRCC3, Rad51B, Rad51C und Rad51D). „Wechselwirkungen mit den Rad51-Paralogen Rad51C und XRCC3 in menschlichen Zellen - PMC (nih.gov); C. Wiese u.a.; Feb 2002; doi: 10.1093/nar/30.4.1001“]. „XRCC3“ gehört folglich nicht zum tetrameren Komplex „RAD51B, RAD51C, RAD51D und XRCC2 (BCDX2)“ [„Strukturelle Einblicke in die Funktion des BCDX2-Komplexes in der homologen Rekombination | Natur (nature.com); S. Olsen, Jun 2023; https://doi.org/10.1038/s41586-023-06219-w].
„BCDX2“-Komplex (RAD51B:RAD51C:RAD51D:XRCC2): Das Protein (Mensch) „RAD51C_FANCO“ {}=376AS steigt von extern in die „RAD51“-Spalte (!!) in der Spalte Z.38368#_[8!573!34…]#_[8]“!{15}“[3!51…]/#_[7]“{73}“[„37“0…]/#_[7313“91“…] ein, und verzichtet damit scheinbar auf „2“ gleichwertige Ergebnisse innerhalb dieser Spalte, wodurch sich ein Komplex-Partner an der Spalten-Besetzung beteiligen kann. Dieses gilt aber nur für die Position im tetrameren „BCDX2“-Komplex [Rad51B (B), Rad51C (C), Rad51D (D), XRCC2 (X2)]. „RAD51C“ kann sich alternativ in die „RAD51-Spalte“ (!!) zurückdrehen, um mit dem 5. Paralog „XRCC3“ alternativ den CX-Komplex „Rad51C-XRCC3“ mit dessen ATP zu bilden [Die Rad51-Paralogkomplexe BCDX2 und CX3 wirken in verschiedenen Stadien des BRCA1-BRCA2-abhängigen homologen Rekombinationswegs - PubMed (nih.gov); S. Powell u.a. ; Jan 2013; doi: 10.1128/MCB.00465-12].
Im tetrameren „BCDX2“-Komplex gilt „RAD51C“ {} in Z.38370 als 73 links für „37“_absteigend 15=QS=“6“ mit 37_6 für RAD51C {}=376AS. „Der BCDX2-Subkomplex RAD51B:RAD51C weist eine einzelsträngige DNA-abhängige ATPase-Aktivität auf“. Zur Findung von „ATP“ wird die „RAD51B“-Position mit verwendet. ATP („“) als 15=QS=“6“_aufsteigend 7337=QS=“20“ mit Summe 6+20=“26“_aufsteigend 91=QS=10 für „0“ mit 26_0 für ATP=260E. [RAD51C - DNA repair protein RAD51 homolog 3 - Homo sapiens (Human) | UniProtKB | UniProt]. „RAD51C“ wechselt in den verschiedenen Stadien der DNA-Reparatur den Komplexpartner. Der BCDX2-Komplex erleichtert den Zusammenbau des RAD51-Nukleoproteinfilaments. Der CX3-Komplex ist der RAD51-Rekrutierung an Schadensstellen nachgelagert. In einer Brustkrebszelllinie wurde eine Chimäre Genen „RAD51C“ und „ATXN7“ festgestellt [RAD51C – Wikipedia]. „ATXN7“ besetzt die freie RAD51-Position zuzüglich „RAD51C“ in der Spalte „57“[3]/“1“5“[3]/“7“3“[3], und zwar absteigend in Spalte 5/3=QS=8_57 links für 75_aufsteigend 1/7 für „17“ mit „8“_Summe 75+17=“92“ mit 8_92 für „ATXN7“=892AS [ATXN7 - Ataxin-7 - Homo sapiens (Human) | UniProtKB | UniProt]. „ATXN7“-Mutation führt die Erweiterung der Zahl „73“ über „7337“0“ mit 7337=QS=20_0 zur Hyaluronsäure= C14H21O11N=84+21+88+7= 200E und damit zum Auge.
Das Protein (Mensch) „RAD51B“ ()=384AS bildet mit RAD51C {} ein Heterodimer, um sich das „ATP“-Energie zu teilen. Beide Proteine teilen sich am Start die Spiegelung „73|37“ Z.38368#_[8!573!“34“…]#_[8]!{15}[3!“5“1…]/#_[7]{73}(3)(„7“0)…]/#_[73](13)(„9“1)[…], und zwar RAD51B“ ()=384AS als „3“_“70“_aufsteigend 91=QS=“10“_13=QS=“4“ mit „3“_Summe 70+10+4=“84“ mit 3_84 für „RAD51B“ ()=384AS.
„Haltepunkt für die Translokation zu HMGA2-RAD51B“ [RAD51B - DNA repair protein RAD51 homolog 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „HMGA2“ („“)=109AS zieht als Spalte durch „RAD51B“ () bis seitlich an RAD51 (!!), um „CCNA2“ zu erreichen, das mit CDK1/CDK2 in der Zellzyklus-Spalte interagiert, und zwar absteigend in Spalte 7/9 für „97“_absteigend Spalte 3/5=QS=8_4 mit Summe 97+8+4=“109“AS [HMGA2 - High mobility group protein HMGI-C - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RAD51D“ (||)=328AS bildet den BCDX2-Subkomplex „XRCC2:RAD51D“. Interagiert mit dem Protein des Bloom-Syndroms „BLM“ sowie mit „SWSAP1“ und „ZSWIM7“. Die rechte Begrenzung erfolgt von „BLM“=1417AS in Z.38368 über „34717“ als 347=QS=“14“_“17“ für „BLM“=1417AS [BLM - RecQ-like DNA helicase BLM - Homo sapiens (Human) | UniProtKB | UniProt]. „ZSWIM7“=140AS folgt aufsteigend mit einer Zinkbindung in Z.38369 als 14_aufsteigend 30(Zink)=QS=“3“_aufsteigend „7“ mit „14“_Summe 3+7=10 für „0“ mit 14_0 für „ZSWIM7“=140AS [ZSWIM7 - Zinc finger SWIM domain-containing protein 7 - Homo sapiens (Human) | UniProtKB | UniProt]. RAD51D“ (||) startet oder endet in einem Spalt, der vom Subkomplex „RAD51C:Rad51B“ sowie von „BLM“ und „ZSWIM7“ begrenzt ist. Die andere Grenze bildet „SWSAP1“=229AS in Z.38365 über „98329“ als 9832=QS=“22“_“9“ für „SWSAP1“=229AS [SWSAP1 - ATPase SWSAP1 - Homo sapiens (Human) | UniProtKB | UniProt].
„RAD51D“ (||)=328AS liegt in der Spalte Z.38366#_[41]|3||0|[788788]/#_|99||3||2|[020816]/#_|57||3|[3471712]/#_{15}|35|[141459]/#_{73}(3)(70)[30040]/#_[3](13)(91)[37438], und zwar in Z.38369 als 35=QS=“8“_absteigend „3“ mit Summe 8+3=11=QS=“2“_57=QS=“12“_absteigend 99=QS=“18“ mit Summe 2+12+18=“32“_absteigend Spalte 3/3=QS=“6“_aufsteigend Spalte 0/2=QS=“2“ mit „32“_Summe 6+2=“8“ mit 32_8 für „RAD51D“ (||)=328AS [RAD51D - DNA repair protein RAD51 homolog 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Komplexpartner, das Protein (Mensch) „XRCC2“=280AS passt sich der Kontur an, und zwar in Z.38367 als 932=QS=“14“_aufsteigend 347=QS=“14“ mit Summe 14+14=“28“_“1“_absteigend 020=QS=“2“_absteigend 07=QS=“7“ mit 28_Summe 1+2+7=10 für „0“ mit 28_0 für XRCC2“=280AS. Die Reaktion auf Gamma-Strahlung ist ein Zusammenhang von Cobalt=27E und Nickel=28E [Gammastrahlung – Wikipedia]. Die Zahl „27“ ist in der Ecke doppelt enthalten, in der Spalte 8/2 für „28“ liegt die Ziffer „8“ extern im Protein „p53“, dessen Zahl „78“ im speziellen Zink „7887“=QS=30 getrennt wird [XRCC2 - DNA repair protein XRCC2 - Homo sapiens (Human) | UniProtKB | UniProt].
„CX“-Komplex (Rad51C-XRCC3“): Das Protein (Mensch) „RAD51C“ (§§)=376AS verändert bei unveränderter Grundposition seine Ausrichtung beim Wechsel vom tetrameren „BCDX2“-Komplex zum CX-Komplex „RAD51C:XRCC3“ als Heterodimer. Das modifizierte „RAD51C“ (§§) liegt gespiegelt zu „RAD51C“ {} in der Spalte Z.38368#_[8!573!34…]#_[8]“!{15}“[3!51…]/#_[7]“{73}“[„37“0…]/#_[7313“91“…], und zwar in Z.38368 als 73 links für 37_aufsteigend 15=QS=“6“ mit 37_6 für „RAD51C“ (§§)=376AS [RAD51C - DNA repair protein RAD51 homolog 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Komplexpartner, das Protein (Mensch) „XRCC3“ (**)=346AS startet in Z.38368 als „34“ (aus XRCC2)_aufsteigend 141=QS=“6“ mit 34_6 für „XRCC3“ ($$)=346AS. Die Zahl „46“ - gespiegelt – „64“ ergibt einen Bezug zum Telomerkreis. „Der CX3-Komplex assoziiert mit der Holliday-Junction-Resolvase-Aktivität“ [XRCC3 – Wikipedia]. Ein Holliday-Übergang ist eine verzweigte Nukleinsäurestruktur, die vier doppelsträngige Arme enthält, die miteinander verbunden sind [Holliday-Kreuzung – Wikipedia]. Es handelt sich dabei um 2 diagonal gespiegelte rechte Winkel, die nochmals gekreuzt werden. „XRCC3“ (**) besetzt den Winkel „4/1_14“. Im Zeilenlauf ist eine Vertikale mit einem Nullpunkt als Spalte „4/1/0/4/1“ vorhanden, an dessen Ende aufsteigend die Zahl „41“ für den 2.Winkel angeschlossen ist. Diese Dopplung wird von „3/37 /0/ 3/37“ gekreuzt [XRCC3 - DNA repair protein XRCC3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Holliday-Junction-Erkennungsprotein, Protein (Mensch) „HJURP“ („“) =748AS zieht mit einer Schleife durch „XRCC3“ von der Startziffer „4“ bis zur Endziffer „1“, womit der Arm 4/1_41 erkannt wird. „HJURP“=748AS liegt mit „XRCC3“ (**) in der Spalte Z.38368#_*3*“*4*“[7]“1“[…]/#_[5]*1*4*“1“*[…]/#_[7]“0“3““0“[…]/#_[91]“3““7“[…]/#_[1]4[63…], und zwar aufsteigend in Z.38368 Spalte 4/1 für „41“_absteigend „0“(Zentrum)_Spalte 3/3 für „33“ mit Summe 41+0+33=“74“_absteigend Spalte 1/0/7=QS=“8“ mit 74_8 für „HJURP“=748AS [HJURP - Holliday junction recognition protein - Homo sapiens (Human) | UniProtKB | UniProt]._dat_14.06.2024
„Wird die DNA durch einen Doppelstrangbruch beschädigt, dann wird der Bereich um den Bruch beschnitten. Es entstehen ca. 1.000 bp lange, einzelsträngige 3'-Überhänge.“ Diese 1000 Basenpaare (bp) sind den „6“ „RAD1“-Molekülen in einer Spalte vorgelagert, und zwar in der Spalte Z. 38364#_[528]“9“/#_[329]“7“/#_[1]“30“7“/#_[9]“3“[20] aufsteigend als Spalte „9/7/7 für „977“_links „0“_Spalte 3/3 für „33“ mit Schnittbereich Summe 977+0+33=“1000“ Basenpaare. Diese „1000er-bp-Strecke“ wird vom Protein (Mensch) „Replication Protein A [RPA/Single-Stranded DNA-Binding Protein/ einzelsträngige DNA (ssDNA)-bindende Protein] geschützt, das ein Heterotrimer (RPA1/RPA2/RPA3) bildet.
Das Protein (Mensch) „RPA1_Replikationsprotein A1“ {}=616AS liegt mit „RPA2“ () und „RPA3“ (||) in der Spalte Z.38365/#_[1]§0§9§8§{3}{2}[97…]/#_[10]§9§4§{1}{3}[07…]/#_[108]|99|{3}(2)[0…]/#_[108]|5|{7}{3}(3)[4…]/#_[108]|1|(53)(5)[1…]/#_[7]|7|[337030040], und zwar in Z.38365 als „2“_aufsteigend Spalte 3/1=QS=“4“ mit Summe 2+4=“6“_aufsteigend 3/3/3=QS=“9“_links “7“ mit 6_Summe 9+7=“16“ mit 6_16 für „RPA1“ {}=616AS [RPA1 - Replication protein A 70 kDa DNA-binding subunit - Homo sapiens (Human) | UniProtKB | UniProt]. „RPA1“ interagiert u.a. mit „p53“, dass rechts über eine Ziffer „0“ binden kann [Replikationsprotein A1 – Wikipedia].
„RPA1“ interagiert mit dem Protein (Mensch) „PrimPOL“ („“)=560AS, das eine Zink-Ionen-Bindung und den Cofaktor Mangan/Magnesium besitzt. Der Name „PrimPOL“ kombiniert Primase- und Polymerase-Aktivitäten [PrimPol – Wikipedia]. „PrimPOL“ wird bei DNA-Schäden an der blockierten Replikationsgabeln rekrutiert [„hPrimpol1/CCDC111 ist eine humane DNA-Primase-Polymerase, die für die Aufrechterhaltung der Genomintegrität benötigt wird - PMC (nih.gov)“; L. Wan u.a; Dez. 2013; doi: 10.1038/embor.2013.159]. Der Cofaktor „Mn/Mg“ ist in Z.38364 als „1025“ für „Mangan“=25E lesbar. „Magnesium“ reagiert schwächer, weil eine Addition 10+2=Mg=12E erfolgt. „RPA1“ hat das lesbare Zink „30“ beseitigt, weil es die Ziffer „3“ besetzt. „PrimPOL“ zählt sich das Zink links von „RPA1“ über die Spalte 98/94=QS=“30“ für Zink=30E selbst. „PrimPOL“ kann links von „RPA1“ binden, weil „RPA3“ dort erst ansetzt. „PrimPOL“ („“)=560AS liegt in der Spalte Z.38363#_[161]“1““0““67“2“[…]/#_[161]“1““0“2““5““2“[…]/#_[161]“0““98{32}[…]/#_[161]“0““9““4“{13}[…], und zwar in Z.38364 als „5“_absteigend Spalte 2/2=QS=“4“_67=QS=“13“_aufsteigend „2“ (Drehung um die Startzahl „5“ nach links beendet) mit „5“_Summe 4+13+2=“19“_absteigend Spalte 0/0=QS=“0“_aufsteigend Spalte 1/1 für „11“(Zählgröße)_aufsteigend Spalte 0/0=QS=“0“ mit „5“_Summe 19+0+11+0=“30“_absteigend Spalte 9/9=QS=“18“_aufsteigend Spalte 8/4=QS=“12“ mit „5“_Summe 30+18+12=“60“ mit 5_60 für „PrimPOL“ („“)=560AS. Die Bindung an der RPA1-Startecke, an der Ziffer {3}, in der Spalte 25/8{3} am Cofaktor Mangan=25 enthält die Zahl „8“_QS2+5=“7“ mit 8_7 für „Diphosphate (CHEBI:33019)“=HO7P2 =1+56+30=87E im Katalyseergebnis [PRIMPOL - DNA-directed primase/polymerase protein - Homo sapiens (Human) | UniProtKB | UniProt]. „PrimPOL“ wird als Reaktion auf DNA-Schäden dephosphoryliert [„PrimPol: Ein Durchbruch bei DNA-Replikationsenzymen und ein potenzielles neues Ziel für die Krebstherapie - PMC (nih.gov)“; C. Modero-Conte u.a.; Feb 2022; DOI: 10.3390/BIOM12020248]. Im Normalfall wird „PrimPol“ verhindert, in dem es durch die Serin/Threonin-Protein-Kinase, das Protein (Mensch) „PLK1“=603AS phosphoryliert wird. Die bisherige Fundstelle für „PLK1“ ist weit entfernt, und muss zur Interaktion mit „PrimPOL“ neu an der Zellzyklus-Spalte „30/32“ positioniert werden, um „ATP“ zu generieren. „PLK1“ überlagert folglich den „RPA1“-Startbereich in Z.38365 der Spalte „3“29“/“1“30“/[932]“, und zwar als „1“_“30“_absteigend „29“ mit Summe 1+30+29=“60“_“3“ für „PLK1“=603AS. Eine Tubulin-Bindung ist statt 451AS nur mit dem allgemeinen Tubulin=450AS als Spalte 3/1=“4“_Spalte 2/3=“5“_“0“ mit 4_5_0 für Tubulin=450AS vorhanden. Das „Magnesium“ zur Mg-Bindung fehlt und muss seitlich aus der „PrimPOL-Spalte“ 8/4=QS=12 für Mg=12 gewonnen werden. Bei dieser Aktion wird die PLK1-Endziffer „3“ (Eckziffer in RPA1) mit der Mg-Zahl „12“ zu 12+3=“15“ für Phosphor=15E addiert, so dass „PrimPOL“ durch P-Entnahme dephosphoryliert und somit aktiviert wird. Die ATP-Erweiterung zur Zellzyklus-Spalte erfolgt für die Kinase durch das Serin=56E als 32=QS=“5“_Spalte 3/3=“6“ für Serin=56E [PLK1 - Serine/threonine-protein kinase PLK1 - Homo sapiens (Human) | UniProtKB | UniProt].
„RPA1“ interagiert mit dem DNA-Reparaturprotein, Protein (Mensch) „XPA“=273AS, das eine Zink-Bindung besitzt. Vom lesbaren Zink= 3“0“E wird nur die Ziffer „0“(Null) durchlaufen, so dass Zink fehlt. Das Problem wird über eine Schleife im Zählweg gelöst, die über Kreuz ein Diagonale „9-9 (seitlich)“ und eine unverbundene Gegendiagonale „8 -7“ diagonal ideel verbindet, so dass in der Folge „8-7“_aufsteigend „78“ mit Summe 8+7+7+8=Zink=30E zählbar ist. Vergleichsweise gilt in „p53“ „7887“=QS=30 als unlesbare Zink-Bindung. „XPA“ („“)=273AS liegt mit „XAB2“ (~~) in der Spalte Z.38364#_“2“5“28“9“[8]~1~~4~[05]/#_[832]“9“7“[7]~5~[645]/#_[413]“0““78“~8~[788], und zwar in Z.38364 als „2“_“5“_“28“_aufsteigend Spalte 9/7=“16“_aufsteigend 9/0=QS=“9“_78=QS=“15“ mit „2“ Summe 5+28+16+9+15=73 mit 2_73 für „XPA“ („“)=273AS. „XPA“ verbindet „XPD/ERCC2“ und „XPB/ERCC3“ [XPA - DNA repair protein complementing XP-A cells - Homo sapiens (Human) | UniProtKB | UniProt].
„ERCC3“=782AS zieht durch „XPA“ und „ERCC2“ bindet rechts an „XPA“. Die Randspalte „405/645“ enthält den ERCC2-Cofaktor „4Fe-4S-Cluster“ als „104/64“ und der Cofaktor „Magnesium“ wird aus „1“/56=QS=11=QS=“2“ für Mg=12E gebildet. „ERCC2“=760AS als „7“_“56“_absteigend „4“ mit „7“_Summe 56+4=“60“ für ERCC2“=760AS [ERCC2 - General transcription and DNA repair factor IIH helicase subunit XPD - Homo sapiens (Human) | UniProtKB | UniProt].
„XPA“ interagiert weiterhin mit „ERCC1“ und „XAB2“ [XPA – Wikipedia]. Das Protein (Mensch) „XAB2“ (~~)=855AS bindet an der XPA-Endziffer, und zwar in Z.38366 als „8“_ absteigend Spalte 1/5 für „51“_“4“ mit „8“_Summe 51+4=“55“ mit 8_55 für „XAB2“=855AS [XAB2 - Pre-mRNA-splicing factor SYF1 - Homo sapiens (Human) | UniProtKB | UniProt]. „ERCC8“=396AS bindet rechts an „XAB2“ mit der Ubiquitin-Spalte „6/7“ für 76AS in Z.38365 über Randspalte „6“45“/“7“88“/[8]“1“6“ absteigend 6/7=QS=“13“_45=QS=“9“_aufsteigend Spalte 8/8=QS=“16“_aufsteigend „1“ mit Summe 13+9+16+1=39_6 für „ERCC8“=396AS [ERCC8 - DNA excision repair protein ERCC-8 - Homo sapiens (Human) | UniProtKB | UniProt].
„ERCC1“ liegt in Z.38364 Spalte „81“[4]/“7“56“ als 56=QS=11=QS=“2“_aufsteigend 81=QS=“9“_aufsteigend „7“ mit 2_9_7 für ERCC1=297AS bilden [ERCC1 - DNA excision repair protein ERCC-1 - Homo sapiens (Human) | UniProtKB | UniProt]. „ERCC4“=916AS bildet einen Komplex mit „ERCC1“, und zwar „ERCC4“ in Z.38365 Randspalte „45/[8]8/[1]6/[1]2“, wobei der Anteil „16“ nicht aus „88“, sondern mit den Cofaktor „Mg“=12E als Vertikale zählt, und zwar als 45=QS=9_aufsteigend Spalte 8/6/2=QS=“16“ mit 9_16 für „ERCC4“=916AS [ERCC4 - DNA repair endonuclease XPF - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Tipin“=301AS bindet an der linken Seite von „RPA1“ in der Spalte Z.38364#_“1“[025…]/#_“0““98“[3…/#_“94“[1…], und zwar in Z.38366 als 94=QS=“13“ absteigend 98=QS=“17“ mit Summe 13+17=“30“_absteigend Spalte 1/0 =QS=“1“ mit 30_1 für „Tipin“=301AS [TIPIN - TIMELESS-interacting protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „BLM_Bloom-Syndrom-Protein“=1417AS wird beim „Bloom-Syndrom“ nicht exprimiert. „BLM“ gehört mit „TOP3A“, „RMI1“ und „RMI2“ zum BLM-Dissolvasom (BTR-Komplex), so dass „BLM“ seinen Platz nicht allein findet. [„Der Bloom-Syndrom-Komplex erkennt RPA-beschichtete einzelsträngige DNA, um blockierte Replikationsgabeln neu zu starten | Nature Communications“; A. Blackford u.a.; Jan 2021; https://doi.org/10.1038/s41467-020-20818-5]. Zwischen dem „BLM-Dissolvasom“ und „FANCM“/„FANCJ“ bestehen Proteinwechselwirkungen [Das BLM-Dissolvasom bei der DNA-Replikation und -Reparatur - PMC (nih.gov)]. Der Komplex bindet lang gezogen rechts an „RPA1“, so dass die „RPA2“-Position besetzt wird. „BLM“ wird erst bei Stillstand der Replikationsgabel rekrutiert, weil erst dadurch genügend RPA-Proteine zur Bindung vorhanden sind. „BLM“ („“) liegt in der Zeile Z.38368#_“347“17“[12], und zwar als 347=QS=14_17 für „BLM“=1417AS. „BLM“ zählt sich selbst, um das fehlende Zink zu kreieren, und zwar als „3“_47=QS=11=QS=2_17=QS=8 mit „3“_Summe 2+8=“10“ für „0“ mit 3_0 für Zink=30E. [BLM - RecQ-like DNA helicase BLM - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RMI1“=625AS folgt „RPA1“ und liegt rechts neben „RPA3“ in der Spalte Z.38369#_[1]“53““5““1““4“[1…]/#_[7]“33““7““0“[30…], und zwar in Z.38370 als 33=QS=“6“_absteigend 53=QS=“8“_aufsteigend Spalte 5/7=Q=“12“_absteigend Spalte 1/0=QS=1_4 mit „6“_ Summe 8+12+1+4=“25“ mit 6_25 für „RMI1“ („“) =625AS [RMI1 - RecQ-mediated genome instability protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TOP3A“=1001AS liegt in der Spalte Z.38365#_[2]“9“!7!!7![5645]/#_[3]“0“!7!“88“788/#_[3]2020816, und zwar aufsteigend in der Spalte 9/0/2 für „902“_ 02=QS=“2“_absteigend „88“_aufsteigend 081=QS=“9“ mit Summe 902+2+88+9=“1001“ für „TOP3A“=1001AS. Die Schleife liegt an der Spalte 020/1, die üblich als Cofaktor Mg=12E gilt. Darin kann rückwärts „Zink“ absteigend 0/1 für „10“_02 links für „20“ mit Summe 10+20=Zink=30E erkannt werden. Zusätzlich wird die das lesbare Zink=30E in der Ziffer „0“(Null) passiert [TOP3A - DNA topoisomerase 3-alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „RMI2“ (!!) =147AS ist in „TOP3A“ integriert, und zwar absteigend in Z.38365 Spalte 7/7=QS=“14“_“7“ für „RMI2“ (!!) =147AS [RMI2 - RecQ-mediated genome instability protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Fanconi-Anämie, Komplementationsgruppe M“, das Protein (Mensch) „FANCM“ {}=2048AS wird zur Reparatur an der Replikationsgabel rekrutiert [FANCM - Wikipedia]. In der Krebstherapie muss dieses verhindert werden. Das zeilenartige „BEM“ (!!) wird am rechten Rand nadelartig aufsteigend von „FANCM“ {} begrenzt, das durch die klassische ATP-Randspalte „12/59“ zieht. „ATP“ und Wasser „28“ stehen in der Katalyse auf der gleichen Seite als Eingangsgröße. In der Randspalte „2/9/0“/“8“ sind die Ziffern 2/9 bereits für ATP=260E verbraucht. Weil die Ziffer „2“ für Wasser „28“ als 2/9/0=QS=11=QS=“2“ neu bestimmt wird, „glaubt“ die Evolution, dass es sich um eine zusätzliche Ziffer „2“ handelt, d.h. die Ziffer „0“ ist ein zeitanhängiger Platzhalter für die Ziffer „2“. „FANCM“ {}=2048AS liegt in der Spalte Z.38368#_[73]!347!17!{12}/#_[5351414]{5}{9}/#_[3370300]{4}{0}/#_[1391374]{3}{8}, und zwar als aufsteigend in Z.38369 Spalte 9/0/8=QS=“17“_“3“ mit Summe 17+3=“20“_absteigend Spalte 5/4 für „45“_absteigend 12=QS=“3“ mit „20“_Summe 45+3=“48“ mit 20_48 für „FANCM“ {}=2048AS. [FANCM - Fanconi anemia group M protein - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Fanconi-Anämie, Komplementationsgruppe J“, das Protein (Mensch) „FANCJ_ BRIP1“ ()=1249AS umklammert zusammen mit „FANCM“ den Komplex „BLM-Dissolvasom (BTR-Komplex)“, weil „FANCJ“ weit vorgelagert mit „BRCA1“ interagiert und an „BRCA1“-Startzahl „88“ bindet. „FANCJ“ besitzt den „[4Fe-4S]-Cluster“ als Cofaktor, der kompakt eine „zweizahlige“, summierte „Eisen-Schwefel-Kette“ 4Fe=4*26E=“104“E /4S=4*16E=“64“E bildet, die als interne-externe-Mischung zur Wegfindung positioniert ist. „FANCJ“ () liegt in der Spalte Z.38364#_[2898](1)(@4@0)(5]/#_[2977](5)(@6@)(€4€5€)/#_[30788]€78€8€, und zwar in Z.38365 als „6“_ über die Grenze absteigend Spalte 1/5=QS=“6“ mit Summe 6+6=“12“_“40“_aufsteigend 45=QS=“9“ mit „12“_Summe 40+9=“49“ mit 12_49 für „FANJ_BRIP1“=1249AS. Der „4Fe-4S-Cluster“ liegt in der Randspalte @4@[05]/@6@€4€5€/€78€8€ mit „4Fe“ (€€)=104E als 78=QS=“15“_absteigend Spalte 5/8 für 85_4 mit Summe 15+85+4=“104“ für 104E und „4S“ (@@)=64E als Spalte 4/6 für 64E [BRIP1 - Fanconi anemia group J protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RPA2_Replikationsprotein A2“ ()=270AS liegt mit „RPA1“ {} und „RPA3“ (||) in der Spalte Z.38365/#_[1]§0§9§8§{3}{2}[97…]/#_[10]§9§4§{1}{3}[07…]/#_[108]|99|{3}(2)[0…]/#_[108]|5|{7}{3}(3)[4…]/#_[108]|1|(53)(5)[1…]/#_[7]|7|[337030040], und zwar „RPA2“ ()=270AS in Z.38367 als „2“ Spalte 3/5 für „35“_53 links für „35“ mit „2“_Summe 35+35=“70“ mit 2_70 für „RPA2“ ()=270AS [RPA2 - Replication protein A 32 kDa subunit - Homo sapiens (Human) | UniProtKB | UniProt]. „RPA2“ bindet an „KU70“ [Replikationsprotein A2 – Wikipedia]. Das Protein (Mensch) „KU70_XRCC6“=609AS bindet an der „RPA2“-Startziffer „2“ in der Spalte Z.38366#_[4]“1““3“07…/#_“9““9““3“(2)[0…], und zwar absteigend in Z.38366 Spalte 3/3=QS=“6“_aufsteigend Spalte 1/9=QS=10 für „0“_“9“ mit 6_0_9 für „KU70“=609AS [XRCC6 - X-ray repair cross-complementing protein 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MEN1“= 610AS nutzt die Zahl „10“ von „KU70“ ohne Null-Umformung und ohne Endziffer „9“ [MEN1 - Menin - Homo sapiens (Human) | UniProtKB | UniProt].
„RPA2“ interagiert mit der „DNA-abhängige Proteinkinase, katalytische Untereinheit (DNA-PKcs). Das Protein (Mensch) „DNA-PKcs_PRKDC“=4128AS ist die katalytische Untereinheit der Serin/Threonin-Proteinkinase „DNA-PK“. „DNA-PK“ ist ein Heterotrimer von „PRKDC“ und dem Ku-Dimer (bestehend aus XRCC6/Ku70 und XRCC5/Ku86). Die Bildung dieses Komplexes kann durch Interaktion mit „ILF3“ gefördert werden. Das Protein (Mensch) „XRCCR5_Ku86“ (??)=732AS bindet als Dimer an „Ku70“ („“) und umgeht RPA2 () zur rechten Seite in der Spalte Z.38365#_[8329775645]/#_[4]“1““3“?07?[88788]/#_“9“9““3“(2)?02??0?[816]/#_|5|{73}(3)?47??1?[712], und zwar in Z.38366 als 07=QS=“7“_aufsteigend 02=QS=“2“_aufsteigend Spalte 0/1=QS=“1“ mit „7“_Summe 2+1=“3“_47=QS=11=QS=“2“ mit 7_3_2 für „XRCC5“ (??)=732AS. Ubiquitin=76AS ist in der Spalte „02/47“ vorhanden [XRCC5 - X-ray repair cross-complementing protein 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „DNA-PKcs_PRKDC“ (µµ)=4128AS bindet am „Ku70-Ku86-Dimer“ in der Spalte Z.38364#_[2528981405]/#_[8]µ329µ7!7!µ!5645!/#_[4]“1““3“?07?µ887µ!88!/#_“9“9““3“(2)?02??0?µ81µ!6!/#_|5|{73}(3)?47??1?[712], und zwar in Z.38367 als 81 links für „18“_absteigend 887=QS=“23“ mit Summe 18+23=“41“_absteigend 77=QS=“14“_329=QS=“14“ mit „41“_Summe 14+14=“28“ mit 41_28 für PRKDC=(µµ)=4128AS. „ATP“ wird als Klammer links nur mit der Ziffer „3“ angeschlossen und vorgelagert über Z.38364 und „Threonin“=64E als Spalte „4/6“ verarbeitet zu „ADP“ mit Anschluss in der rechten Ziffer „7“. „ATP“ in Z.38364 als 8981=QS=“26“_“2“_aufsteigend Spalte 5/3=QS=“8“ mit „26“_Summe 2+8=10 für „0“ mit 26_0 für „ATP“=260E. „ADP“ in Z.38365 als 75=QS=“12“_absteigend Spalte 4/6=QS=“10“ mit Summe 12+10=“22“_“0“ für ADP=220E [PRKDC - DNA-dependent protein kinase catalytic subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IRF3“ (!!)=427AS besetzt den rechten Rand und bindet zur Stimulierung in die PRKDC-Eckziffer „7“ ein, die zu Phosphor-Spalte „7/8“ gehört. IRF3 (!!) in Z.38367 Randziffer „6“_absteigend 88=QS=16_absteigend 5645=QS=“20“ mit Summe 6+16+20=“42“_“7“ für IRF3 (!!)=427AS [IRF3 - Interferon regulatory factor 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „HERC2“ (**)=4843AS ubiquitiniert „RPA2“ () [„HERC2 reguliert RPA2 durch Vermittlung der ATR-induzierten Ser33-Phosphorylierung und des Ubiquitin-abhängigen Abbaus | Wissenschaftliche Berichte (nature.com)“; Y. Lai u.a.; Okt. 2019; https://doi.org/10.1038/s41598-019-50812-x]. Die „Herc2“-Endziffer „1“ bindet für Phosphor an der RPA2-Ziffer (53„5“). Für Ubiquitin=76AS als 3[4]=QS=“7“_aufsteigend 141=QS=“6“ für 76AS müsste eine externe Ziffer „4“ ergänzend vermittelt werden. „HERC2“ (**)=4843AS liegt in der Spalte Z.38365#_[97756]*4*[5]/#_[0788]*7**8*[8]/#_(2)[020]*8**1*[6]/#_(3)[471*7**1*2/#_(5)*141**4*[59], und zwar aufsteigend in Z.38365 Spalte 4/8 für „48“_aufsteigend Spalte 7/8=QS=“15“_Spalte 1/1 für „11“_aufsteigend Spalte 7/4=QS=11=QS=“2“_141=QS=“6“ mit „48“_Summe 15+11+2+6=“34“ mit 48_34 für „HERC2“ (**)=4843AS. Das „Zink“ für die Zink-Bindung wird von „HERC2“ selbst addiert. Dabei bleibt die mathematische Entkopplung durch die Schleife über „1/1“ unbeachtet, weil die mathematisch getrennte Spalte 7/8 physisch (wie optisch sichtbar) nach Meinung der Evolution für die Zink-Zählung „78“_“7/8“=QS=30 für Zink=30E korrekt ist [HERC2 - E3 ubiquitin-protein ligase HERC2 - Homo sapiens (Human) | UniProtKB | UniProt]. „HERC2“ interagiert mit „BRCA1“, um es abzubauen [HERC2 ist eine E3-Ligase, die auf BRCA1 abzielt - PubMed (nih.gov); W. Hu u.a.; Jul 2010; DOI: 10.1158/0008-5472.CAN-10-1304]._dat12.06.2024
Das Protein (Mensch) „RPA3_ Replikationsprotein A3“ (||)=121AS liegt mit „RPA1“ {} und „RPA2“ () in der Spalte Z.38365/#_[1]§0§9§8§{3}{2}[97…]/#_[10]§9§4§{1}{3}[07…]/#_[108]|99|{3}(2)[0…]/#_[108]|5|{7}{3}(3)[4…]/#_[108]|1|(53)(5)[1…]/#_[7]|7|[337030040], und zwar „RPA3“ (||)=121AS in Z.38370 als „7“ absteigend Spalte 5/1 für „15“_“99“ mit Summe 7+15+99=“121“ für „RPA3“ (||)=121AS. „Through recruitment of ATRIP activates the ATR kinase a master regulator of the DNA damage response“. Für die Rekrutierung RAD51 und RAD52 [RPA3 - Replication protein A 14 kDa subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Es wirken „2“ ATIP und „2“ ATR-Moleküle als Tetramer zusammen. Die beiden ATRIP-Moleküle sind von einer Spalte getrennt und binden jeweils „1“ ATR-Molekül. Weil eine gespiegelte Zählung als ATR-Homodimer möglich ist, ergibt sich eine tetramere Kette. „ATR“ kann alternativ zu „ATRIP (ATR-interagierendes Protein)“ bei metazoischen Zellen (vielzelliges Gewebe) durch „TOPBP1“ und „ETAA1“ aktiviert werden [„ATR activation is regulated by dimerization of ATR activating proteins - ScienceDirect“; D. Cortes u.a.; Jun 2021; https://doi.org/10.1016/j.jbc.2021.100455].
„ATR“ ist eng mit „ATM“ verbunden [ATR-Protein - DocCheck Flexikon]. Das Protein (Mensch) „ATM“ („“)=3056AS zieht durch die klassische ATP-Randspalte „12/59“ über die Spalte Z.38367#_“20“8“1“[6]/#_[717]“1““2“/#_ [414]“5““9“/#_[300]“4““0“, und zwar in Z.38367 als „20_8“ aufsteigend Spalte 1/1=QS=“2“ mit Summe 20+8+2=“30“_aufsteigend Spalte 5/4 für „54“_absteigend Spalte 2/9/0=QS=11=QS=“2“ mit „30“_Summe 54+2=“56“ mit 30_56 für „ATM“ („“)=3056AS. „Gehemmt durch „Wortmannin“ [ATM - Serine-protein kinase ATM - Homo sapiens (Human) | UniProtKB | UniProt]. „Wortmannin“=C23H24O8=138+24+64=226E liegt in der Randspalte „16/12“ und zieht hemmend durch die ATM-Spalte 1/1=QS=“2“_aufsteigend Spalte 6/2 für „26“ mit 2_26 für „Wortmannin“= 226E. Das Protein (Mensch) „ATR“ (°°)=2644AS (Monomer) positioniert sich für die Startzeile Z.38368 am unlesbaren Cofaktor „Mangan“=25E in 47/14 als 47=QS=11_14_Summe 11+14=“25“ mit für Mangan=25E. Die „Mangan-Bindung“ verhindert die Bindung am seitlichen „RPA2“. „ATR“ (°°) (Monomer) liegt in der Spalte Z.38368#_°47°[1712]/#_°14°°1°[459]/#_[0]°3°°0°[040]/#_!1!°3°74°^3^[8], und zwar in Z.38368 als 47=QS=“11“_aufsteigend „14“_aufsteigend Spalte 1/0 für „1“ mit Summe 11+14+1=“26“_aufsteigend Spalte 3/3 für „33“_74=QS=“11“ mit „26“_Summe 33+11=“44“ mit 26_44 für ATR“ (°°)=2644AS (Monomer). Erweitert zum Homodimer „ATR“ (^^)=2644AS (Homodimer) in der Spalte Z.38371#_[1391]°3°°74°^38^/#_[9]^4^1463^6^36^/#_[7]^44^[008616], und zwar in Z.38373 als 44=QS=“8“_absteigend „4“_1463=QS=“14“ mit Summe 8+4+14=“26“_“6“_“36“_absteigend 38=QS=11=QS=“2“ mit „26“_Summe 6+36+2=44 mit 26_44 für „ATR“ (^^)=2644AS. Die Endspalte „41“/“4“4 enthält 41=“5“_“4“ mit Summe 5+4=“9“, die mit der externen Spalte 9/7=QS=“16“ den Cofaktor=9+16=Mangan=25E ergibt [ATR - Serine/threonine-protein kinase ATR - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „ATRIP“ (**)=791AS aktiviert ATR“ (°°) in der Spalte Z.38370#_*7*[0…]/#_*91*[…], und zwar als „7“_aufsteigend „91“ für „ATRIP“ (**)=791AS. Das Double, ATRIP“ (;;)=791AS aktiviert ATR“ (^^) in der Spalte Z.38370#_|7|;3;[3]*7*[03…]/#_;31;[3]*91*[3…]/#_;89;^4^ 146^[…]/#_;47;^44^[00…], und zwar in Z.38370 als „3“_aufsteigend 31=QS=“4“ mit Summe 3+4=“7“_aufsteigend „89“_aufsteigend 47=QS=11=QS=“2“ mit „7“_Summe 89+2=“91“ mit 7_91 für ATRIP“ (;;)=791AS [ATRIP - ATR-interacting protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das „Doppel-ATRIP“ aktiviert das „ATR-Homodimer“. Weil aber das Heterodimer „ETAA1/TOPBP1“ auf der der „ATR-Position“ liegt, kann dieses Heterodimer nur „ATRIP“ vorab aktivieren und muss dann den Platz für „ATR“ räumen. Das Protein (Mensch) „ETAA1“=926AS enthält bereits die spätere ATR-Startzahl „26“. ETAA1 („“)=926AS liegt in der Spalte Z.38372#_;89;41463636/#_;47:“44“[008616], und zwar in Z.38372 als 63=QS=“9“_“4“_41 links für „14“_aufsteigend 44=QS=“8“ mit „9“_Summe 4+14+8=“26“ mit 9_26 für ETAA1 („“)=926AS [ETAA1 - Ewing's tumor-associated antigen 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Weil „ETAA1“ im Vergleich zum späteren „ATR (^^) verkürzt ist, wird zur Bindung am zweiten ATRIP-Molekül die Randerweiterung „TOPBP1“ benötigt. „TOPBP1“ bindet zur Aktivierung in die Endziffer *1* von ATRIP=79*“1“*AS ein. „Aktin“=374AS ist lesbar enthalten. Das Protein (Mensch) „TOPBP1“ („“)=1522AS liegt in der Spalte Z. 38370#_*7*“0“3004“[0]/#_*9“1“*“3“74“38“/#_(1463)“6““3““6“/#(4)[0086]“1““6“, und zwar in Z.38370 als 3004=QS=“7“_aufsteigend Spalte 0/1=QS=“1“_“3“_74=QS=11=QS=“2“_38=QS=11=QS=“2“ mit Summe 7+1+3+2+2=“15“_aufsteigend Randspalte 6/6=QS=“12“_absteigend 3/1=QS=“4“_“6“ mit „15“_Summe 12+4+6=“22“ mit 15_22 für „TOPBP1“ („“)=1522AS [TOPBP1 - DNA topoisomerase 2-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]._dat14.06.202
BiXnom-Master-Protein: Der „aktivierende Transkriptionsfaktor 2 (ATF2)“ besitzt mit „505“ Aminosäuren die markante Strukturgröße „505“, die aus anatomischen BiXnom-Episoden bekannt ist. „ATF2“ ist im Zusammenhang mit RNA‐bindenden Proteine „TIA1“ und „TIAR (TIAL1)“ relevant, die sich bei "Replikationsstress" anreichern. Es entwickeln sich u.a. Beziehungen zu den „4“ Histonen“ und „20“ Zentromer-Proteinen (CENP…). „ATP2“ gehört zu einer Gruppe von „8“ ATF-Transkriptionsfaktoren. „ATP2“ aktiviert die Transkription von Insulin-Genen.
Bei einer blockierten Replikationsgabel wird der „ATR-Chk1-Signalweg“ aktiviert, damit Zellen die DNA-Synthese wieder aufnehmen, so dass die Replikationsgabel nicht zusammenbricht, keine nicht replizierte DNA in die Mitose gelangt und keine DNA-Doppelstrangbrüche entstehen. Der Übergang von S-Phase zur M-Phase wird durch die Aktivierung von „CDK1“ und Bindung von „Cyclin B“ sowie Beteiligung von „CDK7“ und „CDC25“ angetrieben. Im Falle von "Replikationsstress" wird die Replikationsgabel abgewürgt. Im ungünstigen Fall reichern sich die RNA‐bindenden Proteine „TIA1“ und „TIAR (TIAL1)“ im Zytoplasma der Zelle an, wo sie als Repressoren der Translation wirken. „TIA1 und TIAR sind nukleozytoplasmatische Shuttle-Proteine, die das alternative Spleißen regulieren, indem sie U1 snRNP an schwache 5'-Spleißstellen rekrutieren“ [„TIAR markiert nukleäre G2/M-Übergangsgranula und schränkt die CDK1-Aktivität unter Replikationsstress ein - PMC (nih.gov)“; V. Lafarga u.a.; Jan 2019; DOI: 10.15252/embr.201846224]. Zum RNA-Protein-Komplex „U1 snRNP (small nuclear ribonucleoprotein)“ gehört die Komponente „U1 spliceosomal RNA“, die aus 164 Basenpaaren (Mensch) besteht [U1 spleißosomale RNA – Wikipedia]. Die Fundstelle verteilt sich auf den Anteil „100“ innerhalb „TIAR“ und „64“ in „TIA1“ in der Randspalte Z.38365#_[32977]“5“64“[5]/#_[130]“78“8“[788], und zwar in Z.38366 als 78=QS=“15“_absteigend 5/8 für „85“_“64“ mit Summe 15+85+64=164 Basenpaare. Unter hypoxischen Bedingungen coaggregiert „TIAR“/“TIA-1“ zu Granulaten, so dass ein Kontakt besteht [TIAR and TIA-1 mRNA-binding proteins co-aggregate under conditions of rapid oxygen decline and extreme hypoxia and suppress the HIF-1α pathway - PubMed (nih.gov);: O. Gottschald; Dez.2010; DOI: 10.1093/jmcb/mjq032]
„ATF2“ leitet zu einer Vielzahl bedeutender Proteine über:
1.) MCL1: TIA1 und TIAL fördern die Mcl1-mRNA-Translation, um das Keimzentrum vor der Apotose zu schützen. Keimzentren (GCs) sind für die Etablierung lang anhaltender Antikörperreaktionen unerlässlich [The RNA binding proteins TIA1 and TIAL1 promote Mcl1 mRNA translation to protect germinal center responses from apoptosis | Cellular & Molecular Immunology (nature.com); I.C. Osma-Garcia u.a; Jul 2023; https://doi.org/10.1038/s41423-023-01063-4]. Das Protein (Mensch) „MCL1“ („“)=350AS startet und endet in der Startziffer „140“ von „p53“ und zieht mit einer Schleife durch „TIAR“/“TIA-1“ in der Spalte Z.38364#_“14““0“[5]/#_“5““6““4“[5]/#_[8]“7““8“[8], und zwar in Z.38364 als 14=QS=“5“_links aufsteigend „5“_Spalte 6/7=QS=“13“_absteigend Spalte 4/8=QS=“12“ mit Summe 5+5+13+12=“35“_absteigend „0“ mit 35_0 für „MCL1“=350AS [MCL1 - Induced myeloid leukemia cell differentiation protein Mcl-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Enthalten sind „2“ Spalten für Ubiquitin=76AS und die BiXnom-Schwerachse „84“ (Symbol) für die Überlebensfähigkeit [„Die p53-Familie steuert die Apoptosesuszeptibilität der Zelle durch Regulation von Mcl-1 | PDF anfordern (researchgate.net)“; DOI: 10.1055/s-0036-1582069].
Das Arzneimittel „Omacetaxin-Mepesuccinat“=C29H39NØ9=174+39+7+72=292E (||) hemmt „MCL1“ („“) in der Spalte Z.38364#_“1|4|““|0|“[5]/#_“|5|““|6|““|4|“[5]/#_[8]“7““|8|“[8]/#_[08]|1|[6]/#_[17]|1|||2|, und zwar in Z.38268 als „2“(Randziffer_absteigend Spalte 1/1=QS=“2“_absteigend 4/8 für „84“_absteigend 40=QS=“4“_aufstiegend 56=QS=11=QS=“2“ mit „2“_Summe 2+84+4+2=“92“ mit 2_92 für „Omacetaxin-Mepesuccinat“=292E (||) [Omacetaxin-Mepesuccinat | C29H39NO9 | CID 285033 - PubChem (nih.gov)].
Das Protein (Mensch) „BAK1“ (!!)=211AS bindet an MCL1 („“) und besitzt eine Zink-Bindung in der Spalte Z.38364#_!52!!8!!98!“14““0“[5]/#_ [3]!2!!9!!7!!7!“5““6““4“[5]/#_ [1]!3!!0!!7![8 8]“7““8“[8], und zwar in Z.38364 als „52“_aufsteigend Spalte 2/3 für „23“_absteigend Spalte 8/9/0=QS=“17“_“98¬“_aufsteigend „7“_aufsteigend Spalte 7/7=QS=“14“ mit Summe 52+23+17+98+7+14=“211“ für „BAK1“ (!!)=211AS. An der „Serien-Grenze“ sammeln sich Zahlen > 50, die zweckmäßig als Einzelzählung verarbeitet werden. Einzelzählungen wirken dominant [BAK1 - Bcl-2 homologous antagonist/killer - Homo sapiens (Human) | UniProtKB | UniProt].
2.) „TIA-1“: Das Protein (Mensch) „TIA-1“_short {}=386AS bindet an uridinreiche (U-reiche) RNA-Sequenzen in der Spalte Z.38365#_{6}{4}{5}/#_{7}{8}{8}/#_[81]]{6}, und zwar aufsteigend in Z.38365 Spalte 6/7=QS=13_absteigend Spalte 4/8=QS=12_aufsteigend Spalte 5/8=13 mit Summe 13+12+13=“38“_aufsteigend „6“ mit 38_6 für „TIA-1“ {}=386AS. „Wirkt als Modulator des alternativen Spleißens für den apoptotischen FAS-Rezeptor und fördert dadurch die Apoptose“. „Interaktion mit SNRPC/U1-C. „Bindet auch an COL2A1“. Beteiligt sich auch an der zellulären Reaktion auf Umweltstress, indem es stromabwärts der stressinduzierten Phosphorylierung von EIF2S1(EIF2A) wirkt. Die Modifikation, die Isoform „TIA-1“_long (@@)=386AS ist weniger effektiv und zählt in die Gegenrichtung. und zwar absteigend in Z.38366 Spalte 8/6=QS=14_absteigend 45=QS=“9“_aufsteigend 78=QS=“15“ mit Summe 14+9+15=“38“_aufsteigend „6“ mit 38_6 für „TIA-1“_long (@@)=386AS [TIA1 - Cytotoxic granule associated RNA binding protein TIA1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „FasR“ (**)=335AS bindet an „TIA-1“ {} in der Spalte Z.38365#_*29775*{6}{4}{5}/#_*3“[0788]{7}{8}{8}/#_*320*µ20µ81µ{6}, und zwar in Z.38365 als 29775=QS=“30“_links aufsteigend „3“ mit Summe 30+3=“33“_aufsteigend 320=QS=“5“ mit 33_5 für „FasR“ (**) =335AS [FAS - Tumor necrosis factor receptor superfamily member 6 - Homo sapiens (Human) | UniProtKB | UniProt]. „FasR“ (**) ist der Rezeptor für das Protein (Mensch) „TNFSF6“ (µµ)=281AS in Z.38367 als 20=QS=“2“_“81“ für „TNFSF6“ (µµ)=281AS [TNFSF6 - Tumor necrosis factor ligand superfamily member 6 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „COL2A1“ (©©)=1487AS entwickelt Kollagenfibrillen und besitzt eine Calcium-Bindung. Der Knorpel steht über die Hyaluronsäure=200E, vermittelt über Makrophagen, auf der Kehrseite (vis-a-vis) zum Auge. Die Hyaluronsäure bindet an „TIA-1“ in Z.38367#_[20]“20“8“1“{6}/#_34717“1“[2] als 20_8_Spalte 1/1=2 mit „20“_Summe 8+2=10 für „0“ mit 20_0 für Hyaluronsäure=200E. Die Spalte „1/1“ erzeugt Fibrillen. „COL2A1“ (©©)=1487AS liegt in der Spalte Z.38367#_[20]©208©1©{6}/#_[34]©71©7©©1©2©, und zwar in Z.38368 als „2“(Rand)_absteigend 1/1=“2“_(Calcium)208=QS=“10“ mit Summe 2+2+10=“14“_aufsteigend 71=QS=“8“_“7“ mit 14_8_7 für „COL2A1“ (©©)=1487AS [COL2A1 - Collagen alpha-1(II) chain - Homo sapiens (Human) | UniProtKB | UniProt].
„TIA-1“ {} interagiert mit dem Protein (Mensch) „SNRPC_U1-C“ (;;)=159AS. Für die Zink-Bindung muss das Zink selbst gezählt werden, weil die beiden lesbaren Zink-Positionen besetzt sind [Achtung: „SNRPC“ ist der Gen-Name. Das Protein „SNRPC“=306AS wird vom Gen „HNRNPC“ codiert]. „SNRPC_U1-C“ (;;) bindet an beide „TIA-1“-Enden in der Spalte Z.38365#_[297];7;;5;{645}/#_[30];7;;8;;8;{788}/#_[32];0;;2;;0;[81]{6}/#_[3347];17;[1];2;/#_[35141];45;;9;/#_[370300];40;, und zwar in Z.38366_aufsteigend Spalte 7/0 für „70“_absteigend Spalte 7/8/2=QS=“17“_aufsteigend Spalte 5/8/0=QS=“13“ mit „70“_Summe 17+13=“30“(Zink)_aufsteigend 17=QS=“8“_“45“_aufsteigend 40=QS=“4“_absteigend Randspalte 2/9=QS=11=QS=“2“ mit Summe 70+30+8+45+4+2=“159“ für „SNRPC“ (;;)=159AS [SNRPC - U1 small nuclear ribonucleoprotein C - Homo sapiens (Human) | UniProtKB | UniProt]. „SNRPC“ interagiert mit der „Ewing sarcoma breakpoint region (EWS)“ [Small nuclear ribonucleoprotein polypeptide C - Wikipedia]. Das RNA-bindende Protein, das Protein (Mensch) „EWSR1“ (%%) =656AS besitzt eine Zink-Bindung und interagiert mit dem Zinkfinger-Protein „ZNF165“. „EWSR1“ (%%) =656AS liegt in der Spalte Z.38365#_[297];7;;5;{645}/#_[30];7;;8;;8;{788}/#_[32];0;;2;;0;[81]{6}/#_%33%4%%7%;17;[1];2;/#_[35]%1%%41%];45;;9;/#_[37]%0%30%[0];40; , und zwar in Z.38368 als 33=QS=“6“_„4“_aufsteigend Spalte 1/0=QS=“10“_“30“ (Zink)_absteigend 41=QS=“5“_absteigend „7“ mit „6“_Summe 4+10+30+5+7=“56“ mit 6_56 für „EWSR1“ (%%) =656AS [EWSR1 - RNA-binding protein EWS - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ZNF165“ (??)=485AS liegt in der Spalte Z.38365#_[297];7;;5;{645}/#_[30];7;;8;;8;{788}/#_[32];0;;2;;0;[81]{6}/#_%33%4%%7%;17;[1];2;/#_[35]%1%%41%];45;;9;/#_[37]%0%30%[0];40; , und zwar in Z.38365 als „7“ _29=QS=“11“_aufsteigend „30“ (Zink) mit Summe 7+11+30=“48“_aufsteigend 32=QS=“5“ mit 48_5 für „ZNF165“ (??)=485AS [ZNF165 - Zinc finger protein 165 - Homo sapiens (Human) | UniProtKB | UniProt].
3.) eukaryotische Initiationsfaktoren (eIF): „TIA-1“ bindet am Komplex „eIF2“, so dass alle Komplexe „eIF1“ bis „eIF6“ darstellbar sind [Eukaryotic initiation factor - Wikipedia; (en)] /[Initiationsfaktoren – Wikipedia; (de)]. „eIFs“ sind für den ersten Schritt (Initiation) der Translation und damit der Proteinbiosynthese notwendig. Bei der Translation wird die Basensequenz der Messenger-RNA (mRNA) in die Aminosäuresequenz der Proteine übersetzt [Translation (Biologie) - DocCheck Flexikon].
3.1) Komplex „eIF2“ [EIF2S1;EIF2S2; EIF2S3]: „TIA-1“ {} interagiert und bindet am Protein (Mensch) „EIF2S1 ¬¬(EIF2A)“ (°°) =315AS - und beide binden an „Guanosintriphosphat (GTP)“ (xx)=268E in der Spalte Z.38365#[329]°7°°7°°5°{6}{4}{5}/#_[130]°7°°8°[8]{7}{8}{8}/#_[932]°0°°2°[0]x8xx1x{6}7334]x71x7xx1x[2]. „GTP“ (xx)=268E absteigend in Z.38367 Spalte 1/1 für „11“_aufsteigend Spalte 8/7=QS=“15“ mit Summe 11+15=“26“_71=“8“ mit 26_8 für „GTP“ (xx)=268E.
„EIF2S1“ (°°) =315AS aufsteigend in Z.38365 Spalte 7/7/0=QS=“14“_absteigend Spalte 7/8/2=QS=“17“ mit Summe 14+17=“31“ _“5“ für „EIF2S1“ (°°) =315AS. Die Stressreaktion auf Mangan=25E erfolgt über die interne Spalte „7/8“/“2“ für QS=“15“_“2“ und die seitlich mit unbesetzte externe Spalte 8/0=QS=“8“ (statt Methionin=80E) mit Summe 15+2+8=Mangan=25E. Damit „eIF2“ eine weitere Initiierungsrunde recyceln und katalysieren kann, muss das an „eIF2“ gebundene „Biphosphat (BIP)“ durch eine von „eIF2B“ katalysierte Reaktion mit „GTP“ ausgetauscht werden. Die Formel für „BIP“ gilt speziell nur für die jeweilige Katalyse. Die Name „eIF2B“ ist doppelt besetzt: 1.) Synonym für das Protein „eIF2S2“ und 2.) „Guaninnukleotid-Austauschfaktor für eIF2“, der 5-teilige Komplex „eIF2B [eIF2B1 bis eIFB5]“. „EIF2S1“ ist Mitglied des eIF2-Komplexes“. Es erfolgt eine Bindung am „Präinitiationskomplex (43S PIC)“ [EIF2S1 - Eukaryotic translation initiation factor 2 subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt].
„EIF2S1“ (°°) wird im Komplex mit „EIF2S2“ / „EIF2S3“ stabilisiert. Das Protein (Mensch) „EIF2S2“ (!!)=333AS liegt mit einer Zink-Bindung in der Spalte Z.38365#!3!29]°7°°7°°5°{6}{4}{5}/#_!1!30!°7°°8°[8]{7}{8}{8}/#_^93^!2!°0°°2°[0]x8xx1x{6}/#_[7]^33^4^x71x7xx1x[2], und zwar in Z.38365 als 3_austeigend „1“_“30“(Zink)_aufsteigend mit „3“_Summe 1+30+2=“33“ mit 3_33 für „EIF2S2“ (!!)=333AS [EIF2S2 - Eukaryotic translation initiation factor 2 subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF2S3“ (^^)=472AS startet links am „GTP“ (xx) in Z.38368 als „4“_“33“_absteigend 93 links für „39“ mit „4“_Summe 33+39=“72“ mit 4_72 für „EIF2S3“ (^^)=472AS. Für eine weitere Initiierungsrunde wird der Austausch von „GDP“ durch „GTP“ vom Komplex eIF-2B katalysiert. „GDP“=228E zieht von der Randziffer „2“ durch die GTP-Position. Wenn die GDP-Randziffer „2“ besetzt ist, kann statt „GDP“ nur „GTP“ existieren, und zwar liegt „GDP“ in der Randspalte Z.38367#„8““1“{6}/#_[7]“1““2“ als „2“_absteigend Spalte 1/1=QS=“2“_“8“ mit 2_2_8 für GDP=228E. Zunächst geht die Hydrolyse des an „eIF2“ gebundenen „GTP“ und die Freisetzung eines eIF2-GDP-Binärkomplexes voraus. Die Katalyse ist eine Umwandlung in der GTP-Position: GTP + H2O=BIP(CHEBI:58189) +H +Phosphat(CHEBI:43474). Mit „BIP(CHEBI:58189)“=GDP(3−)=228-3=225E und Phosphat+ (CHEBI:43474)= HO4P=1+32+15=48E. Wasser ist dem „GTP“ vorgelagert als „0208“ für Wasser 28(Symbol). BIP„HO4P“=225E über Randspalte Z.38367#_[08]“1“[6]/#_[17]“1““2“/#_[14]“59“ als „2“(Rand)_aufsteigend 59=QS=“14“_absteigend Spalte 1/1=“11“ mit „2“_Summe 14+11=“25“ mit 2_25 für BIP=GDP(3−)=225E. In der Spalte „17/14“ sind „HO4P“=48E als „1“_aufsteigend Spalte 7/4 für „47“ mit 1+47=48E und „Wasserstoff“=1E enthalten [EIF2S3 - Eukaryotic translation initiation factor 2 subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt].
3.2) Komplex „eIF2B“ [EIF2B1; EIF2B2; EIF2B3; EIF2B4; EIF2B5] , „eIF-2A“ und „eIF-2AD“:
Das Protein (Mensch) „EIF2B1“ {}=305AS liegt in der Spalte Z.38366#_[130]{7887}88/#_[9]{320}[20816], und zwar links 7887=QS=30_aufsteigend links 320=QS=“5“ mit 30_5 für „EIF2B1“ {}=305AS. Reaktion auf Mangan, wenn die externe Ziffer „2“ in „{3“20}[2]“ besetzt ist, und zwar als Summe 3+20+2=Mangan=25E [EIF2B1 - Translation initiation factor eIF2B subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF2B2“ ()=351AS liegt in der Spalte Z.38368#-_[733](4)[71712]/#_[535](1)[41459]/#_(3)(37)(0)[30040], und zwar in Z.38370 als „3“_“37“_“0“ absteigend Spalte 4/1 für „14“ mit „3“_Summe 37+0+14=“51“ mit 3_51 „EIF2B2“ ()=351AS [EIF2B2 - Translation initiation factor eIF2B subunit beta - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF2B5“ (||)=721AS bindet an „EIF2B1“ {} und „EIF2B2“ () in der Spalte Z.38366#_[130]{7887}88/#_[9]{320}|208||1|[6]/ _[733](4)|7|[17]|1|[2]/#_[535](1)[41459]/#_(3)(37)(0)[30040], und zwar in Z.38367 über Spalte |208||1|/|7|[17]|1|“ als „7“_absteigend 208=QS=“10“_ aufsteigend Spalte 1/1=QS=11 mit „7“_Summe 10+11=“21“ mit 7_21 für „EIF2B5“=721AS [EIF2B5 - Translation initiation factor eIF2B subunit epsilon - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF2B3“ (§§)=452AS liegt in der Spalte Z.38368#_[733](4)|7|[17]|1|§2§/#_[535](1)§4§§1§[45]§9§/#_(3)(37)(0)[3]§0§§0§§40§, und zwar in Z.38369 als „4“_aufsteigend Spalte 1/0 für „10“_“0“_“40“_absteigend Spalte 2/9=QS=11=QS=“2“ mit „4“_Summe 10+0+40+2=“52“ mit 4_52 für „EIF2B3“ (§§)=452AS [EIF2B3 - Translation initiation factor eIF2B subunit gamma - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF2B4“ (**)=523AS liegt in der Spalte Z.38366#_*1*[30]{7887}88/#_*9*{320}|208||1|[6]/#_*73*3*(4)|7|[17]|1|§2§/#_[53]*5*(1)§4§§1§[45]§9§/#_(3)(37)(0)[3]§0§§0§§40§, und zwar in Z.38369 als „5“_absteigend „3“_links 73=QS=“10“_absteigend Spalte 1/9=QS=“10“ mit „5“_Summe 3+10+10=“23“ mit 5_23 für „EIF2B4“ (**)=523AS [EIF2B4 - Translation initiation factor eIF2B subunit delta - Homo sapiens (Human) | UniProtKB | UniProt].
Der Komplex „eIF2B“ wird vom Wirkstoff „Chemical Integrated Stress Response (ISR)-Inhibitor „ISRIB“=C22H24Kl2N2O4=132+24+19+106+14+32=327E stimuliert. Funktionell werden zweckmäßig alle „5“ „eIF2B“-Proteine eingebunden, um dann die „Methionin“-Spalte 8/0 für 80E zu besetzen, wodurch die globale Translation unterdrückt wird. „ISRIB“ (!!)=327E liegt in der Spalte Z.38365#_[32977]!5![645]#_*1*[30]{78!8!7}88/#_*9*{3!20!}|!20!8||1|[6]/#_*73*!3!*(!4!)|!7!|[17]|!1!|§!2!§/#_[53]*5*(1)§!4!§§!1!§[!45!]§9§/#_(3)(37)(0)[3]§0§§0§§40§,, und zwar in Z.38368 als 12(Rand)=QS=“3“_aufsteigend 145=QS=“10“_absteigend Spalte 7/4=QS=11=QS=“2“_links 34=QS=7_absteigend 2020=QS=“4“ mit „3“_“2“_Summe 7+4=11=QS=“2“_absteigend Spalte (Grenze)5/8=QS=“13“ mit „3“_Summe 10+2+2+13=“27“ mit 3_37 für „ISRIB“ (!!)=327E.
Zur „eIF2-Familie“ gehören zusätzlich „eIF-2A“ (Achtung: kein Synonym zu „eIFS1“) und „eIF-2D“, die seitlich am „eIF2B“-Komplex binden, um zweckmäßig Störungen durch fremde Proteine auszuschließen. Das Protein (Mensch) „eIF-2A“ ($$)=585AS liegt in der Spalte Z.38365#_[832977]$5$64$5$/#_[41307887]$8$$8$, und zwar als „5“_“64“_aufsteigend Randspalte 5/8=QS=“13“_“8“ mit „5“_Summe 64+13+8=“85“ mit 5_85 für „eIF-2A“ ($$)=585AS [EIF2A - Eukaryotic translation initiation factor 2A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „eIF-2D“ (€€)=584AS liegt in der Spalte Z.38365#_€8€€32€[977]$5$64$5$/#_€4€[1307887]$8$$8$, und zwar als links 32=QS=“5“_aufsteigend Spalte 8/4 für „84“ mit 5_84 für „eIF-2D“ (€€)=584AS [EIF2D - Eukaryotic translation initiation factor 2D - Homo sapiens (Human) | UniProtKB | UniProt].
3.3) eIF-3“-Module: Der „eukaryotische Initiationsfaktor 3 (eIF3)“ ist ein Multiproteinkomplex aus „13“ Untereinheiten (eIF3a-m). Weil außer „EIF3M“ alle an „EIF3A“ binden, muss „EIF3A“ nadelförmig aufsteigen, um Bindungsstellen zu präsentieren. Außer „EIF3J“ werden die Untereinheiten 3 Modulen (A, B, C) zugeordnet. „EIF3J“ ist eine labile Untereinheit, die über EIF3B an den eIF-3-Komplex bindet.
3.3.1) „eIF3-Modul-A“ [EIF3A, EIF3B, EIF3G, EIF3I] und „EIF3J“: Das Protein (Mensch) „EIF3A“ (!!)=1382AS liegt in der Spalte Z.38365#_!8![3…]/#_!4!!1![…]/#_[9]!9![…]/#_[5]!7![…]/#_[1]!5![…]/#_[7]!3![…]/#_!31![…], und zwar aufsteigend in Z.38365 Spalte 8/4=QS=12_1 mit Summe 12+1=“13“_aufsteigend Spalte 9/7=QS=“16“_ aufsteigend Spalte 5/3 für „53“ aufsteigend 31 links für „13“ mit „13“_Summe 16+53+13=“82“ mit 13_82 für „EIF3A“ (!!)=1382AS [EIF3A - Eukaryotic translation initiation factor 3 subunit A - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3I“ (ii)=325AS kann sich als Nadelkopf auf „EIF3A“ (!!) setzen, weil es mit dem „TGF beta 1“=390AS interagiert, dessen Zahl „90“ neben der „EIF3A“-Startziffer liegt. „EIF3I“ (ii)=325AS liegt in der Spalte Z.38364#_“11“i“0“2i5i[2]b8b[981405]/#_“1“0“9“!8!i3ib29b[775645]/#_[109]!4!!1!b3b[0788788]/#_[1089]!9!g320g[20816], und zwar in Z.38365 als „3“_absteigend „5“_links 02 für „20“ mit „3“_Summe 5+20=“25“ mit 3_25 für EIF3I“ (ii)=325AS [EIF3I - Eukaryotic translation initiation factor 3 subunit I - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TGF beta 1“ („“)= 390AS interagiert nicht mit „EIF3A“, weil es sich in der Ringform die Ziffer „0“ mit „EIF3I“ teilt, und zwar absteigend in Z.38364 als 11=QS=“2“_aufsteigend „1“_“0“ mit Summe 2+1+0=“3“_absteigend Spalte 0/9 für „90“ mit 3_90 für „TGF beta 1“ („“)= 390AS [TGFB1 - Transforming growth factor beta-1 proprotein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3B“ (bb)=814AS bindet das entfernte „EIF3J“. Die Endzahl „4“ in 81_4 wird vorgelagert gewählt, um das folgende Modul nicht zu blockieren. „EIF3B“ (bb)=814AS liegt in der Spalte Z.38363#_[1106728]b40b[6085]/#_“11“i“0“2i5i[289]b8bg1gg4g[05]/#_“1“0“9“!8!i3ib29bb77bg5gg6g[45]/#_[109]!4!!1!b30b[78]g8g[788]/#_[1089]!9!g320g[20816], und zwar in Z.38366 als „30“_absteigend „29“_77=QS=“14“_absteigend „8“ mit Summe 30+29+14+8=“81“_absteigend 40=QS=“4“ mit 81_4 für „EIF3B“ (bb)=814AS [EIF3B - Eukaryotic translation initiation factor 3 subunit B - Homo sapiens (Human) | UniProtKB | UniProt].
Der eIF-3-Komplex interagiert bei Nährstoffmangel über „EIF3B“ (bb) mit „RPS6KB1“. Folglich kann im Normalfall „EIF3J“ alternativ anbinden. Das Protein (Mensch) „RPS6KB1“ („“) =525AS liegt in der Randspalte Z.38364#_“140“5“/#_“5“64“5“, und zwar in Z.38365#_“5“_64=QS=“10“_absteigend Spalte 5/5=QS=“10“_links 140=QS=“5“ mit „5“_Summe 10+10+5=“25“ mit 5_25 für „RPS6KB1“ („“) =525AS [RPS6KB1 - Ribosomal protein S6 kinase beta-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3J“ (jj) =258AS bindet an EIF3B“ (bb) in der Randspalte Z.38364#_b8bj1jj4j[05]/#_b7bj5jj6j[45]/#_[8]j8j[788], und zwar absteigend in Z.38364 Spalte 4/6=QS=“10“_links „1“ mit Summe 10+1=“11“=QS=“2“_aufsteigend Spalte 5/8 für „58“ mit 2_58 für „EIF3J“ (jj) =258AS [EIF3J - Eukaryotic translation initiation factor 3 subunit J - Homo sapiens (Human) | UniProtKB | UniProt].
Das „eIF3-Modul A“ endet mit dem lesbaren „EIF3J“ (gg) =320AS mit Bindung an „EIF3A“ (!!) in der Zeile Z.38367#!9g320g[20816] mit „320“ für „EIF3J“ (gg) =320AS [EIF3G - Eukaryotic translation initiation factor 3 subunit G - Homo sapiens (Human) | UniProtKB | UniProt].
3.3.2) „eIF3-Modul B“ [EIF3F, EIF3H, EIF3M]: Das Protein (Mensch) „EIF3H“ (hh) =352AS liegt in der Spalte Z.38367#_!9!g320gh2h[0816]/#_!7!h33h47hf1f[712]/#_!5!f35f14ff1f[459]. „EIF3H“ und „EIF3F“ binden am nadelartigen „EIF3A“ (!!) binden. „EIF3M“ liegt am rechten Rand. „EIF3H“ (hh) =352AS in Z.38368 als „33“_47=QS=11=QS=“2“ mit Summe 33+2=“35“_absteigend „2“ mit 35_2 für „EIF3H“ (hh) =352AS [EIF3H - Eukaryotic translation initiation factor 3 subunit H - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3F“ (ff) =357AS in Z.38369 als „35“_14=QS=“5“_ absteigend Spalte 1/1=QS=“2“ mit „35“_Summe 5+2=“7“ mit 35_7 für „EIF3F“ (ff) =357AS. Seitlich liegt extern die Spalte 7/4 für „74“, die sich mit der internen Ziffer „2“ zu Ubiquitin=74+2=76AS summiert, wodurch in der Folge Proteine durch Hydrolyse abgebaut werden. Der Wirkstoff „Rapamycin“ wird daher bei Implantationen verwendet, um die Immunabwehr zu begrenzen [EIF3F - Eukaryotic translation initiation factor 3 subunit F - Homo sapiens (Human) | UniProtKB | UniProt]. „Rapamycin“ ist ein erhofftes „Anti-Aging-Mittel“, weil es auf den Darm „808“ einwirkt [DZNE : Rapamycin: geringe Anti-Aging-Effekte]. „Rapamycin“= C51H79NO13=306+79+7+104=496E zieht vom Rand durch die Darm-Spur „808“ in der Spalte Z.38369_“414“[5]“9“/#_“3““004““0“/#_“3““74““38“/#_[63]“6“[36], und zwar aufsteigend in Z.38368 als Spalte 2/9/0=QS=11=QS=“2“_aufsteigend 38=QS=“2“ mit Summe 2+2=“4“_absteigend links 004=QS=“4“_aufsteigend 141=QS=“6“_aufsteigend „0“_aufsteigend Spalte 3/3=QS=“6“_“74“_aufsteigend „6“ mit „4“_Summe 4+6+0+6+74+6=“96“ mit 4_96 für „Rapamycin“=496E [Rapamycin | CAS 53123-88-9 | Cayman Chemical | Biomol.de].
Das Protein (Mensch) „EIF3M“ ist nicht mit „EIF3A“ verbunden und sollte mit „EIF3F“ und „EIF3H“ interagieren [Die m-Untereinheit des murinen Translationsinitiationsfaktors eIF3 erhält die Integrität des eIF3-Komplexes und wird für die Embryonalentwicklung, die Homöostase und die Kontrolle der Organgröße benötigt - ScienceDirect , L.Zeng; Okt.2013; https://doi.org/10.1074/jbc.M113.506147]. Eine Bindung ist im „Modul B“ jedoch nur an „EIF3F“ darstellbar. „EIF3F“ enthält intern die Zahl „71“, die seitlich neben „EIF3H“ extern mit der Zahl 081=QS=“9“ summiert 71+9=Methionin=80E ergibt. „EIF3M“ zeigt einen Zusammenhang zu „Methionin“, so dass indirekt eine Stabilisierung an „EIF3H“ erfolgen könnte. Beim Merkmal „Cleaved initiator methionine“ wird der Initiator „Methionin“ vom reifen Protein abgespalten. Das Protein (Mensch) „EIF3M“ (mm) =374AS liegt in der Spalte Z.38367#_!9!g320gh2h[0816]/#_!7!h33h47hf1fm7mm12m/#_!5!f35f14ff1fm4m[59], und zwar in Z.38368 als 12(Rand)=QS=“3“ aufsteigend Spalte 7/4 für „74“ mit 3_74 für „EIF3M“ (mm) =374AS [EIF3M - Eukaryotic translation initiation factor 3 subunit M - Homo sapiens (Human) | UniProtKB | UniProt].
3.3.3) „eIF3-Modul C“ [EIF3C, EIF3D, EIF3E, EIF3K und EIF3L]: „EIF3C“ bindet am nadelförmigen „EIF3A“(aus Modul A). Die zusätzliche Interaktion mit „EIF3G“=320AS(lesbar) ist ein Phänomen, weil „EIF3G“ eingekapselt ist und das „Modul B“ eine weitere Barriere bildet. Das Protein (Mensch) „EIF3C“=913AS liegt in der Spalte Z.38367#_!9!g320gh2h[0816]/#_!7!h33h47hf1fm7mm12m/#_!5!f35f14ff1fm4mc5c[9]/#_!3!c370300cc4c[0], und zwar aufsteigend in Z.38369 Spalte 5/4=QS=“9“_links „370300“=QS=“13“ mit 9_13 für „EIF3C“=913AS. Zur Interaktion zwischen „EIF3C“ und „EIF3G“ müsste das „Modul B“ durchquert werden, und „EIF3G“ würde ggf. in anderer Position die Bindung an „EIF3A“ verlieren. „In vito“ (im Glas) ist die Interaktion unkompliziert möglich, indem sich „EIF3C“ direkt auf die Bindungsstelle „EIF3A“/ „EIF3G“ in der Spalte Z.38367#_!9!g320g[…]/#_!7!h33h4[…] setzt, und zwar über Spalte 93/73 als „9“(aus EIF3A)_aufsteigend 73=“10“_absteigend „3“ mit „9“_Summe 10+3=“13“ mit 9_13 für EIF3C“=913AS [EIF3C - Eukaryotic translation initiation factor 3 subunit C - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF3L“ (LL)= 564AS erzeugt einen Matrix-Ring in der Spalte Z.38370#_[77]!3!c37c030cc4c[0]/#_[7]!31!L39L1374L[38]/#_[689]L41L4L636L[36], und zwar in Z.38372 als 41 links für „14“_ absteigend 39=QS=“12“_1374=QS=“15“_aufsteigend 636=QS=“15“ mit Summe 14+12+15+15=“56“_“4“ für „EIF3L“ (LL)= 564AS. „Im Falle einer FCV-Infektion spielt es eine Rolle beim ribosomalen Terminations-Reinitiationsereignis, das zur Translation von VP2 führt“. [EIF3L - Eukaryotic translation initiation factor 3 subunit L - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Feline Calicivirus (FCV)“ ist ein in der Katzenpopulation weit verbreitetes Virus. Das „Polyomavirus-Kapside“ besteht aus dem Hauptkapsidprotein „VP1“ sowie „VP2“ und „VP3“. „The complete capsid is composed of 72 VP1 pentamers, with a minor capsid protein, VP2 or VP3“ [Nebenkapsidproteine VP2 und VP3 – Wikipedia].
Das virale Protein (Polyomavirus) „VP2“=351AS besetzt den linken Rand von „EIF3L“ in der Spalte „3913/4146“, und zwar als „3“_aufsteigend 41_46=QS=“10“ mit „3“_Summe 41+10=“51“ mit 3_51 für „VP2“=351AS. „VP1“ folgt mit der Anzahl „72“ über „3636“ mit Summe 36+36=“72“ für „72“ VP1-Pentamere mit je etwa 350AS. „VP1-Pentamer“=5*350AS=1750AS, die sich als lange Spalte durch den „EIF3-Komplex“ ziehen, und mit der Endzahl „6“ in der 72-Menge „3636“ kreuzend endet. „VP1 monomers are generally around 350 amino acids long“ [Major capsid protein VP1 - Wikipedia]. „V1-Pentamer“=1750AS in Z.38368 als „17“_aufsteiegend Spalte 4/0 für „40“_aufsteigend 4/6=QS=10 mit „17“_Summe 40+10=“50“ mit 17_50 für „V1-Pentamer“=1750AS. Die Isoform „V3“ wird analog „V2“ als V3=351AS angenommen, die neben der V1-Spalte einen Ring in der Spalte 41/30/37 bildet, und zwar V3 als „3“ absteigend „41“ aufsteigend „0“_aufsteigend 37=QS=10 mit „3“_Summe 41+0+10=“51“ für V3=351AS [Minor capsid protein VP2 - BK polyomavirus (BKPyV) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3D“ (dd)= 548AS zieht mit einer durch die Schwerachse 8/4 für 84 (Symbol), um auf der linke „EIF3A“-Seite „Z.38370#_d7d[7]!3!c37c030cc4c[0]/#_d7d!31!L39L1374L[38]/#_d689dL41L4L636L[36] /#_d647d44d[008616] zu binden, und zwar aufsteigend in Z.38370 Spalte 7/7=QS=“14“_aufsteigend 689=QS=“23“_aufsteigend 647=QS=“17“ mit Summe 14+23+17=“54“_44=QS=“8“ mit 54_8 für „EIF3D“ (dd)=548AS. „Im eIF-3-Komplex erkennt und bindet EIF3D spezifisch, erkennt und bindet die 7-Methylguanosin-Kappe einer Untergruppe von mRNAs“. „EIF3D“ enthält „7-Methylguanosin“=C11H16N5O5=66+16+35+40=“157“ intern mit einer Kappen-Krümmung als „Kreis“=64_absteigend intern „89“ und extern die Ziffer „4“ in „EIF3L“, und zwar als Summe 64+89+4(extern)=157E [EIF3D - Eukaryotic translation initiation factor 3 subunit D - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3K“ (kk)= 218AS bindet links an der „EIF3A“-Nadel in der Spalte Z.38368#_85!7!h33h47hf1fm7mm12m/#_81!5!f35f14ff1fm4mc5c[9]/#_d7dk7k3c37c0300c4c[0], und zwar in Z.38368 als „5_aufsteigend Spalte 8/8=“16“ mit Summe 5+16=“21“_aufsteigend Spalte 1/7=QS=“8“ mit 21_8 für „EIF3K“ (kk)= 218AS. Das EIF3K-Merkmal, die zelluläre Komponente „Membran“=33(Symbol) ist rechts an der Endziffer „7“ als k7k!3!c3c gebunden. Die zusätzliche Bindung an „Cyclin D3“ ist ein Phänomen, weil es unerreichbar rechts von der „EIF3A“-Nadel liegt. „Die Assoziation von Cyclin D3 mit eIF3k wurde durch In-vitro-Bindungsassay, In-vivo-Koimmunpräzipitation und konfokale mikroskopische Analyse weiter bestätigt“ [Identifizierung der p28-Untereinheit des eukaryotischen Initiationsfaktors 3 (eIF3k) als neuer Interaktionspartner von Cyclin D3 - Shen - 2004 - FEBS Letters - Wiley Online Library: J. Gu u.a.; Aug 2004; https://doi.org/10.1016/j.febslet.2004.07.071]. Bei einer isolierten Betrachtung ist „Cyclin D3“ tatsächlich ein Bindungspartner, weil „EIF3K“ für „218AS“ die Zahl „21“ durch die Besetzung von „Cyclin D3“ gewinnt und dann links mit !5!3=QS=“8“ in „EIF3A“ für die Ziffer „5“ eindringt. Eine Interaktion ist somit vorhanden, es handelt sich aber um keine mathematische EIF3-Komplex-Bindung. „EIF3K“-alternativ in Cyclin D3 in Z.38365 als 29=QS=“11“_aufsteigend Spalte 0/2/3/5(1)=QS=“10“ (ohne rechts Ziffer 1) mit Cyclin-Summe 11+10=“21“_links 53=“8“ mit 21_8 für 218AS [EIF3K - Eukaryotic translation initiation factor 3 subunit K - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF3E“ (ee)=445AS vollendet die Umrundung der „EIF3A“-Nadel und verstärkt den Nadelkopf in der Spalte Z.38363#_[1106728]b40b[6085]/#_“11“i“0“2i5i[289]b8bg1gg4g[05]/#_“1“0“9“!8!i3ib29bb77bg5gg6g[45]/#_[109]!4!!1!b30b[78]g8g[788]/#_[1089]!9!g320g[20816], und zwar aufsteigend in Z.38363 Spalte 11/11=QS=“4“_aufsteigend 10_aufsteigend Spalte 9/9=QS=“18“_aufsteigend 89=QS=“17“ mit „4“_Summe 10+18+17=“45“ mit 4_45 für „EIF3E“ (ee)=445AS.
3.4.) „eIF4F-Komplex“ [EIF4A, EIF4E, EIF4G] sowie Coenzyme von „EIF4A“ [EIF4B und EIF4H]: Der heterotrimere „eIF4F-Komplex“ enthält „The DEAD-box RNA helicase eIF4A, the cap-binding protein eIF4E, and the large "scaffold [Gerüst]" protein eIF4G“ [ Eukaryotic initiation factor 4F - Wikipedia]. Das nadelförmige „EIF3A“ (!!) der eIF3-Familie bleibt zunächst als Strukturmerkmal für den „EIF4-Komplex“ erhalten, weil „EIF4B“ und „EIF4G2“ mit „EIF3A (!!) interagieren, um für den „EIF4-Komplex“ eine Begrenzung zu erzeugen. „EIF4H“ erkennt den Nadelkopf von „EIF3A (!!)“, um in dessen Position als Verlängerung von „EIF4B“ links neben „EIF4G2“ die Schwerachse „8/4“ für „84“ zu besetzen.
Das Protein (Mensch) „EIF4G2“ ()=907AS liegt mit „EIF3A“ (!!) in der Spalte Z.38364#_[25](2)[8…]/#_!8(9)[…]/#_!4!!1!(3)(0)[…]/#_[9]!9!{3}{2}[…]/#_[5]!7!{3}{3}[…]/#_[1]!5!{3}[5…]/#_[7]!3!{3}[7…]/#_!31![39…], und zwar aufsteigend in Z.38365 Spalte 9/0 für „90“_absteigend Spalte 2/2/3=QS=“7“ mit 90_7 für „EIF4G2“ ()=907AS [EIF4G2 - Eukaryotic translation initiation factor 4 gamma 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF4H“ (||)=248AS liegt mit „EIF3A“ (!!) in der Spalte Z.38364#_|2||5|(2)[8…]/#_!|8|!|3|(2)(9)[…]/#_!|4|!!|1|!(3)(0)[…], und zwar in Z.39364 als „2“_aufsteigend Spalte 5/3/1=QS=“9“ mit Summe 2+9=11=QS=“2“_absteigend Spalte 8/4 für „48“ mit 2_48 für „EIF4H“ (||)=248AS. Das Gen ist bei der multisystemischen Entwicklungsstörung „Williams-Syndrom“ deletiert, weil dieser DNA-Abschnitt fehlt. [EIF4H - Eukaryotic translation initiation factor 4H - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF4B“ soll die Entwicklung des „EIF4F-Komplexes“ nicht erschweren. „EIF3A“ (!!) wird bei der Interaktion nicht seitlich gebunden, sondern durchkreuzt, um links eine begrenzende Kontur-Spalte anzuordnen. Das Protein (Mensch) „EIF4B“ {}=611AS liegt in der Spalte Z.38364#_[25](2)[8…]/#_!8(9)[…]/#_!4!!1!(3)(0)[…]/#_[9]!9!{32}[…]/#_[5]!7!{33}[…]/#_{1}!5![35…]/#_{7}!3![37…]/#_{!3!}!1![39…]/#_{8}{9}[41…]/#_{47}[44…], und zwar in Z.38367 als „32“_aufsteigend „33“_links „7“_aufsteigend in Z.38368 Spalte 5/1/7 für „517“_aufsteigend Spalte 3/8=QS=“11“_“9“_aufsteigend 47=QS=11=QS=“2“ mit Summe 32+33+7+517+11+9+2=“611“ für „EIF4B“ {}=611AS [EIF4B - Eukaryotic translation initiation factor 4B - Homo sapiens (Human) | UniProtKB | UniProt].
„EIF4G1“ und „EIF4G3“ interagieren mit „PABPC1“, so dass sie benachbart sind. Das Protein (Mensch) „PABPC1“ (~~)= „636“AS ist am Rand lesbar, und zwar in der Zeile Z.38372#_[3]“636“ als „636“ für „PABPC1“ (~~)= 636AS [PABPC1 - Polyadenylate-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF4G1“ ($$)=1599AS interagiert im Komplex mit „EIF4A1“ und „EIF4E“ in der Spalte Z.38369#_[1]$5$3$[5141459]/#_[7]$3$3$[7030040]/#_[3]$1$$3$$91$$37$[438]/#_[89]€41€$463§~636~/#_[47]€44€€00861€[6], und zwar mit Start aus der besetzten EIF3A-Ziffer „1“_absteigend Spalte 5/3=QS=8_3 mit „1“_Summe 8+3=11=QS=“2“_aufsteigend Spalte 3/3 für „33“_“91“_aufsteigend „463“_absteigend 37=QS=“10“ mit „1“_Summe 2+33+91+463+10=“599“ mit 1_599 für „EIF4G1“ ($$)=1599AS [EIF4G1 - Eukaryotic translation initiation factor 4 gamma 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF4G3“ (€€)=1585AS folgt in Z.38373 als links 00861=QS=“15“_“44“_absteigend „41“ mit „15“_Summe 44+41=“85“ mit 15_85 für „EIF4G3“ (€€)=1585AS [EIF4G3 - Eukaryotic translation initiation factor 4 gamma 3 - Homo sapiens (Human) | UniProtKB | UniProt].
„EIF4A1“, „EIF4A2“ und „EIF4A3“ besitzen zwar eine ATP-Bindungsstelle, aber die ATP-Energie fehlt. Die Energie-Zufuhr wird vom „Zellzyklus“ reguliert, indem die „3“ Proteine eine Kette bilden. Diese eröffnet einen Weg über den „ATP“ transportiert werden kann. „ATP“ ist in einer Verbindung vom „ATP“ der Zellzyklus-Spalte zur klassischen ATP-Randspalte zählbar. Bei der Katalyse werden „ATP“ und „Wasser“ zu „ADP“, Wasserstoff und Phosphat (CHEBI:43474)= HO4P=1+32+15=48E umgeformt.
Das Protein (Mensch) „EIF4A2“ (§§)=407AS liegt lesbar rechts neben der „ATP-Zellzyklus-Spalte“ „30/32“ in der Spalte Z.38366#_§7§[88788]/#_§0§[20816]/#_§4§[71712], und zwar absteigend in der Spalte 7/0/4 mit „407“ für EIF4A2“ ($$)=407AS [EIF4A2 - Eukaryotic initiation factor 4A-II - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF4A3“ (%%)=411AS liegt der Spalte Z.38366#_§7§[88788]/#_§0§[20816]/#_§4§%7%[1712]/#_%1%%4%[1459]/#_%0%300%[40], und zwar in Z.38370 als links 300=QS=“3“_absteigend Spalte 1/0=QS=“1“ mit Summe 3+1=“4“_absteigend 7/4=QS=“11“ mit 4_11 für „EIF4A3“ (%%)=411AS [EIF4A3 - Eukaryotic initiation factor 4A-III - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF4A1“ (&&)=406AS liegt der Spalte Z.38366#_§7§[88788]/#_§0§[20816]/#_§4§%7%[1712]/#_%1%%4%[1459]/#_%0%300%[40], und zwar in Z.38370 als 40_aufsteigend 38=QS=11=QS=2_4 mit „40“_Summe 2+4=“6“ mit 40_6 für „EIF4A1“ (&&)=406AS. „Helikaseaktivität und -funktion in der Translation werden durch die Interaktion mit PDCD4 gehemmt“ [EIF4A1 - Eukaryotic initiation factor 4A-I - Homo sapiens (Human) | UniProtKB | UniProt]. In der EIF4A1-Randspalte „438/636“ kann die Zahl „636“ vom lesbaren „PABPC1“=636AS besetzt werden. Alternativ bindet das Protein (Mensch) „PDCD4“=469AS in die Ziffer „4“ von „EIF4A1“ ein und ergänzt über „636“ für „4“_“6“_36=QS=“9“ mit 4_6_9 für „PDCD4“=469AS [PDCD4 - Programmed cell death protein 4 - Homo sapiens (Human) | UniProtKB | UniProt].
„EIF4E1“, „EIF4E2“ und „EIF4E3“ erkennen die 7-Methylguanosin-haltige mRNA-Kappe. Der Wirkstoff „7-Methyl-GTP“=C11H18N5O14P3=66+18+35+112+45=276E kann an eine Besonderheit gekoppelt werden: Die Zählgröße „11“ als Spalte 1/1 ist in der Symmetrie 7“1“7/4“1“4 enthalten. „7-Methyl-GTP“ („“)=276E liegt in der Spalte Z.38367#_“2“[08];1;6;/#_“7““1“;7;;1;[2]/#_“4““1“;4;;5;[9], und zwar aufsteigend in Z.38367 Spalte 2/7/4 für „274“_absteigend Spalte 1/1=“2“ mit Summe 274+2=“276“ für „7-Methyl-GTP“ („“)=276E. Dopplung als Fortsetzung: „7-Methyl-GTP“ (;;)=276E in aufsteigend in Z.38368 Spalte 7/4=QS=11=QS=“2“_absteigend Spalte 1/1/5=QS=“7“_“6“ mit 2_7_6 für Methyl-GTP“=276E [7-Methylguanosintriphosphat | C11H18N5O14P3 | CID 135450598 - PubChem (nih.gov)].
Das Protein (Mensch) „EIF4E2“ (**)=245AS liegt in der Spalte Z.38367#_^2^08^16^/#_[7]*1*°7°1°2°/#_[4]*1*45*[9], und zwar aufsteigend in Z.38368 Symmetrie-Spalte 1/1=QS=“2“_“45“ für „EIF4E2“ (**)=245AS [EIF4E2 - Eukaryotic translation initiation factor 4E type 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF4E1 (EIF4E)“ (°°)=217AS ist in Z.38368#_°7°1°2° gespiegelt als „217“ für EIF4E1“ (°°)=217AS lesbar [EIF4E - Eukaryotic translation initiation factor 4E - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „EIF4E3“ (^^)=224AS ist am zentralen „7-Methyl-GTP“ angeschlossen und besetzt mit seiner Endziffer das zweite „7-Methyl-GTP“, so dass „EIF4E1“ in seiner Aktivität gehemmt wird. „EIF4E3“ (^^)=224AS liegt in der Zeile Z.38367#_^2^08^16^, und zwar als „2“_08=QS=“8“_“16“ mit „2“_Summe 8+16=“24“ mit 2_24 für „EIF4E3“ (^^)=224AS [EIF4E - Eukaryotic translation initiation factor 4E - Homo sapiens (Human) | UniProtKB | UniProt].
3.5.) „eIF5-Komplex“ [„EIF5“; „eIF5A“ und „eIF5B“]: Das Protein (Mensch) „EIF5“ (vv)=431AS ist ein GTPase-aktivierendes Protein, das an aktivierte G-Proteine [Synonyme: GTP-bindendes Protein, GTPase, Guaninnukleotid-bindendes Protein] bindet, um das Signalereignis zu beenden. Speziell wird die „GTP-Hydrolyse“ durch „EIF2S3“ gefördert, indem „EIF5“ in Z.38367 das Wasser 28(Symbol) als „208“ zur Aktivierung besetzt. „EIF2S3“ (^^)=472AS wurde bereits ermittelt, und zwar in der Spalte Z.38367#_^93^[2020]x8xx1x[6]/#_[7]^33^4^x71x7xx1x[2]/#_[535141459] ermittelt in Z.38368 als „4“_“33“_absteigend 93 links für „39“ mit „4“_Summe 33+39=“72“ mit 4_72 für „EIF2S3“ (^^)=472AS. „GTP“ (xx)=268E endet neben der „EIF2S3“-Startzahl in Z.38367 Spalte 1/1 für „11“_aufsteigend Spalte 8/7=QS=“15“ mit Summe 11+15=“26“_71=“8“ mit 26_8 für „GTP“ (xx)=268E. Die Startcodon-Erkennung ist ein zeitlich befristeter Scan-Vorgang, bei dem „EIF5“ links an „EIF1“ und rechts an „EIF1B“ bindet. Wenn „EIF5B“statt „EIF5“ aktiv ist, kann es nur rechts an „EIF1B“ binden, weil es auf der „EIF1“-Position sitzt, dass dann dort nicht existent sein kann. „EIF5“ (vv)=431AS in Z.38368 als „3“_absteigend „20“_“20“ mit Summe 3+20+20=“43“_aufsteigend „1“ mit 43_1 für EIF5“ (vv)=431AS [EIF5 - Eukaryotic translation initiation factor 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das doppelte „Calcium“ wird nicht erkannt, weil es für einen „Arginin-Finger“ verwertet wird, und zwar in der Spalte „2020/3471“ als 47 links für „74“_absteigend 0_20 für „20“ mit Summe 74+20=“94“ für Arginin= C6H14N4O2=36+14+28+16=94E [Functional significance and mechanism of eIF5-promoted GTP hydrolysis in eukaryotic translation initiation - ScienceDirect; U. Maitra u.a.;ja, 2004; https://doi.org/10.1016/S0079-6603(01)70018-9].
„EIF5A“ enthält die ungewöhnliche Aminosäure „Hypusin“=C10H23N3Ø3=60+23+21+24=128E [Eukaryotic initiation factor - Wikipedia]. „Hypusin“ wird auf „eIF5A“ an einem spezifischen Lysinrest aus dem Polyamin „Spermidin“ durch zwei katalytische Schritte synthetisiert [EIF5A - Wikipedia (en-m-wikipedia-org.translate.goog)]. „Lysin"=C6H14N2O2=36+14+14+16=80E. „eIF5A“ ist zwar ein „Translations“-Initiationsfaktor, aber tatsächlich auch am Elongationsschritt der Proteinsynthese beteiligt. Beim Menschen wurden „2“ Isoformen von „eIF-5A“ beschrieben: „eIF5A-1“ und „eIF5A-2“. Sie werden von zwei verschiedenen Genen, „EIF5A“ und „EIF5A2“, kodiert [Hypusine – Wikipedia]. „eIF5A“ interagiert mit dem Elongatitionsfaktor „eEF2“ [eIF5A interacts functionally with eEF2 - PMC (nih.gov); C. Zanelli u.a; Aug 2011; u.a. DOI: 10.1007/S00726-011-0985-0]. „eEF-2“ wird zeitlich nach „eEF-1“ aktiv und bezieht ebenfalls Energie aus der Hydrolyse eines GTP [Elongationsfaktor - DocCheck Flexikon].
Das Protein (Mensch) „EIF5A“ (@@)=154AS liegt rechts von „EIF5“, dessen Position erst bei der „Hypusin“-Synthese besetzt wird, in der Spalte Z.38365#_[75645]/#_[88]@7@[88]/#_[20]@8@@1@[6]/#_717@1@@2@/#_[41459]/#_[30040], und zwar aufsteigend in Z.38366 Spalte 7/8=QS=“15“_aufsteigend Spalte 1/1=QS=“2“_“2“(Rand) mit „15“_Summe 2+2=“4“ mit 15_5 für „EIF5A“ (@@)=154AS. Die EIF5A-Ziffer „8“ in 20“8“ zählt anch links für Lysin=80E an dem die Modifikation erfolgt. Spermidin=C7H19N3=42+19+21=“82“. Die Ziffer „0“ gehört zur Spalte 8/0 für „80“, die links mit der Ziffer „2“ zu 80+2=Spermidin=82E summiert wird. Somit wird die Spalte Z.38365#“75“[6…]/#_“88“@7@[…]/#_“20“@“8“@[…] aktiviert, um „Hypusin“ („“)=128E zu synthetisieren, und zwar als 75=QS=“12“_aufsteigend „88“_aufsteigend „20“_“8“ mit Summe 12+88+20+8=“128“E [EIF5A - Eukaryotic translation initiation factor 5A-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF5A2“ (~~)=153AS liegt auf der Position von „EIF5A“ (@@), und zwar aufsteigend in Z.38367 Spalte 8/7=QS=“15“_12=QS=“3“ mit 15_3 für „EIF5A2“ (~~)=153AS. Bei diesem Zeilenversatz liegt die Startziffer nicht mehr im Einfluss auf „p53“ [EIF5A2 - Eukaryotic translation initiation factor 5A-2 - Homo sapiens (Human) | UniProtKB | UniProt].
3.6) Initiationsfaktor „EIF6“ bzw. „Integrin-Beta-4-Bindungsprotein (ITGB4BP)“: Die Evolution kann „Nichts“ darstellen. Der Mensch kann zwar einen Kamm als eine Reihe von Zinken beschreiben, aber die Negativform ist die angrenzende Luft – also „Nichts“. [Evolution can represent "nothingness". Humans can describe a comb as a series of teeth, but the negative form is the adjacent air - i.e. nothing.] Um das „Nichts“ zu beschreiben, muss der Kamm mit seinen Zinken dargestellt werden. „EIF6“ ist der Kamm, an dem seitlich das „Nichts“ positioniert ist, und zwar die Spalte „3/3/3“. „EIF6“ reagiert auf Insulin „INS“=110AS.
Die „Basallamina“ ist eine spezielle Proteinschicht in Epitelzellen, die im BiXnom-Code mit „333“ symbolisiert wird. „Hemidesmosomen“ sind Haftkomplexe, die die Basallamina mit dem intermediären Filamentzytoskelett verbinden. Die „Integrin-beta-4-Untereinheit (ITGB4)“ ist eine funktionelle Komponente von „Hemidesmosomen“. „EIF6“ interagiert mit „ITGB4“ sowie „FHL2“ und „GNB2L1 (RACK1)“ [EIF6 – Wikipedia]. „RACK1“ ist hier bekannt: Das Protein (Mensch) „RACK1“=317AS verbindet „PPP2R1A“ mit AKT1, und zwar in Z.38366 als „3“_07=QS=“7“_aufsteigend Spalte 8/2=QS=“10“ mit „3“_Summe 7+10=“17“ mit 3_17 für RACK1=317AS [RACK1 - Small ribosomal subunit protein RACK1 - Homo sapiens (Human) | UniProtKB | UniProt].
„Die zytoplasmatische Freisetzung von TIF6 aus 60S-Untereinheiten und die nukleäre Relokalisierung wird durch eine RACK1 (RACK1)-abhängige Proteinkinase-C-Aktivität gefördert.“ Bei „TIF6“ handelt es sich nicht um Hexafluorotitansäure“= H2[TiF6], sondern um den „Antiassoziationsfaktors Tif6“. „EIF6“ besitzt eine Anti-Assoziationsaktivität, so dass es sich offensichtlich um die Freisetzung von „EIF6“ selbst handelt [Die Anti-Assoziationsaktivität von eIF6 ist für die Ribosomenbiogenese, die Translationskontrolle und die Tumorprogression erforderlich - ScienceDirect]. „RACK1“ interagiert u.a. mit „Cyclin A1“. „Cyclin A1“ ist hier bekannt. Es ist eine große Ringform, die mit einem Spalt 0/4/1 von „EIF6“ getrennt ist. „RACK1“ muss sich in dieser Position seine Endziffer „2“ mit „Cyclin A1“ teilen.
„RACK1“ () bindet am Protein (Mensch) „PRKCB1“ (°°)=671AS in der Spalte Z.38366#_(3)(07)(8)[2…]/#_°3°°20°(2)[…]/#_°3°°34°°7°[…]/#_[3]°51°°4°[…]/#_[3703…]. Für die Calcium-Bindung ist das Calcium=20E zwar lesbar, weil es sich aber um „3“ Calcium-Ionen handelt, wird eine 60er-Spalte über die Position von „EIF6“ gezogen. „PRKCB1“ (°°) absteigend in Spalte 3/3=QS=“6“_“20“(Calcium)_aufsteigend „34“_aufsteigend 51=QS=“6“ mit „6“_Summe 20+34+6=“60“ (3-fach Ca)_absteigend Spalte 7/4=QS=“11“ mit „6“_Summe 60+11=“71“ mit 6_71 für „PRKCB1“ (°°)=671AS [PRKCB - Protein kinase C beta type - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „EIF6“ {}=245AS liegt mit Insulin „INS“ (||)=110AS, der „Basallamina“, dem „Nichts“ (!!!)=333(Symbol), und „RACK1“ () in der Spalte Z.38366#_(3)(07)(8)[8788]/#_!3!{2}[0](2)[0816]/#_!3!{3}[471712]/#_!3!{5}[141459]/#_{37}[030040], und zwar aufsteigend in Z.38367 Spalte 2/3/5 für „235“_aufsteigend 37=QS=“10“ mit Summe 235+10=“245“ für „EIF6“ {} =245AS. „EIF6“ steuert in Geweben, die auf „Insulin“ ansprechen, die Fettsäuresynthese und Glykolyse, indem es die Translationskontrolle von adipogenen Transkriptionsfaktoren ausübt.
[EIF6 - Eukaryotic translation initiation factor 6 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Insulin „INS“ (||)=110AS liegt zunächst ohne Reaktion seitlich an „EIF6“ {}, und zwar aufsteigend in Z.38369 Spalte 1/0/1 für „101“_“9“ mit Summe 101+9=“110“ für INS“ (||)=110AS. „EIF6“ {} nimmt das „Insulin“ auf und schiebt es durch die Basallamina, und zwar extern „91“_absteigend „0“_intern 37=QS=“10“_absteigend quer durch die mikroskopisch sichtbare Grenzschicht „Basallamina“ 3/3/3=“9“ mit Summe=91+0+10+9=“110“ für Insulin=110AS.
Das Protein (Mensch) „ITGB4“ (**)=1822AS bindet an „EIF6“ {} und besitzt Bindungsstellen für Calcium und Magnesium. Die Position wäre leicht zu erkennen, es handelt sich aber nicht um Cofaktoren, die seitlich einen Pfad weisen, sondern Mg=12E und Calcium=20E müssen zumindest mit einer Ziffer einbinden. „ITGB4“ ist ein „Biomarker“ bei Darmkrebs [ITGB4 als neuartiger Biomarker für die Serumdiagnostik und potenzielles therapeutisches Ziel für Darmkrebs - PMC (nih.gov); W. Yu u.a.; Okt 1921; DOI: 10.1002/cam4.4216]. Weil der Darm beim Menschen mit „Darm=808“ symbolisiert wird, startet „ITGB4“=1822AS in der Spalte 8/08 mit einem Darm-Bezug [Muskel-Schlauch „Speiseröhre“=505 (Symbol); Harntrakt=303 (Symbol); Eileiter=606; Luftröhre=202]. EIF6“ {} bindet real beide faserartigen Domänen, die doppelt als 1/1 für „11“ vorhanden wären. Diese müssen sich aber als 11=QS=“2“ verstecken, weil EIF6“ {} nur punktuell an der Ziffer „4“ links von 47=QS=11 bindet. Weil die 1. Spalte „1/1“=QS=2=“paarig“ folgt, ist die punktuelle Bindung ausreichend. ITGB4“ (**)=1822AS liegt in der Spalte, und zwar Z.38366#_(3)(07)(8)[8788]/#_!3!{2}[0](2)[0816]/#_!3!{3}[471712]/#_!3!{5}[141459]/#_{37}[030040], und zwar neben „RACK1“ aufsteigend in Z.38366 Spalte 8/0 =QS=“8“_“8“_aufsteigend Spalte 1/1=QS=“2“ mit Summe 8+8+2=“18“_aufsteigend Wende 45=QS=“9“_ absteigend Spalte 1/1=QS=“2“_47=QS=“11“ mit „18“_Summe 9+2+11=22 mit 18_22 für „ITGB4“ (**)=1822AS [ITGB4 - Integrin beta-4 - Homo sapiens (Human) | UniProtKB | UniProt].
„EIF6“ {} bindet das Protein (Mensch) „FHL2“ (©©)=279AS, wobei die Postition von „ITGB4“ (**) besetzt wird. „FHL2“ reguliert negativ den Transkriptionsrepressor „E4F1“ und kann beim Zellwachstum wirken, d.h. „E4F1“ wird von „FHL2“ hemmend besetzt.
Der Transkriptionsfaktor, das Protein (Mensch) „E4F1“ (€€)=784AS besitzt nur deshalb eine Zink-Bindung, weil die Startziffer „7“ das unlesbare Zink 788“7“=QS=Zink=30E von „p53“ besetzt. „E4F1“ (€€) liegt in der Spalte Z.38364#_[1405]/#_[5645]/#_[8]€7€88/#_[0]€8€€1€[6]/#_[17]€1€€2€, und zwar aufsteigend in Z.38366 Spalte 7/8 für „78“_aufsteigend Spalte 1/1=QS=11=QS=“2“_“2“ mit „78“_Summe 2+2=“4“ mit 78_4 für „E4F1“ (€€)=784AS [E4F1 - Transcription factor E4F1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Startposition von „FHL2“ (©©) wird ergänzend zu „E4F1“ (€€) vom Protein (Mensch) „PSEN2_Presenilin-2“ ($$)=448AS präzisiert, weil „FHL2“ den intrazellulären Signalweg mit „PSEN2“ verbindet. „PSEN2“ ($$) liegt in der Spalte Z.38364#_[1]$40$[5]/#_[56]$4$[5]/#_[8]€7€$8$[8]/#_[0]€8€€1€[6]/#_[17]€1€€2€, und zwar in Z.38364 als „40“_aufsteigend „4“ mit Summe 40+4=“44“_aufsteigend „8“ mit 44_8 für „PSEN2“ ($$)=448AS [PSEN2 - Presenilin-2 - Homo sapiens (Human) | UniProtKB | UniProt].
„FHL2“ (©©)=279AS bindet an „EIF6“ {} mit einem „Doppel-Zink-Finger-Motiv“ [FHL2 – Wikipedia]. Dieses Motiv ist erforderlich, weil ansonsten die Zink-Bindungszahl „03“0 nach links gezählt nur schwer als Zink=30E erkennbar wäre. Statt „03“ wird aufsteigend eine Summe „50“ als Bindung über „39137“ mit Summe 39+1+3+7=“50“ verwendet, die sich mit der EIF6-Endzahl 37=QS=“10“ mit 50+10=“60“ zu Doppel-Zink=2*30=60E summiert. In Zählrichtung ergibt die Fußpunkt-Summe 39137=QS=„23“. FHL2“ (©©)=279AS liegt in der Spalte Z.38367#_[320208]©1©[6]/#_[334717] ©1©©2©/#_[351414]©5©©9©/#_[3703]©00©©4©[0]/#_©39137©[438], und zwar aufsteigend in Z.38367 Spalte 1/1=QS=“2“_Rand-Aufweitung rechts/links Spalte 2/9=QS=11=QS=“2“_aufsteigend Spalte 5/4 für „54“_“00“_aufsteigend 39137=QS=„23“ mit „2“_Summe 2+54+00+23=“79“ mit 2_79 für „FHL2“ (©©)=279AS. „Reguliert negativ den Calcineurin/NFAT-Signalweg in Kardiomyozyten“. „Hemmt die transkriptionelle Aktivität von FOXO1 und seine apoptotische Funktion“. [FHL2 - Four and a half LIM domains protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Die katalytische Untereinheit „Calcineurin B“, Protein (Mensch) „PPP3CB_ Calmodulin-abhängige Calcineurin-A-Untereinheit Beta-Isoform“ („“)=524AS ist hier bekannt. „PPP3CB“ bindet an „FHL2“ (©©) in der Spalte Z.38369#_[3]“5““14“[ 14]©5©9©©/#_{3“7}03“[©00©4©[0], und zwar in Z.38369 als „5“_“14“_aufsteigend 703 („3“ aus Zink=“3“0E)=“10“ mit „5“_Summe 14+10=“24“ mit 5_24 für „PPP3CB“ („“)=524AS [PPP3CB - Serine/threonine-protein phosphatase 2B catalytic subunit beta isoform - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FOXO1“ („“)=655AS bindet hemmend in den Fußpunkt von „FHL2“ (©©) ein, und zwar in der Spalte Z.38369 #_[3]“5“14“[14]©5©9©©/#_{37}[0]“3“©00©4©[0]/#_©391“3“7©[438] absteigend in Z.39370 Spalte 3/3=QS=“6“_absteigend 14=QS=“5“_“5“ mit 6_55 für „FOXO1“ („“)=655AS [FOXO1 - Forkhead box protein O1 - Homo sapiens (Human) | UniProtKB | UniProt].
3.7.) „eIF1“-Familien „EIF1“ und „eIF1A“ [EIF1AX, EIF1AY]: „eIF1“ und „elF1A“ induzieren sie eine "offene" Konformation des mRNA-Bindungskanals. Die Dissoziation von eIF1 von der 40S-Untereinheit als ein wichtiger Schritt bei der Erkennung von Start-Codons. eIF1 bindet in der Nähe der ribosomalen P-Stelle und eIF1A in der Nähe der A-Stelle [Eukaryotic initiation factor - Wikipedia (en)].
Die Erkennung des Startcodons, AUG-Basentriplett aus Adenin=C5H5N5=30+5+35=70E, Uracil=C4H4N2O2=24+4+14+16=58E, Guanin=C5H5N5O=30+5+35+8=78E wird von „eIF1“ und „eIF1A“ unterstützt. „AUG“ codiert für die Aminosäure „Methionin“=80E. Die Zahl „70“ und Spalte 8/0 für „80“ werden bei einer „AUG“-„Methionin“-Komplexbildung nicht verwendet. Das AUG-Startcodon liegt in der Spalte Z.38366#_[130788788]/#_[932020]µ81µ[6]/#_[73]g34g71gµ71µa2a/#_[5]u35u14ua1a45a9a/#_[33703]a0a0a40a, und zwar „Adenin“ (aa) =70E aufsteigend in Z.38368 Randspalte 2/9=QS=“11“_45=QS=“9“_aufsteigend Spalte 1/0 für „10“_“0“_“40“(Randzahl) mit Summe 11+9+10+0+40=“70“ für „Adenin (aa) =70E; „Uracil“ (uu) =58E in Z.38369 über „3514“ als 14=QS=“5“_35=QS=“8“ mit 5_8 für „Uracil“ (uu) =58E; „Guanin“ (gg) =78E in Z.38368 über „3471“ als 34=QS=“7“_71=QS=“8“ mit 7_8 für „Guanin“ (gg) =78E. „Methionin“ kann extern vielfach gebunden werden. In die Lücke zu „TIA-1“ fügt sich Methionin in Z.38367 als Spalte „81/71“ mit „71“_absteigend 81=“9“ mit Summe 71+9=“80“ für „Methionin“ (µµ)=80E ein.
Das Protein (Mensch) „eIF1“ ($$)=113AS liegt in der Zeile Z.38369#_$3$5141$[459], und zwar als 5141=QS=“11“_links „3“ mit 11_3 für „eIF1“ ($$)=113AS [EIF1 - Eukaryotic translation initiation factor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
„eIF1A“ existiert in „2“ Isoformen „eIF1AX“/ „eIF1AY“. „eIF1AX“ interagiert mit „eIF5B“, bindet aber nicht an „eIF1“. Die Bindung ist mathematisch vorhanden, kann aber nicht realisiert werden, weil „eIF5B“ die „eIF1“-Bindungsstelle besetzt. „eIF1AX“ interagiert mit „Importin 13 (IPO13)“ [EIF1AX – Wikipedia]. Als Transport-Rezeptor greift „IOP13“ in das ringförmige „eIF1AX“ ein. Das Protein (Mensch) „IPO13“ (~~)=963AS liegt in der Spalte Z.38367#_[0]~81~6~/#_[17]~12~, und zwar als 81=QS=9_6_aufsteigend 12(Rand)=QS=“3“ mit 9_6_3 für „IPO13“=963AS [IPO13 – Importin-13 – Homo sapiens (Human) | UniProtKB | UniProt]. „eIF5B“ startet in der eIF1-Position, um in der Endziffer „0“(Null) die Methionin-Spalte 8/0 für 80E zu erreichen, „eIF5B“ bildet den 80S-Initiationskomplex mit der Initiator-Methionin-tRNA, die mit dem Startcodon gepaart ist“. Das Protein (Mensch) „eIF5B“ (°°)=1220AS liegt in der links neben „IPO13“ in der Spalte Z.38366#_[788788]/#_[0]°20°~81~6~/#_[4]°7°[17]~12~/#_[1]°4°°1°[459], und zwar in Z.38369 als „1“_absteigend Spalte 7/4=QS=11=QS=“2“_absteigend „20“ mit 1_2_20 für „eIF5B“ (°°)=1220AS [EIF5B - Eukaryotic translation initiation factor 5B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „eIF1AX“ (xx)=144AS liegt in der Spalte Z.38368#_[4]°7°[1]x7x~x1xx2x~#_[1]°4°°1°x4x[5]x9x/#_[030]x0x40x, und zwar in Z.38368 als „1“_aufsteigend Spalte 7/4/0=QS=11=QS=“2“_“40“_absteigend Spalte 2/9=QS=11=QS=“2“ mit „1“_Summe 2+40+2=44 mit 1_44 für „eIF1AX“ (xx)=144AS [EIF1AX - Eukaryotic translation initiation factor 1A, X-chromosomal - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „eIF1AY“ (yy)=144AS kann nicht vorgelagert zu „eIF1“ in „33“47““1“ für 144AS gelesen werden, weil „eIF5B“ durchzieht. Folglich dreht sich „eIF1AY“ (yy)=144AS im gleichen Ring wie „eIF1AX“ (xx), jedoch in Gegenrichtung. Dieses ist möglich, weil die Zahl „40“ in „040“ in beide Richtungen zählbar ist. „eIF1AY“ (yy)=144AS ist rechtsdrehend mit links „04“ für „40“. „eIF5B“ zwingt „eIF1A“ in die ringförmige Randlage [EIF1AY - Eukaryotic translation initiation factor 1A, Y-chromosomal - Homo sapiens (Human) | UniProtKB | UniProt]. „eIF1Y“ wird wie „eIF1X“ für die Bindung des 43S-Komplexes benötigt, der aus 40S-Untereinheit, eIF2/GTP/Met-tRNAi und eIF3 besteht. „eIF2“ ist ein Heterotrimer [EIF1AY – Wikipedia].
3.8) adipogene Transkriptionsfaktoren: Das Fettgewebe besteht aus „Adipozyten“, die in ein lockeres Fasergerüst eingebaut sind [Fettgewebe - DocCheck Flexikon]. Fettgewebe ist meist weißes Fettgewebe, braunes Fettgewebe ist nur an wenigen Stellen vorhanden. Zu den „adipogene Transkriptionsfaktoren“ gehören u.a. CEBPB“, „CEBPD“ und „ATF4“ sowie „Osr1“.
„Osr1“ (odd-skipped related 1)“: Die Präsenz von „6“ „Generellen Transkriptionsfaktoren (GTFs)“ ist am Promotor erforderlich, damit die „RNA-Polymerase II“ den „Core-Promotor“ (Sequenz auf dem Promotor) binden kann. Der Promotor reguliert die Expression eines Gens und liegt als Abschnitt auf der DNA. „Spezifische Transkriptionsfaktoren“ (Aktivatoren / Repressoren bezeichnet) kontrollieren u.a. die Effizienz und Geschwindigkeit die Initiation. Außer den 3 im Zusammenhang mit „EIF6“ bekannten „3“ Proteinen ist der Transkriptionsfaktor, das Zinkfinger-Protein „Osr1“ (odd-skipped related 1)=266AS als Regulator der Adipogenese bekannt, der u.a. auch der Entwicklung von Herz und Nieren dient. Es sind „3“ Zinkfingerdomänen [C2H2-type] vorhanden. „C2H2“ ist ein klassischer Typ. „Triple-C2H2“ bindet einen einzigen Liganden [Zinc finger C2H2-type (IPR013087) - InterPro entry - InterPro (ebi.ac.uk)].
Weißes Fettgewebe (WAT) speichert Energie in Form von Triacylglyceriden und braunes Fettgewebe (BAT) setzt Energie durch Wärmebildung frei. „Osr1“ wird in Fibro-adipogene Vorläuferzellen (FAPs) exprimiert. „FAPs“ sind ansässige mesenchymale Vorläuferzellen in der erwachsenen Skelettmuskulatur, die die Muskelreparatur unterstützen, aber auch als Reaktion auf Krankheiten und chronische Verletzungen zu fibröser und fetter Infiltration führen. [Odd skipped-related 1 (Osr1) identifiziert muskelinterstitielle fibro-adipogene Vorläuferzellen (FAPs), die durch akute Verletzungen aktiviert werden - PubMed (nih.gov);
Odd skipped-related 1 (Osr1) identifiziert muskelinterstitielle fibro-adipogene Vorläuferzellen (FAPs), die durch akute Verletzungen aktiviert werden - ScienceDirect; S. Sticker u.a.; Okt 2018; https://doi.org/10.1016/j.scr.2018.08.010 ].
„Tbx5“ und „Osr1“ interagieren, um die Progression des atrialen Vorläuferzellzyklus zu regulieren. Tbx5 und Osr1 interagieren, um das Fortschreiten des Zellzyklus des hinteren zweiten Herzfeldes für die Herzseptation zu regulieren - Journal of Molecular and Cellular Cardiology (jmcc-online.com); L. Xie u.a.; Mai 2015; DOI:https://doi.org/10.1016/j.yjmcc.2015.05.005
„Osr1“ interagiert mit „Osr2“. „OSR1“ verhindert die Aktivität des Wnt-Signalwegs, indem es die Expression von „SOX9“ und „Beta-Catenin“ unterdrückt [OSR1 – Wikipedia].
Das Protein (Mensch) „Osr1“ {}=266AS enthält für das Herz-Blut=26 und die Pumpfunktion als Flexibilität „66“. Folglich muss die Zeitbasis „60“ in der Zerlegung „2_6_60“ gezählt werden, wobei die „6“ für das Gewebe als 33=QS=6 zählt. Um das hier bekannte Beta-Catenin zu hemmen, muss der Zink-Startbereich nach rechts von Zink=30 auf „3-fach Zink“ „0307887“ mit dem speziellen Zink „7887“=QS=“30“ gedehnt werden, wobei die Spiegelung eine Dopplung ist. Die Startziffer „2“ verschiebt sich dadurch nach rechts in die Serin-Ziffer „56“ „Osr1“ {}=266AS liegt in der Spalte Z.38365#_[832977{56}4]/#_[41]{3}[07887}88]/#_[99]{320}[20816]/#_[57]{3}{34}[71712]/#_[15]{3}{51}[41459]/#_[77337030040], und zwar in Z.38365 als „56=QS=11=QS=2“_aufsteigend links 07887=QS=30=QS=“3“_links „3“_aufsteigend rechts 320=QS=“5“_aufsteigend links 34 für „43“_rechts 51=QS=“6“_absteigend links Spalte 3/3=QS=6 (verlängert Fettspalte) mit „2“_Summe 3+3+5+43+6+6=“66“ mit 2_66 für „Osr1“ {}=266AS [OSR1 - Protein odd-skipped-related 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Zur Interaktion bindet das Protein (Mensch) „Tbx5“=518AS links an „Osr1“ in der Spalte Z.38366#_41{3}{07887}[88]/#_99{320}[20816], und zwar in Z.38366 als 41=5_aufsteigend 99=QS=18 mit 5_18 für „Tbx5“=518AS. „DNA-bindendes Protein, das die Transkription mehrerer Gene reguliert und an der Herzentwicklung und der Bildung von Gliedmaßenmustern beteiligt ist [TBX5 - T-box transcription factor TBX5 - Homo sapiens (Human) | UniProtKB | UniProt]. „TBX5“ interagiert mit dem Protein (Mensch) „GATA4=442AS. Für die Zink-Bindung wird das direkt anliegende Zink von „Osr1“ besetzt. „GATA4“ kann „Osr1“ winkelförmig umgehend und zur 2.Zink-Position aufsteigend, und zwar über Spalte Z.38368#_“5“[7]{3}…/#_“1“5“{3}…/#_[7]“33“… aufsteigend Spalte 5/1=QS=“6“_“5“_aufsteigend mit Summe 5+6+33=“44“_7030(Zink=30)=QS=“10“_absteigend „1“ mit „44“_Summe 10+1=“11“=QS=“2“ mit 44_2 für GATA4=442AS [GATA4 - Transcription factor GATA-4 - Homo sapiens (Human) | UniProtKB | UniProt].
„Osr1“ muss hemmend auf der Position vom Transkriptionsfaktor, Protein (Mensch) „SOX9“=509AS, liegen, der an der Geschlechtsbestimmung beteiligt ist [SOX9 – Wikipedia]. Weil „SOX9“ an „Beta-Catenin“ bindet, wird die Lücke „Osr1“| 2/7=QS=“9“ | „Beta-Catenin“ von der SOX9-Endziffer „9“ gefüllt. Die SOX9-Interaktionspartner „MLL3/MLL4“ sind mit Zink-Bindungen beschäftigt, so dass „SOX9“ über „33“=männlich in eine Ringform gelenkt wird. „SOX9“ („“)=509AS liegt in der Spalte Z.38367#_[320]“2“[0816]/#_“33“4““7“[1712]/#_“35““14“[1459], und zwar in Z.38368 über links „334“ als „4“_33=QS=“6“_aufsteigend „35“_14=QS=“5“ mit Summe 4+6+35+5=“50“_absteigend Spalte 2/7=QS=“9“ mit 50_9 für „SOX9“ („“)=509AS [SOX9 - Transcription factor SOX-9 - Homo sapiens (Human) | UniProtKB | UniProt]. „SOX9“ interagiert mit dem Protein (Mensch) „MED12“=2177AS. „MED12“ bindet winkelförmig rechts als Spalten-Summe „21“ an „Beta-Catenin“ und aufsteigend mit „77“ quer an „SOX9“ , und zwar aufsteigend in Z.38365 Spalte 4/8/1/1=QS=“14“_links „7“ mit Summe 14+7=“21“_aufsteigend Spalte „4/0“ für „40“_“0“_03 links für „30“_“7“ mit 21_Summe 40+0+30+7=“77“ mit 21_77 für „MED12“=2177AS [MED12 - Mediator of RNA polymerase II transcription subunit 12 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CEBPB“ (bb)=345AS müsste von „EIF6“ auf maximaler Strecke regulierend besetzt werden. Weil aber „CEBPB“ und „CEBPD“ ein Heterodimer bilden, liegt nur die „CEBPB“–Startziffer „3“ in der „EIF6“–Spalte 2/“3“/5/7. „CEBPD“ liegt auf „EIF6“, umgeht aber die „EIF6“-Spalten-Ziffer „3“ mit einer Schleife durch die seitliche Basallamina (!!) „3/3/3“. „CEBPB“ (bb)=345AS liegt mit „EIF6“ {} in der Spalte Z.38367#_[3]{2}[020816]/ [3]b{3}b47bb1b[712]/[3]{5}b14bb1bz45z[9]/#_{37}z0300z[40], und zwar in Z.38368 als „3“_47=QS=11=QS=“2“_aufsteigend Spalte 1/1=QS=“2“ mit 3_Summe 2+2=“4“_14=QS=“5“ mit 3_4_5 für „CEBPB“=345AS [CEBPB - CCAAT/enhancer-binding protein beta - Homo sapiens (Human) | UniProtKB | UniProt]. „CEBPB“ (bb) bindet am Zinkfinger-Protein (Mensch) „Zif268_EGR1“ (zz)=543AS, und zwar in Z.38369 als 45 links für „54“_aufsteigend 030(Zink)0=QS=“3“ mit 54_3 für „EGR1“ (zz)=543AS [EGR1 - Early growth response protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CEBPD“ (dd)=269AS liegt mit „EIF6“ {} in der Spalte Z.38367#_[3]{2}[020816]/ [3]b{3}b47bb1b[712]/[3]{5}b14bb1bz45z[9]/#_{37}z0300z[40], und zwar in Z.38367 als „2“_aufsteigend Spalte 3/3/3=QS=“9“_ aufsteigend Spalte 5/7 für „57“_“3“ mit 2_Summe 9+57+3=“69“ mit 2_69 für„CEBPD“ (dd)=269AS. „Transkriptionsaktivator, der die IL6-Transkription allein und als Heterodimer mit CEBPB verbessert“[CEBPD - CCAAT/enhancer-binding protein delta - Homo sapiens (Human) | UniProtKB | UniProt]. „CEBPD“ hat nach der Startziffer „2“_ der Basallamina 3/3/3 und der Endziffer „3“ die Spalte 3/3/3/3=“12“ mit 2_12, die Transkription vom Protein (Mensch) „IL6“=212AS gefördert [IL6 - Interleukin-6 - Homo sapiens (Human) | UniProtKB | UniProt]. „Die Anti-Tumor-Wirkung von C/EBPδ wird oft durch seine tumorfördernden Aktivitäten außer Kraft gesetzt“. „C/EBPδ“=“CEBPD“ interagiert mit „ATF4 (CREB2)“ und bindet tatsächlich an „ATF5“ [Die Doppelrolle von C/EBPδ bei Krebs - ScienceDirect; L.Hartl u.a.; Mai 2023; https://doi.org/10.1016/j.critrevonc.2023.103983].
Das Protein (Mensch) „ATF5“ (@@)=282AS wirkt als Cofaktor von „CEBPB“, um „CEBPA“ zu aktivieren. Das Protein (Mensch) „CEBPA“ (aa)=358AS gehört zur Familie und kann links mit „CEBPD“ (dd) ein Heterodimer bilden, und zwar in der Spalte Z.38369#a1aa5ad3dd5da1a4a1a@45@[9]/#_a@7aa3@ad3dd7d[0]@3@00@[40]/#_[3]@1@39@1@@3@[7438] über Spalte 15/73 als „3“_absteigend „5“_aufsteigend Spalte 1/7=“8“ mit 3_5_8 für „CEBPA“ (aa)=358AS [CEBPA - CCAAT/enhancer-binding protein alpha - Homo sapiens (Human) | UniProtKB | UniProt]. „CEBPB“ (bb) bildet rechts ein Heterodimer mit „CEBPD“ (dd). „ATF5“ verbindet linke und rechte Seite und muss bei dieser Passage an „CEBPD“ (dd) binden. Zur Aktivierung besetzt „ATF5“ links die „CEBPA“-Zahl „73“. „ATF5“ (@@)=282AS in Z.38370 als 73(aus CEBPA)=QS=“10“_aufsteigend „1“ mit Summe 10+1=11=QS=“2“_“39“_“1“_absteigend Spalte 3/3 für „33“_00=QS=“0“_absteigend rechts von CEBPB“ (bb) als 45=QS=“9“ mit „2“_Summe 39+1+33+0+9=“82“ mit 2_82 für ATF5“ (@@)=282AS. Statt für cAMP= C10H12N5O6P=170E auf die lesbare Zahl „70" abzuzielen, wird intern über 313=QS=“7“_“91“_“3“ mit Summe 7+91+3=“100“ die Zahl „100“ summiert und extern aufsteigend die Spalte 0/7 für „70“ ergänzt als 100+70=cAMP=170E [ATF5 - Cyclic AMP-dependent transcription factor ATF-5 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ATF4“=351AS ist in Z. 38369 lesbar und kreuzt bei der Interaktion „EIF6“ {}, das zugleich „CEBPD“ (dd) besetzt. Die „ATF4“-Startziffer „3“, „5“ und Endziffer „1“ gehören zu „cAMP“, und zwar als „3“_ 5/7 für „57“_aufsteigend „9“_absteigend Spalte 1/0/1 für „101“ mit Summe 3+57+9+101=cAMP=“170“E [ATF4 - Cyclic AMP-dependent transcription factor ATF-4 - Homo sapiens (Human) | UniProtKB | UniProt]._dat25.07.24
4. „Generelle (allgemeine) Transkriptionsfaktoren (GTFs)“ [TF-IIA, -IIB, -IID, -IIE, -IIF, -IIH)]:
Zu den „GTFs“ gehören „6“ Komplexe „TF-IIA, TF-IIB, TF-IID, TF-IIE, TF-IIF, TF-IIH“ [General transcription factor - Wikipedia]. „TF-IIG“ und „TF-IIJ“ sind ebenfalls mit dem Gesamtkomplex verbunden [TFII - Oxford-Referenz (oxfordreference.com)]. Es existiert „TF-II i“ [GTF2I - General transcription factor II-I - Homo sapiens (Human) | UniProtKB | UniProt].
TATA-Box: Von den insgesamt ca. „70“ Proteinen bindet zuerst „TF-IID“ an die „DNA“. Der Komplex „TF-IID“ enthält das TATA-Binde-Protein (TBP), welches die „TATA-Box“ erkennt, sowie viele „TBP-assoziierte Faktoren (TAFs)“, welche TATA-lose Promoter erkennen. „TF-IIA“ bindet an den Promoter, wodurch „TFIID“ stabilisiert wird. Zwecks Bindung der Polymerase assoziiert „TF-IIB“. Der „TF-IIF“ führt die Polymerase II zum Promoter. Ergänzend folgt „TF-IIE“, um das Andocken von „TF-IIH“ zu ermöglichen [Transkriptionsinitiation (bionity.com)].
Die „RNA-Polymerase II“ transkribiert die mRNA-kodierenden Gene und die Mehrheit der Gene der kleinen nukleären RNA (snRNA) [Die allgemeinen Transkriptionsfaktoren IIA, IIB, IIF und IIE sind für die RNA-Polymerase-II-Transkription aus dem humanen U1-Promotor für kleine nukleäre RNA - PMC erforderlich (nih.gov); T.Kuhlman u.a. Mai 1999; doi: 10.1128/mcb.19.3.2130
Die Zellzyklus-Spalte „30/32“ wird dem Bereich der „TATA-Box“ zugeordnet. Die „TATA-Box“ wird durch die Sequenz „5' - T A T A (A/T) A (A/T) - 3' gekennzeichnet, die „2“ Nukleobasen „Thymin (T)“=C5H6N2O2=30+6+14+16=66E und „Adenin(A)“=C5H5N5=30+5+35=70E enthält. „Diese DNA-Sequenz befindet sich „30“ Basenpaare (bp) stromaufwärts der Transkriptionsstartstelle in Genpromotoren [TATA-binding protein - Wikipedia]. Die Zahl „30“ in der Zellzyklus-Spalte ist die „TATA-Box“ mit „30“bp, die vom lesbaren (1.)Zink=30E repräsentiert wird.
Die Zink-Position der „TATA-BOX“ dehnt sich durch das angehängte, unlesbare Zink [30]“7887“=QS=“30“, so dass „TBP“ in einem TF-IID-Subkomplex, bei der Hefe mit Taf1, Taf2, Taf7, flexibel ist, und sich die anderen TAFs entsprechend formieren müssen. Einige TAFs können aufgrund ihrer „histone fold domain“ (HFD) Heterodimere bilden, bei der Hefe: Taf3-Taf10, Taf4-Taf12, Taf6-Taf9, Taf8-Taf10 und Taf11-Taf13. Der „TF-IID-Komplex“ verteilt sich räumlich auf „3“ Lappen (Lobe A, B, C). Weil sich die Dimere nochmals verdoppeln können, ist „Taf10“ vierfach vorhanden. „In höheren Eukaryoten gibt es mehrere TFIID-Varianten mit unterschiedlicher Zusammensetzung“ [„Interaktionen zwischen Transkriptionsaktivatoren und Coaktivatoren sowie Corepressoren in der Hefe Saccharomyces cerevisiae“; Jan. 2021; Doktorarbeit_MaikeEngelhardt.pdf (uni-greifswald.de) ; Bezug auf: „Hahn, S., Young, E. T. (2011) Transcriptional regulation in Saccharomyces cerevisiae: transcription factor regulation and function, mechanisms of initiation, and roles of activators and coactivators. Genetics, 189: 705-736“].
Der „TF-IID-Komplex“ erhält im BiXnom-Code für jedes „Taf“ eine feste Position mit passenden Interaktionen. Dieses wird abweichend von der Realität dadurch erreicht, dass statt dem singulären vertikalen „TBP“ (Original) für die Verbiegung der TATA-Box eine seitlich horizontale „TBP-Biege-Position (Duplikat)“ angeordnet wird. Theoretisch kann sich „TBP“ nach rechts verschieben, indem es ein Dimer bildet. Weil TBP-Dimere nicht an der „DNA“ binden können, muss das Dimer zum Monomer dissoziieren. Dieses entspricht hier dem fiktiven, horizontalen „TBP-Duplikat“ [Dimerisierung des TATA-Bindungsproteins - ScienceDirect
Dimerization of the TATA Binding Protein - ScienceDirect; F. Pugh u.a.; Jun 1995; https://doi.org/10.1074/jbc.270.23.13842] / [Struktur des humanen TFIID und Mechanismus der TBP-Beladung auf Promotor-DNA - PMC (nih.gov); P.Patel u.a.; Dez. 2018; doi: 10.1126/science.aau8872].
Das Dimer „TBP(Original)-TPB(Duplikat)“ ist die natürliche Ausgangsbasis vor der DNA-Bindung. Das horizontale TBP (Duplikat) dient als „Kleiderstange“, an der aufsteigend „TAF10“, „TAF11“ und „TAF13“ hängen. „TAF15“ bindet diese „3“ TAFs in einer Auffangwanne. Die Zink-Bindung von „TAF15“ ist weder das 1. lesbare Zink, noch die seitliche unsichtbare 80°-Biege-Verlängerung „7887“=QS=30, sondern aufsteigend das 2. lesbare Zink. „TAF15“ spielt eine Vermittlerrolle zwischen beiden „TBPs“: Es bindet links am „vertikalen TBP“ und nimmt rechts die „3“ TAFs vom „horizontalen TBP“(Duplikat) in der „Zink-Wanne“ auf. „Nach Bindung von „TF-IID“ an der „DNA“ verbiegt sich die TATA-Box um den Winkel „80°“, damit „TF-IIA“ binden kann“ [Transkriptionsfaktor IID – Wikipedia (de)]. Dieses kann hier so nicht nachgebildet werden. Vielmehr enthält „TAF1“ am rechten Rand die Zahl „80“ für den Biegewinkel. Weil aber „TF-IIA1“ links am „vertikalen TPB“ bindet, muss sich rechts ein „TF-IIA1(GTF2A1)“-Duplikat formieren.
Das Protein (Mensch) „TAF1“ (**) =1893AS ist das größte TAF-Protein. Cofaktor ist „Magnesium=12E“; es wurden aber auch „2“ DNA-Bindestellen an „Zink“ festgestellt. Weil „TAF1“ mit „p53“ interagiert, muss es am rechten Rand liegen, weil das versteckte Zink [30]“7887“=QS=Zink=30E gespiegelt doppelt zählt. Das versteckte Zink wird als Zink erkannt, weil es das lesbare Zink erweitert. In diesem Sinne kann sich auch die TATA-BOX=“30“ verschieben [Zinc knuckle of TAF1 is a DNA binding module critical for TFIID promoter occupancy | Scientific Reports (nature.com); N. Zheng; März 2018; https://doi.org/10.1038/s41598-018-22879-5]. Grundsätzlich muss das „ATP“ aufgrund des Mg-Cofaktors aus der klassischen ATP-Randspalte „12/59“ gewonnen werden. Zwecks Dominanz erfolgt eine Einzelzählung in der Spalte Z.38366#_*8**788*/#_*0*[81]*6*/#_[171]*2*/#_ [145]*9*, und zwar absteigend in Z.38367 Spalte 6/2/9 für „926“_absteigend 788 links für „887“_aufssteigend Spalte 8/0 für „80“ mit Summe 926+887+80=“1893“ für „TAF1“ (**) =1893AS [WOW! Linda Ronstadt - Just One Look (Live) - YouTube]. „TAF1“ enthält „2“ Brom-Domänen, die doppelt als 2 * Brom=35E“ mit „70“E am rechten Rand in der Spalte 8/6/2 mit Summe 8+62=“70“E vorhanden sind. „TAF1 bildet zusammen mit TAF7 und TAF2 einen Promotor-DNA-bindenden Subkomplex von TF-IID“. „TAF1“ phosphoryliert „GTF2A1“ und „GTF2F1“ [TAF1 - Transcription initiation factor TFIID subunit 1 – Homo sapiens (Human) | UniProtKB | UniProt].
Die Bindung von „TAF1“ an „GTF2F1“ über die Spalte „71/41“ ist als Überlagerung von „TAF2/TAF7“ vorhanden. Zur TAF1-Bindung an „GTF2A1“ entsteht zusätzlich zum linken „GTF2A1“ ein rechtes Duplikat „GTF2A1“ (%%)=376AS (Duplikat) winkelförmig in der Spalte Z.38370#_[300]!4!%0%/#_%374%3%8%, und zwar in Z.38371 als „374“_“3“_absteigend Spalte 0(bindet an TAF1)/8=QS=“8“ mit „374“_Summe 3+8=11=QS=“2“ mit Summe 374+2=“376“ für „GTF2A1“=376AS (Duplikat) [WOW! Willie Nelson & Shania Twain - Blue eyes crying in the rain (youtube.com)].
Die Zahl 38=QS=“11“ summiert mit der externen Ziffer !4! ergibt Phosphor=15E [GTF2A1 - Transcription initiation factor IIA subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „TAF1“ interagiert mit der „Casein-Kinase II „CSNK2A1“ über eine Lücke 7/8=QS=Phosphor=15E, so dass „TAF1“ nicht direkt an der Kinase, sondern an dem angekoppelten „Casein“ bindet, das die Lücke füllt.
Im Komplex „TAF1-TAF2-TAF7“ ist eine gegenseitige Kopplung vorhanden. Das Protein (Mensch) „TAF7“ {}=349AS besitzt mit der Funktion „Spermientransport“ einen männlichen „33“er-Bezug, und zwar in Z.38368#_{334}{717}(1)*2* als „334“_717=QS=“15“ mit Summe 334+15=“349“ für „TAF7“ {}=349AS [TAF7 - Transcription initiation factor TFIID subunit 7 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TAF2“ ()=1199AS klemmt sich mit der Spaltzahl „11“ in den freien Spalt „1/1“ in der Spalte Z.38367#_[3202]*0*[8}(1)*6*/#_[7]{334}{717}(1)*2*/#_[35](14)(1)[4](5)*9*/#_[37](03)(00)!(4)!%0%/#_[391]%374%3%%8%, und zwar aufsteigend in Z.38367 Spalte 1/1 für „11“_aufsteigend Spalte 5/4 für „54“_links 00=QS=“0“_03 links für „30“_absteigend „14“_“1“ mit „11“_Summe 54+0+30+15=“99“ mit 11_99 für „TAF2“ ()=1199AS [TAF2 - Transcription initiation factor TFIID subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt].
TATA-Binde-Protein (TBP): „TBP“ gehört zum Komplex „TF-IID“, dessen Proteine sich auf „3“ Lappen (A, B, C) verteilen und mehrfach vorhanden sein können. Im Unterschied zu einem „Modul“ ist der „Lappen“ (Lobus) nur ein Entwicklungsraum, dessen Inhalt nicht eindeutig ist. „TBP“ ist mit den „3“ Lappen verbunden. Bei den „TBP-Interaktionen“ mit „TAF1“ bis „TAF13“ fehlen nur „TAF8“ und „TAF12“. Die „3“ Lappen könnten als „Module A, B, C“ bezeichnet werden, wenn eine komplette Inhaltsliste vorläge – das ist aber zurzeit nicht Fall [TATA-bindendes Protein – Wikipedia]. „TBP“ bildet zwar mit „TAF3“ und „TAF5“ das Modul „TFIID-A“, aber „TAF5“ gehört zusammen mit „TAF8“ auch zum Modul „TFIID-B“.
Das vertikale Protein (Mensch) „TBP“ {}=339AS (Monomer/Original) liegt aufsteigend an der TATA-Box !30! in der Spalte Z.38366#_[10941]!30![7…]/#_[10899]{3}[20…]/#_[10857]{3}[34…]/#_[108]{153}[51...], und zwar aufsteigend in Z.38367 Spalte 3/3 für „33“_links 153=QS=“9“ mit 33_9 für „TBP“ (!!)=339AS (Monomer). Das Zink=30E dient somit zugleich für den Abstand von 30bp. [TBP - TATA-box-binding protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF3“ ()=929AS zieht mit einer Zink-Bindung durch die Position der „TATA-Box“ und ist damit an „TBP“ {} gebunden. „TAF3“ () liegt in der Spalte Z.38365#_[10983](29)[7…]/#_[10941]!(30)![7…]/#_[10899]{3}(20)[…]/#_[10857]{3}[3](4)…]/#_[108]{153}[51...], und zwar absteigend in Z.38367 Spalte 0/4 für „40“_absteigend 0/2 für „20“_absteigend 2/3 für 32 mit Summe 40+20+32=92_9 oder „alternativ“ in Gegenrichtung in Z.38368 als 29 links für „92“_aufsteigend 30=QS=“3“_aufsteigend 20=QS=“2“_aufsteigend 4 mit 92_Summe 3+2+4=“9“ mit 92_9 für „TAF3“ ()=929AS. „Der TAF3-TBPL2-Komplex ersetzt TFIID an bestimmten Promotoren in einem frühen Stadium des Differenzierungsprozesses“ [TAF3 - Transcription initiation factor TFIID subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TBPL2“=342AS muss auf der Position von „TBP“ liegen und die TPB-Spalte 3/3/3 für „333“ besetzen, und zwar aufsteigend in Z.38367 Spalte [9]“3“/“7““3“/“5““3“/“33“ über Spalte 3/3/3 für „333“_33=QS=“6“_absteigend „5“ mit „333“_Summe 6+5=11=QS=“2“_absteigend „7“ mit Summe 333+2+7=“342“ für „TBPL2“=342AS. Zur Aufnahme der Endziffer „7“ ist eine Interaktion mit „TFIIA“ erforderlich, um sich die Ziffer „7“ zu teilen [TBPL2/TFIIA complex establishes the maternal transcriptome by an oocyte-specific promoter usage (biorxiv.org); TBPL2 - TATA box-binding protein-like 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF5“ (||)=800AS liegt winkelförmig rechts an „TBP“ in der Spalte Z.38365#_[10983](29)[7…]/#_[10941]!(30)![7…]/#_[10899]{3}(20)[…]/#_[10857]{3}|3|(4)…]/#_[108]{153}|5|[1...]/#_[10]|77|33||7|[0…], und zwar in Z.38370 als 77=QS=“14“_“33“_absteigend in Z.38368 Spalte 3/5/7 für „753“ mit Summe 14+33+753=“800“ für „TAF5“ ()=800AS [TAF5 - Transcription initiation factor TFIID subunit 5 - Homo sapiens (Human) | UniProtKB | UniProt].
„TF-IID“-Teilkomplex: „TBP“ (Duplikat), TAF8/TAF10, TAF11, TAF13 und TAF15:
„TAF8“ ist zur Integration von „TAF10“ notwendig, und liegt somit zeitlich vorgelagert auf der TAF10-Position. Weil „TAF8“ auch die TAF15-Endzahl blockiert, muss vor dem Erscheinen von „TAF15“ zuerst „TAF10“ an „TBP“ binden, damit dann ungestört „TAF15“ an „TAF10“ bindet.
Das Protein (Mensch) „TBP“ (horizontales Duplikat) (;;)=339AS liegt in der Spalte Z.38366#_[41];307;[88788]/#_[993];20;208;;1;[6]/#_[57334717];1;[2], und zwar in Z.39366 als „307“_aufsteigend „20“_208=QS=“10“_aufsteigend Spalte 1/1=QS=“2“ mit „307“_Summe 20+10+2=“32“ mit Summe 307+32=339 für 339AS [TBP - TATA-box-binding protein - Homo sapiens (Human) | UniProtKB | UniProt]. [WOW! Willie Nelson / On The Road Again - YouTube].
Das Protein (Mensch) „TAF8“ („“)=310AS liegt in der Spalte Z.38368#_;1;“2“/#_“5““9“/#_“4““0“/#_“38“, und zwar aufsteigend in der Randspalte 2/9/0 für „290“_ aufsteigend 38=QS=“11“_absteigend Spalte 5/4=QS=“9“_ mit Summe 290+11+9=“310“ für „TAF8“ („“)=310AS [TAF8 - Transcription initiation factor TFIID subunit 8 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TAF10“ ()=218AS verdrängt „TAF8“ in der Spalte Z.38368#_;1;(2)/#_(5)(9)/#_(4)[0]/_[38], und zwar in Z.38368 als „2“_aufsteigend „9“_links Spalte 5/4=“9“ mit „2“ Summe 9+9=“18“ mit 2_18 für TAF10“ ()=218AS [TAF10 - Transcription initiation factor TFIID subunit 10 - Homo sapiens (Human) | UniProtKB | UniProt]. Wissenschaftlich agieren TAF8/TAF10 zeitgleich [Überlagerung als Falte]: „Strukturstudien zeigten, dass „TAF8“ ein Histonfaltenpaar mit „TAF10“ im Lappen B […Modul B] bildet und an der Verbindung von Lappen B mit Lappen C […Modul C] beteiligt ist. …“TAF8“ interagiert mit „TAF2“ im Lappen C [TAF8-Regionen, die für die B-Assemblierung des TFIID-Lappens oder für TAF2-Interaktionen wichtig sind, sind für das Überleben embryonaler Stammzellen erforderlich - Journal of Biological Chemistry (jbc.org); L.Tora u.a.; Nov.2021; DOI:https://doi.org/10.1016/j.jbc.2021.101288].
Das Protein (Mensch) „TAF11“ (§§)=211AS liegt mit dem vertikalen TBP {} (Original) und dem gekoppelten horizontalen TBP (;;) (Duplikat) in der Spalte Z.38366#_[41];307;[88788]/#_[99]{3};20;208;;1;[6]/#_[57]{3}[347]§1§§7§;1;(2)/#_{153}[514]§1§§4§(5)(9), und zwar in Z.38368 über Spalte 17/14 aufsteigend Spalte 1/1 =QS=“2“_absteigend Spalte 7/4=QS=“11“ mit 2_11 für „TAF11“ (§§)=211AS. Ein geschlechtlicher Bezug ist nur als Pärchen-Dopplung von 2 Zählgrößen „11“ enthalten. „Vitamin-D-Rezeptor-Binding“ [TAF11 - Transcription initiation factor TFIID subunit 11 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Vitamin D3 (Calciol)=C27H44O=162+44+8=214E wird am rechten Rand aus der modifizierten klassischen ATP-Spalte „[1]2/59“ aufgenommen, so dass das Sonnenlicht in verwertbare Energie gewandelt wird, und zwar als „2“_59=QS=“14“ mit 2_14 für D3=214E. Es folgt das Protein (Mensch) „VDR_Vitamin-D-Rezeptor“=427AS mit einer Bindung am 2. lesbaren Zink in Z.38370 als Randzahl „0“_links 004 für „400“_neben „TAF11“ absteigend Spalte 4/3=“7“_Ring absteigend 347=QS=“14“_aufsteigend 51=QS=“6“ mit Summe 0+400+7+14+6=“427“ für VDR=427AS [VDR - Vitamin D3 receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF13“ (€€)=124AS bindet am „TBP“ (Duplikat) und rechts an „TAF11“ und wird zentral eingeschlossen in der Spalte Z.38367#_[34]€7€[…]/#_[51]€4€[…]/#_€7€€0€€3€[…]/#_[9]€1€€3€[…], und zwar aufsteigend in Z.38368 Spalte 7/4 für 74_aufsteigend Spalte 3/3 für 33_absteigend Spalte 0/1 für „10“_links „7“ mit Summe 74+33+10+7=124AS. Eine Interaktion von „TAF13“ mit „TAF10“ ist nicht möglich, solange „TAF15“ eine Trennung verursacht, um sich in einer Kerbe „[3]“00“ das (2.) Zink zu sichern. Ohne „TAF15“ kann „TAF10“ seine Endziffer um „00“ verlängern, um an „TAF13“ zu binden [TAF13 - Transcription initiation factor TFIID subunit 13 - Homo sapiens (Human) | UniProtKB | UniProt].
Die „Zink-Wanne“, das Protein (Mensch) „TAF15“ ($$)=124AS liegt in der Spalte Z.38370#_$73$$3$€7€0€3€$0$$0$(4)[0]/#_[31]$3$$9$€1€3€$7$$4$$38$/#_[894]$1$$463$[636], und zwar mit Bindung an vertikales TBP (Original) folgend in Z.38370 als 73=QS=“10“_aufsteigend Spalte 3/3 für „33“_aufsteigend Spalte 9/1 für „10“_“463“(Wannenboden)_aufsteigend in Zink-Kerbe Spalte [3]0/7 für „70“_absteigend 0/4=QS=“4“_38 (Rand)=QS=11=QS=“2“ mit Summe 10+33+10+463+70+4+2=“592“ für „TAF15“ ($$)=124AS [TAF15 - TATA-binding protein-associated factor 2N - Homo sapiens (Human) | UniProtKB | UniProt].
„TF-IID“-Sonstige TAFs [TAF4, TAF5L, TAF6, TAF6L, TAF 9, TAF9b, TAF12]:
Der Aktivator, das Protein (Mensch) „SPT3-Homolog“ (!!)=317AS interagiert mit TAF4, TAF5L, TAF6L, TAF9, TAF10, TAF12 [Transkriptionsinitiierungsprotein SPT3 Homolog – Wikipedia]. Das horizontale TBP (Duplikat) existiert nicht, weil „SPT3“ nicht an „TBP“ bindet. Folglich besetzt „SPT3“ die zentrale Position von TAF11/TAF13 in der Spalte Z.38368#_!7!!1![712]/#_!4!!1!!4![59]/#_!300![40], und zwar in Z.38369 über „414“ von links nach rechts als „4“_absteigend Spalte 1/1=QS=“2“_aufsteigend Spalte 7/4=QS=“11“ mit Summe 4+2+11=“17“_aufsteigend „300“ mit Summe 17+300=“317“ für „SPT3“ (!!)=317AS [SUPT3H - Transcription initiation protein SPT3 homolog - Homo sapiens (Human) | UniProtKB | UniProt]. „SPT3“, „TRRAP“ und „TAF9“ binden sich gegenseitig als Komplex.
Die TRRAP-Startzahl „10“ wird aufsteigend aus der Spalte „1“/“0“/1 entnommen, um eine notwendige Bindung an „TAF9“ zu erreichen. „TAF12“ kann diese Spalte „1/0“ erst besetzen, wenn „TRRAP“ fehlt [oder, ohne TAF9-Kopplung, mit der Startzahl absteigend „9/1“=QS=“10“]. Die Wirkung auf „p53“ erfolgt nur indirekt im Komplex mit „TAF9“.
Das Protein (Mensch) „TRRAP“ {}=3859AS bindet an „SPT3“ in der Spalte Z.38369#_[5]{1}!4!!1!!4![59]/#_[7]{0}!300![40]/#_[9]{1}{3743}{8}/#_[1]{46}[3]{63}{6}, und zwar mit an „TAF9“ aufsteigend in Z.38369 Spalte 1/0/1 für Summe 10+1=“11“_aufsteigend 46=QS=“10“_absteigend „3743“_ Randspalte 8/6 für 86_links 36=QS=“9“ mit Summe 11+10+3743+86+9=“3859“ für „TRRAP“ {}=3859AS [TRRAP - Transformation/transcription domain-associated protein - Homo sapiens (Human) | UniProtKB | UniProt]. „TAF9“ ergänzt den „SPT3-TRRAP-TAF9-Komplex“ mit Bindungen links am vertikalen „TBP“ (Original) und rechts von „TAF10“, das den rechten Rand besetzt. Die Bindung an „p53“ an dessen unlesbarer Zink-Position ist vorhanden. „TBP“ (Duplikat) fehlt, so dass „p53“ erreicht wird.
Das Protein (Mensch) „TAF9 (^^)=264AS liegt in der Spalte Z.38367#_^2^^0^^208^^1^[6]/#_^3^^4^!7!1![7]^1^[2]#_[5]{1}!4!!1!!4![59]/#_[7]{0}!300![40]/#_[9]{1}{3743}{8}/#_[1]{46}[3]{63}{6}, und zwar aufsteigend in Z.38367 Spalte 2/3=QS=“5“_absteigend Spalte 0/4 für „40“_“208“_aufsteigend Spalte 1/1 für „11“ mit Summe 5+40+208+11=“264“ für „TAF9“ (^^)=264AS [TAF9 - Transcription initiation factor TFIID subunit 9 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF9b“ (µµ)=251AS reagiert in vitro („im Glas“) genau wie „TAF9“, weil es lediglich in Gegenrichtung zählt. Hierzu startet „TAF9b“ aus einem Loch (Kerbe) neben „SPT3“. Weil dieses Loch speziell durch „TAF6L“ verstopft wird, ist eine Reihenfolge notwendig [TAF9b (ehemals TAF9L) ist ein echtes TAF, das einzigartige und sich überschneidende Rollen mit TAF9 hat: Molecular and Cellular Biology: Vol 25 , No 11 - Get Access (tandfonline.com); M. Frontini u.a.; Feb 2005; https://doi.org/10.1128/MCB.25.11.4638-4649.2005].
„TAF9b“ (µµ) liegt in der Spalte Z.38366#_32020816/#_3471712, und zwar absteigend in Z.38367 Spalte 8/7=QS=“15“_“0“_“202“_“34“ mit Summe 15+0+202+34=“251“ für „TAF9b“ (µµ)=251AS [TAF9B - Transcription initiation factor TFIID subunit 9B - Homo sapiens (Human) | UniProtKB | UniProt].
„SPT3“ ist bereits umschlossen, muss aber auch mit „TAF12“ interagieren. „TAF12“ kann die notwendige Bindung an das vertikale „TBP“ (Original), „TAF9“ und „SPT3“ realisieren, wenn „TRRAP“ abwesend ist. „TAF12“ interagiert sowohl direkt mit „TBP“ als auch mit „TAF11(TAF2i)“ [TAF12 – Wikipedia]. Die Bindung von „TAF12“ an „TAF11“ ist möglich, wenn „SPT3“ auf dieser Position fehlt.
Das Protein (Mensch) „TAF12 (°°)=161AS liegt mit „TBP“ {}, „TAF9“ (^^)=SPT3“ (!!) in der Spalte Z.38368#_[57]{3}^3^^4^!7!!1! [7]^1^[2}#_{153}°51°!4!!1!!4![59]/#_°7°33°°70°!300![40], und zwar in Z.38369 zwischen „TBP“ und „SPT3“ als „51“ aufsteigend „70“_links „33“_“7“ mit Summe 51+70+33+7=“161“ für „TAF12 (°°)=161AS [TAF12 - Transcription initiation factor TFIID subunit 12 - Homo sapiens (Human) | UniProtKB | UniProt].
„TAF4“ kann analog zu „TAF12“ mit dem „TPB“ (Original) und „SPT3“ interagieren, wenn „TRRAP“ abwesend ist. Außerdem muss die Endziffer „1“ bei der Ringbildung mit „TAF9“ geteilt werden. „TAF4“ zielt am rechten Rand auf die ATP-Spalte ab, die auch „Vitamin D3“ enthält. Dieser Bezug wird durch Retinsäure=C20H28O2=120+28+16=164E unterstützt. Die ATP-Spalte enthält aufsteigend 1/5/4 für „154“, so dass die Restzahl am Rand 38=QS=11=QS=“2“_absteigend 2/9/0=QS=11=QS=“2“_absteigend „6“ mit Summe 154+2+2+6=Retinsäure=“164“E ergibt. „TAF4“ interagiert mit „CBX5“ [TAF4 – Wikipedia].
„CBX5“=191AS liegt in der Zeile Z.38372#_“146“36“36“ und zwar als „146“_“36“_36=QS=“9“ mit Summe 146+36+9=191AS [CBX5 - Chromobox protein homolog 5 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF4“ (µµ) =1085AS liegt in der Spalte, und zwar aufsteigend in Z.38369 Spalte 5/7 für „57“_“913“_74=QS=“11“_38=QS=“11“_ansteigend „0“_absteigend 2/9 für „92“_links „1“ mit Summe 57+913+11+11+0+92+1=1085AS für „TAF4“ =1085AS [TAF4 - Transcription initiation factor TFIID subunit 4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TAF6L“ (~~)=622AS interagiert mit „TAF9“ und „SPT3“. In Abwesenheit von TAF10/TAF4 wird „SPT3“ rechts gebunden. Die „TAF6L“-Startziffer „7“ verschließt ein bisheriges Loch in der Spalte, und zwar in Z.38368 als „7“_rechts „“1“_Spalte 5/4 für „54“ mit Summe 7+1+54=“62“_absteigend Randspalte 2/9/0=QS=11=QS=“2“ mit 62_2 für TAF6L“ (~~)=622AS [TAF6L - TAF6-like RNA polymerase II p300/CBP-associated factor-associated factor 65 kDa subunit 6L - Homo sapiens (Human) | UniProtKB | UniProt].
„TAF6L“ bindet rechts an „TAF9“. „TAF6“ ist weit entfernt und bindet links an „TAF9“. „TAF6“ interagiert mit „TAF5“ und dem vertikalen „TBP“(Original) [TAF6 - Wikipedia]. Die Interaktion von „TAF5/TAF6“ wird hier nicht als Bindung erwartet, sondern als Überlagerung, weil „TAF5“, zeitlich vorgelagert, „TAF6“ moduliert. „TAF5“ muss sich mit „TAF9“ die Ziffer „3“ teilen. „TAF6“ entschärft diesen Konflikt und gibt die Ziffer „3“ frei, um an „TAF9“ zu binden [Die Bildung des TFIID TAF6-TAF9-Komplexes umfasst die HEAT-Repeat-enthaltende C-terminale Domäne von TAF6 und wird durch das TAF5-Protein moduliert - PMC (nih.gov); E. Scheer u.a; Aug.2012 DOI: 10.1074/JBC. Nr. M112.379206].
Das „Protein (Mensch) „TAF6“ (xx)=677AS liegt in der Spalte Z.38368#_[857]{3}^34^[!7!…]/#_[8]{153}x5x[1!4!…]/#_[7733]x7x[0!3!…]/#_[73]x13x9x[13…]/#_[68]x94x[146..], und zwar aufsteigend in Z.38369 Spalte 5/7/9 für „579“_links 13=QS=“4“_aufsteigend „94“ mit Summe 579+4+94=“677“ für „TAF6“ (xx)=677AS [TAF6 - Transcription initiation factor TFIID subunit 6 - Homo sapiens (Human) | UniProtKB | UniProt].
Zuletzt wird das Protein (Mensch) „TAF5L“ (ßß)= 589AS positioniert, das mit „TAF9“ und „SPT3“ interagiert, d.h. bindet [TAF5L – Wikipedia]. „TAFs“ sind sowohl im „TFIID-Komplex“ als auch „Histon-Acetylase-Komplex“ aktiv. „TAF5L (PAF65-Beta)“ ist zusammen mit „TAF6L (PAF65-Alpha)“ eine Komponente des „PCAF-Komplexes“, der sich auf die „Histon-Acetylierung“ bezieht. Die „DNA“ wird auf Histone gewickelt, so dass bei der Übertragung einer Acetylgruppe Gene ein- und ausgeschaltet werden. Die Modifikation am „Lysin“ des DNA-Verpackungsproteins „Histon H3“ bezieht sich auf die Modifikation „H3K9ac". „TAF5L“ und „TAF6L (PAF65-Alpha)“ dienen als epigenetischer Regulator, der für die somatische Reprogrammierung notwendig ist. Das „Lysin“=C6H14N2O2=80E liegt in Z.38368 Spalte „71/45“ als „71“_45=QS=“9“ mit Summe 71+9=Lysin=80E, wobei die Ziffer „7“ die Kerbe (Loch) bildet und mit der Zahl „45“ für Histon H3=136AS die Endzahl und wechselseitig die Startzahl enthält. Hier wird angenommen, dass nachdem die Kerbe „7“ zwischen „TAF9“ und „SPT3“ von „TAF6L“ besetzt wurde, sich „TAF5L“ schützend am Zeilenrand auf „TAF6L“ legt. „TAF5L“ (ßß)= 589AS liegt in der Spalte Z.38367#_^208^^1^[6]/#_!7!!1![7]^1^[2]/#_!4!!1!!4!ß5ßß9ß/#_!300!ß4ßß0ß/#_[374]ß3ßß8ß/#_[636]ß36ß, und zwar mit Bindung an „TAF9“ (^^) und rechts neben „SPT3“ (!!) aufsteigend in Z.38369 Spalte 5/4/3 für „543“_aufsteigend „36“_absteigend „8“_absteigend Spalte 2/9/0=QS=11=QS=“2“ mit Summe 543+36+8+2=“589“ für TAF5L=589AS [TAF5L - TAF5-like RNA polymerase II p300/CBP-associated factor-associated factor 65 kDa subunit 5L - Homo sapiens (Human) | UniProtKB | UniProt]; [WOW! Schlagertrio KLUBBB3 zingt hit '‘Het Leven Danst Sirtaki" - RTL LATE NIGHT (youtube.com)].
TF-IIA-Komplex: „TFIIA“ ist Teil des Präinitiationskomplexes (PIC). „TFIIA“ besteht aus „TFIIA1“ und „TFIIA2“, die an der Grenze liegen und auf die Zellzyklus-Spalte „30/32“ abzielen. Es wird angenommen, dass „TFIIA“ den TFIID-Komplex über Interaktion mit TAFs zwar reguliert, hauptsächlich aber am vertikalen „TBP“(Original) zwecks Stabilisierung links bindet.
Das Protein (Mensch) „TFIIA2“ ($$)=109AS liegt in der Spalte Z.38364#[16]$1$10$[2…]/Grenze/#[1610]$98$[…], und zwar in Z.38364 über „110“ als Summe 1+10=“11“_aufsteigend „98“ mit Summe 11+98=“109“ für „TFIIA2“ ($$)=109AS. Die lesbare Zahl „109“ dient nur zur Motivation. „TFIIA“ in einem Komplex mit „TBP“ vermittelt die transkriptionelle Aktivität“ [GTF2A2 - Transcription initiation factor IIA subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TFIIA1“ (€€)=376AS liegt in der Spalte Z. 38364#_[16]$1$10$€ 2€€5€[28…]/Grenze/#_[1610]$98$€3€[29…]/#_[1610}€94€€1€30/#_[1610]€8€€9€€9€[32…]/#_[1610]€8€€5€€7€[33…], und zwar mit Bindung an „TFIIA2“ ($$) in Z.38364 als „2“_aufsteigend Spalte 5/3 für „53“ aufsteigend Spalte 1/9/7 für „197“_links absteigend Spalte 9/5 für „59“_absteigend 94 links für „49“_aufsteigend Spalte 8/8=QS=“16“ mit Summe 2+53+197+59+49+16=“376“ für „TFIIA1“ (€€)=376AS [GTF2A1 - Transcription initiation factor IIA subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt].
TFIIB-Komplex: Das Protein (Mensch) „TFIIB“ (bb)=316AS ist an „Serin“=56E phosphoryliert [Transkriptionsfaktor II B – Wikipedia]. „TFIIB“ (bb) liegt am rechten Rand auf der Grenze in der Spalte Z.38364#_[981]b405b/Grenze/#_[7]b7b56b45b/#_[7]b8b[8788]/#_[0]b2b[0816], und zwar absteigend in Z.38365 Spalte 7/8/2 für „287“_56(Serin)=QS=“11“_45=QS=“9“_absteigend 405(Rand)=QS=“9“ mit Summe 287+11+9+9=“316“ für „TFIIB“ (bb)=316AS [GTF2B - Transcription initiation factor IIB - Homo sapiens (Human) | UniProtKB | UniProt].
TFIIF-Komplex: „TFIIF“ interagiert direkt mit „TFIIB“. „TFIIF“ wird kodiert von 3 Genen „GTF2F1“, „GTF2F2“ und „GTF2F2L“. Keine Daten von GTF2F2L [GTF2P1= general transcription factor IIF, polypeptide 2 pseudogene 1; GTF2F2P1 Gene - GeneCards | GTF2F2P1 Pseudogene]. „Pseudogene“ sind DNA-Abschnitte, die nicht für ein funktionelles Protein kodieren bzw. kann es sich im BiXnom-Code nicht passend entfalten. Das Protein (Mensch) „GTF2F1“ (°°)=517AS bindet aufsteigend an „TFIIB“ in der Spalte Z.38366#_[4]°71°[712]/#_[1]°41°[459], und zwar in Z.38369 als 41=QS=“5“_absteigend 71 links für „17“ mit 5_17 für „GTF2F1“ (°°)=517AS. Die Zink-Bindung resultiert aus dem an die Startzahl gebundenen lesbarem (2.)Zink=30E [GTF2F1 - General transcription factor IIF subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GTF2F2“ (^^)=249AS bindet rechts an „TFIIB“ in der Spalte Z.38366#_|7|b8b^8^[788]#_|0|b2b^0^8^^16^/#_|4|°71°^7^1^2^/#_|1|°41°[459], und zwar aufsteigend in Z.39366 Spalte 8/0=QS=“8“_aufsteigend Spalte 8/7=QS=“15“_rechts „1“ mit Summe 8+15+1=“24“_absteigend 16=QS=“7“_absteigend „2“(Rand) mit „24“_Summe 7+2=“9“ mit 24_9 für „GTF2F2“ (^^)=249AS [GTF2F2 - General transcription factor IIF subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt].
TFIIH-Komplex: Der Proteinkomplex „TFIIH“ besteht aus „10“ Untereinheiten, inclusive „CDK7“ und „Cyclin H“. Zu den „7“ Kernuntereinheiten gehören GTF2H1, GTF2H2 und GTF2H3 [Transkriptionsfaktor II H – Wikipedia]. Das lesbare Zink ist an der Grenze besetzt und das 2.Zink lesbare Zink=30E ist umkämpft, weil es zugleich von GTF2H2 und GTF2H3 benötigt wird. Im Spiel „Der Plumpsack geht herum“ hat „GTF2H3“ die Vergabe von „Zink“ für die Zink-Bindung verpasst, obwohl die Position geeignet ist [La Signora - der Plumpsack geht um (youtube.com)]. Links von „TFIIB“ gehört die freie Ziffer „7“ zum speziellen Zink „7“887=QS=Zink=30E, die über einen langen Spalt als Alternative verfügbar ist.
Das Protein (Mensch) „GTF2H1“ (&&)=548AS liegt in Z.38369 Spalte &535&/&3&37& als „535“_aufsteigend „3“_37=QS=“10“ mit Summe 535+3+10=“548“ für „GTF2H3“ (&&)=548AS [GTF2H1 - General transcription factor IIH subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GTF2H2“ (§§)=395AS liegt in der Spalte Z.38369#_&535&|1|°41°§45§[9]/#_&3&37&|0|§300§§40§/#_[13]|91|§37§[438], und zwar in Z.38371 als links 37=QS=“10“_absteigend „300“ (enthält Zink)_absteigend „45“_aufsteigend „40“ mit Summe 10+300+45+40=“395“ für „GTF2H2“ (§§)=395AS [GTF2H2 - General transcription factor IIH subunit 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GTF2H3“ (||)=308AS erblickt in Z.38265 absteigend über eine 7-zeilige Spalte eine weit entfernte, freie Ziffer „7“ links von „TFIIB“, die zum speziellen Zink „7“887=QS=Zink=30E gehört. „GTF2H3“ (||) zwängt sich 7-zeilig durch den Spalt „GTF2H1“ || „GTF2H2“ in Z.38371 als “91“_absteigend im Spalt „0“ (im Spalt) _absteigend Spalte 0/4/1 für „140“_absteigend Spalte 7/7(aus Z.38365) für „77“ mit Summe 91+0+140+77=“308“ für „GTF2H3“ (||)=308AS [GTF2H3 - General transcription factor IIH subunit 3 - Homo sapiens (Human) | UniProtKB | UniProt].
TFIIE-Komplex: Das Zink-Thema ist ausgereizt, trotzdem benötigt „GTF2E1“ nochmals „Zink“, und zwar im Tetramer doppelt. Weil „TFIIE“ den „TFIIH-Komplex“ rekrutiert, kann „GTF2E1“ die TFIIH-Komplex-Postition besetzen, weil es zusammen mit „GTF2E2“ zeitlich vorgeschaltet ist. Jeweils 2 Proteine setzen sich zum „Tetramer“ zusammen. Es sind 2 Ketten, aber keine förmlichen Dimere notwendig. Das „Tetramer“ interagiert mit „TAF6“ [Transkriptionsfaktor II E – Wikipedia]. „TAF6“ koordiniert den „TFIID“-Komplex, der aus dem TATA-bindenden Protein (TBP) und einer Gruppe von Coaktivatoren „TAFs (TBP-assoziierte Faktoren)“ besteht.
Das Protein (Mensch) „GTF2E1“ {}=439AS (Monomer) bereitet die spezielle „Plumpsack-Spalte“ zur Zink-Gewinnung bereits vor. Die linke Zeilen-Seite ist für „TFIID“ reserviert und rechts bleibt „TFIIB“ (bb) unantastbar. „GTF2E1“ {}=439AS liegt in der Spalte Z.38365#_[29775645]/#_30{7}b8b[8788]/#_[32]{0}b2b[0816]/#_[33]{4}{7171}{2}/#_[351]{4145}{9}, und zwar in Z.38369 als 4145=QS=“14“_absteigend Randspalte 2/9=QS=11=QS=“2“_7171=QS=16_absteigend in Z.38366 Spalte 7/0/4 für „407“ mit Summe 14+2+16+407=“439“ für „GTF2E1“ {}=439AS (Monomer). Das Protein (Mensch) „GTF2E1“ ()=439AS (Double) liegt in der Spalte Z.38370#_[370](3)(00)(4)[0]/#_[391](3)[74]3[8]/#_[414636](3)[6], und zwar absteigend in Z.38370 Spalte 3/3(aus Zink)=QS=“6“_(aus Zink)00=QS=“0“_aufsteigend Spalte 4/3/3 für 433 mit Summe 6+0+433=“439“ für „GTF2E1“ ()=439AS (Double) [GTF2E1 - General transcription factor IIE subunit 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „GTF2E2“ (;;)=291AS (Monomer) liegt in der Spalte Z.38365#_[2];9;;7;b75645b/#_[3];0;{7}b8b[8788]/#_[3];2;{0}b2b[0816]/#_[3];3;{4}{7171}{2}/#_;35;|1|{4145}{9}/#_;37;|0|(3)(00)(4)[0], und zwar in Z.38370 als 37 links für „73“_absteigend 35=QS=“8“_absteigend „3“ mit „73“_Summe 8+3=11=QS=“2“_absteigend in Z.38365 Spalte 9/0/2 für „209“_“7“ mit Summe 73+2+209+7=“291“ für „GTF2E2“ (;;)=291AS (Monomer). Das Protein (Mensch) „GTF2E2“ (||)=291AS (Double) liegt in der Spalte Z.38369#_[35]|1|{4145}{9}/#_[37|0|(3)(00)(4)[0]/#_[3]|9||1|(3)|7||4|3[8]/#_[4]|1||46||3|6|(3)[6]/#_ [440]|08||61|[6], und zwar aufsteigend in Z.38369 Spalte 1/0/1 für „101“_aufsteigend Spalte 9/1 für „91“_46=QS=“10“_aufsteigend 08=QS=“8“_absteigend Spalte 7/3=QS=“10“_aufsteigend Spalte 4/6=QS=“10“ mit Summe 101+91+10+8+10+10+61=“291“ für „GTF2E2“ (||)=291AS (Double) [GTF2E2 - Transcription initiation factor IIE subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]._dat25.07.2024
... es gab Fritten statt Pommes
5.) Eukaryotische Elongationsfaktoren „eEF1“ [EF1A und EF1B] und „eEF2“: Bei der Proteinbiosynthese folgt nach der „Transkription“ die „Translation“. Im Rahmen der „Translation“ findet am Ribosom eine „Elongation“ statt, um die an der „tRNA“ gebundenen Aminosäuren zu einer „Polypeptidkette“ zu verknüpfen. „eEF1“ liegt zeitlich vor „eEF2“, wobei sich die Reihenfolge automatisch ergibt, weil „eEF1“ aus der ermittelten „eEF2-Position“ erkennbar sein muss. Weiterhin wird eine Zählgröße=11 für die Polypeptidkette benötigt. Zusätzlich wirkt der Initiationsfaktor „eIF-5A“ auch als Elongationsfaktion (Dehnungsfaktor).
5.1) „eEF2“: Die Interaktion zwischen „eIF5A“ und „eEF2“ beinhaltet eine negative Kooperativität, die zu einem Gleichgewicht bei der Bindung am Ribosom führt. Der gegenseitige Ausschluss beruht darauf, dass die Position geteilt wird. [Hinweise auf eine negative Kooperativität zwischen eIF5A und eEF2 bei der Bindung an das Ribosom - PMC (nih.gov); D. Rossi u.a.; Apr 2016;. doi: 10.1371/journal.pone.0154205]. „eEF2“ enthält ein posttranslational „modifiziertes Histidindiphthamid“ als Diphthamid= C13H23N5O3=78+23+35+24=160E. Das Protein (Mensch) „eEF2“ (EEF2) (;;)=858AS liegt mit „EIF5A“ (@@) in der Spalte Z.38365#_[75645]/#_[88]@7@[88]/#_[20]@8@@1@[6]/#_[7];17;@1@@2@/#_[4];14;[5]9]/#_[30040], und zwar in Z.38368 als 71=QS=“8“_14=QS=“5“_aufsteigemd 040=QS=“4“_absteigend Randspalte 2/9=QS=11=QS=“2“_aufsteigend Spalte 1/1=QS=2 mit „85“_Summe 4+2+2=“8“ mit 85_8 für „eEF2“ (;;)=858AS. „eEF2“ umringt die Ziffer [5], die „extern“ für „Diphthamid“=160E in der Spalte 1/5/4 für „154“ mitwirkt. Intern weiter absteigend Spalte 4/0=QS=“4“_absteigend Spalte 1/1=QS=“2“ mit Summe 154+4+2=„Diphthamid“=“160“E [EEF2 - Elongation factor 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„eEF2“ (;;) interagiert mit dem Protein (Mensch) „RBPMS2“ (&&)=209AS, indem es an der „eEF2“-Startzahl „17“ bindet, und zwar in der Spalte Z.38367#_&20&&2&[0]@8@;1;[6]/#_[34]&7&;17;;1;;2; als „20“_aufsteigend Spalte 2/7=QS=“9“ mit 20_9 für „RBPMS2“ (&&)=209AS [RBPMS2 - RNA-binding protein with multiple splicing 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„eEF2“ interagiert und bindet am Protein (Mensch) „SERBP1“ (ss)=408AS, wodurch die Interaktionsstellen des mRNA-tRNA-Komplexes blockiert werden, um die Ruhe am Ribosom zu fördern. Dieses resultiert aus einem Ring von „SERBP1“ und „CHD3“ mit „wundersamen“ 2000AS. Der Ring umschließt die Spalte 2/3/5=QS=“10“ für die 10er-Teilung des rotierenden BiXnom-Zählkreises, die von der Zahl „334“ als 33=QS=“6“_4 für BiXnom-Kreis=64 (Symbol) gekreuzt wird, so dass mit der 10er-Kapsel eine Pause adressiert wird. Darin summiert sich links die Zahl „3“ mit 57+“3“=60=Zeitbasis gekreuzt mit dem Lebensalter 9/7 für 97 Jahre, sofern die Zeitbasis „365“ zu finden ist. Und tatsächlich, der Zahl „130“ folgt lotrecht die Kapsel-Zahl „235“ mit Summe 130+235=“365“=Zeitbasis=1 Jahr. Die Einzelzählung wirkt dominant. „SERBP1“ (ss)=408AS liegt in der Spalte Z.38365#_s329s[775645]/#_[13]s0ss7s[88788]/#_[932]s0ss2s[08];1;[6]/#_[733]s4ss7s;17;;1;;2;/#_535s1ss4s;14;[5];9;/#_337030;040; , und zwar in Z.38365 als „329“_aufsteigend „0“_Spalte 7/0 für „70“_“2“_aufsteigend Spalte 7/4=QS=11=QS=“2“_absteigend Spalte 4/1=QS=“5“ mit Summe 329+0+70+2 +2+5=“408“ für „SERBP1“ (ss)=408AS [SERBP1 - SERPINE1 mRNA-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „CHD3“ (©©)=2000AS bindet zwecks Ringbildung an beiden Enden von „SERBP1“ (ss) in der Spalte Z.38365#_s329s[775645]/#_©1©©3©s0ss7s[88788]/#_©9©©3©[2]s0ss2s[08];1;[6]/#_©7©©3©[3]s4ss7s;17;;1;;2;/#_©5©©3©[5]s1ss4s;14;[5];9;/#_[3]©3©©703©0;040; , und zwar in Z.38370 als links 703=QS=“10“_absteigend Spalte 3/3/3/3/3=QS=“15“_aufsteigend Spalte 1/9/7/5 für „1975“ mit Summe 10+15+1975=“2000“ für „CHD3“ (©©)=2000AS. „Erforderlich für die Verankerung von zentrosomalem Pericentrin sowohl in der Interphase als auch in der Mitose, für die Spindelorganisation und Zentrosomintegrität“ [CHD3 - Chromodomain-helicase-DNA-binding protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Auf wundersame Weise zeigt sich das Protein (Mensch) „PCNT_Pericentrin“=3336AS mit einer Spalte „3/3/3“, die folglich in Z.38366 auf der „CHD3“-Spalte „3/3/3/3/3“ liegt, und zwar als 333_Spalte 3/3=QS=“6“ mit 333_6 für „Pericentrin“ =3336AS [PCNT - Pericentrin - Homo sapiens (Human) | UniProtKB | UniProt]. Die „PCNT“-Fußpunktziffer [„3“] in der Spalte Z.38370#_73[“3“]…/#_139[…] wird von „Calmodulin“ als Summe 73=QS=“10“_aufsteigend „139“ mit Summe 10+139=“149“ für „Calm1“=149AS gebunden [CALM1 - Calmodulin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das PCNT-Homolog „PCNTB“ besitzt vermutlich ebenfalls 3336AS in Verbindung mit einer zusätzlichen Coiled-Coil-Domäne und einem einzigartigen C-Terminus mit 1000 Resten, so dass eine Aufteilung 2336+1000=“3336“AS erfolgen müsste. „PCNTB“ startet 8-zeilig bereits in Z.38365 in der Spalte „2/3/3/3/3“ als 2333_3 mit Summe 2333+3=“2336“_aufsteigend in 25er-Schleife in Z.38370 als links 733=QS=13_aufsteigend rechts 313=QS=7_aufsteigend Wende 41=“5“ mit Summe 13+7+5=“25“_absteigend Spalte 5/7/9 für „975“ mit 2336_Summe 25+975=“1000“ mit Summe 2336+1000=3336 für „PCNTB“=3336AS. Die Schwerachse ist als Spalte 7/9 für 79 und der Endzahl 41=QS=5 mit 79+5=84 enthalten. [PCNT - Wikipedia].
5.2) „eEF1“: „eEF-1“ besteht aus mehreren Elongationsfaktoren (EF-1A, EF-1B etc.) [eEF-1 – Wikipedia]. Es sind 2 Paraloge mit unterschiedlichen Funktionen. „EF1A ist für die Auswahl und Bindung der verwandten Aminoacyl-tRNA an die A-Stelle (Akzeptorstelle) des Ribosoms verantwortlich. Der Elongationsfaktor EF1B ist ein Nukleotidaustauschfaktor, der erforderlich ist, um EF1A von seiner inaktiven Form (EF1A-GDP) in seine aktive Form (EF1A-GTP) zu regenerieren. EF1A ist dann bereit, mit einer neuen Aminoacyl-tRNA zu interagieren, um den Zyklus erneut zu beginnen.
5.2.1 „EF-1A“ [EF-1A1 und EF-1A2]: „EF-1A“ wird von 2 Genen als „eEF1A1“ und „eEF1A2“ codiert. Die Unterschiede resultieren aus der klassischen ATP-Randspalte 12/59 bei der an der Ziffer „5“ wahlweise 2 Startziffern „4“ angehängt sind. Über die vertikale Ziffer „4“ kann der Muskel „55“ gezählt werden, der für „EF-1A2“ gilt, entsprechend wird Unterschied von 463AS statt 462AS für EF-1A1 zugeordnet.
Das Protein (Mensch) „eEF1A1“ ($$)=462AS liegt in der Spalte Z.38368#_[7]$12$/#_$4$59$/#_[30040], und zwar in Z.38369 als 4_59_absteigend 12=QS=“3“ mit „4“_Summe 59+3=“62“ mit 4_62 für „eEF1A1“ ($$)=462AS. „GTP“=268E liegt in der Randspalte Z.38367#_“8“16“/#_“712“ als „16“ aufsteigend 712=QS=“10“_absteigend „8“ mit Summe 16+10=“26“_“8“ für GTP=268E. Weil die Ziffer „8“ aus dem Wasser 28 als 20“8“ für GTP verwendet wird, wird Wasser aus der Spalte 8/2 für „28“ bei der Katalyse verwendet. Aktin=374AS liegt in der Randspalte Z.38368#_“7“12“/#_“4“[59] als links „12“=QS=“3“_Spalte 7/4 für 74 mit 3_74 für Aktin=374AS. „eEF1A1“ wird gehemmt durch das Arzneimittel „Plitidepsin“=C57H87N7O15=342+87+49+120=598E in der Randpalte Z.38368#_16/#_12/#_59, und zwar als „59“_absteigend „2“_6“ mit „59“_Summe 2+6=“8“ mit 59_8 für „Plitidepsin“=598E. Hemmt auch „eEF1A2“.
„eEF1A1“ ($$) interagiert und bindet am Protein (Mensch) „SPSG1“ (gg)=1290AS mit dem Cofaktor „Calcium“=20E in der Spalte Z.38366#_g8gg8g[788]/#_g2gg0g[816]/#_g7g17]$12$/#_g4gg1g4$59$/#_[30040], und zwar in Z.38369 als „1“_absteigend Spalte 7/4=QS=“11“ mit Summe 1+11=“12“_absteigend 8/2(aus Calcium)=QS=“10“_aufsteigend Spalte 8/0(aus Calcium) für „80“ mit „12“_Summe 10+80=“90“ mit 12_90 für „SPSG1_1-Phosphatidylinositol 4,5-bisphosphat-Phosphodiesterase-gamma-1“ (gg)=1290AS [PLCG1 - 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „eEF1A2“ (€€)=462AS liegt mit einer GTP-Bindung in der Spalte Z.38367#_[8]€1€[6]/#_[7]€12€/#_[4]€59€/#_[0]€4€[0], und zwar in Z.38370 als 4_59_absteigend 12=QS=“3“ absteigend „1“ mit „4“_Summe 59+3+1=“63“ mit 4_63 für „eEF1A1“ (€€)=462AS [EEF1A2 - Elongation factor 1-alpha 2 - Homo sapiens (Human) | UniProtKB | UniProt].
5.2.2 „EEF1B2“, „EEF1G“, „EEF1D“, EEF1E1, VARS]: Vermutlich liegt „EEF1D“ auf der Position von „EEF1B2“. „EEF1G“ interagiert zwar mit beiden Proteinen, was aber nicht zeitgleich erfolgen muss. Wie bekannt interagiert folglich „EEF1B2“ nicht mit „EEF1D“, sowie „EEF1D“ nur mit „EEF1G“.
Das Protein (Mensch) „EEF1B2“ {}=225AS ist ein Translationsverlängerungsfaktor und ein Guanin-Nukleotid-Austauschfaktor, der mit „EEF1G“ und „HARS“ interagiert. „EEF1B2“ {} liegt mit „Guanin“=C5H5N5O=30+5+35+8=78E in der Spalte Z.38365#_{7}[88]/#_{8}{16}/#_{7}{12}/#_{4}[59], und zwar aufsteigend in Z.38365 Spalte 7/8=QS=“15“_16=QS=“7“ mit Summe 15+7=“22“_aufsteigend 12=QS=“3“_aufsteigend Spalte 7/4=QS=11=QS=“2“ mit „22“_Summe 3+2=“5“ mit 22_5 für „EEF1B2“ {}=225AS [EEF1B2 - Elongation factor 1-beta - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „HARS_Histidin-tRNA-Ligase“ () =509AS bindet seitlich an „EEF1B2“ {}, in dem es sich an die Spalte !8!/!2! für „Histidin“= C6H9N3O2=36+9+21+16=82E anhängt, um „Histidin“ in einer Schleife zum rechten Rand zu führen. Das aufgenommene „Histidin“ wird dann integriert in der Spalte „8/0/1/1“ mit Summe 80+1+1=82E. „HARS“ ()=509AS liegt in der Spalte Z.38364#_[81](405)#_ [7](5645)/#_!8!(8){7}[88]/#_!2!(0){8}{16}/#_(7)(1){7}{12}/#_(4)(1){4}[59], und zwar der „Histidin“-Spalte in Z.38366 !8/2! folgend aufsteigend in Z.38368 Spalte 7/4=QS=“11“_absteigend Spalte 1/1 für „11“_absteigend Spalte 8/0=QS=“8“_absteigend 5645=QS=“20“ mit Summe 11+11+8+20=“50“_absteigend 405=QS=“9“ mit 50_9 für „HARS“ ()=509AS [HARS1 - Histidine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt].
„EEF1B2“ {} und „HARS“ () binden an „EEF1G“ (||). „HARS“ () schränkt die Suche nach EEF1G“ (||) erheblich ein. „EEF1G“ (|)| besetzt das potentielle Zink=30E, das bei der Interaktion von „RECQL5“ selbst benötigt wird. „RECQL5“ muss sich das alternative, vorgelagerte Zink daher über eine lange Schleife beschaffen. Indem sich „EEF1G“ (||) nach links an „RECQL5“ bindet, kann „LZTS1“ den rechten Rand besetzen.
Das Protein (Mensch) „EEF1G“ (||)=437AS liegt in der Spalte Z.38369#_[5351](4)(1){4}[59]/#_[33]|70||300|[40]/#_[139137]|4|[38], und zwar in Z.38371 als „4“_absteigend 300=QS=“3“_70=QS=“7“ mit 4_3_7 für „EEF1G“ (|)|=437AS [EEF1G – Wikipedia -- EEF1G - Elongation factor 1-gamma - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „RECQL5“ (°°)=991AS findet „ATP“ und „Zink“ beim Abstieg in der Zellzyklus-Spalte „30/32“ in der Spalte Z.38366#_°1°°3°[0788788]/#_°9°°3°[2020816]/#_°7°°3°[3471712]/#_°5°°3°[5141459]/#_[3]°3°|70||300|[40]/#_[139137]|4|[38], und zwar aufsteigend in Z.38366 Spalte 3/3/3/3/3=QS=15_1_absteigend Spalte 9/7/5 für 975 mit Summe 15+1+975=“991“ für „RECQL5“ (°°)=991AS [RECQL5 - ATP-dependent DNA helicase Q5 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „LZTS1“ (^^)=596AS liegt in der Spalte Z.38367#_[208*1*6]/#_[*7*1*7*1*2]/#_[414]^59^/#_|300|^40^/#_[37]|4|^38^, und zwar in Z.38369 als „59“_aufsteigend 40=QS=“4“_aufsteigend 38=QS=11=QS=“2“ mit „59“_Summe 4+2=“6“ mit 59_6 für „LZTS1“ (^^)=596AS. Die Bindung erfolgt am „Leucin-Zipper“ mit einer gespiegelten Leucin-Dopplung für Leucin=C6H13NO2=36+13+7+16=“72“E als *7*_*1*/*1*=“2“ (doppelt) [LZTS1 - Leucine zipper putative tumor suppressor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „LARS1“ (§§)=1176AS liegt auf HARS () und „EEF1B2“ {} und bindet an „EEF1G“ (||), wobei „LARS1“ auf dem Leucin-Zipper sitzt in der Spalte Z.38367#_§2081§[6]/#_§7§§1§[712]/#_§4§§1§[459]/#_|300|40/#_[37]|4|[38], und zwar aufsteigend in Z.38367 als links 2081=QS=“11“_aufsteigend „*7*“_Spalte *1*/*1“=QS=“2“_“4“ mit „117“_Summe 2+4=“6“ mit 117_6 für „LARS1“ (§§)==1176AS [LARS1 - Leucine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt].
Für das Protein (Mensch) „EEF1D“ =281AS werden die Isoformen 1 und 2 genannt. Es existieren verschiedene Längen. Bekannt sind eine lange Isoform 647AS und 3 kurze Isoformen 281, 257 und 262AS[Regulation der Translationsfaktor-EEF1D-Genfunktion durch alternatives Spleißen - PMC (nih.gov); T. Kaisuka; Feb. 2015; DOI: 10.3390/IJMS16023970]. „Zellulärer Stress aktiviert den Hitzeschock-Transkriptionsfaktor 1, HSF1. Dieser bindet dann an DNA-Abschnitte und ermöglicht somit die Produktion der zellulären Helfer“ [Im Krisenfall HSF1 | Max-Planck-Institut für Biochemie (mpg.de); Feb 2016].
HSF1 interagiert mit der Isoform 2.Die „Isoform 2“ ($$) nutzt den freien Spalte zwischen „RECQL5“ (°°) und „HARS“ (). Die „Isoform 1“ (€€) sitzt auf „EEF1B2“ {} in der GTP-Spalte. Das Protein (Mensch) „EEF1D_Isoform 2“ ($$)=281AS bindet an EEF1G“ (||) und liegt in der Spalte Z.38365#_97…/#_07…/#_20…/#_34…/#_51…, und zwar aufsteigend in Z.38365_9/0/2=QS=11=QS=“2“_aufsteigend Spalte 3/5=QS=“8“_„1“ mit 2_8_1 für „EEF1D_Isoform 2“ ($$)=281AS. „Reguliert die Induktion von Genen, die auf Hitzeschocks reagieren“. Dieses ist ersichtlich, weil der Hitzeschock-Transkriptionsfaktor 1 (HSF1) =529AS von der „EEF1D“-Spalte besetzt wird, und zwar absteigend Spalte 0/4/1=QS=“5“_absteigend 0/2 für „20“_absteigend „9“ mit 5_Summe 20+9=“29“ für (HSF1) =529AS [HSF1 - Heat shock factor protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die „Isoform 1“ ist nicht genau bekannt, sie liegt funktionell bei GDP/GTP. [EEF1D - Elongation factor 1-delta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TMEM63A“=807AS müsste mit „EEF1D“ interagieren, dessen „Isoform 1“ hier nicht genau bekannt ist. Feststellbar ist lediglich, dass „TMEM63A“=807AS neben „EEF1G“ (||) in der Spalte Z.38370#_40/#_38 liegt und zwar absteigend Spalte 0/8 für 80_aufsteigend Spalte 4/3=QS=7 mit 80_7 für „TMEM63A“=807AS [TMEM63A - CSC1-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „Das Gen EEF1D kodiert für die eEF1Bδ-Untereinheit des eEF1B-Komplexes. EEF1D wird abwechselnd gespleißt, wodurch eine lange und drei kurze Isoformen entstehen. Die veröffentlichten Varianten betreffen nur die lange Isoform von EEF1D, die als Transkriptionsfaktor von Hitzeschockelementproteinen fungiert.“ [Erweiterung des Spektrums der EEF1D-neurologischen Entwicklungsstörungen: Biallelische Varianten in der Guanin-Austauschdomäne - Averdunk - 2023 - Klinische Genetik - Wiley Online Library; Dez. 2022; https://doi.org/10.1111/cge.14290]
Das Protein (Mensch) „VARS_Valin-tRNA-Ligase“ (vv) =1264AS gehört ergänzend zum Elongationsfaktor „eEF1“ [eEF-1 – Wikipedia]. Valin=C5H11NO2=30+11+7+16=64E ist in VARS=12“64“AS enthalten. „VARS“ muss am externen Valin=64E liegen, das dann intern zählbar aufgenommen wird. Die Randspalte „816/712“ enthält GTP/GDP=268E/228E. „VARS“ muss jedoch aufgrund der Katalyse mit „ATP“ aufsteigend die klassische Randspalte „12/59“ wählen, enthalten in Z.38367#_[20816]/#_[717]v12v/#_[4]v14v59v. Internes „Valin“ ist als 14=QS=“5“_“59“ mit Summe 5+59=Valin=64E enthalten. „VARS“ (vv)=1264AS in Z.38368 als „12“(Rand)_aufsteigend Summe Valin=“64“ mit 12_64 für VARS (vv) =1264AS. Der externe Valin-Anhang summiert sich bis zur GTP-Spalte absteigend in Z.38368 Spalte 7/4 für 47_17_absteigend 208=QS=“10“ mit Summe 47+17+10=Valin=64E. Beim Kaninchen (Rabbit) bindet „VARS“ an „eEF1Bδ“. Hier grenzt absteigend „EEF1G“ an „VARS“. Die „EEF1D“_Isoform“ (€€) =“64“7AS, frei gewählt nach der bekannten Länge, bindet auch beim Menschen an „VARS“, weil es sich aufgrund der Zahl „64“ um die Position des externen Valins handelt, die am Rand der GTP-Spalte mit 16(Rand)=QS=“7“ für 647AS ergänzt wird.
Der Eleongationsfaktor „eEF1E1“ gehört ebenfalls zu „eEF1“ [eEF-1 – Wikipedia]. „eEF1E1“ dient als Gerüstprotein für den „
Aminoacyl-tRNA-Synthetase-Multienzym-Komplex“. Für diesen Zweck müssen Proteine an die GTP- und ATP-Energie gebunden werden. Die Spalten-Zahl „115“, eine Kombination von Zählgröße „11“ und Struktur „5“, gilt beim Menschen für das anatomische Gerüst, und zwar bei der Zählung einer Wirbel-Position in der Wirbelsäule. Die Ziffer „5“ besetzt die benötige 59er-Ergänzung 115+“59“=174AS, so dass die Zahl „59“ neu angefügt wird. Es ist eine Wende absteigend zur Bindung an „p53“ erforderlich, um die Funktion „positive Regulation der DNA-Schadensantwort, Signaltransduktion durch p53-Klasse-Mediator“ darzustellen. Das Protein (Mensch) „eEF1E1“ (**)=174AS könnte in der Spalte Z.38367#_*2**0*[8]*1*[6]/#_[7]*1**7**1*[2]/#_[41]*4**5*[9] liegen, und zwar aufsteigend in Z.38367 Spalte 1/1/5 für „115“_absteigend Spalte 7/4 für „47“_absteigend Spalte 0/1 für „10“_links „2“ mit „115“_Summe 47+10+2=“59“ als Summe 115+59=“174“ für „eEF1E1“ (**)=174AS. „Positiver Modulator der ATM-Antwort auf DNA-Schäden“ [EEF1E1 - Eukaryotic translation elongation factor 1 epsilon-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Enzym, die „Serin-Proteinkinase ATM (Ataxia Telangiectasia Mutated)“ ist der zentrale Regulator der zellulären Antwort auf DNA-Schäden, u.a. Doppelstrangbrüche. „ATM“ interagiert u.a. mit „p53“. „ATM“ ist hier bekannt. „ATM“ zieht durch die klassische ATP-Randspalte „12/59“ und passiert die „eEF1E1“-Spalten-Zahl „115“. „ATM“ („“)=3056AS liegt in der Spalte Z.38367#_“20“8“1“[6]/#_[717]“1““2“/#_ [414]“5““9“/#_[300]“4““0“, und zwar in Z.38367 als „20_8“ aufsteigend Spalte 1/1=QS=“2“ mit Summe 20+8+2=“30“_aufsteigend Spalte 5/4 für „54“_absteigend Spalte 2/9/0=QS=11=QS=“2“ mit „30“_Summe 54+2=“56“ mit 30_56 für „ATM“ („“)=3056AS [ATM - Serine-protein kinase ATM - Homo sapiens (Human) | UniProtKB | UniProt]._dat26.07.2024
6.) „Tau“-Oligomerisierung: Das bei der Alzheimer-Erkrankung relevante Protein (Mensch) „Tau“ =758AS wurde für das Monomer bereits ermittelt. „Tau“ zieht von Z.38366 als 41=QS=“5“_“30“_aufsteigend „20“_“20“ mit Summe 5+30+20+20=“75“_“8“ für „Tau“ (!!)=758AS bis zur Bindung an „TIA-1“ [MAPT - Microtubule-associated protein tau - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Tau-Monomer“ ist zwar unproblematisch, aber vorgelagert bindet seitlich lesbar nochmals das „Tau-Protein“ an „TIA-1“, und zwar als Spalte 75/[8]8 mit „75“_aufsteigend „8“ mit 75_8 für „Tau“=758AS, woraus eine „Oligomerisierung“, d.h. eine Vervielfachung angeregt wird [TIA1 potenziert die Tau-Phasentrennung und fördert die Bildung von toxischem oligomerem Tau - PMC (nih.gov); B. Wolozin u.a.; Feb. 2022; doi: 10.1073/pnas.2014188118]. Alzheimer-Symptome (AD) zeigen sich typisch bei Patienten ab 65 Jahren. „Es gibt immer mehr Hinweise darauf, dass aggregiertes, hyperphosphoryliertes Tau ein Schlüsselfaktor für die Neurodegeneration bei Alzheimer sein könnte. Das Tau-Protein wird durch das Mikrotubuli-assoziierte Protein Tau (MAPT)-Gen kodiert und ist ein Mikrotubuli-assoziiertes Protein, das hauptsächlich in Neuronen exprimiert wird“. Zur ersten Behandlung erfolgt mit „Aducanumab“ und „Lecanemab“ [Tau-zielgerichtetes Antisense-Oligonukleotid MAPTRx bei leichter Alzheimer-Krankheit: eine randomisierte, placebokontrollierte Phase-1b-Studie | Natur Medizin (nature.com); C.Mummery u.a.; Apr 2023; https://doi.org/10.1038/s41591-023-02326-3]. Das Arzeimittel „Lecanemab“ ist hier bereits bekannt. „Die Entdeckung, dass sich Tau, insbesondere oligomeres Tau, an Synapsen anreichert, könnte Auswirkungen auf das Verständnis der AD-Pathogenese haben“ [Synaptic oligomeric tau in Alzheimer's disease - A potential culprit in the spread of tau pathology through the brain - PubMed (nih.gov); A. Lleo u.a.; Jul 2023; https://doi.org/10.1016/j.neuron.2023.04.020].
7.) „Uridin“: Uridin gehört gemeinsam Adenosin, Thymidin, Cytidin und Guanosin zu den 5 Standardnukleoside, aus denen Nukleinsäuren bestehen. Thymidin kommt in der Desoxyribonukleinsäure (DNA) und in der Regel nicht in der Ribonukleinsäure (RNA) vor, umgekehrt kommt Uridin in der RNA und nicht in der DNA vor [Uridin – Wikipedia]. Bestandteile von „Uridin (U)“(§§)=C9H12N2O6=54+12+14+48=“128“E der Ribonukleinsäure (RNA): „Uridin“ liegen seitlich von „TIA-1“ {}, und zwar Uracil=C4H4N2O2=24+4+14+16=“58“E in Spalte 5/8 für „58“ und D-Ribose=C5H10O5=30+10+40=“80“E als 08 links für „80“. Die Summe 58+80=138E ergibt gegenüber „Uridin“ einen Überschuss „10“, der als Spalte 8/2(Wasser)=QS=“10“ vorliegt. „Uridin“ (§§)=128E folgt aufsteigend als Ergebnis, und bindet zugleich an „TIAR“ und “TIA-1“ in der Spalte Z.38365#_[329775]{6}{4}{5}/#_[130788]{7}{8}{8}/#_[9320]§20§81${6}/#_[7334]§71§712§], und zwar „Uridin“ (§§) in Z.38368 als 712(Randziffer)=QS=“10“_71 links für „17“_absteigend „20“_“81“ mit Summe 10+17+20+81=“128“E für Uridin“ (§§)=128E.
8.) „Nucleolysin-TIAR“: „TIAR“ wird vom Gen „TIAL“ kodiert. „TIAR“ ist wie „TIA-1“ ein RNA-bindendes Protein. „TIAR“ bindet Adenin- und Uridin-reiche Elemente in mRNA und Prä-mRNAs [TIAL1 – Wikipedia]. „TIAR fungiert ist als translationaler Repressor über die Bildung von "Stressgranula" beteiligt, d.h. die Expression seines Zielgens wird unterdrückt. „Die Fähigkeit von rekombinantem TIA-1, DNA-Fragmentierung in permeabilisierten Zellen zu induzieren, deutet darauf hin, dass dieses Protein die Granulatkomponente ist, die für die Induktion der Apoptose in zytolytischen Lymphozyten (CTL)-Zielen verantwortlich ist“ [Identifizierung und funktionelle Charakterisierung eines TIA-1-verwandten Nukleolysins. | PNAS; P. Anderson u.a. Sep 1992; https://doi.org/10.1073/pnas.89.18.8681]. TIAR-Synonym: „TIA1 Cytotoxic Granule Associated RNA Binding Protein-Like 1.“
Das RNA-bindende Protein (Mensch) „Nucleolysin-TIAR“ () =375AS liegt mit “TIA-1“ {} und „Uridin“ (§§)=128E in der Spalte Z.38365#_(3)(29)(775){6}{4}{5}/#_(13)[0](788){7}{8}{8}/#_[9320]§20§81${6}/#_[7334]§71§712§], und zwar in Z.38365 als „3“_aufsteigend 13=QS=“4“_absteigend „29“_775=QS=“19“_aufsteigend 788=QS=“23“ mit „3“_Summe 4+29+19+23=“75“ mit 3_75 für „Nucleolysin-TIAR“ () =375AS. „Posttranslationale Modifikation: Phosphoryliert durch MAPK14 nach DNA-Schädigung, wodurch TIAR aus GADD45A mRNA freigesetzt wird“ [TIAL1 - Nucleolysin TIAR - Homo sapiens (Human) | UniProtKB | UniProt].
Die TIAR-Position wird aufgrund der gegensätzlichen Expression vom Protein (Mensch) „LOXL1“ (xx) =574AS und dem Cofaktor „Kupfer“=29E besetzt. „Es wurden niedrige TIAR-Spiegel und hohe LOXL1-AS1-Spiegel in Gliomzellen und -geweben gefunden“. [„LOXL1-AS1, das mit TIAR kommuniziert, moduliert die vaskulogene Mimikry bei Gliomen über die Regulation der miR-374b-5p/MMP14-Achse - PMC (nih.gov)“; Z. Li u.a.; Jan 2022; DOI: 10.1111/jcmm.17106]. „Gliome“ sind hirneigene Tumore, die mit Nerv=7 über die Endzahl „77“ beteiligt sind. Mit dem 1. Cofaktor „Kupfer“ wird zwar „TIAR“ besetzt, aber die Katalyse-Teilnehmer sind seitlich versetzt in einer langen Spalte zu finden. Die Spalte enthält in der Zahl „71“ eine Wendestelle für „L-lysinium residue (CHEBI:29969)“=C6H13N2O=36+13+14+8=71E. Vorgelagert sind „Wasser“ als 20_8 für „28“ und Luftsauerstoff „O2“ als „88“. Der 2.Cofaktor „Lysin-Tyrosylchinon“(CHEBI:20489)=C15H17N3O4=90+17+21+32=160E beginnt in der Cu-Folgezeile mit „130“, wodurch Kupfer=29E erkannt und Zink=30E ausgeschlossen ist. „LOXL1“ (xx) =574AS liegt in der Spalte Z.38365#_x329xx77xx5x[645]/#_x130x78xx8x[788]/#_[9320]x20xx8x16, und zwar in Z.38365 als „329“ (enthält Kupfer=29E)_aufsteigend „130“_“78“_aufsteigend Spalte 2/7=QS=“9“_absteigend Spalte 0/1=QS=“1“_absteigend Spalte 5/8=QS=“13“_77=QS=“14“ mit Summe 329+130+78+9+1+13+14=“574“ für „LOXL1“ (xx) =574AS. Interaktion mit „BMP1“. [LOXL1 - Lysyl oxidase homolog 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „BMP1“ (~~)=986AS besitzt eine Zink- und Calcium-Bindung und bewirkt eine Spaltung, indem es sich durch die schleifenförmige „LOXL1“-Spalte zieht. „BMP1“ (~~)=986AS liegt in der Spalte Z.38364#_[52898]~1~[405]/#_[3]~2~[977]~5~[645]/#_[1]~3~~0~[78]~8~[788]/#_[93}~2~~020~[816], und zwar aufsteigend in Z.38365 Spalte 2/3(aus Zink)=QS=“5“_aufsteigend 0/2(aus Calcium)=QS=“2“_020=QS=“2“ mit Summe 5+2+2=“9“_absteigend Spalte 5/8 für „85“_absteigend „1“ mit 9_Summe 85+1=“86“ mit 9_86 für „BMP1“ (~~)=986AS [BMP1 - Bone morphogenetic protein 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „GADD45A“ ($$)=165AS interagiert mit „p21“, das mit „p53“ verschachtelt ist. Folglich muss „GADD45A“ auf „p53“ liegen. „GADD45A“ liegt aufgrund der Interaktion mit „CDK1“ in Z.38366#_[30]$78$87$[88] als Summe 78+87=165AS für „GADD45A“=165AS [GADD45A - Growth arrest and DNA damage-inducible protein GADD45 alpha - Homo sapiens (Human) | UniProtKB | UniProt] „GADD45A“ ($$) hemmt den Durchlauf des Proteins (Mensch) „Calnexin_p88“ (€€)=592AS mit Calcium-Bindung in der Spalte Z.38366#_[30]€$78$87$€[88]/#_[93]2]€020€[816], und zwar in Z.38367 als „20“(Calcium)_ absteigend 7887=QS=“30“_aufsteigend Spalte 8/1=QS=“9“ mit Summe 20+9+30=“59“_aufsteigend 171=QS=“9“_absteigend 20 (Calcium)=QS=“2“ mit „59“_Summe 9+2=11=QS=“2“ mit 59_2 für „Calnexin_p88“ (€€)=592AS [CANX - Calnexin - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „MAPK14“ (^^)=360AS besitzt den Cofaktor „Magnesium“=12E und liegt in der Spalte Z.38366#_[307887]^8^[8]#_[320208]^16^/#_[33]^4^7^17^12^, und zwar in Z.38366 als „8¬¬“_aufsteigend “16“_absteigend „12“(Magnesium) mit Summe 8+16+12=“36“_17=QS=“8“_47=QS=11=QS=“2“ „36“_Summe 8+2=10 für „0“ mit 36_0 für „MAPK14“ (^^)=360AS. „MAPK14 interagiert auch mit der Caseinkinase II, was zu ihrer Aktivierung durch Autophosphorylierung und weitere Phosphorylierung von TP53/p53 führt“ [MAPK14 - Mitogen-activated protein kinase 14 - Homo sapiens (Human) | UniProtKB | UniProt]. „MAPK14“ interagiert mit einer Vielzahl von Proteinen, wobei die ermittelten „CDC25B“ /“CDC25C“ binden [MAPK14 – Wikipedia]. Das Zinkfingerprotein (Mensch) „ZFP36L1“ („“)=338AS zieht einen Ring durch Zink=30 und bindet an der MAPK14-Endziffer, und zwar aufsteigend in Z.38366 als Spalte 3(aus Zink)/3 für „33“__aufsteigend 33=QS=“6“_absteigend Spalte 0 (aus Zink)/2 =QS=“2“ mit „33“_Summe 6+2=“8“ mit 33_8 für „ZFP36L1“=338AS [ZFP36L1 - mRNA decay activator protein ZFP36L1 - Homo sapiens (Human) | UniProtKB | UniProt].
9.) Das BiXnom-Master-Protein, das Protein (Mensch) „ATF2_Activating transcription factor 2“ {}=505AS enthält mit „505“ eine klassische BiXnom-Struktur-Zahl, eine Zink-Bindung und einen „Leucin-Zipper“, der eine gespiegelte „Leucin=72E-Dopplung“ in Z.38365#_“297756“ enthält. „ATF2“ {}=505AS (Monomer) bindet spektakulär an der MAPK14-Endziffer in der Spalte der Episode „Epi.Vir.Z.38365“#_{329}{77}{56}[45]/#_{130}{7887}[88]/#_[932020816]/#_[733471712], und zwar ringförmig in Z.38366 als „130“_absteigend „329“_77=QS=“14“_56=QS=11=QS=“2“_aufsteigend 7887=QS=“30“(Zink) mit Summe 130+329+14+2+30=“505“ für „ATF2“ {}=505AS. Für cAMP=170E sind „130“ intern enthalten, und extern über 2020 für „40“ zu ergänzen. Mit dieser Ergänzung ist die Hyaluronsäure für das klassische Auge „505“ als 130_aufsteigend Spalte 7/0 für 70 mit 130+70=200E adressiert. Für die Sekundenzählung ist Zeitbasis „60“ als „29“_aufsteigend „30“_links „1“ mit Summe „60“ enthalten. Für das lesbare Lebensalter „97“ Jahre, fehlt die Zeitbasis „365“, damit die Jahre noch erlebt werden. Das „Alter“ wird von der „Zeitbasis“ „307“(Monatstage/Woche)_“Alter“_“58“ für Zeitbasis 307+58=“365“ Tage = 1 Jahr eingeschlossen, und als „3“_29=QS=11(Zählgröße)=QS=“2“_aufsteigend Spalte 7/7 für „77“_absteigend Spalte 7/8 für QS=“15“ mit Summe 3+2+77+15=“97“ gezählt, somit „3“ Jahre Krippe, „2“ Jahre Kindergarten, „77“ Jahre „high-life“ und „15“ Jahre Restzeit. [ATF2 - Cyclic AMP-dependent transcription factor ATF-2 - Homo sapiens (Human) | UniProtKB | UniProt]. „ATF2“ kann ein Homodimer bilden, wodurch sich die Funktion erweitert [Gegenseitige Regulation von c-Jun und ATF2 durch transkriptionelle Aktivierung und subzelluläre Lokalisierung - PubMed (nih.gov); März 2006; DOI: 10.1038/sj.emboj.7601020]. „ATP2“ wechselt die Position vom Zellkern zum Zytosol. Die Erweiterung „ATP2“ (§§) =505AS (Homodimer) liegt in der Randspalte Z.38364#_[52898140]§5§/#_{329}{77}{56}§4§§5§]/#_{130}{7887}§8§§8§]/#_[9320208]§1§§6§, und zwar aufsteigend in Z.38364 Spalte 4/8/1 für „481“_absteigend Spalte 8/6=QS=14_absteigend Spalte 5/[Grenze]/5=QS=“10“ mit 481_Summe 14+10=“24“ (Zeitbasis) mit Summe 481+24=“505“ für „ATP2“ (§§) =505AS (Homodimer). Das „ATP2-Homodimer“ ist bei der Aktivierung von Insulin-Genen gegenüber dem Monomer sekundär beteiligt. „ATP2“ {} ist im Komplex an „MafA (synonym: „RIPE3b1“)“ gebunden und interagiert auch mit „Pdx1“ und „NeuroD1/BETA2“ [ATF2 interacts with beta-cell-enriched transcription factors, MafA, Pdx1, and beta2, and activates insulin gene transcription - PubMed (nih.gov); S.Han; märz 2011; DOI: 10.1074/jbc.M110.209510].
Das Protein (Mensch) „MafA“ (µµ)=353AS liegt mit „ATP2“ {}/(§§) in der Spalte Z.38364#_[252898140]§5§/#_µ8µ{329}{77}{56}§4§§5§]/#_µ4µ{130}{7887}§8§§8§]/#_µ9µµ932µ[0208]§1§§6§/#_[573]µ3µ$47$17$12$], und zwar aufsteigend in Z.39365 Spalte 8/4/9=QS=“21“_932=QS=“14“ mit Summe 21+14=“35“_aufsteigend „3“ mit 35_3 für MafA (µµ)=353AS. „MafA“ reagiert auf „Glucose“=C6H12O6=96E, indem die interne Zahl „93“ 3-fach lesbar oder gebildet wird und extern mit der Ziffer „3“ zur Glucose=96E summiert wird [MAFA - Transcription factor MafA - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PDX1“ ($$)=283AS bindet an der MafA-Endziffer über die Randzahl „471712“, und zwar in Z.38368 als 47=QS=11=QS=“2“_17=QS=“8“_12=QS=“3“ mit 2_8_3 für „PDX1“=283AS. „PDX1“ aktiviert die Transkription von Insulin (INS). Die Ziffer „1“ in 7“1“7 ist die Startziffer „1“ von Insulin (INS)=110AS als Spalte 1/1/0 für INS=110AS [PDX1 - Pancreas/duodenum homeobox protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „PDX1“ ist außer für „Insulin“ auch für die Expression von „NKX6-1“ erforderlich [PDX1 - Wikipedia]. Protein (Mensch) „NKX6-1“ (~~)=367AS liegt neben „Insulin“ in der Spalte Z.38368#_[3]{3}µ47µ17µ12µ/#_~35~1~4~[1459]/#_[370]~3~[0040], und zwar in Z.38369 als 35_1 mit Summe 35+1=36_aufsteigend Spalte 3/4=QS=“7“ mit 36_7 für. „NKX6-1“ (~~)=367AS [NKX6-1 - Homeobox protein Nkx-6.1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „NeuroD1_BETA2“ (€€)=356AS bindet an „Cyclin D1“ und „MafA“ aufgrund ihrer gemeinsamen Endziffer „3“. „NeuroD1“ (€€) endet in der Insulin-Ziffer „1“ in der Zeile Z.38369#_€35€141€“459“, und zwar als 35_141=QS=6 mit 35_6 für „NeuroD1“ (€€)=356AS. „NeuroD1“ interagiert mit MAP3K10=954AS, das mit ATP und Magnesium als Randzahl „459“ gespiegelt für 954AS existiert [NEUROD1 - Neurogenic differentiation factor 1 - Homo sapiens (Human) | UniProtKB | UniProt].
10.) „Caseinkinase II (CK2)“:
10.1) Alter: In „ATF2“ ist das normierte Lebensalter=97 Jahre in der Zeitbasis „365“ zur Jahreszählung eingebettet. Über das Alter „97“ wird die Zeitbasis „365=1 Jahr“ mit Zeitbasis „24=1 Tag“ für den zirkadianen 24-Stunden-Rhythmus eingebunden, der alle Zellen erreicht. Um die eingefügte Zeitbasis „24“ herauszulesen, ist der Proteinkomplex „Caseinkinase II (CK2)“ erforderlich. Bingo! Tatsächlich, „CK2“ ist am Rhythmus beteiligt. „Eine ordnungsgemäße CK2-Funktion ist für das Überleben der Zellen erforderlich, da keine Knockout-Modelle erfolgreich generiert wurden“ [Kaseinkinase 2 – Wikipedia]. „CK2“ reguliert alle bösartigen Merkmale bei Krebs [„Proteinkinase CK2: ein potenzielles therapeutisches Ziel für verschiedene menschliche Krankheiten | Signaltransduktion und zielgerichtete Therapie (nature.com)“; C.Borgo u.a.; März 2021; DOI: https://doi.org/10.1038/s41392-021-00567-7].
Das Alter „97“ gehört zur Ringspalte Z.38365#_“29“7[…]/#_“3“[0]7[…]/#_“3“20“[…] und zwar als 29=QS=11(Zählgröße)=QS=2_aufsteigend Spalte 3/3=QS=6_20=QS=2_absteigend Spalte 7/7=QS=14 mit Summe 2+6+2+14=Zeitbasis=“24“. Die ringförmige Zeitbasis „24“ fordert eine tägliche Wiederholung, wobei zusätzlich ein Motivationsring „O“(Null) eingeschlossen wird. „CK2“ bildet ein Tetramer aus „2“ katalytischen Alpha-Untereinheiten [„CSNK2A1“: „CSNK2A2“] und „2“ regulativen Beta-Untereinheiten [„CSNK2B“]. „CSNK2B“ (Mensch nur 1 Typ) sorgt für Enzymstabilität (Nadelform) und wählt die Substrate aus (Randnähe). Die Alpha-Untereinheiten bilden gemischt ein Heterodimer oder doppelt ein Homodimer. Die beiden Beta-Untereinheiten sind zwar verbunden, aber nicht wie ein Homodimer gespiegelt verbunden, sondern sind den beiden Alpha-CK2 jeweils zugeordnet. „CK2“ ist auch in monomerer Form aktiv. „CK2“ reagiert nicht auf äußere Reize, sondern ist bereits als Signalverstärker vorhanden und wird in Krebszellen überexprimiert. „CK2-Inhibitoren“ wie „CX-4945“/“CIGB-300“ werden klinisch erprobt. „Silmitasertib (CX-4945)“=C19H12ClN3O2=114+12+17+21+16=180E hemmt beide „Alpha-CK2“. „CX-4945“ (**)=180E hemmt CK2, indem die Position der dimeren Koppel-Spalte „7:0“ der beiden „Alpha-CK2“ am Start besetzt wird, die Startziffer „2“ für „Beta-CK2“ folgt mit einer Schleife bis in die Ziffer „2“ am medikamentösen Zeilenrand (Abbau der Wirkstoffe). Die Randziffer „2“ gehört zur klassischen ATP-Spalte „12/59“, wodurch die ATP-Energieversorgung gehemmt wird. Das Medikament ist – wie hier erst nachträglich festgestellt - optimal angelegt in der Spalte Z.38366#_[30]*7*[8]*87*[88]/#[32]*0**20**81*[6]/#_[334717]*12*, und zwar aufsteigend in Z.38366 in Spalte 7/0 für „70“_20=QS=“2“_absteigend “87“_aufsteigend 81=QS=“9“_aufsteigend „12“ mit Summe 70+2+87+9+12=„180“ für „CX-4945“ (**)=180E.
„CK2“ beeinflusst Proteine, die den zirkadianen Rhythmus regulieren. „Bei Säugetieren phosphoryliert „CK2“ das maßgebliche „PER2“ und führt zu Kernakkumulation oder Abbau und phosphoryliert auch „BMAL1“, was zu einer Kernakkumulation führt“ [Zellbasiertes Screening identifiziert einen neuen potenten und hochselektiven CK2-Inhibitor zur Modulation des zirkadianen Rhythmus und des Krebszellwachstums - PMC (nih.gov); T. Oshima u.a.; Jan 2019; DOI: 10.1126/sciadv.aau9060]. Der „CK2-Hemmer“, der Wirkstoff „GO289“ (°°)=C17H15BrN4O2S=102+15+35+28+16+16=212AS ist ein zirkadianer Uhrmodifikator, der die zirkadiane Periode der zellulären Uhr verlängert. „GO289“ startet im „24er Uhrenring“, wobei über die Koppel-Spalte „0:2“ beide „Alpha-CK2“ gehemmt werden. „GO289“ kreuzt „Beta-CK2“ und endet in der Mg-Randzahl „12“ in der Spalte Z.38367#_[3]°0°°7°[88788]/#_°3°2°°0°°20°°8°[16]/#_[33471]°7°°12°, und zwar „GO289“ (°°) in Z.38366 als „3“_absteigend Spalte 0/2 für „20“_aufsteigend Spalte 7/0 für „70“_“20“_aufsteigend 8/7 für „87“_“12(Rand) mit Summe 3+20+70+20+87+12=“212“ für „GO289“ (°°)=212AS.
10.2) Alpha-CK2: Die Casein Kinase II, Untereinheit „CSNK2A1“ ist hier bereits aus der Interaktion mit „CDC25B“ bekannt. „CSNK2A1“ {} 391AS liegt in der Spalte Z.38365#_{329}{7}[75645]/#_[1]{30}{7}[88788], und zwar in Z.38366 als 30=QS=“3“_absteigend Spalte 7/7 für „77“_links 329=QS=“14“ mit „3“_Summe 77+14=“91“ mit 3_91 für „CSNK2A1“ {}=391AS [CSNK2A1 - Casein kinase II subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) “CSNK2A2“ ()=350AS umschließt die Spalte [3/5=QS=“8“=EXTRA] in der Spalte Z.38365#_{329}{7}[75645]/#_[1]{30}{7}[88788]/#_ [9](32)(0)[20816]/#_[7](3)[3](4)[71712]/#_[5](3)[5](1)[41459]/#_[3](3)(7)(0)[30040], und zwar absteigend in Z.38268 Spalte 3/3/3 dominant für „333“_absteigend 32=QS=“5“_aufsteigend Spalte 0/4/1/0=QS=“5“_Ringschluss „7“ mit Summe 333+5+5+7=“350“ für “CSNK2A2“ ()=350AS [CSNK2A2 - Casein kinase II subunit alpha' - Homo sapiens (Human) | UniProtKB | UniProt].
10.2) Beta-CK2: Das Protein (Mensch) „CSNK2B“ (§§)=215AS (1.Monomer) bindet an „CSNK2A1“ {} mit einer unlesbaren Zinkbindung, die üblich in Variationen von „7“887=QS=Zink=“30“ realisiert wird. Weil „CSNK2A1“ außer dem lesbaren Zink auch die Ziffer „7“ besetzt, wird die Zahl „8-8“ in einer Ringzählung als Anfang/Ende gespalten und die fehlende Ziffer „7“ vertikal als Start-Spalte „7/8“ besetzt. Das 1.Monomer von „CSNK2B“ (!!) liegt in der Spalte Z.38365#_{329}{7}§7§§56§§4§[5]/#_[1]{30}{7}§8§§87§§8§[8], und zwar ringförmig absteigend in Z.38365 Spalte 7/8 für „87“_56=QS=11=QS=“2“_aufsteigend 4/8 für „48“_87 links für „78“ mit Summe 87+2+48+78=215 für „CSNK2B“ (!!)=215AS (1.Monomer). Das Protein (Mensch) „CSNK2B“ (||)=215AS (2.Monomer) bindet nadelförmig an „CSNK2A2“ () mit einer lesbaren Zink-Bindung „30“ in der Spalte Z.38320#_[9](32)(0)|2|[0816]/#_[7](3)[3](4)|7|[1712]/#_[5](3)[5](1)|4||1|[459]/#_[3](3)(7)(0)|30|[040], und zwar in Z.38367 als „2“_aufsteigend Spalte 7/4=QS=“11“_aufsteigend 30 (Zink)=QS=“3“_absteigend „1“ mit „2“_Summe 11+3+1=“15“ mit für „CSNK2B“ (||)=215AS (2.Monomer) [CSNK2B - Casein kinase II subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Für die Interaktion von „CK2“ sind die Uhren-Proteine „PER2“ und „BMAL1“ hier bereits bekannt. „PER2“=1255AS zieht von Z.38370 absteigend bis Z.38365 mit einer dominanten Einzelzählung komplett durch alle „4“ Untereinheiten, und zwar zeilenweise lesbar als Summe 37+514+347+202+78+77=“1255“ für „PER2“ =1255AS [PER2 - Period circadian protein homolog 2 - Homo sapiens (Human) | UniProtKB | UniProt]. „BMAL1“=626AS zieht in Gegenrichtung verkürzt durch die von „PER2“ aktivierte Spalte mit Start in Z.38365 über die Spalte 7/7 für „77“ bis Z.38368, und zwar als dominante Einzelzählung mit Summe 77+0+202+347=“626“ für BMAL1“ {}=626AS [BMAL1 - Basic helix-loop-helix ARNT-like protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Prinzip der dominanten Einzelzählung ist somit bestätigt!
11.) Histone: Das BiXnom-Master-Protein „ATF2“ ist eine „Histon-Acetyltransferase (HAT)“, die spezifisch die Histone „H2B“ / „H4“ in vitro („im Glas“) acetyliert. Die „4“ verschiedenen Histone bilden einen octameren Kern, um den sich die „DNA“ wickelt. „H2B“ und „H4“ gehören zu verschiedenen Dimeren, die sich zum Tetramer verdoppelt, um gemeinsam ein Octamer zu bilden.
11.1) „Maße“: Maße wurden an anderer Stelle bereits festgestellt, sind aber auch hier zu finden: Die von der „DNA“ umwickelten Histon-Oktamere gruppieren sich linear als DNA-Kette, die kürzer als die DNA-Gesamtlänge=1,8 m ist. Jedes Histon-Oktamer wird von „1,65“ DNA-Spiralwindungen („146“ Basenpaare) umwickelt, so dass ein Faserdurchmesser von „10“ nm entsteht. Die Histon-Oktamere sind durch die "Linker"-DNA aus „10-60“ Basenpaaren getrennt. Die einfache "Perlen-auf-einer-Schnur"-Anordnung wird zu 30 nm dicken Fasern gefaltet. Für diesen Querschnitt werden „6“ Histon-Oktamere zum Ring-Querschnitt gefaltet. Das „Histon H1“ dient der Stabilisierung, kennt aber auch Maße. Links neben den beiden männlichen / weiblichen Histonen „H1t“/„H1oo“ wird in Z.38361 die Spalte 1/4/0[60] für 140 Basenbase mitgezogen (aufgewickelt) und seitlich werden einerseits 6 bp für 146bp ergänzt und andererseits sind 60 bp als DNA-Verbindungsstränge vorhanden, die mit der Wicklung=Kreis=“64“ über die Spalte „60/4“ für „64“ verbunden sind. Diese Treppe als 140/6[4] setzt sich kombiniert als 146/64 in Z.38365 für die 2. Windung mit der lesbaren Windung „64“ fort. Die Endziffer „4“ der Maß-Treppe setzt sich als Ring fort, um den Zweck der Wicklung, die Bildung einer Perlenkette, mit dem Winkel „180°“ „linksdrehend“ zu erzeugen, und zwar absteigend in Zeile Z.383“64“ als Spalte 0/4 für 40°_absteigend über „0608“ links für 80°_60° mit Summenwinkel 40+80+60=180° (DNA-Streckung). „Dadurch entsteht der oktamere Nukleosomenkern (englisch core particle), um den sich die DNA in ca. zwei großen linksgängigen Windungen legen kann“ [Histon – Wikipedia].
Ohne Umwicklung besitzt das Histon-Oktamer statt 10 nm nur einen Durchmesser von 6,3 nm, was eine Interpretation voraussetzt. Zwischen Zink=30E für 30 nm und der Spalte 0/1 für 10 nm, ist die Anzahl „6“ mit der Ring-O(Null) kombiniert, und zwar in der Spalte Z.38366#_“30“[7887…]/#_[320]“2““0“[8…]/#[33]“47““1“[7…] absteigend in Z.38368 Spalte 0/1[7=Form] für 10 nm_“2“_aufsteigend=47=QS=11(Zählgröße)=QS=“2“_absteigend 20=QS=“2“ mit 10 nm_Summe 2+2+2=“6“ Oktamere_absteigend 30 für 30 nm. In Leserichtung sind entweder nur 10 nm oder nur 30 nm lesbar. Die Zahl „30“ ist somit zeitweise überschüssig und dient dann als Kommastelle. Statt der Anzahl= „6“ Histon-Oktamere dient die Zahl „6“ als Maßzahl=6 nm, und zwar für „6“ absteigend „0“_links „3“ für „Oktamer-Durchmesser“=6,3 nm (63 Angström). Die Zahl „30“ (7=Form) ist für diesem Zweck mit der Form=7 kombiniert und im Durchlauf ist eine Zählgröße „11“[=QS=2] enthalten. Erstmals fällt eine Fortsetzung in Z.38367 als Spalte „0/1/1/[3]0/7““ auf. Real besteht die Fortsetzung darin, dass die „Histon-Perlenkette“ mit der auf die Histone gewickelten chromosomalen DNA „nochmals“ zum Chromosom komprimiert wird. Während der Kernteilung besitzen Chromosomen eine Stäbchen-Form. „Diese sind etwa „1“ bis „50“ µm [1000 nm bsi 50000 nm] lang, was ca. 1/10.000 der ursprünglichen Länge entspricht. Wie dieser Vorgang organisiert wird, ist derzeit (2023) noch unklar. Die resultierende Form wird als Metaphasenchromosom bezeichnet.“ [Chromosom - DocCheck Flexikon]. Die besondere Spalte enthält mit dem 2. lesbaren Zink=30E den Nanomter-Umrechnungsfaktor 1*1000 nm. Die notwendige Form=7 [43] ist an die Spalte angehängt.“Wow“. das ist aber easy: Die Form „7“ ist mit der Zahl „43“ für die maximale Chromosomen-Länge=Summe 7+43=50 * Faktor 10³=50 000 nm. Funktionell wird nach dem Histon-Winkel „180°“ nunmehr der volle Chromosomen-Winkel=360° summiert, und zwar in der Spalte Z.38371#_[7]“0“3“[0040]/#_“91“37438/#_“14“6“[3636]. Der Prozess wird über den „Zirkadianen Rhythmus“ mittels der Zeitbasis “24“ angeschoben, um alle Zellen zu adressieren, weil alle Zellen Chromosomen enthalten. Physiologische Vorgänge werden dabei auf eine Periodenlänge von „24“ Stunden synchronisiert. „Chromosomen-Winkel“=360° über Zeitbasis=24 (Symbol) in Spalte „91/14“ als „14“_absteigend 91=QS=“10“ mit Summe 14+10=“24“_absteigend Wende „0“_aufsteigend Spalte 3/3/6 für „336“ mit Summe 24+0+336=“360“ für „Chromosomen-Winkel“=360°. Zellen können Informationen erben, die nicht in Genen enthalten sind. Spezialisierte Zellen haben die Fähigkeit, sich an ihre individuelle Identität zu erinnern, indem sie wissen, welche Gene aktiviert sein müssen oder nicht oder sogar, indem sie sich selbst kopieren. Projekt EPICENTROMERE ("Determining the epigenetic mechanism of centromere propagation"): „In dieser neuesten Studie zeigen die Forscher wie die gleichen Mechanismen, die den bekannten Prozess der DNA-Duplizierung steuern, dies auch für die CENP-A-Duplizierung tun. Diese Mechanismen wirken wie eine molekulare Uhr, sie regen die verschiedenen Schritte des Zellzyklus nacheinander an“ [Ein genetisches Rätsel lösen (europa.eu)]. „CENP-T“ und „CENP-W“ bindet verspätet an „CENP-A“. Die Zeitbasis „24“, integriert im Chromosom-Winkel 360° (vollgewickelt), wird hier von „CENT-T“ induziert.
11.2) Histon H1: Das „Histon H1“ bindet am „Histon-Octamer“. Die Episode „EPI.VIR“ kontrolliert den korrekten Zusammenbau des Octamers. Histone enthalten keine Introns, so dass eine dominante Einzelzählung notwendig ist. „Histon H1“ wird vorgelagert an den Grenzübergang gestellt. Das Protein (Mensch) „Histon H1.0“=194AS liegt in der Spalte Z.38364#_[2528]“981“[405]/Grenze/#_[832977]“5“[645], und zwar in Z.38365 als „5“_absteigend 981 links für „189“ mit Summe 5+189=“194“ für „Histon H1.0“=194AS. Das Histon „H1.0“ gehört zu den „11“ „H1-Subtypen“ mit unterschiedlichen Längen [H1-0 - Histone H1.0 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Startziffer „1“ von „Histon H1.0“ ist zugleich die Startziffer „1“ von „p53" in der Randzahl „140“, so dass eine Interaktion vorliegt [„Linker-Histon H1 und Protein-Protein-Wechselwirkungen - PMC (nih.gov)“; J. Hansen u.a.; Okt 2015; DOI: 10.1016/j.bbagrm.2015.10.004]. „p53“-Zielgene werden durch das Protein (Mensch) „CHD8“ (!!)=2581AS in der Spalte Z.38364#_!1!!4!!0![5]/#_!5!!6!!4![5]/#_[8]!7“[88]/#_[0]!8![16] unterdrückt, und zwar aufsteigend in Spalte 1/5 für „15“_absteigend Spalte 6/4=QS=“10“ mit Summe 15+10=“25“_aufsteigend Spalte 0/4/8=QS=12=QS=“3“_7/8 für „78“ mit „25“_Summe 3+78=“81“ mit 25_81 für „CHD8“ (!!)=2581AS [CHD8 - Chromodomain-helicase-DNA-binding protein 8 - Homo sapiens (Human) | UniProtKB | UniProt]. Die anderen Histone halten an der Startziffer „1“ fest, wobei sich in der Spalte 60/140 ein Basiswert „200“ bildet. Das Protein (Mensch) „H1-t“=207AS ist eine „Hoden-spezifisches Histon H1“ während der Spermatogenese. Für dem männlichen Bezug „33“ wird die Zahl „22“ und die Spalte „1/1“ in der Spalte Z.38361#_“22“7“1“/#_“9“70“1“/#_“6“[085]/#_“1“[405] durchlaufen, und zwar absteigend in Z.38362 Spalte „9/6/1“ für „169“_absteigend “22“_Form=“7“_aufsteigend 1/1=QS=“2“_70=QS=“7“ mit Summe 169+22+7+2+7=“207“ für „H1-t“=207AS [H1-6 - Histone H1t - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Histon H1c_H1.3“=221AS wird während der Oogenese schnell durch „H1oo“ ersetzt. „H1c“ positioniert sich ordnungsgemäß mit der Startziffer „1“, so dass „H1oo“ mit abweichender Startposition nachrückt, um dem funktionellen Zweck zu dienen. Histon „H1c“ liegt in der Spalte Z.38361#_“22“[71]/#_“9“[701]/#_“6““08“[5]/#_“140“[5], und zwar in Z.38364 als „140“_absteigend links 08=QS=“8“_absteigend Spalte 9/6 für „69“_absteigend 22=QS=“4“ mit Summe 140+8+69+4=“221“ für „H1c_H1.3“=221AS [H1-3 - Histone H1.3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Histon H1oo_H1.8“=346AS ist ein „Eizellen-spezifisches Histon H1.8“ während der Oogenese. „H1oo“ zielt ebenfalls auf die Zählgröße 1/1 am Rand ab, um die männliche Endzahl „70“ ringförmig als Extra „8“ in der Ei-Spalte „7O/O8“ einzufangen. Es folgt ein Ringschluss über die Zeitbasis „24“. Das Histon „H1oo“ zählt zunächst die Zeitbasis „60“, um eine Spalte „6/1/5“ mit „6“_QS1+5=“6“ mit 6_6 für das notwendige Symbol „66“ (weiblich) zu erzeugen. „Histon H1oo“=346AS liegt in der Spalte Z.38361#_“22“71“/#_“9“[70]“1“/#_“6“[08]“5“/#_“1““4“0““5“/#_ „56““4“[5], und zwar in Z.38365 als „56“_absteigend „4“_absteigend in der Spalte „9/6/1“ für „169“_absteigend „22“_“71“_aufsteigend Spalte 1/5 für „15“_aufsteigend „5“_aufsteigend Spalte 0/4=QS=“4“ mit Summe 56+4+169+22+71+15+5+4=“346“ für Histon „H1oo_H1.8“=346AS [H1-8 - Histone H1.8 - Homo sapiens (Human) | UniProtKB | UniProt].
11.3) Histone „H2B“ / „H4“: Die beiden von „ATF2“ gebunden, aber selbst nicht verbundenen Histone „H2B“ / „H4“ müssen eine Verdopplung ermöglichen, und zugleich müssen das Dimer „Histone H2A: H2A“ und das Dimer „Histone H3:H4“ zur Positionsbestätigung ermittelt werden. „H3“ und „H2A“ werden von „ATF2“ nicht gebunden, so dass diese im Dimer direkt auf „ATF2“ sitzen müssen. Das Dimer „Histone H3:H4“ verfügt über eine Besonderheit, um ein Tetramer anzulegen.
„Lysin"=C6H14N2O2=36+14+14+16=80E wird auf Histonproteinen acetyliert, wobei eine Acetylgruppe von Acetyl-CoA Acetyl-CoA=C23H38N7O17P3S=138+38+49+136+45+16=422E übertragen wird [Aktivierung des Transkriptionsfaktors 2 – Wikipedia]. Für die Acetylgruppe ergibt sich ein Acetyl-Rest= C2H3O=12+3+8=23E [Acetylgruppe – Wikipedia]. Die lesbare Zahl „32“ liegt, links für „23E“, an der Kontur, gefolgt von „2“ Lysin-Einbindungen als Spalten „intern=78/2=extern“ und „intern= 8/0=extern“ für Lysin=80E.
Das Protein (Mensch) „Histon H2A“_left (@@)=130AS liegt im linken Dimer lesbar auf „ATF2“ in der Zeile Z.38366#_@130@[788788], und zwar als „130“ für „Histon H2A“_left (@@)=130AS. Das Protein (Mensch) „Histon H2A“_right (©©)=130AS zieht im rechten Dimer wendelförmig (alle Spalten „auf/ab“ usw.) durch „ATF2“ zum rechten Rand in der Spalte Z.38365#_[329]©775©©6©©4©[5]/#_@130@©788©©7©©8©[8], und zwar 775=QS=“19“_aufsteigend 788=QS=“23“_absteigend Spalte 6/7 für „76“_rechts neben ATF2-Spalte 4/8=QS=“12“ mit Summe 19+23+76+12=“130“ für „Histon H2A“_right (©©)=130AS [H2AC18 - Histone H2A type 2-A - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Histon H2B“_left ($$)=126AS als Dimer mit „Histon H2A“_left (@@) und somit in vito gebunden an „ATF2“ liegt in der Spalte Z.38365#_[329]©775©©6©©4©[5]/#_@130@©788©©7©©8©[8]/#_$9$$3$$2$[020816]/#_$7$$3$$3$[471712], und zwar aufsteigend in Z.38367 Spalte 9/7 für „97“_absteigend Spalte 3/3=QS=“6“_aufsteigend Spalte 2/3 für „23“ mit Summe 97+6+23=“126“ für „Histon H2B“_left ($$)=126AS. Das Protein (Mensch) „Histon H2B“_right (€€)=126AS als Dimer mit „Histon H2A“_right (©©) und somit in vito gebunden an „ATF2“ liegt in der Spalte Z.38365#_[329]©775©©6©©4©[5]/#_@130@©788©©7©©8©[8]/#_$9$$3$$2$[0]€20€€8€€1€[6]/#_$7$$3$$3$[4]€71€€7€€1€[2], und zwar in Z.38368 als links 71=QS=“8“ absteigend „20“_aufsteigend Spalte 8/7 für „87“_absteigend Spalte 1/1 für „11“ mit Summe 8+20+87+11=“126“ für „Histon H2B“_right (€€)=126AS [H2BC3 - Histone H2B type 1-B - Homo sapiens (Human) | UniProtKB | UniProt].
11.4) Dimer „H2A:H2B“ / Dimer „H3:H4“: Das doppelte Dimer „H2A:H2B“ wird auf das doppelte Dimer „H3:H4“ montiert, das sich als gegenläufige Zählung doppelt zählt und zeitlich vorgelagert auf der Position beider Histone „H2B“ liegt. Die Histone „H2B left/right“ sind durch die Spalte [0/“4“] getrennt, die mit der Ziffer „4“ die Montage an das „Tetramer H3:H4/ H3:H4“ fordert. Am rechten Rand steht die Ziffer „2“=paarig für insgesamt „8“ Histone (Octamer).
Das Protein (Mensch) „Histon H4“_linksdrehend“ (||)=103AS liegt als Heterodimer mit H3_rechtsdrehend {} in der Spalte Z.38366#_[130788788]#_|9||3|{2020}{8}[16]/#_|7||3|[3471]{7}[12]/#_[535141]{45}[9], und zwar aufsteigend in Z.38367 Spalte 9/7 für „97“_absteigend Spalte 3/3=QS=“6“ mit Summe 97+6=“103“ für Histon H4“_linksdrehend“ (||)=103AS. Das Protein (Mensch) „Histon H4“_rechtsdrehend“ (;;)=103AS liegt als Heterodimer mit H3_linksdrehend () in der Spalte Z.38366#_[130788788]#_;93;(2020)(8)[16]/#_;73;[3471](7)[12]/#_[535141](45)[9], und zwar in Z.38367 als „93“_aufsteigend 73=QS=“10“ mit Summe 93+10=“103“ für „Histon H4“_rechtsdrehend“ (;;)=103AS [H4C1 - Histone H4 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Histon H3“_rechtsdrehend“ {}=136AS liegt in der Spalte Z.38366#_[130788788]#_[93]({2020})({8})[16]/#_[733471]({7})[12]/#_[535141]({45})[9], und zwar in Z.38367 als 2020=QS=“4“_aufsteigend Spalte 8/7 für „87“_“45“ mit Summe 4+87+45=“136“AS. In Gegenrichtung zählbar, das „Histon H3“_linksdrehend“ ()=136AS in Z.38369 als 45 links für „54“_absteigend Spalte 8/7 für „78“_„2020“=QS=“4“ mit Summe 54+78+4=“136“AS [H3-3A - Histone H3.3 - Homo sapiens (Human) | UniProtKB | UniProt].
Die chromosomale DNA wird bei der Interaktion mit Hsitonen komprimiert. Während der Kernteilung besitzen Chromosomen eine Stäbchen-Form. „Diese sind etwa 1 bis 50 µm lang, was ca. 1/10.000 der ursprünglichen Länge entspricht. Wie dieser Vorgang organisiert wird, ist derzeit (2023) noch unklar. Die resultierende Form wird als Metaphasenchromosom bezeichnet.“[ Chromosom - DocCheck Flexikon].
12.) „Centromer-Proteine“ (Zentromer):
Im Ergebnis der Replikation entstehen 2 DNA-Doppelstränge, die getrennt als Chromatiden verpackt werden (2 Schwesterchromatide) [Zwei-Chromatid-Chromosom in der Metaphase]. Das Centromer teilt das Chromatid in einen langen und 1 einen kurzen Arm; bei metazentrischen Chromosom mittig. „Im Bereich des Centromers hängen die beiden Chromatiden noch zusammen, bis sie zu Beginn der Anaphase einer Kernteilung – bei der Mitose oder bei der zweiten meiotische Teilung – getrennt werden “ [Centromer – Wikipedia]. Am Centromer ausbildenden Proteinkomplexen, (Kinetochore) setzen die Fasern des Spindelapparates an und ziehen die getrennten zwei Chromatiden zu entgegengesetzten Zellpolen. Die Centromer-Position wird von „CENPA“ vererbt.
„CENPA“: Die Zentromer-assoziierten Proteine „CENP-A, -T; -W;-S; -X und –E“ stehen in einem Zusammenhang, weil „CENPA“ eine Modifikation von „Histon H3“ ist. Das Protein (Mensch) „CENPA“ (°°)=140AS ist eine „Histon H3-Modifikation“, die auf jedem Chromosom die Kinetochor-Position fixiert. Visuell ist ersichtlich, dass bei der Modifikation die zusätzlichen „4“ AS in Z.38370#_00“4“0 mit 136+4=140AS am „Histon H3_rechtsdrehend“ {} =136AS angehängt werden. „CENPA“ (°°) in Z.38367 als 2020=QS=“4“_aufsteigend Spalte 8/7 für „87“_“45“_aufsteigend „4“ mit Summe 4+87+45+4=“140“AS für „CENPA“ (°°)=140AS. Hierdurch wird eine Dopplung durch Rückwärtszählung verhindert, und somit kann H4:CENPA kein Tetramer erzeugen [CENPA - Histone H3-like centromeric protein A - Homo sapiens (Human) | UniProtKB | UniProt] Das Protein (Mensch) „HJURP“ (^^) =748AS besetzt den Zeilenand und legt sich schützend um die „4 AS“-Verlängerung in der Spalte Z.38367#_°2020°°8°^16^/#_[3471]°7°^12^/#_[51]^41^°45°^9^/#_[703]^0^[0]°4°^0^/#_[913]^743^^8^, und zwar in Z.38367 als links 16=QS=“7“_aufsteigend „12“_aufsteigend Randspalte 9/0/8=QS=“17“_743=QS=“14“_absteigend 41=QS=“5“ mit 7_Summe 12+17+14+5=48 mit 7_48 für „HJURP“_long (^^) =748AS. Im Ergebnis wird die „0“(Null) als Fixpunkt eingeschlossen [HJURP - Holliday junction recognition protein - Homo sapiens (Human) | UniProtKB | UniProt]. Die Modifkation, Protein (Mensch) „HJURP“_short (~~) =570AS bindet „CENPA“ (°°) abweichend auf der linken Seite und besetzt mit der Endzahl die „0“(Null), die von „HJURP“(^^)=748AS eingeschlossen wird. Die Modifikation „HJURP“ (~~) liegt in der Spalte Z.38367#_°2020°°8°[16]/#_[3471]°7°[12]/#_[5141]°45°[9]/#_[70300]°4°[0]/#_[9137438], und zwar in aufsteigend Z.38368 Spalte 4/1 für „41“_41=QS=“5“_aufsteigend Spalte 0/7=QS=“7“_“4“ mit Summe 41+5+7+4=“57“_absteigend „0“ mit 57_0 für Modifikation „HJURP“ (~~) =570AS [HJURP - Holliday junction recognition protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CENPT“ (**)=561AS bindet links an der Kontur von „HJURP“_¬long (^^)=748AS, um dessen Schutzwirkung durch einen Anschluss an „CENPA“ in der Spalte Z.38367#_°2020°°8°^16^/#_[3]*4*[71]°7°^12^/#_[5]*1*^41^°45°^9^/#_[7]*0**3*0^[0]°4°^0^/#_[9]*1**3*^743^^8^ zu vollenden, und zwar aufsteigend in Z.38368 Spalte 4/1/0=QS=“5“_aufsteigend Spalte 3/3=QS=“6“_links „1“ mit 5_6_1 für „CENPT“ (**)=561AS. „Komponente des heterotetrameren CENP-T-W-S-X-Komplexes, der DNA bindet und superwickelt und eine wichtige Rolle bei der Kinetochor-Assemblierung spielt“. [CENPT - Centromere protein T - Homo sapiens (Human) | UniProtKB | UniProt].
Der Komplex weitert sich aus, so dass eine geordnete Anordnung erforderlich ist, die eine Bewegung erzwingt. Zum „Zentromer-assoziierten Netzwerk (CCAN)“ gehören „16“ Kinetochorproteine [CENP-C, CENP-H, CENP-I, CENP-K, CENP-L, CENP-M, CENP-N, CENP-O, CENP-P, CENP-Q, CENP-R, CENP-S, CENP-T, CENP-U, CENP-W, CENP-X), die während des gesamten Zellzyklus im Zentromer lokalisiert sind [CDK1-vermittelte CENP-C-Phosphorylierung moduliert CENP-A-Bindung und mitotische Kinetochor-Lokalisierung - PMC (nih.gov); R. Watanabe; Nov.2019; DOI: 10.1083/jcb.201907006]. „CENP-E“ wird spät ergänzt. „CENP-A“ wird durch „CENP-C (!!) und „CDK1“ („“) - wie bekannt - positioniert. „CDK1“=297AS besetzt in Z.38365 die Spalte [„3““29“/“130“] und „CENP-C“ verbindet „CDK1“ mit „CENP-A“ an der Startziffer °2° in der Spalte Z.38365#_[8]“3“29“…/#_!4!“130“…/#_!9!93!°2°… mit „CENP-C“ als Spalte 4/9=QS=13=QS=4_93 für „CENP-C“= (!!) =493AS [CENPC - Centromere protein C - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPB“: Das Protein (Mensch) „CENPB“ (µµ)=599AS gehört nicht zum „CCAN“-Netzwerk. „CENPB“ muss die Position von CENTA (°°) besetzen, weil es ein verlorenes „CENTA“ (°°) =140AS wieder an die korrekte Position heranführt. „CENPB“ (µµ) liegt mit CENTA“ (°°) in der Spalte Z.38367#_µ3°20µ20°°8°µ[16]/#_[33471]µ°7°1µ[2]/#_[35141]°45°[9]/#_[370300]°4°[0], und zwar in Z.38367 als „320“_“208“_aufsteigend „71“ mit Summe 320+208+71=599AS. Die angehängte Zahl „71“ dient gespiegelt als Motivation zur Bindung von „17“ Basenpaaren. „Interacts with centromeric heterochromatin in chromosomes and binds to a specific 17 bp subset of alphoid satellite DNA, called the CENP-B box“ [CENPB - Major centromere autoantigen B - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPW“: Im „CENP-T-W-S-X-Komplexes“ bindet das Protein (Mensch) „CENPW“ (ww)=88AS rechts an CENPT (**) in der Spalte Z.38368#_[33]*4*w71wµ71µ[2]/#_x3xx5x*1*[4]w1w[459]/#_x3xx7x*0**3*w0w[040]/#_3s9s*1**3*w7ws4s[38]/#_4s1ss4s63s6s[36]/#_s44s[008616], und zwar in Z.38368 als 71_aufsteigend Spalte 1/0 für „10“_aufsteigend „7“ mit Summe 71+10+7=“88“ für „CENPW“ (ww)=88AS [CENPW - Centromere protein W - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPX“: Das Protein (Mensch) „CENPX“ (xx)=81AS bindet links an CENPT (**), und zwar in Z.38369 über Spalte 35/37 absteigend 5/7 für „75“_aufsteigend 3/3=“6“ mit Summe 75+6=“81“ für „CENPX“ (xx)=81AS [CENPX - Centromere protein X - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPS“: Das Protein (Mensch) „CENPS“ (ss)=138AS verbindet den CENP-T-W-S-X-Komplex, und zwar aufsteigend in Z.38371 Spalte 4/6 für „46“_63 links für „36“ _“4“_absteigend Spalte 9/1=QS=“10“_aufsteigend Spalte 3/4 für „34“_aufsteigend 44(Gruppe)=QS=“8“ mit Summe 46_36_4_10_34_8=“139“ für „CENPS“ (ss)=138AS [CENPS - Centromere protein S - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPE“: Das Protein (Mensch) „CENPE“ {} =2701AS ist ein Kinesin-ähnliches Motorprotein, das sich in der G2-Phase des Zellzyklus anreichert. Im Gegensatz zu anderen Zentromer-assoziierten Proteinen ist es während der Interphase nicht vorhanden und tritt erst während der Prometaphase in der Zentromerregion der Chromosomen auf [Zentromerprotein E – Wikipedia]. „CENPE“ ist motiviert die Randzahl 2363 winkelförmig linksdrehend mit der Spalte 733 für 337 mit Summe 2363+337 =2700 zu addieren, was aber wegen der falschen Richtung und der fehlenden Endziffer „1 scheitert. „CENPE“ rechtsdrehend für „2_701“ über eine typische Zentromer-Spalte 0/0, die für „ATP“ notwendign ist. Es bildet sich eine Ringform, die das externe Gewebe „33“ als Randspalte 3/3 einbindet. CENPE“ {} =2701AS liegt in der Spalte Z.38373#_[008]{61}{6}/#_[77]{2}{36}{3}/#_[75]{4}[8|5]{7}|/#_[95]|{6}{0}|[|83|]/#_[37|6]{0}|{2}[3], und zwar als „2“_absteigend Spalte 0/0=QS=“0“ mit Summe 2+0=“2“ absteigend Spalte 2/4/6 für „642“_“36“_absteigend 61=QS=“7“_“6§_aufsteigend Spalte 3/7=QS=“10“ mit „2“_Summe 642+36+7+6+10=“701“ mit 2_701 für „CENPE“ {} =2701AS. „ATP“ (||)=260E spektakulär absteigend in Z.38376 Spalte „60/60“_absteigend Randspalte „57/83“ mit Summe 60+60+57+83=“260“ für „ATP“ (||) =260E. Diese Einzelzählung ist dominant, so dass das Chromosom an diese neue ATP-Position bewegt wird. ATP“ (||) wirkt in der Katalyse mit „L-serine residue“ [CHEBI:29999] (**)=C3H5NO2=46E zusammen, dass die Position am Zeilenrand fortsetzt. Entsprechend entwickelt sich in der Katalyse das „ADP“ bis in diese Zone, und zwar in der Z.38373#_[008]{*6*}{*16*}/#_[77]{2}[*3**63*]/#_[75]{*4*}[*8*|5]{7}|/#_[95]|{6}{0}|[|83|]/#_[37|6]{0}|{2}[3] „L-serine residue“=46E Z.38375 als „4“_absteigend Spalte 6/3/8=QS=“17“_“16“_aufsteigend 63=QS=“9“ mit 4+17+16+9=“46“ für 46E [CENPE - Centromere-associated protein E - Homo sapiens (Human) | UniProtKB | UniProt]. An der CENPE-Position werden andere Proteine lokalisiert. Das Protein (Mensch) „BUB1B“ („“)=1050AS benötigt das „ATP“. Für die Katalyse kann das ADP=220E teilweise aus der ATP-Spalte 60/60 gewonnen werden. Die Restzahl „100“ liegt absteigend am Zeilenrand, und zwar „ADP“=220E als 60/60 für „120“ _“83“_absteigend Randspalte 3/7=QS=“10“_absteigend Spalte 1/6=QS=“7“ mit Summe 120+83+10+7=“220“ für ADP=220E. „BUB1B“ (§§)=1050AS nimmt das ADP schleifenförmig in der Spalte Z.38373#_[86]“1““6“/#_“23““6““3“/#_48“5““7“/#_“6““0“[83] auf, und zwar als absteigend in Z.38375 Spalte 6/3/7 für „736“_aufsteigend Spalte 1/6/5 für „165“_aufsteigend Spalte 8/0 für „80“_absteigend Spalte 4/6 für „64“_absteigend 23=QS=“5“ mit Summe 736+165+80+64+5=“1050“ für „BUB1B“ („“)=1050AS [BUB1B - Mitotic checkpoint serine/threonine-protein kinase BUB1 beta - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPQ“: Das Protein (Mensch) „CENPQ“ (qq)=268AS kann sich als Puzzle-Stück an das „unschöne“ „CENPE“ {} heften, um den rechten Zeilenrand als Signalweg zu erreichen [Chromosome congression is promoted by CENP-Q- and CENP-E-dependent pathways - PubMed (nih.gov); J.Bancroft u.a.; Mai 2006; DOI: 10.1242/jcs.163659]. „CENPQ“ (qq) =268AS liegt mit „CENPE“{} in der Spalte Z.38373#_[008]{61}{6}/#_[77]{2}{36}{3}/#_[75]{4}q85q{7}/#_[95]{6}{0}q83q/#_[376]{0}{2}q3q/#_[01]q4q66q0q, und zwar in Z.38375 über Lücke als „85“_aufsteigend „83“_aufsteigend Spalte 3/0 für „30“_“66“_“4“ mit Summe 85+83+30+66+4=“268“ für „CENPQ“ (qq)=268AS [CENPQ - Centromere protein Q - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPP“: „CENPQ“ ist dem „CENP-O-Komplex“ [CENPO, CENPP, CENPQ, CENPU] zugeordnet. Das Protein (Mensch) „CENPP“ (pp)=288AS folgt „CENPQ“ am Rand in der Spalte Z.38379#_71978/#_47958, damit sich „CENPO“ (oo) in die linke Spalte „7/4“ legen kann, und zwar „CENPP“ (pp) aufsteigend in Z.38379 1/7=QS=“8“_“95“_absteigend „97“_aufsteigend Randspalte 8/8 für „88“ mit Summe 8+95+97+88=“288“ für „CENPP“ (pp)=288AS [CENPP - Centromere protein P - Homo sapiens (Human) | UniProtKB | UniProt]. Das „CENPO“: Protein (Mensch) „CENPO“ (°°) =300AS glättet 7-zeilig den linken Komplex-Rand, in dem eine von CENPE/CENPQ erzeugt unbesetzte Kerbe „6“ in einer Schleife herausgezogen wird. „CENPO“ (°°) liegt in der Spalte Z.38374#_°6°°7°[7{2}…]#_°9°°7°°5°[{4}…]#_[2]°9°°5°[{6}…]/#_[6]°3°°76°[…]/[0]°0°°1°[q4q…]/#_[3]°8°°7°[p1p…]/#_[7]°9°°4°[p7p…], und zwar mit Kerbe in Z.38355 als 76=QS=“13“_aufsteigend Spalte 1/7/4 für „174“ _absteigend Spalte 3/0/8/9=QS=“20“_absteigend „9“_absteigend Spalte 5/5 für „55“_absteigend Spalte 7/7=QS=14_aufsteigend 6/9=QS=15 mit Summe 13_174_20_9_55_14_15=“300“ für „CENPO“ (°°) =300AS [CENPO - Centromere protein O - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPU“: Das Protein (Mensch) „CENPU“ (uu) =418AS ist ein Gerüstprotein, das für die PLK1-Population in den Kinetochoren zuständig ist. „CENPU“ folgt absteigend „CEMPO“ und bindet an in Z.38370 „PLK1-Startzahl“ „703“=QS=“10“ (wie bekannt). „CENPU“ (uu) liegt in der Spalte Z.38370#_[7030040]/#_u91uu3u[7438]/#_1[4]u6u[3636]/#_u4u[0]u0u8[{616}]/#_°6°°7°u7u[{2363}], und zwar absteigend in Z.38372 der Spalte 1/4 für „41“_absteigend 91=QS=“10“_aufsteigend Spalte 3/6/0 für „360“_aufsteigend „7“ mit 41+10+360+7=“418“ für „CENPU“ (uu) =418AS [CENPU - Centromere protein U - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLK1“ {}=603AS - ist bekannt - in der Spalte Z.38368#_[34717]“12“/#_[51]“41“45“[9]/#_“703“[0040], und zwar in Z.38370 als 703=QS=“10“_absteigend „41“_45=QS=“9“ mit Summe 10+41+9=“60“_absteigend 12=QS=“3“ mit 60_3 für „PLK1“ {}=603AS. „PLK1“ hier auch an anderer Position (müsste überprüft werden) [PLK1 - Serine/threonine-protein kinase PLK1 - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPJ“: „CENPE“ ist motorisch weit aufgestiegen, so dass rechts von „CENPU“ (uu) das Protein (Mensch) „CENPJ“ (jj)=1338AS in der Spalte Z.38370#_[7030040]/#_u91uu3uj74j38j/#_1[4]u6uj3j[6]j36j/#_u4u[0]u0uj8j[{616}]/#_°6°°7°u7u[{2363}], den freien Rand besetzt, und zwar in Z.38372 als Randzahl 36=QS=“9“_absteigend 38=QS=11=QS=“2“_74=QS=11=QS=“2“ mit Summe 9+2+2=“13“_aufsteigend Spalte 3/8 für „38“ mit 13_38 für „CENPJ“ (jj)=1338AS [CENPJ - Centromere protein J - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPN“: Von den „16“ „CCAN“-CENP-Proteinen sind „10“ Zentromer-Proteine erfasst (CENP_ C/P/U/O/Q/S/T/W/X]. Es folgen „6“ Proteine „CENP_H/I/L/N/K/M“. Die „4“ Zentromer-Proteine „CENP_A/B/E/F“ gehören nicht zum „Zentromer-assoziierten Netzwerk (CCAN)“. Das Protein (Mensch) „CENPN“ (nn)=339AS liegt mit CENPA (°°) in der Spalte Z.38367#_[3]°20°208°[16]/#_n33n[471]°7°[12]/#_n351n[41]°45°[9], und zwar aufsteigend in Z.38368 als „33“_aufsteigend 351=QS=“9“ mit 33_9 für „CENPN“ (nn)=339AS [CENPN - Centromere protein N - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPH“: „CENPH“, „CENPI“ und „CENL“ bilden einen Komplex der auf „CENPA“ abzielt [CENPL-Zentromerprotein L [Homo sapiens (Mensch)] - Gen - NCBI (nih.gov)]. Das Protein (Mensch) „CENPH“ (hh)=247AS könnte zwischen „CENPA“/“CENPA“ die Spalte „71/14“ besetzen, muss zur Komplexbildung die Ziffer „7“ aber aufsteigend verschwenken. „CENPH“ (hh) liegt in der Spalte Z.38368#_n33n[47]h1h°7°[12]/#_n351nh4hh1h°45°[9]/#_[370]h3hh00h[40]/#_[39137]h4h[38], und zwar aufsteigend in Z.38368 Spalte 1/1=QS=“2“_aufsteigend Spalte 4/3 für „43“_00=QS=“0“_aufsteigend „4“ mit „2“_Summe 43+0+4=“47“ mit 2_47 für „CENPH“ (hh)=247AS, wobei die Endziffer „4“ alternativ ohne Aufstieg auch rechts anliegt [CENPH - Centromere protein H - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPL“: Das Protein (Mensch) „CENPL“ (LL)=344AS glättet den linken Rand des Komplexes in der Spalte Z.38370#_L3L[70]h3h00h[40]/#_L3LL9L[137]h4h[38]/#_L4LL1L[463636], und zwar aufsteigend in Z.38370 Spalte 3/3/4 für „334“_absteigend Spalte 9/1=QS=“10“ mit Summe 334+10=“344“ für „CENPL“ (LL)=344AS [CENPL - Centromere protein L - Homo sapiens (Human) | UniProtKB | UniProt]. Der Zweck des Komplexes besteht in der Positionierung von „CENPF“, das die Position von „CENPE“ besetzen soll, um dessen Expression anfangs zu verhindern.
„CENPI“: Das Protein (Mensch) „CENPI“ (ii) =756AS liegt in der Spalte Z.38370#_L3Li70ih3h00h[40]/#_L3LL9Li1i[37]h4h[38]/#_L4LL1Li4ii6i[3636], und zwar als in Z.38370 als „7“_aufsteigend Spalte 0/1/4=QS=“5“ mit 7_5_6 für „CENPI“ (ii) =756AS. „Erforderlich für die Lokalisation von CENPF“ [CENPI - Centromere protein I - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPF“: Das Protein (Mensch) „CENPF“ (ff) =3114AS besetzt in der hemmenden Funktion die CENPE-Zahl „61“ in der Spalte Z.38372/#_L4LL1Li4ii6if3ff6ff3f[6]/#_[4400}f8ff6ff1f[6], und zwar aufsteigend in Z.38373 Spalte 3/1 für „31“_absteigend Spalte 6/6=QS=12_aufsteigend Spalte 3/8=QS=11=QS=“2“ mit „31“_Summe 12+2=“14“ mit 31_14 für „CENPF“ (ff) =3114AS (Inhibitor). In der aktivierenden Funktion dreht sich „CENPF (**) =3114AS“ als Möglichkeit aus der Startziffer „3“ um 180° von der Zerlegung „31_14“ in „3_114“ am Zeilenrand in der Randspalte Z.38368#_°7°*1*2*/#_°45°*9*/#_h0h*4*0*/#_h4h*3**8*/#_[6]*3**6*, und zwar in Z.38372 als „3“_absteigend Spalte 8/6 für „68“_absteigend Spalte 4/3 für „34“_absteigend Spalte 2/9/0=QS=“11“_“1“(rechts von CENPA) mit „3“_Summe 68+34+11+1=“114“ mit 3_114 für „CENPF“ (**) =3114AS (Aktivator). Der „CENPF-Varianten-Umschalter“ liegt in der alternativen Endzahl „4“ von „CENPH“ [CENPF - Centromere protein F - Homo sapiens (Human) | UniProtKB | UniProt].
Bei Krebs werden die Zentromerproteine „CENPA“ und „CENPF“ sowie „CEP55“ hochreguliert, so dass ein Zusammenhang von „CENPF“ und „CENPA“ besteht [„Hohe Expressionsniveaus des Zentromerproteins A sowie eine Hochregulierung der Phosphatidylinositol-3-Kinase/Akt/Säugetierziel des Rapamycin-Signalwegs beeinflussen das Ansprechen und die Prognose der Chemotherapie bei Patientinnen mit Brustkrebs - PMC (nih.gov)“; S. Zhang u.a.; März 2021 DOI: 10.3892/ol.2021.12671]. Das Protein (Mensch) „CEP55“ (µµ)=464AS (Monomer) besetzt in Z.38369 die Endzahl „45“ von „CENPA“ absteigend in der Spalte 4/0/4 für „404“_aufsteigend Spalte 5/4 für „54“_aufsteigend Spalte 3/3=QS=“6“ mit Summe 404+54+6=“464“ für „CEP55“ (µµ)=464AS. „CEP55“ erweitert sich zu einem Homodimer. „CEP55“ interagiert mit „TSG101“ und „ALIX“ [CEP55-Inhibitor: Umfangreicher computergestützter Ansatz zur Definition eines neuen Ziels für einen Zellzyklus-Maschinerie-Wirkstoff - PMC (nih.gov); B. Lestari u.a.; Jan 2022; DOI: 10.34172/APB.2022.021]. Die Erweiterung „CEP55“ (©©)=464AS (Homodimer) liegt spiralförmig in der Spalte Z.38368#_471712/#_141459#_030040#_137438, und zwar aufsteigend in Z.38369 Spalte 4/3/3 für „433“_links absteigend über Spalte 1/0/1 für 10+1=“11“_absteigend 47=QS=“11“_aufsteigend Spalte 1/7/1=QS=“9“ mit Summe 433+11+11+9=“464“ für CEP55“ (©©)=464AS (Homodimer) [CEP55 - Centrosomal protein of 55 kDa - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „TSG101“=390AS besetzt bzw. verhindert die Endposition der alternativen Variante von „CENPF“ in Z.38368 als Randzahl 12=QS=“3“_aufsteigend Spalte 9/0 für „90“ mit 3_90 für „TSG101“ =390AS [TSG101 - Tumor susceptibility gene 101 protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „ALIX“=868AS kann „TSG101“ ersetzen, weil die Bindung an die CENPA-Endziffer „45“ parallel und gemeinsam erfolgt. „ALIX“=868AS schleifenförmig absteigend in Z.38366 Spalte 7/8/7 für „787“_aufsteigend Spalte 8/1 für „81“ mit Summe 787+81=“868“ für „ALIX_PDCD6IP“=868AS [PDCD6IP - Programmed cell death 6-interacting protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Histon-ähnliche Proteine „CENP-A“ ist nicht in allen Zellen vorhanden, so dass der Komplex „CENP-H/I/K/M“ die CENPA-Position nutzen kann; „CENPA“ und „CENP-H/I/K/M“ binden „CENPC“ an derselben Bindestelle. „CENP-H“ und „CENP-I“ wurden bereits ermittelt, so dass nur „CENP-K“ an „CENP-C“ binden kann. „CENP-M“ verbindet den „CENP-H/I/K“-Stapel am rechten Rand zwecks Komplex-Stabilisierung [„Strukturanalyse von Pilz-CENP-H/I/K-Homologen zeigt einen konservierten Assemblierungsmechanismus, der der korrekten Chromosomenausrichtung zugrunde liegt | Nukleinsäure-Forschung | Oxford Akademisch (oup.com)“; L. Hu u.a.; Jan 2019; https://doi.org/10.1093/nar/gky1108].
„CENPL“: „CENPC“ – wie bekannt – in Z.38366 Spalte „4[13]/993 („3“ mathematische Bindestelle)“.
„CENPK“: Das Protein (Mensch) „CENPK“ (kk) =269AS liegt in der Spalte .38367#_k2kk0k20k[816]/#_k3kk4k[71712]/#_k5kk1k[41459], und zwar aufsteigend seitlich an der CENPC-Endziffer „3“ in der Spalte 2/3/5 für „235“_absteigend Spalte 4/1 für „14“_“0“_“20“ mit Summe 235+14+0+20=“269“ „CENPK“ (kk) =269AS [CENPK - Centromere protein K - Homo sapiens (Human) | UniProtKB | UniProt]. „CENPK“ interagiert mit „SOX6“. Das Protein (Mensch) „SOX6“ („“) =828AS bindet schleifenförmig an „CENPC“ und links an „CENPK“ (kk) und „CENPI“ (ii) in der Spalte Z.38368#_[0]©8©[5]@7@@3@k34k[…]/#_[0]©8©[1]@5@@3@k51k[…]/#_[0]©7©[7]@3@@3@i70i[…]/#_[0]©73©©1c@3@9@i1i[…}/#_[068]©9©©41©i4i…/#_[064]©7©44©[0…], und zwar absteigend in Z.38368 Spalte 3/3 für „33“_aufsteigend Spalte 7/5/3 für „753“_aufsteigend Spalte 3/3 für „33“_“9“ mit Summe 33+753+33+9=“828“ für „SOX6“ (@@) =828AS (Monomer). Erweiterung zum „SOX6“-Homodimer aufsteigend in Z.38372 Spalte 41/44=QS=“13“_“7“_absteigend Spalte 1/9=QS=“10“_links 73=QS=“10“_absteigend Spalte 8/8/7 für „788“ mit Summe 13+7+10+10+788=“828“ für „SOX6“ (©©) =828AS (Homodimer) [SOX6 - Transcription factor SOX-6 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Homodimer entsteht über den Protein-Abstand eine Furche. „Im Gegensatz zu den meisten Transkriptionsfaktoren binden SOX-Transkriptionsfaktoren an die kleine Furche der DNA, verursachen eine 70- bis 85-Grad-Biegung und führen lokale Konformationsänderungen ein“ [CENPK – Wikipedia]. Alternativ statt eines Homodimers bindet „SOX6“ (@@) (Monomer) am Protein (Mensch) „CTBP2“ („“) =445AS, das den Ligand „NAD“ (!!)=C21H27N7O14P2=126+27+49+112+30=“344“E besitzt, in der Spalte Z.38371#_[7!31!]@!3!@9@[.../]#_/#_[689]“!4!1“.../#_[647]“44“..., und zwar in Z.38373 als „44“_absteigend 41=QS=“5“ mit 44_5 für „CTBP2“ („“) =445AS. „NAD“ (!!)=344E in Z38371 als 31_3 mit Summe 31+3=“34“_aufsteigend „4“ mit 34_4 für NAD (!!)=344E [CTBP2 - C-terminal-binding protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
„CENPM“: Das Protein (Mensch) „CENPM“ (mm) =180AS liegt winkelförmig in der Randspalte Z.38367#_k20km8mm1m[6]/#_[7]h1h[7]m1m[2]/#_h4hh1h[4]m5m[9]/#_h3h00hm4m[0]/#_m3m7h4hmm3m[8], und zwar in Z.38367 als „8“_aufsteigend Spalte 1/1/5 für „115“_aufsteigend Spalte 4/3=QS=“7“_74=links für „47“_“3“ mit Summe 8+115+7+47+3=“180“ für „CENPM“ (mm) =180AS. „CENPM“ zieht in seiner Winkelecke durch die CENPH-Endziffer „4“ mit beiden Positionsvarianten (CENPH-Umschalter). Damit „CENPM“ linksseitig das „CEMPI“ erreichen kann, muss zur Passage eine dynamische Umschaltung erfolgen. Das Problem kann nicht umgangen werden, durch eine Schleife mit einer alternativen Endsumme „50“ kann aber zusätzlich auch die Endziffer von CENPI-Endziffer gebunden werden, und zwar aufsteigend in Z.38371 Spalte 4/6 =QS=“10“_absteigend Spalte 7/3 für „37“_“3“ mit Summe 8+115+7…alternativ +10+37+3=“180“ für „CENPM“ (mm) =180AS [CENPM - Centromere protein M - Homo sapiens (Human) | UniProtKB | UniProt]. „CENPM“ stabilisiert insbesondere „CENPI“ [Die Pseudo-GTPase CENP-M treibt die Assemblierung menschlicher Kinetochore an | eLife (elifesciences.org); A. Musacchico; u.a.; Jul 2014; https://doi.org/10.7554/eLife.02978].
„CENPG“: Zum Zentromer-Protein „CENP-G“ sind keine Daten bekannt. Beim Menschen fehlt „CENP-B“ auf dem Y-Chromosom, aber „CENPG“ ist dort vorhanden, so dass ein Zusammenhang besteht [CENP-G: ein neues zentromeres Protein, das mit der Alpha-1-Satelliten-DNA-Unterfamilie assoziiert ist - PubMed (nih.gov); D.Er, u.a.; Jun 1998; DOI: 10.1007/S004120050296]
_dat28.07.2024_Wanderung in das „Unberechenbare“ ist beendet
++++
Meiose: Die Meiose treibt den Zeilenlauf zur Bildung von Keimzellen (Spermien / Eizelle) nicht weiter voran, sondern ist eine spezielle Wiederholung der Mitose, die parallel zur Bereitstellung der Mikrotubuli als Stapel abgearbeitet wird. Die Serie #1610 enthält zur Lokalisierung der Meiose einmalig die lesbaren Cofaktoren „Zink“=30E und Magnesium=12E, und zwar an einem geeigneten Symbol „00“. Die Proteine füllen die Matrix aufsteigend bis zum geschlechtsanhängigen Kreuzungssymbol 33/66 in der Spalte Z.38372#_{3}(6){3}/#_[8](6)[1], die zugleich mit 6_3/1=QS=4 mit 6_4 für Kreis=64 und 3/8=11=“2“_“6“ mit 2+6=“8“_3/1=QS=“4“ mit 8_4 für Schwerachse=84 enthält.
Der Mensch verfügt über 2 Chromosomensätze, 1 Satz von jedem Elternteil. Beide Sätze sind ähnlich und werden als homologe Chromosomen bezeichnet. Die Kinder erben die genetische Mischung von allen vier ihrer Großeltern. Die homologen Chromosomen müssen sich zunächst „Crossovers“ miteinander verbinden. Die komplizierte Zellteilung der Keimzellen ist zunächst unwesentlich, weil die Meiose mit dem Merkmal „doppelsträngiger DNA-Brüche (DSBs)“ eingeleitet wird. Bei der Meiose werden homologe (gleichartige) Chromosomen, eines von jedem Elternteil, zusammengeführt und danach korrekt getrennt. Bei der meiotischen Rekombination werden „Crossovers“ zwischen den homologen Chromosomen zu erzeugt [Meiotische DNA-Brüche und DNA-Rekombination | Max-Planck-Gesellschaft (mpg.de); Friedrich-Miescher-Laboratorium, Tübingen; 2021]. Die haploiden Keimzellen enthalten im einfachen Chromosomensatz 23 Chromosomen, davon 1 Geschechtschromosom. Dipolide Körperzellen enthalten im doppelten (diploid) Chromosomensatz 46 Chromosomen. Im Gegensatz zur mitotischen Teilung (Teilung 1 Zelle für 2 Zellen mit doppelten Chromosomensatz) gehen aufgrund der Befruchtung bei der der Meiose vier Zellen mit einfachen Satz hervor [Haploid und Diploid • Definition, Chromosomensätze • [mit Video] (studyflix.de); Meiose: Phasen und Ablauf | Lecturio]. Erst nach der Verschmelzung von mütterlicher Eizelle und väterlichen Spermium ist der Chromosomensatz wieder diploid. Die Meiose läuft nach der DNA-Replikationsphase in zwei aufeinanderfolgenden Reifeteilungen ab. Meiose I: Die erste Reifeteilung (Reduktionsteilung) durchläuft 4 Stadien, bei der homologe Chromosomen werden getrennt werden, damit aus 1 diploiden Zelle 2 haploide Tochterzellen entstehen. [homologe Chromosomen auf 2i separate Zellen aufgeteilt]; Meiose II: Die zweite Reifeteilung (Äquationsteilung) verläuft ähnlich wie die Mitose. [Schwesterchromatiden getrennt und erneut auf zwei Tochterzellen verteilt].
Das Protein (Mensch) „Spo11“=396AS besitzt am rechten Rand den Cofaktor „Magnesium“=12E und erzeugt im Komplex mit „mTopVIB“ (TOP6B; TOPOVIBL) Doppelstrangbrüche, d.h. 2 „Spo11“ beteiligt (1x je Strang). „Spot11“ ist eine Komponente des Komplexes „DNA-Topoisomerase VI (Topo VI)“. „Topo VI“ ist ein „DNA-Kreuzungssensor“. Bevorzugt werden DNA-Kreuzungen mit Geometrien nahe „90°“ erkannt und entkoppelt [Topoisomerase VI ist eine chiral-selektive, bevorzugte DNA-Dekatenase (PMC) (nih.gov); J. Berger; Jan 2022; doi: 10.7554/eLife.67021]. Ist der 90°-Winkel vorhanden? Ja, im „Spo11“ als Randspalte 9/0 für 90°! „Spo11“ {}=396AS liegt mit Magnesium in der Randspalte Z.38368#_x33x47x1x!7“{12}/#_[3]y5y1|41|!4!5!{9}/#_[3]y703y|0|0{4}{0}/#_[3913]|74|{38}/#_[4146](36)(3)(6), und zwar mit Mg=12=QS=“3“_Winkel 90° als Spalte 9/0=QS=“9“_“4“_38=QS=11=QS=2 mit „39“_Summe 4+2=“6“ mit 39_6 für „Spo11“ {}=396AS.
Das 2. Spot11 ()=396AS für den Doppelstrang folgt mit „3636“ als Summe 36+3=“39“_“6“ für „Spot11“ ()=396AS. In „Spo11“ ist mit 3“96“AS automatisch das Tyrosin=C9H11NO3=54+11+7+24=96E mit enthalten. Der Angriff dieser Aminosäure auf die DNA greift deren Phosphor-Rückenstütze an, wodurch ein DNA-Bruch erfolgt. Der Bruch wird über eine kreuzweise Verbindung der Stränge wieder „falsch“ repariert. „SPO11“ bildet einen Komplex mit „TOP6BL“, so dass eine Spur zum Phosphor=15E vorliegt. Beim DNA-Bruch wird Ziffer „1“ vom Magnesium verwertet, so dass auch „Spo11“ entfernt wird. Der Cofaktor Mg=12E im „Sp11-Fall 2“ ist nicht lesbar. „Mg“ kann aus dem Protein selbst zu „12“ summiert werden, wird aber typisch für einen Cofaktor die seitliche Spalte 3/6=QS=“9“ mit der linken Spo11-Randziffer „3“ zu 9+3=Mg=12E zwecks Lokalisierung summieren [SPO11 - Meiotic recombination protein SPO11 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TOP6BL“=511AS wird mit 4 Fällen als 2 Varianten und unterschiedlich für beide Komplexe mit „Spo11“ angelegt [TOP6BL - Type 2 DNA topoisomerase 6 subunit B-like - Homo sapiens (Human) | UniProtKB | UniProt]. Eine „Short“-Variante ergänzt den Phosphor zum DNA-Bruch übergriffig im „Spo11“ und die verlängerte „Long“-Variante besitzt den Phosphor zur DNA-Reparatur selbst. „TOP6BL(Fall 1.1/Short)“ (!!) =511AS als „5“_absteigend Spalte 7/4=QS=“11“ mit 5_11 für „TOP6BL“(!!)=511AS mit Phosphor=15E mit Mg-Ziffer „1“ von „Spo11“. „TOP6BL (!x!) (Fall 1.2/Long)“=511AS verlängert mit (xx) als 5_absteigend Spalte 7/4=QS=11=verlängert QS=“2“_“1“_47=QS=11=QS=“2“_33=QS=“6“ mit „5“_Summe 2+1+2+6=“11“ mit 5_11 für „TOP6BL(Fall 1.2/Long)“ (!x!) =511AS. Das ATP=260E ist für beide Fälle unterschiedlich, so dass jeder Strang seine Bruchstelle „0“(Null) findet, wobei parallel die „00“-Doppelnull durchlaufen wird. Als Besonderheit ist dabei eine wertgleiche Kreuzung möglich, die somit vom ATP initiiert wird.
„TOP6BL(Fall 2.1/Short)“ (||) =511AS in Z.38369 als „4“_aufsteigend Spalte 1/0=QS=“1“ mit Summe 4+1=“5“_74=QS=“11“ mit 5_11 für „TOP6BL(Fall 2.1/Short)“ (||) =511AS, wobei der Phosphor=15E zum DNA-Bruch mit der Ziffer „5“ statt der Ziffer 11 mit der Zahl „10“ aus dem Spo11/Fall 2 über die Ziffer „3 in der Spalte 7[4]/(3)(6) mit QS7¬¬¬¬_3=10 für P=5+10=15E summiert wird. „TOP6BL(Fall 2.2/Long)“ (|y|) =511AS mit Ziffer „5“ alternativ (yy) in Z.38369 als „5“_Kunstgriff 703=QS=10 für „0“_“0“_ mit Summe 5+0+0=“5“_74=QS=11 für „TOP6BL(Fall 2.2/Long)“ (|y|) =511AS.
Die „ATP-00-Kreuzungsstelle (Weiche)“ für „Spo11“ liegt in der Spalte Z.38368#_[7]$1$§7§[12]/#_[4]$1$§4§[59]/#_$3$0$§04$0$/#_$3$7$[4]§38§/#_[6]$3§[636] mit ATP (§§)=260E für „Spo11/Fall1“ rechter Rand aufsteigend über Spalte 7/4=QS=11=QS=“2“_04=QS=“4“_38=QS=11=QS=“2“ mit „2“_Summe 4+2=“6“_absteigend Randziffer „0“ mit 26_0 für ATP (§§)=260E. ATP ($$)=260E für „Spo11/Fall2“ seitlich aufsteigend über Spalte 1/1/0=QS=“2“_Spalte 3/3=QS=6_Spalte 7/3=QS=10 für „0“ mit 2_6_0 für ATP ($$)=260E._dat17.02.2024
Der synaptonemale Komplex [synaptischer Komplex / (SC)] bildet ein leiterförmiges Gerüst für die Paarung und Rekombination homologer Chromosomen während der Meiose. Der synaptische Komplex ist an der inneren Kernhülle fixiert. Die leiterförmige, dreigeteilte Struktur besteht aus dem Zentralelement mit zwei seitlichen Lateralelementen, um die Chromosome für das Crossing-over zueinander auszurichten. Das Chromatin der homologen Chromosomen ist in den seitlichen Elementen gebunden. Das linienförmige Zentralelement wird von leiterartigen Querelementen aus einer Vielzahl von Filamenten durchkreuzt, um die beiden Lateralelemente zu verbinden. [synaptonemaler Komplex - Kompaktlexikon der Biologie (spektrum.de)]. Reihenfolge: väterliche Schwesterchromatiden 1+2 - laterales Element - zentrales Element - laterales Element - mütterliche Schwesterchromatide 3+4; Der Komplex entsteht zeitlich im Zygotän und wird nach dem Pachytän aufgelöst. [Synaptonemaler_Komplex (bionity.com)]. Der Komplex besteht aus „8“ Proteinen: Lateralelemente „SYCP2“ / „SYCP3“; Transversalelement: „SYCP1“ als Dimer; Zentralelement: „SYCE1“ / „SYCE2“ / „SYCE3“ / „TEX12“ / „SIX6OS1“. [Synaptonemal Complex - an overview | ScienceDirect Topics; Superresolution imaging of the synaptonemal complex - ScienceDirect; R. Benavente; 2018; https://doi.org/10.1016/bs.mcb.2018.03.033].
Der Bauplan des synaptonemalen Komplexes wird in Z. 38372#_6“36“36“ am rechten Rand mit der Dopplung „flexibel (Crossing-over)=“6“_36=QS=9=seitlich_36=QS=9=seitlich“ für die beiden Seitenelemente positioniert, wobei eine Spalte linksseitig 3/3 für 33=männlich vorgelagert und am rechten Rand mit der Spalte 6/6 für 66=weiblich nachgelagert ist. Das Protein (Mensch) „SYCP3“ {} =236AS ist für die Zentromerpaarung von männlichen Keimzellen erforderlich. „SYCP3“ ist in Z.38374 zur Motivation als !236! lesbar, so dass sich die weibliche Komponente „SYCP2“ vorgelagert anlegt. „SYPC3“ wechselt dann aber mit Zeilensprung zum anderen SYCP2-Ende. „SYCP3“ {} =236AS wird kompliziert angelegt, um für die Phosphorylierung 14+1=Phosphor=15E zu enthalten und mit der Endziffer „1“ zu aktivieren. Mit diesem Positionswechsel wird der Abstand von 70-140 nm zwischen „SYCP3“ / „SYCP3“ definiert, weil er irgendwo fixiert sein muss. Der „Zeilensprung“ liegt an der Zahl „70“ für 70 nm_aufsteigend Spalte „1/4/0“ für 140 nm wie real als Abstand= 70 - 140 nm vorhanden [Synaptischer Komplex - DocCheck Flexikon]. „SYCP3“ {} =236AS liegt in der Spalte Z.38369#_[5]{141}[459]/#_{70}[3]{0}{0}[40]/#_{91}(37){4}{38}/#_[146](3)[636]/#_[400](8)(6)(1)[6]/#_[677][!2](3)(6)![3], und zwar als am Zeilenrand in Z.38371 als 38=QS=11=QS=“2“_absteigend Spalte 0/4=QS=“4“_“0“_absteigend_141 nach links für 14+1=QS=15 (Phosphor)_absteigend 70=QS=7_absteigend 91=QS=10 mit „2“_Summe 4+0+15+7+10=“36“ mit 2_36 für „SYCP3“ {} =236AS. Die Spalte 3/3 für 33=männlich wird mittels Schleife umgangen. Der Rückstand von Phosphoserin=C3H8NO6P=18+8+7+48+15=96E wird in die Lücke „636“ für QS 6+3=“9“_“6“ für Phosphoserin=96E am rechten Rand zu „SYCP2“ verfrachtet [SYCP3 - Synaptonemal complex protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SYCP2“ () =1530AS als weibliches Seitenelement wird für die Entwicklung von Eizellen (66) und Spermatozyten (33) benötigt. Das lesbare „SYCP3“ dient zur Positionierung und kann aufgrund der Verdrängung (Zeilensprung) verarbeitet werden. Die Spalte 6/6 für 66=weiblich liegt extern am Zeilenrand. „SYCP2“ () =1530AS als „1“_aufsteigend „6“_absteigend Spalte 6/3 für „36“_seitlich absteigend Spalte 3/8=QS=“11“ mit „1“_Summe 6+36+11=“53“_absteigend 37=QS=10 für „0“ mit 1_53_0 für „SYCP2“ () =1530AS [SYCP2 - Synaptonemal complex protein 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SYCP1“=976AS bildet die Leitersprossen. „SYCP1-Moleküle sind langgewundene Coil-Proteine mit zwei kugelförmigen Köpfen, die parallele Homodimere bilden, wobei ihre C-Termini in die lateralen Elemente eingebettet sind“ [Störung der Paarung und Synapse von Chromosomen verursacht stadienspezifische Apoptose männlicher meiotischer Zellen - ScienceDirect; G.Novak u.a.; (2008); https://doi.org/10.1016/j.theriogenology.2007.09.029]. Das spiralförmige Heterodimer ist somit auf beiden Seiten des Zentralelements vorhanden, wobei im Dimer 2 Teile zum transversalen Filament parallel verbunden sind. Es sind keine speziellen Merkmale bekannt. „SYCP1“(§§)=976AS mit der Startziffer §9§ in seitlich=9§9§ zwecks Befestigung im Seitenelement, und zwar in der Spalte Z.38367#_[89]§9§|3|20|208|16|/#_[8]§5§7§|3|3|47|[171]|2|/#_[8]§1§[535]{141}[459], aufsteigend in Z.38367 als Spalte „9/7“ für „97“_Spalte „5/1“=QS=“6“ mit 97_6 für SYCP1“ (§§)=976AS (Monomer). „SYCP1“ (||)=976AS doppelt für Dimer in Z.38367 aufsteigend über Spalte 3/3=QS=“6“_“3“ mit Summe 6+3=“9“_absteigend „20“_aufsteigend „47“_Kunstgriff absteigend 208=QS=10 für „0“_“1“ Randspalte 6/2 (2=paarig!)=QS=“8“ mit „9“_Summe 20+47+0+1+8=76 mit 9_76 für „SYCP1“(||)=976AS (Homodimer). Für das Dimer liegen die beiden Startziffern „9“ zwecks Parallelität nebeneinander. Spiralform als 33=QS=6_4 für Kreis=64_7=Form. Doppelte Leiter als Symmetrie „2020“. Endziffer „2“=paarig [SYCP1 - Synaptonemal complex protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Zentralelement bilden die „SYCE1“ /“SYCE3“ und „SYCE2“/ „TEX12“ zwei Einheiten zuzüglich „SIX6OS1“. Das dimere Leiter-Protein „SYCP1“=976 AS(§§)/(|||) ist einsam vorgelagert. Zur Positionierung binden mehrere Proteine in dieser Lücke direkt in „SYCP1“ ein, und zwar in der Spalte Z.38366#_[9413078]$878$[8]/#_[89]§9§|3|20|208|$1$|6|/#_°8°§5§7§|3|3|47|171|2|/#_°8°§^1^§^53^5{141}€45€[9]. Ergänzend kommt das Protein (Mensch) „FKBP6“ (µµ)=327AS hinzu, das nur männlich ausgerichtet ist. Von der Symmetrie „µ20µ20“ in „SYCP1“(||) wird einseitig in die Zahl „µ20µ“ eingebunden. Die Startziffer „3“ wird extern so platziert, dass eine 3er Spalte für „männlich“=33 verlängert wird. Über diese externe/interne Spalte 30/32 in Z.38366 wird die ATP-Bindung mit ATP=260E als „2“_Spalte 3/3=QS=“6“_“0“ mit 2_6_0 für ATP=260E realisiert. „FKBP6“ (µµ)=327AS als „3“_aufsteigend Spalte 0/2=QS=“2“_absteigend Spalte 7/0=QS=7 mit 3_2_7 für „FKBP6“ (µµ)=327AS. Das ATP wird bei der Interaktion von HP90-Proteinen benötigt [HSP90AA1=732AS; HSP90AA2P=343AS]. „FKBP6“ besitzt eine externe Bindung an das Arzneimittel „FK506“=Tacrolimus= C44H69NO12=264+69+7+96=436E, die extern über Z.38365#_“3“29“7“_/#_“1“[307]_ mit Spalte 3/1=QS=“4“_“29“_“7“ mit „4“_Summe 29+7=“36“ mit 4_47 für „FK506“=436E vorliegt. Bei Menschen zieht zwar kein Zink-haltiges Protein „Zip1“ die Chromatiden als Reißverschluss zusammen, aber „FKBP6“ verwendet die Zahl „30“ [FKBP6 - Inactive peptidyl-prolyl cis-trans isomerase FKBP6 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „TEX12“ ($$)=123AS bindet am rechten Rand in die Ziffer „1“ von „SYCP1“ (||) ein und besetzt in Z.38366 vorgelagert die Zahl 878=QS=“23“ mit 1_23 für „TEX12“ ($$)=123AS [TEX12 - Testis-expressed protein 12 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SYCE2“ (€€)=218AS bindet am rechten Rand in die Endziffer „2“ von „SYCP1“ (||) ein und besetzt aufsteigend die Spalte 171/[1]45 mit „2“_171=QS=“9“_45=QS=“9“ mit „2“_Summe 9+9=“18“ mit 2_18 für „SYCE2“ (€€)=218AS [SYCE2 - Synaptonemal complex central element protein 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SYCE1“ (^^)=351AS bindet in Z.38369 auf der linken direkt in die Endziffer „1“ von „SYCP1“ (§§) ein und ist spiegelbildlich als „153“ für „SYCE1“ (^^)=351AS lesbar [SYCE1 - Synaptonemal complex central element protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das homodimere Protein „SYCE3“ (°°)=88AS setzt sich links als Spalte 8/8 mit „88“ für SYCE3“ (°°)=88AS seitlich an „SYCP1“ (§§) als Monomer fort. „Dimer“ aufsteigend in der Spalte „77“/[7]“3“/[6]“8“ als Summe 77+3+8=“88“ für „SYCE3“ („“)=88AS (Dimer) [SYCE3 - Synaptonemal complex central element protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Matrix „Teil-1“ mit Spalte Z.38366#_[9413078]$878$[8]/#_[89]§9§|3|20|208|$1$|6|/#_°8°§5§7§|3|3|47|171|2|/#_°8°§^1^§^53^5{141}€45€[9] wird fortgesetzt mit „Teil-2“ als Spalte Z.38370#_“77“*33*{70}[3]{0}{0}[40]/#_[7]“3“*13*{91}(37){4}{38}/#_[6]“8“[9]*4*[146](3)[636]/#_[6];47;*4*[400](8)(6)(1)[6]/#_[6];05;*4*“6“[772](3)(6)[3]/#_[5];6;*3*4*“9“[754857]. Die Segmentierung in Längsrichtung als Kette von 10 nm breiten Seitenelementen ist aufgrund des Serien-Randzahl #16“10“ mit 16=QS=“7“=Form_“10“ für 10 nm vorhanden. Diese leiterartige Streckung in der Vertikalen wird durch das Protein (Mensch) „SIX6OS1“ (**)=587AS realisiert, das rechts neben dem Dimer „SYCE3“ („“) aufsteigt, und zwar als Spalte „33/13“ für Summe 33+13=“46“_Spalte 4/4/4=QS=“12“ mit Summe 46+12=“58“_34=QS=“7“ mit 58_7 für „SIX6OS1“ (**)=587AS. Ein Rückstand von Phosphoserin („“)=96E liegt in der Spalte 6/9 für 96E rechts neben „34“ vor. „SIX6OS1“ interagiert mit „SYCE1“(^^) und der Proteasom-Untereinheit „PSMA8“ [SIX6OS1 - Protein SIX6OS1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PSMA8“ (;;)=256AS liegt in der Spalte ;47;*4*/;05;*4*/;6;*3* seitlich an „SIX6OS1“, und zwar als 47=QS=11=QS=“2“ _05=QS=“5“_“6“ mit 2_5_6 für „PSMA8“ (;;)=256AS. Das Ubiquitin=76AS wird aus der Endspalte ;05;/;6;*3* gewonnen, indem links die externe Spalte 6/5=QS=11=QS=“2“ verarbeitet wird, zu 05=QS=“5“_“2“= Summe 5+2=7_6 für Ubiquitin=76AS [PSMA8 - Proteasome subunit alpha-type 8 - Homo sapiens (Human) | UniProtKB | UniProt].
SUMO-Proteine: Der synaptonemale Komplex (SC) streckt sich in Form eines Reißverschlusses, dessen Zähne als „Synatomer“ bezeichnet werden. Hier wird vermutet, dass es bei der wissenschaftlichen Breite von 10 nm um das Synaptomer handelt, das aus verdichtetem Chromatin besteht. Entsprechend würde der Komplex eine 10-Nanometer-Maßkette bilden. Beim geschlossenen Reißverschluss entsteht mittig das Zentralelement. In größeren Abständen liegen Umkopplungsknoten (Rekombinationsknoten) auf dem Zentralelement, an denen eine Kreuzung (Chiasma) den Austausch väterlicher und mütterlicher genetischer Merkmale ermöglicht. Der Austausch „33 vs. 66“ beginnt in der 7. Zeile als Kreuzung der Spalte „3/3“ mit der „66“ in der 8.Zeile mit der Mischung „3636“ am Zeilenrand. Um die Ziffer „10“ als 10-Nanometer-Maßkette zur Segmentierung der Längsachse zu gewinnen, muss der „linke Serien-Rand „#1610“ präzise neben der Ziffer „10“ tangiert werden. Um diesen schmalen Rand zu adressieren, sind kleine Proteine erforderlich, und zwar in der Art von Ubiquitin=76AS (SUMO=Small Ubiquitin-Related Modifier). Im Unterschied zu „Ubiquitin“ besitzen „SUMO-Proteine“ einen Fortsatz von ca. 20AS, d.h. die Zahl „76“ ist noch vorhanden. Die Tangente an der „10er-Kante“ ist das Wesensmerkmal des SUMO-Komplexes. Zur Lysin-Motivation sind „8“ Kanten-Zeilen mit „8“ Zeilen je „10“ mit Summe „80“ für Lysin=80E beteiligt. Sofort am Anfang der Serie „#1610“ werden zeilenweise „SUMO1, SUMO2, SUMO3, SUMO4, SUMO5“ positioniert. Die zusätzlichen Kanten-Zeilen sind zur „SUMOylierung“ erforderlich, um das kleine Ubiquitin-ähnliche Modifikatorpolypeptid (SUMO)“ anzuhängen. „SUMOs“ modifizieren Zielproteine am Lysin-Rest (Lysin=C6H14N2O2=36+14+14+16=80E). Weiterhin muss auch rechte Rand am SUMO-Komplex beteiligt werden, um zur Energieversorgung das „ATP“ zu adressieren und homologe Chromatiden über die Symbole „33/66“ zwecks „Meiose“ anzusprechen. Die „5“ SUMO-Proteine liegen in der Spalte Z.38365#_[10]{9!8}{3}!°29°[775645]/#_[10](94)!(1)!*°3*0°![788788788]/#_[10]§89§9§*3*§!*°2°*§*;0*2;*!;0;![816]/#_[10]$85$7$3$;°3°;°4°;*7*!*;1;*!*7!1*2/#_[10]815351*4*;1;*!4!5[9]/#_[10]773|3703|[0040].
Das Protein (Mensch) „SUMO1“ {}=101AS startet in Z.38365#[1610]“98“3“ als Summe 98+3=“101“ für „SUMO1“ {}=101AS. „SUMO1“ kann von Cadmium (Cd)=48E stimuliert werden, weil die Ziffer „8“ mit „SUMO2“ über die Spalte „8/4“ für „Cd“=48E verbunden ist. „SUMO1“ interagiert mit einer Vielzahl von Proteinen und ist über eine (kovalente) Atombindung mit dem Zinkfingerprotein „ZFHX3“ verbunden „SUMO1“ kann sich zu polymeren Ketten formieren [SUMO1 - Small ubiquitin-related modifier 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das „ZFHX3“ (Zinc Finger Homeobox 3) unterstützt den „SUMO-Komplex“, indem die Proteine auf ihrer rechten Seite stabilisiert werden. Das Protein (Mensch) „ZFHX3“(||)=3703AS ist am 2.Zink-Atom in Z.38370 mit „3703[00] für „ZFHX3“(||)=3703AS (1. Monomer) lesbar, so dass sich vorgelagert am 1.Zinkatom das 2.Monomer von der Einbindung in „SUMO1“ bis zur Koppelstelle „00“ aufbauen muss – eine Dimer-Bildung ist nicht bekannt. „ZFHX3“(!!)=3703AS über die SUMO1-Spalte „83/[4]1“ als 83=QS=11=QS=“2“_“1“(aus SUMO2) mit Summe 2+1=“3“_ 30(Zink)=QS=“3“_aufsteigend 202=QS=“4“ mit „3“_Summe 3+4=“7“_“0“_aufsteigend „1“_Spalte 7/4/[0]=11=QS=“2“ mit 370_Summe 1+2=“3“ für „ZFHX3“(!!)=3703AS [ZFHX3 - Zinc finger homeobox protein 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SUMO2“ ()=95AS in Z.38366#[1610]“94“1“ mit Summe 94+1=“95“ für „SUMO2“ ()=95AS. „Plays a role in the regulation of sumoylation status of SETX“ [SUMO2 - Small ubiquitin-related modifier 2 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SETX“ (**)=2677AS ist an Beladung von „RAD51“ beteiligt, das bei der Reparatur von Doppelstrangbrüchen durch homologe Rekombination benötigt wird. „RAD51“ besetzt als Dimer den rechten Rand. „SETX“ bindet an „SUMO2“ aufsteigend mit der Spalte 3/3=“6“_“20“ mit Summe 6+20=“26“_Schleife „2“_aufsteigend Spalte 7/4=QS=11=QS=“2“_absteigend Spalte 1/1=QS=“2“ mit „26“_Summe 2+2+2=“6“_“71“ mit „26“_Summe 6+71=“77“ mit 26_77 für „SETX“ (**)=2677AS [SETX - Probable helicase senataxin - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SUMO3“ (§§)=103AS als Z.38367#[1610]“89“9“3“2“ mit Summe 89+9=“98“_QS3+2=“5“ mit Summe 98+5=“103“ für „SUMO3“ (§§)=103AS. Wie „SUMO2“ aufgrund der Spalte 3/3 an „SETX“ beteiligt. Bei der Mitose wandern SUMO-2/3 zu den Zentromeren und SUMO1 in die Spindel [SUMO3 - Small ubiquitin-related modifier 3 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SUMO4“ ($$)=95AS als Z.38368#[1610]“85“7“3“ mit „85“_73=QS=“10“ mit Summe 85+10=“95“ für „SUMO4“ ($$)=95AS. Die Endzahl „73“ kann mit der Folgezahl 34=QS=7 passend Summe 73+7=“80“ für Lysin=80E verarbeiten. Speziell wird das „IKBA“ modifiziert. „SUMO4“ aktiviert die SUMO-Protease „SENP1“ [SUMO4 - Small ubiquitin-related modifier 4 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „IKBA“ (;;)=317AS steigt aus der Spalte 1/1 in Z.38369 ab, um seitlich an „SUMO4“ zu binden, und zwar als Spalte 1/1 für „11“_020 für „0“_nach links 02 für „20“ mit Summe 11+0+20=“31“_34=QS=“7“ mit 31_7 für „IKBA“ (;;)=317AS [NFKBIA - NF-kappa-B inhibitor alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SENP1“ (°°)=644AS steigt seitlich von „SUMO1“ auf, und zwar über Spalte 29/30 mit Summe 29+39=59_Spalte 2/3=“5“ mit Summe 59+5=64_4 für „SENP1“ (°°)=644AS [SENP1 - Sentrin-specific protease 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „SUMO5“ (€€)=101AS zweizeilig aufsteigend über Spalte 8/7 für 87_Kunstgriff 73=QS=10 für „0“_absteigend 1535=QS=“14“ mit Summe 87+0+14=101 für „SUMO5“ (€€)=101AS [SUMO1P1 - Small ubiquitin-related modifier 5 - Homo sapiens (Human) | UniProtKB | UniProt]. Bevor seitlich das Lysin als „70“_absteigend 514=QS=“10“ mit Summe 70+10=Lysin=80E adressiert ist, muss eine Bindung über „33“ erfolgen, so dass „SUMO5“ speziell in Geweben (Membran=33) und Hoden (männlich=33) vorhanden ist [SUMO5, eine neuartige Poly-SUMO-Isoform, reguliert PML-Kernkörper | Wissenschaftliche Berichte (www-nature-com.translate.goog); X.Zheng u.a.(2016); https://doi.org/10.1038/srep26509].
„Die Bindung von „SUMO“ an Zielproteine erfolgt in einem dreistufigen enzymatischen Prozess, an dem ein aktivierendes E1-Enzym, ein konjugierendes E2-Enzym und ein ligierendes E3-Enzym beteiligt sind. Dieses letzte Enzym wählt schließlich die Substrate aus und überträgt SUMO-Proteine auf diese“[Die Meister der SUMO-Ketten | Max-Planck-Institut für Immunbiologie und Epigenetik (mpg.de); A new vertebrate SUMO enzyme family reveals insights into SUMO-chain assembly - PubMed (nih.gov); N. Eisenhardt u.a. Dez. 2015 ; DOI: 10.1038/nsmb.3114]. Das Proteine (Mensch) „UBC9“ {}=158AS besetzt an der [#16]“10“er-Kante die 7.+8. Zeile. Zur Interaktion mit „RAD51“ sind Kunstgriffe notwendig. Das Protein (Mensch) „UBC9“ {}=158AS liegt in der Spalte Z.38369#_[10][81535]{1}{4}[1459]#_[10][77337]{0}[30040]/#_[10]{7}{3}{1}{3}{91}[37438]/#_[10]{6}{8}{9}[41463636], und zwar über Z.38371 absteigend in Spalte 7/6=QS=“13“_aufsteigend Spalte 3/8=QS=11=QS=“2“ aufsteigend Spalte 1/9=QS=10 für „0“ mit Summe 13+2+0=“15“_“3“_91=QS=10 für „0“ _absteigend Spalte 1/0=QS=“1“_“4“ mit „15“_Summe 3+0+1+4=“8“ mit 15_8 für „UBC9“ {}=158AS. Alternativ ist eine Verlängerung als Abstieg bis „SUMO1“ möglich, und zwar über „15“_Summe 3+0+1=“4“ _ absteigend Spalte 7/0/4=QS=11=QS=“2“_“0“_29(neben SUMO1)=QS=11=QS=“2“ mit „15“_Summe 4+2+0+2=“8“ mit 15_8 für „UBC9“=158AS [UBE2I - SUMO-conjugating enzyme UBC9 - Homo sapiens (Human) | UniProtKB | UniProt].
Das Zinkfingerprotein „ZNF451“ („“)=1061AS entfaltet eine „E3-Ligase-Aktivität“ und interagiert mit „SUMO-2/3“, weil SUMO1 unerreichbar vorgelagert ist. „ZNF451“ kann sich mit beiden lesbaren Zink-Atome verbinden, die mit der Form=7 gegensätzlich als 307=QS=“10“ und 7030=QS=“10“ verbunden sind. Speziell werden SUMO-2/3 verarbeitet. „ZNF451“ über Z.38366#_[10941]“307“ mit 307=QS=“10“_aufsteigend über Spalte „020“/[47]“1“/[14]“1“ mit „020“ für „20“_Spalte 1/1 für „11“_über Z.38370#_[1077337]“030“ mit „030“ nach links für „30“ mit „10“_Summe 20+11+30=“61“ mit 10_61 für „ZNF451“ („“)=1061AS. „E3 SUMO-protein ligase; has a preference for SUMO2 and SUMO3 and facilitates UBE2I/UBC9-mediated sumoylation of target proteins“ [ZNF451 - E3 SUMO-protein ligase ZNF451 - Homo sapiens (Human) | UniProtKB | UniProt]._dat02.03.2024
Berichtigung: Text: „BRCA1-PALB2-BRCA2-Komplex“ wurde funktionell ersetzt _dat11.06.2024
Nucleus ruber [red nucleus (RN)]: Das Eisen=26 liegt nicht sichtbar vor und ist in Vesikeln als Pigment verpackt. Im Vierhügelbereich „4-4-4-4“ liegt Eisen kombiniert mit der Membran 33 und dem Vesikel-Symbol „0“(Null) in der Randspalte Z.38349#_[4]“6“0“5“[8273]/#_[4]“3“3“[47744] als mögliches Ziel für Proteine mit QS6+0+5=11 (Vielzahl Pigmente)=QS=“2“_QS3+3=“6“ mit 2_6 für Eisen=26E vor. Die Spalte 0/3 mit Zink=30 dient dem Transkriptionsrepressor, Protein (Mensch) „FOXP2“ zur Zink-Ionen-Bindung. „FOXP2“ wird im u.a. im „Nucleus ruber“ exprimiert und ist an Entwicklung von Geweben beteiligt ist. Spielt eine Rolle bei der Synapsenbildung, indem es den „SRPX2“-Spiegel reguliert. „FOXP2“ kann zusammen mit „CTBP1“ die Transkription synergistisch unterdrücken. Das Protein (Mensch) „CTBP1“=440AS liegt mit dem Cofaktor „Coenzym „Nicotinamid-Adenin-Dinukleotid (NAD)“ als oxidierte Form NAD+= C21H28N7O14P2=126+28+49+112+30=245E als QS7+4=11=QS=2_4_5 für NAD=245E in der Spalte Z.38348#_{74}[6058]/#_{5}“{4}“[3347]/#_[3]“40“[856] als 4_40AS für „CTBP1“=440AS; es ist nachgelagert und funktionell daher unnötig [CTBP1 - C-terminal-binding protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SRPX2_ Serine/arginine-rich protein-specific kinase“=688AS zählt dem Cofaktor „Magnesium“=12E in Leserichtung aus der Zahl „21“ in der Spalte Z.38346#_52136/#_948987/#_74605 als 3_QS2+1=3 mit Summe3+3=6_8_QS4_4=8 mit 68_8 für „SRPX2“=688AS. Die Ziffer „6“ liegt im Serin=56E mit „5“_QS2+1+3=“6“ und Arginin=94E ist seitlich lesbar [SRPK2 - SRSF protein kinase 2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „FOXP2“=715AS liegt folglich in der Zeile Z.38348#_“7“4“6“0“5“ als „7“_QS4+6+0+5=“15“ mit 7_15 für „FOXP2“=715AS [FOXP2 - Forkhead box protein P2 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Farbstoff „Carbocyanin“=C25H25IN2=150+25+53+14=242E grenzt den Nuclueus ruber (RN) ab, und zwar als Ring in der Spalte Z.38348#746058/#_543347 als QS7+4=11=QS=2_Kunstgriff 4+3+3=10 für „0“_4 mit „2“_Summe 0+4=“4“_QS6+0+5=11=QS=“2“ mit 24_2 für Carbocyanin=242E [Struktur und Funktion des roten Zellkerns: Von der Anatomie zur klinischen Neurowissenschaft | Struktur und Funktion des Gehirns (springer.com)]. Die Fasern des Hirnnervs III wandern entlang des „RN“ gemäß Randziffer Nerv=7_3=3.Hirnnerv (III) in Z. 38348#_“7“3“. Der „RN“ besteht aus 2 unterschiedlichen Strukturen: 1.) Oben/rostal: magnozellulärer roter Kern (RNm) und 2.) Unten/kaudal: parvozellulärer roter Kern (RNp). Die Zählung von Eisen=26E in der Spalte Z.38248#_[4]“6“0“5“[8273]/#_[4]“3“3“{47}{74}{4} als QS6+0+5=11=QS=“2“_QS3+3=“6“ für Eisen=26 enthält eine Membran „33“, die vom Protein (Mensch)=„Alpha-Synuclein“=140AS geöffnet werden kann, um Eisen zu transportieren. Das Protein wird ist in Synapsen zwecks Ausschüttung von Botenstoffen vorhanden. „Alpha-Synuclein“ ist eine zelluläre „Ferrireduktase“, die Eisen Fe3+ in Fe2+ reduziert. Folglich liegt das Eisen als Kette „26-26“ vor, und zwar als Fortsetzung QS4+7=11=QS=“2“_QS7+4=11=QS=2_4 mit „2“_Summe 2+4=6 für Eisen=26. [Alpha-Synuclein ist eine zelluläre Ferrireduktase | PLOS EINS; P.Davies u.a. 2011; https://doi.org/10.1371/journal.pone.0015814]. „Alpha-Synuclein“=140AS liegt in der Spalte Spalte Z.38247#_[94898](7){9}[95]#_[7460](5)“(8)“{2}“[73]/#_[54334]“7“7“[44] aus dem Eisen-Bindung über „82/77“ als QS7+7=“14“_QS8+2=10 für „0“ mit 14_0 für „Alpha-Synuclein“=140AS, wobei die Ziffer „2“ in der Spalte 9/2 zum Cofaktor „Kupfer“=29E gehört und die Ziffer „8“ zum Cofaktor „Calcium“=20E als QS5+8_7=20 [SNCA - Alpha-synuclein - Homo sapiens (Human) | UniProtKB | UniProt].
Substantia nigra: Der paarig angelegte Nervenknoten „Substantia nigra“ gliedert sich in die dunkle, melaninhaltige „Pars compacta“ mit hohem Dopamin-Gehalt und die rötliche, eisenhaltige „Pars reticularis“. Das Pigment „Melanin“ ist verschiedenartig und die exakte Struktur ist unbekannt. Es handelt sich um Copolymere, deren Indolverbindungen über C-C-Bindungen verknüpft sind. Mit C-C=“6-6“ wird diese Bindung im „Melanin“=8_66_8 eingeschlossen. Mit anderen Zahlen ist die Kombination X_YY_X oder als Spalte X_Y/Y_X als Besonderheit mehrfach vorhanden. Die „Substantia nigra“ liegt in der Spalte Z.38355#_“8“66“8“/“1002“/“5“2“[43], die das Protein (Mensch) „Claudin_CLND1“=253AS enthält, und zwar als 2_5_QS1+0+0+2=“3“ für „CLND1“=253AS. „Claudin“ verschließt den Zellzwischenraum, um den Stofftransport zu kontrollieren [CLDND1 - Claudin domain-containing protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. In der Spalte Z.38354#_“44“5“33“082407/#_40“33“1686681 liegt Indol=C8H7N=48+7+7=62E als Spalte 2/6 für 62E und dem Nerv=7 am Rand. Der Indol-Ring „64“ liegt als Spalte „4/6“ seitlich an. Die beiden Schichten (Pars) sind als Gruppe „44“ doppelt als Gewebe 33/33 und Struktur „5“ vorhanden. In der Spalte Z.38356#_[3613]{0}“5“1“00“2“[8]/#_[31“9“2{9}[552](4)(3)(2) wird zunächst in der Spalte „0“5“1“/“9“[55] das Tyrosin=C9H11NO3=96E als „9“_QS0+5+1=“6“ für Tyrosin=96E erzeugt. Die „Tyrosinhydroxylase“=45AS in der Rand-Zahl „432“ als „4“_QS3+2=“5“ für 45AS mit dem Cofaktor „Eisen“=26E wandelt „Tyrosin“ in „Levodopa (L-DOPA)“=C9H11NO4=54+11+7+32=104E um [Tyrosinhydroxylase – Wikipedia]. Cofaktor „Eisen“ als „2“_QS5+1+0+0=“6“ mit 2_6 für Eisen=26E vor. „Levodopa“ als „10“_QS0_4=“4“ mit 10_4 für Levodopa=104E [TH - Tyrosinhydroxylase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Aromatische-L-Aminosäure-Decarboxylase (DDC)“=480AS erzeugt daraus „Dopamin“=C8H11NO2=48+11+7+16=82E. „DDC“ liegt in der Randspalte Z.38356#_[1002](8)/#_[52]“4“3“(2)/#_[13]“8“7“[6] als 4_8_QS3+7=10 für „0“ mit 48_0 für DDC=480AS mit Dopamin in der Spalte „8/2“ für Botenstoff „Dopamin“=82E. Cofaktor „Pyridoxalphosphat“=C8H10NO6P=48+10+7+48+15=128E als QS1+0+0=“1“_“28“=128E [DDC - Aromatische-L-Aminosäure-Decarboxylase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das giftige Neurotoxin „6-Hydroxydopamin“=C8H11NO3=48+11+7+24=90E schädigt Nervenzellen, weil es in der Randspalte [6]“81“/[0]“2“8/[4](3)(2) das Dopamin=82E in der Spalte 8/2 mit QS82+8=90E verbraucht. Das Protein (Mensch) „CDNF“=187E verhindert die Degeneration der Nervenzelle mit 1_8_QS2_3+2=7 mit 18_7 für „CDNF“=187E [CDNF - Cerebral dopamine neurotrophic factor - Homo sapiens (Human) | UniProtKB | UniProt]. Die „schwarze Substanz“ (Substantia nigra) ist ein motorisches Zentrum, um Bewegungen zu starten. Eine Schädigung führt zur Parkinson-Erkrankung. Der Arzneistoff „Ropinirol“=C16H24N2O=96+24+14+8=142E ist dem L-Dopa=104E ähnlich, aber weniger wirksam. In der Spalte „1“0“0“/[5]“2“4“ führt die Ziffer „2“ seitlich zur Bildung der Zeitbasis „24“ und kann die Hirnschranke im Gegensatz zu von außen zugeführten Dopamin überwinden. Der Arzneistoff „Pramipexol“=C10H17N3S=60+17+21+16=114E zählt als Regulator die Zahl „14“ nach links, und hemmt im Anfangsstadium der Erkrankung bei übermäßiger Dopamin-Bildung und erhöht später die zu geringe Dopamin-Produktion, und zwar in der Spalte Z.38355#_[33168]“6“[681]/#_“1“3“0“[510028] als QS6_5=11_QS1+3+0=“4“ mit 11_4 für „Pramipexol“=114E, wobei die Zeit als QS1+1=2_4 für Zeitbasis=24 ebenfalls enthalten ist.
Das Protein (Mensch) „SLC6A3_Dopamin-Transporter“=620AS liegt in der Randspalte Z.38353#_[82]“4“0“7“/#_[86]“6“81/#_1“0“0“[28], wobei die Spalte 7/1=Chlor=17 für Chlorid und QS4+07=Natrium=11 enthalten sind. Der Transporter legt sich folglich mit einer Schleife spaltenförmig neben das Dopamin=82E als QS4+0+7=11 (Natrium)=QS=“2“_Spalte 6/0 für „60“_“0“ mit Summe=2+60=“62“_“0“ für „SLC6A3“=620AS [SLC6A3 - Sodium-dependent dopamine transporter - Homo sapiens (Human) | UniProtKB | UniProt]. Die Ziffer „4“ gehört zur Zeitbasis „24“, die sich mit einer 2-zeiligen Lücke für ATP=260E in der Spalte Z.38356#_[51]“0“0“2[8]/#_[55]“2“4“[32] als „2“_QS0_2+4=“6“_“0“ für ATP=260E wiederholt. Umformung in ADP=220E als „2“_über Spalte 1/5=QS=6_5 mit „2“_Summe 6+5=11=QS=2_0 mit 22_0 für ADP=220E. Das ATP gehört zum Protein (Mensch) „TOR1A“=332AS, das den Dopamin-Transporter „SLC6A3“ reguliert, und zwar in der Spalte Z.38356#_[5]“1“0“0“2“8/[5]“5“2“4“3“2 ringförmig über Spalte 2/3 für „32“ mit QS32+0+0+1=“33“_QS5+2+4=11=QS=“2“ mit 33_2 für TOR1A“=332AS [TOR1A - Torsin-1A - Homo sapiens (Human) | UniProtKB | UniProt]. Die „Zeitspalte“ Summe „24+66+00+24“ enthält spaltenförmig die Zeitbasis=“60“ doppelt und extra als Summe „24“+[QS6+6=]“12“+“24“=“60“. Das mögliche Anti-Ageing-Protein (Mensch) “KL-Klotho“=1012AS besitzt den Cofaktor „Vitamin D“=C27H44O=162+44+8=214E und wirkt sich vergleichsweise bei einer „Maus“ günstig auf die Lebenszeit aus. Es sind „2“ Zählmöglichkeiten vorhanden: Entweder ist die Zeit „24“ eine Schlussaddition oder dient als Motivation die Zeit=24 am Zeilenrand der Vorzeile zu zählen. In diesem Pfad liegt die Glutaminsäure (E/Glu)=C5H9NO4=30+9+7+32=78E in einer Verlängerung () am Ende: „Es fehlen jedoch in vito essentielle Glu-Reste des aktiven Zentrums an den Positionen 239 und 872“. Mit Vitamin „D“{} in der Spalte Z.38353#[73469](7)(2)(2)(4)#_[53308]“2“4“[0](7)/#_[33]{1}{6}[8]“6“[681]/#_{1}{3}{0}{5}“10“[028] über Spalte 6/5=QS=11=QS=2_1_QS1+3+0=4 mit 2_1_4 für Vitamin „D“=214AS. „Klotho 1. Zählung (Zentrum)“ als „10“_“6“_QS2+4=“6“ als „10“_Summe 6+6=“12“ mit 10_12 für „Klotho“=1012AS. „Klotho 2. Zählung (Rand)“ als „10“_“6“_QS“2“_7_2=11=QS=2_2_QS4_7=11=2 mit „10“_“6“_Summe 2+2+2=6 als „10“_Summe 6+6=“12“ mit 10_12 für Klotho=1012AS; mit Glu=78E am Schluss als „7“_QS4+2+2=“8“ für Glu=78E. Zusammen mit FGF2=251AS [FGF23 - Fibroblast growth factor 23 - Homo sapiens (Human) | UniProtKB | UniProt] und FGFR1=822AS [FGFR1 - Fibroblast growth factor receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt] am ATP in Z.38356 [KL - Klotho - Homo sapiens (Human) | UniProtKB | UniProt]. Das Zink=30E in Z.38356#_30 lesbar, so dass sich auf- und absteigend verschiedene Zinkfinger-Proteine anlagern. Das Zinkfingerprotein (Mensch) „ZNF746“=644AS kann sich in der Spalte Z.38353#_[4873]“4“[6]/#_[445]“3“{3}“{0}/#_[403]“3“1“[6] entwickeln, und zwar aufsteigend in der Spalte 3/3=QS=“6“_absteigend in der Spalte 4/3/1 als QS3_1=“4“_“4“ mit 6_44 für „ZNF746“=644AS. „ZNF746“ bindet am Motiv „5'-TATTTT[T/G]-3'. Threonin (THR/T)=64E, Alanin (Ala/A)=48E und Glycin (Gly/G)=40E sind seitlich vorhanden. „Könnte als nachgeschalteter Effektor von „PRKN“ fungieren und zur Neurodegeneration bei der Parkinson-Krankheit beitragen, die durch Defekte in „PRKN“ verursacht wird: Seine Anhäufung, gefolgt von einer Hochregulierung von „PPARGC1A“, könnte zum selektiven Verlust von Dopamin-Neuronen in der Substantia nigra führen“ [ZNF746 - Zinc finger protein 746 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „PPARGC1A“=798AS liegt in der Spalte Z.38354#_“5“3“3“[0]/#_“3“3“1“6“ und wird blockiert, weil es den Weg von ZNF746 kreuzt, und zwar schleifenförmig QS6+1=7_QS3+3_3=9_QS5_3=8 mit 7_9_8 für „PPARGC1A“=798AS [PPARGC1A - Peroxisome proliferator-activated receptor gamma coactivator 1-alpha - Homo sapiens (Human) | UniProtKB | UniProt].
Die Brücke (Pons) gehört zum Hirnstamm und leitet Informationen zum seitlich anliegenden Kleinhirn weiter. Das Protein (Mensch) „DHB_Dopamine beta-hydroxylase“=617AS wird in der Brücke (Pons) verstärkt produziert. Als Merkmal für die Reihenfolge der Nervenknoten im Hirnstamm dient der Cofaktor „Kupfer“=29E, der dem Zink=30E in einer Folgezeile folgt. Die Dopamin-Spalte „8/2“ liegt als Dopplung erneut am Zeilenrand, so dass Dopamin=82E zum Botenstoff „Noradrenalin“=C8H11NO3=48+11+7+24=90E verarbeitet wird. Für die Katalyse ist 2-fach Ascorbat erforderlich, damit sich 4 gleiche Untereinheiten von „DHB“ zusammenschließen: „Dopamin + 2 L-Ascorbat + O2 = (R)-Noradrenalin + H2O + 2 Monodehydro-L-ascorbat-Radikal“. [Anmerkung: „Oxidationsprodukt des L-Ascorbats ist die Semidehydro-L-Ascorbinsäure (synonym „Monodehydro-L-Ascorbinsäure“ oder „Ascorbyl-Radikal“). Wird die „Semidehydro-L-Ascorbinsäure“ nicht „aktiv“ zu L-Ascorbinsäure reduziert, disproportionieren 2 Moleküle „Semidehydro-L-Ascorbinsäure“ spontan zu „Dehydro-L-Ascorbinsäure“ und „L-Ascorbinsäure“. Somit ist „Dehydro-L-Ascorbinsäure“=C6H6O6=96E zu erwarten]. „Ascorbat“ ist ein Salz der Ascobinsäure (Vtamin–C)=C6H8O6=36+8+48=92E. Das „Vitamin-C“ zählt das Kupfer=29E in der Gegenrichtung aus denselben Ziffern, damit beidseitig jeweils 2 Untereinheiten anliegen können. In der Spalte „6“1“3“0“/“1“9“(29) folgt das doppelte Vitamin-C als „9“_QS1_6¬+1+3+0=11=QS=“2“ mit 9_2 für „Vitamin-C“=92E. „Zink“=30 wird dadurch unlesbar und die Zahl „19“ wird für einen Kunstgriff verwendet. „DBH“=617AS auf der linken Seite mit 2 Untereinheiten je 617AS, und zwar über Z.38355#[1611]“4“0“3“/[1611](3)“61“/#[1](61)(1)(3)“1“9“ als QS1+9=10 für „0“_„61“_QS4+0+3=“7“ für 617AS und weiter über Spalte 3/3 als QS3_3+1=7_61 für 617AS (Dopplung links). Rechte Seite mit doppelt „DBH“=617AS über Spalte Z.38355#_“31“6“[8](6)[681]/#_“30“5“(1)(0)[028]/#_{29}“5“(5)(2)[432] als QS30+31=“61“_QS6_5=11=QS=2_5 mit „61“_Summe 2+5=“7“ für 617AS und weiter gespiegelt mit QS6_0=6_1 für „61“_QS5+2=“7“ für 617AS. In der Randspalte „6“8“1/0{28} geht die Dopamin-Spalte 8/2 in Wasser=28E und QS8+1=9_6 für Dehydro-L-Ascorbinsäure=96E über. Sauerstoff O2 als Eingangsspalte Z.38354#_8/8 mit QS8+8=O2=16E. Das katalysierte Noradrenalin=90E liegt folglich in der Zentralspalte „31/30/29“=QS=90E. Die Rinde des Kleinhirns (Cortex cerebelli) enthält Nerven mit einem stark verästelten Dentritenbaum. Diese „Purkinjezellen“ werden über die Proteine „MYH10“ und „Homer3“ speziell lokalisiert [Das menschliche Gehirn – Kleinhirn – Der menschliche Proteinatlas (www-proteinatlas-org.translate.goog)]. Das Protein (Mensch) „Homer3“=361AS ist in der Spalte Z.38356#_“36(1)“[30]/#_[3](19)[29] lesbar. Bei einem „Tetramer“ müssen sich weitere Untereinheiten von „Homer3“ anlagern. Die Interaktion mit „SHANK1“ ist Calcium-abhängig, und zwar mit in der Spalte [6]1/19 mit QS1+19=Calcium=20E [HOMER3 - Homer protein homolog 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „SHANK1“=2161AS bildet mit Homer3 ein Komplex in der Spalte Z.38356#_[3]“61“[30]/#_31929, und zwar als QS2+19=21_61 für „SHANK1“=2161AS [SHANK1 - SH3 and multiple ankyrin repeat domains protein 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Aktin-basierte Motor-Protein „Myo-10“ findet die Bindung an ATP=260E, ADP=220E und Aktin=374AS in der Spalte Z.38356#_“3“6“1“3“[0]/#_“3“1929/#_“2“7728 mit ATP als „2“_QS3_3=6_QS6+1+3=10 für „0“ mit 26_0 für ATP=260E. „ADP“ über Spalte 2/2 mit 22_QS9_1=10 für „0“ mit 22_0 für ADP=220E. Aktin als „3“6+1=“7“_QS3+1=4 mit 37_4 für Aktin=374AS. Im „Aktin“ bildet das Tropomyosin=568AS eine Spirale (2x 284AS), und zwar seitlich als „5“_QS1_5=“6“_ 2_QS3+8=11=QS=2_4 mit „56“_Summe 2+2+4=“8“ mit 56_8 für 568AS. Calmodulin=149AS begrenzt Myo-10 in der Spalte Z.38355#_14033/#_13613 als 14_QS0+3+3_3=9 mit 14_9 für 149AS. Folglich endet das Protein (Mensch) „MYH10_MYO-10“=1976AS, fortschreitend gezählt, im Calmodulin in der Spalte Z.38355#_[14]“0“3“3“/#_[13]“6“1“[3]/#_[13]“1“9“2“/#_[12]“7“7“2“ als „1“_QS9+2=11=QS=2_2_7 mit „1“_Summe 2+2+7=11=QS=2_7 mit „1“_Summe 2+7=“9“ als „19“_Spalte 6/1=QS=7_QS0+3+3=6 für MYH10=1976AS [MYH10 - Myosin-10 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Spalte „2/3/3“ liegt nochmals rechts für ein alternatives ATP=260E mit „2“_QS3_3=6_Spalte 1/0/9=QS=10 für „0“ für ATP=260E. „Calmodulin“ ebenfalls alternativ neben ATP als „1“_QS0+0_4=“4“_Spalte 2/3/4=QS=“9“ für Calmodulin=149AS[CALML3 - Calmodulin-like protein 3 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „MYO10_Q9HD67= 2058AS besetzt den rechten Rand und muss die linke Lücke mit einer Spectrin-Bindung füllen. „MYO10“ als „2“_Spalte 8/2=10 für „0“_“3“_QS2+4=6_QS3+8=11=QS=2 mit „203“_Summe 6+2=“8“ für „MYO10_Q9HD67“=2038AS [MYO10 - Unconventional myosin-X - Homo sapiens (Human) | UniProtKB | UniProt]. Spectrin_()=2472AS in der Spalte Z.38356#_[5](1)(0)(0)“2“8“/#_[5](5)(“2“4“)3“2“/#_[8](1)(„3“)(„8“)[76] als QS24_0+0=“24“_Spalte 1/5/1=QS=“7“_QS3+8=11=QS=“2“ mit 24_7_2 für Spectrin=2472AS [SPTAN1 - Spectrin alpha chain, non-erythrocytic 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Querverbindung zum Kleinhirn liegt in der Spalte Z.38358#_2{77}28(8)(1)(3)“8“7“[6]/#_23528(2)(9)(4)(3)“4“1“, die den Nerv „7“ als Dopplung „77“ und das Ubiquitin=76AS enthält. Das Protein (Mensch) „E3_Ubiquitinligase E6-AP“=875AS wird im Kleinhirn vom Gen „UBE3A“ codiert. Fehlt dieses Gen, verlangsamt sich die kognitive und motorische Entwicklung [Angelman-Syndrom]. „E6-AP“ zieht den Nerv „7“ als Bezug aus dem Ubiquitin in der Randspalte „8“7“[6]/(3)“4“1“ als 8_7_QS4+1=5 mit 8_7_5 für „E6-AP“=875AS. Die Zinkbindung wird mit QS29_1=30E avisiert, muss aber korrekt anliegen, und zwar als QS8_2=10_QS1_9=10_QS3_4+3=10 mit Summe 10+10+10=Zink=30E [UBE3A - Ubiquitin-protein ligase E3A - Homo sapiens (Human) | UniProtKB | UniProt].
Das Kleinhirn: Das Protein (Mensch) „CBLN1_Cerebellin-1“=193AS bildet die Kleinhirnsynapsen, wobei Sialinsäure als Ligand notwendig ist. Die Sialinsäure ist beim Menschen als Acylneuraminsäure=C11H19NO9=66+19+7+72=164AS vorhanden. „CBLN1“ in der Spalte Z.38357#_(16)(1)(1)“3“1“9{2}/#_[16](1)(1)“2“7“7{2} als „1“_QS2+7=“9“_“3“ mit 19_3 für „CBLN1“=193AS. Acylneuraminsäure=164E als 16_QS1+1_1+1=4 mit 16_4 für 164E [CBLN1 - Cerebellin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „CBLN2_Cerebellin-2“=224AS über Spalte 2/2 mit _QS2+7+7+2_2=20_Randspalte 1/1=2 mit Summe 20+2=“22“_QS3+1=“4“ als 224 für CBLN2=224AS [CBLN2 - Cerebellin-2 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „CBLN3_Cerebellin-3“=205AS liegt in der Spalte Z.38357#_[319]“2“9“5“[5]/#_“2“7“7“2“[881] als QS2+7+7+2=18_QS2+9=11=QS=2 mit Summe 18+2=“20“_“5“ für CBLN3=205AS. Das Kleinhirn liegt praktisch auf der Brücke (Pons). Das Protein (Mensch) „CDH15_Cadherin-15“=814AS ist ein Zelladhäsionsprotein, weil sich diese Proteine gegenseitig suchen und dabei auch Zellen bewegt werden. Bei der Zellbewegung wird das Calcium aktiv gesucht. Wenn im CDH15-Verbund in der Zählung die Summe=20=Calcium enthalten ist, steht Calcium unsichtbar zur Verfügung. CDH15=814AS beginnt als 1. Zählung kompakt in der Spalte Z.38357#_{19}(2)[95]/#_“7“7“(2)[88]/#_“3“5“(2)[82]/#_[93](2)[79]/#_[51](2)(7)(9) als QS3+5=“8“_QS7+7=“14“ für CDH15=814AS [CDH15 - Cadherin-15 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Vorzeile enthält mit QS1+9=10 nur 50% von Calcium=20, so dass durch Interaktion mit dem Protein (Mensch) „ARVCF“=962AS, dessen 10er-Spalte QS2_2_2_2_2=10 zum Calcium ergänzt wird. „ARVCF“=962AS absteigend als „9“_QS2+7_2=11=QS=2_2_2 mit „9“¬_Summe 2+2+2=“6“_“2“ für „ARVCF“=962AS [ARVCF - Splicing regulator ARVCF - Homo sapiens (Human) | UniProtKB | UniProt]. Gleichzeitig können andere „CDH15“ an diese Position gelockt werden, und zwar in der Spalte „2“8“/“2“8“/“2“[7] als 8_QS2+8_2_2=14 mit 8_14 für CDH15=814AS [z.B. um eine Gaumenspalte zu schließen].
Das Guillain-Mollaret-Dreieck legt eine Verbindung vom „Nucleus ruber“ im Mittelhirn zur unteren Olive (Nucleus olivaris inferior), wobei die Querverbindung in das Kleinhirn über die Brücke (Pons) als Dreieck zwischengeschaltet ist. Die Olive ist eine paarige Vorwölbung der „Medulla oblongata“. Kletterfasern steigen von der Olive in das Kleinhirn auf, umschlingen die Purkinje-Zellen und setzen zur Stimulierung den Neurotransmitter „Asparaginsäure“=C4H7NO4=24+7+7+32=70E frei. Der Neurotransmitter wird vom Glutamat-Rezeptor sekundär schwach erkannt, der Glutamat=78E bindet. Die Asparaginsäure=70E ist erforderlich, weil die Zahl „70“ den Nerv=7 und die Ziffer „0“ den Kletterfaser-Querschnitt „O“ darstellt. Das Klettern in der Spalte 2/2/2/2/2=QS=10 für „0“ muss nunmehr bis zu einer Zahl „QS=7“ für 70E am Rezeptor gezählt werden, für den 2 Proteine existieren. Die Zahl „10“ verfolgt das Ziel, jeweils „1“ Kletterfaser mit „10“ Purkinje-Zellen zu verbinden. Hierzu wird die Klettergröße „10“ für „0“ durch ein Umschalten in die Bindungsziffer „0“ des Rezeptors realisiert. Die Rückkopplung in das Kleinhirn dient als Feedback bei der Bewegungskoordination. Die 2er-Spalte Z.38359#_2/#_2/#_2/#_2/#_2 für QS=10 für „0“ wird mit in der Spalte Z.38356#_(3)“0“5“1“0028/#_(2)“9“552432/#_(2)8{8}{1}{38}76 in der Spalte 3/2/2=QS=7 fortgesetzt, wobei die Ziffer „0“ in der Zahl 3“0“[Zink=30 wird nicht gelesen] die Bindung im Protein für Asparaginsäure=70E ergibt. Das Protein (Mensch) „GRIA1_Glutamat-Rezeptor“=906AS folgt über die Spalte 0/9 mit „90“_QS0+5+1=“6“ für 906AS. Das Glutamat bindet auf der rechten Seite über die Ziffer „1“ als QS4+3=7_QS5+2_1=8 für Glutaminsäure=78E [GRIA1 - Glutamate receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GRIN1_Glutamat-Rezeptor“=938AS als QS8+1=9_38 für „GRIN1“=938AS wird von Glutaminsäure =78E über die Ziffer „8“ mehrfach gebunden. Zur Asparaginsäure legt sich mit der Spalte 5/5=QS=10 für „0“ ein Kunstgriff [GRIN1 - Glutamate receptor ionotropic, NMDA 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Verlängertes Mark (MO) / Medulla oblongata): „MO“ ist ein neuronales Zentrum für die Kontrolle des Blutkreislaufs und der Atmung. „MO“ ist ein Reflexzentrum, ein Brechzentrum und reguliert den Säure-Basen-Haushalt. „MO“ sind intrazelluläre Gene (BHLHE23; FOXD3) und sekretbildende Gene (GCG; CRH; IGLV3-9; IGLV4-69) zugeordnet [The human brain - medulla oblongata - The Human Protein Atlas]. Das Protein (Mensch) „FOXD3-Forkhead box protein D3“=478AS reguliert negativ die Transkription des Transkriptionsrepressors „ZNF205“. FOXD3=478AS nutzt das vom Zinkfingerprotein „ZNF205“ kreierte EXTRA-Zink und zieht dann neben „ZNF205“ eine lange Spalte Z.38357#_[9]“2“/#_“7“2“/#_“5[2]/#_“3“[2], und zwar aufsteigend als QS2_2=4_7_QS5+3=8 mit 4_7_8 für FOXD3=478AS [FOXD3 - Forkhead box protein D3 - Homo sapiens (Human) | UniProtKB | UniProt]. Um ein weiteres Zinkfingerprotein zu binden, wird am lesbaren Zink ein weiteres Zink kreiert, damit über das spaltenförmige Protein (Mensch) „ZNF205“ der folgende Zeilenbereich gelesen wird. Das Extra-Zink ist dem Zink{}=30E angelagert, und zwar in der Spalte Z.38356#_[61]{30}“5“1“/#_[19]“29“5“[5]/#_77(2)881/#_[35(2)[829]/#_[93](2)[799]/#_(5)(1)(2)[79] als „1“_Kunstgriff QS5_5=10 für „0“_29 mit „1“_Summe 0+29=“29“ mit QS1+29=Zink=30E. Das Zinkfinger-Protein (Mensch) „ZNF205“()=554AS holt sich das Zink absteigend als „5“_QS1+2_2=“5“_QS2_2=4 mit 5_5_4 für ZNF205=554AS [ZNF205 - Transcriptional repressor RHIT - Homo sapiens (Human) | UniProtKB | UniProt]. Die Wasserspalte „28/28“ ist nur eine Teilnutzung, denn insgesamt sind es 7 Zeilen ab Z.38358 mit QS2+8=10 für den „10“. Hirnnerv (Nervus vagus). Die 2-zeilige Lücke wird „1“mal ersatzweise durch QS1+27=“28“ geschlossen und „1“mal als die seitliche Klammer „5“28/“3“2“[7]/{1}{27} mit „2“_QS3+5=“8“ für „28“. Die Lücke enthält die Nerven-Spalte „7/7“, mit der der „Nervus vagus“ spezielle Funktionen an die Medulla als Zentrum übergibt. Der Sinn der Spalte „28/2(7)/2(7“) liegt in der Bildung der Zahl „68“, und zwar absteigend in Brechrichtung QS2_2_2=6_8 für TOKEN=68. Es handelt sich um ein Erbstück von den Insekten, deren Nahrung aus dem Kropf zurück hochgewürgt wird. Umgekehrt füllt sich der Magen mit TOKEN=86. Die Zeitbasis=“60“ für Atmung und Herz zählt sich neben der Nerven-Spalte 7/7 als QS28+2+2+28=Zeitbasis=60. Das Arzneimittel gegen Brechreiz „Dimenthydrinat“=C24H28ClN5O3=144+28+17+35+24=248E legt sich exakt auf die Reizstrecke, um den Reiz zu verhindern, und zwar absteigend als „2“_QS2+2=“4“_“8“ für „Dimenthydrinat“=248E. Im Übermaß ist ZNF205 schädlich, weil es das Protein (Mensch) „MPV17L“=196AS freisetzt, das mit Wasserstoffperoxid verbunden ist. Zum Zellschutz muss „H2O2“ nachfolgend zu Wasser und Luftsauerstoff „O2“ abgebaut werden. In dieser Gesamtentwicklung wird „MPV17L“=196AS lotrecht weiter entwickelt, obwohl der Luftsauerstoff „O2“=16E eigentlich am linken Rand als Serie #16 läuft. „MPV17L“ in der Spalte Z.38361#[161115]“1“[27]/#_[16111]“0“9“[28]/#_[16110]“6“[728] über Spalte 1/9 mit 1_9_QS0_“6“ als 19_6 für „MPV17L“=196AS. Folglich ist Wasserstoffperoxid=H2O2=2+16=18E in der Spalte „110/106“ als 10_QS1_1+0+6=8 mit Summe 10+8=18E vorhanden [MPV17L - Mpv17-like protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „CAT-Katalase“=527AS nimmt bei der Katalyse „2 H2O2=2 H2O+O2“ das Wasserstoffperoxid (H2O2) auf und liefert in der Spalte „928/728“ doppelt Wasser=28(Symbol) in der Spalte „28/28“ und den Luftsauerstoff „O2“ in 9/7=QS9+7=16=O2. CAT=527AS in der Spalte Z.38361#_[11]“5“{127}{91}/#_“1“1“0“{9}(28){04}/#_“1“0“6“{7}(28){40} als 5_QS1+1+0=2_QS1+0+6=7 mit 5_2_7 für CAT=527AS. Für die Katalyse zieht das zweite H2O2 mit einem Kunstgriff als Klammer um die Wasserspalte 28/28 neben Ziffer “5“ von „CAT“ als QS1+2+7=10 für “0“_QS9+1=10_QS0+4_4+0=8 mit Summe10+8=H2O2=18E [CAT - Catalase - Homo sapiens (Human) | UniProtKB | UniProt]._dat23.10.2023
Blut-Hirn-Schranke (blood-brain barrier) [BBB]; Blut-Rückenmark-Schranke (Blood-Spinal Cord barrier) [BSCB]: Die Trennlinie zwischen Z.Nrn.-Matrix und Code erzeugt eine Barriere. Um das Gehirn vor zirkulierenden schädlichen Stoffen zu schützen, ist weiterhin eine Blut-Liquor-Schranke (CSF) im „Plexus choroideus (CP)“ lokalisiert. Die Serie Z.“383“xx ist flexibel, um Monosaccharide und Vitamin C im Blut=26(Symbol) zu transportieren. „Blut“ mit Spalte Z.“38“3“xx/Z.[38]“3“xx als QS3+8=11=QS=2_QS3_3=“6 für Blut=26. Hexose=C6H12O6=36+12+48=96E (Glucose u.a.) mit Spalte Z.“38“3“xx/Z.“38“3“xx/Z.“38“3“xx als QS3_3_3=9_3-fach QS8+3=11=QS=2 mit „9“_Summe 2+2+2=“6“ für Hexose=96E. Alternativ aus QS38+38=76_38=QS=11_QS3_3_3=9 mit 76_Summe 11+9=20 für QS76+20=Hexose=96E. „Pentose“= C5H10O5=30+10+40=80E mit Spalte Z.“3“8“[3]xx/Z.“3“83“xx/Z.[3]“83“xx als „8“_QS3_3=6_2-fach QS8+3=11=QS=2 mit „8“_Summe 6+2+2=10 für „0“ als 8_0 für Pentose=80E. „Vitamin C“ (Ascorbinsäure)=C6H8O6=36+8+48=92E in der Spalte Z.“3“83“xx/Z.“3“[83]xx/Z.“3“[83]xx als QS3_3_3=“9“_QS8+3=11=QS=2 mit 9_2 für Vitamin C=92E. An der Schranke (BBB/BSCB) und den roten Blutkörperchen (Erythrozyten) transportiert das Protein (Mensch) „Glut1_Glukosetransporter“=492AS die Glucose in das Gewebe. „Glut1“ liegt als Homotetramer 4-fach in der Spalte „3“83“/“3“83“/“3“83“. Die Spalte „83/83“ [bzw. 38/38] mit 2-fach 83=QS=11=QS=2 als Summe 2+2=4 kann in jeder der 4 Ecken eines Quadrats für die Ziffer „4“ erzeugt werden, so dass sich ein Tetramer bildet. Die Zahl „92“ entsteht aus QS3_3_3=9_83 mit Summe 9+83=“92“ mit 4_92 für„Glut1“=492AS. Bei Glut-Proteinen bilden 12 Segmente einen Kanal, darstellbar mittels „12“ Ringen=“64“=12*64=768 (Symbol) in der Spalte 38/38/[3]8 als QS38+38=76_8 Glukosekanal=768 (Symbol) [SLC2A1 - Solute carrier family 2, facilitated glucose transporter member 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Glut3“=496AS versorgt Nervenzellen mit Glucose, ist aber im Unterschied zu Tieren relativ gering vertreten. „Glut3“ liegt in der Spalte „38“3“/“38“3“ als 38_38=QS=11_QS3_3=6 mit Summe 38+11=49_3 für Glut3=496AS, wobei die Glukose=96E enthalten ist. „Glut1“/“Glut2“ transportieren Dehydroascorbinsäure=C6H6O6=36+6+48=90, die von Zellen schnell aufgenommen und zu Ascorbinsäure reduziert wird [SLC2A3 - Solute carrier family 2, facilitated glucose transporter member 3 - Homo sapiens (Human) | UniProtKB | UniProt]. In umgekehrter Richtung transportiert das Protein (Mensch) „MCT1_Monocarboxylat-Transporter-1“=500AS viele Monocarbonsäuren [Lactat, Pyruvat, Mevalonat, Anionen von Valin/Isoleucin] aus der Zelle heraus. „MCT1 liegt 3-zeilig in der Spalte „38“3“/“38“3“/“38“3“ als „38“_38=QS=“11“_ QS3+8=11 als Spaltzahl „1“_“1(Rest)“ als Summe 38 +11+1=50_1 (Rest)_QS3_3_3=9. Mit 50_Summe 1(Rest)+9=10 für „0“ mit 50_0 für „MCT1“=500AS [SLC16A1 - Monocarboxylate transporter 1 - Homo sapiens (Human) | UniProtKB | UniProt]. „MCT1“ benötigt das Protein (Mensch) „BSG_Basigin“=385AS. Die beiden Zerlegungsarten „38_2_3“ und „3_83_2“ führen bei der Bindung an „MCT1“ zu einem Homodimer [Basigin (CD147), ein multifunktionales Transmembran-Glykoprotein mit verschiedenen Bindungspartnern | Das Journal für Biochemie | Oxford Akademiker (oup.com)]. „BSG“ als Variante in der Spalte „38“[3]/“38“3“ „38“_38=QS=11=QS=2_3 mit „38“_QS2+3=“5“ als 38_5 für „BSG“=385AS [BSG - Basigin - Homo sapiens (Human) | UniProtKB | UniProt].
Die Schranken [BBB/ BSCB] benötigen zur funktionellen Durchlässigkeit eine Verbindung zum Code. In der Code-Rand-Serie #1611 wird mit der Zählgröße 11 über 6 Zeilen von Z.38355 bis Z.38360 die Förderhöhe einer Pumpe realisiert. Die Zeile Z.[3]“83“60“ ist geeignet, um am rechten Rand das ATP=260E als Pumpen-Energie zu liefern, und zwar mit 83=QS=11=QS=“2“_“60“ für ATP=260E. In der Spalte Z.„38“[360]/Z.“38“361“ folgt die Umwandlung in ADP=220E als 38=QS=11_38=QS=11 mit Summe 11+11=22_QS3+6+1=10 für „0“ mit 22_0 für ADP=220E. ABC-Transporter transportieren spezifische Substrate aktiv über eine Zellmembran [ABC=ATP binding cassette]. ABC-Transporter bilden Homo- und Heterodimere. Das Protein (Mensch) „p-glycoprotein_MDR1_Q6RVA0=164AS liegt zunächst in der Z.Nrn.-Matrix, um im Code über die Pumpenstrecke ein Homodimer zu erzeugen. Weil andere ABC-Proteine dieselbe Pumpenstrecke nutzen, entsteht dort ein Heterodimer mit dem Protein „MDR1_ABCB1“ (auch: PGP-Pumpe; PGP=permeability glycoprotein)]“=1280AS. „MDR1_Q6RVA0“=164AS liegt in der Spalte Z.[3]“83“60“/Z.[3]836“1“/ Z.[3]{8362} als „1“ _QS 60_83=QS=2_83=QS=11=QS=2 mit „1“_Summe 60+2+4=64 als 1_64 für „MDR1_Q6RVA0“=164AS, so dass links die Membranspalte [3]/[3] frei bleibt. Der Anschluss zum Homodimer am Fußpunkt der vertikalen Pumpenstrecke erfolgt über 2 „wertlose“ Kunstgriffe in der Zeile Z.[3]“83“6“2“#{16111} mit 83=QS=11=QS=2 mit Summe 2+6+2=10 für „0“_weiter im Code mit Summe 1+6+1+1+1=10 für „0“. „MDR1_Q6RVA0“=“0“+“0“+164AS=“164“AS. MDR1_Q6RVA0“=164AS bildet ein Homodimer über die Pumpenstrecke ab der Randspalte Z. 38360#16“11“1“/#16“11“1“, wobei sich die Zahl „16“ aus 8-fach „11“=QS=“2“ bildet. In 7 Zeilen wird die Zählgröße 11=QS=2 gezählt und die seitliche Startspalte 1/1=QS=2 wird mitgezählt. In der Z.38355#[16]“11“4“[033] liegt die Anschlussziffer „4“ für „16“4“AS vor. „MDR1_Q6RVA0“ als (1/1=QS=2_11)_11_11_11_11_11_(11_4) mit Summe 2+ {7*(11=QS=2)=14}=16_4 für„MDR1_Q6RVA0“=164AS [MDR1 - p-glycoprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „MDR1_ABCB1“=1280AS schwingt aus der Z.Nr.-Matrix Z.[383]“6“[0]/Z.383“6“[1]/Z.[383]“6“2“ mit QS6_6=“12“_QS6+2=“8“_in den Code mit QS1+6+1+1+1=10 für „0“ mit 12_8_0 für „MDR1_ABCB1“=1280AS an den Fußpunkt der Pumpenstrecke. Als Homodimer wird der Anschluss aufsteigend ab Z.38355#[16]“11“[4033] über 6 Zeilen bis Z.38360#[16]“11“ mit 11=QS=2 als Summe 2+2+2+2+2+2=“12“_Zahl „80“ in der Spalte Z.38361#16“111“5“/#{16111}“0“ als QS1+1+1+5=“8“_“0“ mit 12_8_0 für „MDR1_ABCB1“ =1280AS (Homodimer) gebildet [ABCB1 - ATP-dependent translocase ABCB1 - Homo sapiens (Human) | UniProtKB | UniProt]. Der Arzneistoff gegen Durchfallerkrankung, das künstliche Opioid „Loperamid“=C29H33ClN2O2=174+33+17+14+16=254E bleibt lokal auf das Darmnervensystem begrenzt, weil es die Opiodrezeptoren nicht erreicht. „Loperamid“ reduziert primär die erhöhte Darmbewegung (Motilität), so dass der Körper mehr Zeit gewinnt, um Wasser und Elektrolyte wieder aufzunehmen sowie Krankheitserreger abzubauen. „Loperamid“ kann z.B. die ATP-Energie aus der Z.Nrn.-Matrix blockieren, in dem es sich in den Zugang zur Pumpenstrecke legt, und zwar aufsteigend in der Spalte Z.38360#“1“61“11“[9]“3“/#“161“11“5“1“ als „161“_QS1+61=“62“_QS11_11=“22“_QS5+1_3=“9“ mit Summe 161+62+22+9=161+93=254 für „Loperamid“= 254E. Für Bildgebungsverfahren wird das membrandurchdringende Radiopharmazeutikum „Technetium(99mTc)-Sestamibi“=C36H66N6O6Tc=216+66+47+48+43=420E eingesetzt, um die Funktion der CSF-Schranke zu überprüfen [Choroid plexus epithelial expression of MDR1 P glycoprotein and multidrug resistance-associated protein contribute to the blood–cerebrospinal-fluid drug-permeability barrier | PNAS; DOI: 10.1073/pnas.96.7.3900]. Der ATP-Bereich wird ebenfalls blockiert, aber wegen der Zugabe diverser Hilfsstoffe und dem Erhitzen erfolgt offensichtlich ein Transport. „99mTc-Sestamibi“=420E in der Spalte Z.38360#“161“1“[1]“9“[32]/#“161“1“1“5“[12], und zwar als offener Ring mit 9_QS1+1+5=7 mit 9_7 als 97_Summe 161+161+1=323 mit QS97+323=420E. „MDR1_ABCB1“=1280AS bildet einen Komplex mit dem Protein (Mensch) „MARCKSL1_MRP“=195AS, in Z.[38360#1611]“19“3“2“ als 19_QS3+2=5 für MRP=195AS. Bindung von Calmodulin=149AS in der Spalte [19[„32“/“1“5“12“ als „1“_QS5+12_32=“49“ mit 1_49 für Calmodulin=149 AS. Bindung von Aktin=374AS in der Spalte Z.[38361]#[1611151]“27“9“1“2“2“{7}{1}/#[1611109280]{49}{7}[01], und zwar als „27“_QS9+1=“10“_QS2+2=“4“ mit Summe 27+10=37_4 für Aktin=374AS. Das integrierte Tropomyosin {}=568AS als QS49+7+0=56_QS7+1=8 für 568AS [MARCKSL1 - MARCKS-related protein - Homo sapiens (Human) | UniProtKB | UniProt].
Das Hirnwasser (Nervenflüssigkeit / Liquor cerebrospinalis) wird durch eine Ultrafiltration des Blutes gebildet. Die Blut-Liquor-Permeabilitätsbarriere ist im Epithel des Plexus choroideus (CP) lokalisiert [CP=arteriovenöse Gefäßkonvolute in den Hirnventrikeln]. Die Blut-Liquor-Schranke (blood-cerebrospinal fluid barrier) [CSF] ist nur für Wasser, Sauerstoff und Kohlendioxid voll durchlässig ist. In der Code-Rand-Serie „#1611“ können Luftsauerstoff O2=#16E, CO2=6+16=22E mit QS11_11=CO2=22 und H2O über Spalte #1/#1=QS=2_QS6+1+1=8 mit 2_8 für Wasser=28 (Symbol) transportiert werden. Das Protein (Mensch) „Albumin“=604AS dient im Blut als Transportprotein für viele kleinmolekulare Verbindungen (u.a. Hormone, Medikamente, Metallkationen). Ein Platzhalter ist mit der „0“(Null) bereits mit dem Kreis=64 kombiniert. „Albumin“ wird in der Leber produziert, so dass ein erhöhter Anteil im Liquor auf eine undichte CSF-Schranke und eine Entzündung hinweist. „Albumin“ besetzt die Matrix-Spalte Z.[3]“83“55“/Z.[3]“83“[56]/Z.“383“[57] mit Summe 55+83+83+383=604AS. Diese Z-Form wird durch eine Bindung von Kupfer=29E geformt, und zwar als 38=QS=2_QS3_3_3=9_QS5+5=10 für „0“ mit „2“_Summe 9+0=“9“ mit 2_9 für Kupfer=29. Das Calcium=20E wird gebunden als QS3_3_3=“9“_QS5+5=“10“_Code-Rand „#1“ mit Summe 9+10+#1=Calcium=20E. Bindung von Zink=30E mit „3“_ 55=QS=10 für „0“ als 3_0 für Zink=30E. Bindung des Blut-Abbauproduktes von Hämoglobin, „Bilirubin“= C33H36N4O6=198+36+28+48=310E mit 3_QS5+5=10 mit 3_10 für Bilirubin=310E. Albumin=604AS durchbricht die CSF-Schranke in Z.[38355#1611]“4033“ mit Membran „33“ als QS3+3=“6“_“0“_“4“ für „Albumin“=604AS. In der Spalte Z.38355#[161140]“3“3“[1]“6“/#[1611361]“3“0“5“ sind Bilirubin=310E in der Spalte 31/30 mit und zugleich Zink=30E als Bindung vorhanden. Weiterhin Kupfer über die Spalte 6/5=QS=11=QS=2_QS3+0_3+3=9 mit 2_9 für Kupfer=29E [ALB - Albumin - Homo sapiens (Human) | UniProtKB | UniProt].
Die Proteine im Hirnwasser (Liquor) stammen aus 3 Quellen: 1.) Aus dem Plexus chorioideus stammt „Beta-Trace“ 2.) Aus dem Hirnparenchym (Neuronen/Gliazelle) stammt das „Tau-Protein“ 3.) Liquorproteine wie „Transthyretin“ bestehen aus einer Blut- und einer ZNS-Fraktion [Brain specific proteins in cerebrospinal fluid (CSF): factors influencing their concentration in CSF and clinical relevance; H.Tumani u.a.; 2005; 10.1515_jlm.2005.057 (1).pdf].
Zu 1: Das Protein (Mensch) „PTGDS_Prostaglandin_Beta-trace“=190AS ist ein Marker, der die Pumpenstrecke in der Spalte Z.38355#[161]“1“40“[33]“1“/#[1611]“36“1“3“0“ passiert hat, und zwar als „1“_QS40_36+1+3=40_Spalte 1/0=QS=10 mit „1“_Summe 40+40+10=“90“ mit 1_90 für „PTGDS“=190AS. Das männliche Fortpflanzung ist tangiert, weil die Zahl 33=Membran=männlich eingeschlossen wird. Bindet kleine lipophile Moleküle Biliverdin, Bilirubin. Dient als Fänger für schädliche hydrophobe Moleküle. Das Wasser=28 liegt am rechten Zeilenrand Z.38356#_30510028 und wird alternativ gezählt und dabei vom Protein eingefangen, und zwar als QS3+0+5+1+2=11=QS=2_8 für Wasser=28. Biliverdin=C33H34N4O6=198+34+28+48=308E ist eine Vorstufe von Bilirubin=310E mit „30“_QS5+1+0+0+2=8 für Biliverdin=308E [PTGDS - Prostaglandin-H2 D-isomerase - Homo sapiens (Human) | UniProtKB | UniProt]. „PTGDS“ zieht eine Schleife um die Zahl „33“, die aus seiner Synthese durch das Protein (Mensch) „Cyclooxygenase 1 (COX-1)_PTGS1 - Prostaglandin G/H synthase 1=599AS stammt, das den Cofaktor „Häm“ (Hämb / Fe-Protoporphyrin)= C34H34FeN4O4 =204+34+26+28+32=324E besitzt [Ligand view of heme b (144129 - KABFMIBPWCXCRK-RGGAHWMASA-L) - BRENDA Enzyme Database (brenda-enzymes.org) ; iron(iii) protoporphyrin IX | C34H34FeN4O4 | ChemSpider]. Der Cofaktor „HÄM (Hämb=Fe-Protoporphyrin)“=324E liegt in der Randspalte Z.38352#_[653]“11“4“[9]/#_[469]“7“2“2“4“/#_“308“2“4“0“7“ als QS11+4=15_QS7+2+2=11 mit Summe 15+11=Eisen=“26“_Randspalte 4/7=QS=11=QS=2_4 mit Summe 2+4=“6“ für Summe 26+6=“32“_2_Cox-Bindung mit QS3+0+8=11=QS=2 mit 32_Summe 2+2=4 als 32_4 für HÄM=324E. „COX-1“ liegt in der Spalte Z.38353#_[87]“3“4“[697224]/#_[4]“5“3“3“0“8“[2407]/#_“0“3“3“[1686681]/#_“6“1“3“[0510028], über Spalte 5/3 mit einer Schleife in die 33er-Lücke als „5“_“3“_Kunstpause über linke Spalte 0/6 mit QS0_6+1+3=10 für „0“_3_3 mit „5“_Summe 3+0+3+3=“9“_QS3+4=7_QS3+0+8=11=QS=2 mit 59_Summe 7+2=9 mit 59_9 für COX-1=599AS [PTGS1 - Prostaglandin G/H synthase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. COX-1/COX-2 metabolisieren „Arachidonsäure“ zu „Prosta¬glandinen“. Arachidonsäure=C20H32O2=120+32+16=168E in der Spalte Z.38355#_[1]“40“33“1“[6]/#_“1“3“[61305] als „1“_QS3+3=“6“_QS0_4=4_QS1+3=4 mit „16“_Summe 4+4=“8“ mit 1_6_8 für Arachidonsäure=168E. An der Katalyse ist die „Cholesteryl arachidonic acid (5Z,8Z,11Z,14Z-eicosatetraenoate) =C47H76O2=282+76+16=374E zur Orientierung beteiligt, und zwar mit „3“_QS3+3+1=“7“_QS4+0=“4“ für 374E. Am Ende der Pumpenstrecke überlagern sich Wirkstoffe. Hemmende Arzneimittel können als Nebenwirkung einen Überschuss an „Arachidonsäure“ verursachen, womit ungünstig „Leukotrine“ gefördert werden. Das Arzneimittel „Acetylsalicylsäure (ASS)“=C9H8O4=54+8+32=94E hemmt COX-1 mit QS3_3_3=9_4 für ASS=94E, um die Bildung der „Prostaglandine“ zu mindern, die als Botenstoff einen Schmerzreiz an das Gehirn leiten. Der Schutz der Magenschleimhaut durch einen ASS-Tabletten-Überzug ist nicht ausreichend, weil die gehemmten Prostaglandine einen Überschuss an Magensäure verhindern. Zum Ausgleich wird Pantozol (Protonenpumpen-Hemmer) oder Misoprostol (Postaglandine–Derivat) verordnet. Günstiger gegen Schmerzen sind COX-2_Hemmer [Analgetika: COX-Hemmer | PTA-Forum (pharmazeutische-zeitung.de); 11/2014].
Zu 2: Das Protein (Mensch) „MART_Protein Tau“=758AS zieht spektakulär durch die Membran „33“. Weil die Alzheimer-Erkrankung viele Jahre im Voraus programmiert ist, liegt auch hier wieder die Zeitbasis 365=1 Jahr an. Im Krankheitsverlauf verursacht der Proteinbiomarker „Amyloid-beta“ Fehlfaltungen, die sich im Gehirn als Plaques ablagern. „MART-Tau“ liegt in einer 5-zeiligen Alzheimer-Matrix, die am Zeilenrand Z.38351#_00 mit einer Erinnerungslücke „00“ endet, und zwar in der Spalte Z.38351#_[5713858]“4“[2]/#_[529]“3“65“3“1“[1]/#_[487]“3“4“[6972]/#_[44]“53“3“[0824]/#_“403“[316866]. „MART-Tau“=758AS absteigend von Z.38355 als QS4+0+3=7_53_Spalte 34/(3)3 mit QS3+4_3=10 als Summe 7+53+10=70_Zeitbasis 365=1 Jahr als 3_QS6+5=11=QS=2 mit Summe 3+2=5 als Summe 70+5=“75“_in der Spalte [8]4/31 wird die Schwerachse 84 zerstört als QS3+1_4=8 mit 75_8 für „MART-Tau“=758AS. In der Spalte sind die 21 Jahre Entwicklungszeit rechts als Spalte „2/1“ für „21“ und als „858“=QS=21 Jahre lesbar. Die ersten Anzeichen sind im Blut 17 Jahre vor den ersten Symptomen der Erkrankung feststellbar [Alzheimer-Früherkennung bis zu 17 Jahre im Voraus - Newsportal - Ruhr-Universität Bochum (rub.de); Juni 2022]. Die Zahl „17“ bildet die linke Matrix-Spalte „1/9/7“ als QS1+9+7=17 Jahre. „Der C-Terminus bindet axonale Mikrotubuli, während der N-Terminus Komponenten der neuronalen Plasmamembran bindet, was darauf hindeutet, dass Tau als Linker-Protein zwischen beiden fungiert“ [MAPT - Microtubule-associated protein tau - Homo sapiens (Human) | UniProtKB | UniProt]. Die „21“ Jahre im Voraus resultieren aus der Magnesium-Spalte „2/1/2“, die je nach Zählrichtung den Cofaktor „Magnesium“=12 für das Heterodimer aus Tubulin Alpha und Beta bildet, und zwar in der Spalte Z.38351#_[385]“8“42“[00]/#_[365]“3“1“1“{49}/#_[34697]{2}{2}{4}/#_[3308240]{7}. Das Protein (Mensch) „Tubulin beta“=451AS beginnt mit der Ziffer „2“ aus der Mg-Spalte „1/2“ als QS2+2=“4“_über Randspalte 49/[2]4/[0]7 mit „49“_QS4_7=11=QS=“2“ mit „4“_Summe 49+2=“51“ als 4_51 für „Tubulin beta“{}=451AS. In der Randspalte ist „Ubiquitin“ =76AS als „7“_QS2+4=“6“ für 76AS vorhanden [TUBA1B - Tubulin alpha-1B chain - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „Tubulin alpha“=451AS liegt in der Spalte „8“42“/“3“1“1“, und zwar über Spalte 8/3=QS=11=QS=2_42_1 mit Summe 2+42+1=45_1 für „Tubulin alpha“=451AS [TUBA1A - Tubulin alpha-1A chain - Homo sapiens (Human) | UniProtKB | UniProt]. „Tubulin“ benötigt für Katalyse das GTP=268AS als 2_Spalte 4/2=QS=6_QS1+1_4=6_Spalte 8/3=QS=11=QS=2 mit „26“_Summe 6+2=“8“ als 26_8 für GTP=268E. Umwandlung in GDP=228E über Spalte „2“0“/1“4“/“22“ als „22“_QS4_2+0_1+1=“8“ mit 22_8 für GDP=228E. Das Protein (Mensch) „ APP_Amyloid-beta-Vorläuferprotein“=770AS wird in der Randspalte durch 3 Liganden fixiert, und zwar in der Spalte Z.38348#_(6)(0)(5)(8){273}/#_[3](3)(4)“77“4“4“/#_[08563]{9}“2“/#_[8584]{20}[0] oberhalb von Zink {} als QS27+3=Zink=30E, unterhalb von Kupfer {} in der Spalte [3]“9(2)/“2“0“[0] als „2“_QS0_9=“9“ für Kupfer=29E. Eisen () in der Spalte 60“5“8“/[3]“3“4“(7) als QS5+8¬_3+4=“20“_QS6+0=“6“ mit Summe 20+6=Eisen=26E. Das Heparin=C12H19NO20S3=72+19+7+160+48=306E bindet in der letzten Lücke unterhalb der Zahl 77 mittels einer äußeren Klammer durch das Zink bis seitlich an das Kupfer, und zwar als 273_QS5+8=13_QS3+4=7_8 mit 273_Summe 13+7+8=28_weiter mit QS5+6=11=QS=2_3 mit „273“_Summe 28+5=“33“ als QS273+33=306E für Heparin=306E. Protein „APP“=770AS mit „77“_QS4+4_2=10 für „0“ mit 77_0 für „APP“=770AS [APP - Amyloid-beta precursor protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Beta-Sekretase_BACE1“=501AS spaltet die Zahl „77“ von „APP“=770AS und trennt den linken Rand 6-zeilig mit einer Klammer zum rechten Rand ab und zieht ein Schleife bis unter die rechte Ziffer 7“7“. Vertikalschnitt ab Z.38346#_“87“99“5“ mit Klammer QS99+5=“104“_Vertikale als QS87+58+47+56+84 (Schwerachse)=“332“_Randklammer QS11+49=“60“_Innenschleife in Spalte „3“[92]/“2“0“0“ mit QS2+0+0_3=“5“. Summe 104+332+60+5=501 für „BACE1“=501AS [BACE1 - Beta-secretase 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PSENEN“=101AS gehört zum 4-teiligen Proteinkomplex „Gamma- Sekretase“ und ist am 2. Schnitt beteiligt in der Spalte [7]“99“[5]/[8]“2“[73]/[7744] mit QS99_2=101 für „PSENEN“=101AS beteiligt. Die Schnittlinie wird vom Protein (Mensch) „PSEN1_Presenilin-1=467AS fortgesetzt, und zwar in der Spalte 7“7“[44]/6“3“[92]/[4]“2“[00]/ [1]“1“4“[9] als „4“_absteigend QS1_2_3=6_7 mit 4_6_7 für „PSEN1“=467AS [PSEN1 - Presenilin-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Die Zerstückelung von „APP“ schnürt eine Gruppe „44“ von Proteinen in der Spalte 44/[9]2 mit A_beta=42AS ab. Diese sind für das Gehirn unverzichtbar, aber als Plaques im Gegenteil krankhaft. Die überschüssige Ziffer „9“ wird dabei vom Protein (Mensch) „NCSTN_Nicastrin“=709AS in der Spalte „7“[44]/“3“9“[2]/“2“0“[0]/“1“4“[9] herausgeschnitten, und zwar als „7“_QS3_2_1+4_0=10 für „0“_“9“ mit 7_0_9 für „Nicastrin“=709AS [NCSTN - Nicastrin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein-Reststücke „A_beta 42“=42AS entsteht durch Spaltung der Gruppe 44, so dass die Randspalte „4/2“ mit 42AS entsteht. Alternativ wird die Gruppe 44 beseitigt, so dass 40AS aus QS2+0=“2“_QS9+2=11=QS=“2“_“0“ mit Summe 2+2=4_0 für „A_beta 40“=40AS entstehen. Das Protein (Mensch) „APH1A _ Gamma-secretase subunit“=265AS trennt die Gruppe „4-4“, so dass die Protein-Spalte „4/2“ für 42AS freigeschnitten wird, und zwar in der Spalte Z.38349#_[47]“7“4“[4]/#_“5“6“3“9“[2]/#_[84]“2“0“[0]/#_[31]“1“4“[9] absteigend QS5+6=11=QS=“2“_Spalte 7/3=QS=10 für „0“_aufsteigend 4_QS9_2+0=11=QS=2 mit „2“_Summe 0+4+2=“6“_QS1+4=5 als 2_6_5 für„APH1A“=265AS [APH1A - Gamma-secretase subunit APH-1A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „APH1B _ Gamma-secretase subunit“=257AS nimmt die Gruppe „44“ auf, so dass „A_beta 40“ als Rest verbleibt. „APH1B“=257AS in der Spalte Z.38348#_“82“73“/#_“7“7“44“ als QS4+4_7+3=18_QS8+2=10 für „0“ mit 18+0=18_7_7 als Summe 18+7=25_7 für „APH1B“=257AS [APH1B - Gamma-secretase subunit APH-1B - Homo sapiens (Human) | UniProtKB | UniProt]. Das Arzneimittel „Semagacestat“=C19H27N3O4=114+27+21+32=194E hemmt die Gamma-Sekretase, so dass beide Reststücke A-beta 42/40 verhindert werden. Statt Plaque ggf. andere Nachteile. „Semagacestat“ wirkt in der Spalte „[7]“7“[44]/[6]“3“9“2“/[4]“2“0“0“ über Spalte 7/3=QS=10_9 mit Summe 10+9=19_QS2_0_0_2=4 mit 19_4 für „Semagacestat“=194E. Das Arzneimittel „Flurbiprofen“=C15H13FO2 wird in der Leber verstoffwechselt, wobei der aktive Wirkstoff „4-Hydroxyflurbiprofen“=C15H13FO3=90+13+9+24=136E entsteht, der in der Randspalte „44/92“ mit QS4+9=13_Randspalte 4/2=QS=6 mit 13_6AS beide Moleküle „A-beta 42/40“ als Nebeneffekt verhindert. „Flurbiprofen“ gehört zu den Antirheumatika (NSAR) und ist ein schmerzlindernder Entzündungshemmer.
Zu 3: Das Protein (Mensch) „TTR_Transthyretin“=147AS bildet ein Tetramer und transportiert das Schilddrüsenhormon „Thyroxin“ aus dem Blutkreislauf ins Gehirn. Im Kanal befinden sich zwei Bindungsstellen für Thyroxin. L-Thyroxin bindet um eine Größenordnung stärker an das Transthyretin als das Trijod-L-Thyronin. Thyroxin-bindendes Globulin ist das wichtigste Trägerprotein für Schilddrüsenhormone beim Menschen. Das Protein wird direkt im „Plexus chorioideus“ synthetisiert. Zum Überwinden der CSF-Schranke muss sich ein Tetramer bilden. Der Wirkstoff „Tolcapon“ ist ein Stabilisator, um die Blut-Hirn-Schranke zu überwinden (kurze Halbwetzeit/Riskiko Leberversagen). Das Arzneimittel „Tafamidis“ stabilisiert das Tetramer [Transthyretin im Visier ‐ Mechanismusbasierte Behandlungsansätze und Zukunftsperspektiven bei hereditärer Amyloidose - Dohrn - 2021 - Zeitschrift für Neurochemie - Wiley Online Library (onlinelibrary-wiley-com.translate.goog); M. Dohrn, u.a. https://doi.org/10.1111/jnc.15233]. In der Z.Nrn.-Matrix wird zur Bildung von Pumpen-Energie an der ATP-Zeile Z.38360 zunächst ein Dimer gebildet. Im Code grenzt das 2. Dimer als Wirkstoff-Pumpe. „TTR-Matrix-Dimer“ in der Spalte Z.[3]“83“5“[9]/Z.[3]“83“6“[0]/Z.[383]“6“{1}/Z.[38]{36}{2}/Z.[38]{3}{6}[3] für 1. Zählung „TTR“=147AS über Spalte 6/6=QS=12_83=QS=11=QS=2 mit Summe 12+2=“14“_83=QS=11=QS=2_5 mit „14“_Summe 2+5=“7“ mit 14_7 für „TTR“=147AS. 2. Zählung „TTR“{}=147AS als „1“_ QS36+2=“38“_QS3+6=“9“ mit 1_ QS38+9=47 für 1_47 für „TTR“=147AS (Homodimer) [TTR - Transthyretin - Homo sapiens (Human) | UniProtKB | UniProt]. Das „Trijodthyronin (T3)“=C15H12I3NO4=90+12+159+7+32=300E beginnt in der Spalte Z.[38]“3“5“[8]/Z.[383]“5“9“/Z.[3836]“0“/Z.[3836]“1“ und besitzt im Dimer 2 Bindestellen als „3“_QS5_5=10 für „0“_QS9+0+1=10 für „0“ mit 3_0_0 für T3=300E. Thyroxin (T4)“=C15H11I4NO4=352E muss jede „TTR“ zur Wirkstoff-Anbindung gesondert ansteuern. Ab Z.[38]“35“[8] mit „35“_Spalte 5/6=QS=11=“2“ für T4=352E. Ab „3“[8360] mit 3_38=QS=11=QS=2_3 mit „3“_Summe 2+3=“5“_QS3+6+2=11=QS=“2“ mit 3_5_2 für T4=352E. Das Thyroxin wird im Blutserum mit dem speziellen „Thyroxin-bindenden Globulin (TBG), Protein (Mensch) „TBG_Serpina7“=415AS transportiert. „TBG“=415AS ist in der Serie Z.383xx durchgehend vorhanden, und zwar in der Spalte 383/383 als QS38+3=41_38=QS=11=QS=2_3 mit „41“_Summe 2+3=“5“ als 41_5 für „TBG“=415AS [SERPINA7 - Thyroxine-binding globulin - Homo sapiens (Human) | UniProtKB | UniProt]. Speziell wird das „TBG“ genutzt, um das Dimer in der Matrix mit dem Dimer im Code zum Tetramer zu verbinden, so dass die Wirkstoffe an den Fußpunkt der Wirkstoff-Pumpe transportiert werden, und zwar in der Spalte Z.[383]“6“0“#[16111]/Z.[3836]“1“#[16111]/Z.[3836]“2“#“16“1“1“1“/Z.38363#“16“1“1“0“ mit dem Matrixanteil QS6+0=“6“_Randspalte „1/2“=QS=“3“ mit Matrix-Summe=“9“_Spalte 16/16=QS=“32“ mit Summe 9+32=“41“_QS1+1+0_1+1+1=“5“ mit 41_5 für „TBG“=415AS. Fortsetzung: 3. Zählung „TTR“=147AS mit Anschluss an freie Randziffer „3“ in Z.[3836]“3“ am Ende des Matrix-Dimers in der Spalte Z.[38362]#[16]“111“0“/Z.[3836]“3“#“16“1“10“6“ als „3“_QS#16+1+10+6=“33“_QS111+0=“111“ mit Summe 3+33+111=147 für „TTR“=147AS. 4. Zählung „TTR“=147AS über 7-zeilige Pumpenstrecke absteigend von Z.38361 bis Z.38355#[16]“11“403“ in der Code-Serie #[16]“11“ mit 11=QS=2, und zwar als QS2+2+2+2+2+2+2=“14“_QS4+0+3=“7“ mit 14_7 für „TTR“=147AS (Tetramer) [TTR - Transthyretin - Homo sapiens (Human) | UniProtKB | UniProt]. Das Thyroxin (T4)“=352E bindet stärker am „TTR“ als „T3“, weil es die Endziffer „3“ von „TTR“ als Startziffer von „T3“ zur Bindung nutzt, und zwar in der Spalte Z.38354#_1144“5“3“3“0“/#_(1140“3“)“3“1“6“/#_(11)[36130]“5“ über Spalte 5/3=3_5 mit „35“_Kunstgriff über Spalte 3/3=QS=6_Spalte 3/1=QS=4_0 mit 35_Summe 6+4+0=10 für „0“_Spalte 6/5=QS=11=QS=2 mit 35_Summe 0+2=2 als 35_2 für Thyroxin (T4)“=352E. „T3“=300E absteigend als „30“_Spalte 33/31=QS=10 für „0“ mit 30_0 für „Trijodthyronin“ (T3)=300E.
Das „Tetamer“ wird in der Endziffer QS4+0+3=“7“ durch die vertikal einbindende Schwerachse 84 in der Spalte 44/40 mit QS4+4=8_4 für 84 (Symbol) stabilisiert. Der künstliche Stabilisator „Tolcapon“=C14H11NO5=84+11+7+40=142E beginnt in dieser Achse in der Spalte {44}[5330]/{40}“3“3“1“6“/[3]“6“1“[30]“5“ und zieht durch die Ziffer „3“ der Thyroxin-Bindestelle als QS6+1=7_QS3+3+1=7 mit Summe 7+7=14_Spalte 6/5=QS=11=QS=2 mit 14_2 für „Tolcapon“=142E. Thyroxin (T4)=352E kann die Spalte 6/5 für die Endziffer „2“ nutzen, um die lesbare Zeitbasis „24“ durch einen Kunstgriff in die Z.38354#_8“24“ mit QS=2_0+8=10 für „0“_Zeitbasis=24 zu erreichen. In der Auswirkung zerstört „Tolcapon“ die Zeitbasis „24“, um die kurze Zeitbasis=60 als QS30_Spalte 6/5=QS=2_8 für 28_2 mit 30_Summe 28+2=30 mit QS30+30=Zeitbasis=60 zu lesen. Das Arzneimittel „Tafamidis“=C14H7Cl2NO3=84+7+34+7+24=156E erzeugt kein Tetramer, sondern bindet an den Thyroxin-Bindungsstellen des „TTR“, um die Auflösung in 4 Monomere durch Stabilisierung zu verhindern. „Tafamidis“=156E kann sich außen als Ecke zur Stabilisierung an die Thyroxin-Bindestelle in der Spalte [44]„5“3“3“0“/(403)“3“1“6“ mit QS5+3_3+1_3+0=15_6 für „Tafamidis“=156E anlegen. Alternativ wird die Bindestelle Ziffer „3“ zur Einbindung genutzt, um die Spalte 6/5 zwecks Kontakt zur lesbaren Zeitbasis „24“ zuhalten, und zwar in der Spalte [5330]/“3“3“1“6“/[1]“3“0“5“ als Spalte 6/5=QS=“11“_Spalte 1/0=QS1_0=“1“_“3“ mit Summe 11+1+3=15_QS3+3=6 mit 15_6 für „Tafamidis“=156E. Bei einer Halbwertzeit=49 Stunden über die Zeitbasis „24“ in der Randspalte „24“[07]/“6“6“8“1“/[00]“28“ als QS6+6+8=20_1_28=49 Stunden. Die Halbwertzeit eines Medikaments ist Eleminationshalbwertzeit des Wirkstoffs über die Eleminationsgeschwindigkeit= ln 2 / Eleminationsgeschwindigeitskonstante [Interaktionslexikon–Teil 10; HWZ.pdf (unimedizin-mainz.de)]. „Tafamidis“ liegt in der vorhandenen Spur._dat01.11.2023
Am Ende der Pumpenstrecke wird der Neurostransmitter „Serotonin“=C10H12N2O=60+12+14+8=94E vom Protein (Mensch) „SLC6A4_Serotonin-Transporter (SERT /5-HTT)“=630AS übernommen und von der horizontalen Seitenlage in eine zentrale Vertikalachse gebracht, weil sich serotoninerge Kerngruppen in der Medianlinie des Hirnstamms („Naht“) beider Hirnstamm-Hälften befinden. Die Membran „33“ ist in der Spalte Z.38354#_[11]“4“4“53“[308]/_[1140]“33“[168] mit QS33_53+4+4=Serotonin=94E enthalten. Der Serotonin-Transport vom synaptischen Spalt zurück in das präsynaptische Terminal beendet die Serotonin-Signalisierung an der Synapse. Serotonin wird natriumabhängig recycelt. Die Dichte der Transporter-Moleküle auf der Plasmamembran wird durch „STX1A“ und „ITGAV/ITGB3“ reguliert. Antidepressiva wirken, indem sie an „SLC6A4/SERT“ binden und so die Serotonin-Wiederaufnahme reduzieren. Katalyse: „H+(in) + K+(in) + Na+(out) + Serotonin(out) = H+(out) + K+(out) + Na+(in)“ + Serotonin(in). Natrium=11E einerseits und Kalium=19E plus 1 Proton (H+) andererseits liegen in einem zentralen „Weihnachtsbaum“, bei dem Natrium den Stammansatz „0“(Null) umringt, und zwar in der Spalte Z.38355#_[3]“3“1“6“[8]/#_“1“3“[0]“5“1“ als QS1+3_3+1=“8“_Spalte 6/5=QS=11=QS=“2“_“1“ mit Summe 8+2+1=Natrium=11E. Im Gegenlauf zieht Kalium=19E ohne Schleife durch die Zahl „1305{1}“ und zieht dabei die rechte Ziffer {1} [Endziffer von Natrium) als „1“ Proton mit, und zwar in der Spalte Z.38354#_[53]“3“[08]/#_“3“3“1“[68]/#_“1“3“0“5“{1}/[92955] als QS1+3+0+5=9_QS3+3+1_3 (Baumspitze)=10 mit Summe 9+10=19E. Das angehängte Proton verhindert, dass das Kalium seitlich im Vertikal-Stapel „6-fach Ziffer 3“ endet. In der Spalte „1“68“/[05]{„1“} ist das „1“ Proton in der Asparinsäure (Asp)=C4H7NO4 =24+7+7+32=70E als Asp=QS1+68+1=70E integriert. Das „Serotonin“ wird mit seinem Absorptionsmaximum=309nm nachgewiesen. Die Spalte „0/9“ bildet den „Baumstamm“, in dessen Achse auch das Serotonin=94 liegt. Wellenlänge=309nm in der Spalte 30/[2]9 mit 30_9 für 309 nm. „Serotonin“ als Vertikale 9_0_QS1_3=4 mit Summe 90+4=Serotonin=94E. Die „Welle“=64 benötigt in der Zählung eine Strecke. Links Zahl „30“ und rechts Spalte 28/[3]2 mit QS28+2=“30“, folglich muss für Welle=30+2+2+30=Kreis=64 die Zahl „4“ erzeugt werden [Halbwellen 64/2=32 mit halber Zeitbasis 60/2=30], und zwar in der Spalte Z.38356#_{30}“5“1“[0](0){28}/#_[929]“5“(5)(2)(4)[3]{2} mit 5_5+1=11=QS=2_QS5+2+4=11=QS=2 mit Summe 2+2=Weg=4 für Welle=64. Für die Wellenfunktion ist Physik=63 in „ (2)(4)[3]“ als QS2+4=6_3 enthalten. Arzneimittel können über die Zeitbasis „24“ eine Halbwertzeit finden. Außer „Serotonin“ und „Natrium“ binden auch „Chloride“ am Transporter. Die Chlor-Spalte 1/7 für Chlor=17 ist weit entfernt und wird über einen Kunstgriff angeschlossen, und zwar in der Spalte Z.38352#_653“1“/#_69“7“/#_30“8“2“ als 1_7_QS8+2=10 für 0 mit 17+0=Chlor=17. Am Ende des Proteins kann ebenfalls über einen Kunstgriff QS0+0+2_8=10 für „0“ für die Randspalte „7/1“ in der Zählrichtung Chlor=17 gezählt werden. Somit liegt „SLC6A4/ SERT“=630AS in der Spalte Z. 38354#_[5]“3“3“0“[8240]/#_[331]“6“[86681]/#_130“5“1“0“[028], und zwar als QS3+3+0=6_Spalte 6/5=QS=11=QS=2_1 mit 6_Summe 2+1=3_0 als 63_0 für „SLC6A4/ SERT“=630AS [SLC6A4 - Sodium-dependent serotonin transporter - Homo sapiens (Human) | UniProtKB | UniProt]. Das Natrium wird über die Natrium-Kalium-Pumpe bereitgestellt. Das Protein (Mensch) „ATP1A1_ Na+/K+-ATPase_Untereinheit alpha-1“=1023AS liegt in der Randspalte Z.38355#_[686681]/#_[5]“10“0“2“[8]/#_[5524]“3“[2] als 10_QS0+2=2_3 mit 10_23 für „ATP1A1“=1023AS. „ATP“=260E in Spalte 66/00/24 als „2“_QS0+6=“6“_QS6_0_4=10 für „0“ mit 2_6_0 für ATP=260E. ADP=220E als „2“_QS0+0+2=“2“_Randspalte 8/2=QS=10 für „0“ mit 22_0 für ADP=220E [ATP1A1 - Sodium/potassium-transporting ATPase subunit alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. SSRI-Antidepressiva wirken, indem sie an „SLC6A4/SERT“ binden und so die Serotonin-Wiederaufnahme reduzieren. Serotonin-Noradrenalin-Reuptake-Inhibition (SNRI) erzielt eine duale Wirkung. „Venlafaxin"=C17H27NO2=152E wird verstoffwechselt, so dass der aktive Metabolit „O-Desmethylvenlafaxin (ODV)“=C16H25NO2=96+25+7+16=144E zusätzlich mitwirkt. „QDV“ dreht sich hemmend in das „SLC6A4“-Zentrum hinein, und zwar in der Spalte Z.38355#_[33]“1“6“[8]/#_“13“0“5“[1]/#_[9]“29“[55] als „1“_Spalte 5/6=QS=11=QS=2_0_29_13 mit „1“_Summe 2+29+13=44 als 1_44 für „QDV“=144E. Venlafaxin=152E vertikal durch den „94er-Serotonin-Baumstamm“ „9-0-1-3“ als QS9_0_1_3+0=13_Spalte 6/5=2 mit Summe 13+2=15_QS5+5_1=11=QS=2 für „Venlafaxin“=152E. Das Noradrenalin=C8H11NO3=48+11+7+24=90E ist im „Baumstamm“ zusammen mit Serotonin in der Achse enthalten. Das Protein (Mensch) „5-HT2A-Rezeptor“=471AS ist ein stimulierender G-Protein-gekoppelter Rezeptor (GPCR) für „5-Hydroxytryptamin (Serotonin)“. Der Rezeptor stellt eine Disulfidbindung mit Schwefel=16 her, in dem die entfernten Zahlen „61_16“ als Spiegelung in der Spalte mittels Serotonin aus Summe 33+61=Serotonin=94E gekoppelt werden, wobei die seitliche Zahl „16“ dann nach innen gespiegelt werden kann als QS3+3=6_1. „5-HT2A-Rezeptor“ liegt in der Spalte Z.38353#[4873]“4“[69]/#_[4453]“3“[08]/#_[40]“3“3“1“[68]/#_[3]“6“1“[3051]/#_[3]“1“[92955] als „4“_Kunstgriff QS3_3+3+1=10 für „0“ mit QS4+0=“4“_QS6+1=“7“_“1“ mit 47_1 für „5-HT2A-Rezeptor“=471AS [HTR2A - 5-hydroxytryptamine receptor 2A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „PLA2G4C_Phospholipase C“=541AS bindet in der Endziffer „1“ des Rezeptors. Das Merkmal für den Zählweg ist die lesbare optimale Temperatur für die Lysophospholipase Aktivität von 40°C (startet bei 0°C). die Temperatur-Basis 100°C ist lesbar. Bei einer „O-acyltransferase Aktivität“ werden 50°C erreicht. Bei der „O-acyltransferase“ liegt das Histidin=C6H9N3O2=36+9+21+16=82E im aktiven Zentrum, das als Spalte „8/2“ für QS40_8_2=50°C addiert wird [Membrane bound O-acyl transferase, MBOAT (IPR004299) - InterPro entry - InterPro (ebi.ac.uk)]. Von 2 Möglichkeiten wird die Zahl „40“ am rechten Zahlenrand gewählt, in der die einzige Calcium-Spalte „2/0“ für Calcium=20E“ einbindend mit „0“ in der Randspalte Z.38353#_[2]{2}[4]/#_“4“0“7“/#_“6“[81] weiter mit Spalte Z.38356#_“3“6“1“3“0“5“10“0“2“[8]/#_“3“1“[92955]“2“4“3“[2]. „PLA2G4C“ als QS „0“ (aus Calcium) +7 (Randziffer)=“7“_QS4_6_0=“10“_ Spalte 2/3=QS=“5“_QS2+4=“6“_“10“ mit „7“_Summe 10+5+6+10=“31“_QS3+6+1+3_3=“16“ mit Summe 7+31+16=“54“_“1“ für „PLA2G4C_Phospholipase A2“=541AS. Am linken Zahlenrand grenzt Calcium in der Serienspalte QS16+1+1_1+1=20 [PLA2G4C - Cytosolic phospholipase A2 gamma - Homo sapiens (Human) | UniProtKB | UniProt]. „5-HT2A-(Serotonin) – Rezeptor“ stimuliert die Aktivität der Phospholipase C (PLC), die anschließend die Freisetzung von Diacylglycerin (DAG) und Inositoltriphosphat (IP3)=C6H15O15P3=36+15+120+45=216E fördert, die wiederum die Aktivität der Proteinkinase C (PKC) und die Freisetzung von Ca2+ stimulieren“ [5-HT2A receptor - Wikipedia]. Der lange Zählweg für „PLC“ ist geeignet, „IP3“=216E in Z.38356#_[3]“6“13051“002“[8] freizusetzen, und zwar als 2_0_0 für „200“_QS1+3+0+5+1=“10“_“6“ mit Summe 200+10+6=IP3=216E. Das Protein (Mensch) „PRKCA_Proteinkinase C alpha“=672AS findet den Cofaktor „Calcium“=20E als 3-fach verteilt auf 2 Domänen in der Spalte Z.38353#_22[4]/#_40[7]/#68[1] als Calcium-Spalte 2/0 und doppelt als 2*20=40. Die Spalte enthält ATP=260E als „2“_QS2+4=“6“_“0“ mit 26_0 für ATP=260E und ADP=220E als 22_0 für ADP=220E. „PRKCA“ beginnt mit einem spaltenförmigen Calcium-Kunstgriff QS2_0_8 =10 für „0“ und beginnt seitlich mit der Ziffer „6“, um den Cofaktor „DAG“ als Spalte gegenläufig zu durchlaufen.
„1,2-Dioleoyl-rac-glycerol is a substrate for DAG kinases=C39H72O5=234+72+40=346E [1,2-Dioleoyl-rac-glycerol | CAS 2442-61-7 | SCBT - Santa Cruz Biotechnology] Z.38355#_[86]“6“8“[1]/#_[10]“0“[28]/#_[52]“4“3“2“ ab Z.38353 mit QS2_0_8=10 für „0“_6 mit Summe 0+6=“6“_QS0_4_3 =“7“_“2“ mit 6_7_2 für PRKCA=672AS. Spalte „10028/52432“ enthält ATP als „2“_QS0_2+4=“6“_“0“ für ATP=260E; ADP als „2“_QS0+0_2=2_QS8+2=10 für „0“ mit 22_0 für ADP=220E. Serin=56/Theronin=64 liegen im Zählweg. „Sphingosin“=C18H37NO2=108+37+7+16=168E hemmt „PKC“ mit Start im Calcium QS2_4+0=6_QS6_0_4=10 mit Summe 6+10=16_8 für 168E, wobei die Ziffer „8“ die Vertikale verlängert [PRKCA - Protein kinase C alpha type - Homo sapiens (Human) | UniProtKB | UniProt].
Dopamin moduliert wechselseitig das Serontonin-System. „Dopamin“=82E ist in 2 Spalten „8/2“ enthalten. Im Labor wird der intrazelluläre Calcium-Spiegel mittels Fluoreszenz des Farbstoffs „Rhod-2 AM“=C52H59BrN4O19=312+59+35+28+152=586E bei Wellenlängen 557nm und 581nm beobachtet [Aktivierung, Internalisierung und Recycling des Serotonin-2A-Rezeptors durch Dopamin – PMC (www-ncbi-nlm-nih-gov.translate.goog); S. Bhattacharyya (2006), doi: 10.1073/pnas.0606578103]. Die beiden Wellenlängen werden 2 Bereichen zugeordnet. Bereich1: Rhod-2 AM“=586AS in der Randspalte Z.38352#_[31]“1“4“[9]/#_[972]“2“[4]/#_[8]“2“4“0“[7]/#_86681 als QS1+4=“5“_Spalte QS{2_0}Calcium _4_2=“8“_“6“ mit 5_8_6 für „Rhod-2 AM“=586E [Rhod-2 AM | CAS 145037-81-6 | Cayman Chemical | Biomol.de]. „Wellenlänge“=557nm in der Randspalte Z.38352#_“49“/#_“2“4“/#_“0“7“ mit „49“_QS2+4=“6“ mit Summe 49+6=“55“_QS0+7=“7“ für 557nm [Rhod-2 AM | CAS 145037-81-6 | Cayman Chemical | Biomol.de]. Die Welle=64 wird über 2 Halbwellen gezählt, und zwar in der Spalte Z.38352#_“31“1“[49]/#_“9“7“2“[24]/#_“8“2“4“[07] als 1. Halbwelle QS31+1=“32“ und 2. Halbwelle QS9_7_2=“18“_QS8_2_4=“14“ mit Summe 18+14=“32“ mit Welle=32+32=Kreis=64. Bereich2: Rhod-2 AM“=586AS in der Randspalte Z.38356#_“1“[0]“0“2“[8]/#_“5“2“4“3“2“ als QS3+2=“5“_QS{2_0} Calcium_2+4=“8“_QS5_1=“6“ mit 5_8_6 für „Rhod-2 AM“=586E [Rhod-2 AM | C52H59BrN4O19 | CID-25229581 - PubChem (nih.gov)]. „Wellenlänge“=581nm in der Randspalte Z.38355#_{6}“81“/#_{0}“2“[8]/#_{4}“3“[2] absteigend mit QS3+2=5_81 für 581nm. Die Welle=64 {} liegt seitlich als „6“_QS0_4="4" mit 6_4 für Kreis=64._dat05.11.2023
Rückenmark:
Ende lfd.Nr.33: Epi.Ref_Rhesus.Z.“810“9#“160“86664“7477“3“58.
tRNA-Gen lfd.Nr.34: Aminosäure „Leucin–Variante-2“: „Leucin“= C6H13NO2=36+13+7+16=72E. Form als L-Leucin - das spiegelbildliche D-Leucin kommt in Proteinen nicht vor [Leucin – Wikipedia]. Leucin–Variante-3“ ist ein Funktionspartner. Zeilen-Nrn. und Code enthalten die Zählgröße „11“. Die Zeilen-Nrn. enthalten 5-fach die Ziffer „1“ und der Code beginnt mit der Spalte 1-1, so dass sich im Ring die Ziffer „7“ für Leucin=72E bildet. Die Ziffer „2“ entsteht für jede Zeile aus der Zählgröße 11 als QS1+1=“2“. Zu „Leucin–Variante-1 (tRNA-Gen lfd.Nr.22) besteht keine Verbindung. Die Ringzählung für 72E verbindet beide Zeilen. Der Spaltensummen-Winkel (Soll=180°) ergibt 10° aus der Zeilen-Nr.81“10“ und im Code [60+80+60=] „200“, so dass ein Überschuss von 30° besteht. Als Äquivalent können Wasser=10 für die hydrophobe Eigenschaft von Leucin und Calcium=20 als Restgröße angenommen werden. Calcium kann über einen Calcium-Kanal passieren, der sich über die Spalte 81188/8118 mit 2*(QS1+1+8=10)=20=Calcium zieht. Für Wasser=28 liegt eine Spalte 8-2 vor. Das Protein „Calcyclin-Ca^2+ bindendes Protein“=228AS kann diesen Bereich darstellen [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Aufgrund der Zeitdifferenz DELTA.TIME.Epi.Ref_Rhesus.Z.8110-Z.8111=“#Kalium=19_Extra=8_Zink=30_Calcium=QS7+00+5+1+6+1=20“ ist auch Zink=30 von Interesse. Zink kann über die Spalte „8-8“ durch die Schwerachse „84“ als 2x [QS 1+6+0+8=]15=30=Zink den linken Zahlenrand beider Zeilen darstellen. Für die Funktion des Proteins „tRNA-Leucin-Ligase“ ist keine Metallionenbindung vorgesehen. Aber alle Zahlen müssen letztlich mit Proteinen besetzt werden. Für die Zeilenverbindung ist das Zinkfingerprotein=1689AS geeignet [Zinc finger protein - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt]. Die Spalte „8-8“erzeugt die Zahl QS8+8=16. In der Zeile Z.8111 schließen sich QS2+6=8 _9 f0r 1689AS an. Kalium grenzt sich in Z.8111 als „9811“=QS9+8+1+1=“19=Kalium ab. In Z.8110 liegt darüber QS8+1+1+8=18, so dass in der Spalte 8-1 die Ziffer „1“ für einen Kalium-Kanal addiert wird. Kalium-Kanal- Proteine PfK1=1966 AS und PfK2=1653AS [Kaliumkanal K1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt; Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. PfK1=1966 bildet aus „6811“ die Ziffernfolge 1_QS1+8=9_6, so dass in der Spalte 6-6 die Ziffer 6 folgt für 1966AS. AS PfK2=1653AS zählt die Spalte 8-8 als QS8+8=16. Der Token-68 wird von „4[68]1“ umschlossen (verzehrte Mahlzeit) als QS 4+1=5 genutzt, aus der Spalte 1-11 ergibt sich die Ziffer 3 für 1653AS. Enzym „Leucin-tRNA-Ligase“=1481AS [Leucin--tRNA-Ligase - Plasmodium falciparum IGH-CR14 | Externe Links | UniProtKB | UniProt]. Die Leucin-Enzyme enthalten die Zahl „14xx“, die zwischen Schwerachse 84 und Zählgröße 11 unsichtbar ist. Der Token-68 ergibt QS6+8=14 in 84“68“11. Beim Parasiten ist der Token-68 umgekehrt zur Mücke eine Richtung für die Nahrungsaufnahme. Die Zählgröße „11“ wird übersprungen und die Zahl 81 über die Spalte 8-1 zur Zeilenverbindung angeschlossen für 1481AS. Das Enzym „Leucin-tRNA-Enzyme[A0A024WUV6 · A0A024WUV6_PLAFA]“=1450AS ist eine Modifikation, die kein gesondertes Gen erfordert, weil die Zahl „50“ in den beiden Zeilennummern mittels der Ziffer „0“ und 5-fach Ziffer „1“ als „5“ gezählt wird [leucine--tRNA ligase - Plasmodium falciparum MaliPS096_E11 | UniProtKB | UniProt]. Das bei der ATP-Bindung entstehende Adenosinmonophosphat (AMP)=C10H14N5O7P=167E schließt den Informationsgehalt zwischen beide Zeilenränder als „16 [ ] 7“ ein: Epi.Ref_Rhesus.Z.8110#160846811885807.
tRNA-Gen lfd.Nr.35: Aminosäure „Leucin–Variante-3“: „Leucin“= C6H13NO2=72E. [Leucin – Wikipedia]. Leucin–Variante-2“ ist ein Funktionspartner. Die Zeilen-Nrn. Z.8“11“0/Z.8“111“ enthalten 5-fach die Ziffer „1“ und der Code beginnt mit der Spalte 1-1, so dass sich im Ring die Ziffer „7“ für Lysin=72E bildet. Die Ziffer „2“ entsteht für jede Zeile aus der Zählgröße 11 als QS1+1=“2“. Enzym „Leucin-tRNA-Ligase (A0A024VRC1 · A0A024VRC1)“=1480AS [Leucin-tRNA-Ligase - Plasmodium falciparum FCH/4 | UniProtKB | UniProt]. Der Zahlenteil „14“ wird in der Vorzeile aus dem Token-68=QS6+8=14 gebildet. Die Zahl „68“ liegt in der Zeile vor als „6_O_8“ und ergibt QS6+0+8=14, Darüber werden in der Vorzeile „8 – 0“ angefügt für 1480AS. Das bei der ATP-Bindung entstehende AMP-Info=“16[ ]7“ ist mangels Ziffer 7 nicht sichtbar. Die Information ist die Differenz beider Möglichkeiten am rechten Zahlenrand „91“=QS9+1=10=Wasser für den „hydrophoben“ Überschuss. Die Differenz entsteht, wenn die Zahl=7 am Rand der Vorzeile gelesen wird oder in der Zeile als QS 5+2=7 zuvor begrenzt wird. Die Ziffer „2“ gehört zur Spalte „8-2“, so dass Wasser (H2O)=28 im Randbereich vorliegt: Epi.Ref_Rhesus.Z.8111#160826981185291.
tRNA-Gen lfd.Nr.36: Guanosin=C10H13N5O5=60+13+35+40=148E liegt in seiner Kern-Zeile Z.8112 aufsteigend in der Randspalte 4001/5012[9] als „1“_QS4+0+0=“4“_QS5+0+1+2=“8“ für 148E [ Guanosin – Wikipedia]. Guanosin gehört nicht zu den Aminosäuren, die durch eine Transfer-RNA transportiert werden, sondern dient als Baustein zur Bildung der RNA. Guanosin ist ein Nukleosid und besteht aus der Nukleinbase „Guanin“ und dem Zucker „β-D-Ribose“. Als Bestandteil der DNA wird der Zucker Ribose durch Desoxyribose ersetzt. „Guanosin“ ist ist Bestandteil der Ribonukleinsäure (RNA) und bildet dort mit Cytidin=C9H13N3O5=54+13+21+40=128E ein Basenpaar. Nukleoside enthalten im Gegensatz zu den Nukleotiden, welche die Nukleinsäuren (DNA oder RNA) aufbauen, keine Phosphatreste. Das Cyditin liegt als Spalte „8[07]/2/0/1“ vor, die die Zeile von Guanosin lotrecht kreuzt und absteigend als „1“_QS0+2=“2“_“8“ für 128E gezählt wird. Guanin=C5H5N5O=30+5+35+8=78E und Ribose=C5H10O5=30+10+40=80E liegen in der Randspalte von Cytidin für die Ziffer „8“ als „807“. Desoxyribose=C5H10O4=30+10+32=72E bildet die Randspalte 7/1/1 mit „7“_QS1+1=“2“ für 72E. Die Transfer-RNA besteht aus kurzen RNA-Strängen aus 73-95 Nukleiotiden, die ein schleifenförmiges Muster bilden, das funktionell zur Proteinbiosyntese beiträgt [tRNA – Wikipedia]. Wissenschaftlich ist beispielsweise der Einbau von Guanosin an der Schleifenposition „37“ von Interesse, so dass dieses Guanosin als Guanosin-37 bezeichnet wird. Es liegt momentan aber keine Information darüber vor, ob sich die Summenformel für Guanosin speziell verändern könnte. Die Enzym-Varianten „781AS, 323AS, 293AS, 904AS“ beruhen auf unterschiedlichen Modifikationen von Guanosin. Die Bindung von Guanosin-37 an die Positionen „37“ wird durch spezielle Proteine katalysiert. Möglicherweise enthält Guanosin-37 Silicium mit der Summenformel: Guanosin-37=C22H39N5O6Si2=132+39+35+48+28=282E [CAS 69304-44-5 3',5'-O-(1,1,3,3-Tetraisopropyl-1,3-disiloxandiyl)Guanosin - Alfa Chemistry (alfa-chemistry.com)]. Das Silciium=14 ist am rechten Zahlenrand gespiegelt als (37)“4“_[00]“1“ lesbar, und die Postition „37“ ist zufällig direkt adressiert. Das mutmaßliche Guanosin-37=282E beginnt in Z.8111 aufstiegend in der Spalte 2/[4]0[01]/5012/[84]11 als „2“_QS0_5+0+1+2=8_QS1+1=2 für 282AS. Darin ist die Kombination der Schwerachse=84 mit der Zählgröße=11 eine Kontrolleinrichtung zur Bindung passender Proteine an der tRNA-Schleife.
Die weiteren beiden RNA-Bausteine, „Adenosin“=C10H13N5O4=60+13+35+32=140E und „Uridin“=C9H12N2O6=54+12+14+48=128E, liegen an gleicher Stelle. Weil „Uridin“ und „Cytidin“ mit 128E in den unterschiedlichen Basenpaaren übereinstimmen, ist eine Unterscheidung notwendig. In der Randspalte 4001/0129/[841186]8 wird „Adenosin“ aufsteigend als 1_QS0+0+4=4_0 für 140E gezählt. Alternativ entsteht „Adenosin“ in der Randspalte „1/9/[118]68“ mit QS1+9=10 für die Ziffer „0“ und QS6+8=“14“ für 140E. Weil dadurch die Ziffer „6“ funktionell gebunden wird, ist wegen der Zählgröße 11 ein Spaltenversatz zulässig, um in der Spalte „12“[9]/[11]“8“[6] aus „12_8“ „Uridin“=128E zu bilden. Diese Abhängigkeit erzeugt ein Basenpaar.
Außer den 4 Grundbausteinen enthält die tRNA unterschiedlich modifizierte Standardbasen [Dihydrouridin (D), Inosin (I), 2-Thiouridin (s2U), 4-Thiouridin (s4U), Pseudouridin (Ψ), N4-Acetylcytidin (ac4C) und 5-Methyl-Uridin (Thymidin) (T) [tRNA – Wikipedia]. In der Transfer-RNA wird 1 Schleife als Dihydrouracil-Arm bezeichnet. Das Nukleosid „Dihydrouridin (D)“=C9H14N2O6=54+14+14+48=130E ist aufgrund seines Ringes mit dem BiXnom-Kreis=64 in Z.8114 über die Spalte „1“55/3“3“4/5“1“8 absteigend als 1_3_QS5+5=10 für Ziffer „0“ in 130E zählbar, worin die Ziffer „3“ in „334“ den Kreis=64 als QS3+3=“6“_“4“ bildet. Das Nukleosid „Inosin (I)“ =C10H12N4O5=60+12+28+40=140E wird an derselben Position in der Spalte „1553/3344“ gebildet, und muss sich vom Adenosin=140E unterscheiden [Inosin – Wikipedia]. „Inosin“ enthält Hypoxanthin=C5H4N4O=30+4+28+8=70E aus der Spalte „[071]553/4“ als QS4+3=7_QS5+5=10 für Ziffer „0“ mit 70E und den Zucker „beta-D-Ribofuranose= C5H10O5=30+10+40=80E [beta-D-Ribofuranose | C5H10O5 | CID 447347 - PubChem (nih.gov)] , der sich gespiegelt und benachbart aus „0“_QS7+1=“8“ für 80E ergibt. In dieser gefüllten Matrix nimmt „Inosin“ die überschüssige Ziffer „1“ aus 5+5=10 auf und bildet aus der Spalte „1/3“ die Ziffer „4“ aus QS1+3=4, dann folgt QS3+4_aufsteigend im Ring zur Ziffer „0“ (aus 5+5=10), so dass rechts mit der Ziffer „3“ die Summe 3+4+3=10 als Ziffer „0“ für 140E entsteht. Das Nukleosid „2-Thiouridin (s2U)“=C9H12N2O5S=54+12+14+40+16=136E enthält den Schwefel=16 als Serie #16, so dass sich das Nukleotid über die Z.Nr.[8]112#16[0_Sauerstoff=807=Form] als „1“_QS1+2=3_QS6+“0“=6 für 136E zählt. Die Ziffer „0“ wird mitgezählt, weil der Austausch von Sauerstoff=8 gegen Schwefel=16 eine Positionsangabe erfordert. Das Nukleosid „4-Thiouridin (s4U) = C9H12N2O5S=54+12+14+40+16=136E kann über die Spalte „0/0“ zur Z.8113#16“0“7“8“7 springen, um eine andere Sauerstoff-Position als Form=7_“8“_7 zum Austausch anzuzeigen.
Das Nukleosid „Pseudouridin (Ψ=Psi)“= C9H12N2O6=54+12+14+48=128E besteht aus β-D-Ribose (Zucker)=80E und der Nukleinbase „Uracil“=C4H4N2O2=24+4+14+16=58. Das Uracil wäre zwar gespiegelt direkt in der Z.Nr.Z.8113 lesbar als QS3+1+1=5_8 für 58E, ist aber von der Ribose=80 zu weit entfernt. Das Uracil ist in Z.8112 mit der Ribose [80]715 kombiniert und gespiegelt als QS7+1=8_5 für 58E lesbar. Der die Ribose=80E ist zusätzlich in der Spalte „0/8“ nochmals enthalten. Folglich setzt sich das Pseudouridin=128E in der Spalte „1608/1607“ aus 6+6=“12“_QS0+0+8=“8“ für 128E zusammen, wobei die Randspalte „1/1“ als Zählgröße „11“ dient. Das Nukleosid „N4-Acetylcytidin“=C11H15N3O6=66+15+21+48=150E ist ein Derivat von Cytidin, bei dem einer der exocyclischen Aminowasserstoffe durch eine Acetylgruppe substituiert ist. Das Nukleosid füllt die noch freie Spalte „807/787“ absteigend als QS7+8=“15“_“0“ für 150E. Das Nukleosid „5-Methyl-Uridin (Thymidin) (T)“=C10H14N2O6=60+14+14+48=136E zieht mit der Code-Randziffer „1“ aus Zeile Z.8113 absteigend zur Vorzeile Z.Nr.Z.8112 als „1“_“3“ QS1+1_1+1+2=6 für 136E. Beide Zeilen werden somit komplett für alle Bausteine der Transfer-RNA verarbeitet. Das ist möglich, weil der BiXnom das Periodensystem der Elemente (PSE) erzeugt, und somit zählen kann.
Die Bausteine für DNA und RNA teilen sich gemeinsam 2 Zeilen. Die genetischen Informationen werden von der DNA in eine RNA (rRNA, tRNA, mRNA) umgeschrieben (Transkription). Die Boten-RNA (mRNA=messenger RNA) stellt mit der Abfolge von Nukleinbasen die Bauanleitung für ein Protein dar. Die DNA-Stränge bestehen aus 4 Grundbausteinen. Diese Nucleotide bestehen aus einem Phosphatrest, dem Zucker „Desoxyribose“ und jeweils einer von 4 Nukleinbasen [Adenin (A), Thymin (T), Guanin (G) und Cytosin (C)].
Das Nukleosid von Guanin ist das Desoxyguanosin in der DNA und das Guanosin in der RNA. „Desoxyguanosin“=C10H13N5O4=60+13+35+32=140E ist ein Nukleosid und besteht aus der Nukleinbase „Guanin“=C5H5N5O=30+5+35+8=78E und dem Zucker „β-D-Desoxyribose“= C5H10O4=30+10+32=72E [Desoxyribose – Wikipedia]. Die Z.Nr.Z.8“11“2“ enthält die Zählgröße 11, um den Zucker=72E gespiegelt mit der Ziffer „2“ und im Code #16[0807] als „2“_QS1+6=7 für 72E zu bilden. Guanin=78E liegt in der Spalte „807/787“ gespiegelt als „8“_QS0+7=7 für 78E, und ist nochmals in der Spalte „7“_QS0_8=“8“ für 78E enthalten. Folglich liegt „Desoxyguanosin“=140E in der Spalte „07/87“ als QS7+7=“14“_“0“ für 140E. „Guanin“ bildet in der Watson-Crick-Basenpaarung 3 Wasserstoffbrücken mit „Cytosin“. Die 3 Wasserstoffbrücken zeigen sich als 3 Spalten „1/1“ für die Zählgröße „11“. Das Nukleosid von „Cytosin“ ist das „Desoxycytidin“ in der DNA und das „Cytidin“ in der RNA. In der Watson-Crick-Basenpaarung bildet es drei Wasserstoffbrücken mit Guanin. „Desoxycytidin“=C9H13N3O4=54+13+21+32=120E ist ein Nukleosid und besteht aus der Nukleinbase „Cytosin“=C4H5N3O=24+5+21+8=58E und dem Zucker „β-D-Desoxyribose“=72E. Die β-D-Desoxyribose“ ist unverändert in Z.Nr.Z.8“11“2“#“16“ als „2“_QS1+6=“7“ für 72E enthalten. Cytosin=58E liegt in der Spalte 553[7]/3[4450] als „5“_QS5+3=“8“ für 58E, und kann nochmals in der Spalte als „5“_QS5_3=8 für 58E gebildet werden. Folglich bildet sich „Desoxycytidin“=120E benachbart in der Spalte „7/50“ aus QS7+5=“12“_“0“ für 120E. Das Desoxyadenosin in der DNA und das Adenosin in der RNA sind Nukleoside, die Adenin enthalten. Mit Thymin bzw. Uracil bildet es in der Watson-Crick-Basenpaarung zwei Wasserstoffbrücken. Desoxyadenosin=C10H13N5O3=60+13+35+24=132E ist ein Nukleosid und besteht aus der Nukleinbase Adenin=C5H5N5=30+5+35=70E und dem Zucker „Desoxyribose“=C5H10O4=30+10+32=72E. Die β-D-Desoxyribose“ ist unverändert in Z.Nr.Z.8“11“2“#“16“ als „2“_QS1+6=“7“ für 72E enthalten. Adenin=70E liegt in der Randspalte [16]0[8]/1607 und kann in Z.8113 als QS1+6=“7“_“0“ für 70E gezählt werden oder alternativ als „7“_QS 0+0=“0“ für 70E zur Vorzeile absteigen. Folglich beginnt Desoxyadenosin=132E in der Z.Nr.Z.81“13“ und zählt im Code die Randspalte als „13“_QS1+1=“2“ für 132E. Thymin (T) = 5-Methyluracil gehört zu den 4 Nukleinbasen der DNA. In der RNA steht an seiner Stelle Uracil. Die Nukleoside von „Thymin“ sind das Desoxythymidin in der DNA und das Ribothymidin in der RNA. In der Watson-Crick-Basenpaarung bildet es zwei Wasserstoffbrücken mit Adenin. Das Nukleosid „Desoxythymidin“=C10H14N2O5=60+14+14+40=128E besteht aus der Nukleinbase „Thymin“=C5H6N2O2=30+6+14+16=66E und dem Zucker „D-Desoxyribose“=72E. Thymin=66E besetzt die Spalte #[1]6/#[1]6 als „6_6“ für 66E. Weil die Ziffer „6“ bisher zum Zucker gehörte, muss der Zucker die Ziffer „6“ in „2“_QS1+6=“7“ für 72E alternativ im Rücklauf zur Z.Nrn.-Matrix Z.8113 finden [Z.8_]QS1+1+3=“5“#“1“[60]=“6“ als Ersatz. Folglich liegt Desoxythymidin“=128E in der Spalte „608/60[7]“ als QS6+6=“12“_QS“0_0+8=8“ für 128E.
Proteine: Protein „tRNA (Guanin(37)-N1)-Methyltransferase“=781AS: „Das Protein methyliert spezifisch die N1-Position von Guanosin-37 in verschiedenen zytoplasmatischen und mitochondrialen tRNAs. Die Methylierung ist nicht abhängig von der Art des Nukleosids 5' des Zielnukleosids. Dies ist der erste Schritt in der Biosynthese von Wybutosin (yW), einer modifizierten Base, die an das Anticodon von tRNAs angrenzt und für eine genaue Entschlüsselung erforderlich ist.“; [tRNA (guanine(37)-N1)-methyltransferase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Eine Methylierung ist der Transfer von Methylgruppen (–CH3=6+3=9) innerhalb einer Reaktion von einem Molekül auf ein anderes (Donator-Akzeptor-Prinzip). Die Biosynthese von Wybutosin= C21H28N6O9=6*21+28+7*6+8*9=126+28+42+72=268E erfolgt in der Vorzeile als „26[9]8“, wobei der Einschluss der Ziffer „9“ die Methylierung (–CH3=6+3=9) darstellt. . Reaktion: „Guanosin37 in tRNA + S-Adenosyl-L-Methionin = H + N+1-Methylguanosin37 in tRNA + S-Adenosyl-L-Homocystein.“ S-Adenosylmethionin (SAM)=C15H22N6O5S=6*15+22+7*6+8*5+16=90+22+42+40+16=210E. Für die Reaktion wird SAM=210E als Summe über 2 Zeilen gebildet. Der 1. Spaltenanteil mit „6028“ ergibt als 60+[QS2+8=]10= Summe 70. Die Folgezeile liefert mit „6080“ den 2. Spaltenanteil „60+80“=140. Insgesamt=70+140=210E. Das angrenzende Anticodon zur Entschlüsselung liegt als Zähleinheit „111“ in der Zeilennummer: Epi.Ref_Rhesus.Z.8“111“#1“608“2698“1185291 und Epi.Ref_Rhesus.Z.“8“11“2“#16080“7“1553“7“4001“.
Das Enzym „Glucose-6-phosphat-Dehydrogenase (G6PD)“ wird beim Menschen zur Stabilisierung der Erythrozyten-Zellmembran benötigt. Ein G6PD-Mangel führt aufgrund eines geringen Hämoglobin-Gehalts im Blut zur „Anämie“. Das Enzym ist als kurze Isoform in Erythrozyten und der Leber vorhanden. G6PD (Mensch)=515AS [G6PD - Glucose-6-phosphate 1-dehydrogenase - Homo sapiens (Human) | UniProtKB | UniProt]. Der Parasit wird durch das Malariamedikament „Primaquin (Primaquinphosphat)“=C15H21N3O=90+21+21+8=140E geschädigt, weil vermutlich die G6PD-Eigenproduktion des Parasiten von G6PD (P.falciparum)=736AS verhindert wird [PFG6PD - Glucose-6-phosphat-Dehydrogenase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Primaquin wird gespiegelt als „1_QS0+0+4=4_QS 3+7=10“, davon mit der Ziffer „0“, als „Primaquin=140E aufgenommen. Weil die Zahl „37“ dadurch verwendet wird, kann das Enzym(Parasit)=736AS gespiegelt als „73“_über Spalte 1-5 zur Vorzeile mit QS5+1=6 für Enzym=736AS nicht hergestellt werden. Gleichzeitig wird aber auch G6PD(Mensch)=515AS verhindert. Die Zahl „51“ liegt zwar unbedenklich in der Folgezeile, aber die 2. Ziffer 5 wird aufsteigend aus QS4+0+0+1=5 addiert. Diese Addition wird von Primaquin=140E verhindert. Das Medikament Acetylsalicylsäure (ASS) /Aspirin= C9H8O4=54+8+32=94 wirkt ähnlich ungünstig, weil es am rechten Zahlenrand der Folgezeile beginnt als 9_QS 1+2=3 mit Aufstieg über die Spalte, um am rechten Zahlenrand die Ziffer „1“ zu addieren als 9_ QS1+2 +1 aus Spalte=4 für ASS=94E.
Bei der Hemmung von Enzym „Glucose-6-phosphat-Dehydrogenase-Mangel (G6PD)“ kann auch das Co-Enzym „Nicotinamid-Adenin-Dinucleotid-Phosphat (NADP)=C21H29N7O17P3=126+29+49+136+45=385E nicht produziert werden. NADP binden und übertragen Elektronen und Wasserstoff. Die protonierte bzw. reduzierte Form wird als NADPH bezeichnet [NADP - DocCheck Flexikon]. Es lagern sich 2 NADP-Moleküle an, so dass die Ziffer 3 startet, in der Folgezeile QS4+4=8 addiert und über die Spalte 5_4 zurück die Ziffer 5 für NADP=385E verwendet. Das 2. Moleküle liegt in der Folgezeile ergibt NADP=3_QS4+4=8_5E. Der Parasit findet seine beiden NADP-Moleküle bereits ab Z.8“11“0, indem die Ziffer „3“ über die Ziffer „1“ und die Spalte herab zur Zählgröße „11“ als QS1+1+1=3 gezählt und die Zahl „85“ angelagert wird für NADP=385E. Das 2. NADP-Molekül summiert im Code die Zählgröße „11“ in Z.8110 und ergänzt die Ziffer „1“ über Spalte 1-1 als QS1+1+1=3. Weiter lotrecht in der Spalte 1-1-5 wird nach rechts QS5+3=8 addiert und links die Ziffer 5 angelagert für NADP=385E. „Das NADPH/H+ ist nötig, da die Erythrozyten durch die Sauerstoffaufnahme und ihren Stoffwechsel ständig unter oxidativem Stress stehen. Sie schützen ihre Zellmembran daher durch membranständiges Glutathion, das durch den Sauerstoff oxidiert wird. Um dieses jedoch kontinuierlich zu reduzieren, benötigt die Zelle NADPH/H+ als Reduktionsäquivalent. Ist die Regulation des Pentosephosphat-Zyklus gestört, kann die Zelle bei hohem oxidativen Stress, wie z.B. einem Infekt, nicht ausreichend NADPH/H+ zur Verfügung stellen, wodurch die Zellmembran beschädigt wird.“ [Glucose-6-phosphat-Dehydrogenase - DocCheck Flexikon].
Ungünstig wirkt, dass der Parasit zum Abbau von Häm das Tripeptid „Glutathion“= C10H17N3O6S=60+17+21+48+16=162E in einer Konkurrenzsituation selbst herstellen muss. Das Molekül „Glutathion=162E“ wird über 4 Zeilen-Nrn. gezählt: Ziffer „1“ aus Z.8“1“09. Die folgenden 3 Zeilen enthalten die Zählgröße „11“, so dass sich QS 1+1+1+1+1+1=“6“ ergibt und die Ziffer „2“in Z. 8“11“2“ angelagert wird als Glutathion=162E. Nachfolgend handelt es sich um die entsprechende Enzyme=…AS. Das Enzym „Glutathion-Synthetase=Glutathion (Parasit)“=655AS liegt mit der Zahl „55“ in der Zeile vor. Die Zahl „6“ entsteht in der Folgezeile mit einem Bezug zur Membran=33 als QS3+3=“6“[Glutathione synthetase - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Der Parasit raubt dem Menschen das schützende Glutathion, weil die Ziffer „33“ als membranständig „33“ nur als Gruppe „33_44“ in der Folgezeile anlagert wird. Weil Glutathion-Synthetase (Mensch)=405AS nur als Ziffernfolge „450“ in der Folgezeile vorliegt, wird das anliegende „Magnesium=12E_9=seitlich“ am Zahlenrand als Cofaktor Mg^+ in „334_“450“_“12“9“ benötigt [Glutathione synthetase - Homo sapiens (Human) | UniProtKB | UniProt].
Das Malariamedikament „Tafenoquin“ ist eine Weiterentwicklung von „Primaquin“. Tafenoquin=C24H28F3N3O3=144+28+27+21+24=244E. In der Folgezeile trifft die Ziffer „2“ den Cofaktor Magnesium=12. Die Zahl „44“ ist links weit entfernt, so dass eine Brücke mit „Succinat“= C4H6O4=24+6+32=62E als 33“44“[501]“2“9 genutzt wird [Tafenoquin – Wikipedia].
Dieser schädliche Effekt ist nicht geplant, sondern der Parasit soll offensichtlich pauschal über 4 Zeilen Z.8110-8113 blockiert werden. Das ist riskant, weil Z.8110 am Zahlenrand mit der Ziffer „7“ auf das Nervensystem einwirken könnte als „16084681188580“7“. Nebenwirkungen: „Schwere intravaskuläre Hämolyse bei Patienten mit G6PD-Mangel, psychiatrischen Reaktionen, Methämoglobinämie, gastrointestinalen Störungen, Überempfindlichkeitsreaktionen“[Table: Nebenwirkungen und Kontraindikationen der Medikamente gegen Malaria - MSD Manual Profi-Ausgabe (msdmanuals.com)]. Tafenoquin=244E liest die Ziffer „2“ in Z.8110 in „8_QS1+1=2_8“. Die Gruppe=44 bildet sich, in dem QS11+11+11+11=44 aus den Zählgrößen „11“ in den Zeilen-Nrn. Zeilen Z. 8110, Z.8111, Z.8112 und Z.8113 addiert werden. „Succinat“=62E wird zur Bestätigung benötigt, indem aufsteigend aus QS“1+1“+“1+1“+“1+1“=“6“ gezählt und aus Z.8“11“0 die Ziffer QS1+1=“2“ angelagert wird als „Succinat“=62E. Das Medikament ist gegen „Plasmodium falciparum“ noch nicht zugelassen.
Das Malariamedikament „Mefloquin“=C17H16F6N2O=102+16+54+14+8=194E enthält einen hexagonalen Doppelring mit jeweils 1 Bindung an „CF3“=6+(9*3)=33E. Das Medikament blockiert, vermutlich die Vakuolen-Membran=33, so dass der Parasit verhungert. Die Zahl „33“ wird aus der Addition der Zahlgrößen QS 11+11+11 aus den Zeilen-Nrn. Z.8“11“0, Z.8“11“1 und 8“11“2 gewonnen. Für den 2. Ring wird die Zahl „33“ aus den Zählgrößen „11“ im Code summiert. In Zeile Z.8112 wird 3. Zählgröße aus QS7+“4“=“11“ gebildet. Die Ziffer „4“ ist in Mefloquin=194E enthalten. Die Zahl „19“ zählt sich gespiegelt als „91“ vom Zahlenrand Z.8111 über die Spalte herunter, wobei mit „OO“ der Mefloquin-Doppelring durchlaufen wird. In Zeile Z.8110 wird das Gleichgewichtsystem des Menschen mit 6_84=Schwerachse_6 und Nerv=7 am Zahlenrand beeinträchtigt. In Zeile Z.8112 wird die Energieversorgung über das ATP-Enzym=551AS als „155“ im Zeilenbereich blockiert, wovon andererseits der Muskel=55 des Menschen aus dem Rhythmus geraten kann.. Das Medikament wird bei Resistenzen gegen die Medikamente wie Chloroquin, Proguanil, Pyrimethamin sowie Pyrimethamin-Sulfonamid-Kombinationen verwendet.
Mensch: Guanosin=C10H13N5O5=60+13+35+40=148E bildet in lfd.Nr.36 (Z.8112) eine Kern-Zeile, die mit der Folgezeile alle Bausteine zur Bildung von DNA und RNA erzeugt. Weiterhin werden Proteine als Methyltransferasen gebildet, um unterschiedliche Positionen in der tRNA als Bindungsstelle zu katalysieren:
Protein (Mensch) „tRNA (Guanin(37)-N1)-Methyltransferase (TRMT5)“=509AS [TRMT5 - tRNA (Guanin(37)-N1)-Methyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die tRNA-Kette ist schleifenförmig geformt, so dass sich mit dem Anticodon ein Bereich mit den 3 drei Nukleotiden einer tRNA bildet, die jeweils als Gegenstück mit dem Codon einer mRNA korrespondieren. Die Positionen der tRNA sind nummeriert. Für den Einbau von Guanosin an Position 37 ist eine Methyltransferase erforderlich, die die Übertragung einer Methylgruppe von einem Donator A zu einem Akzeptor B katalysiert: „Guanosin-37 in tRNA + S-Adenosyl-L-methionin = H + N+1-Methylguanosin-37 in tRNA + S-Adenosyl-L-Homocystein“. Funktion: Methyliert spezifisch die N1-Position von Guanosin-37 in verschiedenen tRNAs. Dies ist der erste Schritt in der Biosynthese von Wybutosin (yW), einer modifizierten Base, die an das Anticodon von tRNAs angrenzt und für eine genaue Entschlüsselung erforderlich ist. In der Randspalte (Z.8111 bis Z.8113) „1/001/129“ ist „S-Adenosyl-L-homocystein“=C14H20N6O5S=84+20+42+40+16=202E als QS1_1=2_0_2 für 202E enthalten [S-Adenosyl-L-homocystein – Wikipedia]. Die Spalte enthält außerdem „1-Methylguanosin“= C11H15N5O5=66+15+40=121E als „1“_QS0_2=“2“_“1 für 121E [1-Methylguanosin – Wikipedia] sowie „S-Adenosylmethionin“=C15H22N6O5S=90+22+42+40+16=210E als „21_0“ für 210E [S-Adenosylmethionin – Wikipedia]. Das Protein „TRMT5“=509AS vermeidet die Kernzeile und beginnt erst in Z.8112 in der Spalte 50[129]/[841]18 aufsteigend als „50“_QS1+8=“9“ für 509AS. Die Struktur von Guanosin-37 ist hier momentan nicht bekannt, geeignet ist das normale Guanosin=148E, das gespiegelt als „841“ direkt anliegt. Wybutosin (yW)=C21H28N6O9=126+28+42+72=268E liegt neben dem Protein in der Randspalte „29/68“ als „2_68“ für 268E [Wybutosin – Wikipedia].
Protein (Mensch) „tRNA (Guanin(37)-N1)-Methyltransferase (H_YH95C04.1)“=138AS [H_YH95C04.1 - tRNA (Guanin-N(1)-)-Methyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein beginnt bereits in der Kernzeile Z.8112 in der Randspalte 00“1“/“12“[90]/“8“[68] als „1“_QS1+2=“3“_“8“ für 138AS, so dass es kein Wybutosin=268E erzeugen kann, weil die Ziffer „8“ benutzt wird. Die Position „37“ wird zufällig in der Kernzeile als „37“4001 angezeigt.
Protein (Mensch) „tRNA (guanine(26)-N(2))-dimethyltransferase (TRMT1)“=659AS [TRMT1 - tRNA (guanine(26)-N(2))-dimethyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Dimethyliert einen einzelnen Guaninrest an Position 26 unter Verwendung von S-Adenosyl-L-Methionin als Donor der Methylgruppe: „Guanosin-26 in tRNA + 2 S-Adenosyl-L-methionin = 2 H + N+2-Dimethylguanosin26 in tRNA + 2 S-Adenosyl-L-Homocystein“. N2-Dimethylguanosin=C12H17N5O5=72+17+35+40=164E zieht von Z.8115 absteigend in der Randspalte [400]1/12[9]/6[8]/1[2] zur Kern-Zeile Z.8112 als „1“_“6“_QS1+2_1=“4“ für 164AS [N2,N2-Dimethylguanosin – Wikipedia]. Die Ziffer 4 steht zur Verfügung um die Dopplungen 2 [S-Adenosyl-L-methionin]=2*210E=420E und 2 [S-Adenosyl-L-Homocystein]=2*202E=404E zu erzeugen. Das Protein „TRMT1“=659AS liegt folglich in der Spalte “4001“/“501“2“9 als QS5+0+1=6_QS4+0+0+1=5_9 für 659E. Hierbei wird die Ziffer „2“ umkreist, die als Spalte „2/6“ zufällig die Position „26“ anzeigt.
Protein (Mensch) „tRNA (guanine(10)-N(2))-methyltransferase (TRMT11)“=463AS. Funktion: „Katalytische Untereinheit eines S-Adenosyl-L-Methionin-abhängigen tRNA-Methyltransferase-Komplexes, der die Methylierung des Guanosin-Nukleotids an Position „10“ (m2G10) in tRNAs vermittelt“ [TRMT11 - tRNA (guanine(10)-N2)-methyltransferase homolog - Homo sapiens (Human) | UniProtKB | UniProt]. „S-Adenosylmethionin“=C15H22N6O5S=210E liegt in der Randspalte 4001/50128/[11868] in 0/12 als 210E vor. Die Zahl 10 ist jedoch nicht als Position 10 geeignet, weil die Ziffer 1 vom Protein „TRMT11“=463AS verwendet wird, und zwar aufsteigend von Z.8112 als „4“_QS 5+0+1=“6“_absteigend QS2_01=“3“ für 463AS. Folglich wird die Position „10“ in der Spalte [5]“0/“1“[1] dargestellt.
Protein (Mensch) „tRNA (Guanin(9)-N(1))-Methyltransferase (TRMT10C)“=312AS, Katalyse: „Guanosin-9 in tRNA + S-Adenosyl-L-methionin = H + N+1-Methylguanosin9 in tRNA + S-Adenosyl-L-Homocystein“ ist vermutlich für die Position 9 bestimmt [TRMT10C - tRNA (Guanin(9)-N(1))-Methyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Beteiligt sind „S-Adenosyl-L-Homocystein“=202E und „S-Adenosylmethionin“= 210E sowie „Adenosyl-L-Homocystein“=202E beginnt mit der Ziffer „2“ in Z.8113 zum Zahlenrand absteigend als 2_0_QS1+1=2 für 202E. „S-Adenosylmethionin“= 210E zählt 2_1_0 für 210AS. „1-Methylguanosin“=C11H15N5O5=66+15+35+40=156E liegt in der Spalte „1 /1185291/374001“ [in U-Form=5+2=7=Form_Position 9] als QS8+7=15_QS4+0+0+1_1=“6“ für 156E. Darin verweist die Randziffer [9]1/1 als Zählgröße 11 auf die Position „9“. Folglich hat das Protein „TRMT10C“=312AS einen Bezug zur Zählgröße 11 und liegt in der Spalte [1]1/11[8]/3[7] von Z.8112 absteigend als 3_1_QS1_1=2 für 312AS. In der Spalte [1]1/[8]11 wird die Zählgröße als Spalte „1/1“ von „1/8“ für QS1+8=Position „9“ begleitet.
Protein (Mensch) „tRNA (Cytidin(32)/Guanosin(34)-2'-O)-Methyltransferase (FTSJ1)“=329AS. Funktion: Methyliert die 2'-O-Ribose von Nukleotiden an den Positionen 32 und 34 der tRNA-Anticodonschleife. Katalyse: „Cytidin-32/Guanosin-34 in tRNA + 2 S-Adenosyl-L-methionin = 2'-O-Methylcytidin-32 / 2'-O-Methylguanosin-34 in tRNA + 2 H + 2 S-Adenosyl-L-Homocystein“ [FTSJ1 - Putative tRNA (Cytidin(32)/Guanosin(34)-2'-O)-Methyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Position „32“ als „3“_QS1+1=“2“ für Pos.32 bildet mit der Position 34 eine gemeinsame Spalte 11/3/344. Darin ist die Position „34“ direkt lesbar oder als Gruppe „44“ nochmals als Spalte „3/4“ vorhanden. Die Moleküle unterstützen diese Abgrenzung und liegen links von der Positionsspalte: 2′-O-Methylcytidin=C10H15N3O5=60+15+21+ 40=186E als 1_8_QS1+5=6 für 186E [2′-O-Methylcytidin – Wikipedia]. 2'-O-Methylguanosin=C11H15N5O5=66+15+35+40=156E liegt in der Spalte 15/33 als „15“_QS3+3=“6“ für 156E [2′-O-Methylguanosin – Wikipedia]. 2*[S-Adenosyl-L-Homocystein]=2*202E=404E liegt in der Spalte 40[0]/012/[1]1 ab Z.8112 aufsteigend als „40“_QS0+1+2_1=“4“ für 404E.2*[S-Adenosyl-L-methionin]=2*210E=420E liegt in der Spalte [58]0/[5]2[9]/40[0] ab Z.8112 absteigend als „4“_QS0+2=“2“_[8]“0“ mit Spaltenversatz „0“ statt „8“ aufgrund der Zählgröße 2+9=11 für 420E. Folglich beginnt das Protein „FTSJ1“=329AS in Z.8113 absteigend zur Randspalte „91/1/12[9]“ als QS1+2_1=3_QS1_1=2_9 für 329AS.
Protein (Mensch) „Queuine tRNA-Ribosyltransferase (QTRT1)“=403AS. Katalyse: Die Katalyse erfolgt durch einen doppelten Verdrängungsmechanismus. Das aktive Nukleophilzentrum greift das C1' des Nukleotids 34 an, um die Guaninbase von der RNA zu lösen und ein kovalentes Enzym-RNA-Zwischenprodukt zu bilden. Das aktive Zentrum des Protonenakzeptors deprotoniert das einfallende Queuin, so dass ein nukleophiler Angriff auf das C1' der Ribose das Produkt bilden kann. „Guanosin-34 in tRNA + Queuin = Guanin + Queuosin-34 in tRNAUniRule-Annotation“. Die Position „34“ kann in einer Spalte über 5 Zeilen vielfach gelesen werden, was für ein Protein zu weitläufig ist, um eine Position fix zu definieren. Die 34er-Zählvariante in der Spalte 11[8]/11[8]/3 als „3“_QS1+1_1+1=“4“ für Position „34“ kann ausgeschlossen werden, wenn sich die Moleküle kompakt ab Z.8112 am Zahlenrand aufsteigend überlagern, so dass die Position „34“ als Spalte „3/344“ eindeutig lesbar begrenzt wird. In dieser Verdrängungsphase liegt das Guanin=78E in Z.8110 am Zahlenrand „807“ für „7“_QS0+8=78E. Guanin=C5H5N5O=30+5+35+8=78E als Spalte 8/7 für 78E [Guanin – Wikipedia]; Guanosin=148E in der Spalte [7]4001/5012[9] als „1“_QS0+0+4=4_QS 5+0+1+2=8 für 148E; Queuin=C12H15N5O3=72+15+35+24=146E in der Spalte [7]4001/501[29] als „1“_QS0+0+4=4_QS 5+0+1=6 für 146E [Queuin – Wikipedia]; Queuosin= C17H23N5O7=102+23+35+56=216E in der Spalte [7]40“0“/50“12“/11[86] als „21“_QS0+4_0_1+1=“6“ für 216E [Queuosin – Wikipedia].
Sonstige Proteine: Das Protein (Mensch) „Terminal Nucleotidyltransferase (TENT4A)“=792AS besitzt Magnesium=12E und Mangan=25 als Cofaktor, so dass deren Lage im Code von Interesse ist. Das Protein liegt am Zeilenrand in der Spalte 07/[52]91/01/[12][9] ab Z.8110 aufsteigend als „7“_QS0+9=“9“_QS1_1=“2“ für 792AS. Mg=12 ist eine Endbegrenzung und Mn=25E ist gespiegelt als „52“ eine Seitenbegrenzung. ATP wird katalysiert vom ATP-Protein=553AS in der Spalte 5/52[91]/001 als 5_5_QS2_0+0+1=3 für 553AS. Funktion: „Katalysiert den Transfer von ATP und GTP auf RNA 3' poly(A)-Schwanz, wodurch ein heterogener 3'-Poly(A)-Schwanz entsteht, der zu einer Stabilisierung der mRNAs führt, indem mRNAs vor aktiver Deadenylierung geschützt werden“ [TENT4A - Terminal nucleotidyltransferase 4A - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Trimethylguanosin-Synthase (TGS1)“=853AS. Funktion: „Katalysiert die 2 seriellen Methylierungsschritte für die Umsetzung des 7-Monomethylguanosins (m7G) Caps von snRNAs und snoRNAs zu einer 2,2,7-Trimethylguanosin (m(2,2,7)G) Cap-Struktur. Das Enzym ist spezifisch für Guanin, und die N7-Methylierung muss der N2-Methylierung vorausgehen. Die Hypermethylierung der m7G-Kappe von U snRNAs führt zu ihrer Konzentration in Kernherden, ihrer Kolokalisation mit Coilin und der Bildung von kanonischen Cajalkörpern (CBs). Spielt eine Rolle bei der Transkriptionsregulation. Katalyse: „a 5'-end (N7-methyl 5'-triphosphoguanosine)-ribonucleoside in mRNA + S-adenosyl-L-methionine = a 5'-end (N2,N7-dimethyl 5'-triphosphoguanosine)-ribonucleoside in mRNA + H+ + S-adenosyl-L-homocysteine“[TGS1 - Trimethylguanosin-Synthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Coilin“= 576 AS ist beim Menschen in den kugelförmigen Cajalkörpern (D=0,3-1 µm) vorhanden. Folglich liegt das Coilin-Protein an der Bixnom-Spalte „1/5[3]/4[4501]“ für Kreis=64“. Coilin-Protein „5“_QS3_4=“7“_QS5+0+1=“6“ für 576AS [COIL - Coilin - Homo sapiens (Human) | UniProtKB | UniProt]. Guanin=C5H5N5O=78E; S-Adenosyl-L-homocystein=C14H20N6O5S=202E; S-Adenosylmethionin =C15H22N6O5S=210E. Beteiligt ist das Protein „5'-(N(7)-methylguanosine 5'-triphospho)-[mRNA] hydrolase (DCP1A)“=582AS in der Randspalte 2[91]/4001/5012[9] ab Z.8113 absteigend als „5“_QS1+2_4+0+0+1=“8“_“2“ für 582AS [DCP1A - 5'-(N(7)-methylguanosine 5'-triphospho)-[mRNA] hydrolase - Homo sapiens (Human) | UniProtKB | UniProt]. Folglich liegt das Protein „TGS1“=853AS in der Randspalte 852[91]/001 in Z.8111 aufsteigend als „85“_QS2_0+0+1=“3“ für 853AS: Epi.Ref_Rhesus.Z.“8“11“2“#16080“7“1553“7“4001“.
tRNA-Gen lfd.Nr.37: Aminosäure „Isoleucin-Variante 1“=C6H13NO2=36+13+7+16=72E [Isoleucin – Wikipedia]. Isoleucin ist hydrophob; Seitenkette: lipophil. Der Abbau von Isoleucin liefert Acetyl-CoA und Propionyl-CoA. „Coenzym A“= C21H36N7O16P3S=126+36+49+128+45+16=400E. Die Elektronenanzahl „72E“ wird gleichfalls von Leucin=72E dargestellt, so dass eine Unterscheidung benötigt wird. Weil das Nachbar-Gen Nr.36 „Transferasen-Komplex“ für „Guanosin“ das „Coenzym A“=400E als „QS7+1=8=Extra_5537_“400“_1“ aufnimmt, ist Isoleucin wahrscheinlich zutreffend positioniert – zufälliger Fund! Für den Funktionspartner „Isoleucin-Var.2“ wird eine Membran-Gruppe „33_44“ avisiert. Zum Isoleucin-Var.3 als lfd.Nr.40 besteht aufgrund der Unterbrechung keine Verbindung. Beide Zeilen ergeben einen Winkelsummen-Überschuss=[160°+160°+50°] - 360°=10°, der als Wasser=10 hydrophob wirkt. Der Spaltensummen-Winkel-Überschuss =[60+50+60] + [2* (Z.QS8+1+1=10)] -180°=10°muss hierzu die Zeilen-Nrn. einbeziehen. Das „Isoleucin“=72E zählt sich für beide Varianten mit der Zeilen-Nr. Z.811x Spalte 3-4 als QS3+4=7 und der Ziffer 2 als QS1+1=2. Von der Ziffer „1“ beginnend kann am gemeinsamen Zeilenrand Calcium gezählt werden. Kalium endet mit der Ziffer 1. Für Calcium ist das Protein CDPK4=528AS zur Bildung einer Matrix aus den 5 Randziffern beider Zeilen beteiligt. Zur Funktion des Calcium-Kanals werden als Gegenspieler 2 Kalium-Kanäle von den Proteinen PfK1=1966 AS und PfK2=1653AS codiert [Kaliumkanal K1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt; Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. PfK2=1653AS nimmt die Zahl 16 am linken Rand auf und steigt als Kanal „Spalte 5-3“ für 1653AS auf. Das Protein PfK1=1966 AS kann mit 1[0]_QS4+5=9 beginnen und in der Spalte QS4+1+1=6 bilden und die markierte Ziffer 8_“6“_8 ergänzen für Pfk2=1966AS. Das Enzym „Isoleucin-tRNA-Ligase“=1490AS kann in der Z.Nr. „1“_QS“1+3=4“ bilden und im Code QS4+5=“9_0“ für Enzym=1490AS bilden [Isoleucin - tRNA-Ligase - Plasmodium falciparum (Isolat 7G8) | UniProtKB | UniProt]. Damit wird auf den Umschalter „O-1“ hingewiesen, der auch als Spalte „O-1“ bildet.
Im Zeilencode sind diverse Proteinbausteine enthalten: Tubulin ist Hauptbestandteil der Mikrotubuli. Alpha-Tubulin II=450AS wird von männlichen Gametozyten exprimiert [Tubulin-alpha-Kette - Plasmodium falciparum (Isolat 3D7) | Feature-Viewer | UniProtKB | UniProt]. In der Kombination „33“4“450“12 wird das Protein=450AS „männlich=33“ adressiert. Die Zeilennummer enthält die Zählgröße „11“, so dass alternativ „45“_QS0+1+2=“3“ für Alpha-Tubulin I =453AS [Tubulin-alpha-Kette - Plasmodium falciparum Vietnam Eichenknoll (BVET) | UniProtKB | UniProt] zählbar sind. Um aus Alpha- und Beta-Tubulin eine Röhrenform zu erzeugen, wird zur Bindung Gamma-Tubulin=452AS benötigt. Hierzu wird die Spalte zur Folgezeile verwendet, um mit der Zählgröße „11“ die Zahl QS1+1=“2“ zu zählen. Die Folgezeile wird eingebunden, weil Tubulin an Guanosintriphosphat (GTP)= C10H16N5O14P3=60+16+35+112+45=268E bindet. Die Ziffer „2“ liegt in der Zeile und wird in der Folgezeile am Zahlenrand durch „68“ ergänzt. Es sind somit alle Modifikationen als Gruppe „44“ enthalten, um Mikrotubuli darzustellen. Das Motorprotein Dynein=4985AS wird gleichfalls daraus gespeist. Mit 4_QS4+5=9 wird in der Spalte 5-1 zur Folgezeile 8_QS4+1=5 für Dynein=4985AS gebildet. Kinesin=1605AS startet in der Folgezeile aus der Zählgröße 11 mit der Ziffer „1“, summiert in der Spalte 5-1 die Ziffer „6“, findet angrenzend die Ziffer „0“, steigt in der Spalte 4-0 auf, um am Zahlenrand QS4+0+0+1=5 zu summieren für Kinesin=1605 AS [Kinesin, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. In der Modifikation Kinesin=1906AS kann noch höher zum Zahlenrand Z.8111 aufgestiegen werden [Kinesin-Motordomänen-enthaltendes Protein - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt]. Die Modifikation Kinesin=1315AS steigt bis Z.8110 auf. Die Ziffer 1 wird in der Folgezeile gezählt und über die Zahl 18 in die Zeilennummer gespiegelt, so dass über die Serie Z.8111 die Ziffer „3“ aus QS1+1+1=3 zählt. Zurück in den Code wird wieder die Zahl „18“ als 8118_5 gefunden. Davon wird erneut die Ziffer „1“ gezählt und die Zahl „5“ angelagert [Kinesin - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Das Motorprotein Myosin=818AS kann sich auf gleichem Weg über die Zeilennummer bewegen [MyoA - Myosin-A - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Der Baustoff für Filamente ist das Aktin=376AS als „3_QS3+4=7“ und in der Folgezeile über die Spalte QS1+5=6 für Aktin 2=376AS [ACT2 - Aktin-2 - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt] Die Gruppe 44 ist geeignet, um das im Aktin enthaltene Topomyosin=568AS zu zählen. Weil es sich um 2 Spiralen handelt, kann auch 284AS gebildet werden. Aktin 1=376AS besitzt die gleiche Länge und kann bereits in der Vorzeile aus „37“ entstehen, in dem am Zahlenrand QS4+0+0+1=5 addiert wird und beim Aufstieg in der Randspalte „1-1“ zur Zahl „6“ summiert wird. Das ist sinnvoll, weil die Ziffer „1“ notwendig zu einem Kaliumion=“19“ gehört (gespiegelt als „91“) [ ACT1 - Aktin-1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“8113“#“1607“873“344“5“0“129“.
tRNA-Gen lfd.Nr.38: Aminosäure „Isoleucin-Variante 2“=C6H13NO2=72E [Isoleucin – Wikipedia]. Isoleucin ist hydrophob; Seitenkette: lipophil. „Isoleucin“=72E zählt sich für beide Varianten mit der Zeilen-Nr. Z.811x Spalte 3-4 als QS3+4=7 und der Ziffer 2 als QS1+1=2. Das Enzym „Isoleucin-tRNA-Ligase“=1696AS kann in der Vorzeile am Umschalter „0/1“ mit der Ziffer „1“ beginnen und in der Spalte QS5+1=6 addieren. In der Zeile schließt sich QS1+8=9 _6 für Enzym=1696AS an [Isoleucin - tRNA-Ligase - Plasmodium falciparum (Isolat HB3) | UniProtKB | UniProt]. DELTA.TIME.Epi.Ref_Rhesus.Z.8113-Z.8114= #Kalium=19_Phosphor=QS8+1+6=15_Zeitbasis=60_Calcium=3+8+2+6+1=20_Erythroyt=26.
Für die ATP-Bindung ist Energie als ATP=551AS für die Funktionspartner mit den Anteilen „501“ und „51“ vorhanden. Das bei der ATP-Bindung entstehende AMP-Info=“16[ ]7“ kann nur den Platzhalter als „16_O_7“ einschießen, aber keinen informativen Ziffernblock. Es sind 2 weitere Proteine „Isoleucin - tRNA-Ligase“ mit „1082“AS und „1648“AS bekannt, die als Modifikation betrachtet werden und momentan kein anderes Gen besetzen [Isoleucin - tRNA-Ligase - Plasmodium falciparum RAJ116 | UniProtKB | UniProt; Isoleucin-tRNA-Ligase - Plasmodium falciparum (Isolat NF54) | Externe Links | UniProtKB | UniProt].
Mensch: Isoleucin=C6H13NO2=36+13+7+16=72E [Isoleucin – Wikipedia] liegt in 3 Kernzeilen als lfd.Nr. 37/38 und 40 (Z.8113/Z.8114 und Z.8116) vor, die gemäß der Analyse des Parasiten erkennbar sind. Der Mensch nutzt diese Grundlage, um darin verzweigte Funktionen für einen Gesamtorganismus durch Bildung geeigneter Proteine zu suchen. Isoleucin stimmt mit Leucin=72E überein, und wird in der Z.Nr.-Matrix 8“11“x als Natrium-Kanal transportiert. Die Zahl „72“ bildet sich in der Code-Randspalte „7/1/1“ ab Z.8110 aufsteigend als „7“_QS1+1=“2“ für Isoleucin=“72“. Zuständig ist das Protein (Mensch) „Sodium-dependent neutral amino acid transporter B(0)AT2“=730AS. Der natriumabhängige neutrale Aminosäuretransporter zeigt eine Präferenz für Leucin, Valin und Isoleucin und Methionin [SLC6A15 - Sodium-dependent neutral amino acid transporter B(0)AT2 - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein steigt bis zur Kernzeile Z.8113 auf, und zwar in der Randspalte 7/1/74001/[5]0[129] als 7_QS1_1_aus der Zählgröße 7+4=11=Natrium nur die Ziffer 1 =“3“_“0“ für 730AS. „Isoleucin=72E“ liegt folglich mit dem Bezug zum Natrium=11 in der Z.Nrn-Matrix Z.81“13“/Z.81“14“ als QS3+4=“7“_QS1+1=“2“ für 72E vor. Das Protein (Mensch) „Aminosäure-Aminotransferase (BCAT2 / M0QXF9 • M0QXF9)“=445AS ist in Z.8112 direkt lesbar [BCAT2 - Branched-chain-amino-acid aminotransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein katalysiert die erste Reaktion im abbauenden Stoffwechsel (Katabolismus) der essentiellen verzweigtkettigen Aminosäuren Leucin, „Isoleucin“ und Valin. Katalyse: 2-Oxoglutarat + L-Isoleucin = (S)-3-methyl-2-oxopentanoat + L-Glutamat. Mit dem Cofaktor=“Pyridoxal-5'-phosphat. Die beiden Modifikationen, Protein „BCAT1“=386AS und Protein „BCAT2 / O15382 • BCAT2“=392AS, bestätigen die Position. Die „2-Oxoglutarsäure“=C5H6O5=30+6+40=76E liegt in der Spalte „7“40/“5“01/“1“18“ als 7_QS5+1=7 für 76E vor [α-Ketoglutarsäure – Wikipedia]. In dieser Spalte begrenzt der Cofaktor=“Pyridoxal-5'-phosphat (VitaminB6)“=C8H10NO6P=48+10+7+48+15=128E die Lage der 3 Proteine als „1“_QS0_1+1=“2“_“8“ für 128E. Der Cofaktor führt in seiner Spur das „(S)-3-methyl-2-oxopentanoat“=C6H9O3=36+9+24=69E als QS5+0+1=6_QS8+1=9 für 69E [(S)-3-methyl-2-oxovalerat | C6H9O3- | CID 6857401 - PubChem (nih.gov)] sowie das „Glutamat/Glutaminsäure“=C5H9NO4=30+9+7+32=78E als QS5+2=7_8 für 78E.
Das Protein (Mensch) „Aminosäure-Aminotransferase (BCAT1)“=386AS liegt in der Spalte „3“[74]/“44“501“/[11] aufsteigend als „3“_QS4+4=“8“_QS5+0+1=“6“ für 386AS [BCAT1 - Verzweigtkettige Aminosäure-Aminotransferase, zytosolisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Aminosäure-Aminotransferase (BCAT2 / O15382 • BCAT2)“=392AS zählt sich in derselben Spalte „3“[74]/[4]“45[01]/2“11“] als 3_QS4+5=9_QS1+1=2 für 392AS. In der folgenden Glutamat-Kernzeile liegt das Glutamat in der Z.Nr.Z.“8“115“ als QS5+1+1=7_8 für 78E. Die Z.Nrn.-Matrix Z.8“1“15/8“1“16“ enthält Isoleucin als QS6+1=“7“_absteigend 1+1=“2“ für 72E, so dass Glutamat den Anschluss separaten 3. Isoleucin-Kernzeile vermittelt.
6 Proteine „tRNA-Isoleucin-Ligase“: Das Protein (Mensch) „tRNA-Isoleucin-Ligase (Lars1)“=1242AS markiert 2 Kernzeilen mit der Code-Spalte [#1]6/#[1]6 als QS6+6=“12“ und findet in der Z.Nr.Z.8114 den Anschluss 4_QS1+1=2 für 1242AS. Katalyse: „ATP + L-Isoleucin + tRNA(Ile) = AMP + Diphosphat + L-Isoleucyl-tRNA(Ile) [IARS1 - isoleucine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. ATP-Synthase =553AS für ATP aus ADP [ATP5F1A - ATP-Synthase-Untereinheit alpha, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt in der Spalte 4001/50-1[29]/11 als QS4+0+0+1=“5“_QS5+0=“5“_QS1+1_absteigend_ 1=“3“ für 553AS. Die gleiche Kettenlänge von 1242 AS entsteht am rechten Zahlenrand mit dem Protein (Mensch) „tRNA-Isoleucin-Ligase (DKFZp686L0869)“=1242AS in der Spalte [5]01[2]/411[8]/2[5] aufsteigend ab Z.8113 als „1“_QS0_1+1=“2“_“4“_“2“ für 1242AS [DKFZp686L0869 - Isoleucin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „tRNA-Isoleucin-Ligase (Lars1/P41252 • SYIC)“=1262AS bildet in den Randspalten von Z.Nrn. und Code einen Ring um alle 4 Zeilen ab der 3. Isoleucin-Kernzeile Z.8116 zu beteiligen. Aus den Z.-Nrn.-Randziffern wird mit QS5+6=11 die Zählgröße 11 mit der Code-Randziffer „1“ als QS11+1=12 gelesen. Absteigend ergeben die restlichen Randziffern 1+1+1=3 und die Randziffer 3 in Z.Nr.8113 zusammen die Ziffer 6 sowie anliegend QS1+1=2 für 1262AS [IARS1 - Isoleucin--tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „tRNA-Isoleucin-Ligase (Lars1/ A0A804HKU1)“=713AS erfüllt den gleichen Zweck und zählt in der Z.Nrn.-Matrix 1+1+1+1_1+1+1=“7“_“13“ für 713AS [IARS1 - Isoleucin--tRNA-Ligase - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt].
Das Protein (Mensch) „tRNA-Isoleucin-Ligase (Lars2_mitochondrial“=1012AS verfügt über eine Kotrolleinrichtung, indem die Schwerachse=84 aufgenommen wird in der Spalte „4501“/“84“[118] ab Z.8113 aufsteigend als QS4+5+0+1=10_QS8+4=12 für 1012AS [IARS2 - Isoleucine--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „tRNA-Isoleucin-Ligase (Lars1/A0A804HJ36)“=1076AS folgt diesem Protein und umhüllt dabei die Schwerachse=84 in der Spalte „1“[8]“4“/“0“7“2“ als QS1+0=“10“_“7“_QS2+4=“6“ für 1076AS [IARS1 - Isoleucin--tRNA-Ligase - Homo sapiens (Mensch) | Weblinks | UniProtKB | UniProt]. Um AMP zu beteiligen, ist das Protein (Mensch) „5'-AMP-aktivierte Proteinkinase“=489AS von Interesse, dass beide Proteine an der Schwerachse=84 verbindet in der Spalte „84/72“ als „48“_QS7+2=“9“ für 489AS. Funktion:
„AMP/ATP-bindende Untereinheit der AMP-aktivierten Proteinkinase (AMPK), einer Energiesensor-Proteinkinase, die eine Schlüsselrolle bei der Regulierung des zellulären Energiestoffwechsels spielt. Als Reaktion auf die Verringerung des intrazellulären ATP-Spiegels aktiviert AMPK energieproduzierende Signalwege und hemmt energiefressende Prozesse“ [PRKAG3 - 5'-AMP-aktivierte Proteinkinase-Untereinheit gamma-3 - Homo sapiens (Mensch) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.8“114“#“1607“675“1841“186“8.
tRNA-Gen lfd.Nr.39: „Glutamat“ ist die ionisierte Form der Aminosäure „Glutaminsäure“ mit gleicher Summenformel. Salze und Ester der Glutaminsäure werden als Glutamate bezeichnet. Den Unterschied bilden hier spezielle Enzyme. „Glutamat“=C5H9NO4=6*5+9+7+8*4=30+16+32=78E [Glutamat - DocCheck Flexikon]. Enzym „Glutamat - tRNA-Ligase“=574AS. Das Enzym katalysiert die Bindung von Glutamat an tRNA(Glu) in einer zweistufigen Reaktion: Glutamat wird zuerst durch ATP aktiviert, um Glu-AMP zu bilden, und dann auf das Akzeptorende der tRNA(Glu) übertragen. [glutamate--tRNA ligase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Das Protein „ATP-Synthase-Untereinheit alpha“=551AS liegt bereits einige Zeilen zuvor gespiegelt als „155“ vor [ATP synthase subunit alpha - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Glutamat wird aktiviert, indem es ebenfalls statt 78 als 807 gespiegelt seitlich anliegt. Glu-AMP=C12H20N4O6=6*12+20+7*4+8*6=72+20+28+48=168E liegt als „1608“ am linken Zahlenrand [Gly-Amp-Glu | C12H20N4O6 - PubChem (nih.gov)]. Der Zahlenteil 160 ist ständig als Spalten-Serie vorhanden, so dass nur noch die Ziffer 8 durch den Code wandert: Epi.Ref_Rhesus.Z.160“807“155“3“74“001. Nach einer Markierung „787“ wandert die Ziffer „8“ rechten Zahlenrand als „868“. In dieser Position bildet die vordere Ziffer „8“ mit der Ziffer „4“ des Enzyms eine Spalte als Schwerachse „84“, so dass ein Zusammenhang vorliegt. Reaktion: ATP + L-glutamate + tRNA(Glu) = AMP + diphosphate + L-glutamyl-tRNA(Glu). Das Enzym=575AS ist direkt lesbar. Die Spiegelung einer Zählgröße 47_74 als QS7+4=11=Zählgröße ergibt das Glutamat=78E aus der Spiegelung „8_QS1+1+5=7“. Eine Zink-Ionen-Bindung mit Zink=30 ist möglich. Zink ist nicht lesbar. Wegen einer Dopplung „74_74“ als Zählgröße ist Zink doppelt in 2*30=60 enthalten. Die Zahl „77“ bildet sich nochmals am rechten Zahlrand „7“_QS4+1+2=“7“, so dass sich zur Vorzeile eine Randspalte „8“-QS=“7“ für die Sekretion von Glutamat=“78“ bildet. Wird am linken Zahlrand die Zahl „Nerv=77“ durch Botenstoffe beeinflusst, wird am rechten Zahlenrand die Glutamat-Sekretion gehemmt.
Mensch: Aminosäure „Glutaminsäure“ [„Glutamat“ ionisierte Form]= C5H9NO4=30+16+32=78E liegt in der Z.Nr.Z.8115 als QS5+1+1=7_8 für 78E vor. Im Code liegt Glutamat als Zeilen-Zugang mit der Vorzeile in der Spalte 8/7 für 78E. Glutamat=78E wird in Glutamin=C5H10N2O3=30+10+14+24=78E umgewandelt, das mit anderer Struktur aber gleicher Elektronen-Anzahl die Zeile in der Spalte 25[74]/8 als QS2+5=7/8 für 78E verlässt. Es handelt sich um das Glutamin, weil ausgangsseitig Phosphat= PO4^3- =15+32=“47“ benachbart ist. In der Zeile stehen die Cofaktoren „Magnesium“=12E und „Mangan“=25 zur Verfügung. Das Protein (Mensch) „Glutaminsynthetase (GLUL)“=373AS katalysiert die Umwandlung von Glutamat und Ammoniak zu Glutamin. Im Gehirn reguliert es den Gehalt an giftigem Ammoniak=NH3=7+3=10E und wandelt neurotoxisches Glutamat=78E in harmloses Glutamin um, während es in der Leber eines der Enzyme ist, die für den Abtransport von Ammoniak verantwortlich sind. Katalyse: ATP + L-Glutamat + NH4 = ADP + H + L-Glutamin + Phosphat++“. Nur 1 Cofaktor-Bindestelle für 2 Cofaktoren Mg+Mn: Mangan=25E liegt zwar in der Zeile, wird aber vom Protein verbraucht, so dass es sich mit der Ziffer „2“ aus der Randzahl „Magnesium“=12E und der Spalte „2/5“ zur Folgezeile als maßgebliche Begrenzung bildet [GLUL - Glutaminsynthetase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „Glutaminsynthetase“=373AS liegt in der Spalte 01[29]/11[8]/12741[2]/[5] aufsteigend ab Z.8113 als QS 1+0_1+1=3_QS2+5=7_QS7+4=11=Zählgröße, reduziert auf 1+1=2_1=3 für 373AS. Das Protein erfüllt eine zusätzliche Funktion in der Interaktion mit dem Protein (Mensch) „Rho-related GTP-binding protein (RhoJ)“=214AS aufgrund der Spiegelung zur Randziffer [7]“412“ [RHOJ - Rho-related GTP-binding protein RhoJ - Homo sapiens (Human) | UniProtKB | UniProt]. In der Kombination mit der Ziffer „7“ bildet sich eine Zählgröße 7+4=11. Im Prinzip handelt es sich darum, das eine Palmitinsäure=C16H32O2=96+32+16=144E angehängt wird (RHOJ-Palmitoylierung) [Palmitinsäure – Wikipedia]. Die „Palmitoylierung“ ergibt sich aus der folgenden Randspalte „55/4/4“ als Transportgröße, wenn die Ziffer „1“ für 1_4_4 als 144E durch Addition 5+5=“1“ 0 erzeugt wird.
Das Protein (Mensch) „Glutamatrezeptor“=1124AS wirkt im Zentralnervensystem als Ionenkanal. „Glutamat“ dient als erregender Neurotransmitter [Glutamatrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Glutamat/Glutamin hängen in Z.8115 seitlich am Nervensystem „QS7+4=11_Nerv=7_Kanal=707“. Der Glutamatatrezeptor bildet nunmehr auch auf der rechten Seite des Nervensystems eine gleichartige Zählgröße aus der Zahl 74 als „74[770725]74“. Der Klammer-Inhalt reduziert sich auf 77=7+7=“14_0_7+2+5=14“ und somit klassisch „11_505_11“ für eine Rechenzentrale in jeder Zelle. Der Glutamatrezeptor liegt direkt rechts neben der Glutamat/Glutamin-Spalte in der Spalte „[518]411/[725]“74“ absteigend in Z.8115 als QS7+4=“11“_QS1+1=“2“_“4“ für 1124AS.
Das Protein (Mensch) „Glutamatrezeptor 1(GRIA1)“=906AS zieht auf der linken Seite an der Glutamat/Glutamin-Spalte vorbei, um die Ziffer „0“ im Ionenkanal „7“0“7=Nerv“ direkt zu passieren, und zwar in der Z.8116 absteigend als QS9+0=“9“_“0“_QS5+1=“6“ für 906AS. Funktion: „Die Bindung des erregenden (exzitatorisch) Neurotransmitters L-Glutamat induziert eine Konformationsänderung, die zur Öffnung des Kationenkanals führt, und wandelt dadurch das chemische Signal in einen elektrischen Impuls um“ [GRIA1 - Glutamate receptor 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Im Code ist durch die Serie #16“0“74/#16“0“72 mit der Null-Spalte ein konkurrierender Kanal vorhanden, der über Z.8115/Z.8116 wegen QS 074+072=QS7+4+7+2=20 auf Calcium=20 reagiert. „In Gegenwart von CACNG4, 7 und 8 zeigt sich eine Resensibilisierung, die durch eine verzögerte Akkumulation des Stromflusses bei fortgesetzter Applikation von Glutamat gekennzeichnet ist.“ Das Protein (Mensch) „Spannungsabhängiger Calcium-Kanal (CACNG7)“=275AS aktiviert den Kanal mit QS7+4=11=QS1+1=“2“_QS1+6+0=“7“_[Z.811]“5“ für 275AS [CACNG7 - Spannungsabhängige Calciumkanal-gamma-7-Untereinheit - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein CACNG8=425AS zieht den Kanal über die Z.Nrn.-Matrix“ weiter [Z.81]“1“4“ /[Z.81]“1“5“ als „4“_QS1+1=“2“_“5“ für 425AS [CACNG8 - Voltage-dependent calcium channel gamma-8 subunit - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Spannungsabhängiger Calcium-Kanal (CACNG4)“=327AS wechselt als Ring von der Randziffer „3“ in der Z.Nr.Z.811“3“ über 2 Code-Randziffern QS1+1=“2“ zurück in Z.8115 mit QS1+6=“7“ für 327AS [CACNG4 - Spannungsabhängige Kalziumkanal-gamma-4-Untereinheit - Homo sapiens (Mensch) | UniProtKB | UniProt].
Die Glutamat-Zeile Z.8115 stellt am rechten Zahlenrand den Cofaktor Magnesium=12 zur Verfügung. Um auf diese Idee zu kommen, wird erst das Protein Mensch „Zytosolische Carboxypeptidase 1 (AGTPBP1)=1226AS benötigt, das ein nicht sichtbaren Cofaktor „Zink(Zn^2+)=30E“ verwendet, nur um den rechten Zahlenrand zu aktivieren. Katalyse: „(L-Glutamyl) (n+1)-gamma-L-glutamyl-L-glutamyl-[Protein] + H2O = (L-glutamyl)(n)-gamma-L-glutamyl-L-glutamyl-[Protein] + L-glutamat“ [AGTPBP1 - Zytosolische Carboxypeptidase 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Zink setzt sich fiktiv aus der Glutamat-Spalte „8/7“ für Glutamat=78E als QS7+8=15 und der Randspalte „8/2/5“ =QS8+2+5=15 für 15+15=30=Zink zusammen. Entsprechend wird das das Protein (AGTPBP1)=1226AS in der Z.Nrn.-Matrix Z.8“1“14/ Z.8“11“5/ Z.8“11“6“ als „1“_QS11+11=“22“_“6“ für 1226AS gebildet. Am Zahlenrand kann Zink dann alternativ in der Randspalte „8/12/955“=8+1+2+9+5+5=30=Zink gezählt werden. Die vorhandene Zahl „90“ auf 3 Zeilen verteilt, ergibt Zink=30 für jede Zeile. Funktionell entscheidend ist, dass die Glutamat-Kernzeile Z.8“115“, die ohnehin bereits mit „115“ maßgeblich für die Zählung der Wirbelknochen ist, den Schwerpunkt der Skelettstruktur bildet, weil die Vor- und Folgezeile die Schwerachse 84 =QS8+4=12 links und rechts versetzt enthalten. Die Summe ergibt 12+12=24=Zeit. Für die Verbindung der 3 Zeilen wird die Spalte durch 11_5 wie in der Z.Nr. ergänzt als Gleichgewichtsspalte 841[1]/5/84 für QS“8+4+“1+[1]+5“+“8+4=30=Zink. Zinkmangel führt zum Knochenabbau (Osteoropose) [Biochemical indices of bone turnover and the assessment of fracture probability - PubMed (nih.gov); O. Johnell u.a.; Osteoporos Int. 2002 Jul;13(7):523-6. doi: 10.1007/s001980200068 ]. Wird die Schwerachse „84_84“ ohne die Ziffer „1“ aus der Zählgröße „11“ als Diagonale gezählt, ergibt sich Kupfer=29E, das ebenfalls nicht fehlen darf. Kupfer liegt tatsächlich am Zeilenrand als Spalte „2/5/4“ als 2_QS5+4=9 für Kupfer=29 vor. Und warum sind ältere Frauen besonders von der Osteoropose bedroht? Das liegt daran, dass sich das Hormon=66 doppelt als Matrix beidseitig an die Formspalte „7/7/7“ für eine Lotrechte legen muss, um keine Krümmung „64“ zu erzeugen. Die Matrix „6[07]6/6[07]4/6[07]2=paarig“ ergibt 6+6+6+“6+4“+2=30=Zink. Aufgrund der Zink-Bindung wird der Kreis=“64“ für die krankhafte Körperkrümmung nicht gelesen, so dass Zink notwendig ist. Die Ziffer „7“ wird nicht mitgezählt, weil sie zur Markierung der Ziffer „6“ in „7_“6“_7_5=Struktur dient, die mit 7+6+7=20=Calcium zur Prozesssteuerung enthält. Die Protein-Funktion kann sich auch auf synaptische Transportprozesse in Bezug auf die Motorik von „Tubulin“ für Mikrotubuli und Aktinfilamente beziehen [DFG - GEPRIS - Untersuchung von Tubulin-Polyglutamylierung/-Deglutamylierung in der Regulation synaptischer Transportprozesse sowie deren Einfluß auf Lernen und Gedächtnis.; Forschung bis 2015]. Das Protein „Tubulin alpha“=551 AS [Tubulin beta analog 551AS] benötigt den Cofaktor „Magnesium“=12E und liegt folglich in der Randspalte „1[2]/55“ als „55_1“ für 551AS. Der Cofaktor „Magnesium“ wird dabei tangiert, aber nicht verbraucht [TUBA1A - Tubulin-alpha-1A-Kette - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „Glutamat-Cystein -Ligase (GCLC)“=637AS ist an der Glutathion-Biosynthese für Glutathion aus Cystein=64E und Glutamat=78E beteiligt. Glutathion (GSH)=C10H17N3O6S=60+17+21+48+16=162E ist ein schwefelhaltiges Tripeptid und wird in der Leber aus Glutaminsäure, Glycin und Cystein für jede Körperzelle gebildet. Es ist kein echtes Tripeptid, da die Amidbindung zwischen Glutaminsäure und Cystein über die γ-Carboxygruppe der Glutaminsäure ausgebildet wird und nicht über die α-Carboxygruppe [Glutathion – Wikipedia]. Katalyse: „ATP + L-Cystein + L-Glutamat = ADP + gamma-L-Glutamyl-L-Cystein + H + Phosphat+A“. Cystein=64 als Spalte 6/4 und Glutamat=78 als Spalte 8/7 begrenzen eine Lücke, in die das Protein „GCLC“=637AS aufsteigend ab Z.8113 in der Spalte 73“3“/7“51“/7“7“ als „3“_QS5+1=“6“_“7/ für 637AS zieht. Das produzierte Glutathion liegt außerhalb direkt neben Glutamat als 1_QS1+5=6_2 für 162E [GCLC - Glutamate--cysteine ligase - Homo sapiens (Human) | UniProtKB | UniProt].
4 Proteine „Glutamat-tRNA-Ligase“: Das Protein (Mensch) „Glutamat/Prolin-tRNA-Ligase (EPRS1)“= 1512AS legt 2 Spalten, und zwar „8/7“ für Glutamat=78 und „6/QS7+4=[1]1_1[2]“ für Prolin=62E, und zieht durch die Lücke „118/574“ als „1“_“5“_“1“_QS7+4=11=QS1+1=“2“ für 1512AS. Funktion: Die durch Interferon-gamma induzierte Phosphorylierung von EPRS1 dissoziiert das Protein vom Aminoacyl-tRNA-Synthetase-Multienzymkomplex und rekrutiert es an den GAIT-Komplex, der an stammschleifenhaltige GAIT-Elemente in der 3'-UTR verschiedener inflammatorischer mRNAs (z.B. Ceruplasmin) bindet und deren Translation unterdrückt. Interferon-gamma kann daher in bestimmten Zellen die EPRS1-Funktion von der Proteinsynthese zur Translationshemmung umleiten. Fungiert auch als Effektor des mTORC1-Signalwegs, indem er über SLC27A1 die Aufnahme von langkettigen Fettsäuren durch Adipozyten fördert. Dabei spielt es auch eine Rolle im Fettstoffwechsel und beeinflusst indirekt die Lebensspanne [EPRS1 - Bifunktionelle Glutamat/Prolin--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Ceruloplasmin (Caeruloplasmin) ist ein Enzym, das als Kupfer-Speicher dient und Eisen abtransportiert, das sich in Zellen angesammelt hat. Es wird in der Leber und im Gehirn gebildet und erhält bereits bei seiner Biosynthese posttranslational sechs oder sieben Kupferionen und kann bis zu acht Kupfer-Ionen pro Molekül transportieren. Protein (Mensch) „Ceruloplasmin“=1065AS. Katalyse: 4 Fe2+ + 4 H + O2 = 4 Fe+3+ + 2 H2O. Cofaktor „Kupfer=29“, bindet 6 Cu Kationen pro Monomer [CP - Ceruloplasmin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Gemäß Katalyse wiederholt sich das Eisen=26 in einer Randspalte 2[9]=Kupfer=29/6[8]/12/5 als 2_6=Eisen=26 sowie 2_QS1+5=6 für Eisen=26. Der Cofaktor „Kupfer“ liegt in der Randspalte 2QS5+4=9 für Kupfer=29. Dabei wird in Z.8114 über die Eisen-Transportstrecke die Kombination von Schwerachse und Zählgröße durchlaufen, und zwar gekoppelt an EXTRA=8_“6“_8 mit der Bedeutung, dass 6 Kupferionen 8 Kupfer-Ionen transportieren [Caeruloplasmin – Wikipedia]. Der „mTORC1-Signalweg“ dient zur Proteinsynthese. Das Protein (Mensch) „mTOR“=1335AS liegt in der Membranspalte 33/51 als 1_33_5 für 1335AS. Von Z.Nr.Z.811“5“ wird mit der Ziffer „5“ die Code-Randspalte QS1+1+1=“3“ durchlaufen, um ringförmig in Z.Nr.81“1“3“ die Zahl „13“ als Weg 1335AS aufzunehmen [RPTOR - Regulatory-associated protein of mTOR - Homo sapiens (Human) | UniProtKB | UniProt].
Das Protein (Mensch) „Glutamat-tRNA-Ligase (H6WCP5)“=863AS liegt in der Randspalte „86“8/4“12“ als „86“_QS1+2=“3“ für 863AS, um die diagonale Schwerachse „84“ zu durchkreuzen. Katalyse: „ATP + L-Glutamat + tRNA(Glu) = AMP + Diphosphat + L-Glutamyl-tRNA(Glu)“ [Glutamat--tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt].
Das Protein (Mensch) „Glutamat-tRNA-Ligase_mitochondrial (EARS2)=523AS liegt in der Spalte 715/[7]33, um funktionell die Membran 33 zu erreichen. Zu diesem Zweck wird aufwändig gezählt „5“_[7_1+3=4 für 74 als QS7+4=11 als QS1+1=“2“ _“3“ für 523AS. Über der Glutamat-Spalte 8/7 liegt eine Gruppe 44, so dass das Protein noch gezählt werden kann als „5“_QS1_1=“2“_QS0+1+2=“3“ für 523AS [EARS2 - Probable glutamate--tRNA ligase, mitochondrial - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „Glutamat-tRNA-Ligase (EPRS1)“=968AS liegt am rechten Zahlenrand in der Spalte „[1]“18“6“[8]/[4]“12“/[5]“5“ aufsteigend ab Z.8114 als QS1+8=“9“_“6“_QS1+2_5=“8“ für 968AS, um die diagonale Schwerachse „84“ zu kreuzen [EPRS1 - glutamate--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.“8“115“#1“60“7“47“70“72“574“12.
tRNA-Gen lfd.Nr.40: Aminosäure „Isoleucin“=C6H13NO2=36+13+7+16=72E. Isoleucin=72E ist direkt lesbar. Das Protein „Isoleucyl-tRNA-Synthetase“=1672AS setzt lediglich den Zahlenteil 16 vor die 72 [Isoleucyl-tRNA synthetase - Plasmodium falciparum IGH-CR14 | UniProtKB | UniProt]. Für die ATP-Binding mit ATP=551AS verfügbar in Zeile-Nr.Z.8112 steht kann die Energie 900_55=Struktur verheizt werden. Für den Weg bis zur Energiequelle muss das Gleichgewicht aller Zahlen „Summe der xO- und xxO- Zahlen“=900. Vorhanden in der der ATP-Zeile „400“. Die Serie „60“ über 5 Zeilen ergibt 5*60=300. Verstreut liegen Summe 80+50+70=200. Insgesamt 400+300+200=900. Epi.Ref_Rhesus.Z.8116#“160“72“7“900“9849“55“.
Die Schilddrüse entwickelt sich embryonal aus dem Bereich eines Zungen-Loches, so dass 1. ein Bezug zur Randziffer Muskel „55“ als Zunge besteht und 2. „seilt“ sich die Schilddrüse an einer langen Code-Spalte 8-8-8… in den Kehlkopf hinunter. Was hier als Venen-Spalte nutzbar ist, dient zugleich als Bezug zu dieser 8er-Spalte. Weiterhin muss es sinnvoll sein, dort auch die Nebenschilddrüse anzuordnen. Die Schilddrüse produziert das Hormon T3 [Triiodthyronin – Wikipedia] und das Hormon T4 [Thyroxin – Wikipedia]: Thyroxin (T4)=C15H11I4NO4=120+11+212+7+32=382E [enthält 4*Jod=4*53=212]. Thyroxin (T4) entsteht in Z.8118/Z.8119 in Spalte 303/511 aus QS0+3=3_Spalte QS3+5=8_QS1+1=2 für T4=382E. Das Triiodthyronin (T3/Trijodthyronin)=C15H12I3NO4=120+12+159+7+32=330E wird aus der Zahl „3030“ mit QS3+0=“3_3_0“ erzeugt. Weiterhin wird den den C-Zellen der Schilddrüse das Hormon „Calcitonin“ produziert, das als Botenstoff den Calcium- und Knochenstoffwechsel beeinflusst [Hormone und Hormonproduktion der Schilddrüse | T3 & T4 Werte (deutsches-schilddruesenzentrum.de)]. Calcitonin Mensch)=141AS. Funktion: Bewirkt einen schnellen, aber kurzlebigen Abfall des Calcium- und Phosphatspiegels im Blut, indem es den Einbau dieser Ionen in die Knochen fördert [CALCA - Calcitonin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Calcitonin startet in Z.8119 mit der Ziffer „1“ in der Zählgröße 1“14“ und nutzt die Spalte 0-4 als Platzhalter, um als Addtion die Ziffer 7=Nerv in der Summe 3+0+7=“1“0 für die Ziffer „1“ zu beteiligen als Botenstoff „Calcitonin“=141AS. In der Nebenschilddrüse wird das Parathormon (Mensch) =115AS als Gegenspieler produziert [PTH - Parathormon - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Parathormon=115AS ist gespiegelt in der Ziffernfolge „511“ direkt lesbar. Weil die Ziffer „1“ mit dem Hormon „Calcitonin“=141AS geteilt wird, kann immer nur eines der beiden Hormone aktiv sein. In der Zeile kann der Phosphatspiegel mit 44_15=Phosphor_44 reguliert werden. Calcium=20 ist aber nur zählbar, wenn der Gegenspiegel die Ziffer „1“ nutzt, so dass sie übersprungen werden kann. Für Calcitonin wird in der Vorzeile der Anteil QS 3+0+7=10 für die Calcium-Zählung beachtet und in Z.8119 rechts um QS4+1+5=10 betragsgleich gekürzt, so dass ebenfalls die Ziffer [1] für Calcium=20 blockiert sein muss.
Der Hormonbedarf wird im Gehirn vom Hypothalamus (Teil des Zwischenhirns) und der Hypophyse (Hirnanhangdrüse) gesteuert. In der Zielsetzung muss ein „Funkverkehr“ zwischen [Nervensystem mit Spaltenserie 7-7-7…] und [Wirkstoffen 8-8-8…] organisiert werden. In Zeile Z.8118 wird der Randgröße „Nerv=7_88_24=Zeit“ eine solche Rezeptor-Funktion zugewiesen. Die Zahl 88 ist allgemein ein Wirkstoff und erfüllt in Z.8118 in Kombination mit Nerv=7_88 die Funktion eines hormonellen Botenstoffes. Nun ist ein Kunstgriff erforderlich, in dem die Zeitbasis=24 als Transportgut dient. Fehlt die Zeitbasis, produziert die Schilddrüse zur Regulation kein Hormon. Bei einer Subtraktion „7“_88-24=“64“ kann mit „764“ das Rezeptotprotein (Mensch) „TSHR - Thyreotropin-Rezeptor“=764AS wirken [TSHR - Thyreotropin-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Nunmehr kann in Z.8118/Z.8119 die anliegende Spalte 307/144 zur Hormonproduktion stimuliert werden. Die Hirnanhangdrüse bildet das Hormon (Mensch) TSH (Thyroid Stimulating Hormone)=138AS, um die Schilddrüsen-Hormonproduktion zu stimulieren [TSHB - Thyrotropin subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Der Start liegt mit der Ziffer „1“ in der „Zählgröße [1]_“1“_ hoch, über Spalte 3-1 mit QS3+0=“3“_herunter, Spalte 0-4 mit QS4+4=“8“. Über einen Rückkoppungsmechanismus wird die Abgabe von TSH vom Hormon (Mensch) „Pro-Thyreotropin Releasing Hormon=242AS“ im übergeordneten Hypothalamus freigesetzt. Funktion: Als Bestandteil der Hypothalamus-Hypophysen-Schilddrüsen-Achse steuert es die Sekretion des Schilddrüsen-stimulierenden Hormons (TSH) und ist an der Regulation der Schilddrüsenhormonsynthese beteiligt. Es wirkt auch als Modulator des Haarwachstums. Es fördert die Dehnung des Haarschaftes, verlängert die Wachstumsphase des Haarzyklus (Anagen) und wirkt dessen Beendigung (Katagen) durch TGFB2 entgegen [TRH - Pro-Thyreotropin-Releasing-Hormon - Homo sapiens (Mensch) | UniProtKB | UniProt].
Die 7er und 8er Spalten-Serien sind in der Vorzeile Z.8117 gegeneinander um den Platzhalter-O“ in „7O8“ versetzt. Über die Spalte 8-8 besteht eine Verbindung und die am rechten Zahlenrand um 88-24 (Zeit)=“64“ gekürzte Zahl „24“ kann in der Nervenspalte 7“4“7 /7“2“7 als Bestandteil von Hormon (Mesch) „TRH – Pro“ =“24“2AS transportiert werden. In Z.8114 wird die Spaltenverlängerung „767“ addiert zu QS7+6+7=20, um einerseits die Ziffer „2“ für Hormon „TRH – Pro“ =242AS zu gewinnen und Calcium zu transportieren.
Zur Kontrolle muss nach Zusammenhängen gesucht wurden: Das Gehverhalten von Erwachsenen [Biological Process: adult walking behavior] wird durch die als Zählgröße markierte Schwerachse „84“ als 1_84_1 mit Schrittzähler als Zählgröße „11“ als Pendel zwischen Code und Z.Nr. zutreffend in Z.8“11“4_#160“767“51“84“11868 symbolisiert. Die Unterstützung des Haarwachstum wird bestätigt, in dem das Haarwuchsmittel "17-alpha-Estradiol (Alfatradiol)"=C18H24O2=108+24+16=148E [PharmaWiki - Alfatradiol] ebenfalls gespiegelt als „841“_1 als Wirkstoff erkennbar ist [Medikamente für den Haarwuchs - Hormone und Vitamine geben Kraft - FOCUS online]. Der Haarwuchs wird gestärkt, in dem die enthalte Schwerachse „84“ auch als Spalte 8-4 durch das Protein (Mensch) „TGFB2“=414AS verarbeitet wird [TGFB2 - Transforming growth factor beta-2 proprotein - Homo sapiens (Human) | UniProtKB | UniProt]. Die Schwerkaft=84 ist als Summe von Kreis=64 und Calcium=20 somit auch zur Regullation des Calciumspiegels geeignet. Dem Zahlenteil „41“ wird die Ziffer „4“ aus einer Addition angelagert: Spalte „1“- QS7+4=11=QS1+1=“2“_“1“ =Summe 1+2+1=“4“ für TGFB2(Mensch)=414AS. Am Zahlenrand wird die Zeit gezählt als 11_QS8+6+8=24 und die Randspalte QS 8+2=“10“ adressiert die mögliche Anzahl von Haarerneuerung über die Lebenszeit. Die Wirkung von Testosteron= C19H28O2=114+28+16=158E ist in Z.8114 ersichtlich, in dem die Schwerkraft=84 in „18411“ für das „stehenden Haar“ vom Testosteron verbraucht wird als „1“_QS1+4=“5“_“8“ für 158E.
Das Haarwuchsmittel „Minoxidil“= C9H15N5O=54+15+35+8=112E wurde ursprünglich gegen Bluthochdruck entwickelt. Minoxidil ist es Kalium-Kanal-Öffner, der in der Kopfhaut die Blutgefäße weitet und die Nährstoffversorgung der Haarfolikel verbessert. [Minoxidil – Wikipedia]. Im Haarwuchsmittel „Regaine Männer" sind 5 Prozent davon enthalten. „Minoxidil“=112E füllt die Z.-Nr. Z.8“112“, so dass sich die lange Null-Spalte 0-0-0… in Z.8+1+1+2=“12“_#QS1+6=“7“_“0“= Nullspalte wegen „Summe=12+7=19=Kalium den Kalium-Ionenkanal öffnet. Das Haarwuchsmittel „Alpecin Liquid“ enthält die Wirkstoffe Coffein=C8H10N4O2=48+10+28+16=102E [Coffein – Wikipedia], Zinksalze mit Zink=30E und Niacin=Nicotinsäure=C6H5NO2=36+5+7+16=64E [Nicotinsäure – Wikipedia]. Das Coffein=102E zieht sich über Z.8113 gespiegelt als „01“ über die Spalte 0-1 in die Zählgröße „11“ als QS1+1=2 für Coffein herunter. Weil die benachbarte Schwerachse=84_11 dadurch aktiviert wird, ist Coffein ein Haarwuchsmittel. Am linken Rand liegt die Nicotinsäure=64E in der Spalte 6-4 zur Bildung von Hormon (Mensch) „Pro-Thyreotropin Releasing“=242AS, bei dem die letzte Ziffer „2“ aus einer Summe=20 gebildet wird. Wird das Zink=30 doppelt zur Ziffer „60“ genutzt, dann wird die Ziffer "1“ am linken Zahlenrand nicht mitgelesen [1]_QS6+0+7+6=19=Kalium wirkt nunmehr offensichtlich analog zu „Minoxidil“als Kalium-Kanal-Öffner. Die Nährstoffversorgung wird über 24 Stunden verbessert. Das Haar-Tonikum „Alpecin-Forte“ wirkt durch Salicyl [Salicylsäure=C7H6O3=42+6+24=72E] gegen Schuppen und Thymol=C10H14O=60+14+8=82E gegen Entzündungen, um Haarausfall vorzubeugen. In Z. 8113 liegt die Haut=33 links neben der Spalte 4-8 (Schwerachse, gespiegelt), so dass die Spalte 33-1 für Ziffer QS3+3+1=“7“ beginnt. Die Spalte 4-8 wird übersprungen und QS1+1=“2“ für Salicylsäure=72E gezählt, so dass die Hautschuppen „33“ beseitigt werden. Für Thymol wird in der Gruppen-Spalte „44/84“ für Ziffer QS4+4=“8“ summiert und QS1+1=2 angelagert für Thymol=82E. Die Schwerachse, gespiegelt in der Spalte 4-8, verbleibt als Überschuss und symbolisiert den zu schützenden Haar-Schaft. Die Z.Nr.“8114“ ist im Code ähnlich in der Ziffernfolge „8411“ und verteilt die Wirkstoffe. Der Blut-Gerinnungshemmer „ASS (Acetylsalicylsäure)“=C9H8O4=54+8+32=94E summiert ähnlich Spalte 4-41 als QS=9 und bildet aus Spalte 012 /1 Ziffer QS1+0+1+2=“4“ für ASS=94E. Im Gegenlauf wird dabei das Blut=26 mit „2“_QS „5+0+1=6“ durchlaufen, wobei die von ASS umgangene Ziffer „5“=Struktur erfasst wird. Zur Herstellung von „ASS“ wird Essigsäureanhydrid=C4H6O3=24+6+24=54 als Zusatzstoff Salicylsäure benötigt, das gespiegelt „45“ enthalten ist
Weiterhin bewirkt das Hormon (Mensch) „Pro-Thyreotropin Releasing Hormon“=242AS eine negative Regulation der Glutamat-Sekretion. Glutamat“=C5H9NO4=6*5+9+7+8*4=30+16+32=78E. Im Zuge der Aktivierung der Ziffer „4“ im Hormon=2“4“2AS wird in der Zeile Z.8115 der Nerv=7 in 07“4“77“ beeinflusst. Dadurch kann die Dopplung der Zahl „77“ am rechten Zahlerand als 7_QS 4+1+2=7 nicht aktiviert werden, um in der Randspalte „8-7“ zur Vorzeile das Glutamat=78E auszuschütten.
Das Histamin=C5H9N3=40+9+21=70E wird mit der Nahrung aufgenommen, aber auch im Rahmen allergischer Reaktionen im Körper von den Mastzellen freigesetzt. Mastzellen gehören zu den Leukozyten. Die Immunzellen sind in vielen Körpergeweben enthalten (Schleimhäuten, Verdauungstrakt, Haut und Atemwegen). Auf bestimmte Auslöser hin werden beispielsweise Histamin, Tryptase, Prostaglandine oder Leukotriene freigesetzt. Die Mastzellaktivierungserkrankung (MCAD) ist eine Überreaktion. In Z.8115 ist Histamin=70E direkt lesbar und wird zum linken Zahlenrand als 07_70 gespiegelt. Die Urinprobe wird auf das Abbauprodukt N-Methylhistamin (1Methylhistamin)=C6H11N3=36+11+21=68E überprüft [1-Methylhistamin | C6H11N3 - PubChem (nih.gov)]. Die Zahlenränder von Z.-Nr. und Code werden zur Ziffer „8“ addiert als Z.8_“QS1+1+5=[7_#1]_“6“0“für 68E. Die Nullspalte ist der Entsorgungsweg. Im Zentralnervensystem wird N-Methylhistamin durch das Protein (Mensch) „Histamin-N-Methyltransferase“=292AS inaktiviert und dann weiter zu Nτ-Methylimidazolylessigsäure abgebaut [HNMT - Histamine N-methyltransferase - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein „HNMT“=292AS entsteht in Z.Nr.Z.8“11“4“/Z.8“11“5“ aus Zählgröße „11“ als 1+1=“2“ doppelt und der Randspalte QS4+5=“9“. In Gewebsproben werden Antikörper gegen CD25 überprüft. Der Rezeptor für Interleukin-2 ist an der Regulation der Immuntoleranz beteiligt, indem er die Aktivität regulatorischer T-Zellen (TREGs) steuert. TREGs unterdrücken die Aktivierung und Expansion von autoreaktiven T-Zellen. Protein (Mensch) „Interleukin-2-Rezeptor-Untereinheit alpha=272AS [IL2RA - Interleukin-2 receptor subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein bildet sich aus der Zählgröße „11“ in Z.Nr. Z.8“11“0 und Z.8“11“8 die Ziffern 1+1=“2“ und summiert in der Serie Zx11x dazwischen 7*“1“=“7“ für Interleukin-2-Rezeptor alpha=272AS.
Weiterhin bewirkt das Hormon (Mensch) „Pro-Thyreotropin Releasing Hormon“=242AS eine positive Regulation der Gamma-Aminobuttersäure-Sekretion. Die Gamma-Aminobuttersäure (GABA)=C4H9NO2=24+9+7+16=56E bildet die Randspalte „5-6“ in der Z.Nr. Z.811“5“/Z811“6“.
Weiterhin bewirkt das Hormon (Mensch) „Pro-Thyreotropin Releasing Hormon“=242AS eine positive Regulation der Insulin-Sekretion. Der Blutzuckerspiegel von Glucose=C6H12O6=36+12+48=96E [24 Atome] wird in der Bauchspeicheldrüse (Pankreas) von 2 Hormonen reguliert, wobei „Insulin“ den Blutzucker senkt und „Glucagon“ erhöht. Gluctose entsteht in der Leber aus Glykogen=C6H10O5=36+10+40=86E Zusätzlich wird der Blutzucker auch durch „Adrenalin“=C9H13NO3=54+13+7+24=98E und „Cortisol“=C21H30O5=126+30+30=186E erhöht.
Insulin (Mensch)=51AS. Abweichend beziehen sich 110AS auf das „Präproinsulin“ [24AS=Signalsequenz+B-Kette=30+2AS+C-Peptit=31+2AS+A-Kette=21; Summe=24+2+30+31+2+21=110AS; https://de.wikipedia.org/wiki/Insulin; „INS - Insulin - Homo sapiens (Mensch) | UniProtKB | UniProt“]. An den Ribosomen entsteht zunächst das Präproinsulin=110AS. Nach Faltung durch Disulfidbrücken werden das Signalpeptid und das C-Peptid abgespalten für „110-24-2-31-2“=51AS. In den Zellen bindet das Membranprotein (Mensch) „Insulinrezeptor (IR)“=2702 AS [Heterotetramer, aus je 2 α- und β-Untereinheiten (2*731+2*620)] ausgeschüttetes Insulin, damit es eine Wirkung enthalten [Insulinrezeptor – Wikipedia]. ; Abweichend Uniprot: 1382AS;1242AS; 99AS; 81AS [INSR - Insulin receptor - Homo sapiens (Human) | UniProtKB | UniProt; IRS1 - Insulinrezeptorsubstrat 1 - Homo sapiens (Mensch) | UniProtKB | UniProt; Insulinrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt; Insulin receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Glucagon(Mensch)=29AS [Glucagon – Wikipedia]. Glucagon-Vorläuferprotein(Mensch)=180AS [GCG - Pro-glucagon - Homo sapiens (Human) | UniProtKB | UniProt]. Aus dem Vorläuferprotein entstehen außer Glucagon 7 weitere Peptide [Glicentin, Glicentin-related polypeptide (GRPP), Oxyntomodulin, Glucagon-like peptide 1 (GLP-1, Inkretin-Hormon), Glucagon-like peptide 1 (7-37), Glucagon-like peptide 1 (7-36), Glucagon-like peptide 2 (GLP-2)]. Die 8 Proteine wirken am Protein (Mensch) „Glucagon-ähnlicher Peptid-1-Rezeptor“=463AS [GLP1R - Glucagon-like peptide-1 receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Die Gegenspieler Insulin/ Glucagon liegen räumlich zusammen, weil die Kettenlängen einen Zusammenhang, 180-29=(1)51 bzw. 180+110=29(0), erzeugen. Insulin=51AS liegt in Z.8112 am Zahlenrand als QS4+0+0+1=5 und kann die Ziffer „1“ entweder abwärts als Spalte 0-„1“[29] oder aufwärts als Spalte [29]“1“. In beiden Fällen liegt Glucagon(Mensch)=29AS seitlich, aber unabhängig direkt an. In Z.8111/Z.8119 wird Präproinsulin=110AS als Randspalte „1/01“gebildet. Glucagon-Vorläuferprotein=180AS liegt mit der Teil-Zahl „18 als „18“5[29]1“ und kann die Zahl 5 auf 2 Wegen mit und ohne Überlagerung von Insulin /Präproinsultion über Spalte QS 5+4=9 bilden und seitlich 0+0+1 oder vertikal 0+1 =10 summieren für eine „0“. Die überschüssige Ziffer „1“ aus „10“ kann hierfür in den Platzhalter-O verschoben werden. Das Protein „Insulinrezeptor (IR)“=2702AS nutzt nur die bereits aktivierten Ziffern: Randspalte, aufsteigend, QS1+1=“2“_“7_0“_QS2+9=11=QS1+1=“2“ für „2702“AS, wobei der Gegenspieler „Glucagon=29AS mit benutzt wird. In Zeile Z.8113 kann zusätzlich nochmals Insulin=51 ebenfalls direkt neben Glucagon=29AS als „501“29“ entstehen. Das Protein „Glucagon-ähnlicher Peptid-1-Rezeptor“=463AS benötigt die Zahl 5_0_1, um im Platzhalter QS5+Spalte[„4“]/“0“+1=6 für Ziffer „6“ zu bilden. Die Randspalte „1 /QS2+9=11“=QS=2 ergibt Ziffer „3“.
Die Glucose=96E wird zur Energieversorgung benötigt und muss zwecks Regulation zunächst einen Aktionsraum definieren. Mit der Z.Nr. Z.8116 kann „Glucose“ QS8+1=“9“_Zähler=1_“6“, avisiert werden. Statt der Randziffer 6 wird die Ziffer 1 als Spaltenreihe 1+1+1+1+1+1=6 gezählt, so dass die Glucose von Z.8111 bis Z.8116 vorhanden ist. Die Z.-Nr. repräsentiert die Leber, weil Glykogen=86E in der Leber aus Z.8_QS Spalte 1+1+1+1+1+1=6 als Vorprodukt analog zur Glucose entsteht. Die Erhöhung des Blutzuckers durch Cortisol“=C21H30O5=126+30+30=186E [Cortisol – Wikipedia] ist in dieser Zählweise gespiegelt mit der Zahl „816“ möglich. Für die Erhöhung durch „Adrenalin“=C9H13NO3=54+13+7+24=98E wird der Bereich um Z.Nr.Z.“81“17=QS8+1=“9“ und für die Ziffer „8“ 7x Ziffer „1“ plus Randziffer „1“ in Z.81“1“1“ addiert.
Der Code wird zur ersten Orientierung links dem Nervensystem und rechts der Bauchspeicheldrüse zugeordnet. Als trennende Spalte wird als Zufälligkeit die Zahlenfolge der Planck-Konstante [SI: 6,62607015E-34 J s] von Z.8109 bis Z.8113 erkannt als „6-6-26-07[ 0]15“. Der Spaltenrand trennt 7/15; dabei wird die fehlende Ziffer „0“ ersatzweise in der Folgezeile mit QS7+3=10 für die Ziffer 0(Null) unter die [fehlt „0“] gestellt, wobei die Potenz E-34 der Zahl 10 benachbart ist. Die Planck-Konstante liegt vor, wenn in der Spalte 6/[84]6 die Schwerachse=84 in der Konstante=„6,6..*10^34“ als ein Komma[,]=84 akzeptiert wird. Zum rechten Rand zieht sich eine aufsteigende Diagonale, die sich mit Proteinen füllt. Im Bereich von Z.8111 bis 8116 ergibt die lotrecht nach rechts abgeteilte Bauchspeicheldrüse mit der Winkelsumme=40+50+70+90=250° ein Defizit=360°-250°=110°, dass sich zufällig als Präproinsulin=110AS als Ausgleichsgröße am rechten Zeilenrand bildet. Zeile Z.8114 ist nicht beteiligt, enthält aber die Zählgröße „11“. Das Hormon „Pro-Thyreotropin Releasing Hormon“=242AS liegt links in der Spalte Nerv=767/747/727 und muss den Prozess steuern. Hierfür wird der Basiswinkel=90° betrachtet, der um Calcium=20 für Präproinsulin=110AS zu erhöhen ist. Im Hormon ist darin das Paket QS7+6+7=20=Calcium zwecks Bildung der Ziffer 2 bereits enthalten. Rechts in der Bauchspeicheldrüse liegt das Steuerungspaket in Z.8112 als QS5+5+3+7=20=Calcium links neben Insulin „QS4+0+0+1=“5“ und Randspalte 1-1 mit Ziffer „1“ für Insulin=51AS. Einer der beiden kreuzenden Wege muss nunmehr im Platzhalter-O über dem Basiswinkel=90° in Nerv=7“O“7 freigeschaltet werden. Horizontal liegt bis in die Hormonspalte für Protein=242AS die Zahl 477_O an und vertikal die Spalte 5-3-1-O. Zur Insulin-Steuerung wird der Rezeptor des Gegenspielers, das Protein (Mensch) „Glucagon Rezeptor“=477AS auf die Zahl 477 gesetzt [GCGR - Glucagon receptor - Homo sapiens (Human) | UniProtKB | UniProt]. Im Hormon=242AS liegt das Calcium-Paket in der Ziffer 2. Die restliche Zahl “24[2]“ kann von „Inosit“, dem sogenannten Muskelzucker C6H12O6=6+12+6=24 Atome besetzt werden, der als Cyclohexanhexol der Zuckerformel entspricht. Das Protein „Glucagon Rezeptor“=477AS hat über „Inosit“ eine Beziehung zum Calcium bei der Signalübertragung über ein „Phosphatidylinositol-Calcium-Second-Messenger-System“. Auf die Zahl 531 kann der „Insulinrezeptor (IR); Q2MKP2 • Q2MKP2_HUMAN=81AS als QS5+3=8_1 gesetzt werden [Insulinrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weil dieser nicht dem gewöhnlichen Insolin-Rezeptor=2702AS entspricht, kann die gemeinsam mit Insulin=51AS ins Blut abgegebene C-Preptid-Kette=31AS auf die Zahl 31 gesetzt. Die abgespaltete C-Peptid-Kette dient indirekt zur Messung von Insulin, weil sie langlebiger nachweisbar ist. Präproinsulin=110AS wurde somit zerlegt, um dieser rechtwinkligen Spur folgen zu können. Das Insulin=51 ist alternativ in Z.8114 direkt über dem Platzhalter „7O7“ lesbar. Nach dem Präproinsolin=110AS folgt die Zwischenstufe „Proinsolin“=86AS am Zeilenrand gespiegelt als 8“68“[Insulin - DocCheck Flexikon]. Hierzu werden die Signalsequenz abgespalten und 3 Disulfidbrücken [(3x Schwefel=16)=48_48=(3x Schwefel=16)] gebildet, die gespiegelt lesbar sind als „Insulin=“51“_3 Disulfidbrücken [84_Zählgröße=11_Spalte 8-4]¬_Proinsolin, gespiegelt= „68“. Weil Schwefel=16 darin für 3 Brücken multipliziert wird, kann vergleichbar im Basiswinkel=90° das Zink=30 somit 3-fach enthalten sein. In Lösung bildet Insulin mittels Wasserstoffbrücken Dimere, die in Anwesenheit von Zink „Hexamere“ bilden. Die Spiegelung „90_09“ ist mit 6-fach Zink das Bindungssymbol für ein Hexamer, wobei „90_0QS9+8+4+9=30=Zink_Struktur=55". Beim Parasiten kann mit dem Zinkfingerprotein (Plasmodium)=1689AS und dem Enzym (Plasmodium) „tryptophanyl-tRNA synthetase“=632AS eine Spur zur erhöhten Bildung von Tryptophan=108E bei hohem Insulinspiegel bis zum Präproinsulin gezogen werden. Beim Menschen ist die Zahl 98 im Zinkfingerprotein (Mensch) „CIZ1“=898AS enthalten, das für Ziffer „8“ mit QS2+4+1+1=8 aufsteigend zum Zeilenrand „868“ mit dem Proinsulin führt [CIZ1 - Cip1-interagierendes Zinkfingerprotein - Homo sapiens (Mensch) | UniProtKB | UniProt] Proinsulin=86E liegt gespiegelt als „68“ am Zahlenrand. Im Gleichgewicht „868 ist Glykogen=86 ein Vorprodukt der Glucose=96 [TOKEN-86/TOKEN-68].
In Z.8113 mit der Spalte [3]3-1-O=Platzhalter muss ein Eingangssignal bestimmen, ob bei Hunger das Glucagon oder bei erhöhtem Blutzucker das Insulin ausgeschüttet wird. Weil die Membran „33“ die Spalte tangiert und sich 2 gegensätzliche Protine „PYG“ und „GYS“ das Membransymbol 33 teilen müssen, kann immer nur 1 Protein temporär aktiv sein. Wird beim Hungersignal das „Glucagon“ ausgeschüttet, wird in der Leber das Protein (Mensch) „Glycogenphosphorylase (PYG)“=847AS aktiviert, das den Abbau von Glykogen zu Glucose einleitet [PYGL - Glykogenphosphorylase, Leberform - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Wird bei erhöhtem Blutzuckerspiegel das „Insulin“ ausgeschüttet, werden in der Leber Reaktionen zum Verbrauch von Glucose ausgelöst. Insbesondere wird das Protein (Mensch) „Glykogensynthase (GYS)“=731AS aktiviert, das den Glucose-Überschuss zum Aufbau des Energiespeichers „Glykogen“ nutzt [GYS1 - Glycogen [starch] synthase, muscle - Homo sapiens (Human) | UniProtKB | UniProt ]. Welches Signal wäre geeignet? Der TOKEN-86 ist (bei der Fliege Drosophila) die Nahrungsaufnahme als Richtung zum Kropf und TOKEN-68 der Reiz die Nahrung wieder hochzuwürgen. Beim Parasiten P. falciparum spiegelt sich die Richtung. Der TOKEN-86 [Glykogen=86E] ist insbesondere in Z.Nr. „8“_11_“6“ ablesbar. Das Proinsulin=86AS wird am Code-Zahlenrand als 8“68“ gespiegelt zum TOKEN-68 für eine Sättigung, d.h. ein Glucose-Überschuss mit überhöhtem Blutzuckerspiegel, wobei das Gleichgewichtssymbol „868“ als Zielfunktion enthalten ist. Als „TOKEN“ wird hier der Staffelstab zur Übergabe bei einer eingleisigen Eisenbahnstrecke verstanden. Die Steuerung erfolgt über das Nervensystem. Bei einem hohen Insulinspiegel wird die Aufnahme der Aminosäure Tryptophan=C11H12N2O2=108E gesteigert [Insulin – Wikipedia]. Das Präproinsulin=110AS beginnt am Zahlenrand Z.8111 mit der Ziffer „1“, die aufsteigend zum Trytophan=108E gehört. Nur bei Anlagerung von Gehirn=Nerv=7 in der Randspalte „8-80[7]-1“ kann Tryptophan vertikal und horizontal gezählt werden.
Ein Umschalter zwischen den Hormonen Insulin=51AS und Glucagon=29 [Glucagon – Wikipedia] ist mit dem Gen-Schalter ARX in den Alpha-Zellen vorhanden. Bei Diabetes TYP1 sind die Betazellen zerstört, so dass fehlendes Insulin durch Injektionen ersetzt wird. Wird der ARX-Schalter blockiert, können auch die Alpha-Zellen nunmehr Insulin produzieren. Im Tierversuch wurde dieser Effekt durch das Malariamedikament „Arteminisine“ nachgewiesen [Malaria-Medikament hilft gegen Diabetes - science.ORF.at]. Ob Medikamente beim Menschen bei Diabetes TYP 1 nachhaltig wirken, müsste eigentlich bei den Millionen Malaria-Patienten schon erprobt sein. Umgekehrt ist bekannt, dass Diabetes TYP 2 wesentlich häufiger bei einer Malaria-Erkrankung entsteht. Das Protein (Mensch) „Homöobox-Protein ARX“=562AS muss in der Membran-Messstrecke als Spalte durch Z.8113 ziehen, dabei bildet sich die Ziffer „6“ aus Membran=QS3+3=“6“. Die Ziffer „2“ kann direkt nicht gezählt werden, weil in der Schalter-Spalte „15/33/51“ die Ziffer „5“ doppelt als Membran-Kreuzung vorhanden ist, so dass Ziffer „2“ dabei ebenfalls kreuzend als QS1+1=2 lesbar ist [ARX - Homeobox protein ARX - Homo sapiens (Human) | UniProtKB | UniProt]. Das Zinkfingerprotein (Mensch) „Transkriptionsregulator ZNF711“ ist in 2 Versionen ein Konkurrent: ZNF711=394AS liegt oben rechts als Spalte 53/44 neben der Messstrecke, wobei 5+4=9 für 394AS zählen [ZNF711 - ZNF711 Protein - Homo sapiens (Mensch) | UniProtKB | UniProt). ZNF711=761AS liegt mit der Ziffer „7“ neben der Membran 33, die in Konkurrenz zu 3+3=6 summiert wird, so dass in der Spalte 3-1 die Ziffer „1“ angelagert für 761AS [ZNF711 - Zinc finger protein 711 - Homo sapiens (Human) | UniProtKB | UniProt]. Zink=30 liegt benachbart nicht als Zahl 30 vor, so dass sich beide Proteine addieren mit 394AS /QS=16 plus 761AS/QS=14 zur Summe QS=30=Zink. Insulin wird in kristalliner Form im Zink-Insulin-Komplex der Bauspeicheldrüse gespeichert. Außer Zink besteht Bedarf an Thiamin (Vitamin B1)=C12H17ClN4OS (Chlorid)=72+17+17+28+8+16=158E und Vitamin B12. Cobalamine bilden eine Vitamin-B12-Gruppe, zu der u.a Methylcobalamin (Vitamin B12)= C63H91CoN13O14P=378+91+27+91+112+16=715E gehört [Cobalamine – Wikipedia]. Bei einer Katalyse durch das Protein (Mensch)„Methioninsynthase“=1118AS wird gleichzeitig Methionin= C5H11NO2S=30+11+7+16+16=80E gebildet. Zink ist für eine Zinkionenbindung erforderlich [ Methioninsynthase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Beide Vitamine liegen am Eingang der Messstrecke in Z.8112. Methionin und Vitamin B12 sind gekoppelt als „80_715“. Das Vitamin B1 teilt sich mit Vitamin B12 die Zahl 15 und lagert QS5+3=8 an für 715E. Die folgenden Ziffer „7“ gehört zum Ligand „Cobalt“=27E für die aufsteigende „Methioninsynthase“=1118AS als Spalte „1“-„11“-QS5+3=8 für 1118AS, so dass die Ziffer „2“ für Cobalt „2“ 7 aus der noch nicht zerlegten Zählgröße „11“ mit QS1+1=2 stammt.
Der Blutzucker kann mit diversen Laser-Messgeräten bestimmt werden. Beim Test nach Warburg kommt eine Wellenlänge von 340nm in Betracht, weil sich optischen Eigenschaften von NADH und NADPH durch eine spezifische Lichtabsorption bei einer Wellenlänge von 340 nm (Absorptionsmaximum) von denen des NAD+ und NADP+ (Nicotinsäureamid-adenin-dinucleotid) unterscheiden [optischer Test - Lexikon der Biochemie (spektrum.de)]. NAD=346E, oxidierte Form „NAD+“=347E; reduzierte Form „NADH“=348E [Nicotinamidadenindinukleotid – Wikipedia]. Der steigende Blutzuckerspiegel ist bei ca. 4 mmol/l ein Sekretionsreiz für Insulin. Die Glucose-Moleküle werden über Glucosetransporter transportiert und im weiteren Prozess verstoffwechselt. Die Glucose liegt in den Z.-Nr. 8111 bis 8116, so dass darin auch die Glucosetransporter erkennbar sind: SLC2A1/Glut1=492AS im Bereich Z.8“1“1“1“ bis Z.8116 in Wellenform mit Ziffer „1“ als Spalte 1-1-1-1 für Ziffer „4“, weiter 1-1 plus Wende 1-1-1-1-1-1 plus Randziffer „1“ für Ziffer „9“ sowie angelagert Randziffer „2“ für 492AS [SLC2A1 - Gelöste Trägerfamilie 2, erleichterter Glukosetransporter Mitglied 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. SLC2A2/Glut2=524AS [maßgeblicher Transporter] in Spalte Z.81“14“/Z.81“15“ mit QS1+1=2 für 524AS [SLC2A2 - Trägerfamilie 2 für gelöste Stoffe, erleichtertes Glukosetransportermitglied 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. SLC2A3/Glut3=496AS als Ring mit Start/Ziel in Z.8116. Umlaufend Ziffer „1“ 6-fach als Spalte 1-1-1-1-1-1, Randziffer „1+1=2“ und zurück in Spalte 1-1 mit Ziffer „1“ für Summe 6+2+1=Ziffer „9“. Fortsetzung in Spalte 1-1-1-1 für Ziffer „4“ und Ziffer „6“ seitlich anlagern für 496AS [SLC2A3 - Gelöste Trägerfamilie 2, erleichtertes Glukosetransporter-Mitglied 3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. SLC2A4/Glut4=509AS zählt in Z.8112 bis Z.8116 den Block „811“ mit 5x8=40 plus 5x QS1+1=2 = 40+10=“50“ und zählt umlaufend die „Anzahl“ von 9 Ziffern als Ziffer 9 für 509AS. Davon enthält die Z.Nr. Z.8111 die Anzahl =4 und die Randspalte „2-3-4-5-6“ die Anzahl=5 für Summe=4+5=Ziffer „9“ [SLC2A4 - Gelöste Trägerfamilie 2, erleichtertes Glukosetransporter-Mitglied 4 - Homo sapiens (Mensch) | UniProtKB | UniProt].
Typ-1-Diabetes: Der Parasit codiert die Glycin-Transfer-RNA in Z.810“4“#QS6+1+0=“7“. Dort kann auch der Mensch seine Glycin-Transfer-RNA (Mensch)=745AS mit der Ziffer „7“ im Code und „45“ in der Z.-Nrn. Randspalte „4-5“ entwickeln [GARS1 - Glycin-tRNA-Ligase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der Mensch benötigt zur Bildung der Mikrotubuli das Protein (Mensch) Tubulin-alpha=451AS. Das Tubulin übernimmt in der Randspalte die Zahl „45“ und lagert QS1+0=1 für 451AS an [TUBA1A - Tubulin alpha-1A Kette - Homo sapiens (Mensch) | UniProtKB | UniProt]. In einer Glycin-Matrix in den Z.-Nrn. bis Zeile 8109 ist es die obere rechte Ecke. Das Mikrotubuli-assoziierte Protein (Mensch) „Gephyrin (GPHN)“=736AS muss mit nur 3 Ziffern eine Matrix über 6 Zeilen ziehen, wobei Tubulin die Zählung unterstützt. Gephyrin bindet an die subsynaptischen Mikrotubuli im Gehirn. Es werden hemmende Synapsen beeinflusst, so dass ein Zusammenhang über GABA-Rezeptoren mit der Senkung des Blutzuckerspiegels besteht [GPHN - Gephyrin - Homo sapiens (Human) | UniProtKB | UniProt]. Im Unterschied zum folgenden Glucose-Bereich liegt in den Z.Nrn. statt Zählgröße „11“ die Zahl „10“. Damit in der Glycin-Matrix „Glycin“=C2H5NO2=12+5+7+16=40E mit 4*10=40=Glycin adressiert werden kann, müssen die ersten beiden Matrix-Zeilen funktionell besetzt werden. Statt der Rechtsdrehung zum Tubulin wird bei einer Links-Drehung mit Ziffer „4“ und Spalte „QS1+1“=Ziffer 2 für Molybdän=42E gelesen. Das Protein „Gephyrin“ katalysiert biologische Prozesse an denen das Molybdän als Coautor beteiligt ist. Glycin Rezeptoren sind Liganden gesteuerte Chlorid Kanäle. In der Glycin-Matrix zieht sich die Spalte „0-0…“ als Chlorid-Kanal, der durch externes Glycin geöffnet werden kann. Der Chlorid-Kanal der oberen beiden Zeilen ab Zeile 8104 wird durch Turin= C2H7NO3S=12+7+7+24+16=66 und Beta-Alanin=C3H7NO2=18+7+7+16=48 geöffnet. Beta-Alanin zählt die Ziffer „4“ und dreht über die Randspalte „4-5“herunter und aufsteigend über die Spalte 1-1 zurück, überspringt die eigene Ziffer „4“ zur Ziffer 1 im Code als QS5+1+1+1=“8“ für Beta-Alanin=48. Im Code schließt die Spalte „6“0/“6“0 für Turin=66 an. Der Chlorid-Kanal bildet sich aufgrund der Serie Z.8“1“0x#QS1+6+0=7 für Chlor=17. Die Code-Serie „60°“ ergibt mit 6*60°=360° eine geschlossene Winkelsumme. Die restliche Winkelsumme ergibt mit 40[0]/60_90/90_40 die Summe=320°, die durch externes Glycin=40E in der Glycin-Matrix für 360° aufgefüllt wird. Zum Protein=“Glycin Rezeptor (GLYR)“ sind im 6-zeiligen Glycin-Bereich 3 Proteine vorhanden. Für die Bedeutung als Chlorid Kanäle ist Chlor=17 2x im Code und 1x mittig in Z.Nr.Z.8“107“ mit einer Kanalanbindung „0“ enthalten. In Z.8104 zieht sich Protein (Mensch) „GLRA1“=457AS über 3 Zeilen. Ziffer „4“ aus Glycin=40, Ziffer „5“als QS=5 summiert über die Spalte „0-11-21“ und aufsteigend mit der Randziffer „7“ aus Chlor=17 für 457AS. Ergänzend ist eine Chlorspalte gespiegelt „7-1“ vorhanden [GLRA1 - Glycin Recep Tor Sub Unit alpha-1 - Homo sapiens (Human) | UniProtKB | UniProt]. Protein (Mensch) „GLRB“=497AS beginnt in Z.8107 mit der Ziffer „4“. Nach links wäre ein Weg über die Zahl 3333 möglich. Weil sich die beiden Proteine aber nicht treffen sollen, wird nach rechts in der Spalte „08/17“ QS1+0+8=“9“ und Ziffer „7“ aus Chlor=17 gewonnen für 497AS [GLRB - Glycine receptor subunit beta - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein (Mensch) „GLRA3“=464AS beginnt in Z.8108 mit den Ziffer 4 und ergänzt in der Spalte in der Spalte 4-64 die Zahl 64 für 464AS. Von Chlor=17 zieht sich eine ergänzende Chlor-Spalte „1-7“ [GLRA3 - Glycinrezeptor-Untereinheit alpha-3 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Chlorid-Kanäle erweitern scheinbar die Möglichkeiten von Medikamenten zur Steuerung im Nervensystem. Zur Senkung des Blutzuckerspiegeln folgt das Medikament Artemether=C16H26O5=96+26+40=162E [Artemether – Wikipedia] einer günstigen Spur. Es nimmt am Zahlenrand Ziffer „1“ aus Präproinsulin auf, enthält absteigend das Insulin=51 in QS5+0+1=6 und bildet QS1+1=2 neben dem Gleichgewicht „868“ am Zahlenrand von Z.8114. Im Kombinationsmedikament „Riamet (Artemether/Lumefantrin)“ kann das Lumefantrin=C30H32Cl3NO=180+32+51+7+8=278E [Lumefantrin – Wikipedia] mit „2“_QS0+0+1+5+0+1=“7“ in Spalte 1-8 die Ziffer „8“ in „8“68 binden, so dass am Zahlenrand Proinsulin=86, gespiegelt als „68“ erreicht wird.
Das Protein (Mensch) „Pro-Glucagon-Rezeptor“=180AS [GCG - Pro-glucagon - Homo sapiens (Human) | UniProtKB | UniProt] bildet mit der Ziffer „0“ in der Spalte 18/0 die Ziffernfolge „018“ für 180AS in Kombination mit dem Protein (Mensch) „Glucagon-Rezeptor“=477AS [GCGR - Glucagon receptor - Homo sapiens (Human) | UniProtKB | UniProt], das links neben dem Platzhalter-O als 477_O direkt lesbar ist. Das Protein (Mensch) „Insulinrezeptor“=81AS besetzt die Messspalte „5-3-1“ als QS5+3=8_1 für 81AS [Insulinrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt].
Eine Beziehung zwischen Insulin und Blut=26 besteht über eine Sonderform des Hämoglobins. Das HbA1c=142AS wird aufgrund einer zu hohen Blutzuckerkonzentration nicht-enzymatisch glykiert und informiert als Zuckergedächtnis über den Langzeitzucker über 120Tage entsprechend der Lebensdauer von Erythrozyten. Es wird die Zahl 120 mit der Zeitbasis 24 benötigt. Das „HbA1c“ bindet an „Hämopressin“ [HBA1 - Hemoglobin subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Hämopressin=C53H77N13O12=318+77+91+96=582E [Hämopressin – Wikipedia]. HbA1c=142AS beginnt mit der Ziffer „1“ in der Folgezeile am Zahlenrand „4001“, so dass sich die Ziffer „4“ anschließt. Die Ziffer „2“ liegt rechts versetzt vom Hämopressin und nicht lotrecht als Spalte über der Ziffer „4“. Aufgrund der Bindung ergibt sich die zulässige Ziffernfolge „421“ für HbA=142AS. Über diesen Versatz wird die Zeitbasis 24 gebildet. Die 120 Tage steigen in der Spalte 0“0“/“12“ als 120Tage auf. Die Zellmembran 33 ist dabei in Z.8113 als “33“44“50“12“ funktionell enthalten. Insulin=51AS ist als „501“ mit den 120Tagen und der Gruppe 44 kombiniert.
tRNA-Gen lfd.Nr.41: Aminosäure „Asparagin-Variante 1“=C4H8N2O3=24+8+14+24=70E ist direkt als „70“ lesbar. „Asparagin“ ist ein Derivat der Aminosäure „Asparaginsäure“ und trägt statt der Carboxygruppe (-COOH) eine Säureamidgruppe (CO NH2). Das bei der ATP-Bindung entstehende Adenosinmonophosphat (AMP)=C10H14N5O7P=167E kann nur einen Platzhalter „O“ als „#16_“O“_70=Asparagin“ umklammert, so dass Zusatzinformation folgen oder im Funktionspartner Asparagin-Var.2 zu finden sind. Die Ziffer „9“ ist mehrfach für OH=8+1=9 und zweifacht NH2=7+2=9 vorhanden. Die Nahrungsquelle, Erythrozyt=26, wird seitlich=9_“26“_9 mit QS9+2+6+9=“26“ als Dopplung markiert. Am rechten Zahlenrand liegt eine Spalte 4-4 für eine Gruppe 44 mit dem Funktionspartner Var.2. Für ATP=551AS ist eine Spalte "5-O“=Platzhalter vorhanden. In „Var.2“ ist keine „ATP-Ziffer-„5“ vorhanden, kann aber aus Teilen addiert werden, wenn die Ziffer „4“ aus der Gruppen-Spalte „4-4“ am Zahlenrand nicht mitzählt, d.h. die Gruppe „44“ ist das gemeinsame Energiepaket 25+25=“50“ aus QS0+6+8+8+3+0=25 plus QS0+7+8+8+2+[4]=25 (ohne 4). Winkelsummen-Defizit im Kreislauf 360°= 360° - (60+70+80=210)-(60+30+30=120)=30°. Der Funktionspartner kann statt 30° scheinbar nur 29° als „7+8+8+2+4=29“ liefern. Mit der Zeitbasis „24“ kann die Zahl „30“ als Zeitzähler durch „1“ Aktion gewonnen werden. Aus der Z.-Nr.-Zählgröße „11“ kann nach der Ziffer „1“ für das Zinkfingerprotein nunmehr als Ergänzung für 29+1=30° für die Winkelsumme=360° gezählt werden. Für die Dopplung „Zink=30_30“ fordert jede Zeile ein Zinkfingerprotein an. „Var.1“ fordert das Zinkfingerprotein=1776AS [Zinc finger protein - Plasmodium falciparum (isolate Palo Alto / Uganda) | UniProtKB | UniProt]: Aus der Zählgröße „11“ der Z.-Nr.81“1“7 wird die Ziffer „1“ entnommen. Mit #QS1+6=“7“_0_ „7“ wird über die Spalte „7-6“ die Ziffer „6“ zur Bindung mit dem Funktionspartner gefunden. „Var.2“ fordert das Zinkfingerprotein=1733AS [C3H1-type domain-containing protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]: Aus der Zählgröße „11“ der Z.-Nr.81“1“8 wird die Ziffer „1“ entnommen. Die Einbindestelle [„6 (aus Var1.)=EXTRA] wird umklammert und „30_30=Zink“ gebunden als Z.xx“1“[ ]_#„QS 1+6=7 [ ] _“303“. Das Enzym „Asparagin-tRNA-Ligase“=721AS verbindet die Zeilen.Nrn. beginnend mit der Ziffer „7“ und QS1+1=“2“. Die Ziffer „1“ liegt in der Spalte „1-1“ [Asparagin - tRNA-Ligase - Plasmodium falciparum (Isolat 7G8) | UniProtKB | UniPro]: Epi.Ref_Rhesus.Z.81“1“7#“160“70“80995“9269“4“.
tRNA-Gen lfd.Nr.42: Aminosäure „Asparagin-Variante 2“=C4H8N2O3=70E. Mit dem Funktionspartner „Var.1“ wird eine Randspalte 4-4 als Gruppe „44“ gebildet und gemeinsam eine Winkelsumme=360° als Kreislauf zur Energieversorgung mit ATP=551AS erzeugt. Es werden mit 30_30=Zink zwei Zinkfingerproteine angefordert, von denen das Zinkfingerprotein=1733AS in der Zeilennummer beginnt, die Einbindung aus dem 2. Zinkfingerprotein aus der Vorzeile einkoppelt und Zink=30_30 aufnimmt. „Asparagin“=70E ist nicht direkt lesbar. Wegen der markierten Zählgröße Z.[8]“11“[8] kann in #“QS1+6=“7_0“_07_[88] das Asparagin=70E codiert werden. AMP-Info=“16[ ]7“ klammert [QS6+0+6+8+8+3+0+3+0=“34“=QS3+4=7=Form. Abzüglich der beiden Zinkfingerproteine=34-3-3=28=Wasser wird die hydrophile Eigenschaft von Asparagin erzeugt wird [Gegenteil: Am Rand herausgeschoben wäre hydrophob].Das Enzym „Asparagin-tRNA-Ligase“=610AS verbindet die Code mit der Zeilen.Nr. beginnend mit der Ziffer „6“ und Ziffer „1“. Die hydrophile Eigenschaft wird symbolisiert, in dem die Ziffer „0“ aus QS1+1=2_8= Wasser H2O=1“0“ entnommen wird, wobei der Rest H=1 verwertet werden kann. [Asparagin - tRNA-Ligase - Plasmodium falciparum (Isolat NF54) | UniProtKB | UniProt]: Epi.Ref_Rhesus.Z.81“1“8#“160“688303“07“8824.
Das Breitbandantibiotikum „Doxycyclin“ ist aufgrund seiner Membrangängigkeit zur Therapie von intrazellulär lokalisierten Erregern geeignet. „Doxycyclin“ wird zur Behandlung bakterieller Infektionskrankheiten wie „Akne und Rosazea“ und zur medikamentösen Prophylaxe gegen „Malaria tropica“ eingesetzt [Tropeninstitut - Schutz vor Malaria - Medikamentöse Prophylaxe]. Die Wirkung beruht auf einer Hemmung der bakteriellen Proteinsynthese, indem die Bindung von „Aminoacyl-tRNA“ an die 30S-Untereinheit des bakteriellen Ribosoms verhindert wird und somit ähnlich wirkend bei Plasmodium. Doxycyclin“=C22H24N2O8=132+24+14+64=234E [Doxycyclin – Wikipedia]. Nachfolgend Teil „A“ Parasit [Das Medikament wirkt auf die „Aminoacyl-tRNA von P. faciparum] und Teil „B“/Mensch [Doppeldeutig treffen dieselben Zeilen das Herz-Kreislauf-System].
Teil A/Parasit: Das Enzym „Aminoacyl-tRNA-Hydrolase“=123 AS zählt sich in der Zeilen-Nr. Z.81“1“9 / Z.81“2“0/ Z.81“21“ [Aminoacyl-tRNA-Hydrolase - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]. Die Enzym-Modifikaltion „Aminoacyl-tRNA-Hydrolase“=189 AS zählt den Rest in der Zifferfolge „81_9“ in Nr. Z.“81“[1]“9“[ Aminoacyl-tRNA-Hydrolase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Hydrolasen sind Enzyme, die Ester, Ether, Peptide, Glycoside, Säureanhydride oder C-C-Bindungen in reversibler Reaktion hydrolytisch spalten [Hydrolasen – Wikipedia]. Die Zeile Z.8117 wird der Aminosäure „Asparagin“ zugeordnet, enthält aber auch Lysin=80E. Erst wenn Lysin vorhanden ist, kann in der Folge Hydroxylysin=C6H14N2O3=36+14+14+24=88E entstehen [Hydroxylysin – Wikipedia]. Kollagen enthält hohe Anteile von Prolin=62E/Glycin=40E benötigt aber auch „Hydroxyprolin und Hydroxylysin“ zur Quervernetzung einer stabilen Kollagenmatrix [Kollagen - DocCheck Flexikon]. In Z.8118 wird das Kollagen in der Haut als Oberflächenmembran „33“ mit „303“ adressiert. Hydroxylysin=88E flankiert die Membran „88_303_88“. Das Hydroxyprolin=C5H9NO3=30+9+7+18=64E summiert die Membran QS3030=“6“ und liest die Ziffer „4“ in der Spalte 0-4 zur Folgezeile. Das ist notwendig, um eine zweischichtige Membran zu bilden. Hierfür werden die auslaufende Serie Z.x“11“x über 2 Zeilen doppelt gezählt und mit der Zählgröße „11“ im Code der Zeile Z. 8119 zu 11+11+11=33_44=Gruppe addiert. Das Medikament „Doxycyclin“=234E zählt in Z.8118 membrangängig mittig im Code die Ziffer „3“ in (3)0“3“0 und lagert über die Null-Spalte zur Folgezeile links QS1+1=2 und rechts Ziffer „4“ an für Doxycyclin=234E. Die zweite Membran-Ziffer „3“ wird als Spalte 3-5 zu Q3+5=8 in summiert, um im Code eine Dopplung zur Z-Nr. 8119 zu bewirken. Doxycyclin=234E wird dann in der Zeilennummer fallend beginnend mit QS1+1=2 gezählt. Doxycyclin wird in der Leber an die „Glucuronsäure“=C6H10O7=36+10+56=102E gekoppelt und mit der Galle ausgeschieden. Die Glucuronsäure wird in der letzten Z.-Nr. Z.8121 in Randspalte „20-1“ aufsteigend gezählt.
Als 1. Wirkmechanismus wird in Z.8118 mit der Zahl „30“ das direkt lesbare Protein „Homöobox-ähnliches Protein (HDP1)“=3078AS blockiert [HDP1 - Homeobox-like protein HDP1 - Plasmodium falciparum (isolate NF54) | UniProtKB | UniProt]. Das Protein „Transkriptionsregulator HDP1“ steuert die Ausdehnung des inneren Membrankomplexes während der frühen sexuellen Differenzierung von Malariaparasiten und bewirkt die Sichelform von P. falciparum. Der 2. Wirkmechanismus hemmt die Proteinsynthese, wodurch lebensnotwendige Eiweißbausteinen nicht herstellbar sind. Über die Spalte (3)0(3)-„1“ wird das Protein „D-Aminoacyl-tRNA-Deacylase=164AS blockiert [D-Aminoacyl-tRNA-Deacylase - Plasmodium falciparum (Isolat 7G8) | UniProtKB | UniProt]. „Deacetylasen“ sind Enzyme, die Acetylgruppen von Proteinen abspalten (Deacetylierung) [Deacetylase - DocCheck Flexikon]. Sialinsäure=C11H19NO9=66+19+7+72=164E und Heparansulfat=(C26H40N2O36S5)n=156+40+14+288+80=578E/Baustein sind ebenfalls ablesbar und vermitteln die Bindung des Enzyms „EBA-140“ =616 AS, damit der Parasit in den Erythrozyten eindringen kann [eba-140 - EBA-140 - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt; „Plasmodium falciparum BAEBL bindet an Heparansulfat-Proteoglykane auf der menschlichen Erythrozytenoberfläche - PMC (nih.gov)“]. P. falciparum kennt den Code des menschlichen Blutkreislaufs, weil er vor Entdeckung durch Makrophagen geschützt ist. Der Blutkreislauf zieht links eine Venen-8-Spalte und rechts eine Arterien-9-Spalte, so dass das Enzym „EBA-140“=616AS als Mittelspalte mitzieht: Ziffer „6“ als QS 3+0+3=“6“ mit O(Null) als Kreislauf. In der Enzym-Spalte „(3)0(3)-1-2-4 folgen die Ziffern „1“ und QS2+4=“6“ für Enzym „EBA-140“=616AS.
Teil „B“/Mensch: In Zeile Z.8118 sind alternativ statt einer Membran „3030“ mit 30+30=60 Herzschläge/min zählbar. Es ist keine Zeitbasis 60, weil die Zeit=24 als Tagesrhythmus den rechten Zahlenrand bildet. Das Herz schlägt durch einen biochemischen Prozess im Ruhezustand 60 bis 80-mal pro Minute. Die variablen 20 Zusatz-Schläge (Calcium=20) werden über einen 3-zeiligen Ring erzeugt, der durch die beiden Nullen zwecks Addition zieht: Spalte fallend 0-1-2/ Verbindung=4/ Spalte steigend 0-4-6/ Verbindung=3 mit Ringsumme=QS0+1+2+4+0+4+6+3=20 für 60 bis 80 Herzschläge/min. Diese Calcium-Zählung ist notwendig, um in der Zeilennummer Magnesium von Calcium unterscheiden zu können. Das Herz-Aktionspotential wird durch 4 Mineralstoffe als geladene Teilchen (Ionen) gesteuert, die jeweils in den 4 restlichen Gen-Code-Zeilennummern enthalten sind: Natrium=Z.8“11“8; Kalium=Z.81“19“; Calcium=Z.81“20“; Magnesium=8“12“1. In der Episode „Blut“ ist der Herzschlag somit inclusive enthalten. Der Code enthält die Venenspalte „8-8-8-8“ und die Arterienspalte „9-9-QS8+1=9“. Der Herzschlag wird im Sinusknoten erzeugt und als Erregungsleitung über Vorhofkammerknoten (AV-Knoten), HIS-Bündel, durch die isolierte Platte des Herzskeletts, über die die Purkinje-Fasern zum Kammermyokard geleitet. Dadurch erfolgt die gleichmäßige Kontraktion zuerst in den Vorhöfen und dann in den Herzkammern. Im Ruhezustand ist das Innere der Zelle negativ geladen, das Äußere positiv. Die dabei entstehende Spannung beträgt ca. -90 mV und wird als Ruhepotenzial bezeichnet. Wird die Zelle durch einen Impuls erregt, bricht die Spannung zusammen und positiv geladene Ionen strömen ein. Das Innere der Zelle wird positiv und es entsteht eine Spannung von ca. +20 bis +30 mV. Durch erneute Umverteilung der Ionen über spezielle Kanäle stellt die Zelle das Ruhepotenzial wieder her. Die Potenzialänderung von insgesamt ca. 120 mV wird als Aktionspotenzial bezeichnet, es erzeugt das Signal für den Herzschlag [siehe: https://www.deutschesarztportal.de/download/public/mfa-fobi/rp_mfa-fortbildung_herzgesundheit.pdf].
Kaliumkanäle (Mensch): Der Mensch nutzt das Kalium-Kanalprotein „KCNH2“=67AS, um die lange Nullspalte in der Serie #QS1+6=7_“0“_6 als Kanal zu nutzen. [KCNH2 - Kaliumkanal HERG - Homo sapiens (Mensch) | UniProtKB | UniProt]. Der hERG-Kanal (engl. human Ether-a-go-go Related Gene) ist im Herzmuskel lokalisiert [siehe: „Charakterisierung der Aktivität und Inhibition des rekombinanten, spannungsgesteuerten Protonenkanals HV1: Funktionelle Rekonstitution in unilamellare Vesikel“; B.Gerdes; Diss. 2017, Uni Göttingen]. Von Z.8115 bis Z.8121 zieht ein innerer Kalium-Kanal fallend in der Ziffer „0(Null)“ 7_“0“_7 zur 9_“00“_9. Die Ziffern „00“ erzeugen einen Spaltenwechsel zur Spalte „QS0+9+3+1+4+2=19=Kalium“. Zwei Kalium-Kanalproteine kreuzen die Spalte: Das Kalium-Kanalprotein „KCNJ1“=372AS nimmt in Z.8118 die Ziffer „3“ auf und zieht über 0-(5)1(1)-2 für KCNJ1=372AS herunter [KCNJ1 - Potassium inwardly-rectifying channel, subfamily J, member 1, isoform CRA_a - Homo sapiens (Human) | UniProtKB | UniProt]. Das Kalium-Kanalprotein „KCNU1“=1149AS startet neben der benachbarten Membran-Null 3030_“7“ aus der Spalte QS7+4=11, lagert die Ziffer „4“ an, und zählt die Ziffern QS5+1+1=7 und „2“ aus KCNJ17 als 7+2=“9“ für KCNU1=1149 AS zusammen [KCNU1 - Potassium channel subfamily U member 1 - Homo sapiens (Human) | UniProtKB | UniProt].
Calcium- und Magnesiumkanal „TRPM7“ (Mensch) =1865AS nimmt die Ziffer „5“ am Zahlenrand der Magnesium-Zeile Z.8121 auf und bildet am Rand der Calcium-Zeile Z.9120 QS0+5+1=“6“. Weiter in der Randspalte Zahl 44 als QS4+4=8. Die Ziffer „5“ blockiert die Anlagerung der Ziffer „1“, so dass mittels Kunstgriff eine Dopplung als Kanalprotein für 2 Atome die Lösung ist. Hierzu wird die Ziffer „6“ über die Spalte 5-0 doppelt nochmals in der Doppelgruppe „11“_44_QS1+5=“6“_44 gelesen, so dass die Zählgröße „11“ ebenfalls die Ziffer „1“ doppelt für 2 verschiedene Atome erzeugt [TRPM7 - Transiente Rezeptorpotential-Kationenkanal-Unterfamilie M Mitglied 7 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Für den Doppelkanal wird Calcium=20 und Magnesium=12 zu „32“= 4-fach Ziffer „8“ addiert. Der 32er Mischkanal steigt neben der Zählgröße „11“ über die Spalte (88) QS3+5=8 auf. Die anliegende Zahl „88“ ergibt einen Spaltenwechsel, so dass in Z.8117 nochmals die Ziffer 0“8“0 als 32er Mischkanal symbolisiert wird, der als Randspalte in der letzten Zeile startet.
Natrium-Kanalprotein „SCNM1“ (Mensch)=230AS. Die Metallionenbindung an Zink=30 ist bereits ablesbar. Das Zink lagert sich in Z.8118 als Zink=30_30 an, wenn das Kanalprotein über die Spalte 03/QS1+1=3 aufsteigt [SCNM1 - Sodium channel modifier 1 - Homo sapiens (Human) | UniProtKB | UniProt]. Natrium-Kanalprotein (Mensch)=391AS [Sodium channel protein - Homo sapiens (Human) | UniProtKB | UniProt]. In der Natrium-Zeile Z.8118 wird die Ziffer 3 als Kanal 030 aufgenommen und die die Ziffer 9 aufsteigend angelagert, um über den Kanalweg „Spalte 1-0-009-3“ die Ziffer 1 zu finden. Natrium-Kanalprotein „SCN3A“ (Mensch)=2000AS [SCN3A - Sodium channel protein type 3 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein trägt zur Regulierung der Serotonin/5-Hydroxytryptamin-Freisetzung bei: Serotonin= C10H12N2O =60+12+14+8=94E liegt in Z.8121 lesbar vor und ist mit dem Rezeptor =422 Über die Spalte 24/42 verbunden [5HT1A - 5-Hydroxytryptamin-Rezeptor 1A - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Kanalprotein beginnt links neben Serotonin=94 mit QS 2+8=10 und addiert über die Spalte 4-2 in Z.8120 QS6+4=10 zur Summe 20. Damit wird die lange Null-Spalte in der Serie 606 erreicht, um aufsteigend 2 Nullen für 2000AS anzulagern. Natrium-Kanalprotein „SCN9A“ (Mensch)=1988AS. Es liegt eine Natrium-Ionenbindung vor, so dass das Protein die Ziffer „1“ in der Zählgröße 11=Natrium gewinnt, QS 4+4+1=9 anlagert und aufsteigend in der Spalte 8-1 die Zahl 88 ergänzt für 1988AS. Weil die restliche Ziffer 1 der Zählgröße 11 eine Funktion benötigt, zieht der Kanal als „Tetrodotoxin-sensitive Na-Kanal-Isoform“ bis zur letzten Zeile weiter. Tetrodotoxin=C11H17N3O8=66+17+21+24=128E enthält die Ziffer „1“, so dass aus der Spalte 24/42 die Ziffer „2“ und Diagonal Ziffer QS4+4=8 ergänzt werden [SCN9A - Sodium channel protein type 9 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Natrium-Kanalprotein „SCN4A“(Mensch)=1836AS [SCN4A - Sodium channel protein type 4 subunit alpha - Homo sapiens (Human) | UniProtKB | UniProt]. Die Spalte „3030/5“1“14“ wird als Ring durchlaufen, so dass das Natrium=“1“1 als Start und Ziel mit der Ziffer „1“ doppelt gezählt wird. Dieser Sonderfall ist vermutlich bei der Muskelkontraktion und dem Transport von Natriumionen nützlich. Start in Z.8119 mit Ziffer „1“ als “1“_links steigend über Spalte QS3+5=“8“_QS0+3=“3“_ fallend über Spalte QS 0+4=4 plus links QS1+1=2 als Summe 4+2=“6“, wobei Ziffer „1“ als Start und Ziel doppelt gezählt werden. Im Prinzip kann der Code zur Z.Nr. Z.8_11_9 ähnlich sein, so dass eine Umschaltung auch als Vene „8“ /Arterie „9“ vorstellbar ist.
Der Herzschlag „1“ und die Zeitbasis=60 sind als Serie #1_60 stets vorhanden. Speziell kann der Ruhezustand aufgrund der Zählgröße „11“ aus 60+30=-90mV zum Ruhepotential addiert werden. Die Folge 30“30“ bildet aufgrund der trennenden Membran „33“ als „3_O=Kreislauf_3“ das absolute Aktionspotential=90+30=120mV, das in der folgenden Zeilennummer Z.8“120“ angezeigt wird. Unter Stress werden Füße und Hände weniger und die Muskeln nicht mehr durchblutet. Der Körper schüttet dann die Hormone „Cortisol“=C21H30O5=126+30+30=186E [Z.8120 in Randspalte steigend „1“_QS4+4=“8“_rechts herunter QS2+4=“6“] und „Aldosteron“= C21H28O5=126+28+30=184E [Randspalte „1“_QS4+4=“8“_“4“] aus. Weiterhin werden die Botenstoffe „Adrenalin“=C9H13NO3=54+13+7+24=98E und „Noradrenalin“ =C8H11NO3=48+11+7+24=90E ausgeschüttet. Beide Botenstoffe sind an die Ziffer „7“= Nerv gekoppelt und liegen mit der Ziffer “9“=Arterie im Blutkreislauf in der Arterien-9-Spalte als 7“9“0/78“9“. Die Arterie-9 und nicht die Vene-8 wird dadurch als Antrieb definiert. Bei Ausschüttung der Botenstoffe steigt der Blutdruck. Bei einem Strom von 1 Ampere fließen 6,2 • 10^18 (6,2 Trillionen) Elektronen pro Sekunde [Ampere – Wikipedia]. In Z.8121 liegt die Zahl „62“ neben der Venen-8-Spalte. Die Kommastelle in 6,2 entfällt als „62*10^17“ ähnlich als „62_QS8+9=17“. Die Serie #1606 enthält über die 4 Kreislaufzeilen eine 0(Null)-Spalte. Im Kreislauf können 4 Nullen als eine Ziffer 4 gezählt werden, die in den Platzhalter 16“4“6 statt einer Null abgelegt wird, daraus folgt QS1+6+4+6=17. Wunschgemäß muss erkannt werden, dass die Serie „1“6“0“6 eine Kombination von „10“ und „66“ (2x33) ist, um den Faktor „10^17“ zu interpretieren. Könnten mit 2 * (Membran=33)=“66“ die Gefäßwände für Vene und Arterie adressiert sein? Es sind zwar 3 Schichten (Intima, Media, Adventitia), aber Kapillaren haben nicht diesen dreiteiligen Aufbau. Sie weisen nur ein Endothel auf [Gefäßwand - DocCheck Flexikon]. Der Durchmesser beträgt 6µm, so dass sich die größeren Erythrozyten verformen müssen. Somit bildet die Serienspalte „606“ mit der Ziffer „0“ eine Kapillare. Für 6µm = 6000nm werden 3 Nullen und für beide Gefäße zusammen „6“ Nullen von Z.8116 bis Z.8121 benötigt. In diesem Sinne ist die Lesbarkeit von Millivolt vorstellbar. Beifall: Linda Ronstadt - Just One Look (Live) [Linda Ronstadt - Just One Look (Live) - YouTube; https://www.youtube.com/watch?v=IsEwBzfdMnk].
Der Muskel=“55“ wird auf dem Pfad der Planck-Konstante „h“=6,62607015*10^-34 [J*s] = „662607015,0 *10^-42“ [J*s] beteiligt. Die Planck-Konstante „h“ ist das Verhältnis von Energie und Frequenz eines Photons und entfaltet als Maßeinheit eine Wirkung. Es muss nur der ganzzahligen Zahl „h“ gefolgt werden, weil 1 Joule= 1 N m und 1 Sekunde bereits zum BiXnom-System gehören. Der Bixnom-Code kann als „geometrisches Ziffern-Gemälde“ vorliegen, auf dem die Planck-Konstante als Weihnachtsdekoration in Form eines halbierten Weihnachtsbaumes mit der Spitze „11“ gezeichnet wird. Der Start liegt in Z.8119 als markierte Zahl „15“ vor. Die Gruppen-Markierung „44_15_44“ bildet den Zeilenrand. Damit der Weihnachtbaum senkrecht steht, bildet die letzte Zeilen-Nr. Z.8_QS1+2+1=4 die Schwerachse=84. Der untere Baumstamm als Spalte 51/45 ergibt ebenfalls QS5+1+4+5=15. Weshalb nur ein halber Baum? Die Biologie ist paarig! Wissenschaftlich werden die paarigen Extremitäten der Wirbeltiere aus der Bauchfalte eines Fisches abgeleitet (Seitenfaltentheorie). Eleganter wäre es, die symmetrische Spiegelung in der Episode „Blut“ zu lesen. Die Doppelgruppe 44_44 ist ein ergänzender Hinweis. Die Basis-Linie des stehenden rechtwinkligen Dreiecks (halber Baum) mit dem rechten Zeilenrand als Symmetrieachse wird mittels der Zählgröße 11 breit aufgezogen als QS1+1+4+4=10, um in dieser Zeile eine Null für QS1+1+4+4=1“0_15“_44 zu gewinnen. Die folgende Kathete liegt diagonal über 2 Zeilen aufsteigend als „07“ und „26=Eisen“ vor und erreicht den Zahlenrand nicht als „66“, sondern zunächst nur als Muskel=55. Die Baumspitze wird als Zählgröße „11“ für 55+11=“66“ über 2 Zeilen aufgesetzt: QS1+2=“3“ und Randspalte „8-2“ ergeben die Spitze „Summe [QS1+2=] 3 +8=“11“. Weil die Evolution einen Muskel bewegt, ist sie in der Lage eine Spalte „4-2-0“ fallend als Faktor „10^-42“ auf die Basiszahl „662607015“ zu interpretieren. Das Dreieck zieht den Baum über 6 Zeilen mit der Serien-Zahl „60“ zu 6*60=360° um die Spalte „4-2“ als negative Potenz zu lesen. In Z.8115/Z.8116 im Code #1607“4“7 und #1607“2“7 ist aufgrund der Ziffer „7“ zwar keine Kombination Faktor „10“ und „66“ als Serie „1606“ möglich, aber die „66“ liegt als Spalte „6-6“ vor, so dass auch der Faktor „10“ erhalten bleibt. Der Zahlenrand „Muskel=55“ bleibt weiter aktiv, so dass die Zahl „55“ in der Randspalte aufsteigend mit QS1+2=“3“ zum Protein „ATP-Synthase alpha (Mensch)“=553AS zwecks Energieerzeugung ergänzt wird. Funktion: „Mitochondriale Membran-ATP-Synthase produziert ATP aus ADP in Gegenwart eines Protonengradienten über die Membran, der durch Elektronentransportkomplexe der Atmungskette erzeugt wird.“ [ATP5F1A - ATP-Synthase-Untereinheit alpha, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Enzym kann bakterielles Eisen binden, um den Menschen vor Bakterien zu schützen. Um das gebundene Eisen zu verwerten wird, das Protein „Säugetier-Siderocalin LCN2“=198AS gebildet [LCN2 - Neutrophiles Gelatinase-assoziiertes Lipocalin - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Ziffer „1“ in QS1+2=3 aus ATP-Synthase=553 AS wird aufgenommen und diagonal als Ziffer „9“ zwischen Schwerachse=84 und Muskel=55 heruntergeführt, um das Eisen=26 für die Ziffer „8“ als QS2+6=8=Extra für LCN2=198AS auch mathematisch aufzunehmen. Die verborgene Zahl „66“ ist am Rand der Zeitdifferenz lesbar: DELTA.TIME.Epi.Ref_Rhesus.Z.8115-Z.8121=#“11“8“7“6446“7“86“66“. Weiterhin sind die paarige Form=7 als Kreis=64 und Gegenform=46 sowie die Zählgröße „11“ enthalten. Der Token-86 als Prozessrichtung ist im Gegensatz zum Parasiten für den Menschen eine Energieaufnahme.
Mensch: Aminosäure „Asparagin“=C4H8N2O3=70E, abgekürzt Asn oder N, liegt als lfd. Nr.41/42 in Z.8117/Z.8118 und integriert Vor- und Folgezeile. Asparagin ist ein Derivat der Aminosäure „Asparaginsäure (Asp), die zuvor in lfd.Nr. 16 /Z.8092 entsteht. 3 Asparagin-Transfer-RNA werden eingeordnet: Das Protein (Mensch) „Asparagin-tRNA-Ligase (NARS1)=548AS besetzt den Zeilenrand in allen 4 Zeilen aufsteigend ab Z.8116 als „5“_“4“-QS4+4=“8“ für 548AS [NARS1 - Asparagine--tRNA ligase, cytoplasmic - Homo sapiens (Human) | UniProtKB | UniProt]. Das Protein katalysiert die Bindung von Asparagin an tRNA(Asn) in einer zweistufigen Reaktion. Das Asparagin=70E liegt hierfür bereits lesbar in Z.8115 vor. Es wird durch ATP aktiviert um Asn-AMP=C14H21N7O9P^+=84+21+49+72+15=241E zu bilden [Asnamp | C14H21N7O9P+ - PubChem (nih.gov)]. Asn-AMP liegt am Zahlenrand in der Ziffernfolge „412“, so dass die Ziffer „2“ gespiegelt ist. Dafür ist eine Spiegelung 47=Form_74 enthalten. Das Protein dient als Signalmolekül, um die Migration von CCR3-exprimierenden Zellen zu induzieren. Das Oberflächenprotein C-C-Chemokinrezeptor Typ 3 (CCR3)=355AS [CCR3 – Wikipedia] beginnt in Z.8118 aufsteigend in Spalte [0]“3“[078]/[1]“1441“, so dass der Bezug zu fremden Zellen durch die enthaltene Gruppe „44“ verursacht wird als „3“_QS1+4=“5“_QS1+4=“5“ für 355AS. In den 4 Zeilen ist 3x „07=Nerv“ enthalten, so dass in der 4. Zeile QS#1+6=7_0=Asparagin zählbar ist. Während der Entwicklung des Nervensystems nutzen Neurone die radiale Glia als Orientierungsstruktur, um während der Zellmigration ihren endgültigen Platz im Nervengewebe zu finden [Radiale Gliazelle - DocCheck Flexikon]. Die Zählgröße „11“ ist integriert, so dass die Spalte „3/1“ mit 3+1=“4“_7=Form_“8“ in Beziehung tritt, um die Schwerachse=84 zu aktivieren. Das Protein ist für das ordnungsgemäße Wachstum (Proliferation) radialer Gliazellen erforderlich. Das Protein (Mensch) „Asparagin-tRNA-Ligase (NARS1_Isoform)=548AS ist bei gleicher AS-Länge eine Isoform, die entgegengesetzt absteigend ab Z.8116 nur über 2 Zeilen gezählt werden kann, und zwar mit der Randspalte „4/544“ als „5“_“4“_QS4+4=“8“ für 548AS [NARS1 - Asparagin-tRNA-Ligase, zytoplasmatisch - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Asparagin-tRNA-Ligase (NARS2_mitochontrial)“=477AS summiert die 4 Ziffern „1“ in den Z.Nrn. Z.8117#160/Z.8118 als „4“_“7“_QS1+6=“7“ für 477AS. Für die Energieerzeugung zur katalytischen Aktivität muss kein ATP-Protein entwickelt werden, weil Adenosintriphosphat (ATP) = C10H16N5O13P3=60+16+35+104+45=260E in der Spalten-Serie #“1“60/“160“ immer direkt als QS1+1=2_60 für 260E vorliegt: „ATP + L-Asparagin + tRNA(Asn) = AMP + Diphosphat + H + L-Asparaginyl-tRNA(Asn)+“. „Adenosinmonophosphat (AMP)“=C10H14N5O7P=60+14+35+56+15=180E bildet sich in Z.8118/Z.8119 über die Spalte „30/51“ als „1“_QS3+5=“8“_“0“ für 180E [NARS2 - Wahrscheinliche Asparagin-tRNA-Ligase, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. 3 Asparaginyl-tRNA-Synthetase werden eingeordnet, die möglichst alle 4 Zeilen erreichen: Das Protein (Mensch) „Asparaginyl-tRNA-Synthetase (2/mitochontrial)“=241AS kann die Zählgröße 11 in den Z.Nrn. in beide Richtungen zählen als QS1+1=2_ doppelt (QS 1_1=2)*2=“4“_“1“ für 241AS [NARS2 - Asparaginyl-tRNA-Synthetase 2, mitochondrial - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Asparaginyl-tRNA-Synthetase (glutamine-hydrolyzing)“=401AS nimmt den gleichen Weg über die Zählgröße 11, indem mit der Ziffer „4“ aus 11/11 in Z.8116 begonnen wird. Die Z.Nr. Z.8“118“ erzeugt mit QS1+1=2 +8=10 die Ziffer „0“. Die Ziffer „1“ kann aus der „1“0 oder aus Z.-Nr. Z.81“1“9 stammen [ASNS - Asparagine synthetase [glutamine-hydrolyzing] - Homo sapiens (Human) | UniProtKB | UniProt]. Das Asparagin entsteht aus der Asparaginsäure mittels des Proteins „Asparaginsynthetase“, wobei ein Ammonion von Glutamin= C5H10N2O3=30+10+14+24=78E angelagert wird [„Asparagin“ – Bearbeiten – Wikipedia]. Glutamin=“78“ bildet eine Z.Nr.-Spalte Z.811“7“/Z.811“8“. Das Protein (Mensch) „Asparaginyl-tRNA-Synthetase (glutamine-hydrolyzing_Modifikation)“=478AS zieht nur über 3 Zeilen, wobei Glutamin 7/8 in den Z.Nrn. aufgenommen wird für 478AS [Asparagine synthetase [glutamine-hydrolyzing] - Homo sapiens (Human) | UniProtKB | UniProt]:Epi.Ref_Rhesus.Z.81“1“8#“160“688303“07“8824.
tRNA-Gen lfd.Nr.43: Funktionskomplex - Teil Alpha „Hydrolase“:
Es werden keine weiteren Transfer-RNA benötigt. Für vermutete zusätzliche Funktionen enthält Gen-Nr.43 eine Gruppenfunktion „44_44“. Weil sich eine Winkelsumme=360° über 3 Zeilen nachweisen lässt, falls der Überschuss=30° durch Wasser-Verbrauch mit QS=10 pro Gen-Zeile beseitigt wird, bilden die tRNA-Gene Nr.43-45 einen Funktionskomplex.
Funktionen: Die Anzahl der „tRNA-Enzyme“ übersteigt die Anzahl der Gene. 1. Ursache: Bei genauerer Betrachtung können einer Gen-Codezeile mehrere Enzyme zugeordnet werden, wenn für den funktionellen Zweck verschiedene gleichwertige Pfade zur Bildung der Kettenlänge existieren. 2. Ursache: Die spezifischen Transfer-RNA (tRNA) transportieren die zugeordnete (kognitive) Aminosäure zum Ribosom. Diese Bindung erfolgt durch „Aminoacyl-tRNA-Synthetasen (aaRSs)“ zusammen mit spezialisierten Gerüstproteinen, den aaRS-interacting multifunctional proteins (AIMPs). Im Malaria-Erreger (Plasmodium) ist das Importprotein „tRip“ am tRNA-Transport beteiligt, wobei es auch als AIMPs mitwirkt. Aufgrund ähnlicher Bezeichnungen wird aus fachlicher Unkenntnis hier evnetuell eine „Aminoacyl-tRNA-Synthetasen (aaRSs)“ bei der Anzahl der spezifischen „Transfer-RNA (tRNA)“ mitgezählt. Andererseits reichen die bekannten überzähligen „aaRSs“ nicht aus, um für jede „tRNA“ eine „aaRSs“ zu finden. Beispiele zur Bezeichnung von „aaRSs“: „Glutamyl-tRNA-Synthetase (ERS)“, „Glutaminyl-tRNA Synthetase (QRS)“ und „Methionyl-tRNA-Synthetase (MRS“). 3. Ursache: Im Bereich der Tranfer-RNA-Gene sind vermutlich weitere Funktionen enthalten, die den tRNA-Genen Nr.43/45 zugeordnet werden. Bildung der Winkelsumme=360°: Maßgeblich ist zu entdecken, dass in Zeile Z.8“120“ nicht als 20°, sondern 120° zählt, zuzüglich Winkel= 90° im Code. Im Code ergibt die Serie #1“60“ 3 Zeilen je 60°=180°. Winkelüberschuss= (120 +90 +180) - 360°= 30°. Im Funktionskomplex muss folglich jede der 3 Zeilen 1 negativen Winkel= -10° als Wasserverbrauch mit Wasser=H20=10E nachweisen. Zeile Z.“8“11“9 zählt „Z.“8“_QS1+1=“2“_seitlich=9“, d.h. H2O=28, wobei Z.“811“x im Code gespiegelt als „#_11_QS4+4=8“ enthalten ist. Damit ist das Wasser im Code versteckt als „1144“ =QS1+1=2_QS4+4=8 codiert. Zeile Z.8120 zählt im Code den Kreis=64=QS6+4=10=Wasser=H20=QS2+8=10. Zeile Z.“8“1“2“1“ kann aufgrund der enthaltenen Zählgröße „11“ die Zahl „82“ herauslösen und gespiegelt als Wasser H2O=28 liefern, die auch im Code als „28“ enthalten ist. Die von der „tRNA“ zum Ribosom transportierte Aminosäure kann durch eine „Hydrolase“ wieder abgekoppelt werden. Hydrolasen sind Enzyme, welche die hydrolytische Spaltung einer Verbindung unter Verbrauch von Wasser reversibel katalysieren. Zu dieser Gruppe III der Enzyme gehören Proteasen, Esterasen, Glycosidasen und Amidasen [Hydrolase - DocCheck Flexikon]. Das Enzym „Aminoacryl-tRNA-Hydrolase“=123AS symbolisiert seine Funktions als Aufzählung „1-2-3“, um eine Vielzahl von Verbindungen zu trennen [aminoacyl-tRNA hydrolase - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt ]. Katalytische Aktivität: „an N-acyl-L-alpha-aminoacyl-tRNA + H2O = a tRNA + an N-acyl-L-amino acid + H+“. Das Enzym „Hydrolase“=123AS kann der Gruppenfunktion dienen, wenn über die Spalte der Zeilen-Nrn. Z.x1“1“9/x1“2“0/x1“21“ die Ziffernfolge „1_2_QS2+1=3“ für Enzym „Hydrolase“=123AS als Zeilenverbinder gezählt wird. Die Phosphor=15 wird markiert als Gruppe=44_15_44. In der Folgezeile liegt die Spiegelung 0_51 am rechten Zahlenrand zur Entsorgung, so dass eine Aminosäurekette getrennt wird. Zu diesem Zweck zieht die Hypoxanthin-Phosphoribosyltransferase=231AS mit dem Cofaktor=Mg(^2+) über beide Zeilen [Hypoxanthin-Phosphoribosyltransferase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Die Gruppe 44_15_44 bildet 11_ QS4+4+1+5+4+4=22, um mit der Ziffer „4“ und Addition der Zählgröße 11 die Membran „33“ 4-fach zu erzeugen, damit das Organell „Apicoplast“ mit seinen 4 Wandschichten adressiert werden kann. Die enthaltene Zahl „66“ ergibt 2 Wände „33“, die Quersumme der Folgezeile mit QS1+6+0+6+4+8+7+2+4+6+7+9+0+5+1=66 insgesamt 4 Wände: Epi.Ref_Rhesus.Z.“811“9#“1606685“11“44“15“44“.
tRNA-Gen lfd.Nr.44: Funktionskomplex - Teil Beta „Deacylase“:
Eine „Deacylase“ ist jede „Hydrolase“, die eine „Acrylgrupp“e durch Hydrolyse entfernt. Acrylgruppe CH2=CH-COR=6+2=8E wie z. B. die Acrylsäure oder Acrylsäureester beziehungsweise Polymere dieser Stoffe. Die Ziffer „8“ bildet eine Spalte, der sich beidseitig eine Spalte anlegt, so dass eine Matrix entsteht. Die beiden Seitenzahlen bilden jeweils QS=11=Zählgröße. Zuzüglich der Ziffer 8 zieht sich über die 3 Zeilen einen Kalium-Kanal [6“8“5;4“8“7;2“8“9]=11+8=19=Kalium. Als Gegenspieler bildet die angrenzende Matric der Spalte [6O6,6O6,6O6] einen Calcium-Kanal, wenn die Ziffer 8=Extra aus der Kalium-Spalte in den Platzhalter-O des Calcium-Kanals springt, womit sich Calcium=6+8+6=20E ergibt. Jeder der 3 Wasseranteile wird nunmehr direkt mit einem Calcium-abhängigen Protein gebunden. Zeile Z.8119 enthält das Protein „CDPK4“=528AS und besetzt “5_11_44“ als „5_QS=2_QS=8“ [CDPK4 - Calcium-dependent protein kinase 4 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Zeile Z.8“12“0 enthält das Protein „ATPase“=1264 AS und besetzt die Zahl „12“ in der Zeilennummer und die Zahl „64“ im Code [ATPase4 - Nicht-SERCA-Typ Ca2+ -transportierende P-ATPase - Plasmodium falciparum (Malariaparasit P. falciparum) | UniProtKB | UniProt]. Zeile Z.81“2“1 enthält das Protein „Calcyclin-bindend“=228AS und besetzt die markierte Ziffer „2“ in der Zeilen und die Zahl „28“ (Wasser) im Code [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Die beiden Proteine für Kaliumkanäle sind enthalten. Das Protein PfK1=1966 AS besetzt die Zahl „19“ in der Zeilen-Nr. Z.81“19“ und im Code die Zahl “66“. Das Protein PfK2=1653AS besetzt zur Zeilenverbindung die Spalte „1-4-2“ für „1_QS4+2=6“ als Zahl „16“. Die Ziffer „5“ neben der Zählgröße „11“ bildet darin nur eine kurze Spalte „1-2“ für QS“1+2=3“ für PfK2=1653AS. Der Zweck der unterschiedlichen Spaltenlängen erklärt sich daraus, dass sich unterhalb eine Matrix „24/42“ aus der Spiegelung der Zeitbasis=24 für den „Circadianer Rhythmus“ der Chronobiologie bildet. Die Zeitdifferenz offenbart den biologischen Extrakt in einer Zahl: DELTA.TIME.Epi.Ref_Rhesus.Z.8119-Z.8121=#39[„5“(686)“5“]19[989]; mit 19=Kalium; QS6+8+6=20=Calcium; QS5+6+8+6+5=30=Zink; QS9+8+9=26=Erythrozyt; 56_65=Schlüssel-Schloss-Prinzip; QS3+9=12 plus 6_6=24=Zeitbasis; 9_Zeitbasis=60_9=QS78=QS15=QS6=flexibel. Das Enzym „Aminoacryl-tRNA-Deacylase=164AS wählt zweckmäßig die gespiegelte Ziffernfolge „146“ in der Spalte (“1“- 4 ) in der Vorzeile und findet die Ziffer 6 anliegend als „46“=MgCl2=12+(2*17)=46E. In Zeile Z.8“12“0 wird Magnesium=12E adresssiert. Die Spieglung ergibt zusätzlich Chlor=17E als „64_QS=8+7+2=17=Chlor_46“ [ DTD - D-Aminoacyl-tRNA-Deacylase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Chlor=17E wird für Magnesiumchlorid=MgCl2 benötigt, weil das Molekül allen „Aminoacryl-tRNA-Synthetasen“ angehängt wird. „All aaRSs require divalent cation MgCl2 for their aminoacylation reaction“; siehe: [A genomic glimpse of aminoacyl-tRNA synthetases in malaria parasite Plasmodium falciparum | BMC Genomics | Full Text (biomedcentral.com), A. Sharma; BMC Genomics; Article number: 644 (2009)]. Apetala 2 (AP2) ist ein Gen und Mitglied einer großen Familie von Transkriptionsfaktoren, der AP2/EREBP-Familie. „AP2“ ist an der Blütenentwicklung von Pflanzen beteiligt. Der Parasit „Plasmodium“ besitzt einen verwandten Satz von Transkriptionsfaktoren. Der „AP2-Transkriptionsfaktor=1597AS“ besetzt in gespiegelter Ziffernfolge den rechten Zeilenrand als “64“872“46“79051“[AP2-Domänen-Transkriptionsfaktor AP2-I - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Für MgCl2=12+2*(17)=46E werden 2 Chlor-Atome benötigt. Daher wird Der „AP2-Transkriptionsfaktor=1597AS“ nochmals ungespiegelt adressiert. Ab Ziffer „1“ über die Randspalte 1-5 mit der Ziffer „5“ zur Zeile Z.8121, weiter mit QS 5+4=9, übersprungen wird QS 8+9=17=Chlor, gefolgt von Ziffer 7 für 1597AS. Um Phosphor=15 aus Zeile Z.8119 hier gespiegelt als „51“ am rechten Rand zu entsorgen, wird der Cofaktor= Mg(^2+) benötigt, um die Vorzeile mit dem Enzym „Hypoxanthin-Phosphoribosyltransferase“=231AS zu beteiligen [Hypoxanthin-Phosphoribosyltransferase - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Hypoxanthin =C5H4N4O=30+4+28+8=70E. Für diese Symbolik werden die 231AS mit den beiden Zeilen-Nrn. gezählt als „2_QS 1+1 (aus Zählgröße 11) + 1 (heruntergezählt)=“3“, wobei sich die Ziffer 1 zur Entsorgung am rechten Zahlenrand anschließt für Enzym=231AS. Der Cofaktor „Magnesium=12“ wird nochmals benötigt, um die Folgezeile mit dem Enzym „4-Hydroxybenzoat-Polyprenyltransferase“=521AS anzuschließen [4-Hydroxybenzoat-Polyprenyltransferase - Plasmodium falciparum (Isolat NF54) | UniProtKB | UniProt]. Das Enzym beginnt am rechten Zeilenrand der Folgezeile mit der Ziffer „5“, und zieht nach links in die Zeilennummer, um in der Spalte 1-1 als Zeilenverbinder QS1+1=2 zu zählen. Die Ziffer „1“ am rechten Zahlenrand gehört zum Enzym „4-Hydroxybenzoat-Polyprenyltransferase“=521AS mit der Funktion: „Katalyse der Übertragung von „Alkylgruppen“{miteinander verbundenen Kohlenstoff- und Wasserstoffatomen [außer Methylgruppen (-CH3); keine“9“]} oder „Acrylgruppen“ {CH2=CH-COR=6+2=8E} von einer Verbindung (Donator) auf eine andere (Akzeptor)“. Mögliche Alkylgruppen sind z.B. Ethylgruppe „-CH2-CH3“=“-8-9“ und die 1-Propylgruppe „-CH2-CH2-CH3“=“-8-8-9“: Epi.Ref_Rhesus.Z.8“12“0#“160“64“872“46“790“5“1“.
tRNA-Gen lfd.Nr.45: Funktionskomplex - Teil Gamma „Thiolprotease“:
Eine bekannte Hydrolase wird zugeordnet, weitere sind hier nicht bekannt. Eine Thiolprotease erkennt eine Peptidbindung am C-terminalen Glycin von Ubiquitin oder NEDD8 und hydrolysiert die Bindung. Protein „Ubiquitin-Carboxyl-terminale Hydrolase (UCH54)=465AS“. „Katalytische Aktivität: Thiol-abhängige Hydrolyse von Ester-, Thioester-, Amid-, Peptid- und Isopeptidbindungen, die durch den C-terminalen Gly von Ubiquitin (ein 76-Rest-Protein, das als intrazelluläres Zielsignal an Proteine gebunden ist) gebildet werden“ [UCH54 - Ubiquitin carboxyl-terminal hydrolase UCH54 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ]. Das Protein „UCH54“=465AS beginnt in Zeilen Z.8121 am rechten Zeilenrand mit der Ziffer „4“ und bildet die Ziffer „6“ aus der Randspalte „QS5+1=6“, so dass die Ziffer „5“ in Z.8120 als Teil von „AP2“ anliegt. Das kleine Molekül Ubiquitin=76AS liegt spiegelbildlich als „67“ in dieser Zeile vor, führt die Spalte „6-7“ herunter und ist dann in Z.8121 gespiegelt als QS4+2=6_7 erneut lesbar. Die Zeile erzeugt Ubiquitin „QS=1+6+0+6+2+8+9+4+2+7+8+9+5+4+5=76“. Ubiquitin wird durch eine Katalyse auf ein Substratprotein mitttels des Enzyms „Ubiquitin-Transferase“=930AS übertragen [RING-type E3 ubiquitin transferase - Plasmodium falciparum (isolate Dd2) | UniProtKB | UniProt]. Die Symbolik „9_3_0 AS“ kann mit der Ziffer 9=seitlich das Ubiquitin=76 gespiegelt als „67“ in der Zeile markieren, mit der Ziffer „3“ das Ubiquitin, wie vorhanden, 3-fach zählen sowie Zink=30 abgegrenzen. Die Spiegelung „Extra=89_[427]_89“ markiert Ubiquitin, gespiegelt=QS4+2=6_7. Das „angehängte“ Ubiquitin wird unsymmetrisch markiert als 8“9“_[QS4+2+7+8+9]=“30“=Zink, so dass daraus Ubiquitin-Transferase=930AS folgt: Epi.Ref_Rhesus.Z.8121#“1606“28“942“7“89“5“4“5“.
Das Phänomen „33/66“ der Geschlechtshormone Testosteron/Östrogen (Estrogen): „Testosteron“=C19H28O2=114+28+16=158E ist als Molekül bekannt. Wie kann das sein? Östrogen existiert primär überhaupt nicht, sondern wird erst mittels Protein (Mensch) „Aromatase (CYP19A1)“=503AS und dem Cofaktor „Häm“ aus Testosteron erzeugt! Funktion: Eine Cytochrom-P450-Monooxygenase, die die Umwandlung von C19-Androgenen, Androst-4-en-3,17-dion (Androstendion) und Testosteron in die C18-Östrogene Östron bzw. Östradiol katalysiert: „3 O2 + 3 reduziert [NADPH--Hämoproteinreduktase] + Testosteron = 17beta-Estradiol + Formiat + 4 H + 4 H2O + 3 oxidiert (NADPH--Hämoproteinreduktase+)“ [CYP19A1 - Aromatase - Homo sapiens (Mensch) | UniProtKB | UniProt]. Cofaktor „HÄM“=Fe-haltiges Protoporphyrin IX=C34H32FeN4O4=204+32+26+28+32=322E. Die Insekten verstehen den Unterschied „33/66“ ebenfalls und ihre Hämolymphe=26 zählt auch ohne Eisen=26 als Blut=26. Wieso ist „Häm“ ein Cofaktor? Der Begriff „Häm“ steht zwar mit dem eisenhaltigen Blutfarbstoff „Hämoglobin“ in einem Zusammenhang, aber es gibt 3 andere Farbstoffe (eisenhaltiges, rotes Hämerythrin, blaues Hämocyanin und grünes Chlorocruorin). Insekten nehmen den Sauerstoff ohne Eisenbedarf in den Tracheen direkt ohne geschlossenen Blutkreislauf auf. Im BiXnom-Code wird das Wasser=H2O statt 1+1+8=10 (10er BiXnom-Schwingkreis) symbolhaft vorzugsweise als „28“ verwendet. Wasser=28 plus Goldener Schnitt mit dem Symbol „5“=Struktur ergibt 28+5=“33“ als fiktives Signal. Die Verdopplung 2*33=66 hat zur Ziffer „2“=paarig einen Bezug. Es ist aber nicht bekannt, dass so ein kleines Molekül mit 33AS real als Signal angehängt wird. Möglicherweise ist das komplexe sexuelle Verhalten mit Beteiligung des Nervensystems als verstärkendes Signal zu verstehen. Der sexuelle Protein-Bereich ist unverkennbar die Spalten-Serie #1613/#1613. In den Spalten wird die Zählgröße 11 mit den Symbolen weiblich=“66“ bzw. männlich=“33“ kombiniert, so dass im Code auch die entsprechenden Moleküle zu erwarten sind. Das Medikament „Oral-Turinabol“= Chlordehydromethyltestosteron=C20H27ClO2=120+27+17+16=180E wurde früher im Leistungssport aktiven Frauen zum Muskelwachstum verabreicht, was zur Vermännlichung des Körpers führte. So etwas kennt man heute nur noch, wenn der urinierende Mann an die Urinal-Wand gepresst wird, wenn Horden von Frauen das enge, bereits überfüllte Herren-WC im Kölner Karneval stürmen. Na und? Hemmt das Medikament das Östrogen erzeugende Protein „Aromatase“? Scheinbar nicht, dann aber ein Volltreffer. Das „natürliche Testosteron“ ist geheim verschlüsselt, dagegen ist das künstliche Testosteron direkt lesbar, was scheinbar nur einen Überschuss an Männlichkeit bewirkt. Das „Testosteron“ liegt rechts neben dem Cofaktor „Häm“ in der Randspalte Z.8085#_7“0“3636 / “18“227“8, um dort ausgeschüttet zu werden. Das künstliche Testosteron-Medikament=180E liegt links aufsteigend als „18_0“ für 180E. Daneben liegt die Zahl 227=QS2+2+7=11=Zählgröße, die eine Aktion auslösen kann. Das „natürliche Testosteron“ findet die Ziffer „1“ in der Spalte 36/22 mit QS3+6_2=11 davon die Ziffer „1“_QS3_2=“5“_“8“ für 158E. Der Cofaktor Häm=322E liegt in der Spalte [17]“3“/“220“ als QS3_0=“3“_“22“ für 322E. Das Protein „Aromatase“=503AS erzeugt die Symbole „66/33“ in der linken Randspalte Z.8086#[1]“6“[1]“32“[4] / [1]“6“[1]“30“ als QS3+2=5_0_3 für 508E. Das künstliche Testosteron 180E legt sich brutal mit „1“_QS 3_3_2=“8“_“0“ für 180E total auf das Protein - die Weiblichkeit hat keine Chance, wenn die enthaltene Zeit=24 ignoriert wird, indem das Medikament ständig aufgenommen wird. Die Zeit „24“ ist an den Cofaktor „Häm“ gekoppelt.
Östradiol=C18H24O2=108+24+16=148E ist das wirksamste der weiblichen Sexualhormone und wird am rechten Zahlenrand in der Spalte 78/34 als QS7+3=10 für Ziffer 1_4_8 für 148E ausgeschüttet. Östrogene sind Östradiol, Östron (Estron)=C18H22O2=108+22+16=146E und mit schwacher Wirkung das Östriol=C18H24O3=108+24+24=156E.Östron=146E zieht vom Zeilenrand Z.8084 nach innen als 14_QS1+5=6 für 146E. Umgekehrt zählt sich Östriol über die Spalte 15[41]/[3]6[3] nach rechts als 15¬_6 für 156E. Östriol entsteht alternativ durch Aromatisierung des A-Ringes von Androstendion. Das ist ersichtlich, weil die Ziffer „6“ in die Membran 33 als 3“6“3 eintaucht, wobei die mögliche Zerlegung 3_6=3+3_3 das Fett als „3333“ symbolisierten würde. Die Ziffer „6“ stammt mit Bezug zu einem A-Ring aus „64“. Androstendion=C18H24O3=106+24+24=154E ist eine Hormonvorstufe und liegt gespiegelt „541“ am Zeilenrand und ist dem Testosteron ähnlich [Androstendion – Wikipedia]. Östradiol=148E wird bei der Frau vor allem in den Ovarien und bei der schwangeren Frauen in der Plazenta gebildet. Beim Mann wird Östradiol in geringer Menge im Hoden und in der Nebennierenrinde produziert. Östradiol wird wie alle Geschlechtshormone aus dem Cholesterin synthetisiert [17-Beta-Östradiol | DocMedicus Gesundheitslexikon (gesundheits-lexikon.com)]. Geschlechtshormone sind Androgene (wie Testosteron), Östrogene und Gestagene (wie Progesteron). Progesteron=C21H30O2=126+30+16=172E wirkt auf die Schleimhaut der Gebärmutter im Menstruationszyklus. Die erwartete Zeitfunktion „Zeitbasis“=24_30Tage wird 100% bestätigt in der Spalte [17]“3“[7]/[22]“0“1“/“2“[715] als „1“QS“3+0“+“2+2“=“7“_“2“ für 172E. Die 30 Tage sind in der Summe „7“ für 2+2=4 Wochen je 7 Tage lesbar. Die Zeitbasis=24 wird präziser über die anliegende Gebärmutter-Spalte 3“24“2/30“42“ gezählt, die die Gebärmutter als 3/3=Summe=6_0_4=BiXnom-Kreis mit Innenkreis=O adressiert.
Die Hormon-Basis „Cholesterin“=C27H46O=162+46+8=216E steigt in der rechten Randspalte Z.8082#_[9}“4“[320]/[5]“7“[825]/“61“[541] als QS4+7=11=QS1+1=2_1_6 für 216E auf. LDL= Low Density Lipoprotein und HDL= High Density Lipoprotein sind keine unterschiedlichen Sorten von Chlolesterin, sondern es sind nur Transportproteine. „LDL“ transportiert u.a. auch selbst gebildetes Chlolesterin im Blutplasma von der Leber zu den Geweben und zirkuliert 5 Tage im Blut. Als Gemeinsamkeit der verschieden großen Partikel dient das enthaltene Apolipoprotein B100 (Apo B100). Bei der Wikipedia-Angabe von 4536AS fehlen 27AS für ein Signalpeptid, so dass es sich um 4563AS handelt [APOB - Apolipoprotein B-100 - Homo sapiens (Mensch) | UniProtKB | UniProt]. LDL-Transporter=4563AS ist mit dem Zahlendreher „3“63“6“ in der Randspalte Z.8084#_[1]54[1]/[3]63[6] als 4_5_63 für 4563AS enthalten und wird von der Zählgröße 1_54_1 flankiert, die 5 Tage und die Zeitbasis 1+1=2_4 normiert. Hohe LDL-Cholesterin-Werte im Blut erhöhen das Risiko für Herzinfarkt und Schlaganfall [Cholesterin – Wikipedia]. „HDL“ transportiert umgekehrt gerichtet u.a. Cholesterin vom Gewebe zur Leber, wo es ausgeschieden wird. Ein normal hoher HDL-Spiegel im menschlichen Blut ist ein Marker für ein geringes Risiko kardiovaskulärer Erkrankungen. Das veränderliche „HDL“ kann nicht strukturell beschrieben werden, aber an der Entstehung sind das Enzym „LCAT“=440AS [LCAT - Phosphatidylcholin-Sterol-Acyltransferase - Homo sapiens (Mensch) | UniProtKB | UniProt] und das Enzym „Cholesterinester-Transferprotein (CETP)“=493AS [CETP - Cholesterylester-Transferprotein - Homo sapiens (Mensch) | UniProtKB | UniPro ] beteiligt. Das Protein „LCAT“ liegt mit Abstand weit links und wird seitlich rechts von der Zählgröße 1/1 begleitet, in der Spalte „641/441“ als „4_4_QS6+4=10“ mit Ziffer „0“ für 440AS. In der Zählrichtung wird 4+4=8_6 als TOKEN-86 als Darm-Richtung gezählt. Das Protein „CETP“ hält die gegensätzlichen Transportrichtungen auf Abstand als QS1+3=“4“_QS2+1+6=9 über Spalte 6/03 zur Ziffer „3“ für 493AS. „LDL“ wird als schlechtes Cholesterin bezeichnet. Cholesterin ist Cholesterin, gutes und schlechtes wurden momentan nicht gefunden, sondern nur 2 Richtungstransporter. Nachfolgend lassen sich aber 2 mathematische Cholesterin-Varianten erkennen, die unterschiedliche Transporteigenschaften zeigen können, so dass die HDL- und LDL-Spiegel beeinflusst werden. „HDL“ wird als gutes Cholesterin bezeichnet, obwohl es sich nicht um Cholesterin, sondern um dessen Transporter handelt. Angeblich sorgt eine große Menge am HDL-Cholesterin dafür, die allgemeinen Cholesterin-Werte niedrig zu halten. Gut, wenn es kein Cholesterin, sondern ein Transporter ist, der das Ausscheiden von Cholesterin bewirkt, ist das dann kein Widerspruch. Das Protein „LCAT“ liegt mit Abstand weit links und wird seitlich rechts von der Zählgröße 1/1 begleitet, und zwar in der Spalte „641/441“ als „4“_“4“_QS6+4=10 mit Ziffer „0“ für 440AS. In der Zählrichtung wird 4+4=8_6 als TOKEN-86 als Darm-Richtung gezählt. Das Protein „CETP“ hält die gegensätzlichen Transportrichtungen auf Abstand als QS1+3=“4“_QS2+1+6=9 über Spalte 6/03 zur Ziffer „3“ für 493AS. Der hässliche Cholesterin-Begleiter ist die Variante QS3+2_2=7_4 für QS7+4=11=QS1+1=“2“. An die Ziffer lagern sich rechts am Zahlenrand die Ziffer „1“ und links QS1+5=“6“ an für 216E. Dieses ist möglich, weil sich die Ziffern zur Rand-Null in der Zählgrößenspalte verschieben können und eine Zählgröße „11“ vorliegt. Im Nahrungsergänzungsmittel „Roter Reis (Rotschimmelreis)“ ist „Monakolin K“ zur Senkung des Cholesterinspiegels enthalten. Das ist ein Risiko, weil der Wirkstoff Lovastatin =C24H36O5=144+36+40=220E enthalten ist, der als Medikament ärztlich verordnet werden sollte. Das „Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)“ warnt daher vor diesem Nahrungsergänzungsmittel. Ersichtlich ist, dass nur das hässliche Cholesterin in Spalte Z.8081#_862/320/825 blockiert wird als QS2+0=“2“_“2“_QS2+8=1“0“ mit Ziffer „0“ für 220E. Lovastatin wird aber eventuell nicht verschrieben, sondern Rosuvastatin=C22H28FN3O6S=132+28+9+21+48+16=254E. Das Übel steckt schon in der Zahl „48“, die die Schwerachse=84 auffrisst. Bevor überhaupt ein Muskelabbau entstehen könnte, klappt es ggf. nicht mehr mit dem Laufen – „Sackhüpfen“ ist dann eine Wohltat. Kann man die Schwerachse im Code erkennen? Ja. stimmt leider. Der Schmerz lässt durch die Hocke nach, weil die Zeitbasis=24 und der Nerv=7 kombiniert sind. Das Rosuvastatin=254E liegt in der Cholesterin-Randspalte [86]“2“/[3]„20“/[8]“2“5/[541] als 25_QS 2+0_2 für 254E. Das Medikament kann nachvollziehbar eine Nebenwirkung erzielen, weil über Spalten ein Zusammenhang zu 84 und 55 in „8“_QS2+2=“4“ und „5“_QS4+1=“5“ hergestellt, aber gleichzeitig als Teilgrößen nur tangiert, d.h. gestört wird. Das Produkt “ArmoLipid“ mit dem roten Reis erzeugt schon wegen des Verkaufspreises keine Überdosis. Die Schwerachse wird voll getroffen, was vielleicht weniger schlimm ist, als nur teilweise, aber der Muskel wird erkennbar verschont. Mit dem Cocktail aus sonstigen Medikamenten bleibt der Kunde trotzdem ratlos.
Beim Parasiten „Plasmodium falciparum“ ist die Anzahl männlicher, weiblicher und ungeschlechtlicher Parasiten als Codesystem mathematisch vorgegeben. Beim Menschen wird das Geschlecht zwar über die Chromosomen festgelegt, trotzdem kann im „BiXn-Punkt“ der „Episode.Mensch.HOV(Hoden+Ovarium).Zeile.Z.210#125733000493280“ ein Übergang von den männlichen zu den weiblichen Geschlechtsorganen im BiXnom-Code festgestellt werden. Dieser Zusammenhang wurde auch bei der Fliege „Drosophila“ gefunden. Wenn das Östriol nur über ein Enzym „Aromatase“ produziert werden kann, sollte sich der „BiXn-Punkt“ durch entsprechende Merkmale bestätigen lassen, als nur das männliche Merkmal „33“ mit „33000“ abzuschalten. Am „BiXn-Punkt“ ist nicht nur eine Zählgröße „11“ vorhanden, sondern das komplette Programm: Am „BiXn-Punkt“ sind folgenden Zeile geschlechtlich aktiv: Epi.HOV.Zeile.Z.206#1281“74“417978587; Epi.HOV.Zeile.Z.207#127“5“5521“7891734; Epi.HOV.Zeile.Z.208#126941971651870; Epi.HOV.Zeile.Z.209#126“334“593797076 BiXn-Punkt: Epi.HOV. Zeile.Z.210#125“733“00“049“3280; Epi.HOV. Zeile.Z.211#125137109495682; Zeile.Z.212#1“24“546“84“0111“268“. Am „BiXn-Punkt“ hat die Weiblichkeit=66 freie Bahn, weil in der Spalte „334/733“ optimal „33+33=“66“, gekoppelt 4+7=11=Zählgröße“, gebildet wird. Nur manche Insekten können mit der Queen-Krönung „666“ toppen, um sich von Arbeiter*innen „66“ zu unterscheiden. Testosteron=158E beginnt mit der Ziffer „1“ aus der potenziellen Zählgröße „74“ in Zeile Z.206. Die Spalte „74/5521“ ergibt QS7+4=11, daraus Ziffer „1“ als „1“_“5“_QS5+2+1=8 für 158E bzw. alternativ über die Spalte zur „33“ als „1“_“5“_QS4+1_3=“8“ für QS 158AS. Das Testosteron wird direkt vom „Enzym „Aromatase“=503AS verwertet, weil es sich mit der anliegenden Ziffer aus der Zahl „55521“ ergibt, und zwar als „5“_QS5+5=1“0“ für Ziffer „0“_QS2+1=“3“ für 503AS. Das vom Enzym „Aromatase“ katalysiert die Bildung von Hormonen in der Randspalte „34/“7“0/“7“6/“8“0“ von Z.207 bis zum BiXn-Punkt. „Östradiol“=148E beginnt in Z.208 als QS7_7=14_8 für 148AS. Das Hormon „Östron“ zählt von Z.207 als QS7_3+4=14_QS0+6=6 für 146E. Das 3. Östrogen-Hormon „Östriol“=156E liegt nur in der Zeile 208 und kann den BiXn-Punkt wegen seiner schwachen Wirkung nicht erreichen als QS7+8=15_QS1+5=6 für 156E. Der Cofaktor „Häm“=322E des Enzyms „Aromatase“ hat die Aufgabe, die Hormone an die Randspalte zu drängen, um deren Ausschüttung zu bewirken. Zu diesem Zweck wird der Cofaktor als Abstandssymbol breit gezogen, und zwar von Z.209 nach Z.208 absteigend in der Spalte 1651/3 als „3“_ QS=1_[QS6+5=11]_1=“22“ für 322AS.
Die Forcierung des Eisprungs wird durch das Hormon „Luteinisierungshormon (LH /Luteotropin)“ erreicht, das beim Mann die Bildung von Testosteron in den Hoden fördert. Das Protein (Mensch) „Luteotropin, Beta“=141AS stammt aus dem Hypophysenvorderlappen [LHB - Lutopin-Untereinheit beta - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weil sich das Testosteron über die Zahl „74“=QS=11 für die Ziffer „1“ bildet, stammt auch die hintere Ziffer „1“ aus dem Protein 1_41 für 141AS. Die vordere Ziffer „1“ ist der Abschluss des Hormons „GNRHR-Rezeptor“=328AS, das im Vorlauf „LH-Freisetzungshormone“ aufnimmt. Die Modifikation „Luteotropin, Beta_Modifikation“=136AS wird über die Spalte 7441/5521 in die Folgezeile aufsteigen, um die Ziffer „1“ ebenfalls noch zu lesen, oder aus 5+5=“1“0 zu entnehmen als „1“_QS2+1=3_QS5_“1“=6 für 136AS [LHB - Beta-Untereinheit des luteinisierenden Hormons - Homo sapiens (Mensch) | UniProtKB | UniProt]. Bei der Länge von nur 121AS nach Wikipedia fehlt vermutlich die Signalsequenz [Luteinisierendes Hormon – Wikipedia]. Das Protein (Mensch)=„Luteotropin-Rezeptor=674AS nimmt das LH-Protein über die LH-Ziffer „5“ auf und zieht über die Spalte [7441]/5“5“21/“4“1“97/“3“45“9 bis Z.209 als QS5+1=6_QS4_3=7_QS4+5=9 für 649AS weiter [LHCGR - Lutropin-choriogonadotroper Hormonrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Beide Geschlechter erzeugen auch das follikelstimulierende Hormon (FSH), das mit dem LH-Hormon gemeinsam einwirkt. Das FSH-Hormon=129AS [FSHB - Follikelstimulierendes Hormon Beta-Untereinheit - Homo sapiens (Mensch) | UniProtKB | UniProt] und der FSH-Rezeptor=695AS [FSHR - Follicle-stimulating hormone receptor - Homo sapiens (Human) | UniProtKB | UniProt] stützen die LH-Spalte rechts seitlich [Follikelstimulierendes Hormon – Wikipedia]. Das Protein „Freisetzungshormon Gonadotropin-Releasing-Hormon (GnRH)“ wird von einem Rezeptor-Protein aufgenommen, das die Freisetzung von LH-Protein und FSH-Protein bewirkt. Protein (Mensch) „GNRHR-Rezeptor“=328AS [GNRHR - Gonadotropin-Releasing-Hormon-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt].
Der Rezeptor aktiviert ein Phosphatidylinositol-Calzium-Botenstoffsystem, so dass Calcium=20 in der Serien der Z.Nrn.Z.“20“x mitläuft. Der „GNRHR-Rezeptor“=328AS beginnt in der Zeile Z.202 mit der Spalte 25“2“6/2“119“, indem die Zahl „2“ in der Folgezeile mit der Ziffer „1“ aus QS1+1+9=11=Zählgröße entnommen wird für QS2+1=3. Die Ziffer „2“ wird seitlich angelagert und die Ziffer „8“ zieht sich lotrecht als Spalte QS2_5_1=“8“ weiter für 328AS, darin ist die Ziffer „1“ das LH-Startsignal. Die Modifikation „GNRHR2-Rezeptor“=292AS beginnt in dieser Spur mit der Ziffer „11“ und zählt die Lotrechte für ein Doppelsignal bis Z.207 weiter als QS1+1=“2“_QS2_2_5=“9“_QS1_1=“2“ für 292AS [GNRHR2 - Putativer Gonadotropin-Releasing-Hormon-II-Rezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt ]. Die beiden rezeptoren für das Feisetzungshormon liegen einem Phosphatidylinositol-Calcium-Botenstoffsystem. Dafür zieht das Calcium=20E ab der Z.-Nr. „200“ als Serie Z.-Nr.“20“x mit, und das Phosphatidylinositol-4,5-bisphosphate (PIP2)= C47H80O19P3=6*47+80+8*19+15*3=282+80+152+45=559E zieht sich aus der klassischen Größe „505“ für „55“ und der Ziffer „9“ als Spalte „3/2/211“ als QS3_2_1+1+2=9 für 559E, um die beiden Rezeptoren 328AS/292AS zu aktivieren. Die Rezeptoren nehmen das Protein (Mensch) „Gonadotropin-Releasing-Hormon (GnRH / Gonadoliberin)“=10AS auf, einen Präcusor „Progonadoliberin“=92AS in der Spalte „9/2“ als Randbegrenzung benötigt [GNRH1 - Progonadoliberin-1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Angabe von nur „69“ AS lt. Wikipedia ist unzutreffend [Gonadoliberin – Wikipedia]. Um in die lange Calcium-Nullspalte der Z-Nrn.-Serie Z.2“0“x zu kommen, zählt sich Gonadoliberin)“=10AS in Z.200 in der Spalte „01/1313“ [13+13=26=Blut] als QS1_0_3_1_3_1=9 plus der Ziffer „1“ aus Z.20“1“ für 10AS. Der GNRHR-Rezeptor vermittelt seine Wirkung zusammen mit intrazellulären G-Proteinen, die guaninbasierten Nukleotide GDP und GTP binden können. Die verschiedenen G-Protinen besitzen eine unveränderliche (hochkonservierte) G-Domäne. Trimere G-Proteine sind in die Signalkaskade vieler Rezeptoren eingeschaltet. Sie aktivieren so intrazelluläre Signalwege wie die Bildung von cAMP oder Inositol-1,4,5-trisphosphat [G-Protein - DocCheck Flexikon].
Mit der nachlassenden Wirkung des LH-Hormons wird das weibliche Hormon „Progesteron“ =172E wirksam. „Progesteron“ ist im BiXn-Punkt fertigstellt, und zwar ab Zeile Z.207 in der Spalte „21“[789]/[9]“7“16“[5]/[593]“7“[9]/[000]“4“[9] als QS2+1_7=10 mit Ziffer „1“_QS6+1=7_QS7_4=11=QS1+1=2 für 172E. Der Progesteron-Rezeptor (PR)=690AS nimmt das Hormon im BiXn-Punkt „Epi.HOV.Zeile.Z.210#1257“33000“4“932800 aufsteigend in der Spalte 33000[4]/9[4]/0[1112]/[131] als QS 3+3+0+0+0=6_9_0 für 690AS auf [PR - Progesteronrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Modifikation als Progesteron-Rezeptor (PGR)=933AS zählt umgekehrt absteigend den gleichen Pfad [PGR - Progesteronrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Die Ziffer „4“ im BiXn-Punkt für das Progesteron bildet mit der Folgezeile einen Gruppen-Spalte 4/4=“44“. Die Abtreibungspille „Mifepriston“=C29H35NO2=174+35+7+16=232E startet mit einer Zählgröße in dieser Gruppen-Zahl als 4_QS4_1+1_1=7“= 47=QS=11=QS=“2“_3_QS1+1=2 für 232E. „Mifepriston“ bildet mit dem Hormon „Progesteron“ eine Gruppe, so dass es seinen Rezeptor nicht mehr erreichen kann. Mifepriston hat in der Zählung „1131“=2_4 die Zeitbasis „24“ aktiviert, so dass das Medikament über die anliegende Spalte „2/28“ mit QS2+2=4_8 nach 48 Stunden seine Wirkung hinterlässt. In der Spalte „2/28“ ist dabei das Wehen-Medikament „Misoprostol“=C22H38O5=132+38+40=210E mit „2“_QS2+8=“10“ für 210E bereits vorgegeben.
Über diesen weitläufigen Pfad muss die Plazenta symbolisiert werden. Um diese Stecke zu begleiten sind 3 Proteine „Progesteronrezeptor“ aktiv. Das Protein (Mensch) „Progesteron-Rezeptor (PR/Q8NG43)“=690AS zieht links neben der Zahl „21“ von Z.207 durch den Bixn-Punkt bis Z.212 als QS5_1=“6“_“9“_Ziffer „0“ wird aus Summe=10 entnommen über „5“_Spaltenwechsel 00_0_QS4+0+1=5 mit 5+5=1“0“ für 690AS [PR - Progesteronrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein (Mensch) „Progesteron-Rezeptor (PGR/ PRGR)“=933AS kann zwar links in der Spalte 9/33 gelesen werden, erstreckt sich aber auf der rechten Seite bis in den BiXn-Punkt, und zwar als ab Z.207 in einer Spalte QS1_1+8_0=“1“0 für Ziffer „1“ mit QS1+2=“3“_“3“_“9“ für 933AS [PGR - Progesteronrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. In Z.207 verbleibt ein Lücke eine Lücke als Spalte „789/5“, die vom Protein (Mensch) „Progesteron-Rezeptor (Q6TZ08)“=255 AS als QS7+8+9=25_5 für 255AS ausgefüllt wird [Progesteronrezeptor - Homo sapiens (Mensch) | UniProtKB | UniProt]. Als Protein-Aufgabenstellung sammelt sich die Ziffer=9=Arterie, um die Geburt als Senkungsvorgang nach Durchlauf des BiXn-Punktes in Zeile Z.212 mit der Schwerachse=84 zu kombinieren. In der Spalte Z.209 „97/933/95“ kann die Zahl 9+9+9=27 gezählt und durch QS3+2_5=10 mit der Ziffer „0“ auf im Mittel 270 Schwangerschaftstage / 30=9 Monate ergänzt werden. In der Folgezeile Z.212 sind die Zeitbasis=24 und die Schwerachse=84 enthalten, wobei das Blut=26 mit den Mindestschwangerschaftstagen=268 Tage enthalten ist. Plazenta: „Ich habe fertig!“: Z.212#1“24“546“84“0111“268“. Das Hormon kann nicht selbst bereits statt 172AS die Obergrenze von „272“ mit 272AS darstellen, weil sich 172AS+ 100 ergeben, wenn „00“ mit Spalte „0/1“ für Ziffer „1“ als Temperatur-Zeitbasis „100°C“ gelesen wird, um aus 00_049 die 0,49°C (rd. 0,5°C) Temperaturerhöhung beim Einsprung zu erkennen, auf die das Hormon „Progesteron“ reagiert, und zwar im „BiXn-Punkt“ Epi.HOV.Zeile.Z.210#1257“33“00“049“3280. Der Eisprung wird 16 bis 32 Stunden nach dem Anstieg des LH-Hormons ausgelöst. Hierzu stellt sich die Zeitbasis=60 in der Randspalte „0/6“ in Z.208/Z.209 ein, um in der Spalte 16[5]/[3]79 die Zahlen „16“ und QS 1+6_9+7=“32“ kombiniert mit dem Ei als Form=7_0_7 zu adressieren. In der Spalte Z.209/Z.210 kann die eingebettete befruchtete [„633/33=QS=6“] Eizelle „707“ als Hormon-Funktionsmerkmal erkannt werden. Wissenschaftlich wird oft die Kopfgröße des Embryos als maßgeblich für die Dauer der Schwangerschaft betrachtet. Alternativ: "Die Kalorien, die ein Körper pro Tag verbrennen kann, sind begrenzt. 9 Monate müssen reichen. Frauen gebären, kurz bevor sie ein Energie-Plateau erreichen. Wird die Schwangerschaft um 1 Monat verlängert, ist der Stoffwechsel und damit die Gesundheit der Mutter in Gefahr [„Metabolic hypothesis for human altriciality“; Holly M. Dunsworth, u.a. Aug.2012; https://doi.org/10.1073/pnas.1205282109]. Als typische Schwangerschaft werden 40 Wochen=40*7=280Tage bezeichnet. Gegen Ende der Schwangerschaft reduziert sich die Wirkung von Progesteron. Mit dem erhöhten Östrogenspiegel wird das wehenfördernde Hormon „Oxytocin=9AS“ produziert. Diese wurde bereits in der Senkungsspalte 9/9/9 für 270Tage gezählt. Das Protein (Mensch) „Oxytocin-Rezeptor“=389AS ist in Z.213 direkt lesbar. Die Aktivität wird durch G-Proteine vermittelt, die ein Phosphatidylinositol-Calcium-Botenstoffsystem aktivieren [[OXTR - Oxytonon receptor - Homo sapiens (Human) | UniProtKB | UniProt].
Von dieser Ruheposition muss in eine Spaltenlesung umgestellt werden, um die Muskelkontraktion mit dem Muskel 55 inclusive Oxytocin=9 als „5995“ in Z.215 zu erreichen. In der Z-.Nr.215 ist mit QS2+1=35AS das Protein (Mensch) „Prostaglandin-Transporter“=35AS enthalten [SLC21A2 - Prostaglandin-Transporter - Homo sapiens (Mensch) | Veröffentlichungen | UniProtKB | UniProt]. Das Protein „OXT - Oxytocin-Neurophysin 1“=125AS kann die horizontale Ruhepostion des Proteins „Oxytonon Receptor=389AS durch die eigene Lage mit der Spalte 12/23 als 1_2_QS2+3=5 für 125AS blockieren [OXT - Oxytocin-Neurophysin 1 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Das Protein „Oxytonon Receptor=389AS wird gezwungen sich über die Vertikale in die Muskelkontraktion als „3“_QS3+5+0=“8“_“9“ für 389AS um 90° zu drehen (90° als Spalte 9/0 vorhanden). An den Wehen wirkt das Gewebshormon „Prostaglandin“ mit, das im Gewebe und nicht in speziellen Drüsen produziert wird. In Z.216 ist die Zeitbasis=24 enthalten, die für Wehen auf die Zeitbasis=60 umgestellt werden muss. Zweckmäßig wird das Protein (Mensch) „Prostaglandin-E-Synthase 2 ( PTGES2)“=604AS gesucht, weil die Zahl „60“ enthalten ist. Katalyse: „5Z,8Z,11Z,14Z)-Eicosatetraenoat + AH2 + 2 O2 = A + H2O + Prostaglandin H2“; „5Z,8Z,11Z,14Z-Eicosatetraenoat“=C47H76O2=282+76+16=374E [PTGS2 - Prostaglandin-G/H-Synthase 2 - Homo sapiens (Mensch) | UniProtKB | UniProt]. Weil keine Zahl 60 sichtbar verfügbar ist, wird in Z.217 in den Muskel 55 ein Zähler „1“ als „515“ gelegt, der in der Folgezeile ein Defizit „29_30“ für die Zeitbasis 1+29_30=60 kompensiert und eine Wehe 29+1=30/30 symbolisiert.. „5Z,8Z,11Z,14Z-Eicosatetraenoat“=374E zieht links mit herunter in der Spalte „1“[4]/“2“5“/“4“2“ als QS1+2=3_QS5_2=7_4 für 377E. In der Zeile Z.218 kann aus „12111“ die Zahl QS1+2=3_QS1+1+1=3 als Membran=33 erkannt werden. Auch in der Zeile Z.219 ist die Zahl QS0+5+6+5+8+9_0=33=Membran für Gewebsproteine interessant. Das Gewebsprotein „Prostaglandin-E2-Rezeptor-EP3(PTGER3)“=390AS kann daraus zusammengesetzt werden als „3“_Summe 3 + 3_3 gezählt als „9“_“0“ für 390AS [PTGER3 - Prostaglandin-E2-Rezeptor-EP3-Subtyp - Homo sapiens (Mensch) | UniProtKB | UniProt].
Es wird erwartet, dass das Protein (Mensch) „Geschlechtsbestimmende Region Y Protein (SRY)“=204AS den BiXn-Punkt (Z.210) nicht überschreitet, weil der transkriptionelle Regulator den genetischen Schalter in der männlichen Entwicklung steuert. Im männlichen erwachsenen Gehirn ist das Protein an der Aufrechterhaltung der motorischen Funktionen von dopaminergen Neuronen beteiligt [SRY - Sex-determining region Y protein - Homo sapiens (Human) | UniProtKB | UniProt]. Das SRY-Protein zieht ab Z.207 aufsteigend in der Spalte 7[8]/1[6]/3[7]/04 als QS7+1+3=11=QS1+1=2_04 exakt in den BiXn-Punkt.
Ribosomale 5S rRNA-Gene: Die 5S rRNA (ribosomale Ribonukleinsäure) wird von „3“ identischen Tandem-Genen auf Chromosom 14 kodiert [siehe: Genome sequence of the human malaria parasite Plasmodium falciparum | Nature; M.Gardner; Okt. 2002; doi: 10.1038/nature01097]. „5S rRNA ist ein integraler Bestandteil der großen ribosomalen Untereinheit in allen bekannten Organismen mit Ausnahme von mitochondrialen Ribosomen von Pilzen und Tieren. Es wird angenommen, dass es die Proteinsynthese durch Stabilisierung einer Ribosomenstruktur verbessert“ [siehe: 5S Ribosomale RNA Datenbank - PMC (nih.gov); V. Erdmann; Jan 2002; doi: 10.1093/nar/30.1.176]. Die ribosomale 5S rRNA wird durch RNA-Polymerase III synthetisiert. „Die Bindung zwischen „5S rRNA“ und „TFIIIA“ dient sowohl dazu, die weitere Transkription des 5S-RNA-Gens zu unterdrücken als auch das 5S-RNA-Transkript zu stabilisieren, bis es für den Ribosomenaufbau benötigt wird. In Xenopus-Eizellen wurde gezeigt, dass die Finger 4–7 des Neun-Zink-Finger-Transkriptionsfaktors TFIIIA an die zentrale Region der 5S-RNA binden können. Die „5S rRNA“ ist etwa 120 Nukleotiden lang. In einer Abbildung sind zusätzlich 20 seltene Einschübe zu insgesamt 140 Nukleotiden positioniert [siehe: 5S Ribosomale RNA Datenbank - PMC (nih.gov); V. Erdmann; Jan 2002; doi: 10.1093/nar/30.1.176]. Die seltenen Einschübe resultieren erkennbar daraus, dass die ideale Molekülform mit 10 Ringen nicht realisiert wurde. Die Wikipedia-Skizze ist mit 10 Ringe und 120 Nukleotiden als Vergleichsbasis verwendbar. Davon sind 2 Basen mit sekundären Sonderfunktionen erkennbar [5S ribosomale RNA – Wikipedia]. Bei Plasmodium falciparum enthält 5S rRNA die Anzahl von 117-119 Nukleotiden [The three 5S rRNA genes from the human malaria parasite Plasmodium falciparum are linked - PubMed (nih.gov); 1988; doi: 10.1016/0166-6851(88)90046-1].
Die ribosomale 5S RNA wird durch das Protein „DNA-gerichtete RNA-Polymerasen I, II und III Untereinheit RPABC3=145 AS synthetisiert [DNA-gerichtete RNA-Polymerasen I, II und III Untereinheit RPABC3 - Plasmodium falciparum (Isolat 3D7) | Publikationen | UniProtKB | UniProt].
In der „11-Zeilen-Lücke“ zwischen dem Ende der 45 Zeilen für die Transfer-RNA (tRNA) und dem „Bakterien-Start“ muss die RNA-Polymerase III eine Synthese nur mit der Zahl „145“ realisieren. Das Darm-Bakterium kann das universelle Protein „5S RNA“ ggf. übernehmen, so dass der Mückendarm und der Darm des Menschen in eine entfernte Beziehung treten. Bindungsmaßnahmen:
1.) Winkelsumme=360°: Weil die Kette der 129 Nukleotiden in Y-Form mit Anfang und Ende umläuft, müssen die Winkel in den 11 Zeilen die „Winkelsumme=360°“ nur aus Null-Zahlen „x0“ergeben. Die Funktion der „RNA-Polymerase III“=145AS bringt mit „45°“ generell den 45°-Winkel ins Spiel. Diese Zeile enthält die Zahl „45“ und die Zählgröße=11. Mit der Zahl 145AS als QS1+4+5=10° wird ein für die Winkelsumme 360° überschüssiger Winkel=10° in einer Zeile blockiert, weil diese Zeile ebenfalls die Zählgröße=11 enthält. Diese Winkelbindung der Zeilen ist nur möglich, wenn die störende Zahl „60“ als Serie #1“60“ beseitigt wird, in dem über alle 11 Zeilen die Sekunden-Zeitbasis=60 einer Sedimentation zeilenweise durchläuft. Somit kann die Sedimentationsgeschwindigkeit des Moleküls als Koeffizient „5S“ in Svedberg-Einheiten (S) zur Messung in einer Hochleistungszentrifuge vergleichbar sein. „Der Sedimentationskoeffizient ist in der Tat die Zeit, die das Teilchen benötigen würde, um seine Endgeschwindigkeit unter der gegebenen Beschleunigung zu erreichen, wenn es keinen Widerstand gäbe“ [Sedimentationskoeffizient – Wikipedia]. Das Molekül wird in Abbildungen T-förmig darstellt, so dass bei voller Weiterentwicklung in die Y-Form gemäß Wikipedia-Abbildung nur ein Ast im 90°-Winkel verbleibt und der andere Ast über die zeilenweise Entwicklung in 5 Stufen 0°-9°-18°-27°-36°-45° weiter öffnet, um 135° Öffnungswinkel zu erreichen. Zufällig steht die Zahl „5“ für die „5“ Winkelphasen und „5“ Svedberg-Einheiten (S). Die Zahl 13 ist dann zunächst zufällig die Zeitbasis 1S (Svedberg)= 1* 10^-13 Sekunden [Svedberg (Einheit) – Wikipedia].
Die 2 Startzeilen können einen Sinn als gleichseitiges Dreieck ergeben. Der Doppelwinkel „60°60°“ zieht eine Grundlinie, die mit der Dopplung „122_122“ von der Zeilen-Nr. Z.8“122“ bis zum rechten Zahlenrand „Form=77_“122“_6“ als Horizont zur 90°-Falllinie der Sedimentation dient. Die Falllinie über den Zeilenlauf ergibt sich als der Zeitbasis=60 über 11 Zeilen. Die Ziffer „1“ in der Serie Z.8“1“xx über 11 Zeilen zählt die Sedimentationszeit. Die Schwerachse=84 ist folglich als Z.“8_[1=Zeit-Zähler]_QS2+2=4“ enthalten: Epi.Ref_Rhesus.Z.“8“1“22“#1“6060“916577“122“6. Das Dreieck als Umriss der Anfangs-T-Form zeigt mit dem Winkel=60° im Zeilenlauf abwärts. Die Zeilen-Nr. enthält mit „1-2-3“ das Durchzählen von Winkelphasen, die sich mit „93_93_6=flexibel_“222=3 Elemente_9_4“ jeweils im Winkelraster=9° weiter öffnen. Die 3 Teile [2229] liegen im Kreis 6_[ ]_4, der die Faltung des Proteins mit der Winkelsumme=360° ergibt. Bei der Anfangs-T-Form zieht die Schwerachse 84 als „8_“9393“_6[]4“ symmetrisch [93-93] senkrecht durch die Dreiecksspitze: Epi.Ref_Rhesus.Z.8“123“#1“60“58“93“93“6“2229“4.
2.) Genstruktur: Das über 2 Zeilen gezogene gleichseitige Dreieck kann die „3 identischen Tandem-Gene“ repräsentieren, weil die beiden enthaltenen Halbgruppen „22“ und „22_2“ zu einer Gruppe 44_2=paarig zusammengefügt werden. Die folgenden Zeilen sind der Gen-Anhang.
3.) Proteine: Über die vordergründigen geometrischen Anordnungen der 119 Nukleotide, kann die Evolution Proteine nach einem mathematischen Pfad produzieren. Die Geometrie muss teilweise umgelagert werden, weil die unveränderbare Ziffernfolge eine funktionelle Bedeutung trägt: 3.1) Zinkfingerprotein=1733AS: In Zeile Z.8126 wird mit Zink=30 das Zinkfingerprotein „Domänenhaltiges Protein vom C3H1-Typ=1733AS wirksam, um eine Ziffernbrücke als Winkel „QS9+9+9=27°“ in der veränderten Ziffernfolge „1373“ anzulegen [C3H1-Typ domänenhaltiges Protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt]. Der Winkel=27° in der Winkelfolge „0°-9°-18°-„27°“-36°-45°“ fehlt, und muss aus einer Quersumme gebildet werden als „QS1+6+0=7=Form_QS5+3+0+“1“=“9“_QS0+6+“3“=“9“_[„7“3“84]_“9“. 3.2) Zinkfingerprotein=538AS: Die Zeilen-Nr.Z.81“30“ enthält Zink=30, um zur Folgezeile einen Zusammenhang herzustellen mit dem „Zinkfingerprotein=538AS“[Zinkfingerprotein, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | Publikationen | UniProtKB | UniProt]. Die Folgezeile wird über die Spalte „5-3“ erreicht, so dass dann horizontal am rechten Zahlenrand die Protein-Ziffer „8“ folgt. Dadurch wird ein Bereich abgegrenzt. Alternativ wird links neben der Ziffer „3“ zur Ziffer „4“ gewechselt und mit der Spalte 4-4_11=Zählgröße in Z.8132 die Summe 4+4=8 gebildet. Die Zeilennummer enthält eine Zählgröße kombiniert mit der Zahl „13“ als Bezug zur Svedberg-Einheit. Abgegrenzt wird 1604“3“[139151320]“8. Die Zahl „13“ ist enthalten und die Anzahl von „5“ Svedberg-Einheiten wird als Zählgröße „151“ markiert. Zur Prozesssteuerung steht Calcium=20 zur Verfügung.
3.3) Calcium-abhängig: Das Protein „Calcium-dependent protein kinase 2 (CDPK2)=513AS stellt einen direkten Zusammenhang zu „5“ (Svenberg-Einheiten)* 10^-„13“ Sekunden“ her. Das Protein zeigt katalytische Aktivität, so dass in den Zeilen weitere Ziffern besetzt werden. Das Protein hat Mg2+ (Magnesium)=12 als Cofaktor [CDPK2 - Calcium-dependent protein kinase 2 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Das Protein liegt neben Calcium=20 als „513_20“. 3.4) Membranproteine: Die Zeilen Z.8130-8132 beschreiben geometrisch den kurzen Gabel-Ast und kodieren am rechten Zahlenrand Proteine, die auf die roten Blutkörperchen als Nahrungsquelle einwirken. Das Protein „Rh5-interagierendes Protein (RIPR)=1086AS besetzt in Z.8132 die Zahl „10“ und überspringt [795]. Der Zahlenteil „86“ wird in „68“ verdreht. Token-68 ist in umgekehrter Transportrichtung für den Parasiten eine Nahrungsaufnahme. Die Randziffer „6“ wird aufgenommen und als Spalte darüber liegt die Ziffer „8“[ RIPR - Rh5-interacting protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Zur Interaktion muss das Protein RH5=526AS benachbart sein [RH5 - Reticulocyte-binding protein homolog 5 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. „RH5“ kann in alle 3 Zeilen aufsteigen. Von der Ziffer „5“ wird die Spalte zur Calcium-„O“ als Seitenschritt im Calcium für die Ziffer „2“ genutzt, darüber liegt die Ziffer „6“. Der Aufstieg gegen den Zeilenlauf ist aufgrund der Winkelsumme=360° zulässig. RH5 wird vom Oberflächenprotein P113=969AS produziert [P113 - Surface protein P113 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. „P113“ beginnt im Rücklauf von Z.8130 neben der Ziffer „6 als „9“ in „69“ nimmt die Ziffer „6“ auf, überspringt in der Spalte Calcium-2[0] und bindet die Ziffer „9“ in Z.8132. Als Nutzen sind „95“ in [7_“95“] gebunden, so dass die Ziffern „10_7=Form“ lesbar sind.
4.) Sedimentation: Der 5-stufige Öffnungswinkel 90°-135° ist ein Sedimentationsprozess, der über den Zeilenlauf gezogen wird. Es sinnvolles Ergebnis entsteht deshalb erst zwischen den Schlusszeilen im kurzen Ast: DELTA.TIME.Z.8131-Z.8132=#1“9“72“84“0“5“2525“ mit QS1+9+7+2+8+4+0+5+2+5+2+5=50 aus QS=31+QS=19, so dass weder Zink=30 noch Calcium=20 direkt adressiert sind. Mit doppelt Kalium=19 als „19_[]_QS=19“ werden die beiden sichtbaren Kalium-Kanäle adressiert, die für den Parasiten notwendig sind. Die beiden Kalium-Kanäle werden von den Proteinen PfK1=1966 AS und PfK2(?)=1653AS erzeugt [Kaliumkanal K1 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt; Potassium channel domain-containing protein - Plasmodium falciparum (isolate NF54) | Publications | UniProtKB | UniProt]. Der Kaliumkanal K2=1653AS zieht mit der O(Null)-Spalte der Serie #160 eine Ionen-Kanal über alle 11 Zeilen und bindet die Null-Spalte in der Zeile Z. 8126 als „16_0_53“ ein. Der Kaliumkanal K1=1966AS startet in Zeile Z.8132 mit der Teilzahl „66“ und zieht links mit der Spalte „1“ zieht über 3 Zeilen hoch, bildet über 4 Null-Zeilen den Ionenkanal „O“ und findet seine Ziffer „9“ über 4 Zeilen. Die Zahl Kalium=19 fehlt vollständig, kann aber als Zeilen-Nr. QS 8+1+2+8=19=Kalium #QS=1+6+0+4+9+0+6+0+5+8+5+5+5+4+8=66 eine Kanalverbindung anlegen, weil der Zahlenteil 66 als QS=66 verfügbar ist. Die Zahl Kalium=19 im Protein PfK1=1966AS klammert den Kreis 6_0_4 mit einem integrierten Ionenkanal als „1_604_9“_0. PfK1 bildet seinen 2. Kalium-Kanal unter 90°, wobei der 90°-Winkel direkt angezeigt wird, weil die eigene Nullspalte des Proteins berührt wird. Zur Interaktion wird ein Calcium-Ionenkanal benötigt, der mit dem Protein „Calcyclin-Ca^2+ bindendes Protein“=228AS erzeugt wird [Calcyclin-binding protein - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt].
In der Startzeile Z.8122 ist der Zahlenteil „22“ enthält und mit Z.QS8+1+2+2=13 und #QS1+6+“0“=7 ergibt die Summe 13+7=20=Calcium. Das Protein liegt an der Kanalspalte „0“ (bereits auch als Kalium-Spalte). Mit der Ziffer „8“ in 822AS wird die Nullspalte mit der Ziffer „1“ als Zähler über 11 Zeilen mit der Ziffer „8“ als Serie Z.8xxx durchgezogen. Die Calcium-Spalte wird in Gegenrichtung zur Kalium-Spalte K2 durchlaufen.
Zur Darstellung der Sedimentation ist die Schwerachse „84“ enthalten. Das Protein bewirkt – wie bekannt - eine Stabilisierung als Struktur=555, die aus den 3 identischen Tandem-Genen hervorgeht. Die Winkelfolge 9° ist mit 9_QS7+2=9 analog zu 25_25 doppelt vorhanden. Die Zahl „5“ entspricht 5 Svedberg-Einheiten (S)= 5* 10−13 Sekunden.
Die Svedberg-Hochleistungszentrifuge erzeugte damals 41000 Umdrehungen / min = 683,333 U/Sek., um Proteine aus dem Zellverband zu lösen und schichtenweise zu trennen. Die Gravitationskonstante G=667,43*10^-13 [m³/(kg*s²)] zeigt die Möglichkeit, den Faktor 10^-13 zu erzeugen. Der Wert von „5S“ müsste um den Faktor 100 erhöht werden, um die Größenordnung der Gravitationskonstante zu erreichen. Die Sedimentationsgeschwindigkeit v nach Svedberg beträgt v= d² [d=Teilchendurchmesser] * Dichtedifferenz von Teilchen und Medium * g [g=relative Zentrifugalbeschleunigung] / (18* ETA-Viskosität [h= 1 (Ns/m²)]). Weil es nach dem archimedischen Prinzip nur auf die Dichtedifferenz ankommt, kann irgendetwas implantiert werden:
In der BiXnom-Formel führt eine Dichte=Wurzel (Pi/2)=1,2533141 zu einem reibungsfreien Zustand, weil die Hülle um den Einheitskreis R=1 als Grenzwert entfällt. Real kommen in diesem Dichtebereich Suspensionen vor, die weder fest noch flüssig sind. Angenommen ein Protein könnte die max. Dichte (Rho) von 1,2533 kg/m³ erreichen und das Medium ist Wasser=1,0 kg/m³, dann beträgt die Dichte-Differenz „0,2533“, was der Hüllendicke im BiXnom-Wassermodell entspricht. Der Bereich ist bisher mysteriös und bautechnisch ungenutzt, weil das Vorzeichen wechselt. Das Protein würde keinen Druck wie ein Sandkorn erzeugen, sondern einem Druck standhalten müssen. Die Svedberg-Einheiten „S“ betragen für Proteine „1-25“, für Ribosome 70-80 und für Zellen 10^6 bis 10^8 [siehe: Ultrazentrifugation - Lexikon der Biochemie (spektrum.de)] Die Maßeinheit =“1 S“ bezieht sich auf Proteine, die sich langsamer als größere Zellbestandteile absetzen. Ersichtlich ist, dass die maximale Protein-Einheit „25S“ um den Faktor 100 höher angesetzt ist, als die Dichtedifferenz „0,2533“. Wenn es also statt „5“ theoretisch „500“ darstellbar sind, erreicht das „5S rRNA-Gen“ einen entfernten Zusammenhang mit der Gravitationskonstante. Mit „25_25“ erzeugt das Tripel-Tandem-Gen somit den Sedimentations-Grenzwert für Proteine von 25S. Der Sedimentationsprozess dauert mehrere Minuten, so dass 1S=1*10^-13 Sekunde keine gemessene Zeit darstellt.
5.) AP2-Transkriptionsfaktoren: Bei Apicomplexa-Parasiten werden pflanzenspezifische Proteine aus der AP2 (ApiAP2) Transkriptionsfaktorfamilie benötigt, um die Genexpressionsprogramme zu regulieren [Inhibitoren der ApiAP2-Protein-DNA-Bindung zeigen mehrstufige Aktivität gegen Plasmodium-Parasiten | PLOS Krankheitserreger]. Weil diese Proteine vom Menschen und der Mücke nicht produziert werden, sind Impfstoffe von Interesse, die diese Proteine hemmen. Das Protein „AP2-Domänentranskriptionsfaktor“=3858AS wird codiert und ist zur Prozesssteuerung mit Calcium=20 notwendig [AP2-Domänentranskriptionsfaktor, mutmaßlich - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Die Zahlenfolge wird als „8538“ gespiegelt. Mit dem Zahlenteil „38“ wird Calcium=20 markiert als 3_“20“_8. Die Ziffer „5“ wird von der Zahlgröße „1_5_1“ markiert, so dass zur Findung der Ziffer „8“ eine Rechenaufgabe zu lösen ist. Die linke Restgröße ergibt QS1+6=7=Form_QS0+4+3+1+3+9=20=Calcium. Weil Calcium doppelt vorhanden ist, wird die Beziehung zur gesuchten Ziffer „8“ in der 11-Zeilen-Randspalte der Zeilennummern nicht als Spiegelung, sondern notwendig als Dopplung „Z.8_13 [1]#__13“ hergestellt.
Struktur des codierten Proteins 5S rRNA [„1“ Extra-Base]: Die gabelförmige 5S rRNA enthält auf dem längeren Ast 4 Ringe und auf dem kürzeren Ast 5 Ringe sowie im Zentrum, eher dem Stiel zuzurechnen, einen 1 Ring, so dass insgesamt 10 Ringe zu adressieren sind. Die Zeilen Z.8122 und Z.8123 enthalten die Geometrie der 3 identischen Tandem-Gene. Das Basisdreieck mit den Winkel 60°_60° und 60° erzeugt eine unsymmetrische Y-Form. Im Durchschnitt beider Zeilen mit QS=59 und QS=69 bildet sich ein Kreis=64. Der Kreis kann die Ursache zur Bildung eines Zentrums für die Faltung sein. Die beiden Zeilen-Nr. mit QS=13 und QS=14 bilden den Mittelwert „13,5“, der eine Beziehung zur Sedimentation 5 (S)*10^-13 zeigt. Die Entwicklung von einer T-Form mit 90° zu einer Y-Form mit 135° in 5 Winkelphasen „9°“ ist lediglich eine Annahme, die als „QS1+6=7=Form_6060_“9°“_QS1+6=7=Form“ unterstützt wird. Die Strangbildung kann durch die Doppelziffer 77=Form als Zählgröße „91_QS6+5=11_77_1“ entstehen, weil mit 911_1[77]1=Zählgröße die Anzahl der 119 Nukleotide gespiegelt wird. Welche der 4 möglichen Basen eine Position besetzt, ist nicht ersichtlich. Als Kettenreaktion könnten sehr viele Zeilen zur Information entstehen. DELTA.TIME.Z.8131-Z.8132=“19“77“21“489316“ zeigt, dass an der Faltung „77“ Kalium=19 und als Mittelwert 19+21=20=Calcium der Prozesssteuerung dienen. Die Restzahl sind gespiegelte Schwerachse „48“ und Kreis= QS3+1=6_4 sowie der Phasenwinkel 9°. Im Wikipedia-5s rRNA-Vergleichsmodell liegen nur 118 Nukleotide geometrisch geordnet vor. Es können 2 Alibi-Nukleotide zur funktionellen Ergänzung gefunden werden. Der 1. Alibi-Nukleotid liegt seitlich am Strang und wird als Achsmarkierung bei einer Umgruppierung benötigt. Die 120 Nukleotide ergeben sich durch den 2. Alibi-Nukleotid, der nicht direkt ablesbar ist. Der 120. Nukleotid ist das hier angenommene Drehzentrum bei der Sedimentation und verdeckt den Öffnungsspalt zwischen Stiel und kurzem Ast. Bei einem T-förmigen Ausgangsstadium mit der Stielachse unter 90° wird der Nukleotid nicht benötigt. Im Endstadium als Y-Form beträgt der Öffnungswinkel 90°+45°=135°. Zum Beginn der letzten Sedimentationsstufe im Winkel 135° - 9°= 126° muss die Drehachse voll sichtbar sein. Links von der Form=77=Form können 119 Nukleotide gelesen werden, so das die „2.“ Alibi-Nukleotide auf der rechten Seite im Winkel=126 als Winkel =“1_[„2.“ Extra-Base]_26“ =126° zu lesen ist. Startzeile: Epi.Ref_Rhesus.Z.8122#16060“9165“77“1“2“26“.
Langer Gabel-Ast [52 Basen]: Der lange Gabel-Ast wird mit der Serie „05“ über 4 Zeilen mit 4 Ringen gebildet. Nullen sind in den Zeilen vorhanden, so dass die Serien-Null=„05“ nicht als Ring verwendet wird. Die Schwerachse=84 ist in der Z.-Nr. „8“12“4“ enthalten. Das in der Serie enthaltene Magnesium=12 resultiert daraus, das an die „tRMA“ als vorheriger Genbereich an die Aminosäure noch „MgCl2=12+17*2=46“ angehängt wird. Am rechten Zahlenrand zeigt die Ziffer „2“ zwei Basen am Zentrum an, die vor dem 1. Ring „64“ als 6_3_4_Ring=O_9=seitlich mit QS3+4=7 Ringbasen liegen. Die 3 Basenpaare (6 Basen) „6_9=seitlich_6_2=paarig“ folgen: Epi.Ref_Rhesus.Z.“8“12“4“#16“05“6962“634“0“9“5“2. Die Ast-Fortsetzung ist über den rechten Rand „52“ mit der Spiegelung „25“ in der Zeilennummer möglich. Am 11er Ring liegt direkt ein 8er Ring, so dass 2x „64“ vorliegen als “60[5]4“98“6_[3925]_4“0[3]“. Die Ringbasen-Anzahl ist in 9+2=11 und 3+5=8 enthalten. Die Randziffer „3“ muss noch zur „5“ in 60“5“4 zu 8 Ringbasen addiert werden. Eine Verschiebung ist möglich, weil „925“ auch links als Z.QS8+1=9_25 vorhanden ist. Mit der Dopplung „54_54“ können nochmals 2 Zeilen zu insgesamt „4“ Zeilen mit der Serie-0“5“ angehängt werden: Epi.Ref_Rhesus.Z.“8“1“25“#1“6054“98“639254“03. Die folgenden beiden Zeilen müssen Inhalte tauschen, weil erst 4 Basenpaare und dann der Außenring folgen kann. Es wird eine zusätzliche Base als 1 Alibi-Base benötigt, die beim Inhaltstausch die Zeile weiterhin als Fixpunkt repräsentiert. Die Zahl 530“1“ ist in der Folgezeile mit „1“035 an der Null-Spalte gespiegelt vorhanden, so dass 1 Alibi-Base mit QS5+3=8=Extra den Platz halten kann. Mit der Ziffer „O“ in beiden Zeilen ist ein Drehung im die Drehachse, die als Spiegelung 53_35 im Schwerpunkt zwischen 3,5 Strangbasen und 3,5 Kreisbasen (Kreismittelpunkt) liegt. Neben der Nullspalte liegt rechts eine Platzhalter-O(Null), so dass eine Spiegelung der „53“ mit Kommastelle 3,5 Basen für den Drehpunkt möglich ist. Zugleich sind beide Zeilen gekoppelt. Die 1 Alibi-Base liegt dann 1=links (Blick vom Zentrum) unharmonisch seitlich am Strang aus 4 Basenpaaren, der jedoch erst im Tausch aus der Folgezeile resultiert. Der Ring „64“ als „6_[3738]_4_seitlich=9=Basen“ enthält als Bezug QS7+3=10 Gesamt-Ringanzahl und QS3+8=11=Zählgröße einen unwichtigen Inhalt. Der Ring wandert „6_[ ]4_9“ inhaltlich aufgrund der Spiegelung „496“in die Folgezeile: Epi.Ref_Rhesus.Z.8126#160“53010“6“3738“4“9“. Die Schwerachse „84“ verhindert in „684_4“ den Kreis „64“, so dass ein Strang aus 8 Basen und aus 4 Basenpaare „44“ als Gruppe gebildet wird. Die Zahl „96“ enthält den aus der Vorzeile gespiegelten Kreis aus 9 Kreis-Basen. Der lange Ast enthält: 1 Basenpaar am Zentrum, 7 Kreisbasen, 3 Basenpaare als Strang, 11 Kreisbasen, 8 Kreisbasen, 4 Basenpaare als Strang + 1 Alibi-Base, 9 Kreisbasen= 34 Kreisbasen + 8 Basenpaare als Strang und 1 Alibi-Base seitlich am Strang=35 Kreisbasen + 2 * (8 Basenpaare) + 1 Alibi-Base = 52 Basen: Epi.Ref_Rhesus.Z.8127#16“05“1035“36“8“44“96“.
Stiel [25 Basen]: Der Stiel beginnt als Zentrum „5“8“555“ mit einer formlosen Kette aus 8 Basen. Davon werden 2 Basenpaare gebildet, die jeweils den Ansatz für die beiden Stränge der kurzen Gabel und des Stiels bilden. Die restlichen 4 Basen legen einen Halbring zwischen dem Stiel und dem langen Gabel-Ast: Epi.Ref_Rhesus.Z.8128#160490“6“058555“4“8“. Die 2. Stielzeile muss mit Calcium=20 aus der Zeilennummer Z.QS8+1+2+9=20 angebunden werden, um als Addition zur Zahl 70 mit 70+20=90 als Spalte darüber den Winkel=90° als Stiel zu finden. Weiterhin wird zur Vorzeile eine Spalte „58-85_2“ gebildet, die den Anschluss an „2“ Basen am Zentrum zeigt. Weil 1 Basenpaar bereits im Stiel liegt, folgen nunmehr als EXTRA=88 zur Strangstreckung 8 Basenpaare. Der Strang wird einseitig um 1 Base verlängert (inklusive 1 Base im Strangansatz 10 Basen). Der Unterschied von „8“ und „9“ Basen entspricht dem rechten Rand beider Zeilennummern. Die Zeilen-Nr. enthält mit der Zahl „12_9“ die Möglichkeit die Ziffer „9“ mit der Spiegelung Z.x12_9#_21 an den rechten Zahlenrand zu fördern. Die 9. Base wird über die Ziffer „9“ in der Zeilen-Nr. Z.[8]12_“9“#_[5]_21_[3] durch eine Spiegelung zum Zahlenrand zu transportiert. Eine Spalte zeigt die Ziffern 8 und 9 in anderer Zeilenzuordnung „9“06-„8“6.
DELTA.TIME.Z.812“8“-Z.812“9“=#“1“9“74“29“70“33[5]3“ zeigt mit QS7+4=11 und QS2+9=11 zwei Zählgrößen, so dass die Ziffer=9_7=Form lesbar ist bzw. die Ziffer 1 Base zur Ergänzung bildet. Summe Stiel= 8 Zentrum-Basen + 2* (8 Basenpaare) + 1 Base=25 Basen. Die 2. Extra-Base in der Lücke zwischen Stiel und kurzem Ast wird gesondert gezählt: Epi.Ref_Rhesus.Z.“8“12“9“#160470862“88“5“21“3“.
Kurzer Gabel-Ast (42 Basen): Über 3 Zeilen bilden sich aus Serie „1604“ und einer Ziffer „1“ im Bedarfsfall 5 Spalten. Die Zahl „16“ als QS=1+6=7=Form ist doppelt enthalten und mit der Zeilen-Quersumme QS=61 als Spiegelung. Mit der 60er Serien-Spalte wird eine Winkelsumme=60+60+60=180° für eine Drehung des Kreises „604“ verwendet. Das Basenpaar zum Anschluss an das bereits vorhandene Stiel-Basenpaar liegt auf der falschen Ringseite und muss die Seite wechseln. Zwischenstege zwischen den 5 Ringen (6er, 14er 10/4 geteilt, 14er und 6er) sind nicht vorhanden. Die 5 Ringe zählen sich als „604=Ring_Anzahl=5_11=Zählgröße“. Die 6 Ringbasen am 1. Ring „604“ summieren sich als QS 1+[Ring=604]+5+1=6. An der Zählgröße „11“ sitzt das zu drehenden Basenpaar mit 2 Nukleotiden als „11_2“. Die Restgröße „4_77_16_QS9+7=16“ enthält eine Dopplung der Zahl „16“ als QS1+6=7=Form für die weitere Entwicklung. Die Zahl „77“ enthält QS7+7=14 zur Bildung einer doppelten 14er Ringform. Wegen „4_77“ können die linken Ringbasen keinen 14er-Ring bilden, sondern 10er Ring und 6er Ring verschmelzen zu 14 Ringbasen. Diese sind im Gleichgewicht mit dem benachbarten 14er Ring.
Die Ringverschmelzung wird in der Restgröße als Form markiert „7_169_7, wobei die Verschmelzung durch einen Kunstgriff symbolisiert wird, indem die Zahl 9=seitlich unsichtbar wird und scheinbar eine Minderung erzeugt als „QS1+6+“9“=16“: Epi.Ref_Rhesus.Z.8130#“1“604“5“11“2“4“77“169“7. Die 3 Zeilen bilden einen gemeinsamen Ast, weil sich an der Spalte „1“ die Zählgröße spiegelt [11; 313; 11]. Am rechten Zahlenrand werden die 28 Ringbasen verteilt über 3 Ringe [14er Ring (verschmolzen aus 10er/6er) plus 14er Ring=28 Ringbasen] mit „3“_2_Ring=0_8“ adressiert. Es fehlt noch ein 6er Außenring: Epi.Ref_Rhesus.Z.8131#“1“604“313“9151“3“208“. Für den Außenring werden 6 Ringbasen gesucht. Vorhanden ist die Basisform „604“. Die Zeitdifferenz enthält wie in der Zeile die Zahl 66, für die Besonderheit, dass die beiden 6er Ringe den kurzen Ast an beiden Enden begrenzen. Im Unterschied „4“6“1_41“ ist die Ziffer „6“ für „6“ Ringbasen genannt – die Zahl 46 ist als Gegenform auch ein Ring: DELTA.TIME.Z.8130-Z.8132=39“4“6“1“66“37“41“2. Die Quersumme der Zeile ergibt QS=56 analog zur Zahl 56 am Zahlenrand mit QS5+6=11. Die Teil-Zahl „63107956“ ergibt zunächst einen Basisring „64“ als „6_QS3+1=4_O=Ring“. „Form=7_QS9+5=14 Ringbasen als Nachbarring_6er Außenring mit „6“ Ringbasen als Zahlenrand: Epi.Ref_Rhesus.Z.8132#160“4116“6310“795“6“.
Das wissenschaftliche Strukturmodell besteht aus fünf Helices (I–V), zwei Haarnadelschleifen (C und D), zwei internen Schleifen (B und E) und einem Scharnierbereich (Loop A), die den Drei-Helix-Übergang bilden. In diesem Modell ist eine T-Form mit etwa 120 Nukleotiden und weiteren seltenen Ergänzungen abgebildet. Die rRNA wird als Strukturgerüst ribosomaler Proteine benötigt. Weiterhin ist die rRNA die wichtigste katalytische Komponente der Peptidyltransferase [siehe: 5S Ribosomale RNA Datenbank - PMC (nih.gov); V. Erdmann; Jan 2002; doi: 10.1093/nar/30.1.176]. Die Peptidyltransferase ist die primäre enzymatische Funktion des Ribosoms, welche während der Proteinbiosynthese mithilfe von „tRNA“ die Peptidbindungen zwischen Aminosäuren formt [Peptidyltransferase – Wikipedia]. Eine Peptidbindung ist eine Carbonsäureamid-Bindung, die zwei Aminosäuren über die Carboxygruppe der einen Aminosäure und die Aminogruppe der anderen Aminosäure verknüpft. Die Carboxygruppe am C-Terminus mit OH=8+1=9 verbindet sich mit der Aminogruppe am N-Terminus mit H2N=2+7=9 zu einer NH-Bindung [7+1=8], wobei H2O freigesetzt wird [Peptidbindung – Wikipedia]. Die NH-Bindung ist durchgehend in der tRNA und rRNA als Serie Z.8xxx vorhanden. Wasser H2O=“28“ wird in Zeile Z.8131 am rechten Zahlenrand als „2O8“ abgesondert, wobei die Ziffer „8“ die Verbindung zur Serie Z.„8“ herstellt. Bei der Peptidbindung treffen die Ziffern „9_9“ zusammen, so dass sich die Peptidbindung als [3]_„9“_[1]_QS5+1+3+2=“9“_Wasser=2_0_8 darstellt. Die Zahl [3][1] ist als Spiegelung der Katalysator einer NH=“8“-Bindung zur Zeilen-Nr. Z.“8“ [1]_[3]_1.
Ribosomale 5.8S-, 18S- und 28S rRNA-Gene:
Im Kerngenom sind insgesamt 7 Gene enthalten, die in 7 Zeilen liegen. Im Allgemeinen entstehen die codierten 3 Proteine gemeinsam aus einem 45S-Vorläufer, der von der „RNA-Polymerase I“ transkribiert wird.
Ribosomale 5.8S-rRNA-Gen: Der Sedimentationskoeffizient=5,8S enthält mit 4+4=8 aus „5“414“ eine Gruppe 44, wobei die Endzahl in allen 3 Genen mit 5,8 S/ 18 S und 28 S enthalten ist. Die Form bildet sich über 2 Zeilen als großer Ring mit diversen unsymmetrischen Anhängen [siehe: 5.8S ribosomale RNA – Wikipedia]. Weil direkt kein Ring vorhanden ist, wird die ringförmige Bogenkette mit Anfang und Ende im Ring mit einer Lücke als mathematischer Durchschnitt von 70 Ringbasen aus der Quersumme beider Zeilen von QS=69 und QS=71 gebildet. Im Kreis sind 2 Bögen von 39 + 18= 47 Ringbasen notwendig, um als ein Seitenzentrum mit 13 Basen Ansätze für diverse Anschlüsse mit Steg und Endring vorzubereiten. Diese Verteilung kann dann auch im Code gelesen werden Ring=0_Bogen=39_1]9]_3[9]. Mit 9+9=18 Ringbasen ist der 2. Bogen im großen Kreis adressiert. Die Zahl „13“ ist die Kette im Zentrum aus 2 Quadraten mit je 4 Basen und einer Halbringkette aus 5 Basen. DELTA.TIME.Epi.Ref_Rhesus.Z.8133-Z.8134=#“19“7“18“70“414“98 enthält die 70 Ringbasen. Weiterhin sind die Gruppe 414 sowie QS1+9=10_7_“18“_7 die Gruppenmitglieder 18S und 10+18=28S zählbar. In der Gruppe 414 ist die Ziffer „1“ markiert, die als Besonderheit eine Spalte „1“ über 4 Zeilen eine Gruppenverbindung erzeugt. Gemäß Zeilen-Nr. Z.“8“13“4“ erzeugen die 13 Zusatz-Ringbasen eine Schwerachse „84“, die auch im Code enthalten ist. Das Protein 5.8S rRNA geht aus der Vorstufe, dem Protein „40S ribosomales Protein S8“=218 AS, hervor [40S ribosomales Protein S8 - Plasmodium falciparum (Isolat 3D7) | UniProtKB | UniProt]. Das Protein „KRR1 kleine Untereinheit“=300AS wird für das Protein 40S benötigt. Damit werden die beiden Spaltennullen in der Serie#_03 besetzt [KRR1 small subunit processome component - Plasmodium falciparum (isolate Dd2) | UniProtKB | UniProt].
Das Protein 40S=218 AS liegt beidseitig neben der Schwerachse, um die Schwerachse als Spalte „1“ über 4 Zeilen der Gruppe zu ziehen. Dabei wird 40S aus „220“ als „2*20=40 S gezählt 2_[220]_[84]_QS9+9=18“ gebildet. Bei den Eukaryoten wird „5.8 rRNA“ aus 160 Nukleotiden gebildet. Diese Anzahl ist als Serie #160 vorhanden. Entsprechend können in den Anhängen am Zentrum noch 160-70=90 Nukleotide gesucht werden. In beiden Zeilen sind hälftig 8 x Ziffer 9 mit 8*9=72 enthalten. Mit 72_2 werden noch 2 Ereignisse auf 10 Ereignisse „9“ zu fiktiven „90“ restliche Nukleotiden gezählt. Die beiden scheinbar fehlenden Ziffern „9“ sind als Z.QS8+1=9 auch in beiden Zeilennummer zu finden: Epi.Ref_Rhesus.Z.8133#160“39“1“9“3“9“55414“9“ und Epi.Ref_Rhesus.Z.8134#16037“2“2“20“84“9999“.
Ribosomale 18S-rRNA-Gen: Das Protein „18S rRNA aminocarboxypropyltransferase“=318AS enthält bereits das Merkmal 18S [18S rRNA aminocarboxypropyltransferase - Plasmodium falciparum UGT5.1 | Publications | UniProtKB | UniProt]. Das Protein „3[7]18 AS“ enthält die Spalte „1“, an der sich 71 und 17 spiegeln. Das Gen liegt somit in 2 Zeilen. QS1+7=8 mit der Spalte „1“ über 4 Zeilen bildet sich die Schwerachse „84“. Dieses erklärt, dass in der Zeitdifferenz der Winkel=90° enthalten ist. DELTA.TIME. Epi.Ref_Rhesus.Z.8135-Z.8136=#19“70“90“10“200“8. Mit der TIME.DELTA-Winkelsumme=200+70+90=360° kann im Protein ein Kreis gebildet werden. Wasser „2[00]8“ als „28“ ist dann zwar nicht mehr möglich, steht aber im Code als Ziffer „10“ mit H2O=2+8=“10“ zur Verfügung. Die Form des Moleküls ist hier z.Z. nicht bekannt. Bei den Eukaryoten wird „18S rRNA“ aus „1874“ Nukleotiden gebildet [Ribosomale RNA – Wikipedia}. Diese Anzahl ist teilweise mit einer Spiegelung „781“ als Randzahl vorhanden, so dass die Ziffer „4“ über die Verbindung zur 2. Zeile zu lesen ist. Hierfür muss die Ziffer „1“ in der Spalte „1“ mit der Ziffer „3“ in der Spalte „3“ als 1+3=4 für insgesamt „1874“ codierte Nukleotide addiert werden: Epi.Ref_Rhesus.Z.8135#16035250699“3“7“18 und Epi.Ref_Rhesus.Z.8136#1603327979835“17“.
Ribosomale 28S-rRNA-Gen: Die 28S-rRNA ist 4000–5000 Nukleotide lang. Einige Eukaryoten spalten 28S rRNA in zwei Teile, bevor sie beide zum Ribosom zusammensetzen, ein Phänomen, das als "versteckter Bruch" bezeichnet wird [28S ribosomale RNA – Wikipedia]. Bei den Eukaryoten sind 4718 Nukleotide codiert. Die Zahl „7000_11“ ergibt daher nur eine große Form, die mit der Zählgröße „11“ gebildet werden muss. Hierfür werden die Markierungen beachtet: Ziffer „4“ aus der Gruppe „9“44“9¬¬¬_“4“. Ziffer „7“ aus der Markierung der Ziffer „3“ in der Spalte über 3 Zeilen als „7_3_7“ und dann als Dopplung „37“ am Zahlenrand „37“ mit der Randziffer „7“, um die Gesamtheit zu symbolisieren. Die Zahl „18“ kann aus der Zeilen-Nr. Z.“81“3x gespiegelt werden, weil im Code die Spalten „3“ und „1“ gespiegelt sind. Um die Gesamtheit als Matrix auch vertikal einzubinden, wird die Zahl „18“ beidseitig der Zählgröße adressiert als 7_3_7_11_QS5+3+7=15, wobei „15+markierte 3=18“. DELTA.TIME. Epi.Ref_Rhesus.Z.8137-Z.8139=#“39“39“380607“39“. Weil sich die Anzahl der Nukleotide aus einer Zählung im Kreis ergibt wird eine Winkelsumme von 360° benötigt. Die Zahl „Zink=30“ ist als Winkel überschüssig und muss durch ein Zinkfingerprotein besetzt werden. Die Winkelsumme=60+60+60+10+70=260° enthält ein Winkeldefizit=100°, so dass „001_1“ als Winkel=100° gespiegelt zu lesen ist. Das Zinkfingerprotein „C3H1-type domain-containing protein“=1733AS [C3H1-type domain-containing protein - Plasmodium falciparum Santa Lucia | UniProtKB | UniProt] muss für die Zahl „33“ die Markierung 9_“33“_9 nutzen. An der Spalte 39_93 spiegelt sich die Ziffer „3“ in die Vorzeile hoch in „9“3“8_17. Der Zahlenteil „17“ ist lesbar, kann aber auch als „9+8=17“ gebildet werden. Die Anzahl 1733 AS entsteht ebenfalls in gespiegelter Ziffernfolge abwärts von „33“ in der Spalte zur 7_[000]_1: Epi.Ref_Rhesus.Z.8137#1“60“31“30“938“17“6“10“; Epi.Ref_Rhesus.Z.8138#1“60“29“33“9449“4“212; Epi.Ref_Rhesus.Z.8139#1“60“2“737“0“00“11“53“7“.
...
Merozoit: Der Parasit wird je nach Spezies im Durchmesser =1,5 bis 2,5 µm erzeugt. Die 1,5 µm stehen mit 15 am rechten Zahlenrand und die 2,5 µm in der Z-.Nr. als Z.QS7+8+3+7=25, sofern man den Vergrößerungsfaktor von „nm auf µm“ erklären kann. Die Zahl 15 ist gegenüber 1,5 schon vergrößert, so dass statt 1000 ein Faktor 100 versteckt ist. Mit der Zählgröße 11 als Klammer 1_“6“8“4“8_1 wird in einer doppelten Markierung durch „1/8“ der BiXnom-Kreis=64 für die Kugelform markiert. Die Markierung ergibt aus „6644“ zwei Faktoren QS 6+4=10 *QS 6+4=10 =Faktor „100“. Der Bezug auf die „Form= 7_Serie= 83=QS 8+3=11=Zählgröße_7 zählt die nachfolgenden Zeilen zu einer zeitlichen Entwicklungsphase als Merozoiten-Kreislauf-Gruppe „6644_5=Struktur“. Der Angriff auf einen Erythrozyten=26=Blut=Eisen ist als Umklammerung mit der Zählgröße 1_QS 6+8+4+8=26=Blut_1 markiert. „1. Zeitebene“: Die Subtraktion=26-1-1=24 Stunden ist eine Zeitbasis 1+1=2 *24= 2 Tage. Diese Dauer eines Vermehrungszyklus erzwingt eine Trennstelle, weil gleichwertig 48 Stunden folgen. „2. Zeitebene“: Die gesamte Zeile ergibt eine Quersumme=78. Folglich bildet die Subtraktion des Überschusses QS 8+4+1+5=18 die Zeitbasis=60 Minuten/Sekunden nach Wahl. Die beiden 10er Multiplikatoren adressieren die Eindringzeit in den Erythrozyten als Addition zu 10+10=20 Sekunden. Die Zeit wird am Ende des Zyklus für die Wiederholung nochmals entwickelt. Das Protein „Merozoite surface protein (MSP 1)“ ist statt mit 1682 Aminosäuren abweichend als 1684 AS enthalten, und wird als Maß für den Vermehrungszyklus zeitlich bis zu einer Korrekturgröße „82“ am rechten Zahlenrand gestreckt: Epi.Ref_Rhesus.Z.“7“83“7“#1“6644“987“1684“81“5“.
Im Erythrozyten Z.QS7+8+3+8=26=Blut wird die Gewebsform des Parasiten als junger Trophozoid adressiert. Der Parasit besitzt keinen eigenen Stoffwechsel und benötigt daher Nährstoffe. Die Malaria-Infektion ist mikroskopisch an Verfärbungen durch Hämoglobin-Abbau an der Maurer’schen Spalte der älteren Trophozyten festzustellen. Der Parasit „erkennt“ sich selbst als EXTRA=8 in der Blutzelle, indem die infizierte Zelle in eine Bildsprache blutig als 2“8“6 übersetzt wird. Im Zeilencode läuft die Serie #166 als Spaltentransporter über mehrere Zeilen, so dass der Kontakt von Parasitenmembran „33“ und Wirtsmembran „33“ als Addition 33+33=66 vorhanden ist. Die Infektion „1_64_1“ ist ersichtlich heftig, weil sie auf einen energetischen Tiefpunkt (downwards Hurrikan) abzielt. Eine Zeitbasis=60 Minuten/Sekunden (nach Wahl) ist aufgrund der Zeilen-QS=66 abzüglich der markierten Ziffer „6“ in 41_6_41 vorhanden. Es handelt sich mit der Doppeldeutigkeit statt Blut=26 um 26 Stunden Entwicklungszeit für den Trophozyten (Restzeit 48-26=22h): Epi.Ref_Rhesus.Z.“7838“#1“66“4“286“354“1641“9.
Der Trophozit vergrößert sich, indem die inneren festigenden Strukturen der Pellikula abgebaut werden. Die gewundenen Aus- und Einbuchtungen des Zellplasma bewirken nach 20-„24“ Stunden eine Ringform des jungen Trophozoiten. Die Zeit=1+6+6+4+0+7=24 wird trotz fehlender Null als Trennstelle abgetrennt, weil QS 7+4=11=Zählgröße. Alternativ: 66_QS 4+0+7+4+0+4+5=24=Zeit_66. Die Besonderheit der Zahl „74“ führt zu Ubiquitin [siehe: Molekulare Konservierung der 74-Aminosäure-Sequenz von Ubiquitin zwischen Rindern und Menschen | Natur (nature.com)]. Das Zellplasma des Erythroziten wird durch eine Öffnung D=“40“-100 nm aufgenommen, wodurch im Zellplasma des Parasiten eine Nahrungsvakuole entsteht als „40nm-Öffnung=40_Form=7_Vakuole=404“ oder Ringform. Das abgebaute Hämoglobin wird in der Vakuole gespeichert. Mit der Restzeit „QS 4+0+4+5=13 Stunden ergeben sich 37 Stunden. In 24-36 Stunden nach der Invasion bilden sich auf der Oberfläche knopfförmige Ausbuchtungen (Knobs), h/b=40nm/100nm, mit Antigenen als Schlüssel-Schloss-Prinzip „56“ um weitere Erythrozyten anzulagern. Bei einer Anlagerung an die Gefäßwand kann der Parasit nicht mit dem Blutstrom zu den Makrophagen in der Milz gelangen: Epi.Ref_Rhesus.Z.7839#166“40“7“404“56“6130.
Beim Dezimalwechsel in der Z.Nr.xx40 springt die Zahl 38=QS3+8=11=Zählgröße in den Code. Der Parasit produziert nunmehr ganz speziell das „Plasmodium falciparum Erythrozytenmembranprotein 1 (PfEMP1). PfEMP1 sitzt dann auf der Oberfläche des infizierten Erythrozyten und kann damit weitere Erythrozyten als Nahrungsquelle anlagern [siehe: Plasmodium falciparum Erythrozytenmembranprotein 1 – Wikipedia]. Für PfEMP1=1711 Aminosäuren ist bereits im Anfangsbereich eine Serie vorhanden [siehe: Erythrocyte membrane protein 1, PfEMP1 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. An der Maurer’schen Spalte=111 ist PfEMP1 aufgrund der Bildsprache unsichtbar: „PfEMP1=17_(oben=9)_1_(3=Haut)_1= 1711 Aminosäuren“. Die „störende“ Ziffer 9=oben, ist hier nicht alternativ 9=seitlich, weil mit der Folgezeile zielführend ein Spalte gebildet wird (9 unter 9). Das Maurer-Spaltprotein (Pfsbp1) =338 AS, in Zusammenarbeit mit dem folgenden Erythrocytenprotein LANCL1, ist in Bildform zerlegt, in dem nur noch die „38“ verbleibt, weil die Ziffer 3 in der Spalt-Zählgröße „11“ als „1“3“1“ geklammert wird - die Zahlenspaltung bewirkt den Spalt. Aufgrund der Zahlenspaltung „131“ als Zählgröße, darf ohne eine Null-Trennstelle als Restgröße QS 1+3+1+8+7+4=24=Zeit abgespaltet werden. Aufgrund der im Zeilenlauf „eingesprungenen“ Zahl „38“ handelt es sich um 38 Stunden bis der Trophozit in den Schizont mit einer Bildung von 8 bis 32 Kernen übergehen soll:
Epi.Ref_Rhesus.Z.“7840“#1“66“38“6“17“9“1“3“1“874.
Ein Maurer findet die Maurer’sche Spalte 959_“111“ als QS9+5+9+1+1+1=26=Blut=Eisen. Das
Erythrocytenprotein LANCL1=399 AS fügt für die Membranzisterne (MC) mit 64_5 eine gekrümmte Struktur als 3“64“9“5“ in Bildsprache ein. Die Membran „33“ entsteht, weil das Maurer-Spaltprotein (Pfsbp1) die Ziffer „3“ abgespalten und nach rechts transportiert hat. Jetzt kann diese „3“ an die vordere „3“ von LANCL1 als intrazelluläre Membran „33“ binden. In der Phase eines Schizonten lösen die Tochterzellen einen calcium-abhängigen Prozess aus, um die Wirtszelle zu schädigen (Ruptur); entsprechend ist mit QS 7+8+4+1=20=Calcium verfügbar: Epi.Ref_Rhesus.Z.“7841“#166“3“64“9“5“9“111“580.
Der Malaria-Parasit produziert selbst die Proteine Stevor und Rifin, um diese auf die Oberfläche der Wirtszelle (RBCs) zu transportieren. Bisher nicht infizierte Zellen werden durch Adhäsion angelagert (Rosetting) [siehe: Membrane integration and topology of RIFIN and STEVOR proteins of the Plasmodium falciparum parasite - Andersson - 2020 - The FEBS Journal - Wiley Online Library; A. Andersson (Dez.2019); https://doi.org/10.1111/febs.15171 ]. Für beide Proteine liegt jeweils eine Zeile vor. Die Ausschüttung des Proteins „Rifin=“317 AS“ ist direkt lesbar [siehe: Rifin - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt ]. Die Ausbreitung der Infektion durch Anlagerung noch nicht infizierter Zellen ist als Gruppen-Struktur „44_5“ als Ziel avisiert. Weil der BiXnom das Periodensystem mit Lichtgeschwindigkeit permanent darstellt, kennt die Evolution auch die Temperaturen in Grad Celsius. Das Fieber wird in der Zeilennummer mit 42°C avisiert und im Code mit 43°C begrenzt. Die Grenztemperatur liegt mit der Kommastelle genauer bei 42,1663°C: Epi.Ref_Rhesus.Z.78“42“#“1663“43“744“5“0“317“5“. Stevor liegt in sehr vielen Varianten vor, eindeutig handelt es sich um „Stevor (096111-096111_PLAF7)=304 Aminosäuren“. Die Verwendung für die Plasmodium falciparum „Maurer´s cleft“ wird bestätigt [siehe: Stevor - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt]. Der Vermehrungszyklus der Merozioten kann im Zeilenlauf nicht direkt stattfinden, weil es keinen Weg in die Vergangenheit gibt. Diese Problem wird immer durch 2 rechte Winkel gelöst (2x Abzweig: ja / Wende: nein). „Stevor“ wird mit dem ersten der beiden 90°-Bögen verbunden. Weiterhin ist der Tophozoit zum Schizont mit seinen „32“ Kernen angewachsen. Der Kern mit der Basiszahl „5“ für den Goldenen Schnitt ist erkennbar als „QS3+2=5_QS2+3=5__5“. Andere Spezies lesen in „535“ nur 8 Kerne als QS 5+3=8_5=Struktur. Aus den 32 Kernen im „Schizont“ entwickeln sich dem „Merozoiten-Segmenter“ meist aber nur 16 neue Meroziten. Wenn nachfolgend der zweite 90° Winkel auftaucht, dann ist es ein Kreislauf geschlossen. Schizont: Epi.Ref_Rhesus.Z.7843#166“32“2535“304“5“90“.
Der Kreislauf wird nicht als zweiter 90° Winkel sichtbar, sondern über 2 Zeilen setzt sich der Winkel aus 30° und 60° zusammen. Aktin=375 AS steht bei Bedarf zur Verfügung. In der Zeilen Nr. xx44 sind für eine Kernbildung 8 Kerne zählbar als QS 1+3+3+1=8_5=Kerne. Weil sich diese Anzahl als „1331“ nachfolgend wiederholt, ergeben sich zusammen 16 Kerne, die als neue Merozoiten entstehen können. In der ersten Zeile wird ein Teilwinkel=30° (fehlen 60°) adressiert: Epi.Ref_Rhesus.Z.7844#166“30“1331“51“375“5. In der zweite Zeile wird ein Restwinkel (90-30)=60° adressiert. Der 2. Anteil von 8 Kernen „1331“=QS1+3+3+1=8 wird adressiert. Der Kreislauf ist als Binom-Kreis=64 in Ringform=6_O_4 adressiert. Der Abbau von Hämoglobin ist ein Recycling-Prozess, der mit dem Blutrecycling=62 eine Spiegelung von Blut=26 ist. Die angelagerte Zahl 62_EXTRA=8 ist der in der Maurer´schen Spalte abgelagerter Blutfarbstoff als „62“8“. Als bräunlicher Farbstoff wird eine Doppelform „88“ benötigt, die sich wegen (62)8_(2)8(6) auch entsprechend spiegelt. Weil diese Zahl nicht am rechten Zahlenrand „ausgeschieden“ wird, muss der Farbstoff eingelagert werden. Die Zeit Z.7+8+4+5=24=Zeitbasis kann nach dem Schizonten einen Merozoiten-Segmenter entwickeln, wenn nachfolgend in der Z.-Nr. die Zahl 84 auf 48 Stunden gedreht wird: Epi.Ref_Rhesus.Z.7845#16“628“0“1331“28“604“. Die Anzahl von „147“ Basenpaaren (bp) von Histonen zur Aufwicklung der DNA im Zellkern wird als typisch gezählt. Zitat: „Wie bei praktisch allen Eukaryoten ist auch bei P. falciparum das Nukleosom die Grundeinheit der Chromatinstruktur und besteht aus einem Oktamer von Kernhistonen, um die „147“ bp DNA gewickelt sind. Plasmodium falciparum hat vier kanonische Kernhistone H2A, H2B, H3 und H4 sowie vier Histonvarianten H2A.Z, H2Bv, H3.3 und CenH3 11“; siehe „Clipped histone H3 is integrated into nucleosomes of DNA replication genes in the human malaria parasite Plasmodium falciparum - PMC (nih.gov); a. Scherf u.a. (mar 2019); doi: 10.15252/embr.201846331“. Die Ziffer „8“ am Zahlenrand kann die 8 Histone bilden, weil in. Z.-Nr. und Code je 4 Histone mit Unterschieden 8_“4“ und 8_(9)_“4“ enthalten sind. Bevorzugt werden 16 neue Merozoiten entstehen, weil die Serie #16 läuft: Epi.Ref_Rhesus.Z.7“84“6#“16“625“894“0“147“06“8“.
Die erwarte Blutzeile „Z.Nr. QS7+8+4+7=26=Blut“ und die Austauschzahl „82“ gegen „84“ liegen vor, so dass der Vermehrungszyklus als Merozoiten-Segmenter abgeschlossen ist. Die Freisetzung von 16 neuen Merozoiten steht bevor. Bei der stufenweisen Freisetzung der Merozoiten sind als Vermittler das vorhandene Serin=C3H7NO3=6*3+7+7+8*3=18+14+24=“56“ und Cysteinproteinasen mit dem im Cystein C3H7NO2S=64 enthaltenen Schwefel=“16 enthalten. In der Folgezeile kann nach dem „Parasitophorous Vacuole Membrane-Enclosed Merozoite Structures (PEMS)“ gesucht werden. Zutreffend ist von den Varianten das Protein „Thioredoxin 2“= „157“ AS. „Der Translokon-PTEX-Komplex ist eine Multiproteinmaschinerie, die sich in der parasitophoren vakuolären Membran des Parasiten befindet und für die Proteinsekretion in Wirtszellen verantwortlich ist“, siehe: „TRX2 - Thioredoxin 2 - Plasmodium falciparum (isolate 3D7) | UniProtKB | UniProt“ Als Bildsprache liegt 1(6)57 AS vor, so dass die Störgröße „6“ erklärungsbedürftig ist: Epi.Ref_Rhesus.Z.7“84“7#“16“6237752“56“70“82“.
Die Zeit von „48“ Stunden ist mit der Z.Nr. xx48 abgelaufen. Der Parasit hat aber ein Problem mit der fehlenden Zeitbasis=24 als Stundenzähler. Die Korrekturgröße „82“ bleibt als Besonderheit am rechten Rand erhalten. Der Sinn besteht darin, die Ziffer „2“ am rechten Rand als Spalte zu markieren. Als Vorgang“ QS8+2=10 plus 1 Aktion=11=Zählgröße“ wird die Ziffer „2“ zur Rechengröße. Am Merozoiten-Semeter bilden sich Knospen, von denen der 1. Merozoit entweicht und die anderen folgen. Hinter der Anzahl „16“ Merozoiten wird mit QS 1+6+6+2+1+“6“=“22“ getrennt. Als Zeitbasis wird Summe 22+2=24 gezählt. Die Ziffer „0“ ist der Merozoiten-Ausgang. Die Zerstörung der Membran zeigt sich durch das Ungleichgewicht, weil die QS=66 nicht mittig als 33=Membran geteilt wird. Die 1 Aktion ist die Ruptur der Membran „QS 1+6+6+2+1+“6“+5+7=“34“_“0“_QS 3+8+6+5+8+2=“32“= Summe „66“. Der Abbau der Membran wird durch „Thioredoxin 2“= „157“ AS als „1(6)57“ bewirkt. Ersichtlich ist, dass die Störgröße „6“ als Teil der 16 neuen Merozoiten eine Funktionsdefinition bezweckt: Epi.Ref_Rhesus.Z.78“48“#“16“62“16“57“0“3865“8“2“.
....
Apicomplexa_dat17.01.2023
Ein genierlicher Bubi applaudiert seinem Double
8.) Darmbakterie „Escherichia coli (E.coli)“
Der Entwicklungszyklus der Parasiten (Apicomplexa) wird durch die Entwicklung der Bakterien beendet, sofern diese keine Apicomplexa-Lücke ausfüllen.
Nach der inneren und äußeren Membran „33“ ist die fertig Struktur entwickelt worden: Epi.Ref_Rhesus.Z.8307#157032“33“9520151 und Epi.Ref_Rhesus.Z.8308#157013438179“333“. Nachfolgend muss sich das Bakterium durch Einschnürung vermehren.
Der bakterielle Zellzyklus von Proteinen zu bestimmten Zeitpunkten und an spezifischen Stellen in der Zelle angetrieben [siehe: „Zellzyklus Präzise räumliche und zeitliche Organisation in Bakterie“; https://vaam.de/media/fp_graumann.pdf]. Bakterien produzieren ein Strukturprotein „Zellteilungsprotein FtsZ“, das mit dem Protein „Tubulin“ bei den Eukaryoten vergleichbar ist. FtsZ= 364 Aminosäuren (in der Sekundärstruktur ringförmig) [siehe: Zellteilungsprotein FtsZ – Wikipedia]. An der Position der zukünftigen Scheidewand bei der Zellteilung wird ein Ring gebildet, an dem für die Teilung relevante Proteine entstehen. Die Ringstruktur (Divisom) zeigt sich als Form-Ring „707“ mit einem Divisor „727_1_727“: FtsZ=264AS: Epi.Ref_Rhesus.Z.8328#56636“364“600612; Divisom „707“: Epi.Ref_Rhesus.Z.8328#15“64“6“727“1“727“707“; FtsZ=264AS: Epi.Ref_Rhesus.Z.8328#15“64“109885“364“38; FtsZ=264AS: Epi.Ref_Rhesus.Z.8328#1563922“364“69715.
E.Coli_dat29.01.23
Die hübsche Chrysomya Rufifacies fliegt auf Makuss´ Stamm
9.) Coronavirus SARS-CoV-2
9.1) Allgmeines
Die Viren gelten nicht als Lebewesen, weil ein potenter Wirt deren Vermehrung realisiert und kein Stoffwechsel erfolgt. Dank Globalisierung hat der „Coronavirus SARS-CoV-2“ sein Ziel, den Menschen, erreicht. Der nächste Globalisierungsschritt wird aus Sprechzimmern souffliert und viral lanciert. „Coronavirus SARS-CoV-2“ ist ein geeigneter Viren-Vertreter, weil er sich mathematisiert zeigt. Coronavirus SARS-CoV-2“unterscheidet sich vom bekannten Gruppe-2-Coronavirus: „SARS-CoV fehlt eine orthologisch ähnliche Papainprotease 1 (PL1pro)“/ „3 Spaltungen in der N-terminalen Hälfte des pp1a, die alle durch die konservierte PL2pro entstehen“/ „einer Protease, die stromabwärts liegt und ein Paralog zu PL1pro darstellt/. PL1pro scheint in HCoV-229E zu dominieren“/„Unmittelbar stromaufwärts von PL2pro als Besonderheit eine 375 Aminosäuren große "Orphan-Domain" vorhanden, die als „SARS-CoV Unique Domain (SUD)“ bezeichnet wird [siehe: https://mediatum.ub.tum.de/doc/1097668/1097668.pdf ]. Dieser Unterschied muss ermittelt werden.
„Coronavirus SARS-CoV-2“ bildet einzelsträngige RNA-Viren. Der Durchmesser wird mit 80-120 nm in anderen Quellen 80-160 nm beschrieben. Zutreffend ist somit eine Rechengröße von i.M.“120“ nm. Aus der Oberflächen ragen Oberflächenproteine (Spikes) in einer Länge von 20 - 25 nm heraus [RKI - Coronavirus SARS-CoV-2 - SARS-CoV-2: Virologische Basisdaten sowie Virusvarianten]. Maße in Nanometer sind direkt ablesbar.
In Z.8“4“2“4“ ist eine Gruppe 44 mit der BiXnom-Schwerachse=84 kombiniert und es eine schützende Virenhülle (Envelope), als Membran „33“ vorhanden. Für eine Lipiddoppelschicht muss dann noch eine zweite Membran folgen: Epi.Ref_Rhesus.Z.8“4“2“4“#15“48“51“33“48“04594.
9.2) VIRUS-Aufbau
9.3) VIRUS-Infektion
9.4 Eindringen in die Wirtszelle
Im Zeilenlauf könnten noch die DNA-Viren folgen. Im Zeilenlauf liegt momentan eine freie Strecke vor, weil die Anzahl der 20 Knorpelspangen „22“ der Luftröhre bis zur Verzweigung auf die Bronchien durchgezählt werden muss. Nachfolgend muss die Vermehrung der RNA-Viren gesucht werden. Die positiven Einzelstrang-RNA-Viren können die DNA im Zellkern der Wirtszelle nicht direkt verwenden. Der Virus muss seine RNA in das „Ribosom“ einer Wirtszelle transportieren. Die Vermehrung der Viren unterscheidet sich [siehe: https://www.scinexx.de/dossierartikel/zellpiraten-in-aktion/]. Was sind Ribosomen? Ribosomen sind 20 –„25“ nm groß und bestehen aus Proteinen und rRNA (ribosomale RNA). Die Ribosomen können sich frei im Cytoplasma befinden oder an der Membran des endoplasmatischen Retikulums angeheftet sein. Die Wirtszelle des Menschen gehört zu den Eukaryoten. Es handelt sich dabei um 80S Ribosomen, die aus 2 Teile bestehen (60S und 40S) [Prokaryoten • Prokaryotische Zelle, Unterschiede zu Eukaryoten · [mit Video] (studyflix.de)]. Die Ribosomen übersetzen den genetischen Code mithilfe von Boten-RNAs (engl. messenger RNA, kurz mRNA) in Proteine. Die von den mRNAs getragenen Nukleotid-Tripletts (Codon) werden in die 20 möglichen Aminosäuren übersetzt. Hierbei sind Interpretermoleküle [Transfer-RNAs (tRNAs)] beteiligt. Diese tragen 2 Informationen: Das Anticodon erkennt das Codon der mRNA und eine entsprechende Aminosäure.
Die Anzahl von Ribosomen in einer Zelle liegt massenhaft zwischen 10^5 und 10^7. Zwischen beiden Ribosom-Untereinheiten zieht sich die Kette der mRNA. Die 60s-Untereinheit besteht aus 49 Proteinen und die 40s-Untereinheit aus 33 Proteinen. Entsprechend kann das Ribosom mit Z.85“49“ als große Einheit „49“ beginnen, weil dann mit Z.8“55“0 eine Strukturbildung mit „33“ Proteinen im Code folgt. Die mRNA kann nur als Zahl „7“ erkannt werden, die sich über die Zählgröße „1“5“1“ mit QS1+5+1=7 vergrößert. Ribosom-60s: „49“ Proteine. Durchmesser der Ribosome als Serie 25 nm. Die Anzahl der Ribosome von 10^5 und 10^7 ist an die Zählgröße „161“ mit „7_161_5“ gekoppelt, wobei sich die Basis 10 aus QS1+6+1=8=EXTRA zählt. Dann wird das EXTRA=8 in die massenhafte Struktur 5_8_5 eingeklammert, so dass sich die Basis 5+5=10 rechnet: Epi.Ref_Rhesus.Z.85“49“#15“25“81“7615“85“436. Ribosom-40s:„33“ Proteine und mRNA „151_7“: Epi.Ref_Rhesus.Z.8“55“0“#15“25“693“151“33“7“89.
10.) Adenoviren
adenoviren_dat03.02.2023
In Fortsetzung von Parasiten, Bakterien und Viren könnte sich eventuell die menschliche Zelle entwickeln. „Stand Jahr 2020 hat das haploide Genom einer menschlichen Zelle eine Länge von etwa 3,1 Milliarden Basenpaaren (bp). Bei einem diploiden Genom und einer Länge von „0,34“ nm pro Basenpaar ergibt sich damit in jedem Zellkern eine Gesamtlänge von gut zwei 2 Metern DNA“ [siehe: Genom – Wikipedia]. Anzahl der Gene= „23000“ bei einer Gendichte=„7“ Gene / 1 Million Basenpaare [Mega-Basenpaare (Mbp)].
Diese Aussage muss in 1 BiXnom-Code-Zeile darstellbar sein. Der Code zählt Maße in „1 Nanometer“, so dass die zu kleine Länge eines Basenpaares von „0,34nm nur als Kompensation mit der Anzahl der 23000 Gene“ als sehr große Zahl darstellbar ist. Weil beide Zahlen das gleiche Objekt „Zellkern“ benennen, vermischen sich die Zahlenteile „23“ und „34“ zur Genom-Gruppe „44“ mit „0_„2“34“4“_0“. Beidseitig ist eine 0(Null) notwendig, um an den beiden Zahlenrändern gegensätzliche Dezimal-Faktoren „100“ und „1/100“ zu unterscheiden. Die gesuchten Zahlen werden zur Lesbarkeit „100-fach“ erhöht auf „23 000 00=23*10^5“ und „34“, um dann anschließend am rechten Zahlenrand als „1/100“ wieder berichtigt. Der Faktor „1*10^5“ muss mit der markierten Potenz-5 in 1_“5“_0 am linken Zahlenrand als 1“5“0_„2344“_0“ erkannt werden. Die Genom-Gruppe „44“ wird in eine Zählgröße umgeformt als 1“5“0_„234_QS4+7=11=Zählgröße_Form=QS6+1=7_“64“_0“. Abschließend wird der BiXnom-Kreis=64 zur Zahl QS6+4=10 verarbeitet und mit der angelagerten Ziffer „0(Null“ am rechten Zahlenrand zum Codefaktor „1/100“ erklärt. Die Zählgröße=11 entsteht alternativ mit der Quersumme QS1+5+0+4+9+2+3+4+4+7+6+1+6+4+0=56=QS5+6=11. Somit kann die Form-Ziffer„7“ in Kombination mit dem 6er-Millionen-Zähler „“7_616“ die Gendichte [Gene/Mbp] darstellen, wobei 1Mbp= 1 Million Basenpaare (bp). Die Ziffer „1“ zählt „1 Basenpaar (bp)“. Es werden somit 23000 Gene / 7 [Gene/Mbp]= 3285,7 Mbp =3,2857* 10^9 Basenpaare avisiert: Epi.Ref_Rhesus.Z.8668#“15“0“49“2“3“4“4“7“616“4“0“.
Außer dem Kerngenom der Zelle existiert im Mitochondrium ein ringförmiges Molekül von etwa 16,5 kbp als ein mitochondriales Genom. Wissenschaftlich wird dem Mitochondrium in der Evolution ein bakterieller Ursprung zugewiesen. Ein Teil der ursprünglichen DNA wurde nicht ins Kerngenom der menschlichen Zelle ausgelagert und bildet die mitochondriale DNA (mtDNA). Die „mtDNA“ kodiert für 13 mitochondriale Proteine, 22 tRNA und 2 rRNA [Mitochondriale DNA - DocCheck Flexikon].
Der Malariaerreger „Plasmodium falciparum“ kann beispielsweise alle 20 Aminosäuren in 45 Transfer-RNA-Genen im Kerngenom codieren. Vergleichsweise kann der Mensch 8 essentielle Aminosäuren [Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan, Valin] und 2 semi-essentielle Aminosäuren [Arginin, Histidin] nicht selbst aufbauen [Essentielle Aminosäure – Wikipedia ]. Sie werden aus der Nahrung gewonnen. Trotzdem sind in der Datenbank auch für essentielle Aminosäuren „spezielle Enzyme „tRNA-Ligase“ zur Katalyse der Bindung einer Aminosäure an ihre spezielle Transfer-RNA vorhanden. Die Transfer-RNA(tRNA) liegt im Unterschied zum Parasiten in mehreren Kopien vor. Beim Menschen wären im Prinzip nur 11 Transfer-RNA-Gene ausreichend. In der 1. Gencode-Zeile wird eine tRNA-Gruppe „44“ avisiert, der dann lückenlos 10 tRNA-Gen-Zeilen zum Transport von 10 Aminosäuren folgen. Glutaminsäure und Glutamin mit jeweils 78 Elektronen liegen zusammen. Alanin, Serin, Cystein folgen. Asparaginsäure und Asparagin mit jeweils 70 Elektronen liegen zusammen. Tyrosin, Tryptophan und Glycin folgen. Das Enzym “Cystein-tRNA-Ligase“=739AS enthält aufgrund der Metallionen-Bindung mit dem Cofaktor „Zink^2+“=30E eine Prüfmöglichkeit [CARS1 - cysteine--tRNA ligase - Homo sapiens (Human) | UniProtKB | UniProt]. Diese Fundstelle liegt hinter den Viren.
Zelle_ Homo sapiens (Mensch).dat08.04.2023
Freedom is just another word for nothin' left to lose ["Freiheit" ist nur ein anderer Begriff für "Nichts zu verlieren haben" / Janis Joplin - Me and Bobby McGee (Official Music Video) - YouTube ; https://www.youtube.com/watch?v=5Cg-j0X09Ag